ISOLASI DAN IDENTIFIKASI BAKTERI
Listeria monocytogenes
DARI SUSU SAPI SEGAR
DI KABUPATEN ENREKANG SULAWESI SELATAN
KUSUMANDARI INDAH PRAHESTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Isolasi dan Identifikasi Bakteri Listeria monocytogenes dari Susu Sapi Segar di Kabupaten Enrekang Sulawesi Selatan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
KUSUMANDARI INDAH PRAHESTI. Isolasi dan Identifikasi Bakteri Listeria monocytogenes dari Susu Sapi Segar di Kabupaten Enrekang Sulawesi Selatan. Dibimbing oleh FACHRIYAN HASMI PASARIBU dan NI LUH PUTU IKA MAYASARI.
Listeria monocytogenes merupakan salah satu bakteri patogen yang mendapat perhatian dalam industri pangan dan kesehatan masyarakat. Bakteri ini menginfeksi manusia melalui bahan pangan sehingga menimbulkan penyakit listeriosis. Kajian epidemiologi pada sejumlah wabah listeriosis yang disebabkan oleh L. monocytogenes memberikan indikasi bahwa susu dan produk susu merupakan bahan pangan yang potensial terhadap kontaminasi dan transmisi L. monocytogenes ke manusia. Kabupaten Enrekang merupakan salah satu wilayah yang menjadi priotitas pengembangan peternakan sapi perah di Propinsi Sulawesi Selatan. Pemerahan susu umumnya dilakukan secara manual oleh peternak, yang memungkinkan terjadinya kontaminasi pada susu segar yang dihasilkan, namun belum ada informasi terjadinya kontaminasi L. monocytogenes pada susu segar yang dihasilkan. Oleh karena itu diperlukan penelitian tentang keberadaan L. monocytogenes dan karakterisasi bakteri tersebut pada susu sapi segar di Kabupaten Enrekang.
Sebanyak 107 contoh susu segar dikumpulkan dari lima kecamatan di Kabupaten Enrekang dan digabungkan ke dalam 31 sampel pool untuk dilakukan isolasi dan identifikasi bakteri. Tahap pengayaan dilakukan dalam media Listeria Enrichment Broth (LEB) kemudian dilakukan kultur pada media Listeria Selective Agar Base (LSA), dilanjutkan dengan uji biokimiawi. Isolat L. monocytogenes yang diperoleh dikonfirmasi dengan metode polymerase chain reaction (PCR) kemudian dilakukan pengurutan oligonukleotida. Identifikasi serotype dilakukan dengan PCR multipleks.
Hasil penelitian menunjukkan keberadaan L. monocytogenes pada 21 isolat sampel yang berhasil dikonfirmasi dengan PCR. Analisa pengurutan oligonukleotida dari isolat L. monocytogenes yang diperoleh pada penelitian ini menunjukkan persentase nilai kemiripan sebesar 99% dengan strain L. monocytogenes yang terdapat pada basis data di GenBank. Identifikasi serotipe menunjukkan bahwa keseluruhan 21 isolat tersebut termasuk dalam serogrup 2, yaitu serotipe 1/2c dan 3c.
SUMMARY
KUSUMANDARI INDAH PRAHESTI. Isolation and Identification of Listeria monocytogenes from Raw Milk in Enrekang District South Sulawesi. Supervised by FACHRIYAN HASMI PASARIBU and NI LUH PUTU IKA MAYASARI.
Listeria monocytogenes is a pathogenic bacteria which was concerned in food industry and public health. This bacteria infects human through food, causing listeriosis. Epidemiology study on listeriosis outbreaks indicated that milk and milk products are potential for L. monocytogenes contamination and transmission to human. Enrekang district is one of priority areas for dairy farm development in South Sulawesi. Farming was done traditionally and the milking process was done manually, which enable contamination to the milk. The aims of this study were to isolate L. monocytogenes in raw milk in Enrekang District, South Sulawesi, to analyze the molecular characterization of L. monocytogenes, and to determine the bacteria serotypes.
A total of 107 raw milk samples were collected from five sub-districts in Enrekang and pooled into 31 pool for further isolation and identification of the bacteria. Enrichment cultures in Listeria Enrichment Broth (LEB) were done prior to plating on Listeria Selective Agar Base (LSA) media and followed by biochemical tests. Isolated L. monocytogenes were confirmed by polymerase chain reaction (PCR) and the PCR products were sequenced. Multiplex PCR was applied for molecular serotyping of the isolated L. monocytogenes.
Result showed that L. monocytogenes were found in 21 samples and were confirmed by PCR. The DNA sequence analysis showed that the isolates found in this study have 99% similiarity with L. monocytogenes strains in GenBank database. Molecular serotyping showed that all 21 isolates belong to serogroup 2, comprising serotype 1/2c and 3c.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi Medik
ISOLASI DAN IDENTIFIKASI BAKTERI
Listeria monocytogenes
DARI SUSU SAPI SEGAR
DI KABUPATEN ENREKANG SULAWESI SELATAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2015 ini adalah tentang bakteri Listeria monocytogenes, dengan judul Isolasi dan Identifikasi Bakteri Listeria monocytogenes dari Susu Sapi Segar di Kabupaten Enrekang Sulawesi Selatan.
Terima kasih penulis ucapkan kepada Bapak Prof Dr Drh Fachriyan Hasmi Pasaribu dan Ibu Dr Drh Ni Luh Putu Ika Mayasari selaku pembimbing dalam penelitian dan penyusunan karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada ketua Lab Mikrobiologi dan Ketua Lab Bioteknologi Terpadu Fakultas Peternakan Unhas, kepada laboran Lab Divisi Mikrobiologi Medik dan laboran Lab Pendidikan dan Layanan FKH IPB. Selanjutnya kepada seluruh staf dosen, pegawai, dan rekan–rekan mahasiswa Prodi Mikrobiologi Medik.
Ungkapan terima kasih juga disampaikan kepada ayah, ibu, suami, ibu mertua, serta seluruh keluarga, atas segala doa, dukungan, dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
Listera monocytogenes pada Bahan Pangan 8
Serotipe Listeria monocytogenes 9
3 METODE 10
Waktu dan Tempat 10
Pengambilan Contoh Susu Segar 10
Isolasi dan Identifikasi Listeria monocytogenes dari Susu Segar 11 Kultur pada Media Agar Darah dan Uji Biokimiawi 11
Ekstraksi DNA 11
Identifikasi Gen Hemolisin (hly) dan Gen Invasive Associated
Protein (iap) 12
Identifikasi Serotipe Listeria monocytogenes dengan Metode PCR 13 Pengurutan Oligonukleotida (Sekuensing) DNA 13 Pengurutan Oligonukleotida Parsial Gen hly dari Listeria
monocytogenes 13
Analisa Hasil Pengurutan Oligonukleotida 14
Analisa Data 14
4 HASIL DAN PEMBAHASAN 14
HASIL 14
Pengambilan Contoh Susu Segar 14
Isolasi dan Identifikasi Listeria monocytogenes dari Susu Segar 15 Kultur pada Media Agar dan Uji Biokimiawi 15 Kualitas DNA Bakteri Hasil Ekstraksi 17 Identifikasi Parsial Gen iap dan hly dari Listeria monocytogenes 17 Identifikasi Serotipe Isolat Listeria monocytogenes 20 Keberadaan Listeria monocytogenes pada Susu Sapi Segar di
Kabupaten Enrekang 22
Pengurutan Oligonukleotida Listeria monocytogenes 23 Pengurutan Oligonukleotida Parsial Gen hly dari
DAFTAR ISI (lanjutan)
PEMBAHASAN 25
5 KESIMPULAN DAN SARAN 27
Kesimpulan 27
Saran 27
DAFTAR PUSTAKA 28
LAMPIRAN 30
DAFTAR TABEL
1 Klasifikasi Listeria monocytogenes 3
2 Diferensiasi karakteristik Listeria spp. 4
3 Identifikasi spesies L. monocytogenes melalui prosedur PCR 5 4 Komposisi antigen somatik (O) dan antigen flagelar (H) pada serotipe L.
monocytogenes 9
5 Primer yang digunakan untuk identifikasi spesies L. monocytogenes 12 6 Primer yang digunakan untuk identifikasi serotipe L. monocytogenes 13 7 Lokasi dan jumlah contoh susu segar yang diambil dari 5 kecamatan di
Kabupaten Enrekang 14
8 Hasil uji biokimiawi dari isolat L. monocytogenes ATCC 7644 dan 24
isolat sampel diduga L. monocytogenes 16
9 Resume hasil identifikasi L. monocytogenes dengan metode kultur
konvensional dan PCR 20
10 Asal sampel dan jumlah isolat yang terdeteksi L. monocytogenes 22 11 Analisa kemiripan urutan oligonukleotida isolat sampel L.
monocytogenes dengan basis data GenBank 21
DAFTAR GAMBAR
1 Skema invasi intraseluler L. monocytogenes 7
2 Skema posisi primer iap dan HlyA pada Genom L. monocytogenes 12
3 Hasil kultur pada media LSA 15
4 Hasil pewarnaan Gram 16
5 Hasil elektroforesis produk PCR menggunakan primer iap 18 6 Hasil elektroforesis produk PCR menggunakan primer hlyA 19
7 Hasil elektroforesis produk PCR multipleks 21
8 Kondisi kandang tempat pengambilan sampel susu segar 23 9 Hasil persejajaran nukleotida isolat sampel dengan beberapa strain L.
monocytogenes yang terdapat pada basis data GenBank 22
DAFTAR LAMPIRAN
1 Hasil pengukuran kualitas DNA bakteri hasil ekstraksi 30 2 Hasil pengurutan oligonukleotida dari isolat kontrol positif L.
monocytogenes ATCC 7644 dan isolat sampel 18A, 18B, 20, 25A, dan
25B 31
3 Kromatogram isolat kontrol positif L. monocytogenes ATCC 7644 32
4 Kromatogram isolat sampel 18A 33
5 Kromatogram isolat sampel 18B 34
6 Kromatogram isolat sampel 20 35
7 Kromatogram isolat sampel 25A 36
1
PENDAHULUAN
Latar Belakang
Listeria monocytogenes merupakan salah satu bakteri patogen yang mendapat perhatian dalam industri pangan dan kesehatan masyarakat. L. monocytogenes terdapat secara luas ditanah, tumbuhan, air permukaan, serta ditemukan pula pada silase, saluran pembuangan, dan limbah rumah potong, susu sapi, dan feses hewan serta manusia. Bakteri ini menginfeksi manusia melalui bahan pangan sehingga menimbulkan penyakit listeriosis. Kajian epidemiologi pada sejumlah wabah listeriosis yang disebabkan oleh L. monocytogenes memberikan indikasi bahwa susu dan produk susu merupakan bahan pangan yang potensial terhadap kontaminasi dan transmisi L. monocytogenes ke manusia. Sumber cemaran L. monocytogenes pada susu dan produknya dapat ditemukan pada rantai pengolahan pangan, termasuk pada susu mentah yang baru diperah, lingkungan, peralatan, alat pengemas, pengelolaan sampah, hingga higiene karyawan yang terlibat (Lovett dan Twedt 2004). Sanjaya et al. (2007) menyebutkan bahwa cemaran mikroba pada susu dapat terjadi pada ambing, alat penampung susu, alat penyimpan susu, rantai transportasi, industri pengolahan, sampai dengan konsumen. Hewan ternak yang terinfeksi oleh L. monocytogenes akan melepaskan bakteri tersebut melalui susu, darah, dan fesesnya. Donnely (2001) menyebutkan sapi dan domba yang terinfeksi oleh L. monocytogenes tanpa disertai gejala klinis dapat melepaskan sel L. monocytogenes pada susu segar yang dihasilkannya.
Pada manusia, kelompok beresiko tinggi terhadap listeriosis adalah wanita hamil, bayi dalam kandungan, dan individu yang mengalami gangguan sistem kekebalan (Garbutt 1997). Kasus kematian pada manusia akibat L. monocytogenes dilaporkan terjadi di beberapa negara Eropa, antara lain di Irlandia pada tahun 2000 ditemukan satu kasus kematian pada manusia karena meningitis.Di Amerika Serikat juga dilaporkan adanya 425 kasus kematian dari 1.850 kasus listeriosis pada manusia. Diperkirakan setiap tahun terjadi 2500 kasus listeriosis pada manusia di Amerika Serikat (FSAI 2005). Di Indonesia belum tersedia data maupun laporan yang mencatat kejadian listeriosis pada manusia. Keberadaan L. monocytogenes pada susu segar di Indonesia juga belum tercatat, data yang ada sifatnya terbatas untuk penelitian. Yuliati dan Malaka (2013) telah melakukan isolasi dan mengamati karakteristik pertumbuhan L. monocytogenes pada susu segar dengan penyimpanan pada suhu 4oC. Isolat diperoleh dari susu segar yang
dikoleksi dari peternakan sapi perah di Makassar, Sulawesi Selatan. Penelitian tersebut menunjukkan perbedaan pembentukan filamen dan pigmen secara perlahan setelah dilakukan penyimpanan susu pada suhu 4 oC. Perbedaan
2
permukaan yang spesifik, yaitu antigen somatik (O) dengan 15 subtipe dan antigen flagelar (H) dengan 4 subtipe. Serotipe spesifik Listeria ditentukan oleh kombinasi spesifik antara antigen O dan antigen H, menghasilkan 12 serotipe L. monocytogenes, yaitu 1/2a, 1/2b, 1/2c, 3a, 3b, 3c, 4a, 4b, 4c, 4d, 4e, dan 7 (Seeliger dan Jones 1986). Penelitian telah membuktikan bahwa hanya serotipe 1/2a, 1/2b, dan 4b yang menjadi 98% penyebab terjadinya wabah listeriosis pada manusia (Wiedmann et al. 1996, Jacquet et al. 2002).
Perumusan Masalah
Epidemiologi L. monocytogenes sangat penting bagi kesehatan manusia berkaitan dengan terjadinya wabah listeriosis yang disebabkan kontaminasi bakteri ini pada berbagai bahan pangan yang dikonsumsi manusia, termasuk daging, susu dan produk susu. Kabupaten Enrekang merupakan salah satu wilayah yang menjadi priotitas pengembangan peternakan sapi perah di Propinsi Sulawesi Selatan dengan populasi sapi perah sebanyak 1200 ekor pada tahun 2014. Populasi terbesar, yaitu sebanyak hampir 50% dari total populasi sapi perah terdapat di Kecamatan Cendana. Usaha ternak dilakukan secara tradisional dan umumnya pada skala kecil (3–8 ekor) dengan produktivitas harian 5–8 liter/ekor/hari. Pemerahan susu umumnya dilakukan secara manual oleh peternak, yang memungkinkan terjadinya kontaminasi pada susu segar yang dihasilkan, namun belum ada informasi terjadinya kontaminasi L. monocytogenes pada susu segar yang dihasilkan. Oleh karena itu diperlukan penelitian tentang keberadaan L. monocytogenes dan karakterisasi bakteri tersebut pada susu sapi segar di Kabupaten Enrekang.
Tujuan Penelitian
Tujuan penelitian ini adalah mengisolasi bakteri L. monocytogenes dari susu sapi segar di Kabupaten Enrekang Sulawesi Selatan, melakukan karakterisasi secara molekuler terhadap isolat yang diperoleh, dan menentukan serotipenya.
Hipotesis Penelitian
3
2
TINJAUAN PUSTAKA
Karakter Listeria monocytogenes
Listeria monocytogenes merupakan bakteri batang Gram-positif, berukuran diameter 0.5 μm dan panjang 1–2 μm, tidak membentuk spora, serta bersifat fakultatif anaerob yang tumbuh pada suhu -4 sampai dengan 50 oC. Bakteri ini bersifat katalase positif, oksidase negatif, H2S negatif, dan
menghasilkan β-hemolysin yang membentuk zona bening pada agar darah (Farber dan Peterkin 1991, Gyles et al. 2010, Liu 2006). L. monocytogenes membentuk reaksi Christie, Atkins, and Munch-Petersen (CAMP) dengan hemolisin dari bakteri Staphylococcus aureus. Bakteri ini bersifat motil bila ditumbuhkan pada suhu 20–25oC dengan adanya pertumbuhan flagela peritrikus. Flagela tersebut tidak terbentuk bila bakteri ditumbuhkan pada suhu tubuh 35–37 oC (Gyles et al. 2010).
Genus Listeria termasuk dalam kelas Bacilli dan ordo Bacillales. Enam spesies yang termasuk dalam genus Listeria adalah L. monocytogenes, L. innocua, L. seeligeri, L. welshimeri, L. ivanovii, dan L. grayi. Dari keenam spesies tersebut, L. monocytogenes dan L. ivanovii yang bersifat patogen. L. ivanovii menginfeksi hewan namun jarang ditemukan pada manusia sedangkan L. monocytogenes menginfeksi hewan dan manusia (Liu 2006). Klasifikasi L. monocytogenes ditampilkan pada Tabel 1. L. monocytogenes terdapat secara luas ditanah, tumbuhan, air permukaan, serta ditemukan pula pada silase, saluran pembuangan dan limbah rumah potong, susu sapi, dan feses hewan serta manusia. L. monocytogenes telah diisolasi dari sapi, kambing, dan unggas, namun jarang ditemukan pada hewan liar (Farber dan Peterkin 1991).
Tabel 1 Klasifikasi L. monocytogenes Kerajaan
4
Tabel 2 Diferensiasi karakteristik Listeria spp.a
Karakteristik
aSumber: Farber dan Peterkin 1991 bv: beragam
5 Tabel 3 Identifikasi spesies L. monocytogenes melalui prosedur PCRa
Spesies Gen Target Protein
Listeria
Infeksi L. monocytogenes yang bersifat invasif menyebabkan penyakit listeriosis. Terdapat dua bentuk gejala klinis yang diakibatkan oleh infeksi L. monocytogenes yaitu listerial gastroenteritis/gastrointestinal illness (bentuk saluran pencernaan) dan invasive listeriosis (bentuk invasif). Pada listerial gastroenteritis, gejala klinis ditandai dengan mual, muntah, kram perut dan diare yang akan tampak setelah tertelannya bakteri selama lebih dari 12 jam (Dalton et al. 1997, Lovett dan Twedt 2004). Perubahan keasaman lambung akibat penggunaan obat–obatan antasida dan cimetidine dapat meningkatkan kepekaan terhadap infeksi Listeria. Manusia yang menelan sejumlah 1.000 sel L. monocytogenes akan menimbulkan gejala klinis seperti flu (rasa tidak enak badan, demam ringan) dan diare. Dilaporkan antara 1–10% manusia terinfeksi tanpa menunjukkan gejala klinis, namun dapat melepaskan L. monocytogenes melalui feses (Lovett dan Twedt 2004).
Umumnya, infeksi dimulai oleh tertelannya L. monocytogenes, melalui makanan terkontaminasi, yang mampu bertahan terhadap enzim proteolitik dan keasaman (pH 2.0) di dalam lambung, garam empedu, serta mekanisme pertahanan non-spesifik. Gambar 1 menunjukkan proses terjadinya invasive listeriosis, (a) bakteri menyerang mukosa saluran pencernaan dan melekat pada sel usus dibantu oleh D-galaktosa yang ada pada permukaan sel bakteri. Bakteri kemudian menginvasi makrofag (sel parenkim) dan (b) terperangkap dalam vakuola yang disebut fagosom, (c) selanjutnya bakteri tersebut menghasilkan toksin listeriolisin O (LLO), phosphatidylinositol-spesific phospholipase C (PIPLC),
dan phosphatidylcholine-spesific phospholipase C (PC-PLC) yang mempunyai
6
sitoplasma. Ketiga toksin tersebut juga mencegah pencernaan bakteri oleh enzim hidrolitik yang dihasilkan oleh lisosom, (d) secara cepat bakteri berkembang biak di dalam sitoplasma dan membentuk F-aktin, (e) bakteri akan menginvasi sel lain dengan bantuan F-aktin, mengakibatkan kerusakan sel dan septikemia. Setelah berhasil menginvasi sel lain, bakteri berada dalam vakuola dengan membran ganda, dan (f) melanjutkan siklus hidupnya dengan terus menginvasi sel lain. Lima hari hingga tiga minggu setelah tertelan, bakteri ini menyebar ke seluruh tubuh dan mengakibatkan kerusakan pada sistem syaraf, jantung, mata, organ lain dan fetus. Infeksi pada sistem syaraf dapat menimbulkan meningitis, ensefalitis dan abses dengan tingkat fatalitas hingga 70%. Pada wanita hamil, bentuk ini mengakibatkan aborsi dan kematian bayi saat dilahirkan dengan rata-rata tingkat kematian sebesar 80% (Lovett dan Twedt 2004; Hamon et al. 2006).
7
Gambar 1 Skema invasi intraseluler L. monocytogenes (Hamon et al. 2006)
Virulensi Listeria monocytogenes
Beberapa faktor yang mempengaruhi patogenesis L. monocytogenes antara lain kemampuan pertumbuhan intraseluler, kandungan senyawa besi, kemampuan melawan sel fagosit, dan menghasilkan hemolisin. Toksin hemolisin yang dihasilkan oleh L. monocytogenes disebut Listeriolisin O (LLO), dan merupakan faktor virulensi yang utama. Sekresi hemolisin sangat penting dalam pertumbuhan intraseluler dan pengenalan organisme ini oleh sel T (Farber dan Peterkin 1991).
8
Toksin hemolisin lain yang ditemukan pada beberapa strain L. monocytogenes dan secara imunologi berbeda dari LLO pertama kali dilaporkan oleh Parrisius et al. (1986). Dua tipe hemolisin teridentifikasi pada klon dari L. monocytogenes yang dikonstruksi pada Escherichia coli. Hemolisin pertama adalah suatu protein dengan ukuran 23kDa, kemungkinan sebagai faktor CAMP, tidak mengalami reaksi silang dengan antilisteriolisin maupun antibodi anti-SLO. Hemolisin kedua mengalami reaksi silang dengan anti-SLO. Vicente et al. (1985) mengidentifikasi 12 rekombinan yang mengekspresikan aktivitas β-hemolitik setelah kloning genom DNA L. monocytogenes pada sel E. coli. Kedua klon yang menunjukkan aktivitas hemolitik dapat terdeteksi setelah dilakukan sonikasi pada subkloning lanjutan. Pada filtrasi gel yang dilakukan setelah sonikasi, menghasilkan dua puncak aktivitas hemolitik, yaitu protein dengan ukuran 22 kDa dan 48 kDa, menunjukkan dua jenis hemolisin.
Pada penelitian yang dilakukan oleh Farber dan Peterkin (1991), digunakan transposon mutagenesis untuk mengidentifikasi peranan hemolisin sebagai faktor virulensi dari L. monocytogenes. Transposon mutagenesis digunakan untuk menginaktivasi determinan genetik pembentukan hemolisin, yaitu tiga non-hemolitik (Hly-) transkonjugan dan satu hemolitik (Hly+) transkonjugan. Hly- menghasilkan protein 49 kDa yang non-virulen, sedangkan Hly+ menghasilkan protein 58 kDa yang bersifat virulen dan hemolitik.
Listeria monocytogenes pada Bahan Pangan
Listeria monocytogenes dapat ditemukan pada lingkungan, seperti debu, tanah, air laut dan tawar, tanaman, hewan liar dan domestik, makanan hewan termasuk silase, limbah rumah potong hewan, selokan dan sedikit ditemukan pada feses (Donnelly 2001; Garbutt 1997). L. monocytogenes juga ditemukan pada buah-buahan, susu mentah, keju, daging, produk daging, hot dog yang tidak dimasak, ikan, rennet, daging unggas, ayam masak yang disimpan pada suhu dingin, ayam masak siap saji, susu pasteurisasi dan produk susu lainnya (Garbutt 1997).
Hewan ternak yang terinfeksi L. monocytogenes dapat melepaskan L. monocytogenes melalui susu dan fesesnya. Donelly (2001), melaporkan adanya pelepasan sel L. monocytogenes yang tinggi pada susu yang dihasilkan oleh sapi dan domba terinfeksi tanpa disertai gejala klinis. Menurut Sanjaya et al. (2007), cemaran mikroba pada susu dapat terjadi pada ambing, alat penampung susu, alat penyimpan susu, transportasi, industri pengolahan dan konsumen. Sumber cemaran L. monocytogenes pada susu dan produknya dapat ditemukan pada rantai pengolahan, termasuk susu mentah, lingkungan, peralatan, alat pengemas, pengelolaan sampah, pengendali hewan pengganggu hingga higiene karyawan yang terlibat (Lovett dan Twedt 2004).
Listeria monocytogenes termasuk golongan bakteri fakultatif anaerobik dan psikrotrofik yang tumbuh pada kisaran suhu 1–44 oC dengan pertumbuhan
9 Sel L. monocytogenes masih mampu tumbuh dalam susu yang telah dipasteurisasi pada suhu 71 oC selama 15 detik, susu yang dipasteurisasi secara komersial dengan High Temperature Short Time (HTST) serta dalam produk susu seperti es krim, keju, yogurt dan susu skim (Johansson 1998; Piyasena et al. 1998). Forsythe dan Hayes (1998) melaporkan bahwa sel L. monocytogenes masih dapat ditemukan pada susu pasteurisasi dengan suhu 72 oC selama 15 detik di hari kedua masa penyimpanan dalam suhu 4 oC. Pertumbuhan sel semakin meningkat setiap
hari hingga 2500 sel per ml pada hari kelima.
Serotipe Listeria monocytogenes
Spesies dari genus Listeria memiliki protein permukaan yang spesifik, yaitu antigen somatik (O) dan antigen flagelar (H). Kedua jenis antigen permukaan tersebut merupakan target pengujian serologis yang paling utama dalam identifikasi strain dari L. monocytogenes. Telah diketahui bahwa terdapat 15 subtipe antigen O (I–XV) dan 4 subtipe antigen H (A–D) (Seeliger dan Jones 1986). Penentuan strain individual Listeria ditentukan dari kombinasi spesifik antara antigen O dan antigen H (Tabel 4).
Tabel 4 Komposisi antigen somatik (O) dan antigen flagelar (H) pada serotipe Listeria monocytogenesa
Serotipe Antigen O Antigen H
1/2 a
10
domba yang mengalami ensefalitis, sedangkan serotipe 1/2a paling banyak menjadi penyebab septisemia dan aborsi (Low dan Donachie 1997).
Borucki dan Call (2003) melakukan identifikasi serotipe dari 122 strain L. monocytogenes asal manusia, hewan, dan lingkungan dengan metode multipleks dan mismatch amplification mutation assay (MAMA) PCR. Strain L. monocytogenes dibagi menjadi 3 genetik lineage (atau divisi), divisi I terdiri atas serotipe 1/2b, 3b, 4b, 4d, dan 4e; divisi II terdiri atas serotipe 1/2a, 1/2c, 3a, dan 3c; divisi III terdiri atas serotipe 4a dan 4c. Doumith et al. (2004) mengembangkan metode PCR multipleks yang lebih sederhana untuk mengidentifikasi serotipe L. monocytogenes dan berhasil memisahkan strain– strain L. monocytogenes ke dalam empat serogrup, yaitu grup 1 terdiri dari serotipe 1/2a dan 3a; grup 2 terdiri dari serotipe 1/2c dan 3c; grup 3 terdiri dari serotipe 1/2b, 3b, dan 7; dan grup 4 terdiri dari serotipe 4b, 4d, dan 4e.
3
METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan April 2015 sampai dengan Maret 2016. Pengambilan sampel susu segar dilakukan di Kabupaten Enrekang Propinsi Sulawesi Selatan. Tahap isolasi dan identifikasi bakteri L. monocytogenes dilakukan di Laboratorium Mikrobiologi dan Laboratorium Bioteknologi Terpadu Fakultas Peternakan Universitas Hasanuddin, sedangkan tahap konfirmasi spesies L. monocytogenes dan identifikasi serotipe dilakukan di Laboratorium Divisi Mikrobiologi Medik Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner dan di Laboratorium Pendidikan dan Layanan, Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Pengambilan Contoh Susu Segar
11 Isolasi dan Identifikasi Listeria monocytogenes dari Susu Segar
Kultur pada Media Agar dan Uji Biokimiawi
Tahap pengayaan dilakukan menggunakan media Buffered Listeria Enrichment Broth (Buffered LEB, CM 0897, Oxoid, England). Sebanyak 25 ml contoh susu segar ditambahkan ke dalam 225 ml LEB kemudian diinkubasi pada suhu 30 oC selama 24 jam, 48 jam, dan 7 hari. Setelah inkubasi 24 jam, dilakukan
tahap isolasi dengan menumbuhkan sebanyak satu ose larutan tersebut pada media Listeria Selective Agar Base (Oxford Agar, CM 0856, Oxoid, England) dengan suplementasi Listeria Selective Supplement (Oxford formula, SR 0140). Inkubasi pada media Listeria Selective Agar Base dilakukan pada suhu 35–37 oC selama
24–48 jam. Cara yang sama dilakukan setelah inkubasi pada media LEB selama 48 jam dan 7 hari apabila tidak ada pertumbuhan bakteri pada media LSA dari biakan media LEB yang diinkubasi selama 24 jam.
Adanya pertumbuhan Listeria ditandai dengan koloni pada media Listeria Selective Agar Base berukuran diameter 1 mm dengan halo berwarna coklat– hitam. Sebanyak 3–5 koloni tersebut kemudian diuji lanjut dengan pewarnaan Gram dan uji biokimiawi, yaitu uji fermentasi karbohidrat (rhamnosa, mannitol, dan xylosa), uji motilitas pada media sulfide-indol-motilitas (SIM), uji katalase, uji KOH 3%, dan uji hemolisa pada media agar darah. Strain L. monocytogenes ATCC 7644 digunakan sebagai kontrol positif.
Ekstraksi DNA
DNA bakteri diekstraksi dengan menggunakan PrestoTM Mini gDNA
Bacteria Kit (Geneaid Biotech Ltd.). Sampel sebanyak 109 sel bakteri dimasukkan ke dalam tabung mikrosentrifugasi ukuran 1.5 ml, kemudian disentrifugasi 14000–16000×g selama 1 menit dan supernatannya dibuang. Sebanyak 200 µl Gram+ buffer (mengandung lisozim 4 mg/ml) ditambahkan ke dalam sampel untuk meresuspensi pelet kemudian diinkubasi pada suhu 37 oC selama 30 menit. Sebanyak 20 µl Proteinase K kemudian ditambahkan ke dalam tabung dan diinkubasi pada suhu 60 oC selama 10 menit. Sebanyak 200 µl GB buffer
12
buffer yang telah dipanaskan sebelumnya, selanjutnya didiamkan selama 3 menit agar Elution buffer terabsorbsi seluruhnya. Tahap akhir dilakukan sentrifugasi 14000–16000×g selama 30 detik untuk memperoleh DNA hasil ekstraksi. Konsentrasi dan kemurnian DNA yang diperoleh diukur dengan spektrofotometer pada panjang gelombang 260 nm dan 280 nm.
Identifikasi Gen Hemolisin (hly) dan Gen Invasive Associated Protein (iap) Polymerase Chain Reaction (PCR) untuk identifikasi spesies L. monocytogenes dilakukan menggunakan primer yang spesifik untuk gen hemolisin (hly) dan invasive associated protein (iap) (Swetha et al. 2012). Sekuens primer yang digunakan ditampilkan pada Tabel 5.
Tabel 5 Primer yang digunakan untuk identifikasi spesies L. monocytogenesa Primer Gen
hlyA hly For: 5'–GCAGTTGCAAGCGCTTGGAGTGAA–3'
Rev: 5'–GCAACGTATCCTCCAGAGTGATCG–3' 456 54 a
Sumber: Swetha et al. 2012
Gambar 2 Skema posisi primer iap dan hlyA pada genom L. monocytogenes Reaksi amplifikasi dilakukan menggunakan kit QIAGEN® HotStarTaq Plus Mastermix sesuai dengan panduan perusahaan. Campuran reaksi amplifikasi mengandung 1 µl template DNA bakteri, 10 µM µM masing–masing primer sebanyak 1µl, 10 µl 2×QIAGEN HotStarTaq Plus Mastermix (mengandung 5U taq polymerase, PCR buffer dengan 3 mM MgCl2, dan 400 µM dNTP), dan
RNAse free water dengan volume akhir 20 µl. Kondisi siklus PCR adalah sebagai berikut: 95 oC selama 3 menit diikuti dengan 35 siklus dengan suhu 95 oC selama 1 menit, 54–59 oC (suhu annealing masing–masing primer seperti tercantum pada
13 Identifikasi Serotipe Listeria monocytogenes dengan Metode PCR
Sampel–sampel yang menunjukkan hasil positif sebagai bakteri L monocytogenes selanjutnya diidentifikasi serotipenya dengan metode PCR multipleks yang mengacu pada Doumith et al. (2004). Tabel 6 menampilkan sekuens primer dan spesifisitas serotipenya yang digunakan dalam PCR multipleks.
Tabel 6 Primer yang digunakan untuk identifikasi serotipe L. monocytogenesa
Primer Sekuen primer Ukuran
produk (bp)
Spesifisitas serotipe
lmo0737 For: 5'–AGGGCTTCAAGGACTTACCC–3'
Rev: 5'–ACGATTTCTGCTTGCCATTC–3' 691 1/2a, 1/2c, 3a, 3c
lmo1118 For: 5'–AGGGGTCTTAAATCCTGGAA–3'
Rev: 5'–CGGCTTGTTCGGCATACTTA–3' 906 1/2c, 3c
ORF2819 For: 5'–AGCAAAATGCCAAAACTCGT–3'
Rev: 5'–CATCACTAAAGCCTCCCATTG–3' 471 1/2b, 3b, 4b, 4d, 4e
ORF2110 For: 5'–AGTGGACAATTGATTGGTGAA–3'
Rev: 5'–CATCCATCCCTTACTTTGGAC–3' 597 4b, 4d, 4e
aSumber: Doumith et al. 2004
Reaksi amplifikasi multipleks dilakukan menggunakan QIAGEN® Multiplex PCR Kit sesuai dengan panduan perusahaan. Campuran reaksi amplifikasi mengandung 1 µl template DNA bakteri, 10 µM masing–masing primer sebanyak 0.4 µl, 10 µl 1×QIAGEN Multipleks PCR Mastermix, dan RNAse free water dengan volume akhir 20 µl. Siklus PCR diawali dengan pre-denaturasi pada suhu 95 oC selama 15 menit, diikuti dengan 35× (94 oC selama 30 detik, 57 oC selama 90 detik dan 72 oC selama 90 detik) dan ekstensi akhir pada 72
oC selama 10 menit. Produk PCR multipleks divisualisasi menggunakan
elektroforesis gel agarose 1.5% yang mengandung etidium bromida 0.4 μg/ml dan diamati menggunakan UV transluminator.
Pengurutan Oligonukleotida (Sekuensing) DNA
14
pada suhu 95 oC selama 5 menit. Campuran produk ekstensi kemudian
dimasukkan ke dalam spin column dan disentrifugasi 730×g selama 2 menit untuk mengkoleksi sampel. Tahap keempat, sampel dimasukkan ke dalam mesin sequencer untuk dibaca susunan oligonukleotidanya.
Analisa Hasil Pengurutan Oligonukleotida (Sekuensing) DNA
Hasil sekuensing DNA dianalisa dengan perangkat lunak BioEdit® sequence alignment editor (Hall 1999). Parameter yang dianalisa adalah menentukan kemiripan susunan oligonukleotida dari isolat sampel dengan beberapa strain L. monocytogenes yang terdapat pada basis data di GenBank.
Analisa Data
Seluruh data yang diperoleh dari penelitian ini dianalisa secara deskriptif.
4
HASIL DAN PEMBAHASAN
HASIL
Pengambilan Contoh Susu Segar
Contoh susu segar diambil dari 107 ekor sapi secara acak dari lokasi pemeliharaan sapi perah pada 5 kecamatan, yaitu Kecamatan Enrekang, Cendana, Baraka, Anggeraja, dan Alla. Kelima kecamatan tersebut merupakan sentra pemeliharaan sapi perah di Kabupaten Enrekang, Sulawesi Selatan. Sebanyak 107 contoh susu segar kemudian digabung menjadi 31 pool berdasarkan kandang tempat pengambilan contoh susu yang lokasinya berdekatan. Tabel 7 menampilkan jumlah contoh susu segar yang diambil dari masing–masing kecamatan.
Tabel 7 Lokasi dan jumlah contoh susu segar yang diambil dari 5 kecamatan di Kabupaten Enrekang
No. Kecamatan Jumlah sampel
15 Isolasi dan Identifikasi Listeria monocytogenes dari Susu Segar
Kultur pada Media Agar dan Uji Biokimiawi
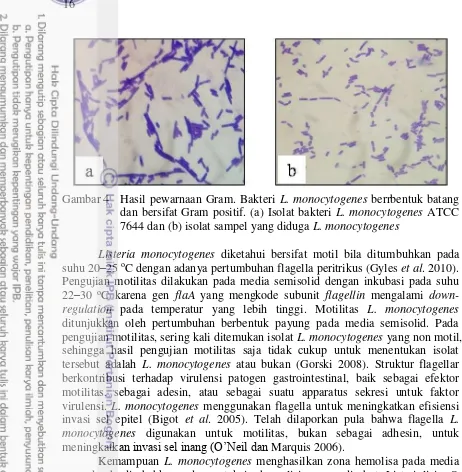
Kultur pada media Listeria Selective Agar (LSA) setelah dilakukan pengayaan pada media Listeria Enrichment Broth (LEB) menunjukkan hasil keseluruhan sampel 31 pool dapat tumbuh pada media selektif tersebut dan sebagian besar kultur terdiri atas 2 koloni bakteri yang berbeda, yaitu koloni yang membentuk halo berwarna coklat–hitam dan koloni yang tidak membentuk halo. Kultur kontrol positif bakteri Listeria monocytogenes ATCC 7644 pada media LSA menghasilkan koloni bakteri berukuran diameter 1 mm dengan halo berwarna coklat–hitam (Gambar 3a).
Gambar 3 Hasil kultur pada media LSA. Koloni yang diduga L. monocytogenes membentuk halo berwarna coklat–hitam dan berukuran 1 mm. (a) kultur isolat kontrol positif bakteri L. monocytogenes, (b) kultur isolat sampel yang diduga L. monocytogenes
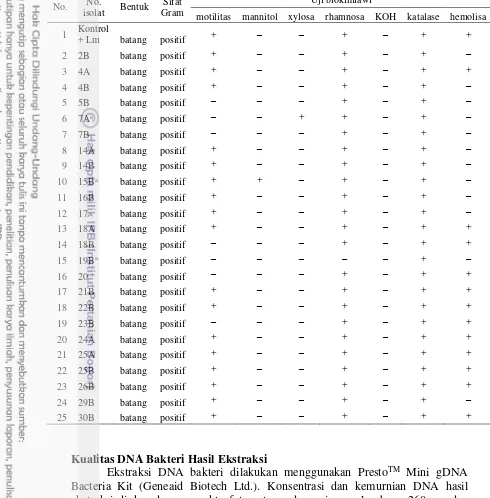
Pewarnaan Gram dari 31 koloni menunjukkan hasil sebanyak 24 koloni yang berbentuk batang dan bersifat Gram positif. Gambar 4 menunjukkan hasil pewarnaan Gram dari isolat kontrol positif dan isolat sampel diduga L. monocytogenes. Sejumlah 24 koloni yang menunjukkan bakteri Gram positif dan berbentuk batang, selanjutnya diuji lanjut dengan uji biokimiawi, yaitu uji fermentasi karbohidrat (rhamnosa, mannitol, dan xylosa), uji motilitas pada media sulfide-indol-motilitas (SIM), uji katalase, uji KOH 3%, dan uji hemolisa pada media agar darah. Tabel 8 menunjukkan hasil uji biokimiawi dari isolat L. monocytogenes ATCC 7644 dan 24 isolat sampel yang diduga L. monocytogenes.
Uji biokimiawi dari L. monocytogenes ATCC 7644 menunjukkan hasil positif untuk uji motilitas, fermentasi rhamnosa, uji KOH, dan uji hemolisa, serta hasil negatif untuk uji fermentasi xylosa, fermentasi mannitol, dan uji katalase. Hasil uji biokimiawi terhadap 24 isolat sampel menunjukkan sebanyak 21 isolat adalah L. monocytogenes. Dua puluh satu isolat tersebut menunjukkan hasil positif untuk fermentasi rhamnosa dan uji katalase, serta hasil negatif untuk fermentasi xylosa, fermentasi mannitol, dan uji KOH. Pada pengujian motilitas, terdapat 5 dari 21 isolat yang menunjukkan hasil negatif, sedangkan pada pengujian hemolisa dengan media agar darah terdapat 9 dari 21 isolat yang menunjukkan hasil negatif.
16
Gambar 4 Hasil pewarnaan Gram. Bakteri L. monocytogenes berrbentuk batang dan bersifat Gram positif. (a) Isolat bakteri L. monocytogenes ATCC 7644 dan (b) isolat sampel yang diduga L. monocytogenes
Listeria monocytogenes diketahui bersifat motil bila ditumbuhkan pada suhu 20–25 oC dengan adanya pertumbuhan flagella peritrikus (Gyles et al. 2010). Pengujian motilitas dilakukan pada media semisolid dengan inkubasi pada suhu 22–30 oC karena gen flaA yang mengkode subunit flagellin mengalami down-regulation pada temperatur yang lebih tinggi. Motilitas L. monocytogenes ditunjukkan oleh pertumbuhan berbentuk payung pada media semisolid. Pada pengujian motilitas, sering kali ditemukan isolat L. monocytogenes yang non motil, sehingga hasil pengujian motilitas saja tidak cukup untuk menentukan isolat tersebut adalah L. monocytogenes atau bukan (Gorski 2008). Struktur flagellar berkontribusi terhadap virulensi patogen gastrointestinal, baik sebagai efektor motilitas, sebagai adesin, atau sebagai suatu apparatus sekresi untuk faktor virulensi. L. monocytogenes menggunakan flagella untuk meningkatkan efisiensi invasi sel epitel (Bigot et al. 2005). Telah dilaporkan pula bahwa flagella L. monocytogenes digunakan untuk motilitas, bukan sebagai adhesin, untuk meningkatkan invasi sel inang (O’Neil dan Marquis 2006).
17
motilitas mannitol xylosa rhamnosa KOH katalase hemolisa
1 Kontrol
Ekstraksi DNA bakteri dilakukan menggunakan PrestoTM Mini gDNA
18
sebesar 1.55, nilai tersebut mengindikasikan adanya kontaminasi oleh protein atau fenol. Hasil pengukuran kualitas DNA bakteri hasil ekstraksi ditampilkan pada Lampiran 1.
Identifikasi Parsial Gen iap dan hly dari Listeria monocytogenes
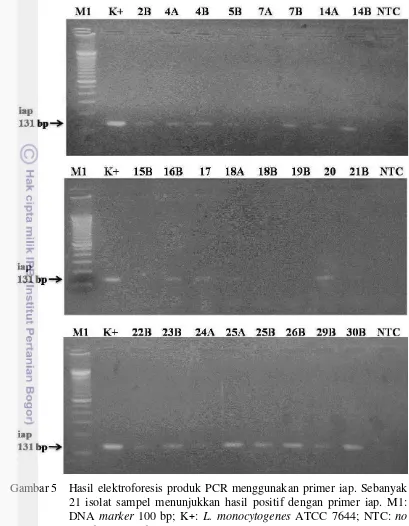
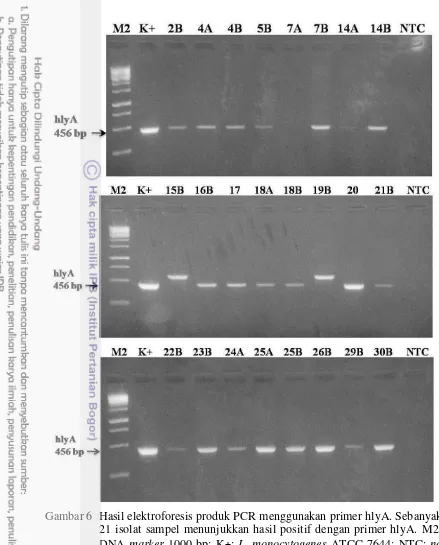
Amplifikasi DNA bakteri dilakukan terhadap isolat L. monocytogenes ATCC 7644 dan 24 isolat sampel diduga L. monocytogenes. Reaksi PCR untuk identifikasi spesies L. monocytogenes dilakukan menggunakan 2 pasang primer, yaitu iap dan hlyA. Hasil elektroforesis gel agarose dari produk PCR menggunakan primer iapsecara umum menunjukkan pita yang lebih tipis daripada hasil PCR dengan primer hlyA(Gambar 5 dan 6).
Keseluruhan hasil PCR dengan primer iap dan hlyA menunjukkan bahwa 21 isolat diidentifikasi sebagai L. monocytogenes. Hasil tersebut sesuai dengan hasil identifikasi melalui metode kultur konvensional. Tabel 9 menunjukkan resume hasil identifikasi L. monocytogenes pada 21 isolat sampel dengan metode kultur konvensional dan konfirmasi dengan PCR menggunakan 2 pasang primer. Tabel 9 Resume hasil identifikasi L. monocytogenes dengan metode kultur
19
20
Gambar 6 Hasil elektroforesis produk PCR menggunakan primer hlyA. Sebanyak 21 isolat sampel menunjukkan hasil positif dengan primer hlyA. M2: DNA marker 1000 bp; K+: L. monocytogenes ATCC 7644; NTC: no templatecontrol.
21 bakteri L. monocytogenes untuk meloloskan diri dari fagosom. Strain L. monocytogenes yang kehilangan fungsi LLO menjadi bersifat nonvirulen. Sifat sitotoksik dari LLO ditandai dengan terjadinya lisis sel darah merah pada media agar darah (yaitu β-hemolisis) dan menjadi indikasi adanya aktivitas gen virulensi (Gorski 2008).
Identifikasi Serotipe Isolat Listeria monocytogenes
Identifikasi serotipe isolat L. monocytogenes dilakukan dengan metode PCR multipleks menurut Doumith et al. (2004). Gambar 7 menunjukkan hasil elektroforesis gel agarose dari produk PCR multipleks.
22
Gen penanda yang digunakan untuk pengujian PCR multipleks adalah lmo0737 dan lmo1118 yang diidentifikasi pada sekuen L. monocytogenes strain EGDe, serta ORF2819 dan ORF2110 yang diidentifikasi pada sekuen parsial dari L. monocytogenes strain CLIP 80459 serovar 4b. Metode PCR multipleks tersebut memisahkan strain–strain L. monocytogenes ke dalam empat grup serotipe, yaitu grup 1 terdiri dari serotipe 1/2a dan 3a; grup 2 terdiri dari serotipe 1/2c dan 3c; grup 3 terdiri dari serotipe 1/2b, 3b, dan 7; dan grup 4 terdiri dari serotipe 4b, 4d, dan 4e (Doumith et al. 2004). Hasil elektroforesis produk PCR multipleks menunjukkan seluruh 21 isolat L. monocytogenes memberikan hasil positif dengan primer lmo0737 dan primer lmo1118, sehingga termasuk dalam serogrup 2, yaitu serotipe 1/2c dan 3c.
Keberadaan Listeria monocytogenes pada Susu Sapi Segar di Kabupaten Enrekang
Sampel susu segar pada penelitian ini diperoleh dari lima kecamatan yang merupakan sentra pemeliharaan sapi perah di Kabupaten Enrekang. Sebanyak 107 sampel susu segar yang diperoleh kemudian digabung menjadi 31 sampel pool. Tahap isolasi dan identifikasi dengan metode kultur konvensional dan konfirmasi dengan PCR mendeteksi keberadaan bakteri L. monocytogenes pada 21 dari 31 isolat. Tabel 10 menampilkan asal sampel dan jumlah isolat yang terdeteksi L. monocytogenes.
Tabel 10 Asal sampel dan jumlah isolat yang terdeteksi L. monocytogenes No. Kecamatan Jumlah isolat
sampel
Proses pengambilan sampel susu segar untuk penelitian ini telah dilakukan secara aseptik, yaitu dimulai dengan membersihkan ambing sebelum melakukan pemerahan dan selanjutnya sampel susu segar langsung ditampung dalam botol kaca steril. Keberadaan bakteri L. monocytogenes yang ditemukan pada sampel susu segar pada penelitian ini diduga berasal dari sapi yang terinfeksi L. monocytogenes namun tidak menunjukkan gejala klinis. Hewan ternak yang terinfeksi L. monocytogenes dapat melepaskan bakteri tersebut melalui feses dan susu. Pada ruminansia, infeksi L. monocytogenes diketahui dapat menyebabkan ensefalitis dan infeksi uterus. Infeksi uterus ditandai dengan terjadinya aborsi dan atau septikemia pada fetus. Bentuk ensefalitis pada hewan yang mengalami listeriosis ditandai dengan gejala gangguan saraf, misalnya hipersalivasi dan paralisis unilateral pada wajah (Low dan Donachie 1997) .
23
Gambar 8 Kondisi kandang tempat pengambilan sampel susu segar. Kandang yang kotor memungkinkan transmisi L. monocytogenes dari lingkungan ke hewan ternak. (a) kandang sapi tanpa saluran urin dan feses yang memadai, (b) tempat pakan dan air minum, (c) tempat penyimpanan hijauan.
Usaha ternak di Kabupaten Enrekang masih dilaksanakan secara tradisional. Pemeliharaan sapi umumnya dilakukan sendiri oleh pemilik ternak tanpa bantuan tenaga kerja tambahan. Proses pemerahan susu juga masih dilakukan secara manual, yaitu susu segar ditampung dalam wadah berupa ember ataupun wadah penampung dari kaleng, untuk langsung diolah menjadi produk lain. Pengamatan yang dilakukan pada lokasi pengambilan sampel untuk penelitian ini menunjukkan kondisi kandang yang umumnya kurang bersih. Saluran pembuangan feces dan urin ternak masih buruk, demikian pula dengan tempat penyimpanan pakan ternak dan air minum (Gambar 8). Kondisi kandang tersebut dapat menjadi sumber transmisi L. monocytogenes ke hewan ternak.
Pengurutan Oligonukleotida Listeria monocytogenes
24
Tabel 11 Analisa kemiripan urutan oligonukleotida isolat sampel L. monocytogenes dengan basis data GenBank
No. Strain L. monocytogenes Kode akses Genbank
25
26
PEMBAHASAN
Bakteri L. monocytogenes yang tumbuh pada media laboratorium atau pada bahan pangan memerlukan faktor–faktor intrinsik dan ekstrinsik media bakteri tersebut. Kondisi yang diperlukan oleh L. monocytogenes dalam pertumbuhannya adalah pH antara 4.39–9.4, suhu -1.5–45 ⁰C, aw minimum 0.90
dan nutrisi esensial seperti asam amino (isoleusin, leusin, glutamate, valin, methionin, arginin, sistein, histidin, dan triptofan) serta biotin, riboflavin, dan thiamin (Lovett et al. 1990, Donnelly 2001). Media pengayaan Buffered Listeria Enrichment Broth (LEB) yang digunakan dalam penelitian ini merupakan media tumbuh yang baik bagi L. monocytogenes dengan kandungan soya broth, yeast extract, potassium dihydrogen orthophosphate, dan disodium hydrogen orhthophosphate dengan pH 7.3+0.2. Media Listeria Selective Agar digunakan untuk menghambat pertumbuhan bakteri selain Listeria. Tahap isolasi dengan metode kultur konvensional dan uji biokimiawi menghasilkan sebanyak 21 isolat dinyatakan sebagai L. monocytogenes yang selanjutnya dilakukan konfirmasi spesies dengan metode PCR.
Reaksi PCR untuk identifikasi spesies L. monocytogenes dilakukan menggunakan dua pasang primer, yaitu iap dan hlyA. Primer iap didesain dari gen iap yang mengkode invasive associated protein (p60), sedangkan primer hlyA didesain dari gen hly yang mengkode Listeriolisin O (LLO). Reaksi PCR menunjukkan bahwa 21 isolat diidentifikasi sebagai L. monocytogenes, hasil tersebut sesuai dengan hasil identifikasi melalui metode kultur konvensional. Beberapa penelitian menunjukkan bahwa deteksi L. monocytogenes dalam bahan pangan dengan metode PCR baru bisa menunjukkan hasil yang sama dengan metode konvensional bila jumlah minimal bakteri di dalam bahan pangan tersebut adalah 100 sel/gram. Konsentrasi bakteri yang lebih rendah bisa dideteksi dengan melakukan kombinasi metode kultur pengayaan dan PCR. Bila pada bahan makanan yang diuji terdapat konsentrasi sel bakteri mati yang tinggi, dapat terdeteksi melalui uji PCR sehingga dilakukan kultur pengayaan sebelum PCR untuk menambah jumlah sel yang masih hidup saja (Josephson et al. 1993, Manzano et al. 1996). Karakterisasi molekular melalui analisa hasil pengurutan oligonukleotida dari isolat sampel L. monocytogenes yang diperoleh dalam penelitian ini menunukkan terdapat kesamaan sebesar 99% dengan strain–strain L.monocytogenes yang terdapat pada basis data GenBank.
27 yang berbeda, yaitu seluruh isolat L. monocytogenes yang diisolasi termasuk dalam serogrup 3, yang terdiri dari serotipe 1/2b, 3b, dan 7.
Penentuan serotipe L. monocytogenes memiliki implikasi klinis, yaitu diketahui bahwa serotipe 4b menyebabkan listeriosis endemik pada manusia sedangkan serotipe 1/2a, 1/2b, dan 1/2c menjadi penyebab listeriosis sporadik. Penelitian yang dilakukan oleh Goulet et al. (2006) di Perancis menyebutkan bahwa serotipe 4b, 1/2a, 1/2b, dan 1/2c yang paling banyak diisolasi dari kasus klinis listeriosis pada manusia, dari jumlah tersebut serotipe 4b menjadi penyebab 49% kasus penyakit endemik foodborne yang dikaitkan dengan Listeria. Pada studi yang dilakukan oleh Barbour et al. (2001), L. monocytogenes serotipe 4b, 1/2a, 1/2b, dan 1/2c menunjukkan infektivitas yang tinggi setelah inokulasi intragastrik pada hewan mencit. Pada penelitian tersebut diketahui pula bahwa seluruh serotipe dari L. monocytogenes, kecuali serotipe 4a, mampu menyebabkan kematian mencit.
5 KESIMPULAN DAN SARAN
Kesimpulan
Bakteri L. monocytogenes dapat diisolasi dari contoh susu sapi segar yang diperoleh dari Kabupaten Enrekang, Sulawesi Selatan. Isolasi dan identifikasi yang dilakukan dengan metode kultur konvensional dan PCR menunjukkan hasil yang sama, yaitu sebanyak 21 isolat diidentifikasi sebagai L. monocytogenes. Hasil analisa kemiripan urutan oligonukelotida dari isolat sampel L. monocytogenes yang diperoleh pada penelitian ini menunjukkan persentase nilai kemiripan sebesar 99% dengan beberapa strain L. monocytogenes yang terdapat pada basis data di GenBank. Identifikasi serotipe menunjukkan bahwa keseluruhan 21 isolat tersebut termasuk dalam serotipe 1/2c dan 3c, hasil tersebut berbeda dengan yang sudah pernah ditemukan di Indonesia.
Saran
28
DAFTAR PUSTAKA
Barbas CF, Burton DR, Scott JK, Silverman GJ. 2001. Quantification of DNA and RNA, CSH Protocol. New York (US): Cold Spring Harbour.
Barbour AH, Rampling A, Hormaeche CE. 2001. Variation in the infectivity of Listeria monocytogenes isolates following intragastric inoculation of mice. Infect Immun 69(7): 4657–4660.
Bigot A, Pagniez H, Botton E et al. 2005. Role of FliF and FliI of Listeria monocytogenes inflagellar assembly and pathogenicity. Infect Immun 73:5530– 5539.
Borucki MK, Call DR. 2003. Listeria monocytogenes serotype identification by PCR. J Clin Microbiol 41:5537–5540.
[BPS] Badan Pusat Statistik (ID). 2014. Kabupaten Enrekang dalam Angka. Kabupaten Enrekang (ID): BPS Kabupaten Enrekang.
Bubert A, Kholer S, Goebel W. 1991. The homologous and heterologous regions within the iap gene allow Genus– and Species–specific identification of Listeria spp. by polymerase chain reaction. Appl Environ Microbiol 58: 2625– 2632.
[CAC] Codex Almentarius Commission (US). 2007. Guidelines on The Application of General Principles of Food Hygiene to The Control of Listeria monocytogenes in Foods [Internet]. Codex Alimentarius. [diunduh 2014 Januari 17]. Tersedia pada: http://www.codexalimentarius.org/standards/list-of-standards/.
Dalton CB, Austin CC, Sobel J, Hayes PS, Bibb WF, Graves LM, Swaminathan B, Proctor ME, Griffin PM. 1997. An outbreak of gastroenteritis and fever due to Listeria monocytogenes in milk. N Engl J Med 336: 100–105.
Donnelly CW. 2001. Listeria monocytogenes. Di dalam: Hui YH, Pierson MD, Gorham JR, editor. Foodborne Disease Handbook 2nd Edition. New York (US): Marcel Dekker Inc. hlm 213–245.
Doumith M, Buchrieser C, Glaser P, Jacquet C, Martin P. 2004. Differentiation of major Listeria monocytogenes serovars by multiplex PCR. J Clin Microbiol 42(8): 3819–3822.
Doumith M, Cazalet C, Simoes N, Frangeul L, Jacquet C, Kunst F, Martin P, Cossart P, Glaser P, Buchrieser C. 2003. New aspects regarding evolution and virulence of Listeria monocytogenes revealed by comparative genomics and DNA arrays. Infect Immun 72(2): 1072–1083
Doyle MP, Glass KA, Bee ry JT, Garcia GA, Pollard DJ, Schultz RD. 1987. Survival of Listeria monocytogenes in milk during high temperature, short time pasteurization. App Enviro Microbiol 53: 1433–1438.
Farber JM, Peterkin PI. 1991. Listeria monocytogenes, a food-borne pathogen. Microbiol Reviews 55(3): 476–511
Forsythe SJ, Hayes PS. 1998. Food Hygiene, Microbiology and HACCP3rd Edition. Gaithersburg, Maryland (US): Aspen Publisher, Inc.
[FSAI] Food Safey Authority of Ireland (IE). 2005. The Control and Management of Listeria monocytogenes Contamination of Food. Dublin (IE): FSAI.
29 Infections in Animals 4th edition. New Jersey (US): Wiley-Blackwell.
Hamon M, Bierne H, Cossart P. 2006. Listeria monocytogenes: a multifaceted model. Nature Rev Microbiol 4: 423–434.
Hall TA. 1999. Bioedit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucl Acids Symp Ser 41: 95–98. Jacquet C, Gouin E, Jeannel D, Cossart P, Rocourt J. 2002. Expression of ActA,
Ami, IniB, and listeriolysin O in Listeria monocytogenes of human and food origin. Appl Environ Microbiol 62: 1461–1466.
Johansson T. 1998. Enhanced detection and enumeration of Listeria monocytogenes from foodstuffs and food processing environments. Int J Food Microbiol 40: 77–85.
Josephson KL, Gerba CP, Pepper IL. 1993. Polymerase chain reaction detection of nonviable bacterial pathogens. Appl Environ Microbiol 59: 3513–3515. Liu D. 2006. Identification, subtyping, and virulence determination of Listeria
monocytogenes, an important foodborne pathogen. J Med Microbiol 55: 645– 659.
Lovett J, Wesley IV, Vandermaaten MJ, Bradshaw JG, Francis DW, Crawford RG, Donnelly CW, Messer JW. 1990. High–temperature short–time pasteurization inactivates Listeria monocytogenes. J Food Protect 53(9): 734–738.
Lovett J, Twedt RM. 2004. Scientific Status Summary, Bacteria Associated with Foodborne Diseases. Chicago (US): Institute of Food Technology.
Low JC, Donachie W. 1997. A review of Listeria monocytogenes and listeriosis. Vet J 153: 9–29.
Manzano M, Cocolin L, Ferroni P, Cantoni C, Comi G. 1996. A simple and fast PCR protocol to detect Listeria monocytogenes from meat. J Sci Food Agric 74: 25–30.
O’Neil HS, Marquis H. 2006. Listeria monocytogenes flagella are used for motility, not as adhesins, to increase host cell invasion. Infect Immun 74:6675– 6681.
Parrisius J, Bhakdi S, Roth M, Tranum-Jensen J, Goebel W, Seelinger HPR. 1986. Production of listeriolysin by beta–hemolytic strains of Listeria monocytogenes. Infect Immun 51: 314–319.
Pine L, Malcolm GB, Brooks JB, Daneshvar MI. 1989. Physiological studies on the growth and utilization of sugars by Listeria species. Can J Microbiol 35: 245–254.
Piyasena P, Liou S, McKellar RC. 1998. Predictive modeling of inactivation of Listeria spp. in bovine milk during high-temperature short-time pasteurization. Int J Food Microbiol 39: 167–173.
30
Sanjaya AW, Sudarwanto M, Soedjoedono RR, Purnawarman T, Lukman DW, Latif H. 2007. Higiene Pangan. Bagian Kesehatan Masyarakat Veteriner Departemen Ilmu Penyakit Hewan dan Kesmavet. Bogor (ID): FKH IPB. Seeliger HPR, Jones D. 1986. Listeria. Di dalam: Sneath PHA, Nair NS, Sharpe
NE, Holt JG, Editor. Bergey’s Mannual of Systematic Bacteriology Volume 2. Baltimore (US): Williams and Wilkins. hlm1235–1245.
Sugiri YD, Kleer J, Golz G, Meeyam T, Chaisowwong W, Alter T. 2013. Prevalence and antimicrobial susceptibility of Listeria monocytogenes in fresh poultry products in Bandung, Indonesia [Internet]. [diunduh 2014 Mei 30]. Tersedia pada: http://disnak.jabarprov.go.id/files_arsip/Chicken_Listeria_ Prevalence_Bandung_YONI.pdf
Swetha CS, Rao TM, Krishnaiah N, Kumar V. 2012. Detection of Listeria monocytogenes in fish samples by PCR assay. Annals Biol Res 3(4):1880–1884. Vincente MF, Baquero F, Perez-Diaz JC. 1985. Cloning and expression of the
Listeria monocytogenes haemolysin in Escherichia coli. FEMS Microbiol 30: 77–79.
Wiedmann M, Bruce JL, Knorr D, Bodis M, Cole EM, McDowell CI, McDonough PL, Batt CA. 1996. Ribotype diversity of Listeria monocytogenes strain associated with outbreaks of listeriosis in ruminants. J Clin Microbiol 34: 1086–1090.
31
LAMPIRAN
Lampiran 1 Hasil pengukuran kualitas DNA bakteri hasil ekstraksi
No. No. isolat A 260 nm A 280 nm A260/A280 Konsentrasi DNA (ng/μl)
1. Kontrol + 1.647 0.900 1.83 82.3
2. 2B 0.582 0.344 1.69 29.1
3. 4A 2.056 1.051 1.96 102.8
4. 4B 4.823 3.119 1.55 241.2
5. 5B 2.252 1.195 1.88 112.6
6. 7A 0.009 0.007 2.34 45.26
7. 7B 3.003 1.654 1.82 150.2
8. 14A 1.267 0.627 2.02 63.3
9. 14B 1.443 0.787 1.83 72.1
10. 15B 0.118 0.053 1.92 59.1
11. 16B 1.450 0.786 1.85 72.5
12. 17 3.657 1.810 2.02 182.8
13. 18A 1.012 0.501 2.02 50.6
14. 18B 2.653 1.361 1.95 132.7
15. 19B 0.370 0.150 1.55 185.1
16. 20 3.255 1.727 1.88 162.7
17. 21B 2.427 1.284 1.89 121.3
18. 22B 0.453 0.245 1.85 22.6
19. 23B 0.938 0.492 1.91 46.9
20. 24A 0.824 0.445 1.85 41.2
21. 25A 1.181 0.645 1.83 59.0
22. 25B 0.842 0.446 1.89 42.1
23. 26B 1.775 0.928 1.89 87.7
24. 29B 0.219 0.107 2.04 10.9
25. 30B 0.655 0.347 1.89 32.8
32
Lampiran 2 Hasil pengurutan oligonukleotida dari isolat kontrol positif L. monocytogenes ATCC 7644 dan isolat sampel 18A, 18B, 20, 25A, dan 25B
....|....| ....|....| ....|....| ....|....| ....|....| ....|....|
5 15 25 35 45 55 2161190_K_ --GTTATCTC TGCA-ATATC TCA-GTGTGG CGTATGGCCG TCAAGTTTAT TTGAAATTAT
2161193_18 -AGGTATCTC TGCATATATC TCA-GTGTGG CGTATGGCCG TCAAGTTTAT TTGAAATTAT 2161195_18 -GAGTATCTC TGCA-ATATC TCA-GTGTGG CGTATGGCCG TCAAGTTTAT TTGAAATTAT 2161198_20 --GCGATCTC TGCATATATC TCA-GTGTGG CGTATGGCCG TCAAGTTTAT TTGAAATTAT 2161201_25 ---CAATCTC TGCATATATC TCA-GTGTGG CGTATGGCCG TCAAGTTTAT TTGAAATTAT 2161203_25 GCCCCATCTC TGCATATATC TCAAGTGTGG CGTATGGCCG TCAAGTTTAT TTGAAATTAT Clustal Co ***** **** ***** *** ****** ********** ********** **********
....|....| ....|....| ....|....| ....|....| ....|....| ....|....|
65 75 85 95 105 115 2161190_K_ CAACTAATTC CCATAGTACT AAAGTAAAAG CTGCTTTTGA TGCTGCCGTA AGCGGAAAAT
2161193_18 CAACTAATTC CCATAGTACT AAAGTAAAAG CTGCTTTTGA TGCTGCCGTA AGCGGAAAAT 2161195_18 CAACTAATTC CCATAGTACT AAAGTAAAAG CTGCTTTTGA TGCTGCCGTA AGCGGAAAAT 2161198_20 CAACTAATTC CCATAGTACT AAAGTAAAAG CTGCTTTTGA TGCTGCCGTA AGCGGAAAAT 2161201_25 CAACTAATTC CCATAGTACT AAAGTAAAAG CTGCTTTTGA TGCTGCCGTA AGCGGAAAAT 2161203_25 CAACTAATTC CCATAGTACT AAAGTAAAAG CTGCTTTTGA TGCTGCCGTA AGCGGAAAAT Clustal Co ********** ********** ********** ********** ********** **********
....|....| ....|....| ....|....| ....|....| ....|....| ....|....|
125 135 145 155 165 175 2161190_K_ CTGTCTCAGG TGATGTAGAA CTAACAAATA TCATCAAAAA TTCTTCCTTC AAAGCCGTAA
2161193_18 CTGTCTCAGG TGATGTAGAA CTAACAAATA TCATCAAAAA TTCTTCCTTC AAAGCCGTAA 2161195_18 CTGTCTCAGG TGATGTAGAA CTAACAAATA TCATCAAAAA TTCTTCCTTC AAAGCCGTAA 2161198_20 CTGTCTCAGG TGATGTAGAA CTAACAAATA TCATCAAAAA TTCTTCCTTC AAAGCCGTAA 2161201_25 CTGTCTCAGG TGATGTAGAA CTAACAAATA TCATCAAAAA TTCTTCCTTC AAAGCCGTAA 2161203_25 CTGTCTCAGG TGATGTAGAA CTAACAAATA TCATCAAAAA TTCTTCCTTC AAAGCCGTAA Clustal Co ********** ********** ********** ********** ********** **********
....|....| ....|....| ....|....| ....|....| ....|....| ....|....|
185 195 205 215 225 235 2161190_K_ TTTACGGAGG TTCCGCAAAA GATGAAGTTC AAATCATCGA CGGCAACCTC GGAGACTTAC
2161193_18 TTTACGGAGG TTCCGCAAAA GATGAAGTTC AAATCATCGA CGGCAACCTC GGAGACTTAC 2161195_18 TTTACGGAGG TTCCGCAAAA GATGAAGTTC AAATCATCGA CGGCAACCTC GGAGACTTAC 2161198_20 TTTACGGAGG TTCCGCAAAA GATGAAGTTC AAATCATCGA CGGCAACCTC GGAGACTTAC 2161201_25 TTTACGGAGG TTCCGCAAAA GATGAAGTTC AAATCATCGA CGGCAACCTC GGAGACTTAC 2161203_25 TTTACGGAGG TTCCGCAAAA GATGAAGTTC AAATCATCGA CGGCAACCTC GGAGACTTAC Clustal Co ********** ********** ********** ********** ********** **********
....|....| ....|....| ....|....| ....|....| ....|....| ....|....|
245 255 265 275 285 295 2161190_K_ GCGATATTTT GAAAAAAGGC GCTACTTTTA ATCGAGAAAC ACCAGGAGTT CCCATTGCTT
2161193_18 GCGATATTTT GAAAAAAGGC GCTACTTTTA ATCGAGAAAC ACCAGGAGTT CCCATTGCTT 2161195_18 GCGATATTTT GAAAAAAGGC GCTACTTTTA ATCGAGAAAC ACCAGGAGTT CCCATTGCTT 2161198_20 GCGATATTTT GAAAAAAGGC GCTACTTTTA ATCGAGAAAC ACCAGGAGTT CCCATTGCTT 2161201_25 GCGATATTTT GAAAAAAGGC GCTACTTTTA ATCGAGAAAC ACCAGGAGTT CCCATTGCTT 2161203_25 GCGATATTTT GAAAAAAGGC GCTACTTTTA ATCGAGAAAC ACCAGGAGTT CCCATTGCTT Clustal Co ********** ********** ********** ********** ********** **********
....|....| ....|....| ....|....| ....|....| ....|....| ....|....|
305 315 325 335 345 355 2161190_K_ ATACAACAAA CTTCCTAAAA GACAATGAAT TAGCTGTTAT TAAAAACAAC TCAGAATATA
2161193_18 ATACAACAAA CTTCCTAAAA GACAATGAAT TAGCTGTTAT TAAAAACAAC TCAGAATATA 2161195_18 ATACAACAAA CTTCCTAAAA GACAATGAAT TAGCTGTTAT TAAAAACAAC TCAGAATATA 2161198_20 ATACAACAAA CTTCCTAAAA GACAATGAAT TAGCTGTTAT TAAAAACAAC TCAGAATATA 2161201_25 ATACAACAAA CTTCCTAAAA GACAATGAAT TAGCTGTTAT TAAAAACAAC TCAGAATATA 2161203_25 ATACAACAAA CTTCCTAAAA GACAATGAAT TAGCTGTTAT TAAAAACAAC TCAGAATATA Clustal Co ********** ********** ********** ********** ********** **********
....|....| ....|....| ....|....| ....|....| ....|....| ....|....|
365 375 385 395 405 415 2161190_K_ TTGAAACAAC TTCAAAAGCT TATACAGATG GAAAAATTAA CATCGATCAC TCTGGAG-AT
34
36
38
39
RIWAYAT HIDUP
Penulis dilahirkan di Ujungpandang pada tanggal 15 Februari 1984 sebagai anak kedua dari pasangan Bapak Totok Prawitosari dan Ibu Suprapti. Pada tahun 2011, penulis menikah dengan Rohan Nurhadi dan dikaruniai seorang putra yang lahir pada tahun 2012.
Penulis menempuh pendidikan sekolah dasar hingga menengah atas di kota Makassar. Tahun 2001, penulis menempuh pendidikan S1 Kedokteran Hewan di Fakultas Kedokteran Hewan IPB, selanjutnya menyelesaikan Pendidikan Profesi Dokter Hewan pada tahun 2007. Sejak tahun 2010 sampai dengan saat ini, penulis bekerja sebagai staf dosen di Fakultas Peternakan Universitas Hasanuddin, Makassar.