RESPONS KETAHANAN SEPULUH KULTIVAR OYONG
(Luffa acutangula (L.)Roxb.) TERHADAP INFEKSI
Squash mosaic comovirus
DIAN SARASWATI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul “Respons Ketahanan Sepuluh Kultivar Oyong (Luffa acutangula (L.)Roxb.)terhadap Infeksi Squash mosaic comovirus”adalah benar karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Dian Saraswati NIM A34110065
____________________
ABSTRAK
DIAN SARASWATI. Respons Ketahanan Sepuluh Kultivar Oyong (Luffa acutangula (L.) Roxb.) terhadap Infeksi Squash mosaic comovirus. Dibimbing oleh TRI ASMIRA DAMAYANTI.
Squash mosaic comovirus (SqMV) merupakan salah satu virus penting yang menginfeksi tanaman Cucurbitaceae, termasuk oyong. Data mengenai respons ketahanan tanaman oyong belum tersedia.Dengan demikian, tujuan penelitian ini adalah untuk menguji respons ketahanan kultivar komersial terhadap infeksi SqMV. Sepuluh kultivar komersial diuji dengan inokulasi mekanis.Peubah pengamatan adalah waktu inkubasi, tipe gejala, insidensi, dan keparahan penyakit, titer virus serta karakter agronomi.Titer virus dideteksi secara serologi menggunakan antiserum spesifik SqMV dengan metode DAS-ELISA.Gejala paling awal muncul pada kultivar Essenza sedangkan paling akhir muncul pada kultivar Anggun F1 dengan waktu inkubasi berkisar dari 3.1 sampai4.4 hari setelah inokulasi.Seluruh tanaman terinfeksi menunjukkan gejala mosaik ringan hingga berat bergantung pada kultivar dengan skor keparahan tanaman berkisar dari 2.20 sampai 3.57 dan insidensi penyakit mencapai 100%.Kultivar Essenza memiliki titer virus tertinggi dan Anggun F1 terendah.Infeksi pada tanaman menunjukkan penurunan tinggi tanaman, jumlah bunga, bobot basah, dan bobot kering tanaman dibandingkan tanaman kontrol.Berdasarkan peubah pengamatan, kultivar Hebata, Estilo, Azura F1, danEssenza tergolong sangat rentan, kultivar Jaka F1, Mahkota, Bidara, dan Grandia F1 tergolong rentan dan kultivar Anggun F1 dan Prima F1 tergolong toleran terhadap infeksi SqMV.
ABSTRACT
DIAN SARASWATI. Resistance Response of Ten Ridged Gourd (Luffa acutangula (L.) Roxb.) Cultivars against Squash mosaic comovirus Infection. Supervised by TRI ASMIRA DAMAYANTI.
Squash mosaic comovirus (SqMV) is one of the important viruses infecting cucurbits including ridged gourd. The data related resistance response to SqMV of this plant species is not available yet. Thus, the aim of this research was to evaluate the resistance response of commercial ridged gourd cultivars against SqMV infection. Ten commercial cultivars were tested by inoculating SqMV mechanically. Incubation time, type of symptom, disease incidence, severity and virus titre were recorded as well as agronomic characters. The earliest symptom appearance was present on Essenza cultivar and the latest one on Anggun F1 cultivar with incubation time ranged from 3.1 to 4.4 days post-inoculation. The infected plants showed mild to severe mosaic symptom depend on cultivars with severity score ranged from 2.20 to 3.57 and disease incidence up to 100%. Essenza cultivars had the highest viral titre and Anggun F1 had the lowest one. The infected plants showed reduction of plant growth, number of flowers, fresh and dry weight compared with healthy plants. Based on thosevariables, Hebata, Estilo, Azura F1 and Essenza cultivars are classified as very susceptible, while Jaka F1, Mahkota, Bidara, and Grandia F1 cultivars are susceptible, and Anggun F1, and Prima F1 cultivar are tolerant against SqMV infection.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
RESPONS KETAHANAN SEPULUH KULTIVAR OYONG
(Luffa acutangula (L.)Roxb.) TERHADAP INFEKSI
Squash mosaic comovirus
DIAN SARASWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
NIM : A34110065
Disetujui oleh
Diketahui oleh
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu waTa’ala atas segala karunia-Nya sehingga karya ilmiah dengan judul “Respons Ketahanan Sepuluh Kultivar Oyong (Luffa acutangula (L.)Roxb.)terhadap Infeksi Squash mosaic comovirus” dapat diselesaikan.
Terima kasih penulis ucapkan kepadaDr. Ir. Tri Asmira Damayanti, M.Agr selaku pembimbing skripsi yang telah banyak membimbing, memberikan masukan, dan saran. Terima kasih kepada Dr. Ir. Pudjianto, M.Si selaku dosen pembimbing akademik yang telah membimbing selama periode akademik berlangsung dan Ir. Djoko Prijono, MAgrSc selaku dosen penguji tamu atas masukan dan saran. Penulis juga mengucapkan terima kasih kepadaorang tua dan kakak atas do’a yang selalu menyertai penulis. Terima kasih kepada M Reza Firdaus, Winarsih, Nur Unsyah Laili, Hany Zetira Putri, Anysa Riska Utomo, Rizky Yunita Putri, Hilda Ayu Kusumaningrum, Aliftya Ramadhani dkk dan seluruh teman-teman Proteksi Tanaman angkatan 48 atas bantuan do’a dan dukungannya. Terimakasih kepada Sari Nurulita SP, M.Si dan seluruh anggota Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman IPB.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2015
DAFTAR ISI
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
Manfaat Penelitian ... 2
BAHAN DAN METODE ... 3
Tempat dan WaktuPenelitian ... 3
Metode Penelitian ... 3
Perbanyakan Inokulum ... 3
Penyiapan Tanaman Uji dan Inokulasi ... 3
Peubah Pengamatan ... 3
Deteksi Virus ... 4
DIBA (Dot Immunobinding Assay) ... 4
DAS (Double Antibody Sandwich) ELISA ... 5
Analisis Data ... 5
HASIL DAN PEMBAHASAN ... 6
Hasil ... 6
Pengaruh Inokulasi SqMV terhadap Waktu Inkubasi, Insidensi Penyakit dan Tipe Gejala ... 96 Pengaruh Inokulasi SqMV terhadap Keparahan Penyakit dan Titer virus ... 97 Pengaruh Inokulasi SqMV terhadap Pertumbuhan Tanaman ... 8
Pengaruh Inokulasi SqMV terhadap Bobot Tanaman ... 10
Respons Sepuluh Kultivar Oyong terhadap SqMV ... 10
Pembahasan Umum ... 12
SIMPULAN DAN SARAN ... 15
DAFTAR PUSTAKA ... 16
DAFTAR TABEL
1 Pengaruh infeksi SqMV terhadap waktu inkubasi, insidensi penyakitdan tipe gejala ... 86 2 Pengaruh infeksi SqMV terhadap keparahan penyakit dan titer virus ... 8 3 Respons ketahanan sepuluh kultivar oyong terhadap SqMV ... 11
DAFTAR GAMBAR
1 Skala kategori serangan penyakit a. skor 1, b. skor 2, c. skor 3, d. skor 4, e. skor 5 ... 84 2 Gejala infeksi SqMV pada tiap kultivar. a. kontrol, (b-c). kultivar
Mahkota dan Hebata (mosaik hijau gelap terang), (d-h). kultivar Jaka F1, Anggun F1, Bidara, Prima F1 dan Grandia F1 (bercak klorosis), (i-k). kultivar Estilo, Azura F1, Esenza (mosaik kuning dan vein clearing) ... 7 3 Pengaruh infeksi SqMV terhadap tinggi tanaman pada 2 MSI (a) dan 4
MSI (b) ... 9 4 Pengaruh infeksi SqMV terhadap jumlah bunga ... 9 5 Pengaruh infeksi SqMV terhadap bobot basah (a) dan bobot kering
tanaman (b) ... 10
6 ...
DAFTAR LAMPIRAN
1 Pengaruh infeksi SqMV terhadap tinggi pada tanaman oyong pada 1-4
MSI ... 21 2 Pengaruh infeksi SqMV terhadap jumlah dan penurunan bunga ... 22 3 Pengaruh infeksi SqMV terhadap jumlah dan penurunan bobot basah
tanaman ... 22 4 Pengaruh infeksi SqMV terhadap jumlah dan penurunan bobot kering
tanaman ... 23 5 Nilai absorbansi ELISA komposit tiap kultivar ... 23 6 Hasil deteksi DIBA tiap tanaman uji dengan antiserum SqMV ... 24 7 Data suhu dan kelembapan bulanan rumah kaca Cikabayan wilayah
PENDAHULUAN
Latar Belakang
Oyong (Luffa acutangula; Cucurbitaceae) disebut juga gambas, emes atau kimput (Sunda), dan timput (Palembang).Tanaman ini berasal dari India dan telah beradaptasi dengan baik di Asia Tenggara termasuk Indonesia.Buah muda merupakan bagian yang umum dikonsumsi.Selain itu, bagian dalam buah tua digunakan untuk sabut, daun untuk lalap dan obat bagi penderita demam.Produktivitas tanaman ini masih sangat rendah, karena hanya digunakan sebagai tanaman sela atau tanaman musiman, padahal tanaman oyong toleran terhadap berbagai jenis tanah; hampir semua jenis tanah cocok ditanami oyong. Tanah yang paling ideal untuk budidaya oyong adalah jenis tanah liat berpasir, misalnya tanah latosol, aluvial, dan podsolik merah kuning (Edi dan Bobihoe 2010).
Kendala budidaya tanaman oyong adalahmedia tanam yang digunakan, teknik penanaman,kelembapan optimal (50-60%) dansuhu optimal (18-24°C)(Edi dan Bobihoe 2010). Adapun kendala lainyaitu gangguan hama dan penyakit. Hama yang sering menyerang oyong adalah kutudaun (Aphis gossypii), oteng-oteng (Epilachna sp.), serta kumbang daun (Aulacophora similis) dan Diaphania indica (Barma dan Jha 2014), sedangkan penyakit yang sering menginfeksi adalah rebah kecambah (Pythium sp.), antraknosa (Colletotrichum orbiculare), embun tepung (Erysiphe cichoracearum), embun bulu (Pseudoperonospora cubensis), busuk buah (Phytophthora capsici) dan virus mosaik (Dana dan Lerner 2000).
Salah satu virus yang menyerang tanaman oyong adalah Squash mosaic virus (SqMV; Comovirus) (Shikata 1998). Partikel SqMV berbentuk isometris dengan diameter 28 nm. Virus ini memiliki titik panas inaktivasi (thermal inactivation point) pada suhu 65-70 oC, titik batas pengenceran (dilution end point) 10-4-10-5 dan ketahanan in vitro(longevity in vitro) 5-6 hari. Infeksi SqMV dilaporkan di Maroko (Lockhart 1982), Iran (Izadpanah 1987), Australia, Selandia Baru (Envirologix 1998), Israel, Jepang, dan Cina (Han et al. 2002).Virus ini berhasil diidentifikasi dan dipublikasikan pada tahun 1934 di California (Nelson dan Knuhtsen 1973).
Virus ini dapat menyebabkan gejala mosaik kuning dimulai dari tepi daun, belang hijau tua dan hijau muda atau klorosis dengan berbagai macam corak pada daun.Bentuk daun dapat berubah menjadi berkerut, kerdil, bagian tepi menggulung ke bawah atau ke atas.SqMV dapat ditemukan pada benih, bunga jantan dan betina.Infeksi SqMV menyebar secara sistemik sehingga dapat menyebabkan kehilangan ekonomi dan kerusakan tanaman yang sulit diatasi.SqMV dapat ditularkan secara mekanis melalui kontak antar tanaman, benih dan grafting(Envirologix 1998). Selain ituSqMV dapat ditularkan melalui serangga vektor kumbang Acalymma trivittata (western striped cucumber beetle) dan Diabrotica undecimpunctata howardi (spotted cucumber beetle) dan kumbang dari famili Coccinellidae (Freitag 1956; Grogan etal. 1959; Cohen dan Nitzany 1963; Lastra dan Munz 1969; Thomas 1973).
2
virus berasosiasi dengan inang dan sebaliknya.Reaksi pada tanaman yang terinfeksi virus terjadi akibat adanya sistem imunitas.Imunitas adalah kemampuan dalam mempertahankan fungsi pada tanaman agar tetap berjalan dengan baik.Tanaman yang resisten terhadap virus mampu mematikan sel-sel di sekitar tempat patogen menyerang sehingga virus tidak dapat merusak dan melanjutkan infeksinya.Tanaman toleran yaitu tanaman yang masih dapat berproduksi walaupun tanaman tersebut telah terinfeksi virus.Tanaman rentan merupakan tanaman yang tidak dapat berproduksi karena infeksi virus yang membuat sel-sel tanaman mati.Mekanisme pertahanan inang terdiri dari pertahanan struktural dan biokimia.Pertahanan secara struktural merupakan hambatan fisik yang dapat menekan patogen saat masuk ke dalam tanaman sampai menyebar, sedangkan pertahanan biokimia merupakan produksi substansi dalam bentuk senyawa kimia yang berasal dari sel atau jaringan tanaman dan bersifat toksik bagi patogen (Agrios 2005).
Diagnosis virus berbeda dengan diagnosis penyakit yang disebabkan oleh cendawan dan bakteri.Diagnosis virus dapat dilakukan melalui uji biologi atau
bioassay, pengamatan partikel virus dengan mikroskop elektron, deteksi protein dengan uji serologi dan deteksi asam nukleat dengan PCR (polymerase chain reaction).Deteksi virus yang banyak digunakan adalah uji serologi, salah satunya ELISA (enzyme linked immunosorbent assay).Uji serologi merupakan pengujian yang mengombinasikan antigen dengan antiserum.Pengujian ini melibatkan virus sebagai antigen yang akan dikenali oleh antiserum(Djiksa dan de Jager 1998).
Menurut Reddy (2010), manajemen yang harus dibangun untuk mencegah dan mengendalikan SqMV adalah menggunakan kultivar toleran dan menghilangkan tanaman yang terinfeksi (eradikasi). Jika terkena kontak langsung dengan virus tersebut, virus dapat dieliminasi menggunakan desinfektan alkohol 70% pada tangan dan alat-alat yang digunakan dalam budidaya tanaman oyong.
Purba (2011) melaporkan bahwa, infeksi SqMV pada lima kultivar mentimun yang berbeda menunjukkan perbedaan respons ketahanan. SqMV dilaporkan menginfeksi oyong di Bogor (Aulia 2004), namun belum tersedia informasi ketahanan oyong terhadap virus ini.
Tujuan Penelitian
Penelitian ini bertujuan menguji tingkat ketahanan sepuluh kultivar oyong komersial terhadap infeksi SqMV.
Manfaat Penelitian
12
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di rumah kaca Cikabayan dan Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor mulai Februari sampai Mei 2015.
Metode Penelitian Perbanyakan Inokulum
Inokulum berasal dari koleksi Laboratorium Virologi Tumbuhan, IPB. Inokulum diperbanyak pada tanaman oyong yang berumur 12 hari setelah tanam (HST). Tanaman sehat ditularkan SqMV secara mekanis. Cairan perasan tanaman dibuat dengan cara menggerus tanaman yang sakit dengan nitrogen cair dalam 0.01 M bufer fosfat pH 7 yang mengandung 1% β-merkaptoetanol dengan perbandingan 1:10 (b/v). Daun tanaman sehat dilukai dengan menggunakan karborundum 600 mesh, cairan sap yang telah dibuat dioleskan dan dibersihkan dengan akuabidesmengalir (Agrios 2005).
Penyiapan Tanaman Uji dan Inokulasi
Benih tanaman oyong yang digunakan 10 kultivar komersial, yaitu kultivar Azura F1, Anggun F1 dan Prima F1 (PT. East West Seed Indonesia), Jaka F1 dan Hebata F1 (PT. Prabu Agro Mandiri), Mahkota (Benih Mutiara Indonesia), Bidara (PT. Agri Makmur Pertiwi), Grandia F1 (Garuda Seed), Esenza dan Estilo (PT. BISI Internasional). Benih tanaman oyong yang sehat ditanam pada wadah plastik yang sudah berisi tanah, pupuk kandang dan arang sekam dengan perbandingan 1:1:1. Setiap polibag ditanam tiga benih pada kedalaman 2 cm. Tiap kultivar oyong diinokulasi SqMV secara mekanis pada umur 12 HST seperti cara inokulasi diatas.
Peubah Pengamatan
Peubah yang diamati adalah waktu inkubasi, tipe gejala, insidensi penyakit, keparahan penyakit, dan titer virus. Karakter agronomi yang diamati adalah tinggi tanaman, jumlah bunga, bobot basah, dan bobot kering tanaman. Titer virus dideteksi secara serologi menggunakan antiserum spesifik SqMV metode DAS-ELISA.
Pengamatan waktu inkubasi dimulai dari satu hari setelah inokulasi ke tanaman sakit sampai tanaman tersebut menimbulkan gejala awal. Pengamatan deskripsi gejala dari awal muncul gejala sampai 8 minggu setelah inokulasi (MSI). Pengukuran tinggi tanaman dilakukan pada 1-4 MSI. Jumlah bunga yang muncul dihitung sampai 4 minggu setelah masa berbunga.
4
d IP = insidensi penyakit (%)
n = jumlah tanaman sakit
N = jumlah seluruh tanaman yang diamati
Keparahan penyakit ditentukan dengan melakukan pengamatan terhadap gejala yang muncul dengan menggunakan skoring, yaitu 1= tidak bergejala, 2= gejala ringan, 3= gejala sedang, 4= gejala berat, dan 5= daun distorsi atau mati (Hassan et al.1991) (Gambar 1).
Gambar 1 Skala kategori serangan penyakit a. skor 1, b. skor 2, c. skor 3, d. skor 4, e. skor 5
Rancangan percobaan menggunakan rancangan acak lengkap dengan 10 kultivar sebagai perlakuan dan masing-masing memiliki 10 tanaman tiap kultivar sebagai ulangan.
Deteksi Virus
DIBA (Dot Immunobinding Assay)
DIBA digunakan untuk mengonfirmasi insidensi penyakit pada tanaman uji berdasarkan metode yang digunakan Asniwita et al. (2013). Jaringan sampel daun tanaman digerus dalam tris buffer saline (TBS: Tris-HCl 0.02 M dan NaCl 0.15 M, pH 7.5) dengan perbandingan 1:10 (b/v). Cairan perasan tanaman sampel selanjutnya diblotkan pada kertas membran nitroselulosa (ukuran 3 cm × 3 cm) sebanyak 2 μl. Tetesan sampel yang telah kering pada kertas membran direndam di dalam 3 ml larutan blocking (3 ml TBS dicampur dengan 0.06 g skim milk dan 60 μl Triton X-100).Kemudian membran diinkubasi pada suhu ruang sambil digoyang dengan kecepatan 50 rpm selama 2 jam menggunakan shaker
Eyelamultishaker MMS. Membran dicuci 5 kali dengan akuabides, tiap pencucian berlangsung 5 menit sambil digoyang dengan kecepatan 100 rpm.Kemudian membran direndam dalam 5 ml larutan antiserum pertama (TBS yang mengandung 2% skim milk dan antiserum SqMV) dengan perbandingan 1:5000 (v/v) dan diinkubasi semalam pada suhu 4 °C. Lalu membran dicuci sebanyak 5 kali dengan TBST (TBS yang mengandung Tween-200.05%), tiap pencucian berlangsung selama 5 menit sambil digoyang dengan kecepatan 100 rpm. Selanjutnya membran nitroselulosa direndam dalam 5 ml antiserum kedua (TBS yang mengandung 2% skim milk dan goat anti rabbit-IgG, Sigma) dengan perbandingan 1:5000 (v/v), kemudian membran diinkubasi selama 60 menit sambil digoyang menggunakan shaker dengan kecepatan 50 rpm. Selanjutnya e b
5
membran dicuci 5 kali dengan TBST.Tiap pencucian berlangsung 5 menit sambil digoyang dengan kecepatan 100 rpm.
Membran direndam dalam 3 ml buffer alkaline phosphate (Tris-HCl 0.1 M, NaCl 0.1 M dan MgCl 5 mM, pH 9.5) yang mengandung NBT (nitro blue tetrazolium, 50 mg/ml yang dilarutkan dalam 100% dimethylformamide) sebanyak 13.5 μl dan BCIP (5-bromo 4-kloro 3-indolil fosfat, 50 mg/ml yang dilarutkan dalam 70% dimethylformamide) sebanyak 10.5 μl. Bila reaksi positif, akan terjadi
perubahan warna menjadi ungu pada sampel uji. Reaksi pewarnaan dihentikan dengan merendam membran nitroselulosa kedalam akuabides.
DAS-(Double Antibody Sandwich) ELISA
Titer virus tanaman uji dideteksi secara serologi dengan metode DAS (double antibody sandwich) ELISA menggunakan antiserum spesifik SqMV (Agdia).Antiserumpertama disiapkan dan dilarutkandalamcarbonate coating buffer (Na2CO3 1.59 g, NaHCO3 2.93 g dan NaN3 0.2 g dalam 1000 ml akuabides) ke dalam tabung dengan perbandingan 1:300. Antiserumpertama dimasukkan ke dalamsumuran plat mikrotiter sebanyak 100 µl. Plat diinkubasi dalam suhu 37 oC selama 4 jam. Selanjutnyaantiserum pertama pada plat dibuang dan dicuci menggunakan PBST (phosphate buffer saline tween) (NaCl 8 g, Na2HPO4 1.15 g, KH2PO4 0.2 g, KCl 0.2 g, akuabides 1000 ml, dan Tween-20 0.5 ml) pH 7.4 sebanyak 8 kali. Antigen disiapkan dengan menggerus tanaman oyong yang sakit dengan generalextraction buffer[Na2SO3 1.3 g, PVP (polyvinylpyrrolidone) 20 g, NaN3 0.2 g, powdered egg albumin grade II 2 g dan Tween-20 20 g dalam 1000 ml PBST]pH 9.6 dengan perbandingan 1:10 (b/v). Sumuran plat diisi antigen yang telah disiapkan sebanyak 100 µl, lalu diinkubasikan selama semalam pada suhu 4 oC. Kemudian antigen pada sumuran plat dibuang dan dicuci menggunakan PBST sebanyak 8 kali. Antiserum kedua disiapkan dan dilarutkan dalamconjugate buffer [BSA(bovine serum albumin) 2 g,PVP 20 g danNaN30.2 g dalam 1000 ml PBST]dengan perbandingan 1:300, kemudian antiserum kedua dimasukkankedalam sumuran platsebanyak 100 µl. Plat diinkubasi pada suhu 37 oC selama 2 jam. Selanjutnya antiserum kedua dibuang dan dicuci menggunakan PBST sebanyak 8 kali. Reaksi pewarnaan dilakukan dengan menggunakan tablet PNP (p-nitrophenylphosphate)yang dilarutkan dalam substrate buffer (NaN3 0.2 g, MgCl2.6H2O 0.1 g dan diethanolamine 97.0 ml dalam 1000 ml akuabides) (satu tablet 5 mg dilarutkan dalam 5 ml substrate buffer). Substrat pewarna dimasukkan ke dalam sumuransebanyak 100 µldan diinkubasi pada suhu ruang sampai terjadi perubahan warna kuning jika reaksi positif. Nilai absorbansi ELISA (NAE) dibaca denganELISA reader pada panjang gelombang 405 nm. Uji positif jika NAE sampel uji besarnya 2 kali dari NAE kontrol negatif (tanaman sehat). Menurut Mayasari (2006), ketahanan tanaman dapat dikategorikan menjadi toleran jika NAE 2 ≤ x ≤ 4 kali NAE kontrol negatif, rentan jika NAE 4 < x ≤ 6 kali NAE kontrol negatif dan sangat rentan jika NAE > 6 kali NAE kontrol negatif.
Analisis Data
12
HASIL DAN PEMBAHASAN
Hasil
Pengaruh Infeksi SqMV terhadap Waktu Inkubasi, Insidensi Penyakit, dan Tipe Gejala
Waktu inkubasi merupakan tenggang waktu antara masuknya virus hingga timbulnya gejala pertama pada tanaman. Gejala pertama kali muncul pada daun oyong yang paling muda berupa bintik-bintik dan berkembang menjadi bercak hijau dan kuning.Berdasarkan hasil penelitian, rata-rata waktu inkubasi yang diperoleh berkisar dari 3.1 sampai 4.4 hari setelah inokulasi (HSI). Gejala yang paling cepat muncul adalah pada kultivar Esenza dengan rata-rata 3.1 HSI sedangkan yang paling lama muncul adalah kultivar Anggun F1 dengan rata-rata 4.4 HSI.
Insidensi penyakit pada kultivar yang terinfeksi SqMVmencapai 100% (Tabel 1). Insidensi penyakit ditentukan berdasarkan pada proporsi tanaman yang terserang virus dalam suatu populasi tanaman tanpa melihat berat atau ringannya tingkat infeksi. Insidensi penyakit merupakan petunjuk keberadaan suatu patogen pada tanaman (Agrios 2005).
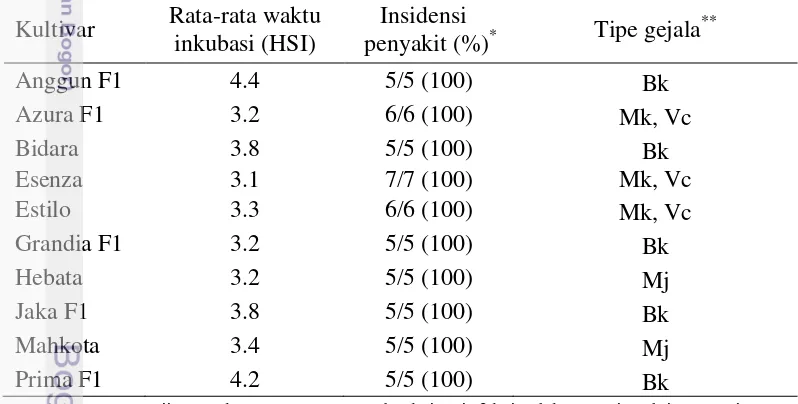
Tabel 1 Pengaruh infeksi SqMV terhadap waktu inkubasi, insidensi penyakit dan tipe gejala
*Jumlah tanaman uji ≤ 10, karena tanaman terdeteksi terinfeksi salah satu virus lain seperti CMV, ZYMV atau CGMMV yang diduga terbawa dari benih. **Mj: mosaik hijau gelap terang, Bk: bercak klorosis pada daun dan pertulangan daun, Mk: mosaik kuning pada daun dan pertulangan daun, Vc: vein clearing
7
sel tanaman yang terinfeksi berkembang membentuk kelompok yang dibatasi oleh kelompok sel tanaman yang sehat (Schumann dan D’Arcy 2012).
Gambar 2Gejala infeksi SqMV pada tiap kultivar.a. kontrol, (b-c). kultivar Mahkota dan Hebata (mosaik hijau gelap terang), (d-h).kultivar Jaka F1, Anggun F1, Bidara, Prima F1 dan Grandia F1 (bercak klorosis), (i-k).kultivarEstilo, Azura F1, Esenza (mosaik kuning dan vein clearing).
Pengaruh Infeksi SqMV terhadap Keparahan Penyakit dan Titer Virus
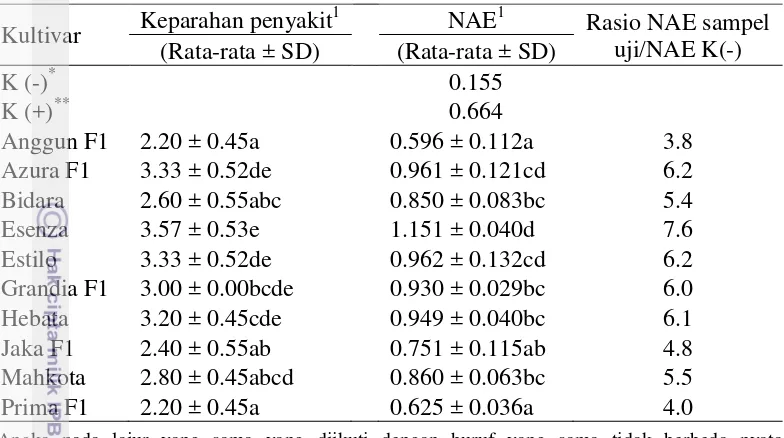
Skor keparahan penyakit kultivar yang terinfeksi SqMV berkisar dari 2.20 sampai 3.57.Keparahan penyakit sejalan dengan titer virus.Semua tanaman uji positif terinfeksi SqMV dengan nilai absorbansi ELISA (NAE) berkisar dari 0.596 sampai 1.151. Kultivar Essenza memiliki titer virus yang paling tinggi yaitu 7.6 kali kontrol negatif, sedangkan Anggun F1 memiliki titer virus terendah yaitu 3.8 kali kontrol negatif (Tabel 2).
b
d
g
j k
a
h e
8
Tabel 2 Pengaruh infeksi SqMV terhadap keparahan penyakit dan titer virus
Kultivar Keparahan penyakit
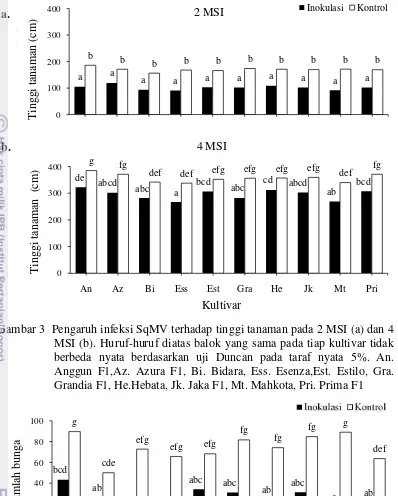
Tanaman kontrol memiliki pertumbuhan yang lebih baik dibandingkan dengan tanaman yang terinfeksi SqMV (Gambar 3).Pada 2 dan 4 MSI, pertumbuhan tinggi kultivar Esenza yang terinfeksi SqMV lebih rendah dibandingkan dengan kultivar lainnya.Tinggi tanaman yang terinfeksi SqMV berbeda nyata lebih rendah dari tanaman kontrol namun pada 3 MSI terdapat tanaman yang tidak berbeda nyata lebih rendah daritanaman kontrol yaitu kultivar Estilo dan Essenza.Nilai hambatan tinggi tanaman tiap kultivar pada 1-4 MSI mengalami penurunan kecuali pada kultivar Mahkota, Azura F1 dan Esenza pada 3-4 MSI (Lampiran 1).
9
Gambar 3 Pengaruh infeksi SqMV terhadap tinggi tanaman pada 2 MSI (a) dan 4 MSI (b). Huruf-huruf diatas balok yang sama pada tiap kultivar tidak berbeda nyata berdasarkan uji Duncan pada taraf nyata 5%. An. Anggun F1,Az. Azura F1, Bi. Bidara, Ess. Esenza,Est. Estilo, Gra. Grandia F1, He.Hebata, Jk. Jaka F1, Mt. Mahkota, Pri. Prima F1
Gambar 4 Pengaruh infeksi SqMV terhadap jumlah bunga. Huruf-huruf diatas balok yang sama pada tiap kultivar tidak berbeda nyata berdasarkan uji Duncan pada taraf nyata 5%. An. Anggun F1,Az. Azura F1, Bi. Bidara, Ess. Esenza,Est. Estilo, Gra. Grandia F1, He.Hebata, Jk. Jaka F1, Mt. Mahkota, Pri. Prima F1
10
Pengaruh Infeksi SqMV terhadap Bobot Tanaman
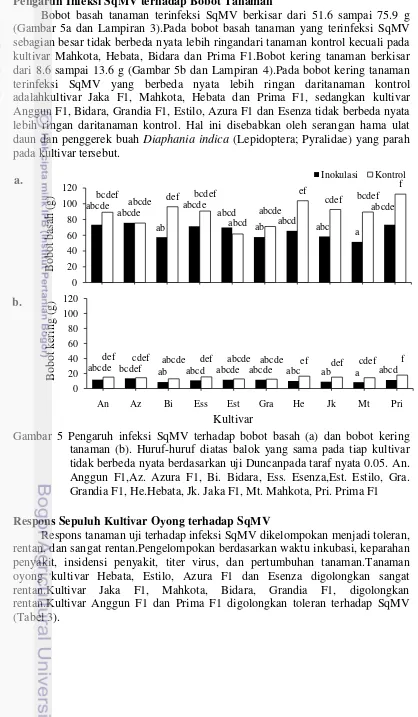
Bobot basah tanaman terinfeksi SqMV berkisar dari 51.6 sampai 75.9 g (Gambar 5a dan Lampiran 3).Pada bobot basah tanaman yang terinfeksi SqMV sebagian besar tidak berbeda nyata lebih ringandari tanaman kontrol kecuali pada kultivar Mahkota, Hebata, Bidara dan Prima F1.Bobot kering tanaman berkisar dari 8.6 sampai 13.6 g (Gambar 5b dan Lampiran 4).Pada bobot kering tanaman terinfeksi SqMV yang berbeda nyata lebih ringan daritanaman kontrol adalahkultivar Jaka F1, Mahkota, Hebata dan Prima F1, sedangkan kultivar Anggun F1, Bidara, Grandia F1, Estilo, Azura F1 dan Esenza tidak berbeda nyata lebih ringan daritanaman kontrol. Hal ini disebabkan oleh serangan hama ulat daun dan penggerek buah Diaphania indica (Lepidoptera; Pyralidae) yang parah pada kultivar tersebut.
Gambar 5 Pengaruh infeksi SqMV terhadap bobot basah (a) dan bobot kering tanaman (b). Huruf-huruf diatas balok yang sama pada tiap kultivar tidak berbeda nyata berdasarkan uji Duncanpada taraf nyata 0.05. An. Anggun F1,Az. Azura F1, Bi. Bidara, Ess. Esenza,Est. Estilo, Gra. Grandia F1, He.Hebata, Jk. Jaka F1, Mt. Mahkota, Pri. Prima F1
Respons Sepuluh Kultivar Oyong terhadap SqMV
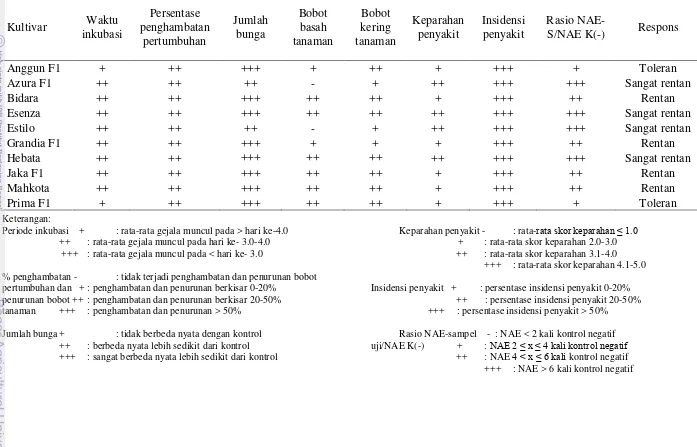
Respons tanaman uji terhadap infeksi SqMV dikelompokan menjadi toleran, rentan, dan sangat rentan.Pengelompokan berdasarkan waktu inkubasi, keparahan penyakit, insidensi penyakit, titer virus, dan pertumbuhan tanaman.Tanaman oyong kultivar Hebata, Estilo, Azura F1 dan Esenza digolongkan sangat rentan.Kultivar Jaka F1, Mahkota, Bidara, Grandia F1, digolongkan rentan.Kultivar Anggun F1 dan Prima F1 digolongkan toleran terhadap SqMV (Tabel 3).
abcde bcdef ab abcd abcde abcde abc ab a abcd
def cdef abcde def abcde abcde ef def cdef f
12
Tabel 3 Respons ketahanan sepuluh kultivar oyong terhadap SqMV
Kultivar Waktu
Periode inkubasi + : rata-rata gejala muncul pada > hari ke-4.0 Keparahan penyakit - : rata-rata skor keparahan ≤ 1.0
++ : rata-rata gejala muncul pada hari ke- 3.0-4.0 + : rata-rata skor keparahan 2.0-3.0
+++ : rata-rata gejala muncul pada < hari ke- 3.0 ++ : rata-rata skor keparahan 3.1-4.0
+++ : rata-rata skor keparahan 4.1-5.0 % penghambatan - : tidak terjadi penghambatan dan penurunan bobot
pertumbuhan dan + : penghambatan dan penurunan berkisar 0-20% Insidensi penyakit + : persentase insidensi penyakit 0-20%
penurunan bobot ++ : penghambatan dan penurunan berkisar 20-50% ++ : persentase insidensi penyakit 20-50%
tanaman +++ : penghambatan dan penurunan > 50% +++ : persentase insidensi penyakit > 50%
Jumlah bunga + : tidak berbeda nyata dengan kontrol Rasio NAE-sampel - : NAE < 2 kali kontrol negatif
++ : berbeda nyata lebih sedikit dari kontrol uji/NAE K(-) + : NAE 2 ≤ x ≤ 4 kali kontrol negatif
+++ : sangat berbeda nyata lebih sedikit dari kontrol ++ : NAE 4 < x ≤ 6 kali kontrol negatif
12
Pembahasan Umum
Secara umum, mekanisme virus menginfeksi tanaman melalui sel epidermis tanaman menuju plasmodesmata.Virus menyebar ke sel-sel inang dan dibawa oleh jaringan pengangkut secara pasif menuju daun muda (Agrios 2005). Hal tersebut menyebabkan terganggunya proses fisiologi tanaman dan gejala awal muncul pertama kali pada daun yang paling muda (Schumann dan D’Arcy 2012).
SqMV merupakan salah satu virus yang menyerang tanaman oyong dan dapat ditularkan secara mekanis (Lockhart 1982).Keberhasilan inokulasi pada tanaman oyong secara mekanis dipengaruhi oleh beberapa faktor, diantaranya faktor genetika (perbedaan jenis dan jumlah gen), konsentrasi virus (virus yang terkandung dalam sap dan sumber inokulum yang digunakan) dan lingkungan (cahaya, suhu dan hara) (Hull 2002).Keberhasilan tersebut dapat dilihat melalui waktu inkubasi.Waktu inkubasi erat kaitannya dengan kemampuan virus menyebar dari tempat inokulasi ke bagian lain tanaman sampai menunjukkan gejala.Cepatnya waktu inkubasi, salah satunya diduga karena faktor lingkungan yang mendukung patogen untuk menginfeksi tanaman.Hal ini sesuai pendapat Latifah et al.(2011) yang menyatakan bahwa, timbulnya gejala pertama salah satunya bergantung pada faktor lingkungan yang mendukung seperti suhu dan kelembapan.
Area daun yang terinfeksi virus biasanya berwarna hijau pucat karena hilang atau berkurangnya produksi klorofil.Hal tersebut mengakibatkan tanaman mengalami penurunan aktivitas fotosintesis (Walkey 1991).Menurut Hemida (2005), salah satu akibat tanaman terinfeksi virus adalah tanaman mengalami penurunan jumlah klorofil a, klorofil b, karotenoid, karbohidrat, protein, dan asam amino. Penurunan persentase kandungan tersebut pada tanaman yang terinfeksi virus dapat menyebabkan gejala yang lebih parah sehingga akan meningkatkan skor keparahan penyakit. Namun saat waktu pengujian, kondisi lingkungan (suhu dan kelembapan) rumah kaca diduga tidak mendukung ekspresi gejala dan perkembangan SqMV di dalam jaringan tanaman sehingga skor keparahan penyakit tidak sesuai dengan nilai titer virus yang tinggi (Tabel 2), namun saat pengujian di rumah kaca (Februari-April 2015), temperatur rata-rata berkisar antara 28.7-30.6 oC dan kelembapan rata-rata berkisar dari 60.7-63.9% (Lampiran 7).Suhu optimal untuk pertumbuhan tanaman oyong berkisar 18-24 °C dan kelembaban optimal 50-60% (Edi dan Bobihoe 2010). Hal ini mengakibatkan tanaman perlakuan menunjukkan gejala berkedok (masking) yang diduga karena terhambatnya translokasi virus namun proses replikasi virus di dalam sel tanaman tidak terhambat (Wahyuni 2005).
13
benih zucchini, 73.3% benih kabocha, serta 100% benih mentimun dan melon. ZYMV hanya ditemukan pada benih oyong dan zucchini berturut-turut 13.3% dan 26.67%.
Menurut Babadoost (1999), tipe gejala SqMV adalah vein clearing
(pemucatan tulang daun),vein banding (penebalan tulang daun), bercak kekuningan dari daun muda, daun melengkung ke atas, mosaik hijau gelap terang dan distorsi pada daun. Pada penelitian ini, gejala yang muncul pada tanaman perlakuan berupa mosaik ringan hingga berat dengan tipe gejala mosaik hijau gelap terang, bercak klorosis, mosaik kuning dan vein clearing.Munculnya gejala mosaik sistemik disebabkan adanya area yang terinfeksi dan tidak terinfeksi virus pada daun.
Menurut Agrios (2005), tanaman yang terinfeksi virus dapat menurunkan kadar hormon pertumbuhan dan merangsang sintesis zat biokimia yang dapat menghambat pertumbuhan tanaman dan pembentukan bunga. Hasil penelitian menunjukkan bahwa infeksi SqMV pada tanaman perlakuan mengakibatkan penghambatan pertumbuhan tinggi tanaman, yaitu berupa pemendekan batang tanaman dan pengecilan helai daun sehingga tanaman yang diinokulasi SqMV tampak lebih pendek (Gambar 3a-b dan Lampiran 1) dan jumlah bunga yang mekar pada tanaman perlakuan menjadi lebih sedikit (Gambar 4 dan Lampiran 2).
Semakin muda umur tanaman terinfeksi SqMV, tinggi tanaman semakin terhambat. Mayasari (2006) melaporkan bahwapertumbuhan melon yang terinfeksi ZYMV pada tanaman berumur muda mengalami peningkatan hambatan dibandingkan dengan tanaman berumur tua.Tanaman yang berumur muda diduga belum memiliki sistem pertahanan yang cukup kuat untuk menghambat replikasi virus sehingga kemampuan virus untuk menghambat pertumbuhan tanaman juga semakin tinggi.Faktor lingkungan juga diduga menjadi penghambat pertumbuhan. Hal ini sesuai dengan pernyataan Darjanto dan Satifah (1990) bahwa fase vegetatif dan generatif salah satunya ditentukan oleh faktor lingkungan seperti suhu, air, dan cahaya. Kekeringan merupakan akibat dari rendahnya kandungan air pada tanaman.
Infeksi virus juga dapat menyebabkan kekeringan.Matthews (1993) menyatakan bahwa, infeksi virus menyebabkan peningkatan respirasi tanaman sehingga menyebabkan kebutuhan air menjadi meningkat.Cekaman kekeringan dapat menurunkan tingkat biomassa tanaman berupa hasil fotosintesis, serapan unsur hara dan air.Hal ini dikarenakan menurunnya metabolisme primer, penyusutan luas daun dan aktivitas fotosintesis. Penurunan akumulasi biomassa akibat cekaman air untuk setiap jenis tanaman besarnya tidak sama. Hal tersebut dipengaruhi oleh tanggapan masing-masing jenis tanaman.Pengaruh kekurangan air selama tingkat vegetatif adalah munculnya daun dengan ukuran yang lebih kecil sehingga dapat mengurangi penyerapan cahaya, sedangkan pada tingkat generatif menjadi berkurangnya jumlah bunga dan kandungan air yang dimiliki oleh buah (Solichatun et al. 2005).
14
ketahanan berbagai spesies tanaman, seperti: fenilalanin amonialiase, tirosin amonialiase, monofenolase, difenolase, difenol oksidase, dan polifenol oksidase.
Pertumbuhan suatu tanaman dapat diukur melalui bobot kering dan laju pertumbuhan relatifnya. Bobot kering tumbuhan berupa biomassa total dipandang sebagai manifestasi proses-proses metabolisme yang terjadi di dalam tubuh tanaman. Bobot kering dapat menunjukkan produktivitas tanaman karena 90% hasil fotosintesis terdapat dalam bentuk berat kering (Gardner et al. 1991).Hal ini menunjukkan pentingnya untuk mengetahui bobot tanaman.Kendala hama yang ditemui di lapang berupa ulat pemakan daun dan penggerek buah Diaphania indica menjadi penyebab sulitnya untuk mengetahui bobot tanaman perlakuan dan kontrol.
Menurut Barma dan Jha (2014), Diaphania indica biasa disebut pumpkin catterpillar atau cucumber moth merupakan salah satu hama penting pada komoditas Cucurbitaceae. Hama ini dapat menurunkan kualitas dan kuantitas produksi serta kerugian ekonomi karena pada masa pradewasa atau larva dapat memakan seluruh bagian tanaman kecuali akar.Visalakshy(2005), melaporkan bahwa tanaman Cucurbitaceae sebagai komoditas ekspor terbesar pada tahun 1990 di Karnataka telah dirusak oleh hama Diaphania indica selama sepanjang tahun sehingga mengakibatkan penurunan ekspor di negara tersebut. Hal ini sesuai dengan pernyataan Darwin (2003), bahwa saat fase larva akan memakan bagian daun, batangdan buah yang masih muda hingga tua. Sehingga pengaruh infeksi SqMV terhadap bobot tanaman pada penelitian tidak menggambarkan pengaruhnya secara nyata.
12
SIMPULAN DAN SARAN
Tanaman oyong yang terinfeksi SqMV menunjukkan gejala mosaik ringan hingga berat dengan tipe gejala mosaik hijau gelap terang, bercak klorosis dan mosaik kuning dengan vein clearing bergantung pada kultivar.Infeksi SqMV pada tiap kultivar tanaman oyong menyebabkan gangguan pada pertumbuhan tanaman dan penurunan bobot tanaman.Berdasarkan peubah yang diamati, tanaman oyong kultivar Hebata, Estilo, Azura F1 dan Esenza tergolong sangat rentan, sedangkan kultivar Jaka F1, Mahkota, Bidara, Grandia F1 tergolong rentan dan kultivar Anggun F1 dan Prima F1 tergolong toleran terhadap infeksi SqMV.
16
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology. 5thed. New York (US): Academic Press. Asniwita, Hidayat SH, Suastika G, Susanto S, Sujiprihati S. 2013. Penggunaan
galur lemah Chilli veinal mottle virus untuk proteksi silang.Jurnal Fitopatologi Indonesia9(5):145-152. DOI: 10.14692/jfi.9.5.145.
Aulia R. 2004. Inventarisasi dan deteksi virus penyebab mosaik pada famili cucurbitaceae di Kotamadya Bogor, Pasir Muncang dan Cibodas [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Barma P, Jha S. 2014. Studies on bio-ecology and voracity of leaf roller (Diaphania indica Saunders, Lepidoptera: Pyralidae) on pointed gourd (Trichosanthes dioica Roxb.). African Journal of Agricultural Research9(36): 2790-2798
Babadoost M. 1999.Mosaic diseases of cucurbits [Internet]. [diunduh pada 2014 Juni 24]. Tersedia pada: http://web.aces.uiuc.edu/vista/pdf_pubs/926.pdf Cohen S, Nitzany FE. 1963. Identity of viruses affecting cucurbits in
Israel.Phytopathology 53(2):193-196.
Dana MN, Lerner BR. 2000. Gourds [Internet]. [diunduh 2015 Januari 17]. Tersedia pada: http://www.hort.purdue.edu/ext/HO-135.pdf.
Darjanto dan Satifah.1990. Pengetahuan Dasar Biologi Bunga dan Teknik Silang Buatan. Jakarta (ID): Gramedia.
Darwin. 2003. Common insect pests of cucurbits [Internet]. [diunduh 2014
Desember 10].Tersedia pada:
www.nt.gov.au/d/Content/File/p/Plant_Pest/805.pdf
Djikstra J. De Jagger CP. 1998. Practical Plant Virology: Protocol and Exercise. Boston (US): Springer.
Edi S, Bobihoe J. 2010. Budidaya Tanaman Sayuran. Jambi (ID): Balai Pengkajian Teknologi Pertanian (BPTP) Jambi.
Envirologix. 1998. Squash mosaic virus [Internet]. [diunduh 2014 Desember 10]. Tersedia pada: http://www.envirologix.com/.
Freitag. 1956. Beetle transmision, host range, and properties of Squash mosaic virus. Phytopathology46(2):73-81.
Galston AW. Davies DJ. 1970. Control Mechanisms in Plant Development. New Jersey (US): Prentice-Hall Inc.
Gardner FP, Perace RB, Mitchell RL. 1991. Fisiologi Tanaman Budidaya. Susilo H, penerjemah. Jakarta (ID): UI Press.
Gergerich RC, Dolja VV. 2006. Introduction to plant viruses, the invisible foe Japanese isolate of Squash mosaic virus. Archives of Virology 147(2):437-443.
yellow-17
stunting disorder in the United Arab Emirate.Cucurbit Genetic Cooperative Report14(34):98-101.
Hemida SK. 2005. Effect of Bean yellow mosaic virus on physiological parameters of Vicia faba and Phaseolus vulgaris. International Journal of Agriculture dan Biology 7(2):154-157.
Hull R. 2002. Matthews’ Plant Virology.Ed ke-4. San Diego (US): Elsevier Academic Press.
Horison C, Rustikawati, Sudarsono. 2007. Aktivitas peroksidase, skor elisa danrespon ketahanan 29 genotip cabai merah terhadap infeksi Cucumber mosaic virus (CMV). Akta Agrosia10(1):1-3
Izadpanah K. 1987. Squash mosaic virus as the cause of melon vein banding mosaic in Iran. Phytopathology 120(3):276-282.
Lastra R, Munz K. 1969. Purification and electron microscopy of squash mosaic virus. Phytopathology 59(10):1429-1435.
Latifah A, Kustantinah, Soesanto Loekas. 2011. Pemanfaatan beberapa isolat
Trichoderma harzanium sebagai agensia pengendali hayati penyakit layu fusarium pada bawang merah in planta. Eugenia 17(2):86-95.
Lestari SM. 2011. Keberadaan beberapa virus dan efisiensi tular benih Squash mosaic viruspada Cucurbitaceae [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Lockhart BEL. 1982. Squash mosaic virus in morocco. Plant Disease66(12): 1191-1193.DOI: 10.1094/PD-66-1191
Matthews REF. 1993. Diagnosis of Plant Disease. Ed ke-3. New York (US): CRC Press.
Mayasari WP. 2006. Ketahanan tujuh varietas melon terhadap Zucchini yellow mosaic potyvirus [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Nelson MR, Knuhtsen HK. 1973. Squash mosaic virus variability: review and serological comparisons of six biotypes. Phytopathology 63(7):920-926.DOI: 10.1094/Phyto-63-920.
Peraturan Menteri Pertanian. 2014. Peraturan Menteri Pertanian Republik Indonesia Nomor 02/Permentan/SR.120/1/2014 tentang Produksi, Sertifikasi, dan Peredaran Benih Bina. Jakarta: Menteri Pertanian.
Purba ERD. 2011. Pengaruh infeksi Squash mosaic comovirus terhadap perkembangan penyakit mosaik pada lima varietas mentimun (Cucumis sativus L.) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Reddy P. 2010.Plant Protection in Horticulture. New Delhi (IN): Scientific
Solichatun, Anggarwulan E, Mudyantini W. 2005. Pengaruh ketersediaan air terhadap pertumbuhan dan kandungan bahan aktif saponin tanaman ginseng jawa (Talinum paniculatum Gaertn.). Biofarmasi 3(2):47-51.
Thomas W. 1973. Seed-transmitted squash mosaic virus[Internet]. [diunduh 2014 Juni 23]. Tersedia pada: http://www.tandfonline.com/loi/tnza20
18
Walkey DGA. 1991. Applied Plant Virology. Ed ke-2. London (GB): Chapman and Hall.
12
20
Lampiran 1 Pengaruh infeksi SqMV terhadap tinggi pada tanaman oyong pada 1-4 MSI
Kultivar Perlakuan
Pertumbuhan (cm) dan hambatan (%) tinggi pada minggu setelah inokulasia
1 2 3 4
Anggun F1 Kontrol 60.1d 186.1b 283.9ef 384.8g Inokulasi 22.6a 105.6a 234.3abcd 322.3de Hambatan 62.1c 42.7a 17.8a 12.9a Azura F1 Kontrol 54.2cd 171.0b 292.4f 370.8fg
Inokulasi 31.5ab 119.3a 253.9abcdef 301.9abcd Hambatan 41.4a 29.9a 13.1a 21.5a Bidara Kontrol 54.6cd 156.2b 269.7cdef 341.5def
Inokulasi 22.2a 93.2a 214.8a 281.9abc Hambatan 56.5abc 37.8a 20.2a 17.2a Esenza Kontrol 57.3d 167.8b 264.2bcdef 337.4def
Inokulasi 18.8a 90.6a 210.3a 266.8a
Hambatan 63.9c 46.3a 19.6a 20.0a
Estilo Kontrol 41.6bc 166.1b 279.0def 352.1efg Inokulasi 21.0a 102.7a 238.8abcde 306.8bcd Hambatan 43.6ab 36.0a 14.9a 13.2a Grandia F1 Kontrol 62.1d 173.9b 297.9f 356.1efg
Inokulasi 27.7ab 102.4a 222.8ab 282.1abc Hambatan 55.3abc 43.1a 25.8a 20.7a Hebata Kontrol 48.5cd 171.1b 284.3ef 356.8efg
Inokulasi 28.4ab 108.7a 227.0abc 312.0cd Hambatan 40.8a 36.2a 18.2a 12.7a Jaka F1 Kontrol 57.6d 169.8b 284.3ef 359.2efg
Inokulasi 26.2a 101.9a 216.9a 302.8abcd Hambatan 54.2abc 38.8a 24.0a 15.6a Mahkota Kontrol 48.2cd 171.5b 269.4cdef 339.7def
Inokulasi 20.2a 91.6a 221.2ab 269.3ab Hambatan 53.6abc 45.4a 16.9a 18.98a Prima F1 Kontrol 57.0d 169.19b 292.7f 370.9fg Inokulasi 21.19a 102.1a 221.9ab 307.0bcd Hambatan 59.8bc 40.3a 23.9a 16.4a a
21
Lampiran 2Pengaruh infeksi SqMV terhadap jumlah dan penurunan bunga mekar
Kultivar Jumlah bunga nyataberdasarkan uji Duncan pada taraf 5%
Lampiran 3 Pengaruh infeksi SqMV terhadap jumlah dan penurunan bobot basah tanaman
22
Kultivar Bobot kering tanaman (g) a
Penurunan bobot kering tanaman (%) Kontrol Inokulasi
Anggun F1 15.3 ± 5.3def 11.9 ± 4.5abcde 22.0 Azura F1 14.5 ± 2.3cdef 13.6 ± 3.7bcdef 6.2 Bidara 13.0 ± 4.1abcde 8.7 ± 2.7ab 33.0 Esenza 15.5 ± 4.1def 11.0 ± 3.4abcd 29.0 Estilo 12.9 ± 2.0abcde 11.7 ± 3.6abcde 9.3 Grandia F1 12.5 ± 5.3abcde 11.7 ± 6.4abcde 6.4
Hebata 16.6 ± 6.7ef 10.2 ± 5.9abc 38.5
Jaka F1 15.2 ± 4.4def 9.1 ± 3.6ab 40.1 Mahkota 14.5 ± 4.9cdef 8.6 ± 2.5a 40.6 Prima F1 17.9 ± 8.6f 11.4 ± 4.2abcd 36.3 a
Angka pada baris yang sama yang diikuti dengan huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%
Lampiran 5 Nilai absorbansi ELISA komposit tiap kultivar
Kultivar NAE sampel komposit Rata-rata
1 2 3
Anggun F1 0.510 0.683 - 0.596
Azura F1 0.910 1.100 0.874 0.961
Bidara 0.889 0.781 - 0.850
Esenza 1.107 1.183 1.165 1.151
Estilo 1.112 0.861 0.914 0.962
Grandia F1 0.951 0.910 - 0.930
Hebata 0.997 0.921 - 0.949
Jaka F1 0.670 0.883 0.702 0.751
Mahkota 0.910 0.821 - 0.860
Prima F1 0.651 0.600 - 0.625
23
Kultivar Ulangan Jumlah
1 2 3 4 5 6 7 8 9 10
Anggun F1 + + - - + + + - - - 5
Azura F1 - + + + - - + + + - 6
Bidara + + - - + + + - - - 5
Esenza + + - - + + + + + 7
Estilo + + - + + - + + - - 6
Grandia F1 + - + + + + - - - - 5
Hebata - - - + + - + + + - 5
Jaka F1 + - + + - + + - - - 5
Mahkota - - - + + - - + + + 5
Prima F1 - + + + + - + - - - 5
+ : Positif SqMV
- : Negatif SqMV tetapi positif salah satu virus CMV/ZYMV/CGMMV (data tidak ditampilkan)
Lampiran 7 Data suhu dan kelembapan bulanan rumah kaca Cikabayan wilayah Dramaga, Bogor, Jawa Barat
Bulan Suhu rata-rata (oC) Kelembaban rata-rata (%)
Februari 30.6 63.1
Maret 28.7 63.9
April 29.3 60.7
24