SINTESIS KOMPOSIT HIDROKSIAPATIT-KITOSAN-PVA
SEBAGAI
INJECTABLE BONE SUBSTITUTE
FIRNANELTY
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul sintesis komposit hidroksiapatit-kitosan-pva sebagai injectable bone substitute adalah benar karya
saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2016
Firnanelty
RINGKASAN
FIRNANELTY. Sintesis Komposit Hidroksiapatit-Kitosan-PVA sebagai
Injectable Bone Substitute. Dibimbing oleh SRI SUGIARTI dan CHARLENA. Bone filler adalah suspensi yang diaplikasikan dengan cara disuntikkan
untuk mengisi celah-celah tulang akibat osteoporosis disebut injectable bone substitute (IBS). Kelebihan IBS yaitu dapat dibentuk sesuai dengan bentuk rongga
tulang yang akan diisi dan terpolimerisasi in situ setelah disuntikkan. Material
dalam bentuk injectable bersifat steril dan siap pakai serta bersifat osteokonduktif.
Salah satu material yang dapat dibentuk menjadi IBS adalah hidroksiapatit. Hidroksiapatit (HAp) merupakan senyawa kelompok mineral apatit dengan rumus kimia Ca10(PO4)6(OH)2 sebagai bone graft substitute. Hidroksiapatit bersifat
biokompatibel, osteokonduktif dan tidak toksik. Sekitar 65% fraksi mineral di dalam tulang tersusun atas hidroksiapatit. Namun HAp memiliki kekurangan yaitu rapuh dan getas. Penambahan kitosan dan PVA bertujuan untuk memperbaiki kekurangan dari HAp. Studi yang dilakukan tidak hanya upaya untuk memperbaiki kekurangan HAp saja namun pemilihan starting material juga
sangat penting dalam pembuatan kalsium posfat yang paling ekonomis. Salah satu sumber kalsium dapat diperoleh dari cangkang tutut. Cangkang tutut merupakan limbah yang melimpah tetapi belum dimanfaatkan secara komersial. Limbah ini kaya berbagai mineral termasuk kalsium. HAp dapat dikompositkan dengan kitosan dan PVA yang dapat digunakan sebagai bahan implan tulang. Penelitian ini bertujuan memanfaatkan cangkang tututsebagai prekursor Ca untuk menyintesis HAp, menyintesis komposit HAp-kitosan-PVA, melakukan karakterisasi HAp dan komposit, menguji viskositas dan sitotoksisitas in vitro
pada kultur sel endotel Calf Pulmonary Artery Endothelium (CPAE) (ATCC-CCL
209).
Analisis serbuk cangkang tutut menggunakan Spektrofotometer Serapan Atom (AAS) menunjukkan kandungan kalsium dalam cangkang sebesar 55.37%. Hasil sintesis dengan metode presipitasi basah menunjukkan HAp yang diperoleh merupakan fasa tunggal HAp. Nilai viskositas komposit HAp-kitosan-PVA diperoleh 36 dPa.s. Hasil ini cukup mendekati nilai standard IBS. Uji sitotoksisitas in vitro pada kultur sel endotel Calf Pulmonary Artery Endothelium
(CPAE) (ATCC-CCL 209) menunjukkan bahwa tidak timbul toksisitas terhadap selpada konsentrasi 12.5% dengan persen inhibisi 13.13%. Hal ini menunjukkan bahwa nilai viabilitas sel lebih dari 50%.
Limbah cangkang tutut berhasil dimanfaatkan sebagai prekursor kalsium dalam sintesis fasa tunggal HAp. Berdasarkan viskositas dan sifat sitotoksisitas, komposit HAp-Kitosan-PVA berpotensi sebagai implan biokompatibel untuk aplikasi implan tulang.
SUMMARY
FIRNANELTY. Synthesis of composite Hydroxyapatite-Chitosan-PVA as Injectable Bone Substitute. Supervised by SRI SUGIARTI and CHARLENA.
Bone filler is a suspension that applied by injection to fill the cracks of bones due to osteoporosis is called injectable bone substitute (IBS). Excess IBS which can be formed according to the shape of the bone cavity to be filled and polymerized in situ after being injected. Material of injectable forms are sterile,
ready to use and osteoconductive. One material that can be formed into IBS is hydroxyapatite. Hydroxyapatite (HAp) is a group of minerals apatite compound with the chemical formula Ca10(PO4)6(OH)2 as a bone graft substitute.
Hydroxyapatite are biocompatible, osteoconductive, and non-toxic. Approximately 65% fraction in bone mineral composed of hydroxyapatite. However HAp has the disadvantage that fragile and brittle. Addition of chitosan and PVA aimed to improve the lack of HAp. This study not only attempt to correct any deficiencies HAp but also the selection of the starting material is very important in making calcium phosphate the most economical. One source of calcium can be obtained from the Tutut shell. Tutut shell of an abundant waste but has not been used commercially. This waste is rich in various minerals, including calcium. HAp can be composited with chitosan and PVA that can be used as bone implant materials. This research aimed to utilize Tutut shell as precursors of Ca to synthesize HAp, synthesize composite HAp-chitosan-PVA, characterize HAp and composite, examine the viscosity and cytotoxicity in vitro in cultured endothelial cells Calf Pulmonary Artery endothelium (CPAE) (ATCC-CCL 209) of composite.
Analysis of calcium content by using Atomic Absorption Spectrophotometer (AAS) showed that Tutut shell was 55.37% (by weight). HAp was synthesized by wet precipitation method, confirmed the formation of single phase of HAp. Viscosity value of composite HAp-Chitosan-PVA obtained 36 dPa.s. These results are quite close to the value standard of IBS. Cytotoxicity assay in vitro in cultured endothelial cells Calf Pulmonary Artery endothelium (CPAE) (ATCC CCL-209) showed there was no toxicity to the cells culture with concentration 12.5% with the percent inhibition 13.13%. Its indicates that the value of cell viability over 50%.
The waste of Tutut shell was utilized as a precursor for the synthesis of calcium in a single phase HAp. Based on the viscosity and cytotoxicity assay, composite HAp-Chitosan-PVA potential as bone implant applications.
Keywords: Osteoporosis, Tutut shell (Bellamya javanica), injectable bone
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kimia
SINTESIS KOMPOSIT HIDROKSIAPATIT-KITOSAN-PVA
SEBAGAI
INJECTABLE BONE SUBSTITUTE
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan dengan judul
“Sintesis Komposit Hidroksiapatit-Kitosan-PVA Sebagai Injectable Bone Substitute”. Penelitian ini dilaksanakan sejak bulan Oktober 2015 sampai dengan
Mei 2016.
Terima kasih penulis ucapkan kepada Ibu Sri Sugiarti, PhD dan Ibu Dr Charlena, MSi selaku pembimbing atas segala curahan waktu, bimbingan, kesabaran, nasehat, saran dan kritik yang membangun, serta dukungannya selama proses penelitian hingga penyelesaian karya ilmiah ini. Terima kasih kepada Prof Dr Dyah Iswantini Pradono, MScAgr selaku Ketua Program Magister Kimia, Bapak Drs Sulistioso Giat Sukaryo, MT yang telah banyak memberikan masukan, Bapak Drs Erizal atas bantuan sterilisasi sampel penelitian, serta seluruh dosen Pascasarjana Kimia atas segala bimbingan dan ilmu yang diberikan. Di samping itu, penghargaan penulis sampaikan kepada Pimpinan dan keluarga besar staf Laboratorium Kimia Anorganik IPB, staf Laboratorium Kimia Fisik IPB, staf Laboratorium Bersama Kimia IPB, staf Laboratorium Radiasi PAIR BATAN Jakarta, staf Pusat Laboratorium Forensik Mabes Polri Jakarta, staf Laboratorium Mikrobiologi Pusat Studi Satwa Primata dan staf Laboratorium Penguji Badan Litbang Departemen Kehutanan yang telah membantu analisis selama penelitian. Tak lupa pula ungkapan terima kasih penulis sampaikan kepada teman-teman mahasiswa Sekolah Pascasarjana Kimia angkatan 2014 atas masukan, saran, dan motivasi yang diberikan dalam menyelesaikan penelitian ini. Ungkapan terima kasih juga disampaikan kepada Bapak, Mama, Ibu, Kakak, dan seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2016
DAFTAR ISI
Uji Sitotoksisitas in vitro Sel Endotel 8
3 METODE 9
Pengukuran Kadar Ca dalam Serbuk Sampel dengan AAS 10 Kalsinasi Serbuk Sampel dan Konversi menjadi Ca(OH)2 10
Sintesis HAp dengan Metode Presipitasi Basah 11
Sintesis Komposit HAp-Kitosan-PVA 11
Uji Viskositas 11
Uji In vitro Sitotoksisitas pada Sel Endotel CPAE 12
4 HASIL DAN PEMBAHASAN 12
Hasil Analisis XRD Cangkang Tutut Sebelum dan
Setelah Kalsinasi 12
Penentuan Kadar Ca Cangkang Tutut 14
Hasil Sintesis HAp 14
Hasil Karakterisasi Fasa HAp menggunakan XRD 15
Hasil Karakterisasi HAp menggunakan FTIR 16
Hasil Karakterisasi HAp menggunakan SEM 17
Komposit HAp-Kitosan-PVA Sebagai Injectable Bone Substitute 17
Karakterisasi Komposit menggunakan FTIR 18
Karakterisasi Komposit menggunakan XRD 19
Karakterisasi Komposit menggunakan SEM 20
Hasil Uji Viskositas 20
5 SIMPULAN DAN SARAN 21
Simpulan 21
Saran 22
DAFTAR PUSTAKA 23
LAMPIRAN 27
DAFTAR GAMBAR
1 Cangkang tutut( Bellamya javanica) 4
2 Struktur hidroksiapatit 5
3 Fenomena antarmuka antara HAp dan sel tubuh 6
4 Struktur kitosan 7
5 Proses polimerisasi radiasi 8
6 Cangkang tutut kering dan serbuk halus 12
7 Difraktogram sinar-x serbuk cangkang tutut sebelum kalsinasi 13 8 Difraktogram sinar-x hasil kalsinasi serbuk cangkang tutut 14
9 Difraktogram sinar-x HAp hasil sintesis 15
10 Spektrum FTIR HAp 16
11 Foto SEM HAp dengan perbesaran 500X 17
12 Spektrum FTIR PVA, kitosan, HAp, dan Komposit HAp-Kitosan-PVA 18 13 Difraktogram sinar-x komposit HAp-Kitosan-PVA 19
14 Morfologi komposit HAp-Kitosan-PVA 19
15 Komposit HAp-Kitosan-PVA terhadap sel CPAE 20
DAFTAR LAMPIRAN
1 Diagram alir penelitian 28
2 Data hasil analisis XRD cangkang tutut 29
a Serbuk cangkang tutut sebelum kalsinasi 29
b Serbuk cangkang tutut setelah kalsinsasi 29
c Hasil sintesis HAp menggunakan metode presipitasi basah 30 3 Data joint cristal powder diffraction standard (JCPDS) 30
a Aragonite : CaCO3 30
b Porlandite : Ca(OH)2 31
c Hidroksiapatit : Ca10(PO4)6(OH)2 31
4 Perhitungan AAS kandungan kalsium cangkang tutut sebelum
Kalsinasi 32
a Absorbans standar kalsium 32
b Absorbans dan konsentrasi kalsium cangkang tutut 32
5 a Penentuan pola h2+k2+l2 33
b Penentuan ukuran kristal HAp hasil sintesis 34
1
PENDAHULUAN
Latar Belakang
Bone filler diaplikasikan dengan cara disuntikkan dalam bentuk suspensi
untuk mengisi celah-celah tulang akibat osteoporosis disebut Injectable Bone Substitute (IBS). Kelebihan injectable system yaitu dapat dibentuk sesuai dengan
bentuk rongga tulang yang akan diisi dan terpolimerisasi in situ setelah
disuntikkan. Selain itu, material dalam bentuk injectable bersifat steril dan siap
pakai (Warastuti et al. 2011). Bahan dalam bentuk IBS harus bersifat
osteokonduktif dan memiliki kekuatan mekanik yang baik (Weiss et al. 2007).
Salah satu material yang dapat dibentuk menjadi IBS adalah hidroksiapatit. Hidroksiapatit (HAp) merupakan senyawa kelompok mineral apatit dengan rumus kimia Ca10(PO4)6(OH)2 sebagai bone graft substitute. Hidroksiapatit (HAp)
merupakan senyawa dari salah satu jenis biokeramik yang paling sering digunakan karena merupakan unsur anorganik utama penyusun tulang. Sekitar 65% fraksi mineral di dalam tulang tersusun atas hidroksiapatit (Petit 1999). Hidroksiapatit memiliki beberapa karakteristik, yaitu bioaktif, biokompatibel, osteokonduktif, tidak toksik, dan tidak imunogenik (Nayak 2010). Namun HAp memiliki beberapa kekurangan yaitu rapuh, getas, tahanannya yang rendah, dan memiliki laju resorpsi yang sangat lambat. Jika digunakan sendiri, hidroksiapatit tidak memiliki kekuatan mekanik dan tidak tahan terhadap tekanan. Sehingga dilakukan pengembangan untuk menghilangkan kekurangan itu untuk menghasilkan bone graft yang ideal. Hidroksiapatit banyak dibuat menjadi
komposit dengan material alam seperti kitosan untuk mengatasi sifat rapuhnya. Sifatnya yang biokompatibel, toksisitas rendah, dan antibakteri (Sugita et al.
2009) menjadikan kitosan memenuhi persyaratan untuk digunakan sebagai pengganti tulang. Kitosan dapat didegradasi oleh enzim dalam tubuh manusia dan hasil degradasinya tidak beracun (Kumar 2004).
Mohamed et al (2011) menyebutkan bahwa penambahan kitosan
menyebabkan sifat degradasi dan kekuatan ikatan akan berkurang. Polivinil alkohol (PVA) yang memiliki karakteristik mekanik dan biokompatibilitas yang baik dapat digunakan untuk meningkatkan kemampuan komposit (Maruf et al.
2013). PVA banyak digunakan untuk menggantikan jaringan tubuh yang mengalami kerusakan atau penyakit karena memiliki sifat fisikokemikal terutama sifat bio-tribiological yang sangat baik, yaitu memiliki permukaan licin, tahan terhadap gesekan, keausan (Suciu et al 2004) dan biokompatibilitas yang baik.
Keberadaan PVA dalam pembentukan komposit juga sebagai agen cross-linking.
Komposit hidroksiapatit-kitosan-PVA cocok digunakan sebagai material pengganti tulang dan aplikasi teknik jaringan dalam bentuk injectable bone substitute dengan menggunakan hidroksipropilmetil selulosa (HPMC) sebagai suspending agent (Weiss et al. 2007).
Studi yang dilakukan tidak hanya upaya untuk memperbaiki kekurangan dari sifat HAp sendiri namun dilakukan juga pemilihan starting material dalam
2
mengandung sebagian besar kalsium karbonat. Kalsium dari cangkang tutut dapat digunakan sebagai prekursor dalam pembuatan kalsium posfat karena mengandung kadar Ca sekitar 64.73% (Herawaty 2014).
Sintesis hidroksiapatit sudah lazim dilakukan dengan metode presipitasi basah dan komposit hidroksiapatit-kitosan-PVA dengan teknik iradiasi gamma. Iradiasi adalah teknik penggunaan energi untuk penyinaran bahan dengan menggunakan sumber iradiasi buatan (Winarno 1980). Teknik iradiasi gamma dapat diaplikasikan pada industri polimer yaitu untuk mengolah bahan mentah menjadi bahan setengah jadi atau bahan jadi, dengan bantuan sinar radiasi sebagai sumber energi. Penggunaan sinar gamma berintensitas tinggi mampu membunuh organisme berbahaya dan sekaligus sterilisasi material. Secara visual komposit hasil iradiasi menunjukkan pasta gel yang kental dan homogen (Warastuti et al.
2011). Walaupun penggunaan material hidroksiapatit sudah digunakan untuk implan dengan pelapisan terhadap logam namun cangkang tutut sebagai IBS belum pernah dilakukan. Pada penelitian ini dilakukan sintesis dan karakterisasi komposit hidroksiapatit-kitosan-PVA dengan teknik iradiasi gamma sebagai
injectable bone substitute. Komposit yang dihasilkan dapat digunakan pada
berbagai keperluan klinis pada bidang periodontal, ortopedik, dan bedah plastik dan telah memenuhi beberapa sifat yang disyaratkan sebagai pengganti tulang (bone substitute) sesuai hasil uji in vitro, fisik, dan kimia (Azami 2012).
Rumusan Masalah
Beberapa penelitian terus mengembangkan penggunaan hidroksiapatit mengatasi defek tulang dalam bentuk injectable bone substitute. Penggunaan
hidroksiapatit sendiri mudah rapuh sehingga perlu material lain yang mampu membuat komposit tersebut kuat dan mampu mempercepat mineralisasi apatit dalam tubuh. Kombinasi komposit HAp-kitosan-PVA merupakan salah satu alternatif yang mampu dijadikan bahan injectable bone substitute sehingga
diharapkan dapat diaplikasikan sebagai implan tulang yang memiliki biokompatibilitas tinggi dan sifat degradasi yang baik. Komposit ini diharapkan memiliki sifat-sifat yang sesuai dengan tubuh. Penelitian tentang sintesis HAp dari cangkang tutut yang dapat dibentuk IBS sangat penting untuk dilakukan agar dapat memperkaya pengetahuan tentang bahan baku dalam sintesis HAp dan aplikasinya terutama dalam bidang biomedis.
Tujuan Penelitian
Penelitian ini bertujuan untuk menyintesis dan mengkarakterisasi hidroksiapatit berbasis cangkang tutut melalui metode presipitasi basah dan membuat komposit HAp-kitosan-PVA sebagai bahan injectable bone substitute
3
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang potensi cangkang tutut sebagai prekursor Ca dalam sintesis HAp dan komposit HAp-Kitosan-PVA yang dapat dimanfaatkan sebagai bahan implan tulang dalam bentuk
injectable.
Ruang Lingkup Penelitian
Penelitian ini terdiri dari 4 tahapan utama. Tahap pertama adalah preparasi sampel, pengukuran kadar Ca dengan AAS, kalsinasi serbuk sampel, dan konversi menjadi Ca(OH)2. Tahap kedua adalah sintesis HAp dengan metode presipitasi
basah. Tahap ketiga adalah sintesis komposit HAp-Kitosan-PVA dengan teknik iradiasi gamma. Tahap keempat adalah tahap uji viskositas dan uji in vitro
sitotoksisitas pada sel endotel CPAE. Diagram alir penelitian disajikan pada Lampiran 1.
2
TINJAUAN PUSTAKA
Injectable Bone Substitute (IBS)
Berbagai kasus kerusakan tulang membutuhkan graft tulang sebagai
pengganti tulang. Saat ini graft tulang yang banyak digunakan pada bidang ortopedi yaitu natural bone antara lain autograft (tulang dari pasien yang sama),
allograft (tulang dari donor manusia lain), dan xenograft (tulang sapi). Autograft mempunyai kelemahan yaitu tulang harus diambil dari bagian tubuh lain pasien yang sama melalui teknik operasi sehingga dapat menimbulkan masalah-masalah klinis hingga resiko kematian. Sedangkan allograft dan xenograft dapat menimbulkan reaksi autoimun serta kemungkinan terjadinya transfer penyakit (Darwis dan Warastuti 2008).
Untuk mengatasi beberapa kelemahan dari proses penggantian tulang yang telah disebutkan diatas maka dibuat pengganti tulang suntik atau injectable bone substitutes (IBS) terdiri dari semen kalsium fosfat yang dapat disuntikkan dan
mudah dibentuk. Hal ini memungkinkan ahli bedah untuk menyuntikkan dan menjangkau daerah-daerah yang sulit di mana mencangkok tulang diperlukan, dan ditujukan untuk tulang yang kosong atau cacat yang tidak intrinsik untuk stabilitas struktur tulang. Hal ini diserap kembali dan diganti dengan tulang selama proses penyembuhan. Penggunaan pengganti tulang dengan kalsium fosfat telah menyebabkan penurunan dalam masalah yang disebabkan oleh cangkok tulang. Pengganti tulang ini harus memiliki instrumen pendukung steril, memastikan siap untuk digunakan dalam ruang operasi. Peran injectable bone substitute bisa juga
4
Cangkang Tutut
Tutut (Bellamya) termasuk dalam kelompok Operculata yang hidup di perairan
dangkal yang berdasar lumpur dengan aliran air yang lamban dan ditumbuhi rerumputan air. Misalnya sawah, rawa, pinggir danau, dan pinggir sungai kecil adalah contoh tempat tutut tumbuh. Ada dua jenis Bellamya yang hidup di sawah, yaitu Tutut
Jawa (Bellamya javanica) dan Tutut Sumatera (Bellamya sumatraensis) yang
sebarannya mencakup Indonesia (Sumatera dan Jawa), Thailand, Kamboja, dan Malaysia. Kelompok hewan ini bisa memiliki tinggi cangkang hingga 40 mm dengan diameter 15-25 mm, bentuk cangkangnya kerucut agak menggelembung, tipis, kecil atau tidak transparan. Tutut memiliki satuatau lebih rangka punggung yang tumpul dan berbentuk spiral. Bagian atas runcing, berdasar bulat, pinggiran bulat atau bersudut. Lingkaran embrio tidak mengikat, walaupun pada beberapa spesies keong dewasa berbentuk bulat dengan warna hijau-kecoklatan atau kuning kehijauan (Jutting 1956). Cangkang tutut dapat dilihat pada Gambar 1.
Tulang pada vertebrata yang telah tumbuh dewasa sebagian besar tersusun dari hidroksiapatit. Senyawa ini memiliki susunan molekul teratur (kristal) dan menempati fibril-fibril kolagen. Keberadaan kolagen dapat diumpamakan dengan cetakan yang menjadi wadah atau tempat tumbuhnya kristal hidroksiapatit. Hasil difraksi sinar-x, teramati bahwa kandungan terbesar tulang vertebrata muda dan vertebrata dewasa ternyata berbeda. Pada tulang muda struktur kristal hidroksiapatit itu belum dijumpai. Artinya, tulang vertebrata yang masih belia sebagian besar terdiri atas bahan amorf (bahan yang molekulnya tidak dalam susunan kristal). Perubahan kemudian terjadi seiring dengan pertumbuhan vertebrata itu. Kandungan tulangnya berubah dari yang sebagian besar berupa bahan amorf ketika muda, menjadi sebagian besar berupa kristal hidroksiapatit ketika dewasa (Miranda 2013).
Tutut merupakan moluska air tawar yang dagingnya banyak dimanfaatkan
sebagai bahan pangan kaya protein dan mineral di berbagai negara di dunia termasuk Indonesia. Cangkang tutut merupakan limbah dari konsumsi daging tutut dan belum memiliki pemanfaatan komersial.
Gambar 1 Cangkang Tutut
Hidroksiapatit
Hidroksiapatit merupakan senyawa kalsium fosfat dengan rumus kimia Ca10(PO4)6(OH)2. Nisbah mol Ca/P agar material HAp terbentuk adalah 1.67.
Struktur kristal HAp (Gambar 2) adalah heksagonal dengan parameter kisi a = b =
5 dalam anggota senyawa kalsium fosfat yang potensial dalam rekayasa jaringan. Berbagai senyawa kalsium fosfat lainnya adalah dikalsium fosfat dihidrat (CaHPO4.2H2O), okta kalsium fosfat (Ca8H2(PO4)6·5H2O), dan trikalsium fosfat
(Ca3(PO4)2). HAp merupakan senyawa kalsium fosfat yang paling stabil (Chow
2009).
Hidroksiapatit memiliki biokompabilitas yang sangat baik dengan jaringan keras, bioaktivitas merekontruksi ulang jaringan tulang yang telah rusak dan juga di dalam jaringan lunak meskipun mempunyai laju degradasi yang rendah, osteokonduktivitas tinggi, non-toksik, memiliki sifat non-inflamasi dan sifat imunogenik (Kusrini dan Sontang 2011).
Gambar 2 Struktur Hidroksiapatit (Aoki 1991)
Sifat kimia yang penting dari hidroksiapatit adalah biocompatible, bioactive,
dan bioresorbable. Biocompatible adalah sifat dimana mineral tersebut tidak
menyebabkan reaksi penolakan dari sistem kekebalan tubuh manusia karena dianggap sebagai benda asing. Bioactive material akan sedikit terlarut tetapi
membantu pembentukan sebuah lapisan permukaan apatit biologis sebelum langsung berantarmuka dengan jaringan dalam skala atomik, yang mengakibatkan pembentukan sebuah ikatan ke tulang. Bioresorbable material akan melarut
sepanjang waktu (tanpa memerhatikan mekanisme yang menyebabkan pemindahan material) dan mengijinkan jaringan yang baru terbentuk tumbuh pada sembarang permukaan tak-beraturan namun tidak harus berantarmuka langsung dengan permukaan material.
Gambar 3 Fenomena antarmuka antara HAp dengan sel tubuh (Bertazzo et al.
2010)
6
proses implan, mulai terjadinya pelarutan permukaan HAp, tahap kedua pelarutan permukaan HAp terus berlanjut, tahap ketiga kondisi kesetimbangan terbentuk antara larutan fisiologis dengan permukaan HAp, tahap keempat terjadi adsorpsi protein-protein dan senyawa bioorganik, tahap kelima terjadi adhesi sel, tahap keenam perkembangan sel, tahap ketujuh awal mula perkembangan sel tulang baru, dan tahap kedelapan tulang baru telah terbentuk (Gambar 3).
Fenomena tersebut merupakan sifat dari HAp yang juga bioaktif. Bioaktif diartikan sebagai sifat material yang akan terlarut sedikit demi sedikit tetapi membantu pembentukan suatu lapisan permukaan apatit biologis sebelum berantarmuka langsung dengan jaringan pada tingkat atomik, yang menghasilkan ikatan kimia yang baik antara implan dengan tulang (Suryadi 2011).
Sintesis HAp membutuhkan suatu prekursor sebagai sumber kalsium. Prekursor berperan sebagai zat awal yang dibutuhkan dalam pembuatan suatu senyawa. HAp dapat dibuat dari prekursor sintetik maupun dari prekursor bahan alam. Saat ini sedang dikembangkan pembuatan HAp dari prekursor bahan alam yaitu tulang ikan, cangkang kerang, batu kapur, cangkang keong dan cangkang telur. Sumber fosfor yang dapat digunakan untuk sintesis HAp yaitu diamonium hidrogen fosfat (NH4)2HPO4, asam fosfat (H3PO4), dan difosfor pentaoksida
(P2O5). Material HAp dapat disintesis dengan menggabungkan sumber Ca
dan P. Kalsium (Ca) yang dibutuhkan dalam sintesa mineral apatit banyak terdapat pada cangkang tutut dengan kandungan gizi tinggi. Cangkang tutut menyimpan potensi kalsium yang luar biasa, kalsium dalam keong tutut kira-kira ada 217 mg dalam 100 gram hampir setara dengan segelas susu (Safrida 2014). Sintesis HAp dapat dilakukan dengan dua metode yaitu metode basah dan metode kering. Metode basah terdiri atas tiga jenis yaitu metode presipitasi, hidrotermal, sol gel, dan hidrolisis (Pankaew et al. 2010; Kehoe 2008). Metode kering yaitu
reaksi solid-state, sintesis mechanochemical. Selain itu spray dan freeze-drying
juga dapat digunakan sebagai metode untuk menyintesis HAp (Kehoe 2008). Metode basah memiliki beberapa kelebihan sehingga mudah diaplikasikan dalam bidang industri diantaranya, hasil samping sintesisnya berupa air, kemungkinan kontaminasi selama proses sangat rendah, dan biaya prosesnya rendah (Kehoe 2008). Metode presipitasi merupakan metode yang sering digunakan dalam sintesis HAp karena metode ini memiliki kontrol komposisi dan karakter fisik HAp yang lebih baik serta mudah diaplikasikan (Pankaew et al.
2010).
Kitosan
Kitosan merupakan salah satu polimer alami yang digunakan secara luas disajikan pada Gambar 4. Kitosan dapat diperoleh dengan deacetylating secara
parsial dari kitin yang dapat diekstrak dari binatang berkulit keras. Kitosan merupakan polisakarida yang terdiri dari glucosamine dan N-acetyl glucosamine
yang dihubungkan dengan sebuah ikatan 1-4 glucosidic. Kitosan besifat
7 kitosan juga bersifat antibakteri (Sugita et al. 2009).
Gambar 4 Struktur kitosan
Polivinil Alkohol (PVA)
Polivinil alkohol (PVA) adalah suatu resin yang dibuat dari penggabungan molekul-molekul (polimerisasi) yang diperoleh dari hidrolisis dari polimer vinil ester dengan menggunakan material awal polivinil asetat. Polivinil Alkohol adalah salah satu dari beberapa polimer sintetik yang biodegradable (Kroschwitz 1998). PVA berwarna putih, bentuk seperti serbuk, rasa hambar, tembus cahaya, tidak berbau dan larut dalam air. PVA salah satu polimer yang mempunyai sifat hidrofolik dan sebagai perekat. PVA dapat digunakan sebagai lapisan tipis yang sensitif. PVA terkenal sebagai polimer sintetik larut air, dan rantai utamanya saling berikatan melalui ikatan hidrogen oleh sebab adanya gugus hidroksil.
Teknik Iradiasi Gamma
Teknologi polimerisasi radiasi adalah salah satu teknologi nuklir yang dapat diaplikasikan pada industri polimer yaitu untuk mengolah bahan mentah menjadi bahan setengah jadi atau bahan jadi, dengan bantuan sinar radiasi sebagai sumber energi. Radiasi berfungsi sebagai alat untuk mempermudah, mempercepat, reaksi kimia yang diperlukan di dalam proses polimerisasi atau memperbaiki. Secara konvensional reaksi kimia dimaksud, biasanya berlangsung melalui inisiator bahan kimia dan energi panas. Dalam proses polimerisasi radiasi, pemakaian bahan kimia dan panas sangat sedikit, baik jenis maupun kadarnya, karena sudah terwakili oleh sumber radiasi tersebut.
8
prosesnya dapat dilakukan pada suhu kamar, disamping itu proses polimerisasi radiasi mudah dikontrol/dipantau, sederhana, cepat, bebas pencemaran baik udara maupun limbah padat, serta produk yang dihasilkan tidak mengandung bahan beracun/karsinogen, karena prosesnya merupakan teknologi bebas pencemaran. Secara garis besar proses polimerisasi radiasi digambarkan sebagai berikut :
Gambar 5 Proses polimerisasi radiasi
Viskositas
Viskositas atau kekentalan merupakan gaya gesekan antara molekul-molekul yang menyusun suatu fluida. Jadi molekul-molekul-molekul-molekul yang membentuk suatu fluida saling gesek-menggesek ketika fluida-fluida tersebut mengalir. Pada zat cair, viskositas disebabkan karena adanya gaya kohesi (gaya tarik menarik antara molekul sejenis). Viskositas disebabkan oleh kohesi dan pertukaran momentum molekuler di antara lapisan-lapisan fluida dan pada waktu berlangsungnya aliran, efek ini terlihat sebagai tegangan tangensial atau tegangan geser di antara lapisan yang bergerak. Akibat adanya gradien kecepatan, akan menyebabkan lapisan fluida yang lebih dekat pada plat yang bergerak, dan akan diperoleh kecepatan yang lebih besar dari lapisan yang lebih jauh. Cairan yang mempunyai viskositas lebih tinggi akan lebih lambat mengalir di dalam pipa dibandingkan cairan yang viskositasnya lebih rendah. Sebuah benda yang bergerak dalam fluida yang punya viskositas lebih tinggi mengalami gaya gesek viskositas yang lebih besar daripada jika benda tersebut bergerak di dalam fluida yang viskositasnya lebih rendah.
Uji Sitotoksisitas In vitro Sel Endotel
Sitotoksisitas merupakan suatu uji viabilitas sel yang mencerminkan non sitotoksisitas suatu biomaterial. Uji ini penting dalam desain biomaterial untuk aplikasi dalam suatu rekayasa jaringan (Hashmi 2014). Uji sitotoksisitas dalam penelitian ini dilakukan secara in vitro menggunakan media kultur sel endotel cell pulmonary artery endhothelium (CPAE ATCC-CCL 209). Sel endotel memainkan
peranan penting dalam penyembuhan luka karena terdapat pada permukaan dalam pembuluh darah dan sel utama yang terlibat dalam angiogenesis (Marques et al.
9 memainkan peranan penting dalam membangun rangka dan perbaikan pada tulang yang retak atau patah. Hal ini dapat ditangani melalui proses implantasi (Kanczler dan Oreffo 2008). HAp untuk mempercepat proses penyembuhan luka setelah implantasi, mampu meningkatkan proliferasi endotel yang dibutuhkan untuk terjadinya angiogenesis (Pezzatini 2007). HAp sebagai implan juga berguna menjaga konsentrasi kalsium pada darah (Zhang 2012).
3 METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Oktober β015‒Mei 2016 di Laboratorium Kimia Anorganik Departemen Kimia IPB, Laboratorium Kimia Fisik Departemen Kimia IPB, Laboratorium Bersama Departemen Kimia IPB, Laboratorium Radiasi PAIR BATAN Jakarta, Pusat Penelitian dan Pengembangan Hasil Hutan, Laboratorium Forensik Markas Besar Kepolisian Republik Indonesia, dan Laboratorium Mikrobiologi Pusat Studi Satwa Primata.
Bahan
Bahan-bahan yang digunakan adalah cangkang tutut diperoleh dari Kabupaten Bogor, CaCO3 (Merck), HNO3(Merck), (NH4)2HPO4 (Merck), air
bebas ion, sel endotel CPAE ATCC CCL-209 (American Type Culture Collection, USA), dulbecco's modified eagle medium (Gibco, USA), dan biru
tripan (Sigma, USA).
Alat
Alat-alat yang digunakan adalah ayakan 100 mesh, pengaduk magnetik, tanur, buret, indikator pH universal, oven, kertas saring, sonikasi, sentrifugasi, dan peralatan uji kultur sel. Sedangkan peralatan karakterisasi terdiri dari Difraksi
Sinar-X (XRD) Shimadzu XD-7000, Spektrometer Infra Merah Transformasi Fourier (FTIR) Bruker Tensor 3, Mikroskop Pemancar Elektron (SEM) Carl-Zeiss Bruker EVO MA10, dan Spektrofotometer Serapan Atom (AAS) Shimadzu AA-7000.
Prosedur Penelitian Preparasi sampel
10
halus. Serbuk sampel diayak 100 mesh. Fasa serbuk lolos 100 mesh dianalisis dengan XRD (Mijan et al. 2015).
Pengukuran Kadar Ca dari CaO Preparasi Sampel
Sampel serbuk tutut yang sudah dikalsinasi CaCO3 ditimbang sebanyak 0.1
gram kemudian ditambahkan 5 mL HNO3 pekat dalam labu ukur 100 mL. Setelah
itu, didiamkan ± 5 menit sampai larut dan jernih. Sampel ditera dengan akuades, lalu dikocok. Selanjutnya dipipet 1 mL larutan yang telah dibuat dan dimasukkan ke dalam labu ukur 100 mL. Sampel ditera dengan akuades dan ditambahkan strontium agar ionnya stabil, kemudian dikocok. Larutan diukur dengan SSA pada
= 4ββ.7 nm.
Preparasi Deret Standar
Larutan 1000 ppm dibuat dengan cara ditimbang sebanyak 0.25 gram CaCO3 ke dalam labu ukur 100 mL. Kemudian ditambahkan 5 mL HNO3 pekat
dan didiamkan ± 5 menit sampai larut dan jernih. Sampel ditera dengan akuades, lalu dikocok-kocok. Setelah itu dibuat 100 ppm dengan memipet 10 mL dari larutan 1000 ppm dan dimasukkan ke dalam labu ukur 100 mL. Kemudian, ditera dengan akuades dan di kocok. Selanjutnya dari larutan 100 ppm dibuat deret standar dengan konsentrasi 2, 4, 8, 12, dan 16 ppm yaitu dipipet 2, 4, 8, 12, dan 16 mL kemudian masing-masing dimasukkan ke dalam labu ukur 100 mL. Ditambahkan sedikit strontium agar ionnya stabil, ditera dengan akuades lalu
dikocok. Deret standar diukur dengan SSA pada = 4ββ.7 nm.
Preparasi Blanko
Sebanyak 5 mL HNO3 pekat dipipet dalam labu ukur 100 mL. Selanjutnya
ditera dengan akuades dan dikocok. Setelah itu, dipipet 1 mL larutan yang telah dibuat dan dimasukkan ke dalam labu ukur 100 mL. Kemudian ditambahkan sedikit strontium, ditera dengan akuades lalu dikocok. Larutan diukur dengan SSA
pada = 4ββ.7 nm.
Kalsinasi CaCO3 menjadi CaO dan Konversi CaO menjadi Ca(OH)2
(Soido et al. 2009)
CaCO3 kemudian di kalsinasi pada suhu 1000 oC selama 3 jam, kemudian
didiamkan selama 1 minggu. Proses kalsinasi bertujuan untuk mengubah CaCO3
menjadi CaO, yang terjadi pada suhu 1000o-1200oC. Sebagian CO2 akan terlepas
dan menyebabkan penurunan massa sampel. Serbuk tutut yang telah dikalsinasi dilanjutkan analisis fasa menggunakan XRD. CaO kemudian dikonversi menjadi Ca(OH)2. Serbuk diratakan pada wadah dan dibiarkan berinteraksi dengan udara
terbuka (dihidrasi) selama seminggu. Serbuk Ca(OH)2 yang terbentuk kemudian
11
Sintesis HAp dengan metode presipitasi basah
Hidroksiapatit disintesis dari Ca(OH)2 yang telah disiapkan dari cangkang
tutut. Ca(OH)2 dibuat menjadi larutan 0.5 M lalu direaksikan dengan (NH4)2.HPO4
0.3 M sebagai berikut.
10Ca(OH)2 + 6(NH4)2.HPO4 Ca10(PO4)6(OH)2 + 6H2O + 12NH4OH
HAp dibuat dengan metode presipitasi basah melalui prinsip reaksi antara kalsium hidroksida dan asam posfat pada suhu 40±2 oC dengan pH 10. Reaksi terjadi dengan cara (NH4)2HPO4 0.3 M diteteskan ke dalam Ca(OH)2 0.5 M
dengan laju alir 1,3 mL per menit selama ±1 jam. Reaksi menghasilkan basa NH4OH sehingga pH nya mencapai nilai 10 dengan menggunakan indikator pH
universal setiap menit. Suspensi yang dihasilkan didiamkan selama 24 jam dan dilanjutkan dengan proses sonikasi selama 6 jam. Setelah itu disentrifugasi selama 15 menit pada 4500 rpm dan dibilas dengan akuades. Endapan yang dihasilkan kemudian dikeringkan pada oven dengan suhu 105 oC selama 3 jam. Serbuk HAp yang telah terbentuk diangkat dan dibiarkan mendingin pada suhu kamar.
Sintesis HAp-Kitosan-PVA
Kitosan terlebih dahulu dilarutkan dalam asam asetat 3% kemudian diaduk dengan pengaduk magnetik. PVA dilarutkan dalam aquades hingga homogen. Kemudian larutan kitosan dicampurkan ke dalam larutan PVA. Larutan hidroksiapatit kemudian dimasukkan ke dalam campuran kitosan dan PVA. Ke dalam larutan HPMC 2% (w/v) dicampurkan campuran hidroksiapatit-kitosan-PVA sedikit demi sedikit dan diaduk selama 6 jam hingga homogen. Dihasilkan suspensi berwarna putih. Kemudian komposit diiradiasi pada dosis 20 kGy. Karakterisasi menggunakan XRD, FTIR dan SEM.
Uji viskositas (Modifikasi Putra et al. 2014)
Analisis viskositas dilakukan untuk mengetahui kekentalan sampel suspensi yang telah disintesis. Pengujian ini dilakukan dengan menggunakan Viscotester TV-10. Suspensi komposit hidroksiapatit-kitosan-PVA langsung dimasukkan
gelasa becker dan dilakukan pengukuran dengan menggunakan rotor nomor 1.
Pengukuran diawali dengan mengaitkan rotor pada viscotester dan sampel dimasukkan ke dalam gelas becker hingga batas sampel pada rotor. Bagian needle clamp yang ada ditepi dipindahkan ke arah sebaliknya dan alat dinyalakan. Ketika
rotor mulai berputar, jarum indikator viskositas secara perlahan akan bergerak ke arah kanan dan akan stabil pada nilai tertentu. Skala yang digunakan sesuai dengan rotor yang digunakan yaitu skala kedua untuk rotor nomor 1. Setelah selesai pembacaan hasil viskositas, alat tersebut dimatikan dan needle clamp
12
Uji in vitro Sitotoksisitas pada Sel Endotel CPAE
Pengujian sitotoksisitas dengan metode 3-(4,5-dimetiltiazol-2-il)2,5-difeniltetrazolium bromide (MTT) dilakukan pada Sel CPAE. Sel CPAE ditumbuhkan dalam media penumbuh Dulbecco’s modified Eangle’s medium
(DMEM). Sel yang digunakan diinokulasi pada pelat yang terdiri atas 96 sumur
dengan jumlah media penumbuh 100 L/sumur yang mengandung ββ00 sel/sumur. Sebanyak 100 L sampel dengan deret konsentrasi tertentu
ditambahkan pada inokulan, kemudian diinkubasi selama 48 jam dalam inkubator CO25% pada suhu γ7 ᵒC. Selanjutnya ke dalam setiap sumur ditambahkan 10 L
MTT dan diinkubasi kembali selama 4 jam dalam inkubator CO2 5% pada suhu
γ7 ᵒC. sel hidup yang bereaksi dengan MTT membentuk formazan menjadi
berwarna biru. Formazan yang terbentuk dilarutkan dalam etanol 96%. Serapan dibaca dengan spektrofotometer ELISA microplate readerpada 5λ5 nm.
4 HASIL DAN PEMBAHASAN
Cangkang tutut pada Gambar 6 merupakan limbah dari konsumsi daging
tutut dan belum memiliki pemanfaatan komersial. Cangkang tutut memiliki bentuk cangkang kerucut agak menggelembung dengan tinggi cangkang hingga 40 mm dengan diameter 15-25, tipis, dan kecil. Cangkang tutut cocok sebagai sumber material komposit karena mengandung berbagai mineral. Salah satunya adalah unsur kalisum. Kalsium dalam cangkang tutut memiliki satu komposisi
fasa yaitu kalsium karbonat (CaCO3).
Gambar 6 Cangkang tutut (Bellamya javanica) (a) kering (b) serbuk halus
Hasil Analisis XRD Cangkang Tutut Sebelum dan Setelah Kalsinasi
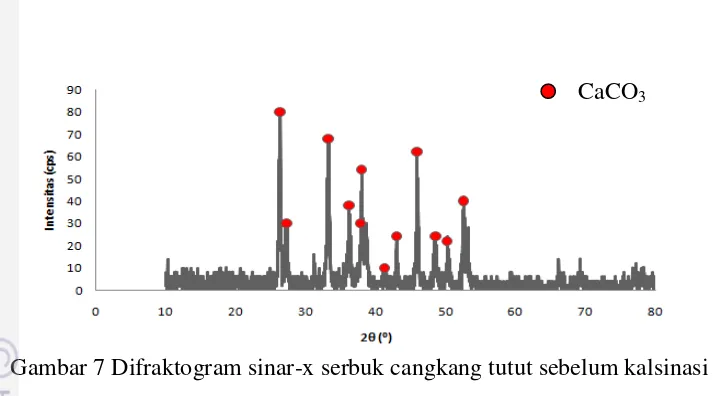
Hasil analisis XRD untuk keberadaan senyawa CaCO3 dari serbuk cangkang
tutut sebelum kalsinasi menunjukkan bahwa cangkang tutut memiliki puncak-puncak pada kisaran βθ β6-53 (°) yaitu 26.34, 27.26, 33.28, 36.16, 37.98, 38.14, 41.52, 42.96, 45.90, 48,54, 50.4, dan 52.52 (Gambar 7). Puncak difraksi fasa CaCO3 (aragonite) dicirikan dari puncak difraksi yang khas dengan intensitas
tertinggi berada pada sudut βθ β6.γ4°, γγ.β8°, γ6.16°, dan 5β.5β° (berdasarkan
data JCPDS No. 41-1475). Analisis difraksi sinar-x terhadap serbuk cangkang tutut menunjukkan bahwa CaCO3 merupakan komponen utama.
13
Gambar 7 Difraktogram sinar-x serbuk cangkang tutut sebelum kalsinasi Fase kristal CaCO3 aragonit terbentuk dari kondisi super jenuh dan
membutuhkan suhu dan tekanan yang tinggi. Fase ini disintesis pada temperatur di atas 60oC. Umumnya, aragonit ditemukan di alam sebagai biomineral dalam batu karang, cangkang kerang, cangkang tutut, dan otolit. Aragonit berisostruktur dengan karbonat dari kation divalen seperti Ba, Sr, dan Pb (Dickens dan Bowen 2007).
Serbuk cangkang tutut yaitu CaCO3 dikalsinasi pada suhu 1000-1β00 ᵒC
selama 3 jam. Kalsinasi pada suhu rendah dapat menyebabkan senyawa CaO yang dihasilkan berubah kembali menjadi CaCO3 dan dekomposisi CO2 yang
dihasilkan akan cukup rendah. Proses kalsinasi bertujuan untuk mengubah senyawa CaCO3 menjadi CaO. Kondisi ini menyebabkan seluruh komponen
organik cangkang tutut terbakar habis menjadi CO2 dan H2O (Adak dan Purohit
2011). Kalsinasi juga dapat menghilangkan senyawa organik dan pengotor yang mengganggu dalam proses pembentukan HAp (Sukaryo et al. 2009). Dengan
demikian di akhir proses kalsinasi, seluruh cangkang tututdiharapkan dapat berubah menjadi CaO dan menyebabkan massa sampel berkurang. Data hasil analisis XRD serbuk cangkang tutut sebelum kalsinasi dapat dilihat pada Lampiran 2a dan standar fasa CaCO3 dapat dilihat pada Lampiran 3a.
Reaksi: CaCO3(s) CaO(s) + CO2(g)
Senyawa CaO yang diperoleh kemudian dikonversi menjadi Ca(OH)2.
Proses konversi dilakukan dengan cara dibiarkan kontak langsung dengan udara. Proses ini bertujuan agar terjadi hidrasi CaO menjadi Ca(OH)2 melalui persamaan
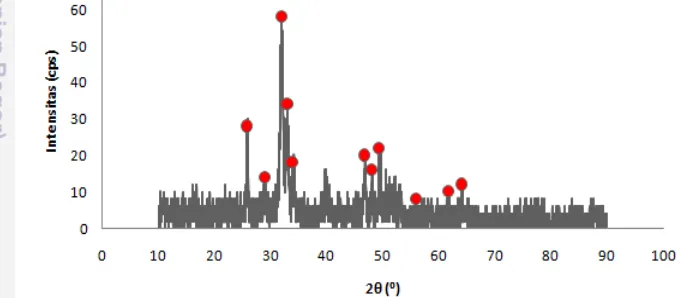
reaksi: 2CaO(s) + 2H2O(g) → βCa(OH)2(s). Pola XRD cangkang tutut setelah
kalsinasi menunjukkan bahwa telah terbentuknya fasa Ca(OH)2 (portlandite) yang
dicirikan keberadaannya pada sudut 2θ = 18.18°, 28.68°, 34.30°, 47.40°, 50.92°, 54.16°, dan 62.62°, 64.16°, 67.46° (berdasarkan data JCPDS No. 44-1481) (Gambar 8).
14
Gambar 8 Difraktogram sinar-x hasil kalsinasi serbuk cangkang tutut Senyawa Ca(OH)2 yang diperoleh ini merupakan starting material yang
digunakan dalam tahap sintesis HAp. Data hasil analisis XRD serbuk cangkang tutut setelah kalsinasi dapat dilihat pada Lampiran 2b dan standar fasa Ca(OH)2
dapat dilihat pada Lampiran 3b.
Penentuan Kadar Ca Cangkang Tutut
Analisis kadar Ca dalam cangkang tutut setelah kalsinasi menggunakan AAS. Hasil analisis serbuk cangkang tutut menunjukkan kandungan kalsium sebesar adalah 55.37% (Lampiran 4). Kandungan kalsium cangkang tutut yang diperoleh lebih rendah dibandingkan cangkang tutut hasil penelitian Herawaty (2014) sebesar 64.73%. Namun kandungan kalsium dari cangkang tutut lebih tinggi dibandingkan cangkang keong sawah hasil Winata (2012) sebesar 52%. Hasil AAS telah membuktikan bahwa cangkang tutut yang kaya akan kalsium berpotensi sebagai prekursor kalsium untuk mensintesis HAp.
Tutut hidup di tanah sawah berlumpur, oleh karena selain kalsium yang terdapat dalam cangkang diduga terdapat unsur lain yang terkandung dalam cangkang tutut yaitu magnesium, fosfor, natrium, besi, mangan, tembaga dan seng. Hasil analisis menunjukkan bahwa seluruh komposisinya memiliki kadar dibawah 0.05%, sedangkan kadar tertinggi sebesar 0.08% berasal dari unsur besi. Kadar ini masih dibawah syarat mutu yaitu 2.00% berdasarkan persyaratan dalam SNI 19-7030-2004 yang mengindikasikan bahwa cangkang tutut ini tidak termasuk limbah organik domestik yang membahayakan (Herawaty 2014).
Hasil Sintesis HAp dengan Metode Presipitasi Basah
Sintesis hidroksiapatit paling banyak dilakukan adalah metode presipitasi basah. Metode ini digunakan karena jumlah produk HAp yang dihasilkan relatif lebih banyak dan tanpa menggunakan pelarut organik (Cunniffe et al. 2010).
Selain itu partikel HAp yang dihasilkan memiliki tingkat kemurnian tinggi dalam waktu sintesis yang cepat. Sintesis HAp dilakukan dengan mereaksikan larutan Ca(OH)2 dengan larutan (NH4)2HPO4 dengan persamaan reaksi:
10Ca(OH)2 + 6(NH4)2HPO4 Ca10(PO4)6(OH)2 + 6H2O + 12NH4OH
15 Proses sintesis berlangsung menggunakan pH optimum terbentuknya HAp yaitu 10 (Dahlan et al. 2009). Apabila pH larutan kurang dari 10 atau melebihi
10akan menyebabkan terbentuknya kalsium monofosfat dan kalsium dehidrat yang mudah larut dalam air (Afshar et al. 2003). Suhu sintering sangat penting
dalam proses menghasilkan HAp murni karena fasa selain HAp dapat terbentuk apabila suhu sintering terlampau tinggi maupun terlampau rendah. Jika suhu sintering terlampau tinggi maka akan terbentuk senyawa apatit karbonat tipe A Ca10(PO4)6CO3 dan jika suhu sintering terlampau rendah maka akan terbentuk
senyawa apatit karbonat tipe B Ca10(PO4)3CO3(OH)2 (Shojai et al. 2013). Proses
sonikasi dilakukan dengan memberikan gelombang ultrasonik yangbertujuan untuk memperkecil ukuran HAp dan membuat partikel HAp homogen sehingga derajat kristalinitasnya meningkat. Proses dekantasi dan sentrifugasi bertujuan agar HAp dapat mengendap sehingga mudah untuk dipisahkan (Earl et al. 2006).
Hasil Karakterisasi Fasa HAp menggnakan XRD
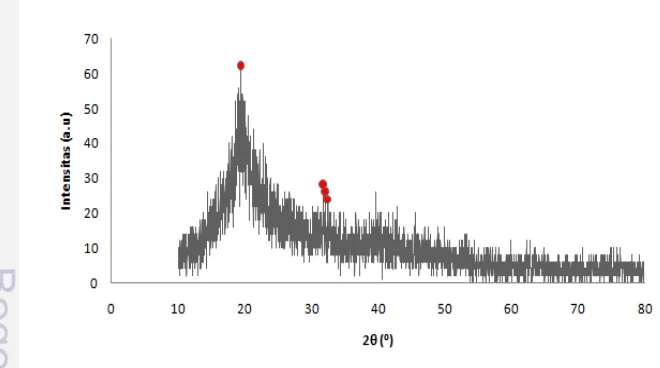
Identifikasi pola difraksi sinar-x HAp hasil sintesis dengan metode
presipitasi dicirikan oleh puncak difraksi di antara sudut βθ ββ–80° (Gambar 9). Pola XRD menunjukkan bahwa serbuk hasil sintesis merupakan murni fasa tunggal HAp berdasarkan data JCPDS No. 09-0432 (Lampiran 3c). Hal ini
dibuktikan dari puncak ciri khas yang kuat pada βθ = γ1.λ8°, γβ.λ6°, dan γγ.08°
tanpa adanya puncak asing. Data hasil analisis XRD HAp dapat dilihat pada Lampiran 2c.
Gambar 9 Difraktogram sinar-x HAp hasil sintesis metode presipitasi
Selain pola difraksi sinar-x khas dari HAp dicirikan pula dengan munculnya beberapa puncak difraksi intensitas sedang pada sudut 2θ β6° dan 39–53°, dua puncak agak lemah di 28–29° dan 64°. Hasil analisis yang dilakukan Lee (2009) menggunakan program general structure analysis system (GSAS) menunjukkan
16
Hasil Analisis HAp menggunakan FTIR
Analisis spektrum FTIR dilakukan untuk mengidentifikasi gugug fungsi yang terdapat pada senyawa HAp yang dihasilkan. Gugus fungsi pada HAp ditandai dengan munculnya serapan pada bilangan gelombang 400–4000 cm-1. Spektrum FTIR HAp hasil sintesis metode presipitasi dapat dilihat pada Gambar 10.
.
Gambar 10 Spektrum FTIR hidroksiapatit hasil metode presipitasi basah Adanya serapan pada bilangan gelombang 1033.12, 604.89 dan 565.77 cm-1 yang merupakan vibrasi gugus PO43-. Bilangan gelombang pada vibrasi gugus
PO43- yang diperoleh sesuai dengan hasil penelitian yang dilaporkan oleh
Farnoush et al. (2012) yaitu muncul pada bilangan gelombang di sekitar 1090,
602, dan 570 cm-1. Sejalan dengan Destainville (2003) yang juga melaporkan
bahwa gugus PO43- muncul pada bilangan gelombang 1041.56, 601.79 dan 567.07
cm-1. Adanya gugus OH- ditunjukkan dengan munculnya serapan pada bilangan gelombang 3431.90 cm-1. Vibrasi gugus OH- yang sama juga telah dilaporkan oleh Farnoush et al. (2012) yaitu muncul pada serapan pada bilangan gelombang
sekitar 3572 dan 632 cm-1. Sejalan dengan hasil penelitian yang dilaporkan oleh Dedourkova et al. (2012) bahwa gugus OH- muncul pada bilangan gelombang
3575 cm-1. Gugus OH- yang sama juga dilaporkan muncul pada bilangan
gelombang 3421.72 cm-1 (Raynaud 2002). Adanya puncak lemah yang merupakan vibrasi dari gugus CO32- ditunjukkan dengan munculnya serapan pada bilangan
gelombang 1421.03 cm-1. Vibrasi dari gugus CO32- yang sama juga telah
dilaporkan oleh Farnoush et al. (2012) bahwa spektrum lemah mengindikasikan
adanya gugus CO32- muncul pada bilangan gelombang 1470 dan 1420 cm-1
sebagai hasil dari absorpsi atmosfer CO2 pada permukaan partikel HAp. Hal ini
sejalan dengan hasil FTIR pada gugus CO32- yang dilaporkan oleh Herawaty et al.
(2014) yaitu muncul pada bilangan gelombang 1454.33 cm-1. Meejoo et al. (2006)
juga melaporkan gugus CO32- muncul pada serapan gelombang 1454.33 cm-1.
Menurut Dedourkova et al. (2012) bahwa adanya substitusi karbonat pada gugus
hidroksil atau fosfat dapat disebabkan oleh kelarutan CO2 di lingkungan sekitar
terkait dengan pengadukan yang kuat selama proses sintesis HAp dengan metode presipitasi kimia. Hasil spektrum terlihat bahwa gugus fosfat terdeteksi paling dominan. Hasil ini menunjukkan tingkat kemurnian HAp yang sangat tinggi,
OH- CO3
3-17 walaupun masih terdapat gugus karbonat sebagai kalsium karbonat dalam jumlah yang sangat kecil (trace element).
Hasil Karakterisasi HAp menggunakan SEM
Analisis SEM bertujuan untuk melihat partikel HAp. Analisis ini dilakukan dengan teknik pelapisan menggunakan emas. Foto SEM partikel HAp dapat dilihat pada Gambar 11. Kristal HAp yang diperoleh cenderung berbentuk bulat atau bola dan ukuran rata-rata pori yang homogen. Farnoush et al. (2012)
melaporkan hal yang sama bahwa morfologi HAp dilihat menggunakan SEM diperoleh HAp berbentuk bola. Porositas HAp berfungsi menyediakan lingkungan biologi yang baik pada adhesi sel, interaksi selular, proliferasi, dan migrasi (Poinern et al. 2013). Dengan demikian, pori HAp yang terdapat diantara butiran
HAp diharapkan memiliki kemampuan sebagai media pertumbuhan tulang baru setelah implantasi.
Gambar 11 Foto SEM HAp hasil sintesis presipitasi basah perbesaran 500X Foto SEM pada HAp menggunakan metode presipitasi yang sama dilaporkan Yoruc dan Koca (2009) bahwa diperoleh HAp berbentuk boladan terjadi aglomerasi pada partikel. Hal ini terjadi karena bergabungnya partikel ukuran nano membentuk aglomerat sehingga diperoleh beberapa ukuran mikro. Sejalan dengan Dedourkova et al. (2012) yang memperoleh partikel HAp
berbentuk bola dan beberapa partikel yang teraglomerasi. Mobasherpour et al.
(2007) juga melaporkan hal yang sama bahwa pada SEM partikel HAp yang dihasilkan menggunakan metode presipitasi diperoleh partikel kecil dan partikel aglomerasi. Morfologi hidroksiapatit menunjukkan aglomerasi dengan karakteristik partikel tunggalnya cenderung bulat-bulat. Morfologi HAp hasil sintesis metode presipitasi membentuk gumpalan-gumpalan yang lebih kecil.
Komposit HAp-Kitosan-PVA sebagai Injectable Bone Substitute
18
Instrumentation (AAMI) TIR33:2005 yang menyatakan bahwa dosis sterlisasi pada kisaran dosis 15 hingga 35 kGy. Iradiasi gamma pada material untuk sterilisasi produk yang akan digunakan dalam bidang kesehatan dan tidak meninggalkan residu radioaktif. Secara visual hasil sampel IBS setelah iradiasi menunjukkan gel tak berwarna (bening) yang kental dan homogen.
Karakterisasi komposit menggunakan FTIR
Spektroskopi Fourier Transform infrared (FTIR) adalah teknik yang tepat untuk menguji interaksi partikel polimer. Hasil pengujian FTIR PVA, kitosan, hidroksiapatit dan komposit HAp-kitosan-PVA ditampilkan pada Gambar 12. Karakteristik spektrum polivinil alkohol terdapat pada bilangan gelombang 3438 cm-1 (vibrasi regang OH), 2924 cm-1 (vibrasi regang C-H/CH2), 1701 cm-1 (vibrasi
regang –C=O), 1381 cm-1 (vibrasi regang –C-H), 1055 cm-1 (vibrasi –C-C-). Dan juga kehadiran dari absorbsi ikatan HOH yang diobservasi pada bilangan gelombang 1649 cm-1. Spektrum kitosan pada bilangan gelombang 3730 cm-1 (vibrasi regang H-NH), sementara 1654 cm-1 merupakan karakteristik dari amida I. Puncak tajam pada 1421 cm-1 yang ditunjukkan oleh mode perubahan bentuk simetris CH3. Bilangan gelombang 3432 cm-1 (vibrasi regang –OH), 2874 cm-1
(vibrasi C-H alifatik), 664 cm-1 (vibrasi tekuk N-H). Spektrum FTIR
hidroksiapatit cangkang tutut antara lain vibrasi regang OH pada daerah 3431 cm
-1, vibrasi tekuk H-OH pada 1640 cm-1, serapan yang khas dari karbonat (CO 32-)
pada 1421 cm-1 dan 873 cm-1, kemudian serapan fosfat (PO43-) pada 1033 cm-1,
604 cm-1 dan 565 cm-1. Pada spektrum FTIR komposit terlihat bahwa spektrum yang terbentuk merupakan gabungan dari spektrum unsur-unsur penyusun dari komposit yaitu PVA, kitosan dan hidroksiapatit. Terjadi pelebaran puncak pada bilangan gelombang 3000-3500 cm-1 yang merupakan penggabungan antara vibrasi –OH dari hidroksiapatit, kitosan dan PVA (Warastuti et al. 2014). Selain
itu terdapat pula puncak serapan yang khas dari kitosan pada 2874cm-1 (vibrasi –
C-H alifatik).
19 Puncak serapan hidroksiapatit cangkang tutut sebelum perlakuan menunjukkan serapan vibrasi regang OH pada daerah 3431 cm-1, vibrasi tekuk H-OH pada 1640 cm-1, serapan yang khas dari karbonat (CO32-) pada 1421 cm-1 dan
873 cm-1, kemudian serapan fosfat (PO
43-) pada 1033 cm-1, 604 cm-1 dan 565 cm-1,
tetapi setelah terbentuk komposit, puncak serapan dari hidroksiapatit berkurang intensitasnya dan agak melebar/broadening berkisar 3000-3500 cm-1. Hal ini
disebabkan karena adanya interaksi antar unsur penyusun komposit, seperti ikatan hidrogen antara kitosan-hidroksiapatit. Gugus –OH dan –NH2 dari kitosan
berikatan dengan gugus –OH dari hidroksiapatit (Pighinelli et al. 2013).
Karakterisasi komposit menggunakan XRD
Hasil pola difraksi sinar-x dari komposit hidroksiapatit cangkang tutut khitosan-PVA ditampilkan pada Gambar 13. Dari pola difraksi terlihat puncak difraksi dari hidroksiapatit pada posisi βθ 31.98°, 32.96°, dan 33.08°. Kitosan memperlihatkan dua puncak difraksi pada 12.41o dan 20.42o sedangkan pada PVA terdapat satu puncak difraksi pada 19.84o.
Dari pola difraksi tersebut terlihat bahwa hidroksiapatit bersifat kristalin karena menghasilkan puncak-puncak yang tajam, PVA bersifat semi kristalin dan kitosan bersifat amorf karena puncaknya yang cenderung melebar. Puncak difraksi sinar-x pada sampel menunjukkan gabungan dari ketiga unsur penyusun komposit. Pada posisi βθ 10-β0ᵒ terdapat puncak difraksi pada posisi 11.γ1o dan
19.93o, dimana puncak difraksi PVA di posisi 19.84o dan kitosan di posisi 21.42o berubah menjadi satu puncak saja di posisi 19.57o. Hal tersebut menunjukkan kitosan memiliki interaksi yang kuat dengan PVA, menghasilkan campuran
miscible (Zhang 2012). Sementara itu, puncak difraksi pada posisi 25o sampai 50o
merupakan puncak difraksi dari hidroksiapatit. Dari pola difraksi sinar-x ini juga dapat diketahui bahwa campuran ketiga unsur berinteraksi membentuk komposit dan tidak membentuk senyawa baru, yang terlihat dari tidak terbentuknya puncak difraksi baru pada pola difraksi komposit.
20
Karakterisasi komposit dengan SEM
Morfologi permukaan dari membran komposit IBS disajikan pada Gambar 14. Permukaan membran terlihat kasar dan terdapat mikropori yang berasal dari penambahan hidroksiapatit. Jaringan penghubung berpori pada membran berfungsi sebagai sirkulasi pada cairan tubuh dan darah (Teng et al. 2008).
Gambar 14 Morfologi komposit hidroksiapatit-kitosan-PVA
Hasil Uji Viskositas
Pengujian tingkat kekentalan atau viskositas dilakukan untuk mengetahui kekentalan sampel atau komposit yang telah disintesis. Pengujian ini bertujuan agar sampel IBS dapat disuntikkan dengan baik ketika proses implan dilakukan. Karena sebagai bahan IBS kekentalan dari bahan implan harus tepat untuk menjaga implan yang akan masuk mengisi rongga kosong pada tulang. Hasil nilai viskositas yang ditunjukkan oleh komposit adalah 36 dPa.s. Nilai viskositas yang dimiliki oleh komposit ini menunjukkan hasil yang mendekati nilai standar viskositas untuk sampel injectable bone substitute yaitu 40 dPa.s. Hal ini
menunjukkan bahwa secara kualitatif, suspensi mampu diaplikasikan sebagai
injectable bone substitute.
Hasil Uji SitotoksisitasIn vitro Sel Endotel
Pengujian sitotoksisitas dilakukan secara in vitro menggunakan media
kultur sel endotel. Uji ini bertujuan untuk menentukan viabilitas sel ketika terjadi kontak langsung dengan sampel. Sel endotel dipilih karena sel endotel merupakan sel utama yang terlibat dalam pembentukan pembuluh darah. Hidroksiapatit diketahui mampu meningkatkan proliferasi endotel yang dibutuhkan untuk terjadinya pembentukan pembuluh darah baru (angiogenesis) (Rucker et al. 2006).
21 Persen inhibisi menunjukkan terhambatnya pertumbuhan sel akibat terpapar oleh sampel. Persen inhibisi dinyatakan dalam dosis efektif median (ED50). Jika
persen inhibisi melebihi 50%, maka sampel tergolong toksik (Matsuura et al.
2000). Konsentrasi komposit yang digunakan dengan deret konsentrasi (%) 100, 75, 50, 25, 12.5 menggunakan uji MTT. Hasil uji toksisitas komposit menunjukkan bahwa batas konsentrasi yang aman adalah 12.5% dengan persen inhibisi 13.13% yang artinya sel CPAE yang digunakan tetap hidup lebih dari 50%. Hasil uji sitotoksisitas dapat dilihat pada Gambar 15.
Gambar 15 Komposit HAp-kitosan-PVA terhadap sel CPAE dengan deret konsentrasi (%) (a) 100, (b) 75, (c) 50, (d) 25, dan (e) 12.5
5 SIMPULAN DAN SARAN
Simpulan
Hidroksiapatit berbahan baku cangkang tutut telah berhasil disintesis menggunakan metode presipitasi basah. Hasil sintesis menunjukkan bahwa hidoksiapatit merupakan fasa tunggal. Komposit hidroksiapatit cangkang tutut-kitosan-polivinil alkohol mampu dibuat menjadi injectable bone substitute untuk
aplikasi defek tulang akibat osteoporosis. Hasil uji viskositas diperoleh 36 dPa.s yang cukup mendekati nilai standard injectable bone substitute. Hasil uji
sitotoksisitas menunjukkan komposit tidak menyebabkan toksis pada kultur sel endotel Calf Pulmonary Artery Endothelium (CPAE) (ATCC-CCL 209) dengan
persen inhibisi 13.13% yang menunjukkan nilai viabilitas sel lebih dari 50%. Berdasarkan nilai viskositas dan sitotoksisitas komposit HAp-kitosan-PVA berpotensi sebagai implan tulang.
a b c
22
Saran
23
DAFTAR PUSTAKA
Adak MD, Purohit KM. 2011. Synthesis of nano crystalline hydroxyapatite from dead snail shells for biological implantation. Trends Biomater Artif Organs.
25(3):101-106 .
Afshar A, Ghorbani M, Ehsani N, Saeri MR, Sorrell CC. 2003. Some important factors in the wet precipitation process of hydroxyapatite. Materials and design. 24:197–202.
Azami M, Tavakol S, Samadikuchaksaraei A', Hashjin M'S, Baheiraei N', Kamali M', NouraniMR. 2012. A porous hydroxyapatite/gelatin nanocomposite scaffold for bone tissue repair: in vitro and in vivo evaluation. J Biomater Sci., Polym Ed.
Aoki, Hideki. 1991. Science and Medical Application of Hydroxyapatite. JAAS:
Tokyo, Japan.
Baby RL, Hasan I, Kabir KA, Naser MN. 2010. Nutrient analysis of some commercially important mollusc of Bangladesh. J Sci Res. 2(2):390–396.
Bertazzo S, Zambuzzi W, Campos D, Ogeda T. 2010. Hydroxyapatite surface solubility and effect on cell adhesion. Colloids Surf., B. 78(2): 177-184. doi:
10/1016/j.colsurfb.2010.02.027.
Chow LC. 2009. Next generation calcium phosphate-based biomaterials. Dent Mater J. 28(1):1–10.
Cunniffe GM, O’Brian FJ, Partap S, Levingstone TJ, Stanton KT, Dickson GR.
2010. The synthesis and characterization of nanophase hydroxyapatite using a novel dispersant-aided precipitation method. J Biomed Mater Res. RCSI
.95(4):1142-1149.
Dahlan K, Prasetyanti F, Sari YW. 2009. Sintesis hidroksiapatit dari cangkang telur menggunakan dry metode. J Biofis 5(2):71-78
Darwis D, Warastuti Y. 2008. Sintesis dan karakterisasi komposit hidroksiapatit (HA) sebagai graft tulang sintetik. Jurnal Ilmiah Aplikasi Isotop dan Radiasi. 4(2): 143-153.
Dedourkova T, Zelenka J, Zelenkova M, Benes L, Svoboda L. 2012. Synthesis of sphere-like nanoparticles of hydroxyapatite. Procedia Engineering.
42:1816–1821. doi: 10.1016/j.proeng.2012.07.576.
Destainville A, Champion E, Bernache-Assollante D, Laborde E. 2003. Synthesis, characterization and thermal behaviour of apatitic tricalcium phosphate.
Mater Chemi and Phys. 80(1): 269 – 277.
Dickens B, Bowen JS. 1971. Refinement of the crystal structure of the aragonite phase of CaCO3. J Res Nat Bur Stand. 75A(1): 27-32
Earl JS, Wood DJ and Milne SJ. 2006. Hydrothermal synthesis of hydroxyapatite. Institute for Materials Research, University of Leeds. UK J of Physics:
Conference (26):268–271 doi:10.1088/1742-6596/26/1/064
Farnoush H, Mohandesi JA, Fatmehsari DH, Moztarzadeh F. β01β. Modification
of electrophoretically deposited nano-hydroxyapatite coatings by wire brushing on Ti–6Al–4V substrates. Ceram Int. 38(6):4885–4893. doi:
10.1016/j.ceramint.2012.02.079.
24
Departement Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Institut Pertanian Bogor.
Jutting B. 1956. Systematic Studies on the Non-Marine Mollusca of the Indo-Australian Archipelago.Critical Revision of the Javanese Freshwater
Gastropods. Amsterdam (AM): Treubia.23(2):259-477.
Kanczler JM, Oreffo RO. 2008. Osteogenesis and angiogenesis: the potential for engineering bone. Eur Cell Mater. 15:100-114.
Kehoe S. 2008. Optimisation of hydroxyapatite (HAp) for orthopaedic application via the chemical precipitation technique [thesis]. Dublin: School of mechanical and manufacturing engineering Dublin City University.
Khaerudini, DS. 2008. Microstructure and Mechanical Behaviour of Powder Metallurgy
Kroschwitz JI. 1998. Concise Encyclopedia of Polymer Science and Engineering. New York: John Willey & Sons Inc.
Kumar MN, Muzzarelli RA, Muzzareli C, Sashiwa H, Domb Aj. 2004. Chitosan Chemistry and Pharmaceutical Perspective. Chem Kev. 104(12): 6017-84
Kusrini E, Sontang, M. 2012. Characterizayion of X-Ray diffraction and electron spin resonance, dalam Pudjiastuti, AR. 2012. Preparasi hidroksiapaptit dari tulang sapi dengan metode kombinasi ultrasonik dan spraydrying. Fakultas Teknik Universitas Indonesia, Jakarta.
Lee YJ, Stephens P , Tang Y, Li W, Phillips BL, Parise J B, Reeder RJ. 2009. Arsenate substitution in hydroxylapatite: structural characterization of the Ca5(PxAs1-xO4)3OH solid solution. Am Mineral 94(5-6): 666-675. doi:
10.2138/am.3120.
Manafi SA, Joughehdoust S. 2009. Synthesis of hydroxyapatite nanostructure by hydrothermal condition for biomedical application. Iran J Pharm Res.5(2):89-94.
Marques JMS, Gomes PS, Silva MA, Cabrita AM, Santos JD, Fernandes MH. 2008. Growth andphenotypic expression of human endothelial cells cultured on a glass-reinforced hydroxyapatite. J Mater Sci: Mater Med.
20(3):725-31. doi:10.1007/s10856-008-3628-6.
Maruf, Siswomihardjo W, Soesatyo MHNE, Tontowi AE. 2013. Uji biokompatibiltas komposit polivinil alkohol-hidroskiapatit dengan penguat catgut sebagai bahan penyambung patah tulang. Jurnal Teknosains; Vol 3
hal 1-80
Matsuura T, Hosokawa R, Okamoto K, Kimoto T, Akagawa Y. 2000. Diverse mechanisms of osteoblast spreading on hydroxyapatite and titanium.
Biomaterials. 21(11):1121–1127.
Meejoo S, Maneeprakorn W, Winotai P. 2006. Phase and thermal stability of nanocrystalline hydroxyapatite prepared via microwave heating.
Thermochimica Acta. 447(1): 115–120.
Mijan NA, Yap YH, Lee HV. 2015. Synthesis of clamshell derived Ca(OH)2
nano-particles via simple surfactant-hydration treatment. The Chemical Engineering Journal. 262:1043–1051. doi:10.1016/j.cej.2014.10.069.
Miranda ZI, Siswanto, Hikmawati D. 2013. Sintesis komposit kolagen-hidroksiapatit sebagai kandidat bone graft. Media Jurnal Fisika dan Terapan. Fakultas Sains
25 Mobasherpour I, Heshajin MS, Kazemzadeh A, Zakeri M. 2007. Synthesis of nanocrystalline hydroxyapatite by using precipitation method. J Alloys Compd. 430:330-333. doi:10.1016/j.jallcom.2006.05.018.
Mohamed KR, El-Rashidy ZM, Salama AA. 2011. In vitro properties of nano-hydroxyapatite/chitosan biocomposites. Journal Ceramic International
2011;37:3265
Nayak KA. 2010. Hydroxyapatite synthesis methodologies: an overview.
International Journal Chem Tech Research., 2 (2), 903-907.
Pankaew P, Hoonnivathana E, Limsuwan P, Naemchanthara K. 2010. Temperature effect on calcium phosphate synthesized from chicken eggshells and ammonium phosphate. Journal of Applied Sciences.
10(24):3337-3342. doi:10.3923/jas.2010.3337.3342.
Petit R. 1999. The use of hydroxyapatite in orthopedic surgery: A ten-year review.
European Journal of Orthopedic surgery & amp; Traumatology
Pezzatini S, Solito R, Morbidelli L, Bigi A, Ziche M. 2007. Nanocrystalline hydroxyapatite promotes angiogenesis in vitro by up-regulation of FGF-2.
Eur Cell Mater. 14(3):107.
Pighinelli L, Kucharska. 2013. Chitosan-hydroxyapatite composites. Carbohydr Polym. vol.93, pp.256-262
Poinern G, Brundavanam R, Fawcett D. 2013. Nanometre scale hydroxyapatite ceramics for bone tissue engineering. American Journal of Biomedical Engineering. 3(6):148-168. doi: 10.5923/j.ajbe.20130306.04.
Putra A, Ifada A, Rahmah A, Rahmawati F, Qulub F, Hikmawati D. 2014. Komposit hidroksiapatit-gelatin-alendronate sebagai injectable bone substitute dalam mengatasi defek tulang akibat osteoporosis. Prosiding Seminar Nasional Fisika Terapan IV. Surabaya : Departemen Sisika Universitas Airlangga
Raynaud S, Champion E, Bernache-Assollant D, Thomas P. 2002. Calcium phosphate apatite with variable Ca/P atomic ratio I. synthesis characterisation and thermal stability of powders. Biomaterials. 23(4):
1065–1072.
Rucker M, Laschke MW, Junker D, Carvalho C, Schramm A, Mulhaupt R,
Gellrich NC, Menger MD. β006.Angiogenic and inflammatory response to
biodegradable scaffolds in dorsal skinfold chambers of mice. Biomaterials.
27:5027–5038.
Safrida. 2014. Pengenalan Struktur Morfologi Dan Anatomi Keong Tutut (Bellamya Javanica V.D Bush 1844) Sebagai Penunjang Praktikum Materi
Invertebrata Sma Kurikulum 2013. Banda Aceh: Universitas Syiah Kuala Shi XH, Wang SL, Zhang YM, Wang YC, Yang Z, Zhou X, Lei ZY, Fan DL.
2014. Hydroxyapatite-coated sillicone rubber enhanced cell adhesion and it
may be through the interaction of EF1 and -actin. Plos One. 9(11):
e111503. doi:10.1371/journal.pone.0111503.
Shojai MS, Khorasani MT, Khoshdargi ED, Jamshidi A. 2013.Synthesis methods for nanosized hydroxyapatite in diverse structures- a review.Acta Biomaterialia. doi:10.1016/j.actbio.2013.04.012.
Soído C, Vasconcellos MC, Diniz AG, Pinheiro J. 2009. An improvement of calcium determination technique in the shell of molluscs. Braz arch biol technol. 52(1):