EKSPLORASI SPASIAL KARANG LUNAK KAITANNYA
DENGAN SENYAWA BIOAKTIF BAKTERI SIMBION
ROZIRWAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa disertasi berjudul Eksplorasi Spasial Karang Lunak Kaitannya dengan Senyawa Bioaktif Bakteri Simbion adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Rozirwan
RINGKASAN
ROZIRWAN. Eksplorasi Spasial Karang Lunak Kaitannya dengan Senyawa Bioaktif Bakteri Simbion. Dibimbing oleh DIETRIECH GEOFFREY BENGEN, NEVIATY PUTRI ZAMANI, HEFNI EFFENDI dan CHAIDIR.
Secara ekologi, karang lunak dan karang keras memiliki fungsi yang sama di perairan. Distribusi dan jenis karang lunak sangat dipengaruhi oleh karakteristis lingkungan perairan. Karang lunak telah diketahui mengandung senyawa bioaktif yang dapat dijadikan sebagai marine natural product, tetapi secara alami ketersediaan sumberdaya ini sangat terbatas dan sulit untuk dibudidayakan. Untuk itu, isolat bakteri simbion adalah salah satu alternatif dalam upaya memanfaatkan sumberdaya tersebut secara keberlanjutan.
Penelitian ini memiliki empat tujuan utama yaitu sebagai berikut: (1) untuk membedakan distribusi dan jenis karang lunak diantara perairan terbuka di Pulau Pongok, Bangka Selatan dan perairan tertutup Pulau Tegal di Teluk Lampung; (2) untuk menemukan jenis-jenis karang lunak yang memiliki potensi senyawa bioaktif sebagai antibakteri yang ditemukan di kedua perairan; (3) untuk mengukur tingkat aktivitas antibakteri dan konsentrasi hambat minimum pada senyawa bioaktif pada spesies target Sinularia flexibilis (SFTLS4) dan S. polydactyla (SPTLS2); (4) untuk menemukan jenis-jenis bakteri simbion karang lunak S. flexibilis dan S. polydactyla yang berpotensi menghasilkan senyawa bioaktif.
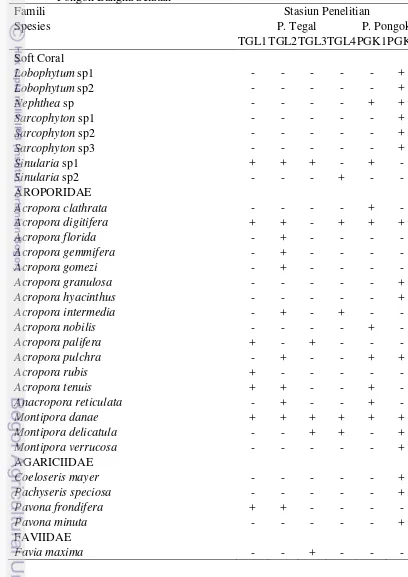
Hasil yang ditemukan ada delapan jenis karang lunak yang diklasifikasikan dalam empat genera (Lobophytum, Nephthea, Sarcophyton dan Sinularia) ditemukan di kedua lokasi penelitian, enam spesies yang diidentifikasi di perairan Bangka Selatan (di kedalaman 9 m) dan dua spesies (di kedalaman 3 m). Di perairan P. Tegal (perairan tertutup), hanya 2 spesies tercatat dari genus Sinularia
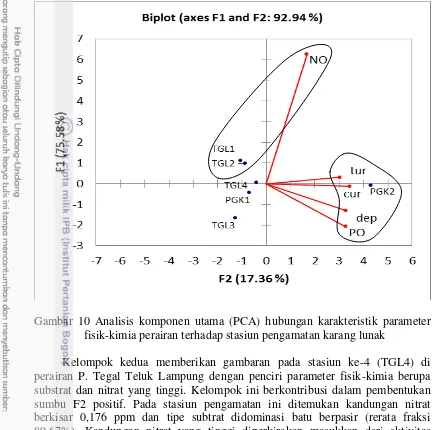
(di kedalaman 2-5m). Ada 2 stasiun di P. Pongok yaitu PGK1 dan PGK2, sementara di Tegal Island, ada 4 stasiun yaitu TGL1, TGL2, TGL3 dan TGL4. Analisis komponen utama menunjukkan bahwa kedua perairan memiliki penciri utama pada faktor fisik-kimianya meliputi; kedalaman, arus, fosfat dan kekeruhan, dengan variabel pembeda adalah fosfat. Hasil analisis similaritas menunjukkan bahawa perairan P. Pongok dan P. Tegal memiliki similaritas sangat kuat di atas 79%.
Hasil dari penanganan sampel menunjukkan bahwa biomassa sampel basah sampai kering cukup bervariasi, selisih penyusutan tertinggi adalah pada sampel genus Nephthea, Lobophytum, Sarcophyton, dan Sinularia. Hasil ekstraksi dari 12 sampel karang lunak diperoleh nilai berat ekstrak terendah pada pelarut semi polar (EtOAc), sedangkan berat ekstrak dalam non polar (n-Hex) dan polar (MeOH) bervariasi. Daya hambat antibakteri dari keseluruhan ekstrak sampel ditunjukkan pada ekstrak karang lunak dalam pelarut EtOAc dan sebagian ekstrak dalam pelarut MeOH. Nilai daya hambat tertinggi ditunjukkan pada karang lunak spesies
perairan dicirikan oleh meliputi; kedalaman, arus, fosfat dan kekeruhan, dengan variable pembeda adalah kedalaman.
Berat ekstrak dari kedua spesies S. flexibilis (SFTLS4) dan S. polydactyla
(SPTLS2) diperoleh relatif sama, kecuali ekstrak dalam pelarut n-Heksan (n-Hex) dari sampel SFTLS4 yang lebih tinggi dibandingkan dengan berat ekstrak dalam pelarut lainnya. Aktivitas antibakteri dari kedua spesies menunjukkan hanya terjadi pada ekstrak dalam pelarut etil asetat (EtOAc) dengan kategori sangat kuat. Hasil pemurnian diperoleh ada delapan fraksi (F1-F8) untuk ekstrak SFTLS4 dan enam fraksi (F1-F6) untuk ekstrak SPTLS2. Spot-spot potensi senyawa bioaktif ditunjukkan pada fraksi F4 dan F5 (untuk SFTLS4) dan fraksi F2 dan F5 (untuk SPTLS2). Nilai KHM dari sampel SFTLS4 menunjukkan bahwa fraksi F4 dan F5 terendah (500 ppm) berkisar 6.12±0.10 dan 6.15±0.18 mm (bakteri E. coli), dan berkisar 6.59±0.55 dan 6.28±0.28 mm (S. dysentri). Nilai KHM dari sampel SPTLS2 menunjukkan hanya fraksi F2 yang mencapai konsentrasi terendah (500 ppm) dengan kisaran 6.20±0.10 mm (untuk bakteri E. coli).
Isolat bakteri simbion dari sampel karang lunak diperoleh dua isolat dari sampel SFTLS4 yaitu: isolat A1 dan A2, dan dua isolat B1 dan B4 dari sampel SPTLS2. Hasil karakterisasi menunjukkan seluruh isolat diklasifikasikan adalah sebagai isolat A1 adalah Pseudomonas diminuta, isolat A2 adalah Edwardsiellla hoshinae, isolat B1 adalah Edwardsiellla hoshinae dan isolat B4 adalah
Pseudomonas acidovorans. Pola pertumbuhan menunjukkan kesamaan pada puncak fase stasioner (<30 jam), dan fase kematian (> 60 jam). Aktivitas antibakteri ditemukan hanya pada bakteri simbion P. diminuta (A1) dari spesies S. flexibilis berkisar 10.16±0.3mm (B. subtilis), 8.66±0.8 mm (E. coli) dan 9.86±1.7mm (S. dysentri), dan tidak ada pada bakteri simbion dari spesies S. polydactyla. Hasil analisis LCMS menunjukkan senyawa bioaktif kelompok diterpen sinularin yang diproduksi karang lunak S. flexibilis (SFTLS4) juga diproduksi oleh isolat bakteri simbionnya P. diminuta (A1).
SUMMARY
ROZIRWAN. Spatial Exploration of Soft Coral Relation with Symbiont Bacterial Bioactive Compounds. Supervised by DIETRIECH GEOFFREY BENGEN, NEVIATY PUTRI ZAMANI, HEFNI EFFENDI and CHAIDIR.
In ecology, soft and hard corals have the same function in the waters. The distribution of soft corals is strongly influenced by the characteristics of the aquatic environment. Soft corals had been knows contain of bioactive compounds that can be used as a marine natural product, but naturally theses resource are limited and very difficult to cultivated. Therefore, the isolation of bacterial symbiont on soft coral is one of alternatives in an effort to utilize these resources in sustainability.
This study had four main objectives that include the following: (1) to determine the differences of the soft corals between sheltered and exposed area in Pongok Island, Soulth of Bangka and Tegal Island in Lampung Bay, Indonesia; (2) to find of the soft corals inhibition potential for antibacterial activity; (3) to measure the antibacterial activity level and minimum inhibitory concentration of bioactive compounds in the soft coral S. flexibilis and S. polydactyla species; (4) to find the isolation of bacterial symbionts from soft coral S. flexibilis and S. polydactyla species that the potential to producted bioactive compound.
The results found eigtht types of soft corals classified in four genera (Lobophytum, Nephthea, Sarcophyton and Sinularia) were found in both sites, six species were identified in the waters of South Bangka (at 9 meters depth) and two species (at 3 meters depth). In Tegal Island waters (closed waters), only 2 species from the genus Sinularia were recorded (at 2-5m depth). There were 2 stations at Pongok Island namely, PGK1 and PGK2, while in Tegal Island, there were 4 stations namely TGL1, TGL2, TGL3 dan TGL4. Principal component analyses showed that both waters can be classified based on their physical-chemical characteristic, which were depth, currents, phosphate and turbidity waters. Discriminant function were showed in phosphate variable. While the similarity analysis showed that both waters had very strong similarity of about 79%.
In sampling treatment, the biomass among wet and dry samples varied. The highest shrinkage due to drying was found in Nephthea, followed by Lobophytum and Sarcophyton, while the lowest was found in the genus of Sinularia. Extracted from 12 samples of soft coral, the lowest extract weight was found in the semi-polar solvent (EtOAc), while the extract weight of n-Hex and MeOH was vary. Inhibition power from all extract samples were found on soft coral extract in the EtOAc and MeOH solvents. The highest value of inhibition power was found in soft coral of Sinularia polydactyla and S. flexibilis within strong catogery. Principal component analysis showed there were corelations between the the environment characteristics with the bioactive compounds inhibition of soft corals, that the identifier parameters include; depth, currents, phosphate and turbidity waters. Discriminant function were showed in depth variable.
Extracts weight of both species S. flexibilis (SFTLS4) and S. polydactyla
Antibacterial activites of both spesies showed only on extract in ethyl acetate (EtOAc), within strong category. For purification were obtained eigth fractions (F1-F8) for SFTLS4 extractions and six fractions (F1-F6) for SPTLS2 extractions. The potential spots of bioactive compounds were showed in F4 and F5 fractions (for SFTLS4) and F2 and F5 fractions (for SPTLS2). MIC values in SFTLS4 showed the lowest F4 and F5 fractions (500 ppm) were about 6.12±0.10 and 6.15±0.18 mm (E. coli), and about 6.59±0.55 and 6.28±0.28 mm (S. dysentri). MIC values of SPTLS2 showed the lowest F2 fraction only (500 ppm), within was about 6.20±0.10 mm (for E. coli).
The isolation of bacterial symbionts from sampels of soft coral were obtained two isolates from SFTLS4 samples i.e: A1 and A2 isolates, and two isolates from SPTLS2 samples i.e: B1 and B4 isolates. The characterization results showed whole of isolates classified as A1 isolate was Pseudomonas diminuta, A2 isolate was Edwardsiellla hoshinae, B1 isolate was Edwardsiellla hoshinae and B4 isolate was Pseudomonas acidovorans. The growth pattern showed similarity at the height of the stationary phase (<30 h) and death phase (> 60 h). Antibacterial activity were found only bacterial symbionts of P. diminuta
(A1) from S. flexiblis species about 10.16 ± 0.3mm (for B. subtilis), 8.66 ± 0.8 mm (E. coli) and 9.86 ± 1.7mm (S. dysentri), and none of it from S. polydactyla
species. The results of LC MS analysis showed the group of bioactive compound diterpenes sinularin that were produced soft corals S. flexibilis (SFTLS4), and bacterial symbionts isolates of P. diminuta (A1) also.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
EKSPLORASI SPASIAL KARANG LUNAK KAITANNYA
DENGAN BIOAKTIF BAKTERI SIMBION
ROZIRWAN
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Kelautan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Ujian Tertutup:
Penguji Luar Komisi: 1. Prof Dr Ir Dedi Soedharma, DEA 2. Dr Munti Yuhana, SPi, MSc
Sidang Promosi Terbuka:
PRAKARTA
Segala puji dan syukur dipersembahkan kepada Allah SWT dan sholawat serta salam untuk Nabi Muhammad SAW, keluarga dan sahabatnya. Ungkapan rasa syukur ini penulis sampaikan atas segala karunia-Nya sehingga disertasi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian adalah ekologi kimia pada karang lunak, dengan judul Eksplorasi Spasial Karang Lunak Kaitannya dengan Senyawa Bioaktif Bakteri Simbion.
Terima kasih penulis ucapkan kepada Bapak Prof Dr Ir Dietriech Geoffrey Bengen, DEA, Ibu Dr Ir Neviaty Putri Zamani, MSc, bapak Dr Ir Hefni Effendi, MPhil dan bapak Dr rer nat Chaidir, Apt selaku pembimbing yang telah banyak membantu dan memberi masukan dari awal penentuan judul, pembuatan proposal, proses penelitian, penulisan hingga tersusunnya ditertasi ini.
Terima kasih penulis ucapkan kepada Bapak Prof Dr Ir Dedi Soedharma, DEA dan Ibu Dr Munti Yuhana, SPi, MSc selaku penguji luar komisi pada ujian tertutup yang dilaksakan pada tanggal 7 Juli 2015 yang lalu. Terima kasih juga saya sampaikan kepada Ibu Dr Munti Yuhana, SPi, MSc dan Bapak Dr Ir Zainal Arifin, MSc selaku anggota luar komisi sidang promosi terbuka pada tanggal 10 Agustus 2015.
Disamping itu, penghargaan dan ucapan terima kasih juga penulis sampaikan kepada Kepala Laboratorium Biologi Laut FMIPA, UNSRI, Kepala Laboratorium Mikrobiologi, FMIPA, UNSRI dan Kepala Labtiap BPPT Serpong yang telah membantu pada proses penelitian sehingga disertasi ini dapat disusun dan diselesaikan. Terima kasih kepada seluruh jajaran IPB, Rektor, Dekan Pascasarjana, Dekan FPIK dan seluruh dosen IPB yang telah memberi kesempatan kepada penulis untuk menimbah ilmu di instansi ini.
Terima kasih kepada Rektor Universitas Sriwijaya, Dekan FMIPA, Ketua Program Studi Ilmu Kelautan dan seluruh rekan-rekan dosen berserta staf UNSRI, atas bantuan dan dukunganya selama ini. Penghargaan dan terima kasih juga penulis sampaikan kepada rekan-rekan seperjuangan di IPB. baik yang sudah selesai maupun yang masih dalam proses, semoga ilmu yang kita dapatkan bermafaat bagi masyarakat luas dan menjadi ladang ibadah untuk kita semua kedepan.
Ungkapan terima kasih dan penghargaan secara khusus, penulis sampaikan kepada istriku tercinta Lisvi Gunaini, SST dan anak-anakku Afandi Maulana Rozi dan Alfatahillah Muhammad Rozi, serta ayahandaku Bapak H. Damli, ibundaku Ibu Hj. Ridawati dan serta ayah dan ibu mertuaku Bapak Drs Darwan Siawas dan Ibu Nihariyah serta seluruh keluarga, atas doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR ISI
PERAIRAN TERTUTUP PULAU TEGAL TELUK LAMPUNG 26
Pendahuluan 26
Bahan dan Metode 27
Hasil 31
Pembahasan 40
Simpulan 41
4 SKRINING POTENSI SENYAWA BIOAKTIF KARANG LUNAK DARI PERAIRAN PULAU PONGOK BANGKA SELATAN DAN
5 AKTIVITAS ANTIBAKTERI PADA ISOLAT SENYAWA BIOAKTIF KARANG LUNAK Sinularia polydactyla DAN S. flexibilis 56
Pendahuluan 56
Sinularia flexibilis dan S. polydactyla 70
DAFTAR TABEL
1 Senyawa aktif genus Sinularia 18
2 Alat dan bahan yang digunakan untuk pengukuran parameter perairan 29 3 Peralatan digunakan untuk pengamatan dan pengambilan sampel karang
lunak 29
4 Jenis-jenis Karang di perairan Pulau Tegal Lampung Selatan dan Pulau
Pongok Bangka Selatan 33
5 Wilks lambda 38
6 Matriks struktur 38
7 Fungsi pada grup centroid 39
8 Koefisien fungsi klasifikasi 39
9 Biomassa karang lunak yang ditemukan di lokasi penelitian 46
10 Berat ekstrak karang lunak 47
11 Skrining aktivitas antibakteri ekstrak karang lunak 47 12 Kategori potensi senyawa bioaktif karang lunak 48
13 Wilks lambda 50
14 Matriks struktur 50
15 Fungsi pada grup centroid 51
16 Koefisien fungsi klasifikasi 51
17 Berat ekstrak yang diperoleh 62
18 Kategori daya hambat ekstrak kasar S. polydactyla dan S. flexibilis 62 19 Aktivitas antibakteri ekstrak karang lunak dalam pelarut etil asetat 62 20 Kategori daya hambat antibakteri pada fraksi-fraksi SFTLS4 dan
SPTLS2 65
21 Aktivitas antibakteri pada konsentrasi hambat minimum (KHM) 67 22 Komposisi media pertumbuhan zobell modifikasi dari (Atlas 2005) 71
23 Timetable gradient perlarut analisis LCMS 76
24 Hasil pengamatan morfologi isolat bakteri (A1-A4) dari karang S.
flexibilis 77
25 Hasil pengamatan morfologi isolat bakteri (B1-B4) dari karang S.
polydactyla 79
26 Hasil uji biokimia isolat bakteri simbion pada sampel karang SFTLS4 80 27 Hasil uji biokimia isolat bakteri simbion pada sampel karang SPTLS2 81 28 Daya hamabat ekstrak isolat bakteri simbion pada karang lunak S.
flexibilis dan S. polydactyla 84
29 Data total ion current (TIC) dari nilai m/z ekstrak karang lunak S.
flexibilis dan isolat bakteri simbion 84
DAFTAR GAMBAR
1 Kerangka pikir penelitian 5
2 Perbedaan struktur tubuh karang lunak dan keras (Ryan 1985) 7
3 Anatomi Karang Lunak (Foster dan Smith 2011) 8
4 Korelasi keragaman dengan kedalaman dan jenis karang dan kedalaman
5 Korelasi antara kedalaman dan laju rata-rata pertumbuhan Porites
lobata (Grigg 2006) 13
6 Hubungan spesies karang terhadap salinitas perairan di Samudera India
Sheppard dalam McClanahan et al. (2000) 15
7 Senyawa aktif diterpen Sinularin dari karang lunak genus Sinularia 17 8 Persentase isolat bioaktif yang diperoleh dari karang keras dan lunak,
air laut dan sedimen (Shnit-Orland dan Kushmaro 2008) 25
9 Peta lokasi penelitian 28
10 Analisis komponen utama karakteristik habitat karang lunak pada sumbu 1 dan sumbu 2; A) lingkaran korelasi variabel fisik-kimia; B)
sebaran spasial stasiun pengamatan 32
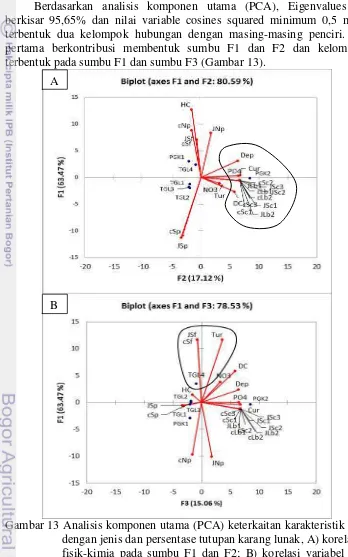
11 Jenis karang lunak yang ditemukan di lokasi penelitian 36 12 Persentasi tutupan karang dan jumlah spesies karang lunak 36 13 Analisis komponen utama (PCA) hubungan karakteristik lingkungan
dengan jenis dan persentase tutupan karang lunak, A) korelasi variabel fisik-kimia pada sumbu F1 dan F2; B) korelasi variabel fisik-kimia
pada sumbu F1 dan F3 37
14 Dendogram similaritas antar stasiun berdasarkan jenis dan persentase
tutupan karang lunak 40
15 Lokasi pengambilan sampel karang lunak 44
16 Bagan alir kegiatan skrining potensi senyawa bioaktif karang lunak 45 17 Aktivitas antibakteri dari ekstrak karang lunak dalam pelarut EtOAc;
(A) ekstrak SpTGL3 terhadap bakteri S. areus; (B) ekstrak SpTGL3 terhadap bakteri E. coli; (C) ekstrak SfTGL4 terhadap bakteri S. areus;
(D) ekstrak SfTGL4 terhadap bakteri E. coli 49
18 Analisis Komponen Utama (PCA) keterkaitan karakteristik perairan dan distribusi karang lunak dengan daya hambat senyawa bioaktifnya 50 19 Spesies S. polydactyla, A) kondisi hidup di air; B) kondisi sesudah
dipotong 52
20 Spesies S. flexibilis, A) kondisi hidup di air; dan B) kondisi sudah
dipotong 52
21 Bagan alir penelitian aktivitas antibakteri 58
22 Skema proses ekstraksi senyawa bioaktif 60
23 Skema proses bioassay aktivitas antibakteri 61
24 Zona bening pada ekstrak kasar karang lunak S. flexibilis dan S. polydactyla. A) Ekstrak dalam n-Hex; B) Ekstrak dalam EtOAc; C)
Ekstrak dalam MeOH 63
25 Pemurnian isolat senyawa bioaktif karang lunak S. polydactyla, A) Hasil pengkoloman; B) Hasil fraksi-fraksi pada KLT 64 26 Pemurnian isolat senyawa bioaktif karang lunak S. flexibilis, A) Hasil
pengkoloman; B) Hasil fraksi-fraksi pada KLT 65
27 Daya hambat antibakteri pada fraksi-fraksi senyawa bioaktif ekstrak
SPTLS2 66
28 Daya hambat antibakteri pada fraksi-fraksi senyawa bioaktif ekstrak
SFTLS4 67
29 Pewarnaan gram dan bentuk koloni bakteri simbion yang diperoleh
30 Pewarnaan gram dan bentuk koloni bakteri simion yang diperoleh pada
sampel SPTLS2 80
31 Kurva tumbuh isolat bakteri simbion 82
32 Kurva kecepatan tumbuh isolat bakteri simbion 82
33 Kurva waktu generasi sel isolat bakteri simbion 83 34 Aktivitas antibakteri isolat bakteri simbion dari S. flexibilis dan S.
polydactyla 83
35 Spektrum TIC senyawa yang sama, A) spesies S. flexibilis (SFTLS4);
dan B) Isolat simbion A1 85
36 Spektrum senyawa aktif, A) spesies S. flexibilis (SFTLS4); dan B)
isolat bakteri simbion A1 86
DAFTAR LAMPIRAN
1 Parameter fisik-kimia perairan di lokasi penelitian 103 2 Analisis komponen utama (PCA) karakteristik habitat perairan 104
3 Persentase tutupan karang 105
4 Analisis komponen utama (PCA) korelasi parameter fisik-kimia perairan dengan jenis dan distribusi karang lunak 106 5 Perhitungan dissimilaritas (Bray-Curties Index) antar titik stasiun 108 6 Hasil skrining biomassa ekstrak sampel karang lunak 110 7 Hasil skrining aktivitas antibakteri pada ekstrak karang lunak 111 8 Analisa beda nyata dengan ANOVA pada data skrining aktivitas
antibakteri (ρ<0,05) 112
9 Analisis komponen utama (PCA) keterkaitan karakteristik perairan, jenis dan distribusi karang lunak dengan daya hambat senyawa
bioaktifnya 115
10 Proses penangan dan ekstraksi sampel karang lunak 117 11 Aktivitas antibakteri ekstrak kasar senyawa bioaktif karang lunak S.
polydactyla dan S. flexibilis 118
12 Zona hambat antibakteri dari ekstrak kasar karang lunak S. flexibilis dan
S. polydactyla 119
13 Hasil kromatografi lapis tipis (KLT) belum pengkoloman dengan
penentuan eluen yang berbeda 120
14 Proses pemurnian dengan kromatografi kolom (KK) 121 15 Hasil pemurnian dengan kromatografi lapis tipis (KLT) setelah
pengkoloman 122
16 Aktivitas antibakteri pada fraksi-fraksi senyawa bioaktif karang lunak
S. flexibilis dan S. polydactyla 123
17 Aktivitas antibakteri pada konsentrasi hambat minimum (KHM) ekstrak
S. flexibilis dan S. polydactyla 124
18 Proses pemurnian bakteri simbion karang lunak 125
19 Komposisi media dan reagen yang digunakan 128
20 Karakteristik isolat bakteri simbion pada sampel karang SFTLS4 132 21 Karakteristik isolat bakteri simbion pada sampel karang SPTLS2 133
23 Data kecepatan pertumbuhan sel isolat bakteri simbion pada fase log 135 24 Data waktu generasi sel isolat bakteri simbion pada fase log 136 25 Proses kultur dan ekstraksi isolat bakteri simbion 137 26 Aktivitas antibakteri ekstrak bakteri simbion 138 27 Hasil LC-MS sampel karang lunka S. flexibilis (SFTLS4) 139 28 Hasil LC-MS sampel bakteri simbion isolat A1 dari S. flexibilis
(SFTLS4) 149
29 Hasil LC-MS sampel bakteri simbion isolat A2 dari S. flexibilis
1 PENDAHULUAN
Latar Belakang
Terumbu karang merupakan ekosistem khas yang terdapat di perairan dangkal tropis dengan produktivitas primer dan keanekaragaman yang tinggi. Ekosistem ini memiliki peran ekologi penting di suatu perairan yaitu sebagai habitat mencari makan (feeding ground), bertelur(spawning ground) dan tumbuh kebang (nursery ground) bagi berbagai biota laut (Nybakken 1982). Secara umum, ekosistem karang dapat dibagi menjadi dua kelompok utama yaitu karang keras (hard coral) dan karang lunak (soft coral). Karang lunak merupakan kelompok kedua terbesar setelah karang keras dan tidak berkontribusi dalam pembentukan terumbu, namun mempunyai peran ekologis yang sama (Manuputty 1996). Peran ini dapat berjalan dengan baik apabila faktor lingkungan dalam mendukung pertumbuhan karang tidak terganggu. Pertumbuhan karang sangat dipengaruhi oleh faktor fisik-kimia suatu perairan seperti nutrien, salinitas, cahaya, suhu, bahan-bahan pencemar dan lain sebagainya (Suharsono 2010).
Indonesia terletak di pusat keanekaragaman karang dunia (Veron 2000), yang sering disebut juga dengan Segitiga Karang (Coral Triangle). Luas penutupan karang di Indonesia diperkirakan sebesar 51.000 Km2 atau sekitar 12-15% dari total luasan karang dunia dengan 60% spesies terumbu karang dunia berada di negara ini. Tomascik et al. (1997), menyatakan bahwa Indonesia memiliki luas ekosistem terumbu karang diperkirakan sekitar 85.707 Km2 yang terdiri dari 50.223 Km2 terumbu penghalang, 19.540 Km2 terumbu cincin (atol), 14.542 Km2 terumbu tepi dan 1.402 Km2 oceanic platform reef. Luas terumbu karang ini mewakili 18% dari total luas terumbu karang yang ada di dunia (Dahuri 2003).
Namun keberadaan ekosistem terumbu karang ini mulai terancam oleh berbagai faktor, terutama faktor yang disebabkan oleh aktivitas manusia seperti pencemaran, overfishing, destructive fishing, aktivitas transportasi, pembangunan lepas pantai (sedimentasi), turis (peyelaman) dan lain-lain. Kondisi terumbu karang di Indonesia diperkirakan dari data 414 stasiun monitoring karang, 2000 penemuan menunjukkan bahwa hanya 6 % terumbu karang Indonesia dalam keadaan sangat baik, sedangkan 24 % dalam kondisi baik dan kira-kira 70 % dalam kondisi buruk atau sedang (COREMAP 2007).
jenis di dunia). Di perairan Kepulauan Seribu, DKI Jakarta luas kawasan konservasi laut mencapai 107.489 Ha, terdapat 54 jenis karang keras/lunak.
Potensi ekosistem terumbu karang yang bernilai ekonomis tinggi ini masih banyak yang belum tergali. Namun pemanfaatan potensi tersebut hendaklah tidak merusak habitatnya. Salah satu potensi yang dapat memberikan nilai tambah ekonomi pada ekosistem karang adalah potensi kandungan senyawa bioaktif karang. Kelompok karang yang memproduksi senyawa bioaktif adalah karang lunak yang dapat dijadikan sebagai antibakteria, antifungi, antifouling, antikanker, antivirus dan sebagainya (Tursch et al. 1975; Aceret et al. 1998; Kamel dan Slattery 2005; Kelman et al. 2006; Tadesse et al. 2008; Hardiningtyas 2009; Cheng et al. 2010; Mayer et al. 2011; Shih et al. 2012; Rajaram et al. 2013; Chen
et al. 2014b; Thao et al. 2014; Dobretsov et al. 2015).
Pemanfaatan karang lunak sebagai sumber bahan bioaktif perlu mempertimbangkan karakteristik biofisik perairannya karena kandungan senyawa bioaktif yang diproduksi sangat dipengaruhi oleh kondisi biofisik lingkungannya. Apabila parameter-parameter biofisik-kimia perairan menyebabkan karang lunak mengalami stress atau tertekan berdampak pada peningkatan produksi senyawa bioaktif. Seperti kajian yang dilakukan oleh Triyulianti (2009), pada kedalaman tiga meter aktivitas antibakteri dari ekstrak karang lunak lebih tinggi dibandingkan kedalaman 10 meter. Artinya, bahwa aktivitas antibakteri dari ekstrak karang lunak semakin menurun dengan bertambahnya kedalaman. Hardiningtyas (2009) menyatakan bahwa aktivitas antibakteri pada senyawa bioaktif karang lunak Sarcophyton sp secara alami (tidak difragmentasi) lebih tinggi dibandingkan karang lunak hasil fragmentasi, dimana 2-5,7 mm alami, sedangkan difragmentasi hanya ≤1,5 mm.
Hasil penelitian Suparno (2012) menunjukkan sebaliknya, aktivitas bioaktif spons laut Petrosia nigricans meningkat dengan bertambah kedalaman, sedangkan faktor yang paling berperan pada peningkatan aktivitas bioaktifnya adalah total organic matter (TOM), tetapi secara temporal aktivitas senyawa bioaktif spons laut yang diambil di alam relatif tidak memiliki variasi.
Berbagai senyawa bioaktif karang lunak sebagai antibiotika telah banyak diketahui. Tursch et al. (1975), menyatakan bahwa karang lunak dapat menghasilkan senyawa terpen dari jenis karang lunak Sinularia flexibilis. Aceret
et al. (1998) jenis karang lunak Sinularia flexibilis ditemukan menghasilkan senyawa diterpen jenis Sinulariolide dan Flexibilide yang memiliki aktivitas terhadap pertumbuhan bakteri Bacillus sp. dan Staphylococcus aureus dengan zona hambat mencapai 13 mm dan 25 mm. Nilai konsentrasi hambat minimum (KHM) yang didapat bervariasi, 10 ppm dan 5 ppm pada bakteri uji S. aureus. Kelman et al. (1998), ekstrak karang lunak jenis Parerythropodium fulvum fulvum
mengatasi masalah tersebut dilakukan berbagai upaya termasuk mengkaji mikroba yang bersimbiosis dengan karang lunak.
Berbagai penelitian bakteri simbion karang lunak telah banyak dilaporkan dapat menghasilkan senyawa bioaktif yang mirip dengan inangnya. Senyawa bioaktif yang dihasilkan bakteri simbion tersebut dapat dijadikan sebagai antibakteri seperti penelitian yang dilakukan oleh Chelossi et al. (2004), ditemukan enam spesies bakteri epibiotik dari Porifera Petrosia ficiformis yang mempunyai aktivitas antibakteri, zona hambat yang dihasilkan bervariasi berdasarkan jenis bakteri uji (indikator). Disisi lain Dobretsov dan Qian (2004) menyatakan bahwa bakteri epifit dari karang lunak Dendronephthya sp umumnya berperan sebagai antifouling yang mengandung biofilm alamia laut. Ritchie (2006) menyatakan bahwa hubungan simbiosis antara bakteria dan karang lunak umumnya terjadi pada permukaan karang. Pada karang keras (hard coral) sangat sedikit atau tidak ditemukan bakteri simbiosis yang dapat menghasilkan bahan aktif sebagai antibakteri, hal ini mungkin dipengaruhi oleh jumlah zat kapur yang berlebihan (Kelman et al. 2006). Pada jenis Sinularia sp ditemukan dua isolat bakteri yang berpotensi sebagai antibakteri Tuberculosis (Sulistiyani et al. 2010).
Potensi senyawa bioaktif yang dihasilkan karang lunak telah menarik perhatian para peneliti terutama dibidang industri farmasi, namun keterbatasan sumberdaya ini di alam menjadi kendala dalam upaya pemanfaatan ekosistem tersebut. Oleh karena itu pencarian alternatif senyawa bioaktif yang dihasikan mikroba simbion yang dapat mencegah degradasi sumberdaya karang lunak perlu dilakukan saat ini (Murti dan Radjasa 2012).
Perumusan Masalah
Potensi senyawa bioakif pada ekosistem terumbu karang banyak ditemukan pada kelompok karang lunak. Namun dalam memanfaatkan potensi tersebut perlu memperhatikan habitatnya. Habitat karang lunak sangat dipengaruhi oleh karakteristik biofisik perairan pada lingkungannya. Diantara karakteristik tersebut terdapat parameter-parameter utama yang berperan terhadap pertumbuhan dan sebaran karang, umumnya seperti kandungan nutrien, kedalaman, kecerahan, jenis substrat, salinitas, pH dan sebagainya. Parameter-parameter ini juga berperan terhadap sebaran dan konsentrasi senyawa bioaktif yang terkandung pada karang lunak. Berdasarkan kajian Triyulianti (2009), aktivitas bioaktif karang lunak semakin kecil dengan bertambahnya kedalaman. Suparno (2012) menyatakan sebaliknya, kandungan bioaktif semakin tinggi dengan bertambahnya kedalaman, dan parameter yang paling berperan dalam peningkatan bioaktif adalah total organic matter (TOM). Informasi ini penting untuk dieksplorasi lebih dalam karena berkaitan dengan upaya pemanfaatan karang lunak yang berbasis konservasi.
menghasilkan senyawa bioaktif yang mirip dengan inangnya. Apabila ini terbukti maka produksi senyawa bioaktif akan lebih mudah dan tidak merusak habitat karang lunak karena bakteri mudah dikembangbiakkan atau dikultur di laboratorium sehingga dapat menghasilkan senyawa bioaktif dalam jumlah yang banyak. Untuk itu perlu dilakukan kajian senyawa bioaktif bakteri simbion karang lunak.
Tujuan Penelitian
Penelitian ini bertujuan adalah sebagai berikut: (1) untuk membedakan distribusi dan jenis karang lunak diantara perairan terbuka di Pulau Pongok, Bangka Selatan dan perairan tertutup Pulau Tegal di Teluk Lampung; (2) untuk menemukan jenis-jenis karang lunak yang memiliki potensi senyawa bioaktif sebagai antibakteri yang ditemukan di kedua perairan; (3) untuk mengukur tingkat aktivitas antibakteri dan konsentrasi hambat minimum pada senyawa bioaktif pada spesies target Sinularia flexibilis (SFTLS4) dan S. polydactyla (SPTLS2); (4) untuk menemukan jenis-jenis bakteri simbion karang lunak S. flexibilis dan S. polydactyla yang berpotensi menghasilkan senyawa bioaktif.
Manfaat Penelitian
Penelitian ini diharapkan bermanfaat bagi pihak-pihak yang berkeinginan mengeksplorasi dan memanfaatkan sumberdaya karang lunak dengan mengutama pengelolaan yang berbasis konservasi. Informasi kandungan bioaktif karang lunak merupakan peningkatan bagi kualitas hidup dan nilai tambah habitat tersebut. Informasi mengenai potensi senyawa bioaktif bakteri simbion diharapkan menjadi alternatif untuk antisipasi kerusakan habitat karang lunak di perairan, sehingga kelangsungan hidupnya tetap lestari.
Kebaruan Penelitian
Kebaruan penelitian ini adalah menemukan isolat bakteri simbion
Pseudomonas diminuta pada karang lunak Sinularia flexibilis yang menghasilkan senyawa bioaktif diterpen Sinularin. Hal ini dapat dimanfaatkan dalam upaya meningkatkan nilai tambah ekosistem tersebut.
2 TINJAUAN PUSTAKA
Ekosistem Terumbu Karang
Ekosistem terumbu karang sangat berperan secara ekologi di perairan bagi berbagai biota laut seperti tempat mencari makan, tempat perlindungan, memijah dan asuhan. Ekosistem ini didominasi dua kelompok hewan bentik invetebrata yaitu karang keras (hard coral) dan karang lunak (soft coral). Karang keras sangat berperan dalam terbentuknya terumbu. Terumbu karang atau coral reef adalah ekosistem di dasar laut tropis yang dibangun terutama oleh biota laut penghasil kapur (CaCO3) yang dikenal juga sebagai karang hermatipik. Ekosistem ini terdapat di laut dangkal yang hangat dan bersih dan merupakan ekosistem yang sangat penting dan memiliki keanekaragaman hayati yang sangat tinggi (Nybakken 1982).
Karang pembentuk terumbu (hermatipik) hidup berkoloni, dan tiap individu karang yang disebut polip menempati mangkuk kecil yang dinamakan koralit. Tiap mangkuk koralit mempunyai beberapa septa yang tajam dan berbentuk daun yang tumbuh keluar dari dasar koralit, dimana septa ini merupakan dasar penentuan spesies karang. Tiap polip adalah hewan berkulit ganda, dimana kulit luar yang dinamakan epidermis dipisahkan oleh lapisan jaringan mati (mesoglea) dari kulit dalamnya yang disebut gastrodermis. Dalam gastrodermis terdapat tumbuhan renik bersel tunggal yang dinamakan zooxantellae yang hidup bersimbiosis dengan polip. Zooxantellae dapat menghasilkan bahan organik melalui proses fotosintesis, yang kemudian disekresikan sebagian ke dalam usus polip sebagai pangan (Suharsono 2010).
Karang berkembangbiak dengan cara seksual atau aseksual. Pembiakan secara seksual terjadi melalui penyatuan gamet jantan dan betina untuk membentuk larva bersilia yang disebut planula. Planula menyebar dan menempel pada substrat yang keras dan tumbuh menjadi polip. Kemudian polip tersebut melakukan pembiakan aseksual. Pembiakan aseksual dilakukan dengan cara fragmentasi, sehingga terbentuk polip-polip baru yang saling menempel sampai terbentuk koloni yang besar, dengan bentuk yang beragam sesuai jenisnya (Manuputty 2002).
Perbedaan Karang Lunak dan Karang Keras
Perbedaan yang sangat mendasar antara karang keras (Zoantharia) dan karang lunak (Alcyonaria) yakni pada rangka tubuhnya. Karang keras memiliki rangka tubuh yang lebih keras dibanding dengan karang lunak. Tidak seperti karang keras, tubuh Alcyonaria lunak tetapi dibentuk oleh sejumlah besar jaringan yang kokoh, berukuran kecil dan tersusun sedemikian rupa sehingga tubuh Alcyonaria lentur dan tidak mudah putus. Jaringan penyokong pada karang lunak mengandung karbonat kalsium dan disebut spikula (Manuputty 2002). Perbedaan struktur karang lunak dan karang keras dapat dilihat pada Gambar 2.
Gambar 2 Perbedaan struktur tubuh karang lunak dan keras (Ryan 1985)
Karang lunak dapat ditemukan diberbagai habitat karang. Pertumbuhan optimal karang lunak di kedalaman antara 10-30 meter. Jenis-jenis karang lunak hidup di daerah pasang surut sampai kedalaman 200 m. Umumnya syarat-syarat hidup karang lunak sama dengan karang keras. Hewan ini menyukai perairan yang hangat atau sedang terutama di Indo-Pasifik. Ada beberapa jenis yang dapat hidup sampai di kedalaman 3000 m (Manuputty 2002). Pada karang keras dapat hidup optimal sampai pada kedalaman 40 m dengan suhu berkisar antara 25-30 oC dan salinitas sekitar 27-40 PSU. Substrat yang keras dan bersih diperlukan untuk penempelan dan pertumbuhan karang. Jika substrat banyak mengandung partikel terlarut seperti lumpur dapat mengganggu pertumbuhan polip karang (Notji 2007).
Karang Lunak (Soft Coral)
Karang lunak dikenal sebagai hewan tingkat rendah hidupnya menetap, tidak berpindah tempat dan melekat erat di dasar perairan yang keras. Filum Coelentrata (Cnidaria atau hewan yang memiliki sengat) dikelompokan dalam 4 kelas yaitu; Hyrdozoa (hydroids), Scyphozoa (jellyfish), Cubozoa (box jellyfish) dan Anthozoa (corals and sea anemones) (Fabricus dan Alderslade 2001). Karang lunak termasuk pada kelas Anthozoa yang terdiri dari 4 ordo yaitu Gorgonacea (sea fans, sea whips), Pennatulacea (sea pens, sea pansies), Heliporacea (blue coral), Alcyonacea (soft coral). Karang lunak yang sebenarnya adalah dalam ordo Alcynacea yang dibagi 4 famili meliputi: Nephtheidae (the genera Capnella, Dendronephthya, Nephthea, Scleronephthya, Cladiella, Lemnalia), Alcyoniidae (Lobophytum, Alcyonium, Cladiella, Sarcophyton, Sinularia), Xeniidae (Xenia, Stereosoma, Anthelia, Efflatournaria) dan Nidaliidae (Chironephthya, Siphonogorgia) (Rose 2009).
Secara morfologi karang lunak tersusun dari polip-polip. Polip adalah hewan invertebrata laut kecil (lemah). Beberapa polip karang adalah sebagaian
kecil sebagai kepala dan bagian lain sebagai kaki dengan diameter yang lebar, namun mayoritas dari polip ini adalah kecil. Tubuh polip memiliki simetri radial, yang berarti bahwa jika garis yang ditarik dengan cara apapun pada bagian tengah tubuh akan menghasilkan dua bagian identik. Struktur tubuh yang dimiliki adalah sederhana berbentuk seperti tabung. Pada bagian atas dari tabung adalah mulut yang digunakan untuk makanan dan repirasi. Tentakel mengelilingi mulut untuk mengumpulkan makanan, dan biasanya ditemukan berjumlah delapan sehingga disebut juga Octocorallia. Jaringan tubuh dari polip sangat sederhana, dengan hanya dua lapisan sel; epidermis luar yang memiliki kontak langsung dengan air, dan gastrodermis dalam. Ruang antara dua lapisan sel diisi dengan substansi
seperti jelly yang disebut "mesoglea” (Manuputty 1996; Foster dan Smith 2011). Untuk lebih jelasnya anatomi karang lunak disajikan pada Gambar 3.
Gambar 3 Anatomi Karang Lunak (Foster dan Smith 2011)
Menurut Tomascik et al. (1997) menyatakan bahwa Alcyonacea kurang atau tidak berperan dalam pembentukan terumbu karang, namun ada beberapa spesies dari ordo Heliporacea (karang biru) jenis Helipora coerulina ditemukan mampu membangunan beberapa paparan terumbu karang yang ditemukan di Pulau Lucipara Laut Banda. Begitu juga koloni terbesar karang biru ditemukan di laguna Shiraho Pulau Ishigaki Jepang (Veron dan Pichon 1976).
Karang lunak secara struktur mirip dengan karang keras, tetapi karang lunak mempunyai tubuh lebih lentur karena tidak mempunyai kerangka kapur luar yang keras atau eksoskeleton. Karang lunak ditunjang oleh tangkai berupa jaringan berdaging diperkuat suatu matrik dari partikel-partikel kapur mikrokopis yang disebut sklerit. Kerangka kapur tersebut dikenal dengan endoskeleton yang segera membusuk apabila karang mati (Foster dan Smith 2011).
Karang lunak juga dapat dikenali melalui tentakel karena tentakel karang
lunak berjumlah delapan, oleh karena itu disebut dengan istilah “Octocoral” (Coll
Jenis-jenis karang lunak hidup di daerah pasang surut sampai kedalaman 200 m. Umumnya syarat-syarat hidupnya sama dengan karang keras. Hewan ini menyukai perairan yang hangat atau sedang terutama di Indo-Pasifik. Ada beberapa jenis yang dapat hidup sampai ke kedalaman 3.000 m (Manuputty 2002). Adapun jenis-jenis karang lunak yang dijumpai di perairan indo-pasifik adalah sebagai berikut:
Genus Lobophytum
Lobophytum memiliki koloni dengan tangkai lebar pendek atau encrusting. Polyparium dengan lobus atau puncak yaitu berbentuk jari (digitata) atau juga mempunyai pematang-pematang, letaknya tegak lurus permukaan kapitulum. kadang-kadang datar. Polip dimorfik. Sklerit dari lapisan permukaan klub; sklerit dari interior kapstan dan spindle. Warna koloni cahaya kuning, krem, coklat, kehijauan. Polip sering putih (Fabricus dan Alderslade 2001). Genus ini ditemukan dari rataan terumbu sampai ke kedalaman 7 m (Manuputty 2002).
Genus Lobophytum (Verseveldt 1983)
Genus Nephthea
Genus karang lunak memiliki morfologi cabang berbeda. Polip yang ditemukan di tangkai-tangkai kecil pada cabang bagian atas, tapi umumnya tidak pada tangkai utama. Polip adalah monomorfik dan tidak bisa ditarik. Koloni ini mampu merubah ukuran, difasilitasi oleh retensi air, dan mereka kasar atau berduri apabila disentuh, karena adanya berbagai sklerit kalsium karbonat tertanam dalam jaringan. Warna koloni keputihan, kecoklatan (Fabricus dan Alderslade 2001).
Koloni berbentuk pohon atau semak (arboresen), lunak dan dinding koloni berbentuk kanal-kanal yang tersusun memanjang, tipis dan gampang sobek, bertangkai dengan kapitulum lobata atau glomerata. Polip non retraktil, tersusun berkelompok pada ujung lobus, mengandung spikula yang tersusun rapi berfungsi sebagai penyokong tubuh. Tangkai berwarna abu-abu sampai putih, lobus krem, abu-abu atau coklat. Genus ini ditemukan dari rataan terumbu sampai ke
Genus Sarcophyton
Koloni biasanya berukuran besar, mempunyai tangkai berwarna putih atau mirip dengan kapitulum. Kapitulum melebar seperti jamur atau bundar dengan bagian tepi berlekuk atau melipat, permukaan halus seperti beludru, jumlah polip autosoid lebih banyak. Koloni yang masih muda dan baru tumbuh berbentuk jamur. Polip berkontraksi penuh terutama pada air laut berarus deras sehingga nampak seperti beludru. Warna koloni krem atau krem keabuan. Di lapangan ditemukan dari rataan terumbu sampai ke kedalaman 15 m dengan konsentrasi pada kedalaman 3-10 m (Manuputty 2002).
Sebuah karang lunak dengan tangkai telanjang yang berbeda dan besar, permukaan atas halus (polypary) dengan tepi yang berbelit-belit yang berbeda. Ada dua jenis polip; yang autozooids lagi yang extensible, dan siphonozooids kecil yang tetap rata dengan permukaan koloni. Koloni memiliki berbeda "berbulu" penampilan ketika auotozooids diperpanjang. Koloni mungkin sampai 1.5 m dengan diameter, namun mereka dapat membentuk berdiri monospecific besar beberapa koloni yang bisa sampai 7 m. Koloni berbentuk jamur. Permukaan polyparium biasanya dengan lipatan terbuka pada margin disk. Polip dimorfik. Sklerit internal adalah spindle tuberculate; sklerit dari lapisan permukaan klub. Warna koloni kuning, kecoklatan dan kehijauan (Fabricus dan Alderslade 2001).
Genus Sarcophyton (Verseveldt 1982)
Genus Sinularia
Koloni bertangkai atau merambat (encrusting). Kapitulum lebar, lobata pada yang merambat, yang bertangkai digitata, aboresen atau glomerata. Polip monomorfik yaitu tidak memiliki sifonosoid, dan retraktil. Beberapa jenis hanya ditemukan pada kedalaman tertentu saja (15-20 m). Tangkai berwarna mirip dengan kapitulum, kecuali Sinularia flexibilis tangkainya berwarna putih, kapitulum lentur dan berwarna krem. Warna koloni krem, coklat muda atau abu-abu. Jenis ini ditemukan dari rataan terumbu sampai ke kedalaman 20 m. Anggota dari marga Sinularia sangat banyak sehingga untuk membedakan jenis yang satu dengan lainnya tidak cukup hanya dengan ciri-ciri morfologinya saja. Untuk itu harus dibedakan dari bentuk sklerit atau spikulanya (Manuputty 2002).
Sinularia memiliki tangkai pendek dan permukaan atas luas bercabang. Ada variasi morfologi yang cukup besar dalam spesies ini, cabang mulai dari lembaran tipis dan berliku-liku untuk ujung-ujung tangkai pendek. Hanya ada satu jenis
polip koloni memiliki penampilan “berbulu" yang berbeda ketika polip
Karang dapat bereproduksi dalam berbagai cara termasuk dengan fragmentasi. Pemijahan terjadi setelah bulan purnama pada bulan November. Pertumbuhan spesies ini lambat sekitar 5 mm per tahun (Verseveldt 1980).
© Andy Lewis
Kingdom Animalia Phylum Cnidaria Class Anthozoa Subclass Octocorallia Order Alcyonacea Family Alcyoniidae
Genus Sinularia (Verseveldt 1980)
Pertumbuhan Karang Lunak
Laju pertumbuahan karang lunak tergantung pada karakteristik biofisik-kimia lingkungan perairan. Berdasarkan hasil penelitian yang dilakukan oleh Arafat (2009) di perairan Pramuka, menunjukan bahwa laju pertumbuhan
Sinuaria dura tidak dipengaruhi oleh faktor kedalaman (antara 3 dan 10 m), namun dipengaruhi oleh faktor musim, dimana pertumbuhan tertinggi terjadi pada bulan Agustus-Desember dengan panjang rata-rata 0,24 cm per bulan dan lebar 0,28 cm per bulan. Pada bulan Januari-Maret, laju pertumbahan mengalami penurunan yakni panjang rata-rata 0,07 cm per bulan dan lebar 0,08 cm per bulan. Hal ini diduga pengaruh musim barat yang mengakibatkan perairan keruh dan berarus relative kuat. Pada spesies Lobophytum strictum, laju perumbuhan bervariasi dan puncak pertumbuhan tertinggi pada bulan Juli yaitu sekitar 0,67 cm panjang, 0,89 cm lebar dan pada bulan Oktober berkisar 0,86 cm panjang dan 0,62 cm lebar.
Karateristik Biofisik Perairan Karang Lunak
Karakteristik biofisik perairan berperan penting dalam menentukan distribusi ekosistem terumbu karang termasuk distribusi karang lunak. Distribusi karang menjadi lebih baik apabila parameter-parameter utama fisik-kimia mendukung pertumbuhan karang. Adapun parameter-parameter fisik-kimia yang mempengaruhi distribusi karang lunak meliputi kecerahan, kekeruhan, kedalaman, arah dan kecepatan arus, suhu, jenis substrat, salinitas, pH, DO, nutrient, TOM dan lain sebagainya (Wolanski 2010).
Kecerahan
pertumbuhan spesies zooxanthela (tingkat radiasi secara langsung mempengaruhi laju fotosintesis). Batas kedalaman dapat dikaitkan dengan kecerahan dan pertumbuhan zooxanthela karang lunak. Pada kecerahan 10 m, spesies zooxanthella didominasi oleh jenis karang lunak Gorgonian dan Dendronephthya. Pada kecerahan mencapai 40 m didominasi oleh spesies zooxanthellate Sinularia dengan kelimpahan tertinggi di kedalaman 25 m (Fabricus dan Alderslade 2001). Di perairan Pramuka kecerahan tertinggi mencapai 13 m dan dasar perairan adalah berpasir, karang lunak yang ditemukan didominasi kelompok Sinularia sp dan
Sarcophyton sp (Arafat 2009). Kekeruhan
Spesies karang mengalami perubahan jumlah dengan adanya perubahan kualitas air dalam hal ini adalah kekeruhan (Fabricius et al. 2012). Hasil kajiannya menunjukkan bahwa Acropora merupakan karang keras yang paling sensitive terhadap perubahan kualitas air. Karang lunak seperti genus Sinularia, Lobophytum dan Sarcophyton dari family Alcyoniidae dan Xeniidae mengalami penurunan dengan menurunnya kualitas air. Kelompok yang lebih banyak mampu bertahan adalah spons dan karang keras Turbinaria. Pengaruh kekeruhan terhadap penurunan kelimpahan dan kepadatan larva karang keras mencapai empat kali lipat dibandingkan karang lunak. Artinya, karang lunak masih lebih mampu bertahan dibandingkan karang keras.
Peningkatan kekeruhan dan nutrient suatu perairan dapat mempengaruhi perubahan struktur komonitas terumbu karang, dimana awalnya biota yang mendominasi adalah komunitas bersifat fototropik, kemudian berubah menjadi didominasi komunitas fototrofik dan algae, selanjutnya didominasi oleh algae. Ini dapat mengancam keberadaan hewan bentik karena tertutup oleh algae (Birkeland 1997).
Di perairan kepulauan seribu tingkat kekeruhan dan padatan tersuspensi (TSS) tertinggi pada barat mencapai 50 mg.L-1. Hal ini akibat terjadinya pengadukan sedimen oleh pasang surut dan arus yang relative lebih kuat, dan berdampak terhadap pola sebaran karang hidup (Handojo 2006).
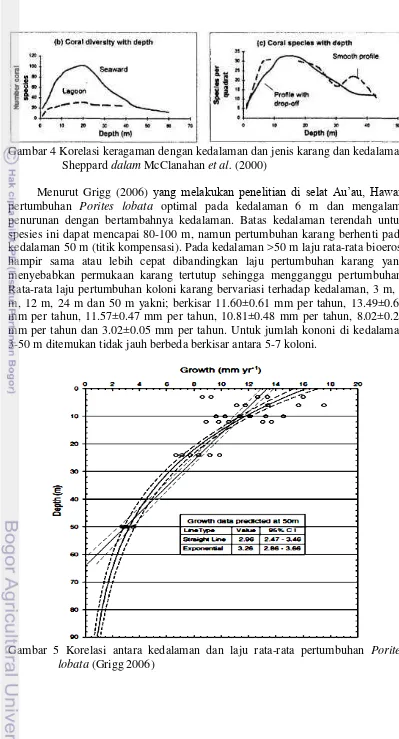
Kedalaman
Gambar 4 Korelasi keragaman dengan kedalaman dan jenis karang dan kedalaman Sheppard dalam McClanahan et al. (2000)
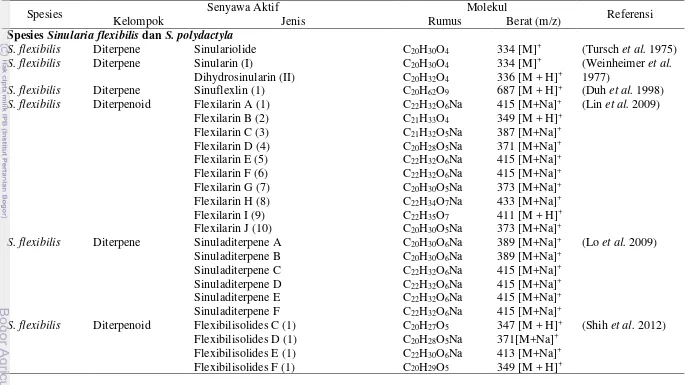
Menurut Grigg (2006) yang melakukan penelitian di selat Au’au, Hawai, pertumbuhan Porites lobata optimal pada kedalaman 6 m dan mengalami penurunan dengan bertambahnya kedalaman. Batas kedalaman terendah untuk spesies ini dapat mencapai 80-100 m, namun pertumbuhan karang berhenti pada kedalaman 50 m (titik kompensasi). Pada kedalaman >50 m laju rata-rata bioerosi hampir sama atau lebih cepat dibandingkan laju pertumbuhan karang yang menyebabkan permukaan karang tertutup sehingga mengganggu pertumbuhan. Rata-rata laju pertumbuhan koloni karang bervariasi terhadap kedalaman, 3 m, 6 m, 12 m, 24 m dan 50 m yakni; berkisar 11.60±0.61 mm per tahun, 13.49±0.64 mm per tahun, 11.57±0.47 mm per tahun, 10.81±0.48 mm per tahun, 8.02±0.24 mm per tahun dan 3.02±0.05 mm per tahun. Untuk jumlah kononi di kedalaman 3-50 m ditemukan tidak jauh berbeda berkisar antara 5-7 koloni.
Berdasarkan kajian yang dilakukan oleh Handojo (2006), persentase tutupan karang lunak di perairan Pramuka lebih tinggi pada kedalaman 15 m (0,16-7,08%) dibandingkan pada kedalaman 7 m (0-4,5 %). Suparno (2012) menunjukkan bahwa laju pertumbuhan spons berdasarkan pada kedalaman tidak berbeda nyata, pertumbuhan pada kedalaman 7 m adalah 4,42-5,53% per bulan, sedangkan di kedalaman 15 m antara 4,90-6,15% per bulan. Pada kawasan subtropis di perairan laut Ligurian, Italia pertumbuhan spons serupa tidak dipengaruhi oleh kekeruhan tetapi dipengaruhi kedalaman, dimana pada kedalaman 10 m pertumbuhan 0,73% per bulan dan kedalaman 20 m adalah 1,30% per bulan (Ferretti et al. 2009). Arah dan Kecepatan Arus
Faktor arus dapat berdampak baik atau buruk terhadap pertumbuha karang. Arus bersifat positif apabila membawa nutrien dan bahan-bahan organik yang diperlukan oleh karang dan zooxanthellae, sedangkan bersifat negatif apabila menyebabkan sedimentasi di perairan terumbu karang yang menutupi permukaan karang sehingga berakibat pada kematian karang. Kelimpahan karang lunak banyak ditemukan pada kawasan dengan arus yang konsisten dan cukup kuat, searah serta membawa makan yang cukup. Kawasan ini seperti kawan yang terlindung dari sapuan arus dan gelombang, lereng dan sebagainya. Arus berfungsi sebagai pembawa makanan, sirkulasi limbah pada koloni karang, dan merangsang aktivitas fotosintesis, dimana suatu zooxanthella gorgonian selalu tumbuh (Fabricus dan Alderslade 2001)
Suhu
Secara ekologi karang lunak memiliki kemiripan dalam hal batasan lingkungan dengan karang keras. Suhu perairan untuk pertumbuhan karang antara 18-36 oC. Suhu optimal untuk pertumbuhan karang rata-rata tahunan berkisar 26-28 oC (Birkeland 1997). Nybakken (1982) menyatakan suhu optimal pertumbuhan karang 23-25 oC. Batas toleransi pertumbuhan karang di beberapa tempat maksimum mencapai 36-40 oC dan minimum 18 oC. Hal serupa juga diungkapkan Notji (2007), bahwa kisaran suhu untuk pertumbuhan karang berkisar 25-40 oC. Perubahan variasi suhu perairan yang tinggi dapat menyebabkan zooxanthellae keluar dari jaringan karang. Kehilangan zooxanthellae yang lama dapat menyebabkan bleaching dan akhirnya mematikan hewan karang tersebut. Fabricus dan Alderslade (2001) menyatakan kisaran suhu untuk pertubuhan karang lunak adalah sekitar 18-31 oC, namun masih ditemukan pertumbuhan pada 35 oC seperti di Teluk Parsian pada puncak panas.
Jenis Substrat
Salinitas
Salinitas optimum untuk pertumbuhan karang adalah pada kisaran 32-35 ‰, tetapi karang masih dapat berkembang di wilayah bersalinitas tinggi seperti Teluk Persia yang salinitasnya mencapai 42 % (Nybakken 1982). Notji (2007) menyatakan bahwa batas tolesansi hewan karang terhadap salinitas berkisar 27-40
‰. Kenaikan salinitas yang kecil (2-3 ‰) tidak memberikan dampak pada pertumbuhan karang lunak dalam keadaan normal, tetapi apabila terjadi perbedaan yang tinggi akan berdampak pada jenis yang mendominasi seperti pada salinitas di
bawah 30 ‰ karang lunak yang mendominasi adalah dari kelompok Xeniidae dan
≤25 ‰ merupakan letal bagi umumnya spesies karang lunak (Fabricus dan Alderslade 2001).
Gambar 6 Hubungan spesies karang terhadap salinitas perairan di Samudera India Sheppard dalam McClanahan et al. (2000)
Nutrien
Menurut Handojo (2006), kondisi nutrient di perairan Pramuka telah menunjukkan di atas baku mutu lingkungan yang ditetapkan Kepmen LH no. 50 tahun 2004. Nitrat sekitar 0,301-0,482 mg.L-1 (untuk baku mutu 0,008 mg.L-1), sedangkan fosfat 0,04-0,059 mg.L-1 (baku mutu 0,15 mg.L-1). Hal ini dapat mengancam kelangsungan hidup ekosistem terumbu karang di perairan tersebut. Masukan nutrient ini diduga akibat dari limbah aktivitas manusia.
Senyawa Bioaktif Karang Lunak
Senyawa bioaktif karang lunak berasal dari proses metabolis sekunder (Patra dan Majumdar 2003; Fleury et al. 2004; Khalesi et al. 2009; Chen et al.
2014b). Metabolik sekunder yang dimaksud adalah metabolik yang menghasilkan bahan-bahan yang bukan untuk pertumbuhan, tetapi digunakan seperti untuk mempertahankan diri (defensive), kamuflase atau membuat kondisi yang tidak nyaman (toksin) (Hoang et al. 2015). Senyawa bioaktif pada karang lunak tersebar dihampir seluruh tubuh, namun dugaan yang paling banyak terdapat pada bagian ujung-ujung tubuh termasuk pada tentakel (Kelman et al. 2006).
lebih dua kali lipat apabila dilakukan relokasi, hal ini diduga akibat peningkatan streesitas yang dialami spesies karang tersebut (Leone et al. 1995). Lobophytum
sp. dari perairan Bunaken diperoleh senyawa alkaloid tipe zoanthamine yaitu lobozoanthamine (1) (Fattorusso et al. 2008b). L. sarcophytoides diketahui mengandung senyawa sarcophytosterol (1) dan emapat cembranoid baru, sarcophytolins A-D (2-5) (Lu et al. 2010).
Genus Nephthea dari Teluk Bengal diketahui menghasilkan senyawa jenis D (-)-2S,3R-2-Aminooctadeca-4E,8E-diene-1,3-diol-N-palmitate (1), Cholesterol27, 1-O-Alkylglycerol27, Fatty acids, Acetylation of ceramide dan Acetonide 3 (Patra dan Majumdar 2003).
Genus Sarcophyton yang diambil dari pesisir selatan Madagascar diperoleh dua senyawa baru cembren terpenoid (Longeon et al. 2002). Spesies Sarcophyton
sp dari perairan Manado ditemukan ada dua tipe cembrene terpenoid. Kedua senyawa tersebut adalah sarcofurano cembrenolides A (1) dan B (2). Senyawa 1 memiliki kerangka karbon unik 8, 19-bisnorfuranocembrenolide. Senyawa 2 adalah furanocembrenolide, tetapi unit C1 (C-20) telah terpasang ke C-10, bukan C-12 dari cembrenolides biasa. Penyusunan ini adalah unik dalam biosintesis diterpenes cembranoid (Kapojos et al. 2010). Spesies S. infundibuliforme
diperoleh 14 jenis senyawa biaoktif yang meliputi; sepuluh senyawa diterpenoid (1-10), satu senyawa turunan α-tocopheryl quinine (11), satu prostaglandin (12), satu lipid (13) dan satu carotinoid (14). Diterpenoid yang ditemukan menunjukkan aktivitas sebagai antifouling pada penempelan larva teritip jenis Balanus amphitrite (Wang et al. 2011). Spesies S. glaucum ditemukan senyawa diterpenoid jenis (1S,2E,4R,6E,8S, 11R,12S)-8,11-epoxy-4,12-epoxy-2,6-cembradiene (2), dua diterpen cembranoid diisolat dari alam untuk pertama kali, (1S,2E,4R,6E,8R,11S,12R)-8,12-epoxy-2,6-cembradiene-4,11-diol (3) and (1S,4R,13S)-cembra-2E,7E,11E-trien-4,13-diol (6), sarcophine (1), (+)-7a,8b-dihydroxydeepoxysarcophine (4) dan sarcophytolide (5) (El-Ezz et al. 2013). S. trocheliophorum dari Laut Merah berhasil diisolasi senyawa trochelioid A (1) dan B (2) (Hegazy et al. 2013). Ada tiga senyawa cembranoids: sarcophytolol (1), sarcophytolide B (2) dan sarcophytolide C (3) diperoleh dari S. glaucum (Al-Lihaibi et al. 2014). Ada tiga senyawa diterpenoid tipe capnosane, sarcophytrols A–C (1–3) diisolat pada karang lunak S. trocheliophorum dari Laut Cina Selatan (Chen et al. 2015c).
Genus Sinularia diketahui menghasilkan berbagai metabolit sekunder seperti sesquiterpenes, diterpenes, polyhydroxylated steroid dan poliamina (Kamel dan Slattery 2005). Satu senyawa baru norcembrane berbentuk sinularectin tiga diisiolat dari S. erecta yang disampling dari perairan Kenyan (Rudi et al. 2006). Karang lunak S. flexibilis diketahui menghasilkan empat senyawa baru sterol (Yu
2009). S. flexibilis menghasilkan enam cembrane diterpenes baru dengan jenis sinuladiterpenes A–F (Lo et al. 2009). S. gyrosa diperoleh pada isotasi enam senyawa norcembranolides berbentuk gyrosanolides A–F (Cheng et al. 2010). S. crassa ditemukan delapan senyawa cembranoid baru jenis crassarines A–H (Chao
et al. 2011). Genus Sinularia merupakan salah satu karang lunak yang paling menyebar dan banyak ditemukan mengandung senyawa bioaktif (Chen et al.
2012a). Sinularia sp dari perairan Siladen, Taman Laut Bunaken, Manado diperoleh senyawa glucosylcerebroside tipe sarcoehrenoside dan sinularioside (Putra et al. 2012a). Sinularia sp. (order Alcyonacea, family Alcyoniidae) diperoleh dua alkaloid baru dengan nama sinulasulfoxide (1) dan sinulasulfone (2) (Putra et al. 2012b).
S. flexibilis yang diambil dari perairan Atol Dongsha, Laut Cina Selatan diperoleh tujuh senyawa, disebut flexibilisolides, flexibilisin dan 11,12-secoflexibillin (Shih et al. 2012). S. polydactyla dari Laur Merah ditemukan ada tiga senyawa terpenoid (Aboutabl et al. 2013). S. gaweli diperoleh senyawa sinulanorcembranolide A (1) (Yen et al. 2013). S. capillosa dihasilkan delapan isolat senyawa baru sesquiterpenoid yang disebut capillosananes S–Z (1–8) (Chen
et al. 2014a). S. gyrosa ditemukan norcembranoid yang disebut sinugyrosanolide A (Cheng et al. 2014). S. numerosa dari perairan Taiwan ditemukan ada empat senyawa tipe cembrane diterpen yang diberi nama numerosol A–D (1–4) (Tseng
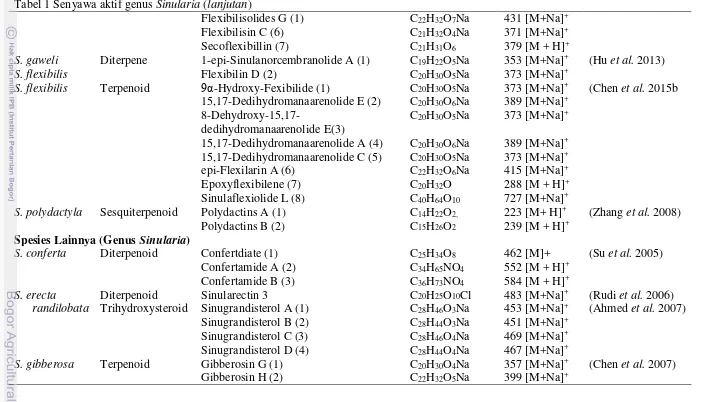
et al. 2014). Ada delapan senyawa baru jenis sinulolides A–H (1–8) berhasil diisolat dari spesies Sinularia sp (Yang et al. 2014), begitu juga dengan S. flexibilis dari perairan Laut Cina Selatan (Chen et al. 2015a). Senyawa aktif utama pada genus Sinularia ditemukan senyawa golongan diterpen Sinularin dengan sinonim flexibilide yang berat molekul m/z 334 dengan formula molekul C20H30O4 dan struktur senyawa pada Gambar 7.
18
Tabel 1 Senyawa aktif genus Sinularia
Spesies Senyawa Aktif Molekul Referensi
Kelompok Jenis Rumus Berat (m/z)
Spesies Sinularia flexibilis dan S. polydactyla
S. flexibilis Diterpene Sinulariolide C20H30O4 334 [M]+ (Tursch et al. 1975)
S. flexibilis Diterpene Sinularin (I) C20H30O4 334 [M]+ (Weinheimer et al.
1977)
Dihydrosinularin (II) C20H32O4 336 [M + H]+
S. flexibilis Diterpene Sinuflexlin (1) C20H62O9 687 [M + H]+ (Duh et al. 1998)
S. flexibilis Diterpenoid Flexilarin A (1) C22H32O6Na 415 [M+Na]+ (Lin et al. 2009)
Flexilarin B (2) C21H33O4 349 [M + H]+
Flexilarin C (3) C21H32O5Na 387 [M+Na]+
Flexilarin D (4) C20H28O5Na 371 [M+Na]+
Flexilarin E (5) C22H32O6Na 415 [M+Na]+
Flexilarin F (6) C22H32O6Na 415 [M+Na]+
Flexilarin G (7) C20H30O5Na 373 [M+Na]+
Flexilarin H (8) C22H34O7Na 433 [M+Na]+
Flexilarin I (9) C22H35O7 411 [M + H]+
Flexilarin J (10) C20H30O5Na 373 [M+Na]+
S. flexibilis Diterpene Sinuladiterpene A C20H30O6Na 389 [M+Na]+ (Lo et al. 2009)
Sinuladiterpene B C20H30O6Na 389 [M+Na]+
Sinuladiterpene C C22H32O6Na 415 [M+Na]+
Sinuladiterpene D C22H32O6Na 415 [M+Na]+
Sinuladiterpene E C22H32O6Na 415 [M+Na]+
Sinuladiterpene F C22H32O6Na 415 [M+Na]+
S. flexibilis Diterpenoid Flexibilisolides C (1) C20H27O5 347 [M + H]+ (Shih et al. 2012)
Flexibilisolides D (1) C20H28O5Na 371[M+Na]+
Flexibilisolides E (1) C22H30O6Na 413 [M+Na]+
19
Tabel 1 Senyawa aktif genus Sinularia (lanjutan)
Flexibilisolides G (1) C22H32O7Na 431 [M+Na]+
Flexibilisin C (6) C21H32O4Na 371 [M+Na]+
Secoflexibillin (7) C21H31O6 379 [M + H]+
S. gaweli Diterpene 1-epi-Sinulanorcembranolide A (1) C19H22O5Na 353 [M+Na]+ (Hu et al. 2013)
S. flexibilis Flexibilin D (2) C20H30O5Na 373 [M+Na]+
S. flexibilis Terpenoid 9α-Hydroxy-Fexibilide (1) C20H30O5Na 373 [M+Na]+ (Chen et al. 2015b
15,17-Dedihydromanaarenolide E (2) C20H30O6Na 389 [M+Na]+
8-Dehydroxy-15,17-dedihydromanaarenolide E(3)
C20H30O5Na 373 [M+Na]+ 15,17-Dedihydromanaarenolide A (4) C20H30O6Na 389 [M+Na]+ 15,17-Dedihydromanaarenolide C (5) C20H30O5Na 373 [M+Na]+
epi-Flexilarin A (6) C22H32O6Na 415 [M+Na]+
Epoxyflexibilene (7) C20H32O 288 [M + H]+
Sinulaflexiolide L (8) C40H64O10 727 [M+Na]+
S. polydactyla Sesquiterpenoid Polydactins A (1) C14H22O2, 223 [M+ H]+ (Zhang et al. 2008)
Polydactins B (2) C15H26O2 239 [M + H]+
Spesies Lainnya (Genus Sinularia)
S. conferta Diterpenoid Confertdiate (1) C25H34O8 462 [M]+ (Su et al. 2005)
Confertamide A (2) C34H65NO4 552 [M + H]+
Confertamide B (3) C36H73NO4 584 [M + H]+
S. erecta Diterpenoid Sinularectin 3 C20H25O10Cl 483 [M+Na]+ (Rudi et al. 2006)
S. grandilobata Trihydroxysteroid Sinugrandisterol A (1) C28H46O3Na 453 [M+Na]+ (Ahmed et al. 2007)
Sinugrandisterol B (2) C28H44O3Na 451 [M+Na]+
Sinugrandisterol C (3) C28H46O4Na 469 [M+Na]+
Sinugrandisterol D (4) C28H44O4Na 467 [M+Na]+
S. gibberosa Terpenoid Gibberosin G (1) C20H30O4Na 357 [M+Na]+ (Chen et al. 2007)
20
Tabel 1 Senyawa aktif genus Sinularia (lanjutan)
Gibberosin I (3) C24H36O5Na 427 [M+Na]+
Gibberosin J (4) C20H30O3Na 341 [M+Na]+
Gibberosin K (5) C20H30O2Na 325 [M+Na]+
Gibberosin L (6) C20H30ONa 309 [M+Na]+
Gibberosin M (7) C19H28O2Na 311 [M+Na]+
Sinularia sp Diterpene Diepoxycembrene A (1) C20H32O2Na 327 [M+Na]+ (Qin et al. 2008)
S. gyrosa Norditerpenoid Gyrosanolide A (1) C19H24O6Na 371 [M+Na]+ (Cheng et al. 2010)
Gyrosanolide B (2) C19H24O6Na 371 [M+Na]+
Gyrosanolide C (3) C20H26O6Na 385 [M+Na]+
Gyrosanolide D (4) C19H24O5Na 355 [M+Na]+
Gyrosanolide E (5) C19H24O5Na 355 [M+Na]+
Gyrosanolide F (6) C19H24O6Na 371 [M+Na]+
Gyrosanolide G (7) C20H28O8Na 419 [M+Na]+
S. crassa Diterpenoid Crassarine A (1) C20H34O4Na 361 [M+Na]+ (Chao et al. 2011)
Crassarine B (2) C22H36O5Na 403 [M+Na]+
Crassarine C (3) C21H34O5Na 389 [M+Na]+
Crassarine D (4) C20H34O4Na 361 [M+Na]+
Crassarine E (5) C20H34O4Na 361 [M+Na]+
Crassarine F (6) C20H32O2Na 327 [M+Na]+
Crassarine G (7) C20H32O2Na 327 [M+Na]+
Crassarine I (8) C20H30O2Na 325 [M+Na]+
Sinularia sp Glycolipid Sinularioside (2) C30H52O12Na 627 [M+Na]+ (Putra et al. 2012a)
Sinularia sp Alkaloid Sinulasulfoxide (1) C23H47NaNO2S 424 [M+Na]+ (Putra et al. 2012b)
Sinulasulfone (2) C23H47NaNO3S 440 [M+Na]+
S. maxima Norditerpenoid 12-hydroxy-scabrolide A (2) C19H23O6 347 [M + H]+ (Thao et al. 2013)
13-epi-scabrolide C (6) C20H27O6 363 [M + H]+
21
Tabel 1 Senyawa aktif genus Sinularia (lanjutan)
Sinularianin D (4) C16H22O4Na 271 [M+Na]+
Sinularianin E (5) C16H24O4Na 303 [M+Na]+
Sinularianin F (6) C16H24O3Na 287 [M+Na]+
S. gaweli Diterpene Sinulanorcembranolide A (1) C19H22O5Na 353 [M+Na]+ (Yen et al. 2013
S. capillosa Sesquiterpenoid Capillosanane S (1) C15H22O3Na 273 [M+Na]+ (Chen et al. 2014)
Capillosanane T (2) C15H22O3Na 273 [M+Na]+
Capillosanane V (3) C15H22O3Na 257 [M+Na]+
Capillosanane U (4) C15H22O3Na 241 [M+Na]+
Capillosanane W (5) C15H26O2Na 261 [M+Na]+
Capillosanane X (6) C15H26O2Na 289 [M+Na]+
Capillosanane Y (7) C15H26O2Na 261 [M+Na]+
Capillosanane Z (8) C15H26O2Na 261 [M+Na]+
S. gyrosa Norcembranoid Sinugyrosanolide A C19H22O5Na 353 [M+Na]+ (Cheng et al. 2014)
S. numerosa Diterpene Numerosol A (1) C20H34O4Na 361 [M+Na]+ (Tseng et al. 2014)
Numerosol B (2) C22H34O4Na 385 [M+Na]+
Numerosol C (3) C20H32O2Na 327 [M+Na]+
Sinularia sp Cyclopentenone Sinulolide A (1) C20H30O6 367 [M + H]+ (Yang et al. 2014)
Sinulolide B (2) C20H30O6 367 [M + H]+
Sinulolide C (3) C20H30O6Na 291 [M+Na]+
Sinulolide D (4) C20H30O6 253 [M – H]
-Sinulolide E (5) C20H30O6 299 [M + H]+
Sinulolide F (6) C20H30O6 283 [M – H]
-Sinulolide G (7) C20H30O6Na 279 [M+Na]+
Sinulolide H (8) C20H30O6Na 251 [M+Na]+
S. numerosa Diterpene 5-Episinuleptolide (1) C20H27O6 363 [M + H]+ (Chen et al. 2015a)