BAB II
REAKTOR GANDA
2.1. Tujuan Percobaan
- Membuat neraca massa
- Menghitung konversi reaksi
2.2. Tinjauan Pustaka
Mengubah bahan baku menjadi produk yang lebih bernilai sintesis kimia banyak dilakukan di industri kimia. Seperti bahan baku asam sulfat, ammonia, etilen, propilena, asam fosfat, klorin, asam nitrat, urea, benzene, methanol, etanol, dan etilen glikol di olah menjadi serat/benang, cat, deterjen, plastic, karet, kertas, pupuk, inteksida, dll. Yang dirancang dan di oprasikan oleh reaktor kimia.[2]
Ada tiga tipe utama yang digunakan dalam pengoprasian reactor yaitu: A. Reaktor batch
1. Reaktor batch adalah tempat terjadinya suatu reaksi kimia tunggal yaitu reaksi yang berlangsung hanya dengan satu persamaan laju reaksi yang berpasangan dengan persamaan kesetimbangan dan stokiometri.[3]
Reactor batch ada 2 jenis yaitu:
- Reactor batch volume konstan yang berupa liquid
B. Reactor tangki berpengaduk
Yaitu satu atau lebih reaktan masuk ke dalam suatu bejana berpengaduk dan bersamaan dengan itu jumlah produk yang sama dikeluarkan dari reactor
C. Reaktor alir pipa
Kecepatan dan konversi keseeimbangan reaksi kimia tergantung pada temperature, tekanan, dan komposisi reaktan.Misal oksidasi SO2 menjadi SO3.
2 SO2(g) + O2(g)2 SO3(g)
Kecepatan reaksi bertambah dengan naiknya temperatur. Konversi keseimbangan SO3 turun dengan naiknya temperatur, yaitu dari 90 % pada 520 0C menjadi 50% pada 6800C. konversi keseimbangan menyatakan konversi maksimum yang dapat dicapai (dengan atau tanpa katalis). Keseimbangan dan kecepatan reaksi harus diperhatikan ketika kita memanfaatkan reaksi kimia untuk tujuan komersial.Meskipun kecepatan reaksi tidak berkaitan dengan termodinamika, tetapi konversi keseimbangan berkaitan.Kebanyakan reaksi di industry tidak dilangsungkan sampai tercapai keseimbangan, biasanya reactor dirancang terutama berdasarkan kecepatan reaksi.Meskipun demikian pemilihan kondisi operasi di pengaruhi oleh keseimbangan. Reaksi secara umum:
[V1]A1 + [V2]A2 +….
V1 adalah koefisien stoikiometri reaksi
Konvensi tanda untuk i :
• Positif (+) untuk produk • Negatif (–) untuk reaktan.[2]
2. Perubahan konsentrasi A setelah berlangsung selama (t):[1] CA ¿NA
V =
NAO
(
1−XA)V CA = CAO (1–XA) - Waktu tinggal
Waktu tinggal merupakan waktu yang diperlukan bahan baku untuk bereaksi di dalam reaktor pada kondisi tertentu. Waktu tinggal berbanding terbalik dengan laju reaksi, dimana semakin kecil waktu tinggal maka laju alir reaksi akan semakin besar.
Hal ini sesuai dengan persamaan : V2O3
τ =V
v0=
(
CAo−CA
)
−rA
- Volum (V)
Volume berbanding terbalik dengan laju reaksi dimana semakin kecil volume maka laju alir reaksi akan semakin besar. Hal ini sesuai dengan persamaan :[4]
τ =V v0=
(CA
o− CA)
−rA
Aplikasi kriteria keseimbangan pada reaksi kimia
Energi Gibbs total dari suatu system tertutup pada T dan P konstan akan berkurang selama proses irreversible dan kondisi keseimbangan akan dicapai jika Gt mencapai nilai minimum.
Pada kondisi keseimbangan: (dGt)
T,P = 0
Jadi jka suatau campuran kimia tidak berasa pada keseimbangan kimia, maka reaksi kimia yang terjadi pada T dan P konstan akan menurunkan energi Gibbs total dari system.[1]
Berikut ini akan dibahas neraca massa, dimana reaksi terjadi di dalam sistem yang ditinjau. Dalam reaksi kimia, stoikiometri reaksi kimia harus diperhatikan.
Contoh suatu persamaan reaksi : a A + b B c C + d D Reaksi di atas mempunyai arti:
1. Kualitatif, yaitu bahan apa yang direaksikan dan yang dihasilkan. Bahan A dan B merupakan reaktan atau pereaksi.Bahan C dan D merupakan produk atau hasil reaksi. 2. Kuantitatif, yaitu perbandingan mol-mol sebelum dan sesudah reaksi. Jika 1 mol A
Di dalam praktek, jarang terdapat peristiwa dimana reaksi berjalan secara stoikiometri tepat.Biasanya, salah satu reaktan berada dalam jumlah yang berlebihan, sehingga reaksi tidak bisa berjalan stoikiometris.Pada akhir reaksi masih ada sisa-sisa jenuh reaktan. Dalam perhitungan kuantitatif sistem reaksi yang demikian, perlu diketahui beberapa istilah seperti di bawah ini :
Dalam perhitungan kuantitatif sistem reaksi yang demikian, perlu diketahui beberapa istilah seperti di bawah ini :
1. limiting reactant (reaktan pembatas) Reaktan yang jumlah molnya paling sedikit bila ditinjau dari segi stoikiometri. Atau reaktan yang akan habis terlebih dulu dibanding reaktan lainnya.
2. Excess reactant (zat reaktan yang berlebihan).
3. Percent excess of reactant = persen kelebihan reaktan yang berlebih.
%excess =jumlah mol kelebihan dari kebutuhan teoritisjumlah mol kebutuhan teoritis 100 %
Jumlah mol kelebihannya = (mol umpan ) – (mol kebutuhan teoritisnya). Teoritis merupakan kondisi jika limiting reactant habis bereaksi.
4. Konversi.
konversi=jumlah mol reaktan yang bereaksi
2.3. Variabel Percobaan
A. Variable Tetap
- Volume NaOH : 1500 mL
- Volume H2SO4 : 800 mL B. Variable Berubah
- Konsentrasi H2SO4 : 0,4 N dan 0,5 N - Waktu tinggal : 0; 5; 10; 15 menit
- Bukaan valve : 450 dan 600
2.4. Alat dan Bahan
A. Alat-alat yang digunakan:
- Batang pengaduk - Beakerglass
- Buret
- Busur
- Corong kaca - Erlemeyer
- Gelas arloji
- Gelas ukur
- Karet penghisap
- Neraca analitik
B. Bahan-bahan yang digunakan:
- Aquadest (H2O)
- Asam oksalat (H2C2O4.2H2O) - Asam sulfat (H2SO4)
- Indicator fenolftalein (C20H14O4)
- Pipet tetes
- Pipet volume
- Seperangkat reactor - Stopwatch
- termometer
2.5. Prosedur Percobaan
A. Kalibrasi laju alir volumetric air pendingin
- Mengisi tangki air penampung dengan air pendingin
- Membukaglobe valve air pendingin pada reaktor 1 dengan bukaan valve, bukaan valve 450 dan 600 menghitung waktu untuk 250 mL air yang keluar.
B. Persiapan bahan
- Membuat larutan asam oksalat 0,2 N sebanyak 250 mL
- Membuat larutan NaOH 0,2 N sebanyak 1500 mL
- Menstandarisasi larutan NaOH dengan menggunakan larutan asam oksalat
- Membuat larutan asam sulfat 0,4 N dan 0,5 N sebanyak 800 mL. C. Percobaan
- Mengatur bukaan valve pada 450 pada keluaran tangki NaOH, H
2SO4, reaktor 1 dan 2 - Memasukkan larutan NaOH sebanyak 1500 mL kedalam tangki NaOH dan biarkan
mengallir secara kontinyu kedalam reaktor 1
- Memasukkan larutan asam sulfat sebanyak 400 mL ke dalam tangki penampung dan mengalirkan larutan secara kontinyu dan menyalakan stopwatch
- Setiap 0;5;10 dan 15 menit, mencatat temperatur pada reaktor, temperatur pada air pendingin masuk dan keluar, dan mengambil hasil reaksi pada keluaran reaktor 1 lalu melakukan titrasi dengan 10 mL asam oksalat sebanyak 3 kali
- Mengambil hasil reaksi keluaran reaktor 2 setelah 15 menit reaksi dan melakukan titrasi sebanyak 10 mL asam oksalat.
- Mengulangi langkah-;angkah tersebut sesuai dengan run yang diminta.
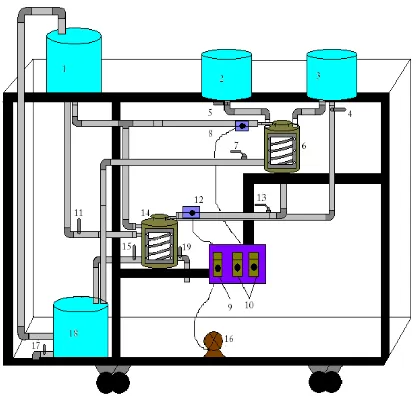
2.6. Gambar Peralatan
Gambar 2.1.instrument reaktor ganda
[image:8.595.223.431.342.544.2]6. Reaktor II 7. Pompa
8. Valve pengeluaran air pendingin 9. Valve air pendingin
10.Valve produk
11.Valve tangki feed NaOH 12.Valve tangki feed H2SO4
13. Tombol dynamo/motor penggerak 14. Tombol pompa recycle air pendingin 15.Valve coil pendingin
16.Coil pendingin 17. Pengaduk
18. Motor penggerak
19.Valve pengeluaran tangki overflow
2.7. Data Pengamatan
2.7.1. Data kalibrasi laju alir volumetric air pendingin
Bukaan valve Volume (mL) Waktu (s) Laju alir (mL/s)
450 250
13,4
6,2344 13,3
13,4
10,5 10,6
2.7.2. Data standarisasi NaOH 0,2 N dengan asam oksalat 0,2 N
No Volume asam oksalat (mL) Volume titrasi NaOH (mL)
1 10 11,6
2 10 11,2
3 10 11,5
Rata-rata 11.43
2.7.3. Data hasil pengamatan suhu reaktor bukaan valve 450
Konsentrasi H2SO4 (N) Waktu (menit) Suhu air masuk (0C) Suhu air keluar (0C)
0,4
0 25 27
5 25 26
10 25 27
15 25 27
0,5
0 25 26
5 25 26
10 25 26
15 25 27
2.7.4. Data hasil pengamatan standarisasi NaOH awal dan produk bukaan Valve 450
Konsentrasi H2SO4
Standarisasi produk (mL)
Reaktor I Reaktor II
0,4
15 22 28 29 32
13 20 25,5 27,5 34,5
0,5 17 24 31 39 42.5
16.5 23 30,5 37,7 41,8
2.7.5. Data hasil pengamatan suhu reaktor bukaan valve 600
Konsentrasi H2SO4 (N) Waktu (menit) Suhu air masuk (0C) Suhu air keluar (0C)
0,4
0 25 26.5
5 25 26
10 25 27
15 25 26
0,5
0 25 26.5
5 25 27
10 25 27
15 25 26
2.7.6. Data hasil pengamatan standarisasi NaOH awal dan produk bukaan valve 600
Konsentrasi H2SO4
Standarisasi produk (mL)
Reaktor I Reaktor II
0 5 10 15 15
0,4
17 23 27 28.5 31
15 21 26 27 33.5
0,5
18 23 31 38 41
2.7.7.
Hasil perhitungan neraca massa reaktor I dengan konsentrasi H2SO4 0,4 N untuk bukaan valve 45° dengan waktu 5-15 menit- Untuk waktu 5 menit
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 15.7656 18.9457
NaOH 10.4520 13.0480
Na2SO4 - 4.6080
H20 2274.4497 2273.2815
Total 2300.6672 2300.6672
- Untuk waktu 10 menit
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 15.7656 24.4639
NaOH 10.4520 17.5527
Na2SO4 - 12.6038
H20 2274.4497 2271.2544
Total 2300.6672 2300.6672
- Untuk waktu 15 menit
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 15.7656 22.1765
NaOH 10.4520 15.6854
Na2SO4 - 9.2893
H20 2274.4497 2272.0946
Total 2300.6672 2300.6672
2.7.8.
Hasil perhitungan neraca massa reaktor I dengan konsentrasi H2SO4 0,5 N untukbukaan valve 45° dengan waktu 5-15 menit
- Untuk waktu 5 menit
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 19.7071 18.6777
NaOH 10.4520 9.6117
Na2SO4 - 1.4916
Total 2302.4729 2302.4729
- Untuk waktu 10 menit
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 19.7071 26.1181
NaOH 10.4520 15.6854
Na2SO4 - 9.2893
H20 2272.3137 2269.9587
Total 2302.4729 2302.4729
- Untuk waktu 15 menit
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 19.7071 21.5878
NaOH 10.4520 11.9872
Na2SO4 - 2.7250
H20 2272.3137 2271.6229
Total 2302.4729 2302.4729
2.7.9. Hasil perhitungan nerca massa pad reactor I dengan konsentrasi H2SO4 0,5 N pada
bukaan valve 45 0C
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 9.9114 12.3106
NaOH 5.6731 7.6316
Na2SO4 8.4826 5.0062
H20 2276.6002 2275.7189
Total 2300.6672 2300.6672
2.7.10. Hasil perhitungan nerca massa pad reactor I dengan konsentrasi H2SO4 0,4 N pada
bukaan valve 45 0C
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 26.1181 21.5878
NaOH 15.6854 11.9872
Na2SO4 9.2893 2.7250
H20 2269.9587 2271.6229
2.7.11.
Hasil perhitungan neraca massa reaktor I dengan konsentrasi H2SO4 0,4 N untuk bukaan valve 60° dengan waktu 5-15 menit- Untuk waktu 5 menit
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 7.8401 2.9619
NaOH 10.4940 0.0000
Na2SO4 - 18.5523
H20 1879.8630 1884.5664
Total 1906.0805 1906.0805
- Untuk waktu 10 menit
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 7.8401 24.4639
NaOH 10.4940 17.5527
Na2SO4 - 12.6038
H20 1879.8630 1876.6676
Total 1906.0805 1906.0805
- Untuk waktu 15 menit
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 7.8401 22.1765
NaOH 10.4940 15.6854
Na2SO4 - 9.2893
H20 1879.8630 1877.5079
Total 1906.0805 1906.0805
2.7.12.
Hasil perhitungan neraca massa reaktor I dengan konsentrasi H2SO4 0,5 Nuntuk bukaan valve 60° dengan waktu 5-15 menit
- Untuk waktu 5 menit
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 9.8000 6.9034
Na2SO4 - 18.5523
H20 1878.8009 1883.5043
Total 1908.9600 1908.9600
- Untuk waktu 10 menit
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 9.8000 26.1181
NaOH 10.4940 15.6854
Na2SO4 - 9.2893
H20 1878.8009 1876.4459
Total 1908.9600 1908.9600
- Untuk waktu 15 menit
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 9.8000 21.5878
NaOH 10.4940 11.9872
Na2SO4 - 2.7250
H20 1878.8009 1878.1101
Total 1908.9600 1908.9600
2.7.13.hasil perhitungan neraca massa reactor II dengan konsentrasi H2SO4 0,4 N pada bukaan valve 45 0C
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 12.4336 10.2021
NaOH 6.2560 4.4344
Na2SO4 4.8280 8.0613
H20 2277.1334 2277.9532
Total 2300.6510 2300.6510
2.7.14.hasil perhitungan neraca massa reactor II dengan konsentrasi H2SO4 0,5 N pada bukaan valve 45 0C
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 13.1970 15.4510
NaOH 3.6616 5.5016
Na2SO4 9.4331 6.1671
H20 1880.0471 1879.2191
2.7.15.hasil perhitungan neraca massa reactor II dengan konsentrasi H2SO4 0,4 N pada bukaan valve 60 0C
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 10.2021 12.4336
NaOH 4.4344 6.2560
Na2SO4 8.0613 4.8280
H20 1880.7614 1879.9417
Total 1903.4593 1903.4593
2.7.16.hasil perhitungan neraca massa reactor II dengan konsentrasi H2SO4 0,5 N pada bukaan valve 60 0C
Komponen Massa masuk (gram) Massa keluar (gram)
H2SO4 13.1970 15.4510
NaOH 3.6616 5.5016
Na2SO4 9.4331 6.1671
H20 2273.5184 2272.6904
Total 2299.8101 2299.8101
A.
Grafik Hubungan antara konversi dan waktu pengambilan sampel untuk konsentrasi H2SO4 0,4 N dan 0,5 N pada bukaan valve 45°0 5 10 15 20 25 30 35 40 45
-80 -60 -40 -20 0 20 40 60 80 100
0,4 N 0,5 N
Waktu (menit)
K
on
ve
rs
i (
%
B.
Grafik Hubungan antara konversi dan waktu pengambilan sampel untuk konsentrasi H2SO4 0,4 N dan 0,5 N pada bukaan valve 60°0 5 10 15 20 25 30 35 40 45
-150 -100 -50 0 50 100 150 200
0,4 N 0,5 N
Waktu (menit)
K
on
ve
rs
i (
%
)
2.9. Pembahasan
A. Secara teori:
Input = output + hilang karena reaksi + akumulasi
1. Pada hasil percobaan yang telah dilakukan, dilihat dari hasil perhitungan neraca massa pada Bukaan valve 450 yaitu:
-
Dilihat dari table 2.7.7. Pada konsentrasi H2SO4 0,4 N untuk waktu reaksi mulai dari 5-15 menit diperoleh massa input sama dengan massa output yaitu 2300.6672gram2. Pada hasil percobaan yang telah dilakukan, dilihat dari hasil perhitungan neraca massa pada Bukaan valve 600 yaitu:
-
Dilihat dari table 2.7.9. Pada konsentrasi H2SO4 0,4 N untuk waktu reaksi mulai dari 5-15 menit diperoleh massa input sama dengan massa output yaitu 1906.0805gram sedangkan input 1898.1971 gram.-
Dan dilihat dari table 2.7.10. Pada konsentrasi H2SO4 0,5 N untuk waktu reaksi mulai dari 5-15 menit diperoleh massa input sama dengan massa output yaitu 1908.9600 gram sedangkan input 1899.0949 gramHal ini tidak sama dengan teori karena kerja alat yang kurang maksimal, karena pada waktu percobaan bukaan valve 600 alat mengalami kerusakan yaitu karet pada motor penggerak putus.
B. Secara teori semakin besar konsentrasi reaktan maka nilai konversi reaksi yang dihasilkan akan semakin besar. Dengan hasil perhitungan sebagai berikut:
Pada bukaan valve 450
1. Untuk konsentrasi H2SO4 0,4 N pada reaktor I diperoleh:
-
waktu 0 menit konversi sebesar 18,2%-
waktu 5 menit konversi sebesar 20,5%-
waktu 10 menit konversi sebesar 22.34%-
waktu 15 menit konversi sebesar 30,5%sedangkan pada reactor II didapatkan konversi 18%
2. Untuk konsentrasi H2SO4 0,5 N pada reaktor I diperoleh: - waktu 0 menit konversi sebesar 37,8%
- waktu 10 menit konversi sebesar 86,9%
- waktu 15 menit konversi sebesar 97,3%
sedangkan pada reaktor II didapatkan konversi reaksi sebesar 13,45%
C. Secara teori hubungan antara konsentrasi H2SO4 dengan konversi adalah semakin besar konsentrasi asamsulfat (H2SO4), maka konversi semakin besar. Hal ini ditunjukkan pada persamaan :
K τ CAO= XA 1-XA Dimana :
CAo = Konsentrasi zat yang masuk (mol bahan yang masuk/volume feed) CA = Konsentrasi zat
XA = Konversi reaksi
2.10. Kesimpulan
- Dari data yang diperoleh dalam suatu percobaan massa yang masuk dalam reactor sama dengan massa yang keluar pada bukaan valve 450, sedangkan pada bukaan valve 600 massa yang masuk ke dalam reactor tidak sama dengan massa yang keluar dari reactor
APPENDIKS
II. Reaktor Ganda
1. Membuat larutan asam oksalat 0,2 N sebanyak 250 mL
Diketahui :N H2C2O4.2H2O = 0,2 N
BE H2C2O4.2H2O = 63
V =250 mL
Maka :
N
=
W
BE
×
1000
V
0,2
=
W
63
×
1000
250
W
=
3,15 gram
2. Membuat larutan NaOH 0,2 N sebanyak 1500 mL Diketahui :NNaOH = 0,2 N
BENaOH = 63
V =1500 mL
Maka :
N
=
W
BE
×
1000
V
0,2
=
W
63
×
1000
1500
W
=
11,994 gram
3. Membuat larutan H2SO4 0,4 N sebanyak 800 mL dari H2SO4 95%
Diketahui : H2SO4 = 1,84 gram/mL
BE H2SO4 = 49
N H2SO4 = 0,4 N
Maka :
N
=
ρ
×
%
×
1000
BE
=
1,84
×
95 %
×
1000
49
=
35,4795 N
V1 .N1 = V2. N2 800 . 0,4 = V2 . 35,4795
V2 = 9.0193 mL
4. Membuat larutan H2SO4 0,5 N sebanyak 800 mL dari H2SO4 95%
Diketahui : H2SO4 = 1,84 gram/mL
% H2SO4 = 95 %
BE H2SO4 = 49
N H2SO4 = 0,5 N
Maka :
N
=
ρ
×
%
×
1000
BE
=
1,84
×
95 %
×
1000
49
=
35,4795 N
V1 .N1 = V2. N2 800 . 0,5 = V2 . 35,4795
V2 = 11,2741 mL 5. Menghitung kalinrasi laju alir Volumetrik:
Diketahui : V = 250 mL t1 = 13,4s t2 = 13,3 s t3 = 13,4 s
trata-rata =
t1+ t2+ t3 3
trata-rata =
13,4 +13,3+13,4 3
trata-rata = 13,37 s Maka :
Q =
volume(mL)
waktu(s)
=
250 mL
13,37 s
= 6,2344 mL/s
b. Contoh perhitungan untuk bukaan golb valve 600 Diketahui : V = 250 mL
t1 = 11s t2 = 10,5 s t3 = 10,6 s
trata-rata =
t1+ t2+ t3 3
trata-rata =
11+10,5+10,6 3
trata-rata = 10,7 s Maka :
Q =
volume(mL)
waktu(s)
=
250 mL
10,7 s
= 23,3645 mL/s 6. Menghitung neraca massa reaktan
= 8.5684 mL
H2SO4 = 1,84 gram/mL
m H2SO4 = H2SO4 ¿ V H2SO4
= 1,84 ¿ 8,5684mL = 15.7659 gram
mol H2SO4 = W
BM
=
15,7659 98
= 0.1609 mol V H2O = (V
total – V H2SO4) mL V H2O = 800 mL – 8,5682 mL
= 791.4318 mL T H2O = 25 oC
H2O25∘C = 0,9971 gram/mL
Massa H2O = H2O ¿ V H2O
= 0,9971 gram/mL ¿ 791.4318 mL = 789.1366gram
Massa larutan H2SO4 = massa H2O + massa H2SO4 = 789.1366gram + 15.7659 gram = 804.9021gram
b. Untuk larutan NaOH 0,2 N 1500 mL bukaan globe valve45
Diketahui :V1 = 11,6 mL V2 = 11,2 mL V3 = 11,5 mL Vrata-rata =
V1+V2+V3 3
=
11,6+11,2+ 11,5 3
V1 . N1 = V2 .N2 10 . 0,2 = 11,43 . N2 N2 = 0,1749 N
N
=
W
BE
×
1000
V
0,1749
=
W
40
×
1000
1500
W
=
10.494 gram
mol NaOH =
W
BM
=
10.494 40
= 0,2610 mol
NaOH25∘C = 1,0082 gram/mL
V NaOH =
m
ρ
=
10.494
1,0082
= 10.4086 mL
T H2O = 25oC
H2O25∘C = 0,9971 gram/mL
V H2O = V
total– V NaOH mL V H2O = 1500 – 10.4086
= 1489,5914 mL
Massa H2O = H2O ¿ V
= 0,9971 gram/mL ¿ 1489,5914 mL = 1485,2715 gram
Massa larutan NaOH = massa H2O + massa NaOH = 1485,2715gram + 10,494 gram = 1495,7655gram
V2 = 29 mL
Vrata-rata =
V1+V2 2
=
29+27. 5 2
= 28,25 mL V1 . N1 = V2 .N2
10 . 0,1742 = 28.5 . N2
N2 = 0,0611 N
Volume campuran = V1 + V2 Volume campuran = V H2SO4 + V NaOH
= 800 mL + 1500 mL = 2300 mL
= 2,3 L N = mol ekivalen
V
Karena:
BE NaOH = BM NaOH
Maka:
mol ekivalen NaOH = mol NaOH
jadi:
mol = N ¿ V = 0,0611 ¿ 2,3 = 0,1405 mol
Persamaan reaksi : 2 NaOH + H2SO4 Na2SO4 + 2 H2O Mula-mula : 0,2610 0,0792 -
-Bereaksi : 0,12050,0119
Sisa : 0,14050,0673 0,01190,1205
8. menghitung konversi reaksi
Konversi reaksi akhir (XA2) =
mol H2SO4 yang bereaksi
mol H2SO4 awal ×100%
=
0,0119
0,0792
×
100
= 15,0252 % CA0= 0,0792 mol
CA2= 0,0673mol
Konsentrasi keluar Reaktor I pada waktu 15 menit :
CA0-CA1
k . C
A1 2 =
CA1-CA2
k . C
A22
CA0-CA1
C
A12 =
CA1-CA2
C
A22
0,0792-CA1
C
A12 =
CA1-0,0673 0,06732
CA13 − 0,0673 CA12 + 4.53 × 10-3 CA1 –36 × 10-5 = 0 Dengan trial diperoleh :
CA1 = 0.081 mol Konversi keluar reaktor I :
CA0-CA1
C
A12 =
XA1
CA0(1- XA1)2
0,1167 -0.081
(
0.081)
2 =XA1
0. 1167 (1- XA1)2
5,4412 =
XA1
0,1167 (1- XA1)2
0,6349(1- XA1)2 = XA1 0, 6349(XA12 - 2XA1 + 1) = XA
0, 6349XA12 – 1,2699 XA1 + 0,6349= XA1 0, 6349XA12 – 2,2699 XA1 + 0,6349= 0 XA12 – 3,5752XA1 + 1 = 0
XA1 = 0.305 = 30,5 %
9. Menghitung neraca Massa reaktan I
a. Untuk larutan H2SO4 0,4 N 95 % pada bukaan valve 600
V H2SO4 = 9,0192 mL ¿ 95 %
= 8,5684 mL
H2SO4 = 1,84 gram/mL
m H2SO4 = H2SO4 ¿ V H2SO4
= 1,84 ¿ 8,5684 mL = 15,7655 gram
mol H2SO4 = W
BM
=
15,7658 98
= 0,1609 mol V H2O = (V
total – V H2SO4) mL V H2O = 800 – 8,5684
= 808,5684 mL T H2O = 25 oC
H2O25∘C = 0,9971 gram/mL
Massa H2O = H2O ¿ V H2O
= 0,9971 gram/mL ¿ 808,5684 mL = 809,5655 gram
Massa larutan H2SO4 = massa H2O + massa H2SO4 = 809,5655gram + 15,7655 gram = 825,331 gram
b. Untuk larutan NaOH 0,2 N 1500 ml pada bukaan valve 450 Diketahui : V1 = 11,6 mL
V3 = 11,5 mL Vrata-rata =
V1+V2+V3 3
=11,6+11,2+ 11,5
3 = 11,43 mL V1 . N1 = V2 .N2 10 . 0,2 = 11,43 . N2 N2 = 0,1749 N
N
=
W
BE
×
1000
V
0,1749
=
W
40
×
1000
1500
W
=
10.494 gram
mol NaOH =
W
BM
=
10.494 40
= 0,2610 mol
NaOH25∘C = 1,0082 gram/mL
V NaOH =
m
ρ
=
10.494
1,0082
= 10.4086 mL
T H2O = 25oC
H2O25∘C = 0,9971 gram/mL
V H2O = V
total– V NaOH mL V H2O = 1500 – 10.4086
= 1489,5914 mL
Massa H2O = H2O ¿ V
Massa larutan NaOH = massa H2O + massa NaOH = 1485,2715gram + 10,494 gram = 1495,7655gram
10. Menghitung neraca massa produk untuk waktu pengambilan 15 menit Diketahui : V1 = 28,5 mL
V2 = 27 mL
Vrata-rata =
V1+V2 2
=
28,5+27 2
= 27,75 mL V1 . N1 = V2 .N2
10 . 0,1496 = 27,75 . N2
N2 = 0,0539 N
Volume campuran = V1 + V2 Volume campuran = V H2SO4 + V NaOH
= 800 mL + 1500 mL = 2300 mL
= 2,3 L N = mol ekivalen
V
Karena:
BE NaOH = BM NaOH
Maka:
mol ekivalen NaOH = mol NaOH
jadi:
mol = N ¿ V = 0,0539 ¿ 2,3 = 0,1239 mol
Persamaan reaksi : 2 NaOH + H2SO4 Na2SO4 + 2 H2O Mula-mula : 0,2610 0,1609 - -Bereaksi : 0,13710,0686
massa Na2SO4 terbentuk = (0,0686 mol) ¿ 142 = 9,7421 gram massa H2O terbentuk = (0,1371 mol) ¿ 18 = 2,4678 gram massa NaOH sisa = (0,1239 mol) ¿ 40 = 4,956 gram massa H2SO4 sisa = (0,0923mol) ¿ 98 = 9,0454 gram 11. Konversi reaksi
Konversi reaksi akhir (XA2) =
mol H2SO4 yang bereaksi
mol H2SO4 awal ×100%
=
0,0686
0,1609
×
100
= 42,6352 % CA0= 0,2610 mol
CA2= 0,1609mol
Konsentrasi keluar Reaktor I pada waktu 15 menit :
CA0-CA1
k . C
A1 2 =
CA1-CA2
k . C
A22
CA0-CA1
C
A12 =
CA1-CA2
C
A22
0,2610-CA1
C
A12 =
CA1-0,1609 0,16092
CA13 − 0,1609CA12 + 25,8 × 10-3 CA1 –675 × 10-5 = 0 Dengan trial diperoleh :
CA1 = 0.1mol
Konversi keluar reaktor I :
CA0-CA1
C
A12 =
XA1
CA0(1- XA1)2
0,2610 -0.1
(
0.1)
2 =XA1
0. 2610 (1- XA1)2
16,1 =
XA1
0,1167 (1- XA1)2
1,8789(1- XA1)2 = XA1 1,8789(XA12 - 2XA1 + 1) = XA
1,8789XA12 – 4,7578 XA1 + 1,8789= 0 XA12 – 2,5322XA1 + 1 = 0
dengan trial diperoleh : XA1 = 0,18 x 100%
= 18 %
Perhitungan Untuk Reaktor II
1. Menghitung Neraca Massa Reaktan
a. Untuk larutan H2SO4 0,4 N (tersedia 95 % ) bukaan globe valve 45
V H2SO4 = 9,0192 mL ¿ 95 %
= 8,5684 mL
H2SO4 = 1,84 gram/mL
m H2SO4 = H2SO4 ¿ V H2SO4
= 1,84 ¿ 8,5684mL = 15,7655 gram
mol H2SO4 = W
BM
=
15,7658 98
= 0,1609 mol
V H2O = (Vtotal – V H2SO4) mL
V H2O = 400 – 8,5684
= 391,4316 mL T H2O = 25oC
H2O25∘C = 0,9971 gram/mL
Massa H2O = H2O ¿ V H2O
= 0,9971 gram/mL ¿ 391,4316 mL = 390,2964 gram
= 406,0619 gram
massa H2SO4 dari reaktor I = (0,0001 mol) ¿ 98 = 0,0098 gram massa H2SO4 masuk = 0,0098 + 15,7655 = 15,7753 gram
mol H2SO4 masuk =
W
BM
=15,7753
98
= 0,1609 mol
b. Untuk larutan NaOH 0,2 N 1500 ml pada bukaan valve 600 Diketahui : V1 = 11,6 mL
V2 = 11,2 mL V3 = 11,5 mL Vrata-rata =
V1+V2+V3 3
=11,6+11,2+ 11,5
3 = 11,43 mL V1 . N1 = V2 .N2 10 . 0,2 = 11,43 . N2 N2 = 0,1749 N
N
=
W
BE
×
1000
V
0,1749
=
W
40
×
1000
1500
W
=
10.494 gram
mol NaOH =
W
BM
=
10.494 40
= 0,2610 mol
NaOH25∘C = 1,0082 gram/mL
V NaOH =
m
ρ
=
= 10.4086 mL
T H2O = 25oC
H2O25∘C = 0,9971 gram/mL
V H2O = V
total– V NaOH mL V H2O = 1500 – 10.4086
= 1489,5914 mL
Massa H2O = H2O ¿ V
= 0,9971 gram/mL ¿ 1489,5914 mL = 1485,2715 gram
Massa larutan NaOH = massa H2O + massa NaOH = 1485,2715gram + 10,494 gram = 1495,7655gram
2. Menghitung neraca massa produk untuk waktu pengambilan 15 meit Diketahui : V1 = 15 mL
V2 = 31 mL
Vrata-rata =
V1+V2
2
=
15+31 2
= 23 mL V1 . N1 = V2 .N2 10 . 0,1496 = 23 . N2 N2 = 0,0650 N
Volume campuran = V1 + V2 Volume campuran = V H2SO4 + V NaOH
= 400 mL + 1900 mL = 2300 mL
= 2,3 L N = mol ekivalen
V
maka, mol ekivalen NaOH = mol NaOH
jadi, mol = N ¿ V
= 0,0650 ¿ 2,3 = 0,1496 mol
Persamaan reaksi : 2 NaOH + H2SO4 Na2SO4 + 2 H2O Mula-mula : 0,2610 0,1609 - Bereaksi : 0.1114 0,0557
Sisa : 0,14960,10520,05570,1114
massa Na2SO4 terbentuk = (0,0557 mol) ¿ 142 = 7,9094 gram massa H2O terbentuk = (0,1114 mol) ¿ 18 = 2,0052 gram massa NaOH sisa = (0,1496 mol) ¿ 40 = 5,984 gram
massa H2SO4 sisa = (0,1052mol) ¿ 98 = 10,3096 gram 3. Menghitung konversi reaksi :
Konversi reaksi akhir (XA4) =
mol H2SO4 yang bereaksi
mol H2SO4 awal ×100%
=
0,0557
0,1609
×
100
= 34,6178 % CA2= 0,2610 mol
CA4= 0,1609 mol
Konsentrasi keluar Reaktor II :
CA2-CA3
k . C
A3 2 =
CA3-CA4
k . C
A42
CA2-CA3
C
A32 =
CA3-CA4
C
A42
0,2610-CA3
C
A32 =
CA3-0,1609 0, 16092
CA33 + 0,1609CA32 – 0,0258CA3+0,006756 = 0 Dengan trial diperoleh :
CA3= 0.0043 mol
CA2-CA3 C
A32 =
XA3
CA2(1- XA3)2
0,1405 -0,0043
(
0,0043)
2 =XA3
0,1405 (1- XA3)2
1345,9041 =
XA3
0,1405 (1- XA3)2
1345,9041 (1- XA3)2 = XA3 1345,9041 (XA22 - 2XA2 + 1) = XA2
1345,9041 XA22 – 2691,8082XA2 + 1345,9041 = XA2 1345,9041 XA22 – 2692,8082XA2 + 1345,9041 = 0 XA22 – 2,0007 XA2 + 1 = 0
dengan trial diperoleh : XA3 = 0.973 x 100%
DAFTAR PUSTAKA
1. Levenspiel, Octave, 1999. Chemical Reaction Engineering. Edisi ke-3, Jhon Wiley & Sons, New York
2. http://www.1-KESEIMBANGAN-KIMIA-1
3. http://www.che.ft-untirta.ac.id/download-center/category/13-teknik-reaktor? download=90%3Ateknik-reaktor-2
4. http://id.wikipedia.org/wiki/Reaktor_kimia