SELEKSIIN VITROPLANLET VANILI (Vanilla planifoliaAndrews) RESISTEN TERHADAP CEKAMAN KEKERINGAN
DENGANPOLY ETHYLENE GLYCOL(PEG) 6000
Oleh
Muhammad Sobran Jamil
ABSTRAK
Vanili (Vanilla planifoliaAndrews) merupakan tanaman budidaya yang
mempunyai nilai jual tinggi, sehingga masyarakat menyebutnya sebagai “Emas Hijau”. Salah satu masalah dalam budidaya vanili adalah kendala kekeringan yang berkepanjangan. Tanaman vanili sangat sensitif terhadap kekeringan, sehingga apabila vanili mengalami kekeringan dan tidak segera dibantu dengan air maka tanaman akan mati. Salah satu alternatif mengatasi kondisi cekaman kekeringan adalah pengembangan kultivarVanilla planifoliaAndrews dengan metode seleksiin vitroyaitu mengkulturkan eksplan dalam medium yang mengandungPoly Ethylene Glycol(PEG) konsentrasi selektif. PEG merupakan senyawa yang menstimulasikan keadaanstressdengan cara menurunkan potensial air. Tujuan dari penelitian ini adalah untuk mengetahui dan
menganalisis 1) konsentrasi PEG 6000 yang toleran untuk seleksi planlet vanili resisten cekaman kekeringan secarain vitro2) karakter ekspresi yang spesifik pada planlet vanili meliputi kandungan klorofil, indeks stomata, dan kandungan prolin. Penelitian ini dilaksanakan pada bulan Januari-Maret 2015 di
Laboratorium Botani (ruang penelitianin vitro), Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan faktor konsentrasi PEG yang terdiri dari lima taraf yaitu 0%, 5%, 10%, 15%, dan 20%. Analisis ragam dilakukan pada taraf nyata 5% dan uji lanjut dengan uji Beda Nyata Terkecil (BNT) pada taraf nyata 5%. Hasil penelitian ini menunjukkan bahwa konsentrasi PEG 6000 yang toleran terhadap cekaman kekeringan adalah 20%. Semakin meningkat konsentrasi PEG 6000 maka kandungan klorofil a, b dan total planlet vanili mengalami penurunan, sedangkan indeks stomata dan kandungan prolin meningkat.
SELEKSI IN VITRO PLANLET VANILI (Vanilla planifolia Andrews) RESISTEN TERHADAP CEKAMAN KEKERINGAN
DENGAN POLY ETHYLENE GLYCOL (PEG) 6000
Oleh
Muhammad Sobran Jamil
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar SARJANA SAINS
Pada Jurusan Biologi
Fakultas Matematika dan Ilmu Penmgetahuan Alam
UNIVERSITAS LAMPUNG BANDAR LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Bagelen 4, Kec. Gedong Tataan, Kab. Pesawaran 22 tahun silam
pada tanggal 26 Maret 1993 sebagai anak pertama dari tiga bersaudara, dari Bapak
Maryanto S.Pd, M.M. dan Ibu Ita Desmi Lestari S.Pd.
Penulis menempuh pendidikan dasar di SDN 1 Bagelen dan menyelesaikannya tahun
2005, pendidikan tingkat menengah hingga tahun 2008 di SMP Negeri 1 Gedong
Tataan. Kemudian penulis melanjutkan pendidikan di SMA Negeri 1 Gedong Tataan
dan menyelesaikannya tahun 2011. Pada tahun yang sama, penulis diterima sebagai
mahasiswa Jurusan Biologi FMIPA Universitas Lampung melalui jalur Seleksi
Nasional Masuk Perguruan Tinggi Negeri (SNMPTN).
Selama menempuh pendidikan di kampus penulis pernah mewakili Universitas
Lampung dalam Olimpiade Nasional (ON) MIPA bidang Biologi tingkat Regional
pada tahun 2013-2014. Penulis pernah menjadi asisten praktikum mata kuliah
Genetika, dan Botani Umum. Selain itu penulis juga aktif di dunia organisasi kampus.
Aktifitas organisasi penulis dimulai sejak menjadi Amar Rois FMIPA Unila dan
Anggota Muda Biologi (Amuba) tahun 2011–2012. Selanjutnya penulis pernah di Rohani Islam (Rois) FMIPA Unila sebagai kepala biro Dana dan Usaha, dan di
tahun 2012-2013. Penulis juga menjadi kepala bidang Sains dan Teknologi (Saintek)
Himbio FMIPA Unila pada tahun 2013-2014. Terakhir penulis menjadi Wakil
PERSEMBAHAN
Segala puji hanya milik ALLAH SWT, Dzat yang maha agung
yang memberikan kenikmatan sehingga karya ini dapat
terselesaikan, dengan mengharap Ridho dan Magfiroh dari
Allah SWT maka karya ini ku persembahkan kepada :
Bapak dan Ibu yang selalu kusayangi, yang telah memberikan
cinta dan kasih sayangnya serta doa yang tak putus-putusnya,
memberikan dukungan moril dan materil, menjadi teladan yang
baik bagi pribadi ini, serta menjadi pengajar sepanjang
hayatku.
Kedua adiku yang selama ini membuat hari-hariku menjadi
lebih berwarna dan terus memotivasiku untuk berkarya dan
menuntaskan studiku
Para guru dan dosen yang telah medidik dan mengajariku
hingga hari ini dengan dedikasi dan keikhlasanya
Sahabat-sahabatku, rekan-rekan seperjuanganku para penyeru
kebaikan, yang selalu menjadi penyemangat, yang banyak
memberikan pengalaman berharga, yang selalu menguatkan
dan mengajarkan arti perjuangan serta persaudaraan.
Moto
“
Raih Hasil Terbaik dengan
Perjuangan Terbaik
”
“Isyhadu bi Anna Muslim”
“Manusia yang paling dicintai Allah
adalah yang paling bermanfaat
iii
SANWACANA
Segala puji hanya milik Allah S.W.T atas limpahan rahmat dan hidayah-Nya , limpahan karunia serta limpahan nikmat-Nya yang tak terhitung hingga hari ini
penulis dapat menyelesaikan Skripsi yang berjudul
“SeleksiIn VitroPlanlet Vanili (Vanilla planifoliaAndrws) Resisten
Terhadap Cekaman Kekeringan denganPoly Ethylene Glycol(PEG) 6000”. Shalawat teriring salam semoga tercurahkan kepada Rasulullah SAW beserta keluarga dan sahabat serta umatnya di akhir zaman,Aamiin.
Teriring doa nan ikhlasjazaakumullah khaiiran katsir,penulis mengucapkan terima kasih kepada :
1. Ibu Dr. Endang Nurcahyani, M.Si. selaku Pembimbing Utama yang telah membimbing penulis dengan penuh kesabaran, memberikan arahan, saran, dan motivasi dalam membimbing penulis dalam penelitian hingga
terselesainya skripsi ini.
2. Bapak Ir. Zullkifli, M.Sc. selaku pembimbing kedua atas dedikasi, arahan,
saran dan semangat kepada penulis selama pelaksanaan penelitian hingga terselesainya skripsi ini.
3. Ibu Dra. Martha Lulus Lande M.P. selaku Pembahas atas segala bimbingan,
4. Ibu Dr. Herawati Soekardi M.S. selaku Pembimbing Akademik atas
bimbingan, kritik, dan sarannya kepada penulis dalam menempuh pendidikan di Jurusan Biologi.
5. Kepala Laboratorium Botani, Jurusan Biologi FMIPA Unila beserta seluruh staf teknisi, yang telah memberikan izin, fasilitas, dan bantuannya selama penulis melakukan penelitian.
6. Dekan FMIPA Universitas Lampung dan Ketua Jurusan Biologi FMIPA Universitas Lampung
7. Bapak Ibu Dosen yang tidak dapat penulis sebutkan satu-persatu, terimakasih atas bimbingan dan ilmu yang sudah diberikan selama penulis melaksanakan studi di Jurusan Biologi.
8. Syukur penulis dan doajazakumullah khaiiran katsir Bapak Maryanto S.Pd., M.M., dan Ibu Ita Desmi Lestari S.Pd yang telah memberikan kasih sayang,
semangat, perhatian, dukungan, dan do’a kepada penulis yang tiada hentinya.
Semoga Allah membalas denganjannah-Nya kelak.Aamiin ya Rabbal Alamiin
9. Adiku Hammam Sobhi Albarra dan Zahra Yulia yang memberikan keceriaan dan dukungan sepanjang hari-hari penulis hingga penulis bisa menyelesaiikan skripsi ini.
10. Rekan kerja penelitian Adi Irawan, Eka Susilowati, Christiana Eka Isharnani, mbak Linda dan mbak Rita. Terimakasih atas semangat, dukungan, canda
11. Sahabat dan rekan-rekan penyeru kepada Allah yaitu Ali Akbar Hasibuan,
Irkham Bariklana, Ade Pamungkas, Wahyudi Pangestu, Ari Susanto, Shintha Yunia Ulfa, Rizki Yara Exsa Narvinda terimakasih atas persaudaraan atas
dasar ukhuwah yang terjalin hingga saat ini. Semoga Allah melimpahkan kebaikan kepadaantum wa antunna.
12. Kakak Tri Julian Muhar, Ahmad Khairuddin Syam, Achmad Triadi Nurul
Adha, Sakban, Rido Septadinata. Mbak Hapin Afriani Serta adik Suyitno, Budi, Herulloh, Muzahid, Anwar, Rizal, Wahyudi, Sabrina, Nurul, Meisitha,
Citra, Dicky, Dibyo, Dian, Dzarkoni, Affan atas dukungannya selama ini. 13. Rekan-rekan seperjuanganku di Himbio FMIPA Unila, Rois FMIPA Unila,
BEM FMIPA Unila yang telah banyak mengembangkan potensi dan selalu
menjadi penyemangat di hari-hariku dan selalu menyegarkan langkah dalam perjuangan ini.
14. Rekan-rekan Presidium BEM FMIPA Unila 2014-2015 Irkham Bariklana,
Shintha Yunia Ulfa, Rizki Yara Exsa Narvinda, Pimpinan BEM Kabinet Sinergis, Aspiratif, dan Profesional Aldino, Nurul, Dini, Edi, Audina, Ima,
Tazkia, Nengah, Bayu, Dona, Tami, Andi, Febita, Ridho, Wulan, Naelul, Fifi, Luna, Budi, Citra, Aas, Sepria, Isna, Gazia dan semua pengurus atas waktu, kebersamaan, keceriaan dan kekeluargaan kita.
15. Teman-teman Biologi 2011 Robith, Rangga, Agung, Dany, Wendy, Anggi, Fadil, Iyan, Ori, Isro, Umi, Dwi, Tiara, Dewi, Rila, Fenida, Agra, Melinda,
Suci, Ariani, Ria, Nindi, Hani, Aysca, Diah terimakasih atas dukungan dan
semangat yang sudah diberikan kepada penulis.
16. Kakak tingkat 2009, 2010 serta adik-adik tingkat angkatan 2012, 2013, dan
2014 yang selalu memberikan semangat dan dukungan kepada penulis. 17. Almamater tercinta
Penulis menyadari bahwa dalam penulisan skripsi ini masih terdapat kekurangan dan kesalahan, untuk itu penulis mengharapkan kritik dan saran yang membangun
demi perbaikan penulisan di masa datang. Akhir kata, penulis berharap semoga tulisan ini dapat bermanfaat dan berguna bagi banyak pihak.
Bandar Lampung, Juli 2015 Penulis
iv
DAFTAR TABEL
Halaman Tabel
1. Tata Letak Satuan Percobaan ... 23
2. Persentase Jumlah Planlet Hidup ... 33
3. Persentase dan Visualisasi Planlet ... 33
4. Kandungan Klorofil a Planlet Vanili ... 37
5. Kandungan Klorofil b Planlet Vanili ... 39
6. Kandungan Klorofil Total Planlet Vanili ... 40
7. Indeks Stomata Daun Planlet Vanili ... 46
8. Kandungan Prolin Planlet Vanili ... 49
9. Komposisi medium Murashige and skoog ... 63
10. Analisis RagamSingle FactorKandungan Klorofil a, b, total Daun Planlet Vanili ... 64
11. Analisis RagamSingle FactorIndeks Stomata Daun Planlet Vanili ... 65
v
DAFTAR GAMBAR
Halaman Gambar
1. Produksi Vanili Indonesia di Level Internasional ... 11
2. Metabolisme Prolin pada Tumbuhan Arabidopsis ... 19
3. Bagan Alir Penelitian ... 24
4. Pertumbuhan Planlet Vanili pada Minggu kelima ... 35
5. Permukaan Bawah Daun Planlet Vanili ... 45
6. Diagram Batang Perbandingan Kandungan Klorofil a ... 67
7. Diagram Batang Perbandingan Kandungan Klorofil b ... 67
8. Diagram Batang Perbandingan Kandungan Klorofil total ... 67
9. Diagram Batang Perbandingan Indeks Stomata ... 68
10. Diagram Batang Perbandingan Kandungan Prolin ... 68
11. Grafik Linear Kandungan Klorofil a ... 69
12. Grafik Linear Kandungan Klorofil b ... 69
13. Grafik Linear Kandungan Klorofil total ... 69
14. Grafik Linear Indeks Stomata ... 70
15. Grafik Linear Kandungan Prolin ... 70
16. Planlet Vanili ... 71
17. Pembuatan Medium Seleksi MS ... 71
18. Sterilisasi Medium dan Alat-alat Penelitian ... 71
19. Pembuatan Konsentrasi Larutan PEG 6000 ... 72
20. Pengkulturan Planlet Vanili ... 72
21. Penataan Letak Planlet Vanili dalam Lemari Inkubasi ... 72
22. Penimbangan Daun Planlet Analisis Klorofil ... 73
23. Pembuatan Ekstraksi Daun Planlet Vanili ... 73
24. Larutan Ekstraksi Daun Planlet Vanili ... 73
25. Uji Kandungan Klorofil ... 74
26. Pengerjaan analisis kandungan klorofil ... 74
27. Pengerjaan Analisis Kandungan Prolin... 74
28. Larutan Prolin Planlet Vanili... 75
29. Uji Spektrofotometer Kandungan Prolin ... 75
30. Perendaman Daun Planlet Vanili pada Kloralhidrat Uji Indeks Stomata ... 75
31. Pengamatan Stomata Daun Planlet Vanili ... 76
ii
DAFTAR ISI
Halaman
HALAMAN PENGESAHAN ... i
DAFTAR ISI ... ii
E. Respon Tumbuhan Terhadap Cekaman Kekeringan ... 14
iii
D. Bagan Alir Penelitian ... 23
E. Pelaksanaan Penelitian ... 24
1. Persiapan Medium Tanam ... 24
2. Persiapan Medium Seleksi ... 25
3. Penanaman Planlet dalam Medium Seleksi PEG 6000 ... 26
4. Pengamatan ... 26
a. Persentase Jumlah Planlet Hidup ... 26
b. Visualisasi Planlet ... 26
c. Analisis Kandungan Klorofil ... 27
d. Analisis Indeks Stomata ... 28
e. Analisis Kandungan Prolin ... 28
f. Analisis data ... 30
IV. HASIL DAN PEMBAHASAN ... 31
A. Persentase Jumlah Planlet Hidup dan Visualisasi Planlet ... 32
B. Kandungan Klorofil ... 36
a. Kandungan Klorofil a ... 37
b. Kandungan Klorofil b ... 38
c. Kandungan Klorofil total ... 40
C. Indeks Stomata ... 43
D. Kandungan Prolin ... 48
V. SIMPULANDAN SARAN ... 53
A. Kesimpulan ... 53
B. Saran ... 53
DAFTAR PUSTAKA ... 54
1
I. PENDAHULUAN
A. Latar Belakang dan Masalah
Vanili (Vanilla planifolia Andrews) merupakan salah satu tanaman rempah yang memiliki kandungan flavor, sehingga menyebabkan vanili mempunyai nilai ekonomi yang cukup tinggi. Indonesia merupakan salah satu negara
penghasil vanili terbesar di dunia. Sentra produksi vanili di Indonesia terdapat di Sumatra Utara, Lampung, Jawa Barat, Jawa Timur, Bali , Nusa Tenggara
Barat, Nusa Tenggara Timur, Sulawesi Utara, Sulawesi Tengah, dan Sulawesi Selatan (Ruhnayat, 2004).
Vanili mempunyai flavor yang dihasilkan dari transformasi enzimatik yang
terjadi selama proses pengeringan. Hidrolisis senyawa glikosida oleh enzim
β-gluko-sidase menjadi aglikon yang memiliki aktivitas flavor
(Setyaningsih et al., 2006)
Vanili memiliki beberapa fungsi antara lain mempunyai antioksidan alami yang membuat fungsi otak lebih tajam dalam bekerja, anti inflamasi, menjaga kesehatan fungsi saraf, menyebabkan sistem saraf bekerja lebih optimal, aroma
dari vanili dapat membantu otak untuk lebih rileks sehingga dapat meredakan stress, membantu mengurangi keluhan pada awal kehamilan, dan meringankan
2
Menurut Ashari (2006) polong vanili Indonesia mempunyai nilai jual yang tinggi, dan Indonesia memiliki potensi yang begitu besar akan perkebunan
membuat vanili menjadi salah satu komoditi ekspor yang dapat memberikan keuntungan besar bagi petani dan pengelola perkebunan.
Vanili di Indonesia sering mendapatkan kendala kekeringan yang
berkepanjangan (Daryanti et al., 2014). Tanaman vanili sangat sensitif terhadap kekeringan. Apabila vanili mengalami kekeringan dan tidak segera dibantu dengan air maka tanaman akan mati yang disebabkan oleh pangkal
batang yang terputus akibat rusaknya akar (Tombe et al., 2004).
Curah hujan di Lampung sejak tahun 1990-an cenderung menurun yang berhubungan dengan peristiwa El Nino menjadikan Lampung memiliki pola
hujan musiman, musim kering, dan musim hujan. Sebagian besar hujan yang terjadi, dibawah rata-rata sehingga tidak dapat memenuhi kebutuhan air untuk
pertanian (Manik et al., 2014)
Penggunaan varietas unggul yang tahan terhadap cekaman kekeringan merupakan salah satu alternatif mengatasi kondisi iklim yang berubah-ubah. Pengembangan kultivar Vanilli planifolia Andrews dapat dilakukan dengan
metode seleksi in vitro yaitu mengkulturkan eksplan dalam medium yang mengandung Poly Ethylene Glycol (PEG) konsentrasi selektif (Krizek,1985)
Seleksi ketahanan terhadap kekeringan dapat dilakukan dengan menggunakan
PEG. Cekaman kekeringan pada tanaman dengan mengurangi potensial air tanpa menyebabkan keracunan dapat dilakukan melalui induksi PEG dengan
3
menginduksi dan berkorelasi positif dengan yang terjadi di lapang maupun rumah kaca (Short et al.,1987). Pendekatan dengan seleksi in vitro dilaporkan
telah menghasilkan varietas tanaman resisten terhadap cekaman kekeringan diantaranya pada nilam (Djazuli, 2010), padi gogo (Lubis et al, 2007), kacang tanah (Yudiwanti et al., 2008), dan jagung (Badami dan Amzeri, 2010).
Poly Ethylene Glycol dapat digunakan sebagai komponen penyeleksi yang
dapat mensimulasikan cekaman lingkungan (Savitri, 2010). Penggunaan PEG 6000 dapat digunakan untuk menyeleksi tanaman yang peka terhadap cekaman
kekeringan baik dalam medium cair maupun medium padat (Savitri, 2010). PEG digunakan untuk mengidentifikasi varian somaklonal yang toleran
terhadap kekeringan (Badami dan Amzeri, 2010). PEG dalam medium dapat menurunkan proliferasi dan pertumbuhan jaringan eksplan dan regenerasi tunas (Kong et al., 1998), sehingga perkembangan dan pertumbuhan embrio
somatik sekunder dapat dihambat dengan medium selektif yang diberi PEG (Badami dan Amzeri, 2010). PEG mempunyai kemampuan untuk menurunkan
potensial air, yang diharapkan sebagai kondisi selektif untuk mengetahui respon jaringan yang ditanam terhadap stress kekeringan serta mengisolasi sel atau jaringan varian yang mempunyai toleransi terhadap stress (Badami dan
Amzeri, 2010).
Sejauh ini belum pernah dilakukan penelitian untuk mendapatkan kandidat planlet Vanili (Vanilla planifolia Andrews) yang tahan terhadap cekaman
4
tahan terhadap cekaman kekeringan, dengan demikian diharapkan akan meningkatkan kembali kualitas dan produksi tanaman vanili di Indonesia.
B. Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mengetahui konsentrasi Poly Ethylene Glycol 6000 yang toleran terhadap cekaman kekeringan untuk seleksi planlet vanili secara in vitro
2. Mengetahui dan menganalisis karakter ekspresi spesifik pada planlet vanili yang mengalami cekaman kekeringan meliputi kandungan klorofil, indeks
stomata, dan kandungan prolin.
C. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai penggunaan Poly Ethylene Glycol untuk mendapatkan planlet vanili yang
resisten terhadap cekaman kekeringan secara in vitro. Planlet yang resisten terhadap cekaman kekeringan diharapkan dapat memberikan kontribusi bagi
pengembangan ilmu pengetahuan terutama di bidang pemuliaan tanaman, dan ilmu terapan yang terkait.
D. Kerangka Pikir
5
negara dengan tingkat produksi vanili terbesar kedua setelah Madagascar (Anonymous, 2014).
Indonesia tidak memanfaatkan langsung vanili menjadi bahan jadi melainkan diekspor ke negara-negara lain, dan tingginya permintaan Internasional akan vanili membuat vanili menjadi tanaman yang dipertimbangkan sebagai
tanaman budidaya yang menguntungkan.
Dalam hal budidayanya vanili mempunyai hambatan-hambatan diantaranya
tanaman ini tidak dapat tahan dengan cekaman abiotik atau kondisi kekeringan di lingkungannya. Apabila vanili mengalami kekeringan dan tidak segera dibantu dengan air maka tanaman akan mati yang disebabkan oleh pangkal
batang yang terputus akibat rusaknya akar (Tombe et al., 2004)
Lampung merupakan salah satu daerah dengan curah hujan yang cenderung
menurun setiap tahunnya. Pola hujan musiman, musim kering dan musim hujan masih terjadi. Sebagian besar hujan di Lampung tidak dapat memenuhi
kebutuhan air untuk pertanian yang disebabkan hujan jatuh dibawah rata-rata (Manik et al., 2014). Curah hujan yang cenderung menurun setiap tahunnya, menyebabkan vanili yang dibudidayakan dapat terpengaruh sehingga
diperlukan solusi untuk pemecahannya.
Seleksi in vitro planlet dengan menggunakan PEG 6000 merupakan salah satu cara yang dapat digunakan untuk mengembangkan kultivar vanili yang resisten
6
Planlet yang dapat tumbuh dalam medium yang mengandung PEG 6000 dengan berbagai konsentrasi diduga akan mampu bertahan dalam kondisi
alaminya di lingkungan yaitu kondisi kekeringan.
Poly Ethylene Glycol (PEG) merupakan senyawa yang dapat menstimulasikan keadaan stress dengan menurunkan potensial air yang ada di lingkungan
sehingga berhubungan dengan penurunan tekanan hidrostatis dalam sel (Oertli, 1985).
Setelah didapatkan planlet yang mampu tumbuh dalam medium yang mengandung PEG 6000, dilakukan karakterisasi dengan menganalisis
kandungan klorofil, indeks stomata dan prolin.
E. Hipotesis
Hipotesis pada penelitian ini adalah :
1. Terdapat konsentrasi Poly Ethylene Glycol 6000 yang toleran terhadap cekaman kekeringan untuk seleksi planlet vanili secara in vitro
2. Adanya karakter ekspresi yang spesifik pada planlet vanili yang
7
II. TINJAUAN PUSTAKA
A. Tanaman Vanili
Vanili merupakan tanaman monokotil, tanaman ini berakar serabut, akar keluar
dari setiap buku. Akar yang berada di dalam tanah memiliki bentuk bercabang-cabang, berbulu halus serta tersebar di sekitar permukaan tanah. Akar yang berada didalam tanah berfungsi menyerap unsur hara dan air sedangkan akar
yang keluar dari buku buku yang disebut sebagai akar lekat (Ruhnayat, 2004).
Batang vanili berbuku-buku, silindris dengan permukaan licin dan diameter 1–2 cm. Batang vanili memiliki warna hijau, mempunyai ruas dan buku, tidak
dapat menegakkan batangnya sendiri dan memerlukan tonggak atau pohon untuk tempat melekat (Ruhnayat, 2004; Agasiswanto, 2015).
Daun vanili berbentuk jorong sampai lanset dengan panjang sekitar 8–25 cm dan lebar 2–8 cm, ujung daun meruncing, pangkal daun membulat dan tepi
daun rata. Daun vanili adalah daun tunggal dengan letak berselang-seling di masing-masing ruasnya. Daun vanili merupakan daun sukulen, memiliki warna
8
setelah daun tersebut tua atau mengering, sedangkan pada waktu daun masih
muda tulang daun tidak jelas terlihat (Zuhdi, 2015).
Bunga vanili berwarna hijau kekuningan, dengan diameter 10 cm. Bunga vanili keluar dari ketiak daun, bunga bersifat hermaprodit, tangkai bunga sangat pendek. Bunga vanili tidak mampu melakukan penyerbukan sendiri dikarenakan
kepala putik tertutup oleh lamela bunga secara keseluruhan, sehingga harus dibantu penyerbukannya (Mochtar, 2012).
Buah vanili berbentuk polong dengan tangkai yang pendek memiliki diameter
5–15 cm dengan panjang 10–25 cm, permukaan buah licin, buah yang kering akan beraroma karena kandungan vanillin didalamnya. Bunga vanili memiliki putik yang berisi cairan perekat, sehingga bila tepung sari diletakkan akan segera
menempel dan terjadi pembuahan (Ruhnayat, 2004). Buah vanili jika dibiarkan masak dipohon maka buah akan pecah menjadi dua bagian dan menghasilkan
aroma vanili (Vickly, 2015).
Vanilla planifoliaAndrews merupakan salah satu tanaman dari keluarga Orchidaceae yang buahnya bernilai ekonomi tinggi dan saat ini telah
berkembang di Indonesia (Rosman, 2005) Tanaman vanili merupakan salah satu
tanaman budidaya di Indonesia. Selain di Indonesia ada negara-negara lain yang membudidayakannya seperti Madagaskar, Meksiko, Pulau Seychelles, Pulau
9
Indonesia memiliki daerah pengembangan vanili meliputi Sumatera, Jawa, Bali,
Nusa Tenggara, Kalimantan, Sulawesi, dan Maluku. Dengan sentra produksinya yaitu Lampung, Sumatera Utara, Jawa Barat, Jawa Timur, Bali, Nusa Tenggara
Barat, Nusa Tenggara Timur, Sulawesi Utara, Sulawesi Tengah dan Sulawesi Selatan (Ruhnayat, 2004). Vanili memiliki kromosom berjumlah 2n atau sama dengan 32 (Ashari, 2006). Negara asal vanili adalah Meksiko, dan tanaman vanili
dikenal oleh orang-orang Indian di Meksiko (Tjahjadi, 1989)
Tanaman Vanili termasuk kedalam familia Orchidaceae yang terdiri dari 700 genus dan 20.000 species. Familia Orchidaceae merupakan tumbuhan yang
dapat hidup epifit atau terestrial dan kadang-kadang memanjat tumbuhan ini merupakan tumbuhan herba perenial. Kelompok tumbuhan ini memiliki
beberapa marga yang salah satunya adalahVanilla(Dasuki, 1991).
Tanaman vanili diklasifikasikan sebagai berikut.
Divisio : Spermatophyta
Classis : Angiospermae
Subclassis : Monocotyledonae
Ordo : Orchidales
Familia : Orchidaceae
Genus : Vanilla
Species :Vanilla planifoliaAndrews
10
Tanaman vanili tumbuh pada tanaman lain sebagai naungan dengan naungan
yang tidak terlalu lebat sehingga mendapatkan cahaya yang tidak terlalu terik (Tjahjadi, 1989). Tanaman ini dapat tumbuh dengan baik pada dataran rendah
dengan tipe iklim panas dan lembab dengan suhu udara berkisar 21-32oC (Ashari, 2006)
B. Nilai Ekonomi Vanili
Di pasar internasional vanili Indonesia dikenal dengan sebutanJava Vanilla Beans.Vanili dapat memberikan keuntungan yang cukup besar karena harganya
yang cukup mahal (Ruhnayat, 2004). Vanili merupakan salah satu komoditas ekspor dengan nilai ekonomi yang tinggi (Firman, 2008). Kualitas vanili ditentukan oleh kadar vanillin dalam vanili olahannya (Sujalmiet al., 1999).
Menurut Tjahjadi (1989) Vanili di Indonesia memiliki kandungan vanillin sebesar 2,75%. Polong vanili digunakan sebagai pengharum rasa pada coklat, es
krim, biskuit, dan manisan (Ashari, 2006). Harga polong atau buah vanili basah di pasar dalam negeri saat ini berkisar Rp. 150.000–Rp. 200.000 per kg dan polong kering berkisar Rp. 1.500.000–2.000.000 (Mochtar, 2012). Vanili
umumnya dimanfaatkan sebagai penyedap aroma makanan, bahan baku es cream, sirup maupun kosmetik (Tjahjadi. 1989). Vanili merupakan komuditas
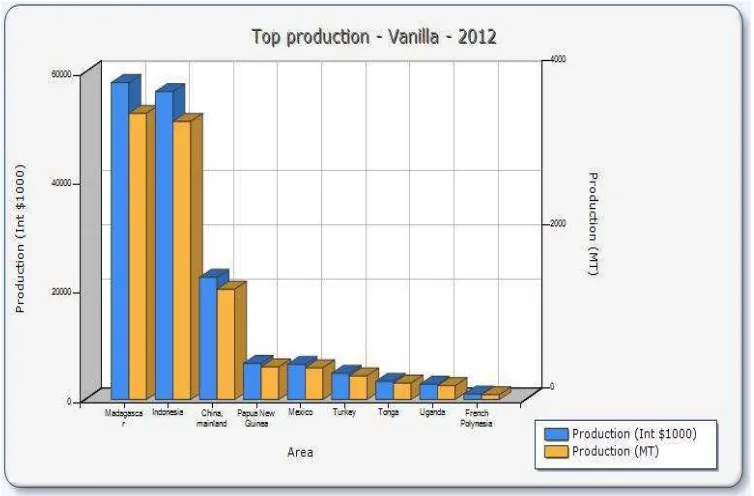
Produksi vanili Indone
Indonesia menurut Anonymous (2014) disajikan da
oduksi vanili Indonesia di level Internasional (Anon
mous (2014) produksi vanili Indonesia di level ngkat kedua setelah Madagaskar. Potensi Indon bunan membuat vanili menjadi salah satu kom
kan keuntungan besar bagi petani dan pengelola p ndonesia yang mempunyai nilai jual tinggi denga
n 1,5–3%, minyak campuran 11% dan minyak resi enurut Tjahjadi (1989) polong vanili memiliki hal ini mengindikasikan baiknya kondisi polong
hingga menyebabkan produksi vanili di Indonesi di dunia. Hal ini dipertegas lagi dengan keguna
12
dunia Internasional yaitu sebagai penyedap aroma makanan, bahan baku es
cream, sirup maupun kosmetik (Tjahjadi, 1989).
C. Cekaman Kekeringan
Salah satu hambatan dalam budidaya vanili adalah kekeringan. Lampung merupakan daerah tropis dengan kondisi curah hujan yang cenderung menurun
setiap tahunnya, hal ini berhubungan dengan El Nino. Pola hujan musiman, musim kering, dan musim hujan masih terjadi di Lampung, dan sebagian besar
hujan tidak dapat memenuhi kebutuhan air untuk pertanian (Maniket al., 2014). Kondisiglobal warmingmenyebabkan terjadinya perubahan iklim yang
berpengaruh terhadap perubahan musim. Musim kemarau yang berkepanjangan
dapat diakibatkan oleh perubahan iklim yang dapat menurunkan ketersediaan air dalam tanah, sehingga memberikan dampak kekurangan air pada lahan pertanian
(Nio Song dan Lenak., 2014).
Cekaman kekeringan mempunyai pengertian kondisi minimum kadar air tanah yang berdampak pada pertumbuhan dan kondisi tanaman (Purwanto dan
Agustono, 2010) Cekaman kekeringan dapat menyebabkan perubahan pada metabolisme. Adaptasi pada tanaman akan kekeringan menyebabkan berbagai rangkaian fisiologis, biokimia dan respon molekular pada tanaman (Kalefetoglu
dan Ekmekci, 2005). Pertumbuhan pada tanaman akan terbatasi dengan adanya kondisi kekeringan (Jiang dan Huang, 2001). Tanaman selalu membutuhkan air
13
kebutuhan air melalui penyerapan oleh akar. Air yang diserap oleh akar tanaman
bergantung pada kemampuan partikel tanah menahan air dan kemampuan akar untuk menyerapnya (Jumin, 1992). Menurut Karti (2004) berkurangnya suplai
air akan menyebabkan penurunan turgor pada sel daun sehingga menyebabkan penurunan luas daun hingga menutupnya stomata yang menyebabkan
menurunya proses fotosintesis.
D. Poly Ethylene Glycol(PEG)
Menurut Boulsmanet al.,(1984)dalamLestari dan Mariska (2006) menyatakan bahwa dalam penentuan galur yang tahan terhadap kekeringan akan mengalami
kesulitan apabila dilakukan dilapangan. Hal ini dikarenakan sulit untuk mendapatkan kondisi lahan yang mempunyai tingkat kekeringan seragam dan
luas, diperlukan waktu yang lama dan biaya yang lebih mahal. Sehingga digunakan cara yang lebih efektif dan efisien yaitu menstimulasikan keadaan stress. Untuk menstimulasi keadaanstressdi alam dapat digunakanPoly
Ethylene Glycol(PEG), dikarenakan PEG dapat menstimulasikan keadaanstress dengan menggunakan potensial air yang ada di lingkungan sehingga
berhubungan dengan penurunan tekanan hidrostatis dalam sel (Oertli, 1985). PEG yang dilarutkan dalam air dapat menurunkan potensial air dengan cara menarik molekul air (H2O) menuju atom oksigen pada subunit etilen oksida
melalui ikatan hidrogen (Odeet al.,2012) Menurut Salisbury dan Ross (1992) potensial air merupakan kemampuan air untuk melakukan difusi yang
14
tumbuhan. Senyawa PEG juga bersifat larut dalam air dan dapat menyebabkan
penurunan potensial air yang homogen. Berat molekul dan konsentrasi PEG mempengaruhi penurunan potensial air (Kaufmann dan Eckard, 1971). Ukuran
molekul dan konsentrasi PEG dalam larutan menentukan besarnya potensial osmotik yang terjadi (Rahayuet al.,2005 ). Menurut Michel dan Kaufmann (1973)dalamRahayuet al.,(2005) larutan PEG 6000 dengan konsentrasi 5%
mempunyai potensial osmotik–0,13 MPa (1,26 bar), sedangkan konsentrasi 20% mempunyai potensial osmotik–0,71 MPa (7,06 bar). Untuk tanah dalam
kondisi kapasitas lapang mempunyai potensial osmotik 0,33 bar dan dalam kondisi titik kelembapan kritis (koefisien layu) mempunyai potensial osmotik 15
bar.
E. Respon Tumbuhan Terhadap Cekaman Kekeringan
Kekurangan air berpengaruh terhadap aspek pertumbuhan tanaman, meliputi proses fisiologis, biokimia, anatomi dan morfologi. Pada saat tumbuhan
kekurangan air, sebagian stomata daun menutup sehingga terjadi hambatan masuknya CO2dan menurunkan aktivitas fotosintesis. Selain menghambat
aktivitas fotosintesis, kekurangan air juga menghambat sintesis protein dan dinding sel (Salisbury dan Ross, 1992)
Tumbuhan dapat merespon keadaan lingkungan tumbuhnya. Menurut Kalefetoglu dan Ekmekci (2005) Cekaman kekeringan dapat menyebabkan
15
pada tanaman. Cekaman kekeringan yang parah dapat menyebabkan penutupan
stomata sehingga pengambilan karbondioksida dan produksi berat kering berkurang (Purwanto dan Agustono, 2010). Menurut Jian (2011) Cekaman
osmotik mengaktifkan beberapa protein kinase termasuk mitogen actived kinase yang dapat memediasi homeostatis osmotik dan memberikan tanggapan
detosifikasi. Sejumlah sistem fosfolipid diaktifkan olehstressosmotik sehingga
menghasilkan beragam molekul messenger, osmotik protein kinase berfungsi aktifnya hulustress.
Menurut Levitt (1980)dalamPalupi dan Dedywiryanto (2008) mekanisme
ketahanan tanaman terhadap cekaman kekeringan adalah dengan cara
menghindari kekeringan (drought avoidance) yaitu tanaman mempertahankan status air dalam jaringan agar metabolisme tetap berjalan dan toleransi terhadap
kekeringan (drought tolerance) dimana tanaman tetap dapat melangsungkan metabolismenya pada kondisi status air yang rendah.
Pada tumbuhan salah satu cara yang dapat dilakukan yaitu menghindari kekeringan. Mekanisme ini terjadi pada tumbuhan monokotil yang dilakukan
dengan cara penggulungan daun. Penggulungan daun terjadi dengan cara menurunkan laju evaporasi atau dengan meningkatkan absorpsi air pada tanah
kering untuk mempertahankan potensial air daun tetap tinggi. Proses ini berhubungan dengan peranan sel kipas yang mana pada saat kekurangan air jumlah dan ukuran sel kipas meningkat sehingga daun menggulung (Nio Song
16
Mekanisme lainnya adalah toleransi terhadap cekaman kekeringan yang biasa digunakan dengan cara menyeleksi tanaman secarain vitro. Tanaman hasil
seleksi mempunyai akumulasi prolin yang meningkat (Badami dan Amzeri, 2011)
F. Stomata
Stomata merupakan celah dalam epidermis yang dibatasi oleh sel penutup. Sel
penutup mengatur pelebaran dan penyempitan celah. Terdapat sel tetangga pada stomata yaitu sel yang mengelilingi stomata. Sel ini berperan dalam perubahan osmotik yang menyebabkan gerakan sel penutup dalam mengatur lebar celah
(Estiti, 1995).
Stomata pada umumnya terdapat pada permukaan bawah daun, tetapi pada beberapa species tumbuhan stomata berada di permukaan atas dan bawah daun.
Tipe stomata dibedakan menjadi empat yaitu anomositik, anisositik, parasitik, dan diastik (Lakitan, 1993). Letak atau kedudukan stomata terhadap sel tetangga, arah membukanya stomata, bentuk stomata, jumlah sel epidermis dan stomata,
jarak antar stomata dan panjang sel epidermis pada setiap jenis tumbuhan dapat berbeda-beda (Rompaset al., 2011).
Menurut Fahn (1991) stomata dikelilingi 4 sel tetangga yang tersususun teratur
membentuk lingkaran. Vanili memiliki stomata berbentuk Ginjal dengan susunan sel epidermis tidak beraturan, stomata pada vanili dikelilingi oleh 4 sel
17
Menurut Mooreet al(1998)dalamPharmawatiet al(2008) stomata berperan dalam proses transpirasi dan fotosintesis. Stomata berfungsi sebagai tempat
terjadinya pertukaran gas dan air antara atmosfer dengan sistem ruang antar sel yang berada pada jaringan mesofil di bawah epidermis. Menurut Blum dan
Ebercon (1981)dalamLestari (2006) stomata mempunyai peran penting sebagai alat dalam adaptasi somaklon yang tahan kekeringan, kerapatan stomata dapat mempengaruhi fotosintesis dan transpirasi pada tanaman.
Stomata memiliki hubungan antara transpirasi dan fotosintesis yang keduanya melibatkan air (H2O) dan stomata memegang peranan penting dalam mengatur
keluar masuknya air yang ada di daun, karena itu stomata dapat dijadikan
parameter dalam seleksi ketahanan terhadap cekaman kekeringan.
G. Biosintesis Klorofil
Klorofil adalah molekul yang kompleks dan berfungsi menyerap cahaya,
mentransfer energi, dan transfer elektron dalam fotosintesis (Taiz dan Zeiger, 1998). Menurut Pandey dan Shin (1979)dalamSumendaet al(2011) molekul klorofil merupakan derivat porfirin yang mempunyai struktur tetrapirol siklis
dengan satu cincin pirol yang sebagian terinduksi. Inti tetrapirol terdapat atom Mg non ionik yang diikat oleh dua ikatan kovalen, memiliki rantai samping.
Klorofil merupakan pigmen berwarna hijau yang terdapat dalam kloroplas. Pada
18
karotenoid dan xantofil terdapat pada membran tilakoid (Salisbury dan Ross,
1991). Klorofil pada tumbuhan mempunyai fungsi untuk melakukan fotosintesis (Hendriani dan Setiari, 2009).
Sintesis klorofil terjadi melalui fotoreduksi protoklorofilid menjadi klorofilid a
dan diikuti dengan esterifikasi fitol untuk membentuk klorofil a yang dikatalisis enzim klorofilase. Perubahan protoklorofilid menjadi klorofilid a pada tumbuhan angiospermae memerlukan cahaya setelah itu klorofil jenis yang lain disintesis
dari klorofil a (Pandey dan Sinha 1979dalamSumendaet al., 2011).
Salah satu respons fisiologis tanaman terhadap cekaman kekeringan adalah
menurunnya konsentrasi klorofil daun yang disebabkan oleh dihambatnya pembentukkan klorofil dan terhambatnya penyerapan unsur hara terutama nitrogen dan magnesium yang berperan penting dalam sintesis klorofil (Nio
Song dan Banyo, 2011). Menurut Fitter dan Hay (1994) kekurangan air akan mempengaruhi proses-proses biokimia yang berlangsung dalam sel. Kekurangan
air berpengaruh terhadap reaksi-reaksi biokimia fotosintesis, sehingga laju fotosintesis menurun. Tersedianya air yang kurang juga akan menghambat sintesis klorofil pada daun yang diakibatkan laju fotosintesis menurun
(Hendriyani dan Setiari, 2009). Menurut Nio Song dan Lenak (2014) PEG dapat membuat kandungan klorofil total dan klorofil a pada tanaman menjadi rendah.
19
H. Metabolisme Prolin
Asam amino prolin mengandung gugus amino sekunder. Prolin memegang
peranan penting untuk metabolisme sel baik sebagai komponen protein dan asam amino bebas. Prolin memiliki konformasi terbatas yang fleksibel, yang
menentukan susunan peptida rantai di sekitarnya, dan sebagai akibatnya
menyebabkan stabilisasi atau destabilisasi struktur sekunder konformasi protein. asam amino prolin bebas merupakan salah satu zat terlarut kompatibel yang
didistribusikan paling banyak pada tanaman dan bakteri selama lingkungan yang merugikan seperti kondisi kekeringan, salinitas tinggi atau suhu rendah
(Lehmanet al., 2010).
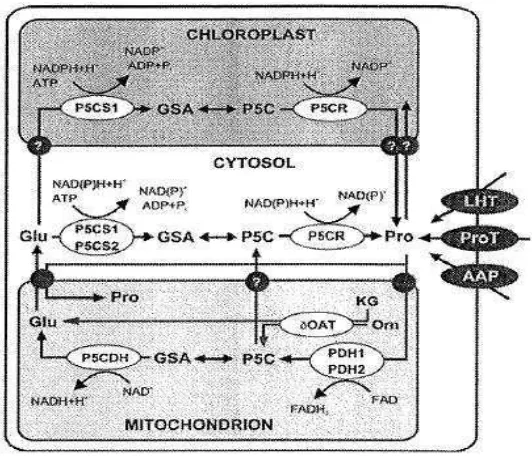
Metabolisme prolin pada tumbuhan Arabidopsis disajikan pada Gambar 2.
Gambar 2.Metabolisme Prolin pada Arabidopsis. Pro: Prolin, Glu: Glutamat, Orn: Ornitin, P5C: pirolin-5-karboksilat, GSA: Glutamic-γ
-Semialdehyde, KG: α-ketoglutarat, AAP: amino acid permease, pro T: prolin transporter, LHT: lisin-histidin transporter
20
Tanaman yang toleran terhadap cekaman kekeringan mempunyai mekanisme
untuk bertahan dalam kondisi kekeringan. Tanaman yang mampu beradaptasi dengan cekaman kekeringan dapat menghasilkan senyawa-senyawa
osmoregulasi yang dapat menurunkan potensial osmotik. Dan penyesuaian tekanan osmotik antara lain dilakukan melalui peningkatan prolin dalam daun (Hamimet al., 1996). Menurut Badami dan Amzeri (2011) terdapat korelasi
antara akumulasi prolin dengan tingkat toleransi terhadap cekaman kekeringan. Cekaman kekeringan yang terjadi pada tanaman meyebabkan kandungan prolin
meningkat, hal ini disebabkan karena biosintesis prolin dengan prosesnya meliputi hidrolisis protein dan degradasi oksidatif. Prolin juga berperan dalam mengakumulasi senyawa biokimia yang berperan dalam penyesuaian osmotik
(Nio Song dan Banyo, 2011). Hal ini dibuktikan melalui penelitian Palupi dan Dedywiryanto (2008) yang menyatakan bahwa akumulasi prolin pada tanaman
kelapa sawit menyebabkan tanaman toleran terhadap cekaman kekeringan.
21
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Januari sampai dengan bulan Maret 2015 di Laboratorium Botani (ruang penelitianin vitro), Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
B. Alat dan Bahan Penelitian
1. Alat–alat Penelitian
Alat- alat yang digunakan untuk seleksi planletVanilla planifoliaAndrews
secarain vitroadalah aluminium foil,Autoklaf, Laminar Air Flow Cabinet (LAF) merk ESCO, pinset, scalpel, mata pisauscalpel, kertas filter,
Erlenmeyer berukuran 50 ml, cawan petri berdiameter 10 cm, corong, botol kultur berukuran 250 ml, gelas ukur bervolume 100 ml dan 500 ml, kertas label, mikroskop, mikropipet, pipet tip, tabung reaksi, rak tabung
reaksi, timbangan analitik, tisu,waterbatt, dan kamera Canon Ixus 265 HS.
Alat-alat yang dipergunakan untuk analisis prolin dan klorofil: gunting,
22
alat-alat gelas (pipet ukur, gelas ukur, pipet Pasteur, tabung reaksi), mortar
dan penumbuk, rak tabung reaksi , kertas pH, corong.
2. Bahan–bahan penelitian
Bahan–bahan yang digunakan adalah planletVanilla planifoliaAndrews steril dalam botol kultur umur 2 bulan yang diperoleh dari koleksi pribadi
Ibu Dr. Endang Nurcahyani, M.Si., alkohol 70%, akuades,Benzine Amino Purine(BAP),Indole-3-Acetic Acid(IAA), sukrosa,Plant Preservative Mixture(PPM), Kalium Hidroksida (KOH), Asam Chlorida (HCl), dan
bahan kimia medium Murashige & Skoog (MS) padat yang komposisinya disajikan dalam Lampiran 1.
Bahan untuk analisa prolin yaitu asam sufosalisilat 3% (MERCK), ninhydrin (MERCK), asam fosforat, asam asetat glacial, toluene, prolin
(SIGMA-ALDRICH), akar tanaman vanili dan kertas saring Whatman no 1. Bahan analisis klorofil yaitu daun ke-2 planlet vanili dan aseton 80%.
C. Rancangan Percobaan
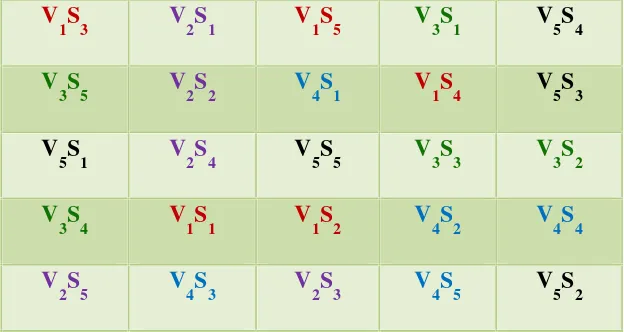
Rancangan Penelitian ini disusun dengan pola dasar Rancangan Acak Lengkap (RAL) dengan faktor tunggal yaitu konsentrasi PEG (BM 6000) dengan 5 taraf
23
planifoliaAndrews dalam setiap botol kultur. Tata letak percobaan disajikan
pada Tabel 1 berikut.
Tabel 1. Tata letak satuan percobaan
V
V1: Konsentrasi 0 % (kontrol)
V2: Konsentrasi 5 %
Penelitian terdiri atas beberapa tahap, yaitu: 1) Penanaman planletVanilla planifoliaAndrews umur 2 bulan kedalam medium MS yang sudah
ditambahkan PEG 6000 sesuai konsentrasi, 2) Penentuan kisaran konsentrasi PEG 6000 toleran untuk seleksi planletVanilla planifoliaAndrews secarain
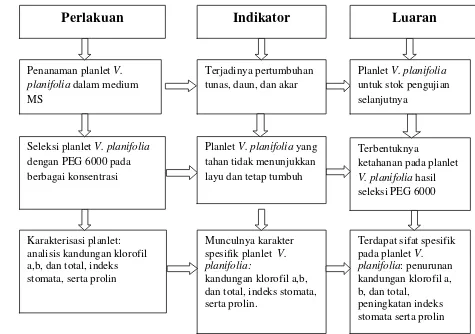
24
dan klorofil total, serta analisis kandungan prolin. Tahap penelitian disajikan
dalam bentuk bagan alir seperti tercantum pada Gambar 3.
Gambar 3. Bagan alir penelitian
E. Pelaksanaan Penelitian
Pelaksanaan penelitian meliputi beberapa langkah sebagai berikut.
1. Persiapan medium tanam
25
ke dalam labu takar 1 liter. Akuades ditambahkan sampai tanda (1 liter)
dan pH diatur sampai 5,5. Untuk mendapatkan pH 5,5 dilakukan penambahan KOH 1 N atau HCl 1 N. Larutan tersebut kemudian
dipindahkan ke dalam wadah yang lebih besar kemudian ditambahkan agar-agar sebanyak 7 g/l, sukrosa 30 g/l, dan PPM 0,5 ml/l. Larutan medium dipanaskan untuk melarutkan agar-agar (sambil diaduk) sampai mendidih.
Penambahan ZPT dilakukan setelah larutan medium diangkat, kemudian dituangkan ke dalam botol kultur sebanyak 20 ml/botol. Sterilisasi medium
dengan menggunakan autoklaf dengan tekanan 17,5 psi, 1210C selama 15 menit.
2. Persiapan medium seleksi
Medium Murashige & Skoog (MS) padat ditambah PEG 6000 dengan
konsentrasi 0% (kontrol), 5% , 10% , 15%, dan 20%. Sebelum digunakan, PEG 6000 yang telah dilarutkan dengan akuades pada konsentrasi tertentu
disaring menggunakansyringe filteryang mempunyai diameter 0,45 µm sebanyak 2 kali, dilanjutkan filter berdiameter 0,22 µm satu kali.
Penyaringan dilakukan dalam ruang steril didalam LAF Cabinet.
Selanjutnya PEG 6000 ditambahkan ke dalam medium MS. Sebelum digunakan, medium diinkubasikan selama 7 hari pada suhu kamar (25oC)
untuk memastikan bahwa PEG 6000 telah tersaring dengan baik. Apabila dalam waktu 7 hari tidak terjadi kontaminasi pada medium, maka medium
26
3. Penanaman planlet dalam medium seleksi PEG 6000
Eksplan yang digunakan berupa planlet steril. Planlet-planlet dari botol kultur dikeluarkan denganscalpelsteril dan satu-persatu diletakkan di atas cawan petri berdiameter 10 cm, kemudian planlet dipilah satu-persatu,
setelah itu ditanam pada masing-masing botol kultur yang berisi medium perlakuan yang telah ditentukan seperti pada butir 2) di atas.
Masing-masing konsentrasi dilakukan 5 kali ulangan dan setiap ulangan terdiri dari 2 eksplanV. planifoliadalam setiap botol kultur.
4. Pengamatan
Pengamatan dilakukan pada akhir minggu ke-5 dan dievaluasi untuk
mengetahui konsentrasi PEG 6000 yang toleran untuk seleksi planletV. planifoliasecarain vitro. Setelah 5 minggu inkubasi, planlet yang masih hidup di dalam botol kemudian dikarakterisasi dengan parameter sabagai
berikut.
a. persentase jumlah planlet yang hidup
Penghitungan persentase jumlah planlet hidup vanili dengan
menggunakan rumus: =
b. visualisasi planlet
meliputi warna warna planlet setelah diseleksi PEG 6000 dengan
klasifikasi sebagai berikut: hijau, hijau dengan bagian tertentu berwarna cokelat, cokelat.
Jumlah Planlet Hidup
Jumlah Seluruh Planlet X 100%
27
c. Analisis kandungan klorofil
Bahan untuk analisis klorofil menggunakan daun planletV. planifolia yang sudah diimbas dengan PEG 6000, menggunakan metode
Harbourne (1987) dengan spektrofotometer. Adapun langkah kerjanya sebagai berikut.
Daun planletV. planifoliaAndrews yang seragam sebanyak 0,1 g dihilangkan ibu tulang daunnya, kemudian digerus dengan mortar (pestle) dan ditambahkan 10 mL aseton 80%. Setelah itu larutan
disaring dengan kertasWhatmannNo. 1, dan dimasukkan ke dalam flakon serta ditutup rapat.
Larutan sampel dan larutan standar (aseton 80%) di ambil sebanyak 1 mL, kemudian dimasukkan dalam kuvet. Setelah itu dilakukan
pembacaan serapan dengan spektrofotometer UV pada panjang
gelombang (λ) 646 nm dan 663 nm, dengan ulangan tiap sampel
sebanyak 3 kali. Kadar klorofil dihitung dengan menggunakan rumus sebagai berikut.
Klorofil total = 17,3 λ646+ 7,18 λ663mg/L
Klorofil a = 12,21 λ663–2,81 λ646mg/L
Klorofil b = 20,13 λ646–5,03 λ663mg/L
28
d. Analisis indeks stomata
Pembuatan preparat stomata dengan metode dari Ruzin (1999) sebagai berikut.
Dibuat potongan-potongan segi empat dari daun planletV. planifolia dengan sisi ± 5 mm dan dimasukkan ke dalam tabung berisi larutan kloralhidrat dalam air (5:1). Tabung dipanasi dalam waterbath selama ±
10-15 menit hingga potongan daun tersebut transparan. Potongan daun diletakkan dalam larutan khloralhidrat pada gelas benda. Permukaan
yang ada stomatanya diletakkan disebelah atas, kemudian ditutup dengan gelas penutup. Preparat diamati pada 3 bagian daerah yang berlainan. Tiap sel epidermis (E) ditandai dengan (x), tiap stoma (S)
ditandai dengan (O). Indeks stomata besarnya dihitung dengan rumus:
x 100. Hasil akhir adalah rata-rata dari 5 buah pengamatan.
e. Analisis kandungan prolin
Daun planlet vanili diambil kemudian dibersihkan dan ditimbang
sebanyak 0,1 gram (masing-masing perlakuan dilakukan 3 ulangan). Daun ditumbuk dengan mortar di dalam larutan sulfosalisilat 3% sebanyak 2 ml kemudian disaring dengan kertas saring Whatman no. 1.
Selanjutnya fitrat diambil sebanyak 0,4 ml, dimasukkan kedalam tabung reaksi, dan ditambah 0,4 ml asam ninhydrin. Asam ninhydrin dibuat dengan cara memanaskan 1,25 gram Ninhydrin dalam 30 ml asam
29
Fitrat dalam asam Nidhydrin ditambah 0,4 ml asam asetat glacial
kemudian dipanaskan pada suhu 100oC selama 1 jam, reaksi diakhiri dengan memasukkan tabung reaksi berisi filtrat kedalam gelas piala berisi es. Campuran filtrat, asam ninhydrin dan asam asetat glisial
ditambah 0,8 ml toluen dan digojok dengan stirrer selama 15-20 detik sehingga terbentuk 2 lapiasan cairan berwarna tidak sama. Toluen
berwarna merah yang mengandung prolin diambil dengan pipet, dimasukkan kedalam kuvet, dan Optical Density (OD) dibaca pada panjang gelombang 520 nm (Bates,1973).
Kadar prolin dihitung dengan cara membuat larutan standar prolin
terlebih dahulu yaitu 0,003 gram prolin standar dilarukan dalam 10 ml asam sulfosalisilat 3 % dan diencerkan. Pengenceran dimaksudkan untuk mendapatkan variasi konsenterasi prolin. Selanjutnya larutan
direaksikan dengan asam Ninhydrin dan asam asetat glasial, kemudian OD larutan dibaca pada panjang gelombang 520 nm.
Hasil absorbansi larutan standar dibuat persamaan regresi linier
sehingga diperoleh persamaaan: Y = ax +b . Nilai absorbansi sample selanjutnya dimasukkan sebagai nilai Y sehingga didapatkan nilai x
(µ/mol).
Kadar prolin = (µ/mol prolin/ ml toluene)/ 115,13 µ/mol) gram sample/5
= µ mol prolin/ gram berat segar sample
30
f. Analisis Data
Data yang diperoleh dari pertumbuhan planletV. planifoliaselama seleksi dengan PEG 6000 berupa data kualitatif dan data kuantitatif.
Data kualitatif disajikan dalam bentuk deskriptif komparatif dan di dukung foto. Data kuantitatif dari setiap parameter dianalisis dengan menggunakan Analisis Ragam. Analisis ragam dilakukan pada taraf
V. SIMPULAN DAN SARAN
A. SIMPULAN
Berdasarkan hasil penelitian dan pembahasan dapat diambil simpulan
sebagai berikut.
1. Konsentrasi PEG 6000 yang toleran untuk seleksi planlet vanili resisten
terhadap cekaman kekeringan secarain vitroadalah 20%
2. Karakter ekspresi yang spesifik pada planlet vanili yang mengalami
cekaman kekeringan adalah menurunnya kandungan klorofil,
meningkatnya indeks stomata, dan meningkatnya kandungan prolin
dibandingkan dengan kontrol.
B. SARAN
Perlu dilakukan penelitian lebih lanjut terhadap planlet vanili yang
mampu bertahan dalam konsentrasi PEG yang tinggi terkait waktu
inkubasi dan respon planlet yang mampu bertahan dalam konsentrasi
DAFTAR PUSTAKA
Agasiswanto. 2015. Makalah Tumbuhan Vanili. https://edoagasiswanto1.wordpress .com /2013/09 /16/ makalah-tumbuhan-vanili/. Diakses pada tanggal 18 Mei 2015 pukul 05.50 WIB
Anonymous. 2014. Data Produksi Vanili. http://faostat.fao.org/site/339/default.aspx. diakses pada 24 November 2014
Anonymous. 2014. Fungsi Vanili. http://jurnalasia.com/2014/08/08/enam-manfaat-vanili/#sthash.n9bhpait.dpuf.di akses pada 21 November 2014 Ashari S. 2006. Hortikultura Aspek Budidaya. Jakarta. UI-Press
Badami K dan A. Amzeri.2010. Seleksi In Vitro untuk toleransi terhadap kekeringan pada jagung (Zea Mays L.) dengan Polyethylene Glycol
(PEG).Agrovigor Volume 3 No 1
Badami K dan A. Amzeri. 2011. Identifikasi Varian Somaklonal Toleran Kekeringan pada Populasi Jagung Hasil Seleksi In Vitro dengan PEG. Agrovior volume 4 NO 1
Banyo Y.E, N.S. Ai, P. Siahaan, dan A.M. Tangapo. 2013. Konsentrasi Klorofil Daun Padi pada Saat Kekurangan Air yang Diinduksi dengan Polietilen Glikol. Jurnal Ilmiah Sains Vol. 13 No. 1
Bates L.S. 1973. Rapid Determination of Free Proline for Water-Stress Studies. Plant and Soil 39: 205-207
Damayanti F. 2007. Analisis Jumlah Kromosom Dan Anatomi Stomata
Pada Beberapa Plasma Nutfah Pisang (Musa Sp.) asal Kalimantan Timur. BIOSCIENTIAE. 4(2): 53-61
55
Dasuki U.A .1991. Sistematik Tumbuhan Tinggi. Bidang Ilmu Hayati ITB, Bandung Djazuli M. 2010.Pengaruh Cekaman Kekeringan Terhadap Pertumbuhan Dan
Beberapa Karakter Morfo-Fisiologis Tanaman Nilam. Bul. Littro. Vol. 21 No. 1, 2010, 8 – 17
Estiti, B. H. 1995. Anatomi Tumbuhan Berbiji. Penerbit ITB. Bandung. Fahn A.1991.Anatomi tumbuhan, Edisi ke-3. Gadjah Mada University Press,
Yogyakarta
Firman C. 2008. Teknik Inokulasi Mikoriza Arbuskula Pada Bibit Vanili. Buletin Teknik Pertanian Vol. 13 No. 2, 2008
Fitter, A.H. dan R.K.M. Hay. 1994. Fisiologi Lingkungan Tanaman. Gadjah Mada University Press.Yogyakarta
Hamim, D. Soepandie, M. Yusus. 1996. Beberapa karakteristik morfologi dan fisiologi kedelai toleran dan peka terhadap cekaman kekeringan. Hayati 3: 30-40.
Haryanti S. 2010. Jumlah dan Distribusi Stomata pada Daun Beberapa Spesies Tanaman Dikotil dan Monokotil. Buletin Anatomi dan Fisiologi Vol. XVIII, No. 2
Hendriyani I. S dan N. Setiari. 2009. Kandungan Klorofil Dan Pertumbuhan Kacang Panjang (Vignasinensis) Pada Tingkat Penyediaan Air Yang Berbeda. J. Sains & Mat. Vol. 17 No. 3, Hal 150
Harborne J.B.1987. Metode Fitokimia dan Penurunan cara Modern Menganalisis Tumbuhan. Diterjemahkan oleh : K. Padmawinata dan I. Joediro. Cetakan ke 2. Penerbit ITB. Bandung, hal : 234-244
Jian K.Z. 2011. Salt and Drought Stress Signal Transduction in Plants. Annu Rev Plant Biol. Author manuscript.
Jiang Y dan B. Huang. 2001. Physiological Responses to Heat Stress Alone or in Combination with Drought: A Comparison between Tall Fescue and Perennial Ryegrass. HORTSCIENCE 36(4):682–686.
56
Kadir A. 2011. Respons Genotipe Padi Mutan hasil Iradiasi Sinar Gamma Terhadap Cekaman Kekeringan. J. Agrivigor 10(3): 235-246
Kalefetoglu T dan Y. Ekmekci. 2005. The Effects Of Drought On Plants And Tolerance Mechanisms. G.U. Journal of Science 18(4): 723-740
Karti P.D.M.H. 2004.Pengaruh Pemberian Cendawan Mikoriza Arbuskula Terhadap Pertumbuhan Dan Produksi Rumput Setaria Splendida Stapf Yang Mengalami Cekaman Kekeringan. ISSN 0126-0472. Vol. 27 N0. 2 hlm. 63-68
Kaufmann, M.R., dan A.N. Eckard. 1971. Evaluation of Water Stress Control with Polyethylene Glycol. Science 133:1486- 1487.
Kong L, S.M. Attree, dan L.C. Fowkw. 1998. Effects of Polyethylene Glycol and Methylglyoxal bis ( guanyhydrazone ) on Endogenous Polyamine Levels and Somatic Embrio Maturation in White Spruce (Picea glauca). Plant Sci 133: 211 – 220.
Krizek, D.T. 1985. Methods of inducing water stress in plant. Hort. Sci.(20):1028- 1038.
Lakitan B.1993.Dasar-dasar fisiologi tumbuhan. Raja Grafindo Persada, Jakarta Lawyer, D.W. 1970. Absorption of polyethilene glycol by plants the effect on plant
growth. New Physiol.(69):501 513
Lehman S, D. Funck D, Laszl, dan Szabados. 2010. Proline metabolism and transport in plant development. Amino Acid 39 (4) : 949 -962
Lestari E.G. 2006. Hubungan antara Kerapatan Stomata dengan Ketahanan
Kekeringan pada Somaklon Padi Gajahmungkur, Towuti, dan IR 64. B I O D I V E R S I T A S Volume 7, Nomor 1 Halaman: 44-48
Lestari E.G. dan I. Mariska. 2006. Identifikasi Somaklon Padi Gajahmungkur, Towuti dan IR 64 Tahan Kekeringan Menggunakan Polyethylene Glycol. Bul. Agron. (34) (2) 71 – 78
Lubis E, R. Hermansari, Sunaryo, A. Santika, dan E. Suparman. 2007 Toleransi galur padi gogo terhadap cekaman abiotik. Apresiasi Hasil Penelitian 2007 Manik T K, B. Rosadi, dan E. Nurhayati. 2014. Mengkaji Dampak Perubahan Iklim
57
Mardiyah S.2014. Pengaruh Kekeringan dan Pupuk Organik terhadap Anatomis dan Pertumbuhan Tanaman Padi Gogo (Oryza sativa L. „Situ Bagendit‟) Pada Tanah Berkapur. Tesis.Yogyakarta. Universitas Gadjah Mada
Mochtar M. 2012. Prospek Pemberian Alkohol Alifatis untuk Peningkatan Produksi Vanilli ( Tinjauan Secara Fisiologis Tanaman ). Primordia. Vol 8 : 2 Nio Song A. 2010. Pengujian Kandungan Klorofil Total, Klorofil A dan B Sebagai
Indikator Cekaman Kekeringan Pada Padi(Oryza sativa L.).Jurnal Ilmiah Sains, 10 (1). pp. 86-90. ISSN 1412-3770
Nio Song A. 2011. Biomassa Dan Kandungan Klorofil Total Daun Jahe (Zingiber officinale L.) Yang Mengalami Cekaman Kekeringan. Jurnal Ilmiah Sains Vol. 11 No. 1
Nio Song A dan Y. Banyo. 2011. Konsentrasi Klorofil Daun Sebagai Indikator Kekurangan Air pada Tanaman. Jurnal Ilmiah Sains Vol. 11 No. 2
Nio Song A dan A. A. Lenak. 2014.Penggulungan Daun Pada Tanaman Monokotil Saat Kekurangan Air. .Jurnal Bioslogos, Agustus 2014, Vol. 4 No. 2 Nurcahyani E, B. Hadisutrisno, I Sumardi, dan Suharyanto. 2014. Identifikasi Galur
Planlet Vanili (Vanilla planifolia Andrews) Resisten terhadap Infeksi Fusariumoxysporum f. Sp. Vanillae hasil seleksi in vitro dengan Asam Fusarat. Prosiding Seminar Nasional: “Pengendalian Penyakit Pada
Tanaman Pertanian Ramah Lingkungan”. Perhimpunan Fitopatologi
Indonesia Komda Joglosemar-Fakultas Pertanian UGM. ISBN 978-602-71784-0-3./2014 Hal. 272-279.
Ode A.L, B.S. Purwoko , A. Junaedi , O. Haridjaja, I.S. Dewi. 2012. Pendugaan Toleransi
Padi Hibrida terhadap Kekeringan dengan Polyetilen Glikol (Peg) 6000. J. Agrivigor 11(2): 292-299
Oertli J J.1985. The response of Plant Cells to Different Forms of Moisture stress.Jurnal of Plant Physiology volume 121. Hal 295–300. Palupi E.R dan Y. Dedywiryanto. 2008.Kajian Karakter Ketahanan terhadap
Cekaman Kekeringan pada Beberapa Genotipe Bibit Kelapa Sawit (Elaeis guineensis Jacq.). Bul. Agron. (36) (1) 24 – 32
58
dalam Mekanisme Pembukaan Stomata akibat Pengaruh Auxin. Jurnal BiologiVolume XII No.1
Prihastanti. 2010. Kandungan Klorofil dan Pertumbuhan Semai Kakao (Theobroma cacao L.) pada Perlakuan Kekurangan air Yang Berbeda. J.Bioma. 12 (2): p.35-39.
Purwanto dan T. Agustono. 2010. Kajian Fisiologi Tanaman Kedelai Pada Berbagai Kepadatan Gulma Teki Dalam Kondisi Cekaman Kekeringan. J. Agroland 17 (2) : 85 – 90
Rahayu E S, E. Guhardja, S. Ilyas, dan Sudarsono. 2005. Polietilena Glikol (PEG) Dalam Media In Vitro menyebabkan Kondisi Cekaman yang Menghambat Tunas Kacang Tanah (Arachis Hypogaea L.). Berk. Penel. Hayati: 11 (39–48), 2005
Rahmawati N.W. 2013. Pertumbuhan dan Perkembangan Sawo Kecik (Manilkara kauki (L.) Dubard), Gebang (Corypha utan Lamk.), Pulai (Alstonia scholaris R.Br), dan Vitex (Vitex pubescens Vahl.) Selama Mengalami Kekeringan. Skripsi. Yogyakarta. Universitas Gadjah Mada
Rompas Y ,H.L. Rampe, M.J. Rumondor. 2011. Struktur Sel Epidermis dan Stomata Daun Beberapa Tumbuhan Suku Orchidaceae. Jurnal Bioslogos, Vol. 1 No. 1
Rosman R. 2005. Status dan Strategi Pengembangan Panili di Indonesia. Prespektif Volume 4 Nomor 2, hal 43 – 54
Ruhnayat A. 2004. Bertanam Panili Si Emas Hijau nan Wangi. Agromedia Pustaka. Jakarta.
Ruzin S.E. 1999. Plant Microtechnique and Microscopy. Oxford University Press. New York.
Salisbury F.B and W.C. Ross.1992. Plant Physiology, 4th Ed. Wadsworth Publishing Company. California
Salisbury F.B dan W.C. Ross.1991.Fisiologi tumbuhan. Jilid 2. ITB, Bandung
59
Savitri E.S, 2010. Pengujian In Vitro Beberapa Varietas Kedelai (Glycine Max L. Merr) Toleran Kekeringan Menggunakan Polyethylene Glikol (Peg) 6000 Pada Media Padat Dan Cair. El-Hayah Vol. 1, No.2
Setyaningsih D, M.S. Rusli, I. Mariska, dan E. Hadipoentyant. 2006. Aplikasi proses pengeringan vanili termodifkasi untuk menghasilkan
ekstrak vanili berkadar vanillin tinggi dan pengembangan produk berbasis vanili - repository.ipb.ac.id di akses pada tanggal 15 Mei 2015
Short, K.C., I. Warburton, dan A.V. Roberts. 1987. In vitro hardening of cultures cauliflower and chrysanthemum plantlets to humidity. Acta Hor.(2120):324-329
Sofyaningsih M, Sugiono, dan D. Setyaningsih. 2011. Retensi Vanilin dan Perubahan Warna Ekstrak Pekat Vanili Selama Penyimpanan. J. Teknologi dan Industri Pangan, Vol. XXII No. 2
Sopandie D, Hamim, M. Jusur, dan N. Heryani. 1996. Toleransi Tanaman Kedelai Terhadap Cekaman Air : Akumulasi Prolin Dan Asam Absisik Dan Hubunganny a Dengan Potensial Osmotik Daun Dan Penyesuaian Osmotik. Bul. Agron. 24 (1): 9-14
Sujalmi S, Supriyanto, dan Astin.1999. Analisis Kadar Vanilin Dalam Buah Panili (Vanilla planifolia Andrews) Olahan Dengan Teknik Emulsi Membran Cair, Spektrofotometri Dan Kromatografi Cair Kinerja Tinggi JMS Vol. 4 No. 2
Sumenda L, H.L. Rampe, F.R. dan Mantiri. 2011. Analisis Kandungan Klorofil Daun Mangga (Mangifera indica L.) pada Tingkat Perkembangan Daun yang Berbeda. Jurnal Bioslogos, Vol. 1 Nomor 1
Suyitno A, D. Suryani, Ratnawati, 2003. Tanggapan Stomata dan Laju Transpirasi Daun Vaccinium Varingiaefolium (Bl.) Miq. Menurut Tingkat
Perkembangan Daun dan Jarak Terhadap Sumber Emisi Gas Belerang Kawah Sikidang Dataran Tinggi Dieng. Publikasi Seminar Hasil Penelitian MIPA. FMIPA UNY
Taiz L dan E. Zieger. 1998. Plant Plant Physiology 2nd ed. Sinaeur Asociates, Inc. Pub. Sunderland
Tjahjadi N.1989. Bertanam Panili. Kanisius. Yogyakarta
60
Mada University Press. Yogyakarta.
Tombe M, Sukamto, Zulhisnain, dan E. Taufiq. 2004 . Budidaya Vanili Dengan Menggunakan Teknologi Bio-Fob. Putlisbang Tanaman Perkebunan. Balittro
Vickly A. 2015. Proposal. https://plus.google.com/109128276294075069096. diakases pada tanggal 18 Mei 2015 pukul 06.40 WIB
Yudiwanti , Sudarsono, H. Purnamawati, Yusnita, H. Hapsoro, H.A. Hemon, dan S. Soenarsih. 2008. Inovasi Teknologi Kacang-kacangan dan Umbi-umbian. Mendukung Kemandirian Pangandan Kecukupoan Energi. Prosiding Seminar Hasil Penelitian Tanaman Kacang-kacangan dan Umbi-umbian, Puslitbangtan, Badan Litbang Pertanian,
DEPTAN.Hal.152-161.