SELEKSI IN VITRO PLANLET PISANG RAJA BULU (Musa paradisiaca L var. sapientum) RESISTEN TERHADAP
CEKAMAN KEKERINGAN
Oleh Adi Irawan
ABSTRAK
Pisang raja bulu (Musa paradisiaca L var. sapientum) merupakan salah satu tanaman buah unggul yang banyak diminati masyarakat sebagai buah hidangan meja yang dapat dikomsumsi baik dalam keadaan segar maupun diolah berbagai jenis makanan. Produksi tanaman pisang dapat mengalami penurunan karena permasalahan lahan kering. Upaya dalam mendapatkan tanaman pisang raja bulu resisten terhadap cekaman kekeringan telah dilakukan dengan menggunakan teknik in vitro yang disimulasi pada kondisi kekeringan menggunakan PEG 6000. Penelitian ini bertujuan untuk mengetahui konsentrasi toleran PEG 6000 dalam menyeleksi planlet pisang raja bulu yang resisten terhadap cekaman kekeringan secara in vitro serta menganalisis karakter ekspresi yang spesifik pada planlet pisang raja bulu yang toleran terhadap kekeringan meliputi kandungan prolin, kandungan klorofil dan indeks stomata. Penelitian ini menggunakan medium Murashige dan Skoog (MS) dengan konsenterasi PEG 6000 yaitu 5%, 10%, 15%, 20% dan kontrol (0%). Rancangan yang digunakan yaitu Rancangan Acak Lengkap (RAL) dengan 5 ulangan. Data dianalisis menggunakan analisis ragam (Anova), kemudian dilanjutkan dengan uji BNT pada taraf nyata 5%. Hasil penelitian menunjukkan bahwa konsenterasi PEG 6000 toleran terhadap seleksi planlet pisang raja bulu pada konsentrasi 20%. Karakter ekspresi pengaruh PEG 6000 terhadap kandungan prolin pada planlet pisang raja bulu mengalami
peningkatan secara nyata pada konsentrasi tertinggi 20%. Kandungan klorofil a, b dan total pada daun planlet pisang raja bulu mengalami penurunan secara nyata, semakin tinggi konsentrasi PEG 6000 maka semakin menurun kandungan klorofil a, b dan total pada daun planlet pisang raja bulu. Konsentrasi PEG 6000 yang diberikan pada medium seleksi juga mampu mempengaruhi indeks stomata pada daun planlet pisang raja bulu, semakin tinggi konsentrasi PEG 6000, maka indeks stomata pada daun planlet semakin meningkat.
SELEKSI IN VITRO PLANLET PISANG RAJA BULU (Musa paradisiaca L var. sapientum) RESISTEN TERHADAP
CEKAMAN KEKERINGAN
Oleh Adi Irawan
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Tanjung karang, Provinsi
Lampung pada tanggal 27 Febuari 1993, sebagai anak pertama dari empat saudara, dari pasangan Bapak Mariman dan Ibu Rupatinah.
Penulis mulai menempuh pendidikan pertamanya di Taman Kanak-Kanak Dharma Wanita Pertiwi Kabupaten Dati II Tulang Bawang pada tahun 1998. Pada tahun 1999 penulis melanjutkan pendidikannya di Sekolah Dasar Negeri 1 Gedung Air Bandar
lampung. Kemudian penulis melanjutkan pendidikan Sekolah Menengah pertama di SMP Negeri 10 Bandar lampung pada tahun 2005, dan melanjutkan pendidikan Sekolah Menengah Atas di Perintis 2 Bandar lampung pada tahun 2008.
Perkembangan Tumbuhan dan Fisiologi Tumbuhan Jurusan Biologi. Penulis juga aktif di Organisasi Himpunan Mahasiswa Biologi (HIMBIO) FMIPA Unila sebagai Ketua Biro Kesekretariatan dan Pengembangan Diri 2013-2014.
Penulis melaksanakan Kuliah Kerja Nyata (KKN) di Kelurahan Sumber Agung, Kec. Kemiling, Bandar Lampung dari bulan Agustus-September 2014. Pada bulan September-Oktober 2014 Penulis melaksanakan Kerja Praktik di Balai Veteriner (B-Vet) Provinsi Lampung dengan judul “Identifikasi Kultur Bakteri Pada Organ Ayam Merawang (Gallus domesticus) Di Balai Veteriner Lampung”.
SANWACANA
Assalamualaikum Wr. Wb.
Puji syukur atas rahmat Allah SWT dengan segala karuniaNya sehingga penulis dapat menyelesaikan salah satu syarat dalam menempuh pendidikan strata satu atau sarjana dalam bidang sains yaitu skripsi yang berjudul “SELEKSI IN VITRO PLANLET PISANG RAJA BULU (Musa paradisiaca L var. sapientum) RESISTEN TERHADAP CEKAMAN KEKERINGAN”.
Dengan terselesaikannya skripsi ini penulis mengucapkan terimakasih yang sebesar-besarnya kepada :
1. Ibu Dr. Endang Nurcahyani M.Si., selaku pembimbing I yang telah begitu sabar membimbing, menasehati, memberikan saran, kritik, serta kepercayaan bagi penulis.
2. Bapak Ir. Zulkifli M.Sc., selaku pembimbing II yang telah membantu penulis dalam menyelesaikan skripsi ini. Terimakasih untuk setiap nasihat, saran, dan motivasi yang membangun bagi penulis.
5. Bapak dan ibu Dosen Jurusan Biologi FMIPA Unila terimakasih atas ilmu, bimbingan dan bantuannya kepada penulis.
6. Ketua Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
7. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Alam Universitas Lampung.
8. Karyawan dan staff Laboran Jurusan Biologi serta seluruh pihak yang tidak dapat penulis sebutkan satu-persatu yang telah membantu dalam penyelesaian skripsi ini, penulis mengucapkan terimakasih yang sebesar-besarnya.
9. Sahabat seperjuangan penelitian kultur jaringan (Sobran, Christy, Eka, mbak gardis, mbak linda dan mbak rita) terimakasih untuk kerjasama, kebersamaan, dukungan, semangat, saran, kritik, bimbingan dan doa selama menjalani penelitian ini.
10.Kedua orangtua tercinta, Ayah (Mariman), Ibu (Rupatinah), adik-adik ku tersayang (Edo Ansyah, Dinda Ajeng Safitri dan Dian Apriliana) dan keluarga besarku terima kasih yang teramat dalam atas doa , kasih sayang, kesabaran, semangat, dan nasehat-nasehatnnya sehingga penulis mampu menyelesaikan skripsi ini.
Reni, Ria, Rila, Riska, Robit, Sa’adah, Siti, Tiara, Umi, Vista, Wayan, Wendy, Widamay dan Yuliani terimakasih atas dukungan, bantuan, saran, kritik, canda tawa, dan kebersamaannya untuk penulis.
12.Kakak tingkat 2008, 2009, 2010, adik-adik tingkat 2012, 2013, 2014, dan seluruh Wadya Ballad HIMBIO yang tidak dapat disebutkan satu persatu, terimakasih kebersamaan dan pembelajaran yang sangat berarti bagi penulis. 13.Keluarga Besar KKN Sumber Agung, Kemiling, BandarLampung dan
kelompok KKN (Arief Alm, Rio, Sari dan Dini) untuk pengalaman, pembelajaran dan kebersamaannya.
14.Keluarga Besar Balai Veteriner (B-Vet) Provinsi Lampung terkhusus staff Laboratorium Bakteriologi, terimakasih atas pembelajaran dan pengalaman selama melaksanakan kerja praktik.
15.Almamater Tercinta.
Semoga Allah SWT selalu memberikan hidayah dan barokah kepada semua pihak yang telah membantu penulis. Akhir kata, Penulis menyadari bahwa masih banyak kekurangan di dalam penyusunan laporan ini dan jauh dari kesempurnaan, akan tetapi besar harapan semoga hasil tulisan ini dapat berguna dan bermanfaat bagi kita semua.
Wassalamualaikum Wr. Wb. Bandar Lampung, Juni 2015 Penulis,
DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
I. PENDAHULUAN ... 1
A. Latar Belakang dan Masalah ... 1
B. Tujuan Penelitian ... 4
C. Manfaat Penelitian ... 5
D. Kerangka Pikir ... 5
E. Hipotesis ... 6
II. TINJAUAN PUSTAKA ... 7
A. Tanaman Pisang ... 7
1. Sejarah Pisang ... 7
2. Biologi Pisang ... 7
3. Morfologi Pisang ... 11
a. Akar ... 11
b. Batang ... 11
c. Daun ... 12
d. Bunga ... 12
e. Buah ... 13
4. Nilai Ekonomi Pisang ... 14
B. Pemuliaan Tanaman Melalui Kultur Jaringan ... 15
1. Penggunaan Kultur Jaringan ... 16
2. Medium Kultur Jaringan ... 16
C. Cekaman Kekeringan ... 17
D. Respon Tumbuhan terhadap Cekaman Kekeringan ... 18
E. Poly Ethylene Glycol (PEG) ... 19
F. Metabolisme Prolin ... 21
ii
III. METODE KERJA ... 28
A. Waktu dan Tempat ... 28
B. Alat dan Bahan ... 28
C. Rancangan Percobaan ... 29
D. Bagan Alir Penelitian ... 30
E. Pelaksanaan Penelitian ... 31
1. Persiapan Medium Tanam ... 31
2. Persiapan Medium Seleksi ... 31
3. Penanaman Planlet dalam Seleksi PEG 6000 ... 32
4. Pengamatan ... 32
a. Persentase Jumlah Planlet Hidup ... 33
b. Visualisasi Planlet ... 33
c. Indeks Stomata ... 33
d. Analisis Kandungan Klorofil ... 34
e. Analisis Kandungan Prolin ... 34
F. Analisis data ... 36
IV. HASIL DAN PEMBAHASAN ... 37
A. Seleksi Planlet Pisang Raja Bulu dengan Poly Ethylene Glycol (PEG) 6000 ... 38
B. Kandungan Prolin ... 42
C. Kandungan Klorofil ... 45
a. Kandungan Klorofil a ... 46
b. Kandungan Klorofil b ... 47
c. Kandungan Klorofil total ... 48
D. Indeks Stomata ... 51
V. KESIMPULAN ... 56
A. Kesimpulan ... 56
B. Saran ... 57
DAFTAR PUSTAKA ... 58
DAFTAR TABEL
Halaman Tabel
1. Perkembangan Provinsi Sentra
Produksi Pisang di Indonesia ... 14
2. Tata Letak Satuan Percobaan ... 30
3. Persentase visualisasi Planlet Pisang Raja Bulu Hasil Seleksi Berbagai Konsentrasi PEG 6000 ... 40
4. Persentase Jumlah Planlet Hidup Pisang Raja Bulu Hasil Seleksi Berbagai Konsentrasi PEG 6000 ... 40
5. Kandungan Prolin Pada Planlet Pisang Raja Bulu ... 43
6. Kandungan Klorofil a Daun Planlet Pisang Raja Bulu ... 46
7. Kandungan Klorofil b Daun Planlet Pisang Raja Bulu ... 48
8. Kandungan Klorofil Total Daun Planlet Pisang Raja Bulu ... 49
9. Indeks Stomata Daun Planlet Pisang Raja Bulu ... 53
10.Komposisi media Murashige and skoog ... 67
11.Visualisasi dan Jumlah Planlet Hidup Pisang Raja Bulu ... 68
12.Analisis Ragam Single Factor Kandungan Prolin Daun Planlet Pisang Raja Bulu ... 70
13.Analisis Ragam Single Factor Kandungan Klorofil a, b, total Daun Planlet Pisang Raja Bulu ... 70
DAFTAR GAMBAR
Halaman Gambar
1. Tanaman Pisang (Musa Paradisiaca L.) ... 10
2. Struktur Poly Ethylene Glycol (PEG) ... 21
3. Struktur prolin ... 22
4. Metabolisme prolin ... 23
5. Planlet pisang Raja Bulu pada Medium MS ... 38
6. Pertumbuhan Planlet Pisang Raja Bulu ... 41
7. Permukaan Bawah Daun Planlet Pisang Raja Bulu ... 51
8. Tahap Penelitian dalam Bentuk Bagan Alir ... 67
9. Grafik Linear Kandungan Prolin ... 73
10.Grafik Linear Kandungan Klorofil a ... 73
11.Grafik Linear Kandungan Klorofil b ... 73
12.Grafik Linear Kandungan Klorofil total ... 74
13.Grafik Linear Indeks Stomata ... 74
14.Diagram Batang Perbandingan Kandungan Prolin ... 75
15.Diagram Batang Perbandingan Kandungan Klorofil a ... 75
16.Diagram Batang Perbandingan Kandungan Klorofil b ... 75
17.Diagram Batang Perbandingan Kandungan Klorofil total ... 76
19.Planlet Pisang Raja Bulu ... 77
20.Pembuatan Medium Seleksi MS ... 77
21.Sterilisasi Medium dan Alat-alat Penelitian ... 78
22.Pembuatan Larutan PEG 6000 ... 78
23.Persiapan dan SubKultur Planlet Pisang Raja Bulu ... 78
24.Penataan Letak Planlet Pisang Raja Bulu Dalam Lemari Inkubasi ... 79
25.Penimbangan Daun Planlet Analisis Klorofil ... 79
26.Pembuatan Ekstrak Daun Planlet Pisang Raja Bulu ... 79
27.Larutan Ekstraksi Daun Planlet Pisang Raja Bulu ... 80
28.Uji Kandungan Klorofil Menggunakan Spektrofotometer Shimidzu UV 800 ... 80
29.Penimbangan Daun Planlet Analisis Prolin ... 80
30.Pembuatan dan Ekstraksi Prolin Planlet Pisang Raja Bulu ... 81
31.Larutan Prolin Pisang Raja Bulu ... 81
32.Uji Spektrofotometer Kandungan Prolin ... 81
33.Perendaman Daun Menggunakan kloralhidrat ... 82
34.Pengamatan Stomata Daun Planlet Pisang Raja Bulu ... 82
35. Pengukuran Bar Penampang Stomata ... 82
I. PENDAHULUAN
A. Latar Belakang dan Masalah
Pisang raja bulu (Musa paradisiaca L var. sapientum) merupakan salah satu tanaman buah tropis yang dapat tumbuh baik pada dataran tinggi dengan kisaran ketinggian 1600 meter di atas permukaan laut (dpl) maupun pada dataran rendah. Buah pisang di Indonesia menduduki peringkat pertama diantara buah-buahan lainnya baik dari segi produksi, penyebaran maupun luas pertanamannya (Anonymous, 2008).
Indonesia merupakan salah satu negara sentral primer keragaman varietas pisang. Pisang sebagai tanaman buah unggul di Indonesia masih memiliki kualitas yang terbatas. Komunitas produksi pisang perlu upaya
penanganan serius agar mampu berkompetisi dengan produk luar negeri. Langkah strategis untuk mengembangkan tanaman pisang dalam
menentukan varietas pisang mampu dikembangkan dalam skala luas maupun sempit secara agronomis (Anonymous, 2007).
segar atau masak sebagai buah meja dan jenis pisang yang harus terlebih dahulu diolah dalam penyajiannya. Kedua jenis pisang tersebut
merupakan anggota familia Musaceae. Terdapat pula jenis pisang hanya dimanfaatkan daunnya saja seperti pisang batu (Prabawati et al., 2008).
Salah satu permasalahan dalam pertanian budidaya pisang adalah adanya gangguan penyakit serta kurangnya ketersedian air yang menyebabkan kekeringan. Gangguan penyakit pada tanaman pisang biasanya
disebabkan oleh beberapa hal, salah satunya adalah penyakit layu fusarium yang disebabkan oleh jamur Fusarium oxysporum. Tanda-tanda
terserangnya pisang oleh layu fusarium ditandai dengan adanya kerusakan pada akar yang dapat mengakibatkan tersumbatnya saluran makanan dan mengganggu pengaliran air dan zat makanan. Selain itu dicirikan dengan menggulungnya pucuk daun yang kelihatan layu dan mati
(Anonymous, 2000).
Selain penyakit, ketersediaan air yang tidak memadai menjadi
3
Upaya dalam mengatasi kendala kekeringan perlu adanya pemuliaan tanaman pisang sebagai prioritas untuk mendapatkan genotip yang resisten terhadap cekaman kekeringan. Hal ini perlu dilakukan supaya dapat diandalkan dalam peningkatan pendapatan petani produksi pisang.
Poly Ethylene Glycol (PEG) merupakan suatu senyawa kimia yang mengandung aktivitas matriks sub unit etilen oksida yang mampu menurunkan pontensial osmotik dengan mengikat molekul air
menggunakan ikatan hidrogen. Pemberian PEG pada planlet bertujuan untuk menghasilkan kondisi cekaman kekeringan karena ketersedian air pada tanaman menjadi berkurang. Besar kecilnya potensial osmotik yang terjadi sangat dipengaruhi oleh ukuran molekul dan konsenterasi PEG yang diberikan (Rahayu et al., 2005).
Seleksi planlet yang toleran PEG 6000 menggunakan teknik in vitro dilakukan sebagai upaya untuk mendeteksi secara dini genotip planlet yang resisten terhadap cekaman kekeringan. Beberapa penelitian
Menurut Afa et al. (2012) menyatakan bahwa PEG 6000 digunakan sebagai upaya dalam mendeteksi secara dini genotip dari varietas tanaman yang toleransi terhadap cekaman kekeringan. Pada tanaman padi hibrida penggunaan PEG 6000 dengan konsentrasi 25% cukup efektif untuk menduga varietas padi yang resisten terhadap kekeringan.
Sejauh ini belum pernah dilakukan penelitian tanaman pisang raja bulu terhadap cekaman kekeringan menggunakan PEG 6000 sehingga penelitian ini menarik untuk dilakukan. Penelitian ini dilakukan untuk mendapatkan kandidat planlet pisang raja bulu (Musa paradisiaca L var. sapientum) yang toleran terhadap kekeringan secara in vitro. Planlet yang mampu bertahan terhadap cekaman kekeringan nantinya diharapkan mampu diaplikasikan dalam meningkatkan produksi pisang yang unggul di Indonesia.
B. Tujuan Penelitian
1. Mengetahui konsentrasi toleran PEG 6000 untuk seleksi planlet pisang raja bulu (Musa paradisiaca L var. sapientum) yang resisten terhadap cekaman kekeringan secara in vitro.
5
C. Manfaat Penelitian
Hasil dari penelitian ini diharapkan mampu memberikan informasi ilmiah mengenai penggunaan PEG 6000 untuk menghasilkan planlet pisang raja bulu (Musa paradisiaca L var. sapientum) yang toleran terhadap cekaman kekeringan secara in vitro. Secara ilmiah diharapkan dapat memberikan suatu kontribusi dalam ilmu pengetahuan terutama bidang pemuliaan tanaman dan bioteknologi dalam membudidayakan tanaman pisang.
D. Kerangka Pikir
Pisang raja bulu (Musa paradisiaca L var. sapientum) merupakan salah satu tanaman buah primadona yang memiliki nilai ekonomi yang cukup tinggi di Indonesia. Produksi pisang menurun salah satunya diakibatkan karena kekeringan yang dipengaruhi oleh iklim ataupun kondisi tanah, hal ini dapat menjadi suatu permasalahan bagi para petani pisang.
Kekeringan pada tanaman dapat terjadi hampir setiap tahun. Indonesia merupakan salah satu negara tropis yang memiliki dua musim yaitu musim hujan dan musim kemarau. Pada musim kemarau yang panjang
ketersediaan air yang tidak memadai menjadi pembatas utama dalam pertumbuhan tanaman. Hal tersebut dapat menjadi tingkat kerugian bagi para petani.
dalam memperbaiki karakter tanaman dan ketahanan tanaman.
Keragaman genetik pada tanaman hasil kultur jaringan memungkinkan untuk mendapatkan planlet dengan karakteristik tertentu. Senyawa biokimia yang dihasilkan planlet sebagai respon terhadap kekeringan diantaranya prolin, asam absisat, gula, glisin, dan sorbitol.
Poly Ethylene Glycol (PEG) 6000 mampu mempengaruhi ketahanan tanaman terhadap kekeringan. Beberapa penelitian menyatakan
penggunaan PEG 6000 pada medium sebagai agen seleksi dalam seleksi in vitro mempunyai tingkat resistensi terhadap kekeringan pada tingkat lapangan. Pendekatan seleksi in vitro yang telah menghasilkan varietas tanaman yang tahan terhadap kekeringan diantaranya tanaman padi hibrida (Wani et al., 2010; Afa et al., 2012); kalus gatang (Zulhilmi et al., 2012); tanaman jagung (Efendi et al., 2009) serta tanaman sorghum (Tsago et al., 2013).
E. Hipotesis
1. Terdapat konsentrasi toleran PEG 6000 yang mampu menyeleksi planlet pisang raja bulu (Musa paradisiaca L var. sapientum) yang resisten terhadap cekaman kekeringan secara in vitro.
2. Adanya karakter ekspresi yang spesifik pada planlet pisang raja bulu toleran terhadap cekaman kekeringan meliputi: peningkatan
II. TINJAUAN PUSTAKA
A. Tanaman Pisang
1. Sejarah
Tanaman pisang pada zaman dahulu merupakan tanaman liar yang tidak dibudidayakan. Pada saat pertanian mulai berkembang tanaman pisang tergolong tanaman pertama yang dibudidayakan oleh manusia. Diduga pisang telah lama dimanfaatkan oleh masyarakat Asia
tenggara, terutama pada bagian tunas dan pelepah yang diolah menjadi sayur. Bukti sejarah lainnya dalam tulisan maupun dalam bentuk relief menunjukkan budidaya tanaman pisang memang sudah ada sejak lama. Bukti tulisan pisang pertama diperkirakan sekitar tahun 500-600 SM menyebutkan bahwa pemeliharaan pisang dilakukan di Epics, Pali Boedhshist (Suyanti dan Supriadi, 2008).
2. Biologi Pisang
pengolahan yang dilakukan oleh masyarakat dalam keragaman cara pengolahannya (Prabawati et al., 2008).
Produksi pisang di Indonesia 70% berasal dari pekarangan. Indonesia merupakan salah satu negara sentra primer keragaman varietas pisang. Pisang sebagai tanaman tropis mampu hidup pada dataran rendah ataupun dataran tinggi lebih dari 1600 meter di atas permukaan laut, serta mampu hidup pada suhu 27 0C sampai maksimum 38 0C, pH keasaman tanah 4,7-7,5 dengan curah hujan antara 2000-2500 mm/tahun. Tanaman pisang memerlukan tambahan pengairan pada daerah bulan kering berturut-turut melebihi 3 bulan agar dapat tumbuh dan berproduksi dengan baik (Anonymous, 2008).
9
Tanaman pisang memiliki buah, daun, batang, bonggol yang dapat dikonsumsi. Pada tahun 1942-1946 sewaktu zaman penjajahan Jepang, Indonesia mengalami krisis pangan, dimana pada saat itu membuat masyarakat memanfaatkan batang bonggol pisang yang semestinya digunakan sebagai indukan baru konon dijadikan bahan pangan pengganti karbohidrat. Daun pisang dimanfaatkan sebagai bahan pengganti pembungkus plastik pada makanan atau dimanfaatkan untuk pakan ternak. Buah pisang dapat diolah menjadi berbagai
macam kreasi makanan seperti keripik, sale pisang, tepung, ledre, pisang goreng ataupun dijadikan buah meja yang dapat dikomsumsi dalam keadaan segar (Suhardiman,1997).
Klasifikasi tanaman pisang menurut Pillay dan Tenkouano (2011) adalah sebagai berikut.
Divisio : Magnoliophyta Classis : Liliopsida Sub-classis : Commelinidae
Ordo : Zingiberales
Familia : Musaceae
Genus : Musa
Species : Musa paradisiaca L var. sapientum
Gambar 1. Tanaman pisang raja bulu a). Habitus pisang raja bulu, b).Buah pisang raja bulu (Anonymous, 2014)
Pisang raja bulu salah satu varietas buah pisang unggul di Indonesia. Buahnya memiliki kulit yang tebal, berwarna kuning, terdapat bintik hitam pada buah yang telah matang. Diameter buah cukup besar berkisar 3,2 cm dengan panjang buah 12-18 cm. Daging buah berwarna kuning kemerahan jika sudah matang. Pisang raja bulu memiliki daging yang legit atau manis dengan aroma buah yang harum. Pada satu tandan buah pisang terdapat
11
5-6 sisir buah, setiap sisir terdapat 14-16 buah. Berat pertandan pisang sekitar 12-16 kg (Sobir, 2009).
Secara morfologi tanaman pisang termasuk kedalam tanaman herba. Tanaman pisang memiliki struktur batang berbentuk bulat, helaian daun berbentuk lanset tipis dengan ukuran panjang helaian daun berkisar antara 30 cm sampai 50 cm saat muda dan 125 cm sampai 165 cm setelah
dewasa. Memiliki bunga betina dan jantan dalam satu rangkaian yang terdiri dari 5-20 bunga (Suhardiman, 1997).
3. Morfologi Tanaman Pisang
a. Akar
Pisang merupakan tanaman yang berakar serabut yang berpangkal pada bonggol batang. Panjang akarnya mencapai kedalaman 75 cm hingga 150 cm di bawah tanah (Widyastuti dan Paimin, 1993), sedangkan pada bagian bonggol batang akarnya tumbuh disamping dan mendatar. Pada usia tanaman 75 hari sampai 90 hari
pembentukan akar akan berlangsung (Suhardiman, 1997).
b. Batang
hijau kemerahan. Batang semu juga terdapat bercak-bercak berwarna merah, cokelat dan keunguan. Bonggol pisang yang terletak di bawah batang semu memiliki ukuran lingkar sekitar 60 cm sampai 110 cm tergantung jenis tanaman pisang (Radiya, 2013).
c. Daun
Tanaman pisang memiliki daun berbentuk lanset. Ukuran lebar daun pisang mencapai 30 cm sampai 40 cm serta mudah koyak (Widyastuti dan Paimin, 1993). Pada pucuk tengah batang semu akan muncul daun baru yang menggulung dan akan terus
memanjang keluar dari tengah batang semu membentuk kanopi-kanopi daun pisang (Ashari, 1995). Terdapat tiga tipe variasi bentuk pucuk daun pisang dilihat dari bentuk tepi pangkal daun pelepah. Bentuk-bentuknya yakni tipe pelepah daun menjepit batang contohnya pada pisang jantan dan pisang susu , tipe daun yang tidak menjepit batang seperti pisang gadang, pisang raja, pisang lidi, dan tipe bergelombang seperti pisang manis dan pisang telur (Radiya, 2013).
d. Bunga
13
seludang akan jatuh ke tanah. Bunga jantan berkembang secara tidak normal dan bunga betina akan berkembang secara normal. Bunga tersebut akan membentuk kelompok sisir, setiap sisir berjumlah 12 sampai 20 buah. Sisir betina berjumlah 5 sampai 15 buah. Panjang bunga betina mencapai 10 cm dan berbentuk segitiga, sedangkan pada bunga jantan berukuran sekitar 6 cm dengan jumlah benang sari 5 (Ashari, 1995).
e. Buah
4. Nilai Ekonomi Pisang
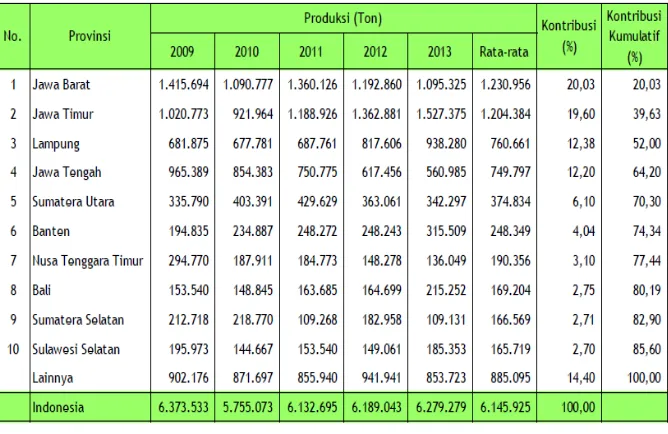
Indonesia menempati peringkat tertinggi produksi pisang. Produksi pisang di Indonesia pada tahun 2001 mencapai 4.300.422 ton
(Prabawati, 2008). Data statistik rata-rata produksi pisang 2009-2013 sebanyak 70,30% disajikan pada Tabel 1. Berdasarkan Tabel 1 provinsi dengan pemasok pisang terbesar di Indonesia diantaranya Jawa Barat, Jawa Timur, Lampung, Jawa tengah dan Sumatera Utara. Produksi pisang dari Jawa timur dan Lampung cenderung meningkat dalam tiga tahun terakhir (Susanti, 2014).
[image:30.595.176.510.431.648.2]Perkembangan provinsi sentra pisang di Indonesia disajikan pada Tabel 1.
Tabel 1. Provinsi Sentra Produksi Pisang di Indonesia, 2009–2013 (Susanti, 2014)
15
menghasilkan buah yang bermutu tetapi perbanyakan dalam pascapanen yang masih terabaikan (Prabawati et al., 2008).
Produksi pisang dunia diperhitungkan sebanyak 68 juta ton per tahun yang berasal dari sekitar 120 negara. Beberapa negara di Asia tenggara merupakan negara produksi pisang tertinggi di dunia.
Produksi tertinggi pada tahun 1987 tercatat di Filipina 3.755.000 ton dari luas 330.500 ha, Indonesia 2.192.000 ton dari 175.600 ha dan Thailand 471.500 ton dari 27.700 ha (Ashari, 1995).
B. Pemuliaan Tanaman melalui Teknik Kultur Jaringan
Kultur jaringan terdiri dari dua kata, kultur yang berarti budidaya dan jaringan yaitu sekumpulan sel yang memiliki bentuk dan fungsi yang sama. Kultur jaringan merupakan jaringan tanaman yang dibudidayakan menjadi tanaman kecil memiliki sifat yang sama seperti induknya
(Hendrayono dan Wijayanti, 1994).
Pada tahun 1988 dalam survei yang dilaksanakan di Belanda
1. Penggunaan Kultur jaringan
Kultur jaringan pada tumbuhan bertujuan untuk meregenerasikan jaringan kalus, memperbanyak sel, regenerasi tanaman secara keseluruhan dan identifikasi seleksi mutan-mutan alami yang terinduksi secara potensial untuk memperbanyak genotip yang diinginkan (Welsh,1991).
Manfaat pemuliaan tanaman dalam kultur jaringan tumbuhan adalah menciptakan klon-klon tanaman yang efektif dan murah serta bebas dari virus saat diisolasi. Manfaaat lainnya menghasilkan genotip-genotip tanaman yang diinginkan secara cepat dan ekonomis dalam pembuatannya (Welsh, 1991).
2. Medium Kultur Jaringan
Medium pada metode in vitro dalam teknologi kultur jaringan terdiri dari beberapa komposisi medium. Komposisi medium pada kultur jaringan tumbuhan mengandung 5 kelompok senyawa-senyawa unsur hara. Senyawa-senyawa medium tersebut terdiri atas garam-garam organik, sumber karbon, vitamin, zat pengatur tumbuh dan pelengkap organik (Watter dan Constabel, 1991).
17
menginduksi sel. Beberapa senyawa yang sering digunakan sebagai pengatur tumbuh yakni asam 2,4- diklorofenoksiasetat (2,4-D) dan Naphthalene Acetic Acid (NAA) pada kadar 0,1-50 mg/l. Medium pelengkap organik adalah air kelapa, ekstrak ragi, hidrolisat protein yang dapat memasok berbagai senyawa yang bertujuan untuk merangsang laju pertumbuhan sel (Watter dan Constabel, 1991).
C. Cekaman Kekeringan
Cekaman kekeringan merupakan kondisi dimana minimumnya kadar air dalam tanah yang berhubungan dalam pertumbuhan dan produksi tanaman. Cekaman kekeringan pada tanaman berdampak pada laju pelebaran daun, indeks luas daun, menutupnya stomata, pengurangan pengambilan karbon dioksida serta penurunan berat kering jika cekaman air pada tanaman terlalu parah. Cekaman kekeringan pada tanaman menyebabkan menurunnya laju fotosintesis, penutupan stomata,
penurunan pertumbuhan daun serta perubahan indeks luas daun (Purwanto dan Agustono, 2010)
akan menghindar dari cekaman kekeringan dengan memanjangkan akar untuk mencari sumber air dalam permukaan tanah (Djazuli, 2010).
D. Respon Tumbuhan terhadap Cekaman Kekeringan.
Beberapa faktor yang terjadi pada tanaman yang mengalami cekaman air yaitu kurangnya ketersediaan air pada medium tanam dan transpirasi berlebihan atau kombinasi dari kedua faktor tersebut. Tanaman dapat mengalami cekaman air, walaupun pada lapangan didalam tanah cukup air. Hal ini dapat terjadi jika kecepatan absorbsi tidak dapat mengimbangi kehilangan air melalui proses transpirasi. Absorbsi air dapat
mempengaruhi kecepatan kehilangan air, penyebaran dan kemampuan sistem perakaran dan potensial air pada tanah. Kecepatan transpirasi menentukan luas struktur daun, stomata dan faktor lingkungan yang dapat mempengaruhi perbedaan potensial air tanaman dan udara
(Islami dan Utomo, 1995).
19
Protoplasma di dalam sel berada dalam keseimbangan osmotik dengan larutan ( Islami dan Utomo, 1995).
Respon tanaman pada kondisi kekeringan akan menyesuaikan diri secara fisiologis, biokimia, anatomi dan perubahan morfologi termasuk transisi dalam ekspresi gen. Respon fisiologi tanaman sangat kompleks pada tingkat kekeringan melibatkan perubahan adaptif. Beberapa faktor kompleksitas tingkat kekeringan yaitu varietas atau spesies tanaman, dinamika, durasi, intensitas penipisan air tanah, kondisi lingkungan, perubahan air dari atmosfer dan pertumbuhan tanaman (Lisar et al., 2012).
E. Poly Ethylene Glycol (PEG)
Poly Ethylene Glycol (PEG) yang dikenal sebagai macrogols pada industri farmasi di Eropa yang diproduksi oleh polimerasi ethylene oxide. Struktur molekul dari PEG adalah HO-[CH2-CH2-O]n-H. Dimana”n” adalah
jumlah dari ethylene oxide (Anonymous, 2002).
Poly Ethylene Glycol (PEG) dapat di bedakan satu sama lain berdasarkan berat molekulnya (BM) atau MW (Molecular Weight). Berat molekul PEG berdasarkan penyebutan atau penulisannya seperti PEG MW 1650, PEG MW 3000, PEG MW 6000 yang semuanya merupakan polymer. Beberapa PEG yang efektif terhadap fusi protoplas memiliki berat molekul sebagai berikut.
PEG 6000 berat molekul 6000-7000
Pengunaan PEG-PEG tersebut yang perlu diperhatikan adalah toksisitas, sifat PEG, kadar PEG optimal dan PEG yang terbaik. Penggunaan PEG 6000 dalam 41 % keatas bagi tumbuh-tumbuhan umumnya bersifat toksik (Suryowinoto, 1996).
Poly Ethylene Glycol (PEG) memiliki dua sifat yakni pertama bersifat memacu adhesi antarprotoplas dan kedua bersifat mengganggu lapisan-lapisan rangkap phospholipid. Kadar optimal penggunaan PEG pada tanaman perlu diperhatikan dosisnya tergantung dari beberapa faktor yakni berat molekulnya, macam tanaman, kondisi ruang yang digunakan untuk inkubasi, temperatur, cahaya, besar kadar PEG yang dipakai dan lain-lain. Berdasarkan berat molekul pemakaian PEG 6000 bisa lebih efektif
digunakan jika kadar keencerannya ditingkatkan. Pemakaian PEG dengan berat molekul kadar tinggi dapat membuat protoplas tidak normal,
terjadinya torsi, bahkan protoplas banyak yang pecah, sedangkan
pemakaian PEG dengat berat molekul rendah seperti PEG 1000 presentase fusi kurang tinggi dan kurang memuaskan (Suryowinoto, 1996).
Poly Ethylene Glycol (PEG) 6000 memiliki struktur bentuk padat,
21
Struktur bangun PEG 6000 di sajikan pada Gambar 2.
Gambar 2. Struktur Poly Ethylene Glycol (PEG) (Anonymous, 2014).
Poly Ethylene Glycol digunakan pada medium budidaya jaringan dalam mencapai salt tolerance. Penggunaan 20 % PEG pada budidaya sel tomat dan budidaya sel tembakau untuk men-subkultur sel-sel hidup sampai 15-20 generasi. Hal ini sebagai upaya untuk mendapatkan lini sel yang toleran terhadap garam NaCl. Pada tanaman yang hidup di atas tanah dengan kadar garam yang tinggi yang masuk kedalam tanaman halofit. Tanaman halofit merupakan tanaman yang mampu hidup pada tanah dengan fisiologis kering. Tanaman ini telah mencapai toleransi terhadap garam-garam atau toleransi terhadap kekeringan. Adaptasi sel atau
tanaman yang berhasil pada garam tinggi tumbuhnya akan mundur bahkan akan mati. Toleransi sel-sel terhadap kadar air yang rendah dapat
menyesuaikan diri terhadap tekanan osmotik sebesar 40 bar untuk PEG. Pada kadar 15% PEG mempunyai Lethal Dose (LD) 50 dengan klon-klon yang Low-water tolerance sedangkan LD-50 pada kadar 5% PEG Klon klon tidak Low-water tolerance (Suryowinoto, 1996).
F. Metabolisme Prolin
keseimbangan neraca potensial air tanah dan tanaman. Seiring dengan lama interval penyiraman, kadar prolin pada daun dapat meningkat. Penggunaan kadar prolin pada tanaman nilam pada kondisi kecukupan air dan kekurangan air menunjukkan toleransi terhadap nilai potensial air yang tetap negatif yaitu kemampuan pada tanaman untuk menjaga pontensial jaringan dalam mengikat air atau mengurangi kehilangan air. Pada mekanisme ini sebagai upaya untuk menjaga potensial jaringan pada tanaman dalam mengikat sistem perakaran, mengurangi absorbsi radiasi surya, pembentukan lapisan lilin, pengaturan stomata, menurunkan permukaan evapotranspirasi melalui penyempitan daun dan pengurangan luas daun (Setiawan dan Shiddieq, 2013).
Struktur prolin disajikan pada Gambar 3.
Gambar 3. Struktur prolin (Anonymous, 2014).
23
Metabolisme prolin pada tanaman berperan dalam mensintesis glutamat menjadi Glutamic-Semi Aldehyde (GSA) oleh Pyroline-5-Carboxylate Synthetase (P5CS) dan dikonversi spontan menjadi proline 5- carboxylate (P5C). Katabolisme prolin terjadi melalui dehidrogenase proline (PDH) atau oksidasi prolin (POX) dalam memproduksi P5C dari proline dan P5C dehidrogenase (P5CDH) dimana P5C diubah menjadi glutamat. Prolin dapat juga disintesis oleh Ornithine. Ornithine delta aminotranferase mentransminasi dalam memproduksi GSA dan P5C kemudian diubah menjadi prolin (Szabados dan Arnould, 2009).
Jalur metabolisme prolin pada tumbuhan disajikan pada Gambar 4.
Gambar 4. Metabolisme prolin pada tumbuhan tingkat tinggi menggunakan Arabidopsis. Garis hijau menandakan jalur biosintesis, garis
Sel meristem dan embrio pada biosintesis prolin terjadi disitosol kemudian dimediasi oleh P5C5 dan P5CR. Pada P5CS terakumulasi dalam kloroplas pada kondisi stress menyebabkan meningkatnya biosintesis pada peptida. Degradasi terjadi di mitokondria dimana prolin dioksidasi menjadi P5C dan glutamat dari PDH dan P5CDH. Arginin digunakan oleh jalur ornithine menghasilkan P5C dan Glutamat di mitokondria. Prolin akan mendaur ulang P5C di mitokondria dalam sitosol oleh P5CR
(Szabados dan Arnould, 2009).
Anabolik metabolisme prolin dijelaskan pertama kali menggunakan bakteri, dimana terdapat tiga langkah glutamat dalam mensintesis prolin. Glutamat terfosforilasi oleh γ-glutamil kinase dengan menggunakan ATP kemudian menghasilkan glutamil-yphosphate direduksi menjadi glutamat-γ-semialdehid (GSA) oleh glutamat-γ semialdehid dehidrogenase. Siklus terbalik GSA menjadi Δ-pyrroline-5-carboxylate (P5C) terjadi secara
spontan kemudian diikuti dengan reduksi P5C menjadi prolin. Pada reaksi tersebut NADPH mengkatalisis Δ-pyrroline-5-carboxylate reduktase
(P5CR) (Lehman et al., 2010).
25
dengan kadar lengas tanah. Hubungan kadar lengas dengan kadar prolin berkolerasi negatif (r=-0,630) artinya semakin kecil kadar lengas tanah maka kadar prolin semakin meningkat (Setiawan dan Shiddieq, 2013).
G. Biosintesis Klorofil
Klorofil merupakan zat hijau daun yang berperan dalam fotosintesis pada tanaman. Pada umumnya klorofil disintesis pada daun untuk menangkap cahaya dengan jumlah berbeda tergantung faktor lingkungan dan genetik setiap spesies. Adapun faktor-faktor yang mempengaruhi sintesis klorofil yaitu cahaya, gula, air, karbohidrat, faktor genetik, temperatur, dan unsur-unsur seperti: N, Fe, Mg, Mn, Cu, Zn, S dan Oksigen. Unsur Nitrogen merupakan faktor utama pembentukan klorofil yang merupakan unsur hara makro. Kekurangan unsur N pada tanaman menyebabkan gejala klorosis pada daun (Hendriyani dan Nantya, 2009).
Homayoun et al., (2011) mengemukakan jumlah klorofil pada tanaman dipengaruhi oleh beberapa faktor seperti:
1. Jumlah klorofil pada daun dan kloroplas memiliki intensitas cahaya berbeda.
2. Biosintesis klorofil melibatkan suhu 30-40 0C pada tanaman (C4) dan suhu 10-25 0C pada tanaman (C3).
Sintesis klorofil sangat dipengaruhi oleh air. Klorofil akan meningkat saat hujan dan akan menurun saat keadaan tanah gersang. Kadar air pada daun berperan dalam mempertahankan jumlah maksimum kadar klorofil
(Homayoun et al., 2011).
Terdapat empat tahap stress air dalam menghambat sintesis klorofil. Pertama; pembentukkan 5-aminolevulinic Acid (ALA), kedua;
kondensasi ALA menuju porfobilinogen dan tetrapyrrol primer kemudian diubah menjadi protochlorophylle, ketiga; konversi cahaya tergantung dari protochlorophylle menuju chlorophylle dan keempat; sintesis klorofil a dan b dalam mengembangkan pigmen kompleks dan protein dalam proses fotosintesis (Lisar et al., 2012).
Klorofil merupakan molekul perangkap yang bertindak sebagai
fotoreseptor. Biosintesis jalur klorofil dioperasikan oleh plastida dalam reaksi kompleks yang melibatkan banyak intermediet. Prekursor universal dari tetrapyrroles yakni δ-aminolevulic acid (ALA) yang disintesis dari rangka karbon glutamat atau 2-oksaglutarat pada tanaman. Kondensasi dua molekul ALA akan membentuk porfobilinogen (PBG) yang dikatalisis oleh δ–ALAD (5- aminolevulinathy drolyase EC 4.1.24, ALAD). ALAD merupakan enzim dari jalur biosintesis dari pembentukan tetrapyrroles
yang memiliki peran utama dalam regulasi biosintesis klorofil (Jain et al, 2013).
Respon tanaman terhadap kekurangan air menyebabkan terjadinya
27
pada daun karena adanya respon fisiologis tanaman yang kekurangan air. Respon fisiologis tersebut terdiri dari pembentukkan klorofil yang
III. METODE PENELITIAN
A. Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Januari sampai bulan Maret 2015 di Laboratorium Botani (ruang penelitian in vitro), Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
B. Alat dan Bahan 1. Alat – alat
Alat- alat yang digunakan untuk seleksi planlet pisang raja bulu (Musa paradisiaca L var. sapientum) secara in vitro adalah aluminium foil, Autoklaf, Laminar Air Flow Cabinet (LAF) merk ESCO, pinset, scalpel, mata pisau scalpel, kertas filter, Erlenmeyer berukuran 50 ml, cawan petri berdiameter 10 cm, corong, botol kultur berukuran 250 ml, gelas ukur bervolume 100 ml dan 500 ml, mikroskop, mikropipet, tabung reaksi, pipet tip, kamera Canon Ixus 951S, waterbatt, rak tabung reaksi, timbangan analitik, tisu, dan kertas label.
29
ukur, gelas ukur, tabung reaksi,), mortar dan penumbuk, kertas pH, corong dan rak tabung reaksi.
2. Bahan – bahan
Bahan–bahan yang digunakan adalah planlet pisang raja bulu (Musa paradisiaca L var. sapientum) steril dalam botol kultur umur 2 bulan yang diperoleh dari koleksi Ibu Dr. Endang Nurcahyani, M.Si, alkohol 70 %, akuades, Benzine Amino Purine (BAP), Indole-3-Acetic Acid (IAA), sukrosa, Plant Preservative Mixture (PPM), Kalium Hidroksida (KOH), Asam Chlorida (HCl), dan bahan kimia medium Murashige & Skoog (MS) padat yang komposisinya disajikan dalam Lampiran 1.
Bahan untuk analisa prolin yaitu asam sufosalisilat 3% (MERCK), ninhydrin (MERCK), asamfosforat, asam asetat glasial, toluen, prolin (SIGMA-ALDRICH), akar tanaman pisang raja bulu dan kertas saring Whatman no 1. Bahan analisis klorofil yaitu daun ke-2 tanaman pisang raja bulu dan aseton 80%.
C. Rancangan Percobaan
Rancangan Penelitian ini disusun dengan pola dasar Rancangan Acak
Lengkap (RAL) yaitu konsentrasi PEG 6000 dengan 5 taraf konsentrasi yaitu 5%, 10%, 15%, 20% dan 0% (kontrol). Masing-masing konsentrasi
dilakukan 5 ulangan dan setiap ulangan terdiri dari 2 eksplan Musa
Tabel 2. Tata letak satuan percobaan
K3U4 K1U3 K4U2 K5U2 K4U3
K1U5 K4U1 K2U3 K4U4 K5U1
K5U4 K2U5 K3U2 K3U3 K1U4
K2U1 K4U5 K5U3 K1U1 K5U5
K3U5 K2U2 K3U1 K2U4 K1U2
Keterangan :
K1 : Konsentrasi 0 % (kontrol)
K2 : Konsentrasi 5 %
K3 : Konsentrasi 10 %
K4 : Konsentrasi 15 %
K5 : Konsentrasi 20 %
U1-U5 : Ulangan 1 – ulangan 5
D. Bagan Alir Penelitian
31
E. Pelaksanaan Penelitian
Pelaksanaan penelitian meliputi beberapa langkah sebagai berikut. 1. Persiapan medium tanam
Medium yang digunakan dalam penelitian ini adalah Murashige & Skoog (MS) padat. Pembuatan medium tanam MS sebanyak 1 liter adalah dengan cara memipet sejumlah larutan stok (Lampiran 1), kemudian dimasukkan ke dalam labu takar 1 liter. Aquades ditambahkan sampai tanda (1 liter) dan pH diatur sampai 5,5. Untuk mendapatkan pH 5,5 dilakukan penambahan KOH 1 N atau HCl 1 N. Larutan tersebut kemudian
dipindahkan ke dalam wadah yang lebih besar kemudian ditambahkan agar-agar sebanyak 7 g/l, sukrosa 30 g/l, dan PPM 0,5 ml/l. Larutan medium dipanaskan untuk melarutkan agar-agar (sambil diaduk) sampai mendidih. Penambahan ZPT dilakukan setelah larutan medium diangkat, kemudian dituangkan ke dalam botol kultur sebanyak 20 ml/botol. Sterilisasi medium dengan menggunakan autoklaf dengan tekanan 17,5 psi, 121 0C selama 15 menit.
2. Persiapan medium seleksi
Medium medium Murashige & Skoog (MS) padat ditambah PEG 6000 dengan konsentrasi 0 % (kontrol), 5% , 10% , 15%, dan 20%. Sebelum digunakan, PEG 6000 yang telah dilarutkan dengan aquades pada
Selanjutnya PEG 6000 ditambahkan ke dalam medium MS. Sebelum digunakan, medium diinkubasikan selama 7 hari pada suhu kamar (25 oC) untuk memastikan bahwa PEG 6000 telah tersaring dengan baik. Apabila dalam waktu 7 hari tidak terjadi kontaminasi pada medium, maka medium dapat digunakan.
3. Penanaman planlet dalam medium seleksi PEG 6000
Eksplan yang digunakan berupa planlet steril. Planlet-planlet dari botol kultur dikeluarkan dengan scalpel steril dan satu-persatu diletakkan di atas cawan petri berdiameter 10 cm, kemudian planlet dipilah satu-satu, setelah itu ditanam pada masing-masing botol kultur yang berisi medium
perlakuan yang telah ditentukan seperti pada butir 2) di atas. Masing-masing konsentrasi dilakukan 5 ulangan dan setiap ulangan terdiri dari 2 eksplan pisang raja bulu dalam setiap botol kultur.
4. Pengamatan
33
a. persentase jumlah planlet yang hidup
Rumus yang digunakan untuk menghitung jumlah planlet pisang raja bulu yang hidup yaitu :
Jumlah planlet hidup
Jumlah Seluruh planlet (Nurcahyani et al., 2014)
b. visualisasi planlet, meliputi warna tunas yang terbentuk dengan
klasifikasi sebagai berikut: hijau, hijau dengan bagian tertentu berwarna cokelat, cokelat.
c. Indeks Stomata
Pembuatan preparat stomata dengan metode dari Ruzin (1999) sebagai berikut.
Daun planlet Musa paradisiaca dibuat potongan-potongan segi empat dengan sisi ± 5 mm dan dimasukkan ke dalam tabung berisi larutan kloralhidrat dalam air (5:1). Tabung dipanasi dalam waterbath selama ± 10-15 menit hingga potongan daun tersebut transparan. Potongan daun diletakkan dalam larutan khloralhidrat pada gelas benda.
Permukaan yang ada stomatanya diletakkan disebelah atas, kemudian ditutup dengan gelas penutup. Preparat diamati pada 5 bagian daerah yang berlainan. Tiap sel epidermis (E) ditandai dengan (x), tiap stoma (S) ditandai dengan (O). Indeks stomata besarnya dihitung dengan rumus: (Ruzin, 1999).
Hasil akhir adalah rata-rata dari 5 buah pengamatan. x 100%
S
d. Analisis kandungan klorofil
Bahan untuk analisis klorofil menggunakan daun planlet pisang raja bulu yang sudah diimbas dengan PEG 6000, menggunakan metode Harbourne (1987) dengan spektrofotometer. Adapun langkah kerjanya sebagai berikut.
Daun planlet pisang raja bulu yang seragam sebanyak 0,1 g dihilangkan ibu tulang daunnya, kemudian digerus dengan mortar (pestle) dan ditambahkan 10 mL aseton 80%. Setelah itu larutan disaring dengan kertas Whatman No. 1, dan dimasukkan ke dalam flakon serta ditutup rapat.
Larutan sampel dan larutan standar (aseton 80%) di ambil sebanyak 1 mL, kemudian dimasukkan dalam kuvet. Setelah itu dilakukan pembacaan serapan dengan spektrofotometer UV pada panjang gelombang (λ) 646 nm dan 663 nm, dengan ulangan tiap sampel sebanyak 3 kali. Kadar klorofil dihitung dengan menggunakan rumus sebagai berikut.
Klorofil total = 17,3 λ646 + 7,18 λ663 mg/L
Klorofil a = 12,21 λ663 –2,81 λ646 mg/L
Klorofil b = 20,13 λ646 –5,03 λ663 mg/L (Harborne, 1987).
e. Analisis kandungan prolin
35
ulangan). Daun ditumbuk dengan mortar di dalam larutan sulfosalisilat 3% sebanyak 10 ml kemudian disaring dengan kertas saring Whatman no. 1. Selanjutnya fitrat diambil sebanyak 2 ml, dimasukkan kedalam tabung reaksi, dan ditambah 2 ml asam ninhydrin. Asam ninhydrin dibuat dengan cara memanaskan 1,25 gram ninhydrin dalam 30 ml asam asetat glasial dan 20 ml asam fosforat. Pemanasan dilakukan dalam waterbath pada suhu 100 0C hingga larut.
Fitrat dalam asam Nidhydrin ditambah 2 ml asam asetat glasial kemudian dipanaskan pada suhu 100 0C selama 1 jam, reaksi diakhiri dengan memasukkan tabung reaksi berisi filtrat kedalam gelas piala berisi es. Campuran filtrat, asam ninhydrin dan asam asetat glisial ditambah 4 ml toluen dan digojok dengan stirrer selama 15-20 detik sehingga terbentuk 2 lapiasan cairan berwarna tidak sama. Toluen berwarna merah yang
mengandung prolin diambil dengan pipet, dimasukkan kedalam kuvet, dan Optical Density (OD) dibaca panjang gelombang 520 nm (Bates, 1973).
Hasil absorbansi larutan standar dibuat persamaan regresi linier sehingga diperoleh persamaaan: Y = ax +b . Nilai absorbansi sample selanjutnya dimasukkan sebagai nilai Y sehingga didapatkan nilai x (µ/mol).
Kadar prolin = (µ/mol prolin/ ml toluene)/ 115,13 µ/mol gram sample/5)
= µ mol prolin/ gram berat segar sample (Bates, 1973).
F. Analisis Data
V. SIMPULAN DAN SARAN
A. Simpulan
Kesimpulan yang diperoleh dari hasil penelitian ini meliputi:
1. Konsentrasi PEG 6000 toleran untuk seleksi planlet pisang raja bulu secara in vitro yaitu konsentrasi 20%.
2. Karakter ekspresi yang dihasilkan oleh perlakuan PEG 6000 terhadap planlet pisang raja bulu menghasilkan perbedaan karakter dengan kontrol.
a. Kandungan prolin pada planlet pisang raja bulu yang diberi perlakuan PEG 6000 pada konsentrasi 5%, 10%, 15% dan 20% mengalami peningkatan secara nyata.
b. Kandungan klorofil a, b dan total daun planlet pisang raja bulu dengan perlakuan PEG 6000 mengalami penurunan secara nyata, semakin tinggi konsentrasi PEG 6000, maka semakin menurun kandungan klorofilo a, b dan total daun planlet pisang raja bulu. c. Semakin tinggi konsenterasi PEG 6000, maka semakin meningkat
B. Saran
Adisyahputra, Reni I dan Eldina D. 2004. Karakterisasi Sifat Toleransi terhadap Cekaman Keringan Kacang Tanah (Archis hypogea L.) Varietas Nasional pada Tahap Perkecambahan. Jurnal Matematika Sains Teknologi Vol 5 No 1
Afa LD, Bambang S, Ahmad J, Oteng H, dan Iswari S. 2012. Pendugaan
Toleransi Padi Hibrida terhadap Kekeringan dengan Polyetilene Glycol (PEG) 6000. Jurnal Agrivigor 11(2) :292-299 ISSN 1412-2286
Anonymous. 2000. Pakez Teknologi Pisang. Jabatan Pertanian Semenanjung Malaysia. Bibilografi.MS 46 ISBN.983.047.075
Anonymous. 2002. Poly-Ethylene Glycols (PEGS) and the Pharmaceutical
industry. http://www.clariant.com /Polyethylene_glycols_(PEGs) and the_pharmaceutical_industry. Diakses 30 Oktober 2014 pukul 19.00 WIB
Anonymous. 2007. Prospek dan Arah Pengembangan Agrobisnis Pisang. Edisi Kedua Departemen Pertanian. Badan Penelitian dan Perkembangan Pertanian. Hlm 1-28
Anonymous. 2008. a. Data Produksi Hortikultura. Basis Data Pertanian. Departemen Pertanian. Http://www.deptan.go.id. Diakses 30 Oktober 2014.
Anonymous. 2008. b. Teknologi Budidaya Pisang. Balai Besar Pengkajian dan Pengembangan teknologi Pertanian. Seri Buku Inovasi .ISBU : 978-979-1415-27.9
Anonymous .2013. Strukture Proline. http://mpbio.com/Structure_Proline / product.php. Diakses 11 Oktober 2014 pukul 16.58 WIB
Anonymous. 2014. Budidaya Pisang Raja Bulu Kuning. Dinas Pertanian Tanaman Pangan dan Hortikultura Provinsi Jawa Tengah. http://dinpertantph. jatengprov.go.id/berita 210514a.html. Diakses tanggal 05 November 2014 pukul 15.45 WIB
Anonymous. 2014. Proline. http://en.wikipedia.org/wiki/Proline. Diakses 11 oktober 2014 pukul 16.30 WIB
Aryulina D, Muslim C, Manaf S dan Winarni EW. 2006. Biologi 2. Penerbit Erlangga. Jakarta
Ashari S. 1995. Hortikulture Aspek Budidaya. Universitas Indonesia (UI Press). Jakarta. Hlm.375-377
59
Bidabadi SS, Mahmood M, Baninasah B and Ghobadi C. 2012. Influence of Salicylic Acid on Morphological and Physiologycal Responses of Banana (Musa acuminata cv. Berangan, AAA) Shoot Tips to In Vitro water Stress Induced by Polyetilene Glycol. Plant Omics Journal. POJ 5(1) : 33-39
Cahyono B. 2009. Pisang Usaha Tani dan Penanganan Pascapanen. Revisi kedua. Penerbit Kanisius. Yogyakarta. Hlm. 85
Djazuli M. 2010. Pengaruh Cekaman Kekeringan terhadap Pertumbuhan dan Beberapa Karakter Morfo- Fisiologis Tanaman Nilam. Bul.Littro Vol 21 No 1 : 8-17
Efendi R, Sudarsono SI dan Sulistiono E. 2009. Seleksi Dini Toleransi Genotipe Jagung Terhadap Kekeringan. Jurnal Penelitian Pertanian Tanaman Pangan Vol 2 No 2
Gunawan B dan Azhari CD. 2010. Karakterisasi Spektofotometri dan Scaning Electron Microcopy (SEM) Sensor Gas dari Bahan Polimer Poly-Etilene Glycol (PEG). Jurnal ISSN :1979-6870
Gunawan L W. 1987. Teknik Kultur Jaringan. Pusat Antar Universitas IPB: Bogor
Harahap RI, Siregar AM dan Bayu ES. 2013. Pertumbuhan Akar Pada
Perkecambahan Beberapa Varietas Tomat dengan Pemberian Polyetilene Glycol (PEG) secara In vitro. Jurnal Online Agroteknologi Vol 1 No 3. ISSN.No 2337-6597
Homayoun H, Daliri MS and Mehrabi P. 2011. Effect of Drough Stress on Leaf Chlorophyll in Corn Cultivars (Zea mays). Middle-East Journal of Scientific Research 9 (3) :418-420
Harborne JB. 1987. Metode Fitokimia dan Penurunanan cara Modern
Menganalisis Tumbuhan. Diterjemahkan Oleh : K. Padmawinata dan I. Joediro. Cetakan ke 2. Penerbit ITB. Bandung, hal : 234-244
Hemon AF. 2009. Induksi Mutasi dengan Iradiasi Sinar Gamma Dan Seleksi In Vitro Untuk Mendapatkan Embrio Somatik Kacang Tanah Yang Toleran Polietilena Glikol. Jurnal Agrotropika 14(2): 67-72
Hemon AF, Syarifinnur, Ujianto L dan Sumarjan. 2012. Uji Toleransi Galur Kacang Tanah Hasil Iradiasi Sinar Gamma Terhadap Larutan Polietilen Glikol. Jurnal Agrotropika 17(2): 81-85
Hendriyani IS dan Nantya S. 2009. Kandungan Klorofil dan Pertumbuhan Kacang Panjang (Vigna sinensis) pada Tingkat Penyediaan Air yang Berbeda. Jurnal Sains dan matematika Vol 17 No.3
Hu CA, AJ Delauney and DPS Verma. 1992. A Bifunctional Enzyme (Delta Pyrroline- Decarboxylase Synthetase) Catalyzez the First Two Step In Proline Biosynthesis in Plants. Proc. Natd. Acad. Sci. USA Vol. 89. 89: 9354-9358
Islami T dan Utomo WH. 1995. Hubungan Tanah, Air dan Tanaman. IKIP Semarang Press. Semarang. Hlm. 215-235
Jain M, Mini M, and Rekha G. 2013. Effect of PEG-6000 Imposed water Deficit on Chlorophyll Metabolism in Meize Leaves. Journal of Stress
Physiology and Biochemistry. Vol. 9 No. 3
Kartikaningtyas D, Quiresia O, Suharyanto dan Sunarti S. 2013. Respon Anatomis Acacia mangium Willd. terhadap Kondisi Cekaman Garam : Observasi Awal untuk Program Pemuliaan Tanaman. Wana Benih Vol. 14 No. 2 Kholova J, Hash, CT Kakkera, Kocova AM & Vadez V. 2010. Constitutive
water-conserving mechanisms are correlated with the terminal drought
tolerance of Pearl Millet [Punnisetum glaucoma (L.) R. Br.]. Journal of Experimental Botany 61(2): 369-377.
Lehman S, Funck D and Szabados L. 2010. Proline Metabolism and Transport in Plant Develoment. Amino Acid 39 (4):949-962
Lestari EG. 2006. Hubungan antara Kerapatan Stomata dengan Ketahanan Kekeringan pada Somaklon Padi Gajahmungkur, Towuti, dan IR 64. Biodeversitas Vol 7. No. 1 Hlm. 44-48
Li H, X Li, Zhang D, Liu H and Guan K. 2013. Effects Of Drought Stress On The Seed Germination And Early Seedling Growth Of The Endemic Desert Plant Eremosparton Songoricum (Fabaceae). EXCLI Journal 12:89-101 ISSN 1611-2156
Lisar SY, Motafakkerazad R, Mosharraf MH and Ismail MMR. 2012. Water Stress in Plants: Causes, Effects and Responses, Water Stress, Prof. Ismail Md. Mofizur Rahman (Ed.), ISBN: 978-953-307-963-9, InTech, Available from: http://www.intechopen.com/books/water-stress/water-stress-inplants-causes-effects-and-responses Diakses tanggal 20 Oktober 2014 pukul 19.00 WIB
61
Nio SA, Tondais SM dan Butarbutar R. 2006. Evaluasi Indikator Toleransi Cekaman Kekeringan pada Fase Perkecambahan Padi (Oryza sativa L.). Jurnal Ilmiah Sains Vol 11 No 2
Nio SA dan Banyo Y. 2011. Konsenterasi Klorofil Daun sebagai Indikator Kekurangan Air pada Tanaman. Jurnal Ilmiah Sains Vol 11 No 2 Nugraheni IT, Solichatun dan E Anggarwulan. 2003. Pertumbuhan dan
Akumulasi Prolin Tanaman Orok-orok (Crotalaria juncea L.) pada Salinitas CaCl2 Berbeda. Bio SMART Vol.5 Hal: 98-101 ISSN: 1411-321X
Nuswamarhani S, Prihatini D dan Endang PP. 1999. Mengenal Buah Unggul Indonesia. PT Penebar Swadaya. Bogor. Hlm. 95-97
Nurcahyani E, Hadisutrisno B, Sumardi I dan Suharyanto. 2014. Identifikasi Galur Planlet Vanili (Vanilla planifolia Andrews) Resisten terhadap Infeksi Fusarium oxysporum f. Sp. Vanillae hasil seleksi in vitro dengan Asam Fusarat. Prosiding Seminar Nasional: “ Pengendalian Penyakit Pada Tanaman Pertanian Ramah Lingkungan”. Perhimpunan
Fitopatologi Indonesia Komda Joglosemar- Fakultas Pertanian UGM. ISBN 978- 602- 71784-0-3./2014 Hal. 272-279.
Pillay M and Tenkouano A. 2011. Banana Breeding Progress and Challengs. CRC Press. United States of America. Hlm. 24-25
Prabawati S, Suyanti dan Setyabudi D A. 2008. Teknologi Pascapanen dan Teknik Pengolahan Buah Pisang. Balai Besar Penelitian dan Pengembangan Pasca Panen Pertanian.Badan Penelitian dan Pengembangan Pertanian. Hlm. 1-51
Prihastanti E. 2012. Peranan dan Pola Akumulasi Prolin tanaman pada Adaptasi Cekaman Kekeringan. Prosiding Seminar Nasional IX Biologi. PP 594-597 ISSN ISBN
Purwanto dan Agustono T. 2010. Kajian Fisiologi Tanaman Kedelai pada Cekaman Kekeringan dan Berbagai Kepadatan Gulma Teki. Agrobisnis 12 (1):24-28
Radiya M . 2013.Konsenterasi Morfologi Tanaman Pisang (Musa paradisiaca L.) di Kabupaten Agam. Journal Universitas Padang
http://www.journal.unitas pdg.ac.id
/downlotfilemh.php?file=KARAKTERISASI%20MORFOLOGI%20TANA MAN.pdf. Diakses tanggal 20 Oktober 2014 pukul 20.00 WIB
Rahayu ES, Edi G, Satriyas I dan Sudarsono. 2005. Poly Etilene Glikol (PEG) dalam Media In Vitro Menyebabkan Kondisi Cekaman yang
Ruzin SE. 1999. Plant Microtechnique and Microscopy. Oxford University Press. New York. 307 p.
Savitri ES. 2010. Pengujian in vitro Beberapa Varietas Kedelai (Glycine max l. Merr) Toleran Kekeringan Menggunakan Polyethylene Glikol (PEG) 6000 pada Media Padat dan Cair. El-Hayah Vol. 1 No.2
Setiawan T dan Shiddieq D. 2013. Pengaruh Cekaman Kurang Air terhadap Beberapa Karakter Fisiologis Tanaman Nilam (Pogostemon cablin Benth). Jurnal Littri 19 (3) Hlm.108-116 ISSN 0853-8212
Sobir. 2009. Buku Pintar Budi Daya Tanaman Buah Unggul Indonesia. Redaksi AgroMedia. Bogor
Soni P, Rizwan1 M, Bhatt KV, Mohapatra T and Govind S. 2011. In-vitro
response of Vigna aconitifolia to drought stress induced by PEG – 6000. Journal of Stress Physiology & Biochemistry, Vol. 7 No. 3
Suhardiman P. 1997. Budidaya Pisang Cavendish. Penerbit Kanisius.Yogyakarta. Hlm. 9-18
Sumarjan dan Hemon AF. 2009. Efektivitas Polietilena Glikol dan Manitol Sebagai Agens Penyeleksi In Vitro untuk Cekaman Kekeringan Terhadap Pertumbuhan Embrio Somatik Kacang Tanah. Crop agro Vol. 2 N0.1 Suryowinoto M. 1996. Pemuliaan Tanaman secara In Vitro. Penerbit Kanisius.
Yogyakarta. Hlm.189-190
Susanti, AA. 2014. Outlook Komoditi Pisang. Pusat Data dan Sistem Informasi Pertanian Sekretariatan Jenderal-Kementerian Pertanian. ISSN: 1907-1507. Hlm. 1-74
Sutjahjo SH, Kadir A dan Mariska I. 2007.Efektivitas Polietilen Glikol Sebagai Bahan Penyeleksi Kalus Nilam Yang Diiradiasi Sinar Gamma Untuk Toleransi Terhadap Cekaman Kekeringan. Jurnal Ilmu-Ilmu Pertanian Indonesia. Volume 9, No. 1, Hlm. 48 – 57
Suyanti dan Supriadi A. 2008. Pisang Budidaya Pengolahan dan Prospek Pasar. Penebar Swadaya. Depok. Hlm. 6-12
Suyitno Al, Suryani D dan Ratnawati. 2003. Tanggapan Stomata dan Laju Transpirasi Daun vaccinium varingiaefolium (bl.) Miq. Menurut Tingkat Perkembangan Daun dan Jarak terhadap Sumber Emisi Gas Belerang Kawah Sikidang Dataran Tinggi Dieng. Publikasi Seminar Hasil Penelitian MIPA, FMIPA UNY
63
Tawfik KM. 2008. Effect of Water Stress in Addition to Potassiomag Application on
Mungbean. Australian Journal of Basic and Applied Sciences, 2(1):
42-52. ISSN 1991-8178
Tsago Y, Mebeaselassie A, Takele A. 2013. In Vitro Screening for Drought Tolerance in Different Sorghum (Sorghum bicolar .L) Moench Varieties. Journal of Stress Physiology and Biochemistry Vol 9 No 3 PP 72-83 ISSN 1997-0838
Utaminingsih. 2012. Mikrosporagenesis Cabai Merah Besar (Capsicum annum L.) Akibat Cekaman Kekeringan. Tesis. Program Studi Biologi Universitas Gajah Mada Yogyakarta.
Wahyudi T, Panggabean TR dan Pujiayanto. 2008. Kakau Manajemen Agribisnis dari Hulu hingga Hilir. Penebar Swadaya. Hlm. 1-151
Wani SH, Parves AS, Satbir SG and Naorem BS. 2010. In Vitro Screening of Rice (Oryza sativa L.) Callus for Drought Tolerance. Journal communication in biometry and crop science Vol 5 No 2 pp108-115
Watter LR dan Constabel F. 1991. Metode Kultur Jaringan Tanaman. Penerbit ITB. Bandung. Alih bahasa Widianto MB. Hlm.1-3
Welsh JR. 1991. Dasar-Dasar Genetika dan Pemuliaan Tanaman. Penerbit Erlangga. Jakarta. Alih bahasa Mogea JP. Hlm. 204-207
Widodo W dan Sumarsih S. 2007. Seri Budidaya Jarak Kepyar, Tanaman
Penghasil Minyak Kaptor untuk Berbagai Industri. Kanisius. Yogyakarta Hlm. 1-117
Widoretno W. 2003. Seleksi In vitro untuk Toleransi terhadap Cekaman Kekeringan pada Kedelai (Glycine max (L). Merr.) dan Karakterisasi Varian Somaklonal yang Toleran. Tesis. Pascasarjana ITB Bogor. Widyastuti EY dan Paimin F. 1993. Mengenal Buah Unggul Indonesia. PT
Penebar Swadaya. Jakarta. Hlm 188-202
Yuliarti N. 2010. Kultur Jaringan Tanaman Skala Rumah Tangga. ANDI OFFSET. Yogyakarta. Hlm. 15-16