ABSTRAK
SHAVIKA MIRANTI. Penggunaan Campuran Tepung Meniran-Bawang Putih dalam Pakan untuk Pengendalian Infeksi Vibrio alginolyticus pada Benih Ikan Kerapu Macan Epinephelus fuscoguttatus. Dibimbing oleh DINAMELLA WAHJUNINGRUM dan IRZAL EFFENDI.
Penelitian bertujuan untuk mengetahui efektifitas campuran meniran-bawang putih dalam pakan sebagai upaya pengendalian penyakit bakteri V. alginolyticus
pada benih ikan kerapu macan. Penelitian terdiri dari uji in vitro dari beberapa kombinasi dosis meniran+bawang putih (15+20, 15+25, 20+20, 20+25 dan 25+20 g/L) dalam menghasilkan zona hambat. Kombinasi 20+25 g/L membentuk 12,33 mm zona hambat, hasil terbaik. Dosis tersebut digunakan dalam pakan untuk uji in vivo. Uji in vivo terdiri dari 4 perlakuan yaitu kontrol negatif, kontrol positif, pencegahan dan pengobatan. Uji ini dilakukan pada benih kerapu macan (panjang 7,74±0,27 cm dan bobot 12,50±0,394 g) berasal dari Kepulauan Seribu, dipelihara di akuarium (60x30x30 cm3) dengan kepadatan 6 ekor/akuarium. Pakan uji (dosis pencegahan 20+25 g/kg pakan) diberikan selama 14 hari pada perlakuan pencegahan sedangkan pada perlakuan kontrol negatif, positif dan pengobatan diberikan pakan komersil. Setelah itu, ikan perlakuan kontrol positif, pencegahan dan pengobatan diinjeksi bakteri V. alginolyticus sebanyak 0,1 ml dengan kepadatan 104 cfu/ml sedangkan ikan perlakuan kontrol negatif hanya diinjeksi dengan PBS. Selanjutnya dilakukan pengamatan selama 7 hari. Pada ikan perlakuan pengobatan diberikan pakan uji (dosis pengobatan 40+50 g/kg pakan) dan pada perlakuan lainnya diberikan pakan komersil. Parameter yang diamati adalah respon makan, laju pertumbuhan harian, kelangsungan hidup, hematologi, organ dalam dan kualitas air. Hasil dari penelitian ini menunjukkan bahwa campuran meniran dan bawang putih dalam pakan efektif diberikan pada tahap pencegahan yaitu dengan dosis meniran+bawang putih 20+25 g/kg pakan dan tahap pengobatan dengan dosis 40+50 g/kg pakan. Pakan dengan kandungan meniran-bawang putih ini berpengaruh nyata terhadap kelangsungan hidup ikan yaitu pada perlakuan pencegahan 83,33% dan pengobatan 61,11%.
ABSTRACT
SHAVIKA MIRANTI. The use of Phyllanthus niruri-Allium sativum
combination powder in fish feed for direction Vibrio alginolyticus infection in tiger grouper Epinephelus fuscoguttatus. Supervised by DINAMELLA WAHJUNIGRUM ang IRZAL EFFENDI.
The purpose of this research was to determined the effectivity of Phyllanthus niruri-Allium sativum powder in fish feed for controlling
Vibrio alginolyticus infection on tiger grouper Epinephelus fuscoguttatus. In vitro test was conducted to evaluated Phyllanthus niruri-Allium sativum dosage combination (15+20, 15+25, 20+20, 20+25 and 25+20 g/L) to inhibit bacterial fish pathogen. The dosage combination of 20+25 g/L was given the highest inhibitory zone (12,33 mm in diameter) and this dosage was used for in vivo test. In vivo test consisted of four treatments; negative control, positive control, preventive dan curative. Tiger grouper (length 7,74±0,27 cm and weight 12,50±0,394 g) were reared in aquarium (60x30x30 cm3) with stocking density of 6 fishes/aquarium. The preventive teratment was fed with feed treatment (20+25 g/kg of feed) for 14 days, while the others treatment was fed with commercial feed. The 0,1 ml of V. alginolyticus at concentration of 104 cfu/ml were injected to fishes of positive control, preventive and curative treatment while negative control fishes were injected with PBS. Curative treatment fishes were given treatment feed (40+50 g/kg of feed) and negative control, positive control and preventive treatment fishes were given with commercial feed. The fish feed response, growth rate, survival rate, hematology, anatomy and water quality were observed for 7 days after injected. The result of research showed that suplemented of Phyllanthus niruri-Allium sativum in fish feed at preventive and curative treatment showed better survival rate, 83,33 % and 61,11 % respectively, than positive control 38,89 % (P<0,05).
1
I. PENDAHULUAN
1.1 Latar Belakang
Ikan kerapu macan (Epinephelus fuscoguttatus) merupakan salah satu komoditas perikanan budidaya yang memiliki prospek usaha yang sangat baik. Ikan ini memiliki harga cukup tinggi yaitu sekitar Rp. 110.000/kg untuk ukuran konsumsi (dalam kondisi hidup) dan Rp. 1000/cm untuk ukuran benih serta memiliki permintaan yang cukup tinggi di pasar Internasional (Handolok, 2009). Sejauh ini Indonesia menjadi pemasok utama ikan kerapu terutama ke Hongkong, Cina dan Singapura (Afero et al. 2010). Produksi ikan kerapu juga terus mengalami peningkatan berdasarkan data statistik Kementrian Kelautan dan Perikanan (KKP), produksi Indonesia pada 2006 sebanyak 4.021 ton, pada 2008 mencapai 5.005 ton dan pada 2009 terus naik menjadi 5.300 ton (KKP, 2011). Hal ini menunjukkan ikan kerapu semakin dibutuhkan oleh pasar.
Budidaya ikan kerapu macan baik pendederan maupun pembesaran biasanya dilakukan menggunakan teknik keramba jaring apung (KJA) yang tentunya tidak terlepas dari permasalahan. Salah satu masalah yang dihadapi adalah tingginya tingkat kematian akibat ukuran benih yang ditebar masih rentan terhadap penyakit. Menurut Rahayu (2009), salah satu penyakit yang sering menyerang benih ikan kerapu macan di KJA adalah penyakit bakterial yaitu vibriosis yang disebabkan bakteri Vibrio sp. Pada penelitian Herfiani (2011) ditemukan jenis Vibrio sp. yang banyak menyerang kerapu macan adalah
2 dan perkembangbiakan hingga mencapai quorum sensing dan menjadi patogen untuk menyerang sistem imun non spesifik seperti sisik dan kulit ikan sehingga dapat masuk ke dalam jaringan tubuh dan menyerang sistem imun spesifiknya sehingga membuat ikan menjadi sakit (Todar, 2002 dalam Sarjito et al., 2007). Pada penelitian Herfiani (2011) bakteri V. alginolyticus ini patogen pada konsentrasi bakteri 104 cfu/ml. Bakteri ini kemudian akan mengeluarkan produk ekstraseluler yaitu toksin yang sangat berbahaya pada organ-organ target seperti usus dan ginjal. Toksin yang dikeluarkan diantaranya adalah haemolysin yang dapat merusak sel darah merah hingga pecah dan keluar dari pembuluh darah yang membuat jaringan kulit pada mulut dan sirip seperti luka kemerahan (Sudheesh dan Xu, 2001). Menurut Koesharyani et al. (2001), penyakit yang disebabkan oleh bakteri ini memperlihatkan gejala klinis seperti borok pada pangkal sirip ekor, sirip yang busuk dan mulut merah serta menyebabkan kematian dengan tingkat mortalitasnya dapat mencapai 20-30%. Hal tersebut pernah terjadi di Kepulauan Seribu dengan kematian ikan mencapai 80% (Rahayu, 2009). Selain tingkat kematian yang tinggi, ikan yang sakit juga mengalami abnormalitas organ tubuh seperti bentuk tubuh abnormal (bengkok), tubuh kurus dan lemah, nafsu makan berkurang, dan sirip ekor geripis. Hal ini tentunya akan menghambat pertumbuhan ikan sehingga dapat menurunkan target produksi.
3 Tanaman obat yang mengandung antibakteri dan imunostimulan serta telah digunakan dalam beberapa penelitian diantaranya adalah meniran (Phyllanthus niruri) dan bawang putih (Allium sativum). Pada bawang putih terdapat zat antibakteri yang berasal dari senyawa allicin. Menurut Palungkun dan Budiarti (1998) allicin memiliki aktifitas antibakteri pada bakteri Gram negatif maupun positif. Pada daun meniran diduga senyawa potensial yang berperan sebagai antimikroba adalah flavonoid, disamping itu senyawa ini juga berperan sebagai imunostimulan, antioksidan, antikarsinogen, hepatoprotektor dan antialergi (Sabir dan Rocha, 2008). Campuran kedua bahan tersebut dalam pakan (repelleting) terbukti dapat menekan angka kematian ikan yang terserang penyakit akibat bakteri. Pakan dengan campuran meniran-bawang putih yang diberikan selama 14 hari menghasilkan kelangsungan hidup sebesar 73,33% pada ikan lele yang diuji tantang dengan bakteri Aeromonas hydrophila (Widiani, 2011) dan 83,33% pada ikan nila yang diuji tantang dengan bakteri Streptococcus agalactiae
(Fauziah, 2012). Pada penelitian ini, campuran meniran-bawang putih diujikan untuk pencegahan dan pengobatan penyakit akibat bakteri V. alginolyticus pada benih kerapu macan.
1.2 Tujuan
4
II. METODOLOGI
2.1 Metode Penelitian
Penelitian ini terdiri dari dua uji utama yaitu uji in vitro dan uji in vivo. Identifikasi dan peningkatan virulensi bakteri uji, penentuan nilai LD50
(Lethal Dosage50) serta pembuatan ekstrak meniran-bawang putih yang dilakukan
sebelum uji in vitro dimulai. Selanjutnya pembuatan pakan perlakuan, persiapan wadah dan ikan uji dilakukan sebelum uji in vivo dimulai.
2.1.1 Identifikasi Bakteri Uji
Bakteri yang digunakan pada penelitian ini berasal dari isolat bakteri yang diperoleh dari Balai Budidaya Air Payau Situbondo, Jawa Timur yang diketahui sebagai Vibrio alginolyticus. Isolat bakteri dibiakkan kembali pada agar miring SWC (sea water complete) lalu diinkubasi pada suhu 28 °C selama 24 jam untuk diidentifikasi ulang di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Identifikasi ulang dilakukan untuk memastikan tidak adanya kontaminan pada isolat bakteri yang meliputi uji karakterisasi fisiologi dan biokimia bakteri yang terdiri dari pewarnaan Gram, uji oksidatif/fermentatif, uji motilitas, uji katalase dan uji oksidase (Holt et.al, 1994). Setelah hasil uji isolat bakteri menunjukkan karakter fisiologi dan biokimia yang sama dengan V. alginolyticus (Lampiran 1), dilakukan peremajaan bakteri ke agar miring SWC dari stok sebelumnya.
2.1.2 Peningkatan Virulensi Bakteri Uji
5 dicuci dengan 1 ml PBS (phosphate buffer saline) lalu divortex dan disentrifuse kembali dan buang supernatannya (dilakukan sebanyak 2 kali). Setelah itu 1 ml PBS dicampurkan kembali dengan endapan yang sudah dicuci selanjutnya divortex dan diambil 0.2 ml untuk diinjeksikan secara intraperitoneal (diantara sirip ventral dan anal) pada satu ekor ikan kerapu macan untuk menguji virulensinya. Setelah ikan menunjukkan gejala klinis seperti hemoragi pada rahang mulut atau sirip yang kemerahan, ikan dibedah dan dilakukan reisolasi bakteri dengan menggoreskan jarum ose steril ke bagian ginjal, empedu, limpa, usus dan organ lainnya yang menunjukkan kelainan kemudian dibiakkan di media TCBS (Thiosulphate Citrate Bile-salt Sucrose) dan diinkubasi selama 24 jam pada suhu 28 oC. Untuk mendapatkan biakan murni maka setiap koloni bakteri yang tumbuh terpisah dan berlainan morfologinya dibiakkan kembali ke dalam agar miring SWC dan diinkubasi pada suhu 28 oC selama 24 jam selanjutnya diidentifikasi kembali yang meliputi uji oksidatif/fermentatif, uji oksidase, uji katalase, uji motilitas dan pewarnaan Gram (Holt et.al, 1994) untuk memastikan kelainan yang terjadi pada organ-organ tersebut disebabkan oleh bakteri yang dinjeksikan. Bakteri hasil uji postulat Koch inilah yang akan digunakan pada uji selanjutnya.
2.1.3 Penentuan Nilai LD50 (Lethal Dosage50)
Penentuan nilai LD50 ini penting dilakukan untuk mengetahui konsentrasi
bakteri yang akan digunakan pada uji tantang karena pada uji ini akan diketahui konsentrasi bakteri yang dapat menyebabkan kematian hingga setengah dari populasi ikan uji. Untuk uji LD50 disiapkan 6 akuarium yang diisi masing-masing
6 perhitungan dilakukan diperoleh konsentrasi bakteri yang digunakan pada uji tantang adalah 104 cfu/ml.
2.1.4 Pembuatan Ekstrak Meniran Phyllanthus niruri-Bawang Putih
Allium sativum
Tepung meniran-bawang putih yang digunakan pada penelitian ini berasal dari BALITTRO (Balai Penelitian Tanaman Obat dan Aromatika) Bogor, Jawa Barat. Tepung meniran-bawang putih digunakan sebagai bahan dasar pembuatan ekstrak meniran-bawang putih untuk uji in vitro. Ekstrak meniran didapatkan dengan melarutkan tepung meniran dengan akuades steril yang kemudian direbus selama 15 menit pada suhu 90 °C (Lampiran 4) sedangkan ekstrak bawang putih didapatkan dengan melarutkan tepung bawang putih dengan akuades steril saja (Lampiran 5) (Fauziah, 2012).
2.1.5 Uji In Vitro
Uji in vitro ini dilakukan untuk melihat aktivitas antibakteri dari bahan tanaman yang digunakan terhadap bakteri uji dengan metode Kirby-Bauer (Lay, 1994). Sebelumnya dipersiapkan campuran ekstrak meniran dan bawang putih dalam beberapa kombinasi dosis yaitu 15+20, 15+25, 20+20, 20+25 dan 25+20 g/L. Hal ini dilakukan untuk melihat dosis yang paling efektif menghambat pertumbuhan bakteri uji dalam media agar plate SWC yang digunakan (Lampiran 6). Selanjutnya suspensi bakteri dengan kepadatan paling virulen dari uji LD50
7
2.1.6 Pembuatan Pakan Perlakuan
Pakan perlakuan yang digunakan pada penelitian ini yaitu pakan
repelleting dimana pakan komersil (protein 45,11 %) ditepungkan kembali kemudian dicetak setelah dicampurkan dengan bahan tambahan masing-masing perlakuan. Pakan tanpa campuran meniran-bawang putih dalam penelitian ini tetap disebut sebagai pakan komersil dan pakan yang mengandung campuran meniran-bawang putih disebut sebagai pakan uji.
2.1.6.1 Pakan Komersil
Pakan komersil pada penelitian ini hanya mendapat tambahan vitamin C 0,1%. Pakan ini diberikan selama 14 hari sebelum uji tantang pada perlakuan kontrol negatif, positif dan pengobatan. Setelah uji tantang hanya diberikan pada perlakuan kontrol negatif, kontrol positif dan pencegahan.
2.1.6.2 Pakan Uji
Pakan uji dalam penelitian ini dibedakan menjadi dua yaitu pakan uji perlakuan pencegahan dan pengobatan. Untuk pakan pencegahan, dosis tepung meniran-bawang putih yang digunakan didapat dari hasil uji in vitro yaitu 20+25 g/kg pakan sedangkan pakan pengobatan menggunakan 2 kali dosis yang digunakan pada pakan pencegahan (Angka, 2005) yaitu 40+50 g/kg pakan. Selain itu, pada pakan pencegahan dan pengobatan juga ditambahkan vitamin C 0,1%. Pakan pencegahan diberikan selama 14 hari sebelum uji tantang pada perlakuan pencegahan dan pakan pengobatan diberikan pada perlakuan pengobatan setelah uji tantang.
2.1.7 Persiapan Wadah
8
2.1.8 Persiapan Ikan Uji
Benih kerapu macan yang digunakan memiliki panjang rata-rata 7,74±0,27 cm dengan bobot rata-rata 12,50±0,394 g yang berasal dari Kepulauan Seribu. Ikan kerapu macan diadaptasikan dalam akuarium selama 1-2 minggu sebelum perlakuan dilakukan. Setiap akuarium diisi ikan sebanyak 6 ekor. Selama proses adaptasi ini ikan diberi pakan 3 kali sehari yaitu pagi, siang dan sore hari serta dilakukan kontrol kualitas air pada tahap adaptasi ini.
2.1.9 Uji In Vivo
Uji in vivo dilakukan untuk mengetahui pengaruh dosis campuran meniran-bawang putih yang digunakan dalam pakan terhadap kelangsungan hidup
ikan kerapu macan setelah diinfeksi bakteri uji. Pakan diberikan secara
at satiation dengan FF (Feeding Frequency) 3 kali sehari yaitu pagi, siang dan sore hari. Pada uji in vivo ini terdiri dari 4 perlakuan dengan 3 ulangan yaitu kontrol negatif, kontrol positif, pencegahan dan pengobatan. Selama uji in vivo
berlangsung dilakukan pengamatan parameter penelitian dan kualitas air dari masing-masing perlakuan. Skema uji in vivo disajikan dalam Gambar 1.
Kontrol negatif : 14 hari pertama ikan diberi pakan komersil, lalu ikan diinjeksi secara intraperitoneal dengan PBS 0,1 ml/ekor dan 7 hari selanjutnya ikan tetap diberi pakan komersil
Kontrol positif : 14 hari pertama ikan diberi pakan komersil, lalu ikan diuji tantang (injeksi secara intraperitoneal dengan V. alginolyticus
0,1 ml/ekor) dan 7 hari selanjutnya ikan tetap diberi pakan komersil
Pencegahan : 14 hari pertama ikan diberi pakan uji, lalu ikan diuji tantang
(injeksi secara intraperitoneal dengan V. alginolyticus 0,1 ml/ekor) dan 7 hari selanjutnya ikan diberi pakan komersil
Pengobatan : 14 hari pertama ikan diberi pakan komersil, lalu ikan diuji tantang (injeksi secara intraperitoneal dengan V. alginolyticus
9 Gambar 1. Skema uji in vivo pada penelitian penggunaan campuran tepung meniran-bawang putih dalam pakan untuk pengendalian infeksi
Vibrio alginolyticus pada benih ikan kerapu macan (Epinephelus fuscoguttatus)
2.2 Parameter Pengamatan
2.2.1 Respons Makan Ikan terhadap Pakan
Pengamatan respon makan ikan terhadap pakan dilakukan dari awal hingga akhir perlakuan. Parameter ini diamati saat pemberian pakan dan dilakukan pada setiap perlakuan. Parameter ini dihitung melalui perbandingan jumlah pakan yang dimakan ikan setiap harinya dengan bobot biomassa ikan (Setyotomo, 2011).
2.2.2 Laju Pertumbuhan Harian
Untuk mengetahui laju pertumbuhan harian, bobot ikan ditimbang saat awal dan akhir perlakuan kemudian dihitung raatan bobotnya. Laju pertumbuhan harian (α) ikan dapat dihitung menggunakan rumus (Huisman, 1987) :
Kontrol (-)
Kontrol (+)
Injeksi bakteri 104 cfu/ml
Pakan komersil Pakan komersil
H-14 H-1 H0 H1 H7
Injeksi PBS
Pakan komersil Pakan komersil
H-14 H-1 H0 H1 H7
Pencegahan
Injeksi bakteri 104 cfu/ml
Pakan uji Pakan komersil
H-14 H-1 H0 H1 H7
Pengobatan
Injeksi bakteri 104 cfu/ml
Pakan komersil Pakan uji
10 Keterangan :
Wt = bobot rataan akhir (gram) Wo = bobot rataan awal (gram)
2.2.3 Kelangsungan Hidup
Kelangsungan hidup ikan diamati setiap hari hingga akhir perlakuan. Perhitungan kelangsungan hidup dilakukan di akhir perlakuan dengan rumus sebagai berikut (Effendie, 1997) :
Keterangan : Nt = Jumlah ikan akhir (ekor) No = Jumlah ikan awal (ekor)
2.2.4 Parameter Hematologi
Pengamatan hematologi dilakukan saat H-2 sebelum uji tantang dan H1, H4 dan H7 setelah uji tantang. Parameter yang diamati yaitu aktifitas fagositosis, jumlah leukosit, jumlah eritrosit, kadar hematokrit dan kadar hemoglobin.
Pengambilan darah ikan dilakukan dengan alat suntik steril yang telah dibilas dengan Na-sitrat 3,8% sebagai antikoagulan darah. Darah ikan diambil ± 0,2 ml setiap ikan uji dari masing-masing perlakuan (2 ulangan) dengan cara ditarik perlahan setelah darah mengalir dengan sendiri ke dalam suntikan yang ditusuk pada bagian vena caudalis. Kemudian darah ditempatkan pada mikrotube untuk dilakukan pengamatan hematologinya.
2.2.4.1 Aktifitas Fagositosis
11 5-10 menit dan dikering udarakan lalu diwarni dengan perendaman 10-15 menit di Giemsa kemudian dibilas dengan akuades. Setelah kering, preparat diamati dibawah mikroskop dan dihitung persentase sel yang aktif menunjukkan proses fagositosis dari 100 sel fagosit yang teramati. Persentase aktifitas fagositosis dapat dihitung menggunakan rumus berikut (Anderson dan Siwicki, 1993) :
2.2.4.2 Sel Darah Putih (Leukosit)
Darah diambil dengan pipet bulir putih sampai skala 0,5 lalu hisap larutan Turk sampai skala 11. Setelah itu pipet diputar membentuk angka delapan selama 3-5 menit, 2 tetesan pertama dibuang, tetesan selanjutnya dialirkan ke dalam hemasitometer sampai membentuk rambatan cairan pada kaca penutup hemasitometer. Jumlah leukosit dihitung di bawah mikroskop pada 5 kotak besar hemasitometer kemudian dilakukan perhitungan menggunakan rumus berikut (Blaxhall dan Daisley, 1973 dalam Alifuddin, 1999) :
2.2.4.3 Sel Darah Merah (Eritrosit)
12
2.2.4.4 Kadar Hematokrit
Darah diambil dengan tabung mikrohematokrit dengan sistem kapiler sampai ¾ bagian tabung, ujung tabung disumbat dengan crytoseal. Setelah itu, tabung disentrifuse 3000 rpm 5 menit. Kadar hematokrit dihitung dengan membandingkan tinggi endapan darah terhadap total darah dalam tabung mikrohematokrit dengan rumus sebagai berikut (Anderson dan Siwicki, 1993) :
2.2.4.5 Kadar Hemoglobin
HCl 0,1 N dimasukkan dalam tabung Hb meter sampai skala 10 garis merah. Selanjutnya darah diambil dengan pipet Sahli sampai skala 20 mm3 kemudian ujung pipet dibersihkan dengan tisu lalu dimasukkan ke tabung Hb meter dan didiamkan selama 3-5 menit agar hemoglobin bereaksi dengan HCl. Setelah itu, akuades dimasukkan tetes demi tetes sambil diaduk dengan batang pengaduk sampai warna larutan di tabung Hb meter sama dengan warna standar. Kadar hemoglobin diketahui dengan membaca skala pada garis kuning (G %) (Wedemeyer dan Yasutake, 1977 dalam Alifuddin, 1999).
2.2.5 Pengamatan Organ Dalam
Pada akhir masa pemeliharaan dilakukan pengamatan organ dalam pada satu ekor ikan uji yang bertahan hidup setelah uji tantang yaitu pada H7 untuk membedakan kelainan klinis yang terjadi antar perlakuan. Pengamatan meliputi morfologi dan warna organ dalam pada ikan uji. Hal ini juga dilakukan pada ikan ikan uji yang mati sebelum H7.
2.2.6 Kualitas Air
13 Tabel 1. Parameter, satuan, alat ukur dan spesifikasi alat pengukuran kualitas air pada penelitian penggunaan campuran tepung meniran-bawang putih dalam pakan untuk pengendalian infeksi Vibrio alginolyticus pada benih ikan kerapu macan (Epinephelus fuscoguttatus)
Parameter Satuan Alat Ukur Spesifikasi Alat
Oksigen terlarut mg/l DO meter DO-5510
Amoniak mg/l Spektrofotometer SP-300
pH - pH meter pH-208
Salinitas mg/l Salinometer Multi 340i
Suhu oC Termometer -
2.3 Analisis Data
14
III. HASIL DAN PEMBAHASAN
3.1 Hasil
3.1.1 Uji In Vitro
Campuran meniran-bawang putih menunjukkan zona hambat terbaik pada kombinasi dosis 20+25 g/L yaitu sebesar 12,33 mm (Tabel 2). Berdasarkan analisis statistik, campuran meniran-bawang putih dosis 20+25 g/L menunjukkan hasil yang berbeda nyata (P<0,05) dengan dosis lainnya.
Tabel 2. Diameter zona hambat (mm) hasil uji in vitro yang dilakukan terhadap
Vibrio alginolyticus menggunakan ekstrak meniran-bawang putih dalam beberapa kombinasi dosis
Kode
Dosis Ulangan ke-
Rata-rata Meniran+ Bawang Putih
1 2 3
(g/L)
A 15+20 7 7 7,6 7,20a
B 15+25 8 8 8,5 8,17b
C 20+20 7 7,5 7,8 7,43ab
D 20+25 12 13 12 12,33d
E 25+20 10 11 10 10,33c
Keterangan: huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
Zona hambat yang dibentuk dari berbagai kombinasi dosis campuran meniran+bawang putih yang diujikan (Tabel 2) menunjukkan zona hambat yang berbeda-beda. Zona hambat terbesar terdapat pada kode D yaitu dosis meniran-bawang putih 20+25 g/L (Gambar 2).
Gambar 2. Zona hambat hasil uji in vitro yang dilakukan terhadap
Vibrio alginolyticus menggunakan ekstrak meniran-bawang putih dalam beberapa kombinasi dosis
A
B
C
5 mm 5 mm 5 mm
D
E
15
3.1.2 Uji In Vivo
3.1.2.1 Respon Makan Ikan terhadap Pakan
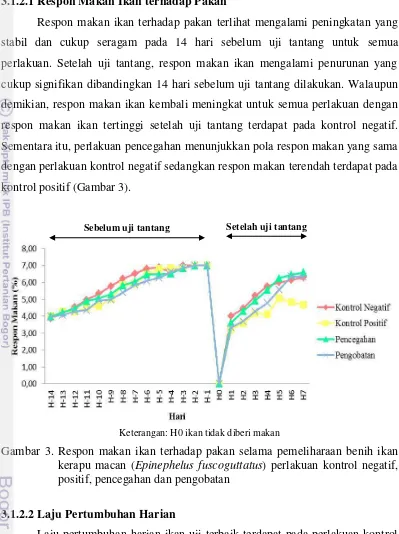
Respon makan ikan terhadap pakan terlihat mengalami peningkatan yang stabil dan cukup seragam pada 14 hari sebelum uji tantang untuk semua perlakuan. Setelah uji tantang, respon makan ikan mengalami penurunan yang cukup signifikan dibandingkan 14 hari sebelum uji tantang dilakukan. Walaupun demikian, respon makan ikan kembali meningkat untuk semua perlakuan dengan respon makan ikan tertinggi setelah uji tantang terdapat pada kontrol negatif. Sementara itu, perlakuan pencegahan menunjukkan pola respon makan yang sama dengan perlakuan kontrol negatif sedangkan respon makan terendah terdapat pada kontrol positif (Gambar 3).
Keterangan: H0 ikan tidak diberi makan
Gambar 3. Respon makan ikan terhadap pakan selama pemeliharaan benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan
3.1.2.2 Laju Pertumbuhan Harian
Laju pertumbuhan harian ikan uji terbaik terdapat pada perlakuan kontrol negatif dengan laju pertumbuhan harian sebesar 0,69%. Perlakuan pencegahan menunjukkan laju pertumbuhan harian ikan sebesar 0,66%, sedangkan pada perlakuan pengobatan laju pertumbuhan hariannya sebesar 0,65% dan pada kontrol negatif sebesar 0,64% (Gambar 4). Berdasarkan analisis statistik
16 (Lampiran 7), laju pertumbuhan harian semua perlakuan tidak berbeda nyata (P>0,05).
Keterangan: huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
Gambar 4. Laju pertumbuhan harian selama pemeliharaan benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan.
3.1.2.3 Kelangsungan Hidup
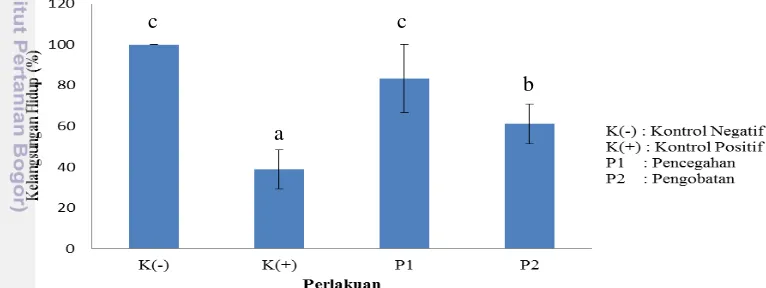
Grafik pola kelangsungan hidup harian mengalami perubahan yang signifikan setelah uji tantang dilakukan. Pola kelangsungan hidup harian antar perlakuan menunjukkan perubahan yang mulai terjadi pada H2 hingga H5 (Gambar 5). Pada akhir perlakuan H7 kelangsungan hidup tertinggi terdapat pada kontrol negatif yaitu 100±0%. Pada perlakuan pencegahan kelangsungan hidup ikan mencapai 83,33±16,67%, sedangkan pada perlakuan pengobatan mencapai 61,11±9,62%, sementara pada kontrol positif kelangsungan hidupnya paling rendah yaitu 38,89±9,62% (Gambar 6). Berdasarkan analisis statistik nilai kelangsungan hidup pada H7 (Lampiran 8), kelangsungan hidup perlakuan kontrol negatif dan pencegahan tidak berbeda nyata (P>0,05), kontrol positif dan pengobatan saling berbeda nyata (P<0,05) begitupun keduanya terhadap perlakuan lain.
a
17 Gambar 5. Pola kelangsungan hidup harian ikan selama pemeliharaan benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan.
Keterangan: huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
Gambar 6. Kelangsungan hidup ikan pada akhir pemeliharaan benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan.
3.1.2.4 Parameter Hematologi 3.1.2.4.1 Aktifitas Fagositosis
Aktifitas fagositosis setelah uji tantang meningkat pada H1 dan H4 untuk perlakuan kontrol positif, pengobatan dan terutama pada perlakuan pencegahan yaitu sebesar 44±1,41% pada H1 menjadi 50±1,41% pada H4. Pada kontrol negatif aktifitas fagositosis cenderung stabil dan pada H7 aktifitas fagositosis mengalami penurunan untuk semua perlakuan (Gambar 7). Berdasarkan analisis statistik (Lampiran 9), pada H-2 dan H1 aktifitas fagositosis perlakuan pencegahan berbeda nyata (P<0,05) dengan perlakuan lain, tetapi antara perlakuan
Sebelum uji tantang Setelah uji tantang
c c
a
18 kontrol negatif, positif dan pengobatan tidak berbeda nyata (P>0,05). Pada H4 dan H7 aktifitas fagositosis perlakuan kontrol positif dan pengobatan tidak berbeda nyata (P>0,05) tetapi keduanya berbeda nyata (P<0,05) dengan perlakuan lainnya sedangkan, kontrol negatif dan pencegahan berbeda nyata (P<0,05) dan keduanya juga berbeda nyata dengan perlakuan lainnya.
Keterangan: huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
Gambar 7. Aktifitas fagositosis dalam darah benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan pada H-2 sebelum uji tantang dan pada H1, H4 dan H7 setelah uji tantang.
3.1.2.4.2 Sel Darah Putih (Leukosit)
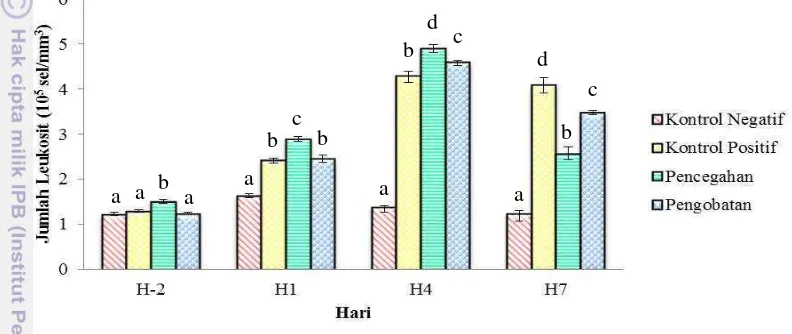
Jumlah leukosit semua perlakuan pada H-2 berkisar antara (1,22-1,50)x105 sel/mm3. Setelah uji tantang terjadi peningkatan jumlah leukosit
yang cukup signifikan pada perlakuan kontrol positif, pencegahan dan pengobatan. Pada perlakuan kontrol negatif jumlah leukosit cenderung stabil hingga akhir pemeliharaan. Jumlah leukosit tertinggi terdapat pada H4 dimana
nilai tertinggi terdapat pada perlakuan pencegahan sebesar 4,90±0,09 x 105 sel/mm3. Pada H7 jumlah leukosit perlakuan pencegahan dan
pengobatan mengalami penurunan, tetapi pada kontrol positif jumlah leukosit masih tinggi yaitu 4,08±0,17 x 105 sel/mm3 (Gambar 8). Berdasarkan analisis statistik (Lampiran 10), pada H-2 jumlah leukosit perlakuan pencegahan berbeda nyata (P<0,05) dengan perlakuan lain, tetapi antara perlakuan kontrol negatif, positif dan pengobatan tidak berbeda nyata (P>0,05). Pada H1 jumlah leukosit
a a a
b
b
a a a
c
a b b
b a
19 perlakuan kontrol positif dan pengobatan tidak berbeda nyata (P>0,05) tetapi keduanya berbeda nyata (P<0,05) dengan perlakuan lainnya sedangkan, kontrol negatif dan pencegahan berbeda nyata (P<0,05) dan keduanya juga berbeda nyata dengan perlakuan lainnya. Pada H4 dan H7 semua perlakuan menunjukkan hasil yang saling berbeda nyata (P<0,05).
Keterangan: huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
Gambar 8. Jumlah sel darah putih (leukosit) benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif,
pencegahan dan pengobatan pada H-2 sebelum uji tantang dan pada H1, H4 dan H7 setelah uji tantang.
3.1.2.4.3 Sel Darah Merah (Eritrosit)
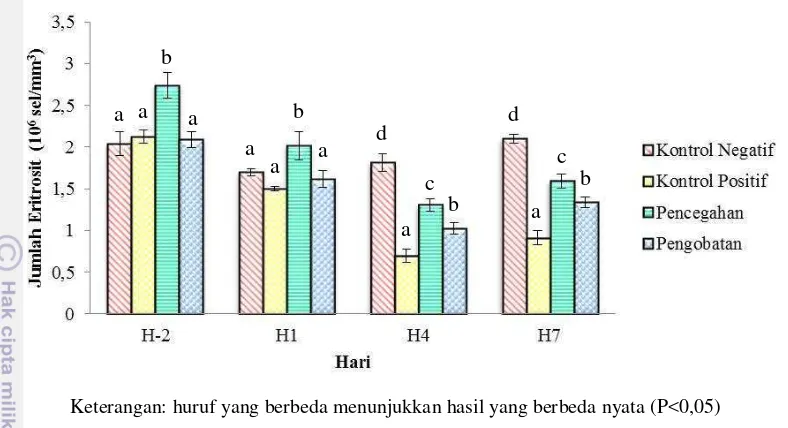
Jumlah eritrosit ikan uji sebelum uji tantang pada perlakuan kontrol negatif, positif dan pengobatan hampir sama, tetapi pada perlakuan pencegahan jumlah eritrositnya lebih tinggi dibandingkan perlakuan yang lainnya yaitu 2,74±0,16 x 106 sel/mm3. Setelah uji tantang, jumlah eritrosit kontrol negatif cenderung stabil dibandingkan perlakuan lain yang mengalami penurunan. Penurunan jumlah eritrosit terendah terdapat pada H4 pada perlakuan kontrol positif yaitu 0,70±0,08 x 106 sel/mm3. Pada H7 jumlah eritrosit semua perlakuan mengalami peningkatan kembali (Gambar 9). Berdasarkan analisis statistik (Lampiran 11), pada H-2 dan H1 jumlah eritrosit perlakuan pencegahan berbeda nyata (P<0,05) dengan perlakuan lain, tetapi antara perlakuan kontrol negatif, positif dan pengobatan tidak berbeda nyata (P>0,05). Pada H4 dan H7 semua perlakuan menunjukkan hasil yang saling berbeda nyata (P<0,05).
20
Keterangan: huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
Gambar 9. Jumlah sel darah merah (eritrosit) benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif,
pencegahan dan pengobatan pada H-2 sebelum uji tantang dan pada H1, H4 dan H7 setelah uji tantang.
3.1.2.4.4 Kadar Hematokrit
Kadar hematokrit perlakuan kontrol negatif cenderung stabil hingga akhir pemeliharaan dibandingkan dengan perlakuan lainnya yang cenderung mengalami penurunan setelah uji tantang dilakukan terutama pada H4. Kadar hematokrit perlakuan kontrol positif, pencegahan dan pengobatan mengalami penurunan yang cukup signifikan pada H4, dimana nilai terendah terdapat pada perlakuan kontrol positif yaitu sebesar 20,81±0,03%. Pada H7 kadar hematrokrit perlakuan yang awalnya mengalami penurunan kembali meningkat (Gambar 10). Berdasarkan analisis statistik (Lampiran 12), pada H-2 kadar hematokrit semua perlakuan tidak berbeda nyata (P>0,05). Pada H1 kadar hematokrit perlakuan kontrol negatif dan pengobatan tidak berbeda nyata (P>0,05) dan keduanya juga tidak berbeda nyata terhadap perlakuan lain, tetapi kontrol positif dan pencegahan berbeda nyata (P<0,05) dan keduanya juga berbeda nyata dengan perlakuan lainnya. Pada H4 kadar hematokrit perlakuan kontrol positif dan pengobatan tidak berbeda nyata (P>0,05) tetapi keduanya berbeda nyata (P<0,05) dengan perlakuan lainnya sedangkan, kontrol negatif dan pencegahan berbeda nyata (P<0,05) dan keduanya juga berbeda nyata dengan perlakuan lainnya. Pada H7 perlakuan kontrol negatif,
21 pencegahan, dan pengobatan tidak berbeda nyata (P>0,05) tetapi pada perlakuan kontrol positif berbeda nyata terhadap perlakuan lainnya.
Keterangan: huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
Gambar 10. Kadar hematokrit dalam darah benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan pada H-2 sebelum uji tantang dan pada H1, H4 dan H7 setelah uji tantang.
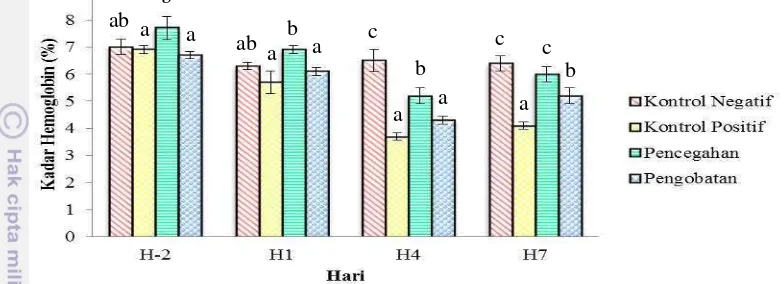
3.1.2.4.5 Kadar Hemoglobin
Kadar hemoglobin perlakuan kontrol negatif cenderung stabil hingga akhir pemeliharaan dibandingkan dengan perlakuan lainnya yang cenderung mengalami penurunan setelah uji tantang dilakukan terutama pada H4. Kadar hemoglobin perlakuan kontrol positif, pencegahan dan pengobatan mengalami penurunan yang cukup signifikan pada H4, dimana nilai terendah terdapat pada perlakuan kontrol positif yaitu sebesar 3,7±0,14%. Pada H7 kadar hemoglobin perlakuan yang awalnya mengalami penurunan kembali meningkat (Gambar 11). Berdasarkan analisis statistik (Lampiran 13), kadar hemoglobin pada H-2 dan H1 perlakuan kontrol negatif, positif dan pengobatan menunjukkan hasil yang tidak berbeda nyata (P>0,05) sedangkan pencegahan berbeda nyata (P<0,05) dengan kontrol positif dan pengobatan tetapi, tidak berbeda nyata dengan kontrol negatif. Pada H4 kontrol positif dan pengobatan tidak berbeda nyata (P>0,05) tetapi keduanya berbeda nyata (P<0,05) dengan perlakuan lainnya sedangkan, kontrol negatif dan pencegahan berbeda nyata (P<0,05) dan keduanya juga berbeda nyata dengan perlakuan lainnya. Pada H7 kontrol negatif dan pencegahan tidak berbeda nyata (P>0,05) tetapi keduanya berbeda nyata (P<0,05) dengan perlakuan lainnya
a a a
a
b ab
a ab b
c
a a
b
b b
22 sedangkan, kontrol positif dan pengobatan berbeda nyata (P<0,05) dan keduanya juga berbeda nyata dengan perlakuan lainnya.
Keterangan: huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
Gambar 11. Kadar hemoglobin dalam darah benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan pada H-2 sebelum uji tantang dan pada H1, H4 dan H7 setelah uji tantang.
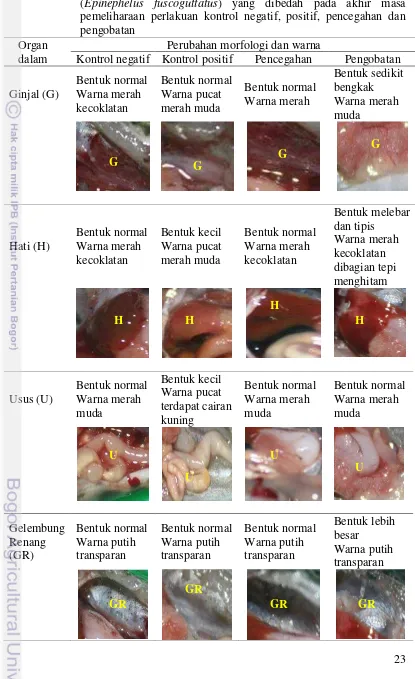
3.1.2.5 Pengamatan Organ Dalam
Ikan uji setiap perlakuan yang bertahan hidup pada akhir masing-masing perlakuan menunjukkan perubahan morfologi dan warna dari organ dalam. Morfologi dan warna dari organ dalam masing-masing perlakuan ada yang normal dan menunjukkan perubahan seperti ukuran organ yang menjadi kecil dan bengkak serta warna organ yang menjadi pucat (Tabel 3).
ab a a
b
b
a a
b c
a a
c c
b
23
Tabel 3. Kondisi organ dalam benih ikan kerapu macan (Epinephelus fuscoguttatus) yang dibedah pada akhir masa
pemeliharaan perlakuan kontrol negatif, positif, pencegahan dan pengobatan
Organ dalam
Perubahan morfologi dan warna
Kontrol negatif Kontrol positif Pencegahan Pengobatan
24
3.1.2.6 Kualitas Air
Standar baku mutu kualitas air untuk pemeliharaan ikan kerapu macan pada penelitian ini mengacu pada standar baku yang dikeluarkan Kementrian Lingkungan Hidup dalam Kep. Menneg. Lingkungan Hidup No. 52/2004.
3.1.2.6.1 Oksigen Terlarut
Kadar oksigen terlarut pada awal perlakuan berkisar antara 4,55-4,85 mg/l, tengah 4,45-5 mg/l dan akhir perlakuan 5,05-5,8 mg/l (Gambar 12). Standar baku oksigen terlarut untuk pemeliharaan ikan kerapu macan yaitu >5 mg/l.
Gambar 12. Kadar oksigen terlarut pada wadah pemeliharaan benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan pada awal, tengah dan akhir perlakuan
3.1.2.6.2 Amoniak
Kadar amoniak pada awal perlakuan berkisar antara 0,03-0,09 mg/l, tengah 0,02-0,03 mg/l dan akhir perlakuan 0,03-0,04 mg/l (Gambar 13). Standar baku kadar amoniak untuk pemeliharaan ikan kerapu macan yaitu <0,3 mg/l.
25
3.1.2.6.3 pH
Kadar pH pada awal perlakuan berkisar antara 7,96-8,27, tengah 7,76-8,07 dan akhir perlakuan 7,93-8,09 (Gambar 14). Standar baku kadar pH untuk pemeliharaan ikan kerapu macan yaitu 7-8,5.
Gambar 14. Kadar pH pada wadah pemeliharaan benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan pada awal, tengah dan akhir perlakuan
3.1.2.6.4 Salinitas
Standar baku kadar salinitas untuk pemeliharaan ikan kerapu macan yaitu 33 mg/l. Pada penelitian ini kadar salinitas pada wadah pemeliharaan mengalami perubahan yang cukup signifikan dari awal hingga akhir perlakuan dengan kadar salinitas tertinggi mencapai 36 mg/l yang terjadi pada H0 perlakuan (Gambar 15).
Gambar 15. Kadar salinitas pada wadah pemeliharaan benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan setiap 4 hari sekali selama masa pemeliharaan
3.1.2.6.5 Suhu
26 Gambar 16. Suhu pada wadah pemeliharaan benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan setiap pagi, siang dan malam hari
3.2 Pembahasan
Identifikasi ulang terhadap isolat bakteri yang digunakan sebagai bakteri uji dilakukan untuk memastikan tidak adanya kontaminan pada isolat bakteri yang digunakan. Hasil identifikasi bakteri uji menunjukkan karakterisasi fisiologi dan biokimia isolat bakteri yang berasal dari Balai Budidaya Air Payau Situbondo, Jawa Timur yang dijadikan bakteri uji memiliki karakter yang sama dengan
Vibrio alginolyticus yaitu sama-sama memiliki sifat Gram negatif yaitu berwarna merah muda dan berbentuk batang tunggal pada hasil pewarnaan Gram, bersifat fermentatif yang ditunjukkan dengan berubahnya warna media dengan dan tanpa parafin dari hijau menjadi kuning dan bersifat motil pada uji motilitas yang ditunjukkan dengan tumbuhnya bakteri pada permukaan media. Selain itu, menunjukkan hasil positif pada uji katalase yang ditunjukkan dengan adanya gelembung udara pada tetesan H2O2 3% dan positif pada uji oksidase ditunjukkan
dengan berubahnya warna kertas cakram yang berwarna ungu saat ditetesi p-aminodimethylaniline oxalate menjadi merah saat bakteri dioleskan pada kertas cakram tersebut. Setelah hasil identifikasi menunjukkan persamaan sifat fisiologi dan biokimia dengan V. alginolyticus, bakteri inilah yang akan digunakan pada uji-uji berikutnya dalam penelitian ini.
Penentuan nilai LD50 dilakukan untuk mengetahui konsentrasi bakteri yang
digunakan pada uji tantang. Setelah pengamatan dengan menghitung jumlah ikan yang masih hidup dan yang mati sampai hari ke-7 dilakukan penghitungan sesuai rumus untuk mengetahui nilai LD50-nya (Lampiran 3). Melalui uji ini diketahui
27 50% dari populasi ikan terdapat pada konsentrasi bakteri 104 cfu/ml. Hal ini dapat dilihat pada Lampiran 3 yang menunjukkan jumlah ikan yang mati saat diinfeksi
V. alginolyticus dengan konsentrasi 105, 104 dan 103 cfu/ml serta perhitungan nilai LD50 nya sehingga didapatkan V. alginolyticus dengan konsentrasi 104 cfu/ml
yang akan digunakan dalam uji tantang selanjutnya. Konsentrasi bakteri 104 pada hasil pengujian LD50 ini juga diperoleh pada penelitian Herfiani (2011) yang
menginfeksikan V. alginolyticus pada benih kerapu macan ukuran 9-10 cm.
28 Tabel 4. Perbandingan zona hambat yang dihasilkan ekstrak meniran-bawang
putih dalam menghambat pertumbuhan bakteri uji pada uji in vitro
Dosis Meniran+Bawang Putih Bakteri Uji Zona Hambat
5 + 20 g/L
(Ayuningtyas, 2008) Aeromonas hydrophila 15 mm
15 + 20 g/L
(Fauziah, 2012) Streptococcus agalactiae 18,3 mm 20 + 25 g/L
(Penelitian ini) Vibrio alginolyticus 12,33 mm
Pada bawang putih terdapat zat antibakteri yang berasal dari senyawa allicin. Menurut Palungkun dan Budiarti (1998) allicin merupakan komponen yang memberi bau khas pada bawang putih dan memiliki aktifitas antibakteri pada bakteri Gram negatif maupun positif. Allicin ini akan terbentuk jika terjadi kerusakan mekanik pada bawang putih yang menyebabkan enzim alliin-lyase mengubah alliin menjadi allicin (Curtis et al., 2004). Durairaj et al. (2009) menyatakan bahwa allicin dapat menghambat sintesis RNA dan lipid. Jika sintesis RNA terhambat maka tidak akan ada messenger RNA, ribosomal RNA dan
transfer RNA. Hal ini akan berakibat pada terhambatnya sintesis protein sehingga struktur sel bakteri akan terganggu karena asam amino dan protein tidak terbentuk. Selain itu, terganggunya sintesis lipid menyebabkan phospholipid biolayer pada dinding sel tidak dapat terbentuk sempurna pada bakteri Gram negatif maupun positif. Hal tersebut tentunya akan menghambat pertumbuhan bakteri karena itulah allicin dapat berperan sebagai senyawa antibakteri.
Pada daun meniran diduga senyawa potensial yang berperan sebagai antimikroba adalah flavonoid, disamping itu senyawa ini juga berperan sebagai imunostimulan, antioksidan, antikarsinogen, hepatoprotektor dan antialergi (Sabir dan Rocha, 2008). Selain itu, pada meniran juga terdapat senyawa lignan, senyawa terpen, benzoid, alkaloid, steroid, alcanes, tanin dan lainnya (Kardinan dan Kusuma, 2004).
29 respon makan terlihat mengalami peningkatan yang stabil dan cukup seragam pada 14 hari sebelum uji tantang untuk semua perlakuan. Setelah uji tantang, respon makan ikan mengalami penurunan yang cukup signifikan dibandingkan 14 hari sebelum uji tantang dilakukan. Hal ini juga terjadi pada perlakuan kontrol negatif yang hanya diinjeksikan PBS. Penurunan respon makan pada perlakuan kontrol negatif ini diduga karena ikan mengalami stres akibat penyuntikan. Menurut Ghufran dan Kordi (2004), stres menyebabkan ikan shock, tidak mau makan, kanibalisme dan meningkatkan kepekaan terhadap penyakit. Penurunan respon makan yang terjadi pada perlakuan kontrol positif, pencegahan dan pengobatan diduga karena uji tantang yang dilakukan dengan menginjeksikan bakteri V. alginolyticus pada ikan uji. Menurut Koesharyani et al. (2001) ikan yang terserang bakteri ini memiliki gejala awal yaitu menurunnya nafsu makan. Walaupun begitu, dari grafik tersebut dapat dilihat respon makan ikan yang kembali meningkat untuk semua perlakuan. Namun, respon makan ikan tertinggi setelah uji tantang terdapat pada kontrol negatif dan perlakuan pencegahan yang terlihat dari terbentuknya pola respon makan yang sama, sedangkan respon makan terendah terdapat pada kontrol positif. Pada kontrol positif uji tantang yang dilakukan tidak hanya menurukan nafsu makan saja, tetapi juga menyebabkan
ikan sakit bahkan mengalami kematian. Penyakit yang diakibatkan
V. alginolyticus memperlihatkan gejala klinis seperti borok pada pangkal sirip ekor, sirip yang busuk dan mulut merah serta menyebabkan kematian dengan tingkat mortalitasnya (kematian) dapat mencapai 20-30% (Koesharyani et al., 2001).
30 Setelah uji tantang dilakukan, ikan uji pada perlakuan kontrol positif, pencegahan dan pengobatan mulai menunjukkan gejala klinis bahkan kematian. Gejala klinis yang ditunjukkan berupa hemoragi pada rahang mulut bagian bawah, borok pada bagian tubuh, dan sirip yang geripis (Gambar 17). Menurut Koesharyani et al. (2001) V. alginolyticus menyebabkan gejala klinis seperti borok pada pangkal sirip ekor, sirip yang busuk dan mulut merah serta menyebabkan kematian. Pada penelitian Herfiani (2011) ikan yang diinfeksi dengan bakteri ini menunjukkan gejala hemoragi pada rahang bawah dan seluruh tubuh, perut bengkak, hati besar pucat, ginjal bengkak, dan gelembung renang membesar.
Gambar 17. Gejala klinis (diberi tanda lingkaran kuning) yang muncul pada benih ikan kerapu macan setelah diuji tantang dengan bakteri Vibrio alginolyticus ; a. Hemoragi pada sirip pektoral dan rahang bawah mulut, b. Borok pada sirip pektoral, c. Borok pada pangkal sirip caudal dan hemoragi pada rahang bawah mulut, d. Borok pada bagian tubuh dan pangkal sirip caudal, e. Sirip busuk pada dorsal, anal dan caudal.
Ikan uji yang sudah mengalami gejala klinis tersebut (Gambar 17) biasanya akan mengalami kematian. Toksin yang dikeluarkan V. alginolyticus
a
b
c
d
32 sebagai pengobatan untuk ikan yang telah terinfeksi bakteri V. alginolyticus. Menurunnya nafsu makan ikan merupakan salah satu gejala awal ikan terserang bakteri ini (Koesharyani et al., 2001). Respon pakan pada perlakuan pengobatan ini dapat dilihat pada grafik Gambar 3 yaitu respon pakannya tidak sebaik perlakuan pencegahan sehingga manfaat campuran meniran-bawang putih memberikan hasil yang kurang maksimal dalam hal kelangsungan hidup ikan setelah diuji tantang dengan V. alginolyticus. Namun, apabila dibandingkan dengan hasil penelitian Setyotomo (2011) yang menggunakan meniran-bawang putih pada tahap pengobatan pada ikan lele yang diinfeksi dengan
Aeromonas hydrophila yang menunjukkan nilai kelangsungan hidup sebesar 46,67%, pengobatan dengan dosis meniran-bawang putih 40+50 gr/kg pakan untuk mengobati infeksi V. alginolyticus ini memberikan hasil yang lebih baik.
33 patogen mengalami peningkatan sebagai upaya meningkatkan pertahanan tubuhnya terhadap bakteri tersebut. Selain itu, imunostimulan yang ada pada meniran dan zat antibakteri pada bawang putih juga mempengaruhi parameter ini. Meniran memberikan efek pada respon non-spesifik berupa peningkatan fagositosis, kemotaksis makrofag, kemotaksis neutrofil dan meningkatkan proliferasi sel limfosit T (Barbour et al., 2004). Pada kontrol negatif aktifitas fagositosis cenderung stabil dan pada H7 aktifitas fagositosis mengalami penurunan untuk semua perlakuan. Penurunan aktifitas fagositosis pada H7 ini juga diikuti penurunan jumlah leukosit. Hal ini diduga karena infeksi bakteri
V. alginolyticus semakin berkurang akibat banyaknya bakteri yang telah difagosit pada hari sebelumnya oleh sel fagosit.
34 eritrosit kembali untuk menggantikan eritrosit yang menurun akibat infeksi bakteri.
Kadar hematokrit perlakuan kontrol negatif cenderung stabil hingga akhir pemeliharaan dibandingkan dengan perlakuan lainnya yang cenderung mengalami penurunan setelah uji tantang dilakukan terutama pada H4. Kadar hematokrit perlakuan kontrol positif, pencegahan dan pengobatan mengalami penurunan yang cukup signifikan pada H4 yaitu nilai terendah terdapat pada perlakuan kontrol positif 20,81±0,03%. Penurunan kadar hematokrit ini dipengaruhi oleh jumlah eritrosit yang juga menurun. Diduga infeksi bakteri V. alginolyticus yang merusak organ ginjal menyebabkan turunnya produksi eritrosit dalam darah ikan sehingga kadar hematrokritnya juga menurun. Selain itu, respon makan ikan yang turun setelah dilakukannya uji tantang juga dapat menjadi penyebab turunnya kadar hematokrit. Menurut Blaxhall (1972) kadar hematokrit dapat digunakan untuk melihat ketercukupan ikan dalam hal protein, vitamin dan tanda ikan terinfeksi bakteri karena menurunnya nafsu makan. Pada H7 kadar hematrokrit perlakuan yang awalnya mengalami penurunan kembali meningkat seiring dengan meningkatnya jumlah eritrosit. Terdapat korelasi yang kuat antara jumlah eritrosit, kadar hematokrit dan kadar hemoglobin (Fujaya, 2004). Semakin rendah jumlah eritrositnya maka rendah pula kadar hematokrit dan hemoglobin.
Kadar hemoglobin perlakuan kontrol negatif cenderung stabil hingga akhir pemeliharaan dibandingkan dengan perlakuan lainnya yang cenderung mengalami penurunan setelah uji tantang dilakukan terutama pada H4. Kadar hemoglobin perlakuan kontrol positif, pencegahan dan pengobatan mengalami penurunan yang cukup signifikan pada H4 yaitu nilai terendah terdapat pada perlakuan kontrol positif 3,7±0,14%. Pada H7 kadar hemoglobin perlakuan yang awalnya mengalami penurunan kembali meningkat. Hal ini juga berkaitan dengan jumlah eritrosit dalam darah ikan seperti yang telah disebutkan Fujaya (2004) bahwa naik atau turun kadar hemoglobin ini dikarenakan jumlah eritrosit yang juga naik atau turun.
35 organ dalam pada ikan uji kontrol negatif tidak menunjukkan adanya kelainan klinis pada ikan. Ginjal dan hati berukuran normal dan berwarna merah kecoklatan, usus normal dan berwarna merah muda serta gelembung renang yang normal (Tabel 3). Pada perlakuan kontrol positif organ dalam ikan uji menunjukkan adanya kelainan klinis, yaitu ginjal berwarna merah muda, hati mengecil dengan warna merah muda yang pucat dan terdapat cairan kuning pada usus yang juga pucat. Hal ini diduga karena infeksi V. alginolyticus yang menyerang ginjal mengganggu proses sekresi sisa-sisa metabolisme dalam tubuh ikan sehingga toksik yang seharusnya dikeluarkan dari tubuh lewat feses dan urin mengendap dalam tubuh ikan (Tabel 3). Pada perlakuan pencegahan tidak terdapat kelainan klinis pada organ dalam ikan uji. Hal ini diduga karena sistem imun yang baik pada ikan uji akibat pemberian pakan yang mengandung campuran meniran-bawang putih. Meniran-meniran-bawang putih yang ditelah disebutkan sebelumnya memiliki peran sebagai imunostimulan dan zat antibakteri sehingga ikan pada perlakuan ini memiliki sistem pertahanan tubuhnya sangat baik. Pada perlakuan pengobatan kondisi organ dalam ikan uji menunjukkan adanya kelainan klinis pada ginjal yang sedikit membengkak dan pucat, terdapat penghitaman pada bagian hati dan gelembung renang yang membesar. Hal ini dikarenakan respon makan ikan yang kurang baik sehingga pemanfaatan campuran meniran-bawang putih tidak bisa maksimal dalam menanggulangi infeksi bakteri V. alginolyticus
dan telah disebutkan sebelumnya bakteri ini menyebabkan turunnya nafsu makan ikan.
Pengukuran parameter kualitas air dilakukan untuk memastikan gejala klinis dan kelainan yang terjadi pada ikan uji disebabkan karena adanya infeksi bakteri bukan karena dari faktor lingkungan seperti kualitas air yang buruk pada wadah pemeliharaan. Parameter kualitas air yang diukur adalah oksigen terlarut, Amoniak, pH, salinitas dan suhu. Kualitas air diukur pada awal, tengah dan akhir perlakuan. Khusus untuk suhu diukur setiap hari pada pagi, siang dan malam hari, sedangkan salinitas diukur setiap 4 hari sekali. Jika dibandingkan dengan standar baku mutu kualitas air untuk pemeliharaan ikan kerapu macan yang dikeluarkan
36 amoniak dan pH pada wadah pemeliharaan tidak terlalu jauh berbeda dengan standar yang telah ditetapkan. Kadar oksigen terlarut pada awal perlakuan berkisar antara 4,55-4,85 mg/l, tengah 4,45-5 mg/l dan akhir perlakuan 5,05-5,8 mg/l (Gambar 12). Standar baku oksigen terlarut untuk pemeliharaan ikan kerapu macan yaitu >5 mg/l. Kadar amoniak pada awal perlakuan berkisar antara 0,03-0,09 mg/l, tengah 0,02-0,03 mg/l dan akhir perlakuan 0,03-0,04 mg/l (Gambar 13). Standar baku kadar amoniak untuk pemeliharaan ikan kerapu macan yaitu <0,3 mg/l. Kadar pH pada awal perlakuan berkisar antara 7,96-8,27, tengah 7,76-8,07 dan akhir perlakuan 7,93-8,09 (Gambar 14). Standar baku kadar pH untuk pemeliharaan ikan kerapu macan yaitu 7-8,5. Standar baku kadar salinitas untuk pemeliharaan ikan kerapu macan yaitu 33 mg/l. Pada penelitian ini kadar salinitas pada wadah pemeliharaan mengalami perubahan yang cukup signifikan dari awal hingga akhir perlakuan dengan kadar salinitas tertinggi mencapai 36 mg/l yang terjadi pada H0 perlakuan (Gambar 15). Hal ini dapat terjadi karena penguapan air akibat suhu yang panas di siang hari dan pergerakan air yang terus-menerus mengalir akibat sistem resirkulasi yang digunakan. Namun, ketika salinitas berada diluar kisaran standar baku dilakukan pengenceran dengan menambahkan air tawar pada wadah pemeliharaan hingga salinitas berada pada kisaran standar baku kembali. Standar baku suhu untuk pemeliharaan ikan kerapu macan berkisar antara 28-30 °C. Pada penelitian ini suhu pada wadah pemeliharaan mengalami perubahan yang cukup signifikan antara pagi, siang dan malam. Suhu tertinggi mencapai 34 °C yang terjadi pada H-8 saat siang hari perlakuan (Gambar 16).
37
IV. KESIMPULAN DAN SARAN
4.1 Kesimpulan
Campuran meniran-bawang putih dalam pakan untuk pengendalian bakteri
Vibrio alginolyticus pada benih ikan kerapu macan Epinephelus fuscoguttatus
efektif diberikan pada tahap pencegahan yaitu dengan dosis meniran+bawang putih 20+25 g/kg pakan dan tahap pengobatan dengan dosis 40+50 g/kg pakan. Pakan dengan kandungan meniran-bawang putih ini berpengaruh nyata terhadap kelangsungan hidup ikan yaitu pada perlakuan pencegahan 83,33% dan pengobatan 61,11%.
4.2 Saran
Penggunaan pakan dengan campuran meniran-bawang putih lebih baik digunakan sebagai tahap pencegahan untuk pengendalian penyakit akibat
PENGGUNAAN CAMPURAN TEPUNG MENIRAN-BAWANG
PUTIH DALAM PAKAN UNTUK PENGENDALIAN INFEKSI
Vibrio alginolyticus
PADA BENIH IKAN KERAPU MACAN
Epinephelus fuscoguttatus
SHAVIKA MIRANTI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa Skripsi yang berjudul :
PENGGUNAAN CAMPURAN TEPUNG MENIRAN-BAWANG PUTIH DALAM PAKAN UNTUK PENGENDALIAN INFEKSI Vibrio alginolyticus
PADA BENIH IKAN KERAPU MACAN Epinephelus fuscoguttatus
Adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalan Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juli 2012
SHAVIKA MIRANTI C14070023
ABSTRAK
SHAVIKA MIRANTI. Penggunaan Campuran Tepung Meniran-Bawang Putih dalam Pakan untuk Pengendalian Infeksi Vibrio alginolyticus pada Benih Ikan Kerapu Macan Epinephelus fuscoguttatus. Dibimbing oleh DINAMELLA WAHJUNINGRUM dan IRZAL EFFENDI.
Penelitian bertujuan untuk mengetahui efektifitas campuran meniran-bawang putih dalam pakan sebagai upaya pengendalian penyakit bakteri V. alginolyticus
pada benih ikan kerapu macan. Penelitian terdiri dari uji in vitro dari beberapa kombinasi dosis meniran+bawang putih (15+20, 15+25, 20+20, 20+25 dan 25+20 g/L) dalam menghasilkan zona hambat. Kombinasi 20+25 g/L membentuk 12,33 mm zona hambat, hasil terbaik. Dosis tersebut digunakan dalam pakan untuk uji in vivo. Uji in vivo terdiri dari 4 perlakuan yaitu kontrol negatif, kontrol positif, pencegahan dan pengobatan. Uji ini dilakukan pada benih kerapu macan (panjang 7,74±0,27 cm dan bobot 12,50±0,394 g) berasal dari Kepulauan Seribu, dipelihara di akuarium (60x30x30 cm3) dengan kepadatan 6 ekor/akuarium. Pakan uji (dosis pencegahan 20+25 g/kg pakan) diberikan selama 14 hari pada perlakuan pencegahan sedangkan pada perlakuan kontrol negatif, positif dan pengobatan diberikan pakan komersil. Setelah itu, ikan perlakuan kontrol positif, pencegahan dan pengobatan diinjeksi bakteri V. alginolyticus sebanyak 0,1 ml dengan kepadatan 104 cfu/ml sedangkan ikan perlakuan kontrol negatif hanya diinjeksi dengan PBS. Selanjutnya dilakukan pengamatan selama 7 hari. Pada ikan perlakuan pengobatan diberikan pakan uji (dosis pengobatan 40+50 g/kg pakan) dan pada perlakuan lainnya diberikan pakan komersil. Parameter yang diamati adalah respon makan, laju pertumbuhan harian, kelangsungan hidup, hematologi, organ dalam dan kualitas air. Hasil dari penelitian ini menunjukkan bahwa campuran meniran dan bawang putih dalam pakan efektif diberikan pada tahap pencegahan yaitu dengan dosis meniran+bawang putih 20+25 g/kg pakan dan tahap pengobatan dengan dosis 40+50 g/kg pakan. Pakan dengan kandungan meniran-bawang putih ini berpengaruh nyata terhadap kelangsungan hidup ikan yaitu pada perlakuan pencegahan 83,33% dan pengobatan 61,11%.
ABSTRACT
SHAVIKA MIRANTI. The use of Phyllanthus niruri-Allium sativum
combination powder in fish feed for direction Vibrio alginolyticus infection in tiger grouper Epinephelus fuscoguttatus. Supervised by DINAMELLA WAHJUNIGRUM ang IRZAL EFFENDI.
The purpose of this research was to determined the effectivity of Phyllanthus niruri-Allium sativum powder in fish feed for controlling
Vibrio alginolyticus infection on tiger grouper Epinephelus fuscoguttatus. In vitro test was conducted to evaluated Phyllanthus niruri-Allium sativum dosage combination (15+20, 15+25, 20+20, 20+25 and 25+20 g/L) to inhibit bacterial fish pathogen. The dosage combination of 20+25 g/L was given the highest inhibitory zone (12,33 mm in diameter) and this dosage was used for in vivo test. In vivo test consisted of four treatments; negative control, positive control, preventive dan curative. Tiger grouper (length 7,74±0,27 cm and weight 12,50±0,394 g) were reared in aquarium (60x30x30 cm3) with stocking density of 6 fishes/aquarium. The preventive teratment was fed with feed treatment (20+25 g/kg of feed) for 14 days, while the others treatment was fed with commercial feed. The 0,1 ml of V. alginolyticus at concentration of 104 cfu/ml were injected to fishes of positive control, preventive and curative treatment while negative control fishes were injected with PBS. Curative treatment fishes were given treatment feed (40+50 g/kg of feed) and negative control, positive control and preventive treatment fishes were given with commercial feed. The fish feed response, growth rate, survival rate, hematology, anatomy and water quality were observed for 7 days after injected. The result of research showed that suplemented of Phyllanthus niruri-Allium sativum in fish feed at preventive and curative treatment showed better survival rate, 83,33 % and 61,11 % respectively, than positive control 38,89 % (P<0,05).
PENGGUNAAN CAMPURAN TEPUNG MENIRAN-BAWANG
PUTIH DALAM PAKAN UNTUK PENGENDALIAN INFEKSI
Vibrio alginolyticus
PADA BENIH IKAN KERAPU MACAN
Epinephelus fuscoguttatus
SHAVIKA MIRANTI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi dan Manajemen Perikanan Budidaya
Departemen Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : Penggunaan campuran tepung meniran-bawang putih
dalam pakan untuk pengendalian infeksi
Vibrio alginolyticus pada benih ikan kerapu macan
Epinephelus fuscoguttatus
Nama Mahasiswa : Shavika Miranti
Nomor Pokok : C14070023
Disetujui,
Pembimbing I Pembimbing II
Dr. Dinamella Wahjuningrum Ir. Irzal Effendi M.si
NIP. 19700521 199903 2 001 NIP. 19640330 198903 1 003
Diketahui,
Ketua Departemen Budidaya Perairan
Dr. Ir. Odang Carman M.Sc NIP. 19591222 198601 1 001
KATA PENGANTAR
Puji syukur atas kehadirat Allah SWT yang telah memberikan rahmat dan hidayah-Nya sehingga Penulis mampu menyelesaikan penelitian dan
penulisan skripsi ini. Penelitian yang berjudul “Penggunaan campuran tepung
meniran-bawang putih dalam pakan untuk pengendalian infeksi
Vibrio alginolyticus pada benih ikan kerapu macan Epinephelus fuscoguttatus” ini dilaksanakan pada Oktober 2011 hingga April 2012 di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Dr. Dinamella Wahjuningrum dan Ir. Irzal Effendi M.Si. selaku Dosen Pembimbing atas saran dan arahannya dalam pelaksanaan penelitian ini, serta kepada Dr. M. Agus Suprayudi selaku Dosen Penguji Tamu. Ungkapan terima kasih tidak lupa juga Penulis sampaikan untuk kedua Orang Tua, Adik dan Keluarga atas doa dan dukungannya. Penulis juga berterima kasih kepada para laboran BDP yaitu Pak Ranta (Laboratorium Kesehatan Ikan), Kang Abe (Laboratorium Lingkungan), Mbak Retno dan Bang Yosi (Laboratorium Nutrisi Ikan) yang telah membantu didalam diagnosis penyakit, analisa kualitas air dan destilasi air laut. Ucapan terima kasih juga Penulis sampaikan kepada Reky Marian Abadi S.Pi. atas bantuan dan motivasinya serta Ibu Yani yang telah memberikan isolat bakteri, Pak Qustam, Pak Suci dan Ibu Rini yang membantu penyediaan ikan serta teman-teman BDP 44 yaitu Hendar yang membantu pembuatan sistem resirkulasi, Ririn, Haezy dan Trian yang membantu Penulis pada uji pendahuluan, Dimas Koi, Lita dan Ridha yang membantu dalam transportasi ikan, Vida, Ima, Lora dan Zaky yang membantu kelancaran penelitian ini sehingga Penulis dapat menyelesaikan penelitian dan penulisan skripsi ini.
Semoga skripsi ini bermanfaat bagi pengembangan ilmu dibidang perikanan khususnya untuk kesehatan ikan budidaya.
Bogor, Juli 2012
RIWAYAT HIDUP
Penulis lahir di Tanjungpinang pada 29 Mei 1989, merupakan anak pertama dari dua bersaudara dengan ayah bernama Syaiful Anwar dan Ibu bernama Hafsah. Pendidikan formal yang telah diselesaikan Penulis diantaranya adalah pendidikan dasar di SDN 05 Tanjungpinang pada 2001, SLTPN 1 Tanjungpinang pada 2004, dan SMAN 1 Tanjungpinang pada 2007. Penulis diterima di Insititut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) pada 2007 dan diterima sebagai mahasiswa Program Studi Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan di IPB Penulis pernah menjadi Asisten pada Mata Kuliah Penyakit Organisme Akuatik periode 2009-2011, Manajemen Kesehatan Organisme Akuatik periode 2010-2012. Penulis juga pernah mengikuti Praktek Lapangan Akuakultur di Balai Budidaya Laut Batam pada Juli-Agustus 2010.
Sebagai salah satu syarat memperoleh gelar Sarjana dalam bidang perikanan Penulis melakukan penelitian dan penyusunan skripsi yang berjudul “Penggunaan campuran tepung meniran-bawang putih dalam pakan untuk pengendalian infeksi Vibrio alginolyticus pada benih ikan kerapu macan
i 2.1.2 Peningkatan Virulensi Bakteri Uji ... 4 2.1.3 Penentuan Nilai LD50 (Lethal Dosage50) ... 5
2.1.4 Pembuatan Ekstrak Meniran Phyllanthus niruri-Bawang Putih
ii 3.1.2.3 Kelangsungan Hidup ... 16 3.1.2.4 Parameter Hematologi ... 17 3.1.2.4.1 Aktifitas Fagositosis ... 17 3.1.2.4.2 Sel Darah Putih (Leukosit) ... 18 3.1.2.4.3 Sel Darah Merah (Eritrosit) ... 19 3.1.2.4.4 Kadar Hematokrit ... 20 3.1.2.4.5 Kadar Hemoglobin ... 21 3.1.2.5 Pengamatan Organ Dalam ... 22 3.1.2.6 Kualitas Air ... 24 3.1.2.6.1 Oksigen Terlarut ... 24 3.1.2.6.2 Amoniak ... 24 3.1.2.6.3 pH ... 25 3.1.2.6.4 Salinitas ... 25 3.1.2.6.5 Suhu ... 25 3.2 Pembahasan ... 26
IV. KESIMPULAN DAN SARAN
4.1 Kesimpulan ... 37 4.2 Saran ... 37
DAFTAR PUSTAKA ... 38
iii
DAFTAR TABEL
Halaman
1. Parameter, satuan, alat ukur dan spesifikasi alat pengukuran kualitas air pada penelitian penggunaan campuran tepung meniran-bawang putih dalam pakan untuk pengendalian infeksi Vibrio alginolyticus pada benih ikan kerapu macan (Epinephelus fuscoguttatus) ... 13 2. Diameter zona hambat (mm) hasil uji in vitro yang dilakukan terhadap
Vibrio alginolyticus menggunakan ekstrak meniran-bawang putih dalam beberapa kombinasi dosis ... 14
3. Kondisi organ dalam benih ikan kerapu macan (Epinephelus fuscoguttatus) yang dibedah pada akhir masa pemeliharaan
perlakuan kontrol negatif, positif, pencegahan dan pengobatan ... 23
iv
Vibrio alginolyticus menggunakan ekstrak meniran-bawang putih dalam beberapa kombinasi dosis ... 14
3. Respon makan ikan terhadap pakan selama pemeliharaan benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan ... 15
4. Laju pertumbuhan harian selama pemeliharaan benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan ... 16
5. Pola kelangsungan hidup harian ikan selama pemeliharaan benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan ... 17
6. Kelangsungan hidup ikan pada akhir pemeliharaan benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan ... 17
7. Aktifitas fagositosis dalam darah benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan pada H-2 sebelum uji tantang dan pada H1, H4 dan H7 setelah uji tantang ... 18
8. Jumlah sel darah putih (leukosit) benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan pada H-2 sebelum uji tantang dan pada H1, H4 dan H7 setelah uji tantang ... 19
9. Jumlah sel darah merah (eritrosit) benih ikan kerapu macan (Epinephelus fuscoguttatus) perlakuan kontrol negatif, positif, pencegahan dan pengobatan pada H-2 sebelum uji tantang dan pada H1, H4 dan H7 setelah uji tantang ... 20