ABSTRACT
Production of Crude Bacteriocin Lactobacillus plantarum 2C12, 1A5, 1B1, 2B2 from Beef and Their Antimicrobial Activity Against Patogenic Bacteria
Jati, A. U. P., I. I. Arief, and Jakaria
PENDAHULUAN Latar Belakang
Bahan pangan asal ternak khususnya daging merupakan bahan pangan yang perishableatau bersifat mudah rusak sehingga tidak tahan lama ketika bahan pangan tersebut disimpan. Saat ini telah banyak cara yang dilakukan untuk mempertahankan umur simpan bahan pangan tersebut, salah satunya dengan menggunakan bahan pengawet. Sebagian besar bahan pengawet yang digunakan adalah bahan pengawet sintetis atau buatan yang dapat menyebabkan penyakit bahkan kematian. Bahan pengawet makanan yang sering digunakan seperti nitrit, sodium benzoat dan sodium metabisulfit masih memiliki kekurangan, yakni dapat menimbulkan alergi pada individu yang sensitif, selain itu bahan-bahan tersebut memiliki efek samping yang berpotensi sebagai zat karsinogenik atau zat penyebab kanker seperti nitrosamine yang berasal dari nitrit. Tantangan selanjutnya adalah mengembangkan sistem pengawetan baru yang dapat memperbaiki kualitas dan memperpanjang masa simpan bahan pangan dengan aman.
Potensi senyawa antimikroba alami dalam menggantikan bahan pengawet sintetis telah banyak dieksplorasi. Hal tersebut ditunjukkan dengan adanya hasil-hasil penelitian yang telah memperlihatkan aktivitas senyawa antimikroba alami dalam melawan organisme patogen dan pembusuk. Bakteri asam laktat (BAL) yang banyak digunakan dalam pembuatan produk pangan fermentasi dapat mencegah pertumbuhan mikroorganisme patogen bahkan membunuhnya dengan asam laktat yang dihasilkan dari proses fermentasi tersebut. Bakteri ini dapat hidup pada bahan pangan hasil ternak seperti susu, daging, juga dapat tumbuh pada tumbuh-tumbuhan meskipun dalam jumlah yang terbatas.
saprofit yang sering digunakan secara bersamaan dengan bahan fermentasi lainnya sebagai kultur starter.
Produksi bakteriosin yang optimal dapat diketahui dengan menentukan terlebih dahulu waktu yang tepat untuk BAL (L. plantarum 2C12, 1A5, 1B1 dan 2B2) terkait aktivitas atau kemampuan BAL tersebut dalam menghasilkan senyawa antimikroba, yakni melalui analisis pertumbuhan. Untuk itu, karakterisasi BAL pada strain yang berbeda melalui pewarnaan Gram, analisis pertumbuhan serta aktivitas antimikrobanya terhadap bakteri pembusuk dan perusak makanan perlu diteliti lebih lanjut.
Tujuan
TINJAUAN PUSTAKA Bakteri Asam Laktat
Kelompok yang telah diketahui sebagai bakteri asam laktat saat ini adalah termasuk kedalam genus Lactococcus, Streptococcus (hanya satu spesies saja), Enterococcus, Pediococcus, Tetragenococcus, Aerococcus, dan lainnya (Axelson, 1998). Awalnya istilah “bakteri asam laktat” dibawa oleh seseorang yang bekerja di perusahaan susu fermentasi untuk menunjukkan bahwa terdapat suatu spesies atau strain yang dapat menghasilkan asam laktat dari proses metabolisme laktosa dalam jumlah yang banyak. Bakteri ini lebih dikenal secara umum dengan istilah “kultur starter” yang biasa digunakan untuk memulai suatu proses fermentasi.
Kemudian dari waktu ke waktu, kedua istilah tersebut digunakan dalam proses fermentasi bahan pangan hasil ternak yakni susu dan daging, serta digunakan untuk sayuran dan untuk produk fermentasi lainnya (Ray dan Miller, 2003). Sejak manusia mengkonsumsi hasil metabolisme dari baketri tersebut selama beberapa lama tanpa efek yang merugikan yang ditimbulkan, bakteri kultur starter kini dipertimbangkan sebagai bahan pangan yang aman, bermutu baik, dan bahkan memilki beberapa keuntungan bagi yang mengkonsumsinya. Saat ini, yang dikenal dalam pangan fermentasi hanyalah beberapa spesies dari Lactococcus, Leuconostoc, dan Pediococcus saja, serta beberapa spesies dari Lactobacillus dan Bifidobacterium yang memiliki manfaat pada saluran pencernaan manusia (Ray, 2000).
Lactobacillus plantarum
L. plantarum termasuk bakteri dalam filum Firmicutes, kelas Bacilli, ordo Lactobacillales, famili Lactobacillaceae dan genus Lactobacillus. L. plantarum merupakan salah satu jenis BAL homofermentatif dengan pertumbuhan yang optimal pada suhu 30-37 oC serta pada pH 5-7 (Emanuel et al., 2005). L. plantarum mempunyai kemampuan untuk menghambat mikroorganisme patogen pada bahan pangan dengan daerah penghambatan terbesar dibandingkan dengan bakteri asam laktat lainnya (Jenie dan Rini, 1995). Salah satu isolat BAL yang berpotensi memproduksi bakteriosin yakni L. plantarum(Elegado et al., 2003).
L. plantarum 2C12 merupakan isolat indigenus yang diisolasi dari daging sapi lokal Indonesia. Arief et al. (2004) melaporkan bahwa suatu senyawa antimikroba diproduksi oleh bakteri asam laktat L. plantarum 2C12 yang diisolasi dari daging sapi lokal. Senyawa antimikroba tersebut dapat menghambat pertumbuhan bakteri patogen E. coli ATCC 25922, S. Thypimurium ATCC 14028, dan S. aureus ATCC 25923 (Arief, 2011). Senyawa antimikroba yang diproduksi oleh L. plantarum 2C12 mengandung bakteriosin. Bakteriosin hasil klasifikasi diketahui bahwa isolat tersebut merupakan L. plantarum2C12 dan bakteriosin yang diproduksinya disebut plantaricin.
Kurva Pertumbuhan Bakteri
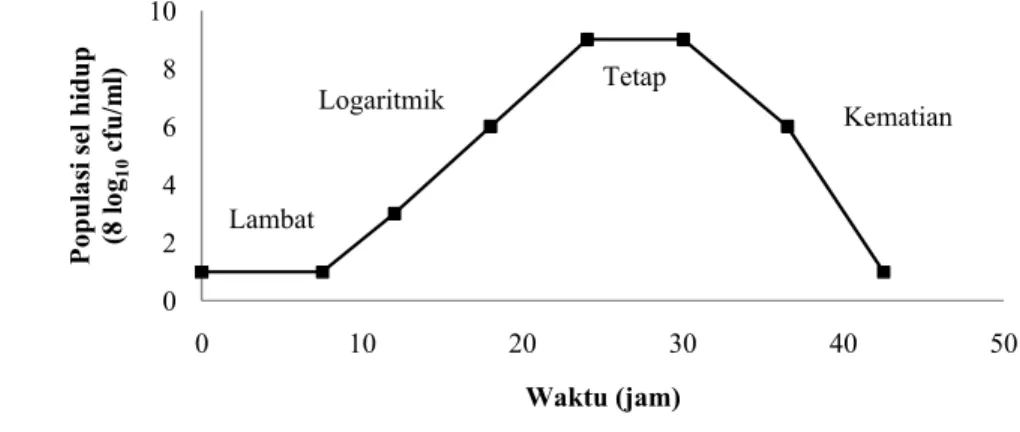
Kurva pertumbuhan menunjukkan perkembangbiakan ataupun siklus hidup bakteri. Pertumbuhan bakteri adalah suatu peningkatan massa atau jumlah sel total dan bukan dalam hal ukuran. Pertumbuhan sel dan pembentukan produk mencerminkan kemampuan sel yang dapat dipengaruhi oleh lingkungan. Pelczar dan Chan (2007) menyatakan bahwa istilah pertumbuhan umum digunakan untuk bakteri dan mikroorganisme lain dan biasanya mengacu pada perubahan di dalam hasil panen (pertambahan total masa sel) dan bukan perubahan individu organisme.
hilangnya viabilitas (fase kematian). Parameter X dan sumbu Y dalam kurva pertumbuhan dapat dinyatakan sebagai perubahan dalam jumlah sel berbanding dengan waktu (Todar, 2009).
Gambar 1. Kurva pertumbuhan bakteri. Sumber: Todar (2009)
Pertumbuhan adalah peningkatan secara teratur dalam kuantitas konstituen seluler. Hal ini tergantung pada kemampuan sel untuk membentuk protoplasma baru dari nutrisi yang tersedia di lingkungan. Sebagian besar bakteri, pertumbuhan melibatkan peningkatan massa sel dan jumlah ribosom, duplikasi kromosom bakteri, sintesis dinding sel baru dan membran plasma, partisi dari dua kromosom, pembentukan septum, dan pembelahan sel. Proses reproduksi aseksual ini disebut pembelahan biner.
Empat fase siklus pertumbuhan bakteri menurut Todar (2009) adalah (1) Fase Adaptasi, yakni fase dimana setelah inokulasi sel ke dalam media tumbuh, bakteri di dalamnya relatif tetap atau tidak berubah untuk sementara waktu. Sel-sel tetap dapat tumbuh dalam hal volume atau massa, sintesis enzim, protein, RNA, serta meningkatkan aktivitas metabolik meskipun tidak terjadi pembelahan sel. Lamanya fase adaptasi atau fase lag akan tergantung pada berbagai faktor termasuk ukuran inokulum, waktu yang diperlukan untuk pulih dari kerusakan fisik atau stres pada saat inokulasi, waktu yang diperlukan untuk sintesis koenzim penting, dan waktu yang dibutuhkan untuk mensintesis enzim baru yang diperlukan untuk membantu metabolisme substrat yang terdapat di dalam media tumbuh; (2) Fase Eksponensial (logaritmik), adalah pola pertumbuhan yang seimbang dimana semua sel-sel membelah diri secara teratur melalui pembelahan biner, dan tumbuh dengan deret
ukur. Sel-sel membelah dengan laju yang konstan tergantung pada komposisi media pertumbuhan dan kondisi inkubasi. Laju pertumbuhan eksponensial dari kultur bakteri dinyatakan sebagai waktu generasi, juga waktu penggandaan populasi bakteri.
Pertumbuhan secara eksponensial tidak dapat dilanjutkan lagi pada fase ini. Pertumbuhan populasi dibatasi oleh salah satu dari tiga faktor yakni yang pertama dapat diakibatkan oleh berkurangnya nutrisi yang tersedia di dalam suatu media tumbuh bakteri tersebut, akumulasi penghambatan hasil metabolit sel atau produk akhir, atau dapat juga terjadi akibat berkurangnya ruang, dalam hal ini disebut kurangnya "ruang biologis"; (3) Fase Stasioner, selama fase stasioner, apabila dilakukan perhitungan pada sel-sel, tidak dapat ditentukan apakah beberapa sel telah mati dan sejumlah sel-sel lainnya sedang membelah diri, atau bahkan populasi sel tersebut telah berhenti tumbuh dan membelah diri. Bakteri yang menghasilkan metabolit sekunder, seperti antibiotik, melakukannya selama fase stasioner dalam siklus pertumbuhan (metabolit sekunder didefinisikan sebagai metabolit yang dihasilkan setelah tahap pertumbuhan aktif); dan (4) Fase Kematian, yakni apabila inkubasi berlanjut setelah populasi mencapai fase stasioner, berikut dengan fase kematian, dimana terjadi penurunan terhadap populasi sel hidup. Selama fase kematian, jumlah sel yang hidup menurun secara geometris (eksponensial) atau berkebalikan dari pertumbuhan selama fase logaritmik.
Antimikroba
Antimikroba adalah suatu antibodi yang dapat bereaksi dengan toksin dan menetralkan toksin (Fardiaz, 1992). Makanan mungkin mengandung komponen yang dapat menghambat pertumbuhan jasad renik. Komponen antimikroba tersebut terdapat di dalam makanan melalui salah satu dari beberapa cara yaitu (1) terdapat secara alamiah di dalam bahan pangan, (2) ditambahkan dengan sengaja ke dalam makanan dan (3) terbentuk selama pengolahan atau oleh jasad renik yang tumbuh selama fermentasi makanan.
menghambat pertumbuhan bakteri dipengaruhi oleh beberapa faktor yakni (1) konsentrasi bahan pengawet, (2) waktu penyimpanan, (3) suhu lingkungan, (4) sifat-sifat mikroba (jenis, umur, dan konsentrasi).
Suatu preservatif untuk memperpanjang masa simpan produk pangan, terutama daging, harus memenuhi kriteria antara lain tidak mengubah flavor, bau dan tekstur bahan pangan; aman bagi konsumen dan efektif sebagai preservatif atau aman untuk dikonsumsi selama masa simpan tertentu; preservatif harus mudah dikenali dan kadarnya dapat dipastikan secara pasti serta harus memenuhi kebutuhan yang diizinkan; kualitas bahan pangan tidak merugikan konsumen; ekonomis (Soeparno, 2005); dan tidak menyebabkan timbulnya galur resisten dan diutamakan bersifat membunuh daripada hanya menghambat pertumbuhan mikroba (Frazier dan Westhoff, 1998). Beberapa senyawa antimikroba yang dapat dihasilkan oleh BAL antara lain asam organik, bakteriosin, H2O2, CO2, serta diasetil (Vuyst dan Vandamme, 1994).
Asam Organik
Asam organik merupakan substansi alami dari berbagai jenis makanan. Aksi antimikroba dari asam organik berdasarkan pada kemampuannya untuk menurunkan pH dalam pangan yang berfase air. Asam organik dalam pangan dapat berfungsi sebagai asidulan atau pengawet, sementara garamnya atau ester dapat menjadi antimikroba yang efektif pada pH mendekati netral. Asam laktat adalah produk utama pada pangan hasil fermentasi. Asam asetat, propionat, malat dan asam-asam lainnya dengan konsentrasi yang beragam juga dihasilkan tergantung jenis produk dan mikroorganisme yang digunakan (Samelis dan Sofos, 2003).
permeabilitas membran akan menghasilkan efek ganda, yaitu mengganggu transportasi nutrisi ke dalam sel dan menyebabkan metabolit internal keluar dari sel.
Hidrogen Peroksida
Bakteri asam laktat memproduksi hidrogen peroksida dibawah kondisi pertumbuhan aerob, dan karena berkurangnya katalase selular, pseudokatalase atau peroksidase. Bakteri asam laktat mengekskresikan H2O2 tersebut sebagai alat pelindung diri yang mampu bersifat bakteriostatik maupun bakterisidal. Hidrogen peroksida merupakan salah satu agen pengoksidasi yang kuat dan dapat dijadikan sebagai zat antimikroba melawan bakteri, fungi dan bahkan virus (Ray, 2004). Kemampuan bakterisidal dari H2O2 beragam tergantung pH, konsentrasi, suhu, waktu dan tipe serta jumlah mikoorganisme. Pada kondisi tertentu, spora bakteri ditemukan paling resisten terhadap H2O2, diikuti dengan bakteri Gram positif. Bakteri yang paling sensitif terhadap H2O2 adalah bakteri Gram negatif, terutama koliform (Quwehand dan Vesterlund, 2004).
Branen (1993) berpendapat bahwa hidrogen peroksida (H2O2) merupakan oksidator, bleaching agent dan anti bakteri. Hidrogen peroksida murni tidak berwarna, berbentuk cairan seperti sirup dan memiliki bau yang menusuk. Kemampuan H2O2 untuk mengoksidasi menyebabkan perubahan tetap pada sistem enzim sel mikroba sehingga digunakan sebagai antimikroba. Selain itu, senyawa ini juga dapat terdekomposisi menjadi air dan oksigen. Perubahan kondisi lingkungan seperti pH dan suhu mempengaruhi kecepatan dekomposisi. Peningkatan suhu dapat meningkatkan keefisienan dalam menghancurkan bakteri, selain itu kecepatan proses terdekomposisinya senyawa tersebut juga semakin cepat.
Bakteriosin
dan penyakit (Gonzales et al., 1994). Bakteriosin merupakan substrat protein antimikroba yang dapat mencegah strain-strain yang sensitif yakni bakteri Gram negatif dan Gram positif (Savadogo, 2004).
Bakteriosin adalah komponen protein antibakterial yang merupakan peptida-peptida antimikrobial hasil sistesis oleh ribosom (Vuyst dan Vandamme, 1994). Savadogo et al. (2006) juga menyatakan bahwa umumnya bakteriosin tersebut adalah peptida-peptida kationik yang terdapat dalam bentuk substansi bersifat hidrofobik atau amphifilik dan membran bakteri merupakan target atau sasaran utama dari aktivitas yang dilakukan oleh bakteriosin tersebut, yakni aktivitas penghambatan terhadap pertumbuhan bakteri perusak dan pembusuk. Jack et al. (1995) menyatakan bahwa senyawa antimikroba khususnya bakteriosin merupakan substansi protein yang diproduksi oleh banyak strain bakteri dan dapat menghasilkan aktivitas penghambatan secara bakterisidal terhadap organisme yang berkerabat dekat.
Banyak bakteriosin dapat secara bakterisidal melawan spesies-spesies dan strain yang berkerabat dekat dengan bakteriosin tersebut, namun ada beberapa dapat secara efektif melawan banyak bakteri dari spesies dan genus yang berbeda (Ray dan Bhunia, 2008). Satu strain bakteri dapat menghasilkan lebih dari satu macam bakteriosin, dan banyak strain dari spesies yang berbeda dapat memproduksi bakteriosin yang sama atau dapat juga berbeda (Ray dan Bhunia, 2008).
Bakteri Patogen
Bahan pangan dapat berperan sebagai agen dari penularan atau pemindahan mikroorganisme ke manusia yang mengakibatkan pembusukan atau menimbulkan penyakit. Dari kelompok mikroorganisme seperti bakteri, kapang dan virus merupakan patogen yang menular dalam bahan pangan. Bahan pangan dapat bertindak sebagai substrat pertumbuhan dan perkembangbiakan spesies mikroorganisme patogenik, dimana jika berkembang dalam jumlah banyak dapat menyebabkan penyakit bagi manusia yang memakannya (Buckle et al., 2007).
dibandingkan dengan dinding sel baketri Gram positif. Hal tersebut menyebabkan terekstraksinya lipid selama proses pewarnaan pada perlakuan dengan etanol (alkohol) sehingga memperbesar daya permeabilitas dinding sel Gram negatif. Larutan pewarna ungu kristal-yodium yang telah memasuki dinding sel selama proses pewarnaan awal dapat diekstraksi dan menyebabkan organisme Gram negatif kehilangan warna tersebut. Dinding sel bakteri Gram positif mengandung peptidoglikan yang lebih banyak dibandingkan dengan bakteri Gram negatif, namun mengandung lebih sedikit lipid. Hal tersebut menyebabkan dinding sel Gram positif terdehidrasi selama perlakuan dengan menggunakan etanol, sehingga pori-pori dinding sel mengecil, permeabilitasnya berkurang dan warna ungu kristal-yodium tidak dapat terekstraksi (Pelczar dan Chan, 2007).
Beberapa organisme penyebab penyakit yang termasuk dalam bakteri patogen dan pembusuk makanan antara lain adalah S. Typhimurium, E. coli, P. aeruginosa, B. cereus, dan S. aureus. Apabila dibedakan berdasarkan kelompok Gram negatif dan Gram positif, S. Typhimurium, E. coli, dan P. aeruginosa termasuk bakteri Gram negatif, sedangkan yang termasuk dalam bakteri Gram positif adalah B. cereusdan S. aureus.
Salmonella entritidis ser. Thypimurium
Gambar 2. Salmonella typhi. Sumber: Black (2005)
Salmonella termasuk tipe bakteri mesofilik, yakni bakteri yang dapat tumbuh secara optimum pada suhu sekitar 35-37 oC, namun umumnya berkisar antara 5-46 o
C. Salmonella akan mati pada suhu pateurisasi dan sensitif terhadap pH rendah yakni pH kurang dari 4,5 dan tidak dapat berkembang biak pada aw 0,94, khususnya dengan kombinasi pH kurang dari 5,5 (Ray dan Bhunia, 2008). Bahan pangan rentan terhadap kontaminasi Salmonella, khususnya bahan pangan asal ternak yang memiliki angka tertinggi terjangkit oleh Salmonella. Bahan pangan ini diantaranya daging sapi, daging ayam, daging kalkun, daging babi, telur, susu, dan produk olahan bahan pangan tersebut (Ray, 2000).
Escherichia coli
Gambar 3. Escherichia coli. Sumber: Black (2005)
Strain ini dapat tumbuh secara efektif dalam media yang sederhana maupun yang kompleks dan kebanyakan di dalam makanan. Pertumbuhannya antara suhu10-50 oC, dengan suhu yang optimum adalah 30-37 oC. Beberapa strain dapat tumbuh pada suhu di bawah 10oC. Pertumbuhan cepat terjadi pada keadaan di bawah suhu optimum. Pertumbuhan dapat terhambat apabila dalam keadaan media yang memiliki pH rendah (di bawah 5,0) dan aw yang juga rendah (di bawah 0,93). E. coli sensitif terhadap suhu rendah, seperti suhu pasteurisasi (Ray dan Bhunia, 2008). Bakteri ini dapat tumbuh optimum pada pH 7,0-7,5 dengan pH minimum 4,0 dan pada pH maksimum 8,5 (Frazier dan Westhoff, 1998).
Pseudomonas aeruginosa
P. aeruginosa merupakan jenis bakteri patogen Gram negatif yang termasuk dalam genus Pseudomonas (Buckle et al., 2007). P. aeruginosa berflagel polar, bersifat aerobik, tetapi dalam hal tertentu nitrit dan digunakan sebagai elektron alternatif yang baik sehingga spesies ini dapat hidup dalam kondisi anaerobik. Selain itu P. aeruginosa dapat tumbuh pada suhu 41 oC bahkan beberapa strain tumbuh pada suhu 44 oC (Palleroni, 2008).
suhu lemari es atau refrigerator dan sering mengakibatkan terbentuknya lendir dan pigmen pada permukaan daging yang didinginkan.
Gambar 4. Pseudomonas aeruginosa. Sumber: Black (2005)
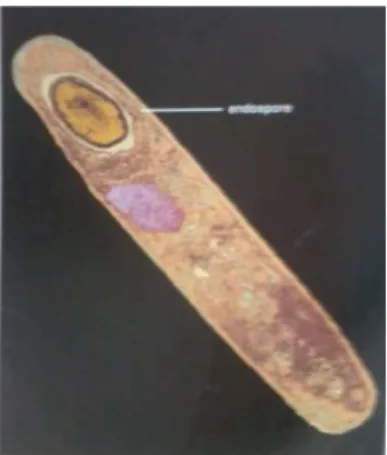
Bacillus cereus
B. cereus termasuk jenis bakteri Gram positif yang berbentuk batang, bergerak, dan dapat membentuk spora, bersifat anaerobik fakultatif dan tersebar secara luas dalam tanah dan air (Buckle et al., 2007). Suhu minimum untuk pertumbuhan B. cereus adalah 10oC. Sel bakteri ini sensitif terhadap pasteurisasi, namun sporanya dapat bertahan terhadap suhu tinggi. Suhu untuk pertumbuhannya berkisar antara 4-50 oC, dengan suhu optimum pertumbuhannya adalah 35-40 oC. Parameter pertumbuhan lainnya adalah bakteri ini dapat tumbuh pada pH 4,9 hingga 9,3 dengan aw minimum 0,95 serta konsentrasi NaCl adalah 10%. Spora dan sel B. cereus terdapat pada tanah serta debu, juga dapat diisolasi dari sebagian kecil makanan (Ray, 2000).
Gambar 5. Bacillus sp.
Staphylococcus aureus
Bakteri ini termasuk dalam family Microccaceae, merupakan bakteri Gram positif yang berbentuk kokus dan berpasangan tetrad atau kelompok menyerupai buah anggur, bersifat anaerobik fakultatif, tidak bergerak, dan tidak berspora (Holt et al., 1994). Bakteri ini tumbuh pada pH optimum sekitar 7,0-7,8 (Supardi dan Sukamto, 1999). Substrat yang baik untuk pertumbuhan dan produksi enterotoksin ialah substrat atau makanan yang mengandung protein seperti daging, ikan, susu dan produk olahannya.
Gambar 6. Staphylococcus aureus. Sumber: Madigan et al. (2009)
Mekanisme Aktivitas Antimikroba
Aktivitas senyawa antimikroba dapat dilihat dengan adanya mekanisme penghambatan pertumbuhan bakteri patogen dan pembusuk. Mekanisme tersebut dilakukan oleh senyawa antimikroba dengan cara merusak dinding sel mikroba sehingga sel yang sedang tumbuh akan terlisis atau terurai, protein sel juga terdenaturasi dan terjadi perusakan sistem metabolisme di dalam sel dengan cara menghambat kerja enzim intraseluler (Pelczar dan Rheid, 1986).
Beberapa cara antimikroba dalam aksinya melawan mikroorganisme yaitu memberikan efek bakteriostatik, bakterisidal ataupun bakterilisis. Sifat bakteriostatik akan menghambat pertumbuhan dan replikasi mikroorganisme, namun tidak menyebabkan kematian. Sifat bakterisidal berhubungan dengan kemampuan senyawa untuk menyebabkan kematian mikroorganisme, sedangkan sifat bakterilisis akan menyebabkan lisis sel mikroorganisme (Gonzales et al., 1994).
konsentrasi rendah. Beberapa bakteriosin mempunyai sifat bakterisidal melawan beberapa strain dan spesies yang berelasi dekat tetapi beberapa dapat efektif melawan banyak strain dalam spesies dan genera yang berbeda. Namun, sel penghasil bakteriosin akan mengalami ketahanan terhadap bakteriosin yang dihasilkannya sendiri, disebabkan memperoleh ketahanan protein yang spesifik. Bakteriosin ini pada umumnya sangat efektif melawan sel dari bakteri Gram positif yang lain (Ray, 2004).
MATERI DAN METODE Lokasi dan Waktu
Penelitian ini berlangsung selama tujuh bulan, yakni mulai dari bulan Februari sampai dengan bulan Agustus 2011. Penelitian ini dilaksanakan di Laboratorium Terpadu Ilmu Produksi dan Teknologi Peternakan, Departemen Ilmu Produksi dan Teknologi, Fakultas Peternakan, Institut Pertanian Bogor.
Materi
Bahan-bahan yang digunakan dalam penelitian ini antara lain isolat bakteri asam laktat yaitu L. plantarum 2C12, 1A5, 1B1 dan 2B2 yang berasal dari daging sapi Peranakan Ongole koleksi Laboratorium Teknologi Hasil Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan IPB (Arief, 2011) dan bakteri patogen yakni S. Thypimurium ATCC 14028, E. coli ATCC 25922, P. aeruginosa ATCC 27853, B. cereus, dan S. aureus ATCC 25923. Media yang digunakan adalah deMan Rogosa and Sharpe broth (MRS broth), deMan Rogosa and Sharpe Agar (MRS agar), Nutrient broth (NB), Nutrient Agar (NA), Mueller Hinton Agar (MHA), BPW, yeast extract, aquadest, larutan NaOH 0,1 N dan 1 N, serbuk ammonium sulfat, dan buffer kalium fosfat (campuran KH2PO4dan K2HPO4 dengan konsentrasi tertentu).
Alat-alat yang digunakan antara lain tabung reaksi, cawan petri, ose, hot plate stirrer, gelas ukur, gelas piala, tabung erlenmeyer, timbangan digital, mikropipet, tip, pemanas bunsen, jangka sorong digital, pH meter, autoklaf, oven, buret, vortex, inkubator, refrigerator, sentrifuge, membran saring miliphore diameter 0,22 µm, spektrofotometer UV-Vis, dan membran dialisis diameter 20 µm.
Prosedur
Karakterisasi Isolat L. plantarumdan Bakteri Indikator
Kultur kemudian diinkubasi pada suhu 37 oC selama 24 jam dan hasilnya disebut kultur kerja. Kultur kerja ini yang digunakan untuk mengkonfirmasi kemurnian bakteri uji dan dilakukan melalui pewarnaan Gram. Inokulasi dilakukan dengan metode yang sama juga dilakukan pada bakteri indikator (bakteri patogen). Perbedaannya adalah pada media tumbuh yang digunakan, untuk menumbuhkan bakteri patogen media yang digunakan adalah media nutrient broth (NB).
Pewarnaan Gram berdasarkan Waluyo (2008) dilakukan dengan cara membuat preparat ulas dari isolat bakteri baik BAL maupun bakteri patogen yang akan digunakan yang dihomogenkan terlebih dahulu dengan vortex kemudian diambil satu ose dan dioleskan pada kaca objek lalu difiksasi panas menggunakan api. Preparat ulas tersebut kemudian ditetesi dengan kristal violet selama satu menit lalu dimiringkan dengan tujuan untuk meratakan kristal violet. Selanjutnya preparat yang telah ditetesi kristal violet dibilas dengan akuades dan dikeringkan. Preparat ulas yang telah kering tersebut diberi iodium selama dua menit dan dimiringkan kembali, kemudian dibilas dengan akuades dan dibiarkan mengering. Preparat ulas dicuci dengan pemucat warna yaitu etanol 95%, tetes demi tetes selama 30 detik atau hingga zat warna kristal violet tidak terlihat lagi ataupun masih mengalir di atas kaca obyek, kemudian dicuci dengan akuades dan dikeringkan. Preparat ulas selanjutnya ditetesi safranin selama 30 detik, dimiringkan, kemudian dibilas dengan akuades dan didiamkan hingga mengering. Preparat diamati dibawah mikroskop untuk melihat bentuk dan warna dinding sel dari masing-masing isolat. Preparat yang berwarna ungu kebiruan menunjukkan bahwa preparat tersebut termasuk dalam kelompok bakteri Gram positif sedangkan preparat yang berwarna merah menunjukkan bahwa preparat tersebut termasuk kelompok bakteri Gram negatif.
Analisis Kurva Pertumbuhan Isolat L. plantarum
sebanyak 1 ml diencerkan dengan MRS broth menjadi enam bagian pengenceran yang berbeda yakni 1, 1/2, 1/4, 1/8, 1/16 dan 1/32. Pengenceran dilakukan menggunakan mikropipet yakni dari masing-masing bagian pengenceran diambil 1 ml untuk diencerkan lagi ke dalam 9 ml media BPW, masing-masing sebanyak 9 kali untuk bagian pengenceran 1, 8 kali untuk bagian pengenceran 1/2, 7 kali untuk bagian pengenceran 1/4, 6 kali untuk bagian pengenceran 1/8, 5 kali untuk bagian pengenceran 1/16, dan 4 kali untuk bagian pengenceran 1/32. Masing-masing pengenceran dengan media BPW selanjutnya dihomogenkan, lalu tiga pengenceran terakhir dari masing-masing bagian pengenceran tersebut diinokulasikan ke dalam cawan sebanyak 1 ml kemudian dituangkan media MRS agar sekitar 15 ml untuk mendapatkan jumlah populasi bakteri.
Nilai optical density (OD) dan jumlah populasi bakteri (cfu/ml) dari kultur yang sama (keenam pengenceran yang berbeda: 1, 1/2, 1/4, 1/8, 1/16 dan 1/32) akan didapatkan persamaan regresi linier: y = ax + b. Hasil pengukuran OD setiap 1 jam sekali merupakan nilai x, kemudian dimasukkan ke dalam rumus tersebut untuk mendapatkan nilai y yang merupakan jumlah populasi yang diinginkan untuk membuat kurva pertumbuhan dengan satuan cfu/ml.
Aktivitas Antimikroba Supernatan Bebas Sel Isolat L. plantarum terhadap Bakteri Indikator selama 24 Jam Inkubasi
Aktivitas antimikroba supernatan bebas sel dapat diketahui melalui uji antagonistik dengan suatu metode yakni metode difusi sumur agar. Metode tersebut dilakukan dengan mengkonfrontasikan bakteri indikator (patogen dan pembusuk makanan) dengan supernatan bebas sel dari masing-masing isolat L. plantarum di dalam sumur agar. Isolat L. plantarumyang berbeda diinokulasikan ke dalam media tumbuh MRS broth. Media hasil inokulasi isolat dipusingkan dengan sentrifuge selama 20 menit dengan kecepatan 6000 rpm pada suhu 4 oC. Supernatan yang dihasilkan dari proses tersebut disebut supernatan bebas sel. Supernatan bebas sel kemudian diukur nilai pH menggunakan pH meter dan persentase Total Asam Tertitrasi (%TAT) dengan NaOH 0,1 N setiap 4 jam sekali selama 24 jam. Perhitungan %TAT menggunakan rumus berikut :
Sumur agar dibuat dengan bakteri indikator sebanyak 106cfu/ml (disesuaikan dengan standar Mc Farland 0,5) yang berumur 24 jam diinokulasikan ke dalam cawan kemudian dituangkan media konfrontasi yakni Mueller Hinton Agar(MHA), ditunggu hingga dingin dan mengeras lalu dibuat lubang-lubang menyerupai sumur dengan diameter lubang 5 mm. Ke dalam sumur tersebut dimasukkan sebanyak 50 µl supernatan bebas sel. Cawan yang digunakan untuk uji konfrontasi tersebut kemudian disimpan ke dalam refrigerator selama kurang lebih 2 jam lalu diinkubasi pada suhu 37 oC selama 24 jam. Zona bening yang terbentuk di sekitar sumur menandakan adanya aktivitas penghambatan supernatan bebas sel terhadap bakteri patogen. Proses sentrifugasi, pengukuran pH dan %TAT hingga uji antagonistik tersebut dilakukan setiap 4 jam sekali selama 24 jam.
Produksi Bakteriosin Kasar Isolat L. plantarum 2C12, 1A5, 1B1 dan 2B2
Produksi Supernatan Netral Isolat L. plantarum yang Berbeda. Sebanyak 1 liter media MRS broth ditambah dengan yeast extract 3% dan NaCl 1% diinokulasi dengan 10% (v/v) kultur L. plantarum 2C12, 1A5, 1B1 dan 2B2, selanjutnya diinkubasi pada suhu 37 oC selama 20 jam. Media hasil inkubasi disimpan pada refrigerator dengan suhu 4oC selama 2 jam, kemudian dilakukan sentrifugasi dengan kecepatan 10000 rpm selama 20 menit pada suhu 4 oC. Proses sentrifugasi menghasilkan cairan yang terpisah dengan endapan. Cairan tersebut kemudian dipisahkan (disebut supernatan bebas sel) dan disaring menggunakan membran saring miliphore berdiameter 0,22 µm. Supernatan bebas sel diukur pH nya lalu dinetralkan menjadi 6 menggunakan NaOH 1 N. Supernatan bebas sel yang telah dinetralkan disebut supernatan netral. Supernatan netral yang terbentuk selanjutnya diuji aktivitas antimikrobanya melalui uji antagonistik.
dan juga menempel pada dinding erlenmeyer. Endapan protein yang melayang dan menempel pada dinding erlenmeyer disebut prespitat bakteriosin kasar. Prespitat bakteriosin kasar tersebut kemudian dikoleksi ke dalam wadah kaca yang lain dan diukur konsentrasi protein serta aktivitas antimikrobanya melalui uji antagonistik.
Dialisis. Dialisis dilakukan dengan tujuan untuk desalting atau menghilangkan garam amonium sulfat yang masih bercampur dengan prespitat bakteriosin kasar. Proses tersebut dilakukan dengan menggunakan buffer kalium fosfat. Buffer kalium fosfat dibuat dengan campuran KH2PO4 dan K2HPO4 dengan konsentrasi tertentu dan memiliki pH 6. Dialisis dilakukan dengan cara memasukkan membran dialisis berdiameter 20 µm yang telah diisi dengan presipitat bakteriosin kasar ke dalam buffer kalium fosfat dengan perbandingan 1:1000 (1 bagian prespitat dan 1000 bagian buffer). Proses tersebut dilakukan di atas stirrer selama kurang lebih 12 jam pada suhu 4oC, dan selama 12 jam tersebut dilakukan penggantian buffer sebanyak 2 kali (jam ke 2 dan jam ke 4). Hasil dari proses tersebut kemudian didapatkan ekstrak kasar bakeriosin. Ekstrak kasar bakteriosin isolat L. plantarum tersebut selanjutnya disebut dengan bakteriosin kasar. Bakteriosin kasar selanjutnya diukur konsentrasi proteinnya dan dilakukan uji antagonistik.
Pengukuran konsentrasi protein dilakukan menggunakan Spektrofotometer UV-Vis pada λ = 280 nm. Pengukuran dilakukan berdasarkan penggunaan manual pada alat tersebut yakni dengan mengkalibrasi alat menggunakan blanko yakni buffer kalium fosfat. Apabila hasil yang tertera pada layar alat menunjukkan bahwa konsentransi protein lebih dari 2,5 µg/ml, artinya sampel terlalu pekat dan perlu dilakukan pengenceran dengan buffer kalium fosfat. Pembacaan nilai konsentrasi protein dilakukan sebanyak tiga kali. Hasil akhir yang merupakan konsentrasi protein sampel diperoleh dari hasil pembacaan dikalikan dengan faktor pengencer kemudian dihitung rata-ratanya.
diinokulasikan ke dalam cawan, selanjutnya dituangkan media konfrontasi MHA. Setelah agar mengeras dan dingin, dibuat sumur pada cawan dengan diameter 5 mm. Sebanyak 50 µl senyawa antimikroba hasil dari masing-masing proses produksi dimasukkan kedalam sumur dengan mikropipet. Cawan disimpan dalam refrigerator selama 2 jam untuk memberikan kesempatan bakteriosin berdifusi ke dalam agar. Setelah itu cawan diinkubasi pada suhu 37 oC selama 24 jam. Zona bening yang terbentuk di sekitar area sumur menandakan bahwa senyawa antimikroba yang dihasilkan dari masing-masing tahap produksi mampu menghambat bakteri indikator. Selanjutnya dilakukan pengukuran diameter zona bening (mm) menggunakan jangka sorong digital.
Rancangan Percobaan dan Analisis Data
Rancangan percobaan dan analisis data terdiri dari perlakuan dan model rancangan penelitian. Rancangan percobaan dan analisis data yang digunakan pada penelitian ini meliputi analisis kurva pertumbuhan isolat L. plantarum (2C12, 1A5, 1B1 dan 2B2), aktivitas antimikroba supernatan bebas sel isolat L. plantarumselama 24 jam inkubasi, serta produksi bakteriosin kasar yang terdiri dari tiga tahap yakni tahap produksi supernatan antimikroba netral isolat L. plantarum, purifikasi parsial menggunakan presipitasi amonium sulfat, dan dialisis.
Analisis Kurva Pertumbuhan Isolat L. plantarum
Analisis kurva pertumbuhan dilakukan untuk mengamati pertumbuhan isolat L. plantarumyang berbeda (L. plantarum2C12, 1A5, 1B1 dan 2B2) yang dilakukan sebanyak tiga kali ulangan. Peubah yang diamati adalah jumlah populasi keempat isolat L. plantarum yang berbeda. Data yang diperoleh kemudian diinterpretasikan secara deskriptif.
Aktivitas Antimikroba Supernatan Bebas Sel Isolat L. plantarum terhadap Bakteri Indikator selama 24 Jam Inkubasi
isolat L. plantarum yang berbeda. Data yang diperoleh diinterpretasikan secara deskriptif.
Produksi Bakteriosin Kasar Isolat L. plantarum 2C12, 1A5, 1B1 dan 2B2
Produksi bakteriosin kasar terdiri dari beberapa tahapan yakni produksi supernatan netral isolat L. plantarum, purifikasi parsial menggunakan presipitasi amonium sulfat dan dialisis. Ketiga tahapan tersebut menggunakan rancangan percobaan rancangan acak lengkap (RAL) pola Faktorial (5x4) dengan perlakuan isolat L. plantarumyang berbeda (L. plantarum 2C12, 1A5, 1B1 dan 2B2) terhadap jenis bakteri indikator (S. Thypimurium ATCC 14028, Escherichia coli ATCC 25922, P. aeruginosaATCC 27853, B. cereus, S. aureusATCC 25923) dengan tiga kali ulangan.
Peubah yang diamati adalah diameter zona hambat dan konsentrasi protein senyawa antimikroba yang dihasilkan oleh keempat isolat L. plantarumyang berbeda dari ketiga tahap produksi. Analisis data yang digunakan untuk diameter zona hambat senyawa antimikroba adalah analisis ragam, sedangkan analisis data yang digunakan untuk konsentrasi protein senyawa antimikroba adalah diinterpetasikan secara deskriptif. Model statistika yang digunakan menurut Steel and Torrie (1995) adalah sebagai berikut:
Yijk= µ + Ai+ Bj + (AB)ij + εijk Keterangan:
Yijk = diameter zona hambat isolat L. plantarum ke-i dan bakteri indikator ke-j pada ulangan ke-k (k = 1, 2, 3)
µ = rataan diameter zona hambat L. plantarum
Ai = pengaruh isolat L. plantarumke-i (i = 2C12, 1A5, 1B1 dan 2B2)
Bj = pengaruh bakteri indikator ke-j (j = S.Thypimurium ATCC 14028, E. coli ATCC 25922, P. aeruginosa ATCC 27853, B. cereus, S. aureus ATCC 25923)
(AB)ij = pengaruh interaksi isolat Lactobacillus plantarumke-i dengan patogen ke-j εijk = pengaruh galat percobaan dari isolat L. plantarum ke-i dan bakteri
HASIL DAN PEMBAHASAN
Karakterisasi Isolat L. plantarum dan Bakteri Indikator
Karakterisasi isolat L. plantarum dan bakteri indikator dilakukan untuk mengetahui karakteristik baik sifat maupun morfologi atau bentuk dari isolat bakteri asam laktat (BAL) dan bakteri indikator yang akan digunakan dalam penelitian ini. Isolat L. plantarum yang digunakan terdiri dari L. plantarum 2C12, 1A5, 1B1 dan 2B2. Keempat BAL tersebut merupakan isolat yang sama yakni L. plantarumnamun yang membedakan adalah strainnya yang dibedakan melalui penamaannya. Menurut Arief et al. (2007), L. plantarum 2C12, 1A5, 1B1 dan 2B2 merupakan isolat indigenus yang berasal dari daging sapi lokal dengan umur postmortem dan tempat pengambilan daging yang berbeda. Bakteri indikator yang digunakan dalam penelitian ini merupakan bakteri patogen dan pembusuk yang terdiri dari S. Thypimurium ATCC 14028, E. coli ATCC 25922, P. aeruginosa ATCC 27853, B. cereus, dan S. aureus ATCC 25923.
Tabel 1. Karakteristik Isolat Bakteri Asam Laktat
Isolat BAL Pewarnaan Gram Morfologi Gambar Morfologi
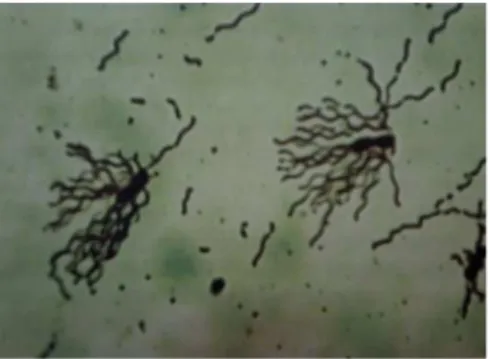
L. plantarum 2C12
Gram positif Berbentuk batang tunggal atau koloni, susunan
rantai pendek
L. plantarum 1A5
Gram positif Berbentuk batang tunggal atau koloni, susunan
rantai pendek
L. plantarum 1B1
Gram positif Berbentuk batang tunggal atau koloni, susunan
rantai pendek
L. plantarum 2B2
Gram positif Berbentuk batang tunggal atau koloni, susunan
rantai pendek
Berdasarkan Tabel 1 dapat dilihat bahwa kelima isolat L. plantarum baik L. plantarum 2C12, 1A5, 1B1 maupun 2B2 termasuk bakteri Gram positif yang berbentuk batang dengan susunan tunggal maupun koloni dan membentuk rantai pendek. Hal tersebut sesuai dengan pernyataan Firmansyah (2009) bahwa L. plantarum 1A5, 1B1 dan 2B2 merupakan bakteri Gram positif berdasarkan pengujiannya melalui pewarnaan Gram. Pelczar dan Chan (2007) juga mendukung pernyataan tersebut bahwa Lactobacillus sp. merupakan bakteri Gram positif morfologi selnya berbentuk batang, terdapat tunggal atau dalam rantai, non motil, bersifat anaerobik atau anaerobik fakultatif, serta dapat ditemui pada produk-produk daging dan susu juga pada air.
L. plantarum termasuk bakteri dalam filum Firmicutes, kelas Bacilli, ordo Lactobacillales, famili Lactobacillaceae dan genus Lactobacillus. L. plantarum merupakan salah satu jenis BAL homofermentatif dengan pertumbuhan yang optimal pada suhu 30-37 oC serta pada pH 5-7 (Emanuel et al., 2005). L. plantarum mempunyai kemampuan untuk menghambat mikroorganisme patogen pada bahan pangan dengan daerah penghambatan terbesar dibandingkan dengan bakteri asam laktat lainnya (Jenie dan Rini, 1995). Menurut Wijayanto (2009), L. plantarum2C12, 1A5, 1B1 dan 2B2 mampu bertahan hidup dengan baik pada pH 2. L. plantarum1A5 dan 1B1 memiliki toleransi yang tinggi terhadap garam empedu dan berpotensi sebagai kandidat probiotik. Firmansyah (2009) menambahkan bahwa L. plantarum 1A5, 1B1 dan 2B2 dapat tumbuh pada suhu 15 oC, dengan suhu pertumbuhan optimum pada 37-45 oC (mesofilik) dan juga dapat bertahan hidup pada lingkungan yang mengandung NaCl 65% (halofilik).
Tabel 2. Karakteristik Isolat Bakteri Indikator
Isolat BAL Pewarnaan Gram Morfologi Gambar Morfologi
E. coliATCC 25922
Gram negatif Berbentuk batang tunggal
atau koloni
S. aureus ATCC 25923
Gram positif Berbentuk bulat, susunan
bergerombol seperti anggur
S. Thypimurium ATCC 14028
Gram negatif Berbentuk batang tunggal
atau koloni
B. cereus Gram positif Berbentuk batang tunggal
atau koloni
P. aeruginosa ATCC 27853
Gram negatif Berbentuk batang tunggal
Tabel 2 memperlihatkan bahwa bakteri indikator memiliki karakteristik yang berbeda pada masing-masing isolat khususnya dalam hal pewarnaan Gram, artinya tidak semua bakteri termasuk dalam satu kelompok bakteri Gram positif saja ataupun kelompok bakteri Gram negatif saja. Seperti yang telah dijelaskan sebelumnya bahwa perbedaan warna yang dihasilkan oleh setiap bakteri setelah mengalami proses pewarnaan Gram disebabkan oleh adanya perbedaan komposisi dinding sel yang dimiliki oleh bakteri. Hal itu juga didukung oleh pernyataan Waluyo (2008) bahwa penyebab perbedaan pewarnaan Gram dimungkinkan karena komposisi dinding sel bakteri Gram positif berbeda dengan bakteri Gram negatif. Perbedaan komposisi dinding sel tersebut dapat mempengaruhi laju lepasnya kompleks warna ungu kristal-iodium yang diberikan pada sel bakteri selama tahap pemucatan.
Hal tersebut dipengaruhi oleh beberapa faktor, antara lain: 1) proses fiksasi pada terhadap olesan, yakni olesan bakteri yang dipanaskan secara berlebihan akan menyebabkan pecahnya dinding sel bakteri. Hal tersebut mengakibatkan sel bakteri Gram positif akan melepaskan warna primer dan menerima warna tandingan; 2) kerapatan sel pada olesan, yakni olesan yang baik hendaknya tidak terlalu tebal atau terlalu tipis karena olesan yang terlalu tebal dapat mengakibatkan pewarnaan tidak cepat memucat seperti pada olesan dengan kerapatan sel yang normal; 3) jenis dan konsentrasi reagen yang digunakan dalam pewarnaan, sebaiknya larutan pemucat yang digunakan adalah campuran antara larutan etanol 95% dan aseton (1:1) karena larutan etanol 95% bekerja paling lambat sebagai larutan pemucat dan aseton bekerja paling cepat; dan 4) umur biakan, pewarnaan Gram akan memberikan hasil yang baik apabila menggunakan biakan segar berumur 24-48 jam, apabila menggunakan biakan tua akan terjadi penyimpangan hasil pada proses pewarnaan Gram karena pada biakan tua banyak sel yang telah mengalami kerusakan pada dinding selnya sehingga dinding sel yang tersebut tidak dapat mempertahankan zat warna yang tertangkap dan menyebabkan zat warna keluar pada saat dicuci dengan larutan pemucat.
alami terdapat di dalam saluran pencernaan manusia dan juga hewan, maka secara luas digunakan sebagai indikator pencemaran. Selain itu, bakteri ini termasuk bakteri anaerobik fakultatif, seperti yang dijelaskan oleh Buckle et al. (2007) bahwa Bakteri ini adalah gram negatif, bergerak, berbentuk batang, bersifat fakultatif anaerob dan termasuk golongan Enterobacteriaceae. Sama halnya dengan S. Thypimurium ATCC 14028 yang menurut Buckle et al. (2007) merupakan jenis bakteri Gram negatif, berbentuk batang, bergerak serta mempunyai tipe metabolisme yang bersifat fakultatif anaerob dan termasuk kelompok bakteri Enterobacteriaceae. P. aeruginosa ATCC 27853 juga merupakan bakteri Gram negatif, berflagel polar, bersifat aerobik, tetapi dalam hal tertentu nitrit digunakan sebagai elektron alternatif yang baik sehingga spesies ini dapat hidup dalam kondisi anaerobik. Selain itu P. aeruginosa dapat tumbuh pada suhu 41 oC bahkan beberapa strain tumbuh pada suhu 44 oC (Palleroni, 2008).
S. aureus menurut Holt et al. (1994) termasuk dalam family Microccaceae, merupakan bakteri Gram positif yang berbentuk kokus dan berpasangan tetrad atau kelompok menyerupai buah anggur, bersifat anaerobik fakultatif, tidak bergerak, dan tidak berspora. B. cereus juga merupakan bakteri Gram positif yang memiliki spora dan selnya terdapat pada tanah serta debu, juga dapat diisolasi dari sebagian kecil makanan (Ray, 2000).
Analisis Kurva Pertumbuhan Isolat L. plantarum
Analisis kurva pertumbuhan isolat L. plantarumdilakukan untuk mengetahui proses pertumbuhan bakteri sehingga dapat digunakan untuk menentukan waktu yang optimal atau waktu terbaik pada isolat BAL tersebut dalam memproduksi senyawa antimikroba. Kurva pertumbuhan juga dapat digunakan untuk menentukan lama waktu inkubasi pada BAL yang dibutuhkan selama proses produksi senyawa antimikroba.
panen (pertambahan total masa sel) dan bukan perubahan individu organisme. Pertumbuhan adalah peningkatan secara teratur dalam kuantitas konstituen seluler. Hal ini tergantung pada kemampuan sel untuk membentuk protoplasma baru dari nutrisi yang tersedia di lingkungan. Dalam sebagian besar bakteri, pertumbuhan melibatkan peningkatan massa sel dan jumlah ribosom, duplikasi kromosom bakteri, sintesis dinding sel baru dan membran plasma, partisi dari dua kromosom, pembentukan septum, dan pembelahan sel (Todar, 2009).
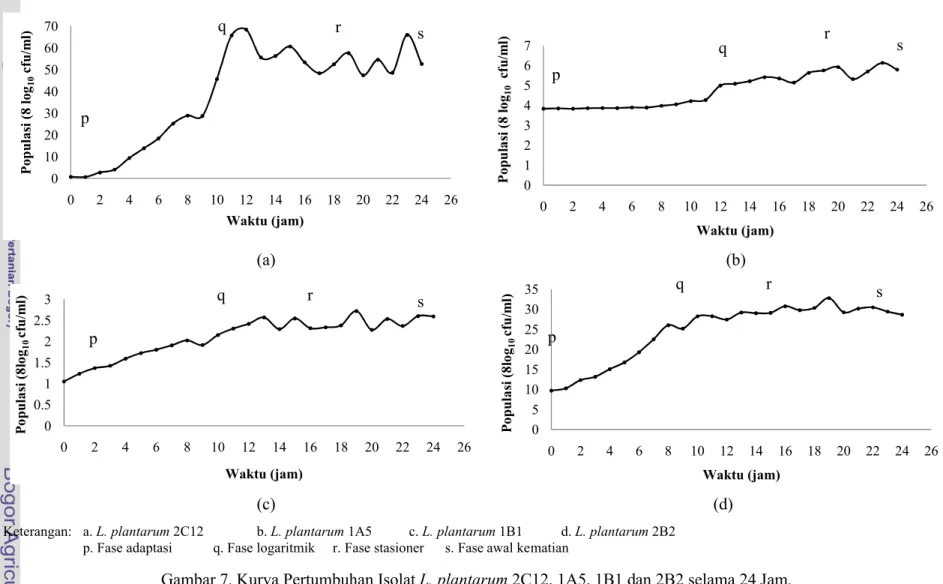
Kurva pertumbuhan keempat isolat L. plantarum yakni 2C12, 1A5, 1B1 dan 2B2 memiliki empat fase yaitu fase adaptasi, fase eksponensial, fase tetap (stationary phase) dan fase menurun atau fase kematian. Hal tersebut sesuai dengan Todar (2009) yang menyatakan bahwa bakteri memiliki empat karakteristik siklus pertumbuhan, yakni fase lag, fase eksponensial (logaritmik), fase stasioner dan fase kematian. Hasil analisis kurva pertumbuhan keempat isolat L. plantarum disajikan dalam Gambar 7.
Gambar 7 menunjukkan bahwa selama 24 jam waktu inkubasi, keempat isolat L. plantarum mengalami empat fase pertumbuhan dengan lama yang berbeda-beda. Fase adaptasi pada L. plantarum2C12 dan L. plantarum2B2 pada jam ke 0-2 waktu inkubasi, L. plantarum1A5 pada jam ke 0-7, dan L. plantarum1B1 pada jam ke 0-9. Lama fase adaptasi yang berbeda pada masing-masing isolat BAL dapat dipengaruhi oleh beberapa faktor, seperti jenis bakteri, umur serta lingkungan hidup bakteri tersebut.
31
Fase logaritmik yang dialami oleh keempat isolat L. plantarumyakni selama kurang lebih 8 jam kemudian isolat tersebut mengalami fase stasioner dimana jumlah populasi dari isolat tersebut sudah dapat dihitung karena pada fase ini bakteri tidak lagi mengalami pembelahan sel namun bakteri tersebut hanya berkonsentrasi pada proses metabolisme di dalam tubuhnya. Proses metabolisme tersebut akan menghasilkan senyawa antimikroba antara lain asam organik, hidrogen peroksida (H2O2) dan juga bakteriosin, sesuai dengan Vuyst dan Vandamme (1994) yang menyatakan bahwa BAL memiliki hasil metabolit yang berfungsi sebagai senyawa antimikroba seperti asam organik, bakteriosin, H2O2, CO2, serta diasetil.
Kurva pertumbuhan BAL pada Gambar 7 juga menunjukkan bahwa fase stasioner rata-rata terjadi pada selang waktu inkubasi antara jam ke-10 hingga jam ke 23 dengan jumlah populasi sel yang berbeda pada masing-masing isolat. L. plantarum 2C12 memiliki jumlah populasi tertinggi pada lama inkubasi jam ke-12 yakni sebebsar 6,84 x 109cfu/ml, L. plantarum1A5 memiliki populasi tertinggi pada lama inkubasi jam ke-23 sebesar 6,13 x 108cfu/ml, L. plantarum1B1 sebesar 2,60 x 108cfu/ml pada jam ke-19 dan L. plantarum2B2 sebesar 3,28 x 109cfu/ml pada jam ke-19. Jumlah populasi bakteri yang hidup dapat mempengaruhi hasil metabolisme sekundernya yakni senyawa antimikroba. Semakin banyak BAL yang hidup maka senyawa antimikroba yang dihasilkan juga semakin banyak.
sel autolisis, bakteriosin juga merupakan molekul proteaneus sehingga molekulnya mudah terdegradasi (Jo et al., 1996).
Aktivitas Antimikroba Supernatan Bebas Sel Isolat L. plantarum selama 24 Jam Inkubasi
Salah satu karakteristik terpenting dari bakteri asam laktat (BAL) yakni kemampuannya dalam menghasilkan sifat antimikroba, dan salah satu senyawa antimikroba yang berasal dari isolat L. plantarum adalah bakteriosin. Untuk itu, sebelum melalui tahapan produksi perlu dilakukan identifikasi awal senyawa antimikroba terhadap keempat isolat BAL untuk memastikan bahwa masing-masing strain dari isolat tersebut memiliki atau mengandung senyawa antimikroba yang diinginkan serta yang akan diproduksi. Identifikasi awal dilakukan melalui pengujian aktivitas antimikroba.
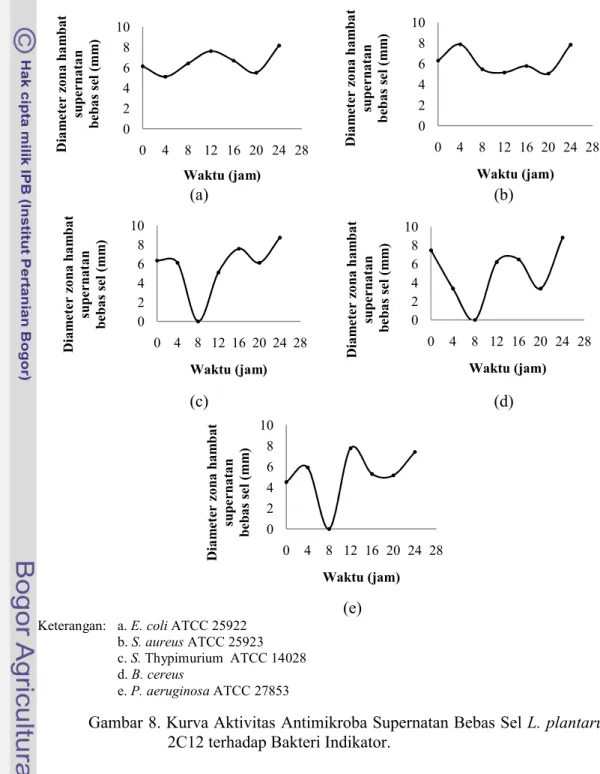
Pengujian aktivitas antimikroba tersebut dilakukan oleh supernatan bebas sel dari masing-masing isolat L. plantarum. Supernatan bebas sel didapat dari hasil inokulasi isolat ke dalam media MRS broth kemudian diinkubasi pada suhu 37 oC selama 24 jam kemudian disentrifugasi. Cairan yang terpisah di bagian atas setelah sentrifugasi merupakan supernatan bebas sel, lalu supernatan bebas sel tersebut dikonfrontasikan dengan bakteri indikator pada sumur agar. Penggunaan supernatan bebas sel untuk uji antagonistik adalah agar dapat dipastikan bahwa yang bekerja sebagai penghambat pertumbuhan bakteri patogen dalam pengujia tersebut adalah senyawa antimikroba dari hasil metabolisme sel atau bakteri, bukan selnya. Hasil uji antagonistik menggunakan sumur agar ditunjukkan dengan adanya zona bening di sekitar sumur agar. Zona bening tersebut merupakan zona hambat yang menunjukkan adanya aktivitas senyawa antimikroba yang berasal dari supernatan bebas sel L. plantarum2C12, 1A5, 1B1 dan 2B2, selanjutnya diameter dari zona bening diukur menggunakan jangka sorong digital. Hasil pengukuran zona hambat supernatan bebas sel masing-masing isolat L. plantarumdisajikan dalam bentuk kurva.
ke-24 inkubasi. Hal tersebut dapat terjadi karena produksi senyawa antimikroba oleh BAL tidak selalu terjadi pada fase stasioner. Menurut Parente et al. (1997), produksi senyawa antimikroba oleh BAL dapat terjadi pada di akhir fase eksponensial atau terkadang pada saat sebelum pertumbuhannya berhenti (fase kematian).
(a) (b)
(c) (d)
(e) Keterangan: a.E. coli ATCC 25922
b. S. aureusATCC 25923 c. S.Thypimurium ATCC 14028 d.B. cereus
e.P. aeruginosaATCC 27853
(a) (b)
(c) (d)
(e) Keterangan: a.E. coli ATCC 25922
b. S. aureusATCC 25923 c. S.Thypimurium ATCC 14028 d.B. cereus
e.P. aeruginosaATCC 27853
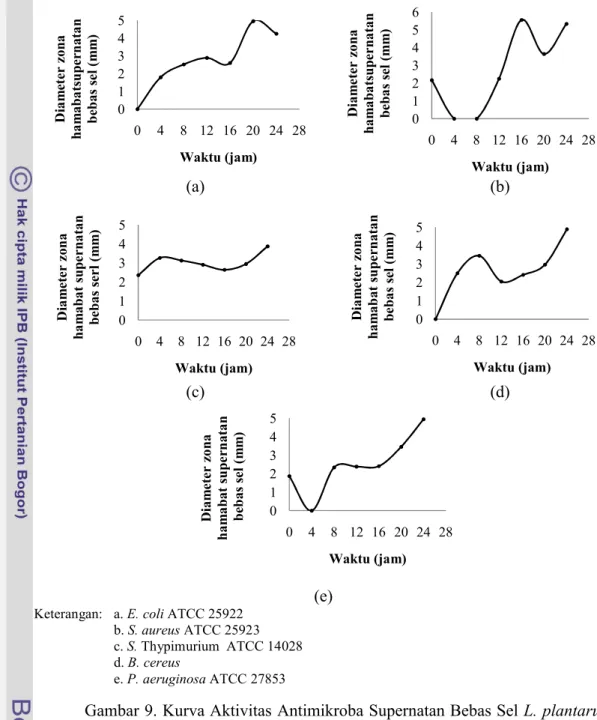
Gambar 9. Kurva Aktivitas Antimikroba Supernatan Bebas Sel L. plantarum 1A5 terhadap Bakteri Indikator.
Produksi senyawa antimikroba oleh BAL dapat dipengaruhi oleh beberapa faktor diantaranya adalah ketersediaan energi (glukosa) oleh BAL dalam bermetabolisme terutama menghasilkan asam laktat dan juga senyawa antimikroba. Ketersediaan glukosa kemungkinan masih tinggi pada akhir fase eksponensial atau pada saat sebelum fase kematian, sehingga produksi senyawa antimikroba juga tinggi dan zona hambat yang dihasilkan pada fase tersebut juga besar. Callewaert dan Vuyst
(2000) menambahkan bahwa penambahan glukosa dengan konsentrasi tertentu dalam media dapat meningkatkan aktivitas bakteriosin pada fase akhir eksponensial dan akan menurun setelah 30 jam inkubasi (setelah fase kematian).
Aktivitas antimikroba supernatan bebas sel L. plantarum 1A5 terhadap S. Thypimurium ATCC 14028, B. cereus dan P. aeruginosa ATCC 27853 mencapai angka tertinggi pada jam ke-24, namun berbeda dengan aktivitas antimikroba terhadap E. coli ATCC 25922 yang terjadi pada jam ke-20 dengan diameter zona hambat sebesar 4,95 mm dan S. aureus ATCC 25923 pada jam ke-16 dengan diameter zona hambat sebesar 5,55 mm. Hal tersebut dapat terjadi karena jumlah populasi sel BAL yang hidup lebih banyak sehingga produksi senyawa antimikrobanya juga banyak. Berdasarkan hasil pembuatan kurva pertumbuhan BAL bahwa produksi senyawa antimikroba terjadi pada fase stasioner yakni pada rata-rata lama inkubasi jam ke-10 hingga jam ke-23.
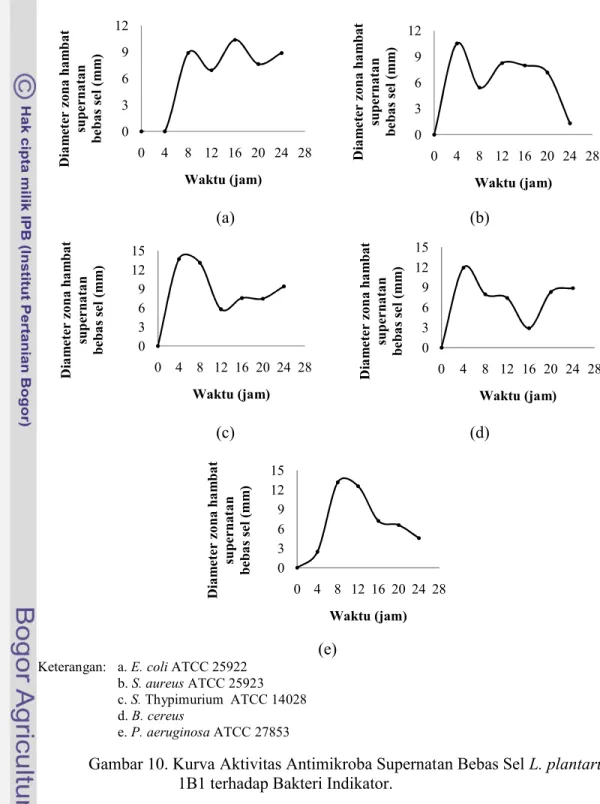
Gambar 10 menunjukkan bahwa aktivitas antimikroba terbesar yang dilakukan oleh upernatan bebas sel L. plantarum 1B1 terjadi pada lama inkubasi jam ke-4 yakni terhadap S. aureus ATCC 25923 dengan besar diameter zona hambat adalah 10,52 mm, S. Thypimurium ATCC 14028 sebesar 13,71 mm dan B. cereus sebesar 11,95 mm. Hal tersebut dapat dikarenakan pada jam ke-4 merupakan fase adaptasi berdasarkan hasil analisis kurva pertumbuhan, dimana pada fase tersebut waktu inkubasi pada BAL untuk beradaptasi terhadap media yang baru dengan cepat sehingga pada fase tersebut sel-selnya juga akan dapat segera membelah diri. Sel-sel yang telah membelah diri membuat populasi sel di dalam media tumbuh menjadi banyak dan hal tersebut akan berkorelasi dengan jumlah senyawa antimikroba yang dihasilkan.
ke-8 waktu inkubasi kultur bakteri mulai mengalami fase pertumbuhan lambat, dimana pada fase tersebut jumlah sel yang lahir mulai seimbang dengan jumlah sel yang mati.
(a) (b)
(c) (d)
(e) Keterangan: a.E. coli ATCC 25922
b. S. aureusATCC 25923 c. S.Thypimurium ATCC 14028 d.B. cereus
e.P. aeruginosaATCC 27853
(a) (b)
(c) (d)
(e) Keterangan: a.E. coli ATCC 25922
b. S. aureusATCC 25923 c. S.Thypimurium ATCC 14028 d.B. cereus
e.P. aeruginosaATCC 27853
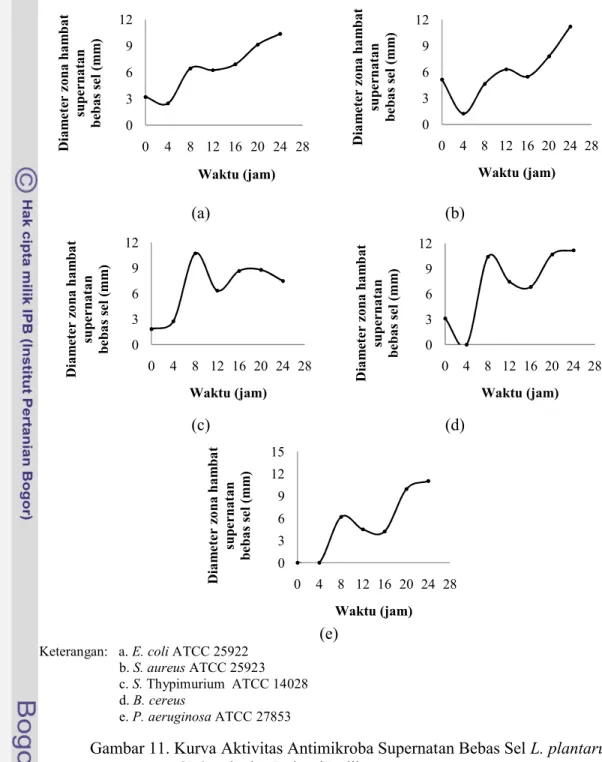
Gambar 11. Kurva Aktivitas Antimikroba Supernatan Bebas Sel L. plantarum 2B2 terhadap Bakteri Indikator.
Hasil pengujian aktivitas antimikroba supernatan bebas sel menunjukkan bahwa terdapat aktivitas penghambatan oleh senyawa antimikroba terhadap bakteri indikator sehingga dapat dipastikan bahwa di dalam keempat isolat BAL yang digunakan masing-masing mengandung senyawa antimikroba yang diduga bakteriosin dan dapat digunakan sebagai penghambat pertumbuhan mikroorganisme
patogen yang secara alami terdapat di dalam bahan pangan. Zona hambat yang terbentuk menunjukkan bahwa keempat isolat BAL yang digunakan (L. plantarum 2C12, 1A5, 1B1 dan 2B2) memiliki senyawa antimikroba. Zona bening yang dihasilkan dapat dilihat pada Gambar 12.
(a) (b)
(c) (d)
(e) (f)
(g)
Gambar 12. Zona Hambat Aktivitas Antimikroba Supernatan Bebas Sel Isolat L. plantarumselama 24 Jam Inkubasi.
L. plantarum 2B2 terhadap B. cereus
L. plantarum 1A5 terhadap E. coli ATCC 25922
L. plantarum 1A5 terhadap S.Thypimurium ATCC 14028
L. plantarum 2C12 terhadap B. cereus
L. plantarum 2C12 terhadap S. aureus ATCC 25923
L. plantarum 1B1 terhadap E. coli ATCC 25922
Antimikroba adalah suatu antibodi yang dapat bereaksi dengan toksin dan menetralkan toksin (Fardiaz, 1992). Makanan mungkin mengandung komponen yang dapat menghambat pertumbuhan jasad renik. Komponen antimikroba tersebut terdapat di dalam makanan melalui salah satu dari beberapa cara yaitu (1) terdapat secara alamiah di dalam bahan pangan, (2) ditambahkan dengan sengaja ke dalam makanan dan (3) terbentuk selama pengolahan atau oleh jasad renik yang tumbuh selama fermentasi makanan.
Fardiaz (1992) juga menyatakan bahwa zat antimikroba bersifat bakterisidial (membunuh bakteri), bakteristatik (menghambat pertumbuhan bakteri), fungisidal (membunuh kapang), fungistatik (menghambat pertumbuhan kapang), dan germisidal (mengahmabat germinasi spora bakteri). Kemampuan suatu zat antimikroba dalam menghambat pertumbuhan bakteri dipengaruhi oleh beberapa faktor yakni (1) konsentrasi bahan pengawet, (2) waktu penyimpanan, (3) suhu lingkungan, (4) sifat-sifat mikroba (jenis, umur, dan konsentrasi).
Gambar 12 menunjukkan zona hambat yang dihasilkan oleh aktivitas antimikroba supernatan bebas sel isolat L. platarum terhadap bakteri indikator (bakteri patogen). Zona hambat dihasilkan dari aktivitas yang terjadi akibat konfrontasi atau peperangan antara senyawa antimikroba dengan bakteri patogen. Senyawa antimikroba yang dihasilkan oleh bakteri asam laktat (BAL) terdiri dari beberapa komponen, antara lain asam organik, hidrogen peroksida dan juga bakteriosin. Dilihat dari spesies atau strain dan kandungan nutrisi, sifat fisik, dan suasana kimia dari tempat tumbuh, BAL dapat menghasilkan asam laktat, asam asetat, etanol, diasetil, CO2(sebagai asam karbonik), H2O2, turunan dari asam laktat (asam laktat karboksi), dan peptida-peptida kecil (Ray, 2000). Antimikroba ini dapat mencegah atau membunuh mikroorganisme yang menjadi target seperti jamur, kapang, bakteri vegetatif, spora, dan bahkan virus. Aktivitas antimikroba bervariasi tergantung dari metabolisme masing-masing.
asam tertitrasi merupakan persentase besarnya total asam yang terbentuk di dalam suatu supernatan atau komponen yang dapat dititrasi atau dinetralisir oleh basa kuat, misalnya NaOH 0,1 N dengan bantuan indikator fenolptalein (pp) 1%. Hasil pengukuran nilai pH dan %TAT dari keempat isolat L. plantarum dapat dilihat pada Gambar 13.
(a) (b)
(c) (d)
Keterangan: a. L. plantarum2C12 b. L. plantarum1A5 c. L. plantarum 1B1 d. L. plantarum2B2
Gambar 13. Nilai pH dan % TAT Supernatan Bebas Sel Isolat L. plantarum. Hasil pengukuran pH dan %TAT menunjukkan bahwa nilai pH berbanding terbalik dengan %TAT. Hal tersebut ditunjukkan dengan grafik pada Gambar 13 bahwa pada saat nilai pH menurun selama 24 jam waktu pengukuran, nilai %TAT meningkat dari jam ke-0 waktu pengukuran baik pada supernatan bebas sel yang berasal dari isolat L. plantarum 2C12, 1A5, 1B1 maupun 2B2. Nilai %TAT yang tinggi menandakan bahwa asam laktat yang dihasilkan oleh BAL juga tinggi, hal itu akan berpengaruh terhadap aktivitas antimikroba dari supernatan bebas sel tersebut karena sebelum dilakukan penetralan pada supernatan bebas sel aktivitas antimikroba
yang dihasilkan tentu juga akan tinggi akibat adanya pengaruh dari asam organik yang masih terkandung di salam supernatan bebas sel tersebut dan dapat menghambat pertumbuhan serta aktivitas bakteri patogen.
Menurut Syahniar (2009), supernatan bebas sel cenderung mempunyai aktivitas penghambatan yang lebih besar terhadap S. aureus ATCC 25923, S. typhimurium ATCC 14028 dan enteropathogenic E. coli K11 (EPEC K11) bila dibandingkan dengan aktivitas penghambatan dari supernatan antimikroba yang telah dikondisikan pada pH 6 atau supernatan netral. Semakin rendah pH supernatan bebas sel yang dihasilkan menunjukkan semakin besar aktivitas penghambatan supernatan antimikrobanya dan begitu pula sebaliknya. Besarnya aktivitas penghambatan diperoleh dari semakin banyaknya konsentrasi asam organik yang terbentuk dengan ditunjukkan oleh semakin rendahnya pH supernatan bebas sel dan juga semakin tingginya nilai total asam tertitrasinya.
Produksi Bakteriosin Kasar dan Aktivitas Antimikrobanya terhadap Bakteri Indikator
Banyak bakteri dengan cabang taksonomi dan habitat yang bermacam-macam yang dapat menghasilkan substrat atau senyawa antimikroba dan dapat menghambat bakteri yang lain. Baik bakteri Gram negatif maupun bakteri Gram positif, keduanya dapat memproduksi bakteriosin (Savadogo et al., 2006). Salah satu bakteri Gram positif yang dapat menghasilkan bakteriosin adalah bakteri asam laktat (BAL). BAL umumnya digunakan dalam fermentasi pangan karena dapat mengurai gula menjadi asam organik, dan juga dapat menghambat kerusakan pangan yang disebabkan oleh aktivitas mikroorganisme pembusuk. Diantara bermacam-macam bahan pengawet yang dihasilkan oleh BAL, bakteriosin merupakan salah satu antimikroba alami yang dapat digunakan sebagai pengawet bahan pangan.
Produksi Supernatan Netral Isolat L. plantarum yang Berbeda
larutan NaOH 1 N hingga pHnya asam organik yang masih netral, sehingga dapat dipastika berasal dari senyawa antimikroba berupa hidrogen peroksida
supernatan bebas sel dan supernatan pada Gambar 14.
Gambar 14. Nilai pH Kondisi Kondisi pH supernat histogram pada Gambar 14
berkisar antara 3,9-4,01. Kondisi asam p oleh adanya asam-asam organik metabolisme bakteri asam
antimikroba serta dapat dibuktikan bakteri indikator.
hingga pHnya menjadi 5,8-6,2. Hal tersebut bertujuan agar masih terkandung di dalam supernatan tersebut dalam dapat dipastikan bahwa aktivitas penghambatan yang dihasilka
antimikroba yang dimiliki oleh supernatan netral yakni peroksida (H2O2) ataupun bakterisoin. Hasil pengukuran
supernatan netral disajikan dalam bentuk diagram
pH Supernatan Antimikroba pada IsolatL. plantarum Kondisi yang Berbeda.
supernatan bebas sel adalah asam yakni sekitar 3-4. Berdasarkan Gambar 14 dapat diketahui bahwa kondisi pH supernatan
Kondisi asam pada supernatan bebas sel tersebut disebabka asam organik yang merupakan salah satu hasil dari
asam laktat. Asam organik merupakan substansi alami makanan. Aksi antimikroba dari asam organik berdasarkan
untuk menurunkan pH dalam pangan yang berfase air (Samelis
Bhunia (2008) menambahkan bahwa kondisi pH yang rendah antara 3-4,5 dapat bersifat bakterisidal atau mampu membunuh
dapat dimanfaatkan untuk memperpanjang masa simpan daging dari bakteri patogen dan pembusuk sebagai dapat dibuktikan dengan melakukan uji antagonistik
Kondisi pH pada supernatan netral berdasarkan pada hasil penelitian yakni berkisar antara 5,8-6,2. Hal tersebut dilakukan agar asam-asam organik yang terkandung di dalam supernatan bebas sel menjadi netral sehingga tidak mengganggu aktivitas penghambatan yang dilakukan oleh supernatan netral yang nantinya akan digunakan untuk tahapan selanjutnya yakni purifikasi parsial yang menggunakan garam untuk mengikat protein yang terkandung di dalam supernatan. Hal tersebut sesuai dengan hasil penelitian Syahniar (2009) bahwa semakin rendah pH supernatan bebas sel menandakan semakin banyak pula asam organik yang terkandung di dalamnya sehingga supernatan yang dihasilkan juga mempunyai tingkat keasaman yang lebih tinggi dan dapat mengganggu pembentukan bakteriosin.
Hata et al. (2010) menambahkan bahwa pH yang optimal untuk aktivitas penghambatan oleh bakteriosin adalah berkisar antara 5,8-6,2 dimana bakteriosin mampu melakukan penghambatan terhadap bakteri patogen sebesar 90-100%. Selain itu kondisi netral pada supernatan diharapkan dapat membantu proses pengikatan protein oleh garam amonium sulfat yang akan dilakukan pada tahap selanjutnya. Supernatan netral kemudian diuji aktivitas antimikrobanya melalui uji antagonistik dan akan menghasilkan zona hambat. Diameter zona hambat hasil uji antagonistik supernatan netral terhadap bakteri indikator dapat dilihat pada Tabel 3.
Tabel 3. Diameter Zona Hambat Supernatan Netral Asal Isolat L. plantarum yang Berbeda terhadap Lima Bakteri Indikator
Bakteri Indikator Isolat L. plantarum Rata-rata
2C12 1A5 1B1 2B2 Keterangan: Diameter zona hambat sudah termasuk diameter sumur yakni ± 5 mm
Pengujian secara statistik terhadap data diameter zona hambat supernatan netral yang berasal dari keempat isolat L. plantarum menunjukkan bahwa data tersebut tidak memenuhi uji asumsi, sehingga data dianalisis secara non parametrik menggunakan uji Kruskal-Wallis pada perlakuan isolat L. plantarum dan bakteri indikator yang berbeda. Hasil uji Kruskal-Wallis menunjukkan bahwa P ≤ 0,05 atau terima H1, hal itu berarti perlakuan supernatan netral yang berasal dari isolat L. plantarumyang berbeda (2C12, 1A5, 1B1 dan 2B2) dan perlakuan bakteri indikator yang berbeda (S. Thypimurium ATCC 14028, E. coli ATCC 25922, P. aeruginosa ATCC 27853, B. cereus, S. aureus ATCC 25923) berpengaruh nyata terhadap diameter zona hambat, namun tidak ada interaksi antara kedua perlakuan tersebut, maka selanjutnya dilakukan uji banding dengan uji All Pairwise Comparisons. Berdasarkan Tabel 3 dapat diketahui bahwa perbedaan aktivitas penghambatan oleh supernatan netral adalah pada supernatan netral yang berasal dari isolat L. plantarum 2C12, hal tersebut ditunjukkan dengan nilai diameter zona hambat terkecil, sedangkan ketiga isolat L. plantarum lainnya yakni 1A5, 1B1 dan 2B2 memiliki aktivitas penghambatan yang sama. Supernatan yang telah dinetralkan mengakibatkan hilangnya pengaruh asam organik yang terkandung di dalam supernatan bebas sel, sehingga aktivitas antimikroba yang dihasilkan oleh supernatan netral tidak sebesar yang dihasilkan oleh supernatan bebas sel. Aktivitas antimikroba tetap dapat terjadi dan kemungkinan dihasilkan oleh adanya senyawa antimikroba lain seperti hidrogen peroksida (H2O2) ataupun bakteriosin.
Perbedaan penghambatan supernatan netral juga terjadi pada perlakuan bakteri indikator, yakni penghambatan terhadap E. coli ATCC 25922 tidak berbeda dengan S.Thypimurium ATCC 14028 dan juga P. aeruginosa ATCC 27853, namun berbeda dengan penghambatan terhadap S. aureus ATCC 25923 dan B. cereus. Hal tersebut disebabkan oleh adanya senyawa antimikroba yang dapat dengan cepat menghambat bakteri yang memiliki kekerabatan dekat dengannya, yakni bakteri Gram positif. Jack et al. (1995) menyatakan bahwa senyawa antimikroba khususnya bakteriosin merupakan substansi protein yang diproduksi oleh banyak strain bakteri dan dapat menghasilkan aktivitas penghambatan secara bakterisidal terhadap organisme yang berkerabat dekat.
Aktivitas penghambatan supernatan netral terhadap S. Thypimurium ATCC 14028 dan P. aeruginosa ATCC 27853 juga tidak berbeda dengan aktivitas penghambatan terhadap S. aureus ATCC 25923 dan B. cereus. Hal itu disebabkan oleh aktivitas senyawa antimikroba tidak hanya dapat menghambat pertumbuhan bakteri Gram positif saja, namun Gram negatif juga. Savadogo et al. (2004) menyatakan bahwa substrat protein antimikroba dapat mencegah strain-strain yang sensitif yakni bakteri Gram negatif dan Gram positif. Selain itu, penghambatan yang dilakukan terhadap bakteri Gram negatif dapat disebabkan karena bakteri tersebut sedang mengalami gangguan secara fisik maupun kimia yang menjadikannya sensitif terhadap senyawa antimikroba khususnya bakteriosin (Ray dan Bhunia, 2008).
Purifikasi Parsial Menggunakan Presipitasi Amonium Sulfat
Tahapan purifikasi parsial dilakukan menggunakan presipitasi amonium sulfat yang bertujuan untuk memaksimumkan aktivitas antimikroba dari bakteriosin yang terbentuk dan juga diharapkan dapat mengurangi bahkan menghilangkan aktivitas antimikroba dari asam organik (Syahniar, 2009). Presipitat bakteriosin kasar selanjutnya diukur konsentrasi proteinnya dan diuji aktivitas antimikrobanya terhadap bakteri indikator dengan metode yang sama yakni metode difusi sumur agar. Hasil pengukuran konsentrasi protein presipitat bakteriosin kasar dapat dilihat pada Tabel 4.
Tabel 4. Nilai Konsentrasi Protein Presipitat Bakteriosin Kasar Hasil Purifikasi Parsial Menggunakan Presipitasi Amonium Sulfat Asal Isolat L. plantarum yang Berbeda
Isolat L. plantarum Konsentrasi Protein
(mg/ml)
L. plantarum2C12 3,41
L. plantarum1A5 24,08
L. plantarum1B1 24,61
L. plantarum2B2 15,56
Berdasarkan data pada Tabel 4, dapat dilihat bahwa konsentrasi protein tertinggi adalah pada isolat L. plantarum 1B1 sebesar 24,61 mg/ml dan konsentrasi protein terendah adalah pada isolat L. plantarum 2C12 yakni 3,41 mg/ml. Tinggi rendahnya konsentrasi protein yang terkandung di dalam suatu BAL dimungkinkan karena adanya pengaruh dari penambahan unsur N (nitrogen) yang berasal dari media yang digunakan dalam proses produksi yakni MRS broth. Presipitat bakteriosin kasar selanjutnya diuji aktivitas antimikrobanya kemudian diukur diameter zona hambat yang terbentuk dari aktivitas antimikroba tersebut. Hasil pengukuran diameter zona hambat presipitat bakteriosin kasar dapat dilihat pada Tabel 5.
bahwa P ≤ 0,05 atau terima H1, hal itu berarti presipitat bakteriosin yang berasal dari isolat L. plantarum yang berbeda (2C12, 1A5, 1B1 dan 2B2) berpengaruh nyata terhadap diameter zona hambat, maka selanjutnya dilakukan uji banding dengan uji All Pairwise Comparisons.
Tabel 5. Diameter Zona Hambat Presipitat Bakteriosin Kasar Hasil Purifikasi Parsial Menggunakan Presipitasi Amonium Sulfat Asal Isolat L. plantarum yang Berbeda terhadap Lima Bakteri Indikator
Bakteri Indikator Isolat L. plantarum Rata-rata
2C12 1A5 1B1 2B2
Keterangan : Diameter zona hambat sudah termasuk diameter sumur yakni ± 5 mm
Huruf superskrip yang berbeda pada baris yang sama menunjukkan hasil yang nyata (P ≤ 0,05)
Dialisis
Tahap dialisis dilakukan menggunakan presipitat bakteriosin yang telah mengalami proses desalting atau penghilangan garam yakni garam amonium sulfat. Hal ini bertujuan untuk mendapatkan protein antimikroba yang tidak lagi bercampur atau terikat pada garam amonium sulfat. Hasil dari tahapan dialisis ini didapat ekstrak kasar bakteriosin yang selanjutnya disebut bakteriosin kasar atau dapat juga disebut dengan plantaricin kasar karena bakteriosin yang dihasilkan berasal dari isolat L. plantarum dan masih belum mengalami tahapan pemurnian yakni melalui tahap kromatografi kolom. Arief et al. (2004) menyatakan bahwa senyawa antimikroba yang diproduksi oleh L. plantarum 2C12 mengandung bakteriosin. Bakteriosin kasar hasil dialisis diukur konsentrasi proteinnya. Hasil pengukuran konsentrasi protein disajikan dalam Tabel 6.
Tabel 6. Nilai Konsentrasi Protein Bakteriosin Kasar Hasil Dialisis Asal Isolat L. plantarum yang Berbeda
Isolat L. plantarum Konsentrasi Protein
(mg/ml)
L. plantarum2C12 0,97
L. plantarum1A5 53,53
L. plantarum1B1 65,81
L. plantarum2B2 61,70
Berdasarkan Tabel 6 dapat diketahui bahwa konsentrasi protein bakteriosin kasar yang tertinggi adalah yang terkandung di dalam isolat L. plantarum1B1 yakni sebesar 65,81 mg/ml. Bakteriosin kasar selanjutnya diuji aktivitas antimikrobanya terhadap bakteri indikator dengan metode yang sama yakni metode difusi sumur agar. Hasil pengukuran aktivitas antimikroba melalui zona hambat yang dihasilkan dapat dilihat pada Tabel 7.