AKTIVITAS ANTIINFLAMASI SENYAWA ASAM SINAMAT DARI
KEMENYAN PADA TIKUS GALUR
Wistar
DIAN RAHMAWATI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
DIAN RAHMAWATI. Aktivitas Antiinflamasi Senyawa Asam Sinamat dari
Kemenyan pada Tikus Galur Wistar. Dibimbing oleh ANNA PRIANGANI
ROSWIEM dan POPI ASRI KURNIATIN.
Penelitian aktivitas antiinflamasi senyawa asam sinamat merupakan salah
satu upaya untuk menguji aktivitas senyawa asam sinamat hasil ekstraksi
kemenyan sebagai antiinflamasi. Uji
In Vivo aktivitas antiinflamasi senyawa
asam sinamat dari kemenyan menggunakan 25 ekor tikus putih jantan galur
Wistar yang dibagi menjadi lima kelompok: kelompok kontrol (CMC 0.5%),
asetosal (8 mg/Kg BB), fraksi asam sinamat dari kemenyan dengan tiga dosis (50
mg/Kg BB, 100 mg/Kg BB, dan 150 mg/Kg BB). Volume edema kaki tikus yang
diinduksi karagenan 1% diamati menggunakan alat pletismometer selama 6 jam.
Hasil penelitian menunjukkan bahwa asam sinamat hasil isolasi dari kemenyan
memiliki rendemen sebesar 12.88 %. Keberadaan asam sinamat hasil isolasi
diukur dengan HPLC dan menunjukkan waktu retensi yang sama dengan standar
asam sinamat pada kromatogram. Rata-rata kadar asam sinamat kemenyan yang
diperoleh adalah 87.14%. Uji potensi hayati asam sinamat dari kemenyan
menunjukkan nilai LC
50sebesar 429 ppm. Nilai persen daya antiinflamasi dari
kelompok kontrol positif, fraksi asam sinamat dari kemenyan dosis 50, 100, dan
150 mg/Kg BB berturut-turut adalah 56.25 %, 28.13 %, 67.50%, dan 43.44%.
Hasil ini menunjukkan bahwa fraksi asam sinamat dari kemenyan dosis 100
mg/Kg BB mempunyai daya antiinflamasi paling tinggi dibandingkan dengan
dosis yang lain.
ABSTRACT
DIAN RAHMAWATI. Anti-inflammatory Activity of Cinnamic Acid from
Kemenyan on Wistar Strain Rats. Under the direction of ANNA PRIANGANI
ROSWIEM and POPI ASRI KURNIATIN.
Anti-inflammatory activities of cinammic acid from kemenyan were assayed
in Wistar albino rats. The aim of this research was to test anti-inflammatory
activity of cinnamic acid from kemenyan. In Vivo test anti-inflammatory activity
of cinnamic acid from kemenyan used 25 male white Wistar strain rats were
divided into five groups: the control group (CMC 0.5%), the acetosal (8 mg/Kg
BW), the cinnamic acid from kemenyan with three doses (50 mg/Kg BW, 100
mg/Kg BW, dan 150 mg/Kg BW). The volume of the rats carrageenan-induced
foot paw was measured using plethysmometer for six hours. The results showed
Cinnamic acid as isolate from kemenyan which has rendement value 12.88 %.
Qualitative analyze of cinnamic acid from kemenyan with HPLC showed the
same retention time with standardized cinnamic acid in chromatogram.
Consentration of cinnamic acid from kemenyan was 87.14%. Biological assay of
cinnamic acid showed LC
50value of 429 ppm. Percentage of anti-inflammatory
value from acetosal group was 56.25 %, whereas treatment by cinnamic acid from
kemenyan with doses 50, 100, dan 150 mg/Kg BW were 28.13 %, 67.50%, and
43.44%. This result showed that 100 mg/Kg BW dose was the highest
anti-inflammatory activity compare to the other doses.
AKTIVITAS ANTIINFLAMASI SENYAWA ASAM SINAMAT DARI
KEMENYAN PADA TIKUS GALUR
Wistar
DIAN RAHMAWATI
G84080082
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
Skripsi
: Aktivitas Antiinflamasi Senyawa Asam Sinamat dari
Kemenyan pada Tikus Galur Wistar
Nama
: Dian
Rahmawati
NIM
:
G84080082
Disetujui
Komisi Pembimbing
Diketahui
Tanggal Lulus:
Dr. Anna P. Roswiem, MS.
Ketua
Popi Asri Kurniatin, S.Si.Apt., M.Si.
Anggota
PRAKATA
Alhamdulillah, segala puji dan syukur penulis panjatkan kepada Allah SWT
atas segala karunia-Nya. Shalawat dan salam semoga selalu tercurah kepada Nabi
Muhammad SAW dan para pengikutnya sampai akhir zaman sehingga penulis
dapat menyelesaikan penelitian ini. Penelitian ini berjudul Aktivitas Antiinflamasi
Senyawa Asam Sinamat dari Kemenyan pada Tikus Galur Wistar.
Kegiatan
penelitian ini dilakukan dari bulan Februari hingga Mei 2012, bertempat di
Laboratorium Penelitian Biokimia, Kandang Percobaan Biokimia, dan
Laboratorium Farmakologi Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Penelitian ini merupakan Program Kreativitas Mahasiswa Penelitian (PKMP)
2012 yang didanai oleh Direktorat Jenderal Pendidikan Tinggi (DIKTI).
Terima kasih penulis ucapkan kepada semua pihak yang telah membantu
dalam penyelesaian penelitian ini, terutama kepada Dr. Anna P. Roswiem, MS.
selaku ketua pembimbing dan Popi Asri Kurniatin, S.Si.Apt., M.Si. selaku
anggota pembimbing dalam memberikan saran, kritik, dan bimbingannya. Tak
lupa pula ucapan terimakasih kepada Pak Nana, Bu Merry, Bu Martini, Bu Tuti,
Pak Yadi, Pak Arya, Mba Eli selaku laboran di laboratorium Biokimia IPB atas
peran, bantuan, dan kerjasamanya dalam menyelesaikan penelitian ini. Selain itu,
ucapan terimakasih juga penulis sampaikan kepada drh. Min Rahminiwati, M.Si,
Ph.D dan Pak Edi atas bantuan dan bimbingannya pada saat penggunaan
pletismometer. Ucapan Terima kasih penulis sampaikan kepada seluruh dosen dan
staf Departemen Biokimia IPB, terutama drh. Sulistiyani, M.Sc, Ph.D, Prof. Dr.
drh. Maria Bintang, MS., dan Dr. Djarot Sasongko Hamiseno, MS. selaku tim
kelayakan skripsi yang telah memberikan waktu dan saran terbaiknya.
Terima kasih kepada Ayah, Ibu penulis atas segala kasih sayang, perhatian,
doa, dan dukungan yang diberikan kepada penulis. Begitu juga terima kasih
penulis ucapkan kepada Danang Adi Prihantoko atas perhatian, bantuan,
semangat, dan saran yang telah diberikan. Penulis juga menyampaikan terima
kasih Daviq Fahrizal, Didit Haryadi, Clara Shinta sebagai teman satu tim PKM
atas kerjasama dan bantuannya selama penelitian. Tak lupa penulis juga
mengucapkan terima kasih kepada Rini, Esti, Shelly, Nina, Aros, Azmi, Rian,
Yoan, Layta, Ridho, Isul, Kenyar, Silvy, Ewi, Ines, Rena, Affan, Ihsan, Vita,
Bang Daniel, Adit, AU, Nuraeni, Mbak yu Riani, Jihan, keluarga wisma Kamila
yang telah memberikan bantuan, kritik, dan saran bagi penulis.
Bogor, November 2012
RIWAYAT HIDUP
Penulis dilahirkan di Banyumas, Jawa Tengah pada tanggal 15 Maret 1989
dari ayah Iksan dan ibu Sulastri. Penulis merupakan anak pertama dari dua
bersaudara.
Pendidikan penulis dimulai dari SDN Ciberung 2 Kabupaten Banyumas,
Jawa Tengah dan melanjutkan pendidikan ke SMPN 1 Ajibarang Kabupaten
Banyumas, Jawa Tengah. Penulis lulus tahun 2007 dari SMAN 1 Purwokerto
Kabupaten Banyumas, Jawa Tengah dan pada tahun 2008 lulus seleksi masuk
IPB melalui jalur Seleksi Masuk Perguruan Tinggi Negeri (SMPTN). Penulis
memilih mayor Departemen Biokimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam dan minor Teknologi Pangan, Fakultas Teknologi Pertanian.
Selama mengikuti perkuliahan, penulis pernah menjadi tentor mata kuliah
Biologi TPB dan Biokimia Pangan di bimbingan belajar Katalis Corp. Selain itu,
penulis juga pernah menjadi asisten praktikum Biokimia Umum tahun 2012 untuk
mahasiswa S1 Kedokteran Hewan, Teknologi Hasil Perairan dan Budidaya
Perairan, Biokimia Klinis tahun 2012 untuk mahasiswa S1 Biokimia, Pengantar
Penelitian Biokimia tahun 2012 untuk mahasiswa S1 Biokimia, Struktur dan
Fungsi Subselular tahun 2012 untuk mahasiswa S1 Biokimia, Struktur dan Fungsi
Biomolekul untuk mahasiswa S1 Biokimia, Keteknikan Asam Nukleat dan
Protein untuk mahasiswa S1 Biokimia. Penulis pernah melakukan Praktik
Lapangan (PL) di Laboratorium Mikrobiologi, Balai Pengkajian Bioteknologi
Badan Pengkajian dan Penerapan Teknologi (BPPT), kompleks PUSPIPTEK,
Serpong, Tangerang dengan judul Konversi Penisilin G menjadi 6-APA
Menggunakan Penisilin Asilase Teramobilisasi
Beberapa organisasi yang diikuti penulis selama perkuliahan yakni
Himpunan Profesi Mahasiswa Biokimia (CREBs) tahun 2009-2011, Unit
Kegiatan Mahasiswa (UKM) voli IPB tahun 2008-2011 dan Organisasi
Mahasiswa Daerah (OMDA) Banyumas tahun 2008-2009. Kegiatan lain penulis
yakni mengikuti kejurnas Voli tingkat universitas se-Indonesia, mengikuti
kejuaraan voli di Olimpiade Mahasiswa IPB. Penulis juga pernah mengikuti
berbagai kepanitiaan seperti Seminar Kesehatan dan Keselamatan Kerja tahun
2009, Lomba Karya Ilmiah Populer tahun 2009 dan 2010, Masa Pengenalan
Departemen tahun 2010, Spirit FMIPA tahun 2010, Olimpiade Mahasiswa IPB
tahun 2010 dan Field Trip Biokimia 45 Never ending Journey tahun 2011
(Bogor-Sukabumi-Bandung-Semarang-Yogyakarta-Bogor).
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Kemenyan ...
1
Asam Sinamat ...
2
Inflamasi ...
2
Obat Antiinflamasi ...
3
Asetosal ...
5
Uji Hayati terhadap Larva Udang (Artemia salina Leach) ...
5
Karagenan sebagai Induksi Inflamasi ...
6
BAHAN DAN METODE
Bahan dan Alat ...
6
Metode ...
6
HASIL DAN PEMBAHASAN
Kadar Asam Sinamat Hasil Isolasi dari Kemenyan ...
8
Analisis kualitatif Asam Sinamat dengan HPLC ...
9
Kadar Asam Sinamat...
9
Uji Hayati dengan BSLT .... ... 10
Uji Daya Antiinflamasi .... ... 10
SIMPULAN DAN SARAN
Simpulan ... 13
Saran ... 13
DAFTAR PUSTAKA ... 13
DAFTAR TABEL
Halaman
1 Rendemen asam sinamat dari ekstrak kemenyan ... 9
2 Hasil pengukuran kadar asam sinamat dengan metode titrimetri ... 10
3 Nilai LC
50fraksi asam sinamat dari masing-masing ulangan ... 10
4 Data AUC kurva rata-rata volume udem terhadap waktu dan % daya
antiinflamasi fraksi asam sinamat dari ekstrak kemenyan ... 12
DAFTAR GAMBAR
Halaman
1 Resin dan batang pohon Kemenyan (Styrax benzoin) ...
2
2 Struktur kimia asam sinamat ... 2
3 Mekanisme terjadinya inflamasi ... 4
4 Struktur kimia asetosal ... 5
5 Kromatogram pemisahan komponen asam sinamat ... 9
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 17
2 Penyiapan bahan uji, kontrol, obat pembanding, dan karagenan ... 18
3 Hasil uji hayati dengan BSLT ... 19
4 Data hasil pengukuran uji antiinflamasi pada tikus Wistar ... 20
5 Hasil analisis ragam faktorial RAL volume udem dan nilai AUC ... 23
6 Hasil analisis ragam faktorial RAL nilai AUC ... 24
7 Hasil analisis ragam RAL data persen daya antiinflamasi ... 26
8 Hasil analisis ragam RAL data waktu perlakuan ... 27
PENDAHULUAN
Alam Indonesia merupakan gudang tanaman obat di dunia. Ribuan jenis tanaman obat tumbuh subur di Indonesia. Sejak zaman dahulu masyarakat Indonesia mengenal dan memanfaatkan tanaman berkhasiat obat sebagai upaya dalam penanggulangan masalah kesehatan. Pengetahuan tentang pemanfaatan tanaman ini merupakan warisan budaya bangsa berdasarkan pengalaman, pengetahuan, dan keterampilan, yang secara turun-temurun telah diwariskan kepada generasi berikutnya (Wijayakusuma 2000).
Radang merupakan mekanisme pertahanan tubuh yang disebabkan adanya respon jaringan terhadap pengaruh-pengaruh merusak baik bersifat lokal maupun yang masuk ke dalam tubuh. Inflamasi merupakan manifestasi dari terjadinya kerusakan jaringan, dimana nyeri merupakan salah satu gejalanya. Pengobatan yang digunakan sebagai anti inflamasi saat ini umumnya masih mengunakan bahan sintetik seperti indometasin, aspirin dan jarang sekali digunakan tanaman herba sebagai terapi untuk mengobati kerusakan jaringan karena terjadinya proses peradangan.
Salah satu tanaman obat yang sudah digunakan sejak zaman dahulu adalah kemenyan (Styrax benzoin). Di daerah Bangka Belitung, kemenyan yang dibakar dapat digunakan untuk menghilangkan bekas cacar, mengobati luka dan mengobati aber (semacam penyakit kulit). Selain itu air yang diberi kemenyan kemudian diminum dapat mengobati malaria. Bagi masyarakat di sebagian besar daerah di Indonesia, pengobatan secara tradisional menggunakan kemenyan masih dihubungkan dengan hal-hal mistis yang tidak dapat dijelaskan secara rasional dan ilmiah. Di sisi lain, beberapa negara maju seperti Perancis, Taiwan, Jepang, dan Singapura mengimpor kemenyan dari Indonesia dan digunakan secara luas dalam industri farmasi, bahan pengawet, parfum, kosmetik, aromaterapi, dan dupa (Edison et al 1983). Seiring berkembangnya ilmu pengetahuan dan teknologi, kandungan senyawa-senyawa bioaktif yang terdapat di dalam kemenyan dapat diteliti sehingga mampu memberikan informasi tentang khasiat kemenyan.
Kemenyan mengandung asam sinamat, asam benzoat, stirol, vanilin, styracin, koniferil benzoat, serta resin yang terdiri dari benziresinol dan suma resinotannol. Asam sinamat yang berasal dari kemenyan
umumnya digunakan sebagai bahan baku industri. Senyawa ini memiliki berbagai aktivitas biologis seperti antibakteri, anestetik, penghambat enzim tirosinase, antispasmodik, antimutagenik, fungisida, herbisida, dan antiinflamasi (Hartanti dan Setiawan 2009). Telah diketahui juga pada penelitian Yesilada (1996) bahwa asam sinamat memiliki aktivitas antiinflamasi dan analgesik.
Asam sinamat merupakan senyawa yang kadarnya paling banyak terkandung di dalam kemenyan (Sagala et al 1980). Penelitian untuk menguji aktivitas antiinflamasi senyawa asam sinamat dari ekstrak kemenyan merupakan salah satu upaya untuk membuktikan secara ilmiah kepada masyarakat Indonesia bahwa khasiat kemenyan dalam pengobatan tradisional tidak berkaitan dengan hal-hal mistis. Hal ini juga dilakukan dalam rangka mempertahankan pengobatan tradisional dengan kajian ilmu pengetahuan dan teknologi.
Tujuan penelitian ini adalah menguji aktivitas senyawa asam sinamat dari kemenyan sebagai antiinflamasi. Hipotesis penelitian ini adalah asam sinamat dari kemenyan Sumatera Utara memiliki aktivitas antiinflamasi. Informasi penting tentang khasiat kemenyan sebagai antiinflamasi berdasarkan kajian IPTEK bisa dikembangkan untuk dijadikan sebagai bahan pengobatan antiinflamasi.
TINJAUAN PUSTAKA
Kemenyan
Laos dan Indonesia merupakan dua negara penghasil kemenyan terbesar dunia. Produksi kemenyan di Indonesia tahun 2010 adalah 4.730,38 ton dengan luas area tanaman berkisar 33.916,85 Ha (Dinas Perkebunan Provinsi Sumatera Utara 2010). Kemenyan asal Laos disebut kemenyan siam (Lao benzoin) dihasilkan dari pohon Styrax tonkinensis, sedangkan kemenyan Indonesia berasal dari Sumatera Utara sehingga disebut kemenyan Sumatera (Sumatera benzoin) yang dihasilkan dari pohon Styrax benzoin dan S. paralleloneurum (Kashio dan Johnson 2001). Kemenyan Siam mengandung komponen utama asam benzoat sedangkan kemenyan Sumatera kandungan utamanya adalah asam sinamat (Anonim 2007).
20
6
melibatkan lebih dari 100 desa dan 18.000 keluarga (Lopez dan Shanley 2005). Di Makasar kemenyan dikenal dengan nama kemanyang. Pohon kemenyan (Gambar 1) memiliki tinggi kurang lebih 18 meter dengan batang tegak, bulat, berkayu, halus, percabangannya simpodial, dan berwarna coklat muda. Pohon kemenyan berdaun tunggal, lonjong, berseling, dan tersebar. Panjang daunnya sekitar 4-8 cm dan lebarnya 2-5 cm, berakar tunggang dan berwarna coklat muda.Pohon ini menghasilkan resin disebut kemenyan yang digunakan secara luas dalam industri farmasi, bahan pengawet, parfum, kosmetik, aromaterapi, dupa, campuran rokok kretek dan lain-lain (Sagala et al. 1980; Widyastuti 1989). Kemenyan dapat dimanfaatkan langsung dengan cara dilarutkan dalam alkohol dan dijadikan obat luka yang berperan sebagai pencegah infeksi dan sebagai stimulan.
Gambar 1 Resin dan batang pohon Kemenyan (Styrax benzoin) (Waluyo 2006).
Asam Sinamat
Asam sinamat (C6H5CH=HCOOOH) adalah salah satu asam organik yang mempunyai ikatan rangkap. Asam sinamat dapat berupa asam-asam bebas maupun terikat sebagai ester-ester yang dikandung dalam minyak atsiri, resin balsam dan di dalam daun pohon kemenyan (Sagala et al 1980).
Asam sinamat memiliki berbagai aktivitas biologis, seperti antibakteri, anestetik, antiinflamasi, antispasmodik, antimutagenik, fungisida, herbisida, serta penghambat enzim tirosinase (Hartanti dan Setiawan 2009). Asam sinamat yang berasal dari kemenyan umumnya digunakan sebagai bahan baku dalam industri farmasi, kosmetik, dan parfum (Sagala et al 1980).
Menurut Sagala et al. (1980), pembuatan asam sinamat dapat dilakukan beberapa cara. Pertama, menurut reaksi Perkin, asam sinamat dapat diperoleh dengan memanaskan benzaldehida dan natrium asetat anhidrat serta
asam asetat anhidrat dengan penambahan beberapa tetes piridin sebagai katalis. Kedua , dapat diperoleh dengan oksidasi dari benzilidina aseton (C6H5CH=CHCOCH3) dengan asam hipoklorida. Terakhir adalah dengan isolasi, baik dalam bentuk asam-asam bebas maupun terikat sebagai ester-ester untuk dijadikan ester seluruhnya dengan kalium hidroksida, kemudian diisolasi dengan eter atau kloroform.
Asam sinamat juga diketahui dengan bentuk “cis” dan “trans”. Bentuk cis mempunyai titik cair 57˚C, sedangkan bentuk trans mempunyai titik cair 133˚C. Asam sinamat berbentuk kristal putih dengan titik didih 300˚C, kemurnian 98.5%, kadar air maksimum 0.2%, kadar abu maksimum 0.25%, dan dapat larut dalam benzene, eter, aseton, karbon disulfida dan minyak-minyak (Sagala et al. 1980). Struktur umum asam sinamat terlihat pada Gambar 2.
Gambar 2 Struktur kimia asam sinamat (Rudyanto 2008).
Inflamasi
Inflamasi merupakan suatu respon protektif normal terhadap luka jaringan yang disebabkan oleh trauma fisik, zat kimia yang merusak, atau zat-zat mikrobiologik. Inflamasi adalah usaha tubuh untuk menginaktifasi atau merusak organisme yang menyerang, menghilangkan dan mengatur derajat perbaikan jaringan. Proses inflamasi merupakan suatu mekanisme perlindungan tubuh untuk menetralisir dan membasmi agen-agen yang berbahaya pada tempat cidera dan mempersiapkan keadaan untuk perbaikan jaringan, misalnya antigen, virus, bakteri, protozoa. Sampai sekarang fenomena mekanisme inflamasi pada tingkat bioseluler masih belum dapat dijelaskan secara rinci. Walaupun demikian banyak hal yang telah diketahui dan disepakati. Fenomena inflamasi ini meliputi kerusakan mikrovaskuler, meningkatnya permeabilitas kapiler, dan migrasi leukosit ke jaringan radang (Lumbanraja 2009).
Gejala proses terjadinya inflamasi yang sudah dikenal adalah rubor, tumor, kalor,
dolor, dan functio laesa. Rubor (kemerahan)
terjadi pada tahap pertama dari inflamasi. Darah berkumpul pada daerah cidera jaringan akibat pelepasan mediator kimia tubuh (kinin,
prostaglandin, histamin). Tumor atau edema
(pembengkakan) merupakan tahap kedua dari inflamasi. Plasma merembes ke dalam jaringan intestinal pada tempat cidera. Kinin mendilatasi asteriol, meningkatkan permeabilitas kapiler. Kalor (panas) dapat disebabkan oleh bertambahnya pengumpulan darah atau mungkin karena pirogen yaitu substansi yang menimbulkan demam, yang mengganggu pusat pengaturan panas pada hipotalamus. Dolor (nyeri), disebabkan pembengkakan pada pelepasan mediator-mediator kimia. Functio laesa (hilangnya fungsi), disebabkan oleh penumpukan cairan pada tempat cidera jaringan dan karena rasa nyeri (Price dan Wilson 1995).
Inflamasi dibagi dalam tiga fase, yaitu inflamasi akut, subkronik, dan kronik. Inflamasi akut merupakan respon awal terhadap cedera jaringan melalui mediator respon inflamasi akut yang terlibat antara lain histamin, serotonin, bradikinin, prostaglandin, dan leukotrin. Pada tahap sub kronik, respon imun terjadi bila sejumlah sel yang mampu menimbulkan kekebalan diaktifkan untuk merespon organisme asing atau substansi antigenik yang terlepas selama respon terhadap inflamasi akut serta kronis. Inflamasi kronis melibatkan keluarnya sejumlah mediator yang tidak menonjol dalam respon akut (Katzung 2001).
Obat Antiinflamasi
Pengobatan anti inflamasi mempunyai dua tujuan utama, yaitu yang pertama meringankan rasa nyeri yang sering kali merupakan gejala awal yang terlihat dan keluhan utama yang terus-menerus dari pasien; dan yang kedua adalah memperlambat atau membatasi perusakan jaringan (Katzung 2001).
Obat-obat anti inflamasi dibagi menjadi dua golongan utama yaitu golongan kortikosteroid dan non-kortikosteroid. Argumen yang dewasa ini diterima mengenai mekanisme kerja obat-obat anti radang berkaitan dengan penghambatan metabolisme asam arakidonat (Higgs dan Whittle 1980).
Asam arakidonat adalah substrat untuk enzim-enzim siklooksigenase dan lipooksigenase. Siklooksigenase mensintesis endoperoksida siklik (prostaglandin G-2 dan H-2) yang kemudian akan diubah menjadi prostaglandin stabil, tromboksan atau protasiklin. Ketiga produk ini berasal dari
leukosit dan senyawa-senyawa itu dijumpai pada keadaan radang. Di dalam leukosit, asam arakidonat oleh lipooksigenase akan diubah menjadi asam-asam mono dan dihidroksi yang merupakan prekusor dari leukotrin (senyawa yang dijumpai saat anafilaksis). Dengan adanya rangsang mekanis atau kimia, produksi enzim lipooksigenase akan dipacu sehingga meningkatkan produksi leukotrin dari asam arakidonat (Katzung 2001). Mekanisme terjadinya inflamasi terlihat pada Gambar 3.
Obat antiinflamasi nonsteroid merupakan salah satu golongan obat yang paling sering diresepkan (Chandrasekharan et al. 2002). Aktivitas antiinflamasi nonsteroid dilaporkan melalui penghambatan sintesis prostaglandin, suatu mediator inflamasi (Vane and Botting 1996). Proses tersebut dapat melalui penghambatan enzim siklooksigenase (COX) (Vane and Botting 1996), penangkapan radikal oksigen (Halliwell et al. 1987) maupun penghambatan glutation-S-transferase (GST) (Ujihara et al.1988).
Enzim siklooksigenase (COX) yang merupakan target aksi obat antiinflamasi nonsteroid (OAINS) terdapat dalam dua isoform, yaitu COX-1 dan COX-2. Kedua enzim tersebut mengkatalisis reaksi dan menghasilkan produk yang sama, yaitu prostaglandin, tetapi dengan fungsi biologis yang berbeda. COX-1 diekspresikan pada hampir semua jaringan dan bertanggungjawab menghasilkan prostasiklin (PGI2) dan tromboksan. Tromboksan berperan dalam vasokontriktif dan menstimulasi agregasi keeping darah, sedangkan prostasiklin berperan menjaga homeostatis saluran pencernaan (Katzung 2001). Ekspresi COX-2 terinduksi oleh berbagai stimulan inflamasi atau mitogenik, dan bertanggungjawab pada biosintesis prostaglandin (PGE2, PGD2, dan PGF2) yang terlibat pada reaksi inflamasi dan rasa nyeri (Tjay 2002).
20
6
Prostaglandin hasil aktivitas COX-2 dinyatakan terlibat dalam karsinogenesis melalui perangsangan proses proliferasi sel, angiogenesis, dan penghambatan apoptosis (Koki and Masferrer 2002).
Aktivitas COX-2 memainkan peranan penting dalam proses inflamasi maupun kanker. Penggunaan OAINS selektif terhadap COX-2 diharapkan akan memberikan aksi
antiinflamasi setara dengan OAINS non selektif tetapi dengan angka kejadian efek samping yang lebih kecil dan mempunyai profil antikanker yang lebih baik. Hal ini memotivasi pencarian agen yang dapat mempengaruhi regulasi COX-2, baik melalui penekanan ekspresi COX-2 dan/atau melalui penghambatan COX-2 (Perera et al. 2001).
fosfolipase Rangsangan
Kortikosteroida Fosfolipida
Asam Arakidonat
Enzim Lipooksigenase Siklooksigenase
Kerusakan membran sel
Prostaglandin
Hidroperoksida Endoperoksida
Tromboksan Leukotrien
LTC4/D4/E4
LTB4 Prostasiklin
Perubahan permeabilitas vaskuler, vasodilatasi bronkhi,
peningkatan sekresi Modulasi leukosit Aktraksi/
aktifasi fagosit
Bronkospasme, kongesti, penyumbatan mukus
Inflamasi Inflamasi
Gambar 3 Mekanisme terjadinya inflamasi (Katzung 2001)
4
Leukotrien B (LTB4)
Asetosal
Asetosal (asam asetilsalisilat) sebagai prototip nonsteroidal anti-inflammatory drugs (NSAID) merupakan analgetika nonsteroid dan nonnarkotik (Reynolds 1982). Kerja utama asetosal dan kebanyakan obat antiradang nonsteroid lainnya adalah sebagai penghambat enzim siklooksigenase yang mengakibatkan penghambatan sintesis senyawa endeperoksida siklik PGG2 dan PGH2. Kedua senyawa ini merupakan prazat semua senyawa prostaglandin sehingga sintesis prostaglandin akan terhenti (Mutschler 1991).
Asetosal (Gambar 4) tidak menghambat metabolisme asam arakidonat melalui jalur lipoksigenase. Penghambatan enzim siklooksigenase akan menambah pembentukan leukotrien pada jalur lipoksigenase. Hal ini dapat terjadi karena bertambahnya sejumlah asam arakidonat yang dibutuhkan enzim lipoksigenase (Mutschler 1991). Selain sebagai penghambat sintesis prostaglandin dari berbagai model eksperimen yang telah dicoba kepada manusia untuk tujuan terapeutik, NSAID ternyata menunjukkan berbagai kerja lain sebagai antiradang.
Energi yang dihasilkan dari oksidasi makanan disimpan dalam bentuk ikatan kimia pirofosfat. Hidrolisis ikatan fosfat membebaskan energi yang digunakan untuk berfungsinya sel, misalnya pada sintesis protein. Asetosal memecah mata rantai diantara proses ketika energi dihasilkan melalui oksidasi dan membentuk coupling dengan fosfat. Kerja asetosal ini disebut uncoupling fosforilasi oksidatif (Melmon dan Morreli 1978). Asetosal dapat melewati membran sel yang membuat intrasel menjadi asidosis, merusak sistem enzim dan menimbulkan kerusakan pada protein sitoplasma. Konsentrasi asetosal yang tinggi berinterferensi dengan reaksi enzimatik yang esensial pada perkembangan proses radang melalui penggabungan dengan lisil, amin, tiol dan beberapa gugus lain (Melmon dan Morreli 1978). Asetosal juga dapat menghambat nonspesifik pembebasan mediator kimia yang memberi efek perifer pada reaksi radang. Pembebasan kinin dihambat melalui aktivasi kalikrein oleh asetosal (Melmon dan Morreli 1978).
Pembebasan bahan-bahan lisosom yang memberi kontribusi pada peradangan dapat dicegah oleh asetosal dengan menstabilkan membran lisosom (Melmon dan Morreli 1978). Asetosal juga mempengaruhi
metabolisme jaringan ikat, efek ini termasuk salah satu dari aksi radang. Asetosal memberi efek terhadap komposisi, biosintesis atau metabolisme mukopolisakarida jaringan ikat (Robins 1974). Asetosal mampu menekan berbagai reaksi antigen-antibodi pada proses imunologi, termasuk diantaranya penghambatan produksi antibodi, penghambatan agregasi antigen-antibodi dan penghambatan antigen yang membebaskan histamin. Asetosal juga menginduksi nonspesifik stabilisasi permeabilitas kapiler selama reaksi imun. Diperlukan konsentrasi asetosal yang tinggi untuk menghasilkan berbagai efek tersebut (Robins 1974).
Asetosal dapat mengencerkan darah karena bekerja cukup kuat pada enzim COX-1 yang mengkatalisis pembentukan tromboksan dari platelet, yaitu suatu keping darah yang terlibat dalam proses pembekuan darah. Penghambatan sintesis tromboksan oleh asetosal menyebabkan berkurangnya efek pembekuan darah sehingga asetosal dapat digunakan sebagai obat pengencer darah pada pasien-pasien pasca stroke untuk mencegah serangan stroke akibat tersumbatnya pembuluh darah. Implikasi penggunaan asetosal adalah tidak digunakan sebagai obat turun panas pada penderita demam berdarah karena pada penderita demam berdarah sudah ada risiko perdarahan karena berkurangnya trombosit (Departemen Kesehatan Republik Indonesia 1995).
Gambar 4 Struktur kimia asetosal (Depkes 1995).
Uji Hayati terhadap Larva Udang (Artemia salina Leach)
20
6
selanjutnya dianalisis probit untuk menentukan konsentrasi LC50 (lethal concentration 50%), yaitu konsentrasi yang menyebabkan kematian populasi larva A. salina Leach sebesar 50% dari populasi total). Senyawa yang mempunyai LC50 lebih kecil dari 1000 ppm dikatakan memiliki potensi bioaktivitas (Meyer et al 1982).
Artemia merupakan kelompok udang (crustaceae) dari filum Arthropoda dan hidup di danau garam (berair asin). Udang ini toleran terhadap selang salinitas yang sangat luas. Secara alamiah salinitas danau dimana mereka hidup sangat bervariasi, tergantung pada intensitas hujan dan penguapan yang terjadi. Apabila kadar garam kurang dari 6% maka telur Artemia akan tenggelam dan tidak menetas. Hal ini biasanya terjadi apabila air tawar banyak masuk ke dalam danau di musim penghujan. Jika kadar garam melebihi 25%, telur akan tetap berada dalam kondisi tersuspensi, sehingga dapat menetas dengan normal (Setiarto 2009).
Uji toksisitas terhadap larva Artemia salina Leach (Brine Shrimp Lethality Test (BSLT)) memiliki kelebihan, antara lain biaya relatif murah, sederhana, cepat, praktis, tidak memerlukan teknik perawatan khusus. Selain itu, jumlah sampel yang digunakan relatif sedikit dan tidak memerlukan serum hewan. Hasil uji berkorelasi baik dengan beberapa metode uji sitotoksik (Meyer et al 1982).
Karagenan sebagai Induksi Inflamasi
Karagenan adalah campuran polisakarida yang disusun oleh unit galaktosa sulfur dan diperoleh dari Chondrus crispus. Karagenan, umumnya dalam bentuk garam karena bereaksi dengan unsur-unsur Na, Ca, dan K. Secara kimia, karagenan terbagi menjadi fraksi-fraksi kappakaragenan, lamdakaragenan dan iotakaragenan. Jenis ganggang yang menghasilkannya antara lain Chondrus, Gigartina, dan Euchema, dengan manfaat dan penggunaan sama seperti agar-agar dan algin (Suriawiria 2008).
Karagenan akan menginduksi cedera sel dengan dilepaskannya mediator yang mengawali proses inflamasi. Pada awalnya masih terjadi adaptasi untuk melepaskan mediator inflamasi, berarti pelepasan mediator inflamasi belum maksimal. Setelah pelepasan mediator maksimal, terjadi udem dan mampu bertahan sampai beberapa jam. Edema yang disebabkan induksi karagenan dapat bertahan selama 6 jam dan berkurang dalam waktu 24 jam (Sumarny dan Rahayu 1994).
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan adalah oven, mortar, neraca analitik, HPLC, buret, blender, corong pisah, statif, pletismometer, kandang tikus, sarung tangan, masker, syringe, lampu, tabung vial, lampu neon, dan alat gelas.
Bahan yang digunakan dalam penelitian ini adalah tikus jantan galur Wistar, pakan tikus, kertas saring, serbuk kemenyan dari resin batang pohon kemenyan (Styrax benzoin) yang berasal dari Tapanuli Utara, Sumatera Barat, HCl, aquades, alkohol absolut, KOH-etanol 0,5 N, MgSO4, eter, NaHCO3, kloroform, standar asam sinamat,
CMC, asetosal, karagenan, air laut, larva udang.
Metode
Isolasi Asam Sinamat dari Kemenyan (Setiawan 2010)
Sebanyak 3 gram serbuk kemenyan dimasukkan ke dalam labu Erlenmeyer bertutup asah lalu ditambahkan 50 ml KOH-etanol 0,5 N dan direfluks selama 1 jam. Etanol diuapkan hingga kering, kemudian sisa penguapan dilarutkan dengan 75 ml akuades panas hingga homogen dan didinginkan. Setelah dingin, larutan ditambah 80 ml akuades dan 75 ml larutan MgSO4 3% kemudian diaduk rata dan didiamkan selama 10 menit lalu disaring. Residu pada kertas saring dicuci dengan akuades dan etanol 96%. Filtrat dikumpulkan dan diasamkan dengan HCl 4 N, kemudian diekstraksi dengan eter sebanyak 3 kali. Fase eter dikumpulkan lalu diekstraksi empat kali secara bertahap dengan volume 40 ml, 40 ml, 40 ml dan 20 ml larutan NaHCO3 5%. Fase akuades dikumpulkan, kemudian dicuci dengan eter sehingga terbentuk fase akuades dan eter. Fase eter dibuang, sedangkan fase akuades diasamkan dengan HCl 4 N, lalu diekstraksi secara bertahap dengan 60, 40, dan 20 ml kloroform. Larutan kloroform dikumpulkan dalam labu Erlenmeyer bertutup asah dan fraksi kloroform diuapkan hingga kering. Hasil penguapan kloroform diperoleh kristal putih di dasar labu Erlenmeyer. Kemudian kristal tersebut ditambah air panas (dipanaskan) dan disaring dalam keadaan panas. Selanjutnya saringan didinginkan pada suhu kamar dan dikeringkan dengan cara dioven pada suhu ± 50oC selama 3 jam. Hasilnya berupa kristal berwarna putih dinyatakan sebagai hablur (fraksi) asam sinamat.
= (W1/W) x 100 %
W = bobot contoh kemenyan (gram)
W1 = bobot hablur asam sinamat kering (gram).
Analisis kualitatif Asam Sinamat dengan HPLC
Larutan fasa gerak (asetonitril : air) dengan perbandingan (65:35) yang telah dihilangkan gasnya dengan vakum sonik dialirkan terus dengan laju alir 0.4 mL/menit pada alat HPLC. Fase diam yang digunakan adalah kolom C-18 nukleosil dengan panjang kolom 150 mm. Sebanyak 30 ppm asam sinamat standar dan fraksi asam sinamat hasil isolasi dari kemenyan disuntikkan ke dalam loop sampel pada HPLC. Kemudian di-running, muncul dua puncak pada kromatogram, yaitu puncak standar asam sinamat dan fraksi asam sinamat dari kemenyan.
Pengukuran Kadar Asam Sinamat (Setiawan 2010)
Pengukuran kemurnian asam sinamat dari kemenyan dilakuakan dengan metode Titrimetri, yaitu sebanyak ± 0.1 gram hablur (fraksi) asam sinamat dimasukkan ke dalam labu Erlenmeyer dan dilarutkan dengan 20 mL etanol. Campuran tersebut dipanaskan dengan cara di oven pada suhu ± 50˚C selama 1 jam. Setelah dipanaskan lalu didinginkan, kemudian dititar dengan larutan NaOH 0.5 N yang distandardisasi oleh asam oksalat 0.0318 N dan fenolftalin sebagai indikator. Perubahan warna yang terjadi dari kuning menjadi jingga kemerahan. Volume NaOH yang terpakai digunakan untuk menetukan kadar asam sinamat dengan rumus:
Keterangan :
V = volume NaOH terpakai ( mL) N = normalitas NaOH (N) W = bobot hablur ( mg) 148, 2 = BE asam sinamat ( g/ek)
Uji Hayati Fraksi Asam Sinamat dari Kemenyan terhadap A. salina (Hardian 2008)
Potensi hayati dari fraksi asam sinamat kemenyan ditentukan dengan menggunakan metode BSLT, melalui pengamatan nilai persen kematian dari larva udang salina Leach (Lampiran 3). Kista larva udang (A. salina) yang sudah ditetaskan ditimbang sebanyak 50 mg kemudian dimasukkan ke dalam toples yang berisi air laut yang sudah disaring, dan kemudian diaerasi. Kista dibiarkan selama 48
jam di bawah pencahayaan lampu agar menetas sempurna. Larva yang sudah menetas diambil untuk uji hayati. Selanjutnya, 0.02 gram hablur (fraksi) aam sinamat dilarutkan dalam 10 mL air laut sebagai larutan induk dengan konsentrasi 2000 ppm. Kemudian larutan induk diencerkan dengan konsentrasi akhir 10, 100, 500, dan 1000 ppm. Sepuluh ekor larva udang kemudian dimasukkan ke dalam setiap lubang vial uji dan ditambahkan 1000 µL larutan fraksi asam sinamat dari kemenyan. Setelah itu, diinkubasi selama 24 jam. Penentuan LC50 dilakukan dengan menggunakan kurva regresi linear. Melalui kurva tersebut, dapat ditentukan hubungan linearitas antara konsentrasi ekstrak terhadap persen kematian dari larva udang.
Uji In Vivo Aktivitas Antiinflamasi Fraksi Asam Sinamat dari Kemenyan (Atmasari et al. 2007)
Tikus yang digunakan dalam percobaan ini adalah tikus putih galur Wistar dengan berat badan 180-220 gram sebanyak 25 ekor yang dibagi ke dalam 5 kelompok secara acak. Setiap kelompok terdiri atas 5 ekor tikus dan
dikandangkan secara individu. Selama perlakuan, tikus diberi pakan standar sebanyak 20 gr/ekor/hari dan diberi minum ad-libitum. Selain itu bobot badan tikus diukur untuk menentukan dosis fraksi asam sinamat yang akan diberikan pada tikus tersebut. Sebelum diberi perlakuan, tikus Wistar dipelihara dan diadaptasi pada lingkungan baru selama 1 minggu di dalam kandang untuk menyeragamkan cara hidup dan makannya. Sebelum pengujian, tikus dipuasakan selama 18 jam dengan tetap diberi air minum. Kaki tikus diberi tanda batas pada lututnya untuk menyamakan persepsi pembacaan pada setiap jamnya. Sebelum tikus disuntik karagenan, volume kaki tikus diukur menggunakan alat pletismometer sebagai volume awal (Vo).
Kelompok I merupakan kelompok kontrol karagenan atau kelompok inflamasi yang hanya diberi suspensi CMC 0,5%. Kelompok II merupakan kontrol positif atau pembanding, tikus diberi obat antiinflamasi, yaitu asetosal dengan dosis 8 mg/Kg dalam CMC 0.5%. Kelompok III, IV, dan V merupakan kelompok perlakuan, tikus diberikan fraksi asam sinamat dari kemenyan dengan dosis 50 mg/Kg BB, 100 mg/KgBB, 150 mg/Kg BB. Semua perlakuan diberikan melalui oral dengan volume 1% berat badan. Satu jam kemudian tikus diberikan suntikan suspensi karagenan 1% sebanyak 0.1 mL pada telapak Kadar asam
sinamat (%) =
,
20
6
kaki tikus secara subplantar. Rakhmawati (1997) menyatakan bahwa pada dosis tersebut sudah dapat menimbulkan edema yang dapat teramati secara jelas. Volume kaki diukur lagi setiap satu jam selama 6 jam sebagai volume akhir (Vt) untuk mengetahui volume edema kaki tikus yang terjadi setiap jamnya (vu).
Analisis Data
Data yang diperoleh berupa volume kaki tikus, kemudian digunakan untuk menghitung volume udem. Volume udem merupakan selisih kaki tikus sebelum dan sesudah diradangkan dengan rumus :
Vu = Vt-V0 Keterangan :
Vu : volume udem kaki tikus tiap waktu Vt : volume kaki tikus setelah diradangkan
karagenin 1% pada waktu t
V0 : volume kaki tikus sebelum diradangkan karagenin 1%
Setelah diperoleh kurva volume udem terhadap waktu, selanjutnya digunakan untuk menghitung AUC (Area Under the Curve). AUC adalah luas di bawah kurva antara rata-rata volume udem dari waktu 0 sampai 6 jam. Rumus yang digunakan untuk menghitung AUCtntn-1 menurut Hakim (2008) adalah :
AUCtntn-1= V V ( tn-tn-1) Keterangan :
Vtn-1 = rata-rata volume udem pada tn-1 Vtn = rata-rata volume udem pada tn
Perhitungan % Daya Anti Inflamasi menurut Hakim (2008), yaitu data yang dikumpulkan berupa luas Area Under the Curve (AUC) kontrol dan luas AUC perlakuan yang dihitung dengan rumus :
%.
Keterangan :
AUCk : AUC rata-rata kurva volume udem terhadap waktu untuk kontrol. AUCp: AUC rata-rata kurva volume udem
terhadap waktu untuk kelompok perlakuan pada tiap individu.
Terdapat tikus yang datanya tidak diikutkan dalam perhitungan untuk analisis ststistik dikarenakan tidak memenuhi persyaratan sehingga jumlah tikus pada kelompok asetosal berbeda dengan kelompok lainnya. Oleh karena itu, data-data tersebut sebelumnya dilakukan uji General Linear Model (GLM) untuk melihat kehomogenan ragam data atau melihat kenormalan sebaran data yang diperoleh. Hasil analisis GLM menunjukkan bahwa data tersebar normal dan homogen sehingga dapat dilakukan analisis
statistik selanjutnya untuk melihat perbedaan pengaruh antar kelompok percobaan.
Antara kelompok perlakuan dengan kelompok kontrol dianalisis secara statistik ANOVA rancangan acak lengkap (RAL) dengan program SAS 9.0. Jika terdapat perbedaan bermakna, maka dilanjutkan dengan uji Duncan sebagai uji lanjut dengan taraf kepercayaan 95 %.
HASIL DAN PEMBAHASAN
Rendemen Asam Sinamat Hasil Isolasi dari Kemenyan
Isolasi Asam sinamat dari kemenyan dilakukan sebagai upaya mendapatkan rendemen atau fraksi asam sinamat pada kemenyan. Hasil isolasi asam sinamat dari tiga kali proses ekstraksi kemenyan yang terlihat pada Tabel 3 menunjukkan bahwa pada ulangan pertama, kedua, dan ketiga menunjukkan rendemen asam sinamat berturut-turut, yaitu 12.25 %, 11.82 %, dan 14.55 %, sedangkan rata-rata rendemen asam sinamat yang diperoleh adalah 12.88 %. Perbedaan nilai rendemen pada masing-masing ulangan disebabkan oleh kandungan asam sinamat pada kemenyan yang tidak merata atau tidak homogen.
Sagala et al. (1980) menyatakan bahwa kandungan asam sinamat pada kemenyan 36.5%. Perbedaan rendemen yang sangat besar ini kemungkinan disebabkan oleh keadaan kemenyan yang sudah mengalami penyimpanan selama beberapa tahun. Selain itu, proses isolasi asam sinamat yang terlalu rumit menyebabkan kesalahan pada penelitiaan. Tetapi, Hughes (2002) menyatakan bahwa kadar asam sinamat yang terdapat pada resin kemenyan sebagai asam bebas minimal 11 %. Rendemen atau kadar asam sinamat hasil isolasi kemenyan dari Sumatera Utara (Tapanuli Utara) adalah di atas 11 %, sehingga hasil penelitian ini memenuhi persyaratan minimal kadar asam sinamat yang terkandung dalam kemenyan.
Isolasi asam sinamat dilakukan dari kemenyan yang merupakan resin batang pohon kemenyan (Styrax benzoin) dan didapatkan langsung dari Tapanuli Utara. Penyadapan resin ini sama seperti penyadapan karet, hanya saja pada penyadapan resin kemenyan, resin tidak dibiarkan kontak langsung udara bebas, tetapi resin ditutup dengan kulit batangnya dan butuh waktu tiga bulan untuk memanennya (Waluyo 2006). % daya anti inflamasi
=
ulangan Bobot kemenyan (gram)
Hablur asam sinamat (gram)
Rendemen Asam sinamat (%)
1 3.00 0.3675 12.25
2 3.00 0.3547 11.82
3 3.00 0.4367 14.55
Rata-rata 12.88 Tabel 1 Rendemen asam sinamat dari ekstrak kemenyan
Teknik isolasi asam sinamat yang dilakukan mengacu pada Setiawan (2010). Asam sinamat diperoleh dari hasil isolasi kemenyan yang terlebih dahulu dilakukan proses penggaraman dengan KOH diikuti hidrolisis dengan asam serta kristalisasi dengan air panas. Komponen lain yang tidak tersabunkan akan dapat dipisahkan dengan pelarut organik dan berlangsung sebelum proses hidrolisis berlangsung (Ginting dan ginting 1997). Proses hidrolisis setelah penggaraman dengan KOH dilakukan dengan metode refluks. Metode ekstraksi ini digunakan untuk bahan yang kasar dan tahan panas, seperti resin kemenyan.
Proses ekstraksi dilakukan secara bertingkat menggunakan pelarut organik seperti eter dan kloroform. Setelah reaksi penyabunan dengan KOH-etanol, dilakukan penguapan etanol dan penambahan MgSO4 dan akuades pada sisa penguapan yang bertujuan untuk mengendapkan pengotor-pengotor yang lain dan juga untuk memberikan suasana basa pada ekstrak. Sebelum dilakukan ekstraksi dengan eter, larutan tersebut diasamkan terlebih dahulu dengan HCl 10%. Hal ini bertujuan untuk memudahkan senyawa yang diinginkan (asam sinamat) terekstrak oleh pelarut eter. Fase eter pada bagian ini diambil dan kemudian diekstraksi kembali sekaligus digaramkan oleh NaHCO3 sehingga pada ekstraksi ini fase aquades yang diambil karena garam asam sinamat larut dalam air. Fase aquades yang bersifat basa ini kemudian diasamkan kembali dengan HCl 10% dan diekstraksi kembali dengan pelarut kloroform. Kemudian pada bagian ini, fase kloroform diambil dan diuapkan sehingga tersisa kristal berwarna kuning dan dilarutkan dengan aquades panas. Proses ini merupakan dekristalisasi asam sinamat sehingga diperoleh fraksi asam sinamat yang dinyatakan sebagai rendemen asam sinamat (Syahmani 2011).
Analisis Kualitatif Asam Sinamat dari Ekstrak Kemenyan
Penentuan keberadaan asam sinamat dari ekstrak kemenyan dilakukan dengan
menggunakan HPLC (High Perfommance Liquid Chromatography). HPLC merupakan metode yang tidak destruktif dan dapat digunakan untuk analisis kualitatif dan kuantitatif. Saat ini, HPLC merupakan teknik pemisahan yang diterima secara luas untuk analisis dan pemurnian senyawa tertentu dalam suatu sampel pada sejumlah bidang, yaitu farmasi, lingkungan, bioteknologi, polimer, dan industri-industri makanan (Rohman 2007).
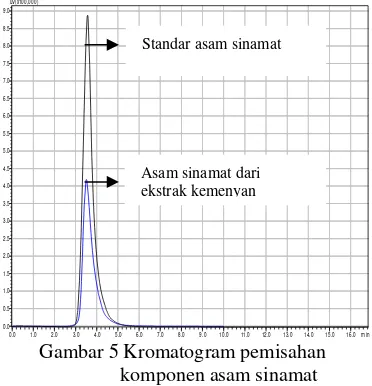
Fasa gerak yang digunakan dalam analisis ini adalah asetonitril : air dengan perbandingan 65:35 dengan laju alir 0.4 mL/menit. Pada laju alir, fasa gerak 0.4 mL/menit komponen asam sinamat sudah terpisah dengan baik dan waktu yang diperlukan relatif singkat. Kromatogram pada Gambar 5 menunjukkan bahwa adanya dua puncak yang saling berimpit. Kedua puncak tersebut menunjukkan standar asam sinamat dengan waktu retensi 3.563 menit dan fraksi murni asam sinamat ekstrak kemenyan dengan waktu retensi 3.307. Hal ini menunjukkan bahwa asam sinamat hasil isolasi dari kemenyan murni, tanpa adanya senyawa pengganggu yang lainnya.
Gambar 5 Kromatogram pemisahan komponen asam sinamat
Kadar Asam Sinamat
Pengukuran kemurnian asam sinamat dari kemenyan dilakuakan dengan metode Titrimetri dengan NaOH sebagai titrannya.
0.0 1.0 2.0 3.0 4.0 5.0 6.0 7.0 8.0 9.0 10.0 11.0 12.0 13.0 14.0 15.0 16.0 min 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 6.5 7.0 7.5 8.0 8.5 9.0 uV(x100,000)
Standar asam sinamat
10
Sebelumnya NaOH distandardisasi terlebih dahulu dengan larutan asam oksalat 0.0318 N. Indikator yang digunakan adalah fenolftalein (PP).
Tiga kali proses ekstraksi kemenyan (ulangan) menghasilkan tiga sampel asam sinamat yang memiliki kadar yang berbeda-beda. Sebagaimana dari hasil analisis yang terlihat pada Tabel 2, kadar asam sinamat ulangan 1, 2, dan 3 berturut-turut adalah 95.38 %, 91.93 % dan 74.12 %, sedangkan rata-rata kadar asam sinamat yang diperoleh adalah 87.14%. Nilai kadar asam sinamat ulangan 1 lebih tinggi dibandingkan ulangan 2 dan 3. Hal ini menunjukkan proses isolasi asam sinamat dari resin kemenyan pada ulangan 1 lebih berhasil dibandingkan ulangan 2 dan 3. Selain itu juga menunjukkan bahwa sampel pada ulangan 2 dan 3 masih terdapat banyak pengotor. Proses isolasi dikatakan berhasil apabila kadar asam sinamat tinggi. Menurut Encyclopedia of Chemical Technology, syarat mutu asam sinamat tidak kurang dari 98.5%. secara teoritis syarat minimal tersebut dapat dicapai dengan jalan memurnikan kembali.
Penelitian ini sengaja tidak dilakukan pemurnian kembali, justru untuk mengetahui sampai dimana hasil percobaan yang dilakukan terhadap kadar asam sinamat yang diperoleh, sehingga dapat memberi gambaran bahwa asam sinamat yang dibuat dari kemenyan dapat mencapai 87.14 %.
Tabel 2 Hasil pengukuran kadar asam sinamat dengan metode titrimetri
Uji Potensi Hayati BSLT
Hasil uji potensi hayati pada Tabel 3 menunjukkan efek farmakologis dengan nilai LC50 sebesar 429 ppm. Semakin rendah
nilai LC50 akan menunjukkan efek
farmakologis yang tinggi. Sedangkan semakin tinggi nilai LC50 menunjukkan
bahwa sampel tersebut memiliki efek farmakologis yang rendah. Menurut Meyer et al. (1982), menyatakan bahwa suatu zat
dikatakan memiliki potensi hayati bila memiliki LC50 ≤ 1000 ppm untuk ekstrak,
sedangkan untuk senyawa murni memiliki nilai LC50 ≤ 30 ppm, sehingga dapat
dikatakan bahwa sampel tidak memiliki potensi hayati.
Penentuan LC50 dilakukan dengan
menggunakan kurva regresi linear. Melalui kurva tersebut, dapat ditentukan hubungan linearitas antara konsentrasi ekstrak terhadap persen kematian dari larva udang. Jumlah letalitas larva udang dihitung secara manual dengan menggunakan kaca pembesar. Kematian larva udang disebabkan oleh perlakuan pemberian ekstrak asam sinamat pada konsentrasi 10, 100, 500, dan 1000 ppm. Hasil perhitungan nilai LC50 dengan
tiga ulangan dapat dilihat pada lampiran 3. Hasil pengujian menunjukkan bahwa asam sinamat dari ekstrak kemenyan menghasilkan mortalitas yang beragam pada setiap konsentrasi. Nilai rata-rata mortalitas yang dihasilkan berkisar 0-100% tergantung jenis ulangannya (Tabel 3). Nilai rata-rata mortalitas kontrol sebesar 0 %, dengan demikian pelarut berupa air laut yang digunakan tidak menyebabkan kematian pada larva udang A. salina serta kualitas lingkungan tempat hidupnya dinilai baik.
Tabel 3 Nilai LC50 fraksi asam sinamat dari
masing-masing ulangan
Uji Daya Antiinflamasi
Tikus yang digunakan dalam percobaan ini adalah tikus putih galur Wistar dengan berat badan 200-300 gram berumur 2-3 bulan sebanyak 25 ekor yang dibagi ke dalam 5 kelompok, yaitu kelompok kontrol karagenan (suspensi CMC 0.5%), kelompok perlakuan fraksi asam sinamat dari kemenyan (dosis 50 mg/Kg BB, 100 mg/Kg BB, dan 150 mg/Kg BB), dan kelompok kontrol positif (asetosal dosis 8 mg/Kg BB). Sebelum perlakuan tikus diadaptasikan selama dua minggu. Bobot badan tikus rata-rata mengalami peningkatan yang signifikan, yaitu sebesar 33 gram terhitung dari awal adaptasi sampai dengan hari ke-14. Sedangkan rata-rata jumlah pakan yang Ulangan Volume NaOH terpakai (mL) Kadar asam sinamat (%)
1 1.38 95.38
2 1.30 91.93 3 1.08 74.12
Rata-rata 87.14
Ulangan Nilai LC50 (ppm)
1 449 2 415
3 423
dikonsumsi per harinya yaitu sekitar 20 gram.
Pengujian efek antiinflamasi dilakukan dengan menggunakan alat pletismometer dengan prinsip pengukuran berdasarkan hukum Archimedes. Induksi radang dilakukan secara kimia dengan menggunakan larutan karagenan (1%) (b/v) dalam NaCl fisiologis. Larutan tersebut disuntikkan secara intraplantar pada telapak kaki tikus sebanyak 0.1 mL.
Karagenan sebagai senyawa iritan menginduksi terjadinya cedera sel melalui pelepasan mediator yang mengawali proses inflamasi. Induksi karagenan menghasilkan peradangan akut dan tidak menyebabkan kerusakan jaringan meskipun radang dapat bertahan selama 360 menit dan berangsur-angsur berkurang selama satu hari. Keuntungan lain menggunakan karagenan adalah memiliki efek yang cepat dalam induksi inflamasi dan memiliki hasil yang konstan dalam setiap uji coba (Juheini 1990).
Data dianalisis dengan metode ANOVA (analisis variansi) menggunakan program SAS 9.0. Analisis dilakukan terhadap hasil perubahan volume kaki tikus dimulai dari satu jam sampai enam jam setelah penyuntikan karagenan. Dari perubahan volume kaki tikus, dapat dihitung nilai AUC dan persen daya antiinflamasi rata-rata kaki tikus.
Pada uji statistik dilakukan uji normalitas dengan GLM diketahui data terdistribusi normal dengan p>0.05. Untuk menghomogenkan dilakukan transformasi dengan menggunakan 1/akar kuadrat dan didapatkan data homogen dengan p>0.05. Uji dilanjutkan ANOVA satu jalan dan dilanjutkan uji Duncan sebagai uji lanjut pada program SAS 9.0.
Volume edema cenderung meningkat pada jam ke-1, ke-2, dan ke-3 dan menurun pada jam ke-4, ke-5, dan ke-6. Hasil analisis uji Duncan menunjukkan bahwa, waktu yang paling berpengaruh pada perlakuan adalah pada jam ke-3 dan ke-4 (Lampiran 8). Volume udem yang terbentuk pada jam ke-4 dosis 100 mg/Kg BB lebih kecil dari volume udem yang terbentuk pada dosis 50 mg/Kg BB dan 150 mg/Kg BB. Diduga hal ini merupakan suatu variasi mekanisme respon tubuh (variasi biologi) karena respon setiap individu terhadap suatu obat bisa sangat bervariasi. Suatu individu dapat memberikan respon yang berlainan terhadap obat yang sama selama masa pemakaian obat. Respon
tersebut dapat disebabkan oleh perbedaan genetik dalam metabolisme obat atau mekanisme imunologi (Katzung 1998).
Berdasarkan perhitungan uji ANOVA yang dilanjutkan dengan Uji Duncan pada perhitungan volume edema, jam ke-1 seluruh perlakuan tidak berbeda nyata, sedangkan pada jam ke-2, ke-3, ke-4, ke-5, dan ke-6 berbeda nyata dengan kontrol karagenan (p<0.05). Waktu-waktu menunjukkan nilai inflamasi (volume edema) pada kontrol karagenan berbeda nyata dengan kontrol asetosal dan seluruh dosis fraksi asam sinamat dari ekstrak kemenyan.
Injeksi karagenan subplantar menghasilkan edema lokal yang meningkat cepat pada jam ke-2 dan belum menunjukkan tanda-tanda penurunan sampai pada jam ke-3. Karagenan akan menginduksi cedera sel sehingga sel yang cedera melepaskan mediator yang mengawali proses inflamasi. Setelah pelepasan mediator inflamasi, terjadi edema yang mampu bertahan selama 6 jam dan berangsur-angsur berkurang dalam waktu 24 jam setelah injeksi (Baghdikian et al 1997).
Edema oleh karagenan tergantung pada peran kinin, leukosit polimorfonuklear, dan mediator-mediator inflamasi yang dilepaskan seperti PGE 1, PGE2, dan PGA2
(Amanlou et al 2005). Setelah injeksi karagenan, terjadi respon yang menyebabkan edema yang terbagi dalam dua fase. Fase awal berhubungan dengan pelepasan histamin dan serotonin. Antara fase I dan II, edema dipertahankan oleh kinin. Fase kedua berhubungan dengan pelepasan prostaglandin (PG) dan Slow Reacting Substances yang mencapai puncak pada 3 jam (Chakraborty et al. 2004). Turnbach et al. 2002 mengatakan bahwa, pemberian karagenan subplantar akan meningkatkan kadar COX-2.
Volume edema pada kelompok asetosal meningkat perlahan dan terus berlangsung sampai pada jam ke-4. Volume udem kelompok perlakuan dengan asetosal lebih kecil dibandingkan kontrol karagenan. AINS seperti asetosal diduga dapat menekan respon pada fase akhir, yang juga disebut fase PG karena kemampuan menekan migrasi leukosit mononuklear ke jaringan radang (DiRosa dan Willoughby 1971 dalam Ammar et al 2005).
12
Keterangan :
a : tidak berbeda nyata (p>0.05) b : berbeda nyata (p<0.05) kontrol karagenan adalah yang paling besar
dibandingkan dengan kelompok lainnya. Hal ini dikarenakan proses penghilangan mediator-mediator inflamasi dalam tubuh hanya terjadi secara alamiah. Kurva terendah yang menunjukkan volume edema terkecil tampak pada kurva kelompok fraksi asam sinamat dari kemenyan dosis 100 mg/Kg BB. Kurva kelompok III, IV, dan V berturut-turut adalah asetosal dosis 8 mg/Kg BB, fraksi asam sinamat dari kemenyan 150 mg/Kg BB, dan 50 mg/Kg BB berada diantara kurva kelompok kontrol karagenan dan kelompok fraksi asam sinamat dari kemenyan dosis 100 mg/Kg BB. Kurva tersebut menunjukkan bahwa volume edema kelompok perlakuan lebih kecil dibandingkan kontrol karagenan sehingga dapat dikatakan bahwa asam sinamat dapat menghambat edema.
Hasil uji daya antiinflamasi dapat dilihat pada Tabel 4, dari hasil ini diketahui bahwa fraksi asam sinamat dari kemenyan dengan dosis 100 mg/Kg BB memberikan efek antiinflamasi lebih baik dibandingkan dosis 50 mg/Kg BB dan 150 mg/Kg BB. Dilihat dari data AUC kontrol karagenan mempunyai AUC paling besar karena tidak ada penghambat inflamasinya. Sedangkan Asetosal memberikan AUC paling kecil karena kemampuannya untuk menghambat inflamasi. Semakin kecil AUC daya hambat terhadap inflamasi semakin besar.
Gambar 6 Grafik antara rata-rata volume edema terhadap waktu pada uji efek antiinflamasi. Kontrol karagenan ( ), asetosal ( ), fraksi asam sinamat 50 mg/Kg BB ( ), fraksi asam sinamat 100 mg/Kg BB( ), fraksi asam sinamat 150 mg/Kg ( ).
Kemampuan suatu bahan dalam mengurangi radang pada kaki hewan uji akibat injeksi karagenan dinyatakan sebagai daya antiinflamasi. Daya antinflamasi (Lampiran 7) pada kelompok asetosal menunjukkan tidak berbeda nyata dengan fraksi asam sinamat dari kemenyan dosis 100 mg/Kg BB dan dosis 150 mg/Kg BB, sedangkan daya antiinflamasi kelompok asetosal dengan fraksi asam sinamat dari kemenyan dosis 50 mg/Kg BB menunjukan beda nyata sehingga kurang efektif dalam menurunkan radang. Nilai persen daya antiinflamasi (Tabel 4) dari kelompok perlakuan fraksi asam sinamat dari kemenyan dosis 50, 100, dan 150 mg/Kg BB berturut-turut adalah 28.13 %, 67.50%, dan 43.44%. Walaupun pada dosis 150 mg/Kg BB persen daya antiinflamasi mengalami penurunan, tetapi hasil uji Duncan (Lampiran 7) menunjukkan bahwa antara dosis 100 mg/Kg BB tidak berbeda nyata dengan 150 mg/Kg BB, begitu juga tidak berbeda nyata dengan kontrol asetosal 8 mg/Kg BB, sehingga dosis 100 dan 150 mg/Kg BB mempunyai aktivitas antiinflamasi yang sama.
Tabel 4 Data AUC kurva rata-rata volume udem terhadap waktu dan % daya antiinflamasi fraksi asam sinamat dari ekstrak kemenyan
0.00 0.02 0.04 0.06 0.08 0.10 0.12 0.14 0.16 0.18 0.20
0 2 4 6 8
Volu me edema (mL) Waktu (Jam) Kelompok perlakuan Total AUC % Daya antiinflamasi Kontrol
Karagenan 0.64 -
Asetosal 8
mg/Kg BB 0.28 56.25
a
Asam sinamat ekstrak
kemenyan dosis 50 mg/Kg BB
0.46 28.13b
Asam sinamat ekstrak
kemenyan dosis 100 mg/Kg BB
0.208 67.50a
Asam sinamat ekstrak
kemenyan dosis 150 mg/Kg BB
Dari ketiga dosis perlakuan, dosis 100 mg/Kg BB adalah dosis yang paling tinggi dalam menurunkan radang karena mempunyai nilai persen daya antiinflamasi tertinggi, yaitu 67.50% melebihi nilai persen daya antiinflamasi kontrol asetosal 8 mg/Kg BB. Hasil ini menunjukkan bahwa fraksi asam sinamat dari kemenyan mempunyai potensi sebagai antiinflamasi. Kemampuan antiinflamasi fraksi asam sinamat ini kemungkinan karena kemampuan dalam penghambatan enzim siklooksigenase dan lipoksigenase sehingga asam arakidonat tidak diubah menjadi prostaglandin dan leukotrien (Amanlou et al 2005).
SIMPULAN DAN SARAN
Simpulan
Senyawa asam sinamat dari kemenyan memiliki aktivitas antiinflamasi secara in vivo. Fraksi asam sinamat dosis 50, 100, dan 150 mg/Kg BB memiliki persen daya antiinflamasi berturut-turut 28.13 %, 67.50%, dan 43.44%. Fraksi asam sinamat kemenyan dosis 100 mg/Kg BB menunjukkan daya antiinflamasi paling tinggi 67.5% melebihi nilai persen daya antiinflamasi obat antiinflamasi komersil asetosal.
Saran
Perlu dilakukan analisis lebih lanjut dengan metode in vitro dan diperlukan juga penambahan dosis perlakuan sehingga bisa dilihat dosis yang paling berpengaruh. Selain itu, Pengukuran kemurnian asam sinamat hasil ekstraksi kemenyan cukup dilakukan dengan HPLC sehingga lebih efektif dan efisien.
DAFTAR PUSTAKA
Amanlou MF, Dadkhah A, Salehnia H, Farsam, Dehpour AR. 2005. An
anti-inflammatory and antinociceptive effects of hydroalcoholic extract of Satureja khuzistanica Jamzad. Journal Pharmacology and Science 8:102-106.
Ammar NM, Al-Okbi SY, Muhamed DA. 2005. Study of the anti-inflammatory activity of some medical edible plants growing in Egypt. Journal of Islamic Academy of Sciences 10 : 96-101.
Archangel. 2005. Benzoin. [terhubung berkala].http://www.archangelartifac ts.com (6 Oktober 2011).
Atmasari I, Rustam E, Yanwirati. 2007. Efek antiinflamasi ekstrak etanol kunyit (Curcuma domestica Val.) pada tikus jantan galur Wistar. J. Sains Tek. Pan. 12: 112-115.
Baghdikian BMC, Lanhers, Fleurentin J, Oliver E, Maillard C. 1997. An analytical study, anti-inflammatory and analgesic effects of
Harpagophytum zeyherl. Planta
Medica 63: 171-176.
Chakraborty A, Devi RKB, Rita S, Sharatchandra, Singh I. 2004. Preliminary studies on anti-inflammatory and analgesic activities of Spilanthes acmella in experimental animal models. Indian Journal Pharmacology 36: 148-150.
Chandrasekharan NV et al. 2002. A cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs. PNAS 99: 13926-13931.
[Departemen Kesehatan]. 1995. Farmakope Indonesia Edisi Keempat. Jakarta : Departemen Kesehatan Republik Indonesia.
[Dinas Perkebunan Provinsi Sumatera Utara]. 2010. Luas tanaman dan produksi kemenyan tanaman perkebunan rakyat menurut kabupaten tahun 2010 [makalah]. Medan: Dinas Perkebunan Provinsi Sumatera Utara.
Edison DT, Putra M, Alhamra. 1983. Pengembangan Kemenyan. Medan : Departemen Perindustrian, Balai Penelitian dan Pengembangan Industri.
14
Pengrtahuan Alam, Universitas Sumatera Utara.
Halliwell B, Gutterigde JMJ, Arouma OS. 1987. The deoksiribosa method : a simple test tube assay for determination of rate constant for reaction of hydroxyl radicals. Anal.Biochem 165:215-219.
Hardian P. 2008. Ekstrak sapogenin akar kuning sebagai hepatoprotektor pada mencit yang diinduksi parasetamol [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam IPB.
Hartanti, Setiawan. 2009. Inhibitory potential of some synthetic cinnamic acid derivatives towars tyrosinase enzyme. Indo.j. Chem. 9 : 158-168. Higgs GA, Wittle BJR. 1980. Therapeutic
and Toxic Effect of Aniinflamantory Drugs. London: Macmillan Publishing Company.
Hu K et al. 2003. Inhibited proliferation of cyclooxygenase-2 expressing human hepatoma cells by NS-398, a selective COX-2 inhibitor. Int. J. Oncol 22:757-763.
Hughes I. 2002. The Resins of BP and BPC.
[terhubung berkala]. http://www.herbdatanz.com/resins_1
.htm. (6 Oktober 2011).
Juheini FA, Mariana Y, Rusmawan. I. 1990. Efek antiinflamasi jahe (Zingiber officinale. Rosc) terhadap radang buatan pada tikus putih. Majalah Farmakologi dan Terapi Indonesia 7: 9-13
Kashio M, Jhonson DV. 2001. Monograph on Benzoin (Balsamic Resin from Styrax Species). Bangkok: Rap. Publication.
Katzung BG. 2001. Farmakologi Dasar dan Klinik Edisi 8. Bagian Farmakologi, Fakultas Kedokteran Universitas Airlangga, penerjemah. Jakarta: Salemba Medika. Terjemahan dari: Basic and Clinical Pharmacology Eight edition .
Koki AT, Masferrer JL. 2002. Celecoxib: a specific COX-2 inhibitor with anti cancer properties. Cancer Control 9: 28-35.
Lopez C, Shanley P. 2005. Kekayaan Hutan Asia : Makanan, Rempah-rempah, Kerajinan Tangan dan Resin. Jakarta : Gramedia Pustaka Utama. Lumbanraja LB. 2009. Skrining fitokimia
dan uji efek antiinflamasi ekstrak etanol daun tempuyung (Sonchus
arvensis L) terhadap radang pada
tikus [skripsi]. Medan: Fakultas Farmasi, Universitas Sumatera Utara.
Melmon KL, Morreli HF. 1978. Clinical Pharmacology, Basic Principles in
Therapeutics 2th Edition. New York :
Macmillan Publishing Company. Meyer BN et al. 1982. Brine shrimp: a
convenient general bioassay for active plant constituents. Planta Medica 45: 31-34.
Moore BC, Simmons DL. 2000. Cox-2 inhibition, apoptosis, and chemoprevention by nonsteroidal anti-inflamatory drugs. Curr. Med. Chem. 7 : 1131-1144.
Mutschler E. 1991. Dinamika Obat. Mathilda B, Anna SR, penerjemah. Bandung : ITB Press. Terjemahan dari: Arzneimittelwirkungen,
Perera P, Ringbom T, Huss U, Vasage M, Bohlin L. 2001. Search for natural product which affect cyclooxygenase-2 in Tringali. Bioactive compounds from Natural Sources 2: 434-465
Price SA, Wilson LM. 1995. Patofisiologi : Konsep Klinis Proses-proses
Penyakit Edisi 4. Jakarta: Penerbit
Buku Kedokteran EGC.
Rakhmawati D. 1997. Efek antiinflamasi lempuyang emprit pada tikus putih jantan. [skripsi]. Yogyakarta: Fakultas Farmasi Universitas Gajah Mada.
Reynolds JEF. 1982. Martindale The Extra
Pharmacopoela 28th Edition.
London: The Pharmaceutical Press Robbins SL. 1974. Pathologic Basis of
Disease. Philadelphia: W. B. Saunders.
Sagala M, Harja H, Tarmiji. 1980. Pembuatan Asam Sinamat. Medan: Balai Penelitian Kimia Departemen Perindustrian.
Schror K, Meyer-Kirchrath J. 2000. Cyclooxygenase-2 inhibition and side effects of non-steroidal anti-inflammatory drugs in the gastrointestinal tract. Curr. Med. Chem. 7 : 1121-1129.
Setiarto HB. 2009. Deteksi dan uji toksisitas LC50 senyawa aflatoksin B1, B2, G1,
G2 pada kacang tanah (Arachis
hypogeal L.) [skripsi]. Bogor:
Fakultas Matematika dan IPA, Institut pertanian Bogor.
Setiawan E, Wahyu TK. 2010. Isolasi asam sinamat dari berbagai kualitas kemenyan asal sumatera utara. Jurnal Penelitian Hasil Hutan 24: 81-86
Suriawiria, Unus. 2008. Bahan Baku Industri Bernilai Tinggi. .[terhubung berkala].http://www2.kompas.com/k ompascetak/0305/28/inspirasi/32482 4.htm - 40k - (6 April 2009).
Sumarny R, Rahayu. 1994. Perbandingan efek antiinflamasi jahe biasa, jahe gajah dan jahe merah [artikel karya tulis ilmiah]. Sulawesi Selatan: Fakultas Farmasi, Universitas Hasanudin.
Syahmani R. 2011. Isolasi etil p-metoksi sinamat dari rimpang kencur [artikel karya tulis ilmiah]. Banjarmasin : FKIP UNLAM.
Hakim Lt, Wahyuningtyas N, Wahyuni AS. Efek antiinflamasi ekstrak patikan kebo (Euphorbia hirta L) pada tikus putih jantan. Pharmacon 9: 1-5. Tjay HT, Rahardja K. 2002. Obat-Obat
Penting: Khasiat, Penggunaan dan
Efek Sampingnya Edisi V. Jakarta :
Elex Media Komputindo.
Turnbach ME, Spraggins DS, Randich A. 2002. Spinal asministration of prostaglandin E2 and prostaglandin
F2α primarly produces mechanical
hyperalgesia that is mediated by nociceptive specific spinal dorsal horn neuron. Pain 97:33-45.
Vane JR, Botting RM. 1996. Mechanism of Action of Anti-inflammatory Drugs.
Great Britain : Kluwer Academic Publishers and William Harvey Press. Ujihara M, Tsuchida S, Satoh K, Urade Y.
1988. Biochemical and immunological demonstration of prostaglandin H2 by various GSTs
isoenzymes. Archs. Biochem. Biophys. 264: 428-437.
Waluyo TK, Hastoeri P, Prihatiningsih T. 2006. Karakteristik dan sifat fisiko-kimia berbagai kualitas kemenyan di Sumatera Utara. Jurnal Penelitian Hasil Hutan 24 : 47-61.
Widyastuti, W. 1989. Perkembangan Aromatherapy. Bogor : Pusat Litbang Tanaman Industri.
Wijayakusuma HMH. 2000. Potensi tumbuhan obat asli Indonesia sebagai produk kesehatan [risalah Pertemuan Ilmiah Penelitian dan Pengembangan Teknologi Isotop dan Radiasi]. Jakarta.
10
Lampiran 1 Diagram Alir Penelitian
Pengukuran kadar asam
sinamat
Sampel Kemenyan
Ekstraksi
Uji Toksisitas Ekstrak kemenyan
(asam sinamat) terhadap A. Salina
Uji In Vivo Aktivitas Antiinflamasi
Ekstrak Kemenyan (asam sinamat)
18
Lampiran 2 Penyiapan Bahan uji, Kontrol, Obat pembanding, dan Karagenan
Pembuatan Suspensi CMC 0,5%
Sebanyak 500 mg CMC ditaburkan merata ke dalam lumping yang telah
berisi air suling panas sebanyak 35 mL. didiamkan selama 15 menit hingga
diperoleh massa yang transparan, digerus hingga terbentuk gel kemudian
diencerkan dengan sedikit air, dimasukkan ke dalam labu ukur 100 mL, lalu
ditambahkan air suling sampai garis tanda.
Pembuatan Suspensi Asetosal Dosis 8 mg/Kg BB
Dosis asetosal ditentukan berdasarkan dosis konsumsi manusia per hari
•
Dosis asetosal per tablet
= 80 mg
•
Dosis manusia per hari
= 3 x 1 tablet
•
Asumsi bobot badan manusia
= 40 Kg
•
Perhitungan dosis
¾
Dosis manusia per hari
= 3 tablet x 80 mg = 240 mg
¾
Dosis per Kg BB
=
= 8 mg/ Kg BB
¾
Dosis per Kg BB dikonversi ke tikus dengan BB 200 g
x 6 mg = 1.2 mg/ 200 g tikus
Asetosal ditimbang sebanyak 8 mg serbuk asetosal kemudian digerus
dengan penambahan suspensi CMC 0,5% sampai homogen, dimasukkan ke dalam
labu ukur 10 mL, dicukupkan sampai garis tanda dengan suspensi CMC 0,5%.
Pembuatan Suspensi Asam Sinamat Ekstrak Kemenyan Dosis 50 mg/Kg BB,
100 mg/Kg BB, 150 mg/Kg BB
Asam sinamat ditimbang sebanyak 50 mg, 100 mg, dan 150 mg.
Masing-masing dilarutkan dengan penambahan suspensi CMC 0,5% sampai homogen,
kemudian dimasukkan ke dalam labu ukur 10 mL, dicukupkan sampai garis tanda
dengan suspensi CMC 0,5%.
Pembuatan Suspensi Karagenan
Lampiran 3 Hasil uji hayati dengan BSLT
konsentrasi
% kematian
1 2
3 Rata-rata
0 0
0 0
10 10
10 20
100 40
40 30
500 70
60 60
1000 90
90 100
LC
50449
415 423 429
Contoh perhitungan mencari nilai LC
50:
Persamaan linear :
Ulangan 1
y = 0.080x + 14.08
50 % = 0.080x + 14.08
x = 449 ppm
Ulangan 2
y = 0.088x + 13.52
50 % = 0.088x + 13.52
x = 415 ppm
Ulangan 3
y = 0.082x + 15.30
50 % = 0.083x + 14.30
x = 423 ppm
Jadi rata-rata nilai LC
50senyawa asam sinamat dari kemenyan adalah 429 ppm
y = 0.082x + 15.30 R² = 0.866
y = 0.080x + 14.08 R² = 0.889
y = 0.088x + 13.52 R² = 0.953
0 20 40 60 80 100 120
0 200 400 600 800 1000 1200
Persen
kematian
(%)
Konsentrasi asam sinamat ekstrak kemenyan (ppm)
20
Lampiran 4 Data hasil pengukuran uji antiinflamasi pada tikus Wistar
Kelompok Nomer tikus
Jam ke-1 Vu (mL)
Jam ke-2 Vu (mL)
Jam ke-3 Vu (mL)
Jam ke-4 Vu (mL)
Jam ke-5 Vu (mL)
Jam ke-6 Vu (mL)
Kontrol positif (Asetosal 8 mg/kg
BB)
3 0.02 0.00 0.03 0.10 0.06 0.02
6 0.04 0.04 0.07 0.04 0.02 0.02
26 0.02 0.12 0.13 0.12 0.10 0.02
13 0.06 0.12 0.13 0.04 0.08 0.00
8 0.04 0.04 0.03 0.04 ‐0.02 ‐0.02
Rata-rata 0.04 0.07 0.09 0.08 0.07 0.02 Standar deviasi 0.02 0.06 0.05 0.04 0.03 0.01
Kontrol karagenan (CMC 0.5 %)
9 0.04 0.12 0.16 0.20 0.09 0.04
19 0.02 0.18 0.2 0.16 0.08 0.04
22 0.06 0.12 0.14 0.16 0.07 0.02
24 0.02 0.12 0.16 0.08 0.1 0.04
30 0.04 0.24 0.26 0.22 0.14 0.06
Rata-rata 0.04 0.16 0.18 0.16 0.10 0.04
Standar deviasi 0.02 0.05 0.05 0.05 0.03 0.01
Fraksi asam sinamat kemenyan dosis 50
mg/kg BB
1 0.04 0.1 0.11 0.16 0.12 0.02
2 0.06 0.08 0.12 0.16 0.15 0.02
7 0.04 0.1 0.12 0.16 0.16 0.04
14 0.02 0.02 0.04 0.04 0.02 0.04
17 0.04 0.09 0.1 0.16 0.1 0.02
Rata-rata 0.04 0.08 0.10 0.14 0.11 0.03
Standar deviasi 0.01 0.03 0.03 0.05 0.06 0.01
Fraksi asam sinamat kemenyan dosis 100
mg/kg BB
5 0.02 0.06 0.06 0.02 0.04 0.04
11 0.02 0.04 0.04 0.02 0.04 0.04
18 0.02 0.06 0.1 0.04 0.02 0.02
25 0.04 0.08 0.1 0.12 0.1 0.02
29 0.04 0.08 0.1 0.04 0.02 0.02
Rata-rata 0.03 0.06 0.08 0.05 0.04 0.03
Standar deviasi 0.01 0.02 0.03 0.04 0.03 0.01
Fraksi asam sinamat kemenyan dosis 150
mg/kg BB
12 0.04 0.08 0.12 0.14 0.06 0.02
15 0.04 0.1 0.1 0.10 0.06 0.02
20 0.06 0.04 0.08 0.12 0.06 0
21 0.08 0.04 0.06 0.10 0.06 0.02
28 0.02 0.1 0.1 0.12 0.04 0.02
Rata-rata 0.05 0.07 0.09 0.12 0.06 0.02
Standar deviasi 0.02 0.03 0.02 0.02 0.01 0.01
Keterangan : Data yang dicetak tebal tidak diikutkan dalam perhitungan statistik
Lampiran 4 (Lanjutan)
Kelompok Nomer tikus
AUC 1-2
AUC 2-3
AUC 3-4
AUC 4-5
AUC 5-6
AUC total
Kontrol positif (Asetosal 8 mg/kg
BB)
3 0.01 0.015 0.065 0.08 0.04 0.21
6 0.04 0.055 0.055 0.03 0.02 0.2
26 0.07 0.125 0.125 0.11 0.06 0.49
13 0.09 0.125 0.085 0.06 0.04 0.4
Rata-rata 0.05 0.08 0.08 0.07 0.04 0.33 Standar deviasi 0.04 0.05 0.03 0.03 0.02 0.14
Kontrol karagenan (CMC 0.5 %)
9 0.08 0.14 0.18 0.145 0.065 0.61
19 0.1 0.19 0.18 0.12 0.06 0.65
22 0.09 0.13 0.15 0.115 0.045 0.53
24 0.07 0.14