DETEKSI VIRUS-VIRUS UTAMA BAWANG MERAH
(
Allium cepa
L.) DAN BAWANG PUTIH (
A. sativum
L) DARI
DAERAH JAWA BARAT DAN JAWA TENGAH
KADWATI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Deteksi Virus-virus Utama Bawang Merah (Allium cepa L.) dan Bawang Putih (A. sativum L.) dari Daerah Jawa Barat dan Jawa Tengah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2013
Kadwati
NIM A34090074
ABSTRAK
KADWATI. Deteksi Virus-Virus Utama Bawang Merah (Allium cepa L.) dan Bawang Putih (A. sativum L.) dari Daerah Jawa Barat dan Jawa Tengah. Dibimbing oleh SRI HENDRASTUTI HIDAYAT.
Penyakit yang disebabkan oleh virus merupakan salah satu kendala dalam meningkatkan produksi bawang merah (A. cepa L.) dan bawang putih (A. sativum
L.). Penelitian dilakukan untuk mendeteksi virus-virus utama bawang merah dan bawang putih dari pertanaman di lapangan dan dari umbi dengan metode ELISA, serta mengetahui perbedaan tingkat sensitivitas metode deteksi DIBA dan ELISA. Sampel berupa daun dan umbi diperoleh dari beberapa daerah pertanaman bawang di Jawa Barat (Bandung, Bogor, dan Cirebon) dan Jawa Tengah (Brebes) serta Yogyakarta (Bantul). Infeksi GCLV, SLV, dan Potyvirus berhasil terdeteksi menggunakan antibodi spesifik. Ketiga jenis virus menginfeksi secara tunggal maupun bersama-sama (infeksi campuran). Rata-rata persentase infeksi virus di pertanaman berkisar antara 11.22% sampai 14.29%, sedangkan pada sampel umbi berkisar antara 9.18% sampai 13.27%. Metode DIBA lebih sensitif dibandingkan metode ELISA, yaitu berhasil mendeteksi ketiga virus dengan pengenceran antibodi 10-7, sedangkan metode ELISA hanya mampu mendeteksi pada pengenceran antibodi 100.
Kata kunci: Carlavirus, DIBA, ELISA, Potyvirus
ABSTRACT
KADWATI. Detection of Major Viruses of Shallot (Allium cepa L.) and Garlic
(A. sativum L.) from West Java and Central Java. Supervised by SRI
HENDRASTUTI HIDAYAT.
Viral disease has been reported to cause significant effect on production of shallot (A. cepa L.) and garlic (A. sativum L.). The study was conducted to detect major viruses from leaves and bulbs of shallot and garlic using ELISA method, and to know the difference in the level of sensitivity of DIBA and ELISA detection methods. Leave and bulb samples was collected from West Java (Bandung, Bogor and Cirebon), Central Java (Brebes), and Yogyakarta (Bantul). Single as well as mix infection of GCLV, SLV, and Potyvirus was successfully detected using specific antibodies. The average percentage of virus infection in the crop ranged from 11.22% to 14.29%, whereas in the bulb ranged from 9.18% to 13.27%. DIBA is a sensitive methods, having capability to detect target viruses with dilution factor of antibody up to 10-7, while ELISA could only detect the virus using undiluted antibody (100).
DETEKSI VIRUS-VIRUS UTAMA BAWANG MERAH
(
Allium cepa
L.) DAN BAWANG PUTIH (
A. sativum
L) DARI
DAERAH JAWA BARAT DAN JAWA TENGAH
KADWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Tanggal disetujui:
Judul Skripsi : Deteksi Virus-Virus Utama Bawang Merah (Allium cepa
L.) dan Bawang Putih (A. sativum L.) dari Daerah Jawa Barat dan Jawa Tengah
Nama Mahasisiwa: Kadwati NIM : A34090074
Disetujui oleh
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc Dosen Pembimbing
Diketahui oleh
PRAKATA
Puji syukur ke hadirat Allah SWT atas segala rahmat dan hidayah-Nya
sehingga penulis dapat menyelesaikan skripsi dengan judul “Deteksi Virus-Virus
Utama Bawang Merah (Allium cepa L.) dan Bawang Putih (A. sativum L.) dari Daerah Jawa Barat dan Jawa Tengah” dapat terselesaikan. Penulis menyampaikan ucapan terimakasih kepada kedua orang tua, kakak, dan adik, serta seluruh keluarga yang senantiasa memberikan doa, dukungan, kasih sayang, serta semangatnya kepada penulis untuk dapat menyeleseikan pendidikan di IPB. Ucapan terimakasih kepada pihak Kementerian Agama Republik Indonesia (Kemenag RI) yang telah memberikan beasiswa pendidikan jenjang S1 sampai selesai kepada penulis. Ucapan terimakasih yang sebesar-besarnya juga penulis sampaikan kepada Dr. Ir. Sri Hendrastuti Hidayat M.Sc selaku dosen pembimbing akademik dan skripsi yang telah membimbing, memberikan ilmu, saran, dan perhatian kepada penulis selama proses penulisan skripsi ini. Penulis mengucapkan terimakasih atas dukungan biaya penelitian melalui proyek ACIAR:
Increasing Productivity of Allium and Solanaceous Vegetable Crops in Indonesia and Sub-Tropical Australia.
Penulis mengucapkan terimakasih juga kepada rekan-rekan di Laboratorium Virologi Tumbuhan atas kebersamaannya, terutama Kak Sari Nurulita dan Ibu Asniwita yang telah membimbing, serta orang-orang terkasih yang selalu menemani saat dibutuhkan dan seluruh teman PTN 46, keluarga besar CSS MoRA IPB terutama CSSMoRA IPB 46, dan keluarga besar PP. Al-Huda Babakan Ciwaringin Cirebon. Semoga kebaikan yang telah diberikan memperoleh balasan yang lebih dari Allah SWT. Penulis berharap semoga hasil penelitian ini nantinya dapat memberikan manfaat bagi dunia pendidikan dan ilmu pengetahuan.
Bogor, Desember 2013
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN ix
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
BAHAN DAN METODE 4
Waktu dan Tempat Penelitian 4
Metode Penelitian 4
Survei dan pengambilan sampel lapangan 4
Sampel daun bergejala 4
Sampel umbi 5
Penanaman sampel umbi di rumah kasa 6
Deteksi virus 6
Deteksi GCLV dengan DAS-ELISA 7
Deteksi SLV dengan TAS-ELISA 8
Deteksi Potyvirus dengan I-ELISA 8
Metode DIBA 9
Pengujian sensitivitas metode DIBA dan ELISA 9
HASIL DAN PEMBAHASAN 11
Gejala infeksi virus pada tanaman bawang di lapangan 11 Hasil deteksi virus pada sampel daun dari lapangan 12
Hasil deteksi virus pada sampel umbi 15
Perbandingan sensitivitas metode DIBA dan ELISA 16
SIMPULAN DAN SARAN 19
DAFTAR PUSTAKA 20
LAMPIRAN 23
DAFTAR TABEL
1 Daftar sampel lapangan/daun yang digunakan dalam penelitian 4 2 Daftar sampel umbi yang digunakan dalam penelitian 6 3 Jenis gejala yang diperoleh dari lokasi pengambilan sampel
lapangan 12
4 Hasil deteksi virus dari sampel tanaman bawang berdasarkan reaksi
ELISA 13
5 Jumlah persentase dan rata-rata infeksi virus dari jenis sampel
bawang lapangan 14
6 Jumlah persentase dan rata-rata infeksi virus dari jenis sampel
bawang umbi 14
7 Pengujian titer antibodi dan antigen yang diserap dengan metode
DIBA pada GCLV 17
8 Pengujian titer antibodi dan antigen yang diserap dengan metode
DAS-ELISA pada GCLV 17
9 Pengujian titer antibodi dan antigen yang diserap dengan metode
DIBA pada SLV 17
10 Pengujian titer antibodi dan antigen yang diserap dengan metode
TAS-ELISA pada SLV 18
11 Pengujian titer antibodi dan antigen yang diserap dengan metode I-
ELISA pada Potyvirus 18
12 Pengujian titer antibodi dan antigen yang diserap dengan metode
DAFTAR GAMBAR
1 Keadaan lahan pertanaman bawang pada saat pengambilan sampel daun. a) lahan bawang merah di Jawa Barat, b) lahan bawang merah di Jawa Tengah, dan c) lahan bawang putih di Jawa Barat 5 2 Sampel umbi/benih yang digunakan dalam penelitian. a) benih
bawang merah dari Brebes, b) umbi bawang merah dari Cirebon, c) umbi bawang merah dari Bogor, dan d) umbi bawang putih dari
Bogor 5
3 Keadaan sampel umbi yang ditanam di rumah kasa (berumur 24 HST). a) bawang merah asal Cirebon, b) bawang merah asal Brebes,
dan c) Bawang putih asal Bogor 6
4 Sampel daun yang dibawa ke laboratorium untuk ditimbang dan disimpan pada suhu -80 0C. a), b), dan c) sampel daun bawang merah,
dan d) sampel daun bawang putih 6
5 Ketentuan respon reaksi pada metode DIBA. a) reaksi negatif (-), b)
reaksi lemah (+), c) reaksi kuat (++), dan d) reaksi sangat kuat (+++) 10 6 Gejala pada sampel daun bawang merah dan bawang putih. (a)
mosaik kuning (b) mosaik hijau muda, (c) bergaris kuning, (d) daun pipih bergaris kuning pucat di tengah, (e) keriting, (f) bercak kuning,
dan (g) permukaan atas daun berlekuk 11
DAFTAR LAMPIRAN
1 Deskripsi varietas bawang yang digunakan dalam penelitian 24 2 Tahapan metode deteksi serologi DAS-ELISA (a), TAS-ELISA (b),
I-ELISA (c), dan DIBA (d) (Albersio et al.2012) 26 3 Nilai absorbansi ELISA (NAE) pada sampel lapangan bawang
merah dan bawang putih 27
4 Nilai absorbansi ELISA (NAE) pada sampel umbi bawang merah
8 Nilai absorbansi ELISA pada pengujian GCLV 35
9 Nilai absorbansi ELISA pada pengujian SLV 35
PENDAHULUAN
Latar Belakang
Tanaman bawang-bawangan (Allium) merupakan komoditas pertanian yang memiliki nilai ekonomi tinggi dan memiliki banyak manfaat, diantaranya berguna untuk bumbu, sayuran, obat, dan tanaman hias. Kebutuhan pasar dunia akan jenis sayuran ini sangat tinggi, begitu pula kebutuhan nasional. Meskipun iklim, musim, dan lahan di Indonesia mendukung budidaya tanaman bawang, namun produksi bawang di Indonesia sangat terbatas, bahkan beberapa spesies bawang harus diimpor (Cahyono 2003). Terdapat beberapa spesies Allium yang sering dibudidayakan di Indonesia, tetapi umumnya dua spesies bawang yang paling sering dikonsumsi masyarakat, yaitu bawang merah (Allium cepa L.) dan bawang putih (A. sativum L.).
Bawang merah (A. cepa L.) merupakan komoditas sayuran yang diprioritaskan pada usaha tani lahan kering. Tanaman bawang merah hampir tersebar di semua wilayah Indonesia terutama di daerah dataran rendah. Produksi bawang merah Indonesia pada tahun 2008, 2009, dan 2010 cenderung mengalami peningkatan, yaitu 853 615, 965 164, dan 1 048 934 ton, tetapi pada tahun 2011 produksi nasional mengalami penurunan menjadi 893 124 ton, kemudian pada tahun 2012 produksinya mengalami peningkatan menjadi 960 072 ton. Produksi bawang merah pada tahun 2012 yang tergolong tinggi terdapat di beberapa provinsi, yaitu Jawa Tengah, Jawa Timur, Jawa Barat, Nusa Tenggara Barat, dan Sumatera Barat, berturut-turut 381 813, 222 862, 115 896, 100 989, dan 35 838 ton (Badan Pusat Statistika 2013).
2
Faktor penyebab rendahnya produksi bawang merah dan bawang putih secara nasional adalah lahan yang semakin sempit, kurangnya penanganan tentang ketersediaan infrastruktur dan pascapanen, kurangnya pengetahuan budidaya dan teknologi yang memadai bagi petani, keadaan iklim yang tidak menentu, sulitnya mendapatkan umbi atau benih yang berkualitas tinggi di pasaran, dan faktor biotik terutama gangguan oleh OPT (Organisme Pengganggu Tanaman) (Duriat dan Ratnawati 2008).
Bawang merah dan bawang putih di Indonesia selalu diperbanyak secara vegetatif, sehingga diduga tidak ada klon atau benih yang bebas dari penyakit. Penyakit pada bawang merah dan bawang putih yang bersifat tular benih dapat berasal dari kelompok bakteri, cendawan, nematoda, dan virus. Bakteri terbawa benih bawang diantaranya Pseudomonas allicola Starr et Burkh dan Xanthomonas
campestris penyebab penyakit bercak daun. Alternaria porri penyebab penyakit
bercak ungu, Botryotinia squamosa penyebab penyakit hawar daun, Botrytis alli
penyebab penyakit busuk leher batang, Cladosporium alli-cepae penyebab penyakit bercak daun, Fusarium spp. penyebab penyakit layu atau busuk umbi,
Peronospora destructor penyebab penyakit busuk daun, Sclerotium cepivorum
penyebab penyakit busuk putih, dan Stemphylium vesicarium penyebab penyakit hawar daun kropak merupakan cendawan-cendawan yang bersifat tular benih. Nematoda Ditylenchus dipsaci dilaporkan menyerang akar bawang dan bersifat tular benih juga. Virus tular benih yang dapat menyebabkan penyakit pada tanaman bawang diantaranya Shallot latent virus (SLV) dan Onion yellow dwarf
virus (OYDV) (Diekmann 1997; Semangun 2010).
Lebih lanjut dilaporkan oleh Diekmann (1997) bahwa kelompok virus yang umum menginfeksi tanaman bawang-bawangan, berasal dari genus Carlavirus,
Potyvirus, dan Allexivirus. Virus utama pada tanaman bawang dan dilaporkan
menyebabkan kerugian ekonomis diantaranya SLV dan Garlic common latent
virus (GCLV) anggota Carlavirus, OYDV, Shallot yellow stripe virus (SYSV),
dan Leek yellow stripe virus (LYSV) anggota Potyvirus, Mite-born filamentous
virus (MbFV) anggota Allexivirus. Di Indonesia infeksi LYSV, SLV, dan OYDV
telah dilaporkan pada bawang di Lembang dan Subang (Duriat dan Sukarna 1990; Wulandari et al. 2002). Gunaeni et al. (2011) melaporkan insiden penyakit virus tular umbi dan mendeteksi infeksi OYDV, SYSV, dan gabungan OYDV dan SYSV. Penelitian terbaru oleh Kurniawan (2012) berhasil mendeteksi SYSV dari bibit bawang merah lokal varietas Jawa dan Brebes.
Metode yang umum dilakukan untuk mendeteksi virus tanaman, yaitu metode serologi Dot immunobinding assay (DIBA) dan Enzyme linked
immunosorbent assay (ELISA) serta metode molekuler Reverse
transcription-polymerase chain reaction (RT-PCR). Fajardo et al. (2001) melaporkan
amaranticolor dan C. quinoa; (2) pengujian titer antiserum OYDV dengan metode serologi Indirect-ELISA (I-ELISA); dan (3) pengujian molekuler RT-PCR untuk mengkonfirmasi hasil pengujian titer antiserum pada metode serologi (I- ELISA). Berdasarkan hasil deteksi menggunakan metode serologi Direct-ELISA melaporkan adanya infeksi OYDV (85%), SYSV (95%), dan gabungan OYDV dan SYSV (85%) dari tiga belas variaetas bawang merah asal Jawa Barat dan Jawa Tengah (Gunaeni et al. 2011). Kurniawan (2012) menggunakan metode RT-PCR dan berhasil mendeteksi SYSV dari bibit bawang merah lokal varietas Jawa dan Brebes dengan kejadian penyakit berturut-turut 60% dan 53%. Kenyataan masih kurangnya informasi mengenai jenis-jenis virus yang menginfeksi tanaman bawang di Indonesia menjadi latar belakang penelitian ini.
Metode deteksi virus yang akurat sangat menentukan hasil pemantauan penyakit di lapangan maupun skrining untuk memperoleh benih bebas virus. Teknik serologi terutama DIBA dan ELISA merupakan teknik canggih yang menjanjikan untuk deteksi dan identifikasi patogen tumbuhan (Seal dan Elpninstone 1994; Converse dan Martin 1990). Teknik serologi dapat diterima secara luas oleh penggunanya, terutama untuk mendeteksi virus dalam jumlah banyak. Bahan yang diuji dapat langsung berupa ekstrak tanaman sakit tanpa harus mengisolasi patogennya terlebih dahulu. Bila dibandingkan antara metode DIBA dan ELISA, metode DIBA relatif lebih sederhana, cepat, ekonomis, dan tingkat sensitivitas antibodinya lebih tinggi dibandingkan ELISA (Suryadi et al.
2009). Pengujian sensitivitas metode deteksi diperlukan untuk menentukan metode diagnosis virus-virus yang menginfeksi bawang.
Tujuan Penelitian
Penelitian bertujuan mendeteksi keberadaan virus-virus utama bawang merah (A. cepa L.) dan bawang putih (A. sativum L.) dari sentra pertanaman bawang di daerah Jawa Barat dan Jawa Tengah dengan menggunakan metode deteksi serologi (ELISA) dan mengetahui persentase infeksi virus di lapangan dan infeksi virus terbawa benih, serta mengetahui perbedaan tingkat sensitivitas antara metode DIBA dan ELISA untuk mendeteksi virus-virus utama bawang.
Manfaat Penelitian
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan dengan dua tahap, tahap pertama ialah survei dan pengambilan sampel dari beberapa pertanaman bawang di daerah Jawa Barat dan Jawa Tengah dimulai dari bulan Desember 2012 sampai April 2013. Tahap kedua, yaitu deteksi virus dilakukan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dimulai dari bulan Februari sampai September 2013.
Metode Penelitian
Penelitian terdiri dari empat kegiatan, yaitu (1) survei dan pengambilan sampel lapangan berupa daun bergejala dan umbi; (2) penanaman umbi di rumah kasa; (3) deteksi virus dari sampel lapangan dan sampel umbi; (4) uji sensitivitas metode DIBA dan ELISA.
Survei dan Pengambilan Sampel Lapangan
Sampel daun bergejala. Sampel daun diambil dari pertanaman bawang merah dan bawang putih di Bandung, Bantul, Brebes, dan Cirebon. Jenis varietas yang ditanam berbeda dari satu daerah dengan daerah lainnya. Sampel daun yang diperoleh dari lapangan berasal dari varietas bawang yang berbeda karena penanaman jenis bawang di masing-masing daerah ditentukan oleh petani setempat. Sampel bawang merah dari Balai Penelitian Tanaman Sayuran, Desa Cikole, Kecamatan Lembang, Kabupaten Bandung adalah varietas Maja dan Trisula. Sampel bawang merah varietas Crok kuning dan Biru berasal dari Desa Sri gading, Kecamatan Sanden, Kabupaten Bantul. Sampel bawang merah dari Desa Pengabean, Kecamatan Losari, Kabupaten Brebes dan Desa Pangenan, Kecamatan Pangenan, Kabupaten Cirebon adalah varietas Bima curut. Sampel bawang putih adalah varietas Lokal dari Desa Alamendah, Kecamatan Rancabali, Kabupaten Bandung (Tabel 1).
Sampel daun yang diambil dari masing-masing lokasi sebanyak 35 sampel daun yang menunjukkan gejala penyakit, yaitu gejala mosaik kuning, mosaik hijau muda, bergaris kuning, daun pipih bergaris kuning pucat di tengah, keriting, bercak kuning, dan permukaan atas daun berlekuk. Sebanyak 14 sampel daun selanjutnya dipilih untuk tahap deteksi virus.
Tabel 1 Daftar sampel lapangan/daun yang digunakan dalam penelitian
Jenis sampel Varietas Asal sampel (Desa, Kecamatan, Kabupaten)
Bawang merah Maja dan Trisula Cikole, Lembang, Bandung Bawang merah Crok kuning dan Biru* Sri gading, Sanden, Bantul Bawang merah Bima curut Pengabean, Losari, Brebes Bawang merah Bima curut Pangenan, Pangenan, Cirebon
Bawang putih Lokal Alamendah, Rancabali, Bandung
Gambar 1 Keadaan lahan pertanaman bawang pada saat pengambilan sampel daun. a) lahan bawang merah di Jawa Barat, b) lahan bawang merah di Jawa Tengah, dan c) lahan bawang putih di Jawa Barat
Sampel Umbi. Umbi diperoleh dari petani (Brebes dan Cirebon) dan dari pasar (Bogor) (Tabel 2). Umbi yang diperoleh memiliki ukuran (diameter umbi) yang berbeda-beda tergantung pada status penggunaannya. Umbi bawang merah asal Brebes rata-rata berukuran 1.5 cm dengan status penggunaan untuk benih, sedangkan umbi bawang merah dan bawang putih asal Cirebon dan Bogor diperuntukkan sebagai umbi bawang konsumsi dengan ukuran berkisar 1 cm sampai 2 cm (Gambar 2). Umbi yang digunakan untuk benih biasanya ditanam lebih lama dibandingkan umbi yang digunakan untuk konsumsi dan biasanya ukuran umbi untuk konsumsi lebih besar dibandingkan untuk bibit (Wulandari 2011).
Seperti halnya dengan sampel daun, sampel umbi berasal dari varietas yang berbeda tergantung asal daerahnya. Sampel umbi bawang merah dari Desa Tanjung, Kecamatan Tanjung, Kabupaten Brebes dan Desa Pangenan, Kecamatan Pangenan, Kabupaten Cirebon adalah varietas Bima curut. Sampel umbi bawang merah dan bawang putih asal Kabupaten Bogor yang diperoleh dari toko Agrolestari Desa Babakan, Kecamatan Dramaga varietasnya tidak diketahui (Tabel 2).
Sampel umbi yang diambil dari masing-masing lokasi ditanam sebanyak 50 sampel umbi, kemudian diambil 14 sampel daun yang selanjutnya dipilih untuk tahap deteksi virus.
Gambar 2 Sampel umbi/benih yang digunakan dalam penelitian. a) benih bawang merah dari Brebes, b) umbi bawang merah dari Cirebon, c) umbi bawang merah dari Bogor, dan d) umbi bawang putih dari Bogor
a b c
6
Tabel 2 Daftar sampel umbi yang digunakan dalam penelitian
Jenis sampel Varietas
Asal sampel (Desa, Kecamatan,
Kabupaten)
Bawang merah Bima curut Tanjung, Tanjung, Brebes Bawang merah Bima curut Pangenan, Pangenan, Cirebon Bawang merah Tidak diketahui Babakan, Dramaga, Bogor Bawang putih Tidak diketahui Babakan, Dramaga, Bogor
Penanaman Sampel Umbi di Rumah Kasa
Umbi bawang yang diperoleh dari lapangan atau pasar ditanam di rumah kasa selama 24 hari atau sampai muncul daun tunas (Gambar 3). Sebelum ditanam, bagian ujung umbi/benih dipotong ± 1.0 cm untuk mempercepat pertumbuhan. Penanaman menggunakan baki semai, dengan media tanam tanah dan pupuk dengan perbandingan 1:1 (b:b).
Deteksi Virus
Sampel daun dari lapangan dan hasil penanaman umbi dibawa ke Laboratorium Virologi Tumbuhan untuk ditimbang sebanyak 0.1 g daun dari masing-masing sampel, kemudian dimasukkan ke dalam kantung plastik, selanjutnya disimpan pada suhu -80 0C atau langsung digunakan untuk deteksi virus dengan metode ELISA (Gambar 4).
Gambar 3 Keadaan sampel umbi yang ditanam di rumah kasa (berumur 24 HST). a) bawang merah asal Cirebon, b) bawang merah asal Brebes, dan c) Bawang putih asal Bogor
Gambar 4 Sampel daun yang dibawa ke laboratorium untuk ditimbang dan disimpan pada suhu -80 0C. a), b), dan c) sampel daun bawang merah, dan d) sampel daun bawang putih
a b c d
Deteksi virus dilakukan dengan metode ELISA menggunakan tiga jenis antibodi secara terpisah, yaitu antibodi spesifik GCLV dan SLV, dan antibodi umum Potyvirus. Metode ELISA untuk masing-masing antibodi mengikuti pedoman yang dianjurkan untuk masing-masing kit, yaitu metode DAS-ELISA untuk GCLV, metode TAS-ELISA untuk SLV, dan metode I-ELISA untuk
Potyvirus. Deteksi virus ini dilakukan untuk mengetahui ada tidaknya ketiga
macam virus target pada sampel uji. Hasil pengujian dengan metode ELISA kemudian digunakan untuk menentukan persentase infeksi virus, yaitu dengan rumus sebagai berikut:
Persentase infeksi virus = jumlah sampel terinfeksi x 100% jumlah sampel yang diuji
Deteksi virus dilanjutkan dengan membandingkan sensitivitas dua metode serologi, yaitu metode DIBA dan ELISA.
Deteksi GCLV dengan Double antibody sandwich-ELISA (DAS-ELISA).
Metode DAS-ELISA dilakukan berdasarkan panduan prosedur kit ELISA (DSMZ). Teknik deteksi diawali dengan mengencerkan antibodi pertama GCLV dalam coating buffer (pH 9.6) [air destilata 1000 ml, 1.59 g sodium carbonate
(Na2CO3), 2.93 g sodium bicarbonate (NaHCO3), dan 0.20 g sodium azide
(NaN3)] dengan perbandingan 1:1000 (v:v), kemudian antibodi yang sudah
diencerkan dimasukkan ke dalam plat mikrotiter sebanyak 100 µl per sumuran. Plat kemudian diinkubasi selama 2 jam pada suhu 37 0C. Setelah inkubasi, cairan dalam plat mikrotiter dibuang dan plat dicuci menggunakan PBST 100 µl per sumuran [phosphat buffer saline tween per 1000 ml air destilata, 8.0 g sodium
chloride (NaCl), 0.2 g monobasic potassium phosphate (KH2PO4), 1.15 g dibasic
sodium phosphate (Na2HPO4), 0.2 g potassium chloride (KCl), 0.2 g sodium azide
(NaN3), dan 0.5 ml Tween-20 per liter] sebanyak 5 kali.
Tahap deteksi selanjutnya yaitu menyiapkan antigen. Antigen disiapkan dengan menggerus 0.1 g daun yang diberi extraction buffer (pH 7.4) [200 ml PBST + 2% PVP (polyvinyl pyrrolidone)] dengan perbandingan 1:10 (b:v). Sebanyak 100 µl antigen diisikan pada sumuran plat mikrotiter secara duplo, dan sebagai pembanding sumuran plat mikrotiter diisi dengan 100 µl extraction buffer, ekstrak tanaman bawang sehat (kontrol negatif), ekstrak tanaman sampel (kontrol positif). Plat mikrotiter kemudian diinkubasi semalaman pada suhu 4 0C.
Setelah inkubasi, cairan dalam plat mikrotiter dibuang dan plat dicuci menggunakan PBST seperti tahapan sebelumnya. Antibodi spesifik kedua GCLV kemudian dimasukkan pada sumuran sebanyak 100 µl setelah dilakukan
8
positif jika nilai absorban sampel yang diuji 2 kali lebih besar daripada kontrol negatif tanaman sehat.
Deteksi SLV dengan Triple antibody sandwich-ELISA (TAS-ELISA).
Metode TAS-ELISA dilakukan berdasarkan panduan prosedur kit ELISA (DSMZ). Teknik deteksi diawali dengan mengencerkan antibodi SLV dalam
coating buffer (pH 9.6) dengan perbandingan 1:1000 (v:v), kemudian antibodi
yang sudah diencerkan dimasukkan ke dalam plat mikrotiter sebanyak 100 µl per sumuran. Plat kemudian diinkubasi selama 2 jam pada suhu 37 0C. Setelah inkubasi, cairan dalam plat mikrotiter dibuang dan plat dicuci menggunakan PBST 100 µl per sumuran sebanyak 5 kali.
Tahap deteksi selanjutnya yaitu menyiapkan antigen. Antigen disiapkan dengan menggerus 0.1 g daun bawang yang diberi extraction buffer dengan perbandingan 1:10 (b:v). Sebanyak 100 µl antigen diisikan pada plat mikrotiter secara duplo, dan sebagai pembanding sumuran plat mikrotiter diisi dengan 100
µl extraction buffer, ekstrak tanaman bawang sehat (kontrol negatif), ekstrak
tanaman sampel (kontrol positif). Plat mikrotiter kemudian diinkubasi semalam pada suhu 4 0C.
Setelah inkubasi, cairan dalam plat mikrotiter dibuang dan plat dicuci menggunakan PBST seperti tahapan sebelumnya. Antibodi spesifik kedua SLV dimasukkan pada sumuran plat mikrotiter sebanyak 100 µl setelah dilakukan pengenceran menggunakan conjugate buffer dengan perbandingan 1:500 (v:v). Plat mikrotiter kemudian diinkubasi pada suhu 37 0C selama 2 jam kemudian dicuci menggunakan PBST sebanyak 5 kali. Selanjutnya antibodi ketiga SLV dimasukkan pada sumuran plat mikrotiter setelah diencerkan menggunakan
conjugate buffer dengan perbandingan 1:1000 (v:v). Plat kemudian diinkubasi
pada suhu 37 0C selama 2 jam, setelah itu dicuci kembali dengan PBST seperti tahap sebelumnya.
Tahapan terakhir adalah memasukkan 100 µl substrat solution yang telah dicampur PNP ke dalam sumuran plat mikrotiter. Plat mikrotiter tersebut kemudian diinkubasi dalam ruang gelap pada suhu ruang selama 15 menit sampai 60 menit. Plat mikrotiter kemudian diamati seperti dijelaskan sebelumnya pada metode DAS-ELISA.
Deteksi Potyvirus dengan Indirect-ELISA (I-ELISA). Metode I-ELISA dilakukan berdasarkan panduan prosedur kit ELISA (DSMZ). Teknik deteksi I-ELISA disebut juga dengan nama Antigen-Coated-Plat ELISA (ACP-ELISA). Teknik deteksi diawali dengan menggerus 0.1 g daun bawang yang diberi coating
buffer pH 9.6 yang ditambahkan 0.05 M DIECA (100 ml coating buffer + 0.855 g
DIECA) dengan perbandingan 1:10 (b:v). Sebanyak 100 µl antigen diisikan pada sumuran plat mikrotiter secara duplo, dan sebagai pembanding sumuran plat mikrotiter diisi dengan 100 µl coating buffer yang mengandung 0.05 M DIECA, ekstrak tanaman bawang sehat (kontrol negatif), ekstrak tanaman bawang terinfeksi virus (kontrol positif), kemudian plat tersebut diinkubasi semalaman pada suhu 4 0C. Setelah inkubasi, cairan dalam plat mikrotiter dibuang dan plat dicuci menggunakan PBST sebanyak 8 kali.
Antibodi kedua Potyvirus kemudian dimasukkan pada sumuran sebanyak 100 µl setelah dilakukan pengenceran menggunakan conjugate buffer dengan perbandingan 1:1000 (v:v). Plat mikrotiter kemudian diinkubasi pada suhu 37 0C selama 2 jam, setelah itu dicuci dengan PBST seperti tahap sebelumnya.
Tahapan terakhir adalah memasukkan 100 µl substrat solution yang telah dicampur PNP ke dalam sumuran plat mikrotiter. Plat mikrotiter tersebut kemudian diinkubasi dalam ruang gelap pada suhu ruang selama 15 menit sampai 60 menit. Plat mikrotiter kemudian diamati seperti dijelaskan sebelumnya pada metode DAS-ELISA.
Metode Dot Immunobinding Assay (DIBA). Metode DIBA dilakukan berdasarkan metode Asniwita (2013). Metode DIBA adalah metode deteksi berdasarkan prinsip serologi ELISA tetapi perbedaan terdapat pada bahan untuk melakukan pengujian. Metode DIBA menggunakan bahan untuk deteksi berupa kertas membran, sehingga penyerapan atau cara kerja dalam penyerapan bahan bekerja lebih efektif dibandingkan metode ELISA yang menggunakan plat mikrotiter yang terbuat dari Polystirene. Reaksi positif pada metode DIBA ditunjukkan dengan perubahan warna bening menjadi ungu pada membran
nitroselulosa yang telah ditetesi cairan tanaman, sedangkan reaksi positif pada
pengujian ELISA ditunjukkan dengan perubahan warna bening menjadi kuning pada plat mikrotiter.
Masing-masing sampel digerus dalam tris buffer saline (TBS) dengan perbandingan 1:10 (b:v) (TBS: Tris-HCl 0.02 M dan NaCl 0.15 M, pH 7.5). Suspensi tanaman selanjutnya diteteskan ke atas membran nitroselulosa sebanyak
4 μl. Setelah tetesan sampel kering, membran direndam di dalam 10 ml larutan
blocking non fat milk 2% dalam TBS yang mengandung Triton X-100 dengan
konsentrasi akhir 2%. Membran kemudian diinkubasi pada suhu ruang sambil digoyang dengan kecepatan 50 rpm selama 1 jam dengan menggunakan EYELA
multi shaker. Membran kemudian dicuci 5 kali dengan dH2O, tiap pencucian Membran selanjutnya direndam dalam 2.5 ml TBS yang mengandung konjugat
2.5 μl (Antibodi kedua) ditambah non fat milk dengan konsentrasi akhir 2% dan
kemudian membran diinkubasi selama 60 menit sambil digoyang dengan kecepatan 50 rpm. Membran selanjutnya dicuci kembali dengan TBST dan direndam selama 5 menit dalam 10 ml bufer AP (Tris-HCl 0.1 M, NaCl 0.1 M, MgCl2 5 mM, dan air) yang mengandung 1 tablet nitro blue tetrazolium (NBT)
dan bromo chloro indolil phosphate (BCIP). Bila reaksi positif akan terjadi
perubahan warna putih menjadi ungu pada membran nitroselulosa yang telah ditetesi cairan tanaman dan reaksi dapat dihentikan dengan merendam membran dalam dH2O.
Pengujian Sensitivitas Metode DIBA dan ELISA
10
Evalusi metode DIBA dan ELISA untuk pengujian sensitivitas dilakukan dengan perlakuan pengenceran antigen dan antibodi 100 sampai 10-7. Respon reaksi ELISA ditentukan sebagai berikut: reaksi negatif (-) bila NAE < 2 kali NAE kontrol negatif; reaksi lemah (+) bila NAE 2-5 kali NAE kontrol negatif; reaksi kuat (++) bila NAE 5-8 kali NAE kontrol negatif; dan reaksi sangat kuat (+++) bila NAE> 8 kali NAE kontrol negatif (Damayanti 2010). Respon reaksi untuk metode DIBA ditentukan berdasarkan intensitas warna yang muncul pada membran (Gambar 5):
Gambar 5 Ketentuan respon reaksi pada metode DIBA. a) reaksi negatif (-), b) reaksi lemah (+), c) reaksi kuat (++), dan d) reaksi sangat kuat (+++)
HASIL DAN PEMBAHASAN
Gejala Infeksi Virus pada Tanaman Bawang di Lapangan
Sampel bawang yang diperoleh dari daerah Jawa Barat dan Jawa Tengah menunjukkan gejala infeksi virus yang berbeda-beda. Gejala tersebut dapat dikelompokkan menjadi tujuh jenis, yaitu (a) gejala mosaik kuning, (b) mosaik hijau muda, (c) bergaris kuning, (d) daun pipih bergaris kuning pucat di tengah, (e) keriting, (f) bercak kuning, dan (g) permukaan atas daun berlekuk (Gambar 6).
Berdasarkan pengamatan gejala di lapangan diketahui bahwa jenis gejala yang paling dominan, yaitu mosaik kuning dan bergaris kuning yang diperoleh dari semua lokasi sampel uji (Bandung, Bantul, Brebes, dan Cirebon), sedangkan jenis gejala yang paling sedikit ditemukan, yaitu gejala permukaan atas daun berlekuk yang ditemukan pada sampel bawang putih dari Bandung. Keragaman gejala tertinggi ditemukan di daerah Brebes dengan lima jenis gejala (mosaik kuning, mosaik hijau muda, bergaris kuning, daun pipih bergaris kuning pucat di tengah, dan keriting), sedangkan keragaman gejala terendah ditemukan di daerah Bandung dengan tiga jenis gejala (mosaik kuning, bergaris kuning, dan daun pipih bergaris kuning pucat ditengah) (Tabel 3).
Gambar 6 Gejala pada sampel daun bawang merah dan bawang putih. (a) mosaik kuning (b) mosaik hijau muda, (c) bergaris kuning, (d) daun pipih bergaris kuning pucat di tengah, (e) keriting, (f) bercak kuning, dan (g) permukaan atas daun berlekuk
g f
e d
c b
12
Tabel 3 Jenis gejala yang diperoleh dari lokasi pengambilan sampel lapangan
No Jenis gejala
BM, Bawang merah; BP, Bawang putih; b +, gejala ditemukan; -, gejala tidak ditemukan
Gejala mosaik bergaris hijau dan bergaris kuning juga dilaporkan oleh Gunaeni (2011) pada bawang merah di Jawa Barat dan Jawa Tengah yang terinfeksi OYDV dan SYSV. Berbeda dengan Klukakcova et al. (2004) yang melaporkan bahwa infeksi SLV dan GCLV seringkali tidak menunjukkan gejala visual yang jelas. Oleh karena itu untuk mengetahui virus-virus yang menginfeksi bawang di lapangan, perlu dilakukan deteksi di laboratorium menggunakan metode yang akurat dan cukup sensitif, misalnya ELISA dan (RT) PCR.
Hasil Deteksi Virus pada Sampel Daun dari Lapangan
Berdasarkan hasil ELISA terdeteksi infeksi tiga jenis virus, GCLV, SLV,
dan Potyvirus baik secara tunggal maupun bersama-sama (infeksi campuran)
(Tabel 4). Sampel dengan gejala mosaik kuning terinfeksi oleh ketiga virus, baik infeksi tunggal, ganda, maupun ketiganya (campuran 3 virus). Selain pada gejala mosaik kuning, jenis infeksi tunggal dan campuran ketiga virus sangat bervariasi. Sebagai contoh, pada gejala mosaik hijau muda hanya terdeteksi Potyvirus dan campuran GCLV, SLV, dan Potyvirus; pada gejala bercak kuning terdeteksi
Potyvirus, campuran SLV dan Potyvirus, campuran GCLV, SLV, dan Potyvirus;
pada gejala permukaan atas daun berlekuk tidak terdeteksi GCLV. Infeksi tunggal virus terutama terjadi oleh Potyvirus. Dilaporkan bahwa Potyvirus yang banyak menginfeksi bawang merah dan bawang putih diantaranya OYDV, SYSV, dan LYSV (Klukackova et al. 2004; Lunello et al. 2007; Gunaeni 2011; Kurniawan 2012). Deteksi menggunakan antibodi spesifik untuk kelompok Potyvirus perlu dilakukan untuk memastikan jenis Potyvirus yang menginfeksi bawang di Jawa Barat dan Jawa Tengah.
Infeksi campuran beberapa virus merupakan fenomena yang sering ditemukan pada penyakit yang disebabkan oleh virus. Dilaporkan bahwa tanaman cabai dapat terinfeksi oleh beberapa virus, misalnya infeksi ganda Chili veinal
mottle virus (ChiVMV) dengan Cucumber mosaic virus (CMV) dapat
Tabel 4 Hasil deteksi virus dari sampel tanaman bawang berdasarkan reaksi ELISA
a
MK, Mosaik kuning; MH, Mosaik hijau muda;GK, Bergaris kuning; PB, Pipih bergaris kuning pucat di tengah; K, Keriting; BK, Bercak kuning; AB, Permukaan atas daun berlekuk; b GCLV, Garlic common latent virus; SLV, Shalot latent virus
Bos (1990) menyatakan bahwa mekanisme penularan infeksi virus tanaman diantaranya dapat terjadi secara mekanis, penyambungan tanaman, penularan dengan tali putri (Cuscuta sp.), melalui alat perkembang biakan vegetatif, melalui biji dan serbuk sari, melalui vektor (serangga dan tungau), serta penularan oleh organisme penghuni tanah (nematoda). Mekanisme infeksi virus bawang umumnya terjadi melalui penularan secara mekanis dengan gesekan antar daun, alat perkembang biakan vegetatif (terbawa umbi), dan penularan melalui vektor (kutudaun dan tungau). Serangga jenis kutudaun yang dilaporkan paling banyak menjadi vektor virus pada tanaman bawang, diantaranya Myzus persicae, M.
ascalonicum, dan Aphis fabae (Diekmann 1997), sedangkan Aceria tulipae,
Rhizoglyphus echinopus, R. setosus, dan Caloglyphus spp. merupakan vektor jenis
tungau yang menyebabkan infeksi virus pada bawang (Kurniawan 2012). Virus bawang yang ditularkan secara mekanis, yaitu SYSV dan MbFV, sedangkan SLV dan OYDV merupakan virus tular benih. Jenis virus yang ditularkan melalui vektor, yaitu GCLV, LYSV, OYDV, SYSV, dan MbFV (Diekmann 1997).
Rata-rata persentase infeksi virus pada jenis sampel lapangan dari lima daerah pengambilan sampel berkisar antara 0% sampai 92.86% (Tabel 5). Infeksi tunggal oleh Potyvirus ditemukan pada semua sampel, infeksi GCLV hanya terdapat pada sampel bawang merah asal Bandung, infeksi SLV ditemukan pada sampel bawang merah asal Bandung, Bantul, dan Cirebon. Infeksi ganda SLV dan
Potyvirus tidak terdeteksi pada bawang merah asal Bandung, infeksi ganda
tersebut ditemukan pada sampel bawang merah asal Bantul, Brebes, dan Cirebon, serta sampel bawang putih asal Bandung. Infeksi ganda GCLV dan Potyvirus
hanya ditemukan pada sampel bawang putih asal Bandung, sedangkan infeksi ganda GCLV dan SLV tidak ditemukan sama sekali pada semua sampel. Infeksi campuran 3 virus GCLV, SLV, dan Potyvirus ditemukan pada sampel bawang merah asal Bantul dan Brebes, serta bawang putih asal Bandung (Tabel 5).
14 Tabel 5 Jumlah persentase dan rata-rata infeksi virus dari jenis sampel bawang lapangan
a
BM, Bawang merah; BP, Bawang putih
Tabel 6 Jumlah persentase dan rata-rata infeksi virus dari jenis sampel bawang umbi/benih
a BM, Bawang merah; BP, Bawang putih
Jenis dan asal sampel lapangana
Varietas
∑ sampel positif virus/∑ sampel yang diuji (%) Rata-rata infeksi virus
Rata-rata infeksi virus target 7.14 7.14 25.71 0 8.57 24.29 20
Jenis dan asal
sampel umbia Varietas
∑ sampel positif virus/∑ sampel yang diuji (%) Rata-rata infeksi virus
Berdasarkan pengujian sampel lapangan bawang merah dan bawang putih diketahui bahwa rata-rata infeksi virus target dari masing-masing daerah pengujian sampel berkisar antara terendah 11.22% (bawang merah varietas Maja dan Trisula asal Bandung) sampai tertinggi 14.29% (bawang merah varietas Bima curut asal Brebes dan Cirebon serta bawang putih varietas lokal asal Bandung) (Tabel 5). Infeksi tertinggi berturut-turut disebabkan oleh Potyvirus (25.71%), SLV dan Potyvirus (24.29%), GCLV, SLV, dan Potyvirus (20%), GCLV dan
Potyvirus (8.57%), GCLV (7.14%), SLV (7.14%), sedangkan infeksi ganda
GCLV dan SLV tidak terdeteksi pada semua sampel (Tabel 5).
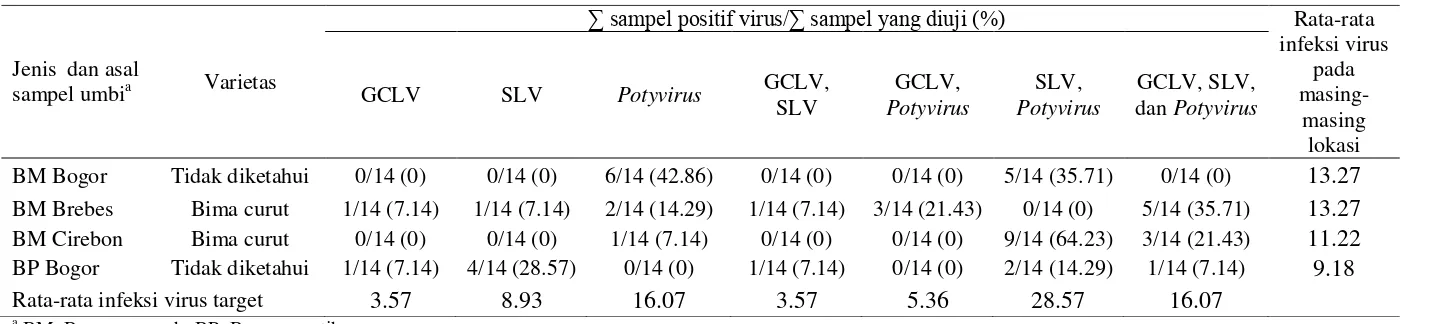
Hasil Deteksi Virus pada Sampel Umbi
Seperti halnya pada sampel daun lapangan, sampel umbi bawang merah dan bawang putih terinfeksi lebih dari satu virus. Sampel umbi bawang merah asal Brebes dan bawang putih asal Bogor terinfeksi virus tunggal GCLV dan SLV, sedangkan infeksi tunggal Potyvirus ditemukan pada sampel bawang merah asal Bogor, Brebes, dan Cirebon. Infeksi ganda GCLV dan SLV ditemukan pada sampel bawang merah asal Brebes dan bawang putih asal Bogor. Infeksi SLV dan
Potyvirus ditemukan pada sampel umbi bawang merah Cirebon dan Bogor serta
bawang putih Bogor. Infeksi GCLV dan Potyvirus hanya terdeteksi pada sampel umbi bawang merah asal Brebes, sedangkan infeksi campuran GCLV dan SLV
dan Potyvirus ditemukan pada sampel umbi bawang merah asal Brebes, Cirebon,
dan bawang putih asal Bogor (Tabel 6).
Berdasarkan pengujian sampel umbi bawang merah dan bawang putih diketahui bahwa rata-rata infeksi virus target dari masing-masing daerah pengujian sampel berkisar antara terendah 9.18% (bawang putih asal Bogor) sampai tertinggi 13.27% (bawang merah asal Bogor dan Brebes) (Tabel 6). Infeksi tertinggi berturut-turut disebabkan oleh SLV dan Potyvirus (28.57%), GCLV, SLV, dan Potyvirus (16.07%), Potyvirus (16.07%), SLV (8.93%), GCLV
dan Potyvirus (5.36%), GCLV (3.57%), GCLV dan SLV (3.57%) (Tabel 6).
16
Perbandingan Sensitivitas Metode DIBA dan ELISA
Metode DIBA dan ELISA merupakan metode deteksi serologi yang paling banyak dilakukan untuk diagnosis virus tumbuhan. Hasil deteksi dengan metode DIBA untuk ketiga virus target menunjukkan reaksi yang sama. Metode DIBA mampu mendeteksi ketiga virus sampai pada pengenceran antibodi 10-7 dengan pengenceran antigen sampai 10-1 (Tabel 7, 9, dan 11). Metode DIBA memberikan hasil lebih baik dibandingkan metode ELISA yang hanya mampu mendeteksi ketiga virus target pada pengenceran antibodi 100, walaupun antigen dapat diencerkan sampai 10-7 (Tabel 8, 10, dan 12).
Tingkat sensitivitas metode DIBA untuk antibodi Potyvirus relatif tinggi karena mampu mendeteksi antigen virus sampai pengenceran 10-2 dengan antibodi pada pengenceran 10-1 dan10-2. Tingkat sensitivitas metode DIBA untuk antibodi GCLV dan SLV tergolong rendah karena hanya mampu mendeteksi antigen virus target sampai pengenceran 10-1 dengan antibodi yang tidak diencerkan (100). Metode ELISA hanya mampu mendeteksi virus target dengan pengenceran antibodi sampai 10-1 untuk GCLV pada pengenceran antibodi 100 dapat mendeteksi antigen sampai pengenceran 10-7, untuk SLV pengenceran antibodi tertinggi 10-1 dapat mendeteksi antigen sampai pengenceran 10-1, untuk Potyvirus
pengenceran antibodi 10-1 dapat mendeteksi antigen sampai pengenceran 100. Perbedaan sensitivitas metode DIBA dan ELISA telah dilaporkan pada pengujian jenis virus lain. Opriana (2009) melaporkan bahwa pada pengujian ChiVMV metode I-ELISA mampu mendeteksi ChiVMV hingga tingkat pengenceran antigen 10-4 sedangkan metode DIBA hanya mampu mendeteksi antigen ChiVMV sampai batas pengenceran 10-3. Anggraini (2011) melaporkan bahwa metode I-ELISA mampu mendeteksi Bean common mosaic virus (BCMV) sampai pengenceran antigen 10-3 sedangkan DIBA mampu mendeteksi BCMV sampai pengenceran 10-5.
Tabel 7 Pengujian titer antibodi dan antigen yang diserap dengan metode DIBA pada GCLV
Pengenceran Ab Pengenceran Ag K(-) Bufer
100 10-1 10-2 10-3 10-4 10-5 10-6 10-7
Pengenceran Ab Pengenceran Ag K(-) Bufer
100 10-1 10-2 10-3 10-4 10-5 10-6 10-7
Pengenceran Ab Pengenceran Ag K(-) Bufer
18
Tabel 10 Pengujian titer antibodi dan antigen yang diserap dengan metode TAS- ELISA pada SLV
Pengenceran Ab Pengenceran Ag K(-) Bufer
100 10-1 10-2 10-3 10-4 10-5 10-6 10-7
Tabel 11 Pengujian titer antibodi dan antigen yang diserap dengan metode DIBA pada Potyvirus
Pengenceran Ab Pengenceran Ag K(-) Bufer
SIMPULAN DAN SARAN
Infeksi GCLV, SLV, dan Potyvirus berhasil terdeteksi dari sampel bawang merah dan bawang putih dari daerah Jawa Barat (Bandung, Bogor, dan Cirebon) dan Jawa Tengah (Brebes) serta Yogyakarta (Bantul). Masing-masing virus menginfeksi secara tunggal atau bersama (infeksi campuran). Rata-rata persentase infeksi virus di lapangan berkisar antara 11.22% sampai 14.29%, sedangkan pada sampel umbi berkisar antara 9.18% sampai 13.27%. Metode serologi DIBA dan ELISA dapat digunakan sebagai metode deteksi untuk virus pada tanaman bawang. Metode DIBA mampu mendeteksi GCLV, SLV, dan Potyvirus sampai pengenceran antibodi 10-7, sedangkan metode ELISA hanya mampu mendeteksi pada pengenceran 100.
DAFTAR PUSTAKA
Akin HM. 2005. Kepatogenan satelit RNA yang berasosiasi dengan Cumcumber
mosaic virus (CMV-satRNA) pada tanaman cabai. Jurnal HPT Tropika.
1(5):37-41.
Albersio J, Lima A, Kelly AQ, Nascimento, Radelli P, Purcifull E. 2012. Serology Applied to Plant Virology, Serological Diagnosis of Certain Human, Animal and Plant Diseases. Di dalam: Dr. Moslih Al-Moslih. Editor. ISBN: 978-mosaik pada kacang panjang (Vigna sinensis L.) berdasarkan teknik serologi dan PCR [Skripsi]. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor. Asniwita, Hidayat SH, Suastika G, Sujiprihati S, Sausanto S, Hayati I. 2012. Eksplorasi isolat lemah Chili veinal mottle virus pada tanamancabai di Jambi, Sumatera Barat, dan Jawa Barat. J.Hort. 22(2):181-186.
Bagi F, Stojsin V, Budakov D, Salma MAE, Varga JG. 2012. Effect of Onnion
yellow dwarf virus (OYDV) on yield components of fall garlic (Allium
sativum L.) in Serbia. African Journal of Agricultural Research. [Internet].
[diunduh 2012 Desember 15]; 7(15):2386-2390. Doi: 10.5897/AJAR11.1772.
Bos L. 1990. Pengantar Virologi Tumbuhan. Triharso, penerjemah. Yogyakarta (ID): Gadjah Mada University Press. Terjemahan dari: Introduction to Plant Virology.
[BPS] Badan Pusat Statistik. 2013. Luas Panen, Produksi dan Produktivitas Bawang Merah dan Bawang Putih [Internet]. [diunduh 2013 Februari 3]. Tersedia pada: http://www.bps.go.id/tab_sub?view.php.
Cahyono B. 2003. Bawang Merah. Semarang (ID): Aneka Ilmu.
Converse RH, Martin RR. 1990. ELISA methods for plant viruses in Hampton. Di dalam: Ball RE, Boer SD. Editor. Serological Methods for Detection and Identification of Viral and Bacterial Plant Patogens. APS Press, St Paul, Minn. hlm 179-196.
Damayanti TA. 2010. Sebaran dan respon ketahanan lima kultivar bengkuang
(Pachyrhizus erosus (L.) Urban) terhadap penyakit mosaik. Agrovigor.
2(3):95-101.
Diekmann M. 1997. FAO/IPGRI Technical Guidelines for the Safe Movement of Germplasm. No. 18. Allium spp.. Roma (IT): Food and Agriculture Organization of the United Nations, Rome/International Plant Genetik Resources Institute, rome.
Duriat AS, Ratnawati ML. 2008. Pengaruh suhu dan waktu pemanasan benih umbi terhadap resistensi dan degradasi virus pada bawang putih (Allium
sativum). Di dalam: Hadisoeganda WW et al.. Editor. Peningkatan
Nasional Pekan Kentang; 2008 Agustus 20-21; Lembang. Bandung (ID). hlm 712-723.
Fajardo TVM, Nishijima M, Buso JA, Torres AC, Avila AC, Resende RO. 2001. Garlic viral complex: Identifikation of Potyviruses and Carlaviruses in Central Brazil. Fitopatologia Brasileira. 26(3):619-626.
Gunaeni N, Wulandari AW, Duriat AS, Muharam A. 2011. Insiden penyakit tular umbi pada tigabelas varietas bawang merah asal Jawa Barat dan Jawa Tengah. Jurnal Hortikultura. 21(2):164-172.
Klukackova J, Navratil M, Vesela M, Havranek P, Safarova D. 2004. Occurrence of garlic viruses in the Czech republic. Acta fytotechnica. 16(7):126-128. Kurniawan A. 2012. Deteksi dan identifikasi virus dan tungau pada bibit bawang
merah impor dan lokal [Tesis]. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor.
Lunello P, Rienzo JD, Conci VC. 2007. Yield loss in garlic by Leek yellow stripe
virus Argentina isolate. Plant Disease. [Internet]. 91(2):153-158. doi:
10.1094/PDIS-91-2-0153.
Mahmoud SYM, Maaty SAAE, Borollosy AME, Ghaffar MHA. 2008. Identifikasi of Onion yellow dwarf Potyvirus as one of the major viruses infecting garlic in Egypt. International Journal of Virology. 4(1):1-3.
Mavric I, Ravnikar M. 2005. A Carlavirus serologically closely related to carnation latent virus in Slovenian garlic. Acta Agriculture Slovenica.
85(2):343-349.
Opriana E. 2009. Metode deteksi untuk pengujian respon ketahanan beberapa genotipe cabai terhadap infeksi Chilli veinal mottle potyvirus (ChiVMV) [Tesis]. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor.
Semangun H. 2000. Penyakit-Penyakit Tanaman Hortikultura di Indonesia. Ed. ke-4: Yogyakarta (ID).
Shah H, Khalid S, Ahmad I. 2001. Prevalence and distribution of four pepper viruses in Sindh, Punjab and North west frontier province. J. Of Biological
Science 1(4):214-217.
Subekti D, Hidayat SH, Nurhayati E, Sujiprihati S. 2006. Infeksi Cucumber
mosaic virus dan Chili veinal mottle virus terhadap pertumbuhan dan hasil
tanaman cabai. Hayati. 13(2):53-57.
Suryadi Y, Manzila I, Machmud M. 2009. Potensi pemanfaatan perangkat diagnostik ELISA serta variannya untuk deteksi patogen tanaman. Jurnal
Agro Biogen. 5(1):39-48.
Sutarya R, Duriat AS. 1991. Respon beberapa kultivar cabai terhadap Cucumber
mosaic virus (CMV) Tobacco etch virus (TEV) dan campuran dari
CMV+TEV. Bul Penel. Hort. 21(1):72-76.
Van Dijk P. 1993. Carlavirus isolates from cultivated Allium sp. represent three viruses. Netherlands Journal of Plant Pathology. 99(1993):233-257.
Weeraratne WAPG, Yappa DR. 2002. Reaction of chili accessions to local isolates of Cucumbar mosaic virus and Chili veinal mottle virus. Annals of
the Sri Lanka Department of Agriculture. 4:345-352.
Wulandari N. Editor. 2011. Petunjuk Praktis Bertanam Bawang. Jakarta (ID): Agromedia.
Seal S. dan dan Elpninstone J. 1994. Advances in identification and detection of
22
and its Cause live agent, P. Solanacearum. CAB International, Wallingford,
UK. hlm 42-57.
24
Lampiran 1 Deskripsi varietas bawang yang digunakan dalam penelitian 1. Nama varietas : Bima curut
Deskripsi varietas: Menurut lampiran SK. Menteri Pertanian No. 594/Kpts/TP 290/8/1984
Varietas Bima curut merupakan bawang merah lokal asli Brebes. Varietas ini mampu menghasilkan 10 ton/ha umbi kering, dengan bobot susut panen rentan terhadap penyakit busuk daun (Phytophthora porii), tetapi tahan terhadap penyakit busuk umbi (Botyritis allii). Di Brebes tanaman ini jarang berbunga dan daunnya berbentuk silinder berlubang.
2. Nama varietas : Crok kuning
Deskripsi varietas: Menurut Balai Penelitian Sayuran (1996)
Varietas ini berasal dari daerah Sidapurna, Brebes, Jawa Tengah. Umur tanaman dari saat tanam sampai panen adalah 59-65 hari. Tinggi tanaman berkisar antara 36-45 cm. Secara alami tanaman ini dapat berbunga di musim kemarau. Bentuk bunga seperti payung dengan warna putih. Jumlah bunga setiap tangkai 130-180 kuntum, sedang jumlah buah setiap tangkai berkisar 80-110 buah. Tangkai bunga setiap rumpun rata-rata 25 tangkai. Biji berbentuk bulat-gepeng, keriput dengan warna hitam. Produksi umbi kering berkisar antara 11.2-17.3 ton/ha kering. Susut bobot umbi dari basah ke kering 22.5%. Bentuk umbi bulat lonjong dengan bagian leher agak besar, warna umbi merah muda. Tahan terhadap penyakit busuk umbi (Botritis sp.), tetapi peka terhadap penyakit bercak ungu (Alternaria porri) dan antraknosa (Colletotrichum sp.). Varietas ini cocok untuk ditanam di dataran rendah pada musim kemarau.
Keunggulan varietas Crok kuning adalah dapat tumbuh pada musim hujan. Sayangnya, kemampuan produksi varietas bawang yang satu ini tergolong rendah, hanya mampu menghasilkan 7 ton/ha. Tinggi tanaman mencapai 44 cm dengan jumlah daun maksimal 35 helai. Satu rumpun memilik 10 anakan.
3. Nama varietas : Maja
Deskripsi varietas: Menurut lampiran SK. Menteri Pertanian No: 597/Kpts/TP 290/8/1984
(basah-kering) 24.9%. Cukup tahan terhadap busuk umbi (Botrytis alli). Peka terhadap penyakit busuk ujung daun (Phytophthora porri). Kultivar ini baik untuk dataran rendah dan dataran tinggi.
4. Nama varietas : Trisula
Deskripsi varietas: Menurut Balai Penelitian Tanaman Sayuran (2011)
26
(a)
(b)
Lampiran 2 Tahapan metode deteksi serologi DAS-ELISA (a), TAS-ELISA (b), I-ELISA (c), dan DIBA (d) (Albersio et al.2012)
(c)
Lampiran 3 Lanjutan...
No Sampel dan Varietas
Jenis antibodi
GCLV SLV Potyvirus
Bawang putih Bandung
1 Bufer 0.18 0.15 0.16
2 K(-) 0.32 0.34 0.38
3 K(+) 0.33 0.33 0.33
4 K(+) 0.15 0.15 1.52
5 1-BP Lokal 0.62 0.27 2.53
6 2-BP Lokal 0.54 0.29 1.96
7 3-BP Lokal 0.56 0.17 2.69
8 4-BP Lokal 0.59 0.12 2.18
9 5-BP Lokal 0.19 0.66 1.80
10 6-BP Lokal 0.50 0.57 2.39
11 7-BP Lokal 0.52 0.27 2.55
12 8-BP Lokal 0.56 0.12 2.81
13 9-BP Lokal 0.39 0.51 0.46
14 10-BP Lokal 0.51 0.92 2.50
15 11-BP Lokal 0.44 0.42 2.47
16 12-BP Lokal 0.18 0.19 2.98
17 13-BP Lokal 0.65 0.36 2.70
30
Lampiran 4 Nilai absorbansi ELISA (NAE) pada sampel umbi bawang merah dan bawang putih
No Sampel dan varietas Jenis antibodi
Lampiran 4 Lanjutan…
No Sampel dan varietas Jenis antibodi
32
100 10-1 10-2 10-3 10-4 10-5 10-6 10-7
Ag Ab
Lampiran 5 Hasil deteksi GCLV menggunakan metode DIBA (a) dan DAS-ELISA (b)
Pengenceran Antibodi
Pengenceran antigen
K (-) Bufer 100 10-1 10-2 10-3 10-4 10-5 10-610-7
100
10-1
10- 2
10-3
10-4
10-5
10-6
10-7
100 10-1 10-2 10-3 10-4 10-5 10-6 10-7 K (-) Bufer b)
100 10-1 10-2 10-3 10-4 10-5 10-6 10-7 Ab
Ag
Lampiran 6 Hasil deteksi SLV menggunakan metode DIBA (a) dan TAS-ELISA (b)
Pengenceran antibodi
Pengenceran antigen
K (-) Bufer 100 10-1 10-2 10-3 10-4 10-5 10-6 10-7
100
10-1
10- 2
10-3
10-4
10-5
10-6
10-7
100 10-1 10-2 10-3 10-4 10-5 10-6 10-7 K (-) Bufer a)
34
100 10-1 10-2 10-3 10-4 10-5 10-6 10-7
Ag Ab
a)
Lampiran 7 Hasil deteksi Potyvirus menggunakan metode DIBA (a) dan I-ELISA (b)
Pengenceran Antibodi
Pengenceran antigen
K (-) Bufer 100 10-1 10-2 10-3 10-4 10-5 10-6 10-7
100 10-1 10-2 10-3 10-4 10-5 10-6 10-7 K (-) Bufer b)
100
10-1
10- 2
10-3
10-4
10-5
10-6
Lampiran 9 Nilai absorbansi ELISA pada pengujian GCLV
Lampiran 10 Nilai absorbansi ELISA pada pengujian SLV
RIWAYAT HIDUP
Penulis dilahirkan di Cirebon, Jawa Barat pada tanggal 16 September 1991. Penulis merupakan anak kedua dari tiga bersaudara pasangan Bapak Jamian dan Ibu Mistina. Penulis menyelesaikan Pendidikan di MA Negeri Model Babakan, Ciwaringin, Cirebon pada tahun 2009. Pada tahun 2009 penulis diterima di IPB melalui jalur seleksi Penerimaan Beasiswa Santri Berprestasi (PBSB) CSS MoRA IPB, diterima di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Selama menempuh pendidikan di IPB, penulis aktif dalam kegiatan kemahasiswaan, diantaranya sebagai pengurus CSS MoRA IPB Divisi Sosial Lingkungan periode 2010/2011 dan Pengembangan Sumber Daya Manusia periode 2011/2012, Bendahara Panitia Bina Ekspo Pesantren tahun 2010, panitia National Plant Protection 2011, dan Sekretaris Panitia Gebyar Prestasi Santri Nasional tahun 2012.