SELEKSI BAKTERI KANDIDAT PROBIOTIK UNTUK PENGHAMBATAN PATOGEN Streptococcus agalactiae TIPE NON-HEMOLITIK PADA IKAN NILA Oreochromis niloticus SECARA IN VITRO DAN IN VIVO
RAHMAT FIRDAUS
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
ABSTRACT
RAHMAT FIRDAUS. Selection of Probiotics Candidate Bacteria to Inhibiting Non-hemolytic Type Streptococcus agalactiae Pathogen on Tilapia Oreochromis niloticus by In Vitro and In Vivo Experiments. Supervised by MUNTI YUHANA and WIDANARNI.
Non-hemolytic type Streptococcus agalactiae is one of pathogenic bacterial strains causing the Streptococcosis in Tilapia. One of alternative
Streptococcosis control is using probiotics bacteria. This research aimed to isolate and to select candidate bacteria as well as to evaluate their antagonistic capability against non-hemolytic type S. agalactiae. In vitro antagonistic test by co-culture of S. agalactiae StR with 10 isolates of probiotics candidate and control with two replications; in vivo antagonistic test by co-injection method of non-hemolytic type S. agalactiae and a isolate of chosen probiotic candidate. The treatments applied including preventing simulation (A), co-injection (B), curative simulation (C), negative control (D), and positive control (E) each with three replications. All data analyzed statistically by one-way ANOVA. Based on in vitro
test, isolate L1k showed the best antagonistic activity and showed as non-pathogenic to Tilapia. Observation results of in vivo test showed that the highest survival rate (SR) showed by treatment D (90,0±10,0 %) and significantly different (P<0,05) compared to those of other treatments. Treatment C showed the SR 43,3±15,3 % and not significantly different to that of treatment A (33,3±11,5 %) and E (26,7±5,8 %), but significantly different to that of treatment B (20,0±10,0 %). Clinical symptoms descriptively were not significantly different between treatments injected by non-hemolytic type S. agalactiae, but significantly different with negative control. Feed consumption decreased in fish injected by non-hemolytic type S. agalactiae, although control was normal. Fish haematology did not show significantly different (P>0,05) at all treatments.
Key words: Non-hemolytic type Streptococcus agalactiae, probiotics bacteria,
ABSTRAK
RAHMAT FIRDAUS. Seleksi Bakteri Kandidat Probiotik untuk Penghambatan Patogen Streptococcus agalactiae Tipe Non-hemolitik pada Ikan Nila
Oreochromis niloticus secara In Vitro dan In Vivo. Dibimbing oleh MUNTI YUHANA dan WIDANARNI.
Streptococcus agalactiae tipe non-hemolitik merupakan salah satu strain bakteri patogen penyebab penyakit Streptococcosis yang menyerang ikan nila. Salah satu alternatif pengendalian penyakit Streptococcosis yang dapat dilakukan adalah menggunakan bakteri probiotik. Penelitian ini bertujuan mengisolasi bakteri kandidat probiotik dari media budidaya dan usus berbagai jenis ikan air tawar serta menguji kemampuan antagonistik kandidat tersebut terhadap S. agalactiae tipe non-hemolitik. Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL) yaitu uji antagonitik in vitro dengan metode kultur bersama S. agalactiae StR dengan 10 isolat kandidat probiotik dan kontrol dengan dua ulangan; serta uji antagonistik in vivo dengan metode injeksi bersama S. agalactiae tipe non-hemolitik dan satu isolat kandidat probiotik terpilih dengan perlakuan simulasi pencegahan (A), injeksi bersama (B), simulasi pengobatan (C), kontrol negatif (D), dan kontrol positif (E) dengan tiga ulangan. Berdasarkan hasil uji in vitro, isolat L1k menunjukkan aktivitas antagonis terbaik dan terbukti tidak patogen terhadap ikan nila. Hasil pengamatan pada uji in vivo
menunjukkan bahwa tingkat kelangsungan hidup (SR) perlakuan D paling tinggi (90,0±10,0 %) dibandingkan perlakuan lainnya (P<0,05). Perlakuan C mampu mempertahankan SR sebesar 43,3±15,3 % tidak berbeda nyata dengan perlakuan A (33,3±11,5 %) dan E (26,7±5,8 %), namun berbeda nyata terhadap perlakuan B (20,0±10,0 %). Gejala klinis secara deskriptif tidak berbeda antar perlakuan yang diinjeksi dengan S. agalactiae tipe non-hemolitik, namun berbeda dengan kontrol negatif. Konsumsi pakan terjadi penurunan pada ikan yang diinjeksi dengan S. agalactiae tipe non-hemolitik, sedangkan konsumsi pakan pada kontrol negatif normal. Hematologi ikan tidak menunjukkan perbedaan yang signifikan (P>0,05) pada semua perlakuan.
SELEKSI BAKTERI KANDIDAT PROBIOTIK UNTUK PENGHAMBATAN PATOGEN Streptococcus agalactiae TIPE NON-HEMOLITIK PADA IKAN NILA Oreochromis niloticus SECARA IN VITRO DAN IN VIVO
RAHMAT FIRDAUS
SKRIPSI
sebagai salah satu syarat memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi dan Manajemen Perikanan Budidaya
Departemen Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul “Seleksi Bakteri Kandidat Probiotik untuk Penghambatan Patogen Streptococcus agalactiae Tipe Non-hemolitik pada Ikan Nila Oreochromis niloticus secara In Vitro dan In Vivo” adalah benar merupakan karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka pada bagian akhir skripsi ini.
Bogor, Agustus 2012
PENGESAHAN
Judul Skripsi : Seleksi Bakteri Kandidat Probiotik untuk Penghambatan Patogen Streptococcus agalactiae Tipe Non-hemolitik pada Ikan Nila Oreochromis niloticus secara In Vitro dan In Vivo
Nama Mahasiswa : Rahmat Firdaus
Nomor Pokok : C14060213
Menyetujui,
Pembimbing I
Dr. Munti Yuhana, S.Pi, M.Si. NIP. 19691220 199403 2 002
Pembimbing II
Dr. Ir. Widanarni, M.Si. NIP. 19670927 199403 2 001
Mengetahui,
Ketua Departemen Budidaya Perairan
Dr. Ir. Sukenda, M.Sc. NIP. 19671013 199302 1 001
KATA PENGANTAR
Puji serta syukur kehadirat Allah SWT atas rahmat dan karunia-Nya sehingga penulis mampu menyelesaikan penelitian dan penulisan skripsi ini dengan baik. Penelitian dengan judul “Seleksi Bakteri Kandidat Probiotik untuk Penghambatan Patogen Streptococcus agalactiae Tipe Non-hemolitik pada Ikan Nila Oreochromis niloticus secara In Vitro dan In Vivo” dilaksanakan sejak
Januari 2011 sampai dengan April 2012 di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Dr. Munti Yuhana, S.Pi, M.Si. dan Dr. Ir. Widanarni, M.Si. selaku Komisi Pembimbing, Dr. Ir. Mia Setiawati, M.Si. selaku Dosen Penguji serta Dr. Ir. Tatag Budiardi, M.Si. selaku Komisi Pendidikan yang telah membantu pembimbingan serta perbaikan skripsi ini. Tidak lupa penulis mengucapkan terima kasih tak berhingga kepada kedua orang tua (Ibu Ir. Eka Meinarsih dan Ayah Ir. Wittari Heiza) yang selalu memberikan dukungan terbaik kepada penulis. Terima kasih kepada laboran LKI (Pak Ranta dan Kang Adna) serta staf TU BDP (Mbak Yuli, Pak Maryanta, Kang Asep, Mang Adi, dan Opie) atas perhatian dan bantuan yang sangat berarti. Terkhusus kepada adik-adik tercinta (Mukhlis Pribadi, Taufik Hikmatriyadi, Ridho Nasrullah, dan Annisa Rizki Mardiah), Al„izzers, DPMers, Buroq43ers, Warga FPIK, serta Awak Samudra 43 terima kasih atas semangat, pengingatan serta keceriaan yang selalu diberikan kepada penulis. Terima kasih sedalam-dalamnya kepada LKIers 2009-2012 (Bang Rahman, Bu Ayu, Bang Rusli, Ewa, Ulfi, Dwi, Trian, Ghita, Hendar, Ezy, Vika, Kak Eza, Fariq, Andini, Isni, Ikbal, Uyung, Kak Arif, Dama, Ririn, Nurlita, Dijah, Yue, Mumun, Kak Wika, Bang Abi, Bu Dian, Bu Lani, Bu Woro, Bu Rini, Dendi, Titi, Retno, Jeni, Lita, Nora, Wahyu, Kak Manda, dan lainnya yang tak bisa disebut satu per satu) dan BDP 40-47 atas bantuan, ilmu dan persahabatan yang telah diberikan kepada penulis selama perkuliahan, penelitian dan penyusunan skripsi.
Semoga skripsi ini dapat memberi manfaat bagi penulis, pembaca dan perkembangan pengetahuan di bidang perikanan budidaya.
Bogor, Agustus 2012
RIWAYAT HIDUP
Penulis dilahirkan di Kota Agung, Kabupaten Tanggamus, Lampung pada tanggal 25 Mei 1988, merupakan anak pertama (5 bersaudara) dari pasangan ibu Ir. Eka Meinarsih dan ayah Ir. Wittari Heiza. Pendidikan formal terakhir yang dilalui penulis adalah SMAN 3 Padang, Gunung Pangilun, Kota Padang, Sumatera Barat (lulus tahun 2006). Penulis diterima di Institut Pertanian Bogor pada tahun 2006 melalui jalur Seleksi Masuk Perguruan Tinggi Negeri (SMPTN) dan menyelesaikan Tingkat Persiapan Bersama (TPB) pada tahun 2007 lalu diterima pada Mayor Teknologi dan Manajemen Perikanan Budidaya, Depertemen Budidaya Perairan, FPIK IPB pada tahun yang sama.
Selama menjalani studi di IPB, penulis pernah menjadi asisten pada mata kuliah Pendidikan Agama Islam semester genap TA. 2008/2009, Manajemen Kesehatan Akuakultur TA. 2009/2010, Penyakit Organisme Akuatik TA. 2010/2011 dan 2011/2012. Selain itu, penulis juga tergabung sebagai anggota Organisasi Mahasiswa Daerah Sumatera Barat (IPMM Bogor), aktif dalam kepengurusan organisasi intrakampus Dewan Perwakilan Mahasiswa (DPM) TPB IPB tahun kepengurusan 2006/2007, DPM FPIK IPB 2007/2008 dan 2008/2009, Majelis Permusyawaratan Mahasiswa Keluarga Mahasiswa (MPM KM) IPB 2008/2009 dan 2009/2010, serta DPM KM IPB 2009/2010. Penulis pernah melaksanakan kegiatan Praktik Lapangan Akuakultur pada usaha Pembenihan Ikan Koi Cyprinus carpio di Kelompok Pembudidaya Ikan Koi “Sumber Harapan” Desa Kemloko, Kabupaten Blitar, Jawa Timur.
Sebagai salah satu syarat memperoleh gelar sarjana dalam bidang perikanan dari FPIK IPB, penulis melakukan penelitian dan menyusun skripsi dengan judul “Seleksi Bakteri Kandidat Probiotik untuk Penghambatan Patogen
ix
2.1 Rancangan Penelitian... 3
2.2 Isolasi Bakteri Kandidat Probiotik ... 3
2.3 Uji Aktivitas Amilolitik dan Proteolitik ... 4
2.4 Uji Sensitivitas Antibiotik ... 4
2.5 Penyiapan Bakteri Resisten Antibiotik... 5
2.6 Uji Antagonistik In Vitro... 5
2.7 Uji Patogenisitas Kandidat Probiotik... 6
2.8 Uji Antagonistik In Vivo ... 6
2.9 Parameter Pengamatan... 9
2.9.1 Konsumsi Pakan ... 9
2.9.2 Survival Rate (SR)... 9
2.9.3 Gejala Klinis ... 9
2.9.4 Hematologi Ikan ... 9
2.9.4.1 Perhitungan Total Eritrosit ... 10
2.9.4.2 Perhitungan Total Leukosit ... 10
2.9.4.3 Perhitungan Kadar Hematokrit ... 11
2.9.4.4 Perhitungan Kadar Hemoglobin ... 11
2.10 Identifikasi Isolat Bakteri ... 11
2.11 Analisis Data ... 11
III. HASIL DAN PEMBAHASAN ... 13
3.1 Isolasi Bakteri Kandidat Probiotik ... 13
3.2 Uji Aktivitas Amilolitik dan Proteolitik ... 14
3.3 Uji Sensitivitas Antibiotik ... 16
3.4 Penyiapan Bakteri Resisten Antibiotik... 18
3.5 Uji Antagonistik In Vitro... 18
3.6 Uji Patogenisitas Kandidat Probiotik... 21
3.7 Uji Antagonistik In Vivo ... 24
x
IV. KESIMPULAN DAN SARAN ... 39
4.1 Kesimpulan ... 39
4.2 Saran ... 39
DAFTAR PUSTAKA ... 40
xi DAFTAR TABEL
Halaman
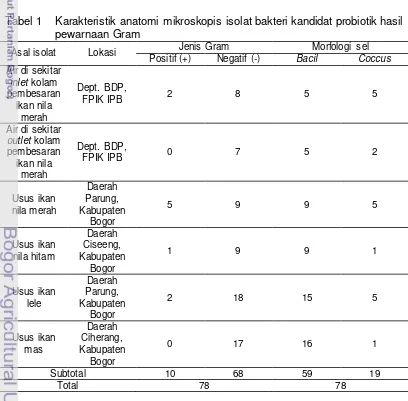
1. Karakteristik anatomi mikroskopis isolat bakteri kandidat probiotik hasil pewarnaan Gram... 13
2. Sepuluh isolat terpilih yang menunjukkan aktivitas amilolitik dan proteolitik terbesar ... 15
3. Sensitivitas kandidat probiotik dan Sa5 terhadap beberapa jenis antibiotik . 16
xii DAFTAR GAMBAR
Halaman
1. Jadwal perlakuan dan sampling selama uji antagonistik in vivo ... 8
2. Hasil uji aktivitas enzim (a) Amilolitik (b) Proteolitik ... 14
3. Uji sensitivitas bakteri terhadap antibiotik Streptomisin 50 μg/mℓ... 16
4. Isolat patogen Sa5 resistensi terhadap antibiotik Streptomisin pada media BHIA + Strep50 ... 18
5. Kepadatan patogen S. agalactiae StR hasil uji antagonistik in vitro dengan metode kultur bersama kandidat probiotik... 20
6. Zona hambat yang dihasilkan kandidat probiotik terhadap patogen dengan metode cawan gores... 21
7. Survival rate (SR) harian selama uji patogenisitas... 22
8. Ikan perlakuan injeksi NB21b yang mengalami kematian pascainjeksi... 22
9. Survival rate (SR) akhir uji patogenisitas... 23
10. Konsumsi pakan harian selama uji antagonistik in vivo ... 24
11. Survival rate (SR) harian selama uji antagonistik in vivo ... 25
12. Survival rate (SR) pada akhir uji antagonistik in vivo ... 26
13. Perubahan pola renang ikan nila pascainjeksi S. agalactiae ... 28
14. Gejala klinis pada organ mata dan tubuh ikan nila... 29
15. Gejala klinis berupa pembengkakan perut dan organ dalam ikan nila ... 30
16. Total eritrosit selama uji antagonistik in vivo ... 32
17. Total leukosit selama uji antagonistik in vivo... 33
18. Kadar hematokrit selama uji antagonistik in vivo ... 35
xiii DAFTAR LAMPIRAN
Halaman
1. Asal dan kode isolat serta hasil identifikasi jenis Gram dan morfologi sel ... 45
2. Analisis statistik uji antagonistik in vitro dengan metode kultur bersama kandidat probiotik dan patogen S. agalactiae StR ... 47
3. Hubungan kekeruhan sampel terhadap kepadatan sel dari isolat asal kolam pembesaran ikan nila merah (K2ic); asal usus ikan nila hitam (NB13a, NB13b, NB21b); asal usus ikan nila merah (RN11a, RN21c, RN21f, RN21g); asal usus ikan lele (L1k, L2m); dan patogen S. agalactiae tipe non-hemolitik (Sa5) ... 48
4. Analisis statistik survival rate (SR) ikan nila pada akhir uji patogenisitas kandidat probiotik ... 52
5. Analisis statistik survival rate (SR) ikan nila pada akhir uji antagonistik in vivo ... 53
6. Gejala klinis harian selama uji antagonistik in vivo ... 54
7. Analisis statistik total eritrosit ikan nila selama uji antagonistik in vivo ... 58
8. Analisis statistik total leukosit ikan nila selama uji antagonistik in vivo... 59
9. Analisis statistik kadar hematokrit ikan nila selama uji antagonistik in vivo.. 60
1 I. PENDAHULUAN
1.1 Latar belakang
Ikan nila Oreochromis niloticus merupakan ikan konsumsi yang digemari masyarakat Indonesia dan termasuk dalam 10 komoditas yang menjadi target peningkatan produksi perikanan budidaya nasional. Target produksi perikanan budidaya nasional hingga tahun 2014 adalah 353%. Produksi ikan nila pada tahun 2008 sebesar 291.037 ton, 2009 meningkat menjadi 323.389 ton dan pada tahun 2010 menjadi 469.173 ton. Angka kenaikan produksi ikan nila dari tahun 2009-2010 adalah 45,08% dengan kenaikan rata-rata tahun 2006-2010 sebesar 29,75% (KKP 2010). Berdasarkan data tersebut, angka produksi ikan nila nasional per tahun masih diharapkan untuk dapat bertambah hingga akhir 2014.
Kegiatan budidaya ikan nila masih mengalami berbagai kendala. Salah satu kendala tersebut yaitu serangan penyakit yang sedang mewabah di berbagai wilayah Indonesia pada lima tahun terakhir ini yakni penyakit
Streptococcosis, yang sebagian besar disebabkan oleh bakteri patogen
Streptococcus agalactiae dan Streptococcus iniae (Hardi 2011). Gejala klinis penyakit Streptococcosis akibat serangan kedua jenis bakteri patogen tersebut hampir sama yaitu berenang lemah, cara berenang yang abnormal, exopthalmia
pada salah satu ataupun kedua mata, dan warna tubuh yang menghitam (Eldar
et al. 1994a). Kedua jenis bakteri ini merupakan bakteri penyebab penyakit yang sering ditemukan sepanjang waktu hampir pada seluruh sentra budidaya ikan nila. Dari hasil pemeriksaan 1000 isolat bakteri yang berasal dari 74 lokasi di 14 negara termasuk Indonesia, kedua jenis bakteri ini ditemukan hampir setengah dari bakteri yang teridentifikasi (Sheehan et al. 2009). Lebih lanjut juga dilaporkan bahwa akhir-akhir ini S. agalactiae lebih sering ditemukan dengan virulensi lebih tinggi dibandingkan S. iniae. Menurut Hardi (2011), S. agalactiae
isolat 5 tipe non-hemolitik merupakan salah satu strain S. agalactiae dengan virulensi tinggi. Dengan demikian kematian massal yang disebabkan oleh serangan patogen tersebut dikhawatirkan akan menjadi salah satu penyebab kerugian atau kegagalan produksi ikan nila.
Solusi penanggulangan penyakit Streptococcosis yang disebabkan oleh
2 bakteri biokontrol sebagai probiotik. Vine et al. (2004) menyebutkan, dari usaha yang telah dilakukan, penggunaan bakteri probiotik merupakan cara yang dianggap paling aman. Penggunaan probiotik secara luas untuk meningkatkan produksi telah memberikan hasil yang lebih baik, murah dan efektif dalam meningkatkan kesehatan hewan dibandingkan penggunaan antibiotik atau bahan kimia lainnya. Penggunaan antibiotik secara terus menerus juga dikhawatirkan dapat menyebabkan terjadinya resistensi bakteri patogen terhadap antibiotik tersebut. Selain itu, meningkatnya isu mengenai keamanan pangan dan keamanan lingkungan menjadi faktor pembatas dalam penggunaan antibiotik.
Perlu diketahui bahwa mekanisme kerja probiotik pun didefinisikan secara beragam. Menurut Fuller (1992) probiotik merupakan makanan tambahan dalam bentuk mikroba hidup yang memberi pengaruh yang menguntungkan bagi inang dengan meningkatkan keseimbangan mikroba dalam saluran pencernaan, seperti Lactobacillus sp., Bacillus sp., Saccharomyces cerevisiae, serta
Aspergillus oryzae. Irianto (2003) menyampaikan bahwa pada dasarnya terdapat tiga mekanisme kerja probiotik antara lain, menekan populasi mikroba melalui kompetisi dengan memproduksi senyawa-senyawa antimikroba atau melalui kompetisi nutrisi dan tempat pelekatan pada saluran pencernaan; mengubah metabolisme mikrobial dengan meningkatkan atau menurunkan aktivitas enzim; dan menstimulus imunitas melalui peningkatan kadar antibodi atau aktivitas makrofag.
1.2 Tujuan
3 II. METODE
2.1 Rancangan Penelitian
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) dengan 6 perlakuan dan 2 ulangan pada uji patogenisitas, serta 4 perlakuan dan 3 ulangan pada uji antagonistik in vivo. Model statistik RAL yang digunakan berdasarkan Steel dan Torrie (1982):
Dimana:
Yij = Data respon yang diamati pada perlakuan ke-i dan ulangan ke- j µ = Nilai tengah data
βi = Pengaruh perlakuan ke- i
εij = Galat percobaan pada perlakuan ke- i dan ulangan ke- j
2.2 Isolasi Bakteri Kandidat Probiotik
Bakteri kandidat probiotik diisolasi dari air kolam pembesaran ikan nila merah Departemen BDP, FPIK IPB dan saluran pencernaan (usus) berbagai macam ikan budidaya air tawar. Kolam pembesaran tersebut menggunakan sistem budidaya intensif, terdapat satu kincir air listrik pada bagian tengah serta
inlet dan outlet yang terus dialiri air. Ikan yang digunakan adalah ikan nila
Oreochromis niloticus yang berasal dari daerah Ciseeng, Kabupaten Bogor, ikan nila merah Oreochromis sp. yang berasal dari daerah Parung, Kabupaten Bogor, ikan lele Clarias batrachus yang berasal dari daerah Parung, Kabupaten Bogor, serta ikan mas Cyprinus carpio yang berasal dari daerah Ciherang, Kabupaten Bogor.
Air kolam sebagai larutan stok diencerkan dengan phosphat buffer saline
(PBS) hingga menjadi pengenceran 10-5. Sampel air kolam yang diencerkan pada 10-3, 10-4, dan 10-5 disebar sebanyak 0,1 mℓ pada cawan petri berisi media
4 dan 10-6 disebar sebanyak 0,1 mℓ pada cawan petri berisi media TSA lalu diinkubasi pada suhu 27-30 °C selama 24 jam.
Setelah 24 jam, koloni tunggal yang tumbuh pada media kultur dan memiliki profil berbeda diambil menggunakan ose lalu digores pada cawan petri berisi media TSA steril dengan metode gores kuadran. Isolat yang telah digores tersebut diinkubasi kembali pada suhu 27-30 °C selama 24 jam untuk mendapatkan isolat tunggal yang murni. Isolat murni dipindahkan ke tabung reaksi berisi media TSA steril untuk disimpan sebagai stok isolat bakteri kandidat probiotik dan digunakan untuk uji selanjutnya.
2.3 Uji Aktivitas Amilolitik dan Proteolitik
Uji ini dilakukan untuk mengetahui aktivitas enzim amilase dan protease yang dihasilkan oleh masing-masing isolat, untuk menunjukkan kemampuannya dalam menghidrolisis karbohidrat dan protein. Bakteri kandidat probiotik ditumbuhkan pada media brain heart infusion agar (BHIA) yang telah ditambahkan pati sebanyak 2% untuk uji amilolitik. Kemampuan menghidrolisis karbohidrat ditandai dengan terbentuknya zona bening di sekitar koloni yang tumbuh, setelah agar digenangi dengan reagen KI 1%. Koloni yang tidak mampu menghidrolisis karbohidrat tidak terdapat zona bening di sekitar koloni yang tumbuh.
Pada uji aktivitas proteolitik, bakteri kandidat probiotik ditumbuhkan pada media BHIA yang telah ditambahkan susu skim sebanyak 2%. Kemampuan menghidrolisis protein ditandai dengan terbentuknya zona bening di sekitar koloni yang tumbuh. Isolat dengan aktivitas amilolitik dan proteolitik paling besar dipilih untuk diuji kemampuannya dalam menghambat pertumbuhan bakteri patogen
S. agalactiae isolat 5 tipe non-hemolitik (Sa5).
2.4 Uji Sensitivitas Antibiotik
Uji ini dilakukan untuk menguji sensitivitas bakteri kandidat probiotik serta Sa5 pada beberapa jenis antibiotik serta membantu dalam pembuatan penanda untuk memonitor keberadaan bakteri yang akan digunakan pada uji in vitro
5 konsentrasi 50 dan 100 μg/mℓ, Kanamisin pada konsentrasi 50 dan 100 μg/mℓ, serta Penisilin G pada konsentrasi 50 dan 100 μg/mℓ. Kandidat probiotik digoreskan pada media BHIA yang telah ditambahkan antibiotik dengan metode
streak plate lalu diinkubasi selama 24 jam pada suhu 28
-30 °C
. Bakteri yang sensitif terhadap antibiotik ditandai dengan tidak adanya pertumbuhan koloni pada media BHIA yang mengandung antibiotik, sedangkan bakteri yang resisten akan tetap tumbuh pada media tersebut.2.5 Penyiapan Bakteri Resisten Antibiotik
Bakteri Sa5 yang digunakan pada uji antagonistik in vitro terlebih dahulu diberi penanda resistensi antibiotik berdasarkan hasil uji sensitivitas. Penanda resistensi antibiotik dipilih berdasarkan konsentrasi terendah yang dapat menumbuhkan Sa5 pada uji sensitivitas sedangkan kandidat probiotik tidak tumbuh pada agar dengan penambahan antibiotik dengan konsentrasi tersebut. Pemberian penanda resistensi antibiotik dilakukan dengan menumbuhkan Sa5 pada media BHIA yang mengandung antibiotik dengan konsentrasi rendah, 25 atau 50 μg/mℓ. Pemberian penanda ini dilakukan untuk memonitor populasi Sa5 pada uji in vitro yang dikultur bersama dengan kandidat probiotik terpilih.
2.6 Uji Antagonistik In Vitro
Aktivitas antagonistik (penghambatan) bakteri kandidat probiotik terhadap Sa5 diuji secara in vitro menggunakan metode kultur bersama. Bakteri Sa5 yang diberi penanda resistensi antibiotik Streptomisin 50 µg/mℓ diganti kode menjadi
S. agalactiae StR (Sa-StR). Bakteri kandidat probiotik dan S. agalactiae StR masing-masing sebanyak satu ose dikultur pada media cair brain heart infusion broth (BHIB) 10 mℓ dalam labu erlenmeyer dan diinkubasi menggunakan shaker water bath pada suhu 29 °C dengan putaran 140 rpm selama 24 jam. Kemudian inokulum tersebut diencerkan hingga mencapai kepadatan yang sama yakni mencapai 106 CFU/mℓ (Tepu 2006). Sebanyak 100 μℓ bakteri kandidat probiotik dan S. agalactiaeStR dimasukkan ke dalam 10 mℓ media BHIB. Sebagai kontrol,
6 ditandai dengan rendahnya jumlah koloni S.agalactiae StR yang tumbuh dari labu kultur bersama dibandingkan dengan yang tidak dikultur bersama kandidat probiotik terpilih.
2.7 Uji Patogenisitas Kandidat Probiotik
Uji patogenisitas dilakukan dengan cara menyuntikkan kandidat probiotik yang diperoleh secara intraperitonial pada ikan nila dengan konsentrasi 108 CFU/mℓ dengan dosis 1 mℓ per 100 g bobot tubuh ikan (Sukenda 2000). Sebagai pembanding digunakan kontrol positif, yakni ikan nila yang disuntik Sa5 dengan konsentrasi 107CFU/mℓ dengan dosis yang sama. Konsentrasi kandidat probiotik dan patogen yang digunakan adalah konsentrasi optimum bakteri-bakteri tersebut dalam kultur cair pada 10 mℓ BHIB dengan lama inkubasi 24 jam pada suhu 29 °C dengan putaran 140 rpm. Ikan nila dipelihara dalam akuarium berukuran (60x35x30) cm dengan volume air 40 ℓ dan kepadatan 10 ekor per akuarium. Ikan yang digunakan memiliki bobot 10,93±0,77 g dengan parameter pengamatan tingkat kelangsungan hidup (survival rate) ikan hingga hari ke-8 pascainfeksi.
2.8 Uji Antagonistik In Vivo
Bakteri kandidat probiotik potensial yang telah diuji antagonistik secara in vitro dan tidak bersifat patogen diuji lagi kemampuan antagonistiknya dalam menghambat pertumbuhan atau perkembangan Sa5 secara in vivo pada ikan nila dengan metode injeksi (penyuntikan). Bakteri kandidat probiotik yang digunakan adalah isolat non-patogenik yang berhasil mempertahankan survival rate (SR) paling tinggi dalam uji patogenisitas. Ikan yang digunakan adalah ikan nila dengan bobot 12,48±0,29 g yang dipelihara dalam akuarium berukuran (60x35x30) cm dengan volume air 40 ℓ dan kepadatan 10 ekor per akuarium.
Konsentrasi (kepadatan) bakteri kandidat probiotik dan Sa5 yang digunakan dalam uji antagonistik in vivo adalah 106 CFU/mℓ, sesuai dengan konsentrasi yang digunakan dalam uji antagonistik in vitro. Injeksi bakteri dilakukan secara intraperitonial pada ikan nila dengan dosis 1 mℓ per 100 g bobot tubuh ikan (Sukenda 2000). Ikan dipelihara selama 17 hari dengan berbagai perlakuan (Gambar 1). Perlakuan yang diberikan pada uji antagonistik in vivo
7 A = simulasi pencegahan, kandidat probiotik diinjeksikan ke ikan uji terlebih
dahulu pada H-4 dan patogendiinjeksi pada H0,
B = injeksi bersama, kandidat probiotik dan patogen diinjeksikan ke ikan uji secara bersamaan pada H0,
C = simulasi pengobatan, patogen diinjeksikan ke ikan uji terlebih dahulu pada H0 dan kandidat probiotik diinjeksi pada H+4,
8
Keterangan: (SB) Sampling Bobot; (GD) Sampling Gambaran Darah; (K-) Kontrol Negatif; (K+) Kontrol Positif; (InjPro) Injeksi Probiotik; (InjPat) Injeksi Patogen; (InjLarfis) Injeksi Larutan Fisiologis.
Gambar 1 Jadwal perlakuan dan sampling selama uji antagonistik in vivo
9 2.9 Parameter Pengamatan
2.9.1 Konsumsi Pakan
Pakan harian diberikan secara ad satiation dengan stok pakan sebanyak 5 g per akuarium dan frekuensi pemberian 3 kali sehari. Jumlah konsumsi pakan harian selama uji antagonistik in vivo dihitung dengan mengurangkan stok pakan harian (a) dengan sisa pakan (b). Sisa pakan merupakan pakan yang tidak dikonsumsi oleh ikan pada setiap akuarium.
2.9.2 Survival Rate (SR)
Tingkat kelangsungan hidup atau survival rate (SR) ikan nila pada uji patogenisitas dan uji antagonistik in vivo diamati setiap hari selama pemeliharaan lalu dihitung dengan menggunakan rumus sebagai berikut:
Keterangan:
SR = survival rate (%)
Nt = jumlah ikan hidup pada hari pengamatan No = jumlah ikan hidup pada hari pengamatan
2.9.3 Gejala Klinis
Gejala klinis selama uji antagonistik in vivo diamati secara visual setiap hari sejak pemeliharaan dalam akuarium hingga akhir pengamatan uji in vivo
selama kurun waktu 17 hari. Gejala klinis yang diamati merupakan modifikasi metode pengamatan Aryanto (2011) dan Hardi (2011) meliputi perubahan pola renang dan tingkah laku, respons terhadap pakan, serta patologi makroskopis organ luar ikan.
2.9.4 Hematologi Ikan
10 pengamatan hematologi ikan. Sampel yang digunakan setiap sampling berjumlah 2 ekor ikan. Sebelum pengambilan sampel darah ikan, syringe dibilas dengan antikoagulan (natrium sitrat 3,8%) untuk mencegah pembekuan darah. Darah ikan diambil melalui vena caudal menggunakan syringe. Darah yang telah diambil kemudian dimasukkan ke dalam eppendorf secara perlahan. Parameter hematologi ikan yang diamati adalah total eritrosit dan total leukosit (Blaxhall dan Daisley 1973), kadar hematokrit (Anderson dan Siwicki 1993), kadar hemoglobin (Wedemeyer dan Yasutake 1977).
2.9.4.1 Perhitungan Total Eritrosit
Darah dihisap menggunakan pipet bulir merah sampai skala 0,5 lalu diencerkan dengan larutan Hayem sampai skala maksimum 101. Kedua ujung ditutup sejajar kemudian digoyangkan membentuk angka 8 selama 3-5 menit. Setelah itu, tetesan darah yang pertama dibuang lalu darah tersebut diteteskan ke hemasitometer yang telah ditutup dengan gelas objek pada bagian yang berlekuk. Perhitungan dilakukan di bawah mikroskop dengan perbesaran 400x dan jumlah eritrosit dihitung pada 5 kotak besar pada hemasitometer dengan faktor pengencer 202. Berikut ini adalah rumus perhitungan total eritrosit:
2.9.4.2 Perhitungan Total Leukosit
11 2.9.4.3 Perhitungan Kadar Hematokrit
Darah dihisap dengan tabung kapiler (mikrohematokrit) hingga ¾ bagian tabung lalu ujung tabung ditutup dengan ditancapkan pada crytoceal. Setelah itu, tabung mikrohematokrit yang berisi darah disentrifuse pada kecepatan 3000 rpm selama 5 menit lalu dilihat endapan darahnya. Perhitungan kadar hematokrit dengan cara membandingkan panjang endapan darah (a) terhadap panjang total seluruh darah (b). Berikut ini adalah rumus perhitungan kadar hematokrit:
2.9.4.4 Perhitungan Kadar Hemoglobin
Perhitungan kadar hemoglobin (Hb) diawali dengan memasukkan HCl 0,1 N ke dalam Hb meter sampai skala 10 (skala merah) menggunakan pipet. Setelah itu darah dihisap menggunakan pipet Sahli hingga skala 0,2 mℓ lalu dimasukkan ke dalam tabung Hb meter dan dibiarkan sambil diaduk selama 3-5 menit dan dincerkan dengan ditambahkan akuades sedikit demi sedikit hingga warnanya sama dengan warna standar yang ada pada tabung Hb meter. Kadar hemoglobin dilihat pada skala berwarna kuning yang dinyatakan dalam satuan gram per 100 mℓ darah (g%).
2.10 Identifikasi Isolat Bakteri
Identifikasi yang dilakukan meliputi pengamatan morfologi koloni antara lain bentuk sel, penataan dan jenis Gram. Karakterisasi secara biokimia meliputi uji oksidatif/fermentatif, uji motilitas, uji katalase, dan uji oksidase.
2.11 Analisis Data
Analisis data dilakukan dengan metode ANOVA single factor untuk menjawab hipotesis penelitian apakah pengaruh perlakuan berbeda nyata atau tidak terhadap penghambatan pertumbuhan patogen oleh kandidat probiotik pada uji in vitro, SR pada uji patogenisitas dan uji in vivo, serta parameter hematologi ikan nila pada uji in vivo.
12 yang memberikan pengaruh berbeda terhadap masing-masing parameter pengamatan.
13 III. HASIL DAN PEMBAHASAN
3.1 Isolasi Bakteri Kandidat Probiotik
Bakteri kandidat probiotik yang berhasil diisolasi dari air kolam pembesaran ikan nila merah dan usus ikan nila merah, usus ikan nila hitam, usus ikan lele, serta usus ikan mas berjumlah 78 isolat. Seluruh isolat tersebut telah diidentifikasi melalui perwarnaan Gram dengan karakteristik anatomi mikroskopis seperti pada Tabel 1. Sebanyak 17 isolat berasal dari air kolam pembesaran ikan nila merah; 14 isolat dari usus ikan nila merah; 10 isolat dari usus ikan nila hitam; 20 isolat dari usus ikan lele; dan 17 isolat dari usus ikan mas. Berdasarkan hasil pewarnaan Gram diketahui 68 isolat diantaranya memiliki sifat Gram negatif dan 10 isolat sisanya memiliki sifat Gram positif, dengan 19 isolat diantaranya memiliki morfologi sel bulat (coccus) dan 59 isolat lainnya berbentuk batang (bacil).
14 Tidak semua isolat bakteri yang berhasil diisolasi dapat digunakan. Karena dalam 2 hingga 3 kali pemurnian dengan metode gores kuadran tidak semua isolat dapat dimurnikan menjadi koloni tunggal. Salah satu faktor yang menyebabkan sulitnya mendapatkan koloni tunggal adalah koloni bakteri yang tumbuh menyebar pada media agar. Dengan demikian, hanya isolat yang teridentifikasi merupakan koloni tunggal saja (Lampiran 1) yang diuji lebih lanjut.
3.2 Uji Aktivitas Amilolitik dan Proteolitik
Pada Gambar 2a ditampilkan contoh hasil uji aktivitas amilolitik, koloni dengan tanda (+) memperlihatkan terbentuknya zona bening dan koloni dengan tanda (-) tidak membentuk zona bening. Gambar 2b menampilkan koloni yang menunjukkan aktivitas proteolitik.
A b
Keterangan: (+) terdapat aktivitas; (-) tidak terdapat aktivitas.
Gambar 2 Hasil uji aktivitas enzim (a) Amilolitik (b) Proteolitik
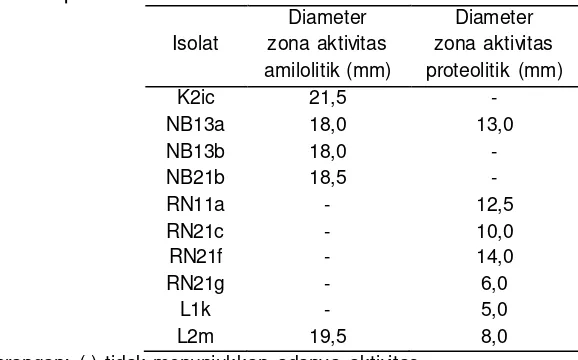
Uji aktivitas enzim (amilolitik dan proteolitik) menjadi salah satu tahap seleksi yang menentukan kandidat probiotik yang digunakan pada penelitian ini. Masing-masing 5 isolat yang menunjukkan aktivitas amilolitik dan proteolitik terbesar (Tabel 2) akan diujikan lebih lanjut.
Aktivitas amilolitik dan proteolitik menandakan adanya kemampuan bakteri dalam menghidrolisis karbohidrat dan protein, artinya bakteri tersebut mampu memanfaatkan sumber energi berupa pati dan protein yang ditambahkan pada media kultur sebagai sumber karbon. Amilolitik merupakan aktivitas bakteri dalam merombak pati dengan bantuan enzim amilase. Enzim amilase adalah enzim yang mampu menghidrolisis pati menjadi senyawa lebih sederhana seperti maltosa dan glukosa. Enzim ini dapat memecah atau menghidrolisis pati, glikogen dan turunan polisakarida dengan cara memecah ikatan glikosidik pati. (Rehm dan Reed 1987).
+
+
+
+
15 Tabel 2 Sepuluh isolat terpilih yang menunjukkan aktivitas amilolitik dan
proteolitik terbesar
Keterangan: (-) tidak menunjukkan adanya aktivitas.
Bakteri proteolitik adalah bakteri yang memproduksi enzim protease ekstraseluler, yaitu enzim pemecah protein yang diproduksi di dalam sel kemudian dilepaskan keluar dari sel. Semua bakteri mempunyai enzim protease di dalam sel, tetapi tidak semua mempunyai enzim protease ekstraseluler. Dekomposisi protein oleh mikroorganisme lebih kompleks daripada pemecahan karbohidrat dan hasil akhirnya juga beragam. Hal ini disebabkan struktur protein yang lebih kompleks. Mikroorganisme melalui suatu sistem enzim yang kompleks, mampu memecah protein menjadi senyawa-senyawa yang lebih sederhana (Durham et al. 1987). Menurut Price dan Stevens (1996) dalam
Yandri et al. (2008) protease merupakan enzim yang berfungsi memecah ikatan peptida untuk menghasilkan asam amino dan peptida sederhana lainnya. Enzim ini dapat diisolasi dari berbagai sumber seperti tanaman, hewan dan mikroba (fungi atau bakteri). Protease atau yang disebut endopeptidase merupakan salah satu enzim pencernaan yang penting, termasuk di dalamnya tripsin dan kemotripsin (Lemos et al. 2000).
16 probiotik dengan aktivitas enzimatik (amilolitik dan proteolitik) menjadi nilai lebih karena bermanfaat dalam merombak makronutrien, selain itu kandidat probiotik terpilih diharapkan juga memiliki kemampuan menghambat pertumbuhan patogen sebagai parameter utama dalam penelitian ini.
3.3 Uji Sensitivitas Antibiotik
Pada Gambar 3 berikut diperlihatkan contoh hasil uji sensitivitas kandidat probiotik pada media agar dengan metode streak plate pada media agar dengan penambahan antibiotik Streptomisin 50 μg/mℓ.
Keterangan: (a) bakteri resisten antibiotik; (b) bakteri sensitif antibiotik.
Gambar 3 Uji sensitivitas bakteri terhadap antibiotik Streptomisin 50 μg/mℓ
Pada Tabel 3 disajikan hasil uji sensitivitas 10 bakteri kandidat probiotik terpilih dan bakteri Sa5 terhadap antibiotik Penisilin-G dengan konsentrasi 50 μg/mℓ, Streptomisin 50 μg/mℓ, Kanamisin 50 μg/mℓ, dan Rifampisin 25 μg/mℓ.
Tabel 3 Sensitivitas kandidat probiotik dan Sa5 terhadap beberapa jenis antibiotik
Isolat PG50 Strep50 Kan50 Rif25
K2ic R S S S
NB13a R S S S
NB13b R S S S
NB21b R S S S
RN11a R S S S
RN21c R S S S
RN21f R S S S
RN21g S S S S
L1k S S S S
L2m R S S S
Sa5 R S S S
Keterangan: (R) Resisten; (S) Sensitif; (PG50) media agar ditambahkan antibiotik Penisilin-G dengan konsentrasi 50 μg/mℓ; (Strep50) media agar +
Streptomisin 50 μg/mℓ; (Kan50) media agar + Kanamisin 50 μg/mℓ; (Rif25)
17 Berdasarkan Tabel 3 diketahui bahwa semua isolat sensitif terhadap antibiotik Strep50, Kan50 dan Rif25, sedangkan terhadap PG50, hampir semua isolat bersifat resisten kecuali RN21g dan L1k. Sifat resistensi terhadap antibiotik pada bakteri dapat disebabkan oleh dua jenis mekanisme yaitu mutasi kromosom dan akuisisi plasmid. Mutasi pada kromosom tidak dapat ditransfer pada bakteri lain, tetapi pada akuisisi plasmid mampu mentrasfer dengan cepat sifat resisten tersebut (Lewin 1922 dalam Schnick 2001). Sifat resisten pada mikroorganisme juga diakibatkan oleh, (1) kemampuan menghasilkan enzim yang mampu mengaktivasi antibiotik; (2) adanya penambahan substansi kimia pada struktur lain oleh sel bakteri sehingga antibiotik tidak dapat masuk ke dalam ribosom; (3) perubahan struktur protein pada dinding sel; (4) berkurangnya permeabilitas dinding sel sehingga antibiotik tidak dapat masuk ke dalam sel (Guilfoile 2007).
Pada Tabel 4 diketahui bahwa pada konsentrasi 100 μg/mℓ semua jenis isolat sensitif terhadap antibiotik jenis Penisilin-G, Streptomisin, Kanamisin, dan Rifampisin. Hal tersebut menurut Guilfoile (2007) berkaitan dengan kemampuan antibiotik dalam membunuh bakteri dengan mekanisme, antara lain (1) merusak kerja ribosom dalam mensintesis protein; (2) menghambat sintesis DNA sebagai sumber informasi genetik; (3) menghambat proses biokimia dalam sel; (4) menghambat sintensis komponen penyusun dinding sel; serta (5) mengganggu fungsi kerja membran sel. Dengan demikian, konsentrasi yang lebih pekat akan meningkatkan kemampuan antibiotik dalam merusak sistem dalam tubuh bakteri.
Tabel 4 Sensitivitas kandidat probiotik dan Sa5 terhadap beberapa jenis antibiotik pada konsentrasi 100 μg/mℓ
Isolat PG100 Strep100 Kan100 Rif100
K2ic S S S S
Keterangan: (R) Resisten; (S) Sensitif; (PG100) media agar ditambahkan antibiotik Penisilin-G dengan konsentrasi 100 μg/mℓ; (Strep100) media agar +
Streptomisin 100 μg/mℓ; (Kan100) media agar + Kanamisin 100 μg/mℓ;
(Rif100) media agar + Rifampisin 100 μg/mℓ; (Sa5) S. agalactiae tipe
18 3.4 Penyiapan Bakteri Resisten Antibiotik
Menurut Madigan et al. (2003) sifat resistensi pada bakteri dapat dipindahkan baik secara horizontal maupun vertikal. Baticados et al. (1990)
dalam Tendencia dan de la Pena (2001) melaporkan bahwa patogen penyebab
luminous disease seperti Vibrio harveyi dan Vibrio splendidus yang diisolasi dari larva udang resisten terhadap antibiotik Erythromycin, Kanamycin, Pencillin-G, dan Streptomycin.
Berdasarkan hasil uji sensitivitas pada Tabel 3, isolat Sa5 yang digunakan pada uji antagonistik in vitro dapat diberi penanda Strep50, Kan50 atau Rif25. Namun, pada penyiapan isolat resisten secara spontan, isolat Sa5 lebih cepat tumbuh pada media dengan penambahan Strep50 (Gambar 4) sehingga penanda yang digunakan adalah Strep50 dan kode isolat patogen diubah menjadi S.agalactiae StR.
Gambar 4 Isolat patogen Sa5 resistensi terhadap antibiotik Streptomisin pada media BHIA + Strep50
3.5 Uji Antagonistik In Vitro
19 menghambat pertumbuhan S. agalactiae StR dengan kemampuan berbeda (Gambar 5). Empat isolat (L1k, RN21f, K21c, dan NB21b) dengan kemampuan penghambatan paling baik diantara isolat yang telah diuji akan diuji sifat patogenitasnya terhadap ikan nila.
Lactid Acid Bacteria (LAB) yang diisolasi dari saluran pencernaan mampu memproduksi komponen bakteriosin yang mampu menghambat pertumbuhan mikroorganisme lainnya dan secara tidak langsung akan mempengaruhi kompetisi dalam memperoleh energi di lingkungannya. Isolat LAB yang ditemukan dalam saluran pencernaan organisme akuatik seperti ikan mampu meningkatkan status kesehatan organisme tersebut (Verschuere et al. 2000).
Penghambatan bakteri kandidat probiotik terhadap bakteri patogen berbeda karena sejumlah probion sering memiliki inang dan patogen yang spesifik (Gram et al. 2001), sehingga media tumbuh dan patogen yang diujikan juga dapat mempengaruhi hasil uji antagonistik. Pelczar dan Chan (1998) menyatakan bahwa daya hambat yang berbeda dapat dipengaruhi beberapa faktor atau keadaan yang akan mempengaruhi efek antimikrobial.
Penelitian yang dilakukan Sugita et al. (1996) menghasilkan beberapa bakteri mikroflora usus ikan air tawar yang mempunyai kemampuan antibakterial terhadap beberapa isolat patogen antara lain Aeromonas hydrophilla. Pengaruh zat antibakteri yang diproduksi bakteri umumnya berkaitan dengan faktor-faktor yang berperan tunggal maupun kombinasi seperti produksi antibiotik, bakteriosin, siderofor, lisozim atau protease, mengubah nilai pH dengan dihasilkannya asam organik. Penelitian yang dilakukan ini tidak sampai menentukan faktor utama yang berperan dalam aktivitas antibakterial dari bakteri asal usus ikan air tawar. Dengan pengujian aktivitas antagonistik secara in vitro cukup untuk menentukan pengaruh penghambatan bakteri kandidat probiotik terhadap bakteri patogen.
20
Keterangan: Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05).
Gambar 5 Kepadatan patogen S. agalactiae StR hasil uji antagonistik in vitro dengan metode kultur bersama kandidat probiotik
21 Perbedaan komposisi media juga mempengaruhi produksi senyawa penghambat (Verschuere et al. 2000). Selain itu, percobaan yang telah dilakukan sebelum uji antagonistik in vitro memperlihatkan hasil secara visual yang kurang baik, zona hambat yang dihasilkan oleh bakteri kandidat probiotik yang digoreskan terhadap bakteri patogen secara streakplate tidak terlihat jelas (Gambar 6). Hal tersebut membuktikan bahwa penghambatan pertumbuhan populasi tidak selalu dapat dilihat melalui metode zona bening (metode Kirby-Bauer), sehingga metode uji antagonistik in vitro yang digunakan adalah metode kultur bersama patogen dan kandidat probiotik pada media broth.
Sasanti (2008) juga melaporkan bahwa dari 110 isolat hasil isolasi dari terumbu karang, hanya 10 isolat saja yang potensial sebagai kandidat probiotik. Lima diantaranya terbukti mampu menghambat pertumbuhan Vibrio harveyi MR 5339 Rf R walaupun tidak menunjukkan adanya zona hambat pada uji in vitro
dengan metode Kirby-Bauer.
Keterangan: Panah merah ( ) menunjukkan zona bening yang dihasilkan tidak terlihat jelas.
Gambar 6 Zona hambat yang dihasilkan kandidat probiotik terhadap patogen dengan metode cawan gores
Kepadatan bakteri kandidat probiotik serta S. agalactiae StR yang diuji dengan metode kultur bersama sebelumnya diukur dengan metode total plating count (TPC) dan optical density (OD) menggunakan spektrofotometer. Pengukuran OD dilakukan pada panjang gelombang ( ) 600 nm. Kepadatan bakteri diketahui dengan membandingkan nilai OD dengan jumlah koloni bakteri yang dikultur selama 24 jam (Lampiran 3).
3.6 Uji Patogenisitas Kandidat Probiotik
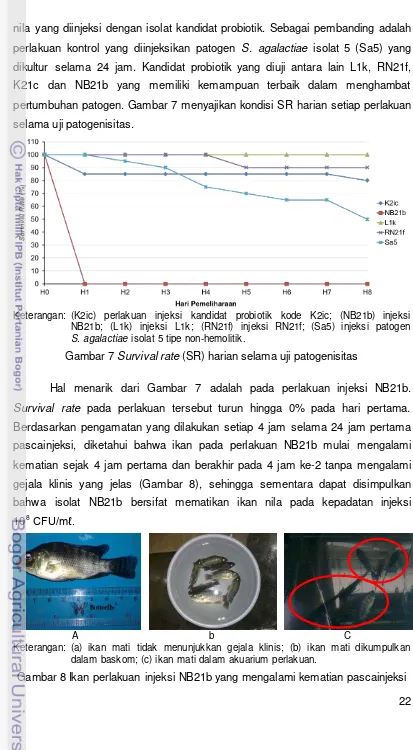
22 nila yang diinjeksi dengan isolat kandidat probiotik. Sebagai pembanding adalah perlakuan kontrol yang diinjeksikan patogen S. agalactiae isolat 5 (Sa5) yang dikultur selama 24 jam. Kandidat probiotik yang diuji antara lain L1k, RN21f, K21c dan NB21b yang memiliki kemampuan terbaik dalam menghambat pertumbuhan patogen. Gambar 7 menyajikan kondisi SR harian setiap perlakuan selama uji patogenisitas.
Keterangan: (K2ic) perlakuan injeksi kandidat probiotik kode K2ic; (NB21b) injeksi NB21b; (L1k) injeksi L1k; (RN21f) injeksi RN21f; (Sa5) injeksi patogen
S. agalactiae isolat 5 tipe non-hemolitik.
Gambar 7 Survival rate (SR) harian selama uji patogenisitas
Hal menarik dari Gambar 7 adalah pada perlakuan injeksi NB21b.
Survival rate pada perlakuan tersebut turun hingga 0% pada hari pertama. Berdasarkan pengamatan yang dilakukan setiap 4 jam selama 24 jam pertama pascainjeksi, diketahui bahwa ikan pada perlakuan NB21b mulai mengalami kematian sejak 4 jam pertama dan berakhir pada 4 jam ke-2 tanpa mengalami gejala klinis yang jelas (Gambar 8), sehingga sementara dapat disimpulkan bahwa isolat NB21b bersifat mematikan ikan nila pada kepadatan injeksi 108CFU/mℓ.
A b C
Keterangan: (a) ikan mati tidak menunjukkan gejala klinis; (b) ikan mati dikumpulkan dalam baskom; (c) ikan mati dalam akuarium perlakuan.
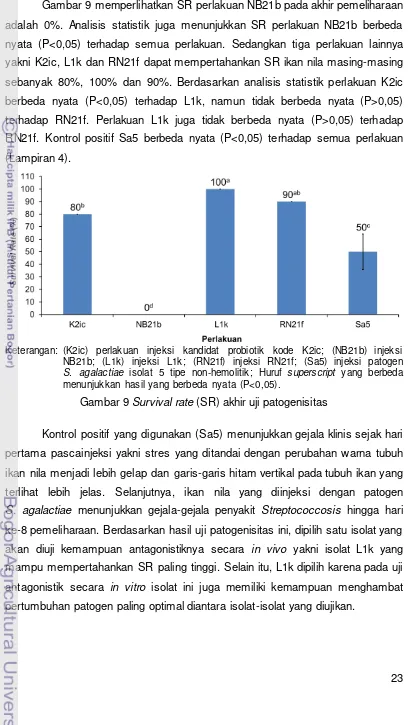
23 Gambar 9 memperlihatkan SR perlakuan NB21b pada akhir pemeliharaan adalah 0%. Analisis statistik juga menunjukkan SR perlakuan NB21b berbeda nyata (P<0,05) terhadap semua perlakuan. Sedangkan tiga perlakuan lainnya yakni K2ic, L1k dan RN21f dapat mempertahankan SR ikan nila masing-masing sebanyak 80%, 100% dan 90%. Berdasarkan analisis statistik perlakuan K2ic berbeda nyata (P<0,05) terhadap L1k, namun tidak berbeda nyata (P>0,05) terhadap RN21f. Perlakuan L1k juga tidak berbeda nyata (P>0,05) terhadap RN21f. Kontrol positif Sa5 berbeda nyata (P<0,05) terhadap semua perlakuan (Lampiran 4).
Keterangan: (K2ic) perlakuan injeksi kandidat probiotik kode K2ic; (NB21b) injeksi NB21b; (L1k) injeksi L1k; (RN21f) injeksi RN21f; (Sa5) injeksi patogen
S. agalactiae isolat 5 tipe non-hemolitik; Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05).
Gambar 9 Survival rate (SR) akhir uji patogenisitas
Kontrol positif yang digunakan (Sa5) menunjukkan gejala klinis sejak hari pertama pascainjeksi yakni stres yang ditandai dengan perubahan warna tubuh ikan nila menjadi lebih gelap dan garis-garis hitam vertikal pada tubuh ikan yang terlihat lebih jelas. Selanjutnya, ikan nila yang diinjeksi dengan patogen
24 3.7 Uji Antagonistik In Vivo
Isolat L1k yang menunjukkan SR paling tinggi pada uji patogenisitas, diujikan lebih lanjut pada uji antagonistik secara in vivo untuk mengetahui kemampuannya dalam menghambat serangan penyakit Streptococcosis dari bakteri patogen S. agalactiae tipe non-hemolitik secara langsung pada tubuh ikan nila dengan metode injeksi bersama dengan berbagai perlakuan. Parameter pengamatan pada uji antagonistik in vivo meliputi konsumsi pakan harian, SR harian, gejala klinis harian, dan hematologi ikan.
3.7.1 Konsumsi Pakan
Pakan yang diberikan adalah pakan komersil dengan merk dagang F999. Konsumsi pakan harian setiap perlakuan selama uji antagonistik in vivo disajikan pada Gambar 10.
Keterangan: (A) simulasi pencegahan; (B) injeksi bersama; (C) simulasi pengobatan; (D) kontrol negatif; (E) kontrol positif.
Gambar 10 Konsumsi pakan harian selama uji antagonistik in vivo
25 probiotik pada perlakuan tersebut, namun hingga hari terakhir konsumsi pakan relatif stabil. Pada hari terakhir (H7 hingga H10), semua perlakuan selain perlakuan D memperlihatkan jumlah konsumsi pakan yang stabil dan relatif sama. Hal ini disebabkan SR dari setiap perlakuan yang tersisa berkisar antara 20,0% hingga 43,3% kecuali pada perlakuan D (Gambar 11).
3.7.2 Survival Rate (SR)
Berdasarkan hasil pengamatan harian secara berkala selama pemeliharaan, kondisi SR harian setiap perlakuan selama uji antagonistik in vivo
dapat dilihat pada Gambar 11.
Keterangan: (A) simulasi pencegahan; (B) injeksi bersama; (C) simulasi pengobatan; (D) kontrol negatif; (E) kontrol positif.
Gambar 11 Survival rate (SR) harian selama uji antagonistik in vivo
Survival rate harian menunjukkan gambaran kematian ikan pada perlakuan A dimulai pada H-1, 3 hari setelah injeksi kandidat probiotik dan terus berlangsung hingga H7 uji antagonistik in vivo dan setelah itu SR relatif stagnan, artinya tidak terhitung adanya kematian. Pada perlakuan B, kematian mulai terjadi H1 pascainjeksi bersama patogen dan kandidat probiotik dan terus berlangsung hingga hari terakhir pemeliharaan selama uji antagonistik in vivo. Kematian ikan pada perlakuan C baru terjadi setelah H2 pascainjeksi patogen. Kematian terjadi secara signifikan antara H4 dan H5 (pascainjeksi kandidat probiotik) dari SR 83,3% hingga angka 63,3% dalam 1 hari, kematian terus terjadi hingga H8 dan stagnan hingga H10.
26 tidak menunjukkan gejala klinis selain garis hitam yang tampak jelas. Pada perlakuan E kematian terjadi antara H1 sampai H7, sedangkan antara H7 sampai akhir pengamatan uji antagonistik in vivo (H10) tidak terjadi lagi kematian dengan SR 26,7%.
Pada Gambar 12 dapat dilihat bahwa perlakuan dengan SR tertinggi adalah D (kontrol negatif) yaitu 90,0±10,0%. Angka tersebut memiliki perbedaan yang signifikan (P<0,05) jika dibandingkan dengan perlakuan lainnya (Lampiran 5). Survival rate terkecil pada perlakuan B (20,0±10,0%) yang berbeda nyata (P<0,05) dengan perlakuan C (43,4±15,3%) dan D, namun tidak berbeda nyata (P>0,05) terhadap perlakuan A (33,3±11,5%) dan E (26,7±5,8%). Perlakuan A dan E tidak berbeda nyata (P>0,05) dengan perlakuan B dan C, namun berbeda nyata terhadap perlakuan D.
Keterangan: (A) simulasi pencegahan; (B) injeksi bersama; (C) simulasi pengobatan; (D) kontrol negatif; (E) kontrol positif; Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05).
Gambar 12 Survival rate (SR) pada akhir uji antagonistik in vivo
3.7.3 Gejala Klinis
27 Pascainjeksi pada H0, mulai terjadi perubahan aktivitas makan, serta anatomi makro pada setiap perlakuan. Pada H1 dan H2, hampir semua perlakuan mengalami penurunan aktivitas makan dan terjadi stres pascainjeksi yakni garis vertikal pada tubuh ikan yang terlihat hitam dan jelas. Kemudian pada H3, gejala klinis mulai terlihat dengan terjadinya perubahan patologi anatomi makroskopis pada perlakuan yang diberi injeksi patogen yakni mulai terjadi
exopthalmia (mata menonjol) pada beberapa perlakuan. Pada H4, semua perlakuan kecuali D menunjukkan perubahan gejala klinis seperti aktivitas makan (respons terhadap pakan) lemah, garis vertikal tubuh terlihat jelas, sirip dorsal tegak, exopthalmia, opacity (kekeruhan pada mata), clear operculum, tingkah laku renang lemah dan terkadang agresif, whirling, serta tubuh membengkok, selengkapnya dapat dilihat pada Lampiran 5. Hampir semua gejala klinis penyakit Streptococcosis ditunjukkan pada H4 pascainjeksi. Gejala klinis pada H4 lebih banyak dibandingkan hari lainnya, sehingga dapat disimpulkan bahwa pada H4 pascainjeksi S. agalactiae non-hemolitik (isolat 5) penyakit
Streptococcosis dapat didiagnosa berdasarkan gejala-gejala yang timbul. Aryanto (2011) melaporkan bahwa bakteri S. agalactiae non-hemolitik lebih cepat menyebabkan perubahan pada pola berenang ikan (pada hari ke-6 pascainfeksi ikan cenderung berenang lemah, gasping dan whirling) sedangkan gejala yang sama baru muncul hari ke-7 pascainfeksi dengan bakteri tipe β-hemolitik.
Perubahan pada mata diawali dengan mata mengkerut, kemudian pupil mata mengecil, mata seperti berkabut (opacity), purulens hingga sebelah mata dapat hilang (Hardi 2011). Aryanto (2011) melaporkan perubahan mata berkabut atau keruh (opacity) terjadi pada hari ke-2 pada saat infeksi tipe non-hemolitik, sedangkan pada tipe β-hemolitik perubahan terjadi pada hari ke-4. Pembengkakan mata atau exopthalmia yang disertai dengan pendarahan terjadi pada hari ke-4 untuk tipe non-hemolitik dan pada hari ke-5 untuk tipe β-hemolitik.
Lateral exopthalmia lebih sering terjadi dibandingkan dengan bilateral exopthalmia. Gejala Streptococcosis spesifik pada ikan nila adalah clear operculum dengan berbagai tanda. Gejala clear operculum muncul rata-rata pada hari ke-3 dan clear operculum yang disertai pendarahan pada hari ke-4 untuk bakteri tipe non-hemolitik dan hari ke-5 pascainjeksi bakteri tipe β-hemolitik tanpa disertai pendarahan.
28 perlakuan yang diberikan Aryanto (2011). Hal ini diduga karena perbedaan dosis injeksi. Dosis yang diberikan pada uji in vivo ini adalah 106 CFU/mℓ sesuai dengan dosis pada uji in vitro sedangkan Aryanto (2011) menggunakan dosis 104,8 CFU/mℓ berdasarkan perhitungan LD50. Pemberian dosis tersebut sesuai dengan Sukenda (2000), ikan uji dengan berat 100 g menerima 1 mℓ suspensi bakteri dari 3x103 hingga 3x106CFU/mℓ sebagai standar dari injeksi bakteri.
Gejala klinis yang teramati juga sesuai dengan gejala yang berhasil diamati oleh Evans et al. (2006), pada ikan nila yang terinfeksi S. agalactiae
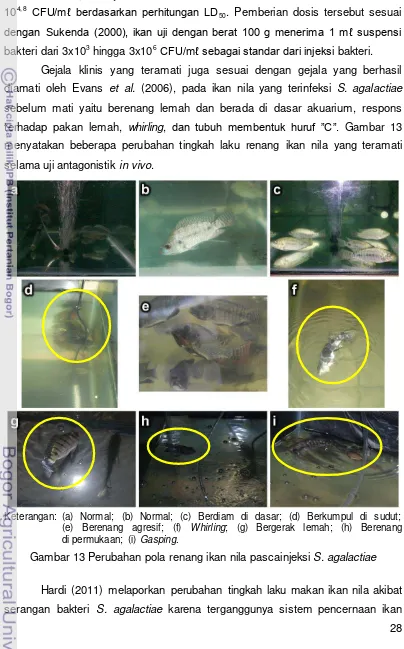
sebelum mati yaitu berenang lemah dan berada di dasar akuarium, respons terhadap pakan lemah, whirling, dan tubuh membentuk huruf ”C”. Gambar 13 menyatakan beberapa perubahan tingkah laku renang ikan nila yang teramati selama uji antagonistik in vivo.
Keterangan: (a) Normal; (b) Normal; (c) Berdiam di dasar; (d) Berkumpul di sudut; (e) Berenang agresif; (f) Whirling; (g) Bergerak lemah; (h) Berenang di permukaan; (i) Gasping.
Gambar 13 Perubahan pola renang ikan nila pascainjeksi S. agalactiae
29 akibat adanya infeksi bakteri S. agalactiae yang menyerang bagian hipotalamus (otak) sebagai pusat yang mengatur rasa lapar dan juga pencernaan ikan. Perubahan tersebut terlihat jelas pada aktivitas makan ikan nila pascainjeksi pada H3 hingga H7. Ikan mulai lambat merespons pakan yang diberikan dan jumlah pakan yang dimakan juga berkurang. Umumnya respons ikan pascainjeksi S. agalactiae lemah, bahkan ikan uji yang diinjeksi dengan bakteri tipe non-hemolitik teramati tidak mengonsumsi pakan yang diberikan sejak H3.
Hingga H7, gejala klinis yang ditunjukkan masih jelas terlihat serta menyebabkan kematian pada ikan. Gejala klinis yang terlihat saat pengamatan tetap terlihat pasca kematian ikan seperti exopthalmia, opacity, clear operculum,
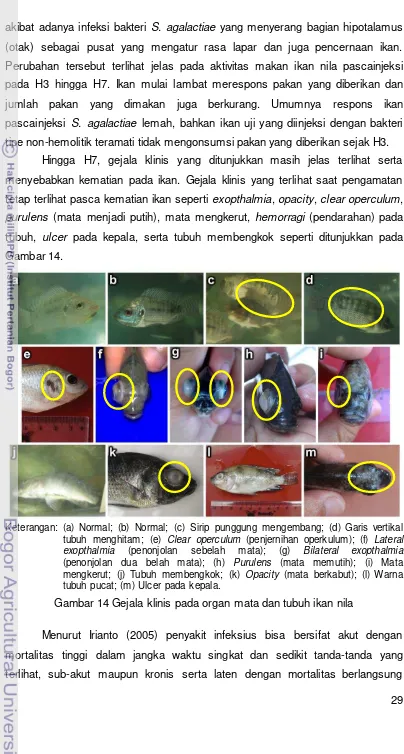
purulens (mata menjadi putih), mata mengkerut, hemorragi (pendarahan) pada tubuh, ulcer pada kepala, serta tubuh membengkok seperti ditunjukkan pada Gambar 14.
Keterangan: (a) Normal; (b) Normal; (c) Sirip punggung mengembang; (d) Garis vertikal tubuh menghitam; (e) Clear operculum (penjernihan operkulum); (f) Lateral exopthalmia (penonjolan sebelah mata); (g) Bilateral exopthalmia
(penonjolan dua belah mata); (h) Purulens (mata memutih); (i) Mata mengkerut; (j) Tubuh membengkok; (k) Opacity (mata berkabut); (l) Warna tubuh pucat; (m) Ulcer pada kepala.
Gambar 14 Gejala klinis pada organ mata dan tubuh ikan nila
30 hingga beberapa minggu sejak munculnya wabah. Bakteri S. agalactiae
merupakan patogen yang menyebabkan septicemia dengan tipikal infeksi yang kronis pada ikan nila (Conroy 2009). Penyakit Streptococcosis memiliki karakteristik yaitu septicemia dan meningoencephalitis (Mian et al. 2009). Gejala klinis dari penyakit ini adalah kelesuan, perut bengkak, lambung dan usus diisi dengan cairan gelatinous atau kekuning-kuningan dan pada beberapa ikan terjadi hemorragi kecil di mata, exopthalmia dan kornea keburaman (opacity), selain itu hati membesar, kongesti ginjal dan limpa, dan adanya cairan di rongga peritoneal (Eldar et al. 1994b). Gejala klinis tersebut juga teramati selama uji in vivo walaupun tidak dilakukan pencatatan, seperti ditunjukkan pada Gambar 15.
Keterangan: (a) Ikan mati dengan perut membengkak, bagian perut kecokelatan dan tubuh pucat; (b) Ikan hidup dengan perut membengkak dan tidak dapat berbalik badan; (c) Ikan mati segar dengan perut membengkak; (d) Bagian sekitar sirip pectoral berwarna kuning kehijuan; (e) Usus berisi cairan kekuning-kuningan; (f) Beberapa organ dalam mengalami pembengkakan. Panah kuning ( ) menunjukkan organ dalam ikan nila: (Gj) Ginjal, (Ht) Hati, (Pk) Pankreas, (Us) Usus, (Lb) Lambung
Gambar 15 Gejala klinis berupa pembengkakan perut dan organ dalam ikan nila
31 pasca kematian. Selain itu, pada H8 hingga H10 aktivitas makan ikan mulai normal walaupun tidak terjadi pada setiap perlakuan.
Permukaan sel bakteri tipe β-hemolitik tidak seperti sel bakteri tipe non-hemolitik (berkapsul) yang selain tersusun atas protein, juga tersusun atas karbohidrat yang lebih banyak, sehingga lebih sulit untuk difagosit. Sel bakteri tipe non-hemolitik lebih cepat tumbuh dan berkembangbiak serta menyebarkan virulensi di sel atau jaringan dibandingkan bakteri tipe β-hemolitik yang mudah dikenali dan mampu dilawan oleh sistem imun (Hardi 2011).
Winarti (2010) menyatakan, bahwa pemaparan antigen pada
intramuscular menyebabkan bakteri langsung masuk ke dalam jaringan dan pembuluh darah (kapiler) kemudian menyebar ke seluruh organ tubuh sehingga dengan dosis lebih rendah menyebabkan kematian ikan nila yang lebih banyak dan cepat. Menurut Cipriano (2001) dalam Winarti (2010), keganasan penyakit dipengaruhi oleh jumlah dari faktor yang saling berhubungan, meliputi virulensi bakteri, macam dan derajat stres yang dipengaruhi populasi ikan, kondisi fisiologi dari inang dan derajat resistensi genetik yang tidak bisa dipisahkan dalam populasi spesifik dari ikan.
3.7.4 Hematologi Ikan
Data lain yang diambil adalah data gambaran darah (hematologi) ikan. Pengamatan hematologi ikan dilakukan sebanyak 5 kali. Secara umum darah berfungsi untuk mengedarkan nutrien yang berasal dari pencernaan makanan ke sel-sel tubuh, membawa oksigen ke sel-sel tubuh (jaringan) dan membawa hormon dan enzim ke organ tubuh yang memerlukannya (Lagler et al., 1977). Amlacher (1970) menyatakan bahwa darah akan mengalami perubahan khususnya bila terkena penyakit infeksius. Beberapa parameter yang dapat memperlihatkan perubahan patologi pada darah adalah kadar hemoglobin, kadar hematokrit, jumlah eritrosit, dan jumlah leukosit. Berikut hasil pengamatan parameter beberapa hematologi ikan yang didapatkan dalam penelitian ini:
3.7.4.1 Total Eritrosit
32 hingga 3,46x106 sel/mm3, sedangkan pada perlakuan B, C, D dan E masing-masing sama yakni 1,93x106 sel/mm3 (Gambar 16). Perlakuan A berbeda nyata (P<0,05) terhadap perlakuan lainnya.
Keterangan: (A) simulasi pencegahan; (B) injeksi bersama; (C) simulasi pengobatan; (D) kontrol negatif; (E) kontrol positif; Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05).
Gambar 16 Total Eritrosit selama uji antagonistik in vivo
Setelah uji tantang pada H0 dilakukan 3 kali sampling pada H2, H6 dan H10 (Gambar 16). Pada H2 jumlah eritrosit tidak jauh berbeda dibandingkan
sampling sebelumnya, berkisar antara 1,10x106 sel/mm3 hingga 1,93x106 sel/mm3 dan tidak berbeda nyata (P>0,05) untuk semua perlakuan. Pada H6 jumlah eritrosit turun pada semua perlakuan, berkisar antara 0,61x106 sel/mm3 hingga 0,97x106 sel/mm3, namun tidak berbeda nyata (P>0,05) untuk semua perlakuan. Pada H10 jumlah eritrosit kembali naik pada semua perlakuan, berkisar antara 2,03x106 sel/mm3 hingga 2,74x106 sel/mm3, dan tidak berbeda nyata (P>0,05) untuk semua perlakuan (Lampiran 7).
Jumlah eritrosit berkaitan erat dengan kadar hemoglobin dan hematokrit (Fujaya 2004). Berdasarkan hasil penelitian, jumlah eritrosit setelah injeksi kandidat probiotik perlakuan A (H-2) tren dari ketiga parameter tersebut hampir sama, peningkatan jumlah eritrosit (Gambar 16) disertai juga peningkatan kadar hemoglobin (Gambar 18) dan hematokrit (Gambar 19). Jumlah eritrosit pada
33 ginjal. Ginjal merupakan organ penghasil eritrosit. Rusaknya ginjal menyebabkan kemampuan ikan untuk memproduksi eritrosit menurun. Rendahnya jumlah eritrosit menandakan ikan menderita anemia dan kerusakan ginjal (Nabib dan Pasaribu 1989). Jumlah eritrosit kembali normal seperti semula pada sampling
terakhir (H10) dan tidak terdapat perbedaan nyata (P>0,05) antar perlakuan.
3.7.4.2 Total Leukosit
Jumlah leukosit ikan nila sebelum perlakuan injeksi (H-6) sebesar 12,63x105 sel/mm3 dan berdasarkan analisis statistik tidak berbeda nyata (P>0,05) pada semua perlakuan. Pada sampling H-2, setelah injeksi probiotik untuk perlakuan A, jumlah leukosit tidak mengalami kenaikan yang signifikan. Perlakuan A naik menjadi 16,99x105 sel/mm3, sedangkan pada perlakuan B, C, D, dan E tidak jauh berubah yakni 12,56x105 sel/mm3 (Gambar 17). Berdasarkan analisis statistik, jumlah leukosit tidak ada perbedaan nyata (P>0,05) pada setiap perlakuan (Lampiran 8).
Keterangan: (A) simulasi pencegahan; (B) injeksi bersama; (C) simulasi pengobatan; (D) kontrol negatif; (E) kontrol positif; Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05).
Gambar 17 Total Leukosit selama uji antagonistik in vivo
Setelah uji tantang pada H0 dilakukan 3 kali sampling pada H2, H6 dan H10. Pada H2 jumlah leukosit tidak jauh berbeda dibandingkan sampling
34 terhadap perlakuan A dan B. Sedangkan pada H10 jumlah leukosit naik pada setiap perlakuan kecuali perlakuan D. Secara statistik jumlah leukosit perlakuan A (12,14x105 sel/mm3) dan B (21,71x105 sel/mm3) berbeda nyata (P<0,05), namun total leukosit kedua perlakuan tersebut tidak berbeda nyata (P>0,05) dengan perlakuan C, D dan E. Analisis statistik jumlah leukosit selama uji antagonistik in vivo dapat dilihat pada Lampiran 8.
Anderson (1993), menyatakan leukosit merupakan salah satu komponen darah yang berfungsi sebagai pertahanan non-spesifik yang akan melokalisasi dan mengeliminir patogen melalui mekanisme fagositosis. Jumlah leukosit pada pengamatan H-6, H-2 dan H2 tidak berbeda nyata (P>0,05) pada semua perlakuan. Akan tetapi pada pengamatan H2 dan H6, tren menunjukkan penurunan jumlah leukosit dan peningkatan terjadi pada H10 hampir pada semua perlakuan kecuali kontrol negatif yang tidak mengalami perubahan signifikan. Peningkatan jumlah leukosit ini terkait dengan kinerja sistem imun ikan dalam mereduksi serangan patogen. Semakin meningkatnya serangan patogen maka akan semakin meningkat pula produksi leukosit dalam darah. Hal ini didukung oleh Martin et al. (2004) yang menyatakan bahwa respons ikan terhadap stresor bergantung pada jenis stres yang dialami oleh ikan tersebut, dimana peningkatan jumlah sel darah putih, penurunan kadar hematokrit dan peningkatan neutrofil bergantung pada jenis stres yang dialami.
3.7.4.3 Kadar Hematokrit
Kadar hematokrit ikan nila sebelum perlakuan injeksi (H-6) sebesar 16,57% dan berdasarkan analisis statistik tidak berbeda nyata (P>0,05) pada semua perlakuan. Pada sampling H-2, kadar hematokrit pada perlakuan A naik menjadi 25,16% setelah injeksi probiotik, sedangkan pada perlakuan B, C, D, dan E masing-masing sama yakni 22,71%. Berdasarkan alalisis statistik tidak ada perbedaan nyata (P>0,05) pada semua perlakuan (Lampiran 9).
Setelah uji tantang pada H0 dilakukan 3 kali sampling pada H2, H6 dan H10 (Gambar 18). Pada H2 kadar hematokrit mulai beragam dibandingkan
35
Keterangan: (A) simulasi pencegahan; (B) injeksi bersama; (C) simulasi pengobatan; (D) kontrol negatif; (E) kontrol positif; Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05).
Gambar 18 Kadar hematokrit selama uji antagonistik in vivo
Kadar hematokrit pada sampling H6 juga bervariasi, perlakuan A (12,66%) dan C (11,64%) tidak berbeda nyata (P>0,05) terhadap perlakuan B dan E. Perlakuan B (17,52%) tidak berbeda nyata (P>0,05) terhadap perlakuan E (15,93%). Sedangkan perlakuan D dengan kadar hematokrit paling tinggi (26,24%) berbeda nyata (P<0,05) terhadap perlakuan A, B, C, dan E. Pada
sampling H10 kadar hematokrit naik pada semua perlakuan yang berkisar antara 22,49% hingga 33,87%. Berdasarkan analisis statistik, kadar hematokrit tidak berbeda nyata (P>0,05) pada setiap perlakuan (Lampiran 9).
Hematokrit adalah perbandingan antara padatan sel-sel darah (eritrosit) dalam darah yang dinyatakan dalam persen (Angka et al. 1985). Menurut Bond (1979) kisaran kadar hematokrit darah ikan adalah sebesar 20-30%. Tidak terjadi perubahan signifikan antar perlakuan pascainjeksi kandidat probiotik perlakuan A (pengamatan H-2). Pasca uji tantang (pengamatan H2), kadar hematokrit cenderung mengalami penurunan. Menurunnya kadar hematokrit diduga karena menurunnya jumlah eritrosit dalam darah. Dengan kata lain, penurunan jumlah eritrosit akan diikuti oleh penurunan kadar hematokrit. Menurut Fujaya (2004), kadar hemoglobin berkorelasi kuat dengan kadar hematokrit dan eritrosit.