KAMSIA DORLIANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul Induksi Kalus Haploid Melalui Kultur Antera pada Beberapa Spesies Jeruk (Citrus sp) adalah karya saya dengan arahan komisi pembimbing dan belum diajukan dalam bentuk karya apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, September 2011
KAMSIA DORLIANA. Induction of Haploid Callus through Anther Cultured on Citrus sp. Supervised by AGUS PURWITO & ALI HUSNI.
Anther culture is one method to produce haploid callus and plants. By the doubling of their chromosome, double haploid plants can be generated and used to produce F1 hybrids. Haploid callus can also be used as tissues for somatic hybriditation to produce triploid Citrus and other non-conventional breeding program. The objective of this research were to study microspore development of four Citrus spesies (Tangerine Garut, Tangerine Batu 55, Siam and Pamelo), effect of cold pretreatment, media type, and plant growth regulator on of callus induction from citrus anther.
The development of microspores can be seen by measuring the ratio of the size of the sepals and petals flower. Microspores that have high percentage of uninukleat given different levels cold pretreatment to improve the ability to form callus. After treated with cold pretreatment, callus was induced with various formulations of media, resulting haploid callus then carried out chromosome counting.
The results shown that the microspore uninucleat was highest (78,2% to 91,4%) in medium-size flowers with a ratio of the sepal: petal (1:4 - 2:6) mm in flower Tangerine Garut, Tangerine Batu 55, Siam Citrus, and (6:14 - 6:17) mm in flower Pamelo. Microspores uninucleat in Garut citrus flowers ranged from 78.2 to 91.4%, at tangerine Batu 55 flowers ranged from 78.2 to 85.6%, the citrus flower Siam from 79.4 to 90.5%, and citrus flower Pamelo ranged from 78.2 to 85.4% of the take total microspores. Cold pretreatment of anther for 5 days was able to inducted callus citrus keprok Garut up to 2%.
MT medium + 3 mg / l BAP + 500 mg / l extract malt on solid media were able to induce callus 14.5% in tangerine Batu 55, while the treatment of liquid media is only able to induce callus up to 4.5%, and solid + liquid media treatments able to induce callus 3.6%. The data is observed when the culture aged 6 weeks after planting. The best medium to induce callus Siam Citrus are MT medium + 3 mg / l 2,4-D + 500 mg / l extract malt, is able to induce callus up to 1,6%. MT medium with 3 mg/l BAP and with 1 mg/l NAA was able to induce callus Pamelo up to 2,6%. Chromosome counting is performed to determine ploidy level of callus produced. The result showed that all chromosome of the anther derived callus was 9 as half of diploid chromosome.
KAMSIA DORLIANA, Induksi Kalus Haploid Melalui Kultur Antera pada Beberapa Spesies Jeruk (Citrus sp). Dibawah bimbingan Dr. Ir. AGUS PURWITO sebagai ketua Komisi Pembimbing dan Dr. ALI HUSNI sebagai anggota Komisi Pembimbing.
Kultur antera merupakan salah satu metode kultur jaringan untuk menghasilkan kalus atau tanaman haploid. Penggandaan kromosom akan menghasilkan tanaman double haploid yang dapat digunakan sebagai tetua dalam pemuliaan konvensional untuk menghasilkan hibrida F1 atau untuk bahan dalam program pemuliaan tanaman. Penelitian ini bertujuan untuk mendapatkan kalus haploid pada beberapa spesies jeruk. Penelitian ini diawali dengan studi perkembangan inti mikrospora pada keempat spesies jeruk (Keprok Garut, Keprok Batu 55, Siam, dan Pamelo). Perkembangan mikrospora dapat dilihat dengan mengukur perbandingan ukuran sepal dan petal masing - masing bunga untuk mendapatkan ukuran bunga yang mempunyai mikrospora inti tunggal yang banyak. Mikrospora yang mempunyai banyak inti tunggal diberi berbagai tingkat praperlakuan suhu dingin untuk meningkatkan kemampuan antera jeruk membentuk kalus. Setelah mendapatkan praperlakuan dingin terbaik kemudian dilakukan induksi kalus pada antera dengan berbagai formulasi media, dan untuk mengetahui kalus yang dihasilkan antera merupakan kalus haploid maka dilakukan analisis kromosom.
Perkembangan inti mikrospora ditandai dengan perubahan morfologi bunga melalui bertambah panjangnya ukuran sepal dan petal bunga. Hasil penelitian pada percobaan pengamatan inti mikrospora menunjukkan bahwa mikrospora yang mempunyai inti tunggal (uninukleat) tertinggi berada pada bunga ukuran sedang dengan perbandingan ukuran sepal : petal (1:4 – 2:6) mm pada bunga jeruk keprok Garut, keprok Batu 55, dan jeruk Siam, (6:14 - 6:17) mm pada bunga jeruk Pamelo. Mikrospora inti tunggal yang terdapat pada bunga jeruk keprok Garut berkisar 78,2 - 91,4%, pada bunga jeruk keprok Batu 55 berkisar 78,2 - 85,6%, pada bunga jeruk Siam 79,4 – 90,5%, dan pada bunga jeruk Pamelo 78,2 – 85,4% dari total mikrospora yang diamati. Pada percobaan pemberian praperlakuan suhu dingin pada antera selama selang waktu tertentu menunjukkan bahwa praperlakuan dingin selama 5 hari merupakan praperlakuan terbaik agar antera jeruk keprok Garut dapat diinduksi menjadi kalus sebanyak 2% pada pengamatan 6 minggu setelah tanam.
mampu menginduksi kalus sebanyak 1,6% sedangkan perlakuan media MT + 5 mg/l 2,4-D + 500 mg/l ekstrak malt hanya mampu menginduksi kalus 0,8%, dan MT + 7 mg/l 2,4-D + 500 mg/l ekstrak malt hanya mampu menginduksi kalus 0,8%. Data tersebut diamati pada saat kultur berumur 4 minggu setelah tanam.
Berdasarkan percobaan induksi kalus pada antera jeruk Pamelo diperoleh data yang menunjukkan persentase kalus tertinggi berada pada media MT + 3 mg/l BAP + 1 mg/l NAA + 500 mg/l ekstrak malt sebanyak 2,6%, sedangkan perlakuan media lain tidak mampu menghasilkan terbentuknya kalus, hanya memberikan respon membengkak. Analisis kromosom dilakukan untuk mengetahui tingkat ploidi kalus yang dihasilkan. Kalus yang dihasilkan merupakan kalus haploid yang berasal dari mikrospora karena mempunyai jumlah kromosom berkisar 9.
©Hak Cipta Milik IPB, tahun 2011 Hak Cipta Dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencamtumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan sebagian besar pengutipan tersebut tidak merugikan kepentingan.yang.wajar.IPB.
KAMSIA DORLIANA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Mayor Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Kamsia Dorliana
NRP : A253080141
Disetujui Komisi Pembimbing
Dr. Ir. Agus Purwito, M.Sc, Agr Dr. Ir. Ali Husni, M.Si Ketua Anggota
Diketahui
Koordinator Mayor Dekan Sekolah Pascasarjana Pemuliaan dan Bioteknologi Tanaman
Dr. Ir. Trikoesoemaningtyas, M.Sc Dr. Ir. Dahrul Syah, M.Sc. Agr.
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas rahmat-Nya dalam penyelesaian tesis ini yang merupakan syarat untuk mendapat gelar Magister di Institut Pertanian Bogor (IPB), dengan judul “Induksi Kalus Haploid Melalui Kultur Antera pada Beberapa Spesies Jeruk (Citrus sp)”.
Penulis menyampaikan ucapan terima kasih kepada Dr. Ir. Agus Purwito, Msc. Agr dan Dr. Ali Husni, Msi atas bimbingan, saran, ilmu, waktu serta perhatiannya dalam pelaksanaan penelitian sampai penulisan tesis ini dapat selesai dengan baik. Terima kasih juga disampaikan kepada dekan sekolah Pascasarjana IPB, Dr. Ir. Trikoesomaningtyas selaku ketua Program studi Pemuliaan dan Bioteknologi Tanaman IPB, seluruh staf pengajar, dan semua teknisi yang telah memberikan bantuan selama penulis belajar di IPB.
Ucapan terima kasih dan penghargaan yang mendalam penulis sampaikan kepada ayah Domu Sitanggang dan ibu Hotnauli Siagian yang setia mendoakan, membimbing, dan mengarahkan saya menjadi anak lebih baik.
Penelitian ini dilakukan di Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB-Biogen) Bogor. Untuk itu, penulis menyampaikan terima kasih kepada kepala Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian atas izin yang diberikan kepada penulis untuk melaksanakan penelitian di BB-Biogen. Terimakasih juga diucapkan kepada Dr. Ir. Ika Mariska, APU sebagai ketua Kelompok Peneliti dan kepada semua peneliti serta teknisi BB-BIOGEN Bogor. Penulis juga mengucapkan terimakasih kepada bapak Ujang Hapid dan bapak Joko yang telah banyak membantu penulis dalam pembuatan preparat dalam analisis jumlah kromosom.
Bogor, September 2011
DAFTAR ISI
Halaman
1. Studi Tahapan Perkembangan Inti Mikrospora3. Induksi Kalus Antera Jeruk Keprok Batu 55,
Jeruk Siam dan Jeruk Pamelo...
4. Analisis Kromosom...
22
24
HASIL DAN PEMBAHASAN
Kondisi Umum Percobaan...
Studi Tahapan Perkembangan Inti Mikrospora Antera Jeruk Keprok Garut, Keprok Batu 55, Jeruk Siam, dan Pamelo...
Studi Lama Praperlakuan Penyimpanan Antera Terhadap
Kemampuan Induksi Kalus Keprok Garut………..
Induksi Kalus pada Antera Keprok Batu 55, jeruk Siam dan jeruk Pamelo...
Analisis Kromosom...
PEMBAHASAN UMUM
25
25
26
31
33
40
41
SIMPULAN DAN SARAN
Simpulan...
Saran...
44
44
44
DAFTAR PUSTAKA... 45
DAFTAR TABEL
Halaman1. Perkembangan Inti mikrospora jeruk keprok Garut, keprok Batu 55, jeruk Siam...
2. Perkembangan Inti Mikrospora Jeruk Pomelo ...
27
30
3. Pengaruh Praperlakuan dingin terhadap kemampuan induksi
kalus jeruk keprok Garut... 31
4. Pengaruh Jenis Media Terhadap Respon Antera Jeruk keprok Batu 55………..
5. Pengaruh 2.4-D Terhdap Respon Antera Jeruk Siam…………...
34
36
6. Induksi Kalus Pada Antera Jeruk Pamelo... 38
DAFTAR GAMBAR
Halaman1. Bagan alir untuk mendapatkan galur murni melalui kultur
antera... 5
2. Perbandingan morfologi daun jeruk keprok Garut,
keprok Batu 55, jeruk Siam dan jeruk Pamelo... 7
3. Morfologi bunga jeruk keprok Garut,
keprok Batu 55, jeruk Siam, dan jeruk Pamelo... 8
4. Morfologi buah jeruk keprok Garut,
keprok Batu 55, jeruk Siam, dan jeruk Pamelo... 9
5. Morfologi umum Bunga Jeruk……….
6. Tahapan perkembangan mikrospora...
10
17
7. Kondisi umum di laboratorium Biologi Sel dan
Jaringan BB-Biogen... 26
8. Perkembangan inti mikrospora jeruk... 28
9. Perbandingan ukuran sepal dan petal bunga
jeruk Pamelo dan bunga Jeruk siam... 29
10. Respon antera jeruk keprok Garut... 32
11. Respon antera jeruk keprok Batu 55...
12. Respon antera jeruk Siam...
35
37
13. Respon antera jerukPomelo... 39
DAFTAR LAMPIRAN Halaman
Komposisi Pembuatan Media MT……….
PENDAHULUAN
Latar Belakang
Jeruk (Citrus sp) merupakan salah satu genus dari famili Rutaceae yang mempunyai nilai ekonomi paling tinggi (Karsinah et al. 2002). Pada umumnya buah jeruk banyak disukai masyarakat karena rasanya yang manis menyegarkan
dan kulitnya yang mudah dikupas serta mengandung vitamin C yang tinggi
(Helmiyesi 2009). Indonesia merupakan salah satu produsen jeruk yang
mempunyai potensi cukup besar untuk memenuhi kebutuhan konsumen di dalam
dan di luar negeri. Meskipun demikian produksi jeruk nasional belum mencukupi
kebutuhan konsumen karena produksi jeruk mengalami penurunan dari 2. 625.
884 ton pada tahun 2007 menjadi 2.467.632 ton pada tahun 2008 (Badan Pusat
Statistik 2010). Oleh sebab itu Indonesia masih termasuk negara pengimpor jeruk
terbesar kedua di ASEAN setelah Malaysia.
Upaya untuk meningkatkan produksi dan kualitas jeruk selain perluasan
areal pertanaman, juga dapat dilakukan melalui program pemuliaan tanaman
dengan menggunakan benih hibrida yang berdaya hasil tinggi dan berkualitas baik
secara genetik maupun daya tumbuhnya. Benih hibrida dapat diperoleh dari
persilangan galur murni yang digunakan sebagai tetua. Untuk memperoleh galur
murni dapat dilakukan melalui pemuliaan secara konvensional, yaitu dengan cara
selfing yang dilanjutkan dengan proses seleksi. Namun penerapan teknik ini membutuhkan waktu yang lama (Somantri dan Ambarwati 2001). Oleh sebab itu,
dibutuhkan suatu metode yang dapat mempersingkat waktu untuk memperoleh
galur murni.
Salah satu alternatif untuk dapat memperoleh galur murni dalam waktu
yang relatif singkat adalah melalui kultur antera. Kultur antera merupakan salah
satu teknik kultur jaringan yang mengkulturkan atau menanam antera sehingga
diperoleh tanaman haploid. Kultur antera dapat menghasilkan embrio maupun
menghasilkan kalus yang dapat diregenerasikan menjadi tanaman haploid, dan
jika dilakukan penggandaan kromosom akan dihasilkan tanaman double haploid yang homozigot. Tanaman double haploid dapat digunakan sebagai tetua dalam pemuliaan konvensional untuk menghasilkan hibrida F1. Selain untuk
digunakan sebagai sumber jaringan haploid untuk fusi protoplas dan pemuliaan
non konvensional lainnya dalam upaya menghasilkan tanaman unggul.
Kultur antera sudah banyak berhasil diterapkan pada banyak tanaman,
diantaranya pada tanaman padi (Zhang dan Oifeng 1993; Dewi dan Purwoko
2001) dan tomat (Zagorska et al. 1998). Faktor - faktor yang mempengaruhi keberhasilan induksi kalus dari kultur antera diantaranya: (1) penentuan fase
perkembangan mikrospora yang responsif, (2) perlakuan cekaman suhu atau
sumber karbon, (3) komposisi media yang sesuai, dan (4) kondisi inkubasi kultur
yang mendukung (Thomas dan Davey 1975).
Salah satu faktor penting yang mempengaruhi produksi tanaman haploid
melalui kultur antera adalah tahap perkembangan mikrospora. Pada sebagian
besar jenis tanaman, antera hanya responsif selama fase uninukleat dari
perkembangan polen. Sebaliknya, pada tanaman tembakau respon optimum
ditemukan pada beberapa saat sebelum, selama dan sesudah fase mitosis pertama
dari polen (akhir fase uninukleat hingga awal binukleat dari polen).
Faktor lain yang menentukan keberhasilan kultur antera ialah pra-
perlakuan terhadap antera sebelum kultur antera. Sebelum diintroduksikan pada
lingkungan in vitro, antera dapat diberi praperlakuan cekaman seperti pemberian manitol, pemberian temperatur (rendah dan tinggi), pemberian osmotik,
pemberian nitrogen dan pemberian karbohidrat (Kyo dan Harada 1986; Immonen
dan Antilla 1999). Dengan praperlakuan cekaman, proses metabolisme pada
jaringan akan terhenti untuk sementara. Setelah periode waktu tertentu jaringan
tersebut mulai berkembang lagi dengan lintasan metabolisme yang baru apabila
berada pada kondisi lingkungan yang mendukung (Immonen dan Antilla 1999).
Praperlakuan cekaman juga berperan dalam pembelokan jalur perkembangan
gametofitik ke arah sporofitik untuk menghasilkan embrio atau tunas. Tanpa
cekaman mikrospora akan berkembang menjadi polen masak yang normal.
Cekaman dapat diaplikasikan pada level tanaman utuh, kuncup bunga, antera atau
langsung pada mikrospora (Touraev et al. 1997).
Komposisi media dasar, dan teknik isolasi merupakan faktor penting lain
yang mempengaruhi keberhasilan kultur antera. Optimasi media terseleksi
menginduksi pembentukan kalus, embrio, maupun regenerasi eksplan yang
dikulturkan. Media dalam kultur jaringan tanaman umumnya terdiri dari
komponen hara makro, mikro, vitamin, asam amino, gula, bahan organik, bahan
pemadat (agar), dan zat pengatur tumbuh.
Tujuan Penelitian
Tujuan penelitian ini adalah: (1) untuk mempelajari perkembangan inti
mikrospora pada beberapa spesies jeruk, (2) mempelajari pengaruh lama
praperlakuan dingin (10oC) terhadap kemampuan induksi kalus jeruk, (3) untuk mempelajari respon berbagai spesies jeruk terhadap formulasi media induksi
kalus.
Hipotesis
Hipotesis penelitian ini adalah: (1) terdapat perkembangan inti mikrospora
yang berbeda pada berbagai ukuran bunga tanaman jeruk, (2) terdapat lama
praperlakuan dingin yang dapat menginduksi kalus antera jeruk dalam jumlah
terbanyak, (3) terdapat respon antera jeruk yang mengkalus terhadap formulasi
media kultur yang digunakan.
Kerangka Pemikiran
Salah satu upaya untuk mendapatkan galur murni yaitu melalui kultur
antera. Melalui kultur antera akan dihasilkan kalus yang dapat diregenerasikan
menjadi tanaman haploid. Kalus haploid dapat digunakan sebagai bahan dalam
pemuliaan non konvensional. Penggandaan kromosom pada tanaman haploid akan
menghasilkan tanaman double haploid. Kultur antera dapat dilakukan secara langsung dimana mikrospora yang terdapat pada antera langsung beregenerasi
menjadi embrio, dan secara tidak langsung dimana antera terlebih dahulu dinduksi
untuk menghasilkan kalus, kemudian kalus diregenerasikan menjadi planlet. Pada
penelitian ini antera di arahkan untuk menghasilkan kalus sebagai sumber jaringan
haploid untuk program pemuliaan tanaman.
Antera yang responsif untuk membentuk kalus atau embrio adalah antera
Mikrospora yang berada pada fase uninukleat ditandai dengan keberadaan inti
yang berada di tengah. Oleh sebab itu, sebelum antera diinduksi pada lingkungan
in vitro, terlebih dahulu dilakukan pengamatan perkembangan inti mikrospora berdasarkan ukuran sepal dan petal bunga dengan tujuan untuk mendapatkan
mikrospora dengan persentase inti tunggal yang banyak.
Bunga yang mengandung mikrospora dengan inti tunggal yang banyak
diberi praperlakuan dingin (10oC) untuk membelokkan jalur perkembangan gametofitik ke arah sporofitik. Induksi kalus dapat ditingkatkan melalui perlakuan
optimasi media, kemudian kalus yang diperoleh dianalisis berdasarkan metode
praperlakuan lengkap untuk mengetahui jumlah kromosom. Bagan alir penelitian
Gambar 1. Bagan alir penelitian yang dilakukan Kultur Antera
Studi perkembangan inti mikrospora jeruk keprok Garut, keprok Batu 55, Siam, dan Pamelo
Mikrospora dengan inti satu (uninukleat) >70%
Praperlakuan dingin (10oC) selama 1, 3,5 dan 7 hari pada bunga jeruk keprok Garut
Lama praperlakuan terbaik untuk menginduksi kalus
Kalus Optimasi media untuk mendapatkan
kalus jeruk keprok Batu 55, Siam dan Pamelo.
uji
TINJAUAN PUSTAKA
Klasifikasi Jeruk
Jeruk merupakan tanaman asli buah tropika yang berasal dari Asia
terutama India dan Indo-Cina (Webber 1967; Chapot 1975). Sejak ratusan tahun
yang lalu, jeruk sudah tumbuh di Indonesia baik secara alami maupun yang
dibudidayakan. Jeruk yang ada di Indonesia didatangkan dari Amerika dan Italia
oleh orang Belanda (Khan 2007). Daerah - daerah yang terkenal sebagai daerah
pusat jeruk di Indonesia diantaranya Garut (Jawa Barat), Tawamangu (Jawa
Tengah), Batu (Jawa Timur), Tejakula (Bali), Selayar (Sulawesi Selatan),
Pontianak (Kalimantan Barat), Brastagi (Sumatera Utara) dan Soe (Nusa
Tenggara Timur) (Martosupono et al. 2007).
Jeruk keprok merupakan salah satu jenis jeruk yang sudah lama dikenal
dan dibudidayakan oleh masyarakat Indonesia serta diperdagangkan di pasar
internasional. Jenis jeruk lain yang banyak dibudidayakan di Indonesia antara lain
jeruk Siam, dan jeruk Pamelo. Van Steenis (1975) mengklasifikasikan jeruk
sebagai berikut: (1) Divisi: Spermatophyta, (2) Sub divisi: Angiospermae, (3)
Kelas: Dicotyledonae, (4) Ordo: Rutales, (6) Keluarga: Rutaceae, (7) Genus:
Citrus, (8) Spesies: Citrus sp. Aspek - aspek penting yang membedakan antara spesies jeruk keprok, jeruk Siam, dan jeruk Pamelo adalah terletak pada habitus
tanaman, morfologi daun, bentuk dan ada tidaknya sayap daun, morfologi bunga,
morfologi buah, dan morfologi biji (Martasari dan Hardiyanto 2003).
Jeruk Keprok merupakan jenis pohon dengan tinggi 2 - 8 meter. Tangkai
daun bersayap sangat sempit sampai tidak bersayap dengan panjang 0,5 - 1,5 cm.
Helaian daun berbentuk bulat telur memanjang atau berbentuk lanset dengan
ujung tumpul, tepinya bergerigi beringgit sangat lemah dengan panjang 3,5 - 8 cm
(Gambar 2). Bunganya mempunyai diameter 1,5 - 2,5 cm, berkelamin dua, daun
mahkotanya putih (Gambar 3). Buahnya berbentuk bola tertekan dengan panjang
5 - 8 cm, tebal kulitnya 0,2 - 0,3 cm dan daging buahnya berwarna oranye
(Gambar 4). Rantingnya tidak berduri, habitus tegak, kulitnya mudah dikupas,
bersifat poliembriogenik, kotiledon berwarna hijau, dan tangkai daunnya selebar 1
berbagai macam senyawa kimia diantaranya tangeraxanthin, tangeritin, tryptophan, tyrosine, nobiletin, cis-3-hexenol, cis-carveol, dan citric-acid. Tangeritin dan nobiletin merupakan senyawa methoxyflavone dan polymethoxyflavon yang mempunyai potensi sebagai antikanker (Tang et al. 2009).
Gambar 2. Morfologi daun: A. Jeruk Keprok Garut; B. Jeruk keprok Batu 55; C. Jeruk Siam; D. Jeruk Pamelo.
Jeruk keprok merupakan tanaman asli Melayu tetapi sekarang
penyebarannya hampir terdapat pada semua daerah tropis dan subtropis di dunia.
Temperatur optimal pertumbuhan tanaman antara 25 - 30 oC namun ada yang masih dapat tumbuh normal pada 38 oC. Semua jenis jeruk tidak menyukai tempat yang terlindung dari sinar matahari. Kelembaban optimum untuk pertumbuhan
jeruk keprok sekitar 70 – 80% (Khan 2007).
Salah satu varietas atau jenis jeruk lain yang banyak disukai oleh
masyarakat adalah jeruk Siam. Jenis jeruk ini banyak disukai masyarakat karena
rasanya yang lebih manis dibanding jeruk keprok. Secara garis besar, jeruk Siam
dan jeruk keprok sulit dibedakan karena mempunyai aroma daun yang sama,
ukuran bunga dan buah yang hampir sama (Gambar 3 dan 4), akan tetapi buah
jeruk Siam lebih sulit dikupas kulitnya dibandingkan dengan buah jeruk Keprok.
Jeruk Siam juga berbeda dengan jeruk Keprok karena mempunyai ranting yang
berduri, habitus tegak menyebar, daunnya bersayap dengan ukuran lebih kecil
dibanding daun jeruk keprok (Gambar 2), monoembrionik, dan kotiledon
berwarna putih. Jeruk Siam mempunyai bentuk bunga seperti lonceng, jumlah
bunga terdiri dari 8-10 buah / tandan (Badan Litbang Pertanian 2005).
D B
Gambar 3. Morfologi bunga: A. Jeruk keprok Garut; B. Keprok Batu 55; C. Jeruk Siam; D. Jeruk Pamelo.
Jeruk Pamelo merupakan salah satu jenis buah jeruk besar yang sudah
lama dikenal di Indonesia dan diduga merupakan salah satu jenis tanaman asli
Indonesia (Purwanto et al. 2003). Jeruk Pamelo mempunyai bentuk daun ovale atau elliptic ovale yang berukuran besar dan bersayap (Gambar 2). Jeruk Pamelo mempunyai ukuran bunga yang lebih besar jika dibandingkan dengan bunga jeruk
Keprok dan jeruk Siam. Bentuk buah jeruk Pamelo berukuran besar dan
mempunyai kulit buah yang tebal (Gambar 3), habitus tegak menyebar dan
cenderung bersifat monoembrioni.
Tanaman jeruk tumbuh baik pada pH tanah antara 5 - 6, pada pH yang
lebih tinggi sering terjadi defisiensi hara terutama unsur mikro Zn, Cu, Mn, dan
Fe. Tanah yang mengandung kadar boron serta memiliki kadar garam tinggi
merupakan jenis tanah yang kurang baik bagi pertumbuhan tanaman jeruk.
Perbanyakan tanaman jeruk secara konvensional dapat dilakukan secara generatif
maupun vegetatif. Perbanyakan secara generatif dapat dilakukan dengan
menggunakan biji, namun akan menghasilkan buah yang beragam dan sering
tidak bersifat unggul walaupun berasal dari pohon induk yang unggul, sedangkan
perbanyakan tanaman jeruk secara vegetatif dapat dilakukan dengan
A
B
menggunakan cabang, batang, akar dan daun melalui setek, cangkok dan okulasi.
Namun tingkat keberhasilannya dipengaruhi oleh cara perbanyakan, waktu
melakukan perbanyakan, dan keterampilan pelaksana (Sukarmin 2008).
Gambar 4. Morfologi buah: A. Jeruk keprok Garut; B. keprok Batu 55; C. Jeruk Siam; D. Jeruk Pamelo.
Upaya untuk menghasilkan buah jeruk yang bersifat unggul dan seragam
dapat dilakukan melalui pembentukan tanaman haploid melalui kultur antera.
Melalui kultur antera dapat diperoleh tanaman haploid atau embrio haploid, dan
jika dilakukan penggandaan kromosom akan diperoleh tanaman haploid ganda
yang homozigot (Morrison dan Evans 1988). Pembentukan tanaman haploid
melalui kultur antera dapat dilakukan melalui jalur tidak langsung yaitu melalui
pembentukan kalus terlebih dahulu. Kalus merupakan kumpulan sel amorphous yang terjadi pada sel-sel jaringan yang membelah diri secara terus-menerus.
Tujuan kultur kalus adalah untuk memperoleh kalus dari penanaman eksplan pada
B A
lingkungan terkendali. Kalus diharapkan dapat memperbanyak massa selnya
secara terus-menerus (Gunawan 1992).
Morfologi Bunga Jeruk
Bunga jeruk merupakan bunga lengkap yang terdiri atas tangkai bunga
(pedicel), sepal (caliyx), petal (corolla), kepala putik (stigma), style, bakal buah
(ovary), kepala sari (antera), filamen (Gambar 5). Bagian – bagian bunga dapat digunakan sebagai eksplan dalam pemuliaan secara kultur jaringan. Salah satu
tujuan yang mengggunakan bagian bunga sebagai eksplan yaitu untuk
mendapatkan tanaman haploid karena tanaman haploid merupakan tanaman yang
mempunyai kromosom sama dengan gamet. Bagian – bagian bunga yang dapat digunakan untuk menghasilkan tanaman haploid yaitu bagian bunga yang
merupakan alat reproduksi yaitu mikrospora, antera, atau bakal buah.
Kultur Antera
Kultur antera merupakan salah satu teknik kultur in vitro yang dapat menghasilkan tanaman haploid. Tanaman haploid adalah tanaman yang
mempunyai jumlah kromosom sama dengan jumlah kromosom gametnya, yakni
mempunyai jumlah kromosom sembilan untuk tanaman jeruk (Bajaj 1983). Jika petal
sepal bakal buah
filamen antera
dilakukan penggandaan kromosom akan diperoleh tanaman double haploid homozigos (galur murni).
Tujuan dari kultur antera adalah untuk mendapatkan tanaman haploid
unggul yang akan dipergunakan untuk merakit kultivar-kultivar baru (Wattimena
1992). Kultur antera akan menghasilkan tanaman homozigot dalam waktu yang
singkat sehingga proses selfing (6-8 generasi) dalam pemuliaan konvensional dapat dihilangkan dan program pemuliaan dapat dilakukan lebih singkat (Taji et al. 2002).
Kultur antera memiliki beberapa keuntungan diantaranya: (1) tanaman
homozigot diperoleh dalam waktu relatif singkat (2) efisiensi seleksi, (3)
memperluas variabilitas genetik melalui produksi variasi gametoklonal, (4) gen
resesif dapat terekspresi (Zapta 1990). Keberhasilan kultur antera untuk
mendapatkan tanaman haploid pertama kali dilaporkan oleh Guha dan Maheswari
(1966) pada tanaman Datura innoxia, dimana kepala sari Datura innoxia yang ditanam pada media yang mengandung kasein hidrolisat, IAA, kinetin, suplemen
air kepala, dan ekstrak anggur dapat menghasilkan embrio pada umur 6 minggu
setelah tanam. Keberhasilan kultur antera selanjutnya dilaporkan oleh Bourgin
dan Nitsch (1967) pada tanaman Nicotiana tabacum.
Ayed et al (2010) melaporkan pengaruh praperlakuan terhadap keberhasilan kultur mikrospora pada tanaman Triticum turgidum. Praperlakuan tediri dari delapan perlakuan: (1) Praperlakuan suhu dingin selama 5 hari, (2)
pemberian 0,3M manitol pada suhu 40C selama 12 hari, (3) pemberian 0,3M manitol pada suhu 40C selama 7 hari, (4) pemberian 0,7M manitol pada suhu 40C selama 5 hari, (5) pemberian PEG 1,5% pada suhu 40C selama 5 hari, (6) pemberian PEG 1% pada suhu 40C selama 15 hari, (7) pemberian PEG 1% pada suhu 40C selama 10 hari, dan (8) kontrol. Berdasarkan hasil penelitian tersebut diperoleh bahwa praperlakuan dingin (40C) selama 5 hari merupakan praperlakuan yang paling efektif untuk menginduksi terbentuknya embrio pada mikrospora
Triticum turgidum. Sebaliknya pada mikrospora cabai merah besar peningkatan induksi embriogenesis dapat dilakukan dengan memberikan praperlakuan pada
Teknik kultur antera relatif sederhana, cepat dan efisien dalam
menghasilkan jaringan atau tanaman haploid pada kebanyakan spesies (Bajaj
1983; Bhojwani dan Radzan 1993). Faktor terpenting dan kritis pada kultur antera
adalah penentuan tingkat perkembangan polen yang tepat untuk dijadikan eksplan
sehingga androgenesis dapat terjadi (Bajaj 1983). Berdasarkan hasil penelitian
yang telah dilakukan oleh Dus et al. (2002) pada kultur antera jagung, diketahui mikrospora yang berada pada tahapan perkembangan inti mid-uninucleat merupakan tahapan perkembangan mikrospora yang paling responsif untuk
menginduksi terbentuknya embrio sebanyak 8,54%
Shirdelmoghanloo et al. (2009) menyatakan bahwa keberhasilan kultur antera dalam pembentukan embrio pada kultur mikrospora juga dipengaruhi oleh
faktor praperlakuan dan faktor media. Berdasarkan hasil penelitian yang
dilakukan oleh Shirdelmoghanloo et al. (2009) pada kultur mikrospora Triticum aestivum, dapat diketahui bahwa dengan memberikan kombinasi praperlakuan dingin (4oC) dan manitol (0,3M) selama 3 minggu dapat menghasilkan jumlah embrio tertinggi yaitu berkisar 112 embrio per malai dibandingkan tanpa
praperlakuan (kontrol) yang hanya mampu menghasilkan embrio berkisar 43 per
malai. Media perlakuan terbaik untuk menginduksi embrio Triticum aestivum tersebut adalah media MT dengan penambahan ZPT 0,2 mg/l 2,4-D + 0,2 mg/l
kinetin + 1 mg/l IAA dengan jumlah embrio yang dihasilkan yaitu 190 per malai.
Antera mengandung serbuk sari (polen), sehingga kultur antera berarti
mengikutsertakan polen didalamnya. Polen akan beregenerasi menjadi tanaman
haploid yang tidak memiliki pasangan kromosom yang homolog sehingga pada
saat meiosis berlangsung, kromosom - kromosomnya tidak berpasang pasangan,
seperti halnya pada tanaman diploid, sehingga individu – individu haploid untuk tanaman diploid bersifat steril. Oleh sebab itu perlu dilakukan penggandaan
kromosom untuk mendapatkan tanaman yang fertil dengan menggunakan bahan
kimia seperti penggunaan kolkisin yang sifatnya dapat menginduksi poliploidi
(Bhojwani dan Razdan 1993; Croughan 1995; Ferrie dan Keller 1995).
Selain secrara sitologi, tanaman haploid dapat dibedakan dengan tanaman
diploid dengan cara morfologi terutama pada saat tanaman tersebut sudah
ukuran daun, perkembangan akar, dan vigor tanaman. Muswita (2003)
menyatakan pada tanaman cabai haploid, ukuran daun lebih kecil dibandingkan
dengan tanaman diploid dan bersifat steril.
Penggunaan tanaman haploid ganda (double haploid) dalam pemuliaan akan lebih efisien dalam mengidentifikasi genotipe - genotipe superior karena
tanaman tersebut akan mengekspresikan semua sifat-sifatnya. Manfaat dari
tanaman haploid ganda: (1) sebagai tetua untuk mendapatkan hibrida F1, (2)
pemuliaan mutasi karena dapat dilakukan untuk skrening mutan dominan dan
resesif pada generasi pertama setelah perlakuan mutagen, (3) bahan tanaman
dalam penembakan gen, dan (4) seleksi transgen(Lentini et al. 1995).
Faktor yang mempengaruhi keberhasilan kultur antera
1. Genotipe tanaman donor
Genotipe dari antera memegang peranan penting dalam menentukan
berhasil atau tidaknya kultur antera. Hasil penelitian Hoque et al. (2007) pada tanaman Trapa sp melaporkan dari 18 genotipe tanaman yang diuji, hanya 15 genotipe tanaman yang memiliki kemampuan untuk diinduksi membentuk kalus.
Hal tersebut menjelaskan bahwa tiap-tiap genotipe tanaman memiliki respon yang
berbeda dalam hal kemampuannya dalam menginduksi kalus.
Munarso et al. (2008) dalam penelitiannya menyatakan bahwa, setiap genotipe (kombinasi persilangan) mempunyai kemampuan yang berbeda dalam
menghasilkan kalus. Pada penelitiannya yang menggunakan eksplan antera padi
dapat diketahui jumlah kalus terbanyak dihasilkan oleh IR58025A/BP51-1,
rata-rata tiga butir kalus/cawan petri, IR68897A/RHS412 menghasilkan 2-3 butir
kalus/cawan petri, IR62829A/MTU 9992 menghasilkan tiga butir kalus/cawan
petri, sedangkan IR68886A/Bio-9 menghasilkan satu butir kalus/cawan petri.
Kemampuan antera dalam menghasilkan kalus sangat beragam diantara keempat
genotipe yang dipergunakan. Persentase induksi kalus tertinggi diperoleh dari
IR58025A/BP51-1 sebesar 2,70%, lebih tinggi dari IR68897A/RHS412 (2,04%),
IR62829A/MTU 9992 (1,56%),dan IR68886A/Bio-9 (0,91%).
2. Komposisi media kultur
Salah satu faktor paling penting yang berkaitan dengan pertumbuhan dan
morfogenesis dari jaringan tanaman adalah komposisi dari media kultur. Media
dalam kultur jaringan tanaman umumnya terdiri dari komponen hara makro, hara
mikro, vitamin, asam amino atau suplemen nitrogen lainnya, gula, bahan organik,
bahan pemadat (agar) dan zat pengatur tumbuh. Optimasi media terseleksi
umumnya dilakukan untuk meningkatkan kemampuan medium dalam
menginduksi pembentukan kalus, embrio, maupun regenerasi eksplan yang
dikultur (Hu dan Zeng 1984).
Menurut Sugiri dan Anton (2006), media kultur jaringan dibedakan
menjadi media dasar dan media tambahan. Komposisi media dasar mengandung
hara baik makro maupun mikro, sumber energi dan vitamin yang jumlah dan
jenisnya tergantung dari penemunya. Komposisi media tambahan dapat berupa
vitamin, senyawa organik komplek atau zat pengatur tumbuh. Zat pengatur
tumbuh khususnya auksin dan sitokinin adalah suatu zat organik utama yang
mengendalikan proses morfogenesis di dalam teknik kultur jaringan.
Media dasar yang sering digunakan untuk kultur antera pada jeruk adalah
media Murashige and Tucker (Geraci dan Starrantino 1990; Deng et al. 1992; Froelicher dan Ollitrault 2000). Berdasarkan hasil penelitian Gioi et al. (2002) untuk induksi kalus antera padi, antera ditanam pada tiga media dasar yaitu MS,
LS dan N6, diperoleh hasil bahwa persentase rata-rata tertinggi antera yang dapat
terinduksi menjadi kalus (35,3%) terdapat pada antera yang ditumbuhkan pada
media dasar N6. Media kultur jaringan tanaman disamping menyediakan unsur
hara makro dan hara mikro juga diberi karbohidrat yang pada umumnya berupa
gula untuk menggantikan karbon. Hasil yang lebih baik pada kultur antera akan
diperoleh apabila kedalam media tersebut ditambahkan vitamin-vitamin, asam
amino, atau zat pengatur tumbuh.
3. Kondisi tanaman (eksplan)
Umur dan kondisi fisiologis eksplan sering mempengaruhi keberhasilan
kultur antera. Secara umum, respon yang paling baik berasal dari bunga pertama
yang dihasilkan oleh tanaman, dan antera yang dikulturkan harus berasal dari
pertumbuhan tanaman donor juga mempengaruhi tanaman dihaploid yang
dihasilkan. Intensitas cahaya, lama penyinaran dan suhu diketahui mempengaruhi
jumlah tanaman dihaploid yang dihasilkan pada beberapa spesies. Kondisi
pertumbuhan optimum yang spesifik berbeda antara tanaman yang satu dengan
yang lainnya. Secara umum hasil terbaik akan diperoleh dari tanaman yang
pertumbuhannya sehat dan vigor (Nasir (2002).
4. Pra perlakuan antera
Salah satu faktor yang menentukan keberhasilan induksi embriogenesis
mikrospora ialah praperlakuan terhadap antera sebelum inisiasi kultur. Sebelum
diintroduksikan pada lingkungan in vitro, antera dapat diberi praperlakuan cekaman seperti pemberian manitol pada suhu rendah selama periode waktu
tertentu (Kyo dan Harada 1986; Immonen dan Antilla 1999). Perlakuan cekaman
menyebabkan proses metabolisme pada jaringan akan terhenti untuk sementara
dan setelah periode waktu tertentu jaringan tersebut akan mulai berkembang lagi
dengan lintasan metabolisme yang baru apabila berada pada kondisi lingkungan
yang mendukung (Immonen dan Antilla 1999).
Berdasarkan penelitian yang telah dilakukan oleh Tang et al. (2007) pada antera Mamordica charantia diperoleh hasil bahwa antera dari varietas Bixiu, Dabai, Changhai dan Pangniu yang dipergunakan sebagai eksplan yang disimpan pada suhu 40 C selama 24 jam menghasilkan persentase kalus paling tinggi masing-masing sebesar 73,16 %; 69,89 %; 60,32 % dan 62,01 % apabila
dibandingkan dengan antera yang disimpan pada suhu yang sama (40C) selama 0, 48, 72, 96, dan 120 jam. Berdasarkan penelitian tersebut, antera yang disimpan
selama lebih dari 120 jam tidak menghasilkan kalus dan berakibat pada kondisi
antera yang menjadi kecoklatan dalam 1 minggu.
Praperlakuan cekaman juga berperan dalam pembelokan jalur
perkembangan gametofitik ke arah sporofitik untuk menghasilkan embrio.
Keberhasilan pembelokan jalur perkembangan gametofitik ke arah sporofitik telah
memberikan praperlakuan nitrogen 15 mM dapat meningkatkan embrio dari
mikrospora tanaman tembakau. Tanpa cekaman mikrospora akan berkembang
menjadi polen masak yang normal.
Produktivitas kultur antera pada beberapa spesies tanaman dipengaruhi
oleh perlakuan pemberian suhu pada kuncup bunga sebelum proses sterilisasi dan
isolasi antera. Produktivitas tanaman dihaploid tembakau yang dihasilkan sering
meningkat dengan perlakuan penyimpanan kuncup bunga pada suhu 7 - 8 oC selama 12 hari (Sunderland dan Robert 1979).
5. Tingkat perkembangan mikrospora
Antera hanya responsif selama fase uninukleat dari perkembangan polen
pada sebagian besar jenis tanaman. Sebaliknya, pada tanaman tembakau respon
optimum ditemukan pada beberapa saat sebelum, selama dan sesudah fase mitosis
pertama dari polen (akhir fase uninukleat hingga awal binukleat dari mikrospora)
(Hidaka et al. 1984). Embriogenesis mikrospora dilakukan dengan cara membelokkan perkembangan gametofitik kearah sporofitik untuk menghasilkan
embrio dan tanaman melalui embriogenesis (Touraev et al. 1997). Pra perlakuan stres berperan dalam pembelokan jalur perkembangan tersebut, tanpa stres
mikrospora akan berkembang menjadi pollen masak yang normal (Heberle 1999).
Stres dapat berupa temperatur (rendah dan tinggi), osmotik, pemberian
nitrogen dan karbohidrat. Stres dapat diaplikasikan pada level tanaman utuh,
kuncup bunga, antera atau langsung pada mikrospora. Palmer dan Keller (1997)
menyebutkan bahwa temperatur tinggi dapat mempengaruhi embriogenesis
mikrospora tembakau, datura, brasika dan cabai, sedangkan Touraev et al. (1997) dalam penelitiannya mendapatkan bahwa pemberian karbohidrat dan nitrogen
dapat meningkatkan mikrospora yang embriogenik pada tembakau.
Perkembangan Mikrospora
Proses terbentuknya mikrospora dalam mikrosporangia pada antera
disebut dengan mikrosporosis. Terbentuknya mikrospora ditandai dengan
perubahan – perubahan yang terjadi pada antera. Antera mempunyai bentuk sel- sel yang hampir sama pada waktu masih muda, kecuali sel-sel epidermis. Pada
mempunyai banyak sekali sel yang disebut dengan mikrospora atau pollen mother cell (Raven et al. 1992).
Polen mengalami pembelahan meiosis yang terdiri dari dua tahap. Tahap
pertama adalah pembelahan meiosis I, merupakan pembelahan reduksi karena dari
satu sel dengan 2n kromosom membentuk dua sel dengan (n) kromosom.
Pembelahan tahap kedua adalah pembelahan mitosis, yaitu dari satu sel dengan
(n) kromosom menjadi dua sel dengan (n) kromosom, sehingga pembelahan
reduksi dari 1 sel 2n kromosom menjadi 4 sel dengan (n) kromosom. Keempat sel
yang terjadi sampai dewasa masih berlekatan terus dinamakan pollentetrad. Kemudian pollentetrad yang berlekatan melepaskan diri sehingga terbentuk pollen dengan inti satu. Polen inti satu yang masih muda dinamakan fase
uninukleat, dimana polen sudah mempunyai satu inti vegetatif dan satu vacuola,
kemudian inti sel membelah menjadi dua gamet jantan, yang besar dinamakan inti
vegetatif dan yang kecil disebut inti generatif yang dikenal dengan fase binukleat
seperti terlihat pada Gambar 6 (Suryowinoto 1996).
Gambar 6. Tahapan perkembangan inti mikrospora (Suryowinoto 1996)
Polen yang masih muda atau mikrospora yang terkandung dalam antera
dapat secara langsung beregenerasi membentuk embrio atau membentuk kalus
yang selanjutnya dapat diinduksi untuk bergenerasi menjadi tanaman dengan
pengaruh zat pengatur tumbuh yang terkandung dalam media tanam. Dengan
dari gamet jantan maupun betina tanpa melalui proses pembuahan (Bhojwani dan
Radzan 1993).
Media yang digunakan pada Kultur Antera
Androgenesis dapat diinduksi pada media sederhana seperti yang
dikembangkan oleh Nitsch untuk polen tanaman tembakau dan beberapa spesies
lainnya. Media yang umum digunakan untuk sebagian besar spesies adalah
Murashige dan Skoog dan N6 (Chu 1978) atau variasi kedua media tersebut.
Media perlu diperkaya dengan senyawa organik komplek seperti ekstrak kentang,
air kelapa dan kasein hidrolisat. Pada sebagian besar spesies tanaman, sukrosa
yang digunakan dalam media antara 2 - 3% sementara untuk beberapa spesies lain
khususnya tanaman serealia responnya lebih baik apabila konsentrasi gulanya
lebih tinggi (hingga 15%). Pada kultur antera jeruk, sumber karbohidrat yang
banyak digunakan adalah sukrosa 5% (Hidaka 1987; Froelicher dan Ollitrault
2000).
Berdasarkan penelitian yang telah dilakukan oleh Tang et al. (2007) pada antera Balsam pear, diperoleh hasil bahwa pembentukan kalus tertinggi diperoleh
apabila pada media ditambahkan 2.4 D 0,5 mg/l dan BA 2 mg /l yaitu sebesar
79,42 %. Penggunaan konsentrasi 2,4-D 1,0 mg/l yang dikombinasikan dengan
kinetin 0,1 mg/l sampai 0,3 mg/l merupakan konsentrasi yang paling optimal
untuk menginduksi kalus. Penggunaan konsentrasi 2,4-D yang rendah (0,1 mg/l
dan 0,5 mg/l) menyebabkan sel - sel tanaman belum mampu meningkatkan
kemampuan jaringan untuk melakukan diferensiasi (Syahid et al. 2007).
Prahardini dan Sudaryono (1992) membuktikan bahwa penambahan 3
mg/l NAA dan 2 mg/l BA efektif untuk menginduksi kalus antera pepaya dimana
jumlah kultur per kalus meningkat seiring dengan peningkatan NAA dari 1 mg/l
sampai 3 mg/l. Berdasarkan kebutuhan zat pengatur tumbuh untuk pembentukan
kalus, maka dalam media tanam perlu ditambahkan auksin dan sitokinin. Interaksi
kedua zat ini mempengaruhi pertumbuhan dan morfogenesis jaringan tanaman.
Inisiasi akar pada planlet, embriogenesis, dan inisiasi kalus umumnya terjadi
sementara proliferasi tunas adventif dan aksilar terjadi apabila perbandingannya
lebih rendah (George et al. 2008)
Pikloram merupakan zat pengatur tumbuh yang termasuk ke dalam
kelompok auksin sintetik yang berperan dalam pembentukan dan pertumbuhan
kalus. Peranan pikloram telah diketahui dalam proliferasi kalus pada kultur
jaringan tanaman kina. Sumaryono dan Riyadi (2005) menyatakan proliferasi
kalus terbaik pada medium WP diperoleh dengan pemberian pikloram 15 atau 30 μM yang dikombinasikan dengan BAP 0,5 μM. Kalus pada medium WP ini tumbuh dengan sangat cepat, bobot basah kalus meningkat 12 - 14 kali dari bobot
awal dalam waktu 6 minggu. Kalus yang diperoleh bertekstur remah, berwarna
putih dan tidak mudah mengalami pencokelatan walaupun disubkultur
berulangkali. Marlina (2009) juga menyatakan media MS + 2 mg/l pikloram + 2
mg/l tidiazuron + 2 mg/l zeatin memberikan pengaruh positif untuk induksi kalus
tanaman.
Kultur Antera pada Tanaman Jeruk
Penelitian pada tanaman jeruk secara kultur jaringan (in vitro) sudah banyak dilakukan, dan pada umumnya menggunakan eksplan jaringan tanaman
yang masih muda karena sel – selnya masih aktif membelah. Salah satu penelitian tanaman jeruk yang masih mempunyai tingkat keberhasilan yang rendah adalah
penelitian kultur antera. Keberhasilan kultur antera dipengaruhi oleh genotipe,
kondisi tumbuh tanaman donor, tingkat perkembangan mikrospora, pra perlakuan,
media, dan lingkungan yang mendukung (Wehr dan Wenzel 1993). Germana
(2000) dalam Maluszynski et al. 2003 menyatakan persentase kalus tertinggi Citrus clementiana dihasilkan pada media MS + 5% sukrosa + 0,02 mg/l NAA.
Salah satu faktor yang mempengaruhi keberhasilan kultur antera adalah
praperlakuan sebelum kultur antera. Chen (1985) memberikan praperlakuan
menyatakan pemberian temperatur rendah (4 oC) selama 10 hari merupakan praperlakuan yang terbaik untuk menginduksi kalus antera Citrus clementina.
Faktor lain yang mempengaruhi keberhasilan kultur antera adalah sumber
karbon. Hidaka (1987) melakukan penelitian kultur antera pada Citrus sinensis dan Citrus aurentum dengan memberikan sukrosa (1, 3, 5, 7, dan 9)%. Hasil penelitian menyatakan pemberian sukrosa 1% dapat menginduksi kalus dan
embrio Citrus sinensis sebanyak 30%, dan pemberian sukrosa 7% merupakan konsentrasi yang paling baik untuk menginduksi kalus dan embrio Citrus aurentum. Ling et al (1988) menyatakan bahwa persentase embrio tertinggi (0,92%) diperoleh dengan pemberian 2mg/l IAA pada Citrus madurensis. Berbeda dengan pernyataan Geraci and Starrantino (1990) yang menyatakan
pemberian 1 mg/l BAP dan 0,5 mg/l 2,4-D merupakan media terbaik untuk
menginduksi kalus dengan persentase tertinggi (25%) pada Citrus reticulata, Citrus deliciosa, dan Citrus paradisi, sedangkan pada Citrus sinensis pemberian 1 mg/l NAA dan 1 mg/l BAP merupakan media terbaik untuk meninduksi kalus
METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Desember 2009 sampai dengan
Januari 2011 di laboratorium kultur in vitro kelompok Peneliti Biologi Sel dan Jaringan, Balai Besar Penelitian dan Pengembangan Bioteknologi dan
Sumberdaya Genetik Pertanian Bogor (BB-BIOGEN) dan di laboratorium kultur
jaringan Departemen Agronomi dan Hortikultura Fakultas Pertanian Institut
Pertanian Bogor.
Bahan dan Alat
Bahan tanam yang digunakan dalam penelitian ini adalah kuncup bunga
jeruk keprok Batu 55 (Citrus reticulata L), jeruk keprok Garut (Citrus reticulata L), Jeruk Siam (Citrus sinensis L) dan jeruk Pamelo (Citrus maxima L). Peralatan yang digunakan adalah Laminar Air Flow Cabinet (LAFC), autoklaf, mikropipet, alat-alat diseksi (pinset, gunting, dan skalpel), pH meter, botol kultur, peralatan
gelas, bunsen dan sprayer.
Metode Penelitian:
1. Studi tahapan perkembangan inti mikrospora antera jeruk
Bahan yang digunakan adalah kuncup bunga jeruk keprok Garut, keprok
Batu 55, dan jeruk Siam dengan perbandingan ukuran sepal : petal = kecil (1:2;
1:2,5; 1:3) mm; Sedang (1:4; 2:5; 2:6) mm; dan Besar (2:7; 2:8; 2:9) mm. Pada
kuncup bunga jeruk Pamelo mempunyai perbandingan ukuran sepal : petal = kecil
(6:10; 6:11; 6:12) mm; Sedang (6:14; 6:15; 6:17) mm; dan Besar (7:19; 7:20;
7:21) mm. Pengamatan mikrospora dilakukan dengan memecah kantung antera,
kemudian mikrospora diisolasi dan diletakkan di atas preparat lalu diberi aquadest
dua tetes. Penghitungan dilakukan secara mikroskopik dengan perbesaran 400x.
Tahap perkembangan mikrospora yang diamati adalah (1) persentase tahap inti
tunggal (uninucleate), (2) persentase tahap inti dua (binucleate), dan (3) tidak teramati. Pengamatan mikrospora dilakukan empat kali bidang pandang
2. Studi praperlakuan lama penyimpanan antera terhadap kemampuan
induksi kalus jeruk Keprok Garut
Rancangan lingkungan yang digunakan adalah Rancangan Acak Lengkap
(RAL) faktor tunggal yaitu praperlakuan penyimpanan pada suhu dingin (10oC) dengan 4 taraf yaitu (1; 3; 5; dan 7) hari. Setiap perlakuan terdiri dari 5 ulangan,
dan setiap botol merupakan satu ulangan, dimana dalam satu botol berisi 10
antera. Pengamatan dilakukan sampai minggu ke-8.
Kuncup bunga jeruk Keprok Garut yang mempunyai tahapan
perkembangan inti mikrospora uninukleat yang tinggi, dimasukkan ke dalam
tabung reaksi dan ditutup dengan aluminium foil, lalu tabung reaksi dimasukkan
ke dalam botol yang telah berisi air dan dimasukkan dalam lemari pendingin
(10oC) sesuai dengan perlakuan. Antera kemudian diisolasi dari kuncup bunga dan ditanam pada media dasar Murashige dan Tucker (MT) yang ditambahkan 10
mg/l pikloram. Peubah yang diamati dalam percobaan ini adalah: jumlah antera
yang membesar / membengkak dan jumlah antera yang menghasilkan kalus.
3. Induksi kalus pada antera jeruk Keprok Batu 55, jeruk Siam dan jeruk
Pamelo
Antera jeruk Keprok Batu 55, jeruk Siam dan jeruk Pamelo yang telah
mendapatkan praperlakuan dingin (10oC) terbaik (5 hari) ditanam pada berbagai komposisi media induksi kalus.
3.1 Jeruk keprok Batu 55
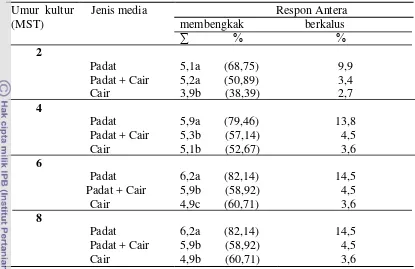
Rancangan yang digunakan adalah RAL faktor tunggal yaitu perlakuan
jenis media dengan 3 taraf yaitu; (1) Padat; (2) Padat + Cair; (3) Cair. Setiap
perlakuan terdiri atas 14 ulangan dimana setiap botol merupakan satu ulangan dan
dalam satu botol berisi 8 antera. Komposisi media yang digunakan adalah media
dasar MT + 3 mg/l BAP + 500 mg/l ekstrak malt. Media dipadatkan dengan
phytagel 2 g/l kecuali media cair, pH media diatur pada 5,8. Kultur diinkubasi
pada ruang gelap. Sub kultur dilakukan dua kali dalam sebulan sampai 4 kali sub
kultur pada media yang sama. Peubah yang diamati dalam percobaan ini adalah:
3.2 Jeruk Siam
Rancangan lingkungan yang digunakan adalah RAL faktor tunggal yaitu
perlakuan 2,4-D dengan 3 taraf yaitu: 3mg/l, 5 mg/l, dan 7 mg/l. Setiap perlakuan
terdiri dari 15 ulangan dimana setiap botol merupakan satu ulangan dan dalam
satu botol berisi 7 antera. Antera jeruk Siam ditanam pada media dasar MT + 500
mg/l ekstrak malt. Media dipadatkan dengan phytagel 2 g/l, pH media diatur pada
5,8 dan diinkubasi pada ruang gelap. Sub kultur dilakukan dua kali dalam sebulan
sampai 4 kali sub kultur pada media yang sama. Peubah yang diamati dalam
percobaan ini adalah: jumlah antera yang membengkak, dan jumlah antera yang
menghasilkan kalus.
3.3 Jeruk Pamelo
Rancangan lingkungan yang digunakan adalah RAL faktor tunggal yaitu
perlakuan media (3 mg/l BAP dan NAA) dengan 3 taraf yaitu: (1) 1 mg/l NAA;
(2) 2 mg/l NAA; (3) 3mg/l NAA. Setiap perlakuan terdiri dari 15 ulangan dimana
setiap botol merupakan satu ulangan dan dalam botol berisi 5 antera. Antera yang
ditanam adalah antera yang mengandung mikrospora dengan inti tunggal tinggi
dan telah mendapatkan praperlakuan dingin (10oC) diinduksi pada media dasar MT + kombinasi (3 mg/l BAP dan NAA) + 500 mg/l ekstrak malt. Semua
perlakuan media dipadatkan dengan phytagel 2 g/l kecuali media cair, pH media
diatur pada 5,8 dan diinkubasi pada ruang gelap. Sub kultur dilakukan dua kali
dalam sebulan sampai 4 kali sub kultur pada media yang sama.
Semua hasil penelitian (studi praperlakuan lama penyimpanan pada antera
jeruk keprok Garut, induksi kalus pada jeruk keprok Batu 55 dan jeruk Siam serta
jeruk Pamelo) dianalisis dengan menggunakan analisis ragam (uji F) pada taraf
Analisis Kromosom
Jumlah kromosom kalus jeruk dianalisis dengan menggunakan Metode
Pra-perlakuan Lengkap (Sastrosumarjo 2006). Kalus dimasukkan kedalam botol
yang berisi larutan 8-Hydroxyquinolin 0,002 M. Botol dimasukkan ke dalam lemari pendingin (4oC) selama 90 menit, lalu kalus dikeluarkan dan dicuci dengan air. Kalus yang telah dicuci dengan air, direndam dalam asam asetat 45% selama
10 menit kemudian dimasukkan dalam botol berisi campuran HCl dengan asam
asetat 45% perbandingan 3:1 selama 2 menit, lalu dipanaskan dalam waterbath dengan suhu 60oC selama 2 menit.
Kalus dipindahkan ke gelas arloji, kemudian diteteskan aceto orcein 2%
dan biarkan selama 10 menit. Kalus diletakkan pada gelas objek, kemudian
diberikan 2 tetes aceto orcein 2% lalu ditutup dengan gelas penutup. Preparat
dilewatkan di atas api bunsen 2-3 kali kemudian preparat diketuk dengan pensil
berkaret (squash), lalu ditekan dengan ibu jari. Preparat siap diamati dibawah
HASIL DAN PEMBAHASAN
1. Kondisi Umum Percobaan
Sejumlah faktor lingkungan yang berpengaruh terhadap pertumbuhan dan
perkembangan kultur adalah suhu, cahaya, karbondioksida, oksigen, etilen, dan
kelembaban (Zulkarnain 2009). Read (1990) menyatakan bahwa faktor suhu
berpengaruh secara langsung terhadap perkembangan sel dan jaringan,
pembentukan organ tanaman, dan berkaitan erat dengan siklus perkembangan
tanaman. Suhu penyebab terjadinya morfogenesis tidak selalu sama pada setiap
spesies tanaman. Pada tanaman tomat, perlakuan suhu 19oC pada beberapa saat dapat meningkatkan potensi regenerasinya. Sementara itu, pada eksplan tangkai
bunga Brassica napus pembentukan pucuk adventif terbaik diperoleh pada suhu 24oC. Laboratorium tempat dilakukannya penelitian sangat menjaga kestabilan suhu ruang kultur supaya tetap terjaga pada kisaran 25 - 28oC (Gambar 7A). Kestabilan suhu ruang kultur tersebut dibantu dengan kondisi Air Conditioner
(AC) yang tetap dihidupkan selama 24 jam.
Faktor lain yang mempengaruhi perkembangan eksplan ialah intensitas
cahaya. Intensitas cahaya selalu dijaga dengan baik agar tanaman dapat
melakukan morfogenesis. Penelitian yang tidak membutuhkan cahaya seperti
induksi kalus dilakukan di ruangan gelap. Laju fotosintesis pada kebanyakan
tanaman yang dikulturkan secara in vitro pada umumnya relatif rendah karena kebutuhan karbohidrat sudah dipenuhi melalui suplai sukrosa dari medium.
Menurut George dan Sherrington (1984), pertumbuhan jaringan tanaman secara in vitro membutuhkan cahaya untuk mendapatkan pertumbuhan dan morfogenesis yang optimal. Sebaliknya untuk inisiasi pembelahan sel pada eksplan dan
pertumbuhan kalus tidak diperlukan adanya cahaya.
Faktor lingkungan lain yang menentukan keberhasilan kultur jaringan
adalah kelembaban. Kelembaban relatif di dalam ruangan sekitar 70%, namun
kebutuhan kelembaban di dalam wadah kultur mendekati 90%. George dan
menyebabkan terbentuknya daun – daun pucuk yang mengalami vitrifikasi (Read
1990).
Keberhasilan kultur jaringan dapat tercapai apabila media yang digunakan
tidak mengalami kontaminasi. Kontaminasi berasal dari eksplan atau media yang
digunakan. Kecilnya kontaminasi disebabkan oleh tersedianya autoklaf
bertekanan tinggi, sehingga dapat menyebabkan denaturasi pada mikroba. Selain
itu, ruang pembuatan media juga harus disterilkan secara periodik dengan
menggunakan formalin (Gambar 7B). Faktor lain yang menyebabkan kecilnya
angka kontaminasi adalah laminar air flow, karena sebelum digunakan laminar
selalu disterilkan dengan sinar UV (Gambar 7C). Jenis kontaminan yang
ditemukan berupa cendawan dengan hifa yang berwarna putih sedikit merah
muda, cendawan berwarna kehitaman, bakteri berwarna putih susu, dan bakteri
berwarna kuning susu. Jenis kontaminan tersebut dapat dikenali dari penampilan
fisiknya. Dari keempat jenis kotaminan yang ditemukan, cendawan yang
berwarna hitam yang paling cepat pertumbuhan dan perkembangbiakannya, dan
cendawan tersebut mampu menutupi seluruh permukaan media kultur. Akibatnya
eksplan tidak mampu tumbuh yang akhirnya akan mati.
Gambar 7. Kondisi umum laboratorium :A. Ruang kultur, B. Ruang pembuatan media, C. Laminar air flow
2. Studi Tahapan Perkembangan Inti Mikrospora Antera Jeruk
Stadium perkembangan mikrospora merupakan faktor yang sangat penting
dalam menentukan keberhasilan induksi kalus pada kultur antera. Stadium
mikrospora yang paling responsif untuk membentuk embrio adalah stadium
uninukleat akhir (Dunwell 1996). Stadium uninukleat akhir ditandai dengan posisi
inti mikrospora berada di tepi karena terdesak oleh vakuola yang besar (Indrianto C
et al. 2004). Hal ini sesuai dengan hasil penelitian yang telah dilakukan oleh Wahidah (2010) yang menyatakan bahwa fase uninukleat akhir mempunyai
peluang yang lebih besar dalam mengiduksi terjadinya kalus pada kultur
mikrospora tanaman tembakau.
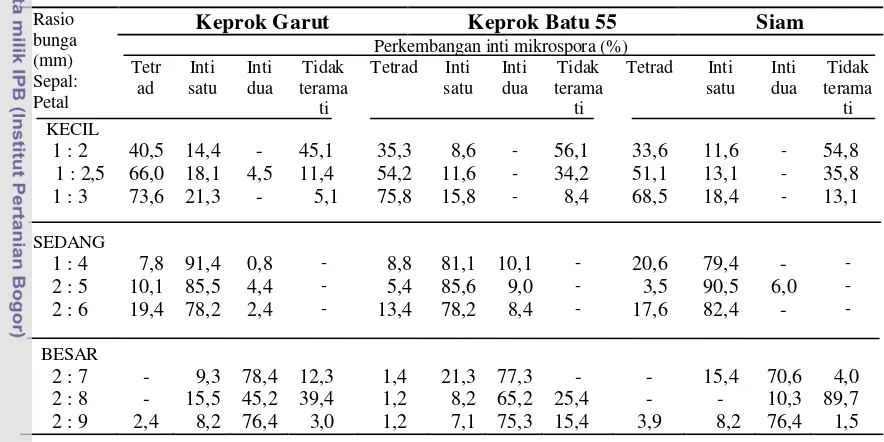
Tabel 1. Persentase perkembangan inti mikrospora pada jeruk keprok Garut, keprok Batu 55, dan jeruk Siam pada ukuran rasio sepal dan petal yang berbeda
Fase perkembangan mikrospora pada bunga dapat ditandai dengan
perubahan morfologi bagian bunga melalui bertambah panjangnya ukuran sepal
dan petal bunga. Secara umum hasil pengamatan menunjukkan bahwa terdapat
hubungan antara ukuran sepal dan petal bunga terhadap fase perkembangan inti
mikrospora. Bunga yang mempunyai ukuran sedang mengandung mikrospora inti
satu paling banyak baik pada bunga jeruk keprok Garut, keprok Batu 55, dan
jeruk Siam (Tabel 1). Pada bunga jeruk keprok Garut, persentase inti satu berkisar
antara 78,2 – 91,4%, bunga jeruk keprok Batu 55 mencapai 78,2 – 85,6% dan bunga jeruk Siam berkisar 79,4 – 90,5% dari total mikrospora yang diamati.
Berdasarkan hasil pengamatan perkembangan inti mikrospora jeruk keprok
Garut, dapat diketahui bahwa bunga dengan ukuran kecil berdasarkan ukuran
sepal dan petal bunga mempunyai mikrospora terbanyak berada pada fase tetrad
(40,5 – 73,6)% dan tidak teramati (5,1 – 45,1) %. Inti mikrospora tidak dapat
Keprok Garut Keprok Batu 55 Siam
diamati keberadaannya karena masih berupa mother cell kemudian kromosom mengalami kondensasi di bagian tengah sel pada tahap sel induk polen (mother cell) dan sel induk polen mengalami pembelahan meiosis membentuk tetrad (Septiani 2008).
Bunga dengan ukuran sedang mempunyai mikrospora uninukleat banyak
berkisar 78,2 – 91,4%. Wahidah (2010) menyatakan bahwa stadium uninukleat awal - tengah memiliki ciri-ciri mikrospora berbentuk bulat dengan vakuola yang
kecil dan pada stadium uninukleat akhir kedudukan inti makin ke pinggir dan
ukuran vakuola semakin besar bahkan menempati sebagian besar volume sel. Hal
tersebut sesuai dengan hasil penelitian Kosmiatin et al. (2009) pada bunga jeruk keprok Garut, dimana bunga jeruk keprok dengan ukuran mahkota kuncup bunga
antara 5-6 mm, memiliki persentase mikrospora dengan inti tunggal terbanyak
yaitu berkisar antara 84,05 – 100%. Bunga dengan ukuran besar didominasi oleh mikrospora binukleat berkisar 45,2 – 78,4%. Stadium binukleat dicirikan dengan adanya 2 inti dalam mikrospora tersebut. Perkembangan inti mikrospora mulai
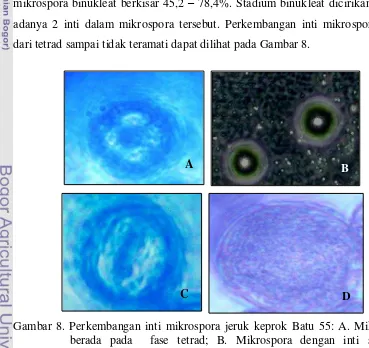
dari tetrad sampai tidak teramati dapat dilihat pada Gambar 8.
Gambar 8. Perkembangan inti mikrospora jeruk keprok Batu 55: A. Mikrospora berada pada fase tetrad; B. Mikrospora dengan inti satu; C. Mikrospora inti dua; D. Tidak teramati.
A B
Ukuran sepal dan petal bunga dari ketiga jenis jeruk (Keprok Garut,
keprok Batu 55, dan jeruk Siam) mempunyai ukuran sepal dan petal bunga yang
tidak begitu berbeda sehingga mempunyai perkembangan inti mikrospora yang
hampir sama. Bunga dengan ukuran kecil didominasi oleh mikrospora yang
berada pada fase tetrad (35,3 – 75,8)% dan mother cell (8,4 – 56,1)%, bunga ukuran sedang didominasi oleh mikrospora uninukleat (78,2 – 85,6)%, dan bunga dengan ukuran besar didominasi oleh mikrospora inti dua (65,2 – 77,3)%.
Semakin panjang ukuran kuncup bunga maka stadium perkembangan
mikrospora semakin dewasa. Fase perkembangan inti mikrospora pada bunga
jeruk Siam dengan ukuran kecil paling banyak terdapat fase tetrad berkisar 33,6 – 68,5% dan fase yang tak teramati (mother cell) berkisar 13,1 – 54,8% dan yang paling sedikit berada pada fase uninukleat berkisar 11,6 – 18,4% dan tidak terdapat mikrospora yang berada pada fase binukleat. Bunga dengan ukuran
sedang mempunyai mikrospora paling banyak berada pada fase inti satu (79,4 – 90,5)% dan bunga dengan ukuran besar mempunyai mikrospora paling banyak
terdapat pada fase inti dua (10,3 -76,4)% dan tidak teramati atau sudah termasuk
kategori polen yang sudah matang berkisar 1,5 – 85,7%.
Bunga jeruk Pamelo mempunyai ukuran sepal dan petal yang lebih
panjang dan tebal dibandingkan dengan ketiga jenis jeruk (keprok Garut, keprok
Batu 55, dan jeruk Siam) seperti terlihat pada Gambar 9. Oleh sebab itu
perbandingan ukuran sepal dan petal untuk mengelompokkan bunga besar, sedang
dan kecil juga berbeda, akan tetapi persentase perkembangan inti mikrospora pada
bunga yang sudah dikelompokkan hampir sama (Gambar 9).
Gambar 9. Perbandingan ukuran sepal dan petal bunga: A. Jeruk Pamelo; B. Jeruk Siam
sepal petal
A
sepal petal
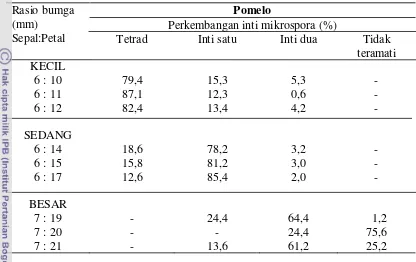
Tabel 2. Persentase perkembangan inti mikrospora jeruk Pamelo pada fase tetrad, inti satu, inti dua, dan tidak teramati
Berdasarkan pengamatan inti mikrospora pada tanaman jeruk pamelo
(Tabel 2), bunga yang dikelompokkan menjadi bunga kecil berdasarkan ukuran
sepal dan petal didominasi oleh mikrospora yang berada pada fase tetrad berkisar
(79,4 – 87,1)%, dan bunga dengan ukuran sedang didominasi mikrospora inti satu berkisar (78,2 – 85,4)% serta bunga dengan ukuran bunga besar didominasi oleh mikrospora inti dua (24,4 – 64,4)% dan tidak dapat diamati (1,2 – 75,6)%. Pada bunga ukuran kecil dan bunga ukuran sedang tidak terdapat mikrospora yang
tidak dapat diamati posisi intinya, sedangkan pada bunga ukuran besar banyak inti
mikrospora yang tidak dapat diamati keberadaannya. Keberadaan inti mikrospora
tidak diamati karena terdapat banyak vakuola didalam mikrospora. Sangwan dan
Norreel (1996) menyatakan pada stadium binukleat akhir (inti dua) sudah dimulai
peristiwa amilogenesis. Setelah terjadi akumulasi amilum biasanya mikrospora
sudah tidak responsip lagi untuk diinduksi menjadi embrio. Tingginya persentase
mikrospora inti satu (uninukleat) pada bunga ukuran sedang dengan perbandingan
ukuran sepal : petal (6:14 - 6:17) menjadikan bunga dengan ukuran sedang yang
3. Studi Lama Praperlakuan Penyimpanan Antera Terhadap Kemampuan
Induksi Kalus pada Jeruk Keprok Garut
Persentase keberhasilan induksi kalus haploid dari antera selain
dipengaruhi oleh fase perkembangan inti mikrospora, juga dipengaruhi oleh
praperlakuan terhadap antera sebelum kultur antera. Secara normal, mikrospora
akan berkembang menjadi alat reproduksi jantan pada tumbuhan. Praperlakuan
suhu dingin akan menghentikan proses tersebut sehingga mikrospora akan
berkembang menjadi embrio atau kalus.
Untuk menginduksi terbentuknya kalus haploid atau embrio yang berasal
dari mikrospora jeruk keprok Garut, kuncup bunga diberikan praperlakuan suhu
dingin (10oC) selama 1, 3, 5, dan 7 hari dan ditanam pada media MT dengan penambahan 10 mg/l pikloram dan 500 mg/l ekstrak malt. Kuncup bunga diberi
perlakuan lama penyimpanan pada suhu dingin dengan tujuan untuk mendapatkan
lama praperlakuan terbaik dilihat dari respon antera yang membengkak dan
mengkalus.
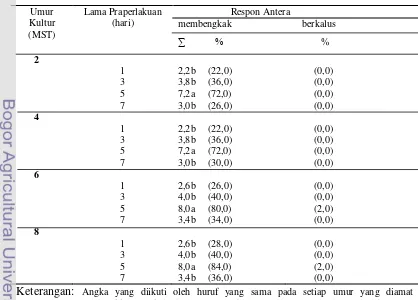
Tabel 3. Pengaruh praperlakuan lama penyimpanan pada suhu dingin (10oC) pada antera jeruk keprok Garut terhadap kemampuan induksi kalus
Berdasarkan hasil pengamatan pada Tabel 3, diketahui bahwa antera jeruk
keprok Garut yang diberi praperlakuan suhu dingin (10oC) selama 5 hari memberikan respon yang paling baik dilihat dari respon antera yang membengkak
dan yang mengkalus. Secara umum respon diawali dengan pembengkakan
kemudian diikuti dengan pembentukan kalus (Gambar 10).
Praperlakuan dingin (10oC) memberikan pengaruh terhadap peubah antera yang membengkak. Hasil tertinggi pada peubah antera membengkak diperoleh
pada praperlakuan 5 hari pada semua umur kultur. Antera membengkak karena
terjadi pembelahan sel - sel pada mikrospora yang terdapat di dalam antera,
kemudian sel sel mikrospora tersebut akan berkembang menjadi kalus. Kalus
yang berada didalam antera akan memaksa dinding antera untuk pecah. Persentase
terbentuknya kalus tertinggi (2%) terjadi pada praperlakuan dingin selama lima
hari pada umur 6 minggu setelah tanam.
Gambar 10. Respon antera Keprok Garut: A. Membengkak, B. Mengkalus
Praperlakuan penyimpanan suhu dingin (10oC) selama 5 hari pada antera jeruk keprok Garut merupakan praperlakuan terbaik karena mampu membentuk
kalus sebesar 2% pada umur 6 minggu setelah tanam, sedangkan praperlakuan
penyimpanan 1, 3, dan 7 hari tidak terdapat antera yang mampu terbentuk menjadi
kalus. Setelah 8 minggu antera cenderung menjadi coklat dan tidak mengalami
perkembangan bahkan sebagian besar antera menjadi mati. Penelitian yang
dilakukan oleh Savaskan et al. (1999) pada tanaman Hordeum vulgare L. menunjukkan terdapat perbedaan yang signifikan antara antera yang diberi
praperlakuan dingin selama 21 hari dengan antera yang tidak diberi praperlakuan