AKTIVITAS ENZIM PEROKSIDASE DAN POLIFENOL
OKSIDASE PADA KALUS TERUNG BELANDA (Solanum betaceum
Cav.) SETELAH DIINDUKSI KOLKISIN
SKRIPSI
WIDYA SARI AKRIYANI
050805041
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : AKTIVITAS ENZIM PEROKSIDASE DAN
POLIFENOL OKSIDASE PADA KALUS TERUNG BELANDA (Solanum betaceum Cav.) SETELAH DIINDUKSI KOLKISIN
Kategori : SKRIPSI
Nama : WIDYA SARI AKRIYANI
Nomor Induk Mahasiswa : 050805041
Program Studi : SARJANA (S1) BIOLOGI
Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA
UTARA
Diluluskan di
Medan, November 2009
Komisi Pembimbing :
Pembimbing II Pembimbing I
Dra. Isnaini Nurwahyuni, M.Sc Dra. Elimasni, M.Si
NIP. 19600523 198502 2001 NIP. 19650524 199103 2001
Diketahui/Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
AKTIVITAS ENZIM PEROKSIDASE DAN POLIFENOL OKSIDASE PADA KALUS TERUNG BELANDA (Solanum betaceumCav.) SETELAH DIINDUKSI
KOLKISIN
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, November 2009
PENGHARGAAN
Puji dan syukur penulis ucapkan atas kehadirat Allah SWT atas rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan hasil penelitian ini dengan judul ”Aktivitas Enzim Peroksidase dan Polifenol Oksidase Pada Kalus Terung Belanda (Solanum betaceum Cav.) Setelah Diinduksi Kolkisin”.
Penulis mengucapkan terima kasih sebesar-besarnya kepada Ibu Dra.Elimasni, M.Si dan Ibu Dra.Isnaini Nurwahyuni, M.Sc yang telah membimbing penulis dalam menyelesaikan skripsi ini serta memberi doa dan dukungannya, kepada Bapak Prof. Dr.Dwi Suryanto, M.Sc selaku pembimbing serta ketua Departemen Biologi, Ibu Yurnaliza, M.Si, Bapak Riyanto Sinaga, M.Si selaku penasehat akademik, Ibu Deni Supriharti, M.Sc, Ibu Prof.Dr.Retno Widhiastuti, M.Si, Bapak Arlen,H.J, Kepada Bapak Nursal, kepada Ibu dan Bapak dosen Departemen Biologi yang telah mendidik dan memberikan ilmu pengetahuannya dalam perkuliahan, kepada Ibu Nurhasni Muluk, Ibu Roslina Ginting dan Bang Erwin selaku pegawai di Departemen Biologi. Kepada Bapak Edi Marliyanto selaku Dekan FMIPA USU. Juga Kepada Pegawai Laboratorium Biomolekuler, Marihat dan para asisten Farmasi Kuantitatif, Suji, Limiyan, dan Gema.
Terima kasih juga kepada Ayahku Bahrul Akri dan Ibuku Rayoani, serta adik-adikku tercinta Dedi Adriyansyah, M. Fachru Rozi dan Dinda Fachrani Akri yang selalu memberi semangat, dukungan, doa dan kasih sayang kepada penulis. Kepada seluruh keluarga besarku di Medan maupun di Padang dan di Jakarta.
Terima kasih juga kepada para sahabat-sahabatku yang selalu menemaniku dalam suka dan duka, Ulan, Nikma, Irfan, Andi, Kabul, Effendi, Imus, Ummi, Utin, Susi, Rico, Maysarah, Diana, Kak Put, Rahmad, Fifi, Dahin, Juned, Eri, Dwi, Andini, Yanti, Seneng, Siti, Riris, Timah, Susanty SM, Susanti Giant, Ocid, Fitria, Kalis, Ruth, Beca, Tober, Misran, Valen, Simlah, Julita, Erna, Erni, Delni, Winda, Dini, Verta, Taripar, Sarah L.P, dan Kurniayanti. Abang asuhku Bang M. Ghazali (Jhalie), kak Maini, Bang Rizki, bang Yophi, kak Atika, kak Ika dan senior-senior stambuk ’02, ’03 dan ’04 lainnya. Adik-adik juniorku Zuki, Umri, Mirza, Asril, Surya, Fatma, Farid, Nila, Zulfa, Nurma, Tetty, Kasbi, Dwi Ramdhani, Sirma, Tombak, dan semuanya adik-adik junior stambuk ’06,’07 dan’08 serta adik-adik dari jurusan Kimia Analis yang selalu memberikan semangat dan doanya.
Terima kasih juga penulis ucapkan kepada teman-teman SMA, kepada Dian, Irma, Ika, Ober, Dinda, Novo, Ratih, Kak Dodi yang selalu memberikan doa dan dukungannya. Kepada Raden Nugroho Adi Negoro, kepada Bang Asrul, Joko, Bang Anto. Kepada Ibu dan Bapak Guru TK/ Madrasah Al Iklasiyah, SD Muhammadiyah 17, SMPN 6 Medan dan SMAN 14 Medan yang telah mendidik dan memberikan ilmu pengetahuannya selama ini.
ABSTRAK
Penelitian tentang”Aktivitas Enzim Peroksidase dan Polifenol Oksidase Pada Kalus Terung Belanda (Solanum betaceum Cav.) Setelah Diinduksi Kolkisin” telah dilakukan pada bulan April sampai dengan Agustus 2009 di Laboratorium Kultur Jaringan, Departemen Biologi, FMIPA USU, Laboratorium Biomolekuler, PPKS, Marihat, Pematang Siantar dan Laboratorium Farmasi Kuantitatif, Fakultas Farmasi USU dan Laboratorium Kimia Bahan Pangan, Fakultas Pertanian USU. Penelitian ini bertujuan untuk mengetahui pengaruh pemberian kolkisin dengan konsentrasi dan lama waktu perendaman yang paling baik terhadap nilai aktivitas enzim Peroksidase dan Polifenol oksidase pada kalus Terung Belanda.
Metode penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL) faktorial dengan 2 faktor yaitu faktor konsentrasi kolkisin 0: 0,01: 0,1 dan 1% serta lama waktu perendaman 5, 15 dan 30 menit. Hasil analisis statistik menunjukkan bahwa konsentrasi yang diberikan akan berpengaruh terhadap nilai berat basah dan nilai aktivitas enzim Peroksidase dan Polifenol oksidase sedangkan waktu perendaman berpengaruh secara fluktuatif. Dari hasil yang diperoleh bahwa perlakuan dengan konsentrasi kolkisin 0,1% (C3) memiliki rataan berat basah yang paling tinggi yaitu sebesar 1,32 g, sedangkan perlakuan kolkisin 1% memiliki berat basah yang paling rendah yaitu sebesar 1,14 g. Untuk nilai aktivitas tinggi terdapat pada perlakuan kolkisin 0,1% dengan waktu perendaman 30 menit (C3T3) sebesar 0,0082 unit dan
nilai aktivitas yang paling rendah pada perlakuan kolkisin 1% dengan waktu perendaman 5 menit (C4T1) sebesar 0,0068 unit. Untuk nilai aktivitas PPO tertinggi
terdapat pada perlakuan kolkisin 0,01% dengan waktu perendaman 30 menit (C2T3)
sebesar 0,0066 unit, sedangkan nilai PPO terrendah pada perlakuan kolkisin 0% dengan waktu perendaman 30 menit sebesar 0,0041unit.
ACTIVITIES OF PEROXIDASE AND POLYPHENOL OXIDASE OF TAMARILLO CALLI (Solanum betaceum Cav.) INDUCTION BY
COLCHISINE
ABSTRACT
The study on “Peroxidase and Polyphenol Oxidase of Tamarillo (Solanum betaceum Cav.) Calli Induction by Colchisine has been done on April to August 2009 in Tissue Culture Laboratory, Biology Departement of North Sumatera, Biomoleculer Laboratory of PPKS Marihat, Pematang Siantar, Quantitative Pharmacy, Pharmacy of North Sumatera and Material of Chemical, Agriculture of North Sumatera. The objective of the research was to obtain the effect of the best concentration and submertion time in colchisine to activity of peroxidase and polyphenol oxidase of tamarillo calli.
The research used Completly Randomized Design with 2 factors, which is 4 levels of colchisine (0; 0,01; 0,1 and 1%) and 3 levels submertion time (5, 15 and 30 minutes). The statistical analysis showed that with concentration affected to fresh weight of calli and the enzyme activities, however, the submertion time is fluctuation. The calli treated 0,1% colchisine has the great value of fresh weight 1,32 g and the lowest of fresh weight 1% (C4) with the value 1,14 g. The colchisine treatment of C3T3 indicated the great value of PO activity was equal to 0,0082 unit and meanwhile
the PPO activity was 0,0066 unit for the treatment of C2T3. The lowest value of
peroxidase activity was 0,0068 unit in C4T1, and PPO activity was 0,0041 unit in
C1T3.
DAFTAR ISI
BAB 2 Tinjauan Pustaka 2.1 Botani Solanum betaceumCav. 5
3.5.2 Pengujian Enzim Polifenol Oksidase (PPO) 22
3.5.3 Parameter Pengamatan 23
3.5.4 Analisa Data 23
BAB 4 Hasil dan Pembahasan
4.1 Persentase Kultur Hidup Setelah Diinduksi Kolkisin 24 4.1.1 Berat Basah Kalus (g) 25
BAB 5 Kesimpulan dan Saran
5.1 Kesimpulan 38
5.2 Saran 38
Daftar Pustaka 39
Lampiran A: Komposisi Media MS (Murashige dan Skoog) 46
Lampiran B: Alur Kerja Pembuatan Reagen 47
Coomassie Briliant Blue G-250
Lampiran C: Alur Kerja Pembuatan Kurva Standar BSA 48
Lampiran D: Alur Kerja Ekstraksi Kalus 49
Lampiran E: Alur Kerja Kerja Determinasi Protein 50 Lampiran F: Alur Kerja Penentuan Aktivitas Enzim Peroksidase 51 Lampiran G: Alur Kerja Penentuan Aktivitas Enzim Polifenol Oksidase 52
Lampiran H: Lay-out Penelitian 53
Lampiran I: Data Pengamatan Persentase Kultur Hidup Setelah Diinduksi 54 Kolkisin
Lampiran J: Data Pengamatan persentase Kultur Terkontaminasi 55
Lampiran K: Data Pengamatan Warna Kalus 56
Lampiran L: Data Pengamatan Awal Pembentukan Kalus 57 Lampiran M: Data Pengamatan Berat Basah Kalus (g) 58 Lampiran N: Data Pengukuran Kurva Standar BSA 60 Lampiran O: Data Pengukuran Kurva Standar Pyrogallol 62 Lampiran P: Data Pengukuran Determinasi Protein Kalus 64 Lampiran Q: Data Pengamatan Hasil Pengukuran Aktivitas Peroksidase 65 Lampiran R: Data Pengamatan Hasil Pengukuran Aktivitas Polifenol Oksidase 66 Lampiran S: Data Pengamatan Nilai Pyrogallol Yang Diubah 67
Menjadi Purpurogallin Pada Peroksidase
DAFTAR TABEL
Halaman
Tabel 4.1.0 Persentase Kultur Kalus Biji Terung Belanda yang hidup 24
setelah diinduksi Kolkisin Tabel 4.1.1 Hubungan Antara Berat Basah Kalus Terhadap Perlakuan 25
Kolkisin Dan Waktu Perendaman Tabel 4.1.2 Warna Kalus Setiap Perlakuan 27
Tabel 4.1.3 Proliferasi Kalus Yang Hidup Dan Beregenerasi 29
Tabel 4.3.0 Pengukuran Nilai Aktivitas Peroksidase 33
DAFTAR GAMBAR
Halaman
Gambar 3.4.4 Biji Terung Belanda yang akan Diinduksi Kolkisin 19 Gambar 3.4.5 Pemeliharaan Kalus pada media MS di Ruang Kultur 20 Gambar 4.1.2 Warna Kalus Yang Terbentuk 28 Gambar 4.1.3 Kalus Yang Membentuk Tunas 29 Gambar 4.1.4 Kalus Yang Mengalami Kontaminasi 31 Gambar 4.2.0 Perlakuan Kolkisin Dengan Nilai Kadar Protein Kalus 32 Gambar 4.3.0 Perlakuan Kolkisin Dan Waktu Perendaman Dengan Nilai 33
Aktivitas Peroksidase
ABSTRAK
Penelitian tentang”Aktivitas Enzim Peroksidase dan Polifenol Oksidase Pada Kalus Terung Belanda (Solanum betaceum Cav.) Setelah Diinduksi Kolkisin” telah dilakukan pada bulan April sampai dengan Agustus 2009 di Laboratorium Kultur Jaringan, Departemen Biologi, FMIPA USU, Laboratorium Biomolekuler, PPKS, Marihat, Pematang Siantar dan Laboratorium Farmasi Kuantitatif, Fakultas Farmasi USU dan Laboratorium Kimia Bahan Pangan, Fakultas Pertanian USU. Penelitian ini bertujuan untuk mengetahui pengaruh pemberian kolkisin dengan konsentrasi dan lama waktu perendaman yang paling baik terhadap nilai aktivitas enzim Peroksidase dan Polifenol oksidase pada kalus Terung Belanda.
Metode penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL) faktorial dengan 2 faktor yaitu faktor konsentrasi kolkisin 0: 0,01: 0,1 dan 1% serta lama waktu perendaman 5, 15 dan 30 menit. Hasil analisis statistik menunjukkan bahwa konsentrasi yang diberikan akan berpengaruh terhadap nilai berat basah dan nilai aktivitas enzim Peroksidase dan Polifenol oksidase sedangkan waktu perendaman berpengaruh secara fluktuatif. Dari hasil yang diperoleh bahwa perlakuan dengan konsentrasi kolkisin 0,1% (C3) memiliki rataan berat basah yang paling tinggi yaitu sebesar 1,32 g, sedangkan perlakuan kolkisin 1% memiliki berat basah yang paling rendah yaitu sebesar 1,14 g. Untuk nilai aktivitas tinggi terdapat pada perlakuan kolkisin 0,1% dengan waktu perendaman 30 menit (C3T3) sebesar 0,0082 unit dan
nilai aktivitas yang paling rendah pada perlakuan kolkisin 1% dengan waktu perendaman 5 menit (C4T1) sebesar 0,0068 unit. Untuk nilai aktivitas PPO tertinggi
terdapat pada perlakuan kolkisin 0,01% dengan waktu perendaman 30 menit (C2T3)
sebesar 0,0066 unit, sedangkan nilai PPO terrendah pada perlakuan kolkisin 0% dengan waktu perendaman 30 menit sebesar 0,0041unit.
ACTIVITIES OF PEROXIDASE AND POLYPHENOL OXIDASE OF TAMARILLO CALLI (Solanum betaceum Cav.) INDUCTION BY
COLCHISINE
ABSTRACT
The study on “Peroxidase and Polyphenol Oxidase of Tamarillo (Solanum betaceum Cav.) Calli Induction by Colchisine has been done on April to August 2009 in Tissue Culture Laboratory, Biology Departement of North Sumatera, Biomoleculer Laboratory of PPKS Marihat, Pematang Siantar, Quantitative Pharmacy, Pharmacy of North Sumatera and Material of Chemical, Agriculture of North Sumatera. The objective of the research was to obtain the effect of the best concentration and submertion time in colchisine to activity of peroxidase and polyphenol oxidase of tamarillo calli.
The research used Completly Randomized Design with 2 factors, which is 4 levels of colchisine (0; 0,01; 0,1 and 1%) and 3 levels submertion time (5, 15 and 30 minutes). The statistical analysis showed that with concentration affected to fresh weight of calli and the enzyme activities, however, the submertion time is fluctuation. The calli treated 0,1% colchisine has the great value of fresh weight 1,32 g and the lowest of fresh weight 1% (C4) with the value 1,14 g. The colchisine treatment of C3T3 indicated the great value of PO activity was equal to 0,0082 unit and meanwhile
the PPO activity was 0,0066 unit for the treatment of C2T3. The lowest value of
peroxidase activity was 0,0068 unit in C4T1, and PPO activity was 0,0041 unit in
C1T3.
BAB 1
PENDAHULUAN
1.1Latar Belakang
Terung belanda merupakan tanaman yang sangat populer di New Zealand. Tanaman ini termasuk keluarga Solanaceae yang berasal dari Peru dan masuk ke Negara Indonesia. Tanaman ini dikembangkan antara lain di Bali, Jawa Barat, dan Tanah Karo Sumatera Utara (Kumalaningsih, 2006). Tanaman ini telah dikenal dikalangan masyarakat Sumatera Utara sebagai salah satu bahan untuk jus buah segar yang sangat diminati karena rasanya yang asam manis. Terung belanda juga mulai dikembangkan pengolahannya dalam bentuk sirup. Selain itu, tanaman ini juga mempunyai potensi yang cukup baik untuk dijadikan selai yang tentunya akan menambah nilai ekonominya (Departemen Pertanian, 2003).
Terung belanda di Sumatera Utara mulai dikembangkan pengolahannya dalam bentuk sirup yang ternyata sangat disukai oleh masyarakat. Namun produksi sirup Terung belanda ini masih sangat terbatas karena tingkat produktivitasnya yang masih rendah dan disebabkan karena penyakit yang menyerang tanaman ini serta tempat tumbuhnya tidak tahan terhadap intensitas cahaya matahari yang terlalu tinggi (Departemen Pertanian, 2005). Disamping itu tanaman ini rentan terhadap serangan penyakit misalnya anthrax yang disebabkan olah jamur Colletotrichum sp (Bohs, 2001), seperti yang dialami tanaman Terung belanda di daerah Brastagi, Sumatera Utara (Departemen Pertanian, 2005).
menghasilkan keragaman baik dari sifat morfologi dan ketahanan terhadap penyakit (Husni, 2005). Untuk mendapatkan keragaman genetik secara cepat dapat dilakukan mutasi induksi dengan pemberian beberapa senyawa kimia seperti pemberian kolkisin untuk memicu poliploidi, ethylmethanesulfonate (EMS) serta radiasi sinar ultraviolet.
Kolkisin selain dapat menyebabkan poliploidi juga dapat menyebabkan pertumbuhan tidak terbatas (indeterminate), sehingga tanaman dapat berbuah beberapa kali dalam setahun. Hal ini tentunya menguntungkan karena memberikan produktivitas yang lebih tinggi dibandingkan dengan tanaman yang tidak mengalami poliploidi (Stebbin, 1984: Sergaves et al., 1999).
Perbanyakan terung belanda dilakukan secara generatif yaitu dengan memanfaatkan bijinya. Hal ini dapat menyebabkan turunnya produksi tanaman tersebut karena dalam pertumbuhannya biji memerlukan waktu yang relatif lama dan seringkali hasilnya tidak seperti tanaman induknya (Yuwono, 2006). Selain itu, hama seperti aphids dan ulat pemakan daun atau penyakit seperti busuk pada batang atau busuk pohon yang menyerang pada musim hujan juga dapat menyebabkan produksi tanaman ini menurun (Kumalaningsih, 2006). Secara fisiologis, mekanisme ketahanan terhadap beberapa penyakit dan mikroorganisme melibatkan peningkatan aktivitas
enzim tertentu, antara lain aktivitas enzim peroksidase, yang merupakan salah satu enzim yang terkait dengan mekanisme ketahanan tanaman terhadap cekaman (Artlip & Funkhouser, 1995).
Dari beberapa hasil penelitian yang telah diperoleh bahwa aktivitas Peroksidase tanaman tomat yang diserang penyakit seperti nematoda akan meningkat pada umumnya jika dibandingkan dengan tanaman yang sehat. Hal ini menggambarkan bahwa makin tinggi infeksi serangan, maka makin tinggi aktivitas peroksidasenya (Simhian, 1998).
genetik (Shannon, 1968). Penggunaan penandaan isozim mempunyai kelebihan karena isozim diatur oleh gen tunggal dan bersifat kodominan dalam pewarisan dan bersegregasi secara normal. Penanda ini bersifat stabil karena tidak dipengaruhi oleh faktor lingkungan, lebih cepat dan akurat karena tidak menunggu tanaman ini sampai bereproduksi (Hadiati et al., 2002). Peroksidase merupakan anggota enzim reduktase yang dianggap memiliki hubungan nyata dengan penyebab perubahan pada rasa, warna, tekstur dan kandungan gizi buah-buahan dan sayur-sayuran yang belum diolah (Burnette, 1977). Peroksidase pada tanaman merupakan isozim yang berperan dalam pertumbuhan, diferensiasi dan pertahanan (Gaspar et al., 1980). Aktivitas isozim peroksidase mudah dideteksi karena aktivitasnya yang luar biasa pada jaringan (Touti, 1988). Peroksidase mengkatalisis H2O2 menjadi H2 dan O2.
Polifenol Oksidase (PPO) tidak terbatas pada beberapa bagian organ tanaman. Keberadaannya dapat dilihat dalam setiap jenis dari organ-organ tersebut. Jaringan, sel, dan ditempat yang sama dalam suatu varietas dari fraksi sel, keduanya terdapat di dalam organela-organela dan dalam cairan sel (Kar and Mishra, 1976; Sato and Hasegawa, 1976).
Beberapa penelitian menemukan bahwa terdapat hubungan yang sangat dekat
antara peningkatan aktivitas dari PPO dan aktivitas metabolik lainnya. Hasil penelitian menunjukkan bahwa peningkatan dari aktivitas PPO berhubungan dengan komposisi dari senyawa fenolat dan aktivitas peroksidase (PO) (Bashan et al., 1987; Czech-Kozlowska and Krzywanski, 1984; Srivastava and van Huystee, 1977b). Para ahli menemukan bahwa PPO dan PO sangat signifikan di dalam reaksi pertahanan (Arora and Wagle, 1985; Bashan et al., 1987; Maraite, 1973; Retig, 1974).
1.2Pemasalahan
Terung belanda mempunyai nilai ekonomi yang tinggi bagi masyarakat Sumatera Utara, tetapi produktivitas tanaman ini mulai menurun dari tahun ketahun yang disebabkan oleh beberapa faktor, salah satunya adalah serangan dari penyakit. Maka dalam penelitian ini bahan tanaman diinduksi kolkisin sehingga menjadi tanaman yang poliploidi dan dapat diseleksi ketahanannya terhadap penyakit berdasarkan aktivitas Peroksidase dan Polifenol Oksidase yang dihasilkan.
1.3 Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh perlakuan kolkisin dengan konsentrasi dan waktu perendaman yang paling baik terhadap kalus yang tumbuh serta pengaruhnya terhadap nilai aktivitas Peroksidase dan Polifenol Oksidase pada kalus terung belanda tersebut.
1.4Hipotesis
Kalus yang tumbuh dari beberapa perlakuan kolkisin dengan konsentrasi dan waktu perendaman yang berbeda akan mempengaruhi nilai aktivitas Peroksidase dan Polifenol Oksidase terung belanda tersebut.
1.5Manfaat
BAB 2
TINJAUAN PUSTAKA
2.1 Botani Solanum betaceum Cav.
Terung belanda pertama kali dikenal dengan nama Cyphomondra betacea, tanaman ini termasuk ke dalam famili Solanaceae. Tanaman ini memiliki akar yang dangkal, pohonnya perdu setengah berkayu, dapat tumbuh di daerah dataran sedang dan tinggi
yang memiliki iklim dingin, serta tumbuh liar (Kumalaningsih, 2006).
Menurut Tjitrosoepomo (2000), bahwa klasifikasi dari Solanum betaceum adalah sebagai berikut:
Kingdom : Plantae
Divisio : Spermatophyta Subdivisio : Angiospermae
Kelas : Dicotyledoneae
Ordo : Solanales
Famili : Solanaceae
Genus : Solanum
Spesies : Solanum betaceumCav.
Terung belanda merupakan tanaman perdu dengan tinggi 2-8 m, memiliki pangkal batang pendek, daun tunggal, berselang-seling, bentuknya bulat telur sampai bentuk jantung, berukuran (10-35) cm x (4-20) cm, berpinggiran rata, berbulu halus, berujung lancip dan pendek. Bunga berada dalam rangkaian kecil di ketiak daun dekat ujung cabang, berwarna merah jambu sampai biru muda, berdiameter kira-kira 1 cm, bagian bunga berbilang lima, daun mahkota berbentuk genta, benang sari 5 utas, berada di depan daun mahkota. Buahnya berupa buah buni yang berbentuk bulat telur,
bertangkai panjang, kulit buah tipis, licin, berwarna lembayung kemerah-merahan, daging buahnya mengandung banyak sari buah, agak asam sampai manis. Bijinya bulat pipih, tipis, dan keras. Setiap 100 g bagian buah yang dapat dimakan mengandung air 85 g, protein 1,5 g, lemak 0,06-1,28 g, karbohidrat 10g, serat 1,4-4,2g, abu 0,7g, vitamin A 150-500 SI, dan vitamin C 25 mg (http://www.iptek.net.id/ind/teknologi_pangan.diakses tanggal 3 Maret 2008).
Terung belanda merupakan tanaman yang sudah banyak dikembangkan terutama di Negara Chili. Buah dari tanaman ini sudah dijadikan komoditi ekspor yang dapat memberikan devisa bagi negara tersebut (Faucon, 1998). Buah Terung belanda biasanya gampang rusak sehingga harus disimpan pada suhu < 0oC (Bohs, 2001).
2.2 Budidaya Terung belanda Secara In Vitro
Suatu kendala yang sering dihadapi dalam pengadaan bibit unggul secara konvensional adalah sulitnya mendapatkan bibit yang berkualitas dalam jumlah besar dalam waktu yang singkat. Salah satu keunggulan perbanyakan tanaman melalui
teknik kultur jaringan adalah sangat dimungkinkan mendapatkan bahan tanaman dalam jumlah besar dalam waktu yang singkat (Priyono et al., 2000)
banyak diminati dalam bidang pertanian, perkebunan, dan bidang-bidang lainnya (Suryowinoto, 1996).
Kultur jaringan tanaman adalah suatu teknik budidaya sel, jaringan, dan organ tanaman dalam suatu lingkungan yang terkendali dan dalam keadaan aseptik atau bebas mikroorganisme (Santoso & Nursandi, 2004). Perbanyakan dengan kultur jaringan tidak mengenal musim karena kondisi lingkungan yang diatur sesuai dengan kebutuhan. Biji yang memegang peranan penting dalam mempertahankan kondisi yang seperti ini. Keadaan seperti ini dapat diterapkan pada kultur biji. Kegunaan kultur biji adalah menghilangkan kontaminasi eksternal seperti jamur, bakteri, dan mikroorganisme lainnya (Katuuk, 1989).
Teori totipotensi sel merupakan prinsip dasar dari metode kultur jaringan. Sel memiliki kemampuan autonom yang ada di dalammya mengandung material genetik lengkap, sehingga apabila ditumbuhkan pada lingkungan tumbuh yang sesuai, sel tersebut akan dapat tumbuh dan berdiferensiasi menjadi tanaman lengkap (Pierik, 1987).
Kegiatan awal yang harus dilakukan sebelum melakukan kultur jaringan suatu
tanaman adalah memilih tanaman induk yang akan diperbanyak. Tanaman tersebut harus jelas jenisnya dan varietasnya serta harus sehat. Umumnya bagian tanaman yang digunakan sebagai eksplan adalah jaringan muda yang sedang tumbuh aktif (meristematis). Jaringan tanaman yang masih muda mempunyai daya regenerasi yang lebih tinggi, sel-selnya masih aktif membelah diri dan relatif lebih bersih (mengandung lebih sedikit kontaminan). Sementara itu tanaman yang lebih tua akan lebih sulit beregenerasi, dan biasanya mengandung lebih banyak kontaminan (Yusnita, 2003).
tanaman seperti daun, batang dan akar (Nugroho & Sugito, 2004). Langkah selanjutnya untuk menentukan bagian tanaman yang akan digunakan sebagai eksplan adalah melihat potensi genetik yang ada pada tanaman di lapangan.
2.3 Media Kultur Jaringan
Media kultur merupakan faktor penentu keberhasilan dalam perbanyakan tanaman dengan menggunakan kultur jaringan. Berbagai komposisi media telah diformulasikan untuk mengoptimalkan pertumbuhan dan perkembangan tanaman yang dikulturkan. Sebagai contoh media yang sering digunakan adalah komposisi Knudson C (1946), Heller (1953), Nitsch dan Nitsch (1972), Gamborg (1976), Murashige dan Skoog-MS (1962). Media yang sering kali digunakan berbentuk padat menggunakan agar-agar atau gelrite (Yusnita, 2003).
Medium MS merupakan media yang paling banyak digunakan karena memiliki komposisi yang lebih lengkap (George & Sherrington, 1984). Media ini digunakan secara luas untuk kultivasi kalus pada agar demikian juga kultur suspensi sel dalam media yang cair. Keistimewaan media ini adalah memiliki kandungan nitrat,
kalium dan amoniumnya yang tinggi (Wetter & Constabel, 1991). Dari banyak jenis media dasar yang digunakan dalam teknik kultur jaringan, media MS (Murashige dan Skoog) mengandung jumlah hara organik yang memenuhi kebutuhan banyak jenis sel tanaman dalam kultur (Gunawan, 1990).
2.4 Kalus
Beberapa jaringan tanaman dapat digunakan untuk membentuk biakan kalus seperti akar, batang, dan daun, Untuk membentuk kalus, jaringan dipisahkan dari tanaman dan permukaan sayatan disterilkan untuk membunuh pengkontaminasi biakan. Beberapa biakan yang membentuk kalus dari tanaman yang tumbuh dalam kondisi aseptik dengan permukaan biji yang disterilkan untuk mengurangi kontaminasi (Nasir, 2002).
2.5 Kolkisin
Kolkisin merupakan suatu alkaloid yang berasal dari umbi dan biji dari tanaman Autumn crocus (Colchicum autumnale Linn.) yang termasuk dalam famili Liliaceae. Nama Colchicum berasal dari nama Colchis yaitu seorang raja yang menguasai daerah tepi Laut Hitam, dan karena di daerah tersebut ditemukan banyak sekali tanaman itu. Pada musim semi tanaman ini memiliki daun, buah dan biji (Suryo, 1995).
Kolkisin atau Colchicine merupakan suatu senyawa alkaloid yang berasal dari tanaman Colchicum autumnale Linn. Yang memiliki sifat sangat toksik. Nama kimia Colchicine adalah 5,6,7,9-tetrahidro 1,2,3,10-tetramethoxy-9-oxobenzo (alpha)
Menurut Mariska (1996), masih rendahnya kalus yang beregenerasi pada perlakuan pemberian kolkisin diduga karena pemberian kolkisin dengan konsentrasi yang tinggi pada awal perlakuan akan mengakibatkan kerusakan fisiologis tanaman. Pemberian kolkisin juga mengakibatkan penundaan pertumbuhan akibat jaringan yang rusak dan memerlukan waktu yang lama untuk tumbuh. Menurut Eigisti dan Dustin (1995), bahwa kolkisin merupakan senyawa kimia yang bersifat toksik yang pada konsentrasi yang tepat dapat mencegah terbentuknya benang-benang spindel, kolkisin dengan konsentrasi yang beragam dapat menyebabkan pengaruh yang beragam pula. Berbagai konsentrasi kolkisin jika tidak sesuai akan memberikan pengaruh yang berbeda pada pertumbuhan tanaman seperti jumlah daun, berat basah tunas, berat basah akar, berat kering tunas dan berat kering akar.
2.6 Poliploidi
Poliploidi adalah suatu kondisi dimana susunan kromosom menjadi lebih dari dua set kromosom. Tanaman poliploidi mempunyai keunggulan yaitu sel-selnya menjadi lebih besar sehingga tanaman menjadi lebih besar. Hal ini tentunya menguntungkan karena memberikan nilai produktivitas yang lebih tinggi dibandingkan dengan
tanaman yang tidak mengalami poliploidi. Selain itu tanaman poliploidi lebih subur dan pertumbuhannya lebih cepat (Griffith, 2000).
Manipulasi poliploidi merupakan suatu cara yang banyak digunakan untuk peningkatan produktivitas pada banyak tanaman seperti Solanum, Citrus, Scutelia baicalansis, Alocasia, Allium cepa dan Azalea. Poliploidi dilakukan pada tanaman untuk berbagai alasan, yaitu (1) menghasilkan tanaman tanpa biji, (2) meningkatkan senyawa metabolit sekunder, (3) untuk mendapatkan varietas baru dan (4) meningkatkan plasma nutfah guna memenuhi kebutuhan pangan masyarakat (Madon, et al., 2006).
Segraves et al., (1999) menyatakan bahwa tanaman yang poliploid berbeda dibandingkan dengan tanaman yang diploid, yaitu :
a. Individu maupun populasinya lebih terjaga sifat heterozigositasnya
b. Pada saat terjadi inbreeding akan lebih menguntungkan karena tekanan yang dialami akan lebih kecil dibandingkan dengan yang diploid
c. Pada umumnya, spesies yang poliploid bersifat polipheletic
Poliploid dapat terjadi melalui pembentukan sel-sel gamet yang terbentuk dari proses mitosis. Bila sel-sel tersebut mengalami penggandaan kromosom, phase S tidak akan dilewati pada siklus sel, maka gamet yang diploid akan terbentuk (Stebbins, 1984 dan Segraves et al., 1999). Secara laboratorium poliploidi dapat dilakukan yaitu dengan menginduksi sel yang akan membelah dengan berbagai zat kimia.
2.7 Enzim
Enzim merupakan protein biokatalisator untuk proses-proses fisiologi tanaman yang pengadaan dan pengaturannya dikontrol secara genetik (Shannon, 1968). Penggunaan penandaan isozim mempunyai kelebihan karena isozim diatur oleh gen tunggal dan
bersifat kodominan dalam pewarisan dan bersegregasi secara normal. Penanda ini bersifat stabil karena tidak dipengaruhi oleh faktor lingkungan, lebih cepat dan akurat karena tidak menunggu tanaman ini sampai bereproduksi (Hadiati et al., 2002).
Menurut Gaman & Sherrington (1992), bahwa sifat-sifat enzim adalah sebagai berikut:
a. Aktivitas enzim sangat spesifik
Pada umumnya enzim tertentu hanya akan mengkatalis satu reaksi. Sebagai contoh laktase menghidrolisis gula laktosa tetapi tidak berpengaruh terhadap disakarida lain. Hanya molekul laktosa saja yang sesuai dalam sisi aktif pada enzim.
b. Pengaruh suhu
Aktivitas enzim sangat dipengaruhi oleh suhu. Untuk enzim pada hewan suhu optimalnya 35-40o C. Pada suhu di atas dan di bawah suhu optimal maka aktivitas enzim akan menurun. Di atas suhu 50o C enzim secara bertahap menjadi inakstif karena protein terdenaturasi. Pada suhu 100o C semua enzim rusak. Pada suhu sangat rendah, enzim tidak benar-benar rusak tetapi aktivitasnya sangat banyak berkurang.
c. Pengaruh pH
Setiap reaksi yang dikatalisatori oleh enzim menunjukkan laju reaksi yang cepat pada pH tertentu. pH optimal dari enzim berkisar 7 (netral) dan jika medium menjadi sangat asam atau sangat alkalis enzim mengalami inaktifasi. Akan tetapi beberapa enzim akan bekerja dalam kondisi asam atau alkalis.
d. Koenzim dan Aktifator
Enzim seringkali memerlukan bantuan substansi lain agar berfungsi secara efektif. Koenzim adalah substansi bukan protein yang mengaktifkan enzim. Beberapa vitamin berfungsi sebagai enzim. Beberapa ion anorganik, misalnya ion kalsium dan ion klorida dapat meningkatkan aktivitas beberapa enzim. Senyawa ini dikenal sebagai kofaktor.
e. Konsentrasi substrat
2.8 Enzim Peroksidase (PO)
Peroksidase pada tanaman (Hydrogen peroxidase oxidoreductase; EC 1.11.1.1) terdiri dari monomer-monomer glycoprotein (Cassab and Varner, 1988; Valpuesata et al., 1989). Enzim ini menggunakan hydrogen peroxida (H2O2) atau oksigen bebas (O2)
untuk mengoksidasi suatu variasi yang lebih luas dari penerima hidrogen. Dengan adanya penambahan dari H2O2, dapat mengkatalisis reaksi oksidasi dari berbagai
bentuk substrat, termasuk phenolik, nitrit, sitokrom c, asam askorbat, atau gugus amin (Kerby and Somerville, 1989; Mäder and Fűssl, 1982; Scandalios, 1974). Reaksi oksidasi terjadi dibawah kondisi aerobik dengan menggunakan oksigen bebas dan tanpa peroksidase eksogen (Mäder and Amberg-Fisher, 1982
Peroksidase (PO) didistribusikan cukup luas pada setiap organ tanaman. Peroksidase dihasilkan dalam organ, jaringan, sel, dan variasi komponen subseluler. PO adalah enzim yang larut di dalam sitoplasma atau tempat intraseluler. PO dapat dideteksi di dalam organel-organel dan pada dinding sel atau membran sel (Birecka et al., 1975a; Bireck et al., 1975b; Catesson et al., 1986; Meudt and Stecher, 1972).
Pada umumnya, PO merupakan isozim. Isozim ini memiliki kekuatan yang
2.9 Enzim Polifenol Oksidase
Polifenol Oksidase (PPO) tidak terbatas pada beberapa bagian organ tanaman. Keberadaannya dapat dilihat pada setiap jenis organ. Jaringan, sel, dan ditempat yang sama dalam suatu varietas dari fraksi sel, keduanya terdapat di dalam organela-organela dan dalam cairan sel (Kar and Mishra, 1976; Sato and Hasegawa, 1976).
Pada tingkat dari aktivitas PPO sering terjadi kesalahan selama proses pertumbuhan dan perkembangan tanaman (Fric, 1976; Scandalios, 1974). Aktivitas PPO akan meningkat apabila terjadi luka pada jaringan tanaman, penyebabnya antara lain terjadinya perubahan bentuk isozim yang akan mempengaruhi aktivitas PPO (Bashan et al., 1987; Maraite, 1973; Sato and Hasegawa, 1976).
Beberapa penelitian menemukan bahwa terdapat hubungan yang sangat dekat antara peningkatan aktivitas PPO dan aktivitas metabolik lainnya. Hasil penelitian menunjukkan bahwa peningkatan aktivitas PPO berhubungan dengan komposisi senyawa fenolat dan aktivitas peroksidase (PO) (Bashan et al., 1987; Czech-Kozlowska and Krzywanski, 1984; Srivastava and van Huystee, 1977b). Para ahli menemukan bahwa PPO dan PO sangat signifikan di dalam reaksi pertahanan (Arora
and Wagle, 1985; Bashan et al., 1987; Maraite, 1973; Retig, 1974), enzim PO dapat terinduksi oleh beberapa senyawa kimia yang akan mempengaruhi ekspresi dari gen yang mengkodenya. Pada tanaman Padi, gen yang terganggu akibat induksi tersebut akan mempengaruhi gen no.3.
BAB 3
BAHAN DAN METODA
3.1 Waktu dan Tempat
Penelitian ini dilakukan pada bulan April sampai dengan Agustus 2009 di Laboratorium Kultur Jaringan, Departemen Biologi, Fakultas Matematika dan Ilmu
Pengetahuan Alam, Universitas Sumatera Utara dan Laboratorium Biologi Molekuler Pusat Penelitian Kelapa Sawit Marihat, Pematang Siantar, Farmasi Kuantitatif, Fakultas Farmasi, USU dan Laboratorium Kimia Bahan Pangan, Fakultas Pertanian, USU.
3.2 Alat dan Bahan Penelitian
Adapun alat-alat yang digunakan dalam penelitian ini adalah autoklaf, laminar air flow (LAF), botol, alumunium foil, pipet serologi, pipet tetes, alat diseksi, gelas beaker, gelas ukur, neraca analitik, spektrofotometer, kuvet, shaker, pH meter, mikrosentrifuse, tabung Nitrogen cair dan mikropipet.
Sedangkan bahan penelitian yang digunakan adalah biji Terung belanda. Buah yang digunakan adalah buah yang masih muda yaitu yang memilki warna kulit buah hijau kemerahan, larutan pemutih, fungisida, alkohol 70%, akuades, agar-agar, gula, hara makro dan mikro, buffer fosfat, pyrogallol, coomassie briliant blue G 250, Bovine Serum Albumin (BSA), Triton X 100, H2O2, H2SO4 5%, buffer Tris HCl,
3.3 Metode Penelitian
Penelitian ini menggunakan metode percobaan dengan Rancangan Acak Lengkap faktorial dengan 2 faktor, yaitu :
A. Faktor konsentrasi kolkhisin (C) C1 : konsentrasi 0%
C2 : konsentrasi 0,01%
C3 : konsentrasi 0,1%
C4 : konsentrasi 1%
B. Faktor lamanya waktu perendaman (T) T1 : selama 5 menit
T2 : selama 15 menit
T3 : selama 30 menit
Sehingga diperoleh 12 kombinasi, yaitu :
C1T1 C2T1 C3T1 C4T1
C1T2 C2T2 C3T2 C4T2
C1T3 C2T3 C3T3 C4T3
Setiap perlakuan diulang sebanyak 6x.
3.4 Cara Kerja
3.4.1 sterilisasi alat dan bahan
3.4.2 Pembuatan Media
Media yang digunakan untuk penumbuhan kalus adalah media dasar MS (Murashige Skoog) dengan penambahan 1 mg/l 2,4 D serta 0,5 mg/l BAP. Tahap awal pembuatan media adalah pembuatan larutan stok yang terdiri dari stok hara makro, mikro, iron, dan vitamin. Sementara unsur lain seperti myo-inisitol, gula sukrosa dan agar dapat ditimbang langsung sesuai kebutuhan tanpa harus dijadikan larutan stok. Pembuatan media sebanyak 1000 ml.
Larutan MS dibuat dengan cara memasukkan hara makro, mikro, iron, vitamin, dan sukrosa ke dalam erlenmeyer yang ditambah aquadest hingga 500 ml kemudian dimasukkan kedalam gelas ukur 1000 ml dan ditambahkan akuades hingga 1000 ml Selanjutnya larutan dibagi ke dalam 16 perlakuan pada erlenmeyer yang setiap perlakuan berisi 62,5 ml. Diukur pH larutan setiap perlakuan dengan menggunakan pH meter sebesar 5,8. Untuk mendapatkan pH yang optimal maka ditambahkan NaOH 0,1 N atau HCl 0,1 N.
Media pada setiap perlakuan dimasak dengan menambahkan agar yang telah ditimbang sebanyak 0,89 gram dan diaduk sampai mendidih dan larutan berubah
menjadi berwarna bening. Setelah mendidih, larutan dituang ke dalam botol-botol kultur yang kemudian ditutup dengan alumunium foil yang telah steril dan diikat dengan karet gelang, selanjutnya disterilkan dalam autoklaf dengan suhu 121oC dengan tekanan 15 Psi selama 15 menit. Botol yang berisi media tersebut kemudian disterilisasi kembali dan disimpan dalam ruang kultur sebelum digunakan untuk penanaman eksplan.
3.4.3 Sterilisasi Biji Dan Perlakuan Biji Pada Larutan Kolkisin
sampai bersih, lalu direndam dalam alkohol 70 % 1 menit. Kemudian eksplan selanjutnya direndam dalam larutan pemutih (NaOCl 0,525%) 10% dan dishaker selama 5 menit lalu dibilas dengan akuades sebanyak 3 kali dan dilanjutkan dengan larutan pemutih (NaOCL 0,525%) 5% dan dishaker selama 5 menit lalu dibilas dengan akuades steril sebanyak 3 kali. Kemudian eksplan steril tersebut diletakkan di dalam cawan petri dan dikeringkan dengan kertas saring. Sterilisasi eksplan tersebut dilakukan di dalam Laminar Air Flow untuk menghindari terjadinya kontaminasi. Setelah biji steril, kemudian diberi perlakuan kolkhisin dengan konsentrasi 0; 0,01; 0,1% dengan lama waktu perendaman 5, 15 dan 30 menit, perendaman dilakukan di dalam Laminar Air Flow.
3.4.4 Penanaman Biji Pada Media MS
Sebelum melakukan penanaman, sudah dipastikan ruang yang akan digunakan benar-benar steril. Penanaman dilakukan di dalam laminar air flow (enkas). Alat-alat diseksi, bunsen, dan alkohol 70% dipersiapkan terlebih dahulu. Botol-botol yang berisi media yang telah disterilkan di letakkan di dalam laminar air flow. Dibuka tutup botol tersebut, penanaman dilakukan didekat bunsen untuk meminimalisir terjadinya
kontaminasi. Eksplan yang telah disterilkan dimasukkan ke dalam botol yang telah berisi media dengan menggunakan pinset steril, eksplan sebaiknya ditekan sedikit sampai benar-benar tertanam ke dalam media, ini untuk mempermudah eksplan dalam mengambil nutrisi dari media. Lalu botol kultur ditutup kembali dengan alumunium foil dan disimpan di rak kultur yang memiliki cahaya yang cukup atau tidak terlalu terang.
a. b.
3.4.5 Pemeliharaan Kultur Kalus Pada Media MS
Eksplan yang ditanam di dalam botol kultur diletakkan pada rak pemeliharaan dengan kondisi ruangan yang steril, dengan suhu ruangan 23oC dan intensitas cahaya yang digunakan adalah dengan penyinaran lampu neon 500 lux. Botol-botol yang berisi eksplan diatur jaraknya antara botol yang satu dengan botol yang lainnya sehingga mempermudah dalam perolehan sinar dan mempermudah dalam pengamatan. Setiap kali pengamatan sebaiknya tangan dan area disekitar tempat botol disterilkan dengan alkohol 70%.
Gambar 3.4.5 Pemeliharaan Kalus Pada Media MS di Ruang Kultur
3.4.6 Pembuatan Reagen Coomassie Briliant Blue G 250
3.4.7 Pembuatan Kurva Standar Bovine Serum Albumin
Larutan BSA dibuat dengan konsentrasi 0; 3; 6; 9; 12 dan 15 μg/ml dengan cara ditimbang sebanyak 0,1 g BSA lalu dilarutkan ke dalam 100 ml akuades. Lalu larutan BSA di masukkan ke dalam tabung reaksi dan ditambahkan Coomassie Briliant Blue G 250 hingga volume total mencapai 5 ml. Absorbansi diukur dengan spektrofotometer pada panjang gelombang 595 nm. Persamaan garis regresi kurva standar larutan protein ditentukan dengan rumus sebagai berikut :
Y = a + bX
Dimana : a = intersep a = Y- bX
n (∑XY) – (∑X)(∑Y) b = slope (koefisien regresi) b = n (∑X2) – (∑Y)2
3.4.8 Ekstraksi Kalus
Kalus dari setiap perlakuan yang telah diperoleh, diambil sebanyak 200 mg dalam 2 kali pengambilan (duplo), kemudian kalus gerus dengan menggunakan Nitrogen cair dan dihomogenasikan dengan 2 mL larutan buffer Tris-HCl 0,05 M pada pH 8 dan suhu 0oC dan 0,15% Triton X 100, kemudian disentrifugasi dengan kecepatan 14.000 rpm selama 20 menit dengan suhu 0oC. Supernatan yang terbentuk diambil untuk analisis selanjutnya.
3.4.9 Determinasi Protein
terjadinya perubahan warna larutan dari warna merah menjadi biru apabila terjadi ikatan antara reagen warna protein dengan protein setelah 2 menit hingga 1 jam.
3.5.0 Penentuan Aktivitas Enzim
Penentuan aktivitas Peroksidase (PO) dan Polyphenoloksidase (PO) dengan menggunakan metoda Kar and Mishra (1976). Prosedur ini berdasarkan kenyataan bahwa PO dan PPO dapat mengoksidasi pyrogallol. Proses oksidasi dari PO dalam mengkatalisis reaksi menggunakan H2O2 (Kar and Mishra, 1976: Maehly and Chance,
1954), sedangkan oksidasi dari PPO tidak menggunakan H2O2.
3.5.1 Pengujian Enzim Peroksidase (PO)
Pengujian aktivitas enzim ini dengan menggunakan 30 μl protein kalus (crude extract) dan ditambahkan 5 ml larutan pereaksi yang terdiri dari 10 mM pyrogallol dicampur 0,1 m buffer fosfat pada pH 6,8 dan suhu 25oC, lalu ditambahkan 10 mM H2O2
sebanyak 0,1 ml, didiamkan selama 5 menit, kemudian ditambahkan 0,5 mL H2SO4
5% (v/v) untuk menghentikan reaksi. Pengukuran kadar purpurogallin dilakukan dengan pengukuran nilai absorbansi yang menggunakan metoda Bausch & Lomb Spectronic 70 kolorimeter dengan panjang gelombang 420 nm. Campuran reaksi antara buffer posfat dengan pyrogallol digunakan sebagai larutan blanko.
3.5.2 Pengujian Enzim Polifenol oksidase (PPO)
Pengujian aktivitas enzim ini menggunakan prosedur yang hampir sama dengan pengujian peroksidase. Pengujian ini menggunakan penambahan ekstrak kalus sebanyak 70 μl dan ditambahkan 5 ml larutan pereaksi yang terdiri dari 0,1 m buffer posfat pada pH 6,8 dan suhu 25oC, didiamkan selama 5 menit, kemudian ditambahkan 0,5 mL H2SO4 5% (v/v) untuk menghentikan reaksi. Larutan diukur nilai
3.5.3 Parameter Pengamatan
Parameter yang diamati dalam penelitian ini adalah : Pengamatan secara kuantitatif
a. Berat basah kultur (gram) b. Persentase terkontaminasi (%)
Persentase kultur terkontaminasi dihitung setiap hari sejak awal hingga akhir penelitian
Jumlah eksplan yang terkontaminasi
Persentase terkontaminasi = X 100 % Jumlah eksplan seluruh perlakuan
c. Penentuan kadar protein
d. Penentuan aktivitas peroksidase (PO)
e. Penentuan aktivitas polifenol oksidase (PPO) f. Warna Kalus
3.5.4 Analisa Data
BAB 4
HASIL DAN PEMBAHASAN
4.1 Persentase Kultur Yang Hidup Setelah Diinduksi Kolkisin (%)
Pengamatan persentase kultur hidup dari semua perlakuan menunjukkan persentase hidup sebesar 90,27% yaitu sebanyak 65 botol dari 72 botol perlakuan (Tabel 4.1). Persentase kultur yang yang hidup untuk semua perlakuan menunjukkan hasil yang fluktuatif untuk konsentrasi dan waktu perendaman.
Tabel 4. 1 Persentase kultur Kalus Terung belanda Yang Hidup Setelah Diinduksi Kolkisin
Pada perlakuan dengan konsentrasi 0,1% memiliki persentase kultur hidup yang lebih besar yaitu 94,4%, sedangkan kultur hidup terendah pada perlakuan dengan konsentrasi 0,01% sebesar 83,33%. Waktu perendaman berpengaruh fluktuatif terhadap persentase kultur hidup. Perendaman selama 30 menit memiliki persentase kultur hidup tertinggi yaitu sebesar 95,83%, sedangkan perendaman selama 15 menit
seperti kerja yang aseptis, eksplan yang bagus dan viabilitas eksplan setelah diinduksi kolkisin.
Menurut Jauhariana (1995), bahwa pada umumnya kolkisin efektif untuk pertumbuhan tanaman pada konsentrasi 0,01-1%. Penelitian Herawati (1989) dalam Sulistianingsih, pada tembakau (Nicotiana tabacum L.) terjadi peningkatan jumlah daun, peningkatan kultur yang hidup, lebar dan panjang serta luas daun semakin besar.
Tetapi Menurut Suryo (1995), bahwa jika konsentrasi kolkisin dan waktu perlakukan yang tidak tepat, maka kolkisin akan memperlihatkan pengaruh negatif yaitu kerusakan sel-sel tanaman bahkan menyebabkan matinya jaringan tanaman. Konsentrasi kolkisin yang digunakan bervariasi dari 0,0005-1% dengan perendaman 1-6 hari, tergantung jenis benih yang digunakan. Umumnya, benih yang lama berkecambah memerlukan waktu perendaman yang lebih lama.
4.1.1 Berat Basah Kalus (g)
Hasil analisis sidik ragam pada pengamatan berat basah kalus (Lampiran M),
menunjukkan bahwa kombinasi perlakuan konsentrasi dan waktu perendaman berpengaruh sangat nyata, dimana pada kombinasi perlakuan yang memiliki berat basah kalus yang tertinggi pada C3T1 dan kombinasi perlakuan yang memiliki berat
basah kalus terrendah pada C4T2. Hasil rataan berat basah kalus dapat dilihat pada
Tabel 4.1.1 dibawah ini.
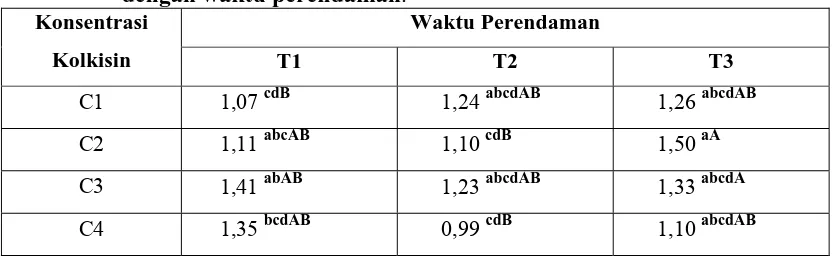
Tabel 4.1.1 Hubungan antara berat basah kalus dengan perlakuan kolkisin dengan waktu perendaman.
Waktu Perendaman Konsentrasi
Kolkisin T1 T2 T3
Dari hasil yang diperoleh bahwa pada semua perlakuan, perlakuan C3T1
memiliki rataan berat basah kultur tertinggi sebesar 1,41 g, sedangkan pada perlakuan C4T2 memiliki rataan berat basah kalus terrendah sebesar 0,99 g. Hasil tersebut
memberikan pengaruh yang berbeda nyata terhadap semua perlakuan. Hal ini menujukkan bahwa pada kombinasi perlakuan C3T1 (konsentrasi 0,1% dengan waktu
perendaman 5 menit) merupakan kombinasi yang paling baik untuk penginduksian dengan kolkisin, ini ditandai dengan peningkatan berat basah kalus. Sedangkan kombinasi perlakuan C4T2 (konsentrasi 1% dengan waktu perendaman 15 menit)
merupakan kombinasi yang kurang baik untuk penginduksian dengan kolkisin yang ditandai dengan penurunan berat basah kalus, begitu juga untuk kombinasi perlakuan dengan konsentrasi 0% (kontrol) memberikan pengaruh yang tidak terlalu baik dimana berat basah kalus tidak terlalu tinggi.
Menurut Eigisti dan Dustin (1995), bahwa kolkisin dengan konsentrasi yang beragam dapat menyebabkan pengaruh yang beragam pula. Berbagai konsentrasi kolkisin jika tidak sesuai akan memberikan pengaruh yang berbeda pada pertumbuhan tanaman seperti jumlah daun, berat basah tunas, berat basah akar, berat kering tunas dan berat kering akar.
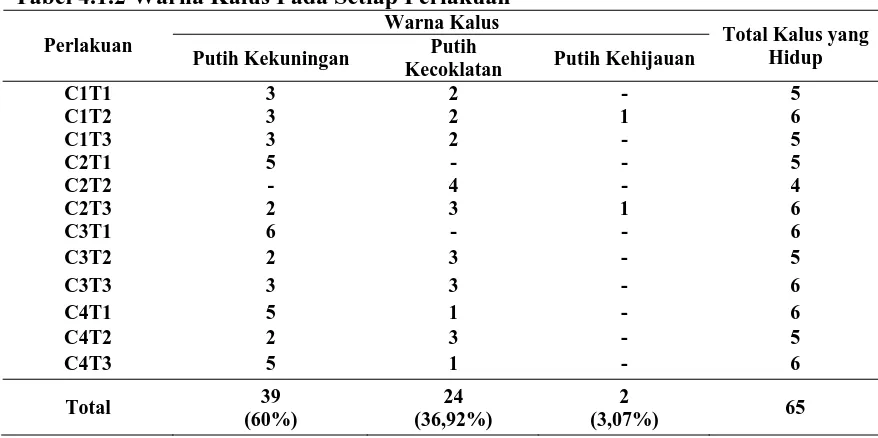
4.1.2 Warna Kalus
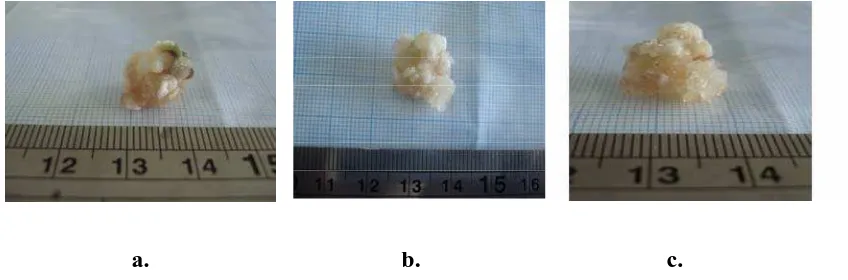
Warna kalus pada setiap perlakuan bervariasi yaitu putih kekuningan, putih kecoklatan dan putih kehijauan (Gambar 4.1.2). Kalus yang bewarna putih kekuningan merupakan kalus yang paling banyak tumbuh dari kedua warna kalus
lainnya yaitu dengan persentase sebesar 60%, sedangkan untuk warna putih kecoklatan dan putih kehijauan yaitu sebesar 36,92% dan 3,07% (Tabel 4.1.2).
kalus ini cendrung mengeluarkan senyawa fenolat yang dapat menghambat pertumbuhan kalus tersebut.
Tabel 4.1.2 Warna Kalus Pada Setiap Perlakuan Warna Kalus Perlakuan
Putih Kekuningan Putih
Kecoklatan Putih Kehijauan
Total Kalus yang
a. b. c.
Gambar 4.1.2 Kalus dengan beberapa variasi warna (a) Kalus yang berwarna coklat (b) Kalus yang berwarna kehijauan (c) Kalus yang berwarna kekuningan
Menurut Fitriani (2003), bahwa warna kalus kekuningan dan kehijauan merupakan kalus yang paling bagus, dimana banyak kalus yang mengalami
diffrensiasi menjadi planlet, sedangkan warna coklat pada kalus menandakan sel mengalami cekaman karena luka pada jaringan selain cekaman dari medium itu sendiri, sehingga terjadi sintesis senyawa fenolat sebagai pertahanan sel tanaman tersebut.
Menurut Santoso dan Nursandi (2004), warna kalus yang tidak hijau disebabkan oleh hilangnya polarisasi dari sel yang diinduksi dan dalam keadaan normal sel akan membentuk lebih banyak klorofil. Jika eksplan pada awalnya berwarna hijau berubah menjadi warna putih kecoklatan berarti terjadi proses degradasi dari klorofil.
4.1.3 Proliferasi Kalus
Tabel 4.1.3 Proliferasi dari Kalus yang Hidup dan Beregenerasi Proliferasi Perlakuan Kalus Yang Hidup
Pembentukan Tunas Pembentukan Planlet
C1T1 5 4 1
Dari keenam perlakuan yang mampu membentuk tunas dan planlet sekaligus terdapat pada 3 perlakuan kontrol, 2 perlakuan dengan konsentrasi 0,1% (C2) dan 1
perlakuan dengan konsentrasi 1% (C4). Hal ini mungkin disebabkan karena pada
perlakuan kontrol, proses pembentukan tunas dan planlet tidak terganggu karena belum diinduksi dengan kolkisin, tetapi pada konsentrasi 0,01% justru menghambat proses pembentukan kalus untuk beregenerasi menjadi planlet, namun akan terlihat kembali pengaruhnya pada konsentrasi 0,1 dan 1%. Kalus yang hidup dan beregenerasi menjadi tunas dan planlet dari semua perlakuan menunjukkan perubahan atau differensiasi dari kalus yang hidup baik. Perubahan itu terjadi karena sifat embriogenik dari kalus, sehingga kalus yang hidup memiliki potensi yang cukup besar dalam membentuk planlet ataupun tunas.
b
a
Menurut Purnamaningsih (2006), untuk memacu regenerasi kalus, media yang digunakan harus sesuai. Keseimbangan nutrisi di dalam suatu media sangat mempengaruhi pertumbuhan kalus maupun diferensiasinya membentuk planlet. Menurut Santoso dan Nursandi (2004), kemampuan kalus dalam beregenerasi dipengaruhi oleh kondisi kalus dan komposisi media. Ketidakmampuan kalus dalam beregenerasi disebabkan karena tidak seimbangnya antara zat pengatur tumbuh yang diberikan yaitu antara auksin dan sitokinin. Perubahan warna kalus menjadi hitam dan pertumbuhan yang lambat bahkan tidak mengalami pertumbuhan sama sekali dapat diindikasikan bahwa kalus tersebut sudah mati.
Menurut Kosmiatin & Mariska (2005), bahwa masih rendahnya kalus yang beregenerasi pada perlakuan diduga karena pemberian kolkisin dengan konsentrasi yang tinggi pada perlakuan mengakibatkan kerusakan fisiologi tanaman. Pemberian kolkisin akan mengakibatkan jaringan tanaman menjadi rusak dan penundaan pertumbuhan sehingga memerlukan waktu yang lama untuk tumbuh kembali.
4.1.4 Persentase Kultur Terkontaminasi (%)
Dari penelitian yang telah dilakukan dapat diketahui bahwa persentase kultur terkontaminasi adalah 9,73% yaitu sebanyak 7 botol dari 72 botol perlakuan, kontaminasi tersebut pada umumnya berasal eksplan (Lampiran J). Kondisi kultur yang terkontaminasi ini lebih banyak yang disebabkan oleh jamur, dimana seluruh permukaan media dan eksplannya tertutupi oleh hifa-hifa jamur (Gambar 4.1.4).
Kalus
Gambar 4.1.4 Kalus biji terung belanda yang mengalami kontaminasi pada eksplan
Menurut Hendaryono & Wijayani (1994), bahwa kondisi laboratorium kultur jaringan harus mengutamakan dan memperhatikan tingkat sterilitas dari ruangan sehingga terbebas dari kontaminasi mikroba yang tidak dikehendaki. Kontaminasi dapat terjadi setiap saat dalam masa kultur yang mungkin berasal dari eksplan, mikroba lingkungan kerja serta kecerobohan dalam pelaksanaan kultur jaringan.
Beberapa jaringan tanaman dapat digunakan untuk membentuk biakkan kalus seperti akar, batang, dan daun, Untuk membentuk kalus, jaringan dipisahkan dari tanaman dan permukaan sayatan disterilkan untuk membunuh pengkontaminasi
biakkan. Beberapa biakkan yang membentuk kalus dari tanaman yang tumbuh dalam kondisi aseptik dengan permukaan biji yang disterilkan untuk mengurangi kontaminasi (Nasir, 2002).
4.2 Pengukuran Kadar Protein Kalus
25,45
Perlakuan Kolkisin dan Waktu Perendaman
N
Gambar 4.Perlakuan Konsentrasi Kolkisin dan Waktu Perendaman Terhadap Kadar Protein Kalus
Dari Gambar 4.2 dapat dilihat bahwa dari hasil pengukuran kadar protein kalus diperoleh hasil yang bervariasi. Kadar protein kalus yang paling tinggi sebesar 25,870 µg/g ekstrak kalus yang terdapat 3 perlakuan yaitu C1T2, C3T3 dan C4T1, sedangkan
2 perlakuan yaitu C2T1 dan C3T1 memiliki kadar protein kalus terendah sebesar
25,617 µg/g ekstrak kalus. Tingginya kadar protein pada ketiga perlakuan tersebut karena banyaknya kandungan senyawa-senyawa lain yang terdapat di dalam ekstrak kalus tersebut seperti enzim dan senyawa metabolit lainnya. Sedangkan rendahnya kadar protein kalus disebabkan karena pengaruh aktivitas sintesis protein secara umum pada suatu jaringan tersebut. Apabila aktivitas sintesis protein terganggu yang disebabkan karena adanya penambahan senyawa mutagen yang bersifat toksik seperti kolkisin yang dapat menghambat proses sintesis protein dari kalus tersebut. Menurut Simhian (1998), bahwa protein dari suatu kalus dapat terhambat pembentukannya apabila ada satu hal yang dapat mengganggu proses sintesis di dalam kalus, hal
tersebut dapat dianalis secara biokimia.
4.3 Penentuan Aktivitas Enzim Peroksidase (PO)
enzim ini ditandai dengan adanya penguraian substrat yang terjadi yaitu pyrogallol terurai menjadi purpurogallin. Rataan hasil pengukuran aktivitas enzim peroksidase dan aktivitas spesifiknya dapat dilihat pada Tabel 4.3 dan Gambar 4.3.
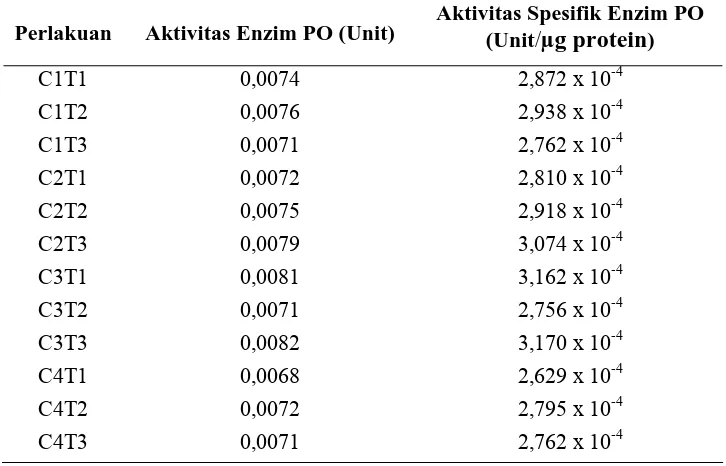
Tabel 4.3 Nilai Pengukuran Aktivitas Enzim Peroksidase dan Aktivitas Spesifik Enzim Peroksidase
Perlakuan Aktivitas Enzim PO (Unit) Aktivitas Spesifik Enzim PO (Unit/µg protein)
C1T1 0,0074 2,872 x 10-4
Perlakuan Kolkisin dan Waktu Perendaman
Ni
Dari Tabel 4.3 di atas terlihat bahwa nilai aktivitas peroksidase pada perlakuan kolkisin 0,1% dengan waktu perendaman 30 menit (C3T3) memiliki nilai aktivitas
peroksidase tertinggi sebesar 0,0082 unit, begitu juga untuk nilai aktivitas spesifiknya sebesar 3,170 x 10-4 unit/µg protein, sedangkan perlakuan kolkisin 1% dengan waktu perendaman 5 menit (C4T1) memiliki nilai aktivitas PO terendah sebesar 0,0068 unit
dan nilai aktivitas spesifiknya sebesar 2,629 x 10-4 unit/µg protein. Sedangkan pada perlakuan kontrol (C1T2) menunjukkan hasil aktivitas enzim dan aktivitas spesifik
yang lebih tinggi dibandingkan dengan perlakuan kolkisin dengan konsentrasi 1% (C4T1) yang memiliki nilai aktivitas PO dan aktivitas spesifik yang lebih rendah
dibandingkan dengan perlakuan lainnya. Hal ini mungkin disebabkan karena aktivitas PO pada perlakuan kontrol yang memiliki aktivitas enzim secara konstitutif yang memang sudah ada di dalam jaringan tanaman tersebut, dan aktivitas tersebut akan terhambat bila diinduksi dengan konsentrasi yang lebih tinggi (1%) namun akan terlihat kembali jika diinduksi pada konsentrasi 0,01-0,1%.
Pengaruh pemberian kolkisin dengan konsentrasi yang berbeda akan mempengaruhi nilai aktivitas peroksidase, dimana kolkisin yang diberikan pada kalus Terung belanda merupakan suatu cekaman eksternal bagi jaringan tanaman tersebut. Pada umumnya enzim PO dan PPO terbentuk di dalam jaringan tanaman bila terdapat
cekaman dari luar, seperti penambahan senyawa mutagen diantaranya kolkisin. Enzim PO dan PPO secara umum berperan dalam perkembangan, pertumbuhan serta resistensi tanaman. Sedangkan waktu perendaman berpengaruh secara fluktuatif untuk setiap perlakuan.
4.4 Penentuan Aktivitas Polifenol Oksidase (PPO)
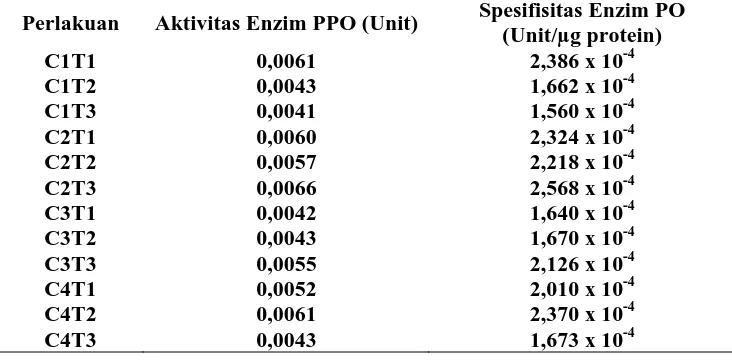
Dari hasil analisi sidik ragam dari pengukuran aktivitas enzim polifenol oksidase menunjukkan hasil yang tidak berbeda nyata untuk setiap perlakuan. Nilai aktivitas enzim ini ditandai dengan adanya penguraian substrat yang terjadi yaitu pyrogallol terurai menjadi purpurogallin. Rataan hasil pengukuran aktivitas enzim polifenol oksidase dan aktivitas spesifiknya dapat dilihat pada Tabel 4.4 dan Gambar 4.4.
Tabel 4.4 Nilai Pengukuran Aktivitas Enzim Polifenol Oksidase dan Aktivitas Spesifik Enzim PPO
Perlakuan Aktivitas Enzim PPO (Unit) Spesifisitas Enzim PO (Unit/µg protein)
Perlakuan Kolkisin dan Waktu Perendaman
N
Dari Tabel 4.4 menunjukkan bahwa nilai aktivitas polifenol oksidase pada perlakuan kolkisin 0,01% dengan waktu perendaman 30 menit (C2T3) memiliki nilai
aktivitas paling tinggi sebesar 0,0066 unit, begitu juga nilai aktivitas spesifiknya sebesar 2,568 x 10-4 unit/µg protein, sedangkan nilai aktivitas polifenol oksidase terendah pada perlakuan kolkisin 0% dengan waktu perendaman 30 menit (C1T3)
sebesar 0,0041 unit dan nilai aktivitas spesifiknya sebesar 1,560 x 10-4 unit/µg protein. Sedangkan pada perlakuan kontrol (C1T1) menunjukkan hasil aktivitas enzim dan
aktivitas spesifik yang lebih tinggi dibandingkan dengan perlakuan kolkisin dengan konsentrasi 1% (C4T2) yang memiliki nilai aktivitas PPO dan aktivitas spesifik yang
lebih rendah dibandingkan dengan perlakuan lainnya. Hal ini mungkin disebabkan karena aktivitas PPO pada perlakuan kontrol yang memiliki aktivitas enzim secara konstitutif yang memang sudah ada di dalam jaringan tanaman tersebut, dan aktivitas tersebut akan terhambat bila diinduksi dengan konsentrasi yang lebih tinggi (1%) namun akan terlihat kembali jika diinduksi pada konsentrasi 0,01-0,1%.
Aktivitas enzim polifenol oksidase dan peroksidase tidak jauh berbeda, dimana aktivitas yang paling tinggi terlihat pada konsentrasi kolkisin yang sesuai diberikan pada tanaman yaitu pada konsentrasi 0,01-0,1% sedangkan waktu perendaman berpengaruh secara fluktuatif. Enzim peroksidase dan polifenol oksidase berjalan secara sinergis di dalam suatu tanaman, enzim ini terdapat hampir di setiap organ tanaman dengan penyebaran dan nilai aktivitas yang berbeda di setiap organ tanaman tersebut. Hal ini terjadi karena pengaruh pemberian kolkisin dengan konsentrasi yang berbeda akan mempengaruhi nilai aktivitas peroksidase, dimana kolkisin yang diberikan pada kalus Terung belanda merupakan suatu cekaman eksternal bagi jaringan tanaman tersebut. Pada umumnya enzim PO dan PPO terbentuk di dalam
suatu jaringan tanaman terjadi apabila terdapat cekaman dari luar antara lain penambahan senyawa mutagen seperti kolkisin. Enzim PO dan PPO secara umum berperan dalam perkembangan, pertumbuhan serta resistensi tanaman. Sedangkan waktu perendaman berpengaruh secara fluktuatif untuk setiap perlakuan.
disebabkan nilai aktivitas yang berfluktuatif untuk setiap perlakuan karena pada penelitian, kalus yang digunakan umumnya telah berwarna kecoklatan, ini menyebabkan nilai PPO untuk setiap perlakuan hampir sama. Dari hasil penelitian tanaman kubis menunjukkan bahwa peningkatan aktivitas PPO berhubungan dengan komposisi senyawa fenolat yang dihasilkan, semakin tinggi senyawa fenolat dihasilkan semakin tinggi pula aktivitas PPO (Bashan et al., 1987; Czech-Kozlowska and Krzywanski, 1984; Srivastava and van Huystee, 1977b).
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari penelitian yang telah dilakukan, diperoleh kesimpulan sebagai berikut :
a. Peningkatan konsentrasi kolkisin menyebabkan penurunan berat basah kalus
dan persentase kultur hidup serta variasi warna kalus, akan tetapi terjadi peningkatan terhadap nilai aktivitas enzim peroksidase dan polifenol oksidase. b. Perlakuan terbaik dari berat basah kalus yaitu pada perlakuan kombinasi C3T3
(konsentrasi kolkisin 0,1% dengan waktu perendaman 30 menit) begitu juga untuk nilai aktivitas enzim peroksidase dan polifenol oksidase.
5.2 Saran
a. Perlu dilakukan penelitian lebih lanjut untuk mengetahui aktivitas enzim peroksidase dan polifenol oksidase pada tanaman yang sakit, untuk dibandingkan dengan aktivitas enzim pada tanaman yang sehat.
DAFTAR PUSTAKA
Arora, Y.K., and K.L Bajaj. 1985. Peroxidase and polyphenol oxidase associated with induced restistance of mung bean to Rhizoctonia solani Kuhn. Phytopath. Z.114: 325-331
Artlip, T.S., and E.A.Funkhouser. 1995. Protein Synthetic Responses to Enviromental Stresses. In M. Pessarakli (Ed). Handbook of Plant and Crop Physiology. Marcel Dekker, Inc., New York. hlm. 627-644
Bakardjieva, N.T. 1986. Metal ions control on activity, polyfunctionality an UV-photosensitivity of plant peroxidase. In: Molecular and Physiological Aspect of Plant Peroxidases. Eds. Greppin, H., C. Penel, and Th. Gaspar. Univ. of Geneva. Geneva, Switzerland. hlm. 143-154
Bashan, Y., Y. Okon, and Y. Henis. 1987. Peroxidase, polyphenol oxidase and phenols in relation to resistance against Pseudomonas syringae pv.tomato in tomato plant. Can. J. Bot. 65: 366-372
Batra, G.K., and C.W. kuhn. 1975. Polyphenoloxidase activities associated with acquired resistance and its inhibition by 2-thiouracil in virus-infected soybean. Physiol. Plant Pathol. 5: 239-248
Bell, A.A. 1981. Biochemical mechanisms of disease resistenace. Ann. Rev. Plant Phyiol. 32: 21-81
Birecka, H., J.L. Catlfamo, and M.O. Garraway. 1975a. Cell wall and protoplast isoperoxidases of corn leaves in relation to cut injury and infection with tobacco mosaic virus. Plant Physiol. 55: 611-619
Bohs. 2001. Tamarillo in New Zealand. http://www. Accthor.Org/books/486/486-33.htm
Bradford, M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72: 248-254
Cantwell. 2001. Keanekaragaman Rekayasa Genetik Pada Tanaman Tomat http://www.highwire.stanford.edu
Catesson, A.M., A. Imberty, R. Goldberg, and Y. Czaninski. 1986. Nature, localization and specificity of peroxidases involved in lignification process. In: Molecular and Physiological Aspects of Plant Peroxidases. Eds. Greppin, H., C. Penel, ang Th. Gaspar. Univ. of Geneva, Geneva, Swizerland. hlm. 189-198
Chiu, S.M., and Y.C. Teng. 1977. Studies on disease resistance, yielding capacity and grain quality of blast, Pyricularia oryzae, resistant multiline and composite varieties of rice. J. Agric. Res. China.25: 249-258
Czech-Kozlowska, M., and Z. Krzywanski. 1984. Phenolic compounds and the polyphenoloxidase and peroxidase activity in callus tissue culture-pathogen combination of red rasberry and Didymella applanata (Niessl.) Sacc. Phytopath. Z. 109: 176-182
Departemen pertanian. 2003. Data Agribisnis Wilayah Sumatera. http://www.agribisnis.deptan.go.id.diakses tanggal 21 Mei 2008
---. 2005. Data Agribisnis Wilayah Sumatera I. http://www.agribisnis.deptan.go.id
Eigisti, P.J. & P.J. Dustin. 1995. Colchichine in Agricultur, Medicine Biology and Chemistry. Lowa: The lowa State Collage Press.hlm.275
Farkas, G.L., and Z. Kiraly. 1962. Role of phenolic compound in the physiology of plant diseases and disease resistance. Phytopathol. Z.44: 105-140
Faucon, P. 1998. Tree Tomato, Tamarillo. http://www.deserttropical.com diakses tanggal 23 Mei 2008
Fitriani, A. 2003. Kandungan Ajmalisin Pada Kultur Kalus Catharanthus roseus L. dan Setelah Dielisitasi Homogenat Jamur Pythium aphanidermatum Edson Fitzp. Makalah Pengantar Falsafah Sains. Bogor: Program Pascasarjana IPB.hlm.10
Fric, F. 1976. Oxidative enzymes. In: Encyclopedia of Plant Physiology. New Series. Eds. Heitefuss, R. and P.H Williams. Springer-Verlag. Berlin, Germany. hlm. 617-631
Fry, S.C. 1986. Polymer-bound phenols as natural substrates of peroxidases. In: Molecular and Physiological Aspects of Plant peroxidases. Eds. Greppin, H., C. Penel, and Th. Gaspar. University of Geneva. Geneva, Switzerland. hlm. 169-182
Gaman. P.M. & sherrington, K.B. 1992. Ilmu Pangan: Pengantar Ilmu Pangan, Nutrisi dan Mikrobiologi. Edisi ke-2. Yogyakarta: UGM Press. hlm: 167-168
George, E.T & Sherrington, P.D. 1984. Plant Propagation by Tissue Culture. Handbook and Directory of commercial laboratories. Exegetics limited. Eastern Press. England. hlm: 220-222
Griffith, A.I. 2000. An Introduction to genetic Analysis. 7th ed. W.H. Freeman. New York. hlm: 207-215
Gunawan, L.W. 1990. Teknik kultur In Vitro Dalam Holtikultura. Jakarta: Penebar Swadaya. hlm: 41
Hadiati, S., Murdaningsih, H.K., Achmad Baihaki dan Neni Rostini. 2002. Variasi Pola Pita dan Hubungan Kekerabatan Nenas Berdasarkan Analisis Isozim. Zuriat 13 (2): 65-72
Hendaryono, D.P.S & A. Wijayani. 1994. Teknik Kultur Jaringan Pengenalan dan Petunjuk Perbanyakan Tanaman Secara Vegetatif. Cetakan pertama. Yogyakarta: Kansius.hlm: 67
Hu, C., M. Krol, and R.B. van Huystee. 1990. Comparison of anionic with cationic peroxidase from cultured peanut cells. Plant Cell Tiss. Org. Cult. 22: 65-70
Husni, A. 2005. Regenerasi Protoplas Tanaman terung dan Ketahanan Regenerasi Terhadap Penyakit Bakteri Layu. Berita Biologi. 7(6):285-293
Jauhariana, A.Y. 1995. Pengaruh Pemberian Kolkisin terhadap Perubahan Jumlah Kromosom, Struktur Kromosom pada Stevia rheubaudina. Skripsi Fakultas Biologi UGM.hlm. 52-61
Kar, M., and D. Mishra. 1976. Catalase, peroxidase, and polyphenoloxidase activity during rice leaf senescence. Plant Physiol. 57: 315-319
Katuuk, J.R.P. 1989. Teknik Kultur Jaringan Dalam Mikropogasi Tanaman. Jakarta: Departemen Pandidikan dan Kebudayaan. hlm: 46
Kerby, K., and S. Somerville. 1989. Enhancement of specific intercellular peroxidases following inoculation of barley with Erysiphe graminis f.sp. hordei. Physiol. Molec. Plant Pathol. 35: 323-337
Kosmiatin, M dan I, Mariska. 2005. Kultur Embrio dan Penggandaan Kromosom Hasil Persilangan Kacang Hijau dan Kacang Hitam. Jurnal Bioteknologi Pertanian 10(1):24-34
Kosuge, T. 1969. The role of phenolics in host response to infection. Ann. Rev. Phytopatol. 7: 195-222
Lazarovits, G., and E.W.B. Ward. 1982. Polyphenoloxidase activity in soybean hypocotyls at sites inoculated with Phytophora megasperma f.sp. glycinea. Physiol. Plant Pathol. 21: 227-236
Lee, T.T. 1973. On extraction and quantitation of plant peroxidase isozymes. Physiol. Plant. 29: 198-203
Madon, M., M.M. Clyde., Hashim, H., Mohd.Yusuf. Y., Mat. H and Saratha. S. 2005. Polyploidy introduction of oil palm through colchicines and oryzalin treatments. Journal of Oil Palm Research. 17:110-123
Maldonado, B.A., and R.B. van Huystee. 1980. Isolation of a cationic peroxidase from cultured peanut cells. Can. J. Bot. 58: 2280-2284
Maraite, H. 1973. Changes in polyphenoloxidases and peroxidases in muskmelon (Cucumis melon L.) infected by fusarium oxysporum f.sp. melonis. Physiol. Plant Pathol. 3: 29-49
Mariska, I. 1996. Penyelamatan Embrio Hasil Persilangan Antara Panili Budidaya dan Panili Luar. Balitbio1(1):1-5
Meudt, W.J., and K.J. Stecher. 1972. Promotion of peroxidase activity in the cell wall of Nicotiana. Plant Physiol. 50: 157-160
Mäder, M., and V. Amberg-Fisher. 1982. Role of peroxidase in lignification on tobacco Cells. I. Oxidation of nicotinamide adenine dinucleotide and formation of hydrogen peroxide by cell wall peroxidases. Plant Physiol. 70: 1128-1131
Mäder, M., and R. Fűssl. 1982. Role of peroxidase in lignification on tobacco cells. II. Regulation by phenolic compounds. Plant Physiol. 70: 1132-1134
Mäder, M., J. Ungemach, and P. Schloβ. 1980. The role of peroxidase isozyme groups of Nicotiana tabacum in hydrogen peroxide formation. Planta147: 467-470
Nasir, M. 2002. Bioteknologi: Potensi dan Keberhasilannya dalam Bidang Pertanian. Cetakan petama. Jakarta: PT. Raja Grafindo Persada. hlm: 33
Nugroho, A & H. Sugito. 2004. Pedoman Pelaksanaan Teknik Kultur Jaringan. Cetakan kelima. Jakarta: Penebar Swadaya. hlm: 41
Page, U.S. 1989. Prinsip-Prinsip Biokimia. Jakarta: Erlangga. hlm: 80
Pierik, R.L.M. 1987. In Vitro Culture of Higher Plants. Martinus Nijhoff Publisher. Netherland. hlm:197
Priyono, D. Suhandi, & Matsaleh. 2000. Pengaruh Zat Pengatur Tumbuh IAA dan 2-IP pada Kultur Jaringan Bakal Buah Pisang. Jurnal Holtikultura. 10 (3): 183-190
Purnamaningsih, R.2006. Induksi Kalus dan Optimasi Regenerasi Empat Varietas Padi Melalui Kultur In Vitro. Jurnal Agrobisnis2(2): 74-80
Retig, N. 1974. Changes in peroxidase an polyphenoloxidase associated with natural and induced resistance of tomato to Fusarium wilt. Physiol. Plant Pathol. 4: 145-150
Ruhland, W. 2004. The inductin in Phlox by Colchicine. Journal of Plant Research 113: 219-225
RnList. 2005. Colchicine. http://www.RnList.cox
Santoso, U & Fatimah, N. 2004. Kultur Jaringan Tanaman. Cetakan kedua. Malang: Universitas Muahammadiyah. hlm: 137
Sastrosupandi, A. 2004. Rancangan Percobaan Praktis Bidang Pertanian. Edisi revisi. Cetakan kelima. Yogyakarta: Kanisius. hlm: 53-57
Sato, M., and M. Hasegawa. 1976. The latency of spinach chloroplast phenolase. Phytochemistry15: 61-65
Scandalios, J.G. 1974. Isozymess in development and differentiation. Ann. Rev. Plant. Physiol.25: 225-258
Seagraves, K.A., Thompson, J.N., Soltis. P.S and Soltis P.E. 1999. Multiple Origins of polyploidy and the Geographic Structure of Heuchera grossulariifolia. Molecular Ecology. 7: 252-262
Sesto, P.A., and R.B. van huystee. 1989. Purification and yield of a cationic peroxidase from a peanut suspention cell culture. Plant Sci. 61: 163-168
Shannon, L.M. 1968. Plant Isozymes. Ann. Rev. Plant Physiology(19): 187-210
Siegel, S.M., and B.Z. Siegel. 1986. Peroxidase activity and stress: a complex relationship. In: Molecular and Physiological Aspects of Plant Peroxidases. Eds. Greppin, hlm: 215-221
Simhian, 1998. Aktivitas Peroksidase Dalam 3 Varietas Tanaman Tomat (Intan, Gondol dan LV 2471) Yang Diserang Nematoda Bengkak Akar (Meloidogyne sp.). ITB. Bandung. hlm. 6-11