PENENTUAN pH DAN SUHU OPTIMUM DARI AKTIVITAS
EKSTRAK KASAR ENZIM SELULASE HASIL ISOLASI
BEKICOT (Achatina fulica) TERHADAP HIDROLISA
SUBSTRAT SELULOSA, KERTAS HVS
DAN AMPAS TEBU
SKRIPSI
DECY NOVITA SARI
070802014
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENENTUAN pH DAN SUHU OPTIMUM DARI AKTIVITAS EKSTRAK KASAR ENZIM SELULASE HASIL ISOLASI BEKICOT
(Achatina fulica) TERHADAP HIDROLISA SUBSTRAT SELULOSA, KERTAS HVS DAN AMPAS TEBU
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
DECY NOVITA SARI 070802014
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PENENTUAN pH DAN SUHU OPTIMUM DARI
AKTIVITAS EKSTRAK KASAR ENZIM SELULASE HASIL ISOLASI BEKICOT (Achatina
fulica) TERHADAP HIDROLISA SUBSTRAT
SELULOSA, KERTAS HVS DAN AMPAS TEBU
Kategori : SKRIPSI
Nama : DECY NOVITA SARI
Nomor Induk Mahasiswa : 070802014
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, 5 Agustus 2011
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Prof. Dr. Jamaran Kaban, M.Sc. Drs. Firman Sebayang, MS NIP. 195106301980021001 NIP. 195607261985031001
Diketahui/Disetujui Oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENENTUAN pH DAN SUHU OPTIMUM DARI AKTIVITAS EKSTRAK KASAR ENZIM SELULASE HASIL ISOLASI BEKICOT (Achatina fulica) TERHADAP
HIDROLISA SUBSTRAT SELULOSA, KERTAS HVS DAN AMPAS TEBU
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dari ringkasan yang masing-masing disebutkan sumbernya.
Medan, 5 Agustus 2011
PENGHARGAAN
Bismillahirrahmanirrahim…
Syukur alhamdulillah, segala puji penulis ucapkan kehidrat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga skripsi ini dapat terselesaikan. Dalam hal ini penulis ucapkan terima kasih dan penghargaan kepada:
1. Kedua orang tua tercinta dan tersayang, ayahanda Emly dan ibunda Upik Yani yang dengan doa dan kerja kerasnya telah ikhlas membesarkan, membiayai, dan mendidik penulis agar dapat menjadi manusia yang berguna bagi bangsa dan agama serta bermanfaat bagi orang lain. Abang Yudha Syahputra SE yang selalu menjadi semangat dan memberi dukungan moril kepada penulis sehingga dapat menyelesaikan skripsi ini.
2. Bapak Drs. Firman Sebayang,MS selaku pembimbing I dan Bapak Prof. Dr. Jamaran Kaban M.Sc selaku pembimbing II dan juga dosen wali penulis, yang telah memberikan arahan, bimbingan, dan dukungan penuh kepada penulis dalam menyelesaikan skripsi ini.
3. Ibu Dr.Rumondang Bulan,MS dan Bapak Drs.Albert Pasaribu,M.Sc selaku Ketua dan Sekretaris Departemen Kimia FMIPA USU yang telah mensahkan skripsi ini.
4. Bapak dan Ibu dosen di Departemen Kimia FMIPA USU, yang tak kenal lelah dalam mengajar dan telah banyak memberikan ilmu yang bermanfaat bagi penulis.
5. Sahabat-sahabatku Pina, Oki, Destia, Reni, Irma, Fitri, Rifky, Rya, Mariana, Mitha, kak Fitri, kak Nelvi, kak Rani, kak Tiwi, kak Febri, Bang Riri serta rekan-rekan stambuk 2006, 2007, dan 2008 atas dukungan, perhatian, keceriaan dan doa yang diberikan kepada penulis.
6. Kepada teman-teman seperjuangan di Laboratorium Biokimia/KBM FMIPA USU (asisten) : kak Nora, kak Nurmala, kak Fiah, kak Vika, bang Agung, bang Egy, bang Eko, bang Ardy, Pina, Oki, Annisa, Arini, Tiwi, Soraya dan Feri atas dorongan dan ide-ide yang diberikan kepada penulis dalam menyelesaikan skripsi ini.
7. Teman-teman kos gang Pelita Sempit : Ika, Maya, Masita, Nisa, Putri, Rani, dan Ulfha atas dukungan serta semangat-semangat yang diberikan kepada penulis.
9. Semua pihak yang tidak bisa disebutkan satu persatu yang telah membantu dan memberikan dukungan kepada penulis dalam menyelesaikan kuliah dan mencapai gelar Sarjana Sains, penulis mengucapkan banyak terima kasih. Semoga Allah SWT akan membahas kebaikan-kebaikan yang telah diberikan kepada penulis, Amin.
ABSTRAK
DETERMINATION OF OPTIMUM pH AND OPTIMUM TEMPERATURE OF CRUDE CELLULOSE ENZYME ACTIVITY ISOLATED FROM SNAIL
(Achatina fulica) IN CELLULOSE SUBSTRATE, HVS PAPER AND BAGASSE
ABSTRACT
DAFTAR ISI
Halaman
Judul i
Persetujuan ii
Pernyataan iii
Penghargaan iv
Abstrak vi
Abstract vii
Daftar Isi viii
Daftar Tabel xi
Daftar Gambar xii
Daftar Lampiran xiii
BAB 1 PENDAHULUAN
1.1. Latar Belakang 1
1.2. Permasalahan 4
1.3. Pembatasan Masalah 4
1.4. Tujuan Penelitian 4
1.5. Manfaat penelitian 5
1.6. Lokasi Penelitian 5
1.7. Metode Penelitian 5
BAB 2 TINJAUAN PUSTAKA
2.1. Bekicot (Achatina fulica) 7
2.2. Enzim 9
2.2.1. Sifat – sifat enzim 10
2.2.2. Dasar Kerja Enzim 11
2.2.3. Faktor – Faktor Yang Mempengaruhi Kerja Enzim 11
2.2.4. Klasifikasi Enzim 13
2.3. Enzim Selulase 15
2.4. Selulosa 17
2.5. Kertas 20
2.6. Ampas Tebu 23
2.7. Metode Analisa Kuantitatif Glukosa 23
2.7.1.Metode Nelson – Somogyi 23
2.7.2.Metode Lane Eynon 23
2.7.3.Metode Saffer Somogyi 24
2.7.4.Metode Anthrone 24
2.7.5.Metode Munson Walker 24
2.8. Spektrofotometer UV- Visible 24
2.8.1.Aspek Kualitatif dan Kuantitatif Spektrofotometri UV-Vis 25
BAB 3 METODE PENELITIAN
3.1. Alat dan Bahan 27
3.1.2. Bahan – bahan 28
3.2. Prosedur Penelitian 28
3.2.1. Pembuatan Larutan Pereaksi 28
3.2.1.1. Pembuatan Larutan Buffer Asetat 0,2 M 28 3.2.1.2. Pembuatan Larutan NaOH 0,1 N 29
3.2.1.3. Pembuatan Larutan NaCl 1% 29
3.2.1.4. Pembuatan Larutan Glukosa 0,2 mg/ml 29 3.2.1.5. Pembuatan Larutan Pereaksi Nelson 29 3.2.1.6. Pembuatan Larutan Arsenomolibdat 30 3.2.2. Penyediaan Ekstrak Kasar Enzim Selulase 30 3.2.3. Pengukuran Panjang Gelombang Maksimum Larutan 30
Glukosa
3.2.4. Penyiapan Kurva Standar Glukosa 31
3.2.5. Penentuan Suhu Optimum Ekstrak Kasar Enzim Selulase 31 3.2.6. Penentuan pH Optimum Ekstrak Kasar Enzim Selulase 31 3.2.7. Pegukuran Aktivitas Ekstrak Kasar Enzim Selulase 32
3.3. Bagan Penelitian 33
3.3.1. Penyediaan Ekstrak Kasar Enzim Selulase 33 3.3.2. Penentuan Suhu Optimum Hidrolisa Selulosa oleh Enzim 34
Selulase
3.3.3. Penentuan pH Optimum Hidrolisa Selulosa oleh Enzim 35 Selulase
3.3.4. Pengukuran Aktivitas Ekstrak Kasar Enzim Selulase Pada
Kondisi Optimum 36
BAB 4 HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian Dan Pembahasan 38
4.1.1. Isolasi Ekstrak Kasar Enzim Selulase dari Bekicot 38 4.1.2. Pengaruh Suhu Terhadap Aktivitas Ekstrak Kasar Enzim 38
Selulase Pada Substrat Selulosa, Kertas HVS dan Ampas Tebu
4.1.3. Pengaruh pH Terhadap Aktivitas Ekstrak Kasar Enzim 41 Selulase
4.1.4. Pengujian Aktivitas Ekstrak Kasar Enzim Selulase Pada 44 Kondisi Optimum Pada Substrat Selulosa, Kertas HVS
dan Ampas Tebu
BAB 5 KESIMPULAN DAN SARAN
5.1. Kesimpulan 47
5.2. Saran 47
DAFTAR PUSTAKA 48
DAFTAR TABEL
Tabel 2.1. Komposisi Kimia dari Pulp Kertas 20
Tabel 2.2. Komposisi Kimia Ampas Tebu 23
Tabel 3.1. Pembuatan Larutan Buffer Asetat 0,2 M 29 Tabel 4.1 Data Pengaruh Suhu Terhadap Aktivitas Ekstrak Kasar 39
Enzim Selulase Pada Substrat Selulosa
Tabel 4.2 Data Pengaruh Suhu Terhadap Aktivitas Ekstrak Kasar Enzim Selulase 39 Pada Substrat Kertas HVS
Tabel 4.3 Data Pengaruh Suhu Terhadap Aktivitas Ekstrak Kasar Enzim 40 Selulase Pada Substrat Ampas Tebu
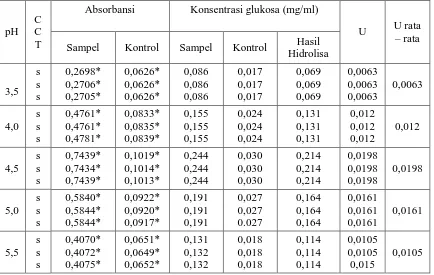
Tabel 4.4 Data Pengaruh pH Terhadap Aktivitas Ekstrak Kasar Enzim Selulase 42 Pada Substrat Selulosa
Tabel 4.5 Data Pengaruh pH Terhadap Aktivitas Ekstrak Kasar Enzim Selulase 42 Pada Substrat Kertas HVS
Tabel 4.6 Data Pengaruh pH Terhadap Aktivitas Ekstrak Kasar Enzim Selulase 43 Pada Substrat Ampas Tebu
Tabel 4.7 Data Aktivitas Ekstrak Kasar Enzim Selulase Pada Kondisi Optimum 44 Pada Substrat Selulosa
Tabel 4.8 Data Aktivitas Ekstrak Kasar Enzim Selulase Pada Kondisi Optimum 44 Pada Substrat Kertas HVS
DAFTAR GAMBAR
Gambar 2.1. Anatomi Tubuh Bekicot 7
Gambar 2.2. Struktur Dari Selulosa 18
Gambar 2.3. Mekanisme Pemecahan Selulosa menjadi Glukosa 19 Gambar 4.1. Grafik Pengaruh Suhu Terhadap Aktivitas Ekstrak Kasar 40
Enzim Selulase
Gambar 4.2. Grafik Pengaruh pH Terhadap Aktivitas Ekstrak Kasar Enzim 43 Selulase
DAFTAR LAMPIRAN
Lampiran 1. Kurva Spektrum λmaks Larutan Standar Glukosa 51
Lampiran 2. Kurva Kalibrasi Larutan Standar Glukosa 52 Lampiran 3. Harga erf (t) atau ert(hx) dari harga T 53 Lampiran 4 Data Pengukuran absorbansi Glukosa Hasil Hidrolisa Selulosa 54 Lampiran 5. Data Pengukuran absorbansi Glukosa Hasil Hidrolisa Kertas 55 Lampiran 6. Data Pengukuran absorbansi Glukosa Hasil Hidrolisa Ampas Tebu 56 Lampiran 7. Perhitungan Kadar Glukosa Hasil Hidrolisis Selulosa 1%, 58 Kertas HVS 1% dan Ampas Tebu 1%
Lampiran 8. Perhitungan Kandungan Glukosa Ekstrak Hasil Isolasi Pada 59 Kondisi Optimum
ABSTRAK
DETERMINATION OF OPTIMUM pH AND OPTIMUM TEMPERATURE OF CRUDE CELLULOSE ENZYME ACTIVITY ISOLATED FROM SNAIL
(Achatina fulica) IN CELLULOSE SUBSTRATE, HVS PAPER AND BAGASSE
ABSTRACT
BAB 1
PENDAHULUAN
1.1Latar Belakang
Bekicot (Achatina Fulica) tercakup di dalam subkelas Pulmonata dari kelas
Gastropoda yang merupakan kelompok molusca yang sangat besar. Meskipun didalam
subkelas ini sudah terdapat spesialisasi untuk hidup di daratan kering,tetapi masih
menunjukkan banyak sifat pokok kelas Gastropoda sebagai keseluruhannya. Pada
tahun 1847 seorang kolektor concha yang mengunjungi Mauriius membawa beberapa
spesimen hidup di Calcuta.Disitu Achatina fulica berkembang baik dan tersebar luas
tanpa ada musuhnya. Pada tahun 1900 ia telah mencapai Cylon dan menjadi hama
pertanian. Pada tahun 1911 sudah tersebar di Singapura dan selanjutnya ke
Kalimantan. Di Sumatera dan Jawa,hewan ini telah merusak perkebunan karet. Pada
tahun itu juga telah mencapai Taiwan,dan disambut hangat oleh orang – orang Jepang
sebagai makanan yang menarik dan berkhasiat obat( Radiopoetro, 1995).
Selulosa merupakan senyawa organik yang paling banyak melimpah di
alam.Diperkirakan sekitar 1011 ton selulosa dibiosintesis tiap tahun.Daun kering
mengandung 10-20% selulosa,kayu 50% dan kapas 90%. Selulosa merupakan
homopolisakarida linier yang tidak bercabang,terdiri dari 10.000 atau lebih unit
D-glukosa yang dihubungkan oleh ikatan 1,4-β-glikosida (Wijayanti, 2005).
Di alam, selulosa banyak dijumpai sebagai selulosa natif yang berikatan
dengan senyawa lain seperti lignin dan selulosa. Ada pula selulosa yang telah
dihilangkan kadar ligninnya seperti pada kertas. Kertas adalah bahan yang tipis dan
rata, yang dihasilkan dengan kompresi serat yang berasal dari pulp. Serat yang
Selulosa banyak terdapat dalam limbah pertanian atau kehutanan dan belum
banyak dimanfaatkan. Limbah ini merupakan salah satu bentuk energi yang cukup
potensial dan pada umumnya merupakan bahan berselulosa yang dapat
dimaanfaatkan.Salah satu limbah pertanian yang dapat dimaanfaatkan adalah ampas
tebu. Ampas tebu merupakan limbah padat industri gula tebu yang mengandung serat
selulosa yang biasanya digunakan sebagai bahan baku industri kertas dan bahan bakar.
Enzim yang dapat digunakan untuk mendegradasi selulosa adalah enzim
selulase. Selulase adalah enzim yang mampu menguraikan selulosa dalam
menghidrolisis ikatan β (1,4) glikosida menjadi bentuk yang lebih sederhana yang
kemudian menguraikan lebih lanjut hingga menjadi monomer glukosa. Penguraian
oleh enzim selulase penting sekali mengingat banyaknya selulosa yang terdapat di
alam, yang perlu diuraikan kembali dimana selulosa merupakan pembentuk struktur
dasar dari tumbuh – tumbuhan,komponen utama pada limbah pertanian dan banyak
terdapat sebagai limbah perkotaan. Mikroorganisme tertentu mempunyai kesanggupan
untuk tumbuh pada selulosa. Mikroorganisme yang digunakan untuk mendapatkan
selulase diantaranya: Myrotechium verucaria,Penecillium pusillim,Trichoderma
viridae,Strepromyces sp (Marsiati, 1989).
Enzim selulase selain dihasilkan oleh mikroba selulolitik yang hidup di alam
bebas juga dapat dihasilkan oleh mikroba selulolitik yang terdapat dalam tubuh
hewan.Secara komersil, harga enzim selulase yang dihasilkan dari jamur atau bakteri
cukup mahal sehingga permasalahan yang sering muncul dalam hidrolisis enzimatis
adalah kurang tersedianya enzim selulase yang murah dan efisien.Oleh karena itu
dilakukan upaya mencari sumber enzim lain yang dapat memproduksi enzim selulase.
Keong mas (Pomacea caniculata) merupakan salah satu hewan yang
menghasilkan enzim selulase. Siregar, (1999) telah mencoba mengisolasi enzim
selulase dari pankreas keong mas dan menggunakannya untuk meghidrolisis selulosa..
Enzim selulase juga dihasilkan dari hewan bekicot (Achatina fulica) yang merupakan
kelas Gastropoda yang sama dengan keong mas. Bekicot merupakan salah satu hewan
banyak ditemukan mikroba selulolitik. Silaban, (1999), berhasil menemukan mikroba
selulolitik tersebut yaitu Pseudomonas alcaligenes PaAf-18 dan Enterobacter
agglomerans EaAf-18. Mikroba ini banyak ditemukan pada sistem pencernaan bekicot
karena di daerah organ inilah selulosa dan senyawa polisakarida lainnya dicerna.
Sewaktu bekicot ditangkap,biasanya perut bekicot dibuang agar tidak ikut
dimasak. Padahal dalam getah lambung dan pankreas terdapat enzim yang dapat
menghidrolisa selulosa menjadi glukosa,sedangka glukosa merupakan sumber
energi.Isolasi enzim selulase bertujuan untuk mendapatkan enzim selulase yang dapat
digunakan untuk mengkonversi selulosa menjadi glukosa dalam industri pangan
(Siregar,1999).
Enzim ini dianggap lebih efektif dan efisien karena isolasi enzim dari bekicot
cukup mudah, murah dan tidak membutuhkan waktu yang lama serta enzim dapat
disimpan dalam waktu 4 bulan dalam suhu -15oC ( Soedigdo,et al). Enzim selulase
yang diproduksi mikroba sebagian besar disimpan dalam hepatopankreas yang
salurannya bermuara ke saluran pencernaan. Sementara itu,cangkang bekicot dapat
dimanfaatkan sebagai hiasan,dan pembuatan kitosan. Dengan demikan bekicot bisa
dijadikan alternatif sumber enzim selulase sehingga diharapkan bekicot dapat
bermanfaat bagi kehidupan.. Masfufatun(2009) telah melakukan penelitian tentang
hidrolisis Carboxy Methyl Cellulose (CMC) dengan enzim selulase dari bekicot untuk
produksi etanol dengan menggunakan Zymomonas mobilis. Dari hasil penelitiannya
didapatkan bahwa enzim selulase bekerja pada kondisi optimum 50o C dan pH 5,2 dan
menghasilkan etanol sebesar 0,457 g/g glukosa atau yield etanol sebesar 89,6%.
Berdasarkan uraian diatas, peneliti tertarik untuk mengisolasi dan menentukan
pengaruh pH dan suhu optimum terhadap aktivitas ekstrak kasar enzim selulase dari
bekicot serta mengetahui apakah terdapat perbedaan aktivitas ekstrak kasar enzim
1.2. Permasalahan
1. Bagaimana cara mengisolasi ekstrak kasar enzim selulase dari bekicot?
2. Bagaimana pengaruh suhu dan pH optimum terhadap aktivitas ekstrak kasar
enzim selulase?
3. Apakah terdapat perbedaan aktivitas ekstrak kasar enzim selulase terhadap
substrat selulosa, kertas HVS dan ampas tebu?
1.2Pembatasan masalah
Dalam penelitian ini permasalahan dibatasi pada:
1. Bekicot (Achatina fulica) yang digunakan diperoleh dari daerah kelurahan
Pahlawan,Kebun Lada, Binjai yang diisolasi dari hasil pengendapan dengan
aseton 50%.
2. Substrat yang digunakan adalah selulosa 1%,kertas 1% dan ampas tebu 1%
3. Pengujian aktivitas dilakukan secara Spektrofotometri dengan metode Nelson
Somogyi
4. Buffer yang digunakan adalah buffr asetat 0,2 M dengan variasi pH 3,5; 4,0;
4,5; 5,0 dan 5,5.
5. Variasi suhu adalah 35oC, 40oC, 45oC, 50oC dan 55oC.
6. Waktu inkubasi yang digunakan adalah 60 menit.
1.3Tujuan Penelitian
1. Menentukan pH dan suhu optimum ekstrak kasar enzim selulase dari bekicot.
2. Membandingkan aktivitas ekstrak kasar enzim selulase terhadap hidrolisa
substrat selulosa, kertas HVS dan ampas tebu.
1.4Manfaat Penelitian
Dari hasil penelitian diharapkan enzim selulase dari bekicot dapat dimanfaatkan pada
pengolahan limbah yang mengandung bahan selulosa seperti limbah pertanian
1.5Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Biokimia FMIPA-USU Medan,
Laboratorium Teknologi Pangan Fakultas PertanianUSU, Laboratorium Kuantitatif
Fakultas Farmasi USU serta Laboratorium Penelitian FMIPA-USU Medan.
1.6Metodologi Penelitian
Penelitian ini adalah eksperimen yang dilakukan di laboratorium. Sampel yang berupa
bekicot (Achatina fulica) diperoleh dari daerah Kelurahan Pahlawan, Kebun Lada,
Binjai. Enzim selulase yang berasal dari saluran pencernaan bekicot diperoleh dengan
cara pengendapan dengan aseton dingin dan sentrifugasi yang digunakan untuk
memisahkan enzim dari pelarut dan proteinnya. Selanjutnya aktivitas enzim dianalisa
dengan metode Nelson – Somogyi menggunakan Spektrofotometer pada λ = 761 nm.
Adapun variabel – variabel dalam penelitian adalah:
1. Variabel bebas adalah variabel yang mempunyai pengaruh terhadap kadar
glukosa yaitu :
• pH yang digunakan yaitu 3,5; 4,0; 4,5; 5,0 dan 5,5
• Suhu yang digunakan yaitu 35oC, 40oC, 45oC, 50oC dan 55oC
2. Variabel terikat adalah variabel yang terukur terhadap perubahan perlakuan.
Dalam penelitian ini yang menjadi variabel terikat, yaitu :
• Aktivitas enzim selulase
3. Variabel tetap adalah variabel yang dibuat tetap sehingga tidak menyebabkan
terjadinya perubahan variabel terikat. Dalam penelitian ini variabel tetap
adalah :
• Konsentrasi enzim
• Konsentrasi substrat
• Jenis substrat
BAB 2
TINJAUAN PUSTAKA
2.1 Bekicot( Achatina Fulica)
Menurut taksonomi hewan, bekicot diklasifikasikan sebagai berikut:
Divisi : Mollusca
Kelas : Gastropoda
Ordo : Pulmonata
Famili : Achatinidae
Genus : Achatinidae
Spesies : Achatina fulica
( http://neilstancwart.wordpress.com)
Bekicot berbeda dengan gastropoda lainnya, pertama dalam hal pernafasan ia
sudah tidak memiliki Ctenidia yaitu semacam insang dan fungsinya telah diganti oleh
bagian pillium yang tipis dan kaya dengan pembuluh darah.
Kedua mengenai sistem Nervosium, ganglia yang utama terkumpul
membentuk bangunan serupa cincin mengelilingi esophagus tanpa jaringan pengikat
didalamnya.Sistem digestorium bekicot terdiri dari rongga mulut dengan alat –
alatnya,esophagus,ingluvies,ventriculus,intestinum,rectum da anus. Pada dasar rongga
mulut terdapat semacam lidah yang disebut radula dan otot – otot yang mengatur
geraknya. Radula terjadi dari satu lapis membran basalis yang mengalami kornifikasi
dan diatasnya melekat deretan – deretan gigi – gigi yang membengkok ke belakang.
Radula ini tiap kali dibentuk baru,oleh sel – sel khusus di dalam kantong
radula,karena yang lama telah rusak dipakai dan dilepaskan. Radula diperkuat dengan
jaringan serupa cartilago,yang juga berguna untuk melekatnya otot.Rongga mulut
dilanjutkan diri kedalam esophagus yang sempit,yang kemudian melebar membentuk
ingluvies. Ingluvies berupa sebuah kantong besar dengan deretan glandulae salivales
dalam sepanjang dindingnya dan saluran- salurannya bermuara di ujung anterior
esophagus. Mereka menghasilkan lendir berair yang berisi enzim – enzim
diastase,yaitu yang menguraikan hidrat arang. Ingluvies juga berisi cairan yang
berasal dari glandulae digestoriae yang mengalir dari tempat keluarnya kedalam
ventriculus. Cairan ini berisi enzim – enzim. Rupa – rupanya termasuk juga
didalamnya ezim cytase yang mencerna selulosa,seperti halnya pada Helix,yaitu
sejenis siput darat yang ada di Eropa.
Penelitian Soedigdo et al, 1962 menunjukkan bahwa cytase itu berasal dari
bakteri hidup di dalam intestinum dan ingluives. Enzim ini menghancurkan dinding
sel tumbuh- tumbuhan sehingga isi sel dapat dilepaskan keluar.Bagian berikutnya
setelah ingluives adalah ventriculus yang berupa kantong yag cukup luas tetapi
sederhana,dilingkupi oleh glandulae digestoriae yang menggerombol di sekeliling
kebanyakan alat – alat dalam. Glandulae digestoriae terdiri dari kumpulan tubuli yang
bercabang – cabang dan berakhir buntu pada gerombolan sel – sel. Dikenal ada tiga
macam sel,yaitu:
1). Sel – sel yang menghasilkan enzim- enzim untuk pencernaan ekstraseluler.
2). Sel – sel yang menyerap partikel- partikel makanan dan mencernakannya
intra-seluler,juga menyerap hasil –hasil pencernaan di luar sel.
3). Sel – sel yang mengasilkan CaCO3 , fungsinya terutama ialah untuk membetuk
berakhir pada rektum yang bermuara keluar melalui anus. Penyerapan hasil – hasil
pencernaan terutama berlangsung di dalam intestinum ( Radiopoetro, 1995).
Bekicot adalah salah satu hewan yang hidupnya bergantung pada enzim
selulolitik untuk mencerna makanannya. Pada tahun 1970,Soedigdo,dkk.melaporkan
bahwa bekicot tidak memiliki enzim selulase,melainkan oleh mikroba selulolitik yang
berasal dari luar tubuhnya.Mengenai jenis mikroba selulolitik maupun non selulolitik
dalam saluran pencernaan bekicot,hingga kini belum pernah diungkap atau diteliti
oleh para peneliti sebelumnya.
Pada sistem pencernaan bekicot, selulosa dan senyawa polisakarida lainnya
dicerna dalam lambung dan intestin, yang berarti bahwa mikroba selulolitik
ditemukan banyak disekitar organ tersebut. Enzim yang diproduksi sebagian disimpan
dalam hepatopankreas yang salurannya bermuara ke sistem pencernaan yang mungkin
sebagai cadangan enzim. Mengingat bahwa bekicot menggunakan selulosa natif
sebagai makanannya,tentu ia telah menyeleksi secara alami mikroba yang efektif
membantu sistem pencernaannya. Saluran pencernaan hewan ini sangat sederhana
yang memungkinkan bagi hidupnya mikroba aerob maupun fakultatif aerob.
Penelusuran mengenai mikroba aerob ini perlu dilakukan agar mudah
memanfaatkannya,mengingat bahwa peristiwa alami umumnya berlangsung secara
aerob (Silaban, 1999).
2.2 Enzim
Kata enzim berasal dari “en-zyme” yang berarti dalam ragi (yeast), mulai dipakai
sejak 1877. Sebelumnya telah dikenal diastase (A.Payen dan J.Persoz,1833), pepsin
(T.Schwan,1836), emulsion (J.V.Liebig dan F.Wohler,1837), masing – masing adalah
senyawa organik yang dapat menghidrolisis pati, protein dan glikosida.
Enzim adalah suatu biokatalisator yang dapat bertindak menguraikan molekul
yang rantainya panjang menjadi lebih sederhana, serta dapat juga membantu
dalam reaksi dan mengalami perubahan fisik selama reaksi, enzim akan kembali
kepada keadaan semula bila reaksi telah selesai.
Enzim mempunyai tenaga katalitik yang luar biasa dan biasanya jauh lebih
besar dari katalisator sintetik. Spesifitas enzim sangat tinggi terhadap substratnya.
Enzim mempercepat reaksi kimia secara spesifik tanpa pembentukan produk samping.
Enzim merupakan unit fungsional untuk metabolisme dalam sel, bekerja menurut
urutan yang teratur. Sistem enzim terkoordinasi dengan baik menghasilkan suatu
hubungan yang harmonis diantara sejumlah aktivitas metabolik yang berbeda.
Kebanyakan enzim diberi nama dengan penambahan akhiran –ase pada kata
yang menunjukkan senyawa asal yang diubah oleh enzim atau pada nama jenis reaksi
kimia yang dikatalisis enzim.
2.2.1. Sifat – Sifat Enzim
1. Spesifitas
Aktivitas enzim sangat spesifik. Pada umumnya enzim tertentu hanya dapat
mengkatalisis satu reaksi. Sebagai contoh, laktase menghidrolisis gula laktosa
tetapi tidak berpengaruh terhadap disakarida yang lain. Hanya molekul laktosa
saja yang akan sesuai dalam sisi aktif molekul.
2. Pengaruh suhu
Aktivitas enzim sangat dipengaruhi oleh suhu. Suhu optimalnya adalah antara
35oC dan 40oC, yaitu suhu tubuh. Pada suhu diatas dan dibawah optimalnya,
aktivitas enzim berkurang.
3. Pengaruh pH
Masing – masing reaksi yang dikatalisis oleh enzim paling cepat terjadi pada pH
yang tertentu. Untuk kebanyakan enzim pH optimal adalah sekitar pH 7 (netral)
dan jika medium menjadi sangat asam atau sangat alkalis enzim mengalami
4. Ko-enzim dan aktivator
Enzim sering kali memerlukan bantuan substansi lain agar berfungsi secara
efektif. Ko-enzim adalah substansi bukan protein yang mengaktifkan enzim
(Gaman and Sherington, 1992).
2.2.2 Dasar Kerja Enzim
Pada umumnya terdapat 2 mekanisme kerja enzim mempengaruhi reaksi katalisis.
Mekanisme tersebut adalah:
1. Enzim meningkatkan kemungkinan molekul – molekul yang bereaksi saling
bertemu dengan permukaan yang saling berorientasi. Hal ini terjadi sebab enzim
mempunyai suatu affinitas yang tinggi terhadap substrat dan mempunyai
kemampuan mengikatnya walaupun bersifat sementara. Penyatuan antara substrat
dengan enzim tidak seenaknya,melainkan substrat terikat dengan enzim
sedemikian rupa,sehingga setiap substrat terorientasi secara tepat untuk terjadi
reaksi.
2. Pembentukan ikatan yang sementara antara substrat dengan enzim menimbulkan
penyebaran elektron dalam molekul substrat dan penyebaran ini menyebabkan
suatu regangan pada ikatan kovalen spesifik dalam molekul substrat,sehingga
ikatan kovalen tersebut menjadi mudah terpecah. Para ahli biokimia menamakan
keadaan dimana terjadi regangan ikatan molekul substrat setelah berinteraksi
dengan enzim,disebut pengaktifan substrat (Shahib, 1992).
2.2.3 Faktor- Faktor Yang Mempengaruhi Kerja Enzim
1. Konsentrasi Substrat
Hasil eksperimen menunjukkan bahwa dengan konsentrasi enzim yang tetap,maka
pertambahan konsentrasi substrat akan menaikkan kecepatan reaksi. Akan tetapi
pada batas konsentrasi tertentu, tidak akan terjadi kenaikan kecepatan reaksi
walaupun konsentrasi substrat diperbesar. Keadaan ini telah dijelaskan oleh
Michealis – Menten dengan hipotesis mereka tentang terjadinya kompleks enzim
substrat. Untuk dapat terjadi kompleks enzim substrat sebagaimana telah
terjadi pada suatu tempat atau bagian enzim yang disebut bagian aktif. Pada
konsentrasi substrat rendah,bagian aktif enzim ini hanya menampung substrat
sedikit. Bila konsentrasi substrat diperbesar,makin banyak substrat yang
berhubungan dengan enzim pada bagian aktif tersebut. Dengan demikian
konsentrasi kompleks enzim substrar makin besar dan hal ini menyebabkan makin
besarnya kecepatan reaksi. Pada suatu batas konsentrasi substrat tertentu,semua
bagian aktif telah dipenuhi oleh substrat atau telah jenuh dengan substrat. Dalam
hal ini, bertambahnya konsentrasi substrat tidak menyebabkan bertambah besarnya
konsentrasi kompleks enzim substrat, sehingga jumlah hasil reaksi pun tidak
bertambah besar.
2. Suhu
Oleh karena reaksi kimia itu dapat dipengaruhi oleh suhu, maka reaksi yang
menggunakan katalis enzim yang dapat dipengaruhi oleh suhu. Pada suhu rendah
reaksi kimia berlangsung lambat, sedangkan pada suhu yang tinggi reaksi
berlangsung cepat.
Disamping itu, karena enzim adalah suatu protein, maka kenaikan suhu dapat
menyebabkan terjadinya proses denaturasi. Apabila terjadi proses denaturasi,
maka bagian aktif enzim akan terganggu dan dengan demikian konsentrasi efektif
enzim menjadi berkurang dan kecepatan reaksinya pun akan menurun.
3. Pengaruh pH
Seperti protein pada umumnya, struktur ion enzim tergantung pada pH
lingkungannya. Enzim dapat berbentuk ion positif, ion negatif atau ion bermuatan
ganda (zwitter ion). Dengan demikian perubahan pH lingkungan akan berpengaruh
terhadap efektivitas bagian aktif enzim dalam membentuk kompleks enzim
substrat.
Di samping pengaruh terhadap struktur ion pada enzim, pH rendah atau pH tinggi
dapat pula menyebabkan terjadinya proses denaturasi dan ini akan mengakibatkan
menurunnya aktivitas enzim.
Oleh karena hambatan atau inhibisi pada suatu reaksi yang menggunakan enzim
sebagai katalis dapat terjadi apabila penggabungan substrat pada bagian aktif
enzim mengalami hambatan. Molekul atau ion yang dapat menghambat reaksi
tersebut dinamakan inhibitor. Hambatan yang dilakukan inhibitor dapat berupa
hambatan tidak reversibel atau hambatan reversibel. Hambatan tidak reversibel
pada umumnya disebabkan oleh terjadinya proses modifikasi sebuah gugus fungsi
atau lebih yang terdapat pada molekul enzim. Hambatan reversibel dapat berupa
hambatan bersaing atau hambatan tidak bersaing (Poedjiadi, 1995).
2.2.4 Klasifikasi Enzim
Pada tahun 1956, The International Union of Biochemistry membentuk suatu panitia
untuk menyusun konsep dan mengusulkan klasifikasi dan nomenklatur enzim. Baru
tahun 1961 usul tersebut diterima secara resmi.
Prinsip penamaan tersebut ternyata berdasarkan tipe reaksi yang dikatalisis dan enzim
yang dibagi menjadi enam kelompok utama, yaitu :
1. Oksidoreduktase
Enzim oksidoreduktase adalah enzim yang dapat mengkatalisis reaksi oksidasi atau
reduksi suatu bahan. Dalam golongan ini terdapat 2 jenis enzim yang paling utama
yaitu oksidase dan dehidrogenase.
Oksidase adalah enzim yang mengkatalisis reaksi antara substrat dengan
molekul oksigen. Yang termasuk enzim oksidase adalah katalase, peroksidase,
tirosinase, dan asam askorbat oksidase.
Dehidrogenase adalah enzim yang aktif dalam pengambilan atom hidrogen
dari substrat. Contohnya yaitu suksinat dehidrogenase, glutamat dehidrogenase, dan
2. Transferase
Enzim transferase adalah enzim yang ikut serta dalam reaksi pemindahan (transfer)
suatu radikal atau gugus. Enzim yang termasuk dalam golongan ini adalah
transglikosidase, transfosforilase, transaminase, dan transasetilase.
3. Hidrolase
Enzim hidrolase merupakan enzim yang sangat penting dalam pengolahan pangan,
yaitu enzim yang mengkatalisis reaksi hidrolisis suatu substrat atau pemecahan
substrat dengan pertolongan molekul air. Enzim yang termasuk kedalam golongan ini
adalah lipase yang menghidrolisis ikatan ester pada lemak alami menjadi gliserol dan
asam lemak, glikosidase menghidrolisis ikatan glikosida dan sebagainya. Disamping
itu masih banyak lagi yang termasuk enzim hidrolase, diantaranya karboksil esterase, pektin metal esterase, selulase, β-amilase, α-amilase dan invertase.
4. Liase
Enzim liase adalah enzim yang aktif dalam pemecahan ikatan C-C dan ikatan C-O
dengan tidak menggunakan melekul air. Yang termasuk dalam golongan enzim ini
adalah enzim dekarboksilase.
5. Isomerase
Enzim isomerase adalah enzim yang mengkatalisis reaksi perubahan konfigurasi
molekul substrat, sehingga dihasilkan molekul baru yang merupakan isomer dari
substrat, atau dengan perubahan isomer posisi. Yang termasuk dalam golongan ini
6. Ligase
Enzim ligase adalah enzim yang mengakatlisis pembentukan ikatan - ikatan tertentu,
misalnya pembentukan ikatan C-O, C-C, dan C-S dalam biosintesis ko-enzim A serta
pembentukan ikatan C-N dalam sintesis glutamin (Winarno, 1983).
2.3 Enzim Selulase
Selulosa merupakan polimer glukosa dengan ikatan β– 1,4.Selulosa kapas mempunyai
derajat polimerisasi tinggi yaitu 10.000,sedang yang dari kayu derajat polimerisasi
rendah yaitu 600-1.000. Karena adanya konfigurasi β , molekul mudah membentuk
ikatan hidrogen dan membentuk serabut kristal fibriler yang rendah daya larutnya
dalam air. Molekul kapas terdiri dari 98% selulosa,sedang kayu biasa 40-50% selulosa
dan sisanya terdiri dari xilan dan glukomanan.
Selulase merupakan nama umum atau trivial bagi enzim,sedang nama
sistematiknya adalah β-1,4 glukan-4-glkanohidrolase (E.C 3.2.1.4). Istilah selulase
mula- mula digunakan khusus untuk enzim yang dapat memecah selulosa kapas saja.
Kini digunakan dalam arti yang lebih luas yaitu asal dapat memecahkan ikatan
glukosidik β-1,4.
Pada hewan,terutama dalam lambung hewan memamah biak banyak terdapat
mikroba anaerobik yang menghasilkan enzim selulase yang mampu mencerna selulosa
dari rumput dan bahan makanan lain.
Ada tiga jenis selulase yang dikenal:
a. Faktor C1,yaitu suatu faktor yang masih belum jelas peranannya,diperlukan untuk
menghancurkan selulosa dalam bentuk kristal denga tingkat polimerisasi yang tinggi.
b. β–Glukanase yang teragi dalam dua jenis yaitu:
1. Ekso-β-1,4-glukanase,menyerupai glukoamilase
2. Endo-β-1,4-glukanase menghidrolisis molekul selulosa secara acak. Endo-β
c. β-Glukosidase : affinitasnya tinggi terhadap molekul kecil.
C1 Cx β-glukosidase
Selulosa selulosa reaktif selubiosa glukosa
Mikroorganisme yang digunakan untuk mendapat selulase adalah
Myrothecium verrucaria,Penicillium pusillum,dan Trichoderma viridae. Penggunaan
Enzim selulase dalam industri pangan masih sangat terbatas ( Winarno, 1983 ).
Mikrofibil selulosa dibusukkan oleh sistem enzim selulase ,tersusun atas
endoglukanase,eksoglukanase dan β - glukosidase( dikenal juga sebagai selubiose).
Enzim selulase mempunyai aturan yang berbeda dalam pembelahan berbagai ikatan
dengan susunan mikrofibil. Ini menyebabkan gangguan pada struktur kristal yang
diikuti oleh depolimerisasi menjadi rantai glukosa pendek. Endoglukanase bekerja
secara acak pada kedua baik rantai glukosa yang dapat larut dalam air dan yang tidak
dapat larut oleh pemotongan ikatan β(1,4) menghasilkan glukosa dan
selooligosakarida.
Sejumlah besar organisme dapat menghasilkan selulosa,tetapi hanya beberapa
yang memiliki depolimerisasi dan hidrolisis yang lengkap dari susunan mikrofibil
kristalin secara in vitro. Sistem selulosa dari tingkat genus jamur Trichoderma telah
secara ekstensif dipelajari dan menunjukkan sejumlah produksi endo- β- glukanase
dan ekso- β- glukanase tetapi jumlah yang rendah dalam β- glukosidase. Berlawanan
dengan Aspergillus yang menghasilkan sejumlah besar endo- β- glukanase dan β-
glukosidase tetapi sedikit pada ekso- β- glukanase. Chaetoium, sejenis jamur
ascomycetes, ditemukan pada banyak varietas bahwa selulosa pada kertas menjadi
kompos khususnya pada lingkungan basa. Ia dapat menghasilkan selulase yang panas
yang boleh dijual terus untuk mengubah selulosa menjadi gula sederhana dari sumber
daya alam yang tersedia. Jamur lain secara luas telah dipleajari sistem selulasenya
termasuk Cremonium celluloyticus, Penicillium, Fusarium dan jamur Agaricus yang
Bakteri mempunyai sistem selulase yang sedikit lebih luas dibandingkan
jamur. Bakteri selulase disusun dalam suatu protein globular yang bertangga yang
disebut selusom,disekitar dinding. Struktur ini berkoordinasi untuk menyerang
kristalin mikrofibil, meningkatkan aktivitas atau efisiensi individual enzim. Gabungan
bakteri tanah aerob yang berdepolimerisasi termasuk Acetobacter, Bacteriodes,
Clostridium, Fibrobacter, dan Rummococcus (Paul, 2010)
2.4. Selulosa
Selulosa terdapat dalam tumbuhan sebagai bahan pembentuk dinding sel. Serat kapas
boleh dikatakan seluruhnya adalah selulosa. Dalam tubuh kita selulosa tidak dapat
dicernakan karena kita tidak mempunyai enzim yang dapat menguraikan selulosa.
Dengan asam encer tidak dapat terhidrolisis, tetapi oleh asam dengan konsentrasi
tinggi dapat terhidrolisis menjadi selobiosa dan D-glukosa. Selobiosa adalah suatu
disakarida yang terdiri atas dua molekul glukosa yang berikatan glikosidik antara
atom karbon 1 dengan atom karbon 4.
Meskipun selulosa tidak dapat digunakan sebagai bahan makanan oleh tubuh,
namun selulosa yang terdapat sebagai serat – serat tumbuhan, sayuran atau buah –
buahan, berguna untuk memperlancar pencernaan makanan. Tentu saja jumlah serat
yang terdapat dalam bahan makanan tidak boleh terlalu banyak (Poedjiadi, 1994).
Selulosa umumya terdiri dari sekitar 300.000 satuan monomer dan mempunyai
berat molekul berkisar 250.000 sampai lebih dari 1.000.000 g/mol dengan rumus
molekul (C5H10O5)n . Di dalam molekul selulosa,monomer- monomernya tersusun
secara linear, sedangkan diantara pita – pita satuan polimernya tersusun secara paralel.
Oleh karena itu, diantara pita – pita polimer tersebut terdapat banyak jembatan
hidrogen intermolekuler dan intramolekuler yang menyebabkan selulosa mempunyai
struktur yang masif / kompak dan merupakan struktur dasar sel tumbuh – tumbuhan
(Riswiyanto,2009)
Susunan linear dari ikatan β-glukosa dalam selulosa menghadirkan distribusi
rantai selulosa berhubungan, kelompok hidroksil secara ideal menjadi tertutup rantai
secara bersama – sama. Pada cara ini diberikan kelarutan yang besar,kekakuan dan
polimer berserabut yang secara ideal digunakan sebagai bahan dinding sel ntuk
tumbuhan. Sifat khusus ini dari rantai selulosa,bukan hanya dari ikatan β 1,4
glikosidik,ini juga merupakan konsekuensi dari stereokimia yang tepat dari D-
glukosa pada setiap pusat stereo. Dimana D- galaktosa dan D- alosa berikatan pada
model yang sama, mereka dengan tepat tidak memberikan tempat untuk pembuatan
polimer dengan sifat seperti selulosa. Maka kita mendapat pandangan lain mengapa
D- glukosa mendapat posisi yang khusus dalam kimia tumbuha dan hewan
(Solomons,1976)
Suatu molekul tunggal selulosa merupakan polimer lurus dari 1,4’-β
-glukosa. Hidrolisis lengkap dalam HCl 40 % dalam-air, hanya menghasilkan
D-glukosa. Disakarida yang terisolasi dari selulosa yang terhidrolisis sebagian adalah
selobiosa, yang dapat dihidrolisis lebih lanjut menjadi D-glukosa dengan suatu katalis
asam atau dengan emulsin enzime (Fessenden danFessenden, 1986).
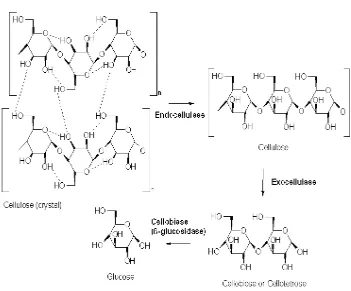
Gambar 2.2 Struktur dari selulosa
Selulosa merupakan homopolisakarida linier tidak bercabang, terdiri dari
10.000 atau lebih unit D-glukosa yang dihubungkan oleh ikatan β-1,4-glikosidik
(Lehninger, 1988).
Selulosa lebih sukar diuraikan dan mempunyai sifat-sifat sebagai berikut :
memberi bentuk atau struktur pada tanaman, tidak larut dalam air dingin maupun air
panas, tidak dapat dicerna oleh pencernaan manusia sehingga tidak dapat
menghasilkan energi (Winarno,1995).
Walaupun selulosa sifatnya keras dan kaku, namun selulosa dapat dirombak
memecah selulosa menjadi polisakarida yang lebih kecil yang disebut dengan
sellodekstrin atau sepenuhnya menjadi unit unit glukosa,hal ini merupakan reaksi
hidrólisis. Karena molekul selulosa terikat kuat antar satu molekul dengan molekul
lainnya,selulolisis relatif lebih sulit bila dibandingkan dengan pemecahan polisakarida
lainnya. Proses selulolisis terjadi pada sistem pencernaan sebagian hewan memamah
biak ruminansia untuk mencerna makanan mereka yang mengandung selulosa. Proses
selulolisis dibantu oleh enzim selulase.
Enzim yang digunakan untuk membelah hubungan glikosidik di glikosida
hidrólisis selulosa termasuk enzim endo-selulase dan ekso glukosidase. Enzim
tersebut biasanya dikeluarkan sebagai bagian dari kompleks multienzim yang
mungkin termasuk selulosa. Untuk proses selulolisis akan dijelaskan pada gambar
dibawah ini.
Gambar 2.3 Mekanisme Pemecahan selulosa menjadi glukosa
Ketiga jenis reaksi yang dikatalisis oleh enzim selulase: 1. Kerusakan dari
interaksi non kovalen hadir dalam struktur kristal selulosa (endo – selulase). 2.
kecil(ekso-selulase). 3. Hidrólisis disakarida dan tetrasakarida menjadi glukosa (beta-
glukosidase).
2.5 Kertas
Adanya kertas merupakan
menyumbangkan arti besar dalam peradaban dunia. Sebelum ditemukan kertas,
bangsa-bangsa dahulu menggunakan tablet dari tanah lempung yang dibakar. Hal ini
bisa dijumpai dari peradaban bangsa Sumeria, Prasasti dari
atau tulang binatang,
naskah naska beberapa abad lampau (http://ms.wikipedia.
Org/wiki/Kertas)
Dua hal yang paling penting dari material pembuatan selulosa kertas adalah
berapa banyak dan berapa panjang serat selulosanya. Banyaknya serat selulosa dalam
kayu tertentu menghasilkan pulp,pengurangan proses dan ongkos produksi pulp. Pada
tabel berikut menunjukkan komposisi kimia dari proses pembuatan pulp kertas.
Tabel 2.1 Komposisi Kimia dari Pulp Kertas
Proses Pembuatan
Pulp
Komponen Kayu
Hasil
Pulp Yang dihilangkan
Proses pemasakan dengan bahan kimia dan pemutihan
Hanya selulosa Lignin,dan
hemiselulosa Kurang dari 40 %
Proses pulp dengan bahan kimia dan pemutihan
Selulosa dan sebagian hemiselulosa
Lignin dan sebagian hemiselulosa
45 – 55%
Proses pulp dengan bahan kimia NO
Selulosa, sebagian hemiselulosa dan sisa lignin
Sebagian lignin dan
selulosa 45 – 55%
Semi- bahan kimia
Selulosa, kebanyakan hemiselulosa dan lignin
Sebagian lignin dan
hemiselulosa 50 – 65%
Proses Pembuatan kertas (pulp)
1. Kayu diambil dari hutan produksi kemudian dipotong – potong atau lebih dikenal
dengan log.Log disimpan ditempat penampungan beberapa bulan sebelum diolah
dengan tujuan untuk melunakkan log dan menjaga kesinambungan bahan baku.
2. Kayu dibuang kulitnya dengan mesin atau dikenal dengan istilah De- Barker
3. Kayu dipotong – potong menjadi ukuran kecil (chip) dengan mesin chipping.
Chip yang sesuai ukuran diambil dan yang tidak sesuai diproses ulang.
4. Chip dimasak didalam digester untuk memisahkan serat kayu(bahan yang
digunakan untuk membuat kertas)dengan lignin. Proses pemasakan ini ada dua
macam yaitu Cheical Pulping Process dan Mechanical Pulping Process. Hasil dari
digester ini disebut pulp (bubur kertas). Pulp ini yang diolah menjadi kertas
Proses Pembuatan Kertas (Paper machine)
Sebelum masuk ke areal paper mesin pulp diolah dulu pada bagian stock
preparation. bagian ini berfungsi untuk meramu bahan baku seperti: menambahkan
pewarna untuk kertas (dye), menambahkan zat retensi, menambahkan filler (untuk
mengisi pori - pori diantara serat kayu). Bahan yang keluar dari bagian ini disebut
stock (campuran pulp, bahan kimia dan air)
Dari stock preparation sebelum masuk ke headbox dibersihkan dulu dengan
alat yang disebut cleaner. Dari cleaner stock masuk ke headbox. headbox berfungsi
untuk membentuk lembaran kertas (membentuk formasi) diatas fourdinier table.
Fourdinier berfungsi untuk membuang air yang berada dalam stock
(dewatering). Hasil yang keluar disebut dengan web (kertas basah). Kadar padatnya
sekitar 20 %.
Press part berfungsi untuk membuang air dari web sehingga kadar padatnya
mencapai 50 %. Hasilnya masuk ke bagaian pengering (dryer). Cara kerja press part
ini adalah kertas masuk diantara dua roll yang berputar. Satu roll bagian atas di beri
tekanan sehingga air keluar dari web. Bagian ini dapat menghemat energi, karena
Dryer berfungsi untuk mengeringkan web sehingga kadar airnya mencapai 6%.
Hasilnya digulung di pop reel sehingga berbentuk gulungan kertas yang besar (paper
roll).Paper roll ini yang dipotong – potong sesuai ukuran dan dikirim ke konsmen.
(http://blogspot.com/poses-pembuatan-kertas.html).
2.6 Ampas Tebu
Tebu (Saccharum officinarum) adalah tanaman yang ditanam untuk bahan baku gula.
Tanaman ini hanya dapat tumbuh di daerah beriklim tropis. Tanaman ini termasuk
jenis rumput-rumputan. Umur tanaman sejak ditanam sampai bisa dipanen mencapai
kurang lebih 1 tahun. Di Indonesia tebu banyak dibudidayakan di pulau Jawa dan
Sumatra (Anonim, 2007).
Ampas tebu atau lazimnya disebut bagas, adalah hasil samping dari proses
ekstraksi (pemerahan) cairan tebu. Dari satu pabrik dihasilkan ampas tebu sekitar 35 –
40% dari berat tebu yang digiling . Berdasarkan data dari Pusat Penelitian Perkebunan
Gula Indonesia (P3GI) ampas tebu yang dihasilkan sebanyak 32% dari berat tebu
giling. Pada musim giling 2006 lalu, data yang diperoleh dari Ikatan Ahli Gula
Indonesia (Ikagi) menunjukkan bahwa jumlah tebu yang digiling oleh 57 pabrik gula
di Indonesia mencapai sekitar 30 juta ton (Anonim, 2007b), sehingga ampas tebu yang
dihasilkan diperkirakan mencapai 9.640.000 ton. Namun, sebanyak 60% dari ampas
tebu tersebut dimanfaatkan oleh pabrik gula sebagai bahan bakar, bahan baku untuk
kertas, bahan baku industri kanvas rem, industri jamur dan lain-lain. Oleh karena itu
diperkirakan sebanyak 45 % dari ampas tebu tersebut belum dimanfaatkan.
Ampas tebu sebagian besar mengandung lignoselulosa. Panjang seratnya
antara 1,7 sampai 2 mm dengan diameter sekitar 20 mikro, sehingga ampas tebu ini
dapat memenuhi persyaratan untuk diolah menjadi papan-papan buatan. Bagase
mengandung air 48 - 52%, gula rata-rata 3,3% dan serat rata-rata 47,7%. Serat bagase
tidak dapat larut dalam air dan sebagian besar terdiri dari selulosa, pentosan dan
Tabel 2.2. Komposisi kimia ampas tebu
Kandungan Kadar (%)
Abu 3,82
Lignin 22,09
Selulosa 37,65
Sari 1,81
Pentosan 27,97
SiO2 3,01
(http://blogspot.com/ampas-tebu.html)
2.7. Metode Analisa Kuantitatif Glukosa
2.7.1. Metode Nelson – Somogyi
Metode ini dapat digunakan untuk mengukur kadar gula reduksi dengan menggunakan
pereaksi tembaga arsenomolibdat. Kupri mula-mula direduksi menjadi bentuk kupro
dengan pemanasan larutan gula. Kupro yang terbentuk selanjutnya dilarutkan dengan
arsenomolibdat menjadi molibdenum berwarna biru yang menunjukkan ukuran
konsentrasi gula dengan membandingkannya dengan larutan standar, konsentrasi gula
dalam sampel dapat ditentukan. Reaksi warna yang terbentuk dapat menentukan
konsentrasi gula dalam sampel dengan mengukur absorbansinya (Sudarmadji, 1989).
2.7.2.Metode Lane-Eynon
Penetapan gula pereduksi dengan metode ini dilakukan secara volumetrik. Biasanya
digunakan untuk penentuan laktosa (anhidrat atau monohidrat) glukosa, fruktosa,
maltosa (anhidrat atau monohidrat) dan lainnya. Penetapan gula pereduksi dengan
metode ini didasarkan atas pengukuran volume larutan gula pereduksi standar yang
dibutuhkan untuk mereduksi pereaksi tembaga basa yang diketahui volumenya. Titik
akhir titrasi ditunjukkan dengan metilen biru yang warnanya akan hilang karena
2.7.3. Metode Shaffer-Somogyi
Metode ini dapat diterapkan untuk segala jenis bahan pangan. Terutama berguna
untuk menetapkan sampel yang mengandung sedikit gula pereduksi. Gula pereduksi
akan mereduksi Cu2+ menjadi Cu+. Cu+ akan dioksidasi oleh I2 (yang terbentuk dari
hasil oksidasi KI oleh KIO3 dalam asam) menjadi Cu2+ kembali. Kelebihan I2 dititrasi
dengan Na2S2O3. Dengan menggunakan blanko, maka kadar gula pereduksi dalam
sampel dapat ditentukan.
2.7.4. Metode Anthrone
Metode ini dapat digunakan untuk semua jenis bahan makanan. Anthrone
(9,10-dihidro-9-oxanthrasena) merupakan hasil reduksi anthraquinone. Anthrone bereaksi
secara spesifik dengan karbohidrat dalam asam sulfat pekat menghasilkan warna biru
kehijauan yang khas.
2.7.5. Metode Munson Walker
Penentuan gula reduksi berdasarkan atas banyaknya endapan Cu2O yang terbentuk,
kemudian dengan melihat tabel Hadmond dapat diketahui jumlah gula pereduksinya.
Jumlah Cu2O ditentukan secara gravimetris, yaitu dengan menimbang larutan endapan
Cu2O yang terbentuk. Dapat juga ditentukan secara volumetrik yaitu dengan titrasi
menggunakan larutan Na-tiosulfat atau K-permanganat (Apriyanto, 1989).
2.8. Spektrofotometer UV-Visibel
Spektrometri adalah pengukuran absorbansi selektif radiasi elektromagnetik yang
dipakai untuk analisis kualitatif dan kuantitatif senyawa kimia. Sedangkan
spektrofotometri merupakan suatu metode yang sangat penting dalam analisis kimia
kualitatif dan kuantitatif. Banyak kelebihan yang dimilikinya, antara lain :
a. Dapat digunakan secara luas dalam pengukuran secara kualitatif dan
b. Kepekaan tinggi, karena dapat mengukur dalam satuan ppm (part per million),
bahkan ppb (part per billion) sehingga dapat mengukur komponen trace (renik)
c. Sangat selektif bila suatu komponen x akan diperiksa dalam suatu campuran,
dengan cara mengatur panjang gelombang cahaya dimana hanya komponen x
yang akan mengabsorbsi cahaya tersebut. Lebih teliti karena hanya
mempunyai persen kesalahan 1 - 3 % bahkan dengan teknik tertentu dapat
mengurangi persen kesalahan sampai 1/10 (Underwood, 1999).
Spektrofotometri UV-Vis adalah pengukuran panjang gelombang dan intensitas sinar
ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel. Sinar ultraviolet dan
cahaya tampak memiliki energi yang cukup untuk mempromosikan elektron pada kulit
terluar ke tingkat energi yang lebih tinggi. Spektroskopi UV-Vis biasanya digunakan
untuk molekul dan ion anorganik atau kompleks di dalam larutan. Spektrum UV-Vis
mempunyai bentuk yang lebar dan hanya sedikit informasi tentang struktur yang bisa
didapatkan dari spektrum ini. Tetapi spektrum ini sangat berguna untuk pengukuran
secara kuantitatif.
Sinar ultraviolet berada pada panjang gelombang 200-400 nm sedangkan sinar
tampak berada pada panjang gelombang 400-800 nm.
Ada dua jenis instrumentasi spektrofotometri UV-Vis, yaitu :
1. Spektrofotometri UV-Vis yang memiliki sumber cahaya tunggal (single
beam), dimana sinyal pelarut dihilangkan terlebih dahulu dengan mengukur
pelarut, setelah itu larutan sampel diukur.
2. Spektrofotometri UV-Vis yang memiliki sumber cahaya ganda (double beam),
dimana larutan sampel dimasukkan secara bersama-sama dengan pelarut yang
tidak mengandung sampel. Alat ini lebih praktis dan mudah serta memberikan
hasil yang optimal (Dachriyanus, 2004).
2.8.1.Aspek Kualitatif dan Kuantitatif Spektofotometri UV-Vis
Spektra UV-Vis dapat digunakan untuk informasi kualitatif dan sekaligus dapat
1. Aspek kualitatif
Data yang diperoleh dari spektroskopi UV dan Vis adalah panjang gelombang
maksimal, intensitas, efek pH, dan pelarut ; yang kesemuanya itu dapat
diperbandingkan dengan data yang sudah dipublikasikan.Misal : dari data
spektra yang diperoleh dapat dilihat, serapan (absorbansi) berubah atau tidak
karena perubahan pH. Jika berubah, bagaimana perubahannya apakah dari
batokromik ke hipsokromik dan sebaliknya atau dari hipokromik
kehiperkromik, dan sebagainya.
2. Aspek Kuantitatif
Dalam aspek kuantitatif, suatu berkas radiasi dikenakan pada cuplikan (larutan
sampel) dan intensitas sinar radiasi yang diteruskan diukur besarnya. Radiasi
yang diserap oleh cuplikan ditentukan dengan membandingkan intensitas sinar
yang diteruskan dengan intensitas sinar yang diserap jika tidak ada spesies
penyerap lainnya. Intensitas atau kekuatan radiasi cahaya sebanding dengan
jumlah foton yang melalui satu satuan luas penampang perdetik. Serapan dapat
terjadi jika foton/radiasi yang mengenai cuplikan memiliki energi yang sama
denagan energi yang dibutuhkan untuk menyebabkan terjadinya perubahan
tenaga. Kekuatan radiasi juga mengalami penurunan denagan adanya
penghamburan dan pemantulan cahaya, akan tetapi penurunan karena hal ini
BAB 3
METODOLOGI PENELITIAN
3.1. Alat dan Bahan
3.1.1 Alat - Alat
1. Gelas Ukur Pyrex
2. Spektrofotometer Genesys 20
3. Gelas Beaker Pyrex
4. Tabung reaksi Pyrex
5. Rak tabung reaksi
6. Labu Takar Pyrex
7. Neraca Analitis Mettler Toledo
8. Sentrifugasi 7000 rpm Gemmy Corp KCE
9. Blender National
10.Inkubator Gallenkamp
11.Pipet Tetes
12.Kapas
13.Botol Akuades
14.pH meter Walklab
15.Penangas air
16.Pipet Serologi Pyrex
17.Pipet Volumetri Pyrex
18.Spatula
19.Aluminium foil
20.Termometer Fisher
3.1.2 Bahan - Bahan
1. Bekicot
2. Aseton p.a.(E.Merck)
3. Selulosa p.a(E.Merck)
4. Ampas tebu
5. Kertas
6. CuSO4.5H2O p.a(E.Merck)
7. KNaC4H4O6.4H2O p.a(E.Merck)
8. NaHCO3 p.a(E.Merck)
9. Na2SO4 p.a(E.Merck)
10.Na2CO3 p.a(E.Merck)
11.H2SO4(p) p.a(E.Merck)
12.(NH4)6Mo7O24.4H2O p.a(E.Merck)
13.Na2HA SO4.7H2O p.a(E.Merck)
14.NaOH p.a(E.Merck)
15.NaCl p.a(E.Merck)
16.CH3COOH p.a(E.Merck)
17.C6H12O6 p.a(E.Merck)
18.Natrium Asetat p.a(E.Merck)
19.Akuades
3.2 Prosedur Penelitian
3.2.1 Pembuatan Larutan Pereaksi
3.2.1.1 Pembuatan Larutan Buffer Asetat 0,2 M
Dipipet sebanyak 11,55 ml asam asetat p.a lalu diencerkan dalam labu takar 100 ml
sehingga konsentrasi larutan asam asetat 0,2 M. Kemudian ditimbang natrium asetat
sebanyak 16,4 gram C2H3O2Na.3H2O dilarutkan dalam labu takar 100 ml sehingga
konentrasi larutan garam natrium asetat 0,2 M. Kemudian untuk membuat larutan
asetat dicampurkan dengan larutan 0,2 M larutan garam natrium asetat sebanyak y ml.
Lihat tabel di bawah ini:
Tabel 3.1. Pembuatan Larutan Buffer Asetat 0,2 M
pH 0,2 M Asam Asetat 0,2 M Natium Asetat
3,5 46,3 ml 3,7 ml
4,0 41,0 ml 9,0 ml
4,5 25,5 ml 24,5 ml
5,5 14,8 ml 35,2 ml
5,5 4,8 ml 45,2 ml
3.2.1.2.Pembuatan Larutan NaOH 0,1 N
Dilarutkan 0,4 g NaOH dengan akuades kemudian dimasukkan kedalam labu takar
100 ml dan diencerkan sampai garis tanda.
3.2.1. 3 Pembuatan Larutan NaCl 1%
Dimasukkan 1 g NaCl dalam labu takar 100 ml kemudian diencerkan dengan akuades
sampai garis tanda.
3.2.1.4 Pembuatan Larutan Glukosa 0,2mg/ml
Sebanyak 20 mg glukosa anhidrat dilarutkan dengan akuades dalam labu takar 100 ml
sampai garis tanda dan dikocok sampai homogen.
3.2.1.5 Pembuatan Larutan pereaksi Nelson
Nelson A :
Dilarutkan12,5 g Natrium karbonat anhidrat, 12,5 g garam Rochelle (K-Na-Tartrat),
10 g Natrium Bikarbonat dan 100 g Natrium Sulfat anhidrat dalam 300 ml akuades
Nelson B :
Dilarutkan 7,5 g CuSO4.5H2O dalam 50 ml akuades dan ditambahkan 1 tetes asam
sulfat pekat.
Pereaksi Nelson dibuat dengan cara mencampur 25 bagian larutan Nelson A dan I
bagian Nelson B. Pencampuran dilakukan setiap kali akan digunakan.
3.2.1.6 Pembuatan Larutan Arsenomolibdat
Dilarutkan 25 g ammonium molibdat dalam 450 ml aquades dan ditambahkan 25 ml
H2SO4(p) .Dilarutkan pada tempat yang lain 3 g Na2HAsO4.7H2O dalam 25 ml
akuades kemudian dituangkan larutan ini kedalam larutan yang pertama.Disimpan
dalam botol, berwarna coklat dan diinkubasi pada suhu 37oC selama 24 jam. Larutan
pereaksi ini dapat digunakan setelah masa inkubasi dan berwarna kuning.
3.2.2 Penyediaan Ekstrak Kasar Enzim Selulase
Ditimbang 250 g saluran pencenaan bekicot,ditambahkan 500 ml larutan NaCl 1%
(dingin) dan diblender selama ± 30 detik kemudian di sentrifugasi pada 7000 rpm
selama 30 menit. Supernatan yang terbentuk sebanyak 400 ml kemudian ditambahkan
aseton dingin sebanyak 200 ml hingga terjadi suatu suspensi. Kemudian suspensi ini
disentrifugasi pada 7000 rpm selama 30 menit. Pellet yang diperoleh di keringkan
dalam freeze drier pada suhu -40oC sampai pellet dalam keadaan kering. Kemudian
ekstrak serbuk yang didapat diambil sebanyak 0,5 gram dan dilarutkan dalam 50 ml
buffer asetat 0,1 M pH 4,5. Kemudian ekstrak kasar enzim selulase disimpan di lemari
es dan siap untuk di analisis.
3.2.3 Pengukuran Panjang Gelombang Maksimum Larutan Standar Glukosa
Ditimbang 20 mg glukosa dan dilarutkan dengan akuades sampai volume 100 mL
(Larutan glukosa 0,2 mg/mL). Dipipet 25 ml larutan lalu diencerkan dengan akuades
sampai volume 100 mL (larutan glukosa 0,05 mg/mL).Dipipet 1 mL larutan glukosa
0,05 mg/mL kedalam tabung reaksi, lalu ditambahkan 1 mL pereaksi Nelson lalu
menit lalu didinginkan. Lalu ditambahkan 0,5 mL Larutan arsenomolibdat lalu
dikocok hingga semua endapan larut. Ditambahkan 7 mL akuades dikocok hinga
homogen. Diukur serapan panjang gelombang pada 400 – 800 nm. (diperoleh panjang
gelombang maksimum).
3.2.4 Penyiapan Kurva Standar Glukosa
Disiapkan larutan glukosa standar dalam beberapa tabung reaksi dengan konsentrasi
bertingkat dari 0,01 – 0,05 mg/mL. Ditambahkan 1 mL Larutan Nelson kemudian
dipanaskan hingga mendidih selama 30 menit dan didinginkan.Ditambahkan 0,5 mL
Larutan arsenomolibdat lalu dikocok. Kemudian ditambahkan 7 mL akuades lalu
dikocok hingga homogen. Diukur serapannya pada panjang gelombang 761 nm.
Dibuat kurva standar yang menunjukkan hubungan antara konsentrasi gula standar
dan absorbansi.
3.2.5. Penentuan Suhu Optimum Ekstrak Kasar Enzim Selulase
Ditimbang 0,05 mg selulosa dan dimasukkan masing – masing ke dalam 5 gelas
beaker dan ditambahkan 5 ml buffer asetat pH 4,5 ( 6 ml untuk blanko). Ditambahkan
1 ml ekstrak kasar enzim selulase (blanko tanpa enzim) lalu ditambahkan 1 ml NaCl
1%. Kemudian diinkubasi dengan variasi suhu 35oC; 40oC; 45oC; 50oC dan 55oC
selama 1 jam. Setelah itu ditambahkan 1 ml NaOH 0,1 N lalu disentrifugasi pada 3400
rpm selama 20 menit. Diambil 1 ml supernatan lalu diencerkan dalam labu takar 10
ml kemudian dihomogenkan. Dimasukkan 1 ml hasil pengenceran kedalam tabung
reaksi kemudian ditambahkan 1 ml pereaksi Nelson dan dipanaskan dalam penangas
air selama 20 menit. Kemudian diangkat dan didinginkan sampai suhunya mencapai
25oC. Diambahkan 0,5 ml arsenomolibdat lalu dikocok sampai semua endapan larut
.Kemudian ditambahkan 7 ml akuades lalu dikocok hingga homogen. Diukur
serapannya pada panjang gelombang 761 nm. Dilakukan perlakuan yang sama untuk
3.2.6. Penentuan pH Optimum Ekstrak Kasar Enzim Selulase
Ditimbang 0,05 mg selulosa dan dimasukkan masing – masing kedalam 5 gelas beaker
dan ditambahkan 5 ml buffer asetat pH 3,5; 4,0; 4,5; 5; 5,5 (6 ml untuk blanko).
Ditambahkan 1 ml ekstrak kasar enzim selulase (blanko tanpa enzim) lalu
ditambahkan 1 ml NaCl 1%. Kemudian diinkubasi pada suhu 45oC selama 1 jam.
Setelah itu ditambahkan 1 ml NaOH 0,1 N lalu disentrifugasi pada 3400 rpm selama
20 menit.. Diambil 1 ml supernatan lalu diencerkan dalam labu takar 10 ml kemudian
dihomogenkan. Dimasukkan 1 ml hasil pengenceran kedalam tabung reaksi kemudian
ditambahkan 1 ml pereaksi Nelson dan dipanaskan dalam penangas air selama 20
menit. Kemudian diangkat dan didinginkan sampai suhunya mencapai 25oC.
Diambahkan 0,5 ml arsenomolibdat lalu dikocok sampai semua endapan larut.
Kemudian ditambahkan 7 ml akuades lalu dikocok hingga homogen. Diukur
serapannya pada panjang gelombang 761 nm. Dilakukan perlakuan yang sama untuk
substrat kertas dan ampas tebu.
3.2.7 Pengukuran Aktivitas Ekstrak Kasar Enzim Selulase
Dimasukkan 0,05 mg selulosa (blanko tanpa substrat) kedalam tabung reaksi lalu
ditambahkan 5 ml buffer asetat pH 4,5. Ditambahkan 1 ml ekstrak kasar enzim
selulase lalu ditambahkan 1 ml NaCl 1%. Kemudian diinkubasi pada suhu 45o C
selama 1 jam. Setelah itu ditambahkan 1 ml NaOH 0,1 N lalu disentrifugasi pada 3400
rpm selama 20 menit.. Diambil 1 ml supernatan lalu diencerkan dalam labu takar 10
ml kemudian dihomogenkan. Dimasukkan 1 ml hasil pengenceran kedalam tabung
reaksi kemudian ditambahkan 1 ml pereaksi Nelson dan dipanaskan dalam penangas
air selama 20 menit. Kemudian diangkat dan didinginkan sampai suhunya mencapai
25oC. Diambahkan 0,5 ml arsenomolibdat lalu dikocok sampai semua endapan larut
.Kemudian ditambahkan 7 ml akuades lalu dikocok hingga homogen. Diukur
serapannya pada panjang gelombang 761 nm. Dilakukan perlakuan yang sama untuk
3.3 Bagan Penelitian
3.3.1 Penyediaan Ekstrak Kasar Enzim Selulase
Ditambahkan 500 ml larutan NaCl 1% isotonic (dingin)
Diblender ± 30 detik
Disentrifugasi pada 7000 rpm selama 30 menit
Ditambah 200 ml aseton dingin
Disentrifugasi pada kecepatan 7000 rpm selama 30 menit
Didekantasi (dalam suasana dingin)
Dikeringbekukan pada suhu -40oC
Diambil 0,5 gr dilarutkan dalam 50 ml buffer asetat 0,1 M pH 4,5
Di ukur aktivitasnya 250 g saluran pencernaan bekicot
Supernatan(400ml) pellet
Suspensi
supernatan pellet
Serbuk ekstrak kasar (8,9 gr)
Ekstrak kasar enzim selulase
3.3.2 Penentuan Suhu Optimum Hidrolisa Selulosa Oleh Enzim Selulase
Dimasukkan masing – masing ke dalam 5 gelas beaker
Ditambahkan masing – masing 5 ml larutan buffer
asetat pH 4,5 ( 6 ml untuk blanko)
Ditambahkan 1 ml enzim selulase(blanko tanpa
enzim)
Ditambahkan 1 ml NaCl 1%
Diinkubasi selama 1 jam pada suhu 35oC,40oC, 45oC,
50oC dan 55oC
Ditambahkan 1 ml NaOH 0,1 N
Disentrifugasi pada kecepatan 3400 rpm selama 20
menit 0,05 mg selulosa
supernatan
Diambil 1 ml
Diencerkan dalam labu takar 10 ml dan dihomogenkan
Diambil 1 ml hasil pengenceran
Ditambahkan 1 ml pereaksi Nelson
Dipanaskan pada penangas air selama 30 menit
Didinginkan pada air mengalir sampai suhu 25 oC
Ditambahkan 0,5 ml arsenomolibdat
Dikocok sampai semua endapan larut
Ditambahkan 7 ml akuades
Diukur absorbansinya pada panjang gelombang 761 nm
* Dilakukan perlakuan yang sama untuk substrat kertas dan ampas tebu pellet
3.3.3 Penentuan pH Optimum Hidrolisa Selulosa Oleh Enzim Selulase
Dimasukkan masing – masing ke dalam 5 gelas beaker
Ditambahkan masing – masing 5 ml larutan buffer
asetat pH 3,5; 4,0;4,5;5,0; dan 5,5( 6 ml untuk blanko)
Ditambahkan 1 ml enzim selulase(blanko tanpa
enzim)
Ditambahkan 1 ml NaCl 1%
Diinkubasi selama 1 jam pada suhu 45oC
Ditambahkan 1 ml NaOH 0,1 N
Disentrifugasi pada kecepatan 3400 rpm selama 20
menit 0,05 mg selulosa
Diambil 1 ml
Diencerkan dalam labu takar 10 ml dan digomogenkan
Diambil 1 ml hasil pengenceran
Ditambahkan 1 ml pereaksi Nelson
Dipanaskan pada penangas air selama 30 menit
Didingiinkan pada air mengalir sampai suhu 25 oC
Ditambahkan 0,5 ml arsenomolibdat
Dikocok sampai semua endapan larut
Ditambahkan 7 ml akuades
Diukur absorbansinya pada panjang gelombang 761 nm
Hasil
3.3.4 Pengukuran Aktivitas Ekstrak Kasar Enzim Selulase Pada Kondisi Optimum
supernatan pellet
Diambil 1 ml
Diencerkan dalam labu takar 10 ml dan dihomogenkan
Diambil 1 ml hasil pengenceran
Ditambahkan 1 ml pereaksi Nelson
Dipanaskan pada penangas air selama 30 menit
Didingiinkan pada air mengalir sampai suhu 25 oC
Ditambahkan 0,5 ml arsenomolibdat
Dikocok sampai semua endapan larut
Ditambahkan 7 ml akuades
Diukur absorbansinya pada panjang gelombang 761 nm
Hasil
PembuatanLarutan Sampel
* Dilakukan perlakuan yang sama untuk substrat kertas dan ampas tebu Dimasukkan ke dalam gelas beaker
Ditambahkan 5 ml buffer asetat pH 4,5
Ditambahkan 1 ml enzim selulase
Ditambahkan 1 ml NaCl 1 %
Diinkubasi selama 1 jam pada suhu 45o C
Ditambahkan 1 ml NaOH 0,1 N
Disentrifugasi pada kecepatan 3400 rpm selama 20
Dimasukkan ke dalam gelas beaker
Ditambahkan 5 ml buffer asetat pH 4,5
Ditambahkan 1 ml NaCl 1 %
Diinkubasi selama 1 jam pada suhu 45o C
Ditambahkan 1 ml NaOH 0,1 N
Disentrifugasi pada kecepatan 3400 rpm selama 20
menit 1 ml enzim selulase
supernatan pellet
Diambil 1 ml
Diencerkan dalam labu takar 10 ml dan dihomogenkan
Diambil 1 ml hasil pengenceran
Ditambahkan 1 ml pereaksi Nelson
Dipanaskan pada penangas air selama 30 menit
Didingiinkan pada air mengalir sampai suhu 25 oC
Ditambahkan 0,5 ml arsenomolibdat
Dikocok sampai semua endapan larut
Ditambahkan 7 ml akuades
Diukur absorbansinya pada panjang gelombang 761 nm
Hasil
BAB 4
HASIL DAN PEMBAHASAN
4
.1.Hasil Penelitian Dan Pembahasan4.1.1 Isolasi Ekstrak Kasar Enzim Selulase Dari Bekicot
Isolasi ekstrak enzim selulase dari bekicot pada penelitian ini menggunakan cara
isolasi dengan aseton. Pada isolasi dengan menggunakan aseton ini hanya terjadi satu
kali tahap fraksinasi yaitu memisahkan protein dengan komponen yang lain. Aseton
berfungsi untuk merusak mantel air yang terdapat di sekeliling enzim, mengakibatkan
larutan enzim berkurang dalam air sehingga protein akan mengendap.Keuntungan
pengendapan dengan aseton adalah waktunya singkat,karena lamanya waktu yang
diperlukan untuk isolasi akan mempengaruhi aktivitas enzim. Selain itu pengendapan
dengan aseton dapat dikerjakan pada suhu di bawah nol. Hal yang paling penting
bahwa suhu dijaga tetap rendah.Karena bila suhu tinggi efek denaturasi akan terjadi.
Setelah tahap pengendapan, dilakukan sentrifugasi dan pengeringan beku sehingga
diperoleh ekstrak kasar enzim selulase sebesar 8,9 gram.
4.1.2 Pengaruh Suhu Terhadap Aktivitas Ekstrak Kasar Enzim Selulase Pada
Substrat Selulosa,Kertas HVS dan Ampas Tebu
Perhitungan pengaruh suhu terhadap aktivitas ekstrak kasar enzim selulase terhadap
ketiga jenis substrat dapat dilihat pada lampiran 9.
Hasil Perhitungan dapat dilihat pada tabel dibawah ini:
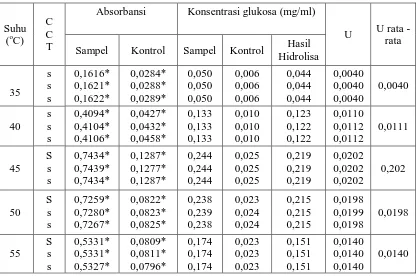
Tabel 4.1: Data Pengaruh Suhu Terhadap Aktivitas Ekstrak Kasar Enzim Selulase Pada Substrat Selulosa
Tabel 4.2 : Data Pengaruh Suhu Terhadap Aktivitas Ekstrak Kasar Enzim Selulase Pada Substrat Kertas HVS
Absorbansi Konsentrasi glukosa (mg/ml)
U U rata -
rata
Sampel Kontrol Sampel kontrol Hasil
hidrolisa
Absorbansi Konsentrasi glukosa (mg/ml)
U U rata -
rata
Sampel Kontrol Sampel Kontrol Hasil
Tabel 4.3 : Data Pengaruh Suhu Terhadap Aktivitas Ekstrak Kasar Enzim Selulase Pada Substrat Ampas Tebu
Suhu (oC)
C C T
Absorbansi Konsentrasi glukosa (mg/ml)
U U rata -
rata
Sampel Kontrol Sampel Kontrol Hasil
Hidrolisa
Keterangan *= 10 kali pengenceran s= signifikan
Untuk membandingkan ketiga data diatas dapat dilihat pada grafik berikut:
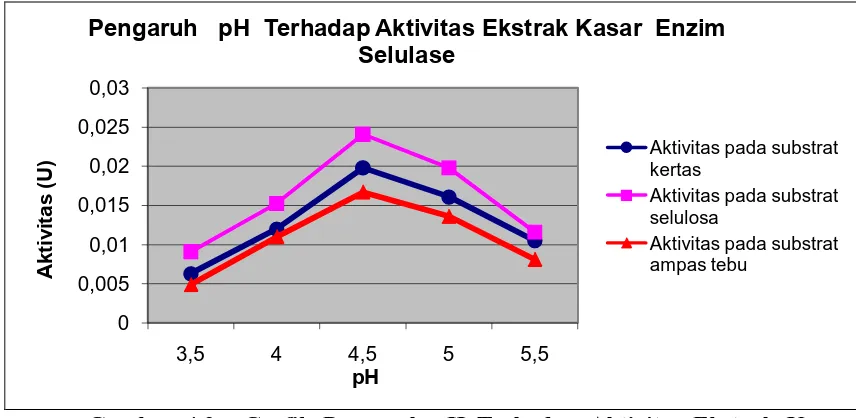
Gambar 4.1. Grafik Pengaruh Suhu Terhadap Aktivitas Ekstrak Kasar
Enzim Selulase
0
Pengaruh SuhuTerhadap Aktivitas Ekstrak Kasar Enzim Selulase
Aktivitas pada substrat selulosa
Aktivitas pada substrat kertas