MEMPELAJARI AKTlVlTAS PROTEASE
Bacillus l i c h e n i f o r m i s6ALUR GIBSON NCTC 10341 PADA FERMENTAS1 TEBKONTWOI,
MEMGGUMAKAM LIMBAW CAlR TAHU
LIE WIE SlAN F 24. 1310
1 9 9 2
FAKULTAS TEKNOLOGI PERTANIAN lNSTlTUT PERTANIAN BOGOR
Lie Wie Sian. F24.1310. Mempelajari Aktivitas Protease
Bacillus licheniformis Galur Gibson NCTC 10341 pada
Fermentasi Terkontrol Menggunakan Limbah Cair Tahu. Dibawah bimbingan Dr. Ir. Maggy T. Suhartono dan Dr. Ir. Budiatman
Satiawihardja, MSc.
Dalam percobaan ini dilakukan perbandingan aktivitas
protease Bacillus licheniformis yang ditumbuhkan pada media
limbah cair tahu dengan penambahan glukosa sebagai sumber
karbon dan kasein sebagai sumber nitrogen. Penambahan miner-
al dilakukan untuk melihat pengaruhnya terhadap aktivitas
protease yang dihasilkan. B. lichenifonnis yang digunakan
ditumbuhkan pada suhu 37 OC dalam fermentor Biostat M dengan
pengaturan kondisi fermentasi sebagai berikut : pH 7.0 -
+
0.05, aerasi 0.4 l/menit (setara 0.26 vvm), dan agitasi 400 rpm.
Dari semua percobaan yang dilakukan dapat dilihatbahwa
aktivitas protease mulai ada setelah kultur mulai memasuki
fase stasioner atau
pasta
fase logaritmik, dan meningkatselama fase stasioner. Dengan membandingkan aktivitas
protease pada media yang ditambah glukosa sebanyak 2 %
dengan media yang ditambah 2% glukosa dan 0.5 % kasein
dapat disimpulkan bahwa protease B. licheniformis disintesis
secara konstitutif, karena penambahan kasein sebagai sub-
strat protease tidak meninykatkan aktivitas enzim protease.
b e r b e d a - b e d a t e r g a n t u n g m e d i a y a n g d i g u n a k a n , y a n g p a l i n g
c e p a t a d a l a h medium LCT
+
2 % g l u k o s a+
0 . 5 % k a s e i n+
m i n e r a l ( 3 0 j a m ),
s e d a n g k a n y a n g l a i n l e b i h d a r i 4 0 jam. A k t i v i t a sp r o t e a s e t e r t i n g g i d i p e r o l e h d a r i f e r m e n t a s i LCT
+
2 % g l u k o - s a y a i t u 0 . 6 3 0 U / m l d e n g a n w a k t u f e r m e n t a s i 4 8 jam. Plassas e l y a n g t e r t i n g g i d i p e r o l e h d a r i f e r m e n t a s e i d e n g a n menggu- n a k a n m e d i a LCT
+
2 % g l u k o s a + 0 . 5 k a s e i n y a i t u 5 . 1 7 g / l .Penambahan l a r u t a n a l k a l i - a s a m k e d a l a m medium u n t u k m e m p e r t a h a n k a n pH s e l a m a f e r m e n t a s i s a n g a t d i p e n g a r u h i o l e h m e d i a y a n g d i g u n a k a n . A l k a l i l e b i h b a n y a k d i p a k a i b i l a menggunakan s u b s t r a t g l u k o s a d a n asam b i l a menggunakan
MEMPELAJARI AKTIVITAS PROTEASE Bacillus lichcnifol-mis
G A L U R GIBSON NCTC 10341 PADA FERMEN'I'ASI TERI(ONrI'IIOL
MENGGUNAKAN LIMBAH CAIII TAHU
Oleh
LIE WIE SIAN
F24.13 10
SI<RII'SI
Sebagai salah satu syarat untuk mempel-oleli
gelar SARJANA TEICNOLOGI PERTAN IAN
pad;^ Jurusan TEKNO1,OCI PANGAN DAN GIZI
Fakuitas Tek~lologi P e r t ; ~ n i ; ~ ~ ~
Institut Pertaninn Bogor
1092
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR
FAKULTAS TEKNOLOGI PERTANIAN
MEMPELAJARI AKTIVITAS PROTEASE B n c i l l ~ ~ r I I ' C I I C I I ~ / ' O I ~ I I Z ~ . S
GALUR GIBSON NCTC 10341 PADA FERMENTASI TERICONTROL
MENGGUNAKAN LIMBAH CAIR TAHU
SICRIPSI
Sehagai salah satu syarat untuk memperoleli
oelar SARJANA TEIOUOLOGI PERTANIAY 3
pada Jurusan TEKNOLOGI PANGAN DAN Ci 121
Institut Pertanian Bogor
Oleh
LIE WIE SIAN
F24.13 I 0
Dilahirkan pada tanggal 7 April 19bS
di Tasikl~ialaya (Jawa Barat)
XATA PENGANTAR
Syukur kepada Tuhan Yang Maha Esa ata berkat clan perto-
1onganNya sehingga tugas akhir dan penyusunan skripsi ini
dapat diselesaikan.
Skripsi ini disusun berdasarkan hasil penelitian selama
5 bulan di laboratorium Teknologi Mikroba dan Biokimia PAU- IPB, Bogor.
Pada kesempatan ini penulis menyampaikan rasa terimaka-
sih yang tak terhingga kepada:
1. Dr. Ir. Maggy T Suhartono dan Dr. Ir. Budiatman Satiawihardja, MSc. sebagai dosen pei~ibimbing yang
banyak memberikan bimbingan dan perh.~tian selama
penelitian
- 2 . Dr. Ir. Jimmy Hariantono, MSc. sebacjiri dosen
pengu j i
3. Papa, Mama dan adik-adik tercinta
4. Kismawan, Hekleman, Sahat, Nelson dan teman-teman di Asrama Gilang Kencana
.
Penulis menyadaril skripsi ini masih ada kekurangan,
untuk itu kritik dan saran yang membangun akan diterima
dengan tangan terbuka.
Akhir kata semoga skripsi ini dapat bermanfaat bagi
yang memerlukan.
DAFTAR IS1
halaman
KATA PENGANTAR
...
viDAFTAR GAMBAR
...
viiDAFTAR TABEL
...
X DAFTAR LAMPIRAN. . .
xiI
.
PENDAHULUAN...
1I1
.
TINJAUAN PUSTAKA...
4A
.
ENZIM PROTEASE...
4B
.
PROTEASE B a c i l l u s. . .
7C
.
B a c i l l u s l i c h e n i f o r m i s. . .
11D
.
PROTEASE B.
l i c c h e n i f o r m i s. . .
1 2 E.
SINTESIS PROTEASE B a c i l l u s. . .
16F
.
MEDIA FERMENTASI...
13G
.
BIOREAKTOR...
22111
.
METODE PENELITIAN...
25A
.
BAHAN DAN ALAT...
25B
.
METODE PENELITIAN. . .
26IV
.
HASIL DAN PEMBAHASAN...
37A
.
LCT+
2 % GLUKOSA...
37B
.
LCT+
5 % GLUKOSA...
41C
.
LCT+
0.5 % KASEIN...
43.
...
D LCT+
2 % KASEIN 47 E.
L C T + 2 % GLUKOSA+ 0.5 %KASEIN. . .
50F
.
LCT t 2 % GLUKOSA+
0.5 % KASEIN+
MINERAL 52 G.
FEDBATCH. . .
54A
.
K E S I M P U L A N. . .
5 8...
B
.
S A R A N 59D A F T A R P U S T A K A
. . .
6 0DAFTAR GAMBAR
[image:9.602.93.534.141.640.2]halaman
Gambar 1.
Gambar 2.
Gambar 3.
Gambar 4.
Gambar 5.
Gambar 6.
Gambar 7
Gambar 8 .
Gambar 9.
Gambar 10.
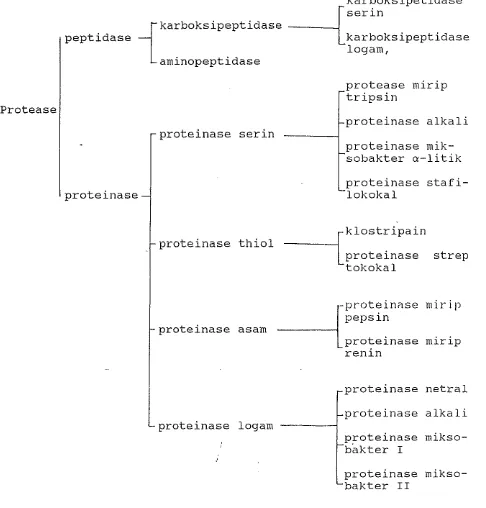
Skema Penggolongan Enzim Protease
Mikroba
...
8 Deret asam amino Subtilisin Carlsberg...
dibandingkan denqan Subtilisin BPN 15
Diagram alir proses fermentasi
. . .
29 Diagram alir analisis konsentrasiprotein terlarut metode Bradford
. . .
3 3 Kurva massa sel, konsentrasi glukosa,konsentrasi protein terlarut, dan akti- vitas protease selama fermentasi pada
. . .
media LCT
+
2 % glukosa 3 9Kurva konsentrasi oksigen terlarut dan akumulasi penambahan larutan alkali-asam selama fermentasi pada media LCT t
2 % glukosa
. . .
3 9Kurva massa sel, konsentrasi glukosa, konsentrasi protein terlarut, dan akti- vitas protease selama fermentasi pada
. . .
media LCT
+
5 % glukosa 4 2Kurva konsentrasi oksigen terlarut dan akumulasi penambahan larutan alkali-asam selama fermentasi pada media LCT +
5 % glukosa
. . .
4 2 Kurva massa &el, konsentrasi glukosa,konsentrasi protein terlarut, dan akti- vitas protease selama fermentasi pada
...
media LCT
+
0.5 % kasein 44Kurva konsentrasi oksigen terlarut dan akumulasi penambahan larutan alkali-asam selama fermentasi pada media LCT
+
0.5 % kasein
...
4 4Gambar 11.
Gambar 12.
Gambar 13.
Gambar 14.
Gambar 15.
Gambar 16.
Gambar 17.
Gambar 18.
Gambar 19.
Gambar 20.
Kurva massa sel, konsentrasi glukosa, konsentrasi protein terlarut, dan akti- vitas protease selama fermentasi pada media LCT
+
2.5 % kasein. . .
:
Kurva konsentrasi oksigen terlarut dan akumulasi penambahan larutan alkali-asam selama fermentasi pada media LCT i
...
2.5 % kasein
Kurva massa sel, konsentrasi glukosa, konsentrasi protein terlarut, dan akti- vitas protease selama fermentasi pada media LCT
+
2 % ylukosa+
0.5 % kaseinKurva konsentrasi oksigen terlarut dan akumulasi penambahan larutan alkali-asam selama fermentasi pada media LCT +
2 % glukosa
+
0.5 % kasein. . .
Kurva massa sel, konsentrasi glukosa, konsentrasi protein terlarut, dan akti- vitas protease selama fermentasi pada media LCT+
2% qlukosa+
0.5 % kasein i.mineral
. . .
Kurva konsentrasi oksigen terlarut dan akumulasi penambahan larutan alkali-asam selama fermentasi pada media LCT
+
2 %glukosa
+
0.5 % kasein+
mineral. . .
Kurva massa sel, konsentrasi ylukosa, konsentrasi protein terlarut, dan akti- vitas protease selama fermentasi metode fedbatch I
. . .
Kurva konsentrasi oksigen terlarut dan akumulasi pe'nambahan larutan alkali-asam
....
selama fermentasi metoda fedbatch I
Kurva massa sel, konsentrasi glukosa, konsentrasi protein terlarut, dan akti- vitas protease selama fermentasi metode fedbatch I1
...
DAFTAR
TABEL
halaman
Tabel 1
.
Klasifikasi protease mikroba...
7Tabel 2
.
Enzim protease yang dihasilkanoleh Bacillus
...
10 [image:11.602.103.552.83.780.2]Tabel 3
.
Komposisi media untuk Bacillus...
penghasil protease 21
. . .
Tabel 4
.
Komposisi limbah cair tahu 22DAFTAR LAMPIRAN
halaman
Lampiran 1. Gambar f e r m e n t o r BIOSTAT M
. . .
6 2Lampiran 2 . P e r a k i t a n dan p e n g o p e r a s i a n f e r m e n t o r
BIOSTAT M
...
6 3Lampiran 3 . Kurva s t a n d a r p e n e t a p a n g l u k o s a metode
. . .
DNS denyan S p e c t r o n i c 2 0 6 4 am pi ran 4 . Kurva s t a n d a r p e n e t a p a n k o n s e n t r a s i
p r o t e i n t e r l a r u t metode B r a d f o r d dengan
...
S p e c t r o n i c 2 0 65
Lampiran 5 . P e r s i a p a n p e r e a k s i u n t u k a n a l i s i s a k t i v i t a s p r o t e a s e metode Bergmeyer
...
I.
PENDANULUAN
Enzim adalah senyawa protein yang dihasilkan oleh sel-
-~
sel hidup untuk mengkatalisis reaksi-reaksi biokimia di
dalam sel hidup. Protease merupakan enzim yang berperan
dalam reaksi yang melibatkan pemecahan protein. Enzim ini
dalam kerjanya membutuhkan air, dan dimasukkan ke dalam
kelas hidrolase.
Sumber-sumber utama enzim protease adalah tumbuhan,
hewan dan mikroba. Enzim yang dihasilkan oleh mikroba
mempunyai kelebihan dibandingkan dengan yang lainnya, yaitu
dapat diproduksi dalam jumlah besar, produkstivitasnya mudah
ditingkatkan, mutunya lebih seragam dan harganya murah.
Meskipun telah lama dikenal, pemanfaatan enzim skala indus-
tri baru dimulai tahun 1960-an. Aplikasi protease dari
mikroba meliputi industri pangan dan non panyan. Pemanfaat-
an protease pada industri non pangan yaitu di industri kulit
dan detergen, sedangkan pada industri pangan digunakan di
industri bir, roti, kue,,keju, daging dan pembuatan protein
hidrolisat.
Adanya perkembangan teknologi yang pesat terutama dalam
bidang bioteknologi menjadikan mikroba sebagi salah satu
penghasil enzim yang potensial, sebab enzim dari mikroba
dapat- diproduksi secara masal dan dapat dioptimalkan dengan
penyeleksian galur murni, pengaturan kondisi fermentasi, clan
untuk hidup dan berkembang biak di dalam media yang disusun
dari limbah pertanianf bahan baku yang relatif murah.
Dalam melaksanakan fermentasi secara industri skala
besar, terutama untuk memproduksi produk-produk fementasi
yang membutuhkan tingkat sterilitas yang tinggi, kontaminasi
merupakan masalah yang utama. Dengan digunakannya fermen-
tor, masalah kontaminasi ini dapat diatasi, sekaligus dapat
dilakukan pengontrolan terhadap parameter-parameter ling-
kungan fisik dan kimia selama fementasi berlangsung. Fer-
mentor merupakan bejana fermentasi aseptik dengan semua
kelengkapan serta sistem penggunaannya dirancang sedemikian
rupa sehingga kondisi aseptik dapat dipertahankan selama
fermentasi berlangsung.
Mikroorganisme tumbuh dalam suatu spektrum fisik dan
kimiawi yang sangat luas. Pertumbuhan dan kegiatan-kegiatan
fisiologis lainnya merupakan suatu respon mikroorganisme
terhadap lingkungan fisik dan kimianya. Xinetika fermentasi
menggambarkan pertumbuhan dan pembentukan produk oleh mi-
kroorganise sebagai respon terhadap lingkungannya, bukan
hanya pertumbuhan sel a ~ t i f tetapi juga keyiatan-kegiatan
sel istirahat dan sel mati. Studi kinetika fermentasi dapat
memberikan beberapa informasi penting antara lain waktu yang
tepat untuk pemungutan hasil dan apakah fementasi berlang-
sung secara tidak normal, yang merupakan petunjuk adanya
Tujuan penelitian ini adalh untuk mempelajari aktivitas
protease selama pertumbuhan pada media limbah cair tahu yang
ditambah dengan glukosa dan atau kasein serta garam-garam
11. TINJAUAN PUSTAKA
A . ENZIM PROTEASE
- .
Enzim adalah protein yang disintesis oleh sel
hidup untuk mengkatalisis reaksi-reaksi yang sangat
spesif ik, dengan demikian maka enzim berperan mengat.ur
fungsi biologis mahluk hidup melalui proses metabolisme.
Pada umumnya enzim mempunyai beberapa karakteristik
sebagai berikut: enzim mempunyai spesifitas yang tinggi,
enzim bekerja lebih cepat dibandingkan katalisator
lainnya, tetapi enzim mudah dihambat oleh kondisi-
kondisi fisik seperti tekanan, konsentrasi larutan, pH
dan suhu yang ekstrim. Enzim berperan terutama di dalam
sel hidup, tetapi enzim ekstraseluler disekresikan
keluar dengan tujuan menyederhanakan nutrisi-nutrisi di
luar sel supaya dapat diserap ke dalam sel (Boing,
1982).
Enzim protease merupakan enzim yang mengkatalisis
pemecahan protein. ,Protease termasuk k e dalam kelas
hidrolase karena dalam menghidrolisis substrat membutuh-
kan molekul air. Seringkali protease dibedalcan daiam
dua golongan yakni proteinase dan peptidase. Proteinase
mengkatalisis hidrolisis molekul protein menjadi frag-
men-fragmen besar, sedangkan peptidase mengkatalisis
fragmen polipeptida menjadi asam amino (Frazier dan
dikeluarkan oleh mikroba pada media fermentasi selama
masa pertumbuhan sedangkan peptidase hanya disintesis
bila sel mengalami autolisis (Casida, 1968).
1. Protease dari Mikroba
Protease dan enzim lain yang dihasilkan oleh
mikroba memiliki beberapa keunggulan dibandingkan
sumber lainnya. Keunggulan itu antara lain dapat
diproduksi dalam jumlah besar, produktivitasnya
mudah dikingkatkan (Standbury dan Whitaker, 1984)
,
mutunya lebih seragam dan harganya lebih murah(Yamamoto, 1975).
Langkah awal dalam memproduksi enzim dari
mikroorganisme adalah seleksi mikroorganisme yang
akan digunakan sebagai penghasil enzim yang diingin-
kan, baik mutu maupun kwalitasnya. Menurut Neubeck
(1970), yang dikutip oleh Schwimmer (1981), terdapat
syarat umum yang dapat diterapkan dalam pemilihan
galur mikroba yaitu :
1. mikroba tersebut mudah tumbuh
2. tidak terdapat faktor yang tidak diinginkan dalam mikroba tersebut seperti patogenesis
3. enzim yang dikehendaki terdapat dalam jumlah jauh lebih banyak dibandingkan produk lainnya
4 . mikroba tersebut stabil (tidak mudah mutasi!
5. enzim mudah dipisahkan dari massa sel mikroba Protease dihasilkan oleh berbagai jenis mikroba
mulai dari bakteri, kapang dan khamir. Berbagai
macam bakteri seperti Bacillus, Pseudomonas, Clos-
-
tridiun~,
Proteus, Seratia, jenis kapang Aspergilus,Penicillium dan Mucor merupakan penghasil protease
yang cukup potensial (Casida, 1968).
2. Klasifikasi dan Sifat
Protease mikroba dapat dikelompokan berdasarkan
beberapa cara. Cara pengelompokan yang paling
sederhana adalah berdasarkan pH optimum mikroba
penghasilnya. Dengan cara ini protease dapat di
kelompokkan menjadi tiga golongan yakni protease
netral, alkali dan asam. Protease mikroba dapat
dibagi menjadi empat kelompok berdasarkan mekanisme
kerja, yaitu (1) protease serin, (2) protease metal, (3) protease thiol, (4) protease asam. Dengan sedikit kekecualian, protease Bacillus kebanyakan
terdiri dari enzim serin atau metal (Priest, 1977).
Klasifikasi yang lebih terinci diberikan oleh Ward
(1983) seperti yang tercantum dalam Tabel 1. Nama enzim dan nomor EC ditulis sesuai dengan rekomendasi dari Komisi Penamaan dan Penggolongan Enzim Interna-
Tabel 1. Klasifikasi protease mikroba
(Subgrup 3.14-peptida hidrolase ) *
Nomor EC Nama yang direkomendasikan
a-Aminopeptidase hidrolase
Dipeptida hidrolase
Dipeptidil dipeptida hidrolase
Karboksipeptidase serin
Karboksipeptidase metal
Protease serin
Protease thiol
Proteinase karboksil (asam)
Proteinase logam
Protease yang belum diketahui
mekanisme katalitiknya
*
Ward, 1983Penggolongan* enzim tersebut dapat dilihat lebih
jelas pada skema 6i Gambar 1.
B. ENZIM PROTEASE Bacillus
Pada dekade ini penggunaan enzim semakin pesat dan
enzim mikrobial makin nyata berperan dalam berbagai
bidang seperti medis, industri bir, roti dan lain-lain.
[image:19.595.127.542.51.624.2]karboksipetidase
-4
serinkarboksipeptidase
peptidase karboksipeptidase
loyam, aminopeptidase
rpr~tease mirip tripsin
C
proteinase alkali- proteinase serin
proteinase mik- sobakter a-litik
Lproteinase staf i- lokokal
klostripain
I
proteinase thiolI
proteinase streptokokal
-proteinase m i r i p
pepsin proteinase asam
proteinase mirip renin
r
proteinase netral proteinase alkali proteinase logamproteinase mikso- bakter I
[image:20.595.55.541.72.580.2]proteinase mikso- 'bakter 11
Gambar 1. Penggolongan protease yang dihasilkan oleh mikroba (Ward, 1983)
an ini, dibuktikan dengan distribusi makalah yang diba-
wakan pada Simposium Internasional Fermentasi ke V tahun
Industrial Interest" tak kurang dari 10 berkenaan dengan
enzim yang berasal dari Bacillus. Ada beberapa
.
alasan *mengapa peranan bakteri ini agak dominan dalam bidang
ini. Pertama mereka terdiri dari grup yang bersifat
kemoorganotropik yang mudah dipelihara dan dikembangbi-
akkan dan mempunyai karakter yang beraneka ragam yaitu
psikrofilik
,
mesofilik thermofilik disamping itu alkal-ofilik, neutrofilik, dan asidofilik (Priest,1977).
Enzim ekstraseluler atau eksoenzim adalah enzim yang
terpisah sama sekall dari sel dan terdapat secara bebas
dalam medium sekelilingnya. Meskipun demikian pembagian
antara enzim ini dengan enzim dinding sel atau enzim .
terikat-membran seringkali sukar. Enzim dapat terikat
dengan membran pada sel muda dan terlepas sebagai ekso-
enzim pada s a a t kultur memasuki fase stasioner atau
terlarut oleh perlakuan ringan misalnya pencucian sel
dengan air atau larutan garam (Priest, 1977).
Banyak jenis eksoenzim yang disintesis oleh basili
Dari Tabel 2 dapat difihat jenis protease ekstraseluler
yang dihasilkan oleh bakteri Bacillus.
Periplasma pada bakteri gram negatif dikenal sebagai
ruang yang mengandung enzim, ruang ini terletak antara
membran sitoplasma di bagian dalam dan membran sel di
bagian luar. Tidak adanya membran luar pada bakteri
gram positif menyebabkan tidak adanya lokasi yang dapat
Tabel 2. Enzim protease yang dihasilkan oleh
Bacillus (Priest, 1977)
Enzim Protease Spesies Keterangan
Alkalofilik Bacillus spp Enzim serin dari alkalo-
alkalofilik filik yang optimum pada
pH tinggi
Amilopeptidase B. licheniformis B. subtilis
Esterase B. subtilis Enzim serin dengan akti-
vitas esterolitik kuat dan proteolitik lemah
Halof ilik Bacillus sp Diproduksi optimal pada
medium yang mengandung NaCl 1M
Metal
Serin
B. amyloliaquefaciens Enzim yang membutuhkan Ca
B. megaterium untuk stabilitas dan Z n
B . polymyxa untuk aktivitasnya,
B. subtilis pH optimum pada pH netral
8. subtilis var atau dekat netrdl
amylosacchariticus
B. thermoprote?liticus B
.
thuringiensisB . amyloliquefaciens Subtilisin;
B. lichenifor~nis pH optimum alkali,
B . pumilus residu serin pada atau
a . subtilis dekat sisi aktif B. subtilis var
sac~hariticus
Serin metal B. likheniformis Enzim hibrid dengan
B. pumilus karakteristik gabungan
antara protease metal dan serin.
dari Bacillus sering digambarkan sebagai enzim 'peri-
plasmik', yang menunjukkan cara yany sama dengan prose-
[image:22.595.79.537.33.723.2]gram negatif. Lokasi yang pasti dari enzim ini sebagai
enzim ekstraseluler sejati tetap tidak jelas, tetapi
enzim tersebut mungkin mempunyai semacam periplasma yang
dilepaskan pada saat pembentukan protoplasma (Priest,
1977).
C. Bacillus licheniformis
Bacillus licheniformis termasuk dalam divisi Proto-
phyta, kelas Schizomycetes, ordo Eubacteriales, famili
Bacillaceae dan genus Bacillus (Clifton, 1958). B.
licheniformis dikenal sebagai spesies dari spektrum B.
subtilis. Yang termasuk dalam spektrum ini adalah B.
subtilis, B. licheniformis dan B. pumilus. Terjadinya
pengelompokan ini adalah karena ketiga spesies ini mem-
punyai bentuk morfologis yang mirip dan beberapa sifat
fisiologis yang juga mirip (Gordon, 1972).
Bakteri dari genus Bacillus adalah bakteri yang
bersifat aerobik atau anaerobik fakultatif, berbentuk
batang dan mempunyai endospora refraktil. Dibandingkan
dengan sel vegetatifnya, endospora lebih tahan terhadap
panas, keadaan kering, desinfektan dan bahan destruktif
lainnya, dan mungkin tetap hidup selama beberapa abad.
B. licheniformis merupakan bakteri gram positif, berben-
tuk batang dengan panjang antara 1.5 urn sampai 3 um dan
lebar antara 0 . 6 um sampai 0.8 um. Spora dari bakteri
sentral atau parasentral dari sel penghasil spora. B.
licheniformis bersifat motil dan memberikan hasil
positif pada uji katalase dan uji Voyeus-Proskauer.
Bakteri ini masih dapat tumbuh pada suhu 50 OC serta
dalam larutan NaCl 7%. Sifat lain dari bakteri ini adalah dapat menyebabkan dekomposisi kasein, dapat
menggunakan asam sitrat dan propionat, dapat mereduksi
NO3 menjadi NO2 dan menghidrolisi pati. B. lichenifor-
mis tumbuh pada suhu maksimum 50-55OC dan suhu minimum
15 OC (Gordon, 1972). B licheniforl~lis menghasilkan
beberapa enzim ekstraseluler yaitu a-amilase, amino
peptidase, protease metal, protease serin, protease
serin-metal, penicilinase (B-laktamase), Endo-N-asetil
glukoaminidase, dan lipase (Priest 1977), selain itu
juga menghasilkan antibiotik bacitracin (Hanlon dkk,
1983).
D
.
Protease B.
licheniformisB. licheniformis, merupakan spesies bakteri yang
mampu menghasilkan enzim protease dalam jumlah tinggi.
Jenis enzim protease yang dihasilkan oleh bakteri ini
adalah enzim ekstraseluler yang tergolong protease serin
alkali karena mempunyai residu serin pada sisi aktifnya
Enzim ini bekerja sebagai endopeptida dan dihambat kuat
oleh senyawa diisopropil fluorofosfat (DFP) karena
serin pada sisi aktif (Aunstrup, 1978).
Protease serin mempunyai berat molekul dengan
kisaran 25.000-30.000 dan dicirikan dengan adanya residu
serin pada sisi aktif. Akibatnya enzim ini dihambat
oleh diisopropil-fluorofosfat tapi tidak membutuhkan ion
metal, tahan terhadap EDTA (Ethylenediamine tetraacetic
acid). Adanya ion ~'+a dapat menstabilkan enzim ini
pada suhu tinggi. Protease serin dapat dibagi menjadi
dua grup berdasarkan sifatnya. Pertama grup A yang
dihasilkan oleh B. licheniformis (Subtilisin Carlsberg)
dan B. puinilus dan grup B protease serin yang disebut
Subtilisin Novo (Subtilisin BPN) dari B. stearothermo-
phillus dan B. amyloliquefaciens (Priest, 1977).
Enzim protease yang dihasilkan oleh B. lichenifor-
mis dikenal dengan nama Subtilisin Carlsberg, yang mana
enzim ini diisolasi pertama kali oleh Guntelberg Lang
dan Ottensen pada tahun 1952 dan mereka hanya melihat
satu komponen enzim. Hall dan kawan-kawan pada tahun
1966 berhasil memisahkan enzim protease yang dihasilkan
oleh bakteri ini m&njadi dua komponen enzim, sebuah
proteinase dan satu lagi peptidase. Selanjutnya pada
tahun 1972, Zuidweg memisahkannya menjadi tiga komponen
enzim dengan menggunakan elektroforesis dan menyimpulkan
bahwa ketiganya terbentuk bukan karena autodijes. B.
licheniformis memproduksi dua komponen proteinase utama
s i menjadi isoenzim melalui otodijes. Komponen utama
diidentifikasi sebagai Subtilisin Carlberg. Dalam
klasifikasi berdasarkan Komisi Penamaan dan Penygolongan
Enzim Internasional, Subtilisin mempunyai namor EC.
3.4.21.14 (ward, 1983).
Enzim Subtilisin Carlsberg mempunyai rantai peptida
tunggal dengan 274 residu asam amino tetapi tidak terda-
pat residu sestein maupun ikatan disulfida; berdiameter
4.2 nm, mengandung Ser 221, His 64, dan Asp 32 pada sisi
aktif, berat molekul 27.277 dan titik isoelektriknya
pada pH 9.4. Enzim ini dihambat aktivitasnya oleh
senyawa yang dapat bereaksi dengan serin seperti Dii-
soprfil fluorofosfat (DFP) dan Fenil meti1 sulfonil
fluorida (PMSF). Seperti protease serin .lainnya, kalsium
tidak diperlukan dan tidak inaktif oleh pengkelat
(EDTA). Subtilisin mempunyai spesifitas yang luas,
menghidrolisa hampir semua ikatan peptidan dan beberapa
ikatan ester, terutama yang mengandung residu asam amino
aromatik, beberapa frigliserida juga dihidrolisis,
misalnya tripropionat,dan tributirat. Subtilisin Carls-
berg mempunyai p H optimum untuk aktivitasnya antara 8.0
sampai 9.0, stabil pada selang pH luas dan dapat diinak- tifkan dengan cepat pada pH di bawah 5.0 dan diatas 11.0 (Ward. 1983). Agen oksidasi seperti hipoklorida dan
hidrogen perooksida cepat merusak enzim, tetapi hidrogen
perklorat, tidak membahayakan aktifitas enzim (Aunstrup,
1 9 7 9 ) . Gambar 2 menunjukkan deret asam amino dari
Subtilisin Carlsberg dibandingkan Substilisin BPN.
. r , ,
~arlsberg-
.
mr It, he uu ALP 1.1 Val ctn At, I n *L,,
AUB ~ N
4 W I ~ A I ~ C ~ n . s t r ~ V ~ I ~ P r ~ l ~ ~ ~ ~ h ' V ~ I ~ S ~ ~ G m ~ l L A ~ v A b H l ~ S C n C l ~ C h . S ~ r ~ A ~ n . V I l ~ L t l ~ V ~ I ~ A U u V I l ~ [image:27.599.126.548.187.724.2]n a 10
Gambar 2 . Perbandingan deret asam amino Subtilisin
E. SINTESIS PROTEASE Bacillus
1: S i n t e s i s P r o t e a s e
S i n t e s i s enzim e k s t r a s e l u l e r dalam jumlah t e r b a n y a k t e r j a d i pada s a a t s e b e l u m s p o r u l a s i y a k n i
pada a k h i r f a s e e k s p o n e n s i a l d a n awal f a s e s t a s i o - n e r . Pada g e n u s B a c i l l u s s i n t e s i s p r o t e a s e n e t r a l akan mencapai a k t i v i t a s maksimum sebelum pembentukan
s e l mencapai b a t a s maksimum, Dalam h a 1 p r o t e a s e a l k a l i , s i n t e s i s n y a t e r t i n q q i d i c a p a i s e s u d a h f a s e
pertumbuhan s t a s i o n e r . Namun d e m i k i a n , k i n e t i k a i n i
d a p a t b e r u b a h dengan adanya pengaruh-penqaruh kompo- nen-komponen s u b s t r a t (Keay d k k , 1 9 7 2 yany d i k u t i p
o l e h Meyrath dan Volvasek, 1 9 7 5 ) .
Hubungan a n t a r a b i o s i n t e s i s dan a k t i v i t a s
p r o t e a s e d a n p r o s e s s p o r u l a s i pada s p e s i e s Bacillus
masih belum d a p a t d i t e n t u k a n s e c a r a p a s t i . Berda-
s a r k a n d a t a g e n e t i k dan f i s i o l o g i S c h a e f f e r (19G9) menyimpulkan bahwa a k t i v i t a s p r o t e a s e e k s t r a s e l u l e r t i d a k e s e n s i a l daiam s p o r u l a s i , d a n menduga a d a s a t u
a t a u l e b i h p r o t e a s e i n t r a s e l u l e r yang b e r p e r a n dalam p e r p u t a r a n p r o t e i n ( p r o t e i n t u r n o v e r ) . B i a r p u n
demikian Mandelstam dari W a i t e s (1968) menyatakan bahwa e k s o p r o t e a s e bertanggung jawab t e r h a d a p p e r p u - t a r a n p r o t e i n i n t r a s e l u l e r ; t e t a p i keduanya t i d a k
Meskipun aktivitas protease ekstraseluler tidak
mempunyai fungsi nyata dalam sporulasi, molekul
enzim mungkin mempunyai hubungan dengan enzim in-
traseluler. Protease intraseluler dibutuhkan untuk
(1) melepaskan enzim tertentu untuk pengaturan metabolisme sel, (2) menyediakan monomer yang dapat dioksidasi pada sel yang aktif, (3) menyediakan monomer untuk sintesis protein atau (4) merusak inhibitor sporulasi. Hubungan mutlak secara lang-
sung antara protease intraseluler dengan ekstrase-
luler tidak ada meskipun korelasi antara keduanya
mungkin ada (Schaeffer, 1969)
.
Studi sintesis protease pada pertumbuhan kultur
dalam batch menyatakan bahwa hubungan antara kece-
patan sintesis yang maksimal pada permulaan spo-
rulasi. Lebih jauh lagi, analisis mutan
spa-
(mutanyang tidak menghasilkan spora) mengungkapkan bahwa
strain ini tidak memproduksi protease elcstraseluler
dan kembalinya k<mampuan untuk berspora diikuti
dengan kemampuan untuk memsintesis protease
(Schaeffer, 1967 di dalam Priest, 1977). Semua
-mutan yang diisolasi memperlihatkan perubahan
aktivitas protease juga perubahan karakteristik
sporulasi. Kebanyakan dari contoh ini mungkin
akibat mutasi pleiotropik, tetapi meskipun demikian
mempunyai fungsi dalam proses sporulasi.
2. Produksi Protease
Dalam produksi protease dan enzim lain pada
umumnya ada dua aspek yang harus diperhatikan yakni
isolasi galur dan mutasi serta kontrol selama
produksi. Isolasi galur bertujuan untuk ineng-
hasilkan enzim dalam jumlah dan aktivitas yang
tinggi (Ward., 1983). Faktor-faktor yang perlu
dikontrol untuk mengoptimalkan produksi meliputi
suhu, pH, kondisi aerasi (transfer , 0 2 ) , komposisi
medium (surfaktan dan unsur kelumit), laju
pertumbuhan mikroba, induksi, represi umpan balik,
serta represi katabolik (Demain (1973) yang dikutip
oleh Schwimmer, 1981).
Untuk mendapatkan galur yang dapat memproduksi
protease dalam jumlah tinggi dilakukan prosedur yang
umuni diteraplcan pada enzim lain. Peiiiantauan aktivi-
tas protease dilbkukan dengan cara melihat luas
/
daerah difusi enzim pada media agar, yang umumnya
terlihat berupa daerah bening di sekeliling koloni,
akan tetapi pendekatan ini tak selamnya memberikan
hasil yang memuaskan untuk seleksi mikroba penghasil
protease. Smith menemukan bahwa pada kultur B.
licheniformis yang menghidrolisis kasein dalam
silkan protease dalam jumlah besar dengan menggunakan
kultur terendam (Ward, 1983).
F. MEDIA FERMENTASI
Pemilihan media fermentasi merupakan faktor
yang sangat penting dalam produksi enzim dari mikro-
ba, disamping faktor kondisi fermentasi, spesies
mikroba yang digunakan dan metoda pemurnian enzim
yang dihasilkan. Terdapat dua bentuk fermentasi
yang dapat dilakukan yaitu fermentasi terendam dan
fermentasi permukaan.' Pada media cair kedua metoda
fermentasi tersebut dapat diterapkan. Teknik kultur
terendam lebih menguntungkan karena tidak mudah
terkontaminasi dan waktu fermentasinya lebih singkat
(Aunstrup, 1979).
Menurut Blevin dan Davis (1979), keuntungan
penggunaan media cair dibandingkan dengan media
padat adalah antara lain komposisi dan komponen
media dapat dia,tur dengan mudah, dapat memberikan
kondisi optimum bagi pertumbuhan, penggunaan sub-
strat efesien, aerasi dapat disesuaikan, laju per-
tumbuhan mikroba dapat diukur dan resiko kontaminasi
kecil, sedangkan kekurangannya adalah dapat terben-
tuk buih, membutuhkan tingkat sterilitas yang ting-
gi, konsentrasi produk yang relatif rendah dan
Persyaratan media fermentasi dalam industri
enzim adalah tersedia sepanjang tahun, mudah dida-
[image:32.599.131.545.73.683.2]pat, harganya murah dan efesien pengyunaannya.
Tabel 3 memperlihatkan komponen yang dapat digunakan
untuk menghasilkan enzim protease dari Bacillus.
Tabel 3. Komposisi media untuk Bacillus penghasil
protease
Komposisi kultur terendam (gram / liter)
1. Hidrolisat pati 50; tepung kacang kedelai 20; kasein 20; Na2HP04 3,3.
2. Hidrolisat pati 150; protein kedelai 3.65; laktosa 4.3; tepung biji kapas 30; khamir 7.2; KH2P04 4.3; MgS04.2H20 1.25; loyam kelumit
3. Ampas gandum 100; tepung kacang kedelai 30; pH diatur dengan Na2C03
Limbah cair tahu
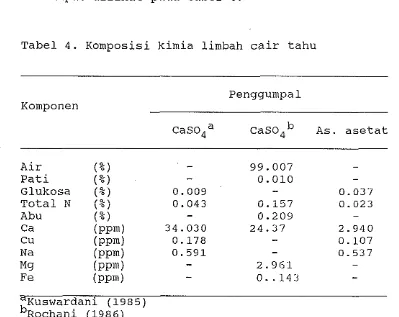
Limbah cair tahu dapat digunakan sebagai media
fermentasi karQna masih mengandung nutrisi yang
dapat digunakan untuk pertumbuhan mikroba. Prinsip
pembuatan tahu adalah menggumpalkan protein dari
susu kedelai hasil ekstraksi kedelai yang telah
dihancurkan dan ditambah air. Fraksi dari susu
kedelai yang tidak menggumpal disebut "whey" atau
limbah cair tahu. Komposisi whey berbeda-beda
kalsium sulfat) dan efesiensi ekstraksi. Komposisi
[image:33.599.138.537.113.430.2]ini dapat dilihat pada tabel 4.
Tabel 4. Komposisi kimia limbah cair tahu
Penggumpal Komponen
casoqa CaS04 As. asetat
- -
Air ( % )
-
99.007 -Pati
( % I
-
0.010 -Glukosa ( % ) 0.009 - 0.037
Total N ( % ) 0.043 0.157 0.023
Abu ( % ) - 0.209 -
ca ( ppm) 34.030 24.37 2.940
CU (
P P ~ )
0.178 - 0.107Na (PPm) 0.591 - 0.537
M9 (PPm)
-
2.961 -Fe (
P P ~ )
-
0. .143 -aKuswardani (1985) b~ochani (1986)
Dari hasil penelitian Nurdin (1988) diteniukan
bahwa aktivitas protease yang dihasilkan oleh Bacil-
lus licheniformis. pada media limbah cair tahu lebih tinggi dibandingkan dengan aktivitas protease pada
media sinteik yang direkomendasikan oleh Hanlon dkk
(1982) dan Hadiutomo (1987). Penelitian ini juga
menemukan bahwa penambahan glukosa dan molases
menurunkan aktivitas protease sedanykan ampas tapio-
ka meningkatkan. Semua fermentasi diatas dilakukan
D. BIOREAKTOR
Bioreaktor adalah sistem tertutup untuk reaksi
biologis darri suatu proses bioteknologi. Bioreaktor
memberikan lingkungan yang terkontrol bagi optimasi
pertumbuhan organisme dan aktivitas metabolisme. Bio-
reaktor ini hendaknya mencegah kontaminasi produksi
dari lingkungan k e kultur sambil mencegah pelepasan
kultur k e lingkungan. Selain itu, bioreaktor tersebut
sebaiknya memiliki instrumen untuk pemeriksaan agar
terjadi pengawasan proses yang optimum. Jenis parameter
dan peralatan yang digunakan dalam operasi suatu bio-
reaktor dapat dilihat pada Tabel 5 (Smith, 1 9 9 0 ) .
Tujuan utama dalam merancang bioreaktor adalah untuk
menekan biaya produksi, namun usaha pengembangan selan-
jutnya diutamakan pada peningkatan kecepatan pen~bentu-
kan dan kualitas produk (Smith, 1 9 9 0 ) .
Ada tiga jenis utama pengoperasian bioreaktor yang
digunakan dalam proses bioteknologi dengan dua biokata-
lis. Bioreaktor dapat' dioperasikan dengan basis diskon-
tinyu, semi kontinyu (fed bacth) atau kontinyu. Reaksi
dapat terjadi dalam kultur statis atau yang diaduk,
dengan atau tanpa oksigen. Katalis biologis dapat
digunakan dalam bentuk bebas atau terikat pada suatu
permukaan zat pendukung atau merupakan sel yang sedang
Tabel 5. Jenis instrumen yang kini digunakan pada bioreaktor.
Parameter yang Peralatan yang digunakan
diukur* Tekanan Isi fermentor Volume Berat PH IZecepatan pengadukan
Laju aliran udara
Produksi karbon
Konsumsi oksigen
Oksigen terlarut
Suhu
Sensor pengukur tekanan udara atau pengukur tegangan
Sel pengukur perbedaan tekanan di atas dan di bawah
Sel pengukur beban fermentor
Elektroda gelas dan standar
Techometer
Flow meter, piringan berlubang
Penganalisis sinar merah
Penganalisis Zirkonia
Polarografi dengan elektroda oksigen
Termometer, termometer tahan an, termistor, kapiler
*sumber dari Smith, 1990
Optimasi suatu pdoses bioreaktor melibatkan minimi-
sasi penggunaan bahan baku, energi, serta maksimasi
kemurnian dan kualitas produk. Optimasi proses dapat
dicapai dengan memanipulasi parameter fisik dan kimia
yang berhubungan dengan proses (Smith, 1990).
Pengembangan proses proses mikrobial umumnya
[image:35.595.125.530.66.708.2]rium, merupakan tahap studi a.wal; 2) skala pilot plant,
dimana kondisi operasi optimal mulai diterapkan; dan 3)
skala industri dimana proses prosesnya dilaksanakan
dengan memperhitungkan ekonomi industri fermentasi
111. BAHAN DAN
METODE
A. BAHAN DAN ALAT
1. Bahan
Bahan yang digunakan pada penelitian ini adalah
kultur murni Bacillus licheniformis galur Gibson
NCTC 10341 yang diperoleh dari Balai Penelitian
Veteriner Bogor, beberapa media serta bahan kimia.
Media yang dipakai adalah Nutrien Broth (Difco),
Nutrien Agar (Difco), kasein ; dan untuk media
fermentasi adalah limbah cair tahu yang diperoleh
dari pabrik tahu di Cibanteng (menggunakan
penggumpal CaS04), glukosa ( merk dagang Glukolin
dengan komposisi 98 % glukosa monohidrat) dan kasein teknis, antifoam silikon, KH2P04, MgS04, CaClZ,
FeSO, dan (NH4)2S04; untuk analisa adalah NaOH, HC1,
asam borat, boraks, kasein, kalsium klorida,
tirosin, Bovin
,
Serum Albumin (BSA), asamtrikloroasetat, gatrium karbonat, pereaksi fenol
(Folin Ciocalteau), Natrium klorida, Commasive
Brilliant Blue, etanol 9 5 % , asam fosfat 8 5 2 , asam
3,5-dinitrosalisilat, Na-K tartarat, fenol, Natrium
metabisulfit, glukosa standar (untuk analisa
2. Alat
Alat-alat yang digunakan adalah Fermentor
Biostat M beserta rekordernya, alat-alat gelas, sen-
trifuse SED 30, inkubator bergoyang Grant SS40-A2,
Spektrofotometer Spektronik 20, stirrer magnetik,
Heidolph MR 2000, vortex Genie-2, mikropipet Socorex
1 dan 5 ml, inkubator Lab-line 3550-1, oven WTB B
115, timbangan Mettler PJ 300, timbangan Libror AEL- 200, kulkas, otoklaf dan penangas air Thermolift.
B. METODE PENELITIAN
1. Persiapan Kultur
a. kultur stok
Untuk pembuatan kultur inokulum, kultur
bentuk ampul harus disegarkan dulu, Persiapan
kultur stok dilakukan dengan cara memecah ampul
kultur, tambahkan sedikit air steril ke dalam
ampul, lalu dikocok dan diinokulasikan ke dalam
!
NB steril, diinkubasi selama sehari. Bakteri
dari NB ini ditumbuhkan di media NA miring,
kemudian diinkubasi selama dua hari pada suhu
37Oc dan disimpan sebagai kultur stok. Kultur
stok disimpan pada 'suhu ~ O C dan disegarkan
kembali setiap 2 minggu. ~ a r i kultur stok ini
dalam persiapan kultur ini dilakukan secara
aseptik.
b. kultur inokulum
Bakteri dari kultur stok diinokulasikan k e
dalam 100 ml limbah tahu steril pH 7, diinkubasi pada 37Oc selama 24 jam dalam inkubator bergo-
yang. Kultur inokulum siap dipakai.
. -
2. Fermentasi
Bacillus licheniformis ditumbuhkan pada suhu
37 OC dalam fermentor Biostat M, dengan pengaturan
sebagai berikut pH 7.0, aerasi 0.4 l/menit, agitasi 400 rpm. Media yang digunakan untuk mempelajari
aktivitas protease adalah limbah cair tahu yang
ditambah dengan 2% glukosa, 5% glukosa, 0.5 % ka-
sein, 2.5 % kasein
,
2 % glukosa+
0.5 % kasein, 2% glukosa+
0.5 % kasein+.
mineral (dalam g/l :MgS04.7H20 0.4, KH2P04 1, CaC12.H20 0.5, (NH4)2S04 5). Sedangkan untuk! fermentasi fed batch menggunakan
media awal LCT ditambah 1 % glukosa
+
0.5 % kasein, dan media fed LCT+
2 % glukosa+
0.5 % kasein. Volume media yang digunakan adalah 1.5 liter untuksistem batch dan 1 liter untuk sistem feed batch
ditambah 0.5 1 untuk medium feed. Kecepatan
Media limbah cair tahu yang diperoleh dari
pabrik tahu disaring dengan kapas. Erlenmeyer yang
berisi glukosa dan atau kasein diisi dengan limbah
cair tahu yang sudah disaring sebanyak 1.5 1.
Larutan tersebut diatur pH-nya dengan menambahkan
NaOH 1.0 M. Setelah glukosa dan kasein larut erlen-
-
meyer disumbat dan disterilisasi bersama bejana
fermentor selama 15 menit pada 121 OC.
Sebelum dipakai dalam fermentasi pH meter dan
p02 meter dikalibrasi dulu. Media steril yang sudah
didinginkan, dimasukkan k e dalam bejana fermentor
secara aseptik. Kemudian dilakukan pengaturan suhu,
pH dan diaerasi sampai jenuh. Setelah pembacaan
stabil, inokulum sebanyak 100 ml dimasukkan secara aseptik dan rekorder dinyalakan. Skema pengopera-
sian fermentor dapat dilihat pada gambar 3 sedangkan prosedur perakitan dan pengoperasian yang lebih
Media LCT
+
glukosa+
kasein+
mineral4
disterilkan
bejana fermentor
I
-
disterilkan
I
I
didinginkanI
I
didinginkanI
\
/masukkan medium
I
secara aseptik1
I
I
atur kontrol pH 7.01
I
suhu 37 O CI
1
diaerasi sampai jenuh\
inokulum inoulasi secara
/
1
fermentasi1
ambil sampel
I
analisis aktivitas protease
% g.iukosa
% protein
[image:41.599.110.522.64.728.2]I
massa sel3. pengambilan dan persiapan sampel
Sekitar dua puluh ml sampel diambil dari
bejana fermentor secara aseptik melalui saluran
khusus pengambilan sampel. Sampel dimasukkan k e
dalam dua tabunq sentrifuse masing-masing se-
banyak 10 ml. Pemisahan supernata dan biomassa
dilakukan dengan sentrifuse selama 1 0 menit
dengan kecepatan 3500 rpm. Biomassa hasil
sentrifuse digunakan untuk penetapan massa sel
dengan metoda oven; supernatan digunakan untuk
analisa kadar giukosa, kadar protein dan aktivi-
tas proteolitik. Bila tidak seyera dianalisa
sampel disimpan di freezer denyan temperatur
-20 Oc.
4. Metoda Analisis
a. penetapan massa sel
Sampel hLsil fermentasi sebanyak 1 0 ml
dimasukkan k e dalam tabung sentrifuse yang
sudah diketahui beratnya; disentrifuse
selama 10 menit dengan kecepatan 3500.
Supernatan dikumpulkan untuk analisa yang
lain. Endapan hasil sentrifuse dicuci
0.85%) kemudian diaduk dengan vorteks dan
disentrifuse lagi. Setelah larutan pencuci
dibuang, tabung berserta sel dikeringkan
dalam oven pada suhu 105 OC selama 12 jam,
didinginkan dan ditimbang.
b. Penetapan kadar glukosa
Glukosa ditetapkan dengan menggunakan
metoda kolorimetri D N S (Asam dinitro-salisi-
lat) (Miller, 1959). Metoda ltolorimetri
berdasarkan pada pembentukan komponen warna
merah, sebagai akibat reduksi asam 3,5-
dinitrosalisilat menjadai asam 3-amino-5-
nitrosalisilat dan oksidasi gugus aldehid
dari gula pereduksi menjadi grup karboksil.
Warna merah yang dihasilkan dapat bervariasi
tergantung jenis gula yang terdekomposisi
dalam larutan alkali (Miller, 1959).
Sampel dilarutkan sehingga mengandung
0.2-1.0 g/l glukosa. Dalam tabung bertutup,
i
sampel .&ebanyak 1.0 ml ditambahkan 3 ml pereaksi D N S , kemudian dididihkan selama 15
menit. Setelah dingin, larutan diukur den-
sitas optiknya pada panajng gelombang 640 nm dan konsentrasi dihitung dari kurva standar
Pereaksi DNS menganduny ( 9 ) : asam
3,5-dinitrosalisilat 10, fen01 2 , sodium
sulfit 0.5, Na-K tartarat 200, dan Natrium
hidroksida 10.
penetapan protein terlarut
Protein terlarut ditetapkan dengan
metoda Bredford (Bredford, 1976). Perhbuatan
larutan Bradford adalah sebagai berikut 100
mg Commasive Brilliant Blue, ditambah 100 ml
etanol 95 %, 50 ml asam fosfat 85 % kemudian
Supernatan hasil protein baku (BSA)
sentrifuse diencerkan
10-100 kali
(konsentrasi 0.01-0.1 mg/ml)
ditambahkan 5 ml pereaksi Bradford
J
1
divorteks dan didiamkanI
]
10 menit pada suhu kamar1
I
diukur absorbansinya pada panjany
\
gelombang 595nrn
dan proteinI
[image:45.602.75.527.92.701.2]I
dihitung dari kurva baku (BSA)Gambar 4. Skema analisis konsentrasi protein terlarut metode Bradford (Bradford, 1976 di dalam
d. penetapan aktivitas proteolitik
Aktivitas protease supernatan ditetap-
kan berdasarkan metode Bergmeyer.
Prinsip penetapan aktivitas adalah
sebagai berikut
Kasein
---
> peptida+
asam aminop r o t e a s e
Laju pembentukan peptida dan asam amino
dari reaksi di atas dapat dijadikan tolak
ukur aktivitas katalitik dari enzim pro-
tease. Asam amino yang telah terbentuk
harus diisolasi dan dipisahkan dari substrat
yang tersisa. Cara yang umum dilakukan
adalah dengan menambahkan asam trikloroase-
tat (TCA) atau asam perklorat. Asam amino
yang telah diisolasi dapat lanysung diukur
absorbansinya pada 280 atau diwarnai terle- bih dulu dpngan pereaksi Folin Ciocalteau
agar dapar dilakukan pembacaan pada daerah
sinar tampak.
Prinsip di atas dapat diaplikasikan
pada hampir semua jenis protease. Kondisi
optimal untuk protease tertentu dapat dilak-
ukan dengan mengatur kondisi fisik dan kimia
~.
dilakukan antara lain : penyaturan pH dan
suhu selama analisis, penanibahan CaC12,
pereaksi -SH atau senyawa lain yang dapat
meningkatkan aktivitas enzim yang dianali-
sis. Metode ini terutama ditujukan untuk
Subtilisin y a n g banyak dihasilkan oleh
Bacillus sp.
Setiap sampel yang akan dihitung unit
aktivitasnya akan memiliki nilai absorbansi
bagi sampel dan standar. Unit aktivitas
tiap sampel dapat dihitung berdasarkan rumus
di bawah ini.
U = A s p X P X l -
Ast T
dimana :
U = Unit aktivitas /ml
= nilai absorbansi sampel :st = nilai absorbansi standar
= faktor pengenceran sampel T = waktu inkubasi (menit)
Berdasarkan perjanjian internasional
dan untuk kepentingan ilmiah aktivitas
dinyatakan dalam Internasional Unit. Satu
IU protease menyatakan jum1,ah enzim yang
dapat menghasilkan satu mikromol produk
Tabel 4. Pengukuran aktivitas protease (Berymeyer, 1976)
blanko standar sampel . (ml) (ml) (ml)
Buffer borat 1.00 1.00 1.00 pH 8.0, 0.05M
Substrat kasein 1.00 1.00 1.00 (20 mg/ml, pH 8)
Enzim dalam CaC12
-
( 2
mM)
Tirosin standar
-
0.20 -( 5mM)
Akuades 0.20 -
-
Inkubasi pada suhu 37 OC selama 10 menit tepat
TCA (0.1M) 2.00 2.00 2.00
CaC12 (0.2 mM) - - 0.20
Enzim dalam CaC12 0.20 0.20
-
Inkunasi pada suhu 37 OC selama 10 menit sentrifuse 1 0 menit pada 3500 rpm
Pereaksi Folin 1.00 1.00 1.00
IV. NASIL DAN PEMBAI-IASAN
Dalam percobaan ini dilakukan perbandingan aktivitas
protease Bacillus licheniformis yang ditumbuhkan pada media
limbah cair tahu dengan penambahan komponen variabel glukosa
sebagai sumber karbon dan kasein sebagai nitrogen, serta
mineral (MgS04, KH2P04, CaC12, (NH4) 2S04) untuk melihat
pengaruhnya terhadap aktivitas protease yang dihasilkan oleh
B. licheniformis yang ditumbuhkan pada suhu 37 OC dalam
fermentor Biostat M dengan pengaturan kondisi fermentasi
sebagai berikut : pii 7.0 -
+
0.05, aerasi 0.4 l/menit (setara0.26 vvm), dan agitasi 400 rpm. Medium yang digunakan
adalah sebanyak 1.5 1 untuk sistem batch dan 1 1 untuk
sistem fed batch, ditambah 0.5 1 untuk medium fed. Untuk
pengaturan pH digunakan larutan NaOH 1 M dan HC1 1 M; se- dangkan untuk menghilangkan buih digunakan silikon dioksida.
Pembahasan hasil penelitian diuraikan berurutan berdasarkan
eksperimen dengan media fermentasi yang berbeda.
A. LCT
+
2% GLUKOSAPercobaan ini bertujuan untuk mengetahui pengaruh
glultosa sebagai sumber karbon terhadap aktivitas pro-
tease yang dihasilkan. Hasil percobaan menunjukkan
bahwa Bacllus licheniformis yang ditumbuhkan pada media
limbah cair tahu yang ditambah glukosa sebanyak 2 %
setelah kurva pertumbuhan bakteri mulai memasuki fase
stasioner (Gambar 5). Aktivitas tertinggi yang dicapai adalah 0.630 U/ml pada umur kultur 4 8 jam. Massa sel
yang dihasilkan adalah 3.44 g/l.Dari Gambar 5 dapat
dilihat glukosa dikonsumsi dengan cepat pada fase loga-
ritmik
.
Pertumbuhan awal bakteri pada medium ini hampir
tidak mengalami fase adaptasi. Hal ini terjadi karena
kondisi medium yang cukup sesuai untuk pertumbuhan sel.
Hanlon (1981) mengemukakan bahwa B. licheniforn~is yang
ditumbuhkan pada media glukosa mempunyai waktu penggan-
daan yang paling singkat yaitu 1.00 jam dibandingkan
dengan gliserol, asam piruvat, asam sitrat, dan asam
laktat yang masing-masing berturut-turut adalah 1.13,
2.00, 3.16, dan 3.95 jam. Dari Gambar 6 dapat dilihat
bahwa pada waktu pertumbuhan logaritmik sampai memasuki
fase stasioner sampai jam ke-27 konsumsi oksigen juga
sangat tinggi, sehingga oksigen yany terlarut menjadi
sangat rendah. Setelah itu konsentrasi O 2 mulai mening-
kat lagi. Dari kedua gambar di atas dapat dilihat
hubungan antara kurva pertumbuhan, konsumsi glukosa,
konsentrasi protein terlarut, aktivitas protease, oksi-
gen terlarut dan kebutuhan larutan alkali-asam untuk
mempertahankan p H mendium tetap 7.
Pada fase logaritmik, uhtuk mempertahankan pH tetap
0 10 20 30 40 60 60 70
lam -.- masea sel
[image:51.602.96.533.44.696.2]4- k protein ierlerut
Gambar 5 . Kurva m a s s a s e l , k o n s e n t r a s i g l u k o s a , k o n s e n t r a - s i p r o t e i n t e r l a r u t , d a n a k t i v i t a s p r o t e a s e s e l a m a f e r m e n t a s i p a d a media LCT i 2 % y l u k o s a
% okalgen rnl 1
M
60
60
a
40
a
I
30
-
1a
20 a
a
rn
.
10
0
0 10 20 30 40 6 0 60 70
jam
-
% okalgen terlarut + alkall-aaarnkarhon melepaskan banyak asam/ ion H+ k e dalam medium,
asam ini dapat juga merupakan produk metabolisme sel
selama pertumbuhan. Pada fase pertumbuhan lambat alkali
tidak ditambahkan, baru setelah memasuki fase stasioner
terjadi penambahan asam pada medium. Penambahan alkali
dan asam k e dalam medium sangat erat hubunyannya dengan
metabolisme yang terjadi dalam sel dan senyawa-senyawa
yang dilepaskan oleh sel. Dari grafik peniompaan alkali
asam dapat dilihat kecenderungan perubahan pH medium
bila pH tidak dikontrol. Bila pada awal fermentasi ini
alkali tidak ditambahkan akan tejadi penurunan pH,
pertumbuhan sel akan lambat kemudian segera memasuki
fase stasioner. Pada fase perturnbuhan loyaritmik,
glukosa dimetabolimne dengan cepat dan sel melepaskan
produk metabolik yang dapat berupa asam k e medium; pada
rase pertumbuhan lambat kebutuhan larutan pengatur
sedikit; setelah kultur memasuki fase stasioner terjadi
keseimbangan antara sel-sel hidup denyan sel-yang mati,
meskipun pertumbuhan terhenti, metabolisme dan akumulasi
produk masih terjadi di dalam sel atau di dalam cairan. Massa sel tetap konstan pads fase stasioner, tetapi
jumlah sel hidup cenderung menurun. Pada saat ketahanan
hidup menurun lisis sel mungkin terjadi dan massa sel
akan menurun. Lisis sel akan menyebabkan terjadinya
suatu medium yang kompleks dari produk-produk hasil
B. LCT
+
5% GLUKOSAPada fermentasi LCT dengan penambahan glukosa yany
lebih tinggi, pengaruh glukosa terlihat jelas, aktititas
protease rendah sekali selama fermentasi berlangsung.
-.
Aktivitas protease mulai ada setelah jam k e 26, ter-
tinggi pada saat umur kultur 69 jam sebesar 0.059 U/ml,
nilai ini sepersebelas kali lebih kecil dibandingkan
dengan medium yang menggunakan 2 % g l h o s a . Bernlohr (1971) menemukan bahwa meningkatnya konsentrasi glukosa
dapat mengningkatkan efek represi katabolik terhadap
sintesis protease. Dengan menggunakan konsentrasi
glukosa yang tinggi sedangkan kadar protein dalam media
hanya berasal dari limbah cair tahu, komposisi antara C
dan N tidak seimbang sehingga massa sel ynng d i h a s i l k ; ~ ~ .
kecil (kurang dari 1 g/ml). Glukosa yany tersisa sete-
lah fermentasi berlangsung.60 jam masih tetap tinggi
yaitu 1.67 % . Karena massa sel yang dihasilkan sedilcit
maka konsentrasi oksigen yang menurun dengan cepat pada
awal fermentasi meningkat lagi setelah jam k e 9. Per-
tumbuhan bakteri mulb;: memasuki stasioner setelah jam k e
18.
Dari Gambar 8 terlihat bahwa kebutuhan alkali pada
3 jam awal fermentasi rendah, ini menunjukkan penggunaan glukosa yang lambat dan adaptasi yang lama dibandingkan
0 10 20 30 40 60 60 70 80 90
[image:54.599.95.539.68.671.2]jam
Gambar 7. Kurva massa sel, konsentrasi glukosa, konsentra- si protein terlarut, dan aktivitas protease selama fermentasi pada media LCT
+
5 % glukosa% oksigen rnl 1
M
,~ ...
.. .. . , .. ,
0 10 20 30 40 50 60 70 80 90
jam
-- % okeigen terlarut + alkall-aeam
i n h i b i s i o l e h s u b s r a t m u l a i t e r j a d i d i a t a s k o n s e n t r a s i
5 0 g / l , j a r a n g t e r j a d i i n h i b i s i - b a r u d i m u l a i s e t e l a h m e l e w a t i 1 0 0 g / m l . Dengan m e n i n g k a t n y a k o n s e n t r a s i
s u b s t r a t t e r l a r u t d a p a t m e n i n g k a t k a n t e k a n a n o s m o s i s l a r u t a n s e h i n g g a menyebabkan d e h i d r a s i p a r s i a l s e l d a n
menurunkan k e c e p a t a n p e r t u m b u h a n s e l .
C . LCT
+
0 . 5 % K A S E I NP e r c o b a a n penambahan k a s e i n s e b a g l s u b s t r a t e n z i m p r o t e a s e b e r t u j u a n u n t u k m e l i h a t a p a k a n e n z i m t e r s e b u t d i s e n t e s i s s e c a r a k o n s t i t u t i f a t a u i n d u k t i f . Penambahan
k a s e i n p a d a media LCT t i d a k menunjukkan p e n i n g k a t a n
a k t i v i t a s p r o t e a s e y a n g b e r a r t i . Massa s e l y a n g d i h a -
s i l k a n j u g a s e d i k i t ( 0 . 8 2 g / m l )
.
A k t i v i t a s p r o t e a s em u l a i a d a s e t e l a h 3 3 jam d a n h a n y a s e d i l c i t m e n i n g g k a t s a m p a i 0.01G U / m l p a d a s a a t k u l t u r b e r u m u r 5 1 jam (Gambar 9 ) . K a s e i n merupakan m o l e k u l p o l i m e r a s a m a m i n o
y a n g b e r u k u r a n b e s a r . P r o t e i n i n i t i d a k d a p a t s e y e r a b e r p e n e t r a s i m e l a l u i , d i n d i n g membran s e l b a k t e r i .
B a k t e r i h a r u s mengelua'rkan e n z i m p r o t e a s e e k s t r a s e l u l e r u n t u k d a p a t m e n d e g r a d a s i p r o t e i n i n i m e n j a d i monomer-
monomer y a n g d a p a t masuk k e d a l a m s e l . K a r e n a p a d a a w a l f e r m e n t a s i b e l u m d i h a s i l k a n e n z i m p r o t e a s e ( e n z i m p r o -
t e a s e y a n g a d a h a n y a b e r a s a l d a r i k u l t u r i n o k u l u n i ) maka
0 10 20 30 40 60 60 70
jam
.
--
ma868 e e l + a k l l v l l a ~ ~ proteaseJ- X prolein Ierlarut + % giuiioaa
[image:56.602.59.524.59.715.2]-
Gambar 9. Kurva massa sel, konsentrasi glukosa, konsentra- si protein terlarut, dan aktivitas protease selama fermentasi pada media LCT
+
0.5 % kaseinmi 1 M % okslgen
60
...
- 40
a
I
20 k
a
I
0
-
Ia
-20 a
a
m
-40
I t I I I I
I
-600 10 20 30 40 5 0 60 70
jam
-
% okslgen terlarut + alkall-aaarndengan massa sel tertinggi hanya 0.82 g/l.
Pada Gambar 10 terlihat bahwa konsumsi oksigen pada fase adaptasi rendah sekali sehingga oksigen yang terla-
rut dalam medium tetap jenuh. Penurunan konsentrasi
terjadi mulai jam ke-9 sampai jam ke-18, tapi konsentra-
s i masih tetap tinggi yaitu 22 % . Hal ini menunjukkan
konsumsi oksigen yang rendah karena massa sel yang
dihasilkan sedikit. Pada fermentasi ini, larutan penga-
tur pH yang pertama kali digunakan adal HC1 (sampai jam
ke-G) setelah itu baru NaOH sampai jam Ice-18, kemudian
HCL lagi. Pola penggunaan larutan pengatur ini berbeda
dengan fermentasi LCT yang ditambah glukosa, yang mana
larutan yang digunakan perfama kali adalah NaOH. Hal
ini disebabkan karena pada fermentasi dengan menggunakan
kasein, bakteri terpaksa hanya menggunakan kasein seba-
gai sumber karbon (sumber karbon dari limbah cair tahu
dapat diabaikan (0.02% berasal dari pati dan glukosa
pada tabel 4). Peningkatan konsentrasi ion OH- yang dapat menyebabkan peningkatan pH ini disebabkan oleh
terjadinya degradasi!protein.oleh protease yang dapat
menghasilkan asam amino. Asam amino hasil hidrolisis
digunakan oleh bakteri sebagai sumber karbon. Proses
ini melibatkan pembebasan amonia yang dikenal dengan
deaminasi. Menurut Cooney (1980) proses deaminasi dapat
berlangsung dalam beberapa cara tergantung pada enzim
deaminasi reduksi yang menghasilkan asam lemak jenuhdan
amonia
,
dan dikatalisis oleh dehidrogenase denganhidrogen sebagai donor hidrogen. Reaksi yang berlangsung
adalah sebagai berikut
R - CH2 - CH - COOH + 2 H+
---
> R - CH2 - CH2 - COOH + NH3 INH2
b. deaminasi desaturasi yang menghasilkan asam lemak
tak jenuh.
R - CH2
-
CH - COOH ---> R - CH = CH-
COOH + NH3I
NH2
Menurut Priest (1977) produk hasil hidrolisis enzim ekstraselular mungkin merepresi sintesis enzim dengan
cara yang sama dengan represi sintesis enzim endoselular
oleh produk akhir. Produksi enzim ekstraselular yang
diatur dengan cara ini direpresi secara kuat oleh
adanya asam amino atau peptida di lingkungannya. Pada
beberapa Bacillus asam amino tersendiri tidak merepresi
pada tingkat yang sama dibandingkan dengan yang diaki-
.
batkan oleh beberapa;asam amino sekaligus. Bacillus
amyloliquefaciens pada fase akhir eksponensial menerus-
kan sintesis protease apabila suspensi medium mengandung
konsentrasi kasein hidrolisat yang rendah (0.25 mg/ml),
tetapi represi secara kuat terjadi bila konsentrasi
makin tinggi (0.5 mg/ml). Dari 16 asam amino yang diuji, prolin, isoleusin, glutamat dan aspartat mengha-
D . LCT
+
2.5 % KASEIN. . -
Pola pertumbuhan pada media LCT dengan penambahan
kasein yang lebih banyak (2.5 % ) berbeda dibandingkan
dengan media sebelumnya (LCT
+
glukosa atau LCT+
0.5 %kasein). Pada medium ini fase adaptasi berlangsung lama
seperti yang terjadi pada medium LCT
+
0.5 % kasein.FaSe pertumbuhan logaritmik berlangsung lambat karena
terbatasnya nutrien mikro yang dapat diserap oleh sel.
Kasein dalam medium harus dihidrolisis dulu oleh pro-
tease menjadi asam amino dan polipepticla sebelum diguna-
kan sel sebagai sumber karbon dan sumber nitrogen. Asam
amino dipakai sebagi sumber karbon karena tidak ada
sumber karbon lain selain yang berasal dari limbah cair
tahu. Fase peralihan antara fase layaritmik ke t a s e
stasioner, atau yang disebut juga fase pertumbuhan
lambat berlanqsunq lama. Perubahan fase pertumbuhan
lamabat k e fase stasioner tidak telihat jelas karena
kurvanya landai (Gambar 11). Massa sel tertinggi tinggi yang dihasilkan oleh m{dium ini adalh 5.04 g/l, dicapai
setelah umur kultur 6 8 jam. Aktivitas protease mening-
kat setelah umur kultur 40 jam dan meningkat terus
sampai 0.173 U/ml. Nilai ini sepuluh kali lipat lebih
besar dibandingkan aktivitas pada media LCT
+
0.5 %kasein, tapi tidak lebih besar dari media yang mengguna-
Gambar 11. Iturva massa sel, konsentrasi glukosa,. konsentra- si protein terlarut, dan aktivitas protease selama fermentasi pada media LCT
+
2.5 % kasein% okslgen m l 1 M
.
4 0
20
0
a
I
-20 k
a
-40 1
I
-60
-
a
-80
;
-
100 rn-
120- 140
0 10 20 30 40 60 80 70
jam
-
% okslgen terlarut 4- alkall-asarn [image:60.599.114.476.68.342.2] [image:60.599.62.521.196.666.2]protease yang dihasilkan maka dapat disimpulakan bahwa
enzim protease ekstraseluler B. licheniformis adalah
enzim konstitutif. Menurut (Priest, 1977) sintesis
enzim ekstraseluler pada genus Bacillus munqkin bersifat
indusibel, konstitutif sebagian dan konstitutif. Enzim
yanq termasuk indusibel pada genus ini ada dua yaitu
levasukrase dan penicilinase.
Dari Gambar 12 dapat dilihat bahwa konsumsi oksigen
selama fermentasi kasein cukup tinggi sehingqa konsen-
trasi oksigen terlarut dipertahankan 0% sampai jam ke-
6 0 . Konsumsi oksigen ini disebabkan karena massa sei
yang banya dan fase pertumbuhan lambat yang lama.
Menurut Wang etal. (1979) kecepatan absorbsi volumetrik
oksiqen berkaitan erat denqan kecepatan tumbuh, konsen-
trasi sel dan jugan konsentrasi produk ( bila produk
metabolisme teroksidasi). Kurva kebutuhan alkali-asam
alkali menunjukkan perbedaan yang n