DETEKSI KEBERADAAN VIRUS AVIAN
INFLUENZA PADA DOC YANG DILALULINTASKAN
MELALUI BANDARA SOEKARNO HATTA
MUJIATUN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Deteksi Keberadaan Virus Avian Influenza pada DOC yang Dilalulintaskan melalui Bandara Soekarno Hatta,
adalah karya saya sendiri, dengan bimbingan para Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2009
MUJIATUN. Detection of Avian Influenza Virus in Day Old Chick (DOC) Transported in Soekarno Hatta Airport. Under direction of RETNO D. SOEJOEDONO and SRI MURTINI.
The aims of this research was detecting and isolating AIV in DOC. Samples were taken from DOC which transported through Soekarno Hatta Airport Quarantine Station. The detect disease method with convenience sampling methods was used with the estimation of prevalence at about 0.9%. The total samples were 346 DOC. There were 58 pooled samples of tracheas and lungs, which collected from 6 DOC per pooled. Afterwards, sera and egg yolks were individually collected. Sera were tested with haemagglutinin inhibition (HI) test. Reverse Transcriptase-Polymerase Chain Reaction (RT-PCR) assays were performed to the pooled tracheas and lungs. This RT-PCR were carried out to prove the presence of Influenza virus A using a pair of matrix primers (F-Matrik-AI; R-Matrik-AI). The samples which were positively AIV detected by RT-PCR assays using matrix primers were tested using H5 primers (F-H5-AI; R-H5-AI). The RT-PCR assays were also generated to the egg yolks. These assays were performed to confirm the absence of AIV in the DOC which were negatively detected by RT-PCR assays. In this detection, three pairs of matrix primers were used (F-Matrik-AI; R-Matrik-AI), (M-Flu 1; M-Flu 2) and (FAI; RAI). The detected matrix protein of AIV in those samples were tested with H5 primers (FH5; RH5) and (HA-1444; H5-1735R). Geometric mean titer (GMT) of the samples were 11.7 while mean titer of the positive AIV were 32. It also identified that 6 of 58 samples were positively detected by AIV matrix primers but negative by H5 primers. Third teen samples negatively detected by matrix primers, 8 samples were positively identified in egg yolks by RT-PCR assays. Influenza virus A were positively identified in those 8 samples using matrix primers (M-Flu 1; M-Flu 2), while 3 of 13 samples were positively detected using different matrix primers (FAI; RAI) and one of them positive by H5 primers (FH5; RH5). The differences between RT-PCR results, it can cause difference of genetic sequences and also resulted from the different target of primer annealing. Also, this research was verifying the possibility of AIV to be transmitted vertically to the DOC. This verification were concluded from the high concentration of AIV detected in egg yolk compared with AIV concentration in tracheas and lungs.
MUJIATUN. Deteksi Keberadaan Virus Avian Influenza pada DOC yang Dilalulintaskan melalui Bandara Soekarno Hatta. Di bawah bimbingan RETNO D. SOEJOEDONO dan SRI MURTINI.
Perpindahan hewan dari suatu daerah/negara ke daerah/negara lain berpotensi menyebarkan penyakit. Salah satu penyakit penting yang bersifat transboundary animal diseases adalah Avian Influenza (AI). Day Old Chick (DOC) diduga berpotensi terinfeksi dan menyebarkan Virus Avian Influenza (VAI) kepada unggas lain melalui importasi dari negara lain dan transportasi dari Jawa ke pulau lain di Indonesia. Peraturan pemerintah yang mengatur pengendalian penyakit AI dituangkan dalam Peraturan Dirjen Peternakan nomor: 46/PD.640/F/08.05. Peraturan tersebut menyatakan bahwa lalu lintas anak ayam umur 1 hari (DOC), anak itik umur 1 hari (DOD), telur dan pakan ternak dari daerah tertular ke daerah bebas dapat diizinkan dengan persyaratan tertentu. Peraturan ini dibuat dengan pertimbangan untuk memenuhi kebutuhan konsumen di daerah bebas yang tidak memiliki peternakan pembibitan karena sentra industri peternakan unggas sebagian besar terletak di Pulau Jawa yang merupakan daerah tertular. Bertolak dari hal tersebut maka penelitian ini dilakukan dengan menggunakan pendekatan metode Detect Diseases.
Penelitian ini bertujuan untuk mendeteksi dan mengisolasi adanya infeksi virus AI pada DOC yang berpotensi menyebarkan virus dari satu daerah/negara ke daerah/negara yang lain. Deteksi keberadaan virus AI dilakukan dengan reverse transcriptase-polymerase chains reaction (RT-PCR). Pengujian untuk pooling sampel organ paru-paru dan trakhea digunakan primer matrik: F-matrik-AI; R-matrik-AI dan H5: F-H5-AI; R-H5-AI (Lee et.al 2001). Setelah diketahui proporsi sampel DOC positif AI, kemudian dilakukan konfirmasi untuk meyakinkan bahwa sampel yang negatif pada organ trakhea dan paru-paru dengan primer Lee et al. (2001) benar-benar negatif. Pengujian dilakukan pada organ kuning telur secara individu dengan 3 jenis primer matrik yaitu: F-Matrik-AI; R-Matrik-AI (Lee et al. 2001), M-Flu 1; M-Flu 2 (Trani et al. 2006) dan FAI; RAI (Lee & Suarez 2004) dilanjutkan dengan 2 jenis primer H5 yaitu FH5; RH5 (Lee & Suarez 2004) dan HA-1444; H5-1735R (WHO 2002). Beberapa sampel positif pada pooling organ trakhea dan paru-paru dilakukan penelusuran pada kuning telur secara individu menggunakan primer matrik: FAI; RAI dan H5: FH5; RH5 (Lee & Suarez 2004). Penelusuran dilakukan untuk mengetahui sumber penularan virus AI pada DOC. Sampel-sampel yang menunjukkan hasil positif AI dilakukan inokulasi pada telur ayam berembrio-specific pathogen free (TAB-SPF) untuk mendapatkan isolat virus AI dari DOC.
Mix, 0.5 µl (0.2 µM) primer forward, 0.5 µl (0.2 µM) primer reverse dan 17 ddH2O. Formulasi reaksi RT-PCR ini berlaku untuk semua jenis primer. Proses
amplifikasi menggunakan mesin Thermal Cycle Sprint Hybaid dan Gene Amp®. Masing-masing reaksi dianalisis dengan menggunakan elektroforesis 135 volt selama 35 menit (Mupid-x Japan) dan elektroforesis 100 volt, 400 mA selama 60 menit (Owl Model OSP-300) dengan konsentrasi agar rose 1.5 % (Invitrogen) dengan pewarnaan ethidium bromida (Sigma), DNA marker 100 bp (Invitrogen dan Fermentas) dan 50 bp (Invitrogen) selanjutnya hasil dibaca dengan UV transilluminator. Sampel-sampel yang menunjukkan hasil dubius, positif lemah dan positif dilakukan inokulasi pada TAB-SPF mengikuti standar OIE (2005). Uji korelasi Spearman digunakan untuk melihat korelasi antara maternal antibodi dengan keberadaan virus AI pada sampel.
Rataan titer maternal antibodi pada sampel adalah 23.5 (11.7). Uji korelasi Spearman antara titer maternal antibodi dengan primer matrik tidak signifikan pada α = 0.05 artinya keberadaan virus Influenza A pada DOC tidak dipengaruhi oleh adanya maternal antibodi. Penelitian ini juga menunjukkan rataan titer antibodi AI dari sampel positif virus dengan uji RT-PCR sebesar 25 (32). Rataan titer dari masing-masing sampel tesebut belum cukup untuk memproteksi unggas terhadap infeksi dan eksresi (shedding) virus AI.
Sejumlah 58 pooling sampel yang diuji terdapat 6 sampel yang menunjukkan positif Influenza A dengan primer matrik (F-Matrik-AI; R-Matrik-AI) tetapi negatif pada pengujian dengan primer H5 (F-H5-AI; R-H5-A1). Jika diasumsikan bahwa dalam 1 pooling organ terdapat sekurang-kurangnya 1 sampel organ DOC mengandung virus Influenza A maka dapat dihitung angka prevalensi. Total sampel 346, sebanyak 6 sampel positif Influenza A (1.73%). Sampel antar area 174, sebanyak 3 sampel positif Influenza A (1.72%). Berdasarkan daerah asal dapat diperoleh angka prevalensi untuk Cianjur yang menunjukkan 1 sampel positif dari 48 sampel DOC (2.08%), Subang 1 sampel positif dari 66 sampel DOC (1.51%) dan Tangerang 1 sampel positif dari 42 sampel DOC (2.38%), sementara itu untuk sampel dari Bogor dan Sukabumi negatif terhadap AI. Sampel kadaver DOC impor dari USA menunjukkan prevalensi virus Influenza A sebesar 3 sampel positif dari 172 sampel kadaver DOC (1.74%).
Penelusuran pengujian RT-PCR pada organ kuning telur dengan 3 macam primer, dilakukan pada 13 sampel negatif AI pada paru-paru dan trakhea yang telah diuji dengan primer matrik (F-Matrik-AI; R-Matrik-AI). Kuning telur diuji menggunakan primer matrix (M-Flu 1; M-Flu 2) menunjukkan 8 sampel positif dan primer matrik (FAI; RAI) menunjukkan 3 sampel positif. Hasil positif berbeda-beda pada setiap pasangan primer, hal ini dapat terjadi karena perbedaan gen penyusun dari masing-masing virus dan perbedaan target annealing dari masing-masing primer. Satu sampel positif matrik dengan primer matrik (FAI; RAI) menunjukkan positif H5 dengan primer H5 (FH5; RH5).
menunjukkan hasil positif AI dengan metode RT-PCR diperoleh isolat virus Avian Influenza.
Penelusuran untuk mengetahui pola penularan AI dilakukan pengujian RT-PCR pada sampel positif dan negatif pada organ paru-paru dan trakhea menggunakan pasangan primer marik dan H5 dari Lee & Suarez (2004). Virus Avian Influenza negatif pada organ trakhea dan paru-paru DOC dengan RT-PCR, tetapi setelah dilakukan penelusuran pada sampel kuning telur menunjukkan hasil yang dubius, positif lemah dan positif (37,5%). Sampel-sampel yang menunjukkan positif pada pooling organ trakhea dan paru-paru tetap menunjukkan hasil yang positif (62,5%). Pooling sampel trakhea dan paru-paru positif matrik setelah diinokulasikan pada TAB-SPF menunjukkan hasil negatif (100%). Sebanyak 100% sampel kuning telur yang positif RT-PCR dengan primer matrik dan H5 menunjukkan hasil positif setelah dilakukan inokulasi pada TAB-SPF. Hasil inokulasi TAB-SPF pada pooling organ paru-paru dan trakhea negatif karena jumlah virus dalam organ tersebut masih sedikit sehingga belum mencapai 1 EID50 (jumlah virus minimal untuk dapat tumbuh pada TAB). Virus
AI pada kuning telur dapat tumbuh pada TAB-SPF karena jumlahnya lebih banyak dari 1 EID50. Penelitian ini menunjukkan adanya fenomena bahwa virus
Avian Influenza dapat ditularkan secara vertikal.
©Hak cipta milik IPB, tahun 2009
Hak cipta ini dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
MELALUI BANDARA SOEKARNO HATTA
MUJIATUN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kesehatan Masyarakat Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nomor Pokok : B 251064084
Disetujui Komisi Pembimbing
Prof. Dr. drh. Retno D Soejoedono MS Dr. drh. Sri Murtini, MSi Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Kesehatan Masyarakat Veteriner
Dr. drh. Denny Widaya Lukman, MSi. Prof. Dr. Ir. Khairil A. Notodiputro, MS.
DETEKSI KEBERADAAN VIRUS AVIAN
INFLUENZA PADA DOC YANG DILALULINTASKAN
MELALUI BANDARA SOEKARNO HATTA
MUJIATUN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Deteksi Keberadaan Virus Avian Influenza pada DOC yang Dilalulintaskan melalui Bandara Soekarno Hatta,
adalah karya saya sendiri, dengan bimbingan para Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2009
MUJIATUN. Detection of Avian Influenza Virus in Day Old Chick (DOC) Transported in Soekarno Hatta Airport. Under direction of RETNO D. SOEJOEDONO and SRI MURTINI.
The aims of this research was detecting and isolating AIV in DOC. Samples were taken from DOC which transported through Soekarno Hatta Airport Quarantine Station. The detect disease method with convenience sampling methods was used with the estimation of prevalence at about 0.9%. The total samples were 346 DOC. There were 58 pooled samples of tracheas and lungs, which collected from 6 DOC per pooled. Afterwards, sera and egg yolks were individually collected. Sera were tested with haemagglutinin inhibition (HI) test. Reverse Transcriptase-Polymerase Chain Reaction (RT-PCR) assays were performed to the pooled tracheas and lungs. This RT-PCR were carried out to prove the presence of Influenza virus A using a pair of matrix primers (F-Matrik-AI; R-Matrik-AI). The samples which were positively AIV detected by RT-PCR assays using matrix primers were tested using H5 primers (F-H5-AI; R-H5-AI). The RT-PCR assays were also generated to the egg yolks. These assays were performed to confirm the absence of AIV in the DOC which were negatively detected by RT-PCR assays. In this detection, three pairs of matrix primers were used (F-Matrik-AI; R-Matrik-AI), (M-Flu 1; M-Flu 2) and (FAI; RAI). The detected matrix protein of AIV in those samples were tested with H5 primers (FH5; RH5) and (HA-1444; H5-1735R). Geometric mean titer (GMT) of the samples were 11.7 while mean titer of the positive AIV were 32. It also identified that 6 of 58 samples were positively detected by AIV matrix primers but negative by H5 primers. Third teen samples negatively detected by matrix primers, 8 samples were positively identified in egg yolks by RT-PCR assays. Influenza virus A were positively identified in those 8 samples using matrix primers (M-Flu 1; M-Flu 2), while 3 of 13 samples were positively detected using different matrix primers (FAI; RAI) and one of them positive by H5 primers (FH5; RH5). The differences between RT-PCR results, it can cause difference of genetic sequences and also resulted from the different target of primer annealing. Also, this research was verifying the possibility of AIV to be transmitted vertically to the DOC. This verification were concluded from the high concentration of AIV detected in egg yolk compared with AIV concentration in tracheas and lungs.
MUJIATUN. Deteksi Keberadaan Virus Avian Influenza pada DOC yang Dilalulintaskan melalui Bandara Soekarno Hatta. Di bawah bimbingan RETNO D. SOEJOEDONO dan SRI MURTINI.
Perpindahan hewan dari suatu daerah/negara ke daerah/negara lain berpotensi menyebarkan penyakit. Salah satu penyakit penting yang bersifat transboundary animal diseases adalah Avian Influenza (AI). Day Old Chick (DOC) diduga berpotensi terinfeksi dan menyebarkan Virus Avian Influenza (VAI) kepada unggas lain melalui importasi dari negara lain dan transportasi dari Jawa ke pulau lain di Indonesia. Peraturan pemerintah yang mengatur pengendalian penyakit AI dituangkan dalam Peraturan Dirjen Peternakan nomor: 46/PD.640/F/08.05. Peraturan tersebut menyatakan bahwa lalu lintas anak ayam umur 1 hari (DOC), anak itik umur 1 hari (DOD), telur dan pakan ternak dari daerah tertular ke daerah bebas dapat diizinkan dengan persyaratan tertentu. Peraturan ini dibuat dengan pertimbangan untuk memenuhi kebutuhan konsumen di daerah bebas yang tidak memiliki peternakan pembibitan karena sentra industri peternakan unggas sebagian besar terletak di Pulau Jawa yang merupakan daerah tertular. Bertolak dari hal tersebut maka penelitian ini dilakukan dengan menggunakan pendekatan metode Detect Diseases.
Penelitian ini bertujuan untuk mendeteksi dan mengisolasi adanya infeksi virus AI pada DOC yang berpotensi menyebarkan virus dari satu daerah/negara ke daerah/negara yang lain. Deteksi keberadaan virus AI dilakukan dengan reverse transcriptase-polymerase chains reaction (RT-PCR). Pengujian untuk pooling sampel organ paru-paru dan trakhea digunakan primer matrik: F-matrik-AI; R-matrik-AI dan H5: F-H5-AI; R-H5-AI (Lee et.al 2001). Setelah diketahui proporsi sampel DOC positif AI, kemudian dilakukan konfirmasi untuk meyakinkan bahwa sampel yang negatif pada organ trakhea dan paru-paru dengan primer Lee et al. (2001) benar-benar negatif. Pengujian dilakukan pada organ kuning telur secara individu dengan 3 jenis primer matrik yaitu: F-Matrik-AI; R-Matrik-AI (Lee et al. 2001), M-Flu 1; M-Flu 2 (Trani et al. 2006) dan FAI; RAI (Lee & Suarez 2004) dilanjutkan dengan 2 jenis primer H5 yaitu FH5; RH5 (Lee & Suarez 2004) dan HA-1444; H5-1735R (WHO 2002). Beberapa sampel positif pada pooling organ trakhea dan paru-paru dilakukan penelusuran pada kuning telur secara individu menggunakan primer matrik: FAI; RAI dan H5: FH5; RH5 (Lee & Suarez 2004). Penelusuran dilakukan untuk mengetahui sumber penularan virus AI pada DOC. Sampel-sampel yang menunjukkan hasil positif AI dilakukan inokulasi pada telur ayam berembrio-specific pathogen free (TAB-SPF) untuk mendapatkan isolat virus AI dari DOC.
Mix, 0.5 µl (0.2 µM) primer forward, 0.5 µl (0.2 µM) primer reverse dan 17 ddH2O. Formulasi reaksi RT-PCR ini berlaku untuk semua jenis primer. Proses
amplifikasi menggunakan mesin Thermal Cycle Sprint Hybaid dan Gene Amp®. Masing-masing reaksi dianalisis dengan menggunakan elektroforesis 135 volt selama 35 menit (Mupid-x Japan) dan elektroforesis 100 volt, 400 mA selama 60 menit (Owl Model OSP-300) dengan konsentrasi agar rose 1.5 % (Invitrogen) dengan pewarnaan ethidium bromida (Sigma), DNA marker 100 bp (Invitrogen dan Fermentas) dan 50 bp (Invitrogen) selanjutnya hasil dibaca dengan UV transilluminator. Sampel-sampel yang menunjukkan hasil dubius, positif lemah dan positif dilakukan inokulasi pada TAB-SPF mengikuti standar OIE (2005). Uji korelasi Spearman digunakan untuk melihat korelasi antara maternal antibodi dengan keberadaan virus AI pada sampel.
Rataan titer maternal antibodi pada sampel adalah 23.5 (11.7). Uji korelasi Spearman antara titer maternal antibodi dengan primer matrik tidak signifikan pada α = 0.05 artinya keberadaan virus Influenza A pada DOC tidak dipengaruhi oleh adanya maternal antibodi. Penelitian ini juga menunjukkan rataan titer antibodi AI dari sampel positif virus dengan uji RT-PCR sebesar 25 (32). Rataan titer dari masing-masing sampel tesebut belum cukup untuk memproteksi unggas terhadap infeksi dan eksresi (shedding) virus AI.
Sejumlah 58 pooling sampel yang diuji terdapat 6 sampel yang menunjukkan positif Influenza A dengan primer matrik (F-Matrik-AI; R-Matrik-AI) tetapi negatif pada pengujian dengan primer H5 (F-H5-AI; R-H5-A1). Jika diasumsikan bahwa dalam 1 pooling organ terdapat sekurang-kurangnya 1 sampel organ DOC mengandung virus Influenza A maka dapat dihitung angka prevalensi. Total sampel 346, sebanyak 6 sampel positif Influenza A (1.73%). Sampel antar area 174, sebanyak 3 sampel positif Influenza A (1.72%). Berdasarkan daerah asal dapat diperoleh angka prevalensi untuk Cianjur yang menunjukkan 1 sampel positif dari 48 sampel DOC (2.08%), Subang 1 sampel positif dari 66 sampel DOC (1.51%) dan Tangerang 1 sampel positif dari 42 sampel DOC (2.38%), sementara itu untuk sampel dari Bogor dan Sukabumi negatif terhadap AI. Sampel kadaver DOC impor dari USA menunjukkan prevalensi virus Influenza A sebesar 3 sampel positif dari 172 sampel kadaver DOC (1.74%).
Penelusuran pengujian RT-PCR pada organ kuning telur dengan 3 macam primer, dilakukan pada 13 sampel negatif AI pada paru-paru dan trakhea yang telah diuji dengan primer matrik (F-Matrik-AI; R-Matrik-AI). Kuning telur diuji menggunakan primer matrix (M-Flu 1; M-Flu 2) menunjukkan 8 sampel positif dan primer matrik (FAI; RAI) menunjukkan 3 sampel positif. Hasil positif berbeda-beda pada setiap pasangan primer, hal ini dapat terjadi karena perbedaan gen penyusun dari masing-masing virus dan perbedaan target annealing dari masing-masing primer. Satu sampel positif matrik dengan primer matrik (FAI; RAI) menunjukkan positif H5 dengan primer H5 (FH5; RH5).
menunjukkan hasil positif AI dengan metode RT-PCR diperoleh isolat virus Avian Influenza.
Penelusuran untuk mengetahui pola penularan AI dilakukan pengujian RT-PCR pada sampel positif dan negatif pada organ paru-paru dan trakhea menggunakan pasangan primer marik dan H5 dari Lee & Suarez (2004). Virus Avian Influenza negatif pada organ trakhea dan paru-paru DOC dengan RT-PCR, tetapi setelah dilakukan penelusuran pada sampel kuning telur menunjukkan hasil yang dubius, positif lemah dan positif (37,5%). Sampel-sampel yang menunjukkan positif pada pooling organ trakhea dan paru-paru tetap menunjukkan hasil yang positif (62,5%). Pooling sampel trakhea dan paru-paru positif matrik setelah diinokulasikan pada TAB-SPF menunjukkan hasil negatif (100%). Sebanyak 100% sampel kuning telur yang positif RT-PCR dengan primer matrik dan H5 menunjukkan hasil positif setelah dilakukan inokulasi pada TAB-SPF. Hasil inokulasi TAB-SPF pada pooling organ paru-paru dan trakhea negatif karena jumlah virus dalam organ tersebut masih sedikit sehingga belum mencapai 1 EID50 (jumlah virus minimal untuk dapat tumbuh pada TAB). Virus
AI pada kuning telur dapat tumbuh pada TAB-SPF karena jumlahnya lebih banyak dari 1 EID50. Penelitian ini menunjukkan adanya fenomena bahwa virus
Avian Influenza dapat ditularkan secara vertikal.
©Hak cipta milik IPB, tahun 2009
Hak cipta ini dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
MELALUI BANDARA SOEKARNO HATTA
MUJIATUN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kesehatan Masyarakat Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nomor Pokok : B 251064084
Disetujui Komisi Pembimbing
Prof. Dr. drh. Retno D Soejoedono MS Dr. drh. Sri Murtini, MSi Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Kesehatan Masyarakat Veteriner
Dr. drh. Denny Widaya Lukman, MSi. Prof. Dr. Ir. Khairil A. Notodiputro, MS.
RIWAYAT HIDUP
Penulis dilahirkan di Kebumen - Jawa Tengah pada tanggal 1 November 1976, merupakan anak pertama dari pasangan Bapak Darudin dan Ibu Sutinah. Penulis menyelesaikan pendidikan Sekolah Dasar pada tahun 1989 di SDN Kaligubug, Prembun, Kebumen dan pada tahun 1992 menyelesaikan pendidikan Sekolah Menengah Pertama di SMP Negeri 2 Prembun. Selanjutnya penulis menyelesaikan Sekolah Menengah Atas di SMAN Prembun dan lulus pada tahun 1995. Tahun 1995 penulis melanjutkan kuliah di Fakultas Kedokteran Hewan Institut Pertanian Bogor dan meraih gelar Dokter Hewan pada tahun 2001.
Pada tahun 2001 sampai 2002 penulis bekerja di Klinik Santa sebagai Dokter Hewan Praktek, tahun 2003 menjadi Dokter Hewan di sekolah berkuda Athena Stables, tahun 2004 bekerja di Laboratorium Kesehatan Hewan Propinsi Banten, pada tahun 2005 Masuk di Badan Karantina Pertanian, Departemen Pertanian dan ditempatkan di Stasiun Karantina Hewan Kelas II Samarinda, pada tahun 2006 penulis dipindahkan ke Balai Besar Karantina Hewan Soekarno Hatta dan pada tahun 2007 sampai sekarang bekerja di Balai Besar Uji Standar Karantina Pertanian, Badan Karantina Pertanian, Departemen Pertanian. Untuk meningkatkan kemampuan teknis dan wawasan tentang laboratorium veteriner, penulis diberi kesempatan untuk mengikuti pelatihan antara lain
PRAKATA
Puji syukur penulis panjatkan ke-hadirat Allah Subhanahu Wata’ala yang telah memberikan rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan tesis ini. Tema yang dipilih dalam penelitian ini adalah Deteksi Keberadaan Virus Avian Influenza pada DOC yang Dilalulintaskan melalui Bandara Soekarno Hatta.
Penghargaan dan terima kasih yang sebesar-besarnya penulis ucapkan kepada Ir. Syukur Iwantoro, MSi, MBA sebagai Kepala Badan Karantina Pertanian periode 2006-2008 dan Ir. Hari Priyono, MSi sebagai Sekretaris Badan Karantina Pertanian periode 2006-2008 beserta Jajarannya atas prakarsa dalam pengadaan beasiswa. Kepala Balai Besar Uji Standar Karantina Pertanian (BBUSKP) beserta staf dan Kepala Balai Besar Karantina Hewan Soekarno Hatta (BBKHSH), Kepala Balai Besar Karantina Pertanian Soekarno Hatta (BBKPSH) dan staf yang telah memfasilitasi penelitian ini. Prof. Dr. drh. Retno D Soejoedono, MS sebagai Ketua Komisi Pembimbing dan Dr. drh. Sri Murtini, MSi sebagai Anggota Komisi Pembimbing, atas segala dukungan, bimbingan, dan arahan terhadap penulis selama penelitian dan penulisan tesis. Tak lupa pula penulis sampaikan ucapan terima kasih kepada Dr. drh. Denny W. Lukman, MSi., selaku Ketua Program Studi Kesehatan Masyarakat Veteriner, Sekolah Pascasarjana Institut Pertanian Bogor; Drh. Sofia Setyawati, MP atas kerjasama dan bantuannya; Drh. Surachmi Setyaningsih, MSc, PhD atas segala bantuannya; Drh. Chairul Basri atas segala informasi dan bantuannya; Drh. Basir Nainggolan sebagai Kepala Balai Karantina Hewan Tanjung Priok periode 2004-2008 beserta staf atas fasilitas transportasinya selama penulis menjalankan kuliah di Program Pasca Sarjana Institut Pertanian Bogor; Drh. Sri Yusnowati atas segala dukungannya; Pak Agus atas bantuannya. Rekan-rekan satu angkatan Kelas Khusus Program Studi Kesehatan Masyarakat Veteriner, Sekolah Pascasarjana Institut Pertanian Bogor tahun 2007, atas kebersamaannya sehingga program ini bisa kita selesaikan bersama-sama. Pak Surya Supir atas dedikasinya mengantarkan kami kuliah.
Ucapan terima kasih yang dalam kepada Ibunda Sutinah, Ayahanda Darudin, Adinda Juniyah, Suami Sapto Subroto, SE serta keluarga besar Bapak Samadi yang telah memberikan dukungan moral dan material dalam menyelesaikan penulisan tesis ini. Terima kasih juga penulis sampaikan kepada semua fihak yang tidak dapat kami sebutkan satu-persatu, yang telah membantu dalam kelancaran studi dan penelitian ini.
Pada kesempatan ini penulis menyampaikan permohonan maaf yang sebesar-besarnya apabila terdapat kesalahan selama penelitian, pembimbingan dan penulisan tesis. Atas segala kebaikan yang telah penulis terima semoga Allah SWT berkenan melimpahkan rahmat dan ridha-Nya kepada kita semua. Harapan penulis semoga tulisan ini dapat bermanfaat untuk meningkatkan ilmu pengetahuan kita semua. Amien.
x DAFTAR TABEL ……… xii
DAFTAR GAMBAR ……… xiii
PENDAHULUAN ………... 1
TINJAUAN PUSTAKA ………... 3
Day Old Chick (DOC) ……… 3 Virus Avian Influenza ……… 4 Penyebaran dan Transmisi Virus Avian Influenza ……….. 7 Patogenesitas Virus AI ………... 8 Pengendalian Avian Influenza ……… 10 Diagnosa Laboratorium Virus Avian Influenza ………... 11
BAHAN DAN METODA ……… 13 Waktu dan Tempat Penelitian ………. 13 Rancangan Percobaan ……….. 13 Uji Serologi Antibody terhadap Antigen H5 ………... 14 Pembuatan RBC 1% ………... 14
Haemaglutination (HA) Test ... 15 Pembuatan Suspensi Virus Standar ... 16 Haemaglutination Inhibition (HI) Test ………... 16 Identifikasi Virus Avian Influenza ……….. 16 Preparasi Sampel ………... 17 Isolasi RNA Virus ………. 17
Runing pada Thermal Cycle ……….. 18 Elektroforesis Hasil RT-PCR pada Gel Agarose 1.5% ... 19 Isolasi Virus Avian Influenza ……….. 20
xi DAFTAR PUSTAKA ………... 41
xii 1 Primer yang digunakan dalam pengujian RT-PCR ……….. 18
2 Hasil sampel DOC yang di ambil di Instalasi Karantina Hewan BBKP-SH dan gudang pemberangkatan dan kedatangan Bandara
Soekarno Hatta ... 21
3 Data sampel positif matriks Influenza A pada sampel DOC dari
Bandara Soekarno Hatta ... 23
4 Penelusuran virus AI dengan berbagai primer pada kuning telur ... 27
5 Konfirmasi pengujian pada sampel kuning telur ... 29
6 Hasil inokulasi pada TAB-SPF dari sampel organ paru-paru dan
trakhea yang positif RT-PCR AI ……….. 30
7 Hasil inokulasi (pasase-1) pada TAB-SPF dari sampel kuning telur yang positif RT-PCR AI ……….. 31
8 Hasil inokulasi (pasase-2) pada TAB-SPF dari sampel kuning telur
yang positif RT-PCR AI ………... 32
xiii 1 Anatomi Virus Influenza A (Subbarao & Joseph 2007)……….. 5
2 Proporsi sampel positif Influenza A ... 25
3 Hasil elektroforesis produk RT-PCR dengan primer matrik: F-matrik-AI; R-Matrik AI (Lee et al. 2001) pada 200 base pairs (bp) ... 26
4 Hasil elektroforesis produk RT-PCR dengan primer matrik: M-Flu 1; M-Flu 2 (Trani et al. 2006) pada 154-172 bp ……… 27
5 Hasil elektroforesis produk RT-PCR dengan primer H5: FH5; RH5
(Lee & Suarez 2004) pada 55 bp ... 28
6 Hasil elektroforesis produk RT-PCR dari inokulasi pada TAB-SPF (pasase ke-1) dengan primer matrik : FAI; RAI (Lee & Suarez 2004) pada 55 bp ... 31
7 Hasil elektroforesis produk RT-PCR dari inokulasi pada TAB-SPF (pasase ke-2) dengan primer matrik: FAI; RAI (Lee & Suarez 2004) pada 55 bp ... 32
8 Hasil elektroforesis produk RT-PCR dari penelusuran sampel kuning telur dengan primer matrik: FAI; RAI (Lee & Suarez 2004) pada 55
bp ... 35
PENDAHULUAN
Perdagangan hewan hidup antar negara, antar pulau maupun antar benua sudah berlangsung sejak puluhan tahun. Perpindahan ternak dan hewan piaraan dari satu negara/daerah ke negara/daerah lain sejalan dengan perpindahan manusia. Perpindahan hewan tersebut selain memindahkan hewan, juga berpotensi menyebarkan penyakit. Perpindahan hewan dapat terjadi dari satu tempat ke tempat lain secara cepat maupun lambat tergantung sarana transportasi yang digunakan.
Salah satu penyakit menular yang sangat mudah menyebar (transboundary animal diseases) adalah Avian Influenza. Peraturan pemerintah yang mengatur pengendalian penyakit AI dituangkan dalam Peraturan Dirjen Peternakan nomor: 46/PD.640/F/08.05. Peraturan tersebut menyatakan bahwa lalu lintas anak ayam umur 1 hari (DOC), anak itik umur 1 hari (DOD), telur dan pakan ternak dari daerah tertular ke daerah bebas dapat diizinkan dengan persyaratan tertentu. Peraturan ini dibuat dengan pertimbangan untuk memenuhi kebutuhan konsumen di daerah bebas penyakit AI. Sebagian besar daerah bebas tersebut tidak memiliki peternakan pembibitan karena sentra industri peternakan unggas terletak di Pulau Jawa yang merupakan daerah tertular. Beberapa ahli melihat adanya pola penyebaran AI di Indonesia berbanding lurus dengan pola penyebaran dan perdagangan DOC.
Anak ayam (DOC) komersial tidak lazim terinfeksi virus H5N1 saat menetas. Telur yang telah terinfeksi secara vertikal dari induknya memiliki daya tetas rendah. Anak ayam (DOC) dapat tertular virus AI akibat terkontaminasi dari alat angkut (FAO (2008). Wibawan (2006) menyatakan kondisi virus AI saat ini sudah berbentuk infeksi subklinik, yang berarti bahwa hewan terinfeksi namun tidak menunjukkan gejala klinis sakit. Adanya penyakit yang tidak terdeteksi dengan tepat menyebabkan meluasnya penyakit di lapangan.
dan menyebarnya penyakit hewan ke Wilayah Indonesia melalui tindakan pengawasan lalu lintas hewan dan produk hewan. Salah satu penjabaran tugas karantina sebagai instansi pencegah masuk dan menyebarnya penyakit hewan ke Wilayah Indonesia adalah melalui kaji tindak deteksi dan diagnosa penyakit. Diagnosa penyakit secara laboratorium menjadi dasar ilmiah dalam tindakan karantina dan kebijakan lalu lintas hewan. Penelitian untuk mendeteksi adanya penyakit AI subklinis pada DOC sangat penting dengan pengambilan sampel yang benar sesuai dengan kaidah-kaidah virologi dan epidemiologi.
TINJAUAN PUSTAKA
Day Old Chick (DOC)
Anak ayam umur sehari atau Day old chick (DOC) adalah unggas yang menetas pada umur 2 jam atau beberapa jam dan atau sebelum makan (Ministry of Food, Agriculture and Cooperative Pakistan 1985). Anak ayam ini merupakan bibit pada peternakan ayam baik peternakan final stock (FS) yang meliputi ayam pedaging dan petelur maupun parent stock (PS). Beberapa negara produsen bibit ayam pedaging diantaranya Amerika (Cobb, Arbor Arcres, Avian), Prancis (Isa Vedette, Shaper Ross), Inggris (Ross) dan Belanda (Hybro, Hubbard). Negara produsen bibit ayam pedaging di Asia, contohnya Thailand (Fadilah (2005).
Bibit ayam yang sehat merupakan salah satu kunci dalam keberhasilan industri peternakan. Ciri-ciri DOC yang berkualitas baik adalah: bebas dari penyakit terutama pulorum, omphalitis dan jamur, DOC terlihat aktif, kakinya besar dan basah seperti berminyak, bulu cerah dan penuh, pantatnya tidak kotor atau tidak terdapat pasta putih, beratnya tidak kurang dari 37 gram. Kualitas DOC yang jelek memiliki ciri-ciri kaki kering, omphalitis, tubuh kerdil dan berat badan tidak merata (Fadilah 2005).
Beberapa negara menerapkan standar pengiriman DOC, Pakistan mensyaratkan DOC harus berasal dari telur yang beratnya tidak kurang dari 48 gram. Anak ayam tersebut juga harus berasal dari peternakan yang telah disertifikasi bebas pulorum, negatif terhadap Salmonella sp dan Aspergillosis, jumlah E. coli tidak lebih dari 10 CFU per gram, bebas dari cacat fisik dan luka, hasil uji pulorum negatif, lincah dan sehat (Ministry of Food, Agriculture and Cooperative Pakistan 1985).
Virus Avian Influenza
Virus Avian Influenza (AI) termasuk ke dalam anggota dari famili Orthomixoviridae dan masuk dalam genus influenza virus A. Famili Orthomixoviridae memiliki 3 genus yaitu virus Influenza A, B dan C berdasarkan karakter antigenik protein M dalam envelope virus dan nukleoprotein. Virus Influenza A memiliki 16 antigen hemaglutinin (H1-H16) dan 9 antigen neuraminidase (N1-N9) dan jika dikombinasikan akan membentuk 144 subtipe. Virus Influenza merupakan virus RNA untai tunggal segmen negatif (OIE 2005, WHO 2002 dan Barrett and Inglis, 1985). Influenza A bersifat patogen terhadap kuda, babi, cerpelai Amerika (mink), anjing laut, ikan paus, unggas dan manusia. Influenza B hanya patogen pada manusia dan Influenza C menginfeksi manusia dan babi tetapi jarang menyebabkan sakit yang serius (WHO 2002 dan Murphy et al. 1999).
Gambar1. Anatomi Virus Influenza A (Subbarao & Joseph 2007)
Virus Influenza A yang menginfeksi unggas dapat dibagi ke dalam dua kelompok berdasarkan kemampuan virus menyebabkan penyakit. Virus yang sangat virulen disebut highly pathogenic Avian Influenza (HPAI), infeksinya bersifat sistemik, dengan mortalitas pada flok pada beberapa spesies rentan dapat mencapai 100% (Capua and Maragon 2007). Terminologi highly pathogenic Avian Influenza dan fowl plague merupakan infeksi dari strain virulen influenza A yang diisolasi dari unggas domestik. Isolat highly pathogenic Avian Influenza diklasifikasikan ke dalam notifiable Avian Influenza (NAI). Isolat strain virulen pada saat ini berasal dari subtipe H5 atau H7, namun sebagian besar H5 dan H7 memiliki virulensi rendah. Penyebab perubahan virulensi pada H5 dan H7 dapat terjadi akibat mutasi pada induk semang unggas, sehingga semua subtipe H5 dan H7 diklasifikasikan sebagai NAI virus (OIE 2005).
Beberapa virus AI (H1-H16) yang memiliki multibasic cleavage site pada gen H yang berada di alam hidup di dalam tubuh burung liar. Interaksi unggas liar dengan unggas air di alam memungkinkan virus AI ditularkan diantara kedua populasi unggas tersebut. Unggas air merupakan inang alami yang menjadi sumber penularan virus bagi hewan lain. Interaksi unggas liar dengan unggas peliharaan menyebabkan virus ini menyebar dalam populasi unggas tersebut. Penyebaran virus pada unggas peliharaan menimbulkan infeksi lokal, gejala sakit ringan seperti gangguan pernafasan, depresi dan masalah produksi telur pada unggas petelur. Teori yang berkembang saat ini menyatakan bahwa virus HPAI berasal dari LPAI H5 dan H7 yang mengalami mutasi atau rekombinasi, yang menyebabkan perubahan gen daerah cleavage site dari protein haemaglutinin (HA) (Capua and Maragon 2007). Kejadian wabah HPAI di Chile dan Kanada disebabkan oleh virus H7 yang bermutasi menjadi HPAI melalui rekombinasi melibatkan nukleoprotein dan gen matrik. Kejadian ini merupakan laporan pertama rekombinasi berasosiasi dengan kenaikan virulensi virus AI (Senne 2007). Introduksi pada populasi burung domestik, menyebabkan bentuk virus menjadi low-pathogenicAvian Influenza (LPAI).
Penyebaran dan Transmisi Virus Avian Influenza
Beberapa faktor yang berperan dalam transmisi virus AI antara lain buruknya biosekuriti pada sistem peternakan, keluar masuknya unggas dan produknya, perdagangan hewan hidup di pasar. Air di kolam atau genangan air memungkinkan virus bertahan di luar induk semang, sehingga dapat menjadi sumber penyebaran virus. Migrasi unggas liar pembawa virus low-pathogenic Avian Influenza (LPAI) maupun highly pathogenic Avian Influenza (HPAI) berperan dalam penyebaran virus ini (Goutard et al. 2007).
Populasi itik di Cina dan Vietnam sangat banyak mencapai 70% populasi itik dunia. Sistem pemeliharaan dengan cara diumbar di kedua negara tersebut menjadi masalah kritis dalam epidemiologi AI karena beberapa itik peliharaan dapat membawa HPAI dalam waktu pendek dan tidak ada penerapan biosekuriti dalam pemeliharaan tersebut. Hal ini berpotensi terjadi pertukaran virus antara itik dengan unggas liar. Itik tersebut banyak yang dijual di pasar unggas hidup yang bercampur dengan spesies unggas darat (Sims 2007). Para ahli biodiversiti menyimpulkan bahwa perdagangan global burung sebagai hewan kesayangan berperan dalam perpindahan virus secara besar-besaran. Jalur penularan AI antara lain melalui migrasi burung liar, perdagangan unggas peliharaan dan unggas liar (Kilpatrick et al. 2006 dalam Daszak and Chmura 2008).
Patogenesitas Virus AI
Mekanisme yang berperan dalam membedakan beberapa strains Avian Influenza lebih virulen dari strain yang lainnya dijelaskan oleh Rudolf Rott, Christof Scholtissek dan kolega-kolega dari Fakultas Kedokteran Hewan Justus Liebig University, Giesen, Germany. Mereka menemukan bahwa haemaglutinin virus sangat penting dalam determinasi virulensi virus, kombinasi atau konstelasi kontribusi gen termasuk gen nukleoprotein dan polymerase (Murphy et al. 1999). Daerah pemotongan (cleavage site) HA menjadi sub unit HA1 dan HA2 menentukan patogenesitas VAI. Proteolisis HA pada daerah pemotongan bersifat spesifik dan spesifisitas protease membatasi distribusi jaringan yang dapat diinfeki virus ini. Kebanyakan AI tidak virulen atau patogenitas rendah mempunyai daerah pemotongan satu asam amino basa, namun strain patogenitas tinggi mempunyai daerah pemotongan lebih dari satu asam amino (Munch et al. 2001).
Haemaglutinin cleavability tergantung dari struktur primer dari daerah terjadinya pemotongan (cleavage site) dan keberadaan protease yang sesuai pada jaringan target tempat pemotongan. Di sel epitel saluran pernafasan dan pencernaan, haemagglutinin dari semua virus influenza yang masuk dipotong oleh protease inang, mengaktivasi terjadinya fusi dan masuknya virus ke dalam sel. Hanya pemotongan hemagglutinin dari virus virulen yang menimbulkan penyakit sistemik dan kematian. Fenomena ini tidak hanya berdasarkan perbedaan strain virus tetapi juga kepekaan atau resistensi dari spesies unggas. Patogenesa AI berbeda pada mamalia, dalam hal ini replikasi virus di saluran pencernan sama baiknya dengan replikasi virus di saluran pernafasan. Infeksi dari strain yang sangat virulen menimbulkan viremia, infiltrasi sel-sel limfoid multifokal dan nekrosis visera, menimbulkan pancreatitis, myocarditis, myositis dan encephalitis (Murphy et al. 1999).
Infeksi HPAI H5N1 strain Thailand pada ayam (Gallus gallus ), puyuh (Coturnix coturnix japonica) dan itik (Anas spp.) menunjukkan adanya konsentrasi virus pada organ paru-paru, trakhea, jantung, hati, limpa, pankreas, rektum, ginjal, otak, otot skeletal, duodenum dan indung telur dengan metode indirect immunofluorescence assay. Pada ayam dan puyuh, antigen nukleoprotein virus dideteksi dalam jumlah paling besar pada organ jantung 88% (ayam) dan 89% (puyuh), saluran nafas, pencernaan dan saluran urinasi. Pada itik virus hanya ditemukan pada organ respirasi sehingga memberikan dukungan terhadap hipothesis bahwa jalur transmisi virus HPAI dari spesies ini melalui aerosol dan oral (Antarasena 2006).
Pengendalian Avian Influenza
Murphy et al. (2001) menyebutkan kontrol terhadap AI dibagi ke dalam tiga tingkatan yaitu international, nasional dan lokal:
1. Tingkat international, suatu negara harus melaporkan kejadian wabah penyakit. “Fowl Plague” atau AI merupakan penyakit list A dalam International Animal Health Code dari Office Internationale des Epizooties; penyakit ini notifiable dan restriksi dalam perpindahan unggas dan ayam produksi. Kesuksesan eradikasi secara international tergantung pada kesadaran setiap negara untuk melaporkan adanya wabah di negaranya.
2. Tingkat nasional, banyak negara menerapkan regulasi yang bertujuan untuk mencegah masuk dan menyebarnya virus ini. Kebijakan meliputi penghentian perdagangan untuk mencegah masuknya unggas yang terinfeksi atau produk unggas dari suatu negara yang tidak mendeklarasikan bebas virus AI. Amerika Serikat, Australia dan hampir seluruh negara Eropa menerapkan bahwa virus AI virulen masuk ke dalam penyakit eksotik; diterapkan tindakan diagnosa, karantina dan pemusnahan. Penyebaran sekunder diminimalisir dengan kebijakan higiena yang ketat meliputi pembersihan dan desinfeksi dalam interval pemotongan dan depopulasi serta melakukan kontrol perpindahan manusia dan hewan.
investigasi epidemiologi dan managemen database. Pengujian klinis dan laboratorium dilakukan pada peternakan pembibitan kalkun sekali seminggu dalam periode selama tindakan karantina. Tindakan stamping out dilakukan dengan pemusnahan unggas dan peralatan peternakan. Membentuk zona infeksi seluas 3 km dan melakukan surveillance sepanjang 10 km diantara peternakan-peternakan yang terinfeksi. Pengujian dilakukan pada unggas di peternakan-peternakan, ayam kampung, unggas di kebun binatang dan unggas-unggas liar. Pembersihan, desinfeksi dan metode deteksi silent infeksi dilakukan oleh industri perunggasan dan dinas terkait. Kegiatan dilakukan dengan pengujian serologi dan uji sentinal di peternakan tersangka. Kebijakan tersebut di atas dapat membebaskan Chile dari AI dalam 7 bulan setelah virus terdeteksi (Max et al. 2007).
Diagnosa Laboratorium Virus Avian Influenza
laoryl sarcosinate buffered sampai pH 9.0 dengan 0.5 M glycine. Konsentrat terdiri dari nukleokapsid dan matrik polipeptida. Preparasi yang kaya nukleokapsid antigen dapat berasal dari membran korioalantois yang digunakan pada AGID test. Membran korioalantois diambil dari telur yang telah diinfeksi. Membran tersebut dihomogenisasi, diikuti dengan freeze-thawing berkali-kali, kemudian disentrifugasi pada 1000 g selama 10 menit. Pelet dibuang dan supernatan digunakan sebagai antigen dengan menambahkan 0.1 % formalin. Uji serologi lain untuk mengidentifikasi virus AI adalah menggunakan uji HI.
Berbagai kit enzyme linked immunosorbent assay (ELISA) menggunakan monoklonal antibodi terhadap Influenza A juga banyak tersedia sebagai kit komersial. Alternatif diagnosa, menggunakan reverse transcriptase-polymerase chains reaction (RT-PCR) dengan primer nukleoprotein spesifik atau matrik spesifik. Keberadaan virus influenza subtipe H5 atau H7 juga dapat dikonfirmasikan menggunakan primer H5 dan H7 (OIE 2005).
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian telah dilakukan mulai bulan Juni 2008 sampai Januari 2009. Pengambilan sampel DOC dilakukan di gudang keberangkatan domestik dan kedatangan international Bandara Soekarno Hatta dan di Instalasi DOC Balai Besar Karantina Pertanian Soekarno Hatta (BBKPSH). Preparasi sampel dilakukan di Laboratorium BBKPSH dan Balai Besar Uji Standar Karantina Pertanian (BBUSKP). Pengujian laboratorium dilakukan di Laboratorium Virologi dan Biologimolekuler Karantina Hewan BBUSKP dan Unit Pelayanan Terpadu Bagian Mikrobiologi Medik, Departemen Ilmu Penyakit Hewan Fakultas Kedokteran Hewan Institut Pertanian Bogor (FKH IPB).
Rancangan Percobaan
Pengambilan sampel mengunakan rumus Detect Diseases dengan prevalensi dugaan 0.9% lebih besar dari prevalensi sampel DOC positif PCR AI yang diuji di BBUSKP pada tahun 2007 sebesar 0.27%. Diasumsikan dengan prevalensi dugaan lebih tinggi dan dengan metode sampling terencana akan mendapatkan jumlah sampel positif lebih banyak dari sampel-sampel yang dikirim ke laboratorium BBUSKP.
Thrusfield (2005) menyebutkan rumus untuk mendetekai penyakit: n = [1-(1-p)1/d] [N-d/2]+1]
N = jumlah populasi DOC n = jumlah DOC
d = jumlah DOC yang sakit dalam populasi (didapat dari prevalensi x jumlah populasi DOC)
p = tingkat konfidensi.
332 ekor DOC maka sampling yang dilakukan sebanyak 56 shipment dalam 4 bulan pertama penelitian. Sampel DOC yang masih hidup diambil darahnya intrakardial untuk mendapatkan serum dan selanjutnya DOC dimatikan. Kadaver DOC dilakukan bedah bangkai dan diambil organ trakhea dan paru-paru (pooling) mengikuti standar WHO (2002). Pooling organ masing-masing sebanyak 6 sampel organ DOC tiap-tiap shipment. Organ kuning telur dikumpulkan secara individu.
Pengujian RT-PCR dilakukan setelah kegiatan pengambilan sampel selesai. Pengujian tersebut dilakukan pada campuran organ paru-paru dan trakhea untuk setiap pooling sampel menggunakan primer matrik: F-Matrik-AI; R-Matrik-AI (Lee et al. 2001). Sampel positif matrik dilanjutkan pengujian dengan primer H5: F-H5-AI; R-H5-AI (Lee et al. 2001). Beberapa data pendukung antara lain: asal daerah/negara, tujuan dan tanggal menetas. Uji statistik yang digunakan adalah korelasi titer antibodi dengan keberadaan virus AI, proporsi sampel positif virus AI dan deskriptif statistik.
Percobaan lanjutan untuk menelusuri virus AI dilakukan pada kuning telur DOC. Pada sampel dengan hasil negatif AI pada paru-paru dan trakhea dengan primer matrik: F-Matrik-AI; R-Matrik-AI (Lee et al. 2001), dilakukan menggunakan 3 macam primer matrik: F-Matrik AI; R-Matrik-AI (Lee et al. 2001), M-Flu 1; M-Flu 2 (Trani et al. 2006), FAI; RAI (Lee & Suarez 2004) dan 2 macam primer H5: HA1144; H5-1735 (WHO 2002) dan FH5; RH5 (Lee & Suarez 2004) untuk meyakinkan bahwa sampel yang diuji benar-benar negatif. Penelusuran keberadaan virus AI pada sampel positif AI pada paru-paru dan trakhea dengan primer matrik: F-Matrik-AI; R-Matrik-AI (Lee et al. 2001), menggunakan pasangan primer matrik: FAI; RAI dan primer H5: FH5; RH5 (Lee & Suarez 2004). Sampel-sampel yang menunjukkan hasil dubius, positif lemah dan positif dilakukan isolasi virus pada TAB-SPF.
Uji Serologi Antibodi terhadap Antigen H5 Pembuatan RBC 1%
dengan perbandingan 1:1. Suspensi darah dicuci dengan PBS 0.01 M pH 7.0-7.2 dengan cara menambahkan PBS ke dalam suspensi RBC tersebut secukupnya sampai tabung sentrifus hampir terisi penuh, kemudian dihomogenkan. Selanjutnya disentrifugasi selama 5-10 menit dengan kecepatan 1500 g. Supernatan PBS dibuang dan juga lapisan leukositnya (lapisan berwarna kelabu yang terletak di atas permukaan RBC) dengan jalan menghisapnya dengan Pipet Pasteur. Pencucian RBC dengan PBS dilakukan sebanyak 4 kali sampai RBC benar-benar bersih, leukositnya habis terbuang dan PBS pencuci tidak berwarna merah (bening). Endapan RBC tersebut dibuat suspensi RBC 10%, yaitu dengan menambah PBS 9 kali banyaknya endapan RBC. Suspensi RBC 10% dibuat RBC 1 % dengan mengambil 1 bagian RBC 10% dan ditambahkan 9 bagian PBS.
Haemaglutination (HA) Test
Uji yang digunakan adalah Haemaglutination Test (HA) atau uji haemaglutinasi, menggunakan Ag AI 4 haemaglutination unit (HAU) Isolat Balitvet tahun 2005 mengikuti metode standar Office International des Epizooties (OIE 2005). Uji HA berdasarkan kemampuan virus AI untuk mengaglutinasi sel darah merah ayam. Uji HA direkomendasikan menggunakan microplate dasar V dengan volume akhir 100 μl. Reagen yang diperlukan antara lain larutan PBS isotonik 0.01 M, pH 7.0-7.2, Antigen AI (H5N1), red blood cell (RBC) 1 % dengan antikoagulan alsevers.
Pembuatan Suspensi Virus Standar
Cara membuat suspensi virus standar 4 HAU dalam 25 μl: misal aglutinasi terakhir hasil uji HA terjadi pada sumur ke 5 atau pada pengenceran 25 = 32 berarti terdapat 32 HA Unit / 25 μl. Jika akan mendapatkan virus dengan jumlah 4 HAU / 25 μl, maka perhitungannya adalah 25-22 = 23= 8. Jadi virus stok diencerkan 1 bagian virus ditambah 7 bagian larutan PBS.
Haemaglutination Inhibition (HI) Test
Uji HI atau penghambatan haemaglutinasi, merupakan salah satu uji serologis berdasarkan atas hambatan serum terhadap haemaglutinasi antigen virus AI, titer serum ditentukan berdasarkan atas hambatan serum pada pengenceran tertinggi masih mampu menghambat antigen (4 HAU) mengaglutinasi sel darah merah. Kontrol positif antigen dan antisera harus disertakan dalam setiap pengujian.
Larutan PBS dimasukkan ke dalam sumur-seumur microplate sebanyak 25 μl, ditambahkan 25 μl serum sampel ke dalam sumur pertama microplate dan dilakukan pengenceran seri sampai sumur ke-11. Antigen AI 4 HAU ditambahkan pada setiap sumur, kecuali pada sumur ke 12, kemudian dicampur. Plate diinkubasikan pada suhu kamar selama 30 menit atau 40 menit pada suhu 20oC, kemudian ditambahkan 25 μl RBC 1% ke dalam setiap sumur. Komponen-komponen tersebut dicampur pada cawan mikro (microplate) dan inkubasi selama 30 menit pada suhu kamar.Hasil penilaian jika telah terjadi endapan pada sumur kontrol maka dimulai pembacaan serum. Serum yang positif mengandung antibodi AI (H5N1) ditandai endapan seperti sumur kontrol (bentuk air mata jauh/tear shaped streaming). Titer serum ditentukan dari pengenceran serum tertinggi yang masih mampu penghambat antigen 4 HAU untuk mengaglutinasi sel darah merah ayam.
Identifikasi Virus Avian Influenza
Preparasi Sampel
Pada penelitian dilakukan pengumpulan (pooling) organ paru-paru dan trakhea (terdiri dari 6 sampel) di homogenisasi dengan Homogenizer (Silent Cruizer) 10.000 g selama 2 menit, disentrifugasi 3000 g selama 5 menit dan diambil supernatannya. Kuning telur dilarutkan dalam PBS pH 7.2-7.4 (1:1), dihomogenisasi dengan kloroform (1:2), diinkubasi 30 menit, disentrifugasi 3000 g selama 15 menit dan diambil supernatannya.
Supernatan tersebut dilakukan ekstraksi dengan TRIzol-LS (Invitrogen Cat No. 10296-010).
Isolasi RNA Virus
dengan 20 µl RNAse free water. Suspensi RNA dapat langsung digunakan atau dapat disimpan pada temperatur -20oC.
Runing pada Thermal Cycle
Reverse transcription (RT) adalah pembuatan cDNA yang bersifat komplementer dengan RNA virus, menggunakan enzim reverse transcriptase-polymerase chains reaction (RT-PCR) merupakan metode alternatif untuk mengidentifikasi virus AI, meskipun material genetik virus hanya terdapat dalam jumlah sedikit (WHO 2002). Reverse transcriptase-polymerase chains reaction
(RT- PCR) menggunakan Superscript TM One-Step RT-PCR with Platinum ® Taq (Invitrogen Cat. No. 10928-034) dengan total reaksi 25 µl yang mengandung 12.5 µl 2x Reaction Mix, 3 µl RNA, 0.5 µl RT/Platinum® Taq Mix, 0.5 µl (0.2 µM) primer forward, 0.5 µl (0.2 µM) primer reverse dan 8 ddH2O. Formulasi reaksi
[image:44.612.131.523.391.700.2]RT-PCR ini berlaku untuk semua jenis primer.
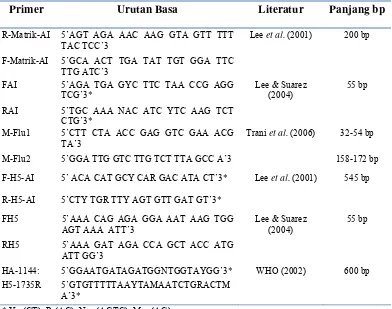
Tabel 1. Primer yang digunakan dalam pengujian RT-PCR
Primer Urutan Basa Literatur Panjang bp
R-Matrik-AI 5’AGT AGA AAC AAG GTA GTT TTT TAC TCC’3
Lee et al. (2001) 200 bp
F-Matrik-AI 5’GCA ACT TGA TAT TGT GGA TTC TTG ATC’3
FAI 5’AGA TGA GYC TTC TAA CCG AGG
TCG’3*
Lee & Suarez (2004)
55 bp
RAI 5’TGC AAA NAC ATC YTC AAG TCT
CTG’3*
M-Flu1 5’CTT CTA ACC GAG GTC GAA ACG
TA’3
Trani et al. (2006) 32-54 bp
M-Flu2 5’GGA TTG GTC TTG TCT TTA GCC A’3 158-172 bp
F-H5-AI 5’ ACA CAT GCY CAR GAC ATA CT’3* Lee et al. (2001) 545 bp
R-H5-AI 5’CTY TGR TTY AGT GTT GAT GT’3*
FH5 5’AAA CAG AGA GGA AAT AAG TGG
AGT AAA ATT’3
Lee & Suarez (2004)
55 bp
RH5 5’AAA GAT AGA CCA GCT ACC ATG
ATT GG’3
HA-1144: 5’GGAATGATAGATGGNTGGTAYGG’3* WHO (2002) 600 bp
H5-1735R 5’GTGTTTTTAAYTAMAATCTGRACTM
A’3*
Program RT-PCR untuk setiap primer sebagai berikut:
1. Primer Lee et al. (2001): 60oC --- 30 menit dan 95oC ---- 2 menit ( pre-denaturasi) sebanyak satu siklus; PCR amplifikasi pada suhu 95oC selama 40 detik (denaturasi), suhu 50oC selama 40 detik (annealing) dan suhu 72oC selama 1 menit (extension) diulang sampai 35 siklus dan 72oC selama 4 menit (final extension) dan 15oC untuk rest, 1 siklus.
2. Primer Lee and Suarez (2004): 48oC --- 30 menit dan 95 derajat---10 menit (pre-denaturasi) masing masing 1 satu siklus; 95 derajat---15 detik (denaturasi); 60 derajat---1 menit (annealing) dan 72 derajat---1 menit (extension) diulang sampai 40 siklus; 72 derajat --- 4 menit (final extension) dan 15 derajat untuk rest, 1 siklus.
3. Primer Trani et al. (2006): 60oC---2 menit; 50oC --- 30 menit dan 94 derajat---4 menit (pre-denaturasi) masing-masing 1 siklus; 95 derajat---45 detik (denaturasi); 60 derajat---30 detik (annealing) dan 72 derajat---2 menit (extension) diulang sampai 35 siklus; 72 derajat --- 2 menit (final extension) dan 15 derajat untuk rest, 1 siklus.
4. Primer WHO (2002): 60oC---2 menit dan 50oC --- 30 menit (pre-denaturasi) masing masing 1 satu siklus; 94 derajat---45 detik (denaturasi); 56 derajat---45 detik (annealing) dan 72 derajat---2 menit (extension) diulang sampai 35 siklus; 72 derajat --- 10 menit (final extension) dan 15 derajat untuk rest, 1 siklus.
Proses amplifikasi menggunakan mesin Thermal Cycle Sprint Hybaid dan Gene Amp® PCR System 9700 Aplied Biosystem.
Elektroforesis Hasil RT-PCR pada Gel Agarose 1.5%
membeku. Setelah membeku gel dimasukkan ke elektroforesis (Mupid-x Japan) atau elektroforesis (Owl Model OSP-300) yang telah diisi dengan larutan buffer TBE 1x sampai semua gel terendam. Sebanyak 6 µl produk PCR dicampur dengan 1 µl loading dye (Invitrogen) kemudian dimasukkan ke dalam sumur-sumur pada gel. Marker DNA digunakan 100 bp (Invitrogen, Fermentas) dan 50 bp (Invitrogen) disesuaikan dengan letak produk PCR dari masing-masing primer. Marker DNA dicampur dengan loading dye dan aquades dengan perbandingan marker DNA: loading dye : aquades (1:1:8). Setiap satu kali elektroforesis digunakan 1 sumur marker DNA sebanyak 5 µl. Running dilakukan pada 135 volt selama 35 menit (Mupid-x Japan) dan 100 volt, 400 mA selama 60 menit (Owl Model OSP-300). Keberadaan pita-pita DNA produk PCR diamati di atas UV transillumination (Vilber Lourmat, France). Hasil positif ditunjukkan adanya pita berwarna jingga pada gel agarose (dimodifikasi dari Payungporn et al. 2004).
Isolasi Virus Avian Influenza
HASIL DAN PEMBAHASAN
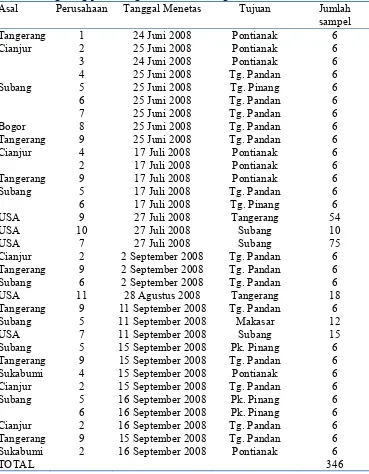
[image:47.612.135.504.225.699.2]Sejumlah 346 sampel DOC diperoleh dari ayam yang diimport maupun pengiriman domestik (antar area). Sampel domestik berasal dari berbagai daerah di Jawa Barat dengan tujuan berbagai pulau di luar Jawa (Tabel 2).
Tabel 2. Hasil sampel DOC yang diambil di Instalasi Karantina Hewan BBKP-SH dan gudang pemberangkatan dan kedatangan Bandara Soekarno Hatta
Asal Perusahaan Tanggal Menetas Tujuan Jumlah
sampel
Tangerang 1 24 Juni 2008 Pontianak 6
Cianjur 2 25 Juni 2008 Pontianak 6
3 24 Juni 2008 Pontianak 6
4 25 Juni 2008 Tg. Pandan 6
Subang 5 25 Juni 2008 Tg. Pinang 6
6 25 Juni 2008 Tg. Pandan 6
7 25 Juni 2008 Tg. Pandan 6
Bogor 8 25 Juni 2008 Tg. Pandan 6
Tangerang 9 25 Juni 2008 Tg. Pandan 6
Cianjur 4 17 Juli 2008 Pontianak 6
2 17 Juli 2008 Pontianak 6
Tangerang 9 17 Juli 2008 Pontianak 6
Subang 5 17 Juli 2008 Tg. Pandan 6
6 17 Juli 2008 Tg. Pinang 6
USA 9 27 Juli 2008 Tangerang 54
USA 10 27 Juli 2008 Subang 10
USA 7 27 Juli 2008 Subang 75
Cianjur 2 2 September 2008 Tg. Pandan 6
Tangerang 9 2 September 2008 Tg. Pandan 6
Subang 6 2 September 2008 Tg. Pandan 6
USA 11 28 Agustus 2008 Tangerang 18
Tangerang 9 11 September 2008 Tg. Pandan 6
Subang 5 11 September 2008 Makasar 12
USA 7 11 September 2008 Subang 15
Subang 5 15 September 2008 Pk. Pinang 6
Tangerang 9 15 September 2008 Tg. Pandan 6
Sukabumi 4 15 September 2008 Pontianak 6
Cianjur 2 15 September 2008 Tg. Pandan 6
Subang 5 16 September 2008 Pk. Pinang 6
6 16 September 2008 Pk. Pinang 6
Cianjur 2 16 September 2008 Tg. Pandan 6
Tangerang 9 15 September 2008 Tg. Pandan 6
Sukabumi 2 16 September 2008 Pontianak 6
Titer Antibodi AI
Sampel serum diperoleh dari DOC yang diambil dari pengiriman antar area Bandara Soekarno Hatta. Hasil pengujian antibodi terhadap AI dari sampel serum menunjukan bahwa DOC yang dilalulintaskan memiliki antibodi terhadap AI dengan titer rataan 23.5. Antibodi yang terdapat dari DOC merupakan antibodi asal induk. Vaksinasi pada induk akan meningkatkan kekebalan antibodi pada DOC. Vaksinasi pada unggas diharapkan dapat meningkatkan kekebalan unggas terhadap paparan virus dan mengurangi tingkat shedding virus sehingga mencegah kasus penyakit (Capua and Maragon 2007). Tizard (1987) menyebutkan anak ayam memperoleh antibodi IgG dari kuning telur. Imunoglobulin ini diturunkan dari induk selama telur masih berada dalam ovarium.
Rataan titer sebesar 23.5 (11.7) belum cukup melindungi unggas dari infeksi virus AI. Sampel-sampel yang menunnjukkan positif AI subtipe H5 dengan uji RT-PCR memiliki rataan titer sebesar 25 (32). Menurut Kumar et al. (2007) ayam dengan titer lebih rendah dari 10 maupun negatif tidak mampu melindungi ayam dari infeksi virus AI, sehingga kematian sangat tinggi bila ditantang dengan virus AI. Titer rendah antara 10-40 dapat melindungi ayam dari kematian akibat infeksi virus AI, tetapi tidak dapat mencegah infeksi dan shedding virus. Titer antibodi lebih dari 40 dapat mencegah kematian dan shedding virus dari trakhea, kloaka atau keduanya pada 4 hari setelah infeksi. Uji coba vaksinasi menggunakan vaksin H5N1 isolat Indonesia dan dibandingkan dengan vaksin H5N2 pada ayam komersial dan ayam kampung di Sukabumi diperoleh titer antibodi > 23. Kedua titer tersebut dapat memproteksi ayam terhadap uji tantang dengan isolat Indonesia (Bouma et al. 2005)
menjadi 3 subclade. Clade dan subclade yang terpisah mempunyai perbedaan struktur antigenik, sehingga setiap clade dan subclade memerlukan vaksin yang berbeda.
Penularan virus AI dapat terjadi baik melalui induk maupun kontaminasi pada penetasan dan alat angkut. Capua and Maragon (2007) menyatakan adanya infeksi AI pada DOC dapat dideteksi dengan adanya antibodi anti-NS1. Protein NS1 hanya disintesa selama virus melakukan replikasi, dan tidak signifikan ada dalam vaksin inaktif. Unggas yang telah divaksin, muncul antibodi NS1 hanya setelah adanya infeksi lapang.
Keberlangsungan perdagangan yang mempersyaratkan vaksinasi, negara pengekspor hendaknya mampu melakukan surveillance dan menyediakan data lain untuk mengkonfirmasikan bahwa notifiable Avian Influenza (NAI) tidak ada dalam kompartemen dimana komoditas ekspor berasal (OIE 2005). Persyaratan seperti ini pada kenyataannya tidak dapat diterapkan di Indonesia untuk perdagangan antar area, khususnya DOC dari Pulau Jawa yang endemik AI. Hal ini mengharuskan peternakan pembibitan dan karantina harus melakukan monitoring keberadaan NAI pada DOC yang dilalulintaskan.
Pengujian RT-PCR untuk Pooling Organ
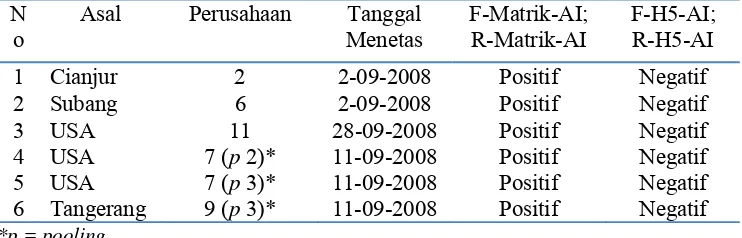
[image:49.612.134.505.574.693.2]Pengujian awal dengan RT-PCR dilakukan pada kumpulan dari organ trakhea dan paru-paru dari semua sampel yang diperoleh. Sebanyak 58 pooling (346 DOC) menunjukkan hasil 6 pooling sampel positif. Selanjutnya dilakukan pengujian dengan primer H5 dan hasilnya negatif virus AI.
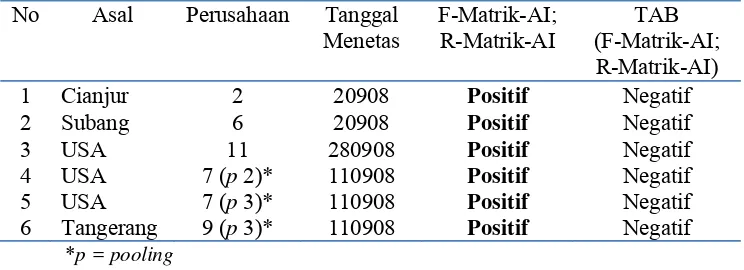
Tabel 3. Data sampel positif matrik Influenza A pada sampel DOC dari Bandara Soekarno Hatta
N o
Asal Perusahaan Tanggal
Menetas
F-Matrik-AI; R-Matrik-AI
F-H5-AI; R-H5-AI
1 Cianjur 2 2-09-2008 Positif Negatif
2 Subang 6 2-09-2008 Positif Negatif
3 USA 11 28-09-2008 Positif Negatif
4 USA 7 (p 2)* 11-09-2008 Positif Negatif
5 USA 7 (p 3)* 11-09-2008 Positif Negatif
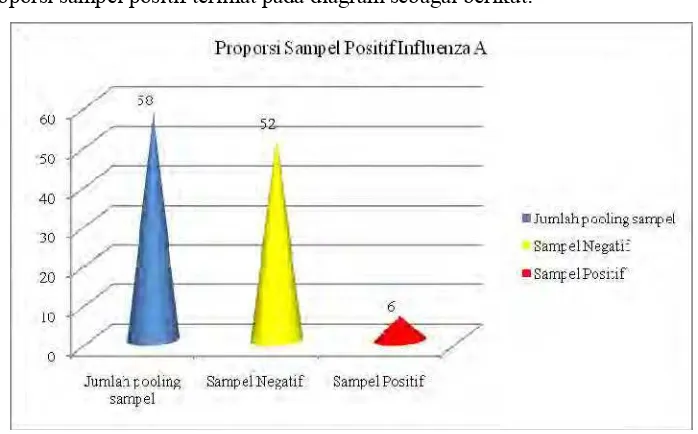
Proporsi sampel positif terlihat pada diagram sebagai berikut:
Gambar 2. Proporsi sampel positif Influenza A
Data di atas mengambarkan bahwa virus influenza A dapat menimbulkan infeksi subklinis karena sampel yang diuji berasal dari DOC yang sehat secara klinis dan secara patologi anatomi tidak menggambarkan lesi spesifik AI. Hal ini juga sesuai dengan pernyataan Wibawan (2006) bahwa kondisi virus AI saat ini sudah berbentuk infeksi subklinik, dimana hewan terlihat sehat tetapi secara subklinis sakit. Adanya kasus penyakit yang tidak terdeteksi dengan tepat menyebabkan meluasnya kasus di lapangan.
terakhir (Peraturan Dirjen Peternakan nomor: 46/PD.640/F/08.05). Temuan dalam penelitian ini dapat menjadi pertimbangan dalam pengambilan kebijakan khususnya menyangkut peraturan-peraturan lalu lintas DOC yang berkaitan dengan penyakit AI.
Keterangan :
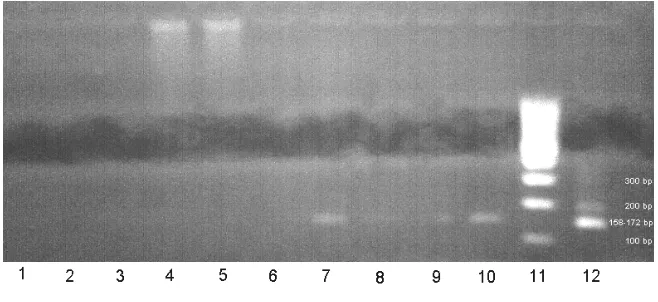
[image:52.612.152.486.176.314.2]1. Kontrol negatif; 2. Import USA11 pooling 1 (280808); 3. Import USA11 pooling 2 (280808); 4. Import USA11 pooling 3 280808); 5. AA Cianjur2 (020908); 6. AA Tangerang9 (020908); 7. AA Subang6 (020908); 8. IKH pooling 1; 9. IKH pooling 2; 10. DNA Marker; 11. Kontrol positif
Gambar 3. Hasil elektroforesis produk RT-PCR dengan primer matrik: F-matrik-AI; R-Matrik AI (Lee et al. 2001) pada 200 base pairs (bp)
Penelusuran Keberadan Virus AI pada Kuning Telur
Tabel 4. Penelusuran virus AI dengan berbagai primer pada kuning telur
No Titer Ab Primer Matrik Primer H5
F-Matrik-AI;
R-Matrik-AI
FAI; RAI M-Flu 1; M-Flu 2
HA1144; H5-1735
FH5;RH5
3A 0 Negatif Negatif Negatif Negatif Negatif
3B 2 Negatif Negatif Negatif Negatif Negatif
3C 1 Negatif Negatif Positif Negatif Negatif
3D 0 Negatif Positif Negatif Negatif Positif
3E 1 Negatif Negatif Negatif Negatif Negatif
3F 1 Negatif Negatif Positif Negatif Negatif
4B 5 Negatif Positif Negatif Negatif Negatif
5F 3 Negatif Positif Positif Negatif Negatif
6C 1 Negatif Negatif Positif Negatif Negatif
6F 1 Negatif Negatif Positif Negatif Negatif
7A 3 Negatif Negatif Positif Negatif Negatif
7F 1 Negaif Negatif Positif Negaif Negatif
9B 3 Negatif Negatif Positif Negatif Negatif
Keterangan: 3A-F. AA Cianjur3 (250708 KTa-f); 4B. AA Cianjur4 (250708 KTb); 5F. AA Subang5 (250708 KTf); 6C. AA Subang6 (250708 KTc); 6F. AA Subang6 (250708 KTf); 7A. AA Subang7 (250708 KTa); 7f. AA Subang7 (250708 KTf); 9B. AA Tangerang (250708 KTb)
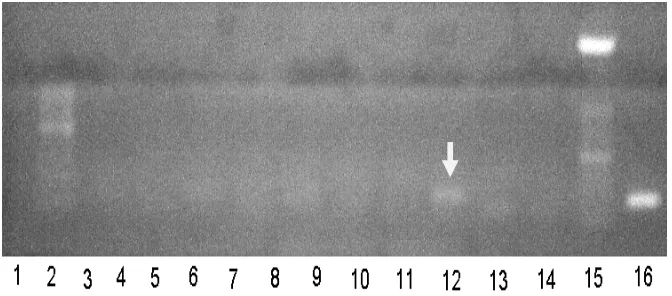
Keterangan:
1. Kontrol negatif; 2. AA Tangerang (120908); 3. Import USA7 pooling 2 (110908); 4. Import USA7 pooling 3 (110907); 5. Import USA7 (Kar) pooling 1; 6. Import USA (Kar)
pooling 2; 7. AA Tangerang (250709 KTa); 8. AA Subang (250709 KTf); 9. AA
Cianjur3 (250708 KTc); 10. AA Cianjur3 (250708 KTf); 11. DNA Marker 100 bp; 12 Kontrol positif
[image:53.612.155.484.381.532.2]Keterangan:
[image:54.612.152.488.79.227.2]1. Kontrol negatif 2; DNA Marker 50 bp; 3. AA Tangerang (250708 KTb); 4. AA Subang7 (250708 KTf); 5. AA Subang7 (250708 KTa); 6. AA Subang6 (250708 KTf); 7. AA Subang6 (250708 KTc); 8. AA Subang5 (250708 KTf); 9. AA Cianjur4 (250708 KTb); 10. AA Cianjur3 (250708 KTf); 11. AA Cianjur3 (250708 KTe); 12. AA Cianjur3 (250708 KTd); 13. AA Cianjur3 (250708 KTc); 14. AA Cianjur3 (250708 KTb); 14. DNA Marker 50 bp; 16. Kontrol positif
Gambar 5. Hasil elektroforesis produk RT-PCR dengan primer H5: FH5; RH5 (Lee & Suarez 2004) pada 55 bp
Berdasarkan hasil penelitian ini diketahui adanya primer yang sesuai untuk mendeteksi virus Influenza A dan virus AI subtipe H5 pada DOC yang berkembang saat ini (Tabel 4). Primer matrik M-Flu 1; M-Flu 2 (Trani et.al 2006) dan matrik FAI; RAI (Lee & Suarez 2004) relevan untuk mendiagnosa virus Influenza A pada DOC. Kedua primer di atas dapat digunakan dalam tindakan karantina untuk diagnosa Influenza A dengan pengujian pararel, untuk meningkatkan kepekaan pengujian. Pengujian pararel adalah pengujian laboratorium yang dilakukan dengan dua atau lebih pengujian pada waktu yang bersamaan, berdasarkan pertimbangan bahwa hewan positif pada beberapa pengujian. Pengujian pararel akan meningkatkan sensitifitas tetapi menurunkan spesifisitas dan nilai prediktif positif. Model pengujian ini akan memperkecil peluang hewan yang sakit tidak terdeteksi dalam pengujian, artinya hewan-hewan yang negatif adalah hewan yang benar-benar sehat, meskipun banyak terdapat adanya positif palsu (Thrusfield 2005).
et al. 2006) dan matrik: FAI; RAI (Lee & Suarez 2004). Adanya sampel yang menunjukkan positif primer matrik tetapi negatif primer H5, menunjukkan bahwa DOC terinfeksi virus Influenza A subtipe lain. Influenza A yang virulen dan menimbulkan gejala klinis pada ayam dan kalkun hanya subtipe H5 dan H7 (OIE 2005). Oleh karena itu perlu dilakukan pengujian lanjutan menggunakan primer H7 perlu dilakukan. Pengiriman DOC yang menunjukkan hasil positif primer H5 dan H7 harus dilakukan tindakan karantina (pengasingan) sesuai dengan peraturan yang berlaku, sambil menunggu hasil inokulasi virus pada TAB-SPF.
Konfirmasi pengujian dilakukan pada sampel positif matrik AI menggunakan primer matrik: F-matrik-AI; R-matrik-AI (Lee et al. (2001). Pengujian dilakukan pada sampel kuning telur secara individu. Hasil penelitian ini menunjukkan bahwa sampel yang positif dengan primer matrik: F-Matrik-AI; R-Matrik-AI (Lee et al. 2001) ketika dikonfirmasi dengan pasangan primer matrik: FAI; RAI dan H5: FH5; RH5 (Lee & Suarez 2004) menunjukkan hasil yang tetap positif.
Tabel 5. Konfirmasi pengujian pada sampel kuning telur Pooling trachea&paru
Kuning telur (individu)
No Asal Perusahaan DOC Tanggal Menetas
F-Matrik-AI; R-Matrik-AI
FAI; RAI FH5; RH5
1 Cianjur 2 C 020908
Positif Positif lemah Tidak diuji
F 020908 Positif lemah Tidak diuji
2 Subang 6 C 020908
Positif Positif lemah Tidak diuji
F 020908 Dubius Positif
3 USA 11 A 280908
Positif Negatif Tidak diuji
C Positif Positif
4 USA 7 (p2)* A 110908
Positif Positif Positif
B Positif Positif
5 Tangerang 9 B 110908
Positif Positif Positif
D 110908 Dubius Positif
*p : pooling
Hasil Isolasi Virus
[image:56.612.134.506.223.358.2]Inokulasi sampel pooling organ trakhea dan paru-paru pada TAB-SPF umur 10 hari menunjukkan hasil negatif (Tabel 6). Hal ini karena konsentrasi virus yang sedikit. Terregino et al. (2007) menyebutkan virus akan tumbuh dalam TAB jika melebihi ambang batas yaitu 1 egg infectious dose 50% (EID50).
Tabel 6. Hasil inokulasi pada TAB-SPF dari sampel organ paru-paru dan trakhea yang positif RT-PCR AI
No Asal Perusahaan Tanggal
Menetas
F-Matrik-AI; R-Matrik-AI
TAB (F-Matrik-AI;
R-Matrik-AI)
1 Cianjur 2 20908 Positif Negatif
2 Subang 6 20908 Positif Negatif
3 USA 11 280908 Positif Negatif
4 USA 7 (p 2)* 110908 Positif Negatif
5 USA 7 (p 3)* 110908 Positif Negatif 6 Tangerang 9 (p 3)* 110908 Positif Negatif
*p = pooling
Inokulasi ulang menggunakan sampel kuning telur menunjukkan hasil seperti yang tersaji pada Tabel 7. Inokulasi sampel kuning telur yang positif RT-PCR AI mengikuti prosedur dari OIE (2005) menggunakan 2 butir TAB-SPF. Deteksi keberadaan virus dari cairan alantois menggunakan primer matrik: FAI; RAI (Lee & Suarez. 2004). Hasil pengujian menunjukkan hasil positif lemah tampak dari tipisnya pita elektroforesis (Gambar 6). Cairan alantois hasil pasase pertama dilakukan penanaman kembali pada TAB-SPF (pasase 2).
adalah perubahan asam amino glikoprotein hemaglutinin (HA) (Plotkin & Dushoff 2003), sehingga antibodi yang telah terbentuk oleh tubuh akibat vaksinasi sebelumnya tidak dapat mengenali keberadaan virus (Munch et al. 2001).
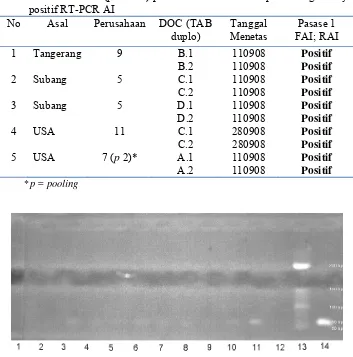
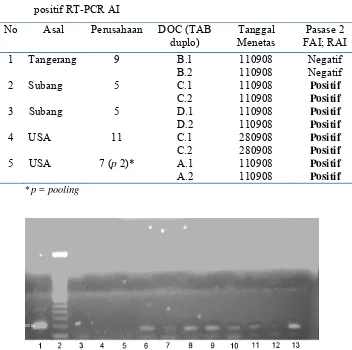
Tabel 7. Hasil inokulasi (pasase-1) pada TAB-SPF dari sampel kuning telur yang positif RT-PCR AI
No Asal Perusahaan DOC (TAB
duplo)
Tanggal Menetas
Pasase 1 FAI; RAI
1 Tangerang 9 B.1 110908 Positif
B.2 110908 Positif
2 Subang 5 C.1 110908 Positif
C.2 110908 Positif
3 Subang 5 D.1 110908 Positif
D.2 110908 Positif
4 USA 11 C.1 280908 Positif
C.2 280908 Positif
5 USA 7 (p 2)* A.1 110908 Positif