UJI DAYA INHIBISI EKSTRAK KASAR FLAVONOID
SAMBILOTO (
Andrographis paniculata
[Burm. F]
Ness) DAN
TEMU PUTIH
(
Curcuma zedoaria
Roscoe)
TERHADAP
AKTIVITAS TIROSIN KINASE SECARA
IN VITRO
TRI RAHAYU
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
TRI RAHAYU. Perbandingan daya inhibisi ekstrak kasar flavonoid sambiloto (Andrographis paniculata [Burm. F]Ness) dan temu putih (Curcuma zedoaria Roscoe) terhadap aktivitas tirosin kinase secara in vitro. Dibimbing oleh GUSTINI SYAHBIRIN dan DYAH ISWANTINI PRADONO.
Tirosin kinase mempunyai peran penting dalam perkembangan sel kanker. Senyawa yang dapat menjadi inhibitor spesifik tirosin kinase merupakan salah satu metode yang digunakan untuk mencari obat antikanker. Senyawa flavonoid berpotensi menghambat aktivitas tirosin kinase. Berdasarkan uji fitokimia, tanaman sambiloto (A. paniculata
[Burm. F] Ness) dan rimpang temu putih (C. zedoaria Roscoe) mengandung senyawa flavonoid.
Tanaman sambiloto dan rimpang temu putih diekstraksi dengan metode maserasi. Jenis pelarut dan nisbah perbandingan mengikuti metode maserasi Markham (1988). Ekstraksi menggunakan pelarut metanol-air dengan nisbah 9:1 dan 1:1. Setelah itu, dipartisi dengan pelarut heksana dan kloroform. Rendemen ekstrak kasar flavonoid sambiloto dan rimpang temu putih masing-masing sebesar 16,90% dan 19,81%. Selanjutnya, uji toksisitas larva udang dan penentuan total fenol dilakukan. Daya inhibisi ekstrak kasar sambiloto konsentrasi 300 ppm terhadap tirosin kinase adalah sebesar 67,19% atau lebih besar dari kontrol positif (genistein), yaitu sebesar 6,71%. Daya inhibisi ekstrak kasar flavonoid rimpang temu putih terhadap tirosin kinase konsentrasi 300 ppm dan 700 ppm masing-masing sebesar 2,83% dan 27,49% atau lebih tinggi dibandingkan genistein. Daya hambat ekstrak kasar sambiloto terhadap tirosin kinase cukup tinggi sehingga dapat berpotensi sebagai obat antikanker, sedangkan daya hambat ekstrak kasar flavonoid temu putih lebih rendah.
ABSTRACT
TRI RAHAYU. In vitro inhibition capacity comparison of sambiloto
(Andrographis paniculata [Burm. F] Ness) and temu putih (Curcuma zedoaria [Berg] Roscoe) flavonoid crude extracts to tyrosine kinase activity in vitro. Supervised by GUSTINI SYAHBIRIN and DYAH ISWANTINI PRADONO.
Tyrosine kinase has an important role in cancer cell development. Screening of compounds that can be tyrosine kinase specific inhibitors is one of methods that are useful to search new anticancer medicines. Flavonoid compounds are potential to inhibit tyrosine kinase activity. Based on phytochemistry test, plants of sambiloto and temu putih’s rhizome comprised of flavonoid compounds.
Both samples were extracted with maceration method. Flavonoid crude extract of these two plants was obtained using Markham’s method. These extractions were using methanol-water solvents with ratios of 9:1 and 1:1. After that, the filtrate partitioned with hexane and chloroform solvents. Flavonoid crude extract yield of sambiloto’s plants and
Judul : Uji Daya Inhibisi Ekstrak Kasar Flavonoid Sambiloto (
Andrographis
paniculata
[Burm. F] Ness) dan Temu Putih (
Curcuma zeodaria
Roscoe)
Terhadap Aktivitas Tirosin Kinase secara
In Vitro
.
Nama : Tri Rahayu
NIM : G44201069
Menyetujui:
Pembimbing I, Pembimbing II,
Dra. Gustini Syahbirin, MS Dr. Dyah Iswantini Pradono, M.Agr
NIP 131 842 414 NIP: 131 956 706
Mengetahui:
Dekan Fakultas Matematika dan Ilmu pengetahuan Alam
Institut Pertanian Bogor
Dr. Ir. Yonny Koesmaryono MS
NIP. 131 473 999
UJI DAYA INHIBISI EKSTRAK KASAR FLAVONOID
SAMBILOTO (
Andrographis paniculata
[Burm. F]
Ness) DAN
TEMU PUTIH
(
Curcuma zedoaria
Roscoe)
TERHADAP
AKTIVITAS TIROSIN KINASE SECARA
IN VITRO
TRI RAHAYU
Skripsi
Sebagai salah satu syarat memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 2 Desember 1982 sebagai anak ketiga dari tiga bersaudara, dari pasangan Sukirman dan Warsi.
Penulis memulai pendidikan formal di SD Negeri 05 Pagi Jakarta pada tahun 1989-1994, lalu dilanjutkan di SMP Negeri 254 Jakarta pada tahun 1994-1997. Pada tahun 1997-2000, penulis menyelesaikan studi tingkat menengah di SMU Negeri 38, dan pada akhirnya diterima di Departemen Kimia Institut Pertanian Bogor pada tahun 2001 melalui jalur Ujian Masuk Perguruan Tinggi Negeri (UMPTN).
PRAKATA
Alhamdulillahirobbilalamiin. Puji syukur penulis panjatkan ke hadirat Allah yang maha pengasih lagi penyayang atas berkah dan rahmat-NYA lah karya ilmiah ini berhasil diselesaikan. Penelitian ini dilakukan dari bulan Mei sampai Desember 2005, di Laboratorium Kimia Organik, FMIPA IPB. Tema yang dipilih adalah Uji Daya Inhibisi Ekstrak Kasar Flavonoid Sambiloto (Andrographis paniculata [Burmf F] Ness) dan Temu Putih (Curcuma zedoaria [Berg] Roscoe) Terhadap Aktivitas Tirosin Kinase Secara In Vitro.
Terima kasih penulis ucapkan kepada Dra. Gustini Syahbirin, M.S. dan Dr. Dyah Iswantini Pradono, M.Agr., selaku pembimbing serta pemberi dana A2. Terima kasih juga penulis ucapkan kepada Prof. Suminar Achmadi, M.Sc., Drs. M. Farid, dan Budi Arifin S,Si., Ema Hendryani S,Si., yang banyak memberi saran dan arahan. Di samping itu, penghargaan penulis sampaikan kepada Bapak, Ibu, kedua Kakanda-ku, seluruh staf dan laboran Kimia Organik, Pusat Studi Satwa Primata terutama Pak Uus, teman-teman Kimia 38 khususnya ‘keluarga Cinte’, Mexindo crew, atas persahabatan, perhatian, ilmu, semangat yang diberikan serta kebersamaan yang indah dan seluruh pihak yang telah memberikan dukungan kepada penulis.
Semoga karya ilmiah ini berguna dan bermanfaat.
Bogor, Februari 2006
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ...viii
DAFTAR LAMPIRAN ... xi
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Sambiloto ... 1
Temu putih ... 3
Flavonoid ... 3
Kanker ... 4
Artemia salina Leach ... 4
Tirosin kinase ... ... 5
BAHAN DAN METODE Bahan dan Alat ... 5
Metode Penelitian ... 5
HASIL DAN PEMBAHASAN Kadar Air ... 7
Rendemen Ekstrak Kasar Flavonoid ... 8
Penapisan Fitokimia ... 9
Penentuan Total Fenol ... 10
Uji Toksisitas Terhadap Larva Udang ... 11
Daya Inhibisi Ekstrak Kasar Flavonoid Sambiloto Dan Temu Putih Terhadap Tirosin Kinase ... 11
SIMPULAN DAN SARAN ... 14
DAFTAR PUSTAKA ... 14
DAFTAR TABEL
Halaman
1 Kadar air tanaman sambiloto dan rimpang temu putih ... 8
2 Rendemen ekstrak kasar flavonoid sambiloto dan temu putih ... 9
3 Penapisan fitokimia tanaman segar, kering dan ekstrak ... 9
4 Hasil uji total fenol ekstrak kasar flavonoid sambiloto dan temu putih ... 10
DAFTAR GAMBAR
Halaman 1 Tanaman sambiloto ... 22 Struktur senyawa terpen pada sambiloto ... 2
3 Struktur senyawa andrografidin A, B, dan C pada sambiloto ... 2
4 Struktur senyawa andrografidin D, E, dan F pada sambiloto ... 2
5 Struktur senyawa andrografidin Struktur senyawa 5-hidroksi-7,8 dimetoksiflavanon, 5-hidroksi-3,7,8,2’-tetrametoksiflavon, dan 5- hidroksi-7,8-dimetoksiflavon. pada sambiloto ... 2
6 Tanaman dan rimpang temu putih ... 3
7 Struktur bisdemetoksikurkumin, kurkumin, dan demetoksikurkumin ... 3
8 Struktur germakron, zederon, kurkumrnol, dan kurkumol rimpang temu putih ... 3
9 Tiga struktur dasar flavonoid ... 4
10 Struktur genistein ... 4
11 Nilai LC50 ekstrak kasar flavonoid sambiloto dan temu putih ... 11
12 Absorbansi uji inhibisi ekstrak kasar flavonoid sambiloto, temu putih, dan genistein terhadap enzim PTK ... 12
13 Daya inhibisi ekstrak kasar flavonoid sambiloto dan flavonoid, genistein pada konsentrasi 300 ppm ... 12
DAFTAR LAMPIRAN
Halaman
1. Determinasi tanaman sambiloto ... 18
2. Determinasi tanaman temu putih ... 19
3. Metode pembuatan pereaksi uji fitokimia ... 20
4. Penentuan kadar air tanaman sambiloto dan temu putih ... 21
5. Diagram alir ekstrak kasar flavonoid ... 22
6. Bagan alir pengujian ekstrak kasar flavonoid tanaman sambiloto dan temu
putih ... 22
7. Rendemen ekstrak kasar flavonoid tanaman sambiloto dan temu putih ... 23
8. Hasil uji hayati larva udang ekstrak kasar flavonoid sambiloto ... 23
9. Hasil uji hayati larva udang ekstrak kasar flavonoid temu putih ... 24
1
PENDAHULUAN
Secara geografis Indonesia terletak di daerah tropis dan menyimpan sumber daya alam yang beraneka ragam. Salah satunya adalah variasi pada berbagai jenis flora yang dimanfaatkan secara turun-temurun sebagai tanaman obat. Pada saat ini masyarakat cenderung menggunakan obat tradisional daripada obat sintetik. Fenomena ini lebih dikenal sebagai terapi back to nature. Hal ini tidak lepas dari upaya mencari solusi pengobatan yang lebih murah, aman, dan efektif.
Penyakit kanker merupakan salah satu jenis penyakit yang mematikan, dengan angka kematian yang cukup tinggi. Teknik pengobatan penyakit kanker meliputi radioterapi, kemoterapi, imunoterapi, terapi gen, dan pembedahan. Namun teknik tersebut memerlukan biaya yang sangat besar dan menimbulkan efek samping seperti mual, pusing, diare, terjadinya malnutrisi, pengurangan sel darah putih, serta kebotakan (Hariani, Hukom, Simadibrata; 2004).
Tanaman yang berpotensi mencegah maupun mengobati penyebaran sel kanker antara lain sambiloto (Andrographis paniculata [Burm. F] Ness) dan temu putih (Curcuma zedoaria [Berg] Roscoe). American Institute Cancer Medical Herbs, melaporkan bahwa temu putih mengandung ribosome inacting protein (RIP) yang berfungsi sebagai antikanker, antioksidan, dan antiperadangan. Selain itu temu putih ternyata dapat menyembuhkan kanker serviks, meningkatkan khasiat radioterapi, dan kemoterapi guna membunuh sel kanker (Dalimartha 1999).
Penelitian yang telah dilakukan oleh Sukardiman et al. (2001) melaporkan bahwa ekstrak metanol tanaman sambiloto mempunyai efek sitotoksik terhadap kultur sel kanker leukemia. Selain itu, kandungan senyawa aktif tanaman A. paniculata Ness yang berfungsi sebagai antikanker telah dipatenkan oleh US. patent nomor 6,486,196 (Nanduri et al. 2002); dan 6,410,590. Namun paten tersebut menggunakan sel kanker untuk mengetahui keaktifan senyawa aktif herbal sambiloto. Sementara itu, penelitian ini menggunakan uji inhibisi ekstrak kasar flavonoid tanaman sambiloto dan rimpang temu putih terhadap aktivitas tirosin kinase secara in vitro.
Tirosin kinase merupakan enzim yang berperan dalam sinyal transduksi sel. Aktivitas tirosin kinase sebagai reseptor faktor pertumbuhan dan produk protein onkogen
sangat penting bagi perbanyakan sel. Inhibitor spesifik tirosin kinase merupakan salah satu metode yang digunakan untuk mencari obat antikanker (Matter 2002). Genistein dan daidzen adalah contoh inhibitor alami tirosin kinase (Challem 2002; Rood 1998)
Genistein merupakan senyawa isoflavon pada biji kedelai. Menurut Dixon dan Ferreira (2005), genistein mampu menghambat aktivitas sel kanker (kemoprotektan), mengobati penyakit kardiovaskular, serta memiliki aktivitas fitoestrogen. Selain itu, genistein mampu memerangkap radikal bebas molekul oksigen sehingga menghambat pembentukan anion superoksida dari xantin oksidase (Wei et al. 1995).
Penelitian ini bertujuan menguji daya inhibisi ekstrak kasar flavonoid tanaman sambiloto (A. paniculata [Burm. F] Ness) dan rimpang temu putih (C. zedoaria Roscoe) terhadap aktivitas tirosin kinase secara in vitro. Selain itu, dilakukan uji fitokimia, total fenol dan nilai LC50 (Lampiran 3) kedua tanaman tersebut.
Hipotesis dari penelitian ini adalah ekstrak kasar flavonoid tanaman sambiloto (A. paniculata [Burm. F] Ness) dan rimpang temu putih (C. zedoaria Roscoe) mampu menghambat aktivitas tirosin kinase secara in vitro. Tujuan akhir penelitian ini, diharapkan dapat memberikan informasi dan wawasan ilmiah tentang potensi ekstrak kasar flavonoid kedua tanaman tersebut sebagai obat antikanker.
TINJAUAN PUSTAKA
Sambiloto Deskripsi Tanaman
Sambiloto atau A. paniculata [Burm. F] Ness (Lampiran 1) merupakan tanaman yang sudah tak asing lagi bagi masyarakat Indonesia. Walaupun bukan tanaman asli Indonesia, masyarakat Indonesia telah mengenal dan memanfaatkannya sejak 150 tahun yang lalu. Spesimen sambiloto tertua yang pernah dicatat di Herbarium Bogoriensis ditemukan pada tahun 1893 di tepian sungai Ciliwung daerah Bogor, Jawa Barat.
2
Taksonomi
Klasifikasi tanaman sambiloto adalah sebagai berikut:
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledoneae Bangsa : Solanales Suku : Acanthaceae Marga : Andrographis
Jenis : Andrographis paniculata
[Burm. F] Ness
Morfologi
Tanaman sambiloto (Gambar 1), tergolong herba yang tumbuh liar di tempat terbuka dengan ketinggian 1–700 m dpl, seperti kebun, ataupun tepi sungai. Sambiloto tumbuh tegak, tingginya 50–90 cm, dengan batang cabang berbentuk segi empat. Daun tunggal, bertangkai pendek, panjang sekitar 1–3 cm, ujung serta pangkalnya runcing. Bentuk bijinya berbentuk pipih, berwarna coklat, dan pangkal ujungnya tajam. Bila biji masak akan pecah membujur menjadi empat keping. Tanaman sambiloto mudah diperbanyak dengan biji (WHO 1999).
Gambar 1 Tanaman sambiloto.
Kandungan senyawa kimia
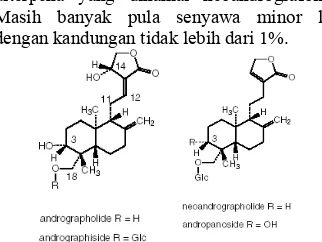
Penelitian mengenai senyawa aktif sambiloto pertama kali dilakukan oleh Boorsman. Pada tahun 1897, ia berhasil mengisolasi kristal tidak berwarna, yang berasa pahit, dan dinamai andrografida. Andrografida diekstraksi dengan pelarut air dari berbagai bagian tanaman A. paniculata
Ness. Tahun 1910, Gorter melakukan ekstraksi dengan pelarut etanol 95% sehingga berhasil mengisolasi senyawa berumus molekul C20H30O5 lalu disebut andrografolida (Gambar 2). Setelah itu semakin banyak ditemukan senyawa aktif dari sambiloto misalnya neoandrografolida, andrografisida, dan andropanosida. Sama seperti andrografolida ketiganya tergolong diterpen lakton (Anonim 2005).
Turunan oksigen dari senyawa-senyawa diatas juga terdapat pada sambiloto seperti deoksiandrografolida, deoksipanikolin, mono
o-metilwitin, apigenin-7’-4-dimetileter, dideoksiandrografolida (andrografonin) dan deoksiandrografosida. Selain itu, telah pula
ditemukan beberapa turunan glikosida diterpena yang dinamai neoandrografolida. Masih banyak pula senyawa minor lain dengan kandungan tidak lebih dari 1%.
Gambar 2 Struktur senyawa terpen sambiloto.
Senyawa yang telah berhasil diisolasi dari akar sambiloto antara lain senyawa glikosida flavanon (andrografidin A) dan glikosida flavon seperti andrografidin B, C (Gambar 3), D, E, dan F (Gambar 4) (WHO1999). Beberapa senyawa flavonoid lain yang juga telah berhasil diisolasi dari akar sambiloto antara lain 5-hidroksi-7,8 dimetoksiflavanon, hidroksi-3,7,8,2’-tetrametoksiflavon dan 5-hidroksi-7,8-dimetoksiflavon (Gambar 5).
O OCH3
H3CO
O O CH2OH
OH OH
OH Andrografidin A
O H3CO
OCH3
OH O OH
O
O CH2OH
OH OH OH
Andrografidin B O
O O OCH3
H3CO
O CH2OH OH
OH
OH Andrografidin C
Gambar 3 Struktur andrografidin A, B, dan C.
OO O OCH3
H3CO
O CH2OH OH
OH OH
H3CO OCH3
Andrografidin D
OO O OCH3
H3CO
O CH2OH OH OH OH OCH3 Andrografidin E OO O OCH3
H3CO
O CH2OH OH
OH OH
OCH3
H3CO OH
Andrografidin F
Gambar 4 Struktur andrografidin D, E dan F.
O
O OCH3 H3CO
OH 1 3 4 5 2 6 7 8 9 10 1' 2' 3' 4' 5' 6' 5-hidroksi-7, 8-dimetoksiflavon O OCH3 H3CO
OH O OCH3 H3CO
5-hidroksi-3, 7, 8, 2' -tetrametoksiflavon O
O OH OCH3 H3CO
5-hidroksi-7,8-dimetoksiflavon Gambar 5 Struktur senyawa 5-hidroksi-7,8
dimetoksiflavanon, hidroksi-3,7,8,2’-tetrametoksiflavon, dan 5-hidroksi-7,8-dimetoksiflavon.
Efek Farmakologi
3
antioksidan, antitumor, antiperadangan, obat diabetes, hipertensi dan diare.
Temu Putih Deskripsi Tanaman
Temu putih (C. zedoaria Roscoe) merupakan tanaman obat yang dibudidayakan dibeberapa negara di Asia Tenggara, seperti Thailand, Filipina, Malaysia dan Indonesia. Di Indonesia, C. zedoaria Roscoe (Lampiran 2) ditemukan di berbagai daerah Jawa Barat dan Jawa Tengah. Beberapa sinonim nama ilmiah temu putih antara lain Amomum zedoaria
Christmann (1779), A. latifolium Lamk (1783), dan Curcuma zerumbet Roxb (1810).
Taksonomi
Klasifikasi tanaman temu putih adalah sebagai berikut:
Divisi : Spermatophyta Sub-Divisi : Angiospermae
Kelas : Monocotyledoneae Bangsa : Zingiberales Suku : Zingiberaceae Marga : Curcuma
Jenis : Curcuma zedoaria [Berg] Roscoe
Morfologi
Temu putih merupakan tanaman semak, tingginya sekitar 1–3 meter dengan batang semu dan berwarna hijau. Di dalam tanah membentuk rimpang (Gambar 6). Daun berjenis tunggal, bentuk lonjong dengan ujung meruncing, pangkal tumpul, berbulu halus, warna hijau bergaris ungu. Bunganya adalah bunga majemuk, berbentuk tabung, mahkota lonjong, dan berwarna putih. (Syukur & Hernani 2001). Di Indonesia, temu putih ditemukan sebagai tanaman liar. Tumbuh pada lahan yang kurang subur dengan ketinggian sekitar 1000 m dpl (Heyne 1987).
Gambar 6 Tanaman dan rimpang Curcuma zedoaria Roscoe.
Kandungan senyawa kimia
Rimpang segar temu putih mengandung air 70%, pati 12%, dan zat lain 18%. Syu et al. (1998) berhasil mengisolasi senyawa bioaktif seperti kurkumin, demetoksikurkumi
dan bisdemetoksikurkumin (Gambar 7). Kandungan zat lain diantaranya senyawa kimia jenis seskuiterpen. Contoh senyawa seskuiterpen antara lain germakron, zederon, kurkumenol, dan kurkumol (Gambar 8).
HO R1 O O OH R2 H
1. R1 = R2 = OCH3
2. R1 = H, R2 = OCH3
3. R1 = R2 = H
Gambar 7 Struktur bisdemetoksikurkumin, kurkumin, dan demetoksikurkumin. O germakron zederon O O OH H O OH O kurkumenol kurkumol
Gambar 8 Struktur germakron, zederon, kurkumrnol, dan kurkumol.
Efek Farmakologi
Rimpang temu putih berkhasiat sebagai antiflogostik, kholeretik, stomakik, antipiretik dan pelega perut (Soedibyo M 1995). Secara empiris, rimpang temu putih digunakan sebagai antiperadangan (Utami 2000; Iswari 1998), antioksidan (Chyau et al. 2002), antikanker, dan melancarkan sirkulasi darah.
Beberapa penelitian telah melaporkan beberapa khasiat ekstrak C. zedoaria Roscoe. Seperti penelitian Jang et al. (2001) yang menyatakan bahwa ekstrak kasar metanol rimpang temu putih dilaporkan mampu menghambat faktor nekrosis tumor-alfa (TNF-alfa). Menurut Iswantini et al. (2003), rimpang temu putih mengandung senyawa terpenoid, alkaloid, dan flavonoid yang berpotensi sebagai antikanker. Selain itu, fraksi 15 (eluen kloroform:etil asetat nisbah 7:3) ekstrak kasar flavonoid mempunyai daya hambat terhadap tirosin kinase sebesar 93,4%.
Flavonoid
4
tersubstitusi) dihubungkan dengan rantai alifatik tiga karbon (Robinson 1993). Terdapat tiga jenis struktur flavonoid (Gambar 9), yaitu 1,3-diarilpropana atau flavonoid, 1,2-diarilpropana atau isoflavonoid, dan 1,1-diarilpropana atau neoflavonoid. Flavonoid alam ditemukan dalam bentuk flavonoid-O -glikosida, yaitu suatu kombinasi antara gula dan gugus flavonoid. Gula dapat terikat langsung pada inti benzena flavonoid dengan suatu ikatan karbon-oksigen.
Flavonoid
Isoflavonoid Neoflavonoid Gambar 9 Tiga struktur dasar flavonoid.
Chen & Han (2000) mengungkapkan bahwa flavonoid pada tanaman, seperti teh, dapat berpotensi menghambat pertumbuhan sel kanker. Senyawa flavonoid jenis isoflavonoid dilaporkan memiliki aktivitas antimikrob dan digunakan oleh tanaman untuk melawan penyakit. Salah satu jenis isoflavonoid yang diketahui berfungsi sebagai antimikrob adalah genistein (4',5,7-trihidroksiisoflavon). Selain itu, genistein (Gambar 10) mampu menghambat kerja tirosin kinase dan DNA topoimerase. Genistein dapat menghalangi fosforilasi tirosin termediasi-EGF di dalam sel karsinoma epidermal manusia.
Gambar 10 Struktur genistein.
Kanker
Kanker merupakan penyakit sel yang disebabkan karena penurunan atau kehilangan daya pengendalian sel normal. Menurut Schunack et al. (1990) sel kanker memiliki beberapa sifat umum, yaitu pertumbuhan berlebihan (umumnya berbentuk tumor), gangguan diferensiasi sel dan jaringan. Selain itu, sel kanker bersifat invasif atau mampu tumbuh dijaringan sekitarnya dan dapat pula menyebar ketempat lain, sehingga dapat menyebabkan pertumbuhan baru. Sel kanker memiliki hereditas bawaan. Hereditas bawaan,
yaitu turunan sel kanker dapat mengakibatkan kanker. Siswandono & Soekardjo (1995) berpendapat bahwa tumor yang membahayakan atau tumor ganas disebut kanker.
Karakter sel kanker berbeda dengan jaringan sel normal, contohnya seperti pada sistem enzim. Pada umumnya sel kanker memiliki keragaman jenis enzim yang lebih sedikit dibandingkan dengan sel normal. Namun pada sel kanker jenis enzim pertumbuhan, seperti tirosin kinase, jumlahnya lebih besar.
Beberapa cara untuk mengatasi penyakit kanker dapat diobati dengan berbagai cara, seperti operasi atau pembedahan, terapi radiasi, dan kemoterapi. Kemoterapi merupakan cara pengobatan dengan menggunakan obat antikanker. Antikanker diharapkan memiliki toksisitas selektif, artinya menghancurkan sel kanker tanpa merusak sel jaringan normal. Antikanker dapat diperoleh dari senyawa metabolit sekunder suatu tanaman yang relatif aman bagi tubuh manusia. Senyawa metabolit sekunder yang telah terbukti sebagai antikanker antara lain alkaloid, kukurbitasin, diterpenoid, flavonoid, dan lignan.
Uji Toksisitas Terhadap Larva Udang
(Artemia salina Leach)
Uji toksisitas merupakan uji pendahuluan untuk mengamati aktivitas farmakologi suatu senyawa. Prinsip uji toksisitas adalah komponen bioaktif selalu bersifat toksik jika diberikan pada dosis yang tinggi dan obat ialah racun dari suatu bahan bioaktif dosis rendah (Hamburger & Hostettmann 1991). Meyer et al. (1982), memperkenalkan suatu metode uji toksisitas terhadap larva A. salina
Leach (brine shrimp lethality test (BSTL)). BSLT digunakan sebagai metode untuk memantau adanya aktivitas farmakologik (termasuk antikanker) dari suatu ekstrak tanaman. Metode ini telah digunakan oleh Lembaga Kanker Nasional Indonesia dalam menapis komponen antineoplastik dari berbagai jenis tanaman.
Uji dilakukan untuk mengamati tingkat kematian larva A. salina Leach yang disebabkan oleh ekstrak kasar tanaman. Tingkat kematian atau mortalitas, selanjutnya dianalisis menggunakan analisis probit ntuk menentukan konsentrasi LC50 (lethal
5
Senyawa yang mempunyai nilai LC50 lebih kecil dari 1000 ppm dikatakan memiliki potensi bioaktivitas (Meyer et al. 1982).
BSLT memiliki kelebihan, antara lain biaya relatif murah, sederhana, cepat, praktis, tidak memerlukan teknik perawatan khusus, jumlah sampel yang digunakan relatif sedikit, dan tidak memerlukan serum hewan. Selain itu, hasil uji berkorelasi baik dengan beberapa metode uji sitotoksik (Meyer et al. 1982).
Tirosin Kinase
Tirosin kinase merupakan enzim yang mengkatalisis transfer gugus fosforil dari ATP ke tirosin pada substrat protein sehingga akan mengakibatkan perubahan struktur dan fungsi substrat (Voller et al. 1986). Tirosin kinase dikenal juga dengan tirosil protein kinase (Mahlmann 2000). Protein kinase dikelompokkan menjadi (1) protein kinase serin dan treonin, serta (2) protein kinase yang memfosforilasi jenis spesifik residu tirosin.
Akseptor dalam reaksi fosforilasi protein terjadi dalam sel ketika jumlah ATP berlimpah. Pada reaksi fosforilasi, gugus fosforil terminal (gama) milik ATP dipindahkan oleh protein kinase ke gugus serin, treonin, atau tirosin. Enzim tersebut mengatalisis transfer gugus fosforil dari ATP ke tirosin pada suatu substrat protein yang berakibat berubahnya struktur dan fungsi substrat itu (O’Dwyer et al. 2000). Tirosin kinase dikenal juga dengan tirosilprotein kinase, protein kinase (tirosin), atau gen lck tirosin kinase. Mutasi yang menyebabkan aktivitas tirosin kinase yang tidak terkendali akan mengakibatkan kanker (Mahlmann 2000).
Aktivitas tirosin kinase dapat dihambat oleh beberapa senyawa metabolit sekunder seperti flavonoid. Beberapa penelitian menunjukkan potensi flavonoid dalam menghambat aktivitas tirosin kinase. Dardanela D (2005), melaporkan bahwa senyawa polifenol tanaman dapat menghambat aktivitas dari EGFR (epidermal growth factor receptor). EGFR merupakan suatu reseptor faktor pertumbuhan epidermal. Selain itu, pada penelitiannya, Dardanela D (2005), melaporkan bahwa ekstrak kasar flavonoid buah mengkudu, buah mahkota dewa, meniran, dan keladi tikus memiliki daya hambat terhadap aktivitas tirosin kinase yang lebih tinggi dibandingkan kontrol positif, yaitu genistein.
Enzim lain yang selalu dilibatkan pada pertumbuhan sel kanker adalah
siklooksigenase khususnya siklooksigenase II dan DNA topoisomerase II. Efek analgesik dan antiperadangan topoisomerase DNA digunakan sebagai target utama dalam penemuan obat antikanker. Inhibitor topoisomerase umumnya memiliki efek stabilisasi lanjutan dari reaksi kovalen topoisomerase, sehingga terlibat dalam pembelahan DNA serta penghancuran sel kanker (Sismindari 2003).
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan ialah pereaksi Mayer, Dragendorf dan Wagner (Lampiran 3), rimpang temu putih diperoleh dari kebun tanaman obat Karyasari, Leuwiliang Bogor, sedang sampel tanaman sambiloto didapat dari kebun tanaman obat Pusat Studi Biofarmaka, Bogor, etanol, metanol, kloroform, air, H2SO4, NaOH, serbuk logam Mg dan Zn, amil alkohol, eter, asam asetat anhidrida, HCl pekat, H2SO4 pekat, FeCl3, pereaksi Folin-Ciocalteau, Na2CO3, larva udang, air laut, aquades, asam galat, dan kit untuk uji aktivitas tirosin kinase dengan metode ELISA (enzyme linked immunosorbent assay).
Alat yang digunakan ialah alat-alat gelas, alat-alat ekstraksi, labu penguap putar, cawan porselin, pipet mohr, pipet volumetrik, neraca analitik, aerator, oven, tabung mikrofuse, spektrofotometer 20 sinar tampak, mikropipet, inkubator, dan peralatan ELISA.
Metode Penelitian
Penentuan Kadar Air
6
Ekstraksi Flavonoid (Metode Markham 1988)
Rimpang temu putih dan daun-batang sambiloto dibersihkan dengan air, diiris tipis, dikeringudarakan lalu dikering oven pada suhu (40-50) oC selama 4 sampai 5 hari. diperoleh kadar air
±
10%, masing-masing sebesar 4 sampai 5 hari. Setelah kering, sampel kering diblender hingga diperoleh serbuk dengan butiran–butiran yang cukup halus. Serbuk tersebut ditimbang dan selanjutnya digunakan sebagai sampel.Kedua sampel, yaitu sambiloto dan temu putih masing-masing diambil sebanyak 50 g kemudian direndam (metode maserasi) dalam 200 mL pelarut metanol-air nisbah 9:1 sebanyak dua kali. Setelah itu, sampel disaring dan diambil filtratnya. Residunya dimaserasi kembali dengan 200 mL pelarut metanol-air nisbah 1:1 sebanyak satu kali. Kemudian dipisahkan antara filtrat dan residunya. Setiap meserasi dilakukan selama 2x24 jam disertai pengadukan teratur. Seluruh filtrat yang diperoleh dikumpulkan menjadi satu. Filtrat kemudian dipekatkan dengan labu penguap putar sampai diperoleh volume menjadi sepertiga volume semula.
Ekstrak hasil pemekatan kemudian dipartisi dengan heksana (teknis) sebanyak dua kali. Lapisan MeOH-H2O dipisahkan dari lapisan heksana, kemudian dipartisi dengan kloroform (p.a) sebanyak satu kali. Lapisan MeOH-H2O kemudian dipisahkan dari lapisan kloroform. Proses partisi menggunakan corong pisah. Fraksi air-MeOH digabungkan dan diuapkan pelarutnya dengan labu penguap putar hingga seluruh pelarut organik hilang. Ekstrak hasil pemekatan labu penguap putar kemudian di kering beku selama 24 jam untuk menghilangkan sisa-sisa pelarut air. (Lampiran 5). Sedangkan Lampiran 6 menggambarkan beberapa penguji terhadap ekstrak kasar flavonoid yang telah didapat.
Rendemen (Lampiran 7) ekstrak kasar flavonoid dihitung berdasarkan perhitungan berikut:
( ) 100%
g sampel) (bobot air kadar -1 g flavonoid) kasar ekstrak (Bobot × ×
Uji Fitokimia (Metode Harborne 1996) Uji Alkaloid. Sebanyak 1 gram ekstrak dilarutkan dengan kloroform dan beberapa tetes NH4OH kemudian disaring dalam tabung reaksi tertutup. Ekstrak kloroform dalam tabung reaksi dikocok dengan 10 tetes H2SO4 2 M lalu lapisan asamnya dipisahkan dalam tabung reaksi yang lain. Lapisan asam ini diteteskan pada lempeng tetes dan ditambahkan pereaksi Dragendorf, Mayer dan
Wagner yang akan menimbulkan endapan dengan warna berturut-turut merah jingga, putih, dan coklat.
Uji Flavonoid. Sebanyak 5 mL filtrat ditambahkan serbuk magnesium (0,5 gram), 1 mL alkohol klorhidrat (campuran HCl 37% dan etanol 95% dengan volume sama), dan amil alkohol, kemudian dikocok kuat-kuat. Terbentuknya warna merah, kuning, dan jingga pada lapisan amil alkohol menunjukkan adanya golongan flavonoid.
Sebanyak 1 mL ekstrak ditambah dengan 1 mL metanol 95%, 0.5 g Zn, dan 2 tetes HCl 2N, didiamkan selama 2 menit lalu ditambah 1 mL HCl pekat. Uji akan positif untuk glikosida flavonoid bila dalam 2–5 menit terbentuk warna merah intensif.
Uji Terpenoid dan Steroid. Sebanyak 2 gram ekstrak tanaman dilarutkan dengan 25 mL etanol panas (50oC) kemudian disaring ke dalam pinggan porselin dan diuapkan sampai kering. Residu ditambahkan eter dan ekstrak eter dipindahkan ke dalam lempeng tetes lalu ditambahkan 3 tetes anhidrida asam asetat dan 1 tetes H2SO4 pekat (uji Lieberman-Buchard). Warna merah atau ungu menunjukkan kandungan terpenoid, sedangkan warna hijau atau biru menunjukkan kandungan steroid.
Uji Saponin. Sebanyak 1 gram ekstrak tanaman dimasukkan ke dalam gelas piala dan ditambahkan 100 mL air panas dan dididihkan selama 5 menit kemudian disaring. Selanjutnya, filtrat digunakan untuk pengujian. Uji saponin dilakukan dengan pengocokan 10 mL filtrat ke dalam tabung tertutup selama 10 menit. Timbulnya busa hingga selang waktu 10 menit (buih stabil) menunjukkan adanya saponin.
Uji Tanin. Sepuluh 1 gram ekstrak tanaman ditambahkan 100 mL air panas, dididihkan selama 5 menit dan disaring. Sebagian filtrat ditambahkan FeCl3. Terbentuknya warna biru tua atau hitam kehijauan menunjukkan terdapatnya tanin.
Penentuan Total Fenol
7
Uji Toksisitas dengan Penentuan Nilai LC50 Penetasan Kista A. Salina Leach. Kista
A. Salina diambil sebanyak 50 mg lalu dimasukkan ke dalam vial yang berisi air laut. Setelah diaerasi kista dibiarkan selama 48 jam di bawah pencahayaan lampu agar menetas sempurna. Larva yang sudah menetas diambil untuk digunakan dalam uji toksisitas.
Uji toksisitas terhadap A. Salina Leach. Sebanyak 10 ekor larva A. Salina dimasukkan ke dalam vial yang berisi air laut lalu ditambahkan larutan ekstrak kasar flavonoid sambiloto (Lampiran 8) dan temu putih (Lampiran 9) sehingga konsentrasi akhirnya menjadi 1000, 500, 100 dan 10 ppm. Pengamatan dilakukan setelah 24 jam dengan menghitung jumlah larva yang mati dari total larva yang dimasukkan ke dalam vial. Perhitungan larva udang menggunakan bantuan kaca pembesar. Pengolahan data persen mortalitas kumulatif digunakan analisis probit LC50 dengan selang kepercayaan 95%. Kontrol dilakukan dengan air laut tanpa penambahan ekstrak.
Penentuan daya inhibisi ekstrak terhadap aktivitas tirosin kinase
Pelapisan 96-wells Microtiter Plate
Pelapisan dilakukan dengan cara-cara berikut. Plastik penutup dilepaskan dari tempatnya, kemudian jumlah sumur yang diperlukan ditempatkan dalam plate holder. Sampel larutan stok substrat tirosin kinase (PGT, Polimer sintetik acak Poli-Glu-Tyr) dicairkan dan sebanyak 125 μL substrat tersebut ditambahkan masing-masing sumur, lalu mikrotiter ditutup. Kemudian plate
diinkubasi sepanjang malam pada suhu 37 °C. Setelah itu, larutan PTK substrat yang tidak terlapis dibuang dan masing-masing sumur dicuci dengan 200 μL bufer pencuci (PBS-Tween 20), kemudian bufer pencuci dibuang dan sumur dikeringkan selama 2 jam dengan suhu 37 °C.
Pengujian Protein Tirosin Kinase
Pelarut bufer tirosin kinase (BTK) dengan konsentrasi 1x dibuat dengan cara, BTK konsentrasi 10x sebanyak 1 mL dilarutkan dengan 9 mL air deionisasi. Selanjutnya, 32,5
μL EGFR (130U) dicairkan, kemudian ditambah 292,5 μL BTK (1x) (setiap 10μl mengandung 4 U), campuran diaduk dan disimpan dalam es. Larutan stok ATP sebanyak 128 μL dilarutkan dengan 3,2 mL BTK (1x), diaduk perlahan dan disimpan dalam es. Setelah itu, vial sebanyak 5 disiapkan, 1 vial untuk kontrol EGFR, 1 vial
untuk genistein dan 3 vial untuk masing-masing sampel. EGFR sebanyak 20 μL dimasukkan ke dalam setiap vial, kemudian ditambahkan 20 μL sampel 300 ppm, 20 μL genistein 300 ppm (sebagai pembanding), dan 20 μL air bebas ion sebagai kontrol.
BTK sebanyak 90 μL (1x) yang mengandung ATP dimasukkan ke dalam masing-masing sumur. Setelah itu, ditambahkan 20 μL larutan sampel yang berisi EGFR ke dalam setiap sumur (duplo). Sehingga tiap sumur mengandung 10 μL sampel 300 ppm dan 10 μL EGFR 4U dengan konsentrasi ATP (adenosin trifosfat) 0,3 mM. Selanjutnya, sumur-sumur ditutup dan diinkubasi pada temperatur kamar selama 30 menit. Campuran dikeluarkan dari masing-masing sumur, dan sumur dicuci dengan 200
μL bufer pencuci dengan lima kali pengulangan.
Larutan antibodi konjugat (HRP, Hoerse Radish Peroxidase) sebanyak 100 μL dengan pelarutan yang tepat dimasukkan ke dalam sumur. Sumur ditutup dan diinkubasi kembali selama 30 menit pada temperatur ruangan.. Setelah itu, larutan antibodi dikeluarkan dari sumur, kemudian masing-masing sumur dicuci dengan 200 μL bufer pencuci, pencucian dilakukan lima kali. Substrat OPD sebanyak 100 μL segar ditambahkan pada masing-masing sumur dan diinkubasi selama tujuh menit dalam keadaan gelap pada suhu ruangan. Larutan substrat peroksidase segar dibuat dengan cara pelarutan satu tablet OPD (O-fenilenadiamina) dan satu tablet urea hidrogen peroksida dalam 20 mL air deionisasi, dicampurkan sampai larut, dan dihindarkan dari cahaya sampai digunakan, larutan ini tidak untuk disimpan.
Warna jingga kuning akan muncul dalam sumur yang positif. Reaksi dihentikan dengan penambahan 100 μL H2SO4 2,5 N sebagai larutan penghenti pada masing-masing sumur. Sumur diukur absorbans-nya dengan mikroplate ELISA yang ditetapkan pada 490 nm. Pengukuran harus dalam waktu 30 menit dari penambahan larutan penghenti. Perhitungan persen inhibisi ekstrak kasar flavonoid pada Lampiran 9.
HASIL DAN PEMBAHASAN
Kadar Air
8
yang tidak diinginkan pada sampel. Suhu ini relatif aman serta mencegah terjadinya kerusakan pada senyawa metabolit sekunder tertentu, khususnya senyawa flavonoid. Flavonoid merupakan golongan senyawa fenol yang memiliki sistem aromatik terkonjugasi. Sistem aromatik terkonjugasi ini mudah rusak pada suhu tinggi. Selain itu, beberapa golongan flavonoid memiliki ikatan glikosida dengan molekul gula. Ikatan glikosida akan mudah rusak atau putus pada suhu tinggi.
Penentuan kadar air dilakukan untuk mengetahui kandungan air yang terdapat dalam sampel tanaman. Dengan mengetahui kadar air suatu sampel, dapat dilakukan cara penanganan terbaik untuk menghindari pengaruh aktivitas mikroorganisme. Penentuan kadar air pada sampel kering tanaman juga berfungsi sebagai faktor koreksi terhadap hasil rendemen ekstrak kasar flavonoid yang diperoleh.
Berdasarkan Tabel 1, kadar air rimpang temu putih segar adalah sebesar 82,81%. Hal ini berarti air yang terkandung dalam rimpang temu putih segar masih sangat besar. Namun setelah proses pengeringan selama 4 hari, kadar air rimpang temu putih ternyata berubah menjadi 10,42%. Sampel segar daun sambiloto memiliki kadar air sebesar 78,34%. Setelah didapatkan bobot kering yang stabil, ternyata kadar airnya berkurang sebesar 67,30% menjadi 11,04%. Kadar air batang kering sambiloto adalah 9,24% atau telah terjadi pengurangan sebesar 50,40% setelah pengeringan selama empat hari. Proses pengeringan menyebabkan kandungan air pada sampel berkurang cukup besar.
Tabel 1 Data kadar air tanaman sambiloto dan rimpang temu putih
Sampel Kadar air (%)
Batang segar sambiloto 59,64 Daun segar sambiloto 78,34 Batang kering sambiloto 9,24 Daun kering sambiloto 11,04 Rimpang segar temu putih 82,81 Rimpang kering temu putih 10,42
Rendemen Ekstrak Kasar Flavonoid
Ekstraksi rimpang temu putih dan tanaman sambiloto kering dilakukan dengan metode maserasi atau perendaman. Maserasi dilakukan hingga larutan ekstrak menjadi pucat atau menunjukkan hasil uji fitokimia yang negatif. Hal ini bertujuan memperoleh ekstrak yang optimum. Metode maserasi
digunakan untuk mengekstrak sampel atau senyawa target yang tidak tahan panas, tetapi metode ini membutuhkan jumlah pelarut cukup banyak.
Sebelumnya, sampel kering dimaserasi dengan heksana. Hal ini bertujuan untuk menghilangkan senyawa-senyawa non polar seperti lemak sehingga diharapkan tidak mengganggu proses ekstraksi tahap selanjutnya. Pelarut yang digunakan untuk ekstraksi adalah metanol-air dengan dua nisbah yang berbeda, yaitu 9:1 dan 1:1. Ekstrak senyawa aktif dari suatu jaringan tanaman dengan berbagai jenis pelarut pada tingkat kepolaran yang berbeda bertujuan untuk memperoleh hasil yang optimal, baik jumlah ekstrak maupun senyawa aktif yang terkandung dalam sampel. Pelarut MeOH-air nisbah 9:1 bertujuan untuk menarik senyawa-senyawa semipolar contohnya flavonoid, sedang nisbah 1:1 berfungsi untuk menarik senyawa metabolit yang bersifat polar seperti flavonoid-O-glikosida.
Proses ekstraksi dengan maserasi mengalami prinsip kelarutan adalah like dissolve like, yaitu pelarut polar akan melarutkan senyawa polar, dan sebaliknya pelarut kurang polar akan melarutkan senyawa yang kurang polar. Flavonoid-O-glikosida memiliki molekul gula. Molekul gula mempunyai gugus hidroksil. Gugus hidroksil bersifat polar, sehingga akan mudah larut dalam pelarut dengan kepolaran yang tinggi. Semakin banyak gugus monosakarida yang berikatan dengan senyawa flavonoid (ikatan glikosida) maka akan lebih bersifat polar. Hal ini disebabkan karena bertambahnya gugus hidroksil. Pelarut MeOH-H2O perbandingan 1:1 memiliki kepolaran yang lebih tinggi bila dibandingkan dengan perbandingan 1:9. Pelarut MeOH-H2O perbandingan 1:9 akan menarik senyawa dengan tingkat kepolaran yang lebih rendah. Contohnya senyawa flavonoid yang tidak memilki ikatan glikosida dengan molekul gula sederhana. Flavonoid ini kurang polar bila dibandingkan dengan flavonoid O-glikosida atau C-glikosida.
Setelah didapat ekstrak metanol, langkah selanjutnya adalah mempartisinya dengan pelarut heksana dan kloroform. Partisi ini bertujuan memisahkan senyawa-senyawa nonpolar sampai sedikit polar dari target senyawa akhir ekstraksi, yaitu golongan flavonoid.
9
berwarna coklat pekat. Rendeman ekstrak temu putih ialah sebesar 19,81 % (Lampiran 5).
Tabel 2 Rendemen ekstrak kasar flavonoid rimpang temu putih dan batang-daun sambiloto
Sampel Rendemen Wujud Sambiloto 16,90 Pasta hijau pekat Temu putih 19,81 Pasta cokelat pekat
Rendemen ekstrak temu putih lebih besar bila dibandingkan dengan tanaman sambiloto. Walaupun selisih rendemen kedua ekstrak tidak terlalu signifikan, yaitu sebesar 2,91%. Hal ini dapat disebabkan karena rimpang temu putih mengandung molekul pati, yaitu sekitar 12 %. Pati merupakan senyawa polisakarida. Polisakarida merupakan rantai panjang atau gabungan beberapa molekul monosakarida. Senyawa polisakarida mempunyai gugus hidroksil yang cukup besar, sehingga bersifat polar. Rendemen ekstrak kasar flavonoid temu putih dapat disebabkan oleh banyaknya senyawa pati yang tertarik saat proses ekstraksi dengan pelarut yang bersifat polar. Ekstrak kasar flavonoid tanaman sambiloto dan temu putih masih berupa pasta walaupun telah dilakukan pengering beku kira-kira 48 jam. Hal ini dapat disebabkan karena waktu yang kurang lama saat pengering beku.
Penapisan Fitokimia
Bagian tanaman yang digunakan dalam penelitian ini adalah bagian batang dan daun sambiloto dan rimpang temu putih. Alasan pemilihan bagian tanaman tersebut berdasarkan kebiasaan pada masyarakat. Uji fitokimia dilakukan pada sampel tanaman segar dan kering serta ekstrak kasar flavonoid. Uji fitokimia merupakan suatu uji kualitatif awal untuk mengetahui kandungan senyawa suatu tanaman atau ekstrak. Hal ini dilakukan untuk mengetahui kandungan senyawa aktif yang terdapat sampel pada tiap-tiap kondisi, yaitu saat segar, setelah dikeringkan dan dalam bentuk ekstrak.
Uji fitokimia kedua jenis sampel daun sambiloto (Tabel 3) menunjukkan bahwa kandungan senyawa dalam kedua jenis daun sama secara kualitatif, yaitu mengandung golongan senyawa alkaloid, flavonoid glikosida, flavonoid aglikon, tanin, dan steroid, tetapi tidak menunjukkan adanya senyawa saponin dan terpenoid. Sedangkan menurut Novalina (2003), daun sambiloto mengandung senyawa terpenoid dan saponin, perbedaan ini dapat disebabkan oleh
perbedaan cara analisis serta perbedaan asal tanaman. Informasi tempat pengambilan sampel tanaman perlu diketahui karena senyawa metabolit sekunder sangat bervariasi dan tergantung pada lingkungan tempat tumbuh antara lain tipe tanah tempat tanaman tersebut tumbuh, curah hujan, intensitas sinar matahari, dan lain sebagainya. Selain itu, analisis kuantitatif akan menghasilkan nilai yang lebih sensitif daripada analisis kualitatif yang hanya mengandalkan visualisasi sehingga tidak terlihat dengan jelas adanya senyawa terpenoid dan saponin pada saat analisis fitokimia dilakukan.
Tabel 3 Hasil penapisan fitokimia tanaman segar, kering dan ekstrak
Sampel Hasil Uji Kualitatif
A F (g) F (a) Sa T Te S
TP
Segar ++ + + + - + -
Kering + + + + - + -
Ekstrak + ++ + + - - -
SB
Segar + + + - + - +
Kering + + ++ - + - +
Ekstrak - +++ +++ + - - +
Keterangan:
TP : Temuputih SB : Sambiloto
Segar : Rimpang atau tanaman segar Kering: Rimpang atau tanaman kering T : Tanin
Sa : Saponin Te :Triterpenoid S : Steroid A : Alkaloid
F (g) : Flavonoid glikosida F (a) : Flavonoid aglikon
(+) : Hasil uji positif dan kepekatan warna (-) : Hasil uji negatif
Uji fitokimia rimpang temu putih segar menunjukkan bahwa kandungan senyawa metabolit rimpang segar tidak berbeda dengan sampel rimpang yang telah dikeringkan (Tabel 3). Proses pengeringan ternyata tidak mengubah susunan senyawa metabolit sekunder rimpang temu putih. Rimpang temu putih segar maupun kering mengandung senyawa metabolit sekunder alkaloid, flavonoid aglikon, flavonoid glikosida, saponin dan terpenoid, sedangkan untuk uji tanin dan steroid diperoleh hasil yang negatif.
10
komponen metabolit sekunder setelah proses ekstraksi sangat mungkin terjadi. Hal ini dapat disebabkan oleh perbedaan tingkat kepolaran antara suatu senyawa metabolit sekunder dengan pelarut. Hasil uji fitokimia pada ekstrak kasar flavonoid sambiloto menunjukkan senyawa tanin dan alkaloid sudah tidak teridentifikasi. Sedangkan pada ekstrak kasar flavonoid rimpang temu putih menunjukkan hasil negatif untuk uji fitokimia senyawa terpenoid.
Berdasarkan hasil uji fitokimia terhadap golongan flavonoid dalam ekstrak kasar flavonoid sambiloto dengan temu putih menunjukkan perbedaan intensitas warna yang didapatkan. Pada uji flavonoid golongan aglikon, ekstrak kasar flavonoid sambiloto menghasilkan warna merah yang cukup pekat pada lapisan amil alkohol. Sementara itu, ekstrak kasar flavonoid temu putih menghasilkan warna jingga. Perbedaan ini dapat disebabkan oleh jenis flavonoid yang dikandung setiap tanaman. Bukti lain yang memperkuat temuan tersebut adalah hasil uji fitokimia senyawa flavonoid glikosida. Warna merah yang timbul saat ekstrak kasar flavonoid sambiloto ditambahkan pereaksi HCl pekat lebih intensif daripada ekstrak kasar flavonoid temu putih.
Penentuan Total Fenol
Penentuan total fenol pada setiap ekstrak dilakukan untuk menentukan kadar senyawa fenol yang terdapat dalam setiap ekstrak. Flavonoid merupakan golongan senyawa fenol terbesar yang terdapat di alam (Harborne 1987), sehingga penentuan total fenol bertujuan untuk mengetahui kadar flavonoid yang terdapat dalam setiap ekstrak. Hasil uji total fenol pada setiap ekstrak menunjukkan absorbansi pada kedua panjang gelombang, yaitu 725 nm dan 760 nm. Pengukuran pada panjang gelombang 760 nm menggunakan standar asam galat, sedangkan pada panjang gelombang 725 menggunakan standar ialah asam tanat. Asam galat merupakan standar untuk mengukuran sampel pada makanan atau minuman yang diperkirakan mengandung senyawa fenol. Pada bidang farmakologi, menggunakan standar asam tanat.
Nilai absorbans yang terukur menyatakan intensitas senyawa fenol yang terdapat pada sampel. Semakin besar nilai absorbans yang dihasilkan maka kandungan senyawa fenol pada ekstrak tanaman tersebut semakin tinggi.
Total fenol ekstrak kasar flavonoid sambiloto dan temu putih dapat dilihat pada Tabel 4.
Tabel 4 Hasil uji total fenol pada tiap ekstrak tanaman dengan metode spektrofotometer sinar tampak
Ekstrak kasar tanaman
Absorbans (A) 725 nm 760 nm
Blanko 0,0052 0,0081
Sambiloto 1,0362 1,6198 Temu putih 0,9830 1,5528
Hasil uji total fenol (Tabel 4) menunjukkan kadar senyawa kedua ekstrak kasar flavonoid tanaman. Nilai absorbans yang dihasilkan pada panjang gelombang 725 nm saat penentuan total fenol tanaman sambiloto dan temu putih masing-masing sebesar 1,0362 dan 0,9830. Sedangkan pada panjang gelombang 760 nm, nilai absorbansi yang didapat pada tanaman sambiloto dan temu putih adalah sebesar 1,6198 dan 1,5528. Nilai absorbansi yang dimiliki oleh kedua ekstrak tanaman tidak jauh berbeda. Selisih nilai absorbans ekstrak tanaman sambiloto dengan temu putih pada panjang gelombang 725 nm adalah sebesar 0,0532; sedang pada pengukuran λ = 760 nm adalah sebesar 0,0670. Absorbans ekstrak tanaman sambiloto lebih besar dari temu putih pada pengukuran kedua panjang gelombang.
Berdasarkan total fenol menunjukkan kadar senyawa fenol yang cukup besar pada kedua ekstrak tanaman tersebut. Hal ini menunjukkan bahwa sebagian besar senyawa metabolit sekunder yang terdapat pada kedua ekstrak tanaman adalah senyawa golongan flavonoid. Hal ini diperkuat oleh hasil uji fitokimia ekstrak kasar flavonoid kedua tanaman.
11
dibandingkan pada temu putih, sehingga memungkinkan terjadinya perbedaan warna yang timbul dari hasil uji senyawa flavonoid dan penentuan total fenol.
Uji Toksisitas Terhadap Larva Udang
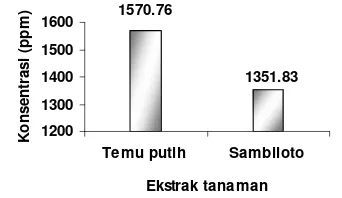
LC50 merupakan konsentrasi suatu ekstrak yang dapat mematikan populasi total larva udang. Uji toksisitas dengan larva udang dilakukan pada dosis (0, 10, 100, 500, 1000) ppm karena dosis ini merupakan dosis standar yang dilakukan untuk memprediksi tingkat ketoksikan dengan uji BSLT. Contoh data telah dianalisis menggunakan metode Probit Quant yang ditampilkan pada Gambar 11.
1351.83 1570.76 1200 1300 1400 1500 1600
Temu putih Sambiloto
Ekstrak tanaman K o n s en tr asi ( p p m )
Gambar 11 Nilai pada tiap ekstrak tanaman terhadap larva A. Salina.
Larva udang yang digunakan berumur 48 jam. Pada kondisi ini larva udang lebih senstif dan peka terhadap kondisi lingkungan Hal ini disebabkan dinding sel larva masih lunak, sehingga perubahan lingkungan air laut yang mengandung senyawa aktif tumbuhan akan diserap melalui kulit secara difusi dalam jumlah yang cukup besar. Akibatnya akan menimbulkan efek sistemik (Lu 1995). Selain itu, keanekaragaman kandungan senyawa metabolit sekunder yang dimiliki oleh suatu ekstrak dapat mempengaruhi kemampuan hidup larva udang. Semakin banyak jenis senyawa metabolit sekunder yang dimiliki oleh suatu ekstrak, maka ekstrak itu semakin berpotensi untuk mematikan populasi larva udang. Sehingga dapat dikatakan bahwa ekstrak tersebut akan lebih toksik bila dibandingkan dengan ekstrak yang kandungan senyawa metabolit sekunder kurang beranekaragam.
Nilai LC50 ekstrak kasar flavonoid tanaman sambiloto (Lampiran 6) adalah sebesar 1351,83 ppm dan temu putih (Lampiran 7) sebesar 1570,76 ppm. Senyawa yang memiliki nilai LC50 lebih kecil dari 1000 ppm dikatakan memiliki potensi bioaktif (Meyer et al. 1982). Sedangkan pada penelitian ini, nilai LC50 kedua ekstrak kasar
flavonoid lebih besar dari 1000 ppm. Artinya senyawa metabolit yang terkandung dikedua ekstrak akan bersifat toksik pada konsentrasi yang lebih tinggi dari 1000 ppm. Korelasi total fenol dengan nilai LC50 kedua ekstrak ternyata saling mendukung. Total fenol ekstrak kasar flavonoid sambiloto lebih besar dibandingkan temu putih, dan ternyata nilai LC50 pun lebih kecil dari temu putih. Semakin kecil nilai LC50 yang dimiliki oleh suatu ekstrak maka ekstrak tersebut akan semakin toksik. Konsumsi kedua ekstrak tanaman ini secara kontinu dalam waktu yang cukup lama diharapkan tidak akan memberikan efek toksik terhadap tubuh.
Uji Inhibisi in vitro Ekstrak Kasar Flavonoid terhadap Enzim Tirosin Kinase
Uji inhibisi tirosin kinase dilakukan secara
in vitro terhadap ekstrak kasar flavonoid tanaman sambiloto dan temu putih. Uji in vitro dilakukan dengan menggunakan teknik ELISA. Konsentrasi ekstrak kasar flavonoid sambiloto yang digunakan untuk menguji terhadap tirosin kinase secara in vitro adalah 300 ppm. Pada ekstrak temu putih menggunakan dua konsentrasi, yaitu 300 ppm dan 700 ppm. Konsentrasi ini dibawah nilai LC50 dari masing-masing ekstrak. Hal ini dilakukan untuk mengetahui daya hambat aktivitas enzim pada keadaan yang diharapkan tidak toksik dan aman untuk tubuh.
Pengujian tirosin kinase dilakukan menggunakan kontrol negatif (tanpa menambahkan ekstrak dan kontrol positif yaitu genistein. Dixon (2005) berpendapat bahwa genistein merupakan golongan senyawa isoflavonoid yang telah digunakan untuk pengobatan kemoterapi sel kanker. Selain itu, genistein mampu menghambat aktivitas kerja tirosin kinase. Genistein digunakan sebagai kontrol positif pada penelitian ini, lazim digunakan sebagai standar dalam menganalisis daya inhibisi dari tirosin kinase. Senyawa flavonoid ini berinteraksi secara kompetitif dengan sisi aktif ATP dan non-kompetitif dengan sisi aktif substrat dari tirosin kinase (Akiyama et al. 1987). Nilai konsentrasi genistein yang digunakan sama dengan konsentrasi ekstrak kasar yang diujikan pada tirosin kinase. Hal ini dimaksudkan untuk membandingkan daya hambat kedua ektrak kasar flavonoid tanaman dengan genistein terhadap aktivitas tirosin kinase.
12
absorbans akan sebanding dengan aktivitas tirosin kinase. Nilai absorbans yang besar menunjukkan bahwa enzim tersebut bekerja maksimal, atau dapat dikatakan bahwa aktivitasnya tidak terhambat oleh apapun. Semakin besar nilai absorbans yang didapat saat uji tirosin kinase, maka daya hambat ekstrak kasar flavonoid tanaman terhadap tirosin kinase akan semakin rendah. Keberadaan ekstrak kasar tanaman akan menghambat aktivitas kerja tirosin kinase agar tidak terbentuk produk.
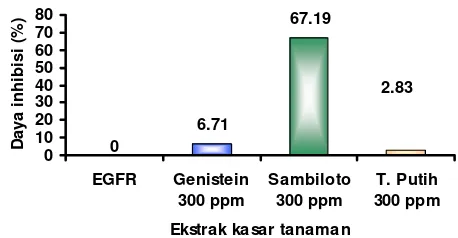
Berdasarkan Gambar 13, daya inhibisi ekstrak sambiloto dengan temu putih memiliki
persen inhibisi yang berbeda walaupun digunakan konsentrasi yang sama besar yaitu 300 ppm. Daya inhibisi ekstrak kasar flavonoid sambiloto 300 ppm lebih besar dibandingkan temu putih 300 ppm. Besarnya daya inhibisi ekstrak kasar sambiloto dan temu putih masing-masing adalah sebesar 67,19% dan 2,83%. Daya inhibisi ekstrak kasar sambiloto lebih besar bila dibandingkan dengan kontrol positif (genistein), sedangkan daya hambat ekstrak kasar temu putih lebih rendah bila dibandingkan genistein. Kontrol positif, yaitu genistein (300 ppm) mempunyai daya inhibisi sebesar 6,71% (Lampiran 10).
0 0.1 0.2 0.3 0.4 0.5 0.6
EGFR 300 PPM
EGFR 700 PPM
Genistein 300 ppm
Genistein 700 ppm
Smblt MeOH 300 ppm
T.putih MeOH 300 ppm
T.putih MeOH 700 ppm
Ekstrak kasar flavonoid
A
b
so
rb
an
s
Gambar 12 Absorbansi hasil uji inhibisi EGFR (kokntrol negatif), ekstrak kasar flavonoid, dan genistein (kontrol positif).
2.83
0
6.71
67.19
0 10 20 30 40 50 60 70 80
EGFR Genistein
300 ppm
Sambiloto 300 ppm
T. Putih 300 ppm
Ekstrak kasar tanaman
D
a
y
a
i
nhi
bi
s
i (
%
)
13
12.89 27.49 0 0 5 10 15 20 25 30EGFR Genistein 700
ppm
Temu putih 700 ppm
Ekstrak kasar tanaman
D a y a i nhi bi s i ( % )
Gambar 14 Persen inhibisi enzim tirosin kinase pada ekstrak kasar flavonoid rimpang temu putih dan genistein pada konsentrasi 700 ppm.
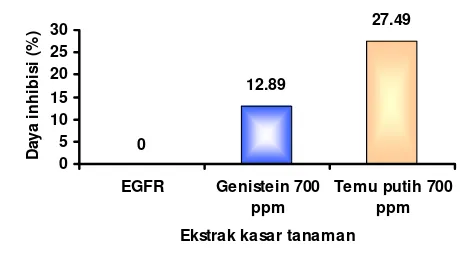
Gambar 14 menunjukkan persen inhibisi ekstrak temu putih pada konsentrasi 700 ppm terhadap aktivitas tirosin kinase. Pengujian ekstrak kasar flavonoid temu putih pada konsentrasi 700 ppm bertujuan untuk membandingkan daya inhibisi ekstrak dengan genistein. Berdasarkan hasil uji (Gambar 12), daya hambat (% inhibisi) ekstrak kasar temu putih pada konsentrasi 700 ppm lebih tinggi bila dibandingkan dengan kontrol positif (genistein). Hal ini dapat disebabkan oleh kandungan senyawa metabolit sekunder dari ekstrak kasar flavonoid rimpang temu putih. Ekstrak kasar flavonoid temu putih (Tabel 3) terdapat metabolit sekunder jenis alkaloid dan saponin. Kedua senyawa ini mempunyai efek sinergis dengan senyawa flavonoid dalam menghambat aktivitas tirosin kinase secara in vitro.
Daya hambat genistein adalah 12,89%; sedangkan ekstrak kasar flavonoid temu putih yaitu sebesar 27,49%. Walaupun demikian daya hambat ekstrak kasar flavonoid temu putih pada konsentrasi 700 ppm tetap lebih kecil dibandingkan dengan ekstrak kasar flavonoid sambiloto pada konsentrasi 300 ppm. Berdasarkan penelitian Pratiwi W (2006), daya hambat ekstrak air kran dan akuademineral temu putih pada konsentrasi 700 ppm tidak lebih besar dari ekstrak kasar flavonoid, yaitu sebesar 26,13% (dH2O) dan 24,40% (air kran).
Daya inhibisi yang dimiliki setiap ekstrak kasar flavonoid diduga berdasarkan kandungan senyawa flavonoid. Menurut Robinson (1995), flavonoid tumbuhan dapat menimbulkan gangguan besar karena kemampuannya membentuk kompleks dengan protein melalui ikatan hidrogen. Bila kandungan sel tumbuhan bercampur dan membran menjadi rusak selama proses isolasi maka golongan flavonoid cepat sekali
membentuk kompleks dengan protein, akibatnya akan menghambat aktivitas kerja enzim. Beberapa flavonoid menghambat fosfodiesterase, aldoreduktase, monoamina oksidase, protein kinase balik traskriptase, DNA polimerase, dan lipooksigenase (Harborne 1987). Dalam penghambatan kanker yang disebabkan benzo(a)pirena, diduga golongan flavonoid berperan dalam menghalangi terjadinya ikatan antara benzo(a)pirena dengan DNA (Le Bon 1993). Selain itu, flavonoid memiliki kemampuan dalam menghambat EGFR dari tirosin kinase (Botelho et al. 1988). Semakin besar kandungan flavonoid yang terdapat dalam setiap ekstrak maka akan semakin besar daya hambatnya terhadap aktivitas tirosin kinase.
Hasil uji total fenol (Tabel 4) pada panjang gelombang 725 nm dan 760 nm, absorbansi ekstrak kasar flavonoid sambiloto lebih besar dibandingkan temu putih. Flavonoid mampu menghambat aktivitas enzim tirosin kinase (Dixon 2002). Selain itu, berdasarkan nilai LC50 ekstrak kasar flavonoid sambiloto relatif lebih toksik bila dibandingkan dengan temu putih, karena konsentrasi LC50 ekstrak kasar flavonoid sambiloto lebih rendah dibandingkan temu putih. Keberadaan beberapa metabolit sekunder pada ekstrak kasar yang diujikan, diduga memiliki peran tersendiri dalam menghasilkan daya inhibisi yang cukup besar.
14
merupakan inhibitor spesifik dari tirosin kinase. Walaupun belum diketahui secara pasti jenis senyawa flavonoid yang terdapat pada ekstrak tanaman tersebut.
Sampai saat ini, inhibitor dari tirosin kinase diketahui terdiri dari dua tipe. Inhibitor pertama adalah inhibitor yang dapat berikatan dengan sisi aktif ATP dan yang kedua ialah inhibitor yang dapat berikatan dengan sisi aktif substrat dari tirosin kinase. Keberadaan senyawa dalam ekstrak kasar flavonoid tanaman memiliki peran tersendiri dalam berinteraksi baik dengan sisi aktif ATP maupun sisi aktif substrat enzim. Genistein yang digunakan sebagai kontrol positif pada penelitian ini merupakan salah satu inhibitor dari tirosin kinase yang berinteraksi secara kompetitif dengan sisi aktif ATP dan nonkompetitif dengan sisi aktif substrat dari tirosin kinase.
Seluruh ekstrak tanaman menunjukkan sifat inhibitor terhadap tirosin kinase, walaupun pada konsentrasi 300 ppm daya inhibisi ekstrak temu putih tidak sebesar genistein. Tetapi pada konsentrasi 700 ppm, ekstrak temu putih mampu menghambat aktivitas tirosin kinase lebih tinggi dari genistein sebagai kontrol positif. Hal ini sangat berguna sebagai bukti ilmiah pada kajian potensi dari ekstrak kasar flavonoid sambiloto dengan temu putih yang berpotensi sebagai antikanker maupun pencegah kanker.
SIMPULAN DAN SARAN
Simpulan
Rendemen ekstrak kasar sambiloto lebih kecil bila dibandingkan dengan temu putih. Namun daya hambat terhadap enzim tirosin kinase ekstrak kasar flavonoid sambiloto lebih baik dibandingkan temu putih. Ekstrak kasar flavonoid tanaman sambiloto serta rimpang temu putih berpotensi menghambat aktivitas enzim tirosin kinase secara in vitro. Pada konsentrasi 300 ppm ekstrak kasar flavonoid sambiloto mempunyai daya hambat yang lebih tinggi bila dibandingkan dengan genistein sebagai kontrol positif, sedangkan ekstrak kasar flavonoid temu putih memiliki daya hambat lebih rendah. Uji inhibisi ekstrak kasar flavonoid terhadap tirosin kinase dilanjutkan pengukuran dengan konsentrasi 700 ppm. Daya inhibisi ekstrak kasar flavonoid tanaman terhadap tirosin kinase secara in vitro akan meningkat dengan kenaikan konsentrasi.
Besar daya inhibisi ekstrak kasar flavonoid herbal sambiloto, rimpang temu putih serta genistein pada konsentrasi 300 ppm
masing-masing sebesar 67,19%; 2,83%; dan 6,71%. Pada konsentrasi 700 ppm, ekstrak kasar flavonoid temu putih dan genistein mempunyai daya inhibisi sebesar 27,49% dan 12,89%.
Saran
Penelitian lebih lanjut perlu penentuan kadar pati, lemak, dan protein kedua tanaman. Uji lebih lanjut yang disarankan adalah penentuan daya hambat kedua ekstrak kasar flavonoid terhadap enzim lain yang berperan pada aktivitas sel kanker dan dilakukan karakterisasi senyawa flavonoid pada kedua ekstrak kasar flavonoid.
DAFTAR PUSTAKA
Akiyama et al. 1987. Genistein, a specific inhibitor of tirosine-spesific protein kinases. J Biol Chem. 262:5592-5595.
[Anonim]. 2005. info Tanaman Obat Indonesia. Tentang Sambiloto. www.mahkotadewa. com/INFO-TO/ sambiloto. htm. [30 Maret 2005].
Challem J, Toecus VD, Knittel L. 2002. The Soy Sensation. New York: McGraw-Hill.
Chen J, C Han. 2000. The Protective Effect of Tea on Cancer: Human Evidance. Di dalam Phytochemicals As Bioactive Agents. Basel: Technomic.
Chyau CC, JL Mau, CC Chen, CH Chang. 2002. Composition and antioxidant activity of the essential oil from Curcuma zeodaria. http: // ift. Confex.com/ift/2002/ techprogram/paper_10795.htm [1 Mei 2005].
Dalimartha S. 1999. Atlas Tumbuhan Obat Indonesia. Jakarta: Trubus Agriwidya.
Dardanella D. 2005. Penapisan Beberapa Tanaman Asli Indonesia yang Berpotensi Sebagai Antikanker Secara Enzimatis [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor; 2005.
Dixon RA, Ferreira D. 2002. Molecules of Interest Genistein. Phytochemistry 60: 205-211.
15
Yielding Non-seed Carbohydrates, Bagian ke-1 & 2 [bibliografi]. Bogor: Prosea Foundation.
Hamburger M, Hostettmann K. 1991. Bioactivity in Plant: The Link Between Phytochemistry and Medicine.
Phytochemistry 12: 3864-3847.
Harborne JB. 1987. Metode Fitokimia: Cara Menganalisis Tanaman. Terjemahan K. Padmawinata & I Sudiro. Bandung: ITB.
Hariani R. 2004. Nutrisi pada Penderita Kanker.http://www.dharmais.co.id./new/c ontent.php?page=article&lang=id&id=4yu . [1 April 2005].
Heyne K. 1987. Tanaman Berguna Indonesia. Terjemehan Badan Litbang Kehutanan Jakarta, Jilid I. Jakarta: Badan Penelitian dan Pengembangan Kehutanan.
Hukom RA. 2004. Transfusi Komponen Darah pada Penderita Kanker. Seminar Sehari RS Kanker Dharmais. http://www.dharmais.co.id./new/content.p hp? page=article&lang=id&id=8. [1 April 2005].
Iswantini D, Sugita P, Saprudin D. 2003. Kajian potensi senyawa flavonoid dari Temu putih sebagai antikanker secara enzimatis [Laporan Penelitian]. Bogor: Institut Pertanian Bogor.
Iswari D. 1998. Seri Pengalaman Obat tradisional. Jakarta: PT Niaga Swadaya.
Jang MK, Sohn DH,Ryu JH. 2001. A curcuminoid and sesquiterpens as inhibitors of macrophage TNF alpha release from Curcuma zedoaria. Planta Med 67: 550-552.
Le Bon AM, Ziegler L, Suschetet M, Fenwick GR. 1993. Comparison of Hydroxylated and non Hydroxylated natural flavonoid as in vitro modulator of rat hepatic benzo(a)pyrene metabolism. Waldron KW, Johnson IT Editor. Royal Society of Chemistry, Cambridge. Paris: INRA Toxycologic Nutritionelle.
Lu FC. 1995. Toksikologi Dasar. Terjemahan Edi Nugroho. Jakarta: Universitas Indonesia.
Malhmann S. 2000. Signalling by Tyrosin Kinase on Regular and Disrupted Hemetopiesis. Swiss: Brussel Institute for Immunology.
Matter A. 2002. Tyrosine kinase inhibitors in cancer drug discovery. http://www. cancerprev.org/Journal/Issue/26/101/901/4 237. [21 Januari 2005].
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Bandung: ITB
Meyer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nichols DE, Mclaughlin JL. 1982. Brine Shrimp: A Convenient General Bioassay for Active Plant Constituents.
Planta Med. 45: 31-34.
Nanduri et al. penemu; Dr. Reddy's Research Foundation. 26 November 2002. Anticancer compounds: process for their preparation and pharmaceutical compositions containing them. US Patent 6.486.196.
Novalina SP. 2003. Penggunaan Tanaman Obat Sebagai Upaya Alternatif dalam Terapi Kanker. [Makalah Pribadi]. http://rudyct.topcities.com/pps702_1034/n ovalina.htm [1 April 2005]
O’Dwyer ME, Druker BJ. 2000. The Role of Tyrosine Kinase Inhibitor ST1571 in The Treatment of Cancer. Portland: Oregon Health Sciences University.
Pratiwi W. Inhibisi ekstrak air dan etanol Temu putih (Curcuma zedoaria Roscoe) terhadap aktivitas tirosin kinase [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor; 2006.
Robinson T. 1993. Kandungan Organik Tumbuhan Tinggi. Ed. Ke-6. Terjemahan Kosasih Padmawinata. Bandung: Penerbit ITB.
Rood L. 1998. The possible role of soy in breast cancer prenvention and treatment.
Nutrition Bytes 4:1-5.
Schunak W, K Mayer & M Haake. 1990.
16
Simadibrata M. 2004. Diare dan Konstipasi Akibat Kemoterapi. Seminar Sehari RS Kanker Dharmais. http://www. Dharmais. co.id./new/content.php?page=article&lang =id&id= 8yu. [1 April 2005]
Sismindari 2003. Cytotoxic effects of methanol extract isolated from Erythrina fusca Lour leaves on cancer cell-lines. Volume 35, No. 2.
Siswandono, Soekardjo. 1995. Kimia Medisinal. Surabaya: Airlangga University Press.
Soedibyo M. 1993. Inventaris Tanaman Obat Indonesia (II). Jakarta: Depkes RI.
Sukardiman, Rahman A, Ekasari W. 2001. Efek sitotoksik senyawa andrografolida dari herba Sambiloto terhadap kultur sel kanker leukimia [Laporan Penelitian]. Surabaya: Fakultas Farmasi, Universitas Airlangga.
Syu et al. 1998. Cytotoxicity of curcuminoids and some novel compounds from
Curcumazedoaria. J Natural Product 261: 128-134.
Syukur C, Hernani. 2001. Budi Daya Tanaman Obat Komersial. Bogor: Penebar Swadaya.
Utami KP. 2000. Temu putih redam kanker leher rahim. Trubus 31 (366):19-20.
Voller A, Bidwell D, Bartlett A. Microplate enzyme immunoassays for the immunodiagnosis of virus infections. Didalam: Rose NR, Friedman H, editor.
Manual of Clinical Laboratory Immunology. Ed ke-3. Washington DC: American Society for Microbiology.
Wei H, Bowen R, Cai Q. 1995. Antioxidant and antipromotional effects of the soybean isoflavone genistein. Proc Soc Exp Biol Med 208: 124-130.
Winarto WP. 2003. Budi Daya Sambiloto dan Pemanfaatan Untuk Obat. Jakarta: Penebar Swadaya.
WHO. 1999. WHO monographs on selected medical plants. http://hinfo198. tempdomainname. com/gsdl2/collect/ edmweb/pdf/s4927e/s4927e.pdf. [17 Desember 2005].
17
20
Lampiran 3 Metode pembuatan pereaksi uji fitokimia
Pereaksi Dragendroff
Bismut subnitrat (basic), BiNO3(OH)2 BiO(OH) ditimbang sebanyak 0.85 gram,
kemudian dilarutkan dalam pelarut campuran CH3COOH glasial 10 mL dengan 40 mL
H2O. Campuran ini kemuadian ditambahkan larutan KI (KI sebesar 8 gram dilarutkan
dalam 20 mL H2O).
Pereaksi Mayer
HgCl2 ditimbang sebanyak 1,3 gram kemudian dilarutkan dalam 30 mL H2O dan
dihomogenkan (larutan 1). KI ditimbang sebesar 5 gram lalu dilarutkan kedalam 30 mL
H2O kemudian dihomogenkan (larutan 2). Larutan 1 dan 2 kemudian dimasukkan
kedalam labu takar 100 mL dan ditambahkan H2O hingga tanda tera. Pereaksi ini
disimpan pada botol coklat atau berwarna untuk menghindari kerusakan.
Pereaksi Wagner
KI ditimbang sebesar 2 gram dan I2 ditimbang sebanyak 2,5 gram. Keduanya
dimasukkan kedalam gelas piala dan ditambahkan H2O sebanyak 100 mL lalu
dihomogenkan. Setelah itu, larutan disaring dan disimpan dalam botol coklat atau
berwarna.
Pereaksi Lieberman-Burchard
Asam sulfat pekat dipipet sebanyak 5,0 mL lalau dimasukkan kedalam gelas piala
dan disimpan dalam penangas es (dalam keadaan dingin). Setelah itu ditambahkan asam
asetat anhidrat sebesar 5,0 mL dan volume akhir dijadikan 50 mL dengan pelarut etanol
21
Lampiran 4 Penentuan kadar air
Kadar air sampel daun sambiloto segar Ulangan Bobot cawan
kosong (g)
Bobot cawan + sampel (g)
Bobot segar (g)
Bobot kering (g)
Kadar air (% b/b)
1 32,4022 33,4086 1,0064 0,2194 78,20
2 34,3217 35,3586 1,0369 0,2215 78,64
3 29,6054 30,6231 1,0177 0,2221 78,18
Kadar air sampel batang tanaman sambiloto segar Ulangan Bobot cawan
kosong (g)
Bobot cawan + sampel (g)
Bobot awal (g)
Bobot kering (g)
Kadar air (% b/b)
1 32,4022 33,4072 1,0050 0,4123 58,97
2 34,3217 35,3721 1,0504 0,4272 60,75
3 29,6054 30,6167 1,0113 0,4126 59,20
Kadar air sampel daun tanaman sambiloto kering Ulangan Bobot cawan
kosong (g)
Bobot cawan + sampel (g)
Bobot awal (g)
Bobot akhir (g)
Kadar air (% b/b)
1 30,9364 31,9612 1,0248 0,9070 11,49
2 28,9933 30,0208 1,0275 0,9228 10,19
3 33,3146 34,3185 1,0039 0,8890 11,44
Kadar air sampel batang tanaman sambiloto kering Ulangan Bobot cawan
kosong (g)
Bobot cawan + sampel (g)
Bobot awal (g)
Bobot akhir (g)
Kadar air (% b/b)
1 32,4033 33,4413 1,0380 0,9482 8,65
2 34,3227 35,3394 1,0167 0,9184 9,67
3 29,6059 30,6220 1,0161 0,9205 9,41
Perhitungan kadar air:
% Kadar air =
(
)
100%g sampel Bobot
g kering) sampel bobot basah sampel
(Bobot − ×
Contoh Perhitungan:
% Kadar air =
(
)
100%g 1,0248
g ) 09070 1,0248
( − ×
= 11,4949%
≈ 11,49%
22
Lampiran 5 Bagan alir metode ekstraksi tanaman sambiloto dan temu putih
Dicuci, ditiriskan, diiris tipis Dikeringkan suhu 40 OC Dihaluskan
Maserasi
Disaring
Filtrat
Filtrat
Rotary evaporator, s.d. 1/3 volume
Lampiran 6 Bagan alir pengujian ekstrak kasar flavonoid tanaman Tanaman segar
(Sambiloto dan Temu Putih)
Serbuk tanaman Uji Fitokimia
Heksana
Ampas
Metanol : Air (9 : 1)
Metanol : Air (1 : 1)
Filtrat dikumpulkan
Partisi oleh heksana dan kloroform
Fraksi air Fraksi Heksana
dan kloroform
Rotari evaporator
Ekstrak kasar flavonoid
Ekstrak kasar
Flavonoid
Uji fitokimia
Uji hayati larva udang
Uji tirosin kinase Penentuan total fenol
23
Lampiran 7 Rendemen ekstrak kasar flavonoid tanaman sambiloto dan temu putih
Data rendemen hasil ekstraksi kasar flavonoid sambiloto dan temu putih Sampel Bobot sampel
kering (g)
Labu kosong (g)
Labu + ekstrak (g)
Bobot ekstrak (g)
Rendemen (%) Sambiloto 5,0401 42,1213 42,8866 0,7653 16,90 Temu putih 5,0550 148,7079 149,6051 0,8972 19,81 Perhitungan rendemen ekstrak kasar flavonoid:
% Rendemen =
(
1
-
kadar
air
)
(bobot
sampel)
g
100%
g
flavonoid)
kasar
ekstrak
(Bobot
×
×
Lampiran 8 Hasil uji hayati larva udang ekstrak kasar flavonoid sambiloto
Ulangan Konsentrasi (ppm) Jumlah awal larva A. salina
Jumlah larva A. Salina
setelah 24 jam
1 0 10 0
10 10 0
100 10 1
500 10 1
1000 10 3
2 0 10 0
10 9 0
100 9 1
500 1