EVALUASI BEBERAPA DESAIN PIPA MIKRO-PORI
SEBAGAI DIFUSER PADA SISTEM AERASI MEDIA
PEMBESARAN IKAN PATIN PASUPATI
Pangasius
sp
KURNIAWAN WAHYU HIDAYAT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul “Evaluasi beberapa desain
pipa mikro-pori sebagai difuser pada sistem aerasi media pembesaran ikan patin pasupati Pangasius sp” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2017
Kurniawan Wahyu Hidayat C151140311
RINGKASAN
KURNIAWAN WAHYU HIDAYAT. Evaluasi beberapa desain pipa mikro-pori sebagai difuser pada sistem aerasi media pembesaran ikan patin pasupati Pangasius sp. Dibimbing oleh EDDY SUPRIYONO, DANIEL DJOKOSETIYANTO dan ANI WIDIYATI.
Produksi ikan patin di Indonesia terus menunjukkan peningkatan setiap tahunnya. Peningkatan produksi dalam negeri dan permintaan yang tinggi di luar negeri menjadikan komoditas ini potensional sebagai komoditas ekspor. Salah satu kendala dalam usaha ekspor produk ikan patin (Pangasianodon hypophthalmus) adalah warna daging yang dihasilkan berwarna kekuningan. Ikan patin pasupati adalah hibrida dari patin siam dan patin jambal yang mempunyai warna daging putih. Spesifikasi daging ikan patin pasupati sesuai dengan permintaan pasar ekspor. Permasalahan ikan patin pasupati adalah intoleran terhadap oksigen terlarut rendah. Usaha untuk mengatasi masalah oksigen terlarut yang rendah adalah dengan aerasi. Pipa mikro-pori adalah pipa karet yang memiliki ukuran pori sangat kecil (µm). Pipa ini jika dijadikan difuser mampu menghasilkan gelembung yang lebih kecil, sehingga mampu meningkatkan kadar oksigen terlarut. Penelitian ini bertujuan mengevaluasi pengaruh penggunaan pipa mikro-pori sebagai difuser terhadap kualitas air, respons fisiologis dan kinerja produksi pada pembesaran ikan patin pasupati (Pangasius sp).
Penelitian ini menggunakan rancangan acak lengkap dengan 4 perlakuan dan 3 ulangan. Data dianalisis secara statistik dengan ANOVA (one-way analysis of variance) menggunakan program SPSS 22. Parameter yang berbeda nyata dilakukan uji lanjut Duncan. Pipa mikro-pori dibentuk dalam beberapa desain yaitu linear (L), sirkular (S), dan paralel (P), batu aerasi digunakan sebagai kontrol (K). Ikan patin dengan bobot 78,33±2,34 g ekor-1 dipelihara di bak fiberglass sebanyak
12 buah yang berukuran ø 1,60 m dan tinggi 0,4 m dengan kepadatan 12 ekor ikan bak-1 selama 60 hari pemeliharaan. Pemberian pakan sebesar 5% dari biomassa ikan,
yang diberikan sebanyak 2 kali sehari pada pukul 08.00 dan 18.00 WIB.
Parameter uji yang diamati yaitu ukuran diameter gelembung, serta kualitas air, yang meliputi oksigen terlarut, suhu, pH, TAN, alkalinitas, dan CO2 bebas.
Respons hematologis meliputi konsentrasi hemoglobin, hematokrit, jumlah sel darah merah, dan sel darah putih, respons stres glukosa dan gas darah (pH dan saturasi oksigen darah). Kinerja produksi meliputi laju pertumbuhan harian, kelangsungan hidup, feed conversion ratio (FCR) dan biomassa panen bersih.
Hasil menunjukkan pipa mikro-pori menghasilkan gelembung dengan diameter lebih kecil 0,039 -0,127 mm (p<0,1) dibandingkan dengan kontrol dan oksigen terlarut lebih stabil pada kisaran 4,9-7,6 mg L-1. Penggunaan pipa
Kualitas air selama penelitian masih dalam kondisi optimal untuk pemeliharaan ikan patin pasupati, dengan kisaran oksigen terlarut 3,7-7,6 mg L-1, suhu antara
25,1-29,5 °C, pH 6,3-8,8, TAN 0,03-0,08 mg L-1, alkalinitas pada kisaran
30,53-45,80 mg L-1, dan CO
2 bebas dalam kisaran 0,36-0,61 mg L-1.
SUMMARY
KURNIAWAN WAHYU HIDAYAT. Evaluation of several design microporous pipe as a diffuser aeration media system on grow out of pasupati catfish Pangasius sp. Supervised by EDDY SUPRIYONO, DANIEL DJOKOSETIYANTO and ANI WIDIYATI.
Catfish production in Indonesia continues to increase each year. Increased domestic production and high demand abroad potensional make these commodities as export commodity. One of the obstacles in the export business of Siamese catfish (Pangasianodon hypophthalmus) products is produced meat color yellowish. Patin Pasupati (Pangasius sp.) is a hybrid of Siamese and jambal catfish which have white meat. The specifications of pasupati catfish meat are suitable for market demand export. Problems of pasupati catfish are intolerant to low dissolved oxygen. To overcome the problem of low dissolved oxygen is by aeration. The microporous pipe is a rubber tube which has a very small pore size (µm), this pipe if used as a diffuser capable of producing smaller bubbles, it is able to increase the levels of dissolved oxygen. This study aimed to evaluate the effect of using a microporous diffuser on water quality, physiological responses and production performance of growing out Pasupati catfish (Pangasius sp).
Completely Randomized Design (CDR) were used, it consist of four treatments and three replications. Data were statistically analyzed by ANOVA (one-way analysis of variance) using SPSS 22. Significantly different to do a further test of Duncan. Micropores pipe were formed in several shape namely : linear (L), circular (S) and parallel (P). Airstone used as a control (K). Catfish with a weight of 78.33±2.34 g tail-1 reared in fiberglass tank spread at 12 units sized ø 1.60 m and
height of 0.4 m with a density of 12 fish tank-1 for 60 days of rearing. The feeding
rate is 5% of the average weight of the biomass is given as much as 2 times daily at 08.00 am and 18.00 pm.
Test parameters were observed, Physical parameters of bubble size diameter, water quality, including dissolved oxygen, temperature, water acidity (pH), TAN, alkalinity, and free CO2. A hematological response such as hemoglobin
concentration, hematocrit, the number of red and white blood cells, the stress response of blood glucose, and blood gases (blood pH and oxygen blood saturation). Production performance includes specific growth rate, survival, feed conversion ratio and harvest.
The results showed the use of micro-porous pipe producing bubbles with a smaller diameter 00.39-0.127 mm (p<0.1). Produced more stable dissolved oxygen in the range of 4.9-7.6 mg L-1. The use of microporous pipe showed was able to
temperature between between 25.1-29.5°C, pH 6.3-8.8, TAN 0.03-0.08 mg L-1,
alcalinity range 30.53-45.80 mg L-1, and free CO
2 between 0.36-0.61 mg L-1.
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
EVALUASI BEBERAPA DESAIN PIPA MIKRO-PORI
SEBAGAI DIFUSER PADA SISTEM AERASI MEDIA
PEMBESARAN IKAN PATIN PASUPATI
Pangasius
sp
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR
Judul Tesis : Evaluasi beberapa desain pipa mikro-pori sebagai difuser pada sistem aerasi media pembesaran ikan patin pasupati Pangasius sp
Nama : Kurniawan Wahyu Hidayat NIM : C151140311
Disetujui oleh
Komisi Pembimbing
Dr Ir Eddy Supriyono, MSc Ketua
Prof Dr Ir Daniel Djokosetiyanto, DEA Anggota
Dr Ir Ani Widiyati, MSi Anggota
Diketahui Oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah Subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul Evaluasi beberapa desain pipa mikro-pori sebagai difuser pada sistem aerasi media pembesaran ikan patin pasupati Pangasius sp. pada Program Studi Ilmu Akuakultur, Program Pascasarjana, Institut Pertanian Bogor.
Ucapan terima kasih penulis sampaikan kepada : Dr Ir Eddy Supriyono, MSc, Prof Dr Ir Daniel Djokosetiyanto, DEA dan Dr Ir Ani Widiyati, MSi selaku komisi pembimbing, Dr Ir Dinar Tri Soelistyowati, DEA selaku penguji luar komisi dan Dr Tatag Budiardi, MSi selaku perwakilan program studi atas waktu, kebijaksanaan, tuntunan, perhatian, kesabaran, nasehat, semangat, serta masukan-masukan yang telah diberikan hingga tesis ini dapat diselesaikan.
Penulis juga mengucapkan terimakasih kepada Ibunda Karsinah SPd, Ayahanda Warsun (Alm), dan Bapak Masngudin SpdI atas doa, semangat, kasih sayang, dan keteladanan untuk selalu pantang menyerah, fokus, sabar dan jujur. Istriku Kurnia Arofah, MSi anakku Alif Shaqiri Kurniawan, Bapak-Ibu mertua Dr Ir Triwulan Tjiptono, Sri Hidayah, BA atas doa, dukungan, dan perhatian, Adik-adiku Rino HP, ST, Destrianita NH, SPd, Drg Fajar N untuk doa dan semangatnya.
Ucapan terimakasih juga penulis sampaikan kepada rekan sepenelitian Ruwaidah, Akhmad Bayu Prasetyo. Deni Radona MSi, Bapak Ranta, Sumitro, Suclyadi D, Eko P, Rinaldi, Suardi L, dan Reinal P, Azhari Tarmizi yang telah membantu kegiatan di lapangan maupun laboratorium serta teman-teman mahasiswa Program Studi Ilmu Akuakultur Angkatan 2014 atas kebersamaan, keceriaan, kekompakan serta motivasinya dalam menempuh studi.
Terimakasih juga kepada Staf dan karyawan pelaksana Instalasi Riset Lingkungan Perikanan Budidaya dan Toksikologi Cibalagung, Balai Riset Perikanan Budidaya Air Tawar Bogor, staf dan pelaksana Laboratorium Lingkungan Akuakultur, Pimpinan, staf, dan pelaksana Laboratorium Darah Rumah Sakit PMI Bogor.
Akhir kata, semoga karya ilmiah ini bermanfaat untuk kemajuan ilmu pengetahuan pada umumnya dan perikanan khususnya.
Bogor, Januari 2017 Kurniawan Wahyu Hidayat
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis 3
2 METODE
Waktu dan Tempat 3
Penelitian Pendahuluan 3
Rancangan Penelitian 4
Bahan Uji 4
Persiapan bak dan Pemeliharaan Ikan 4
Parameter Uji 4
Analisis Data 6
3 HASIL DAN PEMBAHASAN
Hasil 7
Pembahasan 12
4 SIMPULAN DAN SARAN
Simpulan 18
Saran 18
DAFTAR PUSTAKA 19
LAMPIRAN 25
DAFTAR TABEL
1 Parameter kualitas air yang diukur selama penelitian 5 2 Parameter gas darah yang diukur selama penelitian 5 3 Kisaran parameter kualitas air pemeliharaan ikan patin pasupati 8
4 Parameter gas darah ikan patin pasupati 11
5 Kinerja produksi ikan patin pasupati 12
DAFTAR GAMBAR
1 Pengukuran diameter gelembung pada dasar (●) dan permukaan (▲)
bak pemeliharaan perlakuan kontrol (K) 7
2 Pengukuran diameter gelembung pada dasar (●) dan permukaan (▲)
bak pemeliharaan perlakuan mikro-pori 7
3 Hasil pengukuran oksigen terlarut pada media budidaya ikan patin
pasupati 8
4 Konsentrasi hemoglobin awal (■) dan akhir (□) ikan patin pasupati 9 5 Kadar hematokrit awal (■) dan akhir (□) ikan patin pasupati 9 6 Jumlah sel darah merah awal (■) dan akhir (□) ikan patin pasupati 10 7 Jumlah sel darah putih awal (■) dan akhir (□) ikan patin pasupati 10
8 Kadar glukosa darah ikan patin pasupati 11
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar Belakang
Filet ikan patin (Pangasianodon hypophthalmus, Sauvage 1878) menjadi komoditas ekspor yang bernilai ekonomis tinggi. Permintaan pasar yang tinggi, baik domestik maupun internasional terus meningkat setiap tahunnya. Menurut FAO (2014) volume ekspor filet ikan patin dunia tahun 2012 mencapai 1,6 miliar ton, dengan komposisi eksportir 75% disuplai dari Vietnam, 25% dari Indonesia, Bangladesh, Kamboja, Malaysia dan Myanmar. Untuk peningkatan produksi, Indonesia menargetkan ekspor filet patin 500 000-600 000 ton per Tahun.
Menurut Darmawan dan Hastarini (2011) kendala yang dihadapi pada budidaya ikan patin siam P. hypopthalmus adalah dagingnya yang kekuningan, spesifikasi ini tidak sesuai dengan standar ekspor sehingga harga jual menjadi lebih rendah. Ikan patin jambal (Pangasius djambal, Bleeker 1846) memiliki daging berwarna putih dan disukai oleh konsumen luar negeri. Ikan patin jambal P. djambal adalah ikan asli Indonesia, yang merupakan kerabat dekat dari ikan patin Siam (P. hypophthalmus) yang berasal dari sungai Mekong (Ariyanto dan Utami 2006; Legendre dan Parisele 1998).
Menurut Orban et al. (2008) hasil proksimat ikan patin menunjukkan kandungan protein 12,6–15,6%, lemak 1,1–3,0%, kolesterol 21–39 mg/100 g, dan tinggi kandungan asam lemak jenuh 41,1–47,8% (dari total asam lemak), rendah kandungan asam lemak tak jenuh 12,5–18,8% (dari total asam lemak) yang diwakili oleh asam linoleic 44–59% (dari total asam lemak tak jenuh). Tingginya nutrien yang terkandung dan rasa daging ikan patin sangat enak, gurih dan lezat sehingga digemari oleh masyarakat (Rahardja et al. 2011). Permintaan yang tinggi menjadikan ikan ini menjadi populer di dunia, sehingga mampu menggerakan perekonomian (Thuy 2010). Produksi ikan patin di Indonesia terus menunjukkan peningkatan setiap tahunnya. Pemerintah menargetkan angka produksi ikan patin dapat meningkat secara signifikan. Dengan kapasitas produksi yang tinggi, diharapkan visi untuk menjadikan Indonesia sebagai salah satu negara pengekspor ikan patin di dunia dapat tercapai (Roesfitawati 2013). Saat ini Kementerian Kelautan dan Perikanan telah menjadikan ikan patin sebagai komoditas unggulan untuk ketahanan pangan (KKP 2013).
Gunadi et al. (2006) menyatakan bahwa salah satu upaya untuk menggabungkan ciri-ciri keunggulan ikan patin jambal dan ikan patin siam adalah melalui persilangan (hibridisasi). Kegiatan ini perlu dilakukan secara cermat dan perlu kajian yang mendalam agar sasaran yang diharapkan yakni ikan patin unggul dapat dicapai. Ikan patin pasupati (Pangasius sp.) adalah hasil hibridisasi ikan patin Siam (P. hypopthalamus) betina dengan ikan patin djambal (P. djambal) jantan (Setijaningsih et al. 2006). Ikan patin pasupati memiliki keunggulan daging berwarna putih, dan pertumbuhanya relatif lebih cepat. Pemeliharaan ikan patin pasupati di karamba jaring apung (KJA) menghasilkan pertumbuhan harian sebesar 1,12 g hari -1, lebih tinggi dibandingkan dengan ikan patin djambal 0,83 g hari-1
(Gunadi et al. 2006). Namun demikian, pada masa pendederan ikan patin pasupati, tidak toleran pada kondisi perairan dengan kadar oksigen terlarut rendah di bawah
2
memerlukan oksigen terlarut di atas 3 mg L-1. Pernyataan tersebut sesuai dengan
Slembrouck et al. (2009), bahwa selama pendederan, larva ikan patin membutuhkan konsentrasi oksigen terlarut di atas 3 mg L-1.
Salah satu aspek yang mempengaruhi pertumbuhan ikan adalah kualitas air media pemeliharaan. Kecukupan kebutuhan oksigen terlarut yang optimal dapat mendukung pertumbuhan ikan dengan baik. Kebutuhan oksigen bergantung pada spesies, tahapan kehidupan, ukuran, status kesehatan, kualitas air, tingkat pemberian pakan, dan tingkat respirasi bakteri (Clark 2003). Menurut Bewtra dan Mavinic (1977) oksigen terlarut dapat dihasilkan melalui metode yang umum dipakai yaitu agitasi permukaan air (kincir) dan difusi udara melalui difuser aerator (batu aerasi).
Prinsip metode aerasi dengan difuser adalah dengan memaksa udara melalui media berpori yang menghasilkan gelembung dengan jumlah banyak (Endo et al. 2008). Menurut Lekang (2007), tujuan aerasi adalah membuang gas yang berbahaya seperti N2 dan CO2 dan untuk meningkatkan konsentrasi oksigen terlarut
dalam air. Berdasarkan penelitian, penerapan teknologi gelembung mikro dalam sistem aerasi budidaya kerang menghasilkan pertumbuhan yang lebih cepat dan mampu menurunkan kematian (Onari et al. 2002; Matsuo et al. 2001).
Mallya (2007) dalam penelitianya menemukan fakta bahwa ikan halibut (Hippoglossus hippoglossus) menghasilkan pertumbuhan dan FCR (feed conversion ratio) terbaik pada lingkungan dengan saturasi oksigen 80%-120%. Menurut Dickman dan Vollmer (2001) difuser dengan bentuk lingkaran (sirkular) dan persegi (paralel) lebih efektif dalam pengadukan dan aerasi dibandingkan dengan batu aerasi (coarse diffusers). Berdasarkan hal tersebut, untuk meningkatkan produksi dan efisiensi, maka diperlukan suatu kajian ilmiah mengenai penggunaan pipa mikro-pori terhadap kualitas air, respons fisiologis dan kinerja produksi pada pembesaran ikan patin pasupati.
Perumusan Masalah
3 Tujuan Penelitian
Penelitian bertujuan menganalisis penggunaan pipa mikro-pori sebagai difuser aerasi terhadap perbaikan kualitas air khususnya oksigen terlarut, respons fisiologis dan kinerja produksi pada pembesaran ikan patin pasupati (Pangasius sp).
Manfaat Penelitian
Manfaat penelitian ini adalah dapat dijadikan acuan dalam penggunaan pipa mikro-pori dalam sistem aerasi pada pemeliharaan ikan patin pasupati pada skala lapangan.
Hipotesis
Hipotesis yang diajukan pada penelitian ini adalah penggunaan pipa mikro-pori sebagai difuser dengan bentuk yang berbeda dapat menghasilkan gelembung yang mampu memperbaiki kualitas air media pemeliharaan khususnya oksigen terlarut, memberikan hasil terbaik terhadap respons fisiologis (gas darah, glukosa darah dan hematologi) sehingga mendukung kinerja produksi ikan ikan patin pasupati Pangasius sp.
2
METODE PENELITIAN
Waktu dan Tempat
Penelitian dilakukan pada bulan November 2015-Maret 2016. Kegiatan penelitian meliputi persiapan alat dan bahan, pemeliharaan, dan analisis hasil penelitian. Penelitian dilaksanakan di Instalasi Penelitian Lingkungan dan Toksikologi Budidaya Air Tawar, Cibalagung, Balai Penelitian dan Pengembangan Budidaya Air Tawar Bogor. Analisis kualitas air dilakukan di Laboratorium Lingkungan Akuakultur, analisis gambaran darah di Laboratorium Kesehatan Ikan Departemen Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor, analisis gas darah dilakukan di Laboratorium Darah Rumah Sakit PMI Bogor.
Penelitian Pendahuluan
4
Rancangan Penelitian
Penelitian ini dilakukan dengan metode eksperimental. Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) dengan empat perlakuan dan tiga ulangan. Perlakuan yang diterapkan adalah bentuk atau model difuser pipa mikro-pori, yaitu difuser dibentuk linear (L), sirkular (S), dan paralel (P), serta batu aerasi sebagai kontrol (K) (Lampiran 5).
Bahan Uji
Ikan uji yang digunakan adalah ikan patin pasupati (Pangasius sp.) dengan bobot 78,3±2,34 g ekor-1 dan panjang 22,89±1,85 cm. Ikan uji diaklimatisasi
terlebih dahulu sebelum diberi perlakuan pada bak pembesaran. Pipa mikro-pori yang digunakan didatangkan dari Tiongkok, Tianjin Zeguang Rubber and Plastic Products Co., Ltd, dengan spesifikasi diameter pori 0,03-0,06 mm, kerapatan 700-1200 lubang m-1, dan diameter gelembung yang dihasilkan 0,5-2 mm. Pipa
mikro-pori dibentuk sesuai dengan perlakuan.
Persiapan Bak dan Pemeliharaan Ikan
Pemeliharaan ikan menggunakan bak fiber berukuran ø 160 cm dan tinggi 40 cm sebanyak 12 buah ditampilkan pada Lampiran 5. Padat tebar ikan 12 ekor bak -1. Selama pemeliharaan, ikan diberi pakan komersil dengan kandungan protein 32%
sebanyak tiga kali sehari secara at satiation. Pemeliharaan dilakukan selama 60 hari. Adaptasi dilakukan selama seminggu sebelum perlakuan. Penimbangan bobot dan pengukuran panjang ikan dilakukan setiap 14 hari sekali untuk parameter kinerja produksi dan kualitas air, awal dan akhir untuk hematologi dan gas darah.
Parameter Uji Diameter gelembung
Pengukuran diameter gelembung menggunakan metode fotografi dan diolah menggunakan piranti lunak imageJ (Gaillard et al. 2015). Gelembung pada bak pemeliharaan dilakukan pengambilan gambar menggunakan kamera digital di dasar dan di permukaan bak, kemudian gambar digital diproses dengan piranti lunak imageJ.
Kualitas air
5 Tabel 1 Parameter kualitas air yang diukur selama penelitian
Parameter Satuan Alat ukur/ Metode Oksigen terlarut mg L-1 DO-meter
Suhu oC Termometer digital
pH - pH-meter
TAN mg L-1 Spektrofotometer
Alkalinitas mg L-1 Titrimetrik
CO2 bebas mg L-1 Titrimetrik
Uji hematologi
Uji hematologi meliputi kadar hemoglobin, hematokrit, jumlah sel darah merah dan sel darah putih (Maheswaran et al. 2008). Pengambilan sampel darah dilakukan dengan menggunakan dua ekor ikan dari setiap bak perlakuan diambil darahnya menggunakan Syringe yang dibilas dengan inviciot® heparin sodium (antikoagulan) darah diambil dari bagian pembuluh caudal.
Glukosa darah
Glukosa darah ikan patin pasupati diukur melalui proses enzimatik menggunakan tool kit blood glucose test meter. Ikan patin pasupati dipingsankan dengan Ocean Free Stabilizer® 10 mg L-1, darah diambil dari pangkal sirip ekor dengan syringe. Glukosa darah diukur langsung dengan blood glucose test meter (Gluco Dr Auto AGM 2100) (Olmeda et al. 2008).
Gas darah
Menurut Gallagher et al. (2010), metode pengukuran parameter gas darah menggunakan alat Blood gas analyzer model ABL80 FLEX®. Sebelum dilakukan
pengambilan darah, ikan patin pasupati dipingsankan dengan Ocean Free Stabilizer® 10 mg L-1. Darah diambil dari pangkal sirip ekor dengan syringe. sampel darah dikirim ke Laboratorium darah Rumah Sakit PMI Bogor.
Tabel 2 Parameter gas darah yang diukur selama penelitian Parameter Satuan Alat ukur/ Metode
pH darah -
Blood gas analyzer ABL80 FLEX®
saturasi O2 darah %
Kinerja produksi
6
FCR (feed conversion ratio)
Feed conversion ratio (FCR) atau konversi pakan adalah rasio pakan yang diberikan dibandingkan dengan biomassa yang dihasilkan, dihitung dengan menggunakan rumus :
Keterangan: FCR = Feed conversion ratio (rasio konversi pakan) F = Jumlah pakan kering yang diberikan (g)
Wt = Biomassa ikan pada akhir pemeliharaan (g)
Wo = Biomassa ikan pada awal pemeliharaan (g)
D = Biomassa ikan yang mati selama pemeliharaan (g)
Kelangsungan Hidup
Kelangsungan hidup ikan diamati setiap hari hingga akhir perlakuan. Perhitungan kelangsungan hidup dilakukan di akhir perlakuan dengan rumus sebagai berikut:
7
3
HASIL DAN PEMBAHASAN
Hasil
Diameter Gelembung
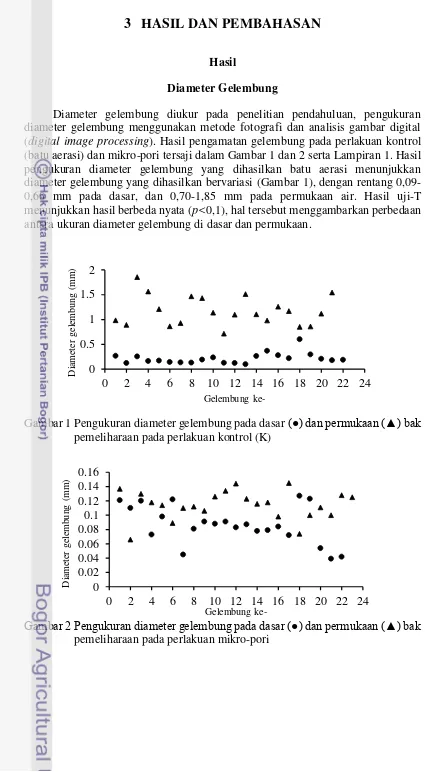
Diameter gelembung diukur pada penelitian pendahuluan, pengukuran diameter gelembung menggunakan metode fotografi dan analisis gambar digital (digital image processing). Hasil pengamatan gelembung pada perlakuan kontrol (batu aerasi) dan mikro-pori tersaji dalam Gambar 1 dan 2 serta Lampiran 1. Hasil pengukuran diameter gelembung yang dihasilkan batu aerasi menunjukkan diameter gelembung yang dihasilkan bervariasi (Gambar 1), dengan rentang 0,09-0,60 mm pada dasar, dan 0,70-1,85 mm pada permukaan air. Hasil uji-T menunjukkan hasil berbeda nyata (p<0,1), hal tersebut menggambarkan perbedaan antara ukuran diameter gelembung di dasar dan permukaan.
Gambar 1 Pengukuran diameter gelembung pada dasar (●) dan permukaan (▲) bak pemeliharaan pada perlakuan kontrol (K)
Gambar 2 Pengukuran diameter gelembung pada dasar (●) dan permukaan (▲) bak
8
Hasil pengukuran diameter gelembung pada difuser mikro-pori menunjukkan diameter gelembung yang dihasilkan (Gambar 2) bervariasi dengan rentang 0,03-0,12 mm pada dasar, dan 0,06-0,14 mm pada permukaan air. Dengan menggunakan uji T diperoleh bahwa ukuran antara dasar dan permukaan pada kontrol tidak berbeda nyata (p>0,1).
Kualitas air
Kisaran parameter kualitas air pemeliharaan ikan patin pasupati yang diukur selama penelitian disajikan pada Tabel 3. Hasil pengukuran parameter kualitas air selama penelitian menunjukkan bahwa kualitas air media pemeliharaan pada setiap perlakuan bentuk difuser yang berbeda masih dalam kisaran yang dapat mendukung kelangsungan hidup dan pertumbuhan ikan patin pasupati.
Tabel 3 Kisaran parameter kualitas air pemeliharaan ikan patin pasupati pada media dengan bentuk difuser yang berbeda selama 60 hari pemeliharaan
Parameter Kontrol Linear Bentuk difuser Sirkular Paralel Oksigen terlarut (mg L-1) 3,7-6,5 5,1-7 5,2-7,5 4,9-7,6
Suhu (oC) 25,2-29 25,2-29,5 25,1-29,1 25,2-29,2
pH 6,8-8,5 6,4-8,6 6,3-8,6 6,8-8,8
TAN (mg L-1) 0,03-0,06 0,05-0,07 0,05-0,06 0,06-0,08
Alkalinitas (mg L-1) 39,69-76,33 30,53-53,46 36,64-45,80 45,80-51,90
CO2 bebas (mg L-1) 0,61-12,42 0,42-23,93 0,36-28,72 0,41-14,33
Gambar 3 Hasil pengukuran oksigen terlarut pada media budidaya ikan patin pasupati yang diaerasi dengan bentuk difuser yang berbeda dalam 60 hari pemeliharaan
Nilai oksigen terlarut cenderung fluktuatif untuk perlakuan difuser kontrol yaitu dengan nilai terendah 3,1 mg L-1, dan 6,5 mg L-1 nilai tertinggi. Pada
perlakuan mikro-pori, fluktuasi oksigen terlarut (Gambar 3) masih dalam kisaran optimal untuk pemeliharaan dan pertumbuhan ikan patin pasupati yaitu pada
9 rentang 4,9-7,6 mg L-1. Saturasi oksigen diukur bedasarkan metode Grasshoff et al.
(1999) dengan hasil menunjukkan rentang 51.9-91.2% pada kontrol, 53.1-91.2% linear, 62.8-91.2% sirkular dan 62.8- 91.2% paralel.
Respons Hematologis
Gambar 4 Kadar hemoglobin awal (■) dan akhir (□) ikan patin pasupati yang
diaerasi dengan bentuk difuser yang berbeda dalam 60 hari pemeliharaan
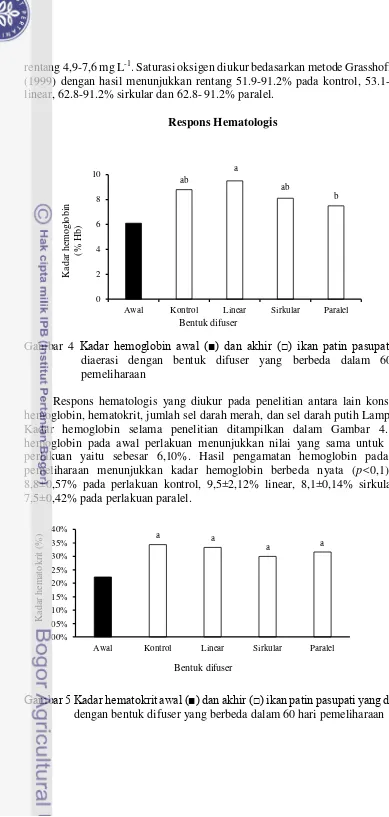
Respons hematologis yang diukur pada penelitian antara lain konsentrasi hemoglobin, hematokrit, jumlah sel darah merah, dan sel darah putih Lampiran 2. Kadar hemoglobin selama penelitian ditampilkan dalam Gambar 4. Nilai hemoglobin pada awal perlakuan menunjukkan nilai yang sama untuk semua perlakuan yaitu sebesar 6,10%. Hasil pengamatan hemoglobin pada akhir pemeliharaan menunjukkan kadar hemoglobin berbeda nyata (p<0,1) yaitu 8,8±0,57% pada perlakuan kontrol, 9,5±2,12% linear, 8,1±0,14% sirkular, dan 7,5±0,42% pada perlakuan paralel.
Gambar 5 Kadar hematokrit awal (■) dan akhir (□) ikan patin pasupati yang diaerasi
10
Hasil perhitungan hematokrit ditampilkan pada Gambar 5. Kadar hematokrit pada awal pengambilan sampel sebesar 22,00±0,00, setelah 60 hari pemeliharaan kadar hematokrit meningkat masing-masing perlakuan yaitu 34,37±3,35 untuk kontrol, 33,33±14,73 linear, 30,00±5,66 sirkular, 31,63±0,53 paralel (p>0,1).
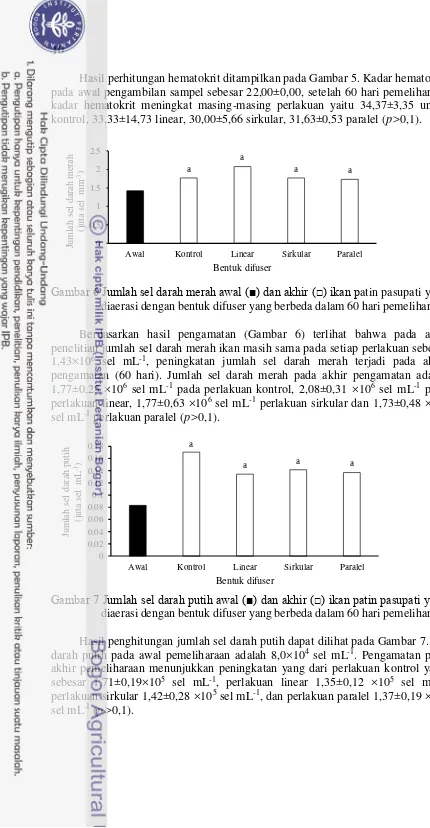
Gambar 6 Jumlah sel darah merah awal (■) dan akhir (□) ikan patin pasupati yang diaerasi dengan bentuk difuser yang berbeda dalam 60 hari pemeliharaan Berdasarkan hasil pengamatan (Gambar 6) terlihat bahwa pada awal penelitian jumlah sel darah merah ikan masih sama pada setiap perlakuan sebesar 1,43×106 sel mL-1, peningkatan jumlah sel darah merah terjadi pada akhir
pengamatan (60 hari). Jumlah sel darah merah pada akhir pengamatan adalah 1,77±0,25 ×106 sel mL-1 pada perlakuan kontrol, 2,08±0,31 ×106 sel mL-1 pada
perlakuan linear, 1,77±0,63 ×106 sel mL-1 perlakuan sirkular dan 1,73±0,48 ×106
sel mL-1 perlakuan paralel (p>0,1).
Gambar 7 Jumlah sel darah putih awal (■) dan akhir (□) ikan patin pasupati yang
diaerasi dengan bentuk difuser yang berbeda dalam 60 hari pemeliharaan Hasil penghitungan jumlah sel darah putih dapat dilihat pada Gambar 7. Sel darah putih pada awal pemeliharaan adalah 8,0×104 sel mL-1. Pengamatan pada
akhir pemeliharaan menunjukkan peningkatan yang dari perlakuan kontrol yaitu sebesar 1,71±0,19×105 sel mL-1, perlakuan linear 1,35±0,12 ×105 sel mL-1,
perlakuan sirkular 1,42±0,28 ×105 sel mL-1, dan perlakuan paralel 1,37±0,19 ×105
11 Glukosa darah
Pengukuran kadar glukosa darah adalah salah satu cara untuk mengetahui respons stress ikan patin pasupati terhadap lingkungan. Hasil pengukuran glukosa darah ditampikan Gambar 8.
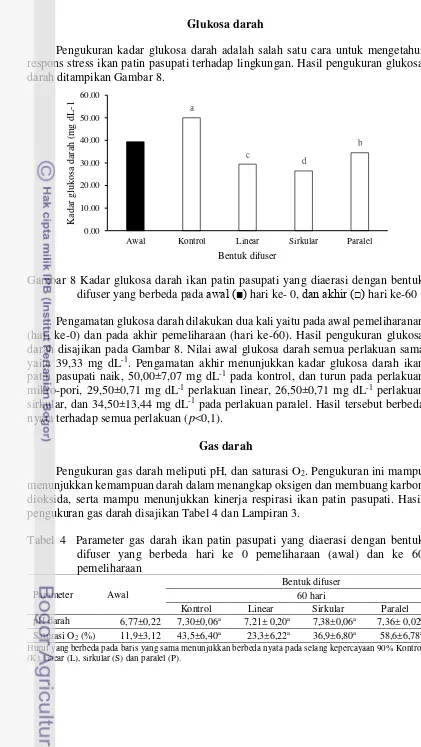
Gambar 8 Kadar glukosa darah ikan patin pasupati yang diaerasi dengan bentuk difuser yang berbeda pada awal (■) hari ke- 0, dan akhir (□) hari ke-60 Pengamatan glukosa darah dilakukan dua kali yaitu pada awal pemeliharanan (hari ke-0) dan pada akhir pemeliharaan (hari ke-60). Hasil pengukuran glukosa darah disajikan pada Gambar 8. Nilai awal glukosa darah semua perlakuan sama yaitu 39,33 mg dL-1. Pengamatan akhir menunjukkan kadar glukosa darah ikan
patin pasupati naik, 50,00±7,07 mg dL-1 pada kontrol, dan turun pada perlakuan
mikro-pori, 29,50±0,71 mg dL-1 perlakuan linear, 26,50±0,71 mg dL-1 perlakuan
sirkular, dan 34,50±13,44 mg dL-1 pada perlakuan paralel. Hasil tersebut berbeda
nyata terhadap semua perlakuan (p<0,1). Gas darah
Pengukuran gas darah meliputi pH, dan saturasi O2. Pengukuran ini mampu
menunjukkan kemampuan darah dalam menangkap oksigen dan membuang karbon dioksida, serta mampu menunjukkan kinerja respirasi ikan patin pasupati. Hasil pengukuran gas darah disajikan Tabel 4 dan Lampiran 3.
Tabel 4 Parameter gas darah ikan patin pasupati yang diaerasi dengan bentuk
Kontrol Linear Sirkular Paralel pH darah 6,77±0,22 7,30±0,06a 7,21± 0,20a 7,38±0,06a 7,36± 0,02a Saturasi O2 (%) 11,9±3,12 43,5±6,40a 23,3±6,22a 36,9±6,80a 58,6±6,78a Huruf yang berbeda pada baris yang sama menunjukkan berbeda nyata pada selang kepercayaan 90% Kontrol (K), linear (L), sirkular (S) dan paralel (P).
12
Hasil pengamatan gas darah awal disajikan pada Tabel 4. Pengukuran awal menunjukkan nilai pH darah 6,77±0,22%, dan Saturasi O2 11,9±3,12%. Parameter
pH darah awal menunjukkan nilai normal pada pengamatan hari ke-0, Pengamatan akhir pemeliharaan, nilai pH menunjukkan 7,30±0,06 kontrol, 7,21±0,20, linear 7,38±0,06 sirkular, dan 7,36±0,02 paralel. Saturasi O2 (%) pada akhir pengamatan
berturut-turut 43,50±0,23 pada perlakuan kontrol, 23,30±0,17 perlaukuan linear, 36,90±0,07 sirkular, dan 58,60±0,02 pada perlakuan paralel.
Kinerja produksi
Hasil pengujian parameter kinerja produksi ikan patin pasupati terdiri atas laju pertumbuhan spesifik (LPS), Feed conversion ratio (FCR) kelangsungan hidup (KH) dan biomassa panen (P) disajikan pada Tabel 5.
Tabel 5 Kinerja produksi ikan patin pasupati yang diaerasi dengan bentuk difuser yang berbeda selama 60 hari pemeliharaan
Parameter Kontrol Linear Bentuk difuser Sirkular Paralel LPS (%) 1,43±0,20a 1,57±0,30a 1,44±0,25a 1,44±0,17a
FCR 1,65±0,30a 1,50±0,14a 1,20±0,19a 1,43±0,33a
KH (%) 33,33±6,80a 97,22±0,39b 91,6±6,80b 97,22±0,39b
P (kg) 2,02±0,88a 6,51±0,69b 6,16±0,4b 6,46±0.12b
Huruf yang berbeda pada baris yang sama menunjukkan berbeda nyata pada selang kepercayaan 90% LPS : laju pertumbuhan spesifik, FCR: Feed conversion ratio dan KH: kelangsungan hidup, P : biomassa panen
Laju pertumbuhan spesifik yang dihasilkan dari pemeliharaan selama 60 hari menunjukkan tidak berbeda nyata (p>0,1) ditampilkan pada Lampiran 4, antara perlakuan kontrol dan mikro-pori, laju pertumbuhan spesifik yang dihasilkan adalah 1,43±0,20% pada kontrol, 1,57±0,30 perlakuan linear, 1,44±0,25 perlakuan sirkular dan 1,44±0,17 pada perlakuan paralel. Feed conversion ratio (FCR) yang dihasilkan pada difuser kontrol 1,65±0,30, pada perlakuan linear sebesar 1,50±0,14, pada perlakuan sirkular 1,20±0,19 dan 1,43±0,33 pada perlakuan paralel. Kelangsungan hidup (%) yang dihasilkan pada perlakuan kontrol 33,33±6,80, perlakuan linear 97,22±0,39, perlakuan sirkular 91,6±6,80 dan perlakuan paralel sebesar 97,22±0,39
Pembahasan Diameter gelembung
13 Kualitas air
Hasil pengukuran parameter kualitas air selama penelitian menunjukkan bahwa kualitas air media pemeliharaan pada setiap perlakuan aerasi media menggunakan difuser yang berbeda masih dalam kisaran yang dapat mendukung pertumbuhan ikan patin pasupati (Tabel 3). Aerasi yang otimal dan pergantian air 20% setiap 14 hari menyebabkan kualitas air media selama penelitian berada dalam kisaran yang baik untuk pertumbuhan ikan patin pasupati. Aerasi yang optimal mampu mengurangi kandungan gas yang berbahaya dalam badan air ke udara (Lekang 2007). Suhu air media selama pemeliharaan masih dalam kisaran yang optimal untuk menunjang pertumbuhan ikan patin pasupati yaitu 25,1-29,2 oC, hal
tersebut sesuai dengan Boyd dan Tucker (1998) yang menyatakan bahwa spesies ikan air tawar dapat tumbuh optimal pada kisaran suhu 25-32 oC.
Oksigen terlarut menunjukkan hasil yang fluktuatif pada semua perlakuan yaitu pada kisaran 3,7- 7,6 mg L-1, perlakuan dengan fluktuasi DO tertinggi adalah
kontrol. Awal pemeliharaan DO pada perlakuan kontrol turun sampai pada level 3,7 mg L-1, hal ini dikarenakan tidak seimbang antara oksigen yang terdifusi melalui
difuser dan kebutuhan oksigen organisme di dalamnya. Fluktuasi oksigen terlarut disebabkan tidak meratanya pengadukan air yang mengandung oksigen, faktor selanjutnya adalah diameter gelembung dan daya tahannya dalam kolom air, semakin kecil diameter gelembung meningkatkan bidang antar permukaan per unit volume sehingga meningkatkan transfer oksigen ke air (Navisa et al. 2014). Keadaan tersebut diduga mengakibatkan kematian pada perlakuan kontrol.
Oksigen terlarut yang optimal untuk ikan patin pasupati menurut BSNI (2009)
adalah ≥3 mg L-1, sedangkan menurut Boyd dan Tucker (1998) ikan air tawar dapat
tumbuh optimal pada level oksigen terlarut ≥5 mg L-1. Hewan darat memperoleh
oksigen langsung dari udara dan hampir tidak terbatas, sedangkan di dalam air keberadaan oksigen bisa 30 kali lebih kecil (Tran-Duy et al. 2007). Oksigen diambil ikan melalui permukaan insang yang luasnya terbatas, proses tersebut memerlukan energi, hal yang sama juga berlaku untuk proses oksidasi yang lain seperti mencerna makanan (Randall 1982).
Parameter pH air menunjukkan hasil kisaran 6,3-8,8. Nilai tersebut masih dalam kisaran dapat ditolerir (BSNI 2009; Boyd dan Tucker 1998). Menurut Sayeed et al. (2008) ikan patin yang dipelihara secara polyculture dengan pH air 7,2-8,9 menghasilkan pertumbuhan yang baik, sedangkan Ahmad et al. (2007) dalam penelitianya lingkungan dengan pH 7,0-7,5 ikan patin dapat tumbuh dengan optimal. PH media budidaya dipengaruhi oleh tingkat karbon dioksida terlarut dalam air, jika konsentrasi karbon dioksida naik, konsentrasi ion hidrogen naik dan menurunkan pH, hal tersebut berlaku sebaliknya. Menurut Kakizawa et al. (1997), keadaan hypercapnia memicu naiknya tekanan PCO2 darah. Meningkatkan kadar
CO2 yang menghasilkan meningkatnya ion [H+] dan [HCO3-], dan menurunkan pH
darah seiring naiknya ion [HCO3-] yang disebut sebagai respiratory acidosis.
Fluktuasi pH dipengaruhi oleh kegiatan respirasi dan fotosintesis, namun di dalam bak pemeliharaan aktivitas yang lebih dominan adalah respirasi ikan dan bakteri pengurai.
Nilai TAN adalah hasil dari protein sisa pembuangan metabolit ikan dari feses dan respirasi (Mook et al. 2011). Pengamatan parameter TAN menunjukkan nilai
14
kisaran optimal untuk pemeliharaan ikan patin pasupati. Nilai TAN yang diperoleh masih dibawah kisaran nilai TAN pada penelitian Ahmad et al. (2007) yaitu pada kisaran 0,01-0,4 mg L-1. Boyd dan Tucker (1998) menyatakan bahwa nilai TAN
optimal pada sistem budidaya air tawar adalah <0,1 mg L-1. Peningkatan nilai TAN
bisa disebabkan oleh tingginya kepadatan individu per satuan volume bak, maupun kurangnya intensitas pergantian air. Aerasi dan pengadukan menjadikan fraksi TAN berupa gas NO3 dan N2 dapat dibuang ke udara, hal tersebut diduga
menurnkan nilai TAN rendah.
Menurut Bhatnagar dan Devi (2013), Alkalinitas adalah kemampuan air untuk menjaga dan mempertahankan perubahan pH, yang di dalamnya adalah konsentrasi basa termasuk karbonat, bikarbonat, hidroksida, phospat dan borat, kalsium terlarut, dan magnesium. Nilai alkalinitas pada penelitian menunjukkan nilai kisaran 30,53-76,33 mg L-1 CaCO
3. Moyle (1946) memberikan kisaran
alkalinitas 0,0 - 20,0 mg L-1 untuk kepadatan rendah, 40,0 - 90,0 mg L-1 kepadatan
sedang 90,0 mg L-1 kepadatan tinggi. Boyd dan Lichtkoppler (1979) menyatakan
bahwa alkalinitas >20,0 mg L-1 mampu mendukung kelimpahan organisme perairan.
Menurut Wurts dan Durborow (1992) alkalinitas antara 75-200 mg L-1, tetapi tidak
kurang dari 20 mg L-1 cocok untuk usaha budidaya ikan, nilai total alkalinitas yang
dianjurkan untuk budidaya ikan jenis catfish adalah minimal 20 mg L-1.
Pengamatan karbon dioksida bebas pada penelitian menunjukkan nilai kisaran 0,36 – 28,72 mg L-1. Kisaran tersebut menurut Wurts dan Durborow (1992),
masih mampu mendukung kelangsungan hidup golongan ikan berkumis (catfish) yaitu pada kisaran 20-30 mg L-1.
Respons hematologis
Hemoglobin adalah komponen yang sangat penting dari sel darah merah, bertugas dalam transport oksigen melalui darah, yang merupakan suatu protein yang kaya akan zat besi. Satu gram hemoglobin dapat mengikat sekitar 1,34 ml oksigen, dan kadar haemoglobin dapat dijadikan sebagai petunjuk mengenai status kesehatan ikan (James dan Sampath 1995). Hasil tersebut menunjukkan ikan masih dalam kondisi sehat. Hasil yang diperoleh pada penelitian Eliyani (2013) pada ikan patin yang sehat memiliki kisaran Hb 6,80-11,92 %. Kadar hemoglobin pada perlakuan kontrol 8,8±0,57%, perlakuan difuser linear 9,5±2,12%, difuser sirkular yaitu sebesar 8,1±0,14%, dan perlakuan paralel 7,5±0,42 %. Hasil analisis statistik nilai hemoglobin tidak berbeda nyata (p>0,1), kadar hemoglobin dalam kisaran normal, hal tersebut mengindikasikan ikan dalam keadaan sehat.
Hematokrit adalah nilai perbandingan antara jumlah sel darah merah dan total volume darah (Anderson dan Siwicki 1993). Peningkatan kadar hematokrit sejalan dengan peningkatan hemoglobin. Analisis statistik menunjukkan tidak berbeda nyata (p>0,1) pada parameter kadar hematokrit. Hal tersebut menjadi indikasi bahwa ikan dalam keadaan sehat dan tidak stress. Kadar hematokrit dipengaruhi oleh nutrisi, ukuran tubuh, status kesehatan, dan lingkungan seperti dikemukakan oleh Maheswaran et al. (2008) bahwa kadar hematokrit menurun secara drastis disebabkan paparan merkuri (Hg).
(98-15 99%) (Witeska 2013). Jumlah SDM pada ikan mas Cyprinus carpio yang sehat berkisar antara 0,79-2,90×106 sel mm-3 (Witeska 2003). Supriyono et al. (2011)
menyatakan bahwa, jumlah SDM dipengaruhi oleh stres dan juga kualitas air media pemeliharaan terutama oksigen terlarut. Rata-rata SDM pada berbagai perlakuan memiliki nilai bervariasi namun berada pada kisaran normal untuk ikan. Analisis statistik menunjukkan tidak berbeda nyata (p>0,1), hal tersebut menggambarkan ikan dalam kondisi sehat. Sel darah merah sebagai bagian terbesar dari sel darah memiliki jumlah bervariasi, berkisar 1,05-3,0 (×106 sel mL-1) (Kumar et al. 2013).
Sel darah putih merupakan bagian dari sistem pertahanan tubuh ikan (Motlagh et al. 2010). Sel darah putih (SDP) merupakan jenis sel yang aktif di dalam sistem pertahanan tubuh, setelah dihasilkan di organ timus dan ginjal, sel darah putih kemudian dibawa dalam darah menuju ke seluruh tubuh (Irianto 2005). Peningkatan nilai sel darah putih pada perlakuan kontrol di akhir pengamatan menunjukkan adanya upaya ikan untuk mengatasi infeksi yang ditandai dengan peningkatan jumlah sel darah putih. Kematian ikan pada perlakuan kontrol diduga disebabkan oleh bakteri Aeromonas hydrophila. Dengan gejala yang mirip dengan serangan bakteri A. Hydrophila, yaitu mengalami nekrosis pada beberapa bagian tubuh, seperti dinyatakan Bücker et al. (2011), serangan A. Hydrophila dapat menyebabkan infeksi dan nekrosis. Rawling et al. (2012) dan menyatakan bahwa sel darah putih memegang peranan penting dalam sistem imun bawaan ikan dan tingkat keberadaannya dapat dijadikan sebagai bio-indiakator status kesehatan ikan. Menurut Malole dan Zaenal (2006) penghitungan komposisi sel darah putih dapat digunakan untuk diagnosis awal serangan penyakit ikan. Respons hematologi pada ikan dipengaruhi oleh kualitas air dan karakter khusus dari lingkungan tempat hidupnya (Van Vuren 1986).
Glukosa darah
Glukosa adalah jenis karbohidrat utama yang memiliki fungsi dalam bioenergetik hewan, yang mampu dirubah dengan cepat menjadi energi (ATP), (Lucas 2002). Pengamatan akhir menunjukkan nilai glukosa darah turun lebih rendah dari hasil pegamatan awal pemeliharaan, hanya perlakuan kontrol yang kadar glukosa darah masih tinggi yaitu 50,00±7,07 mg dL-1. Glukosa darah yang
masih tinggi pada perlakuan kontrol mengindikasikan adanya stres. Pada kondisi yang tidak sesuai dengan kondisi biologis hewan atau kondisi stres, sel kromafin melepaskan hormon katekolamin, adrenalin dan noradrenalin ke pembuluh darah (Reid et al. 1998). Hormon stres tersebut bergabung dengan kortisol bergerak dan meningkatkan kadar gula dalam darah melalui proses glukogenesis dan glikogenolisis (Iwama et al. 1999). Menurut Nelson dan Cox (2005), glukosa darah ini kemudian dikeluarkan dari hati dan otot menuju ke pembuluh darah dengan bantuan insulin.
Gas darah
Parameter gas darah adalah pengukuran terhadap banyaknya oksigen dan karbon dioksida yang terikat di dalam darah, termasuk di dalamnya pH darah. Pengukuran gas darah menggunakan alat Blood gas analyzer model ABL80
16
untuk status kesehatan ikan.
Nilai pH yang baik adalah tujuh, jika nilai di bawah tujuh maka tubuh mengalami acidosis. Terdapat dua jenis acidosis yaitu respiratorik yang disebabkan karena penumpukan CO2 dalam tubuh dan acidosis metabolik yaitu gagalnya ginjal
mengatur asam-basa tubuh. Dalam penelitian nilai pH darah masih dalam kisaran normal, nilai terendah 7,21± 0,20 perlakuan linear, tertinggi 7,38±0,06 perlakuan sirkular (p>0,1), sehingga perbedaan jenis difuser tidak mempengaruhi pH darah ikan patin pasupati. Nilai pH dipengaruhi oleh kadar CO2 dalam darah sesuai
dengan reaksi bolak balik CO2 + H2O↔H+ + HCO3− (Perry dan Gilmour 2006;
Mohammed dan Abdelatief 2015). Total karbon dioksida (CO2) adalah ukuran yang
mencakup seluruh bentuk karbon dioksida, bikarbonat (HCO3-), karbonat (CO32-),
dan asam karbonat (H2CO3-). Sebagian besar karbon dioksida hadir sebagai
bikarbonat. Karbon dioksida (CO2) dilepaskan oleh sel sebagai produk limbah
metabolisme yang kemudian diserap oleh hemoglobin (Hb) dan dikonversi ke asam karbonat dengan bantuan enzim karbonat anhidrase, dalam bentuk ini, karbon dioksida dibawa ke insang untuk ekskresi (Mah dan Cheng 2015).
Berdasarkan hasil pengamatan uji gas darah, menunjukkan bahwa nilai saturasi atau kejenuhan oksigen (SO2) berfluktuasi dari pengamatan awal dan akhir.
Saturasi O2 adalah ukuran persentase hemoglobin yang terkombinasi secara penuh
dengan oksigen, nilai SO2 awal pengamatan adalah 11,85±12,75%, sedangkan pada
akhir pengamatan nilai SO2 pada kisaran 23,30-58,60%. Hasil analisis statistik
menunjukkan hasil berbeda nyata dengan kontrol (p<0,1), tingginya saturasi O2
pada perlakuan paralel diduga disebabkan aliran O2 lebih merata. tingkat saturasi
O2 darah bisa disebabkan oleh tinggi-rendahnya tingkat kejenuhan oksigen pada
media. Sebagai konfirmasi adanya oksigen yang terdeteksi dalam darah, parameter yang digunakan untuk interpretasi keadaan tersebut adalah saturasi atau kejenuhan oksigen dalam darah (SO2). Darah yang tersaturasi oksigen penting dalam
menyediakan bahan bakar untuk oksidasi sel dalam metabolisme, semakin tinggi tingkat saturasi, oksigen yang tersedia di dalam darah diharapkan mencukupi untuk organime bermetabolisme sempurna sehingga dapat memanfaatkan energi dari makanan dan kelebihan dari energi diretensi baik dalam bentuk protein dan lemak sebagai fungsi dari pertumbuhan. Sebagai data pembanding, Eatwell et al. (2013) dalam penelitiannya menunjukkan bahwa kejenuhan oksigen pada darah kelinci (Oryctolagus cuniculus) berkisar antara 88,8-98,0%. Kejenuhan oksigen darah hewan teresterial dan akuatik berbeda, hal ini disebabkan karena kelarutan oksigen lebih rendah di dalam air (Gallagher et al. 2010).
Kinerja Produksi
Parameter kinerja produksi digunakan sebagai evaluasi akhir penggunaan difuser mikro-pori dalam menunjang pertumbuhan ikan patin pasupati. Parameter yang digunakan antara lain laju pertumbuhan spesifik (LPS %) Feed conversion ratio (FCR), kelangsungan hidup (KH %) dan biomassa panen (P kg) Hasil kinerja produksi disajikan dalam Tabel 7 hasil analisis statistik pada Lampiran 4.
17 dilakukan Ebina et al (2013) dimana setelah tiga miggu pemeliharaan peningkataan biomassa ikan Ayu Plecoglossus altivelis dari 3,0 meningkat menjadi 6,4 kg pada pemeliharaan air normal (aerasi normal), sementara peningkatan dari 3,0 menjadi 10,2 kg pada pemeliharaan dengan aerasi gelembung nano. Kombinasi antara kenaikan metabolisme dan rendahnya respon bernafas pada kondisi hyperoxia meningkatkan proporsi energi yang dimetabolisme dan dapat dialihkan untuk pertumbuhan.
Hasil pengamatan kelangsungan hidup menunjukkan bahwa penggunaan pipa mikro-pori mampu meningkatkan kelangsungan hidup Lampiran 4. Kelangsungan hidup perlakuan kontrol 33,33±6,80%, 97,22±0,39 perlakuan linear, 91,6±6,80 perlakuan sirkular, dan perlakuan paralel 97,22±0,39. Hasil tersebut berbeda nyata (p<0,1) dibandingkan dengan kontrol. Hasil tersebut sejalan dengan penelitian Endo et al. (2008) yang melaporkan bahwa penggunaan gelembung mikro mampu menurunkan kematian dan meningkatkan pertumbuhan pada budidaya kerang mutiara (Pinctada martensii). Tingginya kematian pada kontrol diduga disebabkan oleh turunnya oksigen terlarut secara drastis pada hari minggu pertama pemeliharaan, ikan mengalami hipoksia tidak mampu beradaptasi sehingga akhirnya mati (Diaz dan Breitburg 2009). Sebagai perbandingan Hollerman dan Boyd (1990) melaporkan bahwa ikan lele yang dipelihara pada lingkungan dengan aerasi menghasilkan tingkat kelangsungan hidup sebesar 92% dan 40% pada kolam tanpa aerasi.
Feed conversion ratio (FCR) adalah rasio antara daging yang dihasilkan dan pakan yang diberikan. Semakin tinggi pakan yang dimakan dan menghasilkan daging maka rasio yang dihasilkan semakin kecil. Hasil FCR pada penelitian ini menunjukkan bahwa penggunaan difuser mikro-pori mampu menurunkan FCR perlakuan kontrol, linear sirkular dan paralel masing-masing 1,65±0,30, 1,50±0,14, 1,20±0,19, 1,43±0,33. Oksigen yang dihasilkan oleh difuser mikro-pori mampu dimanfaatkan oleh ikan untuk metabolisme dengan optimal, yang akhirnya mampu menghasilkan FCR yang baik. Penelitian serupa yang menunjukkan keberadaan oksigen terlarut yang cukup mampu meningkatkan efisiensi pakan adalah Abdel-Tawwab et al. (2015), pada oksigen terlarut 6,0-6,5 FCR (feed conversion ratio) yang dihasilkan 1,3±0,03, sedangkan pada oksigen terlarut 1,0-1,5 menghasilkan FCR 2,22±0,03.
Panen biomassa (yield) adalah jumlah total biomassa yang didapat pada akhir masa pemeliharaan. Hasil penelitian menunjukkan perlakuan kontrol 2,02±0,88 kg, linear 6,51±0,69 kg, sirkular 6,16±0,41 kg dan paralel 6,46±0.12 kg. Perlakuan kontrol memperoleh hasil terkecil (p<0,1) dibandingkan dengan perlakuan lain, hal ini disebabkan perlakuan kontrol mengalami kematian tinggi pada awal pemeliharaan menjadikan hilangnya potensi pertambahan biomassa diawal periode.
4
SIMPULAN DAN SARAN
Simpulan
18
fisiologis yang baik, pada akhirnya menghasilkan kinerja produksi terbaik yang ditunjukkan oleh laju pertumbuhan spesifik 1,57±0,30 g hari-1, FCR sebesar
1,50±0,14, kelangsungan hidup 97,22±0,39%, dan biomass panen 6,51±0,69 kg. Saran
19
DAFTAR PUSTAKA
Abdel-Tawwab M, Hagras AE, Elbaghdady HAM, Monier MN. 2015. Effects of dissolved oxygen and fish size on Nile tilapia, Oreochromis niloticus (L.): growth performance, whole body composition, and innate immunity. Aquacult Int. DOI 10.1007/s10499-015-9882-y.
Ahmad T, Sofiarsih L, Kusmana. 2007. The growth of patin Pangasianodon hypophthalamus in a close system tank. Indones Aquacult Journal. 1(2): 67-73. Anderson DP, Siwicki AK. 1993. Basic hematology and serology for fish health programs. Paper presented in second symposium on diseases in Asean Aquaculture “Aquatic Animal Health and The Environment”. Phuket, Thailand. 25 – 29th October 1993. 17hlm.
[APHA] American Public Health Association. 1999. Standard Methods for the Examination of Water and Wastewater, 20th ed. Washington D.C. (US): Water
Environment Federation
Ariyanto D, Utami R. 2006. Evaluasi laju pertumbuhan, keragaman genetik dan estimasi heterosis pada persilangan antar spesies ikan patin (Pangasius sp.). J. Fish. Sci. VII (1):81-86.
Bewtra JK, Mavinic DS. 1977. Diffused aeration systems from theory to design. Can. J. Civ. Eng.(5):32-41.
Bhatnagar A, Devi P. 2013. Water quality guidelines for the management of pond fish culture. IJES (3); 6. 1980-2009. doi: 10.6088/ijes.2013030600019.
Boyd CE, Lichtkoppler. 1979. Water quality management in pond fish culture. Research and development series no 22. Alabama. (US): Auburn University Pr. Boyd CE, Tucker CS. 1998. Pond aquaculture water quality management. New
York. [US] : Springer.
Bücker R, Krug SM, Rosenthal R, Günzel D, Fromm A, Zeitz M, Chakraborty T, Fromm M, Epple HJ, Schulzke JD. 2011. Aerolysin from Aeromonas hydrophila perturbs tight junction integrity and cell lesion repair in intestinal epithelial HT-29/B6 cells. J. Infect. Dis 204:1283–92.
[BSNI] Badan Standardisasi Nasional. 2009. Produksi ikan patin pasupati (Pangasius sp.) kelas pembesaran di kolam. SNI 7551.2009.
Clark ML. 2003. Comparison of water quality rainbow trout production and economics in oxygenated and aerated raceways. [Thesis]. Virginia (US) Polytechnic Institute and State University. pp 66.
Darmawan M, Hastarini E. 2011. Karakteristik mutu breaded fillet dari ikan patin jambal (Pangasius djambal) dan ikan patin siam (Pangasius hypopthalamus). Prosiding Forum Inovasi Teknologi Akuakultur. 1107-1112.
Diaz RJ, Breitburg DL. 2009. Fish Physiology. Hypoxia: Volume 27. Amsterdam. The Netherlands (NED): Elsevier Inc.
Dickman DH, Vollmer TK, penemu; Mixairtech Inc. 2001 Jul 2001. Aeration diffuser. United States Patent US 006264176B1.
[DJPB]. Direktorat Jenderal Perikanan Budidaya. 2014. Data statistik series
produksi perikanan budidaya indonesia.
20
Eatwell K, Mancinelli E, Hedley J, Benato LD, Shaw J, Self I, Meredith A. 2013. Use of arterial blood gas analysis as a superior method for evaluating respiratory function in pet rabbits (Oryctolagus cuniculus). Vet Rec. 173(7):166. Doi: 10.1136/ vr.101218).
Ebina K, Shi K, Hirao M, Hashimoto J, Kawato Y, Kaneshiro S, Morimoto T, Koizumi K, Yoshikawa H. 2013. Oxygen and air nanobubble water solution promote the growth of plants, fishes, and mice. PLoS ONE 8(6): e65339. doi:10.1371/journal.pone.0065339.
Endo A, Sarawut S, Hisatsune N, Ichiro T, Takaaki I, Daigo H, Hiroaki T. 2008. DO-increasing effects of a microscopic bubble generating system in a fish farm. Mar Pollut Bull. 57: 78–85.
Eliyani Y. 2013. Pengaruh pemberian probiotik Lactobacillus brevis dan prebiotik oligosakarida terhadap respon imun dan resistensi benih patin siam (Pangasianodon hypophthalmus) yang diinfeksi Aeromonas hydrophila. [Tesis]. Bogor. Sekolah Pascasarjana, Institut Pertanian Bogor.
[FAO] Food Agriculture Organization. Market report pangasious-September2014. http:// www.globefish.org/pangasius-june-2014. (14 Agustus 2016).
Gaillard T, Honorez C, Jumeau M, Elias F, Drenckhan W. 2015. A simple technique for the automation of bubble size measurements. Colloids Surf. A: Physicochem. Eng. Aspects 473:68–74.
Gallagher AJ, Frick LH, Bushnell PG, Brill RW, Mandelman JW. 2010. Blood Gas, Oxygen Saturation, pH, and Lactate Values in Elasmobranch Blood Measured with a Commercially Available Portable Clinical Analyzer and Standard Laboratory Instruments. J. Aquat. Anim. Health. 22:229–234.
Grasshoff K, Kremling K, Ehrhardt M. 1999. Methods of Seawater Analysis. Weinheim. Federal Republic of Germany. (GER): WILEY-VCH.
Gunadi B, Tahapari E, Ariyanto D. 2006. Keragaan Pertumbuhan Ikan Patin Siam Pangasianodon hypophthalmus. Patin Jambal Pangasius djambal dan Hibridanya Pada Karamba Jaring Apung di Perairan Bekas Galian Pasir. Prosiding Seminar Nasionol Ikan IV. Jatiluhur. Indonesia (ID) : Masyarakat Iktiologi Indonesia.
Hollerman WD, Boyd CE.1980. Nightly aeration trincreeye production of Channel Catfish. Trans. Am. Fish. Soc. 109: 440-452.
Irianto A. 2005. Patologi Ikan Teleostei. Yogyakarta (ID): Gadjah Mada University Press.
Iwama GK, Vijayan MM, Forsyth RB, Ackerman PA. 1999. Heat shock proteins and physiological stress in fish. Am. Zool. 39: 901-909.
James R, Sampath K. 1995. Sublethal effects of mixtures of Cu and ammonia on selected biochemical and physiological parameter in the catfish Heteropneustes fossilis (Bloch) Bull Environ Contam Toxicol 55:187–194. Kakizawa SA, Ishimatsu T, Takeda T, Kaneko, Hirano T. 1997. Possible
involvement of somatolactin in the regulation of plasma bicarbonate for the compensation of acidosis in rainbow trout. J. Exp. Biol. 200: 2675-2683. [KKP]. Kementerian kelautan dan perikanan. 2013. industrialisasi catfish yang
21 Kumar S, Raman RP, Pandey PK, Mohanty S, Kumar A, Kumar K. 2013. Effect of orally administered Azadirachtin on non-specific immune parameters of goldfish Carassius auratus (Linn. 1758) and resistance against Aeromonas hydrophila. Fish Shellfish Immunol. DOI: 10.1016/j.fsi.2012.11.038.
Legendre M, Parisele M. 1998. The biological diversity and aquaculture of Clariid and Pangasiid in South-East Asia. Proceedings of the mid-term workshop of the “Catfish Asia Project”. Cantho. Vietnam. 11-15 May. 137-145.
Lekang OI. 2007. Aquaculture Engineering. Oxford. (UK): Blackwell Publishing. Lucas A. 2002. Bioenergetics of Aquatic Animals. English edition. Paris (FR):
Taylor & Francis. pp 169.
Mah KK, Cheng HM. 2015. Learning and Teaching Tools for Basic and Clinical Respiratory Physiology, SpringerBriefs in Physiology. DOI 10.1007/978-3-319-20526-7_2.
Maheswaran AR, Devapaul SM, Velmurugan B, Ignacimuthu S. 2008. Haematological studies of freshwater fish. Clarias batrachus (L.) exposed to mercuric chloride. IJIB. 2 (1): 49-54.
Mallya YJ. 2007. The effects of dissolved oxygen on fish growth in aquaculture. [Thesis]. Reykjavik. Iceland. The United Nation University. Fisheries Training Programme.
Malole MBM, Zaenal FC. 2006. Epidemiologi dan Surveillance. Pelatihan Diagnosa Hama Penyakit Ikan Karantina Golongan Virus. Jakarta (ID): Balai Besar Karantina Ikan Soekarno-Hatta.
Matsuo K, Maeda K, Onari H, Tsunami Y, Onari H. 2006. Water purification of a dam lake using micro bubble technology. In: Progress in multiphase flow research.Gakujutsusyuppaninsatsu. Osaka. pp. 279–286. in Japanese.
Mohammed HM, Abdelatief DA. 2015. Easy blood gas analysis: Implications for nursing. Egyptian journal of chest diseases & tuberculosis. (65):369-376. DOI:10.1016/j.ejcdt.2015.11.009.
Mook WT, Chakrabarti MH, Aroua MK, Khan GMA, Ali BS, Islam MS, Hassan AMA. 2011. Removal of total ammonia nitrogen (TAN), nitrate and total organic carbon (TOC) from aquaculture wastewater using electrochemical technology: A review. J.desal 285:1–13. doi:10.1016/j.desal.2011.09.029. Motlagh SP, Zarejabad AM, Nasrabadi RG, Ahmadifar E, Molaee M. 2010.
Haematology, morphology and blood cells characteristics of male and female Siamese fighting fish (Betta splendens). Comp Clin Pathol. DOI 10.1007/s00580-010-1058-6.
Moyle JB. 1946. Some indices of lake productivity. Trans. Am. Fish. Soc. 76:322-334.
Navisa J, Sravya T, Swetha W, Venkatesan M. 2014. Effect of bubble size on aeration process. Asian. J. Sci. Res.7 (4): 482-487.
Nelson DL, Cox MM. 2005. Lehninger Principles of Biochemistry.4th ed. New York (US): WH Freeman and Co. 1013p.
Olmeda JFL, Álvarez ME, Vázquez FJS. 2008. Glucose tolerance in fish: Is the daily feeding time important. J Physiol & Behav (96); 631–636. doi:10.1016/j.physbeh.2008.12.015.
22
Orban E, Nevigato T, Lena GD, Masci M, Casini I, Gambelli L, Caproni. R. 2008. New Trend in the Seafood Market, Sutchi Catfish (Pangasius hypopthalmus) Filet from Vietnam: Nutritional quality and safety aspects. J. Food. Chem. 110(2): 383-389. doi:10.1016/j.foodchem.2008.02.014.
Perry SF, Gilmour KM. 2006. Acid–base balance and CO2 excretion in fish: Unanswered questions and emerging models. J. Resp Phys & Neurob.
154:199–215. doi:10.1016/j.resp.2006.04.010.
Rahardja BS, Sari D, Alamsjah M.A. 2011. Pengaruh penggunaan tepung daging bekicot (Achatina fulica) pada pakan buatan terhadap pertumbuhan, rasio konversi pakan dan tingkat kelulushidupan benih ikan patin (Pangasius pangasius). JIPK. 3(1): 117-122.
Randall D. 1982. The control of respiration and circulation in fish during exercise and hypoxia. J. exp. Biol. 100:275-288.
Rawling MD, Merrifield DL, Snellgrove DL, Kühlwein H, Adams A and Davies SJ. 2012. Haemato-immunological and growth response of mirror carp (Cyprinus carpio) fed a tropical earthworm meal in experimental diets. Fish Shellfish Immunol. 32: 1002-1007.
Reid SG, Bernier NJ, Perry SF. 1998. The adrenergic stress response in fish: control of catecholamine storage and release. Comp Biochem and Physiol Part C:120: 1-27. DOI: 10.1016/S0742-8413(98)00037-1.
Slembrouck J, Baras E, Subagja J, Hung L.T, Legendre M. 2009. Survival, growth and food conversion of cultured larvae of Pangasianodon hypophthalmus, depending on feeding level, prey density and fish density. Aquaculture (294). 52–59.
Roesfitawati. 2013. Ikan patin hasil alam bernilai ekonomi dan berpotensi ekspor tinggi. Warta ekspor. Ditjen PEN/MJL/004/10/2013. Jakarta. [ID] : Kementerian Perdagangan Republik Indonesia.
Sayeed MAB, Hossain GS, Mistry SK, Huq KA. 2008. Growth performance of thai pangus (Pangasius hypophthalmus) in polyculture system using different supplementary feeds. Univ. j. zool. Rajshahi Univ. (27):59-62.
Setijaningsih L, Gunadi B, Umar C. 2006. Budidaya ikan patin hibrida pada ekosistem pemeliharaan kolam air tenang. Prosiding Seminar Nasionol Ikan IV. Jatiluhur. (ID) : Masyarakat Iktiologi Indonesia.
Supriyono E, Syahputra R, Ghozali FR, Wahjuningrum D, Nirmala K, Kristanto H. 2011. Efektivitas pemberian zeolit, arang aktif, dan minyak cengkeh terhadap hormon kortisol dan gambaran darah benih ikan patin Pangasianodon hyppophtalmus pada pengangkutan dengan kepadatan tinggi. J. Ikhtiol Indones.11 (1): 67-75.
Tahapari E, Darmawan J, Pamungkas WS, Sularto, Nurlela I. 2014. Petunjuk teknis teknologi pembenihan dan pembesaran ikan patin pasupati. Kementerian Kelautan dan Perikanan. Sukamandi. [ID] : Pusat Penelitian dan Pengembangan Perikanan Budidaya Badan Penelitian dan Pengembangan Kelautan dan Perikanan.
23 Tran-Duy A, Schrama JW, van Dam AA, Verreth JAJ. 2007. Effects of oxygen concentration and body weight on maximum feed intake. Growth and hematological parameters of Nile tilapia. Oreochromis niloticus. Aquaculture. 275: 152–162.
Trobos.com. 2008. Kembangkan Patin Berkualitas Secara Efisien. http://www.trobos.com/trobos. 26/09/2016. 1 hal.
Van Vuren. JHJ. 1986. The effects of toxicants on the haematology of Labeo umbratus (Teleostei; Cyprinidae). Comp Biochem Physiol C. 83(1): 155-159. Witeska M. 2003. The Effect of Metals (Pb. Cu. Cd and Zn) on Hematological
Parameters and Morphology of Blood Cells in Common Carp. Monograph 72:113.Siedlce: Akademia Podlaska Publishers.
Witeska M. 2013. Erythrocytes in teleost fishes: a review. Zool and Ecol. 23(4): 275-281, DOI: 10.1080/21658005.2013.846963.
24
25 Lampiran 1 Hasil analisis ragam diameter gelembung
Kontrol
ANOVA
Model Jumlah kuadrat db Kuadrat tengah F Sig.
Regresi 30518,64 1 30518,64 0,350 0,561b
Sisa 1744236,67 20 87211,83
Total 1774755,31 21
a. Dependent Variable: dasar
b. Predictors: (Constant), permukaan
Koefisisen
Model
Koefisien tidak baku Koefisien baku
t Sig.
B Std. Error Beta
1 (konstanta) 1094,61 136,71 8,00 0,00
permukaan 0,40 0,68 0,13 0,59 0,56
a. Dependent Variable: dasar
Mikro-pori
ANOVA
Model Jumlah kuadrat db
Kuadrat
tengah F Sig.
1 Regresi 4441,87 1 4441,87 2,12 0,161b
Sisa 41881,99 20 2094,10
Total 46323,86 21
a. Dependent Variable: dasar
b. Predictors: (Constant), permukaan
Koefisisen
Model
Koefisien tidak baku Koefisien baku
t Sig.
B Std. Error Beta
1 (konstanta) 60,479 25,488 2,373 ,028
permukaan ,444 ,305 ,310 1,456 ,161
26
Lampiran 2 Hasil analisis sidik ragam parameter hematologi a. Hemoglobin (Hb)
ANOVA
Hb
Sumber Keragaman Jumlah kuadrat db
Kuadrat
Sumber Keragaman Jumlah kuadrat db Kuadrat tengah F Sig.
27 c. Sel Darah Merah (SDM)
ANOVA
SDM
Sumber Keragaman Jumlah kuadrat db Kuadrat tengah F Sig.
Perlakuan 0,10 3 0,03 0,71 0,57
Sisa 0,38 8 0,04
Total 0,48 11
SDM
Duncan
Perlakuan N
Alpha = 0.1 1
paralel 3 1,76
kontrol 3 1,79
sirkular 3 1,79
linear 3 1,99
Sig. 0,260
d. Sel Darah Putih (SDP)
ANOVA
Sumber Keragaman Jumlah kuadrat db Kuadrat tengah F Sig.
Perlakuan 0,10 3 0,03 1,141 0,39
Sisa 0,24 8 0,03
Total 0,34 11
SDP
Duncan
Perlakuan N
Alpha = 0.1 1
linear 3 1,38
paralel 3 1,39
sirkular 3 1,42
kontrol 3 1,61
28
Lampiran 3 Hasil analisis sidik ragam parameter gas darah a. Ph darah
ANOVA
Jumlah kuadrat db Kuadrat tengah F Sig.
Perlakuan 0,15 3 0,05 0,60 0,62
Sisa 0,69 8 0,08
Total 0,85 11
PH darah Duncan
Perlakuan N
Alpha = 0.1 1
linear 3 6,91
kontrol 3 6,96
paralel 3 7,12
sirkular 3 7,19
Sig. 0,299
b. Saturasi Oksigen darah
ANOVA
Saturasi O2
Jumlah kuadrat db Kuadrat tengah F Sig.
Perlakuan 0,04 3 0,01 0,24 0,86
Sisa 0,43 8 0,05
Total 0,47 11
Saturasi O2
Duncan
Perlakuan N
Alpha = 0.1 1
sirkular 3 0,32
kontrol 3 0,34
linear 3 0,34
paralel 3 0,46
29 Lampiran 4 Hasil analisis sidik ragam kinerja produksi
a. Laju Pertumbuhan Spesifik (LPS)
ANOVA
LPS
Jumlah kuadrat db Kuadrat tengah F Sig.
Perlakuan 1,13 3 0,37 1,11 0,40
Sisa 2,71 8 0,33
Total 3,84 11
LPS
Duncan
Perlakuan N
Alpha = 0.1 1
kontrol 3 2,5700
linear 3 3,2033
sirkular 3 3,3067
paralel 3 3,3067
Sig. ,183
b. Feed conversion ratio (FCR)
ANOVA
FCR
Jumlah kuadrat db Kuadrat tengah F Sig.
Perlakuan 0,65 3 0,21 0,98 0,44
Sisa 1,76 8 0,22
Total 2,41 11
FCR
Duncan
Perlakuan N
Alpha = 0.1 1
sirkular 3 1,2200
paralel 3 1,4633
kontrol 3 1,7633
linear 3 1,7867
30
c. Survival Rate (SR)
ANOVA
SR
Jumlah kuadrat db Kuadrat tengah F Sig.
Perlakuan 0,84 3 0,28 3,23 0,08
Sisa 0,70 8 0,08
Total 1,54 11
SR
Duncan
Perlakuan N
Alpha = 0.1
1 2
kontrol 3 0,33
sirkular 3 0,90
linear 3 0,96
paralel 3 0,96
Sig. 1,00 0,79
d. Produksi (biomassa panen)
ANOVA
Jumlah kuadrat db Kuadrat tengah F Sig.
Perlakuan 4750904,917 3 1583634,972 4,433 0,041
Sisa 2857654,000 8 357206,750
Total 7608558,917 11
Duncan
Perlakuan N Alpha = 0,1 Pengelompokan
1 2
Kontrol 3 676,0000 a
Sirkular 3 2053,3333 b
Linear 3 2152,3333 b
Paralel 3 2170,6667 b
31 Lampiran 5 Tata letak bak pemeliharaan patin pasupati dan bentuk difuser aerasi
32
RIWAYAT HIDUP
Penulis dilahirkan di Banyumas pada tanggal 4 Juni 1984. Penulis merupakan anak pertama dari tiga bersaudara dari Bapak Warsun dan Ibu Karsinah. Penulis memulai pendidikan S1 pada tahun 2002 pada Program Studi Budidaya Perairan, Fakultas Pertanian, Universitas Gadjah Mada, menyelesaikan pendidikan pada tahun 2010. Penulis pernah bekerja di PT. Aquafarm Nusantara Toba Grow out Project Sumatera Utara 2011-2014. Pada tahun 2014 penulis berkesempatan melanjutkan kembali jenjang pendidikan ke Program Pascasarjana pada Program Studi Ilmu Akuakultur, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Tugas akhir penulis dalam menyelesaikan tesis di Institut Pertanian Bogor untuk mendapatkan
gelar Magister Sains berjudul “Evaluasi beberapa desain pipa mikro-pori sebagai difuser pada sistem aerasi media pembesaran patin pasupati Pangasius sp” bagian
dari tesis ini telah ditebitkan pada berkala ilmiah International Journal of Fisheries and Aquatic Studies (IJFAS) India, dengan judul “Effect of three simple design micro-pore aeration on growth and survival of hybrid catfish Pangasius sp.”