3 ABSTRAK
NURLITA ANNISA SARI. Pemberian sinbiotik dengan dosis berbeda untuk meningkatkan kinerja pertumbuhan dan respon imun benih ikan patin Pangasius
sp.. Dibimbing oleh Widanarni dan Munti Yuhana.
Ikan patin (Pangasius sp.) merupakan salah satu komoditas ikan air tawar yang memiliki nilai ekonomis tinggi. Salah satu permasalahan yang sering dihadapi pembudidaya dalam memproduksi ikan patin adalah masalah penyakit. Penelitian ini bertujuan untuk menguji pengaruh pemberian sinbiotik dengan dosis berbeda yang diberikan melalui pakan terhadap peningkatan kinerja pertumbuhan dan respon imun benih ikan patin. Probiotik yang digunakan adalah bakteri NP5 (Bacillus sp.), sedangkan prebiotik yang digunakan merupakan oligosakarida yang diekstraksi dari tepung ubi jalar varietas sukuh. Benih ikan patin dengan bobot rata-rata 0,43±0,06 gram dan panjang rata-rata 3.55±0.17 cm, dipelihara dengan kepadatan 3 ekor/liter di dalam akuarium berukuran 30x25x25 cm3 yang diisi air sebanyak 10 liter. Penelitian ini terdiri dari 4 perlakuan yaitu K (kontrol), A (penambahan sinbiotik 0,5 dosis), B (penambahan sinbiotik 1 dosis), C (penambahan sinbiotik 2 dosis). Hasil penelitian menunjukkan bahwa pemberian sinbiotik melalui pakan dengan dosis berbeda mampu memberikan peningkatan kinerja pertumbuhan dan sistem imun yang berbeda pada benih ikan patin. Benih ikan patin yang diberi sinbiotik 1 dosis menunjukkan peningkatan pertumbuhan dan respon imun yang terbaik dibanding perlakuan lainnya.
Kata kunci: ikan patin, sinbiotik, pertumbuhan, respon imun
4 ABSTRACT
NURLITA ANNISA SARI. Giving synbiotic with different doses to increase the growth and immune responses on catfish fingerlings Pangasius sp.. Supervised by Widanarni and Munti Yuhana.
Catfish (Pangasius sp.) is one of freshwater commodity which has high economic value. One of problems which often faced by the cultivator in catfish production is the problem of diseases. The aim of this research is to evaluate the effectiveness of giving synbiotic with different doses in feed to increase the growth and immune responses on catfish fingerlings. The probiotic used is NP5 (Bacillus sp.), and the prebiotic used is oligosaccharides extracted from sweet potato Sukuh variety. The catfish fingerlings used has average of weight 0,43±0,06 gram and average of length 3.55±0.17 cm, and it was kept as many as 3 fish/liter in aquarium which (30x25x25) cm3 and filled with 10 liter of water. This research has been done in 4 treatments namely K (control), A (adding 0,5 dose of synbiotic), B (adding 1 dose of synbiotic), C (adding 2 dose of synbiotic). The result study shows that giving synbiotic in feed with different doses can give different increasing of growth and immune responses in catfish fingerlings. The catfish fingerlings given 1 dose of synbiotic showed the best increasing of growth and immune responses compared to the other treatments.
1 I. PENDAHULUAN
Ikan patin (Pangasius sp.) merupakan salah satu komoditas ikan air tawar yang memiliki nilai ekonomis tinggi. Berdasarkan data produksi perikanan budidaya, produksi ikan patin pada tahun 2005 mencapai 32.575 ton dan terus mengalami peningkatan hingga pada tahun 2007 sebesar 36.260 ton (Ferinaldy 2008). Selain itu, ikan patin juga merupakan salah satu komoditas perikanan budidaya yang ditargetkan oleh KKP untuk ditingkatkan produksinya hingga sebesar 1.420% pada periode 2010-2014 (Anonim 2010). Tingginya target peningkatan produksi patin yang ditetapkan oleh KKP ini didasari oleh banyaknya permintaan patin yang masih belum dapat dipenuhi oleh produsen. Hal ini disebabkan karena adanya beberapa permasalahan yang membatasi produksi ikan patin. Salah satu permasalahan yang sering dihadapi para pembudidaya ikan patin adalah masalah penyakit yang menyerang ikan patin dan kerap menurunkan produksi para pembudidaya. Penyakit yang umum menyerang pada ikan misalnya dapat disebabkan oleh bakteri atau virus.
Penanggulangan penyakit yang umum dilakukan oleh para pembudidaya adalah dengan menggunakan antibiotik. Penggunaan antibiotik ini memiliki keunggulan praktis digunakan dan mudah didapatkan. Selain itu antibiotik juga dikenal cukup efektif dalam mengatasi permasalahan penyakit bakterial. Namun seiring dengan penggunaan antibiotik secara terus menerus, dikhawatirkan dapat menyebabkan bakteri resisten terhadap antibiotik. Selain itu, penggunaan antibiotik juga dapat mencemari lingkungan di sekitar lokasi budidaya serta dapat menyebabkan residu di dalam tubuh manusia yang mengkonsumsi ikan yang mengandung antibiotik. Banyaknya permasalahan dari penggunaan antibiotik ini mendorong banyaknya penelitian untuk mencari alternatif guna menanggulangi penyakit bakterial tersebut. Salah satu alternatif yang aman dan cukup efektif digunakan adalah melalui penggunaan sinbiotik.
Menurut Lisal (2005), sinbiotik merupakan gabungan antara probiotik dan prebiotik dengan komposisi seimbang dalam mendukung kelangsungan hidup dan pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan makhluk hidup. Aplikasi pemberian probiotik atau prebiotik saja masih belum
2 menunjukkan hasil yang maksimal karena adanya kelemahan dari keduanya apabila digunakan secara terpisah. Verschuere et al. (2000) menyatakan bahwa probiotik merupakan agen mikroba hidup yang memberikan pengaruh menguntungkan pada inang melalui penyeimbangan mikroflora intestinal, peningkatan efisiensi pakan atau peningkatan nilai nutrisi pakan, peningkatan respon imun, atau dengan melalui peningkatan kualitas lingkungan budidaya. Sedangkan prebiotik merupakan salah satu bahan penyusun makanan yang tidak dicerna oleh saluran pencernaan dan dapat menstimulasi pertumbuhan serta aktivitas bakteri flora normal di dalam saluran pencernaan hewan inang (Ringo et al. 2010).
Lisal (2005) menyatakan bahwa pemberian probiotik tanpa adanya penambahan jumlah nutrien yang cukup untuk kehidupannya, ditambah dengan terjadinya perubahan lingkungan yang ekstrim di dalam saluran pencernaan akan menyebabkan cepatnya terjadi wash out (pencucian) pada bakteri probiotik. Sedangkan pemberian prebiotik tanpa adanya penambahan bakteri probiotik yang memanfaatkan prebiotik tersebut di dalam saluran pencernaan tidak akan memberikan pengaruh yang signifikan terhadap peningkatan respon imun ikan. Putra (2010) menyatakan bahwa pemberian sinbiotik pada kegiatan budidaya ikan nila merah menghasilkan kinerja pertumbuhan yang lebih baik dibandingkan pemberian probiotik atau prebiotik saja. Berdasarkan hasil penelitian Li et al. (2009), penambahan gabungan probiotik Bacillus dan prebiotik
isomaltooligosaccharides dapat meningkatkan respon imun dan resistensi udang vaname terhadap serangan WSSV.
3 II. METODOLOGI
2.1 Penyediaan Bakteri Probiotik
Bakteri probiotik yang digunakan dalam penelitian ini adalah bakteri NP5, yang merupakan bakteri dari genus Bacillus. Bakteri NP5 ini merupakan bakteri yang diisolasi dari saluran pencernaan ikan nila dan telah dilakukan beberapa uji seperti uji ketahanan terhadap pH asam, uji penempelan, serta uji patogenisitas (Putra 2010). Penyediaan bakteri probiotik diawali dengan menumbuhkan bakteri NP5 ke dalam media Trypticase Soy Agar (TSA) miring dan diinkubasi selama 24 jam dalam inkubator. Setelah itu dilakukan kultur bakteri NP5 dalam 10 ml media
Trypticase Soy Broth (TSB) steril dan diinkubasi selama 24 jam di dalam water bath shaker dengan kecepatan 140 rpm. Selanjutnya dilakukan pemanenan bakteri probiotik dengan memindahkan suspensi bakteri ke dalam tabung Corning dan disentrifuse selama 10 menit dengan kecepatan 5000 rpm yang bertujuan untuk memisahkan bakteri probiotik dengan media kulturnya. Kemudian dilakukan pencucian dengan menambahkan Phosphate Buffer Saline (PBS) steril sebanyak 10 ml, lalu dihomogenkan dengan menggunakan vortex dan disentrifuse kembali dengan kecepatan 5000 rpm selama 10 menit. Setelah itu dilakukan tahap pencucian kedua dengan menambahkan 4 ml PBS steril lalu dihomogenkan dengan vortex dan suspensi bakteri probiotik siap dicampurkan ke dalam pakan.
2.2 Ekstraksi Oligosakarida/Prebiotik
4 Hasil pemekatan diencerkan dengan akuades steril dengan jumlah yang ditentukan melalui perhitungan total padatan terlarut (TPT).
2.3 Perhitungan Total Padatan Terlarut
Total padatan terlarut (TPT) diukur berdasarkan metode Apriyantono et al.
(1989) yang bertujuan untuk melihat kepekatan padatan terlarut prebiotik yang berguna pada analisa oligosakarida. Cawan porselin dikeringkan dalam oven selama 1 jam dengan suhu 100 ˚C, kemudian didinginkan selama 30 menit agar berat cawan stabil dan cawan ditimbang (a gram). Sebanyak 1 ml ekstrak oligosakarida ditempatkan dalam cawan porselin tersebut dan cawan ditimbang (b gram). Kemudian cawan yang berisi ekstrak oligosakarida dimasukkan ke dalam oven bersuhu 100 ˚C selama 24 jam, lalu cawan tersebut didinginkan dalam desikator selama 30 menit agar berat cawan stabil dan cawan ditimbang (c gram). Total padatan terlarut dihitung berdasarkan hasil perbandingan berat ekstrak setelah dikeringkan dengan berat ekstrak sebelum dikeringkan.
TPT = x 100% Keterangan:
a = berat cawan sebelum diisi ekstrak oligosakarida b = berat cawan setelah diisi ekstrak oligosakarida
c = berat cawan setelah diisi ekstrak oligosakarida dan dioven 24 jam
2.4 Pengujian Sinbiotik secara In Vivo
2.4.1 Persiapan Wadah dan Ikan Uji
5 Benih ikan patin yang digunakan berasal dari Cibanteng, memiliki bobot rata-rata 0,43±0,06 gram dan panjang rata-rata 3.55±0.17 cm, dipelihara dengan kepadatan 3 ekor/liter (Radyo 2009). Sebelum diberi perlakuan, ikan diadaptasikan terlebih dahulu terhadap lingkungan selama 1 minggu, lalu ikan dipuasakan selama 1 hari sebelum diberi pakan perlakuan.
2.6.2 Uji In Vivo
Pakan uji yang digunakan pada penelitian ini merupakan pakan komersil udang bermerk dagang Feng-Li, berbentuk remah (crumble), dan memiliki kadar protein sebesar 40% (Lampiran 1). Selanjutnya pakan ditambahkan sinbiotik dengan dosis berbeda sesuai pada masing-masing perlakuan. Penelitian ini terdiri dari 4 perlakuan dengan 3 ulangan, yaitu:
K : Pemberian pakan tanpa penambahan sinbiotik
A : Pemberian pakan dengan penambahan sinbiotik 0,5 dosis (probiotik 0,5% + prebiotik 1%)
B : Pemberian pakan dengan penambahan sinbiotik 1 dosis (probiotik 1% + prebiotik 2% (Wang 2007 dan Mahious et al. 2006))
C : Pemberian pakan dengan penambahan sinbiotik 2 dosis (probiotik 2% + prebiotik sebesar 4%)
6 2.5 Parameter Pengamatan
2.5.1 Tingkat Kelangsungan Hidup (SR)
Kelangsungan hidup ikan diamati setiap hari dari awal hingga akhir perlakuan. Tingkat kelangsungan hidup ikan dihitung dengan menggunakan rumus berdasarkan Effendie (1997):
SR = × 100%
Keterangan :
SR = Tingkat kelangsungan hidup (%) Nt = Jumlah ikan pada akhir perlakuan No = Jumlah ikan pada awal perlakuan
2.5.2 Laju Pertumbuhan Harian (LPH)
Laju pertumbuhan spesifik dihitung menggunakan rumus berikut (Huisman, 1987):
LPH (%) = −1 × 100%
Keterangan :
Wt = Bobot rata-rata ikan pada akhir perlakuan (gram) Wo = Bobot rata-rata ikan pada awal perlakuan (gram) n = Lama perlakuan
2.5.3 Pertumbuhan Panjang
Nilai pertumbuhan panjang didapatkan berdasarkan selisih panjang benih ikan patin pada awal perlakuan dengan panjang benih ikan patin pada akhir perlakuan. Pertumbuhan panjang dihitung melalui rumus berikut (Effendie 1997):
Pertumbuhan panjang = Lt – Lo Keterangan :
7 2.5.4 Konversi Pakan (FCR)
Nilai konversi pakan yang digunakan selama perlakuan ini dapat diketahui melalui rumus berikut (Effendie 1997):
FCR = Keterangan :
FCR = Konversi pakan
Pa = Jumlah pakan yang dihabiskan (gram) Bt = Biomassa ikan pada akhir perlakuan (gram) Bo = Biomassa ikan pada awal perlakuan (gram) Bm = Biomassa ikan yang mati (gram)
2.5.5 Hematologi Ikan 2.5.5.1 Total Eritrosit
Total eritrosit dihitung berdasarkan Blaxhall dan Daisley (1973) dengan cara: sampel darah dihisap dengan pipet bulir merah sampai skala 1. Kemudian ditambahkan larutan Hayem’s dengan cara dihisap sampai skala 101, lalu campuran tersebut dihomogenkan dengan cara pipet digoyang membentuk angka delapan selama 3-5 menit. Setelah itu tetesan pertama dari dalam pipet dibuang, dan tetesan selanjutnya dikeluarkan ke atas hemasitometer yang sudah ditutup dengan kaca penutup, Selanjutnya dilakukan perhitungan sel darah merah pada 5 kotak besar hemasitometer di bawah miroskop. Total sel darah merah didapatkan berdasarkan rumus berikut:
∑ eritrosit = ∑ sel eritosit terhitung x (pengencer/volume)
2.5.5.2 Total Leukosit
8 kecil hemasitometer di bawah miroskop. Total sel darah putih didapatkan berdasarkan rumus berikut:
∑ leukosit = ∑ sel leukosit terhitung x (pengencer/volume)
2.5.5.3 Kadar Hemoglobin (Hb)
Kadar hemoglobin diukur melalui metode Sahli dengan menggunakan Sahlinometer (Wedemeyer dan Yasutake 1977). Prosedur pengukuran kadar hemoglobin dilakukan dengan cara: darah dihisap dengan pipet Sahli sampai skala 20 mm3 atau 0,2 ml. Kemudian darah di dalam pipet dimasukkan ke dalam tabung Hb-meter yang telah diisi HCl 0,1 N sampai skala 10 pada skala yang berwarna merah, lalu diaduk dan didiamkan selama 3-5 menit. Setelah itu ditambahkan akuades sedikit demi sedikit sampai warna campuran darah dan HCl sama dengan warna larutan standar yang ada di dalam Hb-meter. Selanjutnya kadar hemoglobin dibaca dengan melihat permukaan cairan dan dicocokkan dengan angka pada skala yang berwarna kuning. Kadar hemoglobin yang terbaca memiliki satuan gram% yang berarti banyaknya hemoglobin dalam satuan gram per 100 ml darah.
2.5.5.4 Kadar Hematokrit (He)
Kadar hematokrit diukur berdasarkan Anderson dan Siwicki (1993) dengan cara: sampel darah dimasukkan ke dalam tabung mikrohematokrit sampai ¾ bagian tabung, lalu ujung tabung disumbat dengan crystoseal. Setelah itu tabung disentrifus selama 5 menit dengan kecepatan 3000 rpm. Kemudian dilakukan pengukuran panjang darah yang mengendap (a) dan panjang total volume darah (b) di dalam tabung mikro hematokrit. Kadar hematokrit dinyatakan sebagai % volume padatan sel darah yang dihitung dengan rumus berikut:
He = (a/b) x 100%
2.5.5.5 Diferensial Leukosit
9 objek yang telah ditetesi darah dengan membentuk sudut sebesar 30˚. Kemudian gelas objek kedua tersebut ditarik sampai bagian ujung terpanjang gelas objek pertama dengan menyentuh darah tetapi tidak menyentuh permukaan gelas objek pertama. Preparat dikeringanginkan dan difiksasi dengan metanol selama 5 menit. Selanjutnya preparat dikeringanginkan kembali dan dilakukan pewarnaan dengan Giemsa selama 15 menit. Setelah itu preparat dibilas dengan air mengalir dan dikeringanginkan, lalu preparat ulas diamati di bawah mikroskop, kemudian dihitung jenis-jenis leukosit dan dihitung pula persentase dari masing-masing jenis leukosit tersebut.
2.5.5.6 Aktivitas Fagositosis
Perhitungan aktivitas fagositosis mengacu pada Anderson dan Siwicki (1993) dilakukan dengan cara: sebanyak 50 µl sampel darah dimasukkan ke dalam eppendorf dan ditambahkan 50 µl suspensi bakteri Staphylococcus aureus dalam PBS yang memiliki kepadatan 107 CFU/ml. Campuran tersebut dihomogenkan dan diinkubasi selama 20 menit. Kemudian sebanyak 5 µl campuran tersebut dibuat preparat ulas dan dikeringanginkan, selanjutnya difiksasi dengan metanol dan dikeringanginkan. Selanjutnya preparat diwarnai dengan pewarna Giemsa selama 15 menit, lalu dibilas dengan air mengalir dan dikeringanginkan. Pengamatan aktivitas fagositosis dilakukan di bawah mikroskop dan dihitung persentase dari total 100 sel darah putih yang menunjukkan aktivitas fagositosis.
2.5.6 Kualitas Air
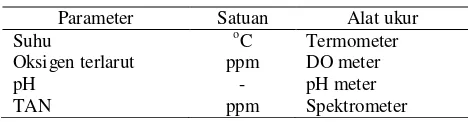
Pengukuran kualitas air yang berupa DO, pH, dan TAN dilakukan pada saat awal dan akhir perlakuan. Sedangkan parameter suhu dilakukan setiap hari pada pagi dan sore hari. Tabel 1 di bawah ini adalah satuan dan alat ukur dari parameter kualitas air yang diamati.
Tabel 1. Satuan dan alat ukur dari parameter kualitas air Parameter Satuan Alat ukur
Suhu oC Termometer Oksigen terlarut ppm DO meter
pH - pH meter
10 2.6 Analisis Data
11 III. HASIL DAN PEMBAHASAN
3.1 Hasil
3.1.1 Kelangsungan Hidup
Kelangsungan hidup benih ikan patin diamati selama 30 hari masa pemeliharaan. Data hasil kelangsungan hidup benih ikan patin dapat dilihat pada Gambar 1 berikut.
Keterangan: Huruf superscript yang sama menunjukkan hasil yang tidak berbeda nyata (P>0,05). Gambar 1. Kelangsungan hidup benih ikan patin selama perlakuan sinbiotik;
K.kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
Berdasarkan hasil yang ditunjukkan pada Gambar 1 dan uji statistik pada Lampiran 2, diketahui bahwa tingkat kelangsungan hidup pada semua perlakuan tidak menunjukkan pengaruh yang berbeda nyata dimana semua perlakuan memiliki tingkat kelangsungan hidup sebesar 100%.
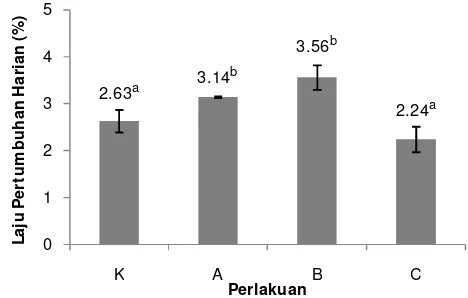
3.1.2 Laju Pertumbuhan Harian
12 Keterangan: Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P>0,05). Gambar 2. Laju pertumbuhan harian benih ikan patin selama perlakuan sinbiotik;
K. kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
Berdasarkan hasil yang ditunjukkan pada Gambar 2 di atas, dapat dilihat bahwa nilai laju pertumbuhan harian tertinggi diperoleh pada perlakuan B yaitu sebesar 3,56%. Sedangkan nilai yang terendah terdapat pada perlakuan C yaitu sebesar 2,24% . Pada kontrol, nilai laju pertumbuhan harian sebesar 2,63% dan pada perlakuan A sebesar 3,14%. Hasil uji statistik pada Lampiran 3 menunjukkan bahwa nilai laju pertumbuhan harian perlakuan A dan B berbeda nyata dengan kontrol dan perlakuan C. Namun perlakuan A tidak berbeda nyata dengan perlakuan B, sedangkan kontrol tidak berbeda nyata dengan perlakuan C.
3.1.3 Pertumbuhan Panjang
Perbedaan panjang awal dan akhir benih ikan patin selama 30 hari pemeliharaan dapat dilihat pada Tabel 2 berikut.
Tabel 2. Rata-rata panjang awal dan akhir benih ikan patin
Perlakuan Rata-rata panjang awal (Lo) (cm) Rata-rata panjang akhir (Lt) (cm)
K 3,52 7,40
A 3,62 7,92
B 3,48 8,02
C 3,62 7,24
Keterangan:
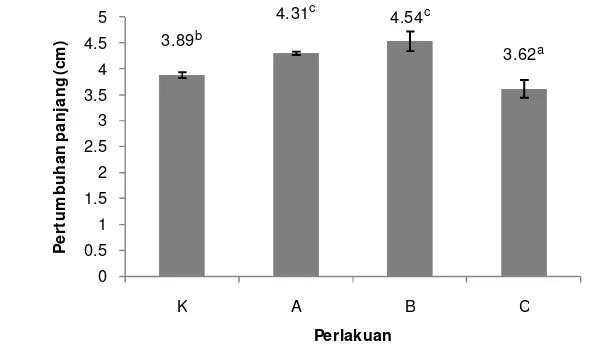
13 Pengaruh pemberian sinbiotik dengan dosis berbeda terhadap pertumbuhan panjang yang dihasilkan oleh masing-masing perlakuan dapat dilihat pada Gambar 3 di bawah ini.
Keterangan: Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P>0,05). Gambar 3. Pertumbuhan panjang benih ikan patin selama perlakuan sinbiotik; K.
kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
Nilai dari pertumbuhan panjang yang dihasilkan masing-masing perlakuan mengalami perbedaan, dimana nilai tertinggi terdapat pada perlakuan B yaitu sebesar 4,54 cm. Nilai pertumbuhan panjang terendah terdapat pada perlakuan C yaitu sebesar 3,62 cm. Sedangkan nilai pertumbuhan panjang pada kontrol dan perlakuan A secara berturut-turut adalah sebesar 3,89 cm dan 4,31 cm. Berdasarkan hasil uji statistik pada Lampiran 4, didapatkan bahwa perlakuan A dan B tidak menunjukkan pengaruh yang berbeda nyata. Namun kedua perlakuan ini menunjukkan pengaruh yang berbeda nyata dengan perlakuan yang lainya.
3.1.4 Konversi Pakan
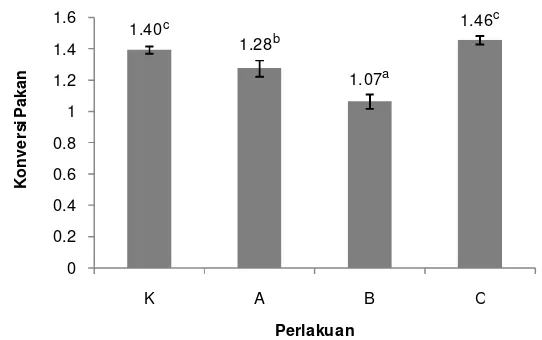
Nilai konversi pakan yang dihasilkan dari pemberian pakan sinbiotik dengan dosis berbeda dapat dilihat pada Gambar 4 berikut.
14 Keterangan: Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P>0,05). Gambar 4. Konversi pakan benih ikan patin selama perlakuan sinbiotik; K.
kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
Berdasarkan Gambar 4 di atas, diketahui bahawa nilai konversi pakan tertinggi selama pemeliharaan benih ikan patin terdapat pada perlakuan C yaitu sebesar1,46. Konversi pakan yang terendah terdapat pada perlakuan B dengan nilai 1,07. Sedangkan nilai konversi pakan pada kontrol dan perlakuan A secara berturut-turut adalah sebesar 1,40 dan 1,28. Setelah diuji statistik, didapatkan pengaruh yang tidak berbeda nyata antara kontrol dengan perlakuan C, namun kedua perlakuan tersebut berbeda nyata dengan perlakuan A dan B (Lampiran 5).
3.1.5 Hematologi Ikan 3.1.5.1 Total Eritrosit
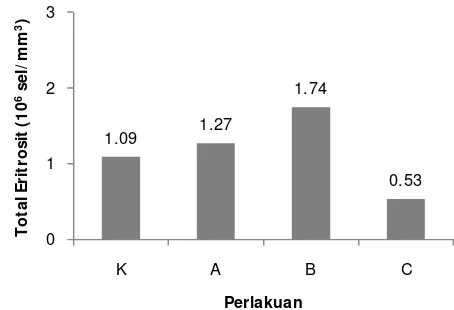
15 Gambar 5. Total eritrosit benih ikan patin selama perlakuan sinbiotik; K. kontrol;
A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis. Total eritrosit benih ikan patin pada akhir pemeliharaan menunjukkan hasil yang berbeda-beda. Total eritrosit dengan nilai tertinggi terdapat pada perlakuan B yaitu sebesar 1,74 x 106 sel/mm3. Nilai terendah total eritrosit terdapat pada diamati pada akhir pemeliharaan ditunjukkan pada Gambar 6 berikut.
Gambar 6. Total leukosit benih ikan patin selama perlakuan sinbiotik; K. kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
16 Berdasarkan data yang disajikan pada Gambar 6 diatas, diketahui bahwa total leukosit pada kontrol adalah sebesar 10,29 x 105 sel/mm3. Berikutnya pada perlakuan A sebesar 8,9 x 105 sel/mm3, perlakuan B sebesar 6,78 x 105 sel/mm3, dan perlakuan C sebesar 6,96 x 105 sel/mm3. Dari data tersebut diketahui bahwa nilai rata-rata total leukosit tertinggi terdapat pada kontrol, sedangkan yang terendah terdapat pada perlakuan B.
3.1.5.3 Kadar Hemoglobin
Kadar hemoglobin (gram%) yang diamati pada masing-masing perlakuan disajikan pada Gambar 7 berikut.
Gambar 7. Kadar hemoglobin benih ikan patin selama pemeliharaan perlakuan sinbiotik; K. kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
Kadar hemoglobin yang didapat pada masing-masing perlakuan menunjukkan korelasi yang positif terhadap total eritrosit, dimana nilai tertinggi terdapat pada perlakuan B dan yang terendah terdapat pada perlakuan C. Adapun nilai kadar hemoglobin pada masing-masing perlakuan adalah kontrol sebesar 5,4 gram%, perlakuan A sebesar 6,4 gram%, perlakuan B sebesar 6,8 gram%, dan perlakuan C sebesar 3,4 gram%.
3.1.5.4 Kadar Hematokrit
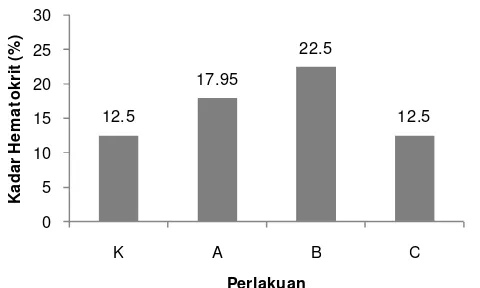
Kadar hematokrit (%) yang terukur dari masing-masing perlakuan pada akhir pemeliharaan disajikan pada Gambar 8 berikut.
17 Gambar 8. Kadar hematokrit benih ikan patin selama perlakuan sinbiotik; K. kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
Sama halnya dengan nilai dari kadar hemoglobin, kadar hematokrit juga memiliki hasil yang berkorelasi positif dengan total eritrosit. Namun nilai terendah dari kadar hematokrit terdapat pada kontrol dan perlakuan C yaitu sebesar 12,5%. Sedangkan kadar hematokrit pada perlakuan B dengan nilai tertinggi adalah sebesar 22,5% dan nilai kadar hematokrit pada perlakuan A adalah sebesar 17,95%.
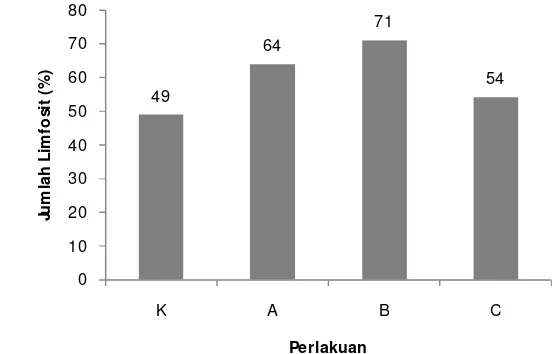
3.1.5.5 Diferensial Leukosit
18 masing perlakuan menunjukkan hasil yang berbeda. Jumlah limfosit terbanyak terdapat pada perlakuan B yaitu sebesar 71%, dan yang paling sedikit terdapat pada kontrol dengan nilai 49%. Sedangkan jumlah limfosit pada perlakuan A dan C secara berturut-turut adalah sebanyak 64% dan 54%.
3.1.5.5.2 Jumlah Monosit
Perbedaan rata-rata jumlah monosit benih ikan patin yang diamati pada akhir perlakuan disajikan pada Gambar 11 berikut.
19 Gambar 11. Jumlah monosit benih ikan patin selama perlakuan sinbiotik; K. kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
Berdasarkan data yang ditunjukkan oleh Gambar 11 di atas, diketahui bahwa rata-rata jumlah monosit benih ikan patin tertinggi terdapat pada kontrol dengan nilai sebesar 26%. Nilai terendah dari jumlah monosit terdapat pada perlakuan B yaitu sebesar 12%. Sedangkan jumlah monosit pada perlakuan A adalah sebesar 16% dan pada perlakuan C adalah sebesar 22%.
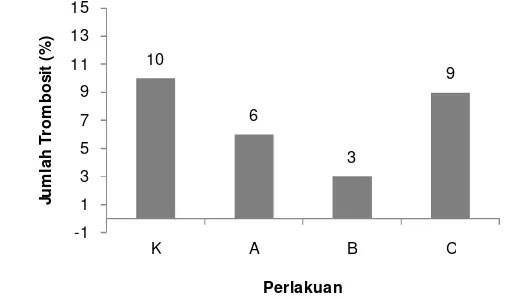
3.1.5.5.3 Jumlah Trombosit
Rata-rata jumlah trombosit (%) yang berbeda-beda dari masing-masing perlakuan pada akhir pemeliharaan dapat dilihat pada Gambar 12 berikut.
20 Seperti halnya dengan jumlah limfosit dan jumlah monosit, jumlah trombosit pada setiap perlakuan memiliki nilai yang berbeda. Nilai tertinggi dari jumlah trombosit terdapat pada kontrol yaitu sebesar 10%. Nilai terendah terdapat pada perlakuan B yaitu sebesar 3%. Sedangkan pada perlakuan A sebesar 6% dan pada perlakuan C sebesar 9%.
3.1.5.5.4 Jumlah Neutrofil
Rata-rata jumlah neutrofil (%) yang terhitung dari masing-masing perlakuan pada akhir pemeliharaan disajikan pada Gambar 13 berikut.
Gambar 13. Jumlah neutrofil benih ikan patin selama perlakuan sinbiotik; K. kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
Data pada Gambar 13 di atas menunjukkan bahwa rata-rata jumlah neutrofil pada beberapa perlakuan menghasilkan nilai yang relatif sama. Jumlah neutrofil pada kontrol dan perlakuan C sebesar 15%, sedangkan pada perlakuan A dan B sebesar 14%.
3.1.5.6 Aktivitas fagositosis
Persentase aktivitas fagositosis yang dihasilkan oleh masing-masing perlakuan dapat dilihat pada Gambar 14 berikut.
21 Gambar 14. Aktivitas fagositosis benih ikan patin selama perlakuan sinbiotik; K. kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
Persentase aktivitas fagositosis yang dihasilkan oleh masing-masing perlakuan menunjukkan nilai yang berbeda. Nilai persentase tertinggi terdapat pada perlakuan B yaitu sebesar 37%. Persentase terendah terdapat pada kontrol dengan nilai 16%. Sedangkan persentase aktivitas fagositosis pada perlakuan A dan C adalah sebesar 29% dan 30%.
3.1.6 Kualitas Air
Parameter kualitas air yang diamati pada penelitian ini terdiri dari suhu, DO, pH, dan TAN. Adapun kisaran dari parameter kualitas air tersebut dapat dilihat pada Tabel 3 di bawah ini.
Tabel 3. Kualitas air selama perlakuan sinbiotik
Parameter Perlakuan Referensi (SNI 2000)
K A B C
22 Berdasarkan data yang ditunjukkan pada Tabel 3, kisaran suhu, DO, pH, dan TAN air selama pemeliharaan masih berada pada batas toleransi benih ikan patin.
3.2 Pembahasan
Penggunaan probiotik dalam kegiatan akuakultur saat ini mulai banyak diterapkan untuk meningkatkan produksi. Ada beberapa fungsi probiotik dalam akuakultur seperti meningkatkan nilai nutrisi pakan, meningkatkan sistem imun, dan memperbaiki kualitas air media pemeliharaan. Dari beberapa keuntungan tersebut, fungsi probiotik yang paling diandalkan saat ini adalah potensinya untuk meningkatkan sistem imun pada ikan (Nayak 2010). Sedangkan prebiotik merupakan salah satu bahan penyusun makanan yang tidak dicerna oleh saluran pencernaan dan dapat menstimulasi pertumbuhan serta aktivitas bakteri flora normal di dalam saluran pencernaan hewan inang (Ringo et al. 2010). Kerjasama antara penggunaan probiotik dan prebiotik biasa disebut dengan sinbiotik. Penggunaan sinbiotik dalam dosis yang tepat mampu meningkatkan pertumbuhan serta sistem imun pada ikan.
Kelangsungan hidup ikan dalam penelitian ini adalah sebesar 100% pada semua perlakuan. Hal ini menandakan bahwa semua ikan dalam keadaan sehat. Namun dilihat dari pertumbuhan dan sistem imun ikan dari masing-masing perlakuan menunjukkan hasil yang berbeda. Dimana dapat dikatakan bahwa terdapat pengaruh pemberian sinbiotik dengan dosis berbeda melalui pakan terhadap kinerja pertumbuhan dan sistem imun pada benih ikan patin.
23 Selain itu, pertumbuhan panjang benih ikan patin yang paling tinggi juga didapat pada perlakuan B yaitu sebesar 4,54 cm. Sedangkan nilai terendah juga terdapat pada perlakuan C yaitu sebesar 3,62 cm. Hasil yang didapat tersebut menunjukkan bahwa dosis optimal pemberian sinbiotik untuk meningkatkan pertumbuhan benih ikan patin adalah 1 dosis (1% probiotik dan 2% prebiotik). Semakin tinggi pemberian dosis sinbiotik menyebabkan semakin menurunnya kinerja pertumbuhan pada benih patin bahkan menghasilkan pertumbuhan yang lebih kecil dibandingkan kontrol. Hasil penelitian Li et al. (2009) menyebutkan bahwa pengaruh optimal pemberian sinbiotik pada udang vaname terdapat pada dosis 0,2% isomaltooligosaccharides (IMO) yang ditambahkan 108 CFU/gram pakan bakteri Bacillus OJ (PB). Selanjutnya, efek positif tersebut menurun secara signifikan ketika dosis pemberian PB ditingkatkan menjadi 1010 CFU/gram pakan. Dalam penelitian ini, pada perlakuan B diduga dosis sinbiotik yang diberikan merupakan dosis yang paling efektif untuk meningkatkan kinerja pertumbuhan pada benih ikan patin. Pada perlakuan ini, diduga bahwa pemberian sinbiotik mampu meningkatkan kecernaan pakan yang mampu meningkatkan laju pertumbuhan. Menurut Putra (2010), gabungan pemberian bakteri NP5 sebagai probiotik dan oligosakarida dari ekstrak ubi jalar sebagai prebiotik menunjukkan pemanfaatan karbohidrat sebagai sumber energi cukup baik, sehingga protein digunakan secara optimal untuk proses pertumbuhan.
24 pemberian probiotik Lactobacillus plantarum dengan dosis 108 CFU/kg pakan pada ikan kerapu lumpur Epinephelus coioides menunjukkan hasil terbaik dibandingkan dosis 106 dan 1010 CFU/kg pakan terhadap peningkatan nilai efisiensi pakan. Pada perlakuan B, terlihat bahwa pemanfaatan pakan yang diberikan menunjukkan hasil yang paling efisien dibandingkan perlakuan lainnya. Hal ini diduga karena adanya peningkatan aktivitas enzim amilase dan enzim protease yang mampu meningkatkan kecernaan karbohidrat dan protein pada pakan sehingga pemanfaatan pakan menjadi lebih efektif. Hasil penelitian Putra (2010) menunjukkan pada perlakuan sinbiotik terjadi peningkatan aktivitas enzim amilase dan enzim protease dalam pencernaan ikan nila yang kemudian mampu meningkatkan nilai kecernaan karbohidrat dan protein dalam pakan. Dengan demikian protein dan energi nutrien pakan yang diserap oleh usus untuk dimanfaatkan tubuh menjadi lebih tinggi, sehingga pemanfaatan pakan menjadi lebih optimal.
Darah ikan tersusun atas cairan plasma dan sel-sel darah yang terdiri dari sel-sel darah merah (eritrosit), sel-sel darah putih (leukosit), dan keping-keping darah (Randal 1970 dalam Affandi dan Tang 2002). Darah ikan berfungsi utuk mengedarkan nutrien yang berasal dari pencernaan makanan ke sel-sel tubuh, membawa oksigen ke sel-sel tubuh (jaringan), serta membawa hormon dan enzim ke organ tubuh yang memerlukannya (Lagler et al. 1977).
25 Li et al. (2009) menunjukkan bahwa pada perlakuan sinbiotik dengan dosis prebiotik IMO 0,2%, menghasilkan penurunan nilai aktivitas fagositosis dan
phenoloxidase ketika dosis probiotik PB ditingkatkan dari 108 menjadi 1010 CFU/gram pakan.
Menurut Chinabut et al. (1991) leukosit terdiri atas dua bagian yaitu agranulosit dan granulosit. Agranulosit terdiri dari limfosit, trombosit, dan monosit. Sedangkan granulosit terdiri dari neutrofil, eosinofil, dan basofil. Jumlah leukosit pada benih ikan patin di akhir pemeliharaan menunjukkan nilai yang berbeda-beda. Nilai leukosit terendah terdapat pada perlakuan B yaitu sebesar 6,78 x 105 sel/mm3, sedangkan nilai tertinggi terdapat pada kontrol yaitu sebesar 10,29 x 105 sel/mm3. Rendahnya nilai leukosit pada perlakuan B ini dapat disebabkan karena kondisi ikan yang sehat. Menurut Angka et al. (1985), ikan yang sehat memiliki jumlah sel darah putih yang lebih rendah dibandingkan dengan ikan yang sakit. Sedangkan tingginya nilai sel darah putih pada kontrol diduga karena pada kontrol tidak diberikan perlakuan sinbiotik yang mampu membentuk sistem kekebalan tubuh pada ikan, sehingga menyebabkan ikan kontrol memiliki kondisi yang rentan terhadap serangan penyakit akibat tidak adanya respon imun yang terbentuk untuk mengatasi serangan penyakit. Marthen (2005) menyatakan bahwa peningkatan jumlah leukosit mengindikasikan adanya respon dari tubuh ikan terhadap infeksi bakteri atau stres.
26 kata lain penurunan kadar hemoglobin adalah indikator ikan terserang anemia (Blaxhall 1971).
Hematokrit merupakan perbandingan antara sel darah merah dan plasma darah, serta berpengaruh terhadap pengaturan sel darah merah (Hesser 1960
dalam Marthen 2005). Hal ini dapat diartikan bahwa kadar hematokrit memiliki korelasi positif terhadap jumlah sel darah merah. Berdasarkan hasil yang ditunjukkan pada Gambar 8, terlihat bahwa kadar hematokrit terendah terdapat pada kontrol dan perlakuan C dengan nilai 12,5%. Sedangkan kadar hematokrit tertinggi terdapat pada perlakuan B dengan nilai 22,5%. Tanbiyaskur (2011) menyatakan bahwa pemberian probiotik, prebiotik dan sinbiotik pada ikan nila memberikan pengaruh yang baik terhadap kadar hematokrit darah. Tingginya kadar hematokrit pada perlakuan B diduga karena pakan perlakuan B memiliki kandungan nutrisi yang paling baik dibandingkan perlakuan lainnya. Hal ini diduga karena adanya peningkatan aktifitas enzim amilase dan enzim protease akibat pemberian sinbiotik yang mampu meningkatkan kecernaan karbohidrat dan protein di dalam pakan. Sedangkan rendahnya kadar hematokrit pada kontrol dan perlakuan C diduga karena nilai nutrisi pakan kedua perlakuan masih belum cukup optimal bagi ikan patin. Pada kontrol, rendahnya nilai nutrisi pakan ini diduga karena tidak adanya penambahan sinbiotik yang mampu meningkatkan nilai nutrisi pakan. Menurunnya kadar hematokrit dapat dijadikan petunjuk mengenai rendahnya kandungan protein pakan, defisiensi vitamin atau ikan mendapat infeksi sehingga nafsu makan menurun (Wedemeyer dan Yasutake 1977).
27 banyak sebagai respon adanya peningkatan respon imun. Menurut Moyle dan Cech (1988), limfosit berfungsi sebagai penghasil antibodi untuk kekebalan tubuh dari gangguan penyakit. Fujaya (2004) menyatakan bahwa limfosit yang bersirkulasi dalam darah dan jaringan berasal dari timus dan organ limfoid perifer seperti ginjal dan limpa. Apabila terjadi kerusakan pada organ penghasil ini maka dapat menghambat pembentukkan limfosit. Kekurangan limfosit dapat menurunkan konsentrasi antibodi dan dapat meningkatkan serangan penyakit.
Monosit berfungsi sebagai fagosit terhadap benda-benda asing termasuk agen penyakit (Moyle dan Cech 1988). Berdasarkan hasil penelitian, presentase jumlah monosit yang paling tinggi terdapat pada kontrol dengan nilai 26%, sedangkan yang paling rendah terdapat pada perlakuan B dengan nilai 12%. Menurut Hurriyani (2011), rendahnya jumlah monosit pada larva patin yang diberi imunostimulan tanpa diuji tantang disebabkan karena kondisi larva yang baik, sehingga monosit akan menembus dinding kapiler, masuk ke jaringan dan berdiferensiasi menjadi sel makrofag yang terikat pada jaringan dan menjadi ekstravaskuler.
Nabib dan Pasaribu (1989) menyatakan bahwa trombosit berperan penting dalam proses pembekuan darah dan juga berfungsi mencegah kehilangan cairan tubuh pada kerusakan-kerusakan di permukaan. Berdasarkan hasil penelitian, persentase nilai trombosit masing-masing perlakuan menunjukkan hasil yang cukup rendah. Persentase nilai trombosit paling rendah terdapat pada perlakuan B yaitu sebesar 3%. Rendahya nilai trombosit ini diduga karena semua ikan dalam keadaan sehat dengan tingkat kelangsungan hidup 100%. Angka et al. (2004) menyatakan bahwa trombosit diproduksi agar darah membeku untuk mencegah terjadinya lebih banyak pendarahan. Menurut Fujaya (2004), trombosit tidak umum terdapat dalam darah pada kondisi normal. Tetapi apabila terjadi sesuatu yang mengejutkan, jumlah trombosit dapat meningkat tajam.
28 serangan bakteri pada semua perlakuan. Hal ini menyebabkan tidak adanya perbedaan signifikan dari jumlah neutrofil dari masing-masing perlakuan. Dellman dan Brown (1989) menyatakan bahwa pada saat terjadi infeksi bakteri biasanya jumlah neutrofil dalam darah akan meningkat, hal ini disebabkan karena limfoid perlu melepas leukosit untuk melawan infeksi.
Fagositosis merupakan pertahanan pertama dari respon selular yang dilakukan oleh monosit (makrofag) dan granulosit (netrofil) (Tizard 1988). Menurut Secombes (1996), proses fagositosis terjadi dalam beberapa tahap yang terdiri dari pergerakkan (kemotaksis), pelekatan partikel (antigen) pada permukaan sel, penelanan yang kemudian terjadi pembentukan fagosom, pemusnahan dan pencernaan. Berdasarkan hasil yang ditunjukan pada Gambar 14, nilai aktivitas fagositosis yang paling tinggi terjadi pada pelakuan B yaitu sebesar 37%, sedangkan yang paling rendah terdapat pada kontrol yaitu sebesar 16%. Rendahnya nilai aktivitas fagositosis pada kontrol diduga karena kontrol tidak diberikan pakan sinbiotik yang mampu membentuk sistem kekebalan tubuh pada benih ikan patin. Menurut Pirarat et al. (2006), pemberian bakteri probiotik
Lactobacillus rhamnosus selama 2 minggu dalam pakan mampu meningkatkan nilai aktivitas fagositosis pada ikan nila. Carver (1994) menyatakan bahwa peningkatan kekebalan tubuh dapat diketahui dari peningkatan aktivitas sel fagositik.
29 IV. KESIMPULAN DAN SARAN
4.1 Kesimpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa penambahan sinbiotik 1 dosis (probiotik 1% + prebiotik 2%) melalui pakan pada benih ikan patin memberikan pengaruh yang paling baik dibanding perlakuan lainnya. Perlakuan ini menunjukkan hasil laju pertumbuhan harian yang paling tinggi yaitu sebesar 3,56% dengan nilai konversi pakan yang paling rendah yaitu sebesar 1,07. Selain itu perlakuan sinbiotik 1 dosis juga menunjukkan adanya peningkatan terhadap respon imun benih patin yang ditunjukkan dengan tingginya nilai aktivitas fagositosis, yaitu sebesar 37%.
4.2 Saran
1
PEMBERIAN SINBIOTIK DENGAN DOSIS BERBEDA UNTUK
MENINGKATKAN KINERJA PERTUMBUHAN DAN RESPON
IMUN BENIH IKAN PATIN
Pangasius
sp.
NURLITA ANNISA SARI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
2
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
PEMBERIAN SINBIOTIK DENGAN DOSIS BERBEDA UNTUK
MENINGKATKAN KINERJA PERTUMBUHAN DAN RESPON
IMUN BENIH IKAN PATIN
Pangasius
sp.
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Maret 2012
3 ABSTRAK
NURLITA ANNISA SARI. Pemberian sinbiotik dengan dosis berbeda untuk meningkatkan kinerja pertumbuhan dan respon imun benih ikan patin Pangasius
sp.. Dibimbing oleh Widanarni dan Munti Yuhana.
Ikan patin (Pangasius sp.) merupakan salah satu komoditas ikan air tawar yang memiliki nilai ekonomis tinggi. Salah satu permasalahan yang sering dihadapi pembudidaya dalam memproduksi ikan patin adalah masalah penyakit. Penelitian ini bertujuan untuk menguji pengaruh pemberian sinbiotik dengan dosis berbeda yang diberikan melalui pakan terhadap peningkatan kinerja pertumbuhan dan respon imun benih ikan patin. Probiotik yang digunakan adalah bakteri NP5 (Bacillus sp.), sedangkan prebiotik yang digunakan merupakan oligosakarida yang diekstraksi dari tepung ubi jalar varietas sukuh. Benih ikan patin dengan bobot rata-rata 0,43±0,06 gram dan panjang rata-rata 3.55±0.17 cm, dipelihara dengan kepadatan 3 ekor/liter di dalam akuarium berukuran 30x25x25 cm3 yang diisi air sebanyak 10 liter. Penelitian ini terdiri dari 4 perlakuan yaitu K (kontrol), A (penambahan sinbiotik 0,5 dosis), B (penambahan sinbiotik 1 dosis), C (penambahan sinbiotik 2 dosis). Hasil penelitian menunjukkan bahwa pemberian sinbiotik melalui pakan dengan dosis berbeda mampu memberikan peningkatan kinerja pertumbuhan dan sistem imun yang berbeda pada benih ikan patin. Benih ikan patin yang diberi sinbiotik 1 dosis menunjukkan peningkatan pertumbuhan dan respon imun yang terbaik dibanding perlakuan lainnya.
Kata kunci: ikan patin, sinbiotik, pertumbuhan, respon imun
4 ABSTRACT
NURLITA ANNISA SARI. Giving synbiotic with different doses to increase the growth and immune responses on catfish fingerlings Pangasius sp.. Supervised by Widanarni and Munti Yuhana.
Catfish (Pangasius sp.) is one of freshwater commodity which has high economic value. One of problems which often faced by the cultivator in catfish production is the problem of diseases. The aim of this research is to evaluate the effectiveness of giving synbiotic with different doses in feed to increase the growth and immune responses on catfish fingerlings. The probiotic used is NP5 (Bacillus sp.), and the prebiotic used is oligosaccharides extracted from sweet potato Sukuh variety. The catfish fingerlings used has average of weight 0,43±0,06 gram and average of length 3.55±0.17 cm, and it was kept as many as 3 fish/liter in aquarium which (30x25x25) cm3 and filled with 10 liter of water. This research has been done in 4 treatments namely K (control), A (adding 0,5 dose of synbiotic), B (adding 1 dose of synbiotic), C (adding 2 dose of synbiotic). The result study shows that giving synbiotic in feed with different doses can give different increasing of growth and immune responses in catfish fingerlings. The catfish fingerlings given 1 dose of synbiotic showed the best increasing of growth and immune responses compared to the other treatments.
5
PEMBERIAN SINBIOTIK DENGAN DOSIS BERBEDA UNTUK
MENINGKATKAN KINERJA PERTUMBUHAN DAN RESPON
IMUN BENIH IKAN PATIN
Pangasius
sp.
NURLITA ANNISA SARI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi dan Manajemen Perikanan Budidaya
Departemen Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
6 Judul : Pemberian sinbiotik dengan dosis berbeda untuk meningkatkan kinerja pertumbuhan dan sistem imun benih ikan patin Pangasius
sp.
Nama : Nurlita Annisa Sari
NRP : C14070014
Disetujui,
Pembimbing I Pembimbing II
Dr. Widanarni Dr. Munti Yuhana
NIP : 19670927 199403 2 001 NIP. 19691220 199403 2 002
Diketahui,
Ketua Departemen Budidaya Perairan
Dr. Odang Carman NIP : 19591222 198601 1 001
7
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan karunia-Nya, sehingga penyusunan skripsi yang berjudul "Pemberian sinbiotik dengan dosis berbeda untuk meningkatkan kinerja pertumbuhan dan sistem imun benih ikan patin Pangasius sp." dapat diselesaikan dengan baik. Penelitian ini dilaksanakan pada bulan September hingga Oktober 2011 bertempat di Laboratorium Kesehatan Ikan, Laboratorium Lingkungan Budidaya Perairan, dan Laboratorium Nutrisi Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Ucapan terima kasih penulis sampaikan kepada Dr. Widanarni dan Dr. Munti Yuhana sebagai dosen pembimbing atas bimbingan dan nasihat yang telah diberikan selama ini, serta kepada Yuni Puji Hastuti, S.Pi, M.Si. sebagai dosen penguji tamu. Penulis juga menyampaikan terima kasih kepada Ibunda Sumiyati atas doa, kasih sayang, dan dukungan yang tidak terbatas, serta kepada Tika Amanda Sari dan Rudy Haryanto. Ucapan terima kasih juga penulis sampaikan kepada Pak Ranta, Pak Wasjan, Mba Retno, dan Kang Abe yang telah membantu penulis dalam pengerjaan penelitian ini, serta kepada Ridha, Ririn, Trian, Kak Rahman, teman-teman di Laboratoium Kesehatan Ikan, teman-teman BDP 44, dan semua pihak yang telah memberikan bantuan dan dukungannya kepada penulis dalam menyelesaikan skripsi ini.
Bogor, Maret 2012
8
DAFTAR RIWAYAT HIDUP
Penulis merupakan anak kedua dari tiga bersaudara yang dilahirkan di Tangerang pada tanggal 19 November 1989 dari pasangan Alm. Bapak Achmad Syarifudin dan Ibu Sumiyati. Pendidikan formal yang telah dilalui oleh penulis adalah SDN Larangan 09 Tangerang (1995-2001), SMPN 267 Jakarta (2001-2004), serta SMAN 90 Jakarta (2004-2007). Pada tahun 2007 penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) dengan mayor Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis pernah melakukan praktik lapang akuakultur (PLA) di PT. Centralpertiwi Bahari Rembang dan PT. Triwindu Graha Manunggal Anyer dengan judul laporan “Pembenihan Udang Vaname (Litopenaeus vannamei)”. Penulis juga pernah menjadi asisten mata kuliah Dasar-dasar Mikrobiologi Akuatik program Sarjana semester genap tahun ajaran 2009/2010 dan 2010/2011, serta Penyakit Organisme Akuatik program Sarjana semester ganjil tahun ajaran 2011/2012.
xi
DAFTAR TABEL
xii
DAFTAR GAMBAR
xiii
DAFTAR LAMPIRAN
Halaman 1. Kandungan nutrisi pakan komersil (Feng Li 3) ... 35 2. Analisis statistik terhadap kelangsungan hidup benih patin selama
perlakuan sinbiotik ... 35 3. Analisis statistik terhadap laju pertumbuhan harian benih patin
selama perlakuan sinbiotik ... 36 4. Analisis statistik terhadap laju pertumbuhan mutlak benih patin
selama perlakuan sinbiotik ... 37 5. Analisis statistik terhadap konversi pakan benih patin selama
1 I. PENDAHULUAN
Ikan patin (Pangasius sp.) merupakan salah satu komoditas ikan air tawar yang memiliki nilai ekonomis tinggi. Berdasarkan data produksi perikanan budidaya, produksi ikan patin pada tahun 2005 mencapai 32.575 ton dan terus mengalami peningkatan hingga pada tahun 2007 sebesar 36.260 ton (Ferinaldy 2008). Selain itu, ikan patin juga merupakan salah satu komoditas perikanan budidaya yang ditargetkan oleh KKP untuk ditingkatkan produksinya hingga sebesar 1.420% pada periode 2010-2014 (Anonim 2010). Tingginya target peningkatan produksi patin yang ditetapkan oleh KKP ini didasari oleh banyaknya permintaan patin yang masih belum dapat dipenuhi oleh produsen. Hal ini disebabkan karena adanya beberapa permasalahan yang membatasi produksi ikan patin. Salah satu permasalahan yang sering dihadapi para pembudidaya ikan patin adalah masalah penyakit yang menyerang ikan patin dan kerap menurunkan produksi para pembudidaya. Penyakit yang umum menyerang pada ikan misalnya dapat disebabkan oleh bakteri atau virus.
Penanggulangan penyakit yang umum dilakukan oleh para pembudidaya adalah dengan menggunakan antibiotik. Penggunaan antibiotik ini memiliki keunggulan praktis digunakan dan mudah didapatkan. Selain itu antibiotik juga dikenal cukup efektif dalam mengatasi permasalahan penyakit bakterial. Namun seiring dengan penggunaan antibiotik secara terus menerus, dikhawatirkan dapat menyebabkan bakteri resisten terhadap antibiotik. Selain itu, penggunaan antibiotik juga dapat mencemari lingkungan di sekitar lokasi budidaya serta dapat menyebabkan residu di dalam tubuh manusia yang mengkonsumsi ikan yang mengandung antibiotik. Banyaknya permasalahan dari penggunaan antibiotik ini mendorong banyaknya penelitian untuk mencari alternatif guna menanggulangi penyakit bakterial tersebut. Salah satu alternatif yang aman dan cukup efektif digunakan adalah melalui penggunaan sinbiotik.
Menurut Lisal (2005), sinbiotik merupakan gabungan antara probiotik dan prebiotik dengan komposisi seimbang dalam mendukung kelangsungan hidup dan pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan makhluk hidup. Aplikasi pemberian probiotik atau prebiotik saja masih belum
2 menunjukkan hasil yang maksimal karena adanya kelemahan dari keduanya apabila digunakan secara terpisah. Verschuere et al. (2000) menyatakan bahwa probiotik merupakan agen mikroba hidup yang memberikan pengaruh menguntungkan pada inang melalui penyeimbangan mikroflora intestinal, peningkatan efisiensi pakan atau peningkatan nilai nutrisi pakan, peningkatan respon imun, atau dengan melalui peningkatan kualitas lingkungan budidaya. Sedangkan prebiotik merupakan salah satu bahan penyusun makanan yang tidak dicerna oleh saluran pencernaan dan dapat menstimulasi pertumbuhan serta aktivitas bakteri flora normal di dalam saluran pencernaan hewan inang (Ringo et al. 2010).
Lisal (2005) menyatakan bahwa pemberian probiotik tanpa adanya penambahan jumlah nutrien yang cukup untuk kehidupannya, ditambah dengan terjadinya perubahan lingkungan yang ekstrim di dalam saluran pencernaan akan menyebabkan cepatnya terjadi wash out (pencucian) pada bakteri probiotik. Sedangkan pemberian prebiotik tanpa adanya penambahan bakteri probiotik yang memanfaatkan prebiotik tersebut di dalam saluran pencernaan tidak akan memberikan pengaruh yang signifikan terhadap peningkatan respon imun ikan. Putra (2010) menyatakan bahwa pemberian sinbiotik pada kegiatan budidaya ikan nila merah menghasilkan kinerja pertumbuhan yang lebih baik dibandingkan pemberian probiotik atau prebiotik saja. Berdasarkan hasil penelitian Li et al. (2009), penambahan gabungan probiotik Bacillus dan prebiotik
isomaltooligosaccharides dapat meningkatkan respon imun dan resistensi udang vaname terhadap serangan WSSV.
3 II. METODOLOGI
2.1 Penyediaan Bakteri Probiotik
Bakteri probiotik yang digunakan dalam penelitian ini adalah bakteri NP5, yang merupakan bakteri dari genus Bacillus. Bakteri NP5 ini merupakan bakteri yang diisolasi dari saluran pencernaan ikan nila dan telah dilakukan beberapa uji seperti uji ketahanan terhadap pH asam, uji penempelan, serta uji patogenisitas (Putra 2010). Penyediaan bakteri probiotik diawali dengan menumbuhkan bakteri NP5 ke dalam media Trypticase Soy Agar (TSA) miring dan diinkubasi selama 24 jam dalam inkubator. Setelah itu dilakukan kultur bakteri NP5 dalam 10 ml media
Trypticase Soy Broth (TSB) steril dan diinkubasi selama 24 jam di dalam water bath shaker dengan kecepatan 140 rpm. Selanjutnya dilakukan pemanenan bakteri probiotik dengan memindahkan suspensi bakteri ke dalam tabung Corning dan disentrifuse selama 10 menit dengan kecepatan 5000 rpm yang bertujuan untuk memisahkan bakteri probiotik dengan media kulturnya. Kemudian dilakukan pencucian dengan menambahkan Phosphate Buffer Saline (PBS) steril sebanyak 10 ml, lalu dihomogenkan dengan menggunakan vortex dan disentrifuse kembali dengan kecepatan 5000 rpm selama 10 menit. Setelah itu dilakukan tahap pencucian kedua dengan menambahkan 4 ml PBS steril lalu dihomogenkan dengan vortex dan suspensi bakteri probiotik siap dicampurkan ke dalam pakan.
2.2 Ekstraksi Oligosakarida/Prebiotik
4 Hasil pemekatan diencerkan dengan akuades steril dengan jumlah yang ditentukan melalui perhitungan total padatan terlarut (TPT).
2.3 Perhitungan Total Padatan Terlarut
Total padatan terlarut (TPT) diukur berdasarkan metode Apriyantono et al.
(1989) yang bertujuan untuk melihat kepekatan padatan terlarut prebiotik yang berguna pada analisa oligosakarida. Cawan porselin dikeringkan dalam oven selama 1 jam dengan suhu 100 ˚C, kemudian didinginkan selama 30 menit agar berat cawan stabil dan cawan ditimbang (a gram). Sebanyak 1 ml ekstrak oligosakarida ditempatkan dalam cawan porselin tersebut dan cawan ditimbang (b gram). Kemudian cawan yang berisi ekstrak oligosakarida dimasukkan ke dalam oven bersuhu 100 ˚C selama 24 jam, lalu cawan tersebut didinginkan dalam desikator selama 30 menit agar berat cawan stabil dan cawan ditimbang (c gram). Total padatan terlarut dihitung berdasarkan hasil perbandingan berat ekstrak setelah dikeringkan dengan berat ekstrak sebelum dikeringkan.
TPT = x 100% Keterangan:
a = berat cawan sebelum diisi ekstrak oligosakarida b = berat cawan setelah diisi ekstrak oligosakarida
c = berat cawan setelah diisi ekstrak oligosakarida dan dioven 24 jam
2.4 Pengujian Sinbiotik secara In Vivo
2.4.1 Persiapan Wadah dan Ikan Uji
5 Benih ikan patin yang digunakan berasal dari Cibanteng, memiliki bobot rata-rata 0,43±0,06 gram dan panjang rata-rata 3.55±0.17 cm, dipelihara dengan kepadatan 3 ekor/liter (Radyo 2009). Sebelum diberi perlakuan, ikan diadaptasikan terlebih dahulu terhadap lingkungan selama 1 minggu, lalu ikan dipuasakan selama 1 hari sebelum diberi pakan perlakuan.
2.6.2 Uji In Vivo
Pakan uji yang digunakan pada penelitian ini merupakan pakan komersil udang bermerk dagang Feng-Li, berbentuk remah (crumble), dan memiliki kadar protein sebesar 40% (Lampiran 1). Selanjutnya pakan ditambahkan sinbiotik dengan dosis berbeda sesuai pada masing-masing perlakuan. Penelitian ini terdiri dari 4 perlakuan dengan 3 ulangan, yaitu:
K : Pemberian pakan tanpa penambahan sinbiotik
A : Pemberian pakan dengan penambahan sinbiotik 0,5 dosis (probiotik 0,5% + prebiotik 1%)
B : Pemberian pakan dengan penambahan sinbiotik 1 dosis (probiotik 1% + prebiotik 2% (Wang 2007 dan Mahious et al. 2006))
C : Pemberian pakan dengan penambahan sinbiotik 2 dosis (probiotik 2% + prebiotik sebesar 4%)
6 2.5 Parameter Pengamatan
2.5.1 Tingkat Kelangsungan Hidup (SR)
Kelangsungan hidup ikan diamati setiap hari dari awal hingga akhir perlakuan. Tingkat kelangsungan hidup ikan dihitung dengan menggunakan rumus berdasarkan Effendie (1997):
SR = × 100%
Keterangan :
SR = Tingkat kelangsungan hidup (%) Nt = Jumlah ikan pada akhir perlakuan No = Jumlah ikan pada awal perlakuan
2.5.2 Laju Pertumbuhan Harian (LPH)
Laju pertumbuhan spesifik dihitung menggunakan rumus berikut (Huisman, 1987):
LPH (%) = −1 × 100%
Keterangan :
Wt = Bobot rata-rata ikan pada akhir perlakuan (gram) Wo = Bobot rata-rata ikan pada awal perlakuan (gram) n = Lama perlakuan
2.5.3 Pertumbuhan Panjang
Nilai pertumbuhan panjang didapatkan berdasarkan selisih panjang benih ikan patin pada awal perlakuan dengan panjang benih ikan patin pada akhir perlakuan. Pertumbuhan panjang dihitung melalui rumus berikut (Effendie 1997):
Pertumbuhan panjang = Lt – Lo Keterangan :
7 2.5.4 Konversi Pakan (FCR)
Nilai konversi pakan yang digunakan selama perlakuan ini dapat diketahui melalui rumus berikut (Effendie 1997):
FCR = Keterangan :
FCR = Konversi pakan
Pa = Jumlah pakan yang dihabiskan (gram) Bt = Biomassa ikan pada akhir perlakuan (gram) Bo = Biomassa ikan pada awal perlakuan (gram) Bm = Biomassa ikan yang mati (gram)
2.5.5 Hematologi Ikan 2.5.5.1 Total Eritrosit
Total eritrosit dihitung berdasarkan Blaxhall dan Daisley (1973) dengan cara: sampel darah dihisap dengan pipet bulir merah sampai skala 1. Kemudian ditambahkan larutan Hayem’s dengan cara dihisap sampai skala 101, lalu campuran tersebut dihomogenkan dengan cara pipet digoyang membentuk angka delapan selama 3-5 menit. Setelah itu tetesan pertama dari dalam pipet dibuang, dan tetesan selanjutnya dikeluarkan ke atas hemasitometer yang sudah ditutup dengan kaca penutup, Selanjutnya dilakukan perhitungan sel darah merah pada 5 kotak besar hemasitometer di bawah miroskop. Total sel darah merah didapatkan berdasarkan rumus berikut:
∑ eritrosit = ∑ sel eritosit terhitung x (pengencer/volume)
2.5.5.2 Total Leukosit
8 kecil hemasitometer di bawah miroskop. Total sel darah putih didapatkan berdasarkan rumus berikut:
∑ leukosit = ∑ sel leukosit terhitung x (pengencer/volume)
2.5.5.3 Kadar Hemoglobin (Hb)
Kadar hemoglobin diukur melalui metode Sahli dengan menggunakan Sahlinometer (Wedemeyer dan Yasutake 1977). Prosedur pengukuran kadar hemoglobin dilakukan dengan cara: darah dihisap dengan pipet Sahli sampai skala 20 mm3 atau 0,2 ml. Kemudian darah di dalam pipet dimasukkan ke dalam tabung Hb-meter yang telah diisi HCl 0,1 N sampai skala 10 pada skala yang berwarna merah, lalu diaduk dan didiamkan selama 3-5 menit. Setelah itu ditambahkan akuades sedikit demi sedikit sampai warna campuran darah dan HCl sama dengan warna larutan standar yang ada di dalam Hb-meter. Selanjutnya kadar hemoglobin dibaca dengan melihat permukaan cairan dan dicocokkan dengan angka pada skala yang berwarna kuning. Kadar hemoglobin yang terbaca memiliki satuan gram% yang berarti banyaknya hemoglobin dalam satuan gram per 100 ml darah.
2.5.5.4 Kadar Hematokrit (He)
Kadar hematokrit diukur berdasarkan Anderson dan Siwicki (1993) dengan cara: sampel darah dimasukkan ke dalam tabung mikrohematokrit sampai ¾ bagian tabung, lalu ujung tabung disumbat dengan crystoseal. Setelah itu tabung disentrifus selama 5 menit dengan kecepatan 3000 rpm. Kemudian dilakukan pengukuran panjang darah yang mengendap (a) dan panjang total volume darah (b) di dalam tabung mikro hematokrit. Kadar hematokrit dinyatakan sebagai % volume padatan sel darah yang dihitung dengan rumus berikut:
He = (a/b) x 100%
2.5.5.5 Diferensial Leukosit
9 objek yang telah ditetesi darah dengan membentuk sudut sebesar 30˚. Kemudian gelas objek kedua tersebut ditarik sampai bagian ujung terpanjang gelas objek pertama dengan menyentuh darah tetapi tidak menyentuh permukaan gelas objek pertama. Preparat dikeringanginkan dan difiksasi dengan metanol selama 5 menit. Selanjutnya preparat dikeringanginkan kembali dan dilakukan pewarnaan dengan Giemsa selama 15 menit. Setelah itu preparat dibilas dengan air mengalir dan dikeringanginkan, lalu preparat ulas diamati di bawah mikroskop, kemudian dihitung jenis-jenis leukosit dan dihitung pula persentase dari masing-masing jenis leukosit tersebut.
2.5.5.6 Aktivitas Fagositosis
Perhitungan aktivitas fagositosis mengacu pada Anderson dan Siwicki (1993) dilakukan dengan cara: sebanyak 50 µl sampel darah dimasukkan ke dalam eppendorf dan ditambahkan 50 µl suspensi bakteri Staphylococcus aureus dalam PBS yang memiliki kepadatan 107 CFU/ml. Campuran tersebut dihomogenkan dan diinkubasi selama 20 menit. Kemudian sebanyak 5 µl campuran tersebut dibuat preparat ulas dan dikeringanginkan, selanjutnya difiksasi dengan metanol dan dikeringanginkan. Selanjutnya preparat diwarnai dengan pewarna Giemsa selama 15 menit, lalu dibilas dengan air mengalir dan dikeringanginkan. Pengamatan aktivitas fagositosis dilakukan di bawah mikroskop dan dihitung persentase dari total 100 sel darah putih yang menunjukkan aktivitas fagositosis.
2.5.6 Kualitas Air
Pengukuran kualitas air yang berupa DO, pH, dan TAN dilakukan pada saat awal dan akhir perlakuan. Sedangkan parameter suhu dilakukan setiap hari pada pagi dan sore hari. Tabel 1 di bawah ini adalah satuan dan alat ukur dari parameter kualitas air yang diamati.
Tabel 1. Satuan dan alat ukur dari parameter kualitas air Parameter Satuan Alat ukur
Suhu oC Termometer Oksigen terlarut ppm DO meter
pH - pH meter
10 2.6 Analisis Data
11 III. HASIL DAN PEMBAHASAN
3.1 Hasil
3.1.1 Kelangsungan Hidup
Kelangsungan hidup benih ikan patin diamati selama 30 hari masa pemeliharaan. Data hasil kelangsungan hidup benih ikan patin dapat dilihat pada Gambar 1 berikut.
Keterangan: Huruf superscript yang sama menunjukkan hasil yang tidak berbeda nyata (P>0,05). Gambar 1. Kelangsungan hidup benih ikan patin selama perlakuan sinbiotik;
K.kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
Berdasarkan hasil yang ditunjukkan pada Gambar 1 dan uji statistik pada Lampiran 2, diketahui bahwa tingkat kelangsungan hidup pada semua perlakuan tidak menunjukkan pengaruh yang berbeda nyata dimana semua perlakuan memiliki tingkat kelangsungan hidup sebesar 100%.
3.1.2 Laju Pertumbuhan Harian
12 Keterangan: Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P>0,05). Gambar 2. Laju pertumbuhan harian benih ikan patin selama perlakuan sinbiotik;
K. kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
Berdasarkan hasil yang ditunjukkan pada Gambar 2 di atas, dapat dilihat bahwa nilai laju pertumbuhan harian tertinggi diperoleh pada perlakuan B yaitu sebesar 3,56%. Sedangkan nilai yang terendah terdapat pada perlakuan C yaitu sebesar 2,24% . Pada kontrol, nilai laju pertumbuhan harian sebesar 2,63% dan pada perlakuan A sebesar 3,14%. Hasil uji statistik pada Lampiran 3 menunjukkan bahwa nilai laju pertumbuhan harian perlakuan A dan B berbeda nyata dengan kontrol dan perlakuan C. Namun perlakuan A tidak berbeda nyata dengan perlakuan B, sedangkan kontrol tidak berbeda nyata dengan perlakuan C.
3.1.3 Pertumbuhan Panjang
Perbedaan panjang awal dan akhir benih ikan patin selama 30 hari pemeliharaan dapat dilihat pada Tabel 2 berikut.
Tabel 2. Rata-rata panjang awal dan akhir benih ikan patin
Perlakuan Rata-rata panjang awal (Lo) (cm) Rata-rata panjang akhir (Lt) (cm)
K 3,52 7,40
A 3,62 7,92
B 3,48 8,02
C 3,62 7,24
Keterangan:
13 Pengaruh pemberian sinbiotik dengan dosis berbeda terhadap pertumbuhan panjang yang dihasilkan oleh masing-masing perlakuan dapat dilihat pada Gambar 3 di bawah ini.
Keterangan: Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P>0,05). Gambar 3. Pertumbuhan panjang benih ikan patin selama perlakuan sinbiotik; K.
kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
Nilai dari pertumbuhan panjang yang dihasilkan masing-masing perlakuan mengalami perbedaan, dimana nilai tertinggi terdapat pada perlakuan B yaitu sebesar 4,54 cm. Nilai pertumbuhan panjang terendah terdapat pada perlakuan C yaitu sebesar 3,62 cm. Sedangkan nilai pertumbuhan panjang pada kontrol dan perlakuan A secara berturut-turut adalah sebesar 3,89 cm dan 4,31 cm. Berdasarkan hasil uji statistik pada Lampiran 4, didapatkan bahwa perlakuan A dan B tidak menunjukkan pengaruh yang berbeda nyata. Namun kedua perlakuan ini menunjukkan pengaruh yang berbeda nyata dengan perlakuan yang lainya.
3.1.4 Konversi Pakan
Nilai konversi pakan yang dihasilkan dari pemberian pakan sinbiotik dengan dosis berbeda dapat dilihat pada Gambar 4 berikut.
14 Keterangan: Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P>0,05). Gambar 4. Konversi pakan benih ikan patin selama perlakuan sinbiotik; K.
kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
Berdasarkan Gambar 4 di atas, diketahui bahawa nilai konversi pakan tertinggi selama pemeliharaan benih ikan patin terdapat pada perlakuan C yaitu sebesar1,46. Konversi pakan yang terendah terdapat pada perlakuan B dengan nilai 1,07. Sedangkan nilai konversi pakan pada kontrol dan perlakuan A secara berturut-turut adalah sebesar 1,40 dan 1,28. Setelah diuji statistik, didapatkan pengaruh yang tidak berbeda nyata antara kontrol dengan perlakuan C, namun kedua perlakuan tersebut berbeda nyata dengan perlakuan A dan B (Lampiran 5).
3.1.5 Hematologi Ikan 3.1.5.1 Total Eritrosit
15 Gambar 5. Total eritrosit benih ikan patin selama perlakuan sinbiotik; K. kontrol;
A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis. Total eritrosit benih ikan patin pada akhir pemeliharaan menunjukkan hasil yang berbeda-beda. Total eritrosit dengan nilai tertinggi terdapat pada perlakuan B yaitu sebesar 1,74 x 106 sel/mm3. Nilai terendah total eritrosit terdapat pada diamati pada akhir pemeliharaan ditunjukkan pada Gambar 6 berikut.
Gambar 6. Total leukosit benih ikan patin selama perlakuan sinbiotik; K. kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
16 Berdasarkan data yang disajikan pada Gambar 6 diatas, diketahui bahwa total leukosit pada kontrol adalah sebesar 10,29 x 105 sel/mm3. Berikutnya pada perlakuan A sebesar 8,9 x 105 sel/mm3, perlakuan B sebesar 6,78 x 105 sel/mm3, dan perlakuan C sebesar 6,96 x 105 sel/mm3. Dari data tersebut diketahui bahwa nilai rata-rata total leukosit tertinggi terdapat pada kontrol, sedangkan yang terendah terdapat pada perlakuan B.
3.1.5.3 Kadar Hemoglobin
Kadar hemoglobin (gram%) yang diamati pada masing-masing perlakuan disajikan pada Gambar 7 berikut.
Gambar 7. Kadar hemoglobin benih ikan patin selama pemeliharaan perlakuan sinbiotik; K. kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
Kadar hemoglobin yang didapat pada masing-masing perlakuan menunjukkan korelasi yang positif terhadap total eritrosit, dimana nilai tertinggi terdapat pada perlakuan B dan yang terendah terdapat pada perlakuan C. Adapun nilai kadar hemoglobin pada masing-masing perlakuan adalah kontrol sebesar 5,4 gram%, perlakuan A sebesar 6,4 gram%, perlakuan B sebesar 6,8 gram%, dan perlakuan C sebesar 3,4 gram%.
3.1.5.4 Kadar Hematokrit
Kadar hematokrit (%) yang terukur dari masing-masing perlakuan pada akhir pemeliharaan disajikan pada Gambar 8 berikut.
17 Gambar 8. Kadar hematokrit benih ikan patin selama perlakuan sinbiotik; K. kontrol; A. sinbiotik 0,5 dosis; B. sinbiotik 1 dosis; C. sinbiotik 2 dosis.
Sama halnya dengan nilai dari kadar hemoglobin, kadar hematokrit juga memiliki hasil yang berkorelasi positif dengan total eritrosit. Namun nilai terendah dari kadar hematokrit terdapat pada kontrol dan perlakuan C yaitu sebesar 12,5%. Sedangkan kadar hematokrit pada perlakuan B dengan nilai tertinggi adalah sebesar 22,5% dan nilai kadar hematokrit pada perlakuan A adalah sebesar 17,95%.
3.1.5.5 Diferensial Leukosit