DINAMIKA POPULASI BULU BABI
(Tripneustes gratilla Linnaeus 1758)
DI PERAIRAN PANTAI SEMERANG, LOMBOK TIMUR
NOAR MUDA SATYAWAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Dinamika Populasi Bulu
Babi (Tripneustes gratilla Linnaeus 1758) di Perairan Pantai Semerang, Lombok
Timur adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2014
Noar Muda Satyawan
RINGKASAN
NOAR MUDA SATYAWAN. Dinamika Populasi Bulu Babi (Tripneustes gratilla
Linnaeus 1758) di Perairan Pantai Semerang, Lombok Timur. Dibimbing oleh YUSLI WARDIATNO dan RAHMAT KURNIA.
Bulu babi (T. gratilla) merupakan salah satu biota laut yang bernilai ekonomis tinggi. Gonad bulu babi dapat dimanfaatkan sebagai bahan pangan yang bergizi tinggi. Gonad bulu babi merupakan makanan yang populer dan mempunyai nilai perdagangan yang sangat layak ekspor khususnya bagi masyarakat Jepang, Korea, Amerika Serikat, Rusia, Kanada, Chili, Meksiko, Perancis dan China. Masyarakat pesisir pulau Lombok telah lama memanfaatkan gonad bulu babi sebagai bahan makanan. Selama periode waktu tersebut eksploitasi terhadap populasi bulu babi terus dilakukan tanpa adanya upaya
pengendalian penangkapan untuk menjaga kelestarian biota tersebut.
Penangkapan yang berlebih (over fishing) dikhawatirkan akan mengancam
kelestarian dan keberlanjutan pemanfaatan sumberdaya bulu babi di peisir pulau Lombok.
Penelitian ini memiliki empat tujuan utama yaitu: (1) Mengkaji sebaran spasial bulu babi T. gratilla serta faktor lingkungan yang mempengaruhinya; (2) Mengkaji beberapa parameter dinamika populasi bulu babi T. gratilla, seperti laju pertumbuhan, mortalitas, tingkat kematangan gonad dan musim pemijahan; (3) Mengetahui ukuran pertamakali matang gonad (Lm) dan ukuran bulu babi T. gratilla yang tertangkap nelayan; dan (4) Menganalisis status dan tingkat pemanfaatan sumberdaya bulu babi T. gratilla.
Hasil penelitian ini menunjukan bahwa 6 jenis lamun ditemukan di pantai
Semerang yaitu Cymodocea rotundata, Cymodocea serullata, Syringodium
isoetifolium, Halophila ovalis, Halodule uninervis, dan Thalassodendron ciliatu.
Tipe vegetasi lamun adalah vegetasi campuran (mixed seagrass beds) yang umumnya didominasi oleh C. rotundata, S. isoetifolium dan H. ovalis. Kepadatan bulu babi T gratilla di Pantai Semerang tergolong rendah berkisar antara 1,07 – 6,32 individu/100 m2 dengan distribusi yang tidak merata terkait dengan kedalaman dan tutupan lamun.
Hasil analisis menunjukan bahwa pertumbuhan bulu babi T. Gratilla
bersifat allometrik negatif (b < 3), tergolong lambat dan memiliki panjang infiniti kecil ( D∞ = 92,4, K =0,780 dan to = - 0,084). Hasil analisis juga menunjukan nilai mortalitas total sebesar 3,78/tahun dengan mortalitas alami yang rendah (1,13/tahun) dan mortalitas penangkapan tinggi (2,65/tahun). Berdasarkan nilai mortalitas tersebut estimasi laju eksploitasi (E) sebesar 0,70 menunjukan gejala tangkap lebih (over fishing). Puncak pemijahan dan rekrutmen terjadi pada bulan Juni (TKG 4 mencapai 25%). Bulu babi T. gratilla matang gonad pada ukuran yang cukup besar (58,2 mm) dan dicapai dalam waktu yang lama (1,2 tahun). Jumlah nelayan berkisar antara 5 – 16 orang dengan kisaran hasil tangkapan sebesar 569 – 1598 ekor/periode penangkapan. Intensitas tangkapan mencapai 52 ekor/orang/jam dan ukuran diameter bulu babi yang tertangkap berkisar antara 48,5 mm - 89,1 mm dengan ukuran rata-rata 67,3 mm.
SUMMARY
NOAR MUDA SATYAWAN. Population Dynamics of Sea Urchin (Tripneustes
gratilla Linnaeus 1758) in Semerang Beach, Eastern of Lombok. Supervised by YUSLI WARDIATNO and RAHMAT KURNIA
Sea urchins (T. gratilla) is one of marine biota which has high economic value. Gonads of sea urchins usually call with “Roe”. Sea urchins roe can be used as a highly nutritious food. The sea urchins roe are a popular food and has very decent trade value, especially for the export of Japan, Korea, USA, Russia, Canada, Chile, Mexico, France, China. Utilization of sea urchin roe as food for coastal communities has longstanding in Lombok island. During the time period of the exploitation of sea urchin population without any caught control to save it sustainability. Over exploitation is one of the causes of declining populations of sea urchins in the wild. Therefore, the over fishing could be threaten the sustainability of sea urchins resource in the coastal of Lombok island.
This research has four main objectives that include the following: (1) study about the spatial distribution of sea urchin (T. gratilla) and environmental factors that influence; (2) study about the population dynamics of sea urchin (T. gratilla), such as growth rate, mortality, gonadal maturation and spawning season, (3) determine the length at sexual maturation (Lm) and length of sea urchin T. gratilla
that caught by fishermen, and (4) to analyze the status and the resource utilization level of sea urchin (T. gratilla).
This result showed that 6 species of seagrasses has been found in
Semerang Beach includes Cymodocea rotundata, Cymodocea serullata,
Syringodium isoetifolium, Halophila ovalis, Halodule uninervis, and
Thalassodendron ciliatum. Seagrass vegetation types in Semerang Beach is mixed vegetation (mixed seagrass beds) were generally dominated by C. rotundata, S. isoetifolium and H. ovalis. Densities of sea urchin T. gratilla ranging from 1,07 to 6,32 individual/100m2 with uneven distribution and related to the depth of water and seagrass cover.
The Result of analysis showed that sea urchins T. gratilla is alometric negative growth (b<3), rated slowly growth and has small infinity length (D∞ = 92,4, K =0,780 dan to = - 0,084). Result also showed the total mortality value of sea urchins is 3,78 year-1 with low natural mortality (1,13 year-1) and high 1598 urchins/period. Harvesting intensity reached 52 urchins/person/hour and diameter of harvest sea urchins by fishermen ranging from 48,5 mm – 89,1 mm with 67,3 mm mean size.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
DINAMIKA POPULASI BULU BABI
(Tripneustes gratilla Linnaeus 1758)
DI PERAIRAN PANTAI SEMERANG, LOMBOK TIMUR
NOAR MUDA SATYAWAN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Pengelolaan Sumberdaya Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Dinamika Populasi Bulu Babi (Tripneustes gratilla Linnaeus 1758) di Perairan Pantai Semerang, Lombok Timur
Nama : Noar Muda Satyawan
NIM : C251110231
Disetujui oleh
Komisi Pembimbing
Dr. Ir. Yusli Wardiatno, M.Sc.
Ketua
Dr. Ir. Rahmat Kurnia, M.Si.
Anggota
Diketahui oleh
Ketua Program Studi
Pengelolaan Sumberdaya Perairan
Dr. Ir. Sigid Hariyadi, M.Sc.
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MscAgr.
i
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga penyusunan tesis tentang “Dinamika Populasi Bulu Babi (Tripneustes gratilla Linnaeus 1758) di Perairan Pantai Semerang, Lombok Timur” dapat diselesaikan tepat pada waktunya.
Terselesaikannya tesis ini tidak terlepas dari bantuan berbagai pihak terutama Bapak Dr. Ir. Yusli Wardiatno, M.Sc. dan Bapak Dr. Ir. Rahmat Kurnia, M.Si selaku dosen pembimbing. Terkait dengan hal tersebut penulis menyampaikan ucapan terimakasih yang sebesar-besarnya. Ungkapan terimakasih juga penulis sampaikan kepada keluarga SDP angkatan 2011, sahabat Biologi FKIP Unram (Eman, Hasan, Epoel, Ali), masyarakat pesisir pantai Semerang (Buan, Amaq Nurman, Inaq Buan, Nurul, Dewi dan Edi Bowoq) yang telah banyak membantu dalam melakukan pengambilan data selama penelitian berlangsung. Terimakasih kepada keluarga besar Asrama NTB Bogor yang telah memberikan dorongan semangat selam penulisan tesis serta “C083K” yang selalu menjadi motivasi untuk menyelesaikan studi. Ucapan terimakasih yang sebesar-besarnya juga peneliti ucapkan kepada Ayah, Ibu, Adik-adik serta seluruh keluarga atas doa dan kasih sayangnya.
Tidak tertutup kemungkinan dalam penyusunan tesis ini masih ditemukan adanya ketidaksempurnaan. Karena itu penulis sangat mengharapkan adanya kritik/saran/masukan dari berbagai pihak untuk memperbaiki kualitas dari tesis ini. Akhirnya penulis berharap tesis ini dapat bermanfaat dalam pengelolaan sumberdaya perairan untuk menjaga agar populasi bulu babi (T. gratilla) tetap lestari.
Bogor, Maret 2014
ii
Pertumbuhan dan reproduksi bulu babi T. gratilla ... 5
Habitat dan penyebaran bulu babi T. gratilla ... 9
3. METODE ... 9
Lokasi dan waktu penelitian ... 9
Pengumpulan data... 10
Pengumpulan data parameter lingkungan ... 10
Pengambilan sampel bulu babi dan lamun ... 10
Analisis Data ... 11
Hubungan diameter cangkang dengan bobot tubuh bulu babi ... 11
Parameter pertumbuhan dan umur (K, D∞, to) ... 11
Mortalitas ... 12
Ukuran pertama kali matang gonad ... 12
Laju tangkapan ... 13
Status dan tingkat pemanfaatan bulu babi ... 13
4. HASIL DAN PEMBAHASAN... 13
Hasil ... 13
Kondisi fisika dan kimia perairan pantai Semerang ... 13
Kondisi vegetasi lamun di pantai Semerang ... 14
Komposisi jenis lamun ... 14
Kerapatan lamun ... 14
Tutupan lamun ... 15
Distribusi dan kepadatan bulu babi T. gratilla di Pantai Semerang ... 15
Dinamika populasi bulu babi T. gratilla ... 16
Hubungan diameter cangkang dengan bobot tubuh bulu babi T. gratilla ... 16
Parameter pertumbuhan dan umur (D∞, K, to) ... 17
Mortalitas dan laju eksploitasi bulu babi (E) ... 18
Aspek reproduksi bulu babi T. gratilla di pantai Semerang ... 19
Intensitas tangkapan per upaya (CPUE) ... 21
Ukuran bulu babi yang tertangkap nelayan ... 22
Pembahasan ... 22
5. SIMPULAN DAN SARAN ... 32
iii 1. Kondisi fisika dan kimia pantai Semerang ... 13
2. Parameter pertumbuhan dan umur bulu babi T. gratilla ... 18
3. Hasil studi kepadatan bulu babi T. gratilla ... 25
4. Hasil studi hubungan diameter-bobot bulu babi T. gratilla ... 29
5. Hasil estimasi parameter pertumbuhan bulu babi T. gratilla di beberapa lokasi ... 29
6. Status sumberdaya bulu babi T. gratilla di pantai Semerang ... 31
DAFTAR GAMBAR 1. Diagram alir perumusan masalah... 3
2. Bentuk morfologi bulu babi T. Gratilla ... 4
3. Diagram bulu babi Regularia ... 5
4. Gambaran skematik struktur testis dan ovary pada tingkat pematangan yang berbeda. Kolom kanan dan kiri memperlihatkan proses yang biasa, kolom tengah proses yang tidak biasa ... 6
5. Gonad bulu babi T. gratilla (A. jantan: cokelat kekuningan; B. betina: putih krem) ... 8
6. Peta lokasi penelitian... 10
7. Metode Transek Kuadrat yang digunakan untuk pengambilan sampel bulu babi dan lamun. ... 11
8. Peta distribusi jenis lamun Pantai Semerang ... 14
9. Kerapatan minimum dan maksimum jenis lamun di pantai Semerang (CR=Cymodocea rotundata; CS=Cymodocea serulata; SI=Syringodium isoetifolium; HO= Halophila ovalis; HU=Halodule uninervis; TC= Thalassodendron ciliatum) ... 14
10.Peta distribusi tutupan lamun Pantai Semerang ... 15
11.Kepadatan bulu babi T. gratilla di Pantai Semerang ... 15
12.Peta distribusi bulu babi T. gratilla di pantai Semerang ... 16
13.Hubungan diameter cangkang dengan bobot tubuh bulu babi T. gratilla di Pantai Semerang ... 16
14.Hubungan diameter cangkang dengan bobot tubuh bulu babi T. gratilla jantan di Pantai Semerang ... 17
15.Hubungan diameter cangkang dengan bobot tubuh bulu babi T. gratilla betina di Pantai Semerang ... 17
16.Kurva plot von Bertalanffy dan frekuensi panjang (diameter) ... 18
17.Kurva hasil tangkapan yang dikonversi ke panjang (diameter)... 19
18.Indeks Kematangan Gonad (IKG) bulu babi T. gratilla di pantai Semerang .. 19
19.Prosentase tingkat kematangan gonad T. Gratilla ... 20
20.Bobot rata-rata bulanan gonad bulu babi (T. gratilla) di Pantai Semerang .... 20
21.Kurva rekrutmen bulu babi T. gratilla di Pantai Semerang ... 21
iv
23.Jumlah nelayan dan hasil tangkapan bulu babi setiap periode pemanenan
“madaq” di Pantai Semerang ... 22
24.Ukuran diameter bulu babi T. gratilla yang tertangkap oleh nelayan ... 22
25.Hubungan antara kedalaman dengan kepadatan bulu babi T. gratilla di Pantai Semerang ... 23
26.Dendogram klasifikasi hierarki tipe asosiasi jenis lamun berdasarkan kepadatan T. gratilla di pantai Semerang (B=CR,CS,SI; C=CR,CS,SI,HO; D=CR,HO; E=CR,HO,HU; F=CR,SI; G=CR,SI,HO; H= CR,SI,HO,HU; I= CR,SI,HU; J= CS,HO; K= CS,SI; L= CS,SI,HO; M= HO; N= HO,HU; O= HO,HU,TC; P= SI,HO; Q= SI,HO,HU; R= SI,HU) ... 26
27.Grafik analisis korespondensi (Corespondency analysis) untuk kepadatan T. gratilla/transek dan asosiasi jenis lamun (S1= transek 1; S2= transek 2; S3= transek 3; S4= transek 4; S5= transek 5) ... 27
28.Hubungan antara tutupan lamun dengan kepadatan bulu babi T. gratilla di pantai Semerang ... 27
29.Model konseptual perikanan bulu babi di pantai Semerang ... 28
DAFTAR LAMPIRAN 1. Kondisi Fisika dan Kimia Perairan Pantai Semerang ... 39
2. Hasil Analisis Vegetasi Lamun ... 40
3. Hasil perhitungan kepadatan bulu babi (T. gratilla) di pantai Semerang ... 47
4. Hasil analisis frekuensi panjang bulu babi (T. gratilla) di pantai Semerang .. 50
5. Hasil perhitungan Indeks Kematangan Gonad (IKG) ... 52
6. Hasil Perhitungan Ukuran Pertama Kali Matang Gonad ... 54
7. Hasil tangkapan nelayan ... 55
8. Bulu babi T. gratilla yang ditemukan di pantai Semerang ... 56
9. Jenis lamun Pantai Semerang ... 57
1. PENDAHULUAN
Latar Belakang
Bulu babi merupakan salah satu biota laut yang bernilai ekonomis tinggi. Gonad bulu babi dapat dimanfaatkan sebagai bahan pangan yang bergizi tinggi. Selain itu beberapa bulubabi memiliki duri-duri yang berwarna-warni dengan ukuran yang berbeda-beda sesuai jenis, yang menjadi daya tariknya sehingga dimanfaatkan sebagai hewan hias terutama dalam akuarium. Bulu babi juga dapat dimanfaatkan sebagai bahan pupuk organik karena cangkang dan durinya mengandung kalsium karbonat.
Gonad bulu babi merupakan makanan yang populer dan mempunyai nilai perdagangan yang sangat layak ekspor khususnya bagi masyarakat Jepang, Korea, Amerika Serikat, Kanada, Chili, Meksiko, Perancis, China, dan Rusia dengan Jepang sebagai konsumen gonad bulubabi yang terbesar di dunia (Pearce et al. 2004; Aslan 2005; Dagget et al. 2005; Hammer et al. 2006). Harga gonad bulu babi di pasaran internasional berkisar dari $6 hingga $200 /kgUSA (Robinson et al. 2002; Sphigel et al. 2005), bahkan di pasaran Jepang diperdagangkan dengan harga mencapai $400/kg(Pearce et al. 2002). Harga yang tinggi ditentukan oleh kualitas gonad. Salah satu faktor yang menentukan kualitas gonad bulubabi adalah warnanya. Warna gonad yang berkualitas baik dapat berkisar dari kuning terang hingga oranye merah (Robinson et al. 2002; Shpigel et al. 2005). Selain warna, kualitas gonad juga ditentukan oleh tekstur gonad (padat dan halus), rasanya yang enak (sangat manis), dan massa gonad (Pearce et al. 2002).
Gonad bulu babi telah lama dimanfaatkan oleh masyarakat nelayan di pesisir Pulau Lombok sebagai bahan makanan. Sebuah tradisi yang secara turun temurun diwariskan oleh masyarakat pesisir yang biasa disebut dengan “Madaq”. Madaq merupakan aktivitas rutin masyarakat nelayan mengambil atau memanen biota pada padang lamun yang dilakukan setiap hari disaat air surut. Biota yang diambil sebagian besar merupakan anggota dari famili Echinodermata (bulu babi dan teripang), bivalvia, gastropoda dan beberapa jenis ikan karang yang terjebak disaat air laut surut.
Jenis bulu babi yang dimanfaatkan gonadnya sebagian besar adalah T. Gratilla. Jenis bulu babi ini cenderung hidup mengelompok dan tersebar di kawasan Indonesia bagian timur seperti Bali, Nusa Tenggara, Maluku dan Sulawesi. Habitat utamanya adalah ekosistem lamun (Aziz, 1995).
Aktivitas penangkapan biota padang lamun khususnya terhadap bulu babi (T. Gratilla) cenderung ke arah penangkapan berlebih (over fishing). Hal ini, diperkuat dengan hasil wawancara dengan masyarakat yang mengakui bahwa hasil tangkapan dari tahun ke tahun cenderung mengalami penurunan. Semakin banyaknya masyarakat nelayan yang terlibat dalam penangkapan yang tidak hanya merupakan masyarakat disekitar pesisir diindikasikan sebagai penyebab turunnya hasil tangkapan nelayan. Disamping itu, penggunaan alat-alat yag tidak ramah lingkungan saat pengambilan biota merusak padang lamun yang merupakan habitat bagi biota tersebut.
2
itu, penelitian mengenai dinamika populasi bulu babi dibutuhkan untuk memprediksi kondisi stok bulu babi dalam kurun waktu ke depan.
Perumusan Masalah
Stok bulu babi di alam dipengaruhi oleh faktor lingkungan, kondisi internal biota dan aktivitas perikanan. Faktor lingkungan yang dimaksud adalah faktor fisika, kimia dan biologi. Bulu babi membutuhkan kondisi fisika dan kimia perairan yang tepat untuk dapat tumbuh optimal. Selain itu, faktor biologi yang terkait dengan keberadaan lamun sebagai sumber makanan memegang peranan penting dalam menunjang kehidupan bulu babi T. gratilla.
Potensi perikanan bulu babi telah dikenal luas secara global termasuk di Indonesia. Pemanfaatan gonad bulu babi T. Gratilla sebagai bahan makanan bagi masyarakat pesisir pulau Lombok telah berlangsung lama. Selama periode waktu tersebut eksploitasi terhadap populasi bulu babi terus dilakukan tanpa adanya upaya pengendalian penangkapan untuk menjaga kelestarian biota tersebut.
Penangkapan berlebih (over fishing) merupakan salah satu penyebab menurunnya
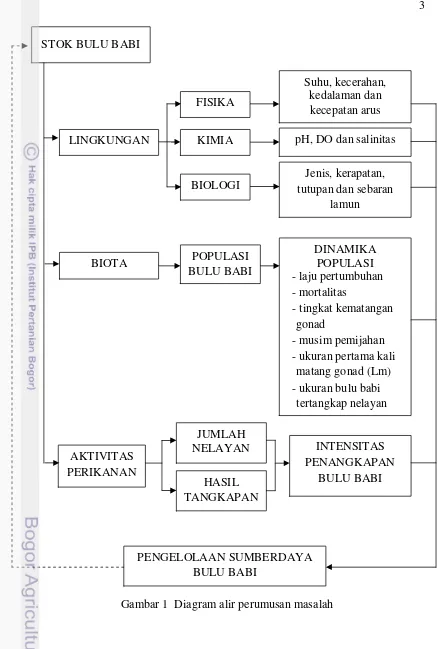
populasi bulu babi di alam. Oleh karena itu, eksploitasi yang berlebih dikhawatirkan akan mengancam kelestarian dan keberlanjutan pemanfaatan sumberdaya bulu babi di pesisir pulau Lombok. Diagram alir perumusan masalah disajikan pada Gambar 1.
Belum adanya data statistik tentang hasil tangkapan bulu babi dan tidak adanya kebijakan terkait dengan pengelolaan sumberdaya tersebut menjadi tantangan dalam menjaga kelestarian sumberdaya. Salah satu unsur penting dalam penentuan pengelolaan sumberdaya adalah dengan mengetahui kondisi stok dan dinamika populasi sumberdaya. Oleh karena itu, pengkajian stok dan dinamika populasi bulu babi diperlukan untuk menyusun langkah-langkah pengelolaan sebagai upaya untuk melestarikan sumberdaya bulu babi T. Gratilla di pesisir seperti laju pertumbuhan, mortalitas, tingkat kematangan gonad dan musim pemijahan.
3. Mengetahui ukuran pertama kali matang gonad (Lm) dan ukuran bulu babi
yang tertangkap oleh nelayan.
4. Menganalisis status dan tingkat pemanfaatan sumberdaya bulu babi T. Gratilla.
Manfaat Penelitian
Adapun manfaat yang diharapkan dari penelitian ini adalah:
1. Memberikan informasi status terkini perikanan bulu babi di pantai Semerang.
2. Menjadi bahan masukan dalam pengelolaan suberdaya bulu babi yang
3
4
2. TINJAUAN PUSTAKA
Klasifikasi bulu babi T. gratilla
Menurut Clark dan Rowe (1971), David dan George (1979), klasifikasi bulu babi jenis T. Gratilla adalah:
Filum : Echinodermata
Kelas : Echinoidea
Subkelas : Regularia Superordo : Echinacea
Ordo : Temnopleuroida
Famili : Toxopneustidae
Genus : Tripneustes
Spesies : Tripneustes gratilla Linnaeus 1758.
Morfologi T. Gratilla
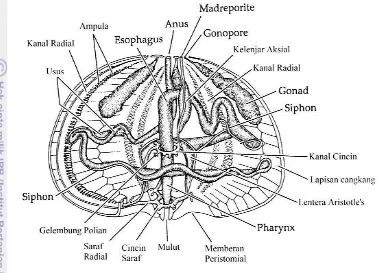
T. gratilla merupakan salah satu jenis bulu babi yang mempunyai struktur cangkang beraturan dan berbentuk membulat. Spesies ini termasuk sub kelas Regularia (Clark dan Rowe 1971). Struktur cangkang ini merupakan struktur yang melindungi organ bagian dalam, dilengkapi dengan spina yang dapat digerak-gerakkan dan tanpa lengan (arms) (Storer dan Usinger 1965; Reseck 1979). Tubuh bulu babi membulat tanpa lengan atau jejari dan pada permukaan tubuh terdapat spina yang dapat digerakkan. Tubuh diselaputi oleh cangkang yang terdiri atas 10 jajar keping-keping ganda yang bertaut bersama-sama.
5
dibandingkan dengan bulu babi yang lainnya. Pada sisi ambilakralnya berwarna putih dan hitam, dan yang lainnya kadang berwarna kemerahan atau kehijauan. Podia yang menjulur keluar biasanya berwarna putih (David dan George 1979).
Gambar 3 Diagram bulu babi Regularia (Brusca dan Brusca 1993)
Tripneustes gratilla memperlihatkan bentuk umum cangkang yang beraturan. Lempengan yang membentuk cangkang tersebut adalah ambulakrum
dan interambulakrum. Daerah antara ambulakrum disebut daderah
interambulakrum, lebar dan tak mempunyai kaki. Pada keping-keping terdapat rangkaian tentakel yang membulat, terdapat spina, yag terdiri atas kristal CaCO3,
mempunyai dasar seperti mangkuk dan di antara spina terdapat pedikelaria yang bercabang tiga.
Bentuk cangkang yang membulat menempatkan posisi mulut pada salah satu ujung badan bagian bawah (sisi oral) dan posisi anus pada ujung yang berlawanan (sisi aboral). Hewan ini bergerak pindah pada posisi mulut. Hewan ini tidak memiliki bagian depan (anterior), dan dapat bergerak pindah ke semua arah tanpa memutar atau membalikan tubuhnya (Reseck 1979). Meskipun dengan pergerkan yang lambat hewan ini dapat dengan mudah memanjat permukaan yang vertikal karena mempunyai kaki tabung (podia) yang ukurannya lebih panjang dari spinanya (Gonser 1971).
Pertumbuhan dan Reproduksi Bulu Babi T. gratilla
6
Darsono (1986), menyatakan bahwa ada enam fase perkembangan bulu babi yaitu: (1) Fertilisasi telur, (2) perkembangan menjadi larva pluteus melewati proses blastula dan gastrula, (3) pertumbuhan dan perkembangan larva pluteus, (4) metamorfosis, dan (5) pertumbuhan bentuk menjadi dewasa dan matang kelamin.
Gambar 4 Gambaran skematik struktur testis dan ovary pada tingkat pematangan yang berbeda. Kolom kanan dan kiri memperlihatkan proses yang biasa, kolom tengah proses yang tidak biasa (Yoshida 1952 diacu dalam Darsono 1986).
7
melintang gonoduct berbentuk bulat, berdiameter 800 μ – 1.000 μ. Bila diperha-tikan, organ gonad terlihat 13 – 15 pasangan percabangan “racemose” pada sisi-sisi gonoduct. Percabangan tersebut disebut “acini”, masing-masing berbentuk Y (Y-shaped). Pada hewan contoh dengan diameter cangkang 20 mm – 25 mm, struktur bentuk acini ini masih berkembang dalam ukuran dan dimensinya. Pada ukuran tersebut terlihat 3 atau 4 percabangan, dengan kenampakan superficial gonad yang semi transparan. Percabangan. (ramification) dari pada “acini” gonad pada individu dengan diameter cangkang kecil dari 25 mm meningkat dalam jumlahnya. Pada tingkat ini warna gonad berbeda dengan sebelumnya, warna menjadi coklat kekuningan (yellowish brown) (Darsono 1986).
Fase netral (0), didapatkan pada individu yang masih kecil/muda. Gonad netral adalah kecil, elongated, relatif tipis, semi transparan kenampakannya. Secara mikroskopis irisan melintangnya terlihat dinding lobus yang sangat tipis. Pada fase ini masih sulit dibedakan jenis kelaminnya.
Fase awal (I), (developing virgin atau recovering spent). Pada fase ini terjadi pertumbuhan sel-sel gamet sehingga jenis kelaminnya sudah bisa dilihat di
bawah mikroskop. Kenampakan preparat pada “developing virgin” dan
“recovering spent” adalah sama, hanya terlihat bahwa folikel pada hal yang belakangan lebih besar dari yang pertama. Pada pengamatan mikroskopis terlihat bahwa pada developing virgin dan recovering spent berbeda dimensinya. Yang pertama nampak lebih kecil dan warnanya masih keputih-putihan (whitish),
sedang pada recovering spent gonad berwarna coklat kemerahan (reddish brown).
Betina: irisan ovary pada tingkat ini mudah dikenal, karena dapat terlihat sejumlah oogonia dan oocytes muda yang menempel sepanjang lapisan germinal dinding folikel. Oogonium berbentuk sebagai gelondong benang. Cytoplasmanya mengelilingi inti (nucleus) sebagai lapisan tipis yang homogen. Oocyte muda berbentuk bola yang tidak beraturan dan mempunyai inti relatif besar yang dikelilingi oleh lapisan tipis yang berupa akumulasi cytoplasma yang basofilik. Ukuran rata-rata diameter dari pada oocyte adalah sekitar 15 μ, tapi kadang-kadang pada individu muda hanya berukuran sekitar 5 μ. Jantan: Kenampakan karakteristik irisan testis pada fase awal ini adanya kandungan sejumlah spermatogonia dan spermatocytes sepanjang dinding folikel. Spermatocyte dengan spermatogonium cukup mudah dibedakan, yang pertama lebih kecil dalam ukuran dan kurang menyerap warna haematoxylin dari pada yang kedua. Pada tingkat ini aktifitas spermatogenesis masih rendah.
Fase tumbuh (II), (Growing). Gonad pada tingkat ini, secara visual tidak terlihat perbedaan antara testis dan ovary. Gonad berwarna sama yaitu coklat
kemerahan (reddish brown). Betina: masih ditemukan oogonia kecil pada
periphery folikel, tapi jumlahnya lebih sedikit dari pada tingkat I. Sejumlah oocyte muda yang berkait satu sama lain mengisi ke arah tengah folikel. Diameternya sekarang mencapai 40 μ – 60 μ. Sejumlah kecil oocytes yang sudah lebih berkembang mengisi bagian tengah folikel. Ovary berkembang sejalan dengan pertumbuhan oocytes. Jantan: spermatogenesis terlihat lebih nyata, produksi spermatocytes dan spermatogonia berkembang cepat sepan-jang periphery folikel. Dengan demikian irisan folikel jantan terlihat lapisan sejumlah gamet. Tidak ditemukan spermatozoa dalam lumen.
8
ini dapat dibedakan antara gonad jantan dan betina dari perbedaan warna. Gonad jantan umumnya cokelat kekuningan (yellowish brown) dan coklatkemerahan (reddish brown), sedang gonad betina umumnya kuning muda (yellow whitish) atau putih krem (creamy white) . Betina: oogenesis terjadi secara aktif, ditandai oleh perkembangan cepat dari ukuran oocyte secara individual. Sejumlah oocyte besar berbentuk oval mengisi lumen dari folikel, berdimensi sekitar 80 – 140 μ x 40 – 80 μ. Sejalan dengan terbebasnya telur (ova) dari dinding folikel, tumbuh men-capai ukuran sekarang 80 μ – 100 μ. Folikel ovary pada tingkat ini
mempunyai sejumlah oocytes dengan ukuran berkisar 10 μ — 70 μ, dan sebagian
telur matang (ova) yang mengisi lumen folikel. Secara umum boleh dikata-kan bahwa folikel telah siap menampung oocytes primer yang akan mencapai ukuran maksimum. Jantan: proses spermatogenesis nampak makin aktif. Spermatocytes dan spermatid terlihat meningkat dalam jumlahnya. Beberapa spermatozoa mengisi bagian lumen folikel secara sentripetal. Pada beberapa folikel jantan yang lain mungkin sekelompok kecil spermatozoa telah mengisi pusat folikel. Kelompok ini diperkirakan terdiri sel – sel yang terbentuk paling awal.
Gambar 5 Gonad bulu babi T. gratilla (A. jantan: cokelat kekuningan; B. betina: putih krem)
Fase matang (IV), (Mature). Gonad jantan dan betina pada fase ini telah mencapai puncak perkembangan, dan memperlihatkan ukuran dan volume maksimum. Betina: seluruh ruang lumen dari pada folikel terisi penuh oleh ova dengan ukuran diameter sekitar 80 μ – 100 μ, kadang-kadang pada dinding folikel juga sudah terlihat oocytes muda baru. Ukuran ova (oocytes yang telah matang) ini tidak jauh berbeda sebagai pada fase III, namun tampak ada perubahan kandungan cytoplasmanya, makin homogen dan lebih menyerap warna
haematoxylin. Jantan: perkembangan spermatogenesis telah mencapai
spermatozoa matang. Sementara itu pada dinding folikel tetap berlangsung proses awal spermatogenesis. Seluruh ruang lumen folikel terisi penuh oleh spermatozoa.
Fase pijah (V), (Spent). Gonad yang telah memijah memberi kenampakan
9
diisi jaringan penunjang, berupa sel – sel nutritif. Kemudian oogonia dan oocystes muda tumbuh kembali dan tanda-tanda kenampakan berulang seperti pada tingkat I. Jantan: perubahan histologis yang jelas adalah berkurangnya spermatozoa sehingga lumen nampak kosong, kadang-kadang terlihat sisa-sisa sperma pada lumen. Keadaan yang terjadi berikutnya adalah identik dengan pada folikel betina.
Habitat dan Penyebaran Bulu Babi T. gratilla
Padang lamun merupakan salah satu habitat yang penting di perairan danagkal. Selain berperan sebagai produsen, penangkap sedimen, pendaur zat hara, padang lamun juga berperan sebagai habitat biota laut lainnya (Philips and Menez 1998). Bulu babi sebagai salah satu penghuni padang lamun, kerap kali ditemukan di daerah padang lamun campuran. T. Gratilla adalah salah satu jenis bulu babin yang hidup di padang lamun campuran. Kondisi ini terutama disebabkan karena hewan ini bergantung kepada berbagai jenis tumbuhan lamun seperti halnya genus Thalassia, Syringodium, Thalasodendron dan Cimodocea.
Selain itu hewan ini juga menyukai substrat yang agak keras, dengan substrat padang lamun campuran terutama yang terdiri atas pasir dan pecahan karang (Aziz 1994). Lawrence (1975) menjelaskan bahwa kelompok bulu babi herbivora
terutama dari genus Tripneustes, Diadema, Temnopleurus, Echinometrix,
Toxopneustes dan Mespilia, disamping dijumpai pada daerah lamun campuran juga ditemukan di daerah pertumbuhan alga. Hal ini disebabkan karena disamping memakan daun lamun mereka juga memakan alga. Aziz (1995) menyatakan bahwa bulu babi genus Tripneustes, Lytechinus dan Temnopleurus lebih sering dijumpai di padang lamun dibandingkan dengan di daerah pertumbuhan alha.
Di padang lamun bulu babi dapat tumbuh soliter atau mengelompok, tergantung pada jenis dan habitatnya. Bulu babi jenis Diadema setosum, D. Antillarum, T. Gratilla, T. Ventricosus, Lytechinus variegatus, Temnopleurus toreumaticus dan Strogylocentrotus sp., cenderung hidup mengelompok, sedangkan jenis Mespilia globulus, Toxoneustes pileolus, Pseudoboletia maculata
dan Echinometric diadema cenderung hidup soliter (Aziz 1994). Bulu babi jenis
T. Gratilla dan Temnopleurus toreumaticus seringkali terlihat hidup mengelompok pada suatu habitat lamun dengan tingkat kepadatan tertentu (De Beer 1990).
3. METODE
Lokasi dan Waktu Penelitian
10
Gambar 6 Peta lokasi penelitian
Pengumpulan Data
Pengumpulan Data Parameter Lingkungan
Pengumpulan data parameter lingkungan dilakukan langsung di lapangan (insitu). Parameter lingkungan yang diukur meliputi parameter fisika (suhu, kecerahan, kedalaman dan kecepatan arus), kimia (pH, DO dan salinitas) serta biologi (jenis, kerapatan, tutupan dan sebaran lamun).
Pengambilan Sampel Bulu Babi dan lamun
Sampel bulu babi diproleh dari hasil pengambilan sampel menggunakan metode transek kuadrat pada saat air surut dan dengan bantuan alat snorkling pada saat air mulai pasang. Lima transek dipasang tegak lurus garis pantai menuju tubir dan kuadrat yang digunakan berukuran 2,5 x 10 m. Selain itu, sampel dari hasil tangkapan nelayan juga daiambil pada setiap periode penangkapan bulu babi. Variabel biologi bulu babi yang diukur antara lain: jumlah (individu), diameter cangkang (mm), bobot tubuh (gram), jenis kelamin, bobot gonad (gram) dan tingkat kematangan gonad (TKG) bulu babi.
Selain parameter biologi, dilakukan juga pengamatan parameter ekologi yang meliputi kerapatan dan sebaran jenis bulu babi. Untuk mengetahui variabel lingkungan yang mempengaruhi keberadaan bulu babi dilakukan analisis vegetasi lamun dengan menggunakan kuadrat berukuran 0,5 x 0,5 m yang diletakkan secara acak di dalam kuadrat bulu babi (Gambar 7). Variabel yang diamati meliputi jenis, kerapatan, tutupan dan sebaran lamun di lokasi penelitian.
Penentuan jenis lamun dilakukan secara langsung dengan menggunakan identifikasi lamun menurut Seagrass Watch Northern Fisheries Center Australia,
Lanyon (1986); Mc Kenzie (2003); Mc Kenzie et al. (2003). Data yang diperoleh
digunakan untuk menentukan kerapatan, tutupan dan distribusi jenis lamun
menggunakan software ArcView GIS 3.3.
11
Gambar 7 Metode Transek Kuadrat yang digunakan untuk pengambilan sampel bulu babi dan lamun.
Analisis Data
Hubungan Diameter Cangkang dengan Bobot Tubuh Bulu Babi
Hubungan diameter cangkang dengan bobot tubuh bulu babi menggunakan uji regresi dengan rumus sebagai berikut (Effendi 2002):
=
Keterangan:
W = bobot tubuh bulu babi (gram)
D = diameter cangkang bulu babi (mm)
a dan b = konstanta
Hubungan parameter diameter cangkang dengan bobot tubuh bulu babi dapat dilihat dari nilai b yang dihasilkan. Nilai b sebagai penduga kedekatan hubungan antara kedua parameter, yaitu:
Nilai b=3, menunjukan pola pertumbuhan isometrik (pola pertumbuhan panjang sama dengan pola pertumbuhan berat)
Nilai b≠3, menunjukan pola pertumbuhan allometrik.
Parameter pertumbuhan dan umur (K, D∞, to)
Penghitungan pertumbuhan bulu babi dilakukan dengan pendekatan metode Plot-Walford untuk menduga parameter pertumbuhan D∞ dan K dari persamaan von Bartalanffy sebagai berikut (King 1995):
= ∞( 1− [ ( ) ])
Keterangan:
Dt = diameter cangkang pada umur t (satuan waktu)
D∞= diameter maksimum secara teoritis (diameter asimtotik)
K = koefisien pertumbuhan (per satuan waktu)
12
pendugaan umur dilakukan dengan pendekatan berdasarkan pengalaman Pauly (1983) dalam mnganalisis data frekuensi panjang, yang kemudian dikenal dengan rumus empiris Pauly:
( – ) = 0.3952−0.2752 ( ∞) −1.038 ( K)
Parameter pertumbuhan dan umur tersebut (K, D∞, to) dapat diduga dengan menggunakan metode ELEVAN 1 yang terakomodasi dalam software FISAT II (FAO 2002).
Mortalitas
Estimasi laju mortalitas total (Z), menggunakan metode kurva hasil tangkapan yang dikonversi ke panjang/diameter (Spare dan Venema, 1999) dan menggunakan rumus Beverton dan Holt (1957):
= ( − )
( − )
Metode lain jika ′ diketahui dapat digunakan rumus berikut:
= ( − )
( − ′)
Keterangan:
K = Indeks kurva pertumbuhan von Bertalanffy
D∞ = diameter infiniti
= diameter rata-rata bulu babi ukuran D’ Dc = diameter pertama tertangkap
D’ = diameter terkecil dalam sampel dengan jumlah sudah dapat
diperhitungkan/ representatif
Mortalitas alami dapat diduga dengan menggunakan rumus empiris Pauly (1983,1984). Pauly menjelaskan bahwa ada pengaruh suhu tahunan terhadap laju mortalitas, berdasarkan pengamatan empirisnya. Rumus empiris Pauly adalah sebagai berikut:
= −0.0066−0.279 log ∞+ 0.6543 log + 0.4638 log
Ukuran Pertama Kali Matang Gonad
Analisis perhitungan ukuran pertama kali matang gonad (Dm) dihitung
13
Intensitas Tangkapan
Analisis intensitas tangkapan per upaya (CPUE) sebagai indeks kelimpahan stok dilakukan dengan pendekatan:
=
∗
Keterangan:
C = intensitas tangkapan (ekor/orang/jam) N = jumlah hasil tangkapan bulu babi (ekor) B = jumlah nelayan (orang)
T = lama waktu penangkapan (jam)
Status Dan Tingkat Pemanfaatan Bulu Babi
Variabel pengukuran dan pengumpulan data sama dengan aspek dinamika populasi yang telah dijabarkan sebelumnya. Penghitungan tingkat pemanfaatan diperoleh dari nilai-nilai dugaan mortalitas alami (M) dan mortalitas penangkapan (F). Pendekatan rumus dari nilai-nilai tersebut digunakan persamaan berikut:
= +
Dijelaskan lebih lanjut apakah suatu stok sudah mengalami kelebihan tangkap atau belum, dengan asumsi bahwa nilai E optimal (Eopt) adalah 0,5. Penggunaan
E~0,5 sebagai nilai optimal untuk rasio pengusahaan suatu stok didasarkan pada asumsi bahwa hasil berimbang adalah optimal bila F=M (Gulland 1983).
4. HASIL DAN PEMBAHASAN
Hasil
Kondisi Fisika dan Kimia Perairan Pantai Semerang
14
Kondisi Vegetasi Lamun di Pantai Semerang
Komposisi jenis lamun
Berdasarkan hasil pengamatan, ditemukan 6 jenis lamun di pantai
Semerang yaitu Cymodocea rotundata, Cymodocea serullata, Syringodium
isoetifolium, Halophila ovalis, Halodule uninervis, dan Thalassodendron ciliatum. Tipe vegetasi lamun di lokasi penelitian adalah vegetasi campuran yang memiliki komposisi 2 – 4 jenis lamun (Gambar 8).
Gambar 8 Peta distribusi jenis lamun Pantai Semerang
Kerapatan lamun
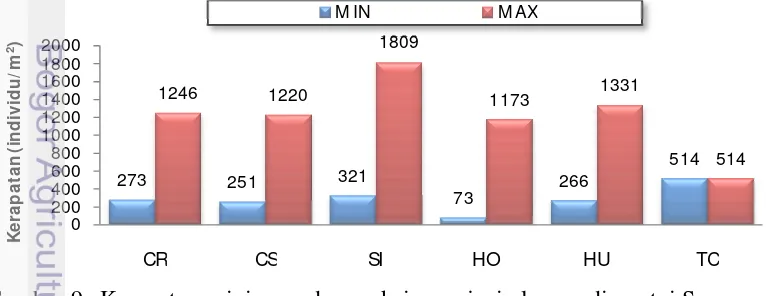
Kerapatan lamun yang menyusun vegetasi di Pantai Semerang ditemukan tidak merata (Gambar 9). Secara keseluruhan jenis lamun yang paling luas sebarannya adalah jenis C. rotundata, S. isoetifolium dan H. ovalis dengan kerapatan jenis berturut-turut antara 273 – 1246 individu/m2, 321 – 1809 individu/m2 dan 73 – 1173 individu/m2. Jenis lamun H. uninervis dan T. ciliatum
merupakan jenis yang sebarannya terbatas dengan kerapatan masing-masing sebesar 0 – 1131 individu/m2 dan 0 – 514 individu/m2.
Gambar 9 Kerapatan minimum dan maksimum jenis lamun di pantai Semerang (CR=Cymodocea rotundata; CS=Cymodocea serulata; SI=Syringodium isoetifolium; HO= Halophila ovalis; HU=Halodule uninervis; TC= Thalassodendron ciliatum)
15
Tutupan lamun
Distribusi tutupan lamun di Pantai Semerang disajikan pada Gambar 10. Pada gambar tersebut terlihat bahwa distribusi tutupan lamun tidak merata dan cenderung membentuk fragmentasi sebaran lamun. Fragmentasi ini kemungkinan disebabkan oleh sebaran substrat dan variasi kedalaman pada lokasi tersebut. Tutupan lamun pada lokasi penelitian berkisar antara 0 – 90%.
Gambar 10 Peta distribusi tutupan lamun Pantai Semerang
Distribusi dan Kepadatan Bulu Babi (T. gratilla) di Pantai Semerang
Jumlah individu bulu babi yang ditemukan berkisar antara 1–6 individu/kuadran (25m2). Secara keseluruhan kepadatan T. gratilla berkisar antara 1,07 – 6,32 individu/100m2 (Gambar 11).
Gambar 11 Kepadatan bulu babi T. gratilla di Pantai Semerang
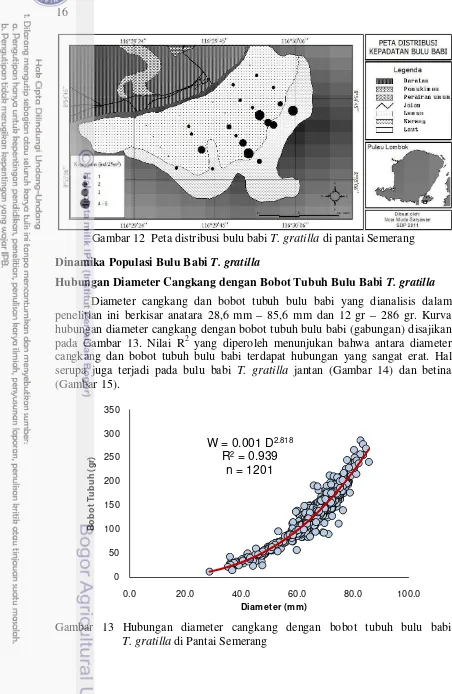
Distribusi bulu babi T. gratilla pada padang lamun pantai Semerang tidak merata (Gambar 12). Distribusi bulu babi tidak tergantung pada kerapatan lamun. Bulu babi T. gratilla baru bisa dijumpai pada jarak sekitar 200 m dari garis pantai. Sebaran bulu babi seperti ini diduga terkait dengan komposisi jenis lamun yang menjadi makanannya. Bulu babi banyak dijumpai pada jarak 200 – 500m yang merupakan daerah dengan tutupan lamun yang relatif rendah dengan komposisi jenis lamun S. isoetifolium, H. uninervis dan C. rotundata.
16
Gambar 12 Peta distribusi bulu babi T. gratilla di pantai Semerang
Dinamika Populasi Bulu Babi T. gratilla
Hubungan Diameter Cangkang dengan Bobot Tubuh Bulu Babi T. gratilla
17
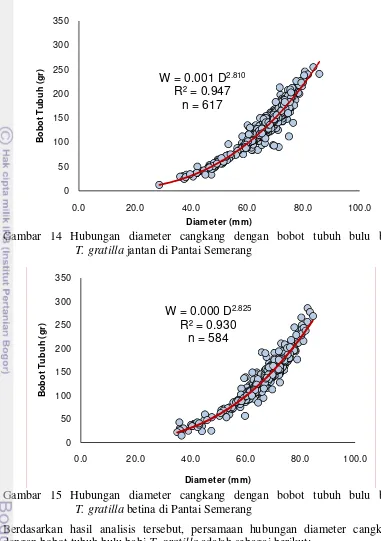
Gambar 14 Hubungan diameter cangkang dengan bobot tubuh bulu babi T. gratilla jantan di Pantai Semerang
Gambar 15 Hubungan diameter cangkang dengan bobot tubuh bulu babi T. gratilla betina di Pantai Semerang
Berdasarkan hasil analisis tersebut, persamaan hubungan diameter cangkang dengan bobot tubuh bulu babi T. gratilla adalah sebagai berikut:
Gabungan : = 0,001 ,
Jantan : = 0,001 ,
Betina : = 0,0001 ,
Parameter pertumbuhan dan umur (D∞, K, to)
Selama 4 bulan pengambilan sampel terlihat pergeseran modus data diameter bulu babi dari bulan Maret yang modusnya terletak pada 65,5 mm bergeser menjadi 70,5 mm pada bulan April. Bulan Mei modus data masih di 70,5 mm akan tetapi individu dengan diameter 75,5 semakin bertambah sehingga pada
18
bulan Juni modus data bergeser ke diameter 75,5 mm. Dengan demikian, tejadi pergeseran modus data diameter panjang dari 65,5 – 75,5 selama waktu
pengamatan. Pergeseran modus diameter ini memperlihatkan adanya
kecenderungan petumbuhan bulu babi rata-rata sebesar 0,25 mm setiap bulannya.
Gambar 16 Kurva plot von Bertalanffy dan frekuensi panjang (diameter)
Pertumbuhan populasi bulu babi T. gratilla di perairan Pantai Semerang diasumsikan mengikuti pola pertumbuhan von Bertalanffy (Gambar 16). Pengkajian parameter pertumbuhan populasi di analisis berdasarkan data frekuensi panjang (diameter) bulu babi yang dikumpulkan mulai bulan Maret –
Juni 2013. Analisis menggunakan alat bantu Electronic Length Frequencys
Analysis I (ELEFAN I) yang terintegrasi dalam paket program FAO-ICLARM
Stock Assessment Tool (FISAT II). Berdasarkan analisis terhadap data frekuensi panjang (diameter) bulu babi menggunakan metode ELEFAN I diperoleh hasil sebagaimana disajikan pada Tabel 2.
Tabel 2 Parameter pertumbuhan dan umur bulu babi T. gratilla
D∞(mm) K (tahun) to (tahun)
Gabungan 92,4 0,780 -0,084
Jantan 92,4 0,760 -0,090
Betina 92,4 0,780 -0,084
Berdasarkan data tersebut persamaan pertumbuhan von Bertalanffy untuk bulu babi T. gratilla adalah sebagai berikut:
Gabungan : = 92,4 ( 1− , [ , ])
Jantan : = 92,4 ( 1− , [ , ])
Betina : = 92,4 ( 1− , [ , ])
Mortalitas dan laju eksploitasi bulu babi (E)
Nilai laju mortalitas total diestimasi menggunakan metode kurva hasil
tangkapan yang dikonversi ke panjang (length-converted catch curve)
19
Pauly. Berdasarkan data tersebut diperoleh nilai estimasi mortalitas alami (M) sebesar 1,13/tahun. Nilai F (laju kematian karena penangkapan) dapat diperoleh melalui rumus F = Z – M, sehingga nilai F adalah 2,65/tahun.
Gambar 17 Kurva hasil tangkapan yang dikonversi ke panjang (diameter)
Aspek Reproduksi Bulu Babi (T. gratilla) di Pantai Semerang
Indeks Kematangan Gonad (IKG)
Hasil analisis Indeks Kematangan Gonad (IKG) bulu babi T. gratilla
20
Tingkat Kematangan Gonad (TKG)
Dari hasil pengamatan tingkat kematangan gonad (TKG) diketahui bahwa secara keseluruhan prosentase tertinggi ditempati oleh TKG 2 (tumbuh) kemudian diikuti oleh TKG III (matang awal), TKG IV (matang), TKG 0 (netral) dan TKG V( memijah). Prosentase tingkat kematangan gonad T. gratilla disajikan pada Gambar 19.
Gambar 19 Prosentase tingkat kematangan gonad T. Gratilla
21
Rekrutmen
Pola rekrutmen bulu babi T. gratilla di perairan Pantai Semerang berdasarkan data frekuensi panjang diperoleh melalui program ELEFAN I. Kurva rekrutmen bulu babi T. gratilla disajikan pada Gambar 21. Kurva tersebut menunjukan adanya rekrutmen setiap bulannya dengan proporsi yang berbeda – beda. Puncak rekrutmen terjadi pada bulan Juni dan Agustus dengan prosentase masing-masing sebesar 17,11% dan 17,67%.
Gambar 21 Kurva rekrutmen bulu babi T. gratilla di Pantai Semerang
Ukuran dan Umur Pertama Kali Matang Gonad
Ukuran dan umur bulu babi pertama kali matang gonad disajikan pada Gambar 22. Gambar tersebut menunjukan bahwa ukuran pertama kali matang gonad terjadi pada umur 1,2 tahun dengan diameter 58,2 mm.
Gambar 22 Ukuran dan umur pertama kali matang gonad T. Gratilla
Intensitas tangkapan per upaya (CPUE)
22
panen/waktu surut terendah 5 – 16 orang nelayan dapat ditemukan memanen bulu babi dengan hasil tangkapan berkisar antara 569 – 1598 ekor bulu babi (Gambar 23). Jumlah nelayan pada periode madaq saat terang bulan (I) lebih tinggi dibandingkan jumlah nelayan pada saat madaq bulan mati (II). Hal ini dikarenakan oleh adanya penambahan jumlah nelayan (3 – 7 orang) yang berasal dari luar kampung nelayan Pantai Semerang. Dari hasil perhitungan dengan rata-rata 2 jam waktu pemanenan diperoleh intensitas tangkapan per upaya sebesar 52 ekor/orang/jam.
Gambar 23 Jumlah nelayan dan hasil tangkapan bulu babi setiap periode pemanenan “madaq” di Pantai Semerang
Ukuran Bulu Babi yang Tertangkap Nelayan
Ukuran diameter bulu babi hasil tangkapan nelayan berkisar antara 48,5 –
89,1 mm dengan rata-rata 67,3 mm (Gambar 24).
Gambar 24 Ukuran diameter bulu babi T. gratilla yang tertangkap oleh nelayan
Pembahasan
Keberadaan bulu babi pada suatu perairan sangat dipengaruhi oleh berbagai faktor lingkungan (biotik dan abiotik). Faktor biotik yang berpengaruh diantaranya adalah lamun yang merupakan sumber makanan bagi bulu babi. Adapun faktor abiotik adalah kondisi fisika dan kimia perairan yang meliputi suhu, kecerahan, kedalaman, kecepatan arus, pH, DO dan salinitas.
Suhu adalah satu dari beberapa faktor penting yang mempengaruhi pertumbuhan bulu babi (Mos et al. 2012). Suhu perairan dapat mempengaruhi proses metabolisme dan siklus reproduksi serta perkembangan singkat periode planktonik bulu babi yang mengakibatkan penurunan tekanan predasi dan juga
23
mengubah hubungan antar populasi (O'Connor et al. 2007; Byrne et al. 2010). Suhu adalah faktor lingkungan utama yang mengendalikan fisiologi, fenologi, durasi larva planktonik dan biogeografi invertebrata laut (O'Connor et al. 2007; Bryne et al. 2010). Suhu perairan pantai Semerang berkisar antara 27°C – 30,5°C. Kisaran ini masih berada dalam suhu optimal untuk kehidupan bulu babi (Husain 1983). Inne (1964) dalam Kasim (1999) menjelaskan bahwa kematian masal bulu babi sering kali dialami di daerah tropis dan sub tropis. Moore (1962) dalam Husain (1983) menyatakan bahwa kematian bulu babi yang tertinggi terlihat pada suhu 33°C – 38°C.
Kedalaman merupakan salah satu faktor yang mempengaruhi distribusi bulu babi. Kedalaman terkait dengan penetrasi sinar matahari yang memasuki kolom perairan. Bulu babi merupakan biota yang sangat sensitif terhadap sinar matahari sehingga seringkali ditemukan pada padang lamun yang tidak terekspose sinar matahari, bersembunyi di sela karang dan membungkus diri dengan daun lamun dan patahan karang. Kepadatan bulu babi T. gratilla di pantai Semerang memiliki korelasi positif dengan kedalaman (Gambar 25).
Gambar 25 Hubungan antara kedalaman dengan kepadatan bulu babi T. gratilla
di Pantai Semerang
Salinitas Perairan Indonesia umumnya berkisar antara 32‰–37‰ (Romimohtarto & Thayib 1982). Salinitas pada lokasi penelitian berkisar antara 28‰ – 30‰. Kondisi salinitas yang demikian adalah kondisi yang baik bagi bulu babi jenis T. gratilla dapat hidup dan bereproduksi. Darsono (1983) menyatakan bahwa kelompok bulu babi umumnya hidup pada kisaran salinitas 26‰ – 32‰. Aziz (1987) menyatakan bahwa kelompok bulu babi yang dikenal sebagai penghuni laut sejati seperti T. gratilla dapat hidup pada kisaran salinitas 29‰ – 34‰. Bulu babi T. gratilla yang ditemukan di Nusa Dua Bali hidup pada kisaran salinitas 28‰ – 32‰.
24
bahwa kelompok filum Echinodermata dapat hidup pada kisaran pH 7,0 – 7,5. Hal ini menunjukan bahwa kondisi pH perairan pada lokasi penelitian masih dalam kisaran toleransi untuk kehidupan bulu babi T. gratilla.
Kecerahan perairan di lokasi penelitian mencapai 100%. Kondisi ini memungkinkan bagi sinar matahari untuk dapat menembus sampai ke dasar perairan. Bulu babi jenis T. gratilla cenderung memiliki sensitifitas yang sangat tinggi terhadap sinar matahari. Pada siang hari jenis ini cenderung membungkus tubuh mereka dengan daun lamun dan patahan karang bahkan cenderung bersembunyi di balik bongkahan karang untuk menghindari cahaya matahari.
Kecepatan arus berkisar antara 0,013 m/s - 0,033 m/s. Kecepatan arus umumnya meningkat pada saat adanya pola arus pasang naik dan pasang surut (Kasim 1999). Saat pasang dan surut kecepatan arus dapat mencapai 0.033 m/s. Pola pasang surut di lokasi penelitian terjadi sebanyak dua kali pasang tinggi dan dua kali pasang rendah (surut). Kedalaman air pada saat pasang terendah berkisar antara 0 – 90 cm. Waktu surut pada saat pengambilan sampel bulu babi antara pukul 15.00 – 19.00 WITA dan 05.00 – 09.00 WITA.
Kandungan oksigen terlarut (DO) berkisar antara 7,2 – 7,9 ppm. Husain (1983) menyatakan bahwa bulu babi dapat hidup berkembang dengan baik umumnya pada kisaran kandungan oksigen 7,0 – 8,5 ppm. Oksigen terlarut sangat vital untuk siklus kehidupan dalam air. Oksigen sangat esensial untuk menjaga organisme tetap hidup, proses reproduksi, dan untuk perkembangan populasi. Konsentrasi oksigen terlarut yang dapat ditolerir biota perairan untuk berbagai kebutuhan hidup berbeda-beda namun tetap berada dalam standar baku mutu lingkungan. Air yang mengandung konsentrasi oksigen rendah akan mempengaruhi kesehatan organisme karena organism akan mudah terserang parasit dan penyakit, dan konsentrasi oksigen terlarut di bawah baku mutu menyebabkan nafsu makan seperti ikan tanpa terkecuali T. gratilla menurun dan tidak berkembang dengan baik (Toha 2012).
Lamun memiliki peranan penting dalam perairan dangkal. Selain sebagai produsen primer, lamun juga memegang peran penting dalam daur ulang zat hara, tempat berpijah dan mencari makan biota padang lamun, stabilisator dan penangkap sedimen serta penahan abrasi. Biota padang lamun dapat memakan tumbuhan lamun secara langsung (direct grazing) maupun melalui jalur detritus. Mc Roy dan Helfferich (1980) melaporkan bahwa salah satu avertebrata yang memakan daun lamun secara langsung adalah bulu babi sehingga keberadaannya sangat tergantung kepada keberadaan lamun (seagraass).
Jumlah jenis lamun di dunia adalah 58 jenis yang dikelompokkan ke dalam 12 famili, empat kelas dan dua ordo (Kuo & Mc Comb 1989). Di perairan Indonesia tercatat sebanyak 12 jenis lamun (Den Hartog 1970), tetapi bila termasuk dengan Halophila beccarii dan Ruppia maritima, maka jumlah jenis lamun di perairan Indonesia adalah 14 jenis (Kiswara 2011). Padang lamun dapat berbentuk vegetasi tunggal dari satu jenis atau dapat terdiri atas dua jenis atau lebih yang tumbuh bersama-sama sehingga membentuk vegetasi campuran (Kirkman 1985).
25
Kuta dan 11 jenis di Teluk Gerupuk. Syukur (2012) melaporkan bahwa di sekitar Tanjung Luar dapat ditemukan 9 jenis lamun yang tersebar pada daerah intertidal di pulau-pulau kecil (gili).
Komposisi jenis lamun dari tiap areal pada semua lokasi padang lamun menunjukkan pola distribusi jenis yang hampir sama (Gambar 10). Pada areal yang dekat dengan garis pantai ditemukan asosiasi lamun dari jenis C. rotundata,
S. isoetifolium dan H. ovalis Selanjutanya semakin ketengah banyak ditemukan asosiasi S. isoetifolium, H. ovalis dan H. uninervis. Pada bagian timur dekat dengan bibir teluk cukup banyak ditemukan vegetasi dengan kombinasi dengan jenis C. serrulata. Di dekat tubir bagian timur dengan substrat karang dan patahan karang ditemukan vegetasi T. ciliatum. Lamun jenis T. ciliatum mampu hidup pada daerah terumbu karang dengan substrat dari pasir kasar dan puing karang mati (Kiswara dan Winardi 1994).
Posisi Pantai Semerang yang berhadapan langsung dengan laut lepas memiliki arus dan gelombang yang relatif besar sehingga menimbulkan fluktuasi dan pergerakan substrat yang dinamis. Kondisi tersebut diduga menjadi penyebab tidak meratanya sebaran lamun. Kerapatan jenis lamun di Pantai Semerang hampir sama dengan kerapatan jenis lamun di sekitaran Tanjung Luar yaitu berkisar antara 29 – 1976 individu/m2 (Syukur 2012), namun lebih rendah bila dibandingkan dengan kerapatan jenis lamun di Teluk Kuta yang berkisar antara 10 – 7120 individu/m2 (Kiswara dan Winardi1994).
Kepadatan bulu babi T. gratilla di pantai Semerang berkisar antara 1,07 – 6,32 individu/100m2. Kepadatan T. gratilla dilokasi penelitian relatif lebih rendah bila dibandingkan dengan kepadatan T. gratilla dilokasi lainnya (Tabel 3). Kepadatan bulu babi tertinggi ditemukan pada trensek 2, 3 dan 4 dekat tubir. Hal ini kemungkinan dipengaruhi oleh kedalaman dan kombinasi jenis lamun. Pada lokasi ini ditemukan jenis lamun S. isoetifolium, H. uninervis dan C. rotundata
yang tidak terekspos pada saat surut terendah. Bulu babi T. gratilla diketauhi sangat sensitif terhadap sinar matahari sehingga seringkali ditemukan pada daerah padang lamun yang tidak terbuka saat air surut dan cenderung membungkus diri dengan daun lamun dan potongan karang (Aziz, 1994).
Tabel 3 Hasil studi kepadatan bulu babi T. gratilla
Lokasi Kepadatan Peneliti
Sanur, Bali 1 – 60 ind/50m2 Darsono dan Sukarno (1993)
Laguna Mombasa, Kenya
10,4 ind/m2 Alcoverro & Mariani (2002)
Sosoikula dan Nukubuco, Fiji
0,006 – 0,02 ind/m2 Coppard & Campbell (2005)
Barat daya Filipina 9,40 – 67,20 ind/100m2 Juinio-Menez et al. (2008)
Bone Batang,Sulawesi 1,55 ind/m2 Vonk et al. (2008)
Pulau Hatta, Sulawesi 4,22 – 5,89 ind/25m2 Dobo (2009)
Dar es Salaam, Tanzania
0,18 – 0,54 ind/m2 Lymo et al. (2011)
Balaoan, Filipina 0,02 – 0,23 ind/m2 Prado et al. (2012)
26
Semerang. Berdasarkan analisis kelompok (cluster analysis) menunjukan adanya
3 kelompok tipe asosiasi jenis lamun yang memiliki kemiripan pada kepadatan T.
gratilla yang ditemukan (Gambar 26). Kelompok pertama terdiri atas satu tipe asosiasi jenis lamun yang tersusun atas C. rotundata dan S. isoetiflium, kelompok kedua terdiri atas 7 tipe asosiasi jenis lamun yang tersusun oleh semua jenis lamun yang ditemukan sedangkan kelompok ketiga terdiri atas 9 tipe asosiasi jenis lamun tanpa T. ciliatum dalam komposisi asosiasinya.
Gambar 26 Dendogram klasifikasi hierarki tipe asosiasi jenis lamun berdasarkan
kepadatan T. gratilla di pantai Semerang (B=CR,CS,SI;
C=CR,CS,SI,HO; D=CR,HO; E=CR,HO,HU; F=CR,SI;
G=CR,SI,HO; H= CR,SI,HO,HU; I= CR,SI,HU; J= CS,HO; K= CS,SI; L= CS,SI,HO; M= HO; N= HO,HU; O= HO,HU,TC; P= SI,HO; Q= SI,HO,HU; R= SI,HU)
Sebaran asosiasi jenis lamun yang diduga memiliki hubungan dengan kepadatan T. gratilla di pantai semerang selanjutnya diverifikasi dengan analisis korespondensi (Corespondency analysis). Matrik korelasi antara kepadaatan bulu babi pada masing-masing transek sebagai variabel aktif dan asosiasi jenis lamun sebagai variabel suplemen. Hasil analisis menunjukan 3 kelompok yang berkorelasi antara kepadatan T. gratilla dengan beberapa tipe asosiasi jenis lamun dengan pengaruh 75,44% (Gambar 27).
Kelompok pertama pada kuadran 1 menunjukan adannya hubungan atara kepadatan T. gratilla pada transek 3 dan 4 dengan asosiasi jenis lamun tipe P,C,M,D,L,J,K dan E. Kelompok kedua pada kuadran 2 terlihat hubungan atara kepadatan T. gratilla pada transek 5 dengan asosiasi jenis lamun tipe F (C. rotundata dan S. isoetifolium) sedangkan kelompok ketiga pada kuadran 3 terlihat hubungan antara kepadatan T. gratilla pada transek 1 dan 2 dengan asosiasi jenis lamun tipe R,G,I,N,H,Q,O dan B. Bulu babi T. gratilla dapat ditemukan pada semua tipe asosiasi jenis lamun. Hal ini menunjukan bahwa kepadatan T. gratilla
tidak berhubungan dengan jenis lamun tertentu di pantai Semerang.
27
Gambar 27 Grafik analisis korespondensi (Corespondency analysis) untuk
kepadatan T. gratilla/transek dan asosiasi jenis lamun (S1= transek 1; S2= transek 2; S3= transek 3; S4= transek 4; S5= transek 5)
Tutupan lamun di pantai Semerang tergolong baik dengan kisaran antara 10% – 90% dengan rata – rata 60%. Distribusi bulu babi T. gratilla di pantai semerang terkait dengan tutupan lamun. Analisis menunjukkan bahwa kepadatan
T. gratilla berkorelasi negatif dengan tutupan lamun (Gambar 28). Hal ini diduga terkait dengan kombinasi jenis lamun. Tutupan lamun yang tinggi biasanya merupakan kombinasi jenis lamun yang memiliki daun panjang dan lebar (genus
Cymodocea). Tutupan juga terkait dengan kerapatan lamun yang diduga mengganggu pergerakan bulu babi. Padang lamun yang memiliki tutupan yang tidak terlalu tinggi biasanya merupakan kombinasi dari jenis lamun yang berdaun kecil dan lunak seperti S. isoetifolium, H. uninervis, dan H. ovalis yang diketahui merupakan makanan favorit bulu babi T. gratilla.
Gambar 28 Hubungan antara tutupan lamun dengan kepadatan bulu babi
Kepadat an T. grat illa/ t ransek Asosiasi jenis lam un
28
Sebaran bulu babi T. gratilla di lokasi penelitian diduga terkait dengan sebaran jenis lamun yang menjadi makanannya. Eksperimen laboratorium dan alam yang dilakukan oleh Haerul et al. (2012) di perairan pulau Barrang Lompo Makassar melaporkan bahwa T. gratilla lebih memilih lamun jenis H. uninervis
dan S. isoetifolium dibandingkan jenis lamun lainnya sebagai makanannya. H. uninervis adalah lamun dengan kandungan tannin paling rendah bila dibandingkan dengan jenis lamun lainnya (Pradheeba et al. 2010). Tannin merupakan zat kayu pada tumbuhan yang dapat menonaktifkan enzim pencernaan pada herbivora, sehingga tumbuhan menjadi sulit dicerna (Kokten et al. 2011). Begitu juga
dengan lamun jenis S. isoetifolium daunnya melunak dan mudah hancur dalam 24
jam setelah lepas dari rhizomanya. Selain itu lamun jenis S. isoetifolium memiliki laju dekomposisi yang lebih tinggi, bila dibandingkan dengan jenis lamun yang lainnya.
Tripneustes gratilla adalah jenis bulu babi yang berperan penting sebagai "grazer" pada padang lamun di kawasan Indo Pasifik Barat (Lawrence,1975). Jenis ini lebih sering dijumpai di padang lamun dibandingkan dengan di daerah pertumbuhan algae dan mempunyai daya grazing antara 1,01 gram sampai dengan 1,33 gram berat kering/individu/hari (Aziz, 1994). Lawrence (1975) menambahkan bahwa pola preferensi pada bulu babi tidaklah begitu jelas, namun ada kecenderungan kesukaan terhadap lamun dari genus Thalassia dan genus
Syringodium.
Struktur ukuran merupakan salah satu informasi penting dalam pengkajian suatu populasi. Pengukuran panjang organisme dalam seri waktu tertentu dapat dijadikan landasan untuk mengkaji pola pertumbuhan, mortalitas dan pola penambahan individu baru (rekrutmen) dari organisme tersebut. Pada penelitian ini panjang yang dimaksud adalah diameter bulu babi.
Ukuran bulu babi yang ditemukan di pantai Semerang berkisar anatara 26,1 – 85,6 mm, relative lebih kecil dibandingkan dengan lokasi lainnya di Indonesia. Radjab (1997) melaporkan bahwa diameter cangkang bulu babi yang ditemukan di Tamedan, Maluku Tenggara Berkisar anatara 42,5 – 95,9 mm dengan dominansi berada pada 60 – 70 mm. Kasim (1999) melaporkan bahwa ukuran T. gratilla diperairan Bone-Bone, Sulawesi Tenggara berkisar antara 2,7 – 7,38 mm dengan bobot 19,7 – 78,7 gram. Di Kapoposan Sulawesi Selatan Diameter bulu babi T. gratilla berkisar antara 38,0 – 71,0 mm.
Gambar 29 Model konseptual perikanan bulu babi di pantai Semerang
Selain faktor lingkungan, sumberdaya bulu babi juga sangat dipengaruhi oleh komponen biologi dan aktivitas perikanan. Komponen biologi yang
29
berpengaruh diantaranya terdiri atas pertumbuhan, rekrutmen, migrasi dan mortalitas alami. Mortalitas tangkapan merupakan komponen yang ditimbulkan oleh aktivitas perikanan. Model konseptual perikanan bulu babi diperairan pantai Semerang disajikan pada Gambar 29.
Analisis hubungan diameter – bobot menunjukan bahwa pertumbuhan bulu babi T. gratilla bersifat allometrik negative (b=2,818) yang berarti bahwa
pertumbuhan beratnya tidak secepat pertumbuhan diameternya. Nilai R2 (=0,939)
menunjukan hubungan yang sangat erat antara panjang dan bobot tubuh bulu babi
T. gratilla (Gambar 13). Hal yang sama terjadi pada bulu babi jantan (Gambar 14) dan betina (Gambar 15). Hasil yang diperoleh dekat dengan hasil penelitian untuk jenis bulu babi yang sama di perairan lainnya (Tabel 4).
Tabel 4 Hasil studi hubungan diameter-bobot bulu babi T. gratilla
Lokasi R2 b (slope) Peneliti
Tamedan, Maluku 0,890 2,4005 Radjab (1997)
Teluk Aqaba, Yordania 0,983 1,8219 Wahbeh (2009)
Southern Guimaras, Philipina 0,766 2,3952 Regalado (2010)
Aziz (1993) menyatakan bahwa bulu babi merupakan hewan yang mempunyai pertumbuhan yang lambat. Ukuran dan pertumbuhanya sangat ditentukan oleh jenis dan habitatnya. Berdasarkan hasil analisa dijelaskan bahwa ukuran maksimal yang bisa dicapai (D∞) T. gratilla yang ditemukan dipantai Semerang adalah 92,4 mm dengan nilai K sebesar 0,780. Nilai yang ditemukan relative lebih rendah dibandingkan dengan hasil estimasi parameter pertumbuhan di lokasi lainnya (Tabel 5). Hal ini mengindikasikan bahwa ukuran T. gratilla di Pantai Semerang lebih kecil dan memiliki laju pertumbuhan yang relative lebih lamban dibandingkan dengan bulu babi sejenis di lokasi lainnya.
Tabel 5 Hasil estimasi parameter pertumbuhan bulu babi T. gratilla di beberapa lokasi
Lokasi D∞ (mm) K (tahun) Peneliti
Danahon Bank, Bohol 108 1,8 Bocolod and Dy (1986)
Elat (Gulf of Aqaba) 95 0,87 Dafni (1992)
Kapoposan, Sulawesi Selatan 147 1,0082 Tuwo (1995)
Pisalayan, Balinao 82 1,7 Menez et al. (2008)
Quezon Island, Bolinao 113 1,3 Menez et al. (2008)
Southern Guimaras 114,2 1,08 Regaldo (2010)
Musim dan jenis makanan yang tersedia mungkin merupakan faktor yang berpengaruh secara signifikan terhadap laju pertumbuhan dan ukuran maksimal yang bisa dicapai oleh bulu babi (Regalado 2010). Dafni (1992) melaporkan bahwa laju pertumbuhan T. gratilla yang diberikan asupan makanan Ulva lactuca
(k = 2,92) menunjukan laju pertumbuhan yang lebih tinggi dibandingkan dengan laju pertubuhannya di alam (k=0,87).
Lyimo et al. (2011) melaporkan bahwa isi lambung bulu babi T. gratilla
yang dikoleksi dari habitat lamun yang monospesifik didominasi oleh spesies
lamun dimana mereka ditemukan. Selanjutnya dijelaskan bahwa T. gratilla
30
didaunnya membuatnya terasa lebih lezat. Di lokasi penelitian terdiri atas vegetasi lamun campuran yang terdiri atas C. rotundata, S. isoetifolium, H. uninervis dan
H. ovalis.
Effendi (1997) menjelaskan bahwa laju pertumbuhan biota menurun seiring peningkatan kematangan gonad karena makanan dialokasikan untuk
perkembangan gonad. Manuel (2013) Melaporkan bahwa pertumbuhan T.
gratilla yang dikultur sejak ukuran rata 24 mm dapat mencapai ukuran rata-rata 143 mm dalam waktu 3 bulan. Laju pertumbuhan capat terjadi pada 30 hari pertama yang ditunjukan dengan ukuran yang mencapai rata-rata 70 mm. setelah 30 hari laju pertumbuhan mulai menurun seiring dengan perkembang gonad yang mulai matang pada ukuran 60 mm. Pertumbuhan bulu babi di perairan Tamedan, Maluku Tenggara adalah 0,05 mm/hari dan 0,10 gr/hari (Radjab 1997).
Regalado (2010) melaporkan bahwa mortalitas bulu babi sebesar 99,3% (Z=4,47/tahun) di Guimaras Selatan, Philipina. Bacolod dan Ty (1986) mengestimasi mortalitas bulu babi sebesar 91% di terumbu karang Danajon, Philipina Tengah. Juinio – menez (2008) juga melaporkan mortalitas alami yang tinggi sebesar 91 – 96% dari lokasi yang berbeda di perairan barat daya Luzon. Tingginya mortalitas T. gratilla dilokasi penelitian disebabkan oleh tingginya intensitas penangkapan yang dilakukan oleh masyarakat nelayan. Hasil estimasi laju eksploitasi sumberdaya (E=0,7) melebihi laju eksploitasi optimum (Eopt=0,5)
mengindikasikan laju eksploitasi sumberdaya bulu babi dilokasi penelitian mengalami penangkapan berlebih (overfishing).
Gambar 18 menjelaskan bahwa pada bulan Maret terlihat dominasi TKG I dan II yang mengindikasikan pada bulan ini kondisi gonad T. gratilla msih dalam fase awal perkembangannya. Pada bulan April masih terlihat dominansi TKG 2 namun terlihat peningkatan proporsi TKG 3 dan 4. Pada bulan Mei tetap didominasi oleh TGK II dan proporsi TKG 3 dan 4 yang semakin besar yang mengindikasikan masa pematangan gonad. Pada bulan Juni porporsi TKG 3 dan 4 mencapai 50% dari total sampel yang diamati yang mengindikasikan bahwa populasi sedang mendekati atau bahkan sudah memasuki masa pemijahan. Ditemukannya individu dengan TKG V pada bulan Juni mengindikasikan bahwa musim pemijahan baru dimulai.
Musim Pemijahan T. gratilla bervariasi pada berbagai daerah di Indonesia. Di pantai Semerang, Lombok Timur (lokasi penelitian) waktu matang gonad dan memijah baru dimulai pada bulan Juni. Diperairan Tamedan, Maluku Tenggara masa pemijahan terjadi pada bulan Agustus sampai dengan Oktober (Radjab 1997). Diperairan Bone-Bone,Sulawesi Tenggara pada bulan Maret – Mei (awal musim timur) merupakan waktu matang gonad dan memijah bagi T. gratilla (Kasim 1999). Wahbeh (2009) melaporkan bahwa di perairan Teluk Aqaba indeks kematangan gonad bulu babi T. gratilla meningkat dari bulan Juli sampai dengan bulan September dan kemudian mengalami penurunan drastis pada bulan November yang mengindikasikan waktu pemijahan.
Pola rekrutmen berdasarkan data frekuensi panjang menunjukan dua puncak rekrutmen yaitu rekrutmen kecil pada bulan Juni dan yang lebih besar pada bulan Agustus (Gambar 21). Ditemukannya T. gratilla dengan tingkat kematangan gonad pada fase V (memijah) pada bulan Juni mengindikasikan
tingginya rekrutmen. Beldia (2003) melaporkan bahwa dua puncak rekrutmen T.