REKAYASA TEKNOLOGI PEMANENAN MIKROALGA MELALUI PERBEDAAN DENSITAS FLOKULAN PADA TEKNIK
BIO-FLOKULASI
EKO HARSONO
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Rekayasa Teknologi Pemanenan Mikroalga melalui Perbedaan Densitas Flokulan pada Teknik Bio-flokulasi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Eko Harsono
ABSTRAK
EKO HARSONO. Rekayasa Teknologi Pemanenan Mikroalga melalui Perbedaan Densitas Flokulan pada Teknik Bio-flokulasi. Dibimbing oleh MUJIZAT KAWAROE and ADRIANI SUNUDDIN.
Pemanenan mikroalga adalah bagian penting dalam sistem kultivasi mikroalga yang bertujuan untuk pengembangan bahan bakar nabati, sehingga dibutuhkan teknik yang berbiaya murah dan berdaya hasil tinggi seperti bio-flokulasi. Penelitian ini dilakukan dengan mengombinasikan mikroalga jenis
Tetraselmis suecica (agen flokulan) dengan Chlorella sp. dan Nannochloropsis
sp. (non-flokulan) dan menentukan tingkat pengendapan yang paling efektif dari beberapa perlakuan (P1-P4). Hasil yang didapat menunjukkan bahwa Tetraselmis suecica mampu mempercepat pemanenan Chlorella sp. dan Nannochloropsis sp, dengan tingkat pengendapan tertinggi diperoleh pada P4. Terjadi peningkatan laju pengendapan mikroalga setelah penambahan Tetraselmis suecica, untuk Chlorella
sp. dari 52.12±1.91% menjadi 70.44±0.22%, sedangkan pada Nannochloropsis sp. dari 13.84±1.27% menjadi 45.06±0.75. Proses pengendapan menggunakan teknik bio-flokulasi pada pemanenan skala indoor jauh lebih cepat dibandingkan kultivasi outdoor. Hasil ekstraksi lemak mikroalga dengan teknik bio-flokulasi lebih tinggi dibandingkan dengan menggunakan bahan kimia berupa NaOH. Kata kunci: bio-flokulasi, Chlorella sp., Nannochloropsis sp., pemanenan,
Tetraselmis suecica.
ABSTRACT
EKO HARSONO. Development of Microalgae Harvesting Method Using Bio-flocculation at Several Yield Density. Under direction of MUJIZAT KAWAROE and ADRIANI SUNUDDIN.
Harvesting method is one crucial process during microalgal cultivation for development of bioenergy, thus low-cost bio-flocculation technique needs continuous improvement for yielding higher biomass and faster harvesting period. The study was conducted by mixing Tetraselmis suecica (flocculant) with microalgal species of Chlorella sp. and Nannochloropsis sp. (non-flocculants) to determine the rate of deposition from several treatment (P1-P4). The results showed that Tetraselmis suecica was functional in accelerating harvest of
Chlorella sp. and Nannochloropsis sp, with the highest precipitation observed at P4. The deposition rate of Chlorella sp. was increased from 52.12±1.91% to 70.44±0.22%, while Nannochloropsis sp. from 13.84±1.27% to 45.06±0.75% after Tetraselmis suecica was added. Rate of deposition during bio-flocculation process was proven efficient at indoor scale cultivation compare to outdoor. Lipid yielded from bio-flocculation technique was higher compare chemical flocculant, such as NaOH.
Key words: bio-flocculation, Chlorella sp., harvesting, Nannochloropsis sp.,
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan
pada
Departemen Ilmu dan Teknologi Kelautan
REKAYASA TEKNOLOGI PEMANENAN MIKROALGA MELALUI PERBEDAAN DENSITAS FLOKULAN PADA TEKNIK
BIO-FLOKULASI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
2015
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini. Tema yang dipilih dalam penelitian yang dilaksanakan pada bulan April hingga bulan Oktober 2014 ini ialah pemanenan mikrolga, dengan judul Rekayasa Teknologi Pemanenan Mikroalga melalui Perbedaan Densitas Flokulan pada Teknik Bio-flokulasi. Penulis banyak mendapat bantuan dan arahan dari berbagai pihak dalam penulisan skripsi, sehingga penulis mengucapkan banyak terima kasih kepada :
1. Ayah, Ibu, dan seluruh keluarga atas dukungannya baik secara moril maupun materil selama penyusunan skripsi ini.
2. Dr Ir Mujizat Kawaroe, MSi dan Adriani Sunuddin, SPi MSi selaku dosen pembimbing yang telah memberikan arahan dan bimbinganya selama ini. 3. Seluruh Dosen dan Staff Departemen Ilmu dan Teknologi Kelautan atas
ilmu dan pelayanan yang diberikan selama penulis melakukan perkuliahan. 4. Surfactan and Bionergy Research Centre (SBRC) khususnya Divisi Alga
yang telah membantu penulis dalam melaksanakan penelitian.
5. Annisa Adzaningtias atas dukungan dan semangat yang telah diberikan. 6. Keluarga besar ITK 47 atas persahabatan dan suka duka yang telah
terbangun selama ini.
Penulis menyadari skripsi ini jauh dari kesempurnaan, namun demikian penulis berharap agar skripsi ini dapat berguna bagi diri sendiri maupun pembaca dan dapat dikembangkan melalui penelitian selanjutnya.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN ix
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
Waktu dan Lokasi Penelitian 2
Rancangan Penelitian 2
Pelaksanaan Penelitian 4
Kultivasi Mikroalga 4
Proses Bio-flokulasi 5
Penghitungan Densitas Mikroalga Skala Cuvette (2 mL) pada Bagian
Atas dan Bawah 5
Proses Ekstraksi Lemak Mikroalga 6
Analisis Data 6
HASIL DAN PEMBAHASAN 7
Bio-flokulasi Mikroalga 7
Densitas Mikroalga Non-flokulan (yang dipanen) pada Proses Bio-flokulasi 12 Kandungan Lemak Mikroalga Hasil Pemanenan dengan Teknik
Bio-flokulasi 15
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 16
LAMPIRAN 18
DAFTAR TABEL
1. Tingkat pengendapan mikroalga flokulan dan non-flokulan sebelum
dilakukan pencampuran 8
2. Tingkat pengendapan mikroalga flokulan dan non-flokulan setelah dilakukan pencampuran pada menit ke-45 dan 90 untuk P1 dan P2 8 3. Tingkat pengendapan mikroalga flokulan dan non-flokulan setelah
dilakukan pencampuran pada menit ke-45 dan 90 untuk P3 dan P4 8 4. Perbandingan kadar lemak hasil panen bio-flokulasi dan NaOH 15
DAFTAR GAMBAR
1. Diagram alir penelitian 3
2. Pencampuran antara spesies flokulan dan non-flokulan 4 3. Perbedaan tingkat pengendapan kombinasi Tetraselmis suecica dan
Nannochloropsis sp. terhadap waktu (menit) 9
4. Perbedaan tingkat pengendapan kombinasi Tetraselmis suecica dan
Chlorella sp. terhadap waktu (menit) 10
5. Ilustrasi laju pengendapan dalam proses bio-flokulasi spesies Chlorella
sp. dan Nannochloropsis sp. dengan Tetraselmis suecica 11 6. Perbedaan densitas Nannochloropsis sp. bagian atas cuvette hasil
pemanenan kultivasi indoor (kiri) dan hasil pemanenan kultivasi
outdoor (kanan) pada menit ke-180 dan 315 12
7. Perbedaan densitas Nannochloropsis sp. bagian bawah cuvette hasil pemanenan kultivasi indoor (kiri) dan hasil pemanenan kultivasi
outdoor (kanan) pada menit ke-180 dan 315 12
8. Perbedaan densitas Chlorella sp. bagian atas cuvette hasil pemanenan kultivasi indoor (kiri) dan hasil pemanenan kultivasi outdoor (kanan)
pada menit ke-180 dan 315 13
9. Perbedaan densitas Chlorella sp. bagian bawah cuvette hasil pemanenan kultivasi indoor (kiri) dan hasil pemanenan kultivasi outdoor (kanan)
pada menit ke-180 dan 315 13
DAFTAR LAMPIRAN
1. Data OD750nm masing-masing spesies mikroalga hasil spektrofotometer 18 2. Tingkat pengendapan masing-masing mikroalga hasil spektrofotometer 18 3. Data OD750nm kombinasi mikroalga flokulan dan non-flokulan dengan
perlakuan 1 (P1), P2, P3 dan P4 hasil spektrofotometer 19 4. Tingkat pengendapan berdasarkan kombinasi mikroalga flokulan dan
non-flokulan dengan perlakuan 1 (P1), P2, P3, dan P4 21 5. Hasil ekstraksi kandungan lemak mikroalga yang dipanen dengan bahan
kimia NaOH dan teknik bio-flokulasi 22
6. Hasil analisis statistik 23
7. Alur kegiatan penelitian dari sterilisasi alat dan bahan hingga ekstraksi
PENDAHULUAN
Latar Belakang
Penelitian terkait mikroalga sudah dilakukan oleh banyak pakar dengan kepentingan utamanya dapat menghasilkan minyak sebagai pengganti bahan bakar fosil. Produksi minyak menggunakan mikroalga lebih menghemat biaya karena salah satu energi utama yang dibutuhkan untuk pertumbuhannya adalah sinar matahari yang terdapat di alam (Kawaroe et al. 2009). Banyaknya minyak yang dihasilkan dapat dipengaruhi pada proses pemanenan mikroalga. Pemanenan mikroalga adalah bagian penting dalam sistem kultivasi mikroalga untuk memperbanyak biomassa panen mikroalga (Sim et al. 1988). Ada beberapa teknik dalam pemanenan mikroalga, yaitu teknik sentrifugasi, filtrasi dan flokulasi (Brennan dan Owende 2009). Sentrifugasi merupakan proses pemisahan menggunakan gaya sentrifugal sebagai driving force untuk memisahkan padatan dan cairan (Wijffels dan Barbosa 2010). Proses sentrifugasi dengan kecepatan tinggi secara efektif dapat memisahkan mikroalga dari cairan medianya (Chen et al. 2011). Menurut Grima et al. (2003), proses filtrasi efektif diaplikasikan untuk proses pemanenan mikroalga dengan ukuran sel yang besar dan tidak cocok untuk operasi pemanenan mikroalga yang memiliki ukuran sel yang kecil seperti spesies
Dunaliella. Penggunaan teknik filtrasi hanya dapat dilakukan untuk memanen mikroalga dengan ukuran yang lebih besar dari 100 μm dan memiliki bentuk tubuh filamen atau berkoloni (Gouveia 2011).
Teknik flokulasi efektif digunakan untuk pemanenan mikroalga yang berukuran lebih kecil dari 100 μm dan tidak berkoloni. Teknik flokulasi akan membantu mikroalga membentuk koloni (flok) dengan bantuan bahan kimia (Lee
et al. 1998). Pemanenan menggunakan flokulan kimia merupakan hal yang umum digunakan karena prosesnya sangat mudah. Waktu yang dibutuhkan tidak lama untuk mengendapkan (mengikat) mikroalga yang dipanen. Flokulan kimia tidak cocok untuk pemanenan mikroalga secara berkelanjutan dalam skala besar karena media yang digunakan harus dibersihkan flokulan kationiknya terlebih dahulu supaya dapat dipergunakan kembali atau dibuang ke alam (Schenk et al. 2008). Penggunaan flokulan kimia akan mengakibatkan perubahan pH, suhu, oksigen, dan penurunan nutrisi pada media kultur.
Teknik flokulasi menggunakan makhluk hidup (bio-flokulasi) dapat menjadi alternatif dalam proses pemanenan mikroalga yang ramah lingkungan. Makhluk hidup yang digunakan dalam pemanenan antara lain mikroalga, bakteri, dan fungi. Teknik bio-flokulasi berdampak positif terhadap lingkungan karena tidak menggunakan bahan kimia dalam pemanenan mikroalga. Berbeda dengan fungi dan bakteri, mikroalga tidak membutuhkan tambahan media khusus pada teknik bio-flokulsai, sehingga akan mengurangi besarnya biaya tambahan dalam pemanenan mikroalga (Salim et al. 2011).
2
Chlorella sp. (sebagai non-flokulan). Proses pencampuran antara mikroalga flokulan dan non-flokulan (bio-flokulasi) dilakukan dengan perbandingan volume/volume (v/v) tanpa mengetahui densitas dari flokulan yang digunakan. Proses bio-flokulasi yang dilakukan pada penelitian ini yaitu dengan menghitung densitas flokulan, sehingga dapat diketahui secara pasti densitas flokulan yang digunakan untuk memanen mikroalga non-flokulan. Penelitian ini juga melakukan pembandingan proses bio-flokulasi dari pemanenan hasil kultivasi indoor dan
outdoor. Penghitungan densitas saat terjadinya proses bio-flokulasi juga dilakukan supaya pengendapan dapat diketahui secara pasti. Spesies mikroalga yang digunakan dalam penelitian ini adalah Tetraselmis suecica (agen flokulan), Nannochloropsis sp. dan Chlorella sp. (non-flokulan). Pemilihan spesies tersebut karena relatif mudah dikultur dalam waktu singkat, sudah banyak penelitian yang terkait dengan spesies tersebut, dan memiliki kandungan lemak yang tinggi.
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Menentukan kombinasi spesies mikroalga yang efisien dalam proses bio-flokulasi.
2. Mengukur kandungan kadar lemak (%) hasil dari pemanenan mikroalga dengan teknik bio-flokulasi.
3. Mengukur kecepatan dari proses pengendapan mikroalga hasil kultivasi
indoor dan outdoor pada teknik bio-flokulasi.
METODOLOGI
Waktu dan Lokasi Penelitian
Penelitian dilaksanakan pada bulan April – Oktober 2014 meliputi 3 kegiatan utama yaitu kultivasi, pemanenan mikroalga (menggunakan teknik bio-flokulasi) dan ekstraksi lemak dari mikroalga. Tahap 1 adalah penelitian pendahuluan dari tanggal 1 April – 6 Mei 2014 yang meliputi kegiatan persiapan alat dan bahan, kultivasi bibit mikroalga untuk stok penelitian dari setiap spesies mikroalga yang digunakan dalam penelitian. Tahap 2 adalah kegiatan penelitian utama dari tanggal 13 Mei – 17 Juni yaitu kultivasi mikroalga untuk penelitian bio-flokulasi dan kegiatan penelitian proses bio-flokulasi. Tahap 3 adalah kegiatan kultivasi mikroalga skala outdoor, pemanenan dengan teknik bio-flokulasi pada hasil kiltivasi skala outdoor dan indoor serta ekstraksi kadar lemak dari hasil panen mikroalga mengunakan teknik bio-flokulasi yang dilaksanakan dari tanggal 9 Juli – 13 Oktober 2014. Pemilihan lokasi penelitian yaitu di Pusat Penelitian Surfaktan dan Bioenergi, LPPM, Kampus IPB Baranangsiang, Kota Bogor.
Rancangan Penelitian
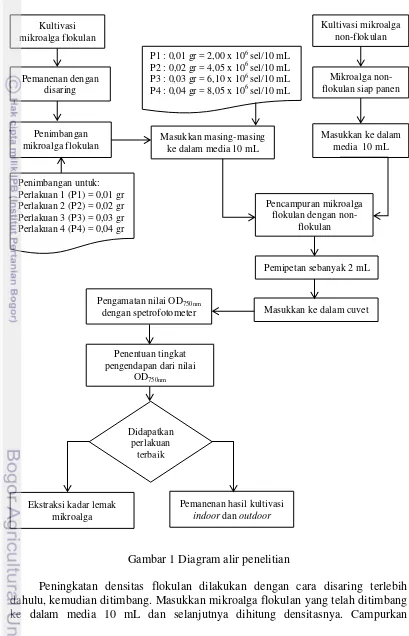
3 (Nannochloropsis sp. dan Chlorella sp.) skala 2 mL (Gambar 1). Perbandingan volume saat pencampuran flokulan dan non-flokulan adalah 1:1 (v/v) berdasarkan hasil terbaik dari penelitian sebelumnya (Kawaroe et al. 2015).
Gambar 1 Diagram alir penelitian
4
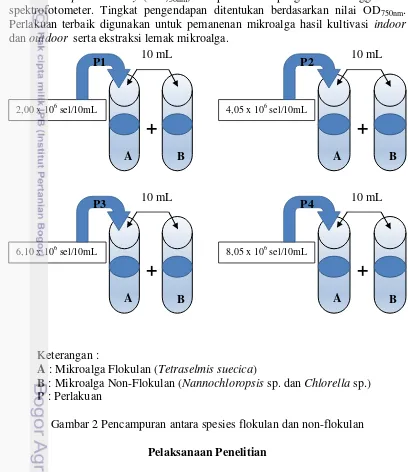
mikroalga flokulan 10 mL dengan non-flokulan 10 mL (Gambar 2). Penimbangan mikroalga flokulan dilakukan berdasarkan 4 perlakuan (P) yang telah ditentukan, yaitu:
P1 = 0,01 gr/10 mL 2,00 x 106 sel/10 mL (flokulan) + 10 mL (non-flokulan) P2 = 0,02 gr/10 mL 4,05 x 106 sel/10 mL (flokulan) + 10 mL (non-flokulan) P3 = 0,03 gr/10 mL 6,10 x 106 sel/10 mL (flokulan) + 10 mL (non-flokulan) P4 = 0,04 gr/10 mL 8,05 x 106 sel/10 mL (flokulan) + 10 mL (non-flokulan).
Nilai optical density (OD750nm) didapatkan dari pengukuran menggunakan spektrofotometer. Tingkat pengendapan ditentukan berdasarkan nilai OD750nm. Perlakuan terbaik digunakan untuk pemanenan mikroalga hasil kultivasi indoor
dan outdoor serta ekstraksi lemak mikroalga.
Keterangan :
A : Mikroalga Flokulan (Tetraselmis suecica)
B : Mikroalga Non-Flokulan (Nannochloropsis sp. dan Chlorella sp.) P : Perlakuan
Gambar 2 Pencampuran antara spesies flokulan dan non-flokulan Pelaksanaan Penelitian
Kultivasi Mikroalga
Kultivasi mikroalga merupakan kegiatan menumbuhkan mikroalga dalam lingkungan tertentu yang terkontrol. Tujuan kultivasi adalah untuk mendapatkan kelimpahan sel yang tinggi (Kawaroe et al. 2010). Bibit mikroalga yang dikultivasi didapatkan dari Balai Besar Pengembangan Budidaya Air Payau (BBPBAP) Jepara. Bibit Tetraselmis suecica, Nannochloropsis sp., dan Chlorella
6,10 x 106 sel/10mL
+
P3
A B
10 mL
8,05 x 106 sel/10mL
+
P4
A B
10 mL 2,00 x 106 sel/10mL
+
P1
A B
10 mL
4,05 x 106 sel/10mL
+
P2
A B
5 sp diambil masing-masing sebanyak 300 mL dan dibagi rata kedalam 3 botol ukuran 500 mL, tiap botol berisi 100 mL bibit mikroalga. Bibit tersebut kemudian ditambahkan air laut yang telah disterilisasi menggunakan autokalaf sebanyak 200 ml untuk masing-masing botol. Pupuk Walne ditambahkan sebanyak 1/3 mL (7 tetes) menggunakan pipet tetes. Kultivasi dilakukan hingga skala 1 L, 10 L dan 100 L. Hari panen masing–masing mikroalga yaitu, spesies Tetraselmis suecica
pada hari ke-13, Chlorella sp. pada hari ke-12, dan Nannochloropsis sp. pada hari ke-11 (Kawaroe et al. 2015).
Proses Bio-flokulasi
Proses bio-flokulasi dilakukan untuk mengetahui perlakuan mikroalga flokulan yang paling optimal untuk mengendapkan mikroalga non-flokulan dan mengetahui mekanisme terjadinya bio-flokulasi sehingga mikroalga non-flokulan dapat terendapkan lebih cepat.
Penelitian proses bio-flokulasi membutuhkan waktu lama, yaitu kurang lebih satu hari. Hasil kultivasi Tetraselmis suecica, Nannochloropsis sp., dan
Chlorella sp. disimpan dalam lemari pendingin untuk mencegah pembelahan sel. Mikroalga flokulan dan non-flokulan dicampurkan dalam 2 mL sesuai ukuran
cuvette dari spektrofotometer dengan perlakuan yang telah ditentukan pada Gambar 1. Pengamatan nilai OD750nm dilakukan tiap 45 menit sebanyak 8 kali pengukuran selama 5 jam 15 menit sampai terjadi pengendapan sempurna antara mikroalga flokulan dan non-flokulan (Salim et al. 2011). Kalibrasi dilakukan sebelum melakukan pengamatan nilai OD750nm dengan menggunakan blangko berupa air laut. Perolehan nilai OD750nm digunakan untuk menentukan tingkat pengendapan mikroalga. Tipe spektrofotometer yang digunakan dalam pengamatan proses bio-flokulasi adalah spektrofotometer single beam dengan merek Optima model SP-300. Cuvette yang digunakan berbahan polystyrene yang memiliki kisaran panjang gelombang antara 340-800 nm.
Proses pengamatan bio-flokulasi dilakukan dengan menggunakan mikroskop Olympus CX21LED. Foto proses bio-flokulasi diambil mengunakan kamera Optilab Microscope Camera yang dipasang pada mikroskop. Pengambilan foto dilakukan pada menit ke-0, 180 dan 315.
Penghitungan Densitas Mikroalga Skala Cuvette (2 mL) pada Bagian Atas dan Bawah
Penghitungan densitas mikroalga dilakukan menggunakan mikroskop setelah pencampuran antara flokulan dan non-flokulan (bio-flokulasi). Penghitungan densitas mikroalga bagian atas dan bawah cuvette dilakukan untuk mengetahui jumlah mikroalga yang telah terendapkan dan yang belum terendapkan. Pengambilan sampel dilakukan dengan menggunakan pipet mikron sebanyak 10 µm tiap penghitungan. Sampel diambil pada bagian atas cuvette dan bagian bawah cuvette. Menit ke-0 tidak dilakukan penghitungan densitas karena belum terjadi flok antara mikroalga flokulan dan non-flokulan serta belum terjadi pengendapan, sehingga penghitungan dilakukan pada menit ke-180 dan 315.
6
yang tidak normal (kekurangan cahaya atau suhu yang tidak normal) akan berpengaruh terhadap proses bio-flokulasi, akibatnya mikroalga akan mengekskresikan substansi polimer ekstrakseluler (EPS) sehingga pengikatan lebih cepat terjadi (Sathe 2010). Peneliti ingin melihat apakah pada saat laju pertumbuhan tinggi proses bio-flokulasi akan berjalan dengan sempurna ataukah sebaliknya serta mengetahui apakah proses pengendapan lebih cepat pada hasil pemanenan kultivasi indoor ataukah lebih lama dibandingkan dengan hasil pemanenan kultivasi outdoor pada proses bio-flokulasi. Pernyataan tersebut juga menjadi dasar peneliti melakukan penghitungan densitas hasil pemanenan kultivasi indoor dan outdoor.
Proses Ekstraksi Kadar Lemak Mikroalga
Ekstraksi lemak mikroalga membutuhkan pasta kering dalam jumlah banyak sehingga proses bio-flokulasi dilakukan dalam skala 10 liter (Kawaroe et al.
2015). Hasil ekstrakasi berupa lemak mikroalga dari proses bio-flokulasi kemudian dibandingkan dengan hasil ekstrasi dengan pemanenan menggunakan bahan kimia berupa NaOH.
Pasta basah mikroalga hasil pemanenan menggunakan teknik bio-flokulasi dan pemanenan menggunakan bahan kimia (NaOH) dikeringkan dengan oven pada suhu 121°C selama ±24 jam (Kawaroe et al. 2015). Pasta kering dipindahkan ke dalam desikator selama ±15 menit kemudian ditimbang dengan menggunakan neraca digital (Kawaroe et al. 2015).
Pasta kering mikroalga kemudian diekstraksi untuk menghasilkan lemak. Ekstraksi lemak merupakan salah satu tahap paling penting dalam produksi biodiesel. Lemak dipisahkan dari sel mikroalga menggunakan metode tertentu. Metode yang digunakan untuk ekstraksi lemak adalah metode soxhlet dan pelarut yang digunakan adalah n-hexan sebanyak 200 mL (Prartono et al. 2013). Waktu yang dibutuhkan dalam proses ekstraksi lemak mikroalga adalah 6 jam (Dayananda et al. 2006). Proses setelah ekstraksi adalah destilasi, yaitu pemisahan antara n-hexan dengan lemak mikroalga. Hasil berupa lemak mikroalga kemudian ditimbang dan diukur tingkat kadar lemak dari berat kering.
Analisis Data
Pengolahan Data Kepadatan Sel
Rumus perhitungan kepadatan sel mikroalga adalah Improved Neubaeur Haemocytometer (Kawaroe et al. 2015), sebagai berikut :
(1)
Keterangan :
Ni = Kepadatan sel mikroalga ke-i (jumlah sel/ml)
ni = Jumlah sel mikroalga ke-i dalam kotak pengamatan Perhitungan Tingkat Pengendapan Mikroalga
7
(2)
Keterangan :
OD750 (t0) = Nilai turbiditas pada saat awal pencampuran OD750 (tn) = Nilai turbiditas pada saat pengukuran waktu ke-n Perhitungan Kadar Lemak Mikroalga
Kadar lemak mikroalga dihitung dari berat kering mikroalga (Kawaroe et al.
2015), sebagai berikut:
(3)
Analisis Statistik
Analisis statistik yang digunakan untuk pengolahan data penelitian adalah Rancangan Acak Lengkap (RAL) dengan 2 faktor, yaitu untuk menentukan pengaruh perlakuan mikroalga flokulan dalam memperbesar tingkat pengendapan mikroalga non-flokulan. Pengolahan data dilakukan secara terpisah untuk masing-masing kombinasi mikroalga dengan perlakuan yang telah ditentukan. Penentukan kombinasi mikroalga terbaik antara Tetracelmis suecica dan Chlorella sp. atau
Tetracelmis suecica dan Nannochloropsis sp. dalam proses bio-flokulasi dilakukan uji nilai tengah (uji T) (Mattjik dan Sumertajaya 2006).
HASIL DAN PEMBAHASAN
Bio-Flokulasi Mikroalga
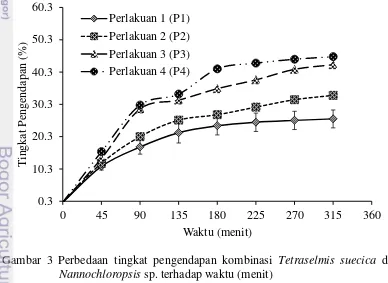
Hasil penelitian menunjukkan bahwa pengendapan paling optimal adalah P4 dibandingkan perlakuan lainnya (Tabel 2 dan Tabel 3). Tingkat pengendapan spesies Chlorella sp. pada menit ke-45 dan 90 sebesar 17.98±1.52% dan 28.29±1.03% sebelum di tambahkan Tetraselmis suecica. Spesies
Nannochloropsis sp. terendapkan pada menit ke-45 dan 90 sebesar 4.97±0.27% dan 11.48±0.32% sebelum ditambahkan Tetraselmis suecica (Tabel 1). Penambahan Tetraselmis suecica (P4) mampu memperbesar tingkat pengendapan spesies Chlorella sp. pada menit ke-45 dan 90 sebesar 26.19±0.82% dan 42.48±0.30%. Tingkat pengendapan Nannochloropsis sp. pada menit ke-45 dan 90 sebesar 15.65±1.43% dan 30.08±1.01% setelah ditambahkan Tetraselmis suecica (Tabel 3).
Besaran tingkat pengendapan antara sebelum dan sesudah ditambahkan flokulan dapat dilihat dari selisih tingkat pengendapannya. Spesies Chlorella sp.
memiliki selisih tingkat pengendapan antara sebelum dan sesudah penambahan
8
Tabel 1 Tingkat pengendapan mikroalga flokulan dan non-flokulan sebelum dilakukan pencampuran
Mikroalga Tingkat Pengendapan (%)
45 menit 90 menit
1. Flokulan
Tetraselmis suecica 30.84±0.81 63.76±0.97
2. Non-Flokulan
Tabel 2 Tingkat pengendapan mikroalga flokulan dan non-flokulan setelah dilakukan pencampuran pada menit ke-45 dan 90 untuk P1 dan P2 Kombinasi
dan Chlorella sp. 21.17±0.68 35.98±0.75 23.77±0.76 37.77±0.71
Tetraselmis suecica
dan
Nannochloropsis
sp.
11.12±1.16 17.10±2.22 12.06±0.13 20.30±0.24
Tabel 3 Tingkat pengendapan mikroalga flokulan dan non-flokulan setelah dilakukan pencampuran pada menit ke-45 dan 90 untuk P3 dan P4 Kombinasi
dan Chlorella sp. 25.50±0.16 40.47±0.74 26.19±0.82 42.48±0.30
Tetraselmis suecica
dan
Nannochloropsis
sp.
13.54±1.20 28.88±0.69 15.65±1.43 30.08±1.01
Besaran tingkat pengendapan membuktikan bahwa Tetraselmis suecica
mampu mempercepat proses pengendapan spesies Chlorella sp. dan
Nannochloropsis sp. Menurut Salim et al. (2011), penambahan konsentrasi spesies flokulan dalam pemanenan akan memperbesar tingkat pengendapan. Perlakuan 4 merupakan penambahan spesies flokulan lebih besar dibandingkan dengan perlakuan lainnya. Hasil uji statistik (Lampiran 6) menggunakan rancangan acak lengkap (RAL) didapatkan nilai p-value < 0.05 untuk kombinasi
Tetraselmis suecica dan Chlorella sp. atau Tetraselmis suecica dan
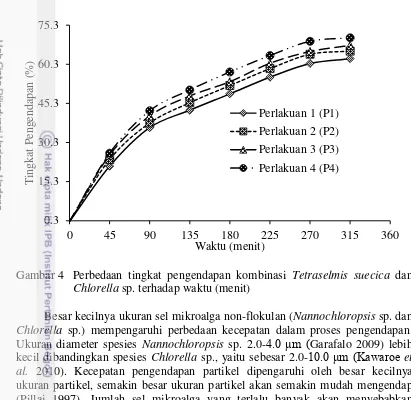
9 yang berbeda-beda dalam menggendapkan mikroalga. Penentuan perlakuan mikroalga flokulan dan non-flokulan terbaik dilihat dari plot pengaruh utama masing-masing perlakuan. Perlakuan terbaik akan menunjukkan tingkat pengendapan paling tinggi. Grafik plot pengaruh utama menunjukkan perlakuan 4 paling optimal dibandingkan dengan perlakuan lainnya. Peningkatan densitas flokulan akan mempercepat pengendapan mikroalga non-flokulan (Nannochloropsis sp. dan Chlorella sp.), sehingga tingkat pengendapan semakin besar (Gambar 3 dan Gambar 4) .
Penentuan kombinasi terbaik dilakukan uji T untuk perlakuan 4 dari 2 kombinasi mikroalga (Tetraselmis suecica dan Chlorella sp. atau Tetraselmis suecica dan Nannochloropsis sp.). Hasil menunjukkan kombinasi Teraselmis suecica dan Chlorella sp. merupakan kombinasi optimal. Nilai rataan Teraselmis suecica dan Chlorella sp. 47.46 lebih besar dari rataan Tetraselmis suecica dan
Nannochloropsis sp. sebesar 31.60, sehingga kombinasi Tetraselmis suecica dan
Chlorella sp. lebih cepat mengendap dibandingkan kombinasi Tetraselmis suecica
dan Nannochloropsis sp.
Bio-flokulasi merupakan flokulasi yang terjadi secara spontan dari sel mikroalga akibat adanya sekresi substansi polimer ekstrakseluler (Extracellular Polymeric Substances (EPS)) pada saat mikroalga berada dalam kondisi stres (Sathe 2010). Flokulasi mikroalga dapat terjadi karena kurangnya nutrisi sehingga menyebabkan sel mikroalga menseksresikan substansi polimer ekstrakseluler (Lee
et al. 2009). Hasil dari substansi polimer ekstrakseluler akan mengakibatkan terbentuknya gumpalan sel (pengikatan antar sel mikroalga). Terjadinya penggumpalan tersebut akan membentuk biomassa yang kemudian terendapkan.
Gambar 3 Perbedaan tingkat pengendapan kombinasi Tetraselmis suecica dan
10
Gambar 4 Perbedaan tingkat pengendapan kombinasi Tetraselmis suecica dan
Chlorella sp. terhadap waktu (menit)
Besar kecilnya ukuran sel mikroalga non-flokulan (Nannochloropsis sp. dan
Chlorella sp.) mempengaruhi perbedaan kecepatan dalam proses pengendapan. Ukuran diameter spesies Nannochloropsis sp. 2.0-4.0 μm (Garafalo 2009) lebih kecil dibandingkan spesies Chlorella sp., yaitu sebesar 2.0-10.0 μm (Kawaroe et al. 2010). Kecepatan pengendapan partikel dipengaruhi oleh besar kecilnya ukuran partikel, semakin besar ukuran partikel akan semakin mudah mengendap (Pillai 1997). Jumlah sel mikroalga yang terlalu banyak akan menyebabkan lamanya proses pengendapan (Kawaroe et al. 2015).
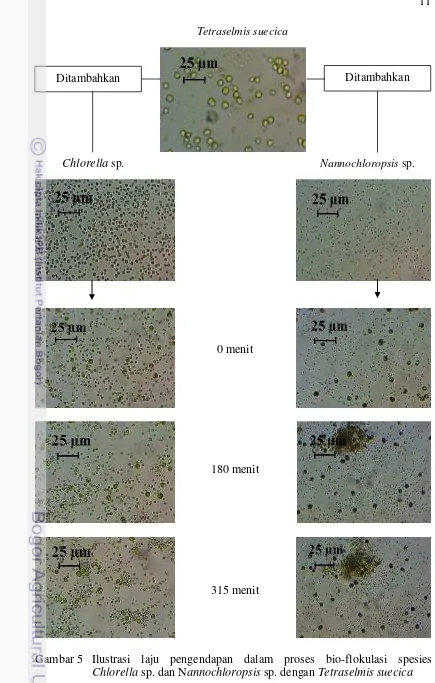
Mekanisme bio-flokulasi terjadi karena adanya polimer kationik yang diekskresikan oleh sel mikroorganisme (Tilton et al. 1972). Salim et al. (2011) menyatakan bahwa flokulasi disebabkan oleh polimer yang dibagi menjadi dua sub-mekanisme patching dan bridging. Patching adalah tipe flokulasi yang terjadi apabila polimer mengikat sel-sel mikroalga sepenuhnya, sehingga polimer terlihat seperti penambalan (patch) yang membentuk kumpulan (agregasi). Bridging
merupakan tipe flokulasi yang memiliki ukuran polimer panjang sehingga dapat mengikat sebagian atau seluruhnya dari sel mikroalga (terikat disepanjang polimer). Polimer akan menjembatani (bridge) ikatan antar mikroalga sehingga akan tebentuk flok dalam bentuk jaringan besar. Mekanisme hasil dari bio-flokulasi antara kombinasi Tetraselmis suecica dan Chlorella sp. atau Tetraselmis suecica dan Nannochloropsis sp. adalah tipe patching (terlihat pada Gambar 5). Awal pencampuran (0 menit) spesies flokulan dan non-flokulan masih terpisah. Secara bertahap sel mikroalga akan mengalami stres karena berkurangnya nutrisi, sehingga mikroalga mengekskresikan polimer ekstraseluler (Sathe 2010). Ikatan antar sel mikroalga berpusat pada Tetraselmis suecica (Kawaroe et al. 2015) dan mulai terlihat menit ke-90. Spesies Chlorella sp. dan Nannochloropsis sp. terikat dalam bentuk lokal pada sel Tetraselmis suecica dan tidak membentuk jaringan besar pada menit ke-315 (Gambar 5).
11
Gambar 5 Ilustrasi laju pengendapan dalam proses bio-flokulasi spesies
Chlorella sp. dan Nannochloropsis sp. dengan Tetraselmis suecica
Ditambahkan Ditambahkan
0 menit
180 menit
315 menit
Chlorella sp. Nannochloropsis sp.
12
Densitas Mikroalga Non-flokulan (yang dipanen) pada Proses Bio-flokulasi
Penghitungan densitas non-flokulan (yang dipanen) saat terjadinya bio-flokulasi dilakukan untuk mengetahui apakah mikroalga sudah terendapkan secara sempurna. Bio-flokulasi dilakukan skala 2 ml dari hasil pemanenan kultivasi
indoor dan outdoor.
Gambar 6 Perbedaan densitas Nannochloropsis sp. bagian atas cuvette hasil pemanenan kultivasi indoor (kiri) dan hasil pemanenan kultivasi
outdoor (kanan) pada menit ke-180 dan 315
Gambar 7 Perbedaan densitas Nannochloropsis sp. bagian bawah cuvette hasil pemanenan kultivasi indoor (kiri) dan hasil pemanenan kultivasi
outdoor (kanan) pada menit ke-180 dan 315
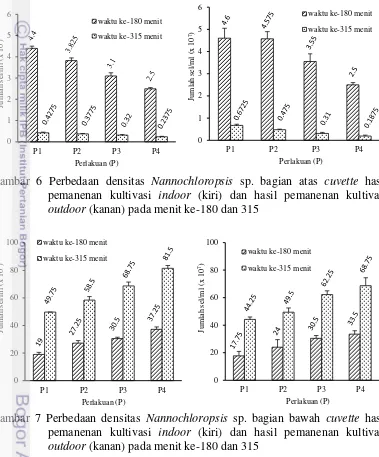
Densitas mikroalga Nannochloropsis sp. (hasil pemanenan kultivasi indoor) bagian atas cuvette pada P1 menit ke-180 sebesar 4.4±0.1x107 sel/ml dan menurun hingga 2.5±0.05x10 sel/ml pada P4. Menit ke-315 terjadi penurunan densitas
Nannochloropsis sp. (hasil pemanenan kultivasi indoor) untuk P1 sebesar 0.4275±0.0275x107 sel/ml dan P4 sebesar 0.1625±0.0175x107 sel/ml (Gambar 6). Densitas mikroalga Nannochloropsis sp. hasil pemanenan kultivasi outdoor
13 sel/ml pada P4 menit ke-180. Menit ke-315 terjadi penurunan densitas
Nannochloropsis sp. (hasil pemanenan kultivasi outdoor) untuk P1 sebesar 0.6725±0.0525x107 sel/ml dan P4 sebesar 0.1875±0.0425x107 sel/ml (Gambar 6).
Densitas Nannochloropsis sp. (hasil pemanenan kultivasi indoor) bagian bawah cuvette pada P1 menit ke-180 sebesar 19±0.15x107 sel/ml dan semakin meningkat hingga 37.25±1.75x107 sel/ml pada P4. Menit ke-315 terjadi peningkatan densitas Nannochloropsis sp. (hasil pemanenan kultivasi indoor) untuk P1 sebesar 49.75±0.75x107 sel/ml dan P4 sebesar 81.50±2x107 sel/ml (Gambar 7). Densitas mikroalga Nannochloropsis sp. hasil pemanenan kultivasi
outdoor meningkat dari P1 sebesar 17.75±3.25x107 sel/ml menjadi 33.5±2.5x107 sel/ml pada P4 menit ke-180. Peningkatan densitas Nannochloropsis sp. (hasil pemanenan kultivasi outdoor) menit ke-315 dari P1 sebesar 44.25±1.75x107 sel/ml menjadi 68.75±5.75x107 sel/ml pada P4 (Gambar 7).
Gambar 8 Perbedaan densitas Chlorella sp. bagian atas cuvette hasil pemanenan kultivasi indoor (kiri) dan hasil pemanenan kultivasi outdoor (kanan) pada menit ke-180 dan 315
Gambar 9 Perbedaan densitas Chlorella sp. bagian bawah cuvette hasil pemanenan kultivasi indoor (kiri) dan hasil pemanenan kultivasi
14
Densitas Chlorella sp. (hasil pemanenan kultivasi indoor) bagian atas
cuvette pada P1 menit ke-180 sebesar 0.82±0.04x107 sel/ml dan semakin menurun hingga 0.4925±0.0175x107 sel/ml pada P4. Menit ke-315 terjadi penurunan densitas Chlorella sp. (hasil pemanenan kultivasi indoor) untuk P1 sebesar 0.1825±0.0225x107 sel/ml dan P4 sebesar 0.085±0.005x107 sel/ml (Gambar 8). Densitas Chlorella sp. hasil pemanenan kultivasi outdoor menurun dari P1 menit ke-180 sebesar 0.09275±0.0375x107 sel/ml menjadi 0.62±0.035x107 sel/ml pada P4. Menit ke-315 terjadi penurunan densitas Chlorella sp. (hasil pemanenan kultivasi outdoor) untuk P1 sebesar 0.2475±0.0075x107 sel/ml dan P4 sebesar 0.1±0.01x107 sel/ml (Gambar 8).
Densitas Chlorella sp. (hasil pemanenan kultivasi indoor) bagian bawah
cuvette pada P1 menit ke-180 sebesar 4.1±0.15x107 sel/ml dan semakin meningkat hingga 6.275±0.175x107 sel/ml pada P4. Menit ke-315 terjadi peningkatan densitas Chlorella sp. (hasil pemanenan kultivasi indoor) untuk P1 sebesar 7.525±0.125x107 sel/ml dan P4 sebesar 10.65±0.25x107 sel/ml (Gambar 9). Densitas Chlorella sp. hasil pemanenan kultivasi outdoor mengalami peningkatan dari P1 menit ke-180 sebesar 3.85±0.2x107 sel/ml menjadi 5.875±0.325x107 sel/ml pada P4. Menit ke-315 terjadi peningkatan densitas
Chlorella sp. (hasil pemanenan kultivasi outdoor) untuk P1 sebesar 7.025±0.425x107 sel/ml dan P4 sebesar 10.20±0.25x107 sel/ml (Gambar 9).
Peningkatan dan penurunan densitas mikroalga non-flokulan secara cepat bagian bawah dan atas cuvette menujukkan terjadinya proses bio-flokulasi. Pengikatan mikroalga yang membentuk flok akan mempercepat proses pengendapan, karena berat dari kumpulan mikroalga bertambah besar (Pillai 1997). Penurunan densitas Nannochloropsis sp. (Gambar 6) bagian atas cuvette
hasil pemanenan kultivasi indoor lebih cepat dibandingkan hasil pemanenan kultivasi outdoor, sehingga densitas Nannochloropsis sp. bagian bawah cuvette
mengalami peningkatan (Gambar 7). Penurunan densitas Chlorella sp. (Gambar 8) hasil pemanenan kultivasi indoor lebih cepat dibandingkan hasil pemanenan kultivasi outdoor, sehingga densitas Chlorella sp. bagian bawah cuvette semakin meningkat (Gambar 9).
Menurut Wagenen et al. (2012), cahaya dan suhu merupakan salah satu faktor penting yang mempengaruhi tingginya produktivitas mikroalga. Suhu pada kultivasi indoor 200 C dan suhu pada kultivasi outdor berkisar antara 28-300 C. Menurut Kawaroe et al. (2010) suhu optimal untuk kultivasi mikroalga antara 24-300 C. Hasil penelitian yang dilakukan oleh Endarwati dan Riniatsih (2013), menujukkan bahwa suhu 280 C sangat optimal untuk mendapatkan produktivitas yang tinggi pada mikroalga jenis Nannochloropsis oculata. Tingkat stres mikroalga pada kondisi yang tidak normal (kekurangan cahaya atau suhu yang tidak normal) akan mengakibatkan mikroalga mengekskresikan substansi polimer ekstrakseluler (EPS), sehingga proses bio-flokulasi cepat terjadi (Sathe 2010). Kondisi suhu yang optimal membuat Tetraselmis suecica tumbuh dengan baik dan lebih aktif bergerak pada kultivasi outdoor dibandingkan kultivasi indoor, sehingga pengikatan Tetraselmis suecica terhadap Nannochloropsis sp. dan
Chlorella sp. membutuhkan waktu yang lebih lama. Produktivitas dan laju pertumbuhan spesies Nannochloropsis sp. dan Chlorella sp. yang dikultivasi skala
15 lamanya proses pengikatan antara mikroalga flokulan dan non-flokulan, sehingga proses pengendapan akan lebih lama.
Kandungan Lemak Mikroalga Hasil Pemanenan dengan Teknik Bio-flokuasi
Perlakuan yang digunakan dalam bio-flokulasi untuk pengukuran kadar lemak adalah perlakuan 4. Pemanenan dengan flokulan kimia berupa NaOH dilakukan sebagai pembanding terhadap pemanenan menggunakan teknik bio-flokulasi. Metode ekstraksi yang digunakan adalah metode soxhlet.
Tabel 4 Perbandingan kadar lemak hasil panen bio-flokulasi dan NaOH
Mikroalga Agen Pemanen Kadar Lemak (%)
Nannochloropsis sp. Tetraselmis suecica 16.05 ± 0.26
Nannochloropsis sp. NaOH 11.00 ± 1.71
Chlorella sp. Tetraselmis suecica 13.08 ± 0.34
Chlorella sp. NaOH 9.33 ± 0.90
Hasil kadar lemak yang diperoleh dari pemanenan menggunakan teknik bio-flokulasi sebesar 16.05±0.26% untuk spesies Nannochloropsis sp. dan 13.08±0.34% untuk spesies Chlorella sp. Hasil ekstraksi lemak mikroalga yang dipanen menggunakan NaOH diperoleh sebesar 11.00±1.71% untuk spesies
Nannochloropsis sp. dan 9.33±0.90% untuk spesies Chlorella sp. (Tabel 4). Hasil penelitian Chisti (2007) menyatakan bahwa kadar lemak untuk spesies
Nannochloropsis sp. berkisar dari 31-68% dan Chlorella sp. berkisar dari 28-32%. Ekstraksi kadar lemak yang diperoleh untuk Nannochloropsis sp. dan Chlorella
sp. memiliki nilai yang lebih kecil dibandingakan hasil literatur. Wiyarno (2009) menyatakan bahwa larutan n-hexan tidak dapat mengekstrak komponen lipid polar seperti klorofil dan phospholipid secara sempurna, sehingga tidak semua lemak dapat terekstrak. Menurut Prartono et al. (2013), persentase lipid yang diekstrak menggunakan n-hexan lebih kecil dibandingkan dengan menggunakan larutan kloroform. Metode ekstrasi yang berbeda mengakibatkan hasil dari ekstraksi juga
berbeda (Kawaroe et al. 2015). Pengikatan lemak oleh n-hexan terjadi karena adanya sifat kepolaran yang sama, artinya lemak bersifat non-polar dan n-hexan
juga bersifat non-polar. Kondisi kultivasi yang berbeda dapat mengakibatkan kadar lemak yang terbentuk selama kultivasi pun menjadi berbeda (Kawaroe et al. 2012).
16
SIMPULAN DAN SARAN
Simpulan
Kombinasi Tetraselmis suecica pada P4 merupakan teknik pemanenan dengan bio-flokulasi pada mikroalga Chlorella sp. dan Nannochloropsis sp. yang paling optimal karena memiliki tingkat pengendapan tertinggi. Hasil ekstraksi lemak menunjukkan bahwa pemanenan mikroalga dengan teknik bio-flokulasi lebih tinggi dibandingkan dengan NaOH. Proses pengendapan pada bio-flokulasi hasil pemanenan kultivasi indoor lebih cepat dibandingkan dengan hasil pemanenan kultivasi outdoor.
Saran
Perlu dilakukan penelitian lebih lanjut mengenai biologi dan morfologi serta kandungan polisakarida ekstrakseluler (EPS) dari spesies mikroalga flokulan. Hal ini bertujuan untuk menemukan spesies flokulan lainnya (selain Tetraselmis suecica) yang selanjutnya dapat digunakan sebagai agen pemanen mikroalga.
DAFTAR PUSTAKA
Brennan L, Owende P. 2009. Biofuels from microalgae – A review of technologies for production, processing, and extractions of biofuels and co-products. Renewable and Sustainable Energy Reviewers. 21. doi:10. 1016/j.rser.2009.10.009.
Chen YC, Yeh KL, Aisyah R, Lee DJ, Chang JS. 2011. Cultivation, photobioreactor design and harvesting of microalgae for biodiesel production: A critical review. Bioresource Technology. 102:71-81. Chisti Y. 2007. Biodiesel From Microalgae. Journal of Biotechnology Advances.
25:294-306. doi: 10.1016/j.biotechadv.2007.02.001.
Dayananda C, Sarada R, Srinivas P, Gokare R. 2006. Presence of Methyl Branched Fatty Acids and Saturated Hydrocarbon in Botryococcene Producing Strain of Botryococcus braunii. Acta Physiologiae Plantarum. 28(3):523-528.
Endarwati H, Riniatsih I. 2013. Kadar Total Lipid Mikroalga Nannochloropsis oculata yang dikultur dengan suhu yang berbeda. Buletin Oseanografi Marina. 1:25-33.
Garafalo R. 2009. Algae and Aquatic Biomass for a Sustainable Production of 2nd Generation Biofuel. Aqua Fuel. 258.
Gouveia L. 2011. Microalgae as a Feedstock for Biofuels. Springer Heidelberg Dordrecht London New York. 68.
Grima EM, Belarbi EH, Fernandez FGA, Medina AR, Chisti Y. 2003. Recovery of Microalgal Biomass and Metabolites: Process Options and Economics.
Biotechnology Advances. 20:491–515.
17 Menggunakan Media Air Limbah dan Gas Buang CO2. Prosiding
Seminar Hasil-Hasil Penelitian IPB 2009; Bogor. Bogor (ID). 89.
Kawaroe M, Prartono T, Sunuddin A, Sari DW, Agustine D. 2010. Mikroalga Potensi dan Pemamfaatan untuk Produksi Bio Bahan Bakar. Bogor (ID): IPB Press. 150.
Kawaroe M, Prartono T, Rachmat A, Sari DW, Agustine D. 2012. Laju Pertumbuhan Spesifik dan Kandungan Asam Lemak pada Mikroalga
Spirulina platensis, Isochrysis sp. dan Porphyridium cruentum. Ilmu Kelautan. 17(3):125-131.
Kawaroe M, Sunuddin A, Saputra D. 2015. Bio-flocculation as Environmentally Friendly Microalgae Harvesting Method : Tetraselmis suecica as Flocculant Agent. Hayati Journal of Biosciences, siap terbit.
Lee SJ, Kim SB, Kim JE, Kwon GS, Yoon BD, Oh HM. 1998. Effects of Harvesting Method and Growth Stage on The Flocculation of The Green Alga Botryococcus braunii. Letters in Applied Microbiology. 27:14–18. Lee AK, Lewis DM, Ashman PJ. 2009. Microbial Flocculation, A Potentially
Low-Cost Harvesting Technique For Marine Microalgae for The Production of Biodiesel. Journal of Applied Phycology.21:559–567. Mattjik AA, Sumertajaya. 2006. Perancangan Percobaan Dengan Aplikasi SAS
dan MINITAB. Bogor (ID): IPB Press.
Pillai J. 1997. Flocculants and Coagulants: The Keys to Water and Waste Management in Aggregate Production: Nalco Company.
Prartono T, Kawaroe M, Katili V. 2013. Fatty Acid Composition of Three Diatom Species Skeletonema costatum, Thalassiosira sp. and Chaetoceros gracilis. International Journal of Environment and Bioenergy. 6(1):28-43. Rocha JMS, Gracia Juan EC, Henriques MHF. 2003. Growth aspects of the
marine microalga Nannochloropsis gaditana. Biomolecular Engineering.
20:237-242.
Salim S, Bosman R, Vermue MH, Wijffels RH. 2011. Harvesting of microalgae by bio-flocculation. Journal of Applied Phycology.23:849-855.
Sathe S. 2010. Culturing and Harvesting Microalgae for the Large-scale Production of Biodiesel. Microbial Engineerring Research Group. 97. Schenk PM, Hall SRT, Stephens E, Marx UC, Mussgnug JH, Posten C, Kruse O,
Hankamer B. 2008. Second Generation Biofuels: High-Efficiency Microalgae for Biodiesel Production. Bioenergy Research. 1:20–43. Sim TS, Goh A, Becker EW. 1988. Comparison of Centrifugation, Dissolved Air
Flotation and Filtration Technique for Harvesting Sewage-grown Algae. Biomass. 16:51-62.
Tilton RC, Dixon JK, Murphy J. 1972. Flocculation of algae with synthetic polymer flocculants. Water Research. 6:155–161.
Wagenen JV, Miller TW, Hoobs S, Hook P, Crowe B, Huesemann M. 2012. Effect of Light and Temperature on Fatty Acid Production in
Nannochloropsis salina. Energies. 5:731-740.
Wijffels RH, Barbosa MJ. 2010. An Outlook on Microalgal Biofuels. Science. 330(6006):913.
18
LAMPIRAN
Lampiran 1 Data OD750nm masing-masing spesies mikroalga hasil spektrofotometer
Lampiran 2 Tingkat pengendapan masing-masing mikroalga hasil spektrofotometer
Spesies Mikroalga
Waktu (menit)
19 Lampiran 3 Data OD750nm kombinasi mikroalga flokulan dan non-flokulan
21 Lampiran 4 Tingkat pengendapan berdasarkan kombinasi mikroalga flokulan
22
Lampiran 5 Hasil ekstraksi kandungan lemak mikroalga yang dipanen dengan bahan kimia NaOH dan teknik bio-flokulasi
a: Penambahan NaOH sebanyak 150 ppm, b: Perlakuan 4
23 Lampiran 6 Hasil analisis statistik
a. Hasil Analisis Statistik Kombinasi antara Tetraselmis suecica dan Chlorella sp.
Hasil analisis ANOVA dengan model faktorial RAL 2 faktor Keterangan:
Kombinasi 1 : Tetraselmis suecica dan Chlorella sp. Kombinasi 2 : Tetraselmis suecica dan Chlorella sp. Kombinasi 3 : Tetraselmis suecica dan Chlorella sp. Kombinasi 4 : Tetraselmis suecica dan Chlorella sp.
Faktor Tipe Banyak Taraf Taraf
Waktu Tetap 8 0; 45; 90; 135; 180; 225; 270; 315 Perlakuan Tetap 4 1; 2; 3; 4
Analisis sidik ragam (ANOVA) menggunakan jumlah kuadrat terkoreksi untuk pengujian Uji Tukey Semua perbandingan pasangan antar taraf Perlakuan 1 dibandingkan dengan:
Perlakuan Selisih Nilai
Tengah Standar Error T hit Nilai Peluang
2 2.518 0.2288 11.00 0.0000
3 4.248 0.2288 18.56 0.0000
4 6.566 0.2288 28.69 0.0000
Perlakuan 2 dibandingkan dengan: Perlakuan Selisih Nilai
Tengah Standar Error T hit Nilai Peluang
3 1.729 0.2288 7.558 0.0000
4 4.048 0.2288 17.690 0.0000
Perlakuan 3 dibandingkan dengan: Perlakuan Selisih Nilai
Tengah Standar Error T hit Nilai Peluang
24
b. Hasil Analisis Statistik Kombinasi antara Tetraselmis suecica dan Nannochloropsis sp.
Hasil analisis ANOVA dengan model faktorial RAL 2 faktor Keterangan:
Kombinasi 1 : Tetraselmis suecica dan Nannochloropsis sp. Kombinasi 2 : Tetraselmis suecica dan Nannochloropsis sp. Kombinasi 3 : Tetraselmis suecica dan Nannochloropsis sp. Kombinasi 4 : Tetraselmis suecica dan Nannochloropsis sp.
Faktor Tipe Banyak Taraf Taraf
Waktu Tetap 8 0; 45; 90; 135; 180; 225; 270; 315 Perlakuan Tetap 4 1; 2; 3; 4
Analisis sidik ragam (ANOVA) menggunakan jumlah kuadrat terkoreksi untuk pengujian
Sumber Keragaman
Derajat Bebas
Jumlah Kuadrat
Jumlah Kuadrat Terkoreksi
Kuadrat Tengah Terkoreksi
F hit Nilai Peluang
Waktu 3 2538.68 2538.68 846.23 282.73 0.000
Perlakuan 7 13747.60 13747.60 1963.94 656.16 0.000 Waktu*Perlakuan 21 729.19 729.19 34.72 11.60 0.000
Error 64 191.56 191.56 2.99
Total 95 17207.03
S = 1.73005 R-sq = 98.89% R-sq (adj) = 98.35%
25 Uji Tukey semua perbandingan pasangan antar taraf
Perlakuan 1 dibandingkan dengan: Perlakuan Selisih Nilai
Tengah Standar Error T hit Nilai Peluang
2 3.805 0.4994 7.619 0.0000
3 10.258 0.4994 20.540 0.0000
4 13.014 0.4994 26.058 0.0000
Perlakuan 2 dibandingkan dengan: Perlakuan Selisih Nilai
Tengah Standar Error T hit Nilai Peluang
3 6.453 0.4994 12.92 0.0000
4 9.209 0.4994 18.44 0.0000
Perlakuan 3 dibandingkan dengan: Perlakuan Selisih Nilai
Tengah Standar Error T hit Nilai Peluang
4 2.756 0.4994 5.517 0.0000
c. Uji T antara kombinasi Perlakuan 4 (P4) (Tetraselmis suecica dan Chlorella sp. dengan Tetraselmis suecica dan Nannochloropsis sp.)
Kombinasi alga Jumlah Data Rata-rata Standar Deviasi
T+C 24 47.46 23.11
T+N 24 31.60 15.46
Selisih = T+C – T+N Estimasi Selisih = 15.86
26
Lampiran 7 Alur kegiatan penelitian dari sterilisasi alat dan bahan hingga ekstraksi lemak mikroalga
Berikut ini adalah alur kegiatan penelitian dari sterilisasi alat dan bahan hingga ekstraksi lemak mikroalga yang telah dilakukan.
Sterilisasi air laut dengan autoklaf Sterilisasi Peralatan di laminar air flow
Persiapan kultivasi mikroalga Kultivasi skala indoor
27
Pengamatan kepadatan mikroalga Penentuan spesies flokulan dan non-flokulan
Hasil panen mikroalga untuk bio-flokulasi skala 2 ml
Pemipetan mikroalaga untuk bio-flokulasi skala 2 ml
28
Hasil pemanenan mikroalga dengan teknik bio-flokulasi
Pemasukan mikroalga kering kedalam selongsong
29
RIWAYAT HIDUP
Penulis dilahirkan di Kabupaten Tulang Bawang Barat, Lampung pada tanggal 20 Mei 1992 dari ayah Sukardi dan ibu Sukinem. Penulis merupakan anak pertama dari dua bersaudara. Tahun 2010 penulis menyelesaikan pendidikan di SMAN 1 Terbanggi Besar, Kecamatan Terbanggi Besar, Kabupaten Lampung Tengah, Lampung. Tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis menjadi asisten mata kuliah Biologi Tumbuhan Laut pada tahun ajaran 2014/2015. Penulis juga pernah aktif dalam organisasi Himpuanan Mahasiswa Ilmu dan Teknologi Kelautan (HIMITEKA) tahun 2012 Divisi Kewirausahaan. Dalam rangka penyelesaian studi di Fakultas Perikanan