SKRINING AKTIVITAS ISOLAT AKTINOMISETES TANAH
ASAL INDONESIA PENGHASIL ANTIBAKTERI
DEDE SRI WAHYUNI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis dengan judul ”Skrining Aktivitas
Isolat Aktinomisetes Tanah Asal Indonesia Penghasil Antibakteri” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2014
RINGKASAN
DEDE SRI WAHYUNI. Skrining Aktivitas Isolat Aktinomisetes Tanah Asal Indonesia Penghasil Antibakteri. Dibimbing oleh MIRNAWATI B. SUDARWANTO dan PUSPITA LISDIYANTI
Wabah baru akibat infeksi bakteri zoonosis terjadi hampir setiap tahun serta berdampak serius terhadap kesehatan manusia dan ekonomi global. Penanggulangan terhadap permasalahan ini dapat dilakukan dengan mencari alternatif antibakteri baru yang relatif mudah diperoleh di alam, berkhasiat, dan aman. Aktinomisetes adalah bakteri tanah yang diminati sebagai sumber antibakteri baru. Penelitian ini bertujuan untuk memperoleh isolat aktinomisetes berasal dari tanah di Indonesia yang menghasilkan senyawa antibakteri penghambat bakteri Salmonella Typhimurium InaCC B.283, Escherichia coli InaCC B.285, Staphylococcus aureus InaCC B.286 dan Bacillus subtilis InaCC B.289.
Isolat aktinomisetes berumur 4 hari pada media ISP-2 diuji terhadap 4 bakteri uji. Setelah diinkubasi pada suhu 30°C selama 24 jam, semua isolat diamati dan diukur zona hambatnya yang ditandai dengan terbentuknya zona bening di sekitar potongan agar dan diukur. Pengujian terhadap 299 isolat memberikan hasil bahwa 48 isolat aktinomisetes dapat menghambat pertumbuhan bakteri uji. Dua isolat aktinomisetes yang reproducible membentuk zona bening pada 3 kali pengujian dan memiliki daya hambat terhadap keempat bakteri uji (spektrum luas) dipilih sebagai isolat untuk pengujian selanjutnya.
Kandidat aktinomisetes InaCC A.234 dan InaCC A.413 dengan zona hambat terbesar, diinkubasi dalam medium produksi cair selama 2, 3, 4, 5, 6 dan 7 hari pada suhu ruang (28-30°C) untuk mengetahui waktu optimal produksi antibakteri. Hasil skrining bioassay filtrat menunjukkan waktu optimum produksi antibakteri kedua isolat yaitu pada hari ke-5. Prosentase indeks hambat isolat aktinomisetes InaCC A.234 diatas 70% dan InaCC A.413 diatas 80% pada dosis 30
μl, suhu inkubasi 37°C sebanyak 2 kali ulangan. Isolat aktinomisetes InaCC A.413 menunjukkan zona hambat lebih besar dibandingkan dengan isolat aktinomicetes InaCC A.234. Masing-masing isolat aktinomisetes diidentifikasi dengan menggunakan analisa gen 16S rRNA sebagai Streptomyces triostinicus (InaCC A.234) dan S. ginsengisoli (InaCC A.413).
SUMMARY
DEDE SRI WAHYUNI. Screening Activities of Actinomycetes Isolat from Soil of Indonesia Origin to Produce Antibacterial. Supervised by MIRNAWATI B. SUDARWANTO and PUSPITA LISDIYANTI
New outbreaks caused by zoonotic bacteria occur almost every year with serious impacts for human health and global economy. Countermeasures against these problems can be solved by looking for new antibacterial alternatives which are relatively easy be found in nature, efficacy, and safety for patient. Actinomycetes are soul bacteria that demanded as a source of new antibacterials. The aims of this study was to obtain isolates of actinomycetes from Indonesia’s soil which producing antibacterial compounds that inhibit Salmonella Typhimurium InaCC B.283, Escherichia coli InaCC B.285, Staphylococcus aureus InaCC B.286 and Bacillus subtilis InaCC B.289.
Actinomycetes isolates on ISP-2 agar medium, at the age of 4 days against all of the four bacterial tested. After incubated at 30°C for 24 hours, each of the isolates was observed and measured for their ability to inhibit the four bacterial tested by the formation of a clear zone around the piece of agar. Screening on 299 isolates gave results that 48 isolates of actinomycetes inhibit tested bacteria. Two isolates actinomycetes that has higher inhibitory effects against all of the four bacterial tested (broad spectrum) in three repetitions were selected for further testing.
Actinomycetes InaCC A.234 and InaCC A.413 with the largest inhibition zones and broad spectrum were incubated on production liquid medium production for 2, 3, 4, 5, 6 and 7 days at 28-30°C to find out the optimal day of the production of antibacterial that inhibit 4 tested bacteria (broad spectrum). The results of bioassay screening filtrate showed that the two candidates actinomycetes have optimum inhibition index was obtained on the fifth day. Percentage rate of inhibition index of actinomycetes InaCC A.234 was more than 70% and InaCC
A.413 was more than 80% in doses 30 μL on 37°C temperature with two repetitions.
Actinomycetes isolates InaCC A.413 more reproducible with inhibition zone larger than the isolates aktinomicetes InaCC A.234. Actinomycetes isolates were identified using 16S rRNA gene sequencing as Streptomyces triostinicus (InaCC A.234) dan S. ginsengisoli (InaCC A.413).
© Hak Cipta milik IPB, tahun 2014
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebut sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
SKRINING AKTIVITAS ISOLAT AKTINOMISETES TANAH
ASAL INDONESIA PENGHASIL ANTIBAKTERI
DEDE SRI WAHYUNI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kesehatan Masyarakat Veteriner
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
x
Judul Tesis : Skrining Aktivitas Isolat Aktinomisetes Tanah Asal Indonesia Penghasil Antibakteri
Nama : Dede Sri Wahyuni
NIM : B251120081
Disetujui oleh
Komisi Pembimbing
Prof Dr med vet drh Hj Mirnawati B. Sudarwanto Ketua
Dr Puspita Lisdiyanti, M Agr Chem Anggota
Diketahui oleh
Ketua Program Studi
Kesehatan Masyarakat Veteriner
Dr med vet drh Denny Widaya Lukman, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji Syukur ke hadirat Allah SWT karena berkat rahmat dan hidayah-Nya sehingga tesis yang berjudul “Skrining Aktivitas Isolat Aktinomisetes Tanah Asal Indonesia Penghasil Antibakteri” berhasil diselesaikan dengan baik. Tesis ini disusun sebagai salah satu syarat menyelesaikan studi di program studi Magister Sains Sekolah Pascasarjana Institut Pertanian Bogor. Penelitian yang telah dilakukan selama 1 (satu) tahun bertujuan secara umum untuk memperoleh isolat aktinomisetes tanah asal Indonesia yang menghasilkan senyawa bioaktif antimikroba penghambat bakteri Salmonella enterica serovar Typhimurium (S. Typhimurium), Escherichia coli, Staphylococcus aureus dan Bacillus subtilis.
Penulis mengucapkan terima kasih dan penghargaan yang setinggi-tingginya kepada Ibu Prof Dr med vet drh Hj Mirnawati B. Sudarwanto dan Dr Puspita Lisdiyanti, MAgr Chem selaku pembimbing yang senantiasa sabar dan disiplin dalam memberikan bimbingan, arahan, nasehat, dorongan semangat serta rela mengorbankan waktunya bagi penulis sampai selesainya tesis ini. Ibu Dr drh Agustin Indrawati, M Biomed, selaku penguji luar komisi yang telah meluangkan waktunya untuk menelaah tesis ini. Bapak Dr med vet drh Denny Widaya Lukman selaku Kepala Program Studi Kesehatan Masyarakat Veteriner yang bersedia memberikan saran untuk perbaikan tesis ini. Badan SDM Kementerian Pertanian atas bantuan dananya kepada penulis. Laboratorium Mikrobiologi Terapan, Pusat Penelitian Bioteknologi LIPI, Cibinong (terutama Pamela, Mira dan Atika) yang telah menyediakan waktu dan semua media yang diperlukan sampai selesainya tesis ini. Penulis juga menghaturkan terima kasih kepada seluruh staf Badan Karantina Pertanian (Bapak drh Mulyanto MM, Bapak drh. Sujarwanto MM, Bapak drh Basir, Bapak drh Bambang, drh Fauziah, drh Maria, drh Yulisma, drh Tika, drh Adi, drh Suryadi dan Ibu Nanik) yang senantiasa siap mendengarkan keluh kesah penulis. Laboratorium BUTTMKP yang telah bersedia meminjamkan alatnya serta seluruh staf pengajar Kesehatan Masyarakat Veteriner yang senantiasa meberikan bimbingannya.
Tesis ini penulis persembahkan kepada kedua orang tua penulis yaitu Bapak Achmad, Ibu Nesah dan Kakak-kakakku tercinta yang tak henti memberikan dukungan dan doanya. Terima kasih penulis sampaikan kepada mahasiswa KMV angkatan 2012 (drh Risma, Nining, drh Vita, Melany, drh Gigih, drh Eko, drh Anis, drh Rastina, drh Murni, drh Nia, drh Loisa) dan drh Winda, drh Ika, drh Saimah, dan drh Novi yang selalu siap membantu. Terima kasih tiada tara kepada Robby Zulkarnaen dan keluarga yang selalu ada dengan bantuan, dukungan, dorongan dan perhatiannya serta semua pihak yang tidak dapat disebutkan satu persatu yang telah membantu penelitian ini.
Penulis menyadari bahwa karya ilmiah ini masih mempunyai keterbatasan. Kritik dan saran penulis harapkan dari semua pihak untuk perbaikan, dan semoga hasil penelitian ini dapat berguna bagi yang memerlukan.
Bogor, Juni 2014
DAFTAR ISI
Halaman
DAFTAR TABEL xvi
DAFTAR GAMBAR xvi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan 2
Manfaat 2
Hipotesis 2
2 TINJAUAN PUSTAKA 2
Bakteri 2
Aktinomisetes 4
Antibiotika 6
3 METODE PENELITIAN 8
Kerangka Konsep Penelitian 8
Waktu dan Tempat 9
Alat dan Bahan 9
Metode 9
Validasi Bakteri Uji (S. Typhimurium, E. coli, S. aureus dan
B. subtilis) 9
Peremajaan Aktinomisetes 10
Skrining Aktivitas Antibakteri Tahap Pertama 10
Ekstraksi Senyawa Aktif Aktinomisetes 11
Skrining Aktivitas Antibakteri Tahap Kedua 11
Identifikasi Aktinomisetes 11
4 HASIL DAN PEMBAHASAN 12
Peremajaan Isolat Aktinomisetes 12
Skrining Aktivitas Antibakteri Tahap Pertama 13
Skrining Aktivitas Antibakteri Tahap Kedua 15
Waktu Optimum Produksi Senyawa Antibakteri 18
Identifikasi Aktinomisetes 21
5 SIMPULAN 23
DAFTAR PUSTAKA 24
xvi
DAFTAR TABEL
Halaman 1 Isolat aktinomisetes yang reproducible pada empat bakteri uji 15
2 Indeks hambat (%) rata-rata aktivitas antibakteri filtrat aktinomisetes InaCC A.234 dengan waktu inkubasi yang berbeda pada keempat
bakteri uji dengan 2 kali ulangan 20
3 Indeks hambat (%) rata-rata aktivitas antibakteri filtrat aktinomisetes InaCC A.413 dengan waktu inkubasi yang berbeda pada keempat
bakteri uji dengan 2 kali ulangan 20
DAFTAR GAMBAR
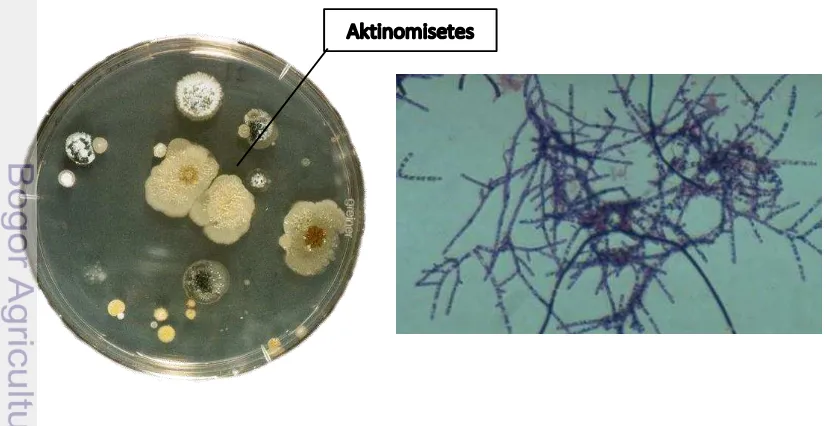
Halaman 1 Kiri: Koloni Aktinomisetes (Albrecht 2013), Kanan: Aktinomisetes
secara mikroskopis (Yepestis 2007) 5
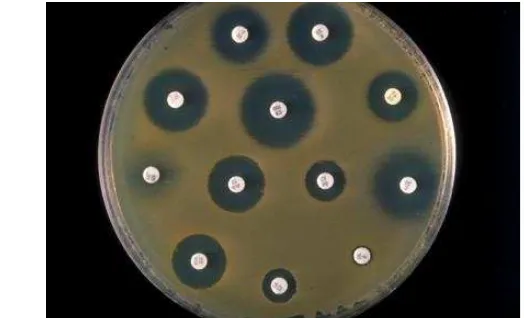
2 Zona hambat antibiotik (Todar 2009) 7
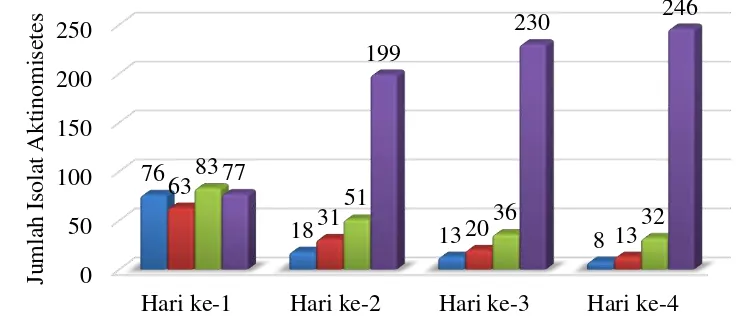
3 Grafik pertumbuhan aktinomietes 13
4 Skrining filtrat kultur aktinomisetes InaCC A.234, waktu inkubasi hari ke-3 pada bakteri uji uji S. Typhimurium InaCC B.283 (ST), E. coli InaCC B.285 (EC), S. aureus InaCC B.286 (SA), dan B. subtilis InaCC B.289 (BS). Kiri atas: cakram etil asetat (EA), kanan atas: supernatan aktinomisetes (SE), kiri bawah: kultur ekstrak etil asetat sebelum dipekatkan (PE) dan kanan bawah: filtrat kultur setelah dipekatkan (PR)
isolat aktinomisetes InaCC A.234. Diameter cawan petri: 90 mm 16
5 Skrining filtrat kultur aktinomisetes InaCC A. 413, waktu inkubasi hari ke-3 pada bakteri uji uji S. Typhimurium InaCC B.283 (ST), E. coli InaCC B.285 (EC), S. aureus InaCC B.286 (SA), dan B. subtilis InaCC B.289 (BS). Kiri atas: cakram etil asetat (EA), kanan atas: supernatan aktinomisetes (SE), kiri bawah: kultur ekstrak etil asetat sebelum dipekatkan (PE) dan kanan bawah: filtrat kultur setelah dipekatkan (PR)
isolat aktinomisetes InaCC A.413. Diameter cawan petri: 90 mm 16
6 Aktivitas antibakteri filtrat aktinomisetes InaCC A.234 dengan masa
inkubasi yang berbeda terhadap empat bakteri uji 18
7 Aktivitas antibakteri filtrat aktinomisetes InaCC A.413 dengan masa
inkubasi yang berbeda terhadap empat bakteri uji 19
8 Isolat aktinomisetes InaCC A.234 dalam media ISP-2 umur inkubasi 4 hari (kiri) dan morfologinya pada pewarnaan lactophenol cotton blue
xvii
9 Isolat aktinomisetes InaCC A.413 dalam media ISP-2 umur inkubasi 4 hari (kiri) dan morfologinya pada pewarnaan lactophenol cotton blue
1 PENDAHULUAN
Latar Belakang
Beberapa tahun terakhir, penyakit yang baru muncul (emerging disease) dan baru muncul kembali (re-emerging disease) banyak disebabkan oleh agen patogen yang bersumber dari hewan dan produk hewan. Berbagai macam spesies hewan domestik dan hewan liar, bertindak sebagai reservoir untuk agen patogen, seperti virus, bakteri maupun parasit (Meslin et al. 2000). Wabah baru yang disebabkan oleh patogen zoonosis (ditularkan dari hewan ke manusia) terjadi hampir setiap tahun dengan dampak serius terhadap kesehatan manusia dan ekonomi global (Daszak et al. 2004).
Penyakit-penyakit menular baru muncul sekitar 60.3% bersifat zoonosis, dengan mayoritas (71.8%) berasal dari satwa liar (Jones et al. 2008). Jones et al. (2008) juga menemukan bahwa 54.3% dari emerging infectious disease disebabkan oleh bakteri atau rickettsia. Sebagai contoh, bakteri Escherichia coli O157:H7 yang terdeteksi pada tahun 1982 ditularkan melalui makanan yang terkontaminasi dan menyebabkan wabah sindrom uremik hemolitik di Amerika Utara, Eropa dan Jepang. Wabah di Jepang pada tahun 1996 menyebabkan lebih dari 6 000 kasus pada anak-anak sekolah, dua orang diantaranya meninggal. Wabah lain di Skotlandia tahun 1996, menyebabkan 496 orang sakit, 16 orang diantaranya meninggal (WHO 1998). Wabah bakteri E. coli di Jerman tahun 2011 telah menginfeksi 2 400 orang dan menyebabkan 24 orang meninggal (BBC Indonesia 2011). Saat ini perang melawan kemunculan penyakit-penyakit bakterial tersebut merupakan kunci dari upaya-upaya kesehatan masyarakat secara nasional dan global. Salah satu upaya pencarian solusi dalam pengobatan dilakukan dengan mencari sejumlah besar antibiotik.
Aktinomisetes asal bakteri tanah diminati sebagai sumber antibakteri baru. Sekitar 8 000 antibiotika asal aktinomisetes telah ditemukan sejak tahun 1994, 80% dari genus Streptomyces dan 20% dari genus aktinomisetes lainnya (Zhao et al. 2004). Hayakawa (2003) juga menyatakan bahwa penghasil antibiotika terbesar adalah aktinomisetes (65%) diikuti dengan bakteri selain aktinomisetes (11%), fungi (23%) dan mikroalga (1%). Aktinomisetes merupakan mikroorganisme tanah yang umum dijumpai pada berbagai jenis tanah dengan populasi yang banyak di alam (Elberson et al. 2000). Aktinomisetes, terutama genus Streptomyces, mampu mensintesis metabolit sekunder seperti antibiotika, herbisida, pestisida dan anti-parasit (Oskay et al. 2004). Aktinomisetes hidup sebagai saprofit dan aktif mendekomposisi bahan organik, sehingga dapat meningkatkan kesuburan tanah (Nonomura dan Ohara 1971).
2
koleksi aktinomisetes tersebut, perlu dilakukan uji karakterisasi senyawa bioaktif yang dihasilkan, terutama yang memiliki sifat antibakteri.
Perumusan Masalah
Banyak penyakit yang baru muncul (emerging disease) disebabkan bakteri patogen zoonosis yang menyebabkan gangguan kesehatan masyarakat. Sebagian dari bakteri patogen tersebut bersifat resisten terhadap antibiotika. Hal ini merupakan masalah yang harus segera diatasi. Penanggulangan terhadap permasalahan ini dapat dilakukan dengan mencari alternatif antibakteri baru yang relatif mudah diperoleh di alam, berkhasiat, dan aman.
Tujuan
Penelitian ini bertujuan untuk memperoleh isolat aktinomisetes tanah asal Indonesia yang menghasilkan senyawa bioaktif antibakteri penghambat bakteri Salmonella enterica serovar Typhimurium (S. Typhimurium), Escherichia coli, Staphylococcus aureus dan Bacillus subtilis.
Manfaat
Diperoleh isolat aktinomisetes tanah asal Indonesia yang menghasilkan senyawa bioaktif antibakteri penghambat bakteri S. Typhimurium, E. coli, S. aureus dan B. subtilis.
Hipotesis
Hipotesis penelitian ini adalah beberapa isolat aktinomisetes tanah asal Indonesia sebagai hasil seleksi, mampu mensekresikan senyawa bioaktif antibakteri penghambat bakteri S. Typhimurium, E. coli, S. aureus dan B. subtilis.
2 TINJAUAN PUSTAKA
Bakteri
3
Produk pangan asal ternak berisiko tinggi terhadap cemaran bakteri yang berbahaya bagi kesehatan manusia. Beberapa penyakit yang ditimbulkan oleh pangan asal ternak adalah penyakit salmonellosis, dan penyakit akibat cemaran S. aureus dan E. coli (Supar dan Ariyanti 2005). Bakteri Salmonella sp., S. aureus dan E. coli biasanya ditularkan melalui daging unggas, telur, daging sapi, susu, sayur dan buah yang terkontaminasi air, tanah dan kotoran hewan (Djaafar dan Rahayu 2007). Bacillus subtilis tumbuh pada makanan dengan pH lebih dari 4 dengan kondisi aerob dan menyebabkan makanan berlendir (Todar 2011).
Beberapa bakteri umum yang merugikan antara lain:
1. Salmonella Typhimurium
Bakteri dari genus Salmonella merupakan bakteri Gram negatif penyebab infeksi. Salmonella yang masuk ke dalam tubuh akan menimbulkan gejala yang disebut salmonellosis. Gejala salmonellosis yang paling sering terjadi adalah gastroenteritis. Selain gastroenteritis, beberapa spesies Salmonella juga dapat menimbulkan gejala penyakit lainnya, seperti demam enterik yaitu demam tifoid dan demam paratifoid, serta infeksi lokal (Poeloengan et al. 2014)
Salmonellosis merupakan penyakit yang menular dari hewan ke manusia (zoonosis). Ternak yang rawan terhadap salmonellosis diantaranya sapi, domba, kambing, babi muda demikian juga dengan hewan kesayangan seperti anjing, kucing, kelinci dan hamster. Ayam adalah salah satu sumber penularan penting Salmonella (Poeloengan et al. 2014).
2. Escherichia coli
Escherichia coli merupakan bakteri batang Gram negatif, biasanya tidak berkapsul, motil, serta tidak membentuk spora (Supardi dan Sukamto 1999). E. coli terdeteksi memproduksi enzim extended spectrum β-lactamase (ESBL) (Locatelli et al. 2009). Berbagai definisi ESBL telah digunakan selama 20 tahun terakhir, berdasarkan spektrum, inhibisi, dan lain-lain. Tidak ada definisi yang sempurna, namun definisi yang diusulkan pada konferensi ESCMID, ESBL
adalah setiap β-laktamase, biasanya diperoleh dari mikroorganisme dan tidak selalu dihasilkan oleh semua spesies, yang diperoleh dengan cepat menghidrolisis, sehingga menyebabkan resistensi terhadap oxyimino-sefalosporin (kecuali carbapenems) atau β-laktamase mutan yang terdapat dalam satu keluarga, dengan kemampuan yang dapat ditingkatkan (Cornaglia et al. 2008).
4
lama daripada bakteri batang Gram negatif lainnya di lingkungan, kulit serta memungkinkan gen ESBL dapat bermutasi (Livermore dan Brown 2001).
Strain E. coli yang enteropatogenik (EPEC) menyebabkan penyakit enteritis. EPEC biasa menyerang organ-organ pencernaan, dapat menyebabkan meningitis pada bayi dan neonatus serta menyebabkan diare akut pada anak-anak berumur dibawah dua tahun. EPEC masuk ke tubuh melalui makanan dan minuman yang terkontaminasi (Juniastuti 2003; Pramudhita 2007).
3. Staphylococcus aureus
S. aureus merupakan bakteri Gram positif, berbentuk kokus dengan diameter 0.7-0.9 μm. Bakteri ini dapat hidup secara aerob maupun anaerob fakultatif, bersifat non motil dan tidak membentuk spora. S. aureus tumbuh optimum pada suhu 30-37°C dan pH 7.0-7.5. Komponen dinding sel terdiri atas peptidoglikan, asam teikoat dan protein (Sulistiyani 2006).
Perkembangan resistensi bakteri terhadap antibiotika sangat dipengaruhi oleh intensitas pemaparan antibiotika di suatu wilayah. Tidak terkendalinya penggunaan antibiotika cenderung meningkatkan resistensi bakteri yang semula sensitif (Wasitaningrum 2009). Uji sensitivitas antibiotika terhadap isolat S. aureus asal kasus mastitis di peternakan sapi Nongkojajar terbukti resisten terhadap penisilin dan ampisilin. Isolat S. aureus dari kasus mastitis di peternakan sapi di Surabaya juga telah terbukti resisten terhadap eritromisin (Effendi 2009). Staphylococcal gastroenteritis adalah radang saluran pencernaan akibat konsumsi makanan yang mengandung satu atau lebih enterotoksin yang dihasilkan oleh beberapa spesies atau strain Staphylococcus (Nugroho 2004).
4. Bacillus subtilis
B. subtilis merupakan bakteri Gram positif. B. subtilis berbentuk batang, ada yang tebal dan yang tipis. B. subtilis diketahui menyebabkan penyakit pada pasien imunodefisiensi (Oggioni et al. 1998). B. subtilis menghasilkan enzim subtilisin, yang dapat menyebabkan reaksi alergi atau hipersensitivitas pada kulit manusia dan reaksi alergi pada paru-paru (Pepys et al. 1969). B. subtilis juga dapat menyebabkan meningitis, endocarditis dan infeksi pada mata (Jawetz et al. 2001).
Aktinomisetes
5
aktinomisetes yang paling banyak dan terkenal menghasilkan antibiotika yaitu genus Streptomyces yang menghasilkan streptomisin sebagai obat anti-tuberkulosis (Pramudhita 2007). Klasifikasi aktinomisetes menurut Zhi et al. (2009) adalah:
Kingdom : Bacteria Filum : Actinobacteria Kelas : Schizomycetes Subkelas : Actinobacteridae Ordo : Actinomycetales
Aktinomisetes merupakan mikroorganisme uniseluler memiliki DNA yang kaya kandungan guanine dan citosyne pada kisaran 57%-75% (Lo et al. 2002). Aktinomisetes termasuk kelompok bakteri Gram positif, memiliki filamen, pleomorfisme dan tumbuh dalam koloni bercabang-cabang luas dengan hifa dasar yang pendek dan sempit serta miselium yang berdiameter kecil berukuran 0.05-2
μm (Dindal 1990). Bentuk koloni aktinomisetes bulat, elevasi timbul dan cembung, tepian rata dan tidak beraturan serta permukaan bertepung, licin, kasar, atau keriput. Warna koloninya juga bermacam-macam, bahkan ada koloni yang dapat mengubah warna medium serta menghasilkan bau menyerupai tanah yang disebut geomisin (Indriasari 1998).
Aktinomisetes umumnya bersifat aerob, namun ada beberapa famili yang dapat tumbuh secara anaerob seperti beberapa spesies dari famili Actinomycetaceae, Propionibactericeae, dan Sporichthceae (Miyadoh dan Otoguro 2004). Aktinomisetes umumnya ditemukan pada substrat alam, seperti tanah, air (Ambarwati dan Gama 2009), kompos, danau, lumpur, debu, serasah (Debananda et al. 2009), bahkan di lingkungan yang ekstrim sekalipun (Hamdali et al. 2008). Aktinomisetes sebagian besar ditemukan tersebar di tanah, karena tanah kaya dengan unsur hara. Dalam 1 gram tanah diperkirakan terdapat 1 juta aktinomisetes (Miyadoh dan Otoguro 2004).
6
Aktinomisetes biasanya tumbuh pada kedalaman tanah 11-15 cm dari permukaan tanah. Pada kedalaman ini, terdapat kombinasi pH dan kandungan air yang terbaik untuk pertumbuhannya. Aktinomisetes tumbuh baik pada pH 6-7.5, pada kisaran suhu 25oC-55oC (Miyadoh dan Otoguro 2004). Menurut Miyadoh dan Oguro (2004), pertumbuhan aktinomisetes pada media agar tergolong lambat. Koloni baru terbentuk pada media pertumbuhan setelah 4-20 hari inkubasi, bahkan ada yang baru tumbuh 1 bulan atau lebih (Suwandi 1993).
Aktinomisetes mengalami pembelahan morfologis kompleks dan mampu mensintesis metabolit sekunder. Pada pembelahan morfologis, spora aktinomisetes mengalami germinasi yang memanjang membentuk miselium vegetatif. Miselium akan membelah membentuk hifa (aerial hypha) yang dilanjutkan dengan membentuk dinding sel miselium dan spora matang (mature spora). Aktinomisetes juga memiliki kelebihan yaitu mensintesis antibiotika (Miyadoh 2003).
Kemampuan aktinomisetes untuk memproduksi senyawa metabolit menyebabkan aktinomisetes memegang peranan yang amat penting dalam industri farmasi. Aktivitas senyawa metabolit yang di hasilkan oleh aktinomisetes bersifat antagonis terhadap bakteri maupun jamur. Berdasarkan hal ini maka aktinomisetes banyak dikembangkan dan digunakan sebagai bahan obat dalam penanggulangan berbagai macam penyakit, baik pada manusia maupun hewan (Solanki et al. 2008). Pencarian bahan obat baru berbasis metabolit aktinomisetes terus dilakukan dengan berbagai macam metode pendekatan, baik berupa eksplorasi daerah khusus atau lingkungan unik, pengembangan metode isolasi, sampai pada teknik rekayasa genetika.
Keragaman dan jenis aktinomisetes sangat dipengaruhi oleh faktor kimia, fisika dan biologi lingkungan di sekitarnya. Faktor krusial dalam menemukan jenis aktinomisetes baru yang memiliki senyawa metabolit antimikrobial dilakukan melalui identifikasi lingkungan ekologi baru. Lingkungan ekologi baru diantaranya adalah lingkungan ekstrim seperti gurun pasir, dasar lautan, daerah es dan daerah hutan hujan tropis (Saadoun dan Gharaibeh 2003). Khusus untuk daerah hutan hujan tropis, merupakan target lingkungan ekologi yang sangat menarik dalam ekplorasi aktinomisetes penghasil senyawa metabolit tertentu. Hutan hujan tropis sangat memungkinkan ditemukannya keragaman dan populasi aktinomisetes yang tinggi dan membuka peluang besar untuk memperoleh metabolit baru (Nurkanto et al. 2010).
Antibiotika
Menurut Setyaningsih (2004), antibiotika sendiri merupakan substansi yang dihasilkan oleh organisme tertentu yang memiliki toksisitas selektif terhadap satu atau beberapa mikroba tujuan. Antibakteri adalah senyawa kimia yang dapat membunuh atau menghambat pertumbuhan bakteri. Toksisistas ini relatif lemah terhadap inangnya yaitu manusia, hewan dan tumbuhan (Sudirman 1996). Menurut toksisitasnya, antibiotika dibedakan menjadi bakteriostatik (menghambat pertumbuhan mikroorganisme) dan bakterisidal (membunuh mikroorganisme) (Pelczar dan Chan 1986).
7
b. Produk sintetik dengan struktur serupa dengan antibiotik di alam, c. Mengantagoniskan pertumbuhan atau kelangsungan hidup satu jenis
atau lebih mikroorganisme, d. Efektif dalam kadar rendah.
Ruang lingkup bakteri yang dapat dipengaruhi oleh antibiotika disebut dengan spektrum aksi antibiotika, yang terbagi menjadi 3 bagian. Pertama, antibiotika spektrum luas (broad spectrum) yaitu senyawa antibiotika yang dapat menghambat berbagai macam mikroba. Kedua, antibiotika berspektrum terbatas (limited spectrum) apabila zat antibiotika tersebut efektif menghambat organisme tunggal atau penyakit tertentu. Ketiga, antibiotika berspektrum sempit (narrow spectrum) yang hanya efektif menghambat sebagian bakteri Gram negatif atau bakteri Gram positif (Todar 2011).
Senyawa antibiotika dapat bekerja dalam beberapa cara (Sullia 1998), antara lain: 1) merusak dinding sel yang mengakibatkan sel lisis atau menghambat pembentukan komponen dinding sel pada sel yang sedang tumbuh; 2) mengubah permeabilitas membran sitoplasma sehingga menyebabkan kebocoran sel; 3) menghambat sintesis protein, 4) menghambat sintesis asam nukleat, dan 5) menghambat enzim di dalam sel.
Gambar 2 Zona hambat antibiotik (Todar 2009)
8
yaitu mengganggu fungsi DNA. Sedangkan bleomisin dan stretonigrin memecahkan ikatan rantai DNA. Mitramisin, kromomisin dan olivomisin berinteraksi dengan DNA (Hasim 2004).
Antibiotik yang dihasilkan oleh mikroorganisme bermanfaat dalam berkompetisi dengan mikroorganisme lain untuk memperoleh nutrisi. Sifat ini menyebabkan antibiotik dapat diaplikasikan dalam bidang medis dan pertanian. Di bidang pertanian, sifat antagonis dari antibiotik tidak dapat dibuktikan di dalam tanah karena produksinya yang sangat sedikit dan dapat menghambat pertumbuhan organisme penghasil antibiotik sendiri (Pramudhita 2007).
Pengujian aktivitas antibiotika dapat dilakukan melalui teknik difusi dan dilusi. Teknik dilusi dengan mencampur zat antibiotika pada medium dan diinokulasi dengan mikroba uji. Dasar pengamatannya adalah melihat tumbuh atau tidaknya mikroba uji tersebut. Pada teknik difusi, zat yang akan ditentukan aktivitas antibiotiknya berdifusi pada lempeng agar yang sebelumnya telah ditambahkan mikroba uji. Dasar pengamatannya adalah ada atau tidaknya zona hambatan pertumbuhan mikroba. Teknik difusi ada 3 macam yaitu cara parit (ditch), cara lubang atau cawan (hole/cup), dan cara cakram (disk) (Sudirman 1996). Pengukuran adanya kekuatan antibakteri menurut metode Davis Stout adalah: sangat kuat (daerah hambat 20 mm atau lebih), kuat (daerah hambat 10-20 mm), sedang (daerah hambat 5-10 mm), dan lemah (daerah hambat 5 mm atau kurang) (Hasim 2004).
Sulistiyani (2006) menemukan bahwa isolat aktinomisetes yang berhasil diisolasi merupakan penghasil antibiotik dengan aktivitas antibiotika bervariasi dari 1-44 mm. Isolat aktinomisetes menghambat pertumbuhan Micrococcus luteus, B. subtilis, S. aureus, E. coli, Saccharomyces cerivisiae, dan Candida albicans. Hasil seleksi awal menunjukkan isolat lebih banyak aktif terhadap Gram positif daripada Gram negatif. Pramudhita (2007) juga meneliti bahwa isolat aktinomisetes dengan metode dual culture mampu melawan bakteri patogen Xanthomonas oryzae, Listeria monocytogenes, Ralstonia solanacearum, dan Enterophatogenic Escherichia coli (EPEC). Senyawa antibakteri yang disekresikan isolat aktinomisetes tersebut merupakan suatu protein antibakteri seperti bakteriosin, stabil pada suhu 87°C selama 10 menit, menghasilkan beberapa pita protein dengan bobot molekul tinggi yaitu sebesar 57.78-641.44 kDa, dan aktivitasnya menurun oleh enzim proteinase K.
3 METODE PENELITIAN
Kerangka Konsep Penelitian
9
bakteri uji terstandar pada biakan hari ke-2, ke-3, ke-4, ke-5, ke-6 dan ke-7 untuk mengetahui waktu optimal aktinomisetes menghasilkan antibakteri.
a. Skrining aktivitas antibakteri tahap pertama: uji daya hambat aktinomisetes terhadap bakteri uji, yaitu S. Typhimurium InaCC B.283, E. coli InaCC B.285, S. aureus InaCC B.286 dan B. subtilis InaCC B.289. Skrining ini dilakukan sebanyak 3 (tiga) kali ulangan untuk memperoleh 2 (dua) kandidat aktinomisetes.
b. Uji optimasi: dua kandidat aktinomisetes diuji skrining aktivitas antibakteri tahap kedua menggunakan bakteri uji standar yang sama. Senyawa antibakteri diekstraksi pada biakan hari 2, 3, 4, 5, 6 dan ke-7 untuk mengetahui waktu optimal aktinomisetes menghasilkan senyawa antibakteri dengan 2 (dua) kali ulangan.
Waktu dan Tempat
Penelitian dilaksanakan di Laboratorium Mikrobiologi Terapan, Pusat Penelitian Bioteknologi, LIPI di Cibinong, pada bulan Juni 2013 sampai dengan Februari 2014.
Bahan dan Alat
Bahan hidup koleksi Laboratorium Mikrobiologi Terapan-Pusat Penelitian Bioteknologi LIPI yang digunakan dalam penelitian ini adalah isolat aktinomisetes (299 isolat asal tanah), S. Typhimurium InaCC B.283, E. coli InaCC B.285, S. aureus InaCC B.286 dan B. subtilis InaCC B.289. Media biakan dan bahan kimia yang digunakan adalah media humic acid-vitamin agar (HVA), media International Streptomyces Project-2 (ISP-2), nutrien agar, nutrien broth, media produksi (soluble starch 20 g/l, CaCO3 30 g/l, soy bean 20 g/l, glukosa 10 g/l, minyak goreng 10 ml/l), NaCl 0.9%, Mueller Hinton agar (Merck® 1.05437.0500), etil asetat pro analysis (Merck® 1.09623.2500), kit kapa PCR (primer 9F dan 1541R).
Alat-alat yang digunakan yaitu mikroskop, evaporator, inkubator, autoklaf, spektrofotometri, shaker, sentrifus, PCR, UV Transluminator, penangas air, dan alat-alat gelas lainnya.
Metode
Validasi dan Pembuatan Suspensi Bakteri Uji (S. Typhimurium, E. coli, S. aureus dan B. subtilis)
10
diperoleh dari NITE Biological Resource Center (NBRC). Bakteri uji divalidasi genus dan spesiesnya berdasarkan analisa gen 16S rRNA (Lisdiyanti et al. 2010).
Bakteri uji ditanam ke dalam nutrient broth dan diinkubasikan selama 24 jam pada suhu 35-37°C. Pertumbuhan bakteri uji terlihat pada perubahan media nutrient broth dari bening menjadi keruh. Bakteri uji dalam nutrient broth diukur transmittannya dengan spektrofotometri. Bakteri uji disuspensikan ke dalam larutan NaCl fisiologis steril 0.9%. Kemudian dilakukan pengenceran suspensi bakteri uji hingga diperoleh nilai transmittan 25% pada spektrofotometer, dengan panjang gelombang 580 nm (Depkes 2010). Sebagai blanko digunakan NaCl steril 0.9% (Johannes 2011). Jumlah sel bakteri yang telah sesuai ditambahkan pada lapisan atas (upper layer) agar Mueller Hinton.
Peremajaan Aktinomisetes
Sebanyak 299 isolat aktinomisetes diremajakan ke dalam media HVA dan diinkubasi pada suhu 30°C (Hayakawa dan Nonomura 1989). Koloni selanjutnya dimurnikan ke dalam media ISP-2 dan diinkubasikan pada suhu 30°C. Aktinomisetes umur 4 hari digunakan untuk seleksi aktinomisetes penghasil antibakteri terhadap empat bakteri uji.
Skrining Aktivitas Antibakteri Tahap Pertama
Prinsip dari metode bioassay secara difusi agar adalah menggunakan dua lapis media agar. Lapisan bawah terdiri dari 10-15 ml media Mueller Hinton. Setelah agar lapisan bawah mengeras, ditambahkan media agar lapisan atas yang terdiri dari 5 ml media Mueller Hinton dengan konsentrasi setengahnya dari lapisan bawah. Bakteri uji dengan nilai transmittan 25% pada panjang gelombang 580 nm yang diinokulasi, ditambahkan terlebih dahulu ke dalam lapisan atas dan dituang dalam cawan petri yang berisi lapisan bawah yang telah mengeras. Menurut Miyadoh dan Otoguro (2004) suspensi bakteri uji yang diinokulasikan ke dalam media Mueller Hinton lapisan atas adalah sebanyak:
0.1% biakan S. Typhimurium InaCC B.283; 0.2% biakan E. coli InaCC B.285;
0.1% biakan S. aureus InaCC B.286; dan 0.1% biakan B. subtilis InaCC B.289.
11
Ekstraksi Senyawa Aktif Aktinomisetes
Aktinomisetes yang memiliki zona hambat besar dan dapat menghambat empat bakteri uji (spektrum luas) diremajakan kembali dalam media ISP-2 dan diinkubasikan pada suhu 30°C. Koloni aktinomisetes ditanam dalam media produksi cair. Kultur aktinomisetes diinkubasikan di shaker dengan kecepatan 200-220 rpm pada suhu ruang (28-30°C) selama 2, 3, 4, 5, 6 dan 7 hari. Biakan aktinomisetes dalam media cair disentrifugasi dengan kecepatan 4 000 rpm, suhu 4°C selama 15 menit dan diambil supernatannya.
Fasa cair (supernatan) diekstraksi menggunakan etil asetat dengan perbandingan volume yang sama sebanyak 3 kali. Campuran dikocok dan didiamkan selama 30 menit sampai terbentuk fraksi cair dan fraksi etil asetat. Fraksi etil asetat yang diperoleh dievaporasi sampai pekat (sampai tersisa 1 ml). Filtrat ini digunakan untuk uji skrining tahap kedua. Pengamatan percobaan dilakukan dengan pengukuran zona hambat pertumbuhan (mm) bakteri uji oleh aktinomisetes dan diukur indeks hambatnya. Indeks penghambatannya dihitung dengan mengacu pada Valestine (2009):
Indeks hambat=diameter zona bening-diameter zona koloni/cakramdiameter zona bening
Skrining Aktivitas Antibakteri Tahap Kedua
Uji aktivitas antibakteri (bioassay) dilakukan dengan metode difusi agar menggunakan kertas cakram berdiameter 6 mm. Sebanyak 30 μL ekstrak sampel diteteskan dalam kertas cakram, kemudian dikeringkan dengan cara diangin-anginkan. Selanjutnya diletakkan pada permukaan agar yang telah diinokulasi bakteri uji. Kontrol yang digunakan yaitu etil asetat dan kontrol negatif.
Inkubasi dilakukan pada suhu 37°C selama 24 jam. Zona bening yang terbentuk diukur diameter zonanya (Prescott et al. 2002). Skrining tahap kedua terhadap kedua kandidat aktinomisetes diuji waktu optimal daya hambatnya pada hari ke 2, 3, 4, 5, 6, dan 7 dengan 2 (dua) kali ulangan.
Identifikasi Aktinomisetes
12
4 HASIL DAN PEMBAHASAN
Peremajaan Isolasi Aktinomisetes
Isolat aktinomisetes yang digunakan dalam penelitian ini berasal dari koleksi laboratorium Mikrobiologi Terapan, Pusat Penelitian Bioteknologi-LIPI hasil kerjasama antara Indonesia dan Jepang. Aktinomisetes ini merupakan isolat yang berasal dari serasah tanah dari beberapa kebun raya dan daerah lain di Indonesia. Total isolat aktinomisetes yang diisolasi mulai tahun 2003 sampai dengan tahun 2008 sebanyak 3 193 isolat. Lima metode isolasi yang digunakan yaitu metode Rehydration-Centrifugation, metode SDS-Yeast Extract, metode Dry Heating, metode Phenol, dan metode Oil-Separation. Semua isolat diidentifikasi sampai level genus berdasarkan analisa gen 16S rRNA. Hasilnya menunjukkan bahwa aktinomisetes tersebut termasuk ke dalam 19 keluarga dan 66 genus. Berdasarkan data molekuler yang diperoleh, sekitar 40% isolat memiliki kesamaan yang rendah dengan spesies aktinomietes yang sudah terdeteksi sebelumnya, yaitu kurang dari 98%. Bahkan beberapa genus menunjukkan jenis yang baru ditemukan (Lisdiyanti et al. 2010).
Beberapa daerah asal aktinomisetes di Indonesia antara lain Pucak (139 isolat), Liwa (104 isolat), S Wain (326 isolat), Baturraden (138 isolat), Lombok (137 isolat), Kutai (263 isolat), Kupang (377 isolat), Enrekang (476 isolat), Purwodadi (322 isolat), Jambi (175 isolat), Cibinong (263 isolat), Ekakarya (229 isolat) dan Kebun Raya Cibodas (244 isolat) (Lisdiyanti et al. 2010). Isolat disimpan dalam media gliserol 10%. Gliserol spesifik dan sensitif untuk aktinomisetes dan digunakan sebagai sumber karbon bagi aktinomisetes (Oskay et al. 2004).
Isolat yang digunakan pada penelitian ini adalah koleksi tahun 2004 dan beberapa koleksi tahun 2005 dengan total aktinomisetes yang diperiksa yaitu 299 isolat. Peremajaan aktinomisetes dilakukan untuk memperoleh koloni aktinomisetes murni. Aktinomisetes yang sudah ditumbuhkan dalam media HV agar kemudian diamati pertumbuhannya di bawah mikroskop. Isolat aktinomisetes murni kemudian dipindahkan dalam media 2. Aktinomietes dalam media ISP-2 diamati pertumbuhannya sampai dengan hari ke-4 sebelum aktinomisetes diuji aktivitas antibakterinya.
13
Gambar 3 Grafik pertumbuhan aktinomietes
Menurut Lo et al. (2002) aktinomisetes merupakan bakteri yang banyak ditemukan tumbuh pada tanah yang berhumus, memiliki miselium, menghasilkan spora dan tumbuh sangat lambat jika dibandingkan dengan bakteri lain pada umumnya. Strategi aktinomisetes dalam bersaing dengan mikroba lain adalah dengan menghasilkan enzim-enzim ekstraseluler dan senyawa antibiotik. Enzim ekstraseluler berfungsi untuk mendegradasi senyawa kompleks menjadi senyawa yang lebih sederhana sehingga dapat digunakan untuk pertumbuhannya. Senyawa antibiotik berfungsi untuk menghambat pertumbuhan mikroba kompetitor.
Skrining Aktivitas Antibakteri Tahap Pertama
Skrining aktivitas antibakteri dilakukan pada isolat aktinomisetes umur inkubasi empat hari. Hal ini sesuai dengan pertimbangan bahwa senyawa aktif diproduksi aktinomisetes terutama genus Streptomyces setelah memasuki fase stasioner (Sunaryanto 2011). Lebih lanjut menurut Sunaryanto (2011), senyawa aktif yang dihasilkan pada fase stasioner menunjukkan bahwa senyawa termasuk dalam metabolit sekunder. Profil fermentasi isolat Streptomyces sp. menunjukkan fase lag terjadi sampai dengan jam ke-8, fase pertumbuhan cepat (fase logaritma) terjadi pada selang waktu jam ke-9 sampai dengan jam ke-48, dan fase stasioner terjadi pada selang waktu jam ke-48 sampai dengan jam ke-144. Susilowati et al. (2007) juga menyatakan bahwa isolat aktinomisetes menghasilkan senyawa antibakteri secara optimum masing-masing setelah diinkubasi selama 72 jam dan 96 jam pada medium soybean meal cair. Hal ini sejalan dengan pernyataan Pelczar dan Chan (1986), bahwa metabolit sekunder (antibiotik, vitamin, dan hormon) dihasilkan oleh mikroorganisme pada akhir fase stasioner pertumbuhannya.
Secara garis besar metabolit yang dihasilkan oleh mikroba dibagi menjadi 2 golongan yaitu metabolit sekunder dan metabolit primer. Metabolit primer dihasilkan oleh dalam proses biokimia yaitu proses anabolik dan katabolik yang menghasilkan asimilasi, respirasi, transportasi, dan diferensiasi. Metabolisme primer telah ditunjukkan pada proses sintesis asam karboksilat melalui siklus Krebs,
0
Hari ke-1 Hari ke-2 Hari ke-3 Hari ke-4 76
14
asam amino, karbohidrat, lemak, protein dan asam nukleat, yang semuanya merupakan kebutuhan dasar untuk tetap dapat hidup dan terjadi pada semua mikroorganime
(Luckner 1990). Sedangkan metabolit sekunder adalah senyawa kimia yang
dihasilkan mikroba, tumbuhan, atau hewan yang tidak secara langsung terlibat dalam pertumbuhan, perkembangan, dan reproduksi. Metabolit sekunder merupakan produk spesifik dari setiap spesies (atau hanya ditemukan dalam bagian kecil dari spesies dalam grup filogenik). Tanpa senyawa ini maka organisme kurang dapat mempertahankan diri, meskipun tidak menyebabkan kematian secara langsung. Fungsi utama dari metabolit sekunder dalam organisme adalah sebagai fungsi ekologi yaitu sebagai alat pertahanan melawan predator, parasit, dan kompetisi antar spesies Contoh senyawa ini adalah antifungi, antibakteri, antikolesterol, enziminhibitor, dan lain-lain. (Prescot et al. 2002). Metabolit sekunder pada awalnya diasumsikan sebagai hasil samping atau limbah organisme sebagai akibat produksi metabolit primer yang berlebih. Namun seiring dengan perkembangan ilmu pengetahuan, terbukti bahwa metabolit sekunder diproduksi oleh organisme sebagai respon terhadap lingkungan yang tidak sesuai (Dewick 2002). Metabolit sekunder dihasilkan melalui jalur biosintesis metabolit primer. Jalur biosintesis metabolit sekunder lebih spesifik untuk setiap famili atau genus mikroba serta berhubungan terhadap mekanisme evolusi suatu spesies (Torssell 1997).
Skrining tahap pertama menunjukkan sebanyak 48 isolat dari 299 isolat aktinomisetes yang diuji terdapat zona hambat yang memiliki spektrum luas dan sempit. Tidak adanya pertumbuhan bakteri uji di sekitar isolat aktinomisetes setelah masa inkubasi 24 jam dengan diameter tertentu menunjukkan adanya aktivitas antibakteri (Arifuzzaman et al. 2010). Karakteristik zona hambat antibakteri pada 48 isolat aktinomisetes bervariasi dengan diameter mulai dari 6.1 mm sampai dengan 30.45 mm.
15
Tabel 1 Isolat aktinomisetes yang reproducible menghambat empat bakteri uji
Isolat Aktinomisetes
Zona Hambat Rata-rata (mm) (Indeks Hambat) S. Typhimurium
Sebanyak 39 isolat dari 48 isolat aktinomisetes menghambat pertumbuhan satu bakteri uji (spektrum terbatas), 3 isolat menghambat pertumbuhan 2 bakteri uji (spektrum sempit), 3 isolat yang menghambat pertumbuhan 3 bakteri uji (spektrum sempit), dan 3 isolat aktinomisetes menghambat pertumbuhan 4 bakteri uji (spektrum luas). Hal ini sesuai dengan pernyataan Todar (2011), ruang lingkup bakteri terbagi menjadi 3 bagian. Pertama, antibiotika spektrum luas (broad spectrum) yaitu senyawa antibiotika yang dapat menghambat berbagai macam mikroba. Kedua, antibiotika berspektrum terbatas (limited spectrum) apabila zat antibiotika tersebut efektif menghambat organisme tunggal atau penyakit tertentu. Ketiga, antibiotika berspektrum sempit (narrow spectrum) yang hanya efektif menghambat sebagian bakteri Gram negatif atau bakteri Gram positif.
Selanjutnya, dari 48 isolat diperoleh 32 isolat menghambat pertumbuhan bakteri uji Gram positif (S. aureus dan B. subtilis), 22 isolat menghambat bakteri uji Gram negatif (S. Typhimurium dan E. coli), dan 6 isolat menghambat bakteri uji Gram positif dan Gram negatif secara bervariasi. Hasil ini mengindikasikan bahwa bakteri uji Gram positif lebih sensitif dibandingkan dengan bakteri uji Gram negatif. Hal ini sesuai dengan pernyataan Pandey et al. (2004); Thakur et al. (2007); dan Kariminik at al. (2010).
Skrining Aktivitas Antibakteri Tahap Kedua
Pada tahun 1960-an beberapa peneliti telah mengembangkan metode difusi agar dengan memakai kertas cakram yang mengandung antibakteri dengan konsentrasi tertentu. Antibakteri tersebut berdifusi dalam media agar, dan menghambat pertumbuhan bakteri pada permukaan agar (Bauer et al. 1966).
Uji filtrat kultur aktinomisetes InaCC A.234 dan aktinomisetes InaCC A.413 dengan dua kali ulangan menunjukkan adanya penghambatan terhadap pertumbuhan empat bakteri uji. Penghambatan ini diasumsikan akibat adanya senyawa antibakteri yang disekresikan oleh aktinomisetes pada media agar. Semakin banyak senyawa antibakteri yang disekresikan ke media, semakin besar diameter zona hambatnya (Susilowati et al. 2007).
16
hambat antara 6.00 mm sampai dengan 43.15 mm. Hal ini dapat dilihat pada Gambar 4.
Gambar 4 Skrining filtrat kultur aktinomisetes InaCC A.234, waktu inkubasi hari ke-3 pada bakteri uji S. Typhimurium InaCC B.283 (ST), E. coli InaCC B.285 (EC), S. aureus InaCC B.286 (SA), dan B. subtilis InaCC B.289 (BS). Kiri atas: cakram etil asetat (EA), kanan atas: supernatan aktinomisetes (SE), kiri bawah: kultur ekstrak etil asetat sebelum dipekatkan (PE) dan kanan bawah: filtrat kultur setelah dipekatkan (PR) isolat aktinomisetes InaCC A.234. Diameter cawan petri: 90 mm.
Uji skrining aktivitas antibakteri isolat aktinomisetes InaCC A.413 menunjukkan semua kontrol etil asetat tidak terdapat zona hambat. Supernatan pada cakram menunjukkan zona hambat mulai dari 6.00 mm sampai dengan 9.50 mm. Ekstrak supernatan menunjukkan zona hambat mulai dari 6.00 mm sampai dengan 25.00 mm. Filtrat aktinomisetes InaCC A.413 menunjukkan aktivitas zona hambat antara 8.15 mm sampai dengan 48.00 mm. Hal ini dapat dilihat pada Gambar 5.
Gambar 5 Skrining filtrat kultur aktinomisetes InaCC A. 413, waktu inkubasi hari ke-3 pada bakteri uji uji S. Typhimurium InaCC B.283 (ST), E. coli InaCC B.285 (EC), S. aureus InaCC B.286 (SA), dan B. subtilis InaCC B.289 (BS). Kiri atas: cakram etil asetat (EA), kanan atas: supernatan aktinomisetes (SE), kiri bawah: kultur ekstrak etil asetat sebelum dipekatkan (PE) dan kanan bawah: filtrat kultur setelah dipekatkan (PR) isolat aktinomisetes InaCC A.413. Diameter cawan petri: 90 mm.
BS SA
EC ST
17
Senyawa aktif antibakteri kultur aktinomisetes InaCC A.234 dengan dosis
30 μl memiliki zona hambat yang lebih kecil pada ekstrak supernatan dibandingkan dengan supernatan sebelum diekstraksi. Sedangkan pada kultur aktinomisetes InaCC A.413 dengan dosis 30 μl memiliki zona hambat ekstrak supernatan yang lebih besar dibandingkan dengan supernatan sebelum diekstraksi. Menurut Pandey et al. (2004), senyawa aktif antibakteri Streptomyces sp. yang dihasilkan bisa menjadi sedikit apabila pelarut yang digunakan untuk ekstraksi tidak cocok. Pandey et al. (2004) juga menjelaskan bahwa konsentrasi daya hambat minimum tidak konstan terhadap agen patogen tertentu, karena dipengaruhi oleh sifat bakteri uji yang digunakan, ukuran inokulum, dan komposisi media kultur, waktu inkubasi, dan aerasi.
Zona hambat paling besar terlihat pada filtrat aktinomisetes InaCC A.234 dan aktinomisetes InaCC A.413. Kultur aktinomisetes diekstraksi dengan menggunakan etil asetat. Senyawa aktif antibakteri bersifat non-polar yang ditunjukkan dengan kemampuannya untuk berikatan dengan etil asetat. Menurut Harborne (1996), untuk memperoleh ekstrak yang mengandung senyawa non-polar dapat digunakan pelarut yang sifatnya non-polar seperti etil asetat. Kelebihan pelarut ini adalah bersifat spesifik untuk senyawa non-polar. Etil asetat dapat melarutkan air hingga 3% dan memiliki kelarutan 8% di dalam air pada suhu ruang. Kelarutannya meningkat pada suhu yang lebih tinggi. Kelemahannya, senyawa ini tidak stabil dalam air yang mengandung basa atau asam.
Isolat aktinomisetes pada skrining pertama dan kedua dapat menunjukkan aktivitas antibakteri yang berbeda. Beberapa isolat aktinomisetes dapat menunjukkan zona hambat yang lebih kecil, zona hambat lebih besar atau bahkan tidak menunjukkan zona hambat pada skrining tahap kedua. Hal ini karena media produksi cair yang tidak sesuai dengan isolat aktinomisetes. Menurut Thakur et al. (2007), pada uji skrining metabolit sekunder baru, isolat aktinomisetes dapat menunjukkan aktivitas antibakteri pada agar tetapi tidak dalam kultur cair. Pada uji filtrat aktinomisetes InaCC A.234 dan InaCC A.413 menunjukkan aktivitas antibakteri yang lebih besar pada skrining tahap kedua dibandingkan dengan tahap pertama. Dengan demikian, media produksi cair sesuai untuk pertumbuhan kedua kandidat aktinomisetes. Tahapan umum ekstraksi dan purifikasi antibiotik tertentu tidak dapat diterapkan untuk semua antibiotik, karena setiap antibiotik bersifat khas yang berhubungan dengan sifat fisika dan kimianya, misalnya sifat kelarutan, kesetabilan dalam suhu dan pH, dan juga tergantung dengan konsentrasinya dan komposisi medium kultur pada akhir fermentasi (Sudirman 1996).
Senyawa aktif antibakteri yang ditunjukkan oleh kedua isolat aktinomisetes terdapat pada filtrat supernatan yang diekstraksi oleh etil asetat. Senyawa aktif yang terdapat pada supernatan menunjukkan bahwa senyawa aktif antibakteri yang diproduksi bersifat ekstraselular (Sunaryanto 2011). Filtrat aktinomisetes juga memiliki daya hambat terhadap keempat bakteri uji Gram positif maupun Gram negatif, sehingga senyawa aktif diduga merupakan antibakteri yang bersifat spektrum luas (broad spectrum).
18
terhadap target fungsi seluler yang penting, prinsip dasarnya yaitu untuk menghambat pertumbuhan bakteri lain (Kohanski et al. 2010). Proses kompleks dimulai dengan interaksi fisik molekul dan target spesifik serta melibatkan perubahan biokimia, molekuler, dan struktural, yang bekerja pada beberapa target seluler seperti: 1) replikasi DNA, 2) sintesis RNA, 3) sintesis dinding sel, dan 4) sintesis protein (Procopioa et al. 2012).
Waktu Optimum Produksi Senyawa Antibakteri
Isolat aktinomisetes dengan umur tertentu yang menimbulkan zona hambat tertinggi dalam waktu tertentu diduga sebagai waktu optimum produksi senyawa antibakteri (Pelczar dan Chan 1986). Waktu optimum aktivitas antibakteri dilihat pada filtrat kultur aktinomisetes. Hasil uji menunjukkan bahwa produksi antibakteri isolat aktinomisetes InaCC A.234 dalam 6 hari waktu inkubasi yang berbeda lebih fluktuatif dibandingkan dengan isolat aktinomisetes InaCC A.413. Filtrat aktinomisetes InaCC A.234 hari ke-2 telah menghasilkan senyawa antibakteri. Zona hambat yang terbentuk pada isolat aktinomisetes InaCC A.234 hari ke-2 ini relatif lebih tinggi dibandingkan dengan isolat aktinomisetes InaCC A.413. Zona hambat tertinggi terjadi pada hari ke-5 masa inkubasi terhadap empat bakteri uji. Penurunan zona hambat isolat aktinomisetes InaCC A.234 terjadi pada waktu inkubasi hari ke-6 dan ke-7 seperti terlihat pada Gambar 6.
Gambar 6 Aktivitas antibakteri filtrat aktinomisetes InaCC A.234 dengan masa inkubasi yang berbeda terhadap empat bakteri uji
Filtrat aktinomisetes InaCC A.413 hari ke-2 juga telah menghasilkan senyawa antibakteri ditandai dengan adanya zona hambat pada uji bioassay menggunakan kertas cakram. Zona hambat optimum terjadi pada waktu inkubasi hari ke-3 untuk B. subtilis InaCC B.289, ke-4 untuk S. Typhimurium InaCC B.283 dan E. coli InaCC B.285, dan ke-5 untuk S. aureus InaCC B.286. Penurunan zona
0
Hari ke-2 Hari ke-3 Hari ke-4 Hari ke-5 Hari ke-6 Hari ke-7
Z
19
hambat terjadi pada waktu inkubasi hari ke-6 dan ke-7 seperti terlihat pada Gambar 7.
Gambar 7 Aktivitas antibakteri filtrat aktinomisetes InaCC A.413 dengan masa inkubasi yang berbeda terhadap empat bakteri uji
Gambar 7 menunjukkan bahwa terdapat hubungan antara produksi antibakteri dan waktu inkubasi. Produksi antibakteri meningkat secara bertahap seiring dengan meningkatnya masa inkubasi dan berakhir di hari ke-5.
Streptomyces yang memproduksi antibiotik dalam medium sintetis mencapai maksimum pada hari ke-5 masa inkubasi dengan suhu 30°C (Raytapadar dan Paul 2001; Atta et al. 2010; Dhananjeyan et al. 2010). Hasil ini juga sesuai dengan penelitian Susilowati et al. (2007) yang menunjukkan waktu optimum zona hambat aktinomisetes terjadi pada jam ke 72 dan 96 serta menurun pada jam ke 120.
Prosentase indeks hambat menunjukkan seberapa kuat senyawa antibakteri dapat menghambat bakteri uji yang tumbuh. Prosentase indeks hambat filtrat aktinomisetes InaCC A.234 dengan dosis 30 μl pada keempat bakteri uji paling tinggi terjadi pada hari ke-5 secara berturut-turut untuk S. Thypimurium, E. coli, S. aureus dan B. subtilis yaitu 73.91%, 76.28%, 77.96%, dan 86.10% seperti terlihat pada Tabel 2.
0 10 20 30 40 50
Hari ke-2 Hari ke-3 Hari ke-4 Hari ke-5 Hari ke-6 Hari ke-7
Z
ona
Ha
mbat
(mm)
20
Tabel 2 Indeks hambat (%) rata-rata aktivitas antibakteri filtrat aktinomisetes InaCC A.234 dengan waktu inkubasi yang berbeda pada keempat bakteri uji dengan 2 kali ulangan
Prosentase indeks hambat filtrat aktinomisetes InaCC A.413 dengan dosis
30 μl pada bakteri uji Gram negatif S. Thypimurium dan E. coli paling tinggi terjadi pada hari ke-4 secara berturut-turut yaitu 82.09% dan 84.40%. Indeks hambat paling tinggi pada bakteri uji Gram positif S. aureus terjadi pada hari ke-5 (83.61%) sedangkan B. subtilis pada hari ke-2 (87.30%) seperti terlihat pada Tabel 3. Menurut Omura (1992), suatu senyawa antibakteri dikatakan memiliki aktivitas tinggi, jika konsentrasi hambat minimum (KHM) terjadi pada kadar antibiotik yang rendah, tetapi mempunyai daya bunuh atau daya hambat yang besar.
Tabel 3 Indeks hambat (%) rata-rata aktivitas antibakteri filtrat aktinomisetes InaCC A.413 dengan waktu inkubasi yang berbeda pada keempat bakteri uji dengan 2 kali ulangan
21
Terdapat hipotesis yang menyatakan bahwa produksi antibiotik sangat terkait dengan sporulasi, yaitu suatu proses dalam kehidupannya yang dipicu oleh menipisnya nutrisi yang tersedia untuk kelangsungan hidupnya. Produksi antibiotik merupakan suatu rangkaian metabolik untuk menghambat pertumbuhan mikroba lain yang merupakan kompetitor bagi aktinomisetes dalam mendapatkan nutrisi yang terbatas. Pembentukan spora, yaitu suatu struktur yang dorman oleh aktinomisetes berfungsi agar mampu bertahan dalam kondisi ekstrim atau dalam kondisi lingkungan yang miskin akan nutrisi (Nurkanto et al. 2008).
Menurut Mangunwijaya dan Suryani (1994) metabolit sekunder diproduksi tidak berasosiasi dengan pertumbuhan sel, dan disintesis pada fase stasioner. Sebaliknya apabila terjadi pertumbuhan sel secara cepat maka pada saat itu terjadi represi antibiotik sintetase, sehingga mikroba tidak menghasilkan metabolit sekunder. Fase pertumbuhan menunjukkan glikolisis lebih banyak terjadi untuk pembentukan metabolit primer seperti asam organik, asam amino atau protein, dan asam lemak (Martin dan Demain 1980).
Pencarian metabolit baru terutama dari jenis aktinomisetes memerlukan sejumlah besar isolat (sampai dengan ribuan) dalam rangka menemukan senyawa antibakteri baru yang bermanfaat dalam dunia kedokteran. Pencarian banyak dilakukan di kebun raya dan serasah didasarkan pada hipotesis bahwa keragaman aktinomisetes dapat dipengaruhi oleh keragaman spesies tanaman dimana aktinomisetes tumbuh. Selain itu, tanaman yang berbeda menghasilkan berbagai jenis metabolit sekunder dan beberapa senyawa kimia beracun bagi mikroorganisme tanah termasuk aktinomisetes (Oskay et al. 2004).
Identifikasi Aktinomisetes
22
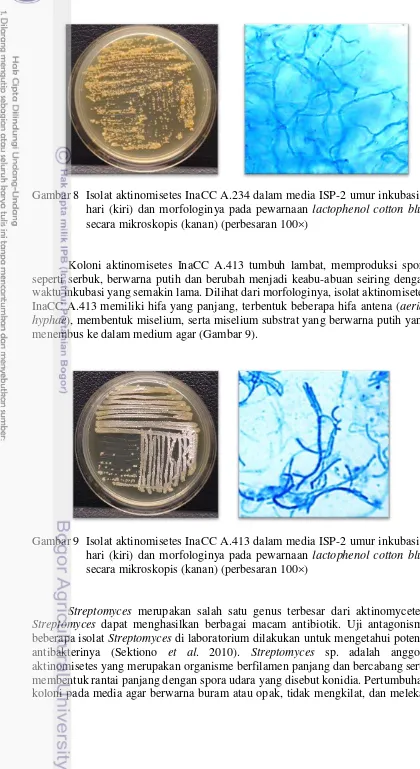
Gambar 8 Isolat aktinomisetes InaCC A.234 dalam media ISP-2 umur inkubasi 4 hari (kiri) dan morfologinya pada pewarnaan lactophenol cotton blue secara mikroskopis (kanan) (perbesaran 100)
Koloni aktinomisetes InaCC A.413 tumbuh lambat, memproduksi spora seperti serbuk, berwarna putih dan berubah menjadi keabu-abuan seiring dengan waktu inkubasi yang semakin lama.Dilihat dari morfologinya, isolat aktinomisetes InaCC A.413 memiliki hifa yang panjang, terbentuk beberapa hifa antena (aerial hyphae), membentuk miselium, serta miselium substrat yang berwarna putih yang menembus ke dalam medium agar (Gambar 9).
Gambar 9 Isolat aktinomisetes InaCC A.413 dalam media ISP-2 umur inkubasi 4 hari (kiri) dan morfologinya pada pewarnaan lactophenol cotton blue secara mikroskopis (kanan) (perbesaran 100)
23
kuat pada medianya. Streptomyces sp. secara umum menyerupai fungi dengan ciri-ciri membentuk miselium dengan karakter percabangan yang luas (Madigan dan Martinko 2006).
Menurut Awad et al. (2009) morfologi Streptomyces sp. dapat dilihat dari hifa antena, miselium substrat, bentuk permukaan koloni, dan warna. Namun demikian identifikasi melalui morfologi saja tidak menunjukkan hasil yang memuaskan, sehingga perlu dilakukan identifikasi secara genetik (Anderson dan Wellington 2001). Menurut Srinivasan et al. (1991), Streptomyces memiliki morfologi yang spesifik yaitu terdapat hifa antena dan miselium substrat, namun demikian hifa dan miselium ini dapat berubah bentuknya tergantung dari komposisi substrat.
Identifikasi dilakukan dengan menggunakan analisa gen 16S rRNA. Analisa partial sekuens 16S rRNA dari isolat aktinomisetes InaCC A.234 dan InaCC A.413 dibandingkan dengan sekuens seluruh bakteri yang ada didalam database Gen-Bank dengan menggunakan program BLAST yang diakses dari website http://www.ncbi.nlm.nih.gov/.BLAST.
Identifikasi dengan menggunakan analisa gen 16S rRNA diperoleh bahwa isolat aktinomisetes InaCC A.234 dan InaCC A.413 memiliki kekerabatan terdekat dengan Streptomyces sp., kelas Actinobacteria, ordo Actinomycetales, famili Streptomycetaceae, dan genus Streptomyces. Aktinomisetes yang dianalisa dengan 16S rRNA sequence menunjukkan isolat aktinomisetes InaCC A.234 termasuk spesies Streptomyces triostinicus strain CKM7 (homologi 99%) dan InaCC A.413 termasuk spesies S. ginsengisoli strain HBUM174543 (homologi 99%).
S. triostinicus menghasilkan triostin A (antibiotik antitumor), yang merupakan metabolit sekunder utama. Spesies ini juga menghasilkan echinomycin. Senyawa ini memiliki aktivitas spektrum yang luas sebagai antibiotik, antiviral dan antitumor (Praseuth et al. 2008).
Penelitian S. ginsengisoli sejauh ini masih sangat sedikit dengan literatur yang masih terbatas. S. ginsengisoli pernah diteliti untuk produksi enzim L-asparaginase, dengan beberapa manfaat aktivitasnya terutama antikanker (Deshpande et al. 2014).
5 SIMPULAN
Sebanyak 48 isolat dari 299 isolat aktinomisetes menunjukkan daya hambat terhadap empat bakteri uji. Kandidat aktinomisetes dengan zona hambat terbesar yaitu aktinomisetes InaCC A.234 dan InaCC A.413. Identifikasi dengan menggunakan analisa gen 16S rRNA diperoleh hasil yaitu spesies Streptomyces triostinicus (InaCC A.234) dan S.ginsengisoli (InaCC A.413).
Indeks hambat optimum isolat aktinomisetes terhadap empat bakteri uji
24
aktinomisetes InaCC A.234 pada kedua tahap skrining aktivitas antibakteri. Hasil ini menunjukkan bahwa isolat aktinomisetes InaCC A.413 lebih berpotensi sebagai kandidat penghasil antibakteri.
DAFTAR PUSTAKA
Albrecht A. 2013. Actinomycetes [Internet]. [diunduh 2013 Mei 17]. Tersedia pada: http://www.uni-giessen.de/~gh1484/actino.html.
Ambarwati, Gama AT. 2009. Isolasi aktinomisetes dari tanah sawah sebagai penghasil antibiotik. J Penel Sains Teknol. 10 (2): 101-111.
Anderson AS, Wellington EM. 2001. The taxonomy of Streptomyces and related genera. Int J Syst Evol Microbiol. 51 (3): 797–814.
Arifuzzaman M, Khatun MR, Rahman H. 2010. Isolation and screening of actinomycetes from Sundarbans soil for antibacterial activity. Af J Biotechnol. 9 (29): 4615-4619.
Atta HM, Bayoumi R, El-Sehrawi M, Aboshady A, Al-Humiany A. 2010. Biotechnological Application for Producing Some Antimicrobial Agents by Actinomycetes Isolates from Al-khurmah Governorate. Europ J Appl Sci. 2 (3): 98-107.
Awad HM, Shahed KYI, Nakkadi. EM. 2009. Isolation, screening and identification of newly isolated soil Streptomyces (Streptomyces sp.
NRC-35) for β-lactamase inhibitor production. World Appl Sci J. 7(5):637-646. Bauer AW, Kirby WMM, Sherris JC, Turck M. 1966. Antibiotic susceptibility
testing by a standardized single disk method. Am J Clin Pathol. 45: 493-496.
BBC Indonesia. 2011. Wabah E. coli Jerman mencapai puncaknya [Internet].
[diunduh 2014 Juni 09]. Tersedia pada:
http://www.bbc.co.uk/indonesia/dunia/2011/06/110608_germany.shtml.
Berg JM, Tymoczko JL, Stryer L. 2002. Protein structure and function. Edisi ke-5. Bethesda MD (US): WH Freeman.
Chater KF, Biró S, Lee KJ, Palmer T, Schrempf H. 2010. The complex extracellular biology of Streptomyces. FEMS Microbiol Rev. 34: 171–198.
Chong Y, Ito Y, Kamimura T. 2011. Genetic evolution and clinical impact in extended-spectrum beta-lactamase-producing Escherichia coli and Klebsiella pneumoniae. Infect Genet Evol. 11: 1499-1504.
Cornaglia G, Garau J, Livermore DM. 2008. Living with ESBLs. Clin Microbiol Inf. 14(s1): 1-2.
25
Debananda, Ningthoujam S, Sanasam S, Nimaichand S. 2009. Screening of actinomycete isolates from niche habitats in manipur for antibiotic activity. Am J Biochem Biotechnol. 5 (4): 221-225.
[Depkes] Departemen Kesehatan Republik Indonesia. 2010. Farmakope Indonesia. Jakarta (ID): Depkes.
Dewick PM. 2002. Medicinal Natural Products: a biosynthetic approach. New York (US): J Wiley. Hlm 8-24.
Deshpande N, Choubey P, Agashe M. 2014. Studies on Optimization of Growth Parameters for L-Asparaginase Production by Streptomyces ginsengisoli. Sci World J. 2014 (2014): 6.
Dhananjeyan V, Selvan N, Dhanapal K. 2010. Isolation, characterization, screening and antibiotic sensitivity of actinomicetes from locally (Near MCAS) collected soil samples. J Biol Sci. 10 (6): 514-519.
Dindal DL. 1990. Soil Biology Guide. Kanada (CA): J Willey.
Djaafar TF, Rahayu S. 2007. Cemaran mikroba pada produk pertanian, penyakit yang ditimbulkan dan pencegahannya. J Litbang Pertanian. 26 (2): 67-75.
Effendi MH. 2009. Resistensi antibiotika Staphylococcus aureus dari kasus mastitis sapi perah di beberapa daerah peternakan. Media Kedokteran Hewan. 24: 3.
Elberson MA, Malekzadeh F, Yazdi MT, Kameranpour N, Noori-Daloii MR, Matte MH, Shahamat M, Colwell RR, Sowers KR. 2000. Cellulomonas persica sp. and Cellulomonas iranensis sp., mesophilic cellulose-degrading bacteria isolated from forest soil. Int Jon Systematic Evol Microbiol. 50: 993-996.
Ganiswara SG. 1995. Farmakologi dan Terapi. Edisi IV. Jakarta (ID): Fakultas Kedokteran UI.
Goodfellow M, William ST, Mordarski M.1988. Actinomycetes in Biotechnology. New York (US): Academic Pr.
Hamdali H, Bouizgarne B, Hafidi M, Lebrihi A, Virolle MJ, Ouhdouch Y. 2008. Screening for rock phosphate solubilizing actinomycetes from moroccan phosphate mines. App Soil Ecol. 38 : 12-19.
Harborne JB. 1996. Metode Fisikokimia. Terbitan ke-2. Bandung (ID): ITB. Hlm. 47-158.
Hasim. 2004. Menanam rumput, memanen antibiotic [Internet]. [diunduh 2013
Februari 17]. Tersedia pada:
http://bidiversitylipi.org/modules.php?name=content&pa=showpage&pid= 32.
Hayakawa M. 2003. Selective Isolation of rare Actinomycete genera using pretreatment Techniques. Ipek Kurtboke, Editor. Quensland (AU): University of The sunshine Coast, Faculty of science.
26
Indriasari V. 1998. Eksplorasi Aktinomisetes dari sedimen ekosistem air hitam serta uji daya hambatnya terhadap Staphylococcus aureus dan Escherichia coli KCAM 11823 [internet]. [diunduh 2013 Februari 16]. Tersedia pada: http://www.icbb.org/indonesia/penelitian/penelitian_05.htm.
Jawetz E, Melnick GE, Adelberg CA. 2001. Mikrobiologi Kedokteran. Edisi ke-1. Penerjemah: Bagian Mikrobiologi Fakultas Kedokteran Universitas Airlangga. Surabaya (ID): Salemba Medika.
Johannes E. 2011. Uji toksisitas dan efektivitas metabolit sekunder dari hydroid Aglaophenia cupressina Lamoureoux sebagai antibakteri. Makassar (ID): Jurusan Biologi, Fakultas MIPA Universitas Hasanuddin.
Johnson JR, Urban C, Weissman SJ, Jorgensen JH, Lewis JS II, Hansen G, Edelstein PH, Robicsek A, Cleary T, Adachi J, Paterson D, et al. 2012. Molecular epidemiological analysis of Escherichia coli sequence type ST131 (O25:H4) and blaCTX-M-15 among extended-spectrum-beta-lactamase-producing E. coli from the United States, 2000 to 2009. AntimicrobiolAgents Chemother. 56: 2364–2370.
Jones KE, Patel NG, Levy MA, Storeygard A, Balk D, Gittleman JL, Daszak P. 2008. Global trends in emerging infectious diseases. Nature. 451 (7181): 990-993.
Juniastuti. 2003. Perbedaan pola hemaglutinasi Escherichia coli diaregenik (EPEC) dan ETEC) dengan Escherichia coli flora normal [tesis]. Surabaya (ID): Unair.
Kariminik A, Baniasadi F. 2010. Pageantagonistic activity of actinomycetes on some Gram negative and Gram positive bacteria. World Appl Sci J. 8 (7): 828-832.
Kohanski MA, Dwyer DJ, Collins JJ. 2010. How antibiotics kill bacteria: from targets to networks. Nat Rev Microbiol. 8: 423–435.
Lisdiyanti P, Otoguro M, Ratnakomala S, Lestari Y, Hastuti RD, Triana E, Katsuhiko A, Widyastuti Y. 2010. Actinokineospora baliensis sp. nov., Actinokineospora cibodasensis sp. nov. and Actinokineospora cianjurensis sp. nov., isolated from soil and plant litter. Int J Syst Evol Microbiol. 60 (10): 2331-2335.
Livermore DM, Brown DF. 2001. Detection of β-lactamase-mediated resistance. J Antimicrob Chemother. 48 (1): 59-64.
Lo CW, lai NS, Cheah HY, Wong NKI, Ho CC. 2002. Aktinomisetes isolated from soil samples from the crocker range Sabah dalam ASEAN review of biodiversity and environmental conversation (ARBEC) July-September 2002.
Locatelli C, Caronte I, Scaccabarozzi L, Migliavacca R, Pagani L, Moroni P. 2009. Extended-spectrum β-lactamase production in E. coli strains isolated from clinical bovine mastitis. Vet Res Commun. 33 (1): S141-S144.