iv By
Revy Susi Maryanti
Abstract
The research of titania silica composite base on titanium butoxide and rice husk with various silica dopant increased in titania has been done. The preparation sampel are pressing and calsination. Sample characterization include XRD, SEM, phocatalyst test and resistivity. The result of XRD for 1:1 ratio sample showed antase fase and the amorph structure. Result of SEM characterization showed change of microstructure of TiO2-SiO2 compatible to comparison of silica in titania and EDS indicated the elements in the TiO2-SiO2 composite namely are titannium, oksigen, silicon, and a litle bit carbon. The photocatalyst result showed over all of sample degradation are relative the same used in UV and visible light. The best degradation of photocatalyst test showed in 1:0,05 comparison in the methylene blue and the methylen orange. Sample resistivity decreases with the decreasing ratio of silica composition.
iii Oleh
Revy Susi Maryanti
ABSTRAK
Telah dilakukan penelitian tentang komposit titania silika berbasis titanium butoksida dan silika sekam padi dengan variasi penambahan dopan silika pada titania. Dengan prosedur preparasi sampel, pressing, kalsinasi. Karakterisasi menyangkut XRD, SEM-EDS, uji fotokatalis, dan resistivitas. Hasil XRD TiO2-SiO2 menunjukkan bahwa pada perbandingan 1:1 menghasilkan fasa anatase dan struktur amorf. Hasil SEM menunjukkan mikrostruktur TiO2-SiO2 berubah seiring dengan perbandingan TiO2 dan SiO2. Hasil EDS menunjukkan unsur-unsur yang teridentifikasi dari komposit TiO2-SiO2, yaitu titanium, oksigen, silikon dan sedikit karbon. Hasil uji fotokatalis menunjukkan bahwa secara keseluruhan daya urai/degradasi pada cahaya ultraviolet relatif sama dengan cahaya tampak. Penguraian terbaik terdapat pada perbandingan komposisi titania silika 1:0,05 baik menggunakan metilen biru maupun metilen jingga. Resistivitas sampel makin turun seiring dengan menurunnya perbandingan komposisi silika.
(Skripsi)
Oleh
REVY SUSI MARYANTI 0817041051
JURUSAN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
I. PENDAHULUAN
A. Latar Belakang
Nanoteknologi merupakan teknologi masa depan, tanpa kita sadari dengan nanoteknologi tersebut berbagai aspek persoalan dapat kita selesaikan (Anonim A, 2012). Pengembangan nanoteknologi yang demikian pesatnya, mendorong semua peneliti dari dunia akademik maupun industri berlomba untuk mewujudkan karya baru di dunia tersebut. Salah satu yang menarik adalah pengembangan metode sintesis nanopartikel yaitu teknologi yang berbasis pada material skala nanometer atau 10-9 m (Cao, 2003).
sifat optik khusus, aktivitas katalitik yang tinggi, dan sifat mekanik yang lebih kuat dibandingkan dengan material sejenis yang berukuran bulk (besar) (Siegel, 1991).
Salah satu nanopartikel yang telah lama menarik perhatian dunia penelitian dan industri adalah titanium dioksida atau titania (TiO2) merupakan oksida inorganik yakni bahan semikonduktor. Titania (TiO2) merupakan katalis yang memiliki banyak keunggulan, diantaranya harga ekonomis, non toksik dan yang paling penting adalah kestabilan dan keaktifannya ketika dikenai cahaya sehingga titania dikenal sebagai fotokatalis yang ramah lingkungan (Arief dkk, 2007). Manfaatnya terutama dalam menguraikan senyawa-senyawa organik berbahaya, seperti zat warna hasil limbah industri tekstil (Fatimah dkk, 2006). Serbuk titania yang dimurnikan secara sintetis dapat digunakan sebagai pewarna atau pigmen putih karena tingkat kecerahannya yang tinggi seperti dalam plastik, kertas, tinta dan pasta gigi. Selain itu, titania memainkan peranan penting untuk aplikasi sterilisasi (anti-bacterial) dan penghilangan bau, menyerap cahaya ultraviolet yang tinggi, sehingga dapat digunakan sebagai tabir surya (Anonim B, 2012 ).
yaitu wujud yang masih berupa larutan, tidak mudah menguap, dan harga yang relatif terjangkau dibanding bahan yang lain.
Namun, pada bahan titania sekarang ini sering ditemukan kendala secara komersil memiliki aktifitas fotokatalis yang masih rendah dan tidak selektif dalam menguraikan senyawa organik, seperti Degussa P-25 dengan komposisi yang terdiri dari 80% anatase dan 20% rutile. Artinya, jika kita menggunakan titania saja, maka hasil yang diinginkan dalam suatu proses reaksi penguraian senyawa organik berbahaya belum maksimal. Untuk mengatasi permasalahan tersebut, para peneliti melakukan modifikasi terhadap katalis TiO2 sehingga memiliki aktifitas fotokatalitik yang lebih tinggi. Modifikasi tersebut dilakukan dengan peningkatan melalui pengembangan pada material pendukung. Salah satu yang dapat digunakan adalah silika (SiO2) yang dapat meningkatkan stabilitas dan aktifitas dari titania bebas (Kunarti dan Wahyuni, 2009).
luas permukaan spesifik, homogenitas, dan kestabilan termal (Shinohara dan Kohyama, 2004).
Penambahan silika sol pada komposit titania silika dilakukan dengan metode sol gel, karena metode ini memiliki beberapa keunggulan diantaranya: dapat dilakukan pada temperatur rendah, fase pemisahan yang cepat, kemurnian yang lebih tinggi, hemat energi, homogenitas yang lebih baik, dan murah serta mudah dibandingkan dengan metode lain. Dengan kontrol metode sol-gel diharapkan akan membentuk komposit titania silika berukuran nano. Dengan mendesain partikel nano dalam komposit memungkinkan untuk meningkatkan sifat katalis dari fotokatalis. Partikel-partikel yang berukuran nano memiliki luas permukaan interaksi yang tinggi. Makin banyak partikel yang berinteraksi, makin tinggi kinerja dari katalis. Kemudian dapat diperoleh penambahan molekul terbaik dari silika sol terhadap pembuatan titania silika dengan metode sol gel tersebut.
B. Rumusan Masalah
Rumusan masalah pada penelitian ini adalah:
1. Bagaimana pengaruh penambahan dopan silika sekam padi terhadap pembuatan komposit titania silika berdasarkan analisis elementalnya? 2. Bagaimana pengaruh penambahan dopan silika sekam padi terhadap
pembuatan komposit titania silika berdasarkan struktur dan mikrostrukturnya?
4. Bagaimana pengaruh penambahan dopan silika sekam padi terhadap pembuatan komposit titania silika berdasarkan nilai resistivitasnya?
C. Batasan Masalah
Pada penelitian ini, pembahasan dibatasi pada pengaruh penambahan molekul silika sekam padi terhadap pembuatan komposit titania silika berdasarkan keadaan struktur dan mikrostruktur, analisis elemental, nilai resistivitas, serta pengujian sampel dalam reaksi fotokatalis berbasis titanium butoksida dan silika sekam padi dengan metode sol-gel.
D. Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah:
1. Mengetahui pengaruh penambahan dopan silika terhadap pembuatan komposit titania silika berdasarkan sifat elementalnya.
2. Mengetahui pengaruh penambahan dopan silika terhadap pembuatan komposit titania silika berdasarkan sifat struktur dan mikrostrukturnya. 3. Mengetahui pengaruh penambahan dopan silika terhadap pembuatan
komposit titania silika berdasarkan aktivitas fotokatalisnya.
4. Mengetahui pengaruh penambahan dopan silika terhadap pembuatan komposit titania silika berdasarkan nilai resistivitasnya.
E. Manfaat Penelitian
Adapun manfaat dari penelitian ini adalah:
2. Hasil penelitian ini diharapkan dapat dimanfaatkan sebagai dasar untuk mengembangkan sintesis komposit titania-silika berbasis silika sekam padi dengan metode sol-gel.
II. TINJAUAN PUSTAKA
A. Titanium Dioksida
1. Alasan Penggunaan Titanium Dioksida
Titanium dioksida (TiO2) merupakan logam transisi yang termasuk golongan IV pada tabel periodik (Anonim A, 2010), disebut juga titanium anhydride, anhidrida asam titanium, titanium oksida, atau titania yang biasanya tersedia dalam serbuk putih. Bahan memiliki banyak keunggulan dibandingkan bahan semikonduktor yang lainnya, sehingga menjadi perhatian dalam penelitian sebagai fotokatalis. Sifat-sifat tersebut diantaranya (Tarr, 2003):
a. mempunyai pita terlarang (band gap) yang sesuai untuk proses fotokatalis sehingga memudahkan terjadinya eksitasi elektron ke pita konduksi dan pembentukan hole pada pita valensi saat diinduksikan cahaya ultraviolet. b. Memiliki aktifitas fotokatalis yang lebih tinggi dibandingkan dengan
fotokatalis lain, seperti: ZnO, CdS, WO2, dan SnO2. c. Mampu menyerap sinar ultraviolet dengan baik.
d. Memiliki kestabilan kimia dalam interval pH yang besar (0 sampai 14). e. Tahan terhadap photodegradasi.
f. Bersifat inert dan tidak larut dalam reaksi baik secara biologis maupun kimia.
h. Memiliki kemampuan oksidasi yang tinggi. i. Relatif murah.
2. Struktur Titanium Dioksida
Di alam TiO2 memiliki beberapa struktur kristal, yaitu: anatase, rutil, dan brookite. Rutil adalah fasa keseimbangan semua suhu. Sedangkan anatase dan brookite adalah fasa metastabil yang dapat diubah menjadi rutil dengan proses pemanasan (Greenwood and Earnshaw, 1984). TiO2 memiliki beberapa fasa tambahan sebagai bentuk tegangan tinggi, seperti monoklinik baddelite dan
orthorombik α-PbO2 keduanya ditemukan di Ries Crater, Bavaria (Goresy et al, 2001). Berikut adalah beberapa bentuk modifikasi fasa yang ditunjukkan Tabel 2.1.
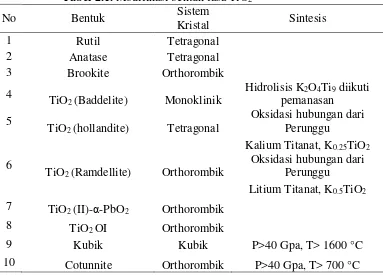
Tabel 2.1. Modifikasi bentuk fasa TiO2
No Bentuk Sistem Kristal Sintesis
1 Rutil Tetragonal
2 Anatase Tetragonal
3 Brookite Orthorombik
4 TiO2 (Baddelite) Monoklinik Hidrolisis K2O4Ti9 diikuti pemanasan 5
TiO2 (hollandite) Tetragonal
Oksidasi hubungan dari Perunggu
Kalium Titanat, K0.25TiO2 6 TiO2 (Ramdellite) Orthorombik Oksidasi hubungan dari Perunggu
Litium Titanat, K0.5TiO2 7 TiO2 (II)-α-PbO2 Orthorombik
8 TiO2 OI Orthorombik
9 Kubik Kubik P>40 Gpa, T> 1600 °C
Pada Tabel 2.1 TiO2 memiliki 8 modifikasi bentuk fasa, diantaranya: anatase, rutil, brookite merupakan fasa yang dapat diproduksi secara sintetis (monoklinik,
orthorombik, tetragonal) dan 5 bentuk tekanan tinggi seperti: α-PbO2, baddelite, cotunnite, orthorombik IO, dan fasa kubik.
Rutil dan anatase merupakan fasa yang sering diproduksi. Rutil (rutilus, bahasa Latin berarti merah) memiliki komposisi 10% besi dan sejumlah niobium serta tantalum. TiO2 struktur rutil dan anatase berukuran nanometer dapat dihasilkan dengan unit sel yang berbentuk tetragonal melalui proses hidrotermal. Perbedaannya hanya terletak pada suhu serta waktu pengovenan (Asrori dkk, 2000).
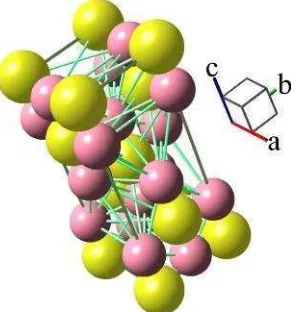
pada 500 °C. Pada suhu 700 °C mulai terbentuk kristal rutil dan mulai terjadi penurunan luas permukaan serta pelemahan aktivitas fotokatalisis secara drastis (Tjahjanto dan Gunlazuardi, 2001). Untuk melihat lebih jelas lagi perbedaan dari struktur anatase dan rutil dapat dilihat pada Gambar 2.1.
Gambar 2.1. Struktur kristal TiO2 (anatase). Model TiO2 yang digunakan adalah TiO2 sistem tetragonal dengan parameter kisi a = b = 3,78 Å dan c = 9,52 Å (Murakami et al, 2001).
Gambar 2.1 menunjukkan struktur kristal TiO2 fasa anatase. Ti4 ditunjukkan pada bulatan besar yang warna kuning dan O2 ditunjukkan pada bulatan kecil yang berwarna ungu. Sifat kristal anatase ini membentuk delapan tetragonal dipiramida berpusat badan dengan nomor space group 141.
Gambar 2.2 menunjukkan struktur kristal TiO2 fase rutil, Ti4
ditunjukkan bulatan besar berwarna kuning dan O2
oleh bulatan kecil berwarna ungu. Struktur kristal rutil pertama kali ditemukan oleh Vegard pada tahun 1916 (Thomas dan Zhou, 1992). Setiap atom titanium dikelilingi oleh 6 atom oksigen pada enam sudut yang teratur dan setiap atom oksigen dikelilingi tiga atom titanium pada sudut sama sisi dengan nomor space group 136 (Swope et al, 1995).
Perbedaan struktur kristal ini menyebabkan perbedaan densitas dan struktur pita elektronik (Linsebigler, 1995), yang telihat pada Tabel 2.2
Tabel 2.2. Perbedaan struktur kristal anatase dan rutil Faktor Perbedaan Sistem Kristal
Anatase Rutil
Energi celah/Eg (eV) 3,2 3
Massa jenis/ρ (g/cm3) 3,894 4,25
Jarak Ti-Ti (Å) 3,97 dan 3,04 3,57 dan 2,96 Jarak Ti-O (Å) 1,934 dan 1,980 1,949 dan 1,980
3. Aplikasi TiO2
Aplikasi lain TiO2 dapat juga diperoleh dengan cara sintesis tunggal kristal, diantaranya:
a. TiO2 dalam larutan atau suspensi dapat digunakan untuk membelah protein yang berisi asam amino prolin (Jones et al, 2007).
b. TiO2 tidak kompatibel dengan agen pereduksi kuat dan asam kuat. Reaksi yang hebat atau pijar terjadi dengan logam cair yang sangat elektropositif, misalnya kalsium, magnesium, kalium, natrium, seng dan lithium.
B. Fotokatalisis
1. Proses Fotokatalisis
Fotokatalisis didefinisikan sebagai fotoreaksi (reaksi yang memanfaatkan absorbsi energi cahaya ultraviolet (UV) yang dipercepat oleh adanya katalis untuk menurunkan energi aktivasi sehingga mempercepat proses reaksi. Namun, intensitas sinar UV di sinar matahari sangat kecil (yaitu sekitar 5%) jadi membutuhkan waktu lebih lama. Reaksi fotokatalisis merupakan sistem reaksi heterogen karena limbah yang diproses berfasa cair sedangkan katalis yang digunakan berfasa padatan. Seperti sistem katalis heterogen pada umumnya, pada fotokatalisis terjadi tahap-tahap sebagai berikut.
a. Perpindahan massa reaktan dari fasa curah ke permukaan katalis (difusi eksternal).
b. Permindahan massa reaktan dari permukaan katalis ke pori-pori katalis (difusi internal).
e. Desorpsi produk.
f. Perpindahan massa dari pori-pori ke permukaan katalis. g. Perpindahan massa produk ke fasa curah.
Tiga komponen yang perlu ada untuk terjadinya suatu reaksi fotokatalisis: a. Foton sebagai sumber energi
b. Permukaan katalis (biasanya bahan semikonduktor) c. Senyawa oksidasi yang kuat (biasanya O2).
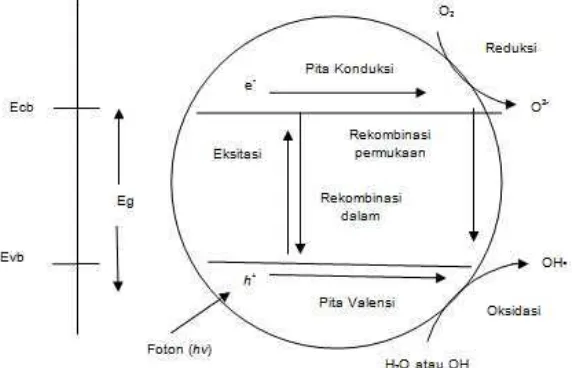
Secara umum, fenomena fotokatalisis pada permukaan TiO2 dapat dijelaskan dengan gambaran reaksi kimia sebagai berikut.
hυ + TiO2 TiO2 + hvb+ + ecb- (1)
Ketika TiO2 dikenai cahaya UV dengan energi hv mengakibatkan eksitasi elektron dari pita valensi ke pita konduksi, dan meninggalkan lubang pada pita valensi (hvb+).
ecb- etr- dan hvb+ htr+ (2)
Sebagaian elektron pada pita konduksi (ecb-) dan lubang pada pita valensi terjebak pada permukaan semikonduktor.
H2O OH- + H+
htr+ + OH- OH• (3.a)
lubang pada permukaan semikonduktor (htr+) mengoksidasi air atau ion OH -membentuk radikal hidroksil yang berperan sebagai agen detoksikasi.
Elektron pada permukaan semikonduktor (etr-) menangkap oksigen membentuk ion superperoksida (O2-) yang dapat menguraikan senyawa polutan.
Keterangan:
Ecb = energi pita konduksi Evb = energi pita valensi
Gambar 2.3. Peristiwa eksitasi dan de-eksitasi pada TiO2 di bawah sinar UV (Arutanti dkk, 2009).
Pada Gambar 2.3 menjelaskan bila suatu semikonduktor dikenai cahaya (foton) sebesar hv dengan h adalah konstanta Planck (6,63 x 10-34 Js) dan v adalah frekuensi, maka (e-) pada pita valensi akan mengabsorpsi energi foton tersebut
2. Teknologi Pemanfaatan Fotokatalis
Air merupakan sumber kehidupan. Namun, sumber kehidupan tersebut telah mengalami penurunan kualitas dikarenakan pencemaran atau degradasi air dimana-mana. Untuk mengatasi hal tersebut, salah satunya dilakukan dengan penjernihan air limbah, dengan proses penyaringan, sedimentasi, filtrasi, dan disinfektansi. Meskipun efektif, namun cara tersebut relatif mahal untuk sistem dan material yang digunakan (Widiyanti dkk, 2004).
Teknologi pemanfaatan fotokatalis sebagai fotodegradasi polutan menggunakan material oksidasi fotokatalis merupakan cara yang tepat untuk mengurangi degradasi air. Oksidasi fotokatalis merupakan proses partikel semikonduktor di dalam suspensi air limbah menangkap cahaya UV dan selanjutnya energi ini digunakan untuk menghasilkan pasangan elektron dan lubang. Pasangan elektron-lubang ini selanjutnya berdifusi ke permukaan partikel yang kemudian mengoksidasi dan mereduksi polutan-polutan beracun (Subiyanto dkk, 2009).
Keuntungan dari oksidasi fotokatalis adalah mengubah senyawa-senyawa berbahaya dan beracun di dalam air menjadi tidak berbahaya, seperti karbondioksida (CO2) dan air (H2O) (Tian et al, 2009). Selanjutnya, proses katalis dapat berlangsung pada suhu kamar, kebutuhan bahan kimia sangat sedikit dan relatif lebih murah, serta dapat mengolah limbah logam berat (reduksi) dan limbah organik (oksidasi) secara simultan.
tersebut. Penelitian lain dengan sistem penjernih menggunakan cahaya UV dengan panjang gelombang 254 nm telah dapat menghilangkan 99,99% bakteri patogen dan 99,99% virus (Abbaszadegan, 1997).
3. Faktor-Faktor yang Mempengaruhi Aktivitas Fotokatalis
Beberapa faktor yang mempengaruhi aktivitas fotokatalisis (Tarr, 2003):
a. Bentuk kristal : Struktur anatase lebih aktif dibandingkan rutil. Keaktifan ini disebabkan oleh pita energi anatase lebih besar daripada rutil, dan struktur anatase yang relatif lebih renggang dibandingkan rutil.
b. Sifat optik absorpsi foton yang dipengaruhi oleh porositas partikel dan
panjang gelombang (λ). TiO2 mengabsorpsi 60% foton pada 365 nm, tapi 100% foton pada 254 nm.
c. Modifikasi TiO2 untuk mengoptimalkan fotokatalisis. Contohnya, doping TiO2 dengan Nitrogen mengakibatkan absorpsi pada spektrum cahaya tampak (400-850 nm).
C. Silika
1. Sumber Silika
silika terbesar yaitu sebesar 94 – 96 % (Siriluk dan Yuttapong, 2005). Selain itu, jumlahnya yang melimpah khususnya di Lampung, berkisar 2,3 juta ton/tahun. Kemudahan perolehan silika dari sekam padi dapat dilakukan dengan sederhana dan biaya relatif murah dibandingkan dengan silika mineral, yakni dengan metode alkalis dan pengabuan. Metode alkalis telah dilakukan (Daifullah et al, 2003; Cheng dan Chang, 1991; Riveros and Garza, 1986), yang didasarkan pada kelarutan silika amoprh yang besar dalam larutan alkalis dan pengendapan silika terlarut dalam asam, sehingga dapat diperoleh silika dalam bentuk sol, yang dapat digunakan langsung dengan metode sol-gel. Metode pengabuan, yang didasarkan perubahan tingkat pembentukan struktur silika pada proses pembakaran dengan suhu terkontrol.
2. Silika Sekam Padi
Sekam padi bagian terluar atau lapisan kerak pembungkus kaopsis dari butir padi yang terdiri dari dua belahan saling bertautan yang disebut lemna dan palea. Komponen zat anorganik yang terkandung pada sekam padi paling dominan adalah unsur silikon (Si) dan disebut juga silikon oksida (SiO2). Dengan diketahui komposisi sekam padi, maka silika dapat diperoleh dengan mudah dari sekam padi terutama melalui metode sol-gel.
Tabel 2.3. Komposisi kimia sekam padi (% berat) pada keadaan kering
No Unsur % Berat
1 Karbon 41,440
2 Hidrogen 4,940
3 Oksigen 37,320
4 Silikon 14,660
5 Nitrogen 0,570
6 Sulfur 0,300
7 Fosfor 0,070
8 Natrium 0,040
9 Pottasium 0,590
10 Kalsium 0,060
11 Besi 0,006
12 Magnesium 0,003
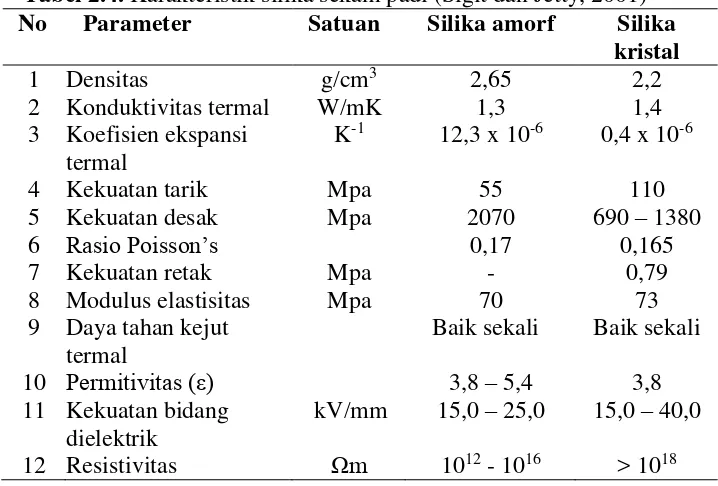
Silikon yang terkandung dalam sekam padi merupakan golongan VI yang memiliki sifat fisik, yaitu berwarna putih dalam bentuk padat dengan berat jenis 2,6 g/cm3. Karakteristik silika diperlihatkan dalam Tabel 2. 4.
Tabel 2.4. Karakteristik silika sekam padi (Sigit dan Jetty, 2001) No Parameter Satuan Silika amorf Silika
kristal
1 Densitas g/cm3 2,65 2,2
2 Konduktivitas termal W/mK 1,3 1,4
3 Koefisien ekspansi termal
K-1 12,3 x 10-6 0,4 x 10-6
4 Kekuatan tarik Mpa 55 110
5 Kekuatan desak Mpa 2070 690 – 1380
6 Rasio Poisson’s 0,17 0,165
7 Kekuatan retak Mpa - 0,79
8 Modulus elastisitas Mpa 70 73
9 Daya tahan kejut termal
Baik sekali Baik sekali
10 Permitivitas (ε) 3,8 – 5,4 3,8
11 Kekuatan bidang dielektrik
3. Struktur Silika
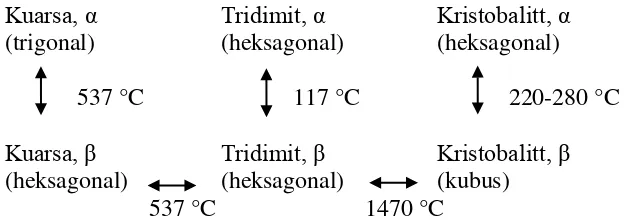
Pada umumnya silika memiliki sifat amorph sampai suhu dibawah 800 °C, sehingga silika amorf sangat baik digunakan sebagai bahan komposit untuk bahan katalis dan kereaktifannya dipengaruhi temperatur 550-700 oC dan keraktifan menurun dengan naiknya temperatur di atas 800 oC dengan tekanan di atas 1 atm, sehingga kenaikan temperatur tersebut dapat meningkatkan kristalinitas (keramik) dan menyebabkan struktur kristal menjadi berubah, seperti skema perubahan berikut (Worrall, 1986):
Kuarsa, α Tridimit, α Kristobalitt, α
(trigonal) (heksagonal) (heksagonal)
537 °C 117 °C 220-280 °C
Kuarsa, β Tridimit, β Kristobalitt, β
(heksagonal) (heksagonal) (kubus)
537 °C 1470 °C
Gambar 2.4. Skema perubahan struktur silika akibat perubahan suhu.
Kuarsa yang berada dalam dua modifikasi adalah fasa rendah (α-kuarsa) dan fasa
tinggi (β-kuarsa). Pada suhu kurang dari 573 °C merupakan kuarsa fasa rendah yang kemudian berubah menjadi fasa tinggi pada suhu 867 °C. Fasa yang stabil mencapai tridimit pada suhu 1470 °C. Kristobalit mempunyai jangkauan stabil suhu lebur pada suhu 1730 °C yang kemudian berubah menjadi cairan (liquid).
4. Aplikasi Silika
seperti pengolahan karet, textil kertas, dan elektronik. Semakin berkembangnya teknologi, aplikasi silika juga makin dikembangkan pada skala nanometer. Dengan ukuran yang sedemikian kecil, maka makin banyak kegunaan yang diperoleh, seperti pada industri pengolahan ban, cat, kosmetik, elektronik, dan keramik, digunakan juga sebagai agen penguat (Saowaroj et al, 2001), silika dalam fasa kaca sebagai penyimpan hidrogen (Seyed et al, 2011), untuk menurunkan BOD (biochemical oxygen demand) yaitu kebutuhan oksigen biologis (Andres et al, 2009) dan COD (chemical oxygen demand) yaitu kebutuhan oksigen kimiawi (Piyawan et al, 2009) serta limbah cair (Adam et al, 2011).
D. Komposit Titania Silika
2009). Pelapisan komposit silika, titania, dan tinuvin pada kain katun dapat berperan sebagai pelindung tekstil serat katun dari sengatan radiasi sinar UV dengan menggabungkan absorber UV yaitu absorber organik dan anorganik untuk mendapatkan sifat perlindungan UV yang lebih optimal. Salah satu faktor yang berpengaruh dalam produksi hidrogen adalah adsorpsivitas air di permukaan fotokatalis, akan tetapi daya adsorpsivitas TiO2 terhadap air masih kecil. Selain itu, TiO2 hanya aktif terhadap sinar UV sedangkan sinar UV dari sinar matahari hanya sampai di permukaan bumi sekitar 5%. Untuk itu perlu dilakukan penelitian mengenai modifikasi fotokatalis TiO2 yang memiliki kemampuan adsorbsivitas terhadap air yang tinggi serta aktif dan responsif terhadap sinar matahari. Mesopori titania-silika komposit yang memiliki aktivitas fotokatalitik telah disintesis dengan mencampurkan oligomer ethoxysilane dan nanopartikel titanium dioksida dengan adanya surfaktan nonionik (n-octylamine). Nanomaterial tersebut menciptakan perekat yang efektif dan retak-bebas pelapis untuk batu. Lapisan batu meningkatkan ketahanan mekanik dan diciptakan memiliki sifat hidrofobik (Pinho and Mosquera, 2011).
E. Sol Gel
Proses sol-gel dapat dikontrol untuk mendapatkan kemurnian dan homogenitas komposisi yang tinggi (Brinker and Scherer, 1990), sehingga katalis yang diperoleh memiliki unjuk kerja yang konsisten. Metode sol-gel juga memungkinkan untuk memasukkan dopan ganda secara simultan sehingga komposisi dopan dapat diatur pada saat preparasi (Lenza and Vasconcelos, 2002). Di samping itu, proses sol-gel juga menghasilkan interaksi dopan-penyangga yang lebih kuat sehingga kehilangan dopan selama proses sintering dapat ditekan (Frenzer and Maier, 2006). Metode sol-gel juga memungkinkan mendapatkan katalis dalam bentuk film tipis dengan ketebalan yang dapat dikontrol sesuai dengan kebutuhan.
yang sangat sederhana menggunakan ekstraksi alkalis atau dengan pengabuan (Daifullah et al, 2003).
Metode sol gel dengan berbagai variasinya, merupakan metode yang paling umum digunakan untuk mensintesis nanopartikel TiO2 terdoping nitrogen, terutama karena dengan metode sol-gel lebih mudah mengontrol tingkat doping nitrogen dan ukuran partikel dengan variasi simple kondisi eksperimen seperti laju hidrolisis, pH larutan dan sistem pelarut. Pada metode ini, spesies prekursor Ti (seperti TiCl3, TiCl4 atau Ti(OC3H7)4) dihidrolisis dan dipolimerisasi umumnya dengan larutan prekursor N seperti amoniak dan amina organik sebagai dopan nitrogen. Gel yang diperoleh kemudian dikeringkan dan dikalsinasi baik dalam atmosfer udara maupun amoniak selama waktu tertentu. Penggunaan pendekatan sol-gel dapat menghasilkan nanopartikel TiO2 terdoping nitrogen dengan konsentrasi doping 1% hingga 20% (Morikawa et al, 2001). Kalsinasi yang cukup dapat menghilangkan sebagian besar residu organik pada permukaan dan meninggalkan tingkat doping N yang cukup tinggi pada nanopartikel yang dihasilkan. Teknologi sol gel dapat juga digunakan untuk mendapatkan teknologi pengembangan bahan baru proses katalis, sensor kimia, media tambahan optik (Gvishi et al, 1997), membran (Xomeritakis et al, 2009), serat (Zeng et al, 2001), photokromik dan aplikasi non linier (Dunn and zink, 1991), serta pada perangkat keras elektrokimia (Dunn et al, 1994).
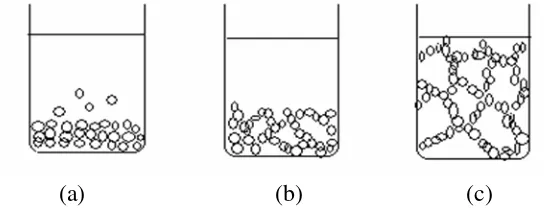
Melalui proses tersebut produksi material keramik dalam berbagai jenis dan bentuk dapat dilakukan. Sebagai contoh adalah partikel koloid SiO2 mempunyai struktur yang sama seperti gelas silika yang dihasilkan dengan cara pengenceran. Dari reaksi kimia hidrolisis, kondensasi dan polimerisasi dari logam alkoksida seperti yang telihat dalam Gambar 2.5.
(a) (b) (c)
Gambar 2.5. Proses pembentukan jaringan koloid gel (a) Pengendapan koloid gel yang stabil, (b) Penyusunan koloid gel, (c) Jaringan koloid gel.
F. Kalsinasi
Proses kalsinasi adalah proses perlakuan panas yang diterapkan pada suatu bahan yang bertujuan untuk dekomposisi termal, transisi fasa, dan penghapusan fraksi volatile. Proses kalsinasi terjadi pada temperatur dibawah titik lebur bahan yang berperan dalam proses penghilangan air, karbondioksida atau gas lain.
meningkatnya diameter pori dan ukuran distribusi pori lebih luas (Sun et al, 2008).
G. SEM/EDS
SEM adalah Scanning Electron Microscope, yakni suatu jenis mikroskop elektron yang menggambarkan permukaan sampel dan dikembangkan pertama kali tahun 1938 oleh Manfred von Ardenne dari Jerman. Konsep dasar dari SEM ini sebenarnya disampaikan oleh Max Knoll (penemu TEM) pada tahun 1935. Alat ini dilengkapi dengan EDS dimana elektron akan berinteraksi dengan atom pada material yang membuat sampel menghasilkan sinyal yang mengandung informasi, seperti topografi permukaan sampel, komposisi, konduktivitas listrik, dan sifat lainnya yang terkait dengan sampel tersebut. SEM juga dilengkapi dengan sistem
pencahayaan menggunakan radiasi elektron yang mempunyai daya pisah λ = 200 Å sampai dengan 1 Å sehingga mikroskop elektron dapat difokuskan kedalam bentuk titik yang sangat kecil (orde 100 Å) atau dengan perbesaran sampai 100.000 kali. SEM mempunyai daya pisah sekitar 0,5 nm dengan perbesaran maksimum sekitar 500.000 kali.
dan panas (Reimer and Tollkamp, 1980). SEM mempunyai kedalaman medan yang besar, yang dapat memfokus jumlah sampel yang lebih banyak pada satu
waktu dan menghasilkan bayangan yang baik dari sampel tiga dimensi. SEM juga
menghasilkan bayangan dengan resolusi tinggi, yang berarti mendekati bayangan
yang dapat diuji dengan perbesaran tinggi dan komposisi serta informasi
kristallografi membuat SEM merupakan satu dari peralatan yang paling banyak
digunakan dalam penelitian, khususnya industri semikonduktor. Adapun sinyal
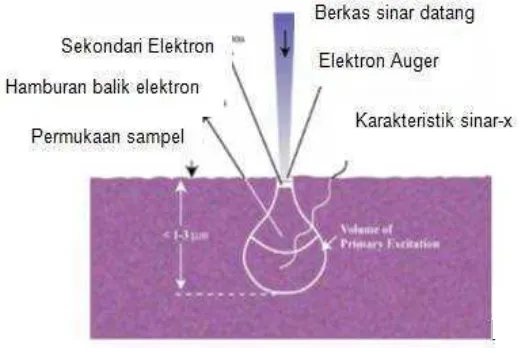
yang dihasilkan SEM-EDS seperti terlihat pada Gambar 2.6.
Gambar 2.6. Sinyal hasil interaksi berkas elektron dengan sampel (Reimer and Tollkamp, 1980).
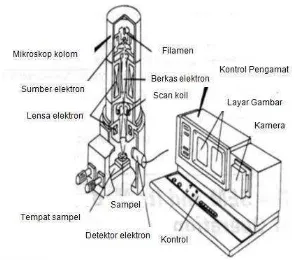
Gambar 2.7. Skema kerja alat SEM (Reimer and Tollkamp, 1980).
Sinyal elektron terhambur balik intensitasnya tergantung pada nomor atom yang ada pada permukaan sampel. Cara ini akan memberikan gambar yang menyatakan perbedaan unsur kimia, warna terang menunjukkan adanya unsur kimia yang lebih tinggi nomor atom. Material yang digunakan untuk membuat katoda atau sumber elektron diantaranya adalah:
b. LaB6 Filamen, merupakan bahan filamen yang 10 kali lebih terang daripada tungsten dengan resolusi tinggi, dan dilengkapi berbagai tegangan percepatan.
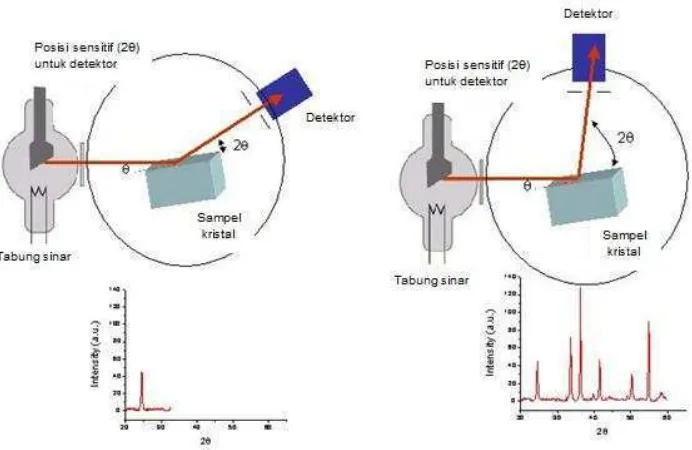
H. XRD (X-Ray Diffraction)
Teknik difraksi sinar x digunakan untuk mengidentifikasi struktur kristal pada sampel dan gambaran umum struktur kisi yaitu parameter kisi dan jenis struktur (Smallman, 1995). Sinar x memiliki panjang gelombang sekitar 0,5- 2,5 Å (0,05-2,5 nm), panjang gelombang tersebut kebetulan mendekati jarak antar atom dalam
kristal. Sinar x dihasilkan oleh tumbukan antara elektron kecepatan tinggi dengan
logam target. Secara umum komponen utama pembangkit sinar x terdiri dari
sumber elektron (katoda), tegangan tinggi untuk mempercepat elektron dan logam
target (anoda).
Gambar 2.8. Skema kerja alat XRD (Bearden, 1967).
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Juni 2012 sampai Desember 2012 di Laboratorium Fisika Material FMIPA Universitas Lampung. Karakterisasi sampel dilakukan di Laboratorium Biomassa FMIPA Universitas Lampung dan Laboratorium Pusat Penelitian dan Pengembangan Geologi Kelautan (P3GL)
Pasteur Bandung.
B. Alat dan Bahan Penelitian
1. Alat
Dalam penelitian ini alat yang digunakan antara lain: timbangan, beaker glass, magnetic strirer, mortal dan pastle, cawan tahan panas, penekan hidrolik, oven, furnace, multimeter, solder, lampu UV Osram 300 V, serta karakterisasi sampel menggunakan XRD merk Shimadzu XD 610, menggunakan SEM-EDS (Model EVO MO 10 ZEISS) dan uji fotokatalis menggunakan Spektrometer UV-VIS.
2. Bahan
C4H9OH (butanol), sekam padi, KOH 5%, kertas saring, tisu, aluminium foil dan kertas label.
C. Prosedur Kerja
Adapun langkah-langkah yang dilakukan adalah pembuatan serbuk TiO2, preparasi komposit TiO2/SiO2, pressing, kalsinasi, karakterisasi struktur menggunakan XRD, analisis mikrostruktur dan analisis elemental menggunakan SEM-EDS, serta uji fotokatalis menggunakan alat spektrofotometer UV-Vis.
1. Preparasi Sol TiO2
Pembuatan sol TiO2 diawali dengan pencampuran bahan titanium butoksida dengan kemurnian 99%, HCl dengan kadar 37%, dan butanol. Pencampurannya dilakukan dengan perbandingan molar 1:0,2:4,2. Dalam hal ini butanol berfungsi sebagai pelarut dan HCl sebagai katalis. Selanjutnya semua bahan yang telah dicampur di stirr selama 12 jam pada suhu kamar dengan penambahan HCl sebanyak 40 µl/jam.
Dalam penelitian ini sampel TiO2 yang dibuat sebanyak 6 sampel dengan perbandingan komposisi antara titanium butoksida, butanol dan HCl 20: 50: 0,48 ml secara berturut-turut.
2. Preparasi Silika Sol dari Sekam Padi
tersebut, sekam padi terlebih dahulu dibersihkan dari senyawa-senyawa organik dengan cara mencuci sekam padi dengan air hingga bersih dan merendamnnya. Kemudian sekam padi yang telah tenggelam diambil sebab kandungan silikanya relatif tinggi dan direndam kembali dengan air panas selama 6 jam. Setelah itu, sekam padi pilihan siap untuk diekstraksi menjadi filtrat dengan cara melarutkannya sebanyak 50 g dengan larutan KOH 5% di dalam beaker glass dan diaduk hingga sekam padi tenggelam dalam larutan tersebut. Selama proses pengadukan campuran tersebut, perlu dilakukannya pemanasan selama 30 menit menggunakan kompor listrik. Proses pelarutan dan pemanasan, berguna untuk memperoleh hasil ekstraksi yang optimal. Setelah pemanasan selesai, silika sol disaring menggunakan saringan. Hasil penyaringannya (silika sol) dituangkan ke dalam beaker glass dan dilakukan proses penjenuhan (penuaan) selama 24 jam agar memperoleh silika sol (Si(OH)4) yang homogen.
3. Sintesis Komposit Titania-Silika
[image:35.595.155.469.629.729.2]Sintesis komposit titania-silika dilakukan dengan metode sol-gel dimana titania sol dan silika sol dicampur dengan perbandingan molar 1:1, 1:0,25, 1:0,20, 1:0,10, 1:0,05, 1:0,01. Dengan perbandingan molekul seperti yang ditunjukkan pada Tabel 3.1.
Tabel 3.1. Perbandingan komposisi antara titania-silika.
No Sampel Titania (ml) Silika (ml)
1 A 20 42
2 B 20 10
3 C 20 8
4 D 20 4
5 E 20 2
Titania sol dihasilkan dari pencampuran bahan titanium butoksida dengan kemurnian 99%, HCl dengan kadar 37%, dan butanol. Pencampurannya dilakukan dengan perbandingan molar 1:0,2:4,2. Dalam hal ini butanol berfungsi sebagai pelarut dan HCl sebagai katalis. Selanjutnya semua bahan yang telah dicampur di stirr selama 12 jam pada temperatur ruangan. Titania sol yang dihasilkan kemudian ditambahkan ke dalam larutan silika sol sambil di stirr selama 3 jam sampai terbentuk gel. Gel yang terbentuk kemudian didiamkan selama 24 jam agar mengalami penuaan (aging) dan dipanaskan pada suhu 120 oC selama 12 jam. Setelah dikeringkan material ditumbuk sampai halus dan dilanjutkan dengan proses pressing dan kalsinasi. Proses kalsinasi berfungsi untuk menghilangkan zat-zat lain yang terdapat pada serbuk TiO2 seperti butanol, HCl dan kadar uap air (H2O). Kalsinasi dilakukan menggunakan tungku pembakaran, selama 7 jam pada suhu 500 ºC, ditahan pada suhu 200 ºC selama 3 jam dan waktu naik 1 jam.
4. Karakterisasi Sampel
Kombinasi kedua uji ini akan dapat mengkonfirmasi dengan jelas sampel manakah yang menunjukkan hasil terbaik dari penambahan sol silica terhadap pembuatan nanokomposit titania-silika. Selain itu uji fotokatalis untuk melihat aktivitas fotokatalis meningkat atau tidak.
a. Karakterisasi X- Ray Diffraction (XRD)
Karakterisasi difraksi sinar x bertujuan untuk mengetahui struktur kristal dengan komposisi dasar pembentuk senyawa keramik mullite setelah dilakukan proses sintering. Langkah-langkah untuk melakukan proses karakterisasi X- Ray Diffraction (XRD) adalah:
1. Menyiapkan sampel yang akan dianalisis, yaitu sampel dengan perbandingan 1:1, kemudian direkatkan pada kaca dan dipasang pada tempatnya berupa lempeng tipis berbentuk persegi panjang (sampel holder) dengan lilin perekat.
2. Memasang sampel yang telah disimpan pada sampel holder kemudian diletakan pada sampel stand dibagian goniometer.
3. Memasukkan parameter pengukuran pad software pengukuran melalui komputer pengontrol, yaitu meliputi penentuan scan mode, penentuan rentang sudut, kecepatan scan cuplikan, memberi nama cuplikan dan memberi nomor urut file data.
4.Mengoprasikan alat difraktometer dengan perintah “start” pada menu komputer, dimana sinar x akan meradiasi sampel yang terpancar dari target Cu dengan panjang gelombang 1,54 Å.
tertentu dapat dicetak oleh mesin printer.
6. Mengambil sampel setelah pengukuran cuplikan selesai.
7. Data yang terekam berupa sudut difraksi (2), besarnya intensitas (I), dan waktu pencatatan perlangkah (t).
Setelah data diperoleh analisis kualitatif dengan menggunakan search match analisys yaitu membandingkan data yang diperoleh dengan pangkalan data (data base PDF = Power Diffraction File data base).
b. Karakterisasi Scanning Electron Microscopy (SEM)
Karakterisasi SEM dilakukan untuk mengetahui mikrostruktur keramik mullite untuk sampel tanpa sintering dan setelah sintering. Langkah-langkah dalam proses SEM adalah:
1. Memasukkan sampel yang akan dianalisa ke vacuum column, dimana udara akan dipompa keluar untuk menciptakan kondisi vakum. Kondisi vakum ini diperlukan agar tidak ada molekul gas yang dapat mengganggu jalannya elektron selama proses berlangsung.
2. Elektron ditembakkan dan akan melewati berbagai lensa yang ada menuju ke satu titik di sampel.
c. Uji Resistivitas dengan Metode 4 Titik Probe
Pengukuran resistivitas nanokomposit titania silika dengan sampel yang telah dikalsinasi pada suhu 500 °C sebagai material semikonduktor. Adapun langkah pengukuran panas jenis pada sampel sebagai berikut:
1. Sampel berbentuk bulat komposit titania silika berbasis titanium butoksida dansilika sekam padi sebanyak 6 sampel.
2. Meletakkan dua buah kawat ke permukaan sampel pada posisi sejajar dan dilekatkan menggunakan pasta perak kemudian dipanaskan pada suhu 100 °C.
3. Kawat disambungkan dengan membuat dua buah elektroda pada papan PCB.
4. Menyambungkan elektroda pada sampel ke alat ukur arus/tegangan untuk mengukur arus dan tegangan yang muncul pada masing-masing sampel. Seperti pada Gambar 3.1.
[image:39.595.203.422.498.691.2]D. Diagram Alir Penelitian
[image:40.595.55.571.112.718.2]Preparasi komposit titania-silika ditunjukkan seperti pada Gambar 3.2.
Gambar 3.2. Diagram alir pembentukan komposit titania-silika. Mulai
Pengadukan hingga homogen menggunakan
stirrer
Pencampuran Titanium Butoksida, HCl dan butanol dengan perbandingan 1:0,2:4,2
Titanium Butoksida
Titania sol (TiO2)
Sekam padi kering dan bersih
Penambahan KOH 5 %
Penuaan (aging) selama 24 jam
Penyaringan Pemanasan selama 30 menit
Silika sol (SiO2)
Penuaan (aging) selama 24 jam
Pengadukan hingga homogen selama 3 jam hingga terbentuk gel
Pembilasan dengan air hangat dan pemutih
Penggerusan dan Pembuatan pelet Pengeringan pada suhu 120 oC selama 12
jam
Kalsinasi pada suhu 500 oC selama 7 jam
Karakterisasi XRD, SEM/EDS, uji fotokatalis, resistivitas
Selesai
vii
Puji syukur berkat limpahan rahmat dan karunia Allah SWT, maka penulis dapat
menyelesaikan penelitian dan penulisan skripsi yang berjudul “Sintesis dan
viii
Berikan yang terbaik, jika ingin mendapatkan yang terbaik.
Pribadi indah adalah dapat menjaga penampilan dengan seburuk-buruknya perasaan.
ix
kupersembahkan kepada:
My looply (mama Nurbaiti dan papa alm. A. Syarifuddin), berkat doa yang tulus dan cinta kasih dalam mendidik sehingga terbentuk pribadi istimewa
untuk mempersembahkan yang terbaik.
My dbest brother (M.Amin S dan Dewi Karlina), terima kasih atas dukungan baik secara materil maupun dalam bentuk doa.
x
Dalam kesempatan ini penulis ingin mengucapkan terima kasih kepada pihak-pihak yang telah membantu dan mendukung selama penelitian sehingga penulis dapat menyelesaikan skripsi yang berjudul “ Sintesis dan Karakterisasi Titania Silika berbasis Titanium Butoksida dan Silika Sekam Padi dengan Metode
Sol-Gel ” adalah salah satu syarat untuk memperoleh gelar sarjana Sains di
Universitas lampung.
Dalam kesempatan ini penulis ingin mengucapkan terima kasih kepada :
1. Bapak Posman Manurung, M.Si, Ph.D selaku pembimbing yang telah memberikan pengarahan selama penulis melaksanakan Penelitian maupun dalam penyusunan laporan sehingga skripsi ini dapat terselesaikan.
2. Ibu Dra. Dwi Asmi, M.Si.,Ph.D selaku dosen penguji yang telah memberikan saran dan kritikan yang membangun sehingga skripsi ini dapat terselesaikan.
3. Bapak Drs. Safriadi selaku Pembimbing akademik yang telah memberikan masukan dari awal perkuliahan sampai sekarang.
4. Ibu Dr. Yanti Yulianti, S.Si., M.si selaku Ketua Jurusan Fisika FMIPA Universitas Lampung.
xi
7. Teman-teman yang setia menemani di Laboratorium Fisika Eksperimentasi dan membantu dalam penyelesaian skripsi: Violina Sitorus, Risky Sastia Ningrum, Dian Yulia Sari, Indra Pardede, Iwan M Ridwan, Sisca Aprila, Mardalena, Melinda Safitri, Laila Kurniati, Heni Handayani, Ameilda Larasati, Reza Pahlephi.
8. Semua pihak yang telah memberikan bantuannya dalam penyelesaian skripsi ini, khususnya angkatan 2008.
Penulis menyadari bahwa dalam penulisan skripsi ini masih banyak terdapat kekurangan. Oleh karena itu, kritik dan saran yang sifatnya menuju perbaikan sangat diharapkan sehingga skripsi ini dapat memberikan manfaat bagi pengembangan kita semua.
Bandar lampung, Januari 2013 Penulis,
i Nama : Revy Susi Maryanti NPM : 0817041051
Jurusan : Fisika
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI,
1. Pembimbing 2. Ketua Jurusan
Posman Manurung, Ph.D Dr. Yanti Yulianti
ii 1. Tim Penguji
Ketua : Posman Manurung, Ph.D...
Penguji Bukan Pembimbing : Dra. Dwi Asmi, M.Si., Ph.D...
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof . Suharso, Ph.D
NIP. 196905301995121001
v
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 18 Maret 1989 di Tanjung Karang, dari pasangan Bapak A. Syarifuddin (Alm) dan Ibu Nurbaiti yang merupakan anak kedua dari dua bersaudara.
Pendidikan Sekolah Dasar (SD) Negeri 1 Tanjung Baru, Bandar Lampung pada tahun 2001, Sekolah Lanjutan Tingkat Pertama (SLTP) Negeri 5 Bandar Lampung pada tahun 2004, dan Sekolah Menengah Atas (SMA) Negeri 3 Bandar Lampung pada tahun 2007. Pada tahun 2008 penulis diterima sebagai mahasiswa Universitas Lampung, Jurusan Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam.
vi
(PKL) di LIPI UPT. Balai Pengolahan Mineral Lampung di Tanjung Bintang, lampung Selatan tahun 2011, pernah mendapatkan hibah PKMP pada tahun 2008/2009 dan 2009/2010 dari Departemen Pendidikan Nasional Direktorat Jendral Pendidikan Tinggi Republik, mendapatkan Piagam Penghargaan Juara 1
Lomba Karya Tulis Ilmiah pada kegiatan “Fisika Expo Tahunan IX “ pada tanggal
20 Maret - 18 April 2010, dan pernah mengikuti Pelatihan skripsi Fisika Expo Tahunan IX pada tanggal 20 Maret – 18 April 2010 di Jurusan Fisika FMIPA Universitas Lampung, Piagam sebagai “Pemakalah Seminar Umum Statistika”
V. KESIMPULAN DAN SARAN
A.Kesimpulan
Dari penelitian yang telah dilakukan dapat diambil kesimpulan bahwa:
1. Hasil analisis XRD TiO2-SiO2 perbandingan mol 1:1 mengindikasikan terbentuknya pertumbuhan kristal meskipun yang dominan adalah amorf. 2. Hasil SEM menunjukkan mikrostruktur TiO2-SiO2 menghasilkan partikel
mengalami perubahan ukuran kristal dan agregrasi kristal yang berbeda sebagai fungsi persentase SiO2. Penambahan dopan silika terlalu kecil menghasilkan agregasi kristal yang kurang teratur dan homogenitas yang rendah.
3. Hasil EDS menunjukkan unsur-unsur yang teridentifikasi dari komposit TiO2-SiO2, yaitu titanium, oksigen, silikon dan sedikit pengotor berupa carbon.
4. Hasil uji fotokatalis menunjukkan bahwa secara keseluruhan daya urai/degradasi pada lampu UV dan cahaya tampak relatif sama, dengan demikian besar kemungkinan bahwa Eg bahan lebih kecil dari 3,2 eV. Penguraian terbaik terdapat pada perbandingan komposisi titania silika 1:0,05 pada metilen jingga maupun metilen biru.