DAN RISIKO ZOONOSIS PADA IKAN LAUT DI
PERAIRAN INDONESIA BAGIAN SELATAN
ADHI RACHMAT SUDRAJAT HARIYADI
SEKOLAH PASCA SARJANA INSTITUT PERTANIAN BOGOR
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan dalam tesis saya yang berjudul:
Pemetaan Infestasi Cacing Parasitik Pada Ikan Laut di Perairan Indonesia Bagian Selatan
Merupakan gagasan atau hasil penelitian tesis saya sendiri dengan arahan Komisi Pembimbing, kecuali dengan jelas ditunjukkan rujukannya. Tesis ini belum pernah diajukan untuk memperoleh gelar pada program sejenis di perguruan tinggi lain. Semua data dan informasi yang digunkan telah dinyatakan secara jelas dan dapat dipertanggungjawabkan kebenarannya.
Bogor, Agustus 2006
Adhi Rachmat Sudrajat Hariyadi
ADHI RACHMAT SUDRAJAT HARIYADI. Pemetaan infestasi cacing parasitik pada ikan laut di perairan Indonesia bagian Selatan. Dibawah bimbingan RISA TIURIA PRIOSOERYANTO, BAMBANG PONTJO PRIOSOERYANTO, dan ETIH SUDARNIKA.
Penelitian ini dirancang untuk mempelajari perbedaan infestasi cacing parasitik pada tiga jenis ikan inang (tuna, ekor kuning, dan kerapu). Sampel ikan dikumpulkan dari perairan Indonesia bagian Selatan (Selat Sunda, Bali dan Nusa Tenggara Timur) untuk mempelajari pula variasi infestasi parasit secara geografis. 26 genera cacing parasitik berhasil diisolasi, diidentifikasi serta dipelajari risiko zoonosisnya. 3 genera dari filum Nemathelminthes, 1 genus dari filum Plathyhelminthes, dan 1 genus dari filum Acanthocephala teridentifikasi sebagai cacing zoonotik. Analisis histopatologi dilakukan untuk mempelajari perubahan yang terjadi pada saluran cerna ikan serta hubungannya dengan infestasi cacing parasitik. Penelitian ini menemukan berbagai perubahan patologis seperti keberadaan parasit, atrofi vili, infeksi sekunder, dan juga korelasi antara tingkat infestasi dengan kondisi peradangan (enteritis). Dengan pemetaan, tingkat infestasi (jumlah parasit di setiap inang dan jumlah parasit per gram daging) dapat digunakan untuk menunjukkan risiko zoonosis di berbagai lokasi. Variabel yang sama dapat pula digunakan untuk menunjukkan jumlah parasit dan keberadaan inang definitif/antara/paratenik yang kemudian dapat digunakan untuk menduga status kesehatan satwa lain di perairan yang sama.
ADHI RACHMAT SUDRAJAT HARIYADI. Mapping of parasitic helminth
infestation and zoonotic risk in marine fishes of southern Indonesian waters.
Under the guidance OF RISA TIURIA PRIOSOERYANTO, BAMBANG PONTJO
PRIOSOERYANTO, and ETIH SUDARNIKA.
This research was designed to study the differences in helminth parasitic
infestation of three different fish hosts (Tuna, fusilier, and grouper). Fish
samples were collected from three regions in south Indonesian waters (Sunda
Strait, North Bali and East Nusa Tenggara) in order to observe geographical
variations of parasitic infestations. Twenty six genera of parasitic worms from
the viscera were isolated, identified, and their respective zoonotic risks were
assessed. Three genera of phylum nemathelminthes, one genus from phylum
plathyhelminthes, and one genus from phylum acanthocephala were identified as
zoonotic parasites. Histopathological analysis of the digestive tract found that
there were presence of parasites, atrophy of villi, secondary infection, as well as
correlation between parasite infestation and cases of inflammation (enteritis). By
mapping, level of infestation (numbers of parasites per host and numbers of
parasites per gram muscle) could be used to indicate zoonotic risks in different
locations. The same variable could potentially be used for indicating the amount
of parasites and the presence of intermediate/paratenic/definitive hosts; thus
contributing to the estimation of other marine wildlife’s health status.
© Hak cipta milik Institut Pertanian Bogor, tahun 2006 Hak cipta dilindungi
DI PERAIRAN INDONESIA BAGIAN SELATAN
ADHI RACHMAT SUDRAJAT HARIYADI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Sains Veteriner
SEKOLAH PASCA SARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis:
PEMETAAN INFESTASI CACING PARASITIK DAN RISIKO ZOONOSIS PADA IKAN LAUT DI PERAIRAN INDONESIA BAGIAN SELATAN
Nama: Adhi Rachmat Sudrajat Hariyadi
Nomor Pokok: B053040091
Program Studi: Sains Veteriner
Disetujui:
Komisi Pembimbing
drh. Risa Tiuria Priosoeryanto, MS. PhD Ketua
drh. Bambang Pontjo P, MS. PhD Ir. Etih Sudarnika, MSi
Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Sains Veteriner
drh. Bambang Pontjo P, MS. PhD Dr. Ir. Khairil A. Notodiputro, MSc
RIWAYAT HIDUP
Penulis lahir di Jakarta pada tanggal 28 April 1971 dan merupakan anak pertama dari 2 bersaudara. Sejak kecil penulis tertarik dengan kegiatan alam terbuka dan juga mempelajari ilmu biologi. Dengan berbekal latar belakang ini, pendidikan S1 di bidang biologi dari University of Alberta, Kanada diselesaikan pada tahun 1994 dengan gelar Bachelor of Science (BSc). Selepas pendidikan, penulis menempuh berbagai pengalaman kerja antara lain sebagai teknisi karantina dan kesehatan ikan di SeaWorld Indonesia, konsultan biologi, sampai akhirnya menangani kegiatan pelestarian satwa Badak Jawa sebagai Manajer proyek WWF Indonesia di Taman Nasional Ujung Kulon.
PRAKATA
Penulis mengucapkan puji syukur kepada Allah SWT yang telah memberi jalan, petunjuk, dan kekuatan selama penulis menempuh studi di sekolah pasca sarjana Institut Pertanian Bogor. Tesis ini tidak mungkin dapat tersusun tanpa bantuan dan dukungan moral dari keluarga tercinta: Indriani Noverita dan Rahadrian Ksatria yang selalu memberikan motivasi dan juga inspirasi.
Rasa terimakasih dan penghormatan yang sedalam-dalamnya penulis ucapkan kepada para dosen pembimbing: drh. Risa Tiuria, MS, PhD; drh. Bambang Pontjo Priosoeryanto, MS, PhD; dan Ir. Etih Sudarnika, MSi, yang dengan penuh kesabaran dan dedikasi memberikan pengarahan dan masukan yang sangat berarti dalam penelitian ini. Kepada Nisa dan Kenty mahasiswi-mahasiswi FKH, serta kepada Bibi dan Pak Eman di Laboratorium Helmintologi yang telah banyak membantu kerja penulis di laboratorium.
Penelitian ini didukung pula oleh kekompakan rekan-rekan WWF proyek Ujung Kulon: Adji, Pinor, Andri, Hari, Nina, Endang, Ngatiman, Iwan, Mawi, Jaya, Sueb, dan Neng yang berhasil menjalankan kegiatan kantor secara sempurna selama penulis meninggalkan tugas-tugas kantor untuk menempuh pendidikan.
Penghargaan yang besar penulis sampaikan kepada masyarakat desa Lamalera di provinsi Nusa Tenggara Timur: Bpk Josef Keraf, Bapak Miguel, Rafael, Bpk Stanis Prason Bataona, Bpk. Abel Beding, dan ibu- ibu di pasar ikan Lewoleba yang juga telah memberikan bantuan berupa informasi dan juga pendampingan selama penulis melakukan pengambilan sampel di provinsi yang indah ini.
Semoga Allah memberikan yang terbaik
Bogor, Agustus 2006
DAFTAR ISI
DAFTAR TABEL... iii
DAFTAR GAMBAR... iv
DAFTAR LAMPIRAN... v
PENDAHULUAN Latar belakang... 1
Tujuan dan Manfaat Penelitian... 3
Hipotesis penelitian………... 3
TINJAUAN PUSTAKA Cacing Parasitik dan Manusia………...……….... 4
Cacing Parasitik dan Satwa liar perairan (mamalia laut)... 5
Sebaran cacing parasitik di dunia... 7
Kondisi Patologis akibat Infeksi Cacing Parasitik... 8
Pemantauan Kesehatan Satwa Liar Perairan... 8
BAHAN DAN METODA PENELITIAN Lokasi dan Waktu Penelitian... 10
Bahan dan Alat... 10
Parasitologi... 10
Patologi... 11
Metoda... 11
Pemilihan dan pengacakan sampel... 11
Isolasi cacing dari sampel ikan laut... 13
Isolasi cacing (stadium infektif) dari daging... 15
Metoda pewarnaan Semichon’s Acetocarmine... 15
Metoda pewarnaan minyak cengkeh... 16
Metoda Identifikasi... 17
Analisis patologis... 18
HASIL
Jenis parasit yang ditemukan... 22
Prevalensi dan intensitas... 26
Kondisi patologis... 29
PEMBAHASAN Intensitas parasit... 35
Intensitas cacing parasitik dan kondisi patologis... 36
Pemetaan infestasi cacing parasitik... 38
Pendugaan kesehatan pada satwa liar perairan... 40
Kecacingan... 41
Aspek kesehatan lainnya... 42
SIMPULAN... 43
SARAN... 44
DAFTAR PUSTAKA……….. 45
DAFTAR TABEL
1 Kriteria identifikasi cacing parasitik... 18 2 Cacing parasitik yang diisolasi dari 3 lokasi
pengambilan sampel... 22 3 Tabel pendugaan proporsi (prevalensi) kecacingan pada
populasi ikan di lokasi pengambilan sampel... 26 4 Tabel analisis galat baku intensitas kecacingan di setiap lokasi
pengambilan sampel... 26 5 Prevalensi (persentase jumlah kasus dari total sampel)
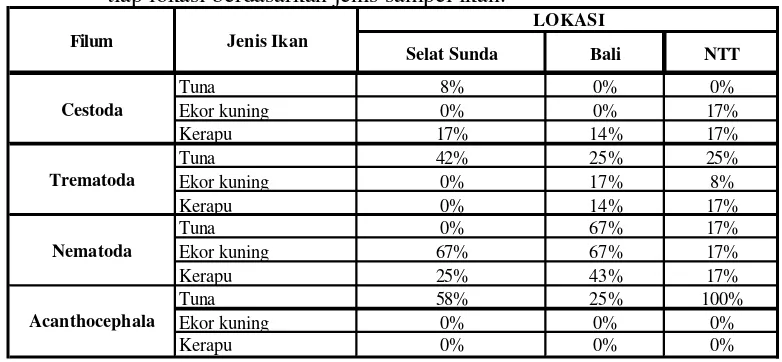
kecacingan di tiap lokasi berdasarkan jenis sampel ikan………….. 27 6 Intensitas Nematoda dan Acanthocephala di setiap lokasi
berdasarkan jenis sampel ikan... 27 7 Kategori infeksi berdasarkan prevalensi
(Williams & Bunkley-Williams 1996)……….. 27 8 Perbandingan persentase radang (enteritis)
dengan intensitas dan prevalensi... 37 9 Indikator pendugaan jenis cacing parasitik yang dapat
DAFTAR GAMBAR
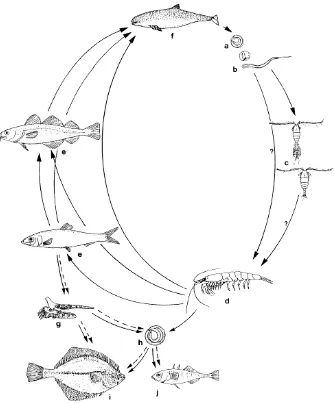
1 Siklus hidup nematoda zoonotik Anisakis sp. di ekosistem laut.... 6
2 Jenis ikan-ikan sampel yang digunakan dalam penelitian... 13
3 Pengendapan dengan gelas Baerman untuk mengisolasi cacing dari daging ikan... 14
4 Perangkat pewarnaan Semichon Acetocarmine yang digunakan dalam proses identifikasi cacing……….. 17
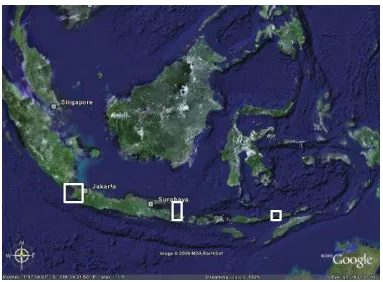
5 Lokasi pengambilan sampel di perairan Banten, Bali dan NTT... 21
6 Keragaman dan komposisi genera cacing parasitik... 23
7 Cacing zoonotik yang ditemukan selama penelitian... 24
8 Cacing-cacing non- zoonotik... 25
9 Box plot dari intensitas cacing parasitik nematoda ………... 29
10 Histogram hasil pengamatan sediaan histopatologi……….. 30
11 Keberadaan parasit pada sediaan histopatologi pada ikan ……… 31
12 Infiltrasi sel radang ……… 32
13 Atrofi pada vili usus ikan tuna, deskuamasi sel epitel pada ikan tuna, dan edema pada villi ikan Kerapu……… 34
14 Pemetaan risiko zoonosis berdasarkan intensitas cacing yang ditemukan pada tiap gram daging ikan... 39
DAFTAR LAMPIRAN
Lampiran 1. Daftar Temuan Cacing Parasitik dan Inang... 49 Lampiran 2. Perhitungan Statistika – Analisis Korelasi
Patologi dan Infestasi Cacing Parasitik... 50 Lampiran 3. Analisis Intensitas cacing parasitik dengan menggunakan
Standard Error Mean (SEM)……… 51 Lampiran 4. Analisis Prevalensi Dengan Menggunakan Uji Proporsi... 52 Lampiran 5. Analisis box plot untuk Intensitas parasit pada
Latar Belakang
Sejak lama orang mengenal hidangan laut yang terdiri dari berbagai jenis ikan, udang, kepiting, dan beberapa invertebrata lainnya yang merupakan jenis makanan yang digemari di seluruh dunia. Di tahun 1989 saja, konsumsi hasil laut (dilihat dari jumlah tangkapan hasil laut seluruh dunia) mencapai 85.7 juta metrik ton (Garrison 1993). Dalam kurun waktu 15 tahun jumlah ini meningkat seiring dengan meningkatnya jumlah populasi manusia. Telah diketahui bahwa beberapa jenis ikan merupakan inang antara yang membantu penyebaran cacing hati
Chlonorchis sinensis, sementara kepiting merupakan inang antara bagi cacing paru-paru Paragonimus westermanii pada manusia.
Tidak semua orang dapat menikmati hidangan laut, hal ini karena adanya sekelompok protein pada otot yang disebut parvalbumins pada ikan dan tropomyosin pada krustasea yang dapat menimbulkan reaksi alergis pada beberapa individu. Hal ini dikenal dengan istilah Seafood Hypersensitivity
(Auckland Allergy Clinic 2003). Selain dari alergen ini, hidangan laut juga dapat mengandung berbagai jenis parasit yang dapat menimbulkan reaksi mirip atau lebih parah dibanding dengan Seafood hypersensitivity. Meningkatnya konsumsi jenis makanan tertentu dapat menyebabkan meningkatnya prevalensi parasit pada suatu populasi. Salah satu contoh adalah penyebaran cacing parasitik Anisakis spp. Larva cacing Anisakis spp telah ditemukan pada ikan yang dijual di pasar daerah Jakarta pada tahun 1978, namun belum ada kasus anisakiosis tercatat pada saat itu (Hadidjaja et al. 1978, Ilahude et al. 1978). Pada tahun 1996 kasus hipersensitifitas anisakiosis akibat infeksi larva nematoda tersebut tercatat di Sidoarjo Jawa Timur (Uga et al. 1996), kejadian ini kemungkinan besar terkait dengan meningkatnya konsumsi ikan mentah atau kurang matang (sushi /
Dari penjelasan di atas terlihat bahwa konsumsi ikan dapat menyebabkan penyebaran parasit baik pada manusia (zoonosis) maupun pada satwa liar perairan, karenanya perlu dipelajari sebaran ikan laut, parasit serta prevalensi dan tingkat infestasi yang terjadi pada populasi yang diwakili oleh sampel ikan hasil tangkapan dari alam.
Aspek lain yang berkaitan dengan infestasi cacing parasitik adalah hubungan antara ikan laut dengan satwa liar perairan pemangsa ikan laut. Salah satu kendala pengelolaan satwa liar adalah sulitnya memantau kesehatan satwa yang hidup di habitat alami. Untuk satwa liar yang hidup di darat, sampai saat ini tinja dapat digunakan dalam pendugaan kesehatan satwa tersebut, namun hal ini hampir tidak mungkin dilakukan pada satwa liar perairan karena sulitnya mendapatkan sampel tinja yang utuh. Untuk itu perlu dilakukan beberapa metode pendekatan menggunakan indikator- indikator lainnya. Pada satwa perairan, terutama ikan, pemantauan status kecacingan merupakan hal yang penting karena cacing yang menginfeksi ikan di populasi alam dapat pula menginfeksi ikan di fasilitas penangkaran atau budidaya (akuakultur), yang akhirnya dapat menimbulkan kerugian ekonomis pada sektor perikanan (Buchmann & Bresciani 2001).
Tujuan Penelitian
• Mengidentifikasi keberadaan cacing parasitik dan yang memiliki potensi
zoonosis pada ikan laut dari perairan di bagian selatan Indonesia.
• Mengembangkan metoda pemetaan risiko zoonosis.
• Mempelajari perbedaan prevalensi dan intensitas infestasi cacing parasitik dari setiap lokasi.
• Mempelajari perubahan patologi anatomi dan histopatologi pada saluran cerna ikan dari populasi alami.
Manfaat Penelitian
• Diketahui jenis parasit yang zoonotik dan non- zoonotik pada ikan laut di lokasi perairan bagian selatan Indonesia.
• Identifikasi lokasi perairan dengan risiko zoonosis dari ikan laut.
• Penggunaan tingkat infestasi cacing parasitik pada ikan laut sebagai
indikator pendugaan kondisi kesehatan khususnya infestasi cacing pada satwa liar perairan.
• Diketahui gambaran perubahan patologis akibat infestasi cacing parasitik zoonotik dan non-zoonotik yang terjadi pada ikan dari beberapa lokasi yang berbeda.
Hipotesis Penelitian
• Ditemukan jenis parasit cacing pada ikan laut baik yang bersifat zoonotik
maupun non-zoonotik.
• Terdapat perbedaan prevalensi dan intensitas infestasi cacing parasitik
pada ikan dari tiap lokasi perairan.
• Data jenis parasit, preva lensi dan intensitas dapat digunakan untuk pemetaan jenis parasit ikan dan risiko zoonosis serta indikator biologis untuk pendugaan kesehatan satwa perairan.
• Terdapat berbagai perubahan patologis pada saluran cerna ikan laut yang terinfestasi cacing parasitik.
TINJAUAN PUSTAKA
Cacing Parasitik dan Manusia
Infeksi cacing parasitik pada manusia terjadi dengan masuknya stadium infektif parasit tersebut ke dalam tubuh manusia. Hilderbrand et al. (2003) menyebutkan bahwa jenis parasit yang sering ditemukan pada ikan laut adalah jenis nematoda Anisakis spp. dan cacing pita Dihyllobothrium spp. Ikan terinfeksi parasit tersebut akibat memakan krustasea kecil yang sudah terinfeksi. Koie (2001) menunjukkan bahwa larva dari nematoda Anisakis simplex tidak berkembang di tubuh krustasea kecil (copepoda), namun berkembang menjadi larva 3 (L3) di tubuh ikan. Beberapa spesies cacing pipih seperti Chlonorchis sinensis dan Paragonimus westermanii memerlukan inang antara (siput) dan inang definitif dalam siklus hidupnya. Stadium infektif masuk ke dalam tubuh manusia bila ikan dimakan dalam keadaan mentah atau kurang matang.
Cacing Parasitik dan Satwa liar perairan (Mamalia laut)
Satwa liar seperti lumba- lumba dan paus merupakan inang definitif dari berbagai jenis cacing parasitik. Walaupun cacing ini merupakan parasit yang lazim ditemukan dalam tubuh beberapa mamalia laut, pola migrasi dari lumba-lumba ataupun paus dapat menjadi sarana penyebaran cacing parasitik tersebut kepada satwa lainnya. Perairan Indonesia di sekitar Taman Nasional Komodo, P. Alor, P. Pantar, dan Lembata, Nusa Tenggara Timur merupakan jalur lintasan paus dari Samudera Pasifik dan perairan Timur Indonesia ke Samudra Indonesia dan juga sebaliknya melewati daerah ini disamping satwa setempat (residen) yang menggunakan jalur lintasan ini sebagai daerah jelajah mereka (Kahn 2001; Pet-Soede 2002). Beberapa jenis cacing parasit ini merupakan agen zoonosis karena dapat menimbulkan reaksi hipersensitifitas bahkan dapat pula hidup di dalam saluran pencernaan manusia (Bircher et al. 2000; Lopez-Serrano 2000).
Infestasi dan sebaran parasit ini pada ikan sangat terkait erat dengan ketahanan inang definitifnya yaitu mamalia laut. Daya tahan inang yang rendah dapat menimbulkan infestasi berlebih dan menyebabkan kerusakan pada jaringan. Dalam ekosistem laut, satwa yang menempati posisi atas dalam piramida makanan memiliki risiko terinfeksi yang tinggi oleh berbagai macam parasit apabila sumber makanan (mangsa) mereka telah terinfeksi oleh parasit.
Sebaran Cacing Parasitik di Dunia
Beberapa jenis cacing parasitik memiliki sebaran yang luas di seluruh dunia, namun ada pula beberapa jenis yang spesifik dari daerah tertentu. Selain sebaran geografis, cacing parasitik juga tersebar di beberapa jenis perairan seperti perairan air tawar, payau dan perairan laut. Berikut ini beberapa catatan mengenai jenis cacing parasitik yang ditemukan serta tingkat infeksi pada berbagai jenis satwa perairan.
Filipina dan Pasifik
Menurut Arthur & Lumanlan-Mayo (1997), jenis ikan kerapu (Serranidae) terinfeksi berbagai jenis cacing parasitik yang terdiri dari: 7 genera dari phylum Plathyhelminthes dan 3 genera dari phylum Nemathelminthes. Sementara jenis ikan Ekor kuning (Caesionidae) terinfeksi oleh: 1 genus dari filum Plathyhelminthes dan 2 genera dari filum Nemathelminthes. Dari ikan jenis tuna (Scombridae) ditemukan: 7 genera dari filum Plathyhelminthes dan 2 genera filum Nemathelminthes. Beberapa genera yang ditemukan di Filipina seperti
Anisakis spp, dan Lecithocladium spp tercatat pula di perairan Indonesia. Sugawara et al. (2004) mencatat bahwa terjadi infeksi sangat berat nematoda
Anisakis simplex pada ikan salmon Oncorhynchus keta. Infeksi terjadi saat ikan tersebut bermigrasi. Berdasarkan penelitiannya, cacing paling banyak ditemukan pada jaringan otot jenis ikan salmon.
Samudera Atlantik
Williams & Bunkley-Williams (1996) menyebutkan tentang terjadinya infeksi sangat berat (> 1,000 parasit per individu) cacing trematoda dari genus Dinurus sp pada lumba- lumba di perairan Karibia. Sementara infeksi berat Dinurus sp
Kondisi Patologis akibat Infeksi Cacing Parasitik
Menurut Williams & Bunkle y-Williams (1996), kerusakan yang berat pada jaringan tubuh inang timbul akibat infeksi berat (250 parasit per individu) dan infeksi sangat berat (> 1,000 parasit per individu). Cacing memasuki tubuh inang melalui makanan (plankton, ikan atau cumi). Larva infektif yang termakan akan tumbuh dewasa dan berkembang biak di dalam tubuh inang definitif ini. Beberapa jenis cacing memiliki antigen Ekskretori Sekretori hasil metabolit (ES) yang digunakan untuk menyerang jaringan inang dan menyebabkan luka / ulkus pada dinding saluran pencernaan. Pada usus inang, ujung anterior dari cacing genus Anisakis spp. tertanam pada ulkus. Ulkus ini dapat bersifat akut dan hemorrhagi atau kronis dimana proses persembuhan berjalan dengan adanya fibrosis dan jaringan granulasi (Duignan 2003).
Fibrosis dapat terjadi bila sel-sel platelet dari darah terlibat dalam proses penyembuhan. Dengan adanya jaringan yang rusak akibat adanya produk ES dan invasi cacing, netrofil datang sebagai bagian dari proses peradangan dan menimbulkan kondisi mirip granuloma (granulomatous). Semakin tinggi intensitas cacing parasitik, kondisi patologis yang timbul juga akan semakin parah.
Pemantauan Kesehatan Satwa Liar Perairan
BAHAN DAN METODA PENELITIAN
Lokasi dan Waktu Penelitian
Sampel ikan diambil dari beberapa lokasi yang mewakili perairan Indonesia bagian Selatan (Selat Sunda, Bali, dan Nusa Tenggara Timur) yang terletak di Indonesia bagian, Barat, Tengah, dan Timur. Identifikasi spesimen dan analisa histopatologi dilakukan di Laboratorium Helmintologi dan Bagian Patologi Fakultas Kedokteran Hewan IPB, Bogor. Penelitian berjalan selama bulan Maret 2005 sampai dengan Juni 2006.
Bahan dan Alat Penelitian 1. Parasitologi
Bahan dan alat yang digunakan dalam teknik parasitologi terdiri dari: a. Seperangkat alat bedah (dissecting kit)
b. Kaca pembesar c. Mikroskop cahaya d. Mikroskop stereo e. Timbangan elektronik f. Cawan Petri
g. Gelas plastik h. Botol plastik film i. Gelas objek
2. Patologi
Bahan dan alat yang digunakan dalam analisis patologi terdiri dari: a. Seperangkat alat bedah (dissecting kit)
b. Kaca pembesar
h. Mikroskop cahaya i. Mikroskop video
Metode
1. Pemilihan dan Pengacakan Sampel
Penelitian ini merupakan studi observasional yang dilakukan terhadap kondisi yang sudah terjadi di populasi alamiah. Untuk itu, metoda pemilihan dan pengacakan sampel dilakukan agar gambaran umum populasi tersebut dapat terwakili. Besaran sampel yang diambil didefinisikan berdasarkan dua kategori yaitu: kelompok jenis ikan dan kelompok lokasi pengambilan. Besaran sampel ikan ditentukan menggunakan formula seperti dijelaskan dalam Permin & Hansen (1998). Dengan tingkat kepercayaan 90%, dugaan prevalensi kecacingan pada 70%, dan presisi 15%, maka di setiap lokasi diperlukan minimal 26 satuan sampel ikan. Kelompok ikan laut yang diteliti terdiri dari:
• Ikan Pelagis 1 yang memiliki relung, pola penyebaran dan diet yang sama dengan mamalia la ut predator pemakan ikan (12 satuan sampel dengan ukuran panjang 15-20 cm)
dunia: Animalia filum: Chordata kelas: Osteichthyes ordo: Perciformes famili: Scombridae
• Ikan Pelagis 2 yang memiliki relung yang sama, namun pola penyebaran dan diet yang berbeda dengan kelompok Pelagis 1 (12 satuan sampel dengan ukuran panjang 30-50 cm)
dunia: Animalia filum: Chordata kelas: Osteichthyes ordo: Perciformes famili: Caesionidae
genus: Caesio, Pterocaesio
• Ikan Demersal yang memiliki relung, pola penyebaran dan pola diet
yang berbeda dengan ikan pelagis 1 dan Pelagis 2 (12 satuan sampel dengan ukuran panjang 20-30 cm).
dunia: Animalia kelas: Osteichthyes ordo: Perciformes famili: Serranidae
genus: Cephalopolis, Variola, Aethaloperca,Epinephelus
Gambar 2 Jenis ikan- ikan sampel yang digunakan dalam penelitian. A= tuna/tongkol (Scombridae), B=kerapu (Serranidae) dan C=ekor kuning (Caesionidae)
Sampel ikan merupakan hasil tangkapan beberapa nelayan dengan tonase kapal kurang dari 10 ton di lokasi- lokasi tersebut di atas, dan ikan telah dicampur di pasar atau pelelangan ikan sebelum dibeli untuk diteliti. Dengan demikian telah terjadi pengacakan terhadap ikan laut hasil tangkapan tersebut. Untuk menjamin bahwa sampel ikan ditarik dalam satu siklus yang sama, maka pengambilan sampel dilakukan pada fase bulan kwartal pertama (awal bulan dalam penanggalan Jawa/Islam). Semua sampel ikan diidentifikasi berdasarkan cara Allen (2000) dan diberi kode untuk penandaan pengelompokan berdasarkan jenis ikan dan lokasi sampel.
2. Isolasi Cacing Dari Sampel Ikan Laut
Ikan pelagis diambil dari hasil tangkapan nelayan di beberapa lokasi tersebut di atas. Ikan tuna/tongkol, kerapu dan ekor kuning tersebut diawetkan dengan pendinginan sebelum dibedah dan diteliti saluran pencernaannya. Di setiap provinsi tempat pengambilan sampel, 12 ekor ikan tuna atau tongkol, 12 ekor ikan kerapu, dan 12 ekor ikan ekor kuning diambil dari pelelangan ikan, atau tangkapan nelayan. Isolasi cacing parasitik dilakukan di lokasi pengambilan sampel. Telaah dilakukan terutama pada insang, organ pencernaan, dan daging
A B
(otot di sekitar rongga abdomen). Spesimen ikan dibedah dengan membuat sayatan pada bagian ventral ikan. Sayatan dimulai dari kloaka ke arah anterior sampai operkulum untuk memaparkan insang dan organ pencernaan. Organ dipisahkan berdasarkan kategori: insang, lambung, hati-empedu, dan usus untuk kemudian direndam dalam cairan garam fisiologis selama 2-3 jam. Cacing yang ditemukan kemudian dipindahkan ke dalam larutan garam fisiologis segar dan diidentifikasi menggunakan mikroskop cahaya. Spesimen yang didapat dari daerah diawetkan dengan alkohol 70% untuk analisis lebih lanjut dengan pewarnaan di Laboratorium Helmintologi Fakultas Kedokteran Hewan IPB. Pewarnaan pada spesimen cacing perlu dilakukan agar cacing dapat diidentifikasi dengan lebih tepat.
Cacing yang berhasil diisolasi disimpan di dalam larutan NaCl fisiologis selama 8 jam dalam suhu dingin, kemudian dipindahkan dalam alkohol 70% yang baru dididihkan dan disimpan dalam suhu ruangan sampai suhu alkohol kembali ke suhu ruangan. Tingkat infestasi cacing parasitik dari berbagai daerah ditentukan dengan cara mengidentifikasi dan menghitung jumlah cacing yang ditemukan dari jaringan tubuh inang (insang, saluran pencernaan, daging).
3. Isolasi Cacing (stadium infektif) dari Daging
Stadium infektif berbagai jenis cacing (larva, plerocercoid, cercaria, atau metacercaria) diisolasi menggunakan metoda pengendapan menggunakan gelas Baerman pada Gambar 3 dengan langkah- langkah sebagai berikut:
1. Sampel daging dari etanol 70% dikeringkan dengan menggunakan saringan selama 5 menit dalam suhu ruangan.
2. Sampel dikeringkan lebih lanjut sebelum ditimbang menggunakan timbangan elektronik
3. Daging kemudian digerus secara perlahan menggunakan mortar dan sedikit akuades
4. Daging diletakkan di atas kain kasa dan saringan yang terpasang pada bibir gelas Baerman (Gambar 3)
5. Gelas Baerman kemudian diisi dengan akuades sampai daging terendam
6. Biarkan selama satu malam (8 jam atau lebih) dalam suhu ruangan 7. Endapan diambil dengan pipet dari dasar gelas Baerman dan
diamati dibawah mikroskop stereoskopik
8. Parasit dihitung dan dipindahkan ke dalam etanol 70% untuk identifikasi
4. Metoda Pewarnaan Semichon’s Acetocarmine
Pewarnaan Semichon Acetocarmine digunakan untuk mengidentifikasi cacing pipih (Trematoda dan Cestoda), hal ini karena pewarnaan tersebut merupakan metoda pewarnaan yang tepat (Kusumamihardja 1995). Pewarnaan spesimen dilakukan dengan merendam spesimen dalam larutan acetocarmine dan melakukan dehidrasi dengan alkohol bertahap sebelum fiksasi pada sediaan gelas objek. Bahan pewarnaan acetocarmine seperti pada Gambar 4 disiapkan melalui langkah-langkah berikut:
1. 100 ml akuades dicampur dengan 100 ml asam asetat glacial 2. Bubuk lithium carmine dicampurkan sampai larutan menjadi jenuh 3. Larutan dipanaskan sampai 950 C selama 15 menit
Pewarnaan spesimen dilakukan dengan prosedur sebagai berikut
a) Spesimen cacing direndam dalam larutan pewarna acetocarmine selama 15-20 menit sampai warna terserap (spesimen menjadi berwarna merah cerah)
b) Spesimen dibilas dalam etanol 70% dan kemudian direndam dalam larutan asam alkohol (99 bagian etanol 70% dicampur dengan 1 bagian HCl)
c) Dehidrasi spesimen dengan alkohol bertahap (70%, 85%, 95%, 100%) direndam selama 5 menit pada tiap-tiap konsentrasi alkohol.
d) Perendaman dengan xylol sampai spesimen terlihat tembus pandang e) Membuat sediaan dengan bahan Entellan sebagai media fiksasi
5. Metoda Pewarnaan dengan Minyak Cengkeh
Untuk cacing nematoda dan acanthocephala yang memiliki struktur berbeda dengan cacing pipih (trematoda/cestoda) digunakan pewarnaan khusus dengan menggunakan KOH dan minyak cengkeh. Pewarnaan KOH- minyak cengkeh dilakukan dengan prosedur sebagai berikut:
1. Spesimen direndam dalam larutan KOH 1% (Bubuk KOH dilarutkan dalam akuades) selama 1-3 menit sampai kutikula / lapisan luar spesimen terlihat agak melunak dan tembus pandang
2. Cacing kemudian dipindahkan ke dalam minyak cengkeh selama 1-3 menit sampai organ-organ tubuh terlihat berwarna lebih jelas
Gambar 4 Perangkat pewarnaan Semichon Acetocarmine yang digunakan dalam proses identifikasi cacing
6. Metoda Identifikasi
Identifikasi cacing parasitik mengacu pada panduan dalam Yamaguti (1958), Soulsby (1982), Noble & Noble (1989), Kusumamihardja (1995), Williams & Bunkley-Williams (1996), dan Moravec et al. (1999). Secara garis besar, kriteria identifikasi terangkum dalam Tabel 1. Spesimen yang telah diwarnai diidentifikasi di bawah mikroskop cahaya dengan pembesaran lensa 160x. Berdasarkan morfologi spesimen dibedakan menjadi 3 filum yaitu: cacing pipih (Plathyhelminthes), cacing gilig (Nemathelminthes), dan Acanthocephala. Masing- masing kelompok tersebut dipisahkan lagi menjadi beberapa stadium yaitu: dewasa, larva pada Nemathelminthes; dan procercoid / plerocercoid pada Plathyhelminthes. Untuk cacing gilig (Nemathelminthes) dibedakan berdasarkan bentuk esophagus menjadi: cacing parasitik (esophagus lurus), cacing non-parasitik (esophagus berbentuk gada). Identifikasi dilakukan sampai tingkat
genus untuk kemudian menentukan sifat zoonosis cacing tersebut berdasarkan
genus. Penentuan risiko zoonosis dilakukan dengan menggunakan daftar cacing parasit zoonosis pada ikan yang disusun oleh Orlandi et al. (2002).
Filum Klasifikasi Bentuk tubuh Morfologi
Plathyhelminthes Cestoda Pipih, segmen,
tanpa rongga
Trematoda Pipih, dengan
rongga badan,
Nemathelminthes Nematoda Gilig, dengan atau
tanpa selubung
Bentuk mulut, esofagus, bentuk lambung, ujung posterior
Acanthocephala Acanthocephala Gilig, tanpa
segmen, proboscis
1. Keberadaan parasit
2. Infeksi bakteria (untuk menduga adanya infeksi sekunder)
3. Kondisi enteritis (keberadaan sel-sel radang, edema radang, dan bentuk vili)
4. Perubahan-perubahan patologis lainnya (sarang-sarang nekrosis, atrofi vili, deskuamasi epitel, dll)
8. Analisis Statistik dan Pemetaan
Perhitungan statistik dilakukan untuk menghitung:
1. Prevalensi (pendugaan proporsi) dari sampel dan populasi ikan terinfeksi cacing parasitik dengan menggunakan rumus:
P = x/n
P = pendugaan proporsi (prevalensi) pada populasi x = jumlah sampel dengan infeksi cacing parasitic n = total sampel yang diambil
Selang dengan tingkat kepercayaan 95% dihitung sebagai:
P ± Za/2 P(1-P)/n
2. Galat baku dari intensitas kecacingan pada sampel ikan dengan menggunakan rumus:
x ± t a/2 s___ vn
x = rata-rata intensitas kecacingan (jumlah cacing per individu) t a/2 = nilai distribusi t dua arah dengan tingkat kepercayaan 95% n = jumlah sampel
3. Korelasi Pearson antara jumlah temuan parasit pada inang (intensitas), prevalensi, dan kondisi patologis menggunakan rumus:
? (x.y) – n x y p =
(? xi2 – n x2)(? yi2 – n y2)
p = koefisien Pearson
x, y = nilai dari variable x dan y x, y = rata-rata variable x dan y
Data disusun dalam bentuk tabulasi untuk mempermudah perhitungan dan juga analisis box plot, sementara pendugaan proporsi digunakan untuk menganalisis perbedaan pada prevalensi. Perangkat lunak SPSS versi 12 digunakan dalam analisis data dimana sebagian besar dari analisis statistik yang digunakan bersifat deskriptif dengan membandingkan prevalensi dan juga intensitas dari tiap-tiap jenis parasit yang ditemukan. Keragaman parasit dari setiap lokasi dan jenis ikan juga diteliti untuk melihat apakah ada perbedaan prevalensi dan intensitas pada tiap jenis ikan ataupun lokasi. Selain tabulasi, grafik juga digunakan untuk memaparkan hasil agar dapat dianalisis secara visual. Tabulasi dan grafik juga digunakan pada hasil pengamatan kondisi patologis saluran cerna ikan untuk mempelajari perubahan yang terjadi pada spesimen jaringan usus dari tiap jenis ikan.
Gabungan dari fungsi kedua perangkat lunak ini digunakan untuk memetakan sebaran jumlah dan cacing parasitik berdasarkan data dari lapangan (tingkat infestasi dan koordinat lokasi pengambilan sampel). Database pemetaan dilakukan dengan keterwakilan pada tingkat provinsi (pengamatan dilakukan di provinsi-provinsi yang berbeda) seperti terlihat pada Gambar 5.
HASIL
1. Jenis Parasit yang Ditemukan
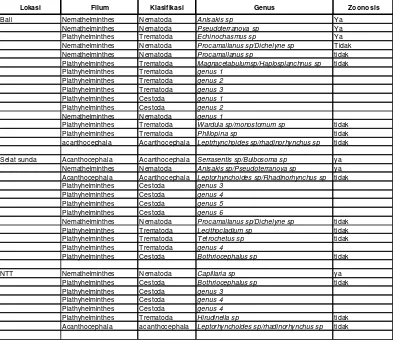
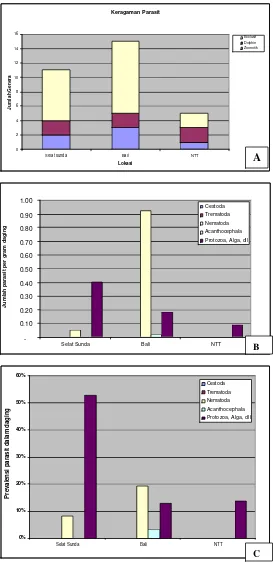
Spesimen parasit menunjukkan keragaman yang berbeda-beda di tiap lokasi. Lokasi dengan genera terbanyak adalah Bali (15 genera), Selat Sunda (11 genera) dan NTT (5 genera). Semua genera kemudian dikelompokkan dalam tiga kategori yaitu: Zoonotik (tercatat memiliki risiko zoonosis), Dolphin (ditemukan juga pada satwa liar lumba- lumba), dan eksklusif (hanya terdapat pada ikan). Gambar 6 menunjukkan keragaman dan komposisi genera dari tiap lokasi beserta intensitas cacing zoonotik dalam tiap gram daging ikan, sementara rincian genera dari tiap lokasi ditampilkan pada Tabel 2, sementara jenis-jenis ikan inang dapat dilihat pada Lampiran 1.
Tabel 2 Cacing parasitik yang diisolasi dari 3 lokasi pengambilan sampel
Lokasi Filum Klasifikasi Genus Zoonosis
Bali Nemathelminthes Nematoda Anisakis sp Ya
Nemathelminthes Nematoda Pseudoterranova sp Ya Plathyhelminthes Trematoda Echinochasmus sp Ya Nemathelminthes Nematoda Procamallanus sp/Dichelyne sp Tidak Nemathelminthes Nematoda Procamallanus sp tidak Plathyhelminthes Trematoda Magnacetabulumsp/Haplosplanchnus sp tidak Plathyhelminthes Trematoda genus 1
Plathyhelminthes Trematoda Wardula sp/monostomum sp tidak Plathyhelminthes Trematoda Phillopina sp tidak acanthocephala Acanthocephala Leptrhynchoides sp/rhadinorhynchus sp tidak
Selat sunda Acanthocephala Acanthocephala Serrasentis sp/Bulbosoma sp ya Nemathelminthes Nematoda Anisakis sp/Pseudoterranova sp ya Acanthocephala Acanthocephala Leptorhynchoides sp/Rhadinorhynchus sp tidak Plathyhelminthes Cestoda genus 3
Plathyhelminthes Cestoda genus 4
Plathyhelminthes Cestoda genus 5
Plathyhelminthes Cestoda genus 6
Nemathelminthes Nematoda Procamallanus sp/Dichelyne sp tidak Plathyhelminthes Trematoda Lecithocladium sp tidak Plathyhelminthes Trematoda Tetrochetus sp tidak Plathyhelminthes Trematoda genus 4
Plathyhelminthes Cestoda Bothriocephalus sp tidak
NTT Nemathelminthes Nematoda Capillaria sp ya
Plathyhelminthes Cestoda Bothriocephalus sp tidak Plathyhelminthes Cestoda genus 3
Plathyhelminthes Cestoda genus 4
Plathyhelminthes Cestoda genus 4
Plathyhelminthes Trematoda Hirudinella sp tidak Acanthocephala acanthocephala Leptorhynchoides sp/rhadinorhynchus sp tidak
Keragaman Parasit
Jumlah parasit per gram daging
Cestoda
Gambar 6 Keragaman dan komposisi genera cacing parasitik (A) beserta intensitasnya pada tiap gram daging ikan (B) dan juga prevalensi (C) dari tiap lokasi
A
B
Semua cacing yang ditemukan dari ikan sampel merupakan cacing parasitik, baik yang bersifat zoonotik maupun non- zoonotik. Terlihat bahwa genera yang bersifat zoonotik ditemukan di semua lokasi, namun demikian keragaman genera parasit tersebut tidak berbeda jauh (2 genera di Selat Sunda, 3 di Bali, dan 1 genus di NTT). Sebaran cacing parasitik di setiap lokasi cukup bervariasi, nematoda genus Anisakis sp. dan Procamallanus/Dichelyne sp. ditemukan hanya di lokasi Bali dan Selat Sunda, sementara Acanthocephala genus Leptorhynchoides/Rhadinorhynchus sp. ditemukan di Selat Sunda dan NTT. Total genera yang telah diidentifikasi terdiri dari: Trematoda (11 genera), Cestoda (7 genera), Nematoda (5 genera), dan Acanthocephala (2 genera). Jenis Trematoda menunjukkan jumlah genera yang tertinggi, pola serupa juga ditemukan oleh Arthur & Lumanlan-Mayo (1997) pada spesies parasit dari ikan di Filipina (90 spesies trematoda, 6 spesies cestoda, 20 spesies nematoda, dan 5 spesies Acanthocephala). Beberapa genera cacing belum dapat diidentifikasi karena kondisi spesimen atau pewarnaan yang tidak memadai. Foto dari beberapa cacing zoonotik yang ditemukan dari ikan- ikan sampel disajikan dalam Gambar 7, dan cacing non- zoonotik pada Gambar 8.
Gambar 7 Cacing zoonotik yang ditemukan selama penelitian. (A) Anisakis sp. dari usus ikan tuna dan ekor kuning di Selat Sunda dan Bali. (B)
Capillaria sp. dari usus ikan kerapu di NTT.
Gambar 8 Cacing-cacing non- zoonotik. (A) Cacing pita tetraphyllidae stadium pleroserkoid, (B) Cacing pipih Lecithocladium sp. (C)
Leptorhynchoides sp. / Rhadinorhynchus sp. dari filum
2 Prevalensi dan Intensitas
Proporsi individu yang terinfeksi parasit (prevalensi) dari setiap lokasi menunjukkan adanya perbedaan, namun demikian total prevalensi di semua lokasi tidak menunjukkan perbedaan yang mencolok (Selat Sunda 84%, Bali 94% dan NTT 90%). Fakta ini diperkuat dengan analisis pendugaan proporsi pada Tabel 3 yang menunjukkan selang prevalensi yang saling tumpang tindih antar lokasi. Grafik histogram pendugaan proporsi ditampilkan dalam lampiran 4. Analisis galat baku untuk intensitas kecacingan (jumlah cacing per individu) secara keseluruhan disajikan dalam tabel 4, sementara tabel 5 dan 6 masing-masing menunjukkan rincian tingkat prevalensi dan intensitas parasit di tiap lokasi berdasarkan jenis parasit dan jenis sampel ikan. Intensitas dari setiap lokasi juga tidak menunjukkan perbedaan yang mencolok (tumpang tindih selang intensitas kecacingan di semua lokasi).
Tabel 3 Tabel pendugaan proporsi (prevalensi) kecacingan pada populasi ikan di lokasi pengambilan sampel
Lokasi Prevalensi +/- Selang kepercayaan 95%
Selat sunda 84% 12% 72% - 96%
Bali 94% 9% 85% - 100%
NTT 90% 10% 83% - 100%
Tabel 4 Tabel analisis galat baku intensitas kecacingan di setiap lokasi pengambilan sampel
Lokasi Intensitas Galat baku Selang kepercayaan 95%
Selat sunda 4.08 1.9 2.18 - 5.98
Bali 8.17 3.62 4.55 - 11.79
Tabel 5 Prevalensi (persentase jumlah kasus dari total samp el) kecacingan di tiap lokasi berdasarkan jenis sampel ikan.
Selat Sunda Bali NTT
Ekor kuning 67% 67% 17%
Kerapu 25% 43% 17%
Tabel 6 Intensitas Nematoda dan Acanthocephala (rata-rata jumlah cacing dalam tiap kasus) di setiap lokasi berdasarkan jenis sampel ikan.
Selat Sunda Bali NTT
Tuna 0 4.5 1
Ekor Kuning 2 3.5 2.5
Kerapu 1.33 1.67 1
Keterangan: Cacing cestoda dan tematoda tidak ditampilkan karena jumlahnya terlalu kecil untuk
dibandingkan.
Tabel 7 Kategori infeksi berdasarkan prevalensi (Williams & Bunkley-Williams 1996)
Berdasarkan kategorisasi yang dikembangkan oleh Williams & Bunkley-Williams (1996) pada tabel 7, prevalensi dan intensitas di lokasi- lokasi sampel dapat dibagi menjadi:
1. Prevalensi pada lokasi Selat Sunda masuk kategori “biasanya” (Usually
70%-89%) dengan intensitas yang tergolong ringan (light 1-5), dan intensitas zoonosis sangat ringan (verylight <1)
2. Prevalensi pada lokasi Bali tergolong “hampir selalu” (almost always
90%-98%) dengan tingkat infestasi yang tergolong ringan (light 1-5), dan intensitas zoonosis ringan (light 1-5)
3. Prevalensi di NTT tergolong “hampir selalu” (almost always 90%-98%) dengan intensitas ringan (light 1-5) dan intensitas zoonosis sangat ringan (very light <1)
TUNA
Gambar 9 Box plot dari intensitas cacing parasitik nematoda (A), trematoda (B) dan acanthocephala(C) dari semua lokasi termasuk pencilan (outlier) yang ditandai dengan asterisk (*) dan lingkaran (o)
3. Kondisi Patologis
Secara patologi anatomi (PA) terlihat beberapa perubahan seperti mengelupasnya lapisan epidermis ikan, lepasnya sisik, serta ditemukannya gas yang berlebih pada rongga abdomen ikan dasar dari famili Serranidae (kerapu). Lesio traumatik juga teramati pada beberapa organ seperti insang, dan juga sirip-sirip (dorsal, ventral, pektoral dan kaudal). Namun demikian, tidak terlihat adanya perubahan yang terjadi akibat agen infeksius pada pengamatan PA. Hasil pengamatan pada sediaan histopatologi terangkum dalam Gambar 10.
Parasit berhasil ditemukan di jaringan usus ikan (lumen dan vili) dari semua lokasi, dan 20% dari total spesimen histopatologi yang diamati di setiap lokasi menunjukkan keberadaan berbagai jenis cacing parasitik. Namun demikian teknik histopatologi tidak dapat digunakan untuk mengidentifikasi genus parasit tersebut.
A B
0%
Persentase dari total spesimen yang diamati
Parasit Sel Radang Infeksi sekunder Perubahan Umum
Gambar 10 Histogram hasil pengamatan sediaan histopatologi. Batang menggambarkan persentase variabel (parasit, Sel radang, Infeksi sekunder, dan perubahan umum) dari total gelas objek yang diamati.
Gambar 11 menunjukkan cacing parasitik yang terpotong secara melintang saat pembuatan sediaan histopatologi. Walaupun cacing tidak dapat teridentifikasi sampai tingkat genus, berdasarkan morfologi organ masih dapat dikenali stadium larva (Gambar 11A) dan cacing dewasa (Gambar 11B dan 11C) di antara vili usus, atau pada lumen. Spesimen pada Gambar 11 menunjukkan berbagai perubahan pada jaringan usus seperti:
1. Distorsi pada vili karena adanya tekanan dari cacing (Gambar 11A).
2. Pembengkakan dan distorsi pada struktur vili akibat keberadaan cacing di lumen, sementara vili dipenuhi oleh sel-sel radang (Gambar 11B).
Gambar 11 Keberadaan parasit pada sediaan histopatologi pada ikan Tuna (A dan B) serta ikan ekor kuning (C). Tanda panah menunjukkan adanya parasit (kemungkinan dari filum Nemathelminthes). HE. 500X
A
B
Gambar 12 Infiltrasi sel radang ditandai dengan panah pada (A) pada usus ikan kerapu, dan bakteri pada jaringan usus ikan tuna sebagai infeksi sekunder (B) serta sel radang eosinofilik pada usus ikan tuna (C). HE. (A) 1000X. (B) 5000X. (C) 1000X
A
B
Hal-hal lain yang teramati pada sediaan histopatologi terdiri dari adanya sel-sel radang yang kebanyakan bersifat eosinofilik dan juga adanya infeksi sekunder (bakteri) seperti terlihat pada Gambar 12. Sel radang ini merupakan reaksi tanggap kebal inang terhadap agen infeksius yang masuk ke dalam tubuh inang. Ada perbedaan jenis sel radang yang muncul dalam kasus kecacingan dan infeksi bakteri. Pada Gambar 12A terlihat adanya deskuamasi sel epitel / vili dengan sel radang yang masih berada pada propria jaringan tersebut. Sel radang seperti pada Gambar 12A juga dapat menunjukkan kondisi hiperleukositosis akibat adanya pendarahan.
Selain keberadaan parasit, sel radang, dan juga infeksi sekunder (bakteri), perubahan umum yang terjadi pada saluran cerna ikan terdiri dari:
1. Atrofi vili
2. Deskuamasi sel-sel epitel yang bukan terjadi akibat proses autolisis 3. Sarang-sarang nekrosis dan peradangan
4. Edema vili (indikator peradangan)
Perubahan-perubahan umum ini dapat dipastikan sebagai reaksi terhadap infeksi kecacingan, namun ada beberapa kemungkinan patogenesa dari perubahan-perubahan umum ini. Gambar 13 menyajikan beberapa perubahan-perubahan umum yang teramati pada beberapa individu ikan inang. Perubahan ini terdiri dari:
Gambar 13 Atrofi pada vili usus ikan tuna (A), deskuamasi sel epitel pada ikan tuna (B), dan edema pada villi ikan Kerapu (C). HE. (A) 500X. (B) 1000X. (C) 2000X.
A
B
PEMBAHASAN
1. Intensitas Parasit
Intensitas larva nematoda yang tinggi dalam tiap gram daging ikan dari Bali kemungkinan disebabkan oleh kondisi sistem pertahanan tubuh inang (IL-4 dan IL-10) yang menyebabkan larva cacing Anisakis sp. bermigrasi ke luar saluran cerna (Schopf et al. 2002), dan memilih jaringan lemak di mesenterium usus untuk bertahan hidup dan tumbuh (Strømnes & Andersen 2003). Lokasi mesenterium ini berdekatan dengan daging (otot) di sekeliling abdomen, sehingga cacing dapat juga masuk ke dalam jaringan ini. Sistem pertahanan tubuh inang sangat dipengaruhi lingkungan perairan. Limbah buangan dari banyak hotel di sekitar perairan di Bali berpengaruh terhadap kualitas perairan habitat ikan. Disamping itu, banyaknya lumba- lumba (inang definitif Anisakis
sp.) di perairan ini mengakibatkan banyaknya telur dan larva cacing parasitik tersebut di perairan Bali.
Banyaknya lumba- lumba dan paus sebagai inang definitif Anisakis sp. di perairan Pulau Lembata NTT tidak disertai tingginya intensitas Nematoda zoonotik Anisakis sp. pada ikan. Bahkan tidak ada cacing ditemukan dari 12 ikan kembung yang ditangkap oleh nelayan di perairan lintasan paus dan lumba- lumba di Lamalera, NTT (data tidak ditampilkan untuk analisis). Rendahnya jenis parasit yang ditemukan di lokasi NTT dapat disebabkan oleh dua kemungkinan yaitu: terbatasnya penyebaran parasit secara alami, dan/atau dominasi oleh jenis-jenis parasit tertentu. Pada sampel ikan tuna di NTT, terlihat dominasi jenis-jenis parasit Acanthocephala (prevalensi 100% pada sampel ikan tuna).
Dari pengamatan di lokasi Selat Sunda, Bali dan NTT dapat diperkirakan bahwa faktor kualitas air merupakan faktor utama yang mempengaruhi reaksi tanggap kebal ikan, yang akhirnya mempengaruhi tingginya intensitas cacing zoonotik pada saluran cerna dan juga daging ikan sampel.
Bila dibandingkan secara keseluruhan, intensitas kecacingan pada ikan di semua lokasi sampel memang tidak menunjukkan perbedaan yang mencolok; namun bila ditelaah lebih jauh, variasi intensitas tiap jenis cacing parasitik pada setiap inang dapat diamati. Variasi intensitas ini disebabkan oleh: banyaknya parasit (jumlah dan jenis) di perairan tersebut, kualitas air di masing- masing lokasi (Nabib & Pasaribu 1989), dan juga kemampuan tanggap kebal inang (Wakelin 1984). Sebaran dan pola diet ikan tuna memungkinkan banyaknya jumlah dan jenis parasit yang masuk ke dalam tubuh ikan tersebut, sementara kualitas perairan juga akan mempengaruhi kemampuan tanggap kebal ikan untuk menghadapi infestasi cacing parasitik.
Dari box plot pada Gambar 6 terlihat bahwa cacing parasitik nematoda dapat menginfeksi semua jenis ikan dengan variasi intensitas yang beragam, sementara trematoda hanya menginfeksi ikan ekor kuning dan kerapu (dengan pengecualian pada beberapa ikan tuna) dan acanthocephala hanya menginfeksi ikan tuna. Hal ini menunj ukkan bahwa banyaknya nematoda dan acanthocephala sangat bervariasi di lokasi- lokasi pengambilan sampel sementara banyaknya trematoda relatif sama di semua lokasi.
2. Infestasi Cacing Parasitik dan Kondisi Patologis
Berdasarkan perbandingan persentase variabel patologis dan prevalensi/intensitas kecacingan, maka terlihat pola yang sama pada kondisi enteritis (peradangan) dan intensitas cacing parasitik seperti terangkum dalam Tabel 8. Analisis korelasi yang dilakukan antara persentase enteritis dengan intensitas dari setiap lokasi menunjukkan koefisen korelasi sebesar 0.96. Mengacu pada koefisien korelasi ini, kemungkinan besar persentase enteritis berhubungan erat dengan intensitas infestasi cacing parasitik. Variabel patologis lainnya tidak menunjukkan hubungan yang erat dengan prevalensi maupun intensitas cacing parasitik. Hasil analisis korelasi dengan koefisien Pearson ditampilkan pada Lampiran 2.
Tabel 8 Perbandingan persentase radang (enteritis) dengan intensitas dan prevalensi kecacingan di masing- masing lokasi.
Lokasi Persentase Intensitas Prevalensi
Selat Sunda 0.7 1.88 0.84
Bali 0.9 3.38 0.94
NTT 1 5.42 0.9
Keterangan: * = persentase enteritis dari total spesimen histopatologi yang diamati
Infeksi sekunder yang ditemukan terdiri dari bakteri coccus dan baccillus
Edema radang pada vili dan juga mukosa tidak terwarnai oleh metode HE, oleh karenanya ruang yang ditempati oleh jenis sel-sel ini terlihat sebagai rongga kosong di vili usus pada sediaan histopatologi. Mukus pada vili usus dihasilkan oleh sel goblet dan merupakan salah satu mekanisme pertahanan inang terhadap infestasi cacing di dalam saluran cerna, dengan demikian keberadaan sel goblet di vili usus berhubungan erat dengan infestasi cacing parasitik pada saluran cerna (Tiuria et al. 2000). Edema radang tidak dapat terwarnai dalam kondisi enteritis karena:
1. Ada gap pada sub epitelium antara membran basal dengan jaringan propria.
2. Terjadi di dalam propria di antara sel-sel radang dan vaskula propria.
3. Enteritis parah yang mencapai jaringan sub mukosa.
Kondisi patologis lainnya seperti deskuamasi sel epitel serta vili usus yang luruh ke dalam lumen dapat dijelaskan dengan beberapa kemungkinan seperti yang terjadi dalam proses fiksasi. Pada beberapa pengamatan, sel-sel radang terlihat memenuhi ruang di bawah lapisan epitel yang terangkat. Ada kemungkinan besarnya jumlah sel radang mengakibatkan edema lapisan epitel yang memungkinkan sel radang mencapai lokasi infeksi lebih cepat. Deskuamasi epitel mukosa usus terjadi post mortem, mekanisme pemotongan, dan juga akibat peradangan.
3. Pemetaaan Infestasi Cacing Parasitik
#
#
#
Idn_adm2.shp Zoonosis_daging.dbf
# 0
# 0 - 0.05
# 0.05 - 1.04
500 0 500 1000 1500 Kilometers
N
E W
S
Gambar 14 Pemetaan risiko zoonosis berdasarkan intensitas cacing yang ditemukan pada tiap gram daging ikan. Lingkaran merah menunjukkan tingkat risiko berdasarkan intensitas cacing (jumlah cacing per gram daging).
Ñ
Ñ
Ñ
Idn_adm2.shp Enteritis_prev.dbf
Ñ 0.7
Ñ 0.7 - 0.9
Ñ 0.9 - 1
500 0 500 1000 1500 2000 Kilometers
N
E W
S
Gambar 15 Persentase enteritis pada ikan dari lokasi- lokasi pengambilan sampel. Persentase digambarkan dengan tanda silang berwarna merah di tiap-tiap lokasi. Besarnya tanda silang berkorelasi dengan tingginya persentase peradangan pada saluran cerna ikan.
4. Pendugaan Kesehatan Pada Satwa Perairan
Infeksi cacing parasitik akibat predasi dan juga ingesti larva telah dipelajari dalam penelitian Køie (2001) yang menunjukkan bahwa jenis ikan
Gasterosteus aculeatus terinfeksi cacing Anisakis sp. akibat memakan inang (krustasea atau ikan) yang sudah mengandung L3. Penelitian yang sama juga menunjukkan bahwa L3 dapat hidup selama 6 minggu secara bebas di air payau. Setelah masuk ke dalam tubuh inang, L3 melakukan enkapsulasi di jaringan otot ikan Gasterosteus aculeatus dan Plathichthys flesus (ikan sebelah) di mana larva tersebut dapat bertahan hidup sampai 2 tahun (Køie 2001).
Tabel 9 Indikator pendugaan jenis cacing parasitik yang dapat menginfestasi satwa perairan lainnya berdasarkan kesamaan sebaran dan pola diet (informasi di dapat dari Encarta Reference Library Premium 2005).
Jenis Ikan Sebaran Pola diet Indikator Pendugaan
untuk
Tuna Pelagis Ikan Lumba-lumba, paus pilot,
paus pembunuh (orca), hiu
Ekor Kuning Pelagis Plankton, udang Paus biru, Paus bungkuk,
Pari manta, Hiu Paus
Kerapu Dasar Ikan, krustasea Lumba-lumba, Pari
Kecacingan
pola pergerakan satwa dan juga arus perairan. Kecacingan dapat menyebabkan rendahnya produktifitas satwa yang terinfeksi (kurus dan reproduksi rendah). Menurut Buchmann & Bresciani (2001), kecacingan pada ikan dapat menimbulkan kondisi patologis seperti: letargi, anoreksi, inflamasi (peradangan), ascites atau dropsy yang pada akhirnya dapat menurunkan jumlah populasi ikan di alam. Kecacingan pada ikan dapat juga mengakibatkan rendahnya nilai ekonomis ikan tangkapan yang pada akhirnya mengakibatkan menurunnya penghasilan nelayan. Morton et al. (2004) menunjukkan bahwa infestasi parasit dapat menyebabkan penurunan stok ikan salmon di perairan British Columbia, Kanada sampai 98% dan 87%.
Pada mamalia laut, kecacingan juga dapat menyebabkan berbagai macam perubahan patologis. Pascual et al. (2000) menunjukkan bahwa jenis cacing nematoda Crassicauda sp. menyebabkan lesio dan erosi pada tengkorak lumba-lumba hidung botol (Tursiops truncatus). Lesio semacam ini dapat juga disertai infeksi sekunder maupun infeksi simpatrik (Pascual et al. 2000).
Aspek Kesehatan Lainnya
Selain pendugaan status kecacingan, beberapa aspek kesehatan lain yang dapat diamati pada satwa liar perairan meliputi:
1. Lesio epidermal dengan pengamatan visual dan fo tografi. Berdasarkan dari pengamatan foto dari populasi lumba- lumba Stenella longirostris di perairan Lovina Bali, 35 dari 280 individu (12.5%) terlihat memiliki lesio pada sirip atau permukaan dorsal. Lesio traumatik semacam ini dapat timbul akibat interaksi agresif antara lumba- lumba (Cahill 2000) ataupun akibat benturan dengan lalu lintas kapal laut yang juga dapat mengganggu pola istirahat dan sosialisasi lumba- lumba (Lusseau 2003). Wilson et al.
2. Kadar imunosupresan (organoklorin, logam berat, PCB) pada daging, usus, dan lemak (blubber) mamalia laut (Birkun 2002). Zat-zat ini dapat menurunkan daya tahan tubuh satwa dan menjadikannya rentan terhadap serangan agen infeksius yang ada di perairan tempat hidupnya. Tingginya kadar organoklorin di perairan mengakibatkan penumpukan konsentrasi bahan kimia ini di jaringan tubuh hewan. Posisi hewan tersebut dalam rantai makanan tidak berkorelasi dengan konsentrasi organoklorin di jaringan tubuh (Hoekstra et al. 2003).
SIMPULAN
• Cacing parasitik bersifat zoonosis ditemukan di semua lokasi pengambilan sampel.
• Kelompok ikan tuna merupakan jenis ikan dengan variasi intensitas infestasi cacing parasitik nematoda dan acanthocephala yang tinggi
• Pengelompokkan data dan informasi menggunakan pemetaan sederhana dapat menunjukkan perbedaan prevalensi dan intensitas tiap genera cacing parasitik secara geografis.
• Perubahan patologis pada saluran cerna ikan dapat digunakan untuk mendeteksi keberadaan cacing parasitik pada saluran cerna ikan.
• Ada korelasi antara persentase kejadian enteritis dengan tingkat infestasi cacing parasitik pada ikan
SARAN
• Memasak ikan (terutama ikan jenis pelagis bebas seperti tuna, cakalang, dan tenggiri) dengan sempurna sebelum dikonsumsi untuk menghindari risiko zoonosis
• Pene litian lanjutan dengan jumlah sampel dan titik pengambilan sampel lebih banyak untuk menyempurnakan pemetaan
• Identifikasi parasit pada satwa perairan lainnya (lumba- lumba, paus, hiu, pari, dll) untuk menguatkan kemungkinan penggunaan ikan sebagai indikator pendugaan status kecacingan pada satwa perairan.
• Melakukan analisis prevalensi/intensitas infestasi cacing parasitik pada satwa perairan lainnya untuk dibandingkan dengan prevalensi/intensitas pada ikan indikator.
• Menggunakan teknik histopatologi dan juga imunohistokimia untuk mengidentifikasi infestasi cacing parasitik.
Allen G. 2000. Marine Fishes Of South-East Asia; A Field Guide for Anglers and Divers. Singapore. Periplus Editions (HK) Ltd.
Arthur JR, Lumanlan-Mayo, S. 1997. Checklist of the parasites of fishes of the Phillipines. FAO Fisheries Technical Papers. No 369. Rome, FAO
Auckland Allergy Clinic. 2003. Seafood Allergy. Auckland Allergy Clinic. [website] http://www.allergyclinic.co.nz/guides/51.html [1 September 2005]
Berón-Vera B. et al. 2001; Gastrointestinal helminths of Commerson’s dolphins
Cephalorhynchus commersonii from central Patagonia and Tierra del
Fuego; Diseases Of Aquatic organisms. Vol. 47: 201–208, 2001
Bircher AJ, Gysi B, Zenklusen HR. Aerni R. 2000; Eosinophilic oesophagitis associated with recurren urticaria: Is there a worm (Anisakis simplex) in the rose?; Schweiz Med Wochenschr 2000;130: 1814-9 Peer reviewed article
Birkun A, Jr..2002. Natural Mortality Factors affecting cetaceans in the Black Sea. In: G. Notarbartolo di Sciara (Ed.), Cetaceans of the Mediterranean and Black seas: state of knowledge and conservation strategies. A report to ACCOBAMS Secretariat, Monaco, February 2002 Section 16, 13p.
Buchmann K, Bresciani J. 2001. An Introduction to Parasitic Diseases of Freshwater Trout. Denmark. DSR Publisher.
Cahill T. 2000. Dolphins. USA. MacGillivray Freeman Films – National Geographic Societies
Duff P. 2003. Wildlife Disease Surveillance by the Veterinary Laboratory Agency. Microbiology Today Vol 30. November 2003
Duignan PJ, Gibbs, NJ, Jones, GW. 2003. Part 2: Autopsy of cetaceans incidentally caught in fishing operations 2000/02. Doc Science Internal Series 119. New Zealand Dept. Of Conservation, Wellington. 66p.
Garrison T. 1993. Oceanography-An Invitation to Marine Science. Belmont California. Wadsworth Publishing Company
Hadidjaja P, Ilahude HD, Mahfudin H, Burhanuddin, Hutomo M. 1978. Larvae of Anisakidae in marine fish of coastal waters near Jakarta, Indonesia [abstract]. Am J Trop Med Hyg. 1978 Jan;27(1 Pt 1):51-4.
Hilderbrand KS Jr, Price RJ, Olson RE. 2003. Parasites in Marine Fishes
Questions and Answers for Seafood Retailers National Sea Grant College Program of the U.S. Department of Commerce’s National Oceanic and Atmospheric Administration.
Hoekstra PF. et al. 2003. Trophic transfer of Persistent Organochlorine (OCs) within an Arctic Marine Food Web from the Souther Beaufort-Chukchi Seas. Environmetal Pollution (2003) 509-522
Ilahude HD, Hadidjaja P, Mahfudin H 1978. Survey on Anisakid larvae in marine fish from fish markets in Jakarta [abstract]. Southeast Asian J Trop Med Public Health. 1978 Mar;9(1):48-50.
Kahn B. 2001. Komodo National Park Cetacean Survey; TNC, APEX Environment
Karanth U, Nichols JD, 2002. Monitoring Tigers andTheir Prey – A Manual for researchers, managers, & conservationists in tropical Asia. India. Centre For wildlife Studies.
Kennedy MW. 2000. Immune response to Anisakis simplex and other ascarid nematodes. Allergy 2000: 55: Suppl 59: 7±13
Køie M,. 2001. Experimental infections of copepods and sticklebacks
Gasterosteus aculeatus with small ensheathed larvae of Anisakis simplex
(Nematoda, Ascaridoide, Anisakidae). Parasitol Res2000;87: 32-36
Kusumamihardja S. 1995. Parasit dan parasitosis pada hewan ternak dan hewan piaraan di Indonesia. Bogor. Pusat Antar Universitas. IPB
Lopez-Serrano MC., Alonso-Gómez A, Moreno-Ancillo A, Dashner A, Suárez de Parga J., 2000; Gastroallergic anisakiasis: immediate hypersensitivity due to Anisakis simplex; Allergol Imunol Clin 2000;15: 230-236
Lusseau D. 2003. Effects of tour boats on the behavior of bottlenose dolphins: using Markov chains to model anthropogenic impacts. Conserv. Biol.
17:1785-1793
Morton A, Routledge R, Peet C, Ladwig, A. 2004. Sea lice (Lepeophtheirus salmonis) infection rates on juvenile pink (Oncorhynchus gorbuscha) and chum salmon (Oncorhynchus keta) in the nearshore marine environment of British Columbia. Canadian Journal of Fisheries and Aquatic Sciences 61: 147-157
Nabib R, Pasaribu FH. 1989. Bahan Pengajaran Patologi dan Penyakit Ikan. Bogor. Departemen Penididikan dan Kebudayaan Direktorat Jenderal Pendidikan Tinggi Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor
Noble ER, Noble GA. 1989. Parasitologi Biologi Parasit Hewan. Edisi ke-5. Wardiarto, penerjemah; Soeripto N. editor. Yogyakarta. Gadjah Mada University Press. Terjemahan dari: Parasitology: The Biology of Animal Parasites 5th edition
Orlandi PA, Chu DT, Bier JW, Jackson GJ,. 2002. Parasites and the Food Supply. Food Technology Vol 56 No 4. April
Pascual S, Abollo E, Lopez A. 2000. Elemental analysis of cetacean skull lesions associated with nematode infections. Dis Aquat Org. Vol 42:71-75
Permin A, Hansen JW. 1998. Epidemiology, Diagnosis and Control of Poultry
Parasites. Rome. Food And Agriculture Organization (FAO) of the
United nations
Pet-Soede (editor), 2002; The Solor And Alor Islands Expedition Results; TNC, WWF, David And Lucille Packard Foundation
Reeves RR, Smith BD, Crespo EA, di Sciara GN. 2003. Dolphins, Whales, and Porpoises: 2002-210 Conservation Action Plan for World’s Cetacean. Switzerland-UK. IUCN/SSC Cetacean Specialist Group. IUCN
Schopf LR, Hoffman KF, Cheever AW, Urban Jr JF, Wynn TA.. 2002. IL-10 Is Critical for Host Resistance and survival During Gastrointestinal Helminth Infection. The Journal of Immunology, 168: 2383–2392
Soulsby EJL. 1982. Helmithns, Arthropods, And Protozoa of Domesticated animals. Edisi ke-7. London. Bailiere-Tindall
Sugawara Y, Urawa S, Kaeiyama M. 2004. Infection of Anisakis simplex (Nematoda: Anisakidae) larvae in chum salmon (Oncorhynchus keta) in
the North Pacific Ocean, Bering Sea, and a river of Hokkaido.
Hokkaido Jpn. North Pacific Anadromus Fish Commission (NPAFC doc. 791) Hokkaido Tokai University.
Tiuria R et al. 2000. Pengaruh Infeksi Cacing Ascaridia galli Terhadap respon Sel goblet dan Sel Mast pad Usus Halus Ayam Petelur. Majalah Parasitologi Indonesia 13 (1-2): 40-48
Tiuria R, Handajani SU, Hariyadi ARS. 2004. Telaah endoparasit pada satwa liar Badak Jawa (Rhinoceros sondaicus) di Taman Nasional Ujung Kulon. Laporan Penelitian Program SP-4 FKH-IPB
Uga S, Ono K, Kataoka N, Hasan H. 1996. Seroepidemiology of five major zoonotic parasite infections in inhabitants of Sidoarjo, East Java, Indonesia. [abstract] Southeast Asian J Trop Med Public Health. 1996 Sep;27(3):556-61.
Wakelin D. 1984. Immunity to Parasite, How animals control parasitic infections. London. Edward Arnold-a division of Hodder and Stoughton
Williams EH Jr, Bunkley-Williams L. 1996. Parasites Of Offshore Big Game fishes in Puerto Rico and Western Atlantic. Puerto Rico. Department of Natural and Environmental Resources and The University of Puerto Rico
Wilson B, et al. 1999. Epidermal diseases in Bottlenose dolphis: Impacts of natural and anthropogenic factors. Proc. R. Soc. Lond. B. 266: 1077-1083
Yamaguti S. 1958. Systema Helminthum. Volume ke-1. The digenetic tramatodes of fishes. New York. Interscience Publishers, Inc.
Yman L, 2000. Specific IgE in the diagnosis of parasite- induced allergy. Allergy
Lampiran 1. Daftar Temuan Cacing Parasitik dan Inang
Kode Ikan Klasifikasi Genus 1 Genus 2 Stadium Zoonosis
Ekuning 2 Nematoda Procamallanus Dichelyne Dewasa
Ekuning 20 cestoda unidentified Plerocercoid
Ekuning 3 Nematoda Anisakis Pseudoterranova Larva 3 8
Procamallanus Dewasa
Dichelyne Dewasa
Dewasa
ekuning 4 dewasa
Ekuning 5 Anisakis Pseudoterranova Larva 3 8
Krapu 1 Cestoda Plerocercoid
Krapu 11 Bothriocephalus plerocercoid
Krapu 19 plerocercoid
Unidentified plerocercoid
Nematoda Capilaria dewasa 8
Krapu 6 cestoda Unidentified plerocercoid
Krapu 8A Nematoda Procamallanus Dichelyne Dewasa
Krapu 8E Cestoda Unidentified Plerocercoid
Plerocercoid
Tuna 1 Trematoda Echinochasmus Dewasa 8
Magnacetabulum Haplosplanchnus Dewasa
Philopinna Dewasa
Unidentified dewasa
Wardula Monostomum Dewasa
Tuna 10 Acanthocephala Leptorhynchoides Rhadinorhynchus Dewasa
Dewasa
Dewasa
Rhadinorhynchus Leptorhynchoides Dewasa
Nematoda Anisakis Larva 3 8
Larva 3
Tuna 12 Trematoda
Tuna 16 Acanthocephala Leptorhynchoides Rhadinorhynchus Dewasa
Dewasa
Tuna 18 Cestoda sitiserkus
Tuna 2 Nematoda Anisakis Larva 3 8
tuna 20 acanthocephala Serrasentis Bulbosoma dewasa 8
Cestoda Bothriocephalus plerocercoid
Trematoda Tetrochetus Pseudopecoeloides Dewasa
Tuna 23 trematoda Unidentified dewasa
Tuna 24 Lecithocladium dewasa
Tuna 3 Nematoda Anisakis Larva 3 8
Larva 3
Tuna 32 Trematoda Hirudinella Dewasa
Tuna 4 Cestoda Unidentified Procercoid
Nematoda Anisakis Larva 3
Tuna 5 Larva 3
Tuna 6 Trematoda
Tuna 7 Acanthocephala Leptorhynchoides Rhadinorhynchus Dewasa
Nematoda
Anisakis Larva 3
Tuna 9 Acanthocephala Leptorhynchoides Rhadinorhynchus Dewasa
Lampiran 2. Perhitungan Statistika – Analisis Korelasi Patologi dan Infestasi Cacing Parasitik
Analisis berdasarkan korelasi Pearson (r):
Lokasi Persentase Prevalensi cacing Lokasi Persentase Intensitas cacing
Selat Sunda 70% 0.84 Selat Sunda 70% 1.88
Bali 90% 0.94 Bali 90% 3.38
NTT 100% 0.9 NTT 100% 5.42
r = 0.74 r = 0.96
Lokasi Persentase Intensitas cacing Lokasi Persentase Prevalensi cacing
Selat Sunda 25% 1.88 Selat Sunda 25% 0.84
Bali 70% 3.38 Bali 70% 0.94
NTT 4% 5.42 NTT 4% 0.9
r = (0.39) r = 0.58
Lokasi Persentase Intensitas cacing Lokasi Persentase Prevalensi cacing
Selat Sunda 85% 1.88 Selat Sunda 85% 0.84
Bali 100% 3.38 Bali 100% 0.94
NTT 79% 5.42 NTT 79% 0.9
r = (0.36) r = 0.61
ENTERITIS (SEL RADANG)
INFEKSI SEKUNDER (BAKTERI)
Lampiran 3. Analisis Intensitas cacing parasitik dengan menggunakan Standard Error Mean (SEM)
Bali NTT Selat Sunda
Mean +- 2 SE Nematoda
Mean +- 2 SE Acanthocephala
Bali NTT Selat Sunda
Mean +- 2 SE Trematoda
Lampiran 4. Analisis Prevalensi Dengan Menggunakan Uji Proporsi
0% 20% 40% 60% 80% 100% 120%
Selat sunda Bali NTT
Lokasi
Prevalensi (%)
Prevalensi
Lokasi Prevalensi
Selat sunda 84% 0.00375766 0.0613 12%
Bali 94% 0.0019469 0.044124 9%
NTT 90% 0.00242803 0.049275 10%
Uji Proporsi (+/-)
Prevalensi cacing parasitik pada semua jenis ikan di setiap lokasi tidak menunjukkan perbedaan. Uji proporsi memberikan error bar yang saling overlap
Lampiran 5. Analisis box plot untuk Intensitas parasit pada semua jenis ikan per lokasi
Lembata Lovina B Selat Su
Lokasi
0.00 2.00 4.00 6.00 8.00 10.00
Juml_Parasit
34
Intensitas cacing parasitik di setiap lokasi pengambilan sampel tidak
Lampiran 6. Komposisi intensitas cacing parasitik dari setiap lokasi
Selat Sunda Bali NTT
0.00 1.00 2.00 3.00
4.00 Cestoda