INDUKSI TETRAPLOID JERUK SIAM SIMADU (
Citrus nobilis
Lour.) MENGGUNAKAN KOLKISIN SECARA
IN VITRO
FITRI YULIANTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Induksi Tetraploid
Jeruk Siam Simadu (Citrus nobilis Lour.) Menggunakan Kolkisin secara In
Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
FITRI YULIANTI. Induksi Tetraploid Jeruk Siam Simadu (Citrus nobilis Lour.) Menggunakan Kolkisin secara In Vitro. Dibimbing oleh AGUS PURWITO, DINY DINARTI dan ALI HUSNI.
Buah tanpa biji merupakan salah satu kriteria yang diperlukan untuk dapat meningkatkan kualitas jeruk Siam Simadu. Metode yang paling efektif untuk mendapatkan jeruk Siam Simadu tanpa biji adalah dengan cara menyilangkan antara tetua tetraploid dan diploid. Tujuan penelitian ini adalah untuk mendapatkan planlet jeruk Siam Simadu tetraploid yang akan dijadikan sebagai tetua untuk menghasilkan jeruk Siam Simadu tanpa biji. Penelitian dilaksanakan di Laboratorium Biologi Sel dan Jaringan BB-Biogen dan Laboratorium Micro Technique Departemen Agronomi dan Hortikultura IPB, Bogor pada Bulan Januari-Agustus 2013. Tunas pucuk tanpa daun, tunas samping tanpa daun dan embrio somatik fase globular jeruk Siam Simadu diberikan perlakuan empat konsentrasi kolkisin yang berbeda (0%, 0.1%, 0.2%, dan 0.3%) selama 3 jam (tunas pucuk), 6 jam (tunas samping) dan 1 jam (globular).
Hasil penelitian induksi tetraploid tunas pucuk jeruk Siam Simadu secara in vitro menunjukkan bahwa perlakuan kolkisin menurunkan pertumbuhan tunas pucuk jeruk Siam Simadu. Daun tunas pucuk yang diberikan perlakuan kolkisin lebih tebal dibandingkan dengan daun tunas pucuk kontrol. Jumlah kloroplas dari daun tunas yang dihasilkan dari kontrol (kolkisin 0%) dan perendaman kolkisin 0.1% adalah 8.67 dan 18.25 kloroplas per pasang sel penjaga. Daun dari tunas perlakuan kolkisin 0.1% memiliki ukuran stomata yang lebih besar dibandingkan dengan tunas kontrol. Daun dari tunas perlakuan kolkisin 0.1% memiliki kerapatan stomata yang lebih rendah dibandingkan dengan tunas kontrol. Tunas jeruk Siam Simadu tetraploid dihasilkan pada perlakuan kolkisin 0.1%.
Hasil penelitian induksi tetraploid tunas samping jeruk Siam Simadu secara in vitro menunjukkan bahwa tunas yang diberikan perlakuan kolkisin lebih tinggi tanamannya dari pada tunas kontrol. Tunas yang diberikan perlakuan kolkisin memiliki daun yang lebih lebar dari pada tunas kontrol. Daun tunas yang diberikan perlakuan kolkisin lebih tebal dibandingkan dengan daun tunas kontrol. Perlakuan kolkisin meningkatkan jumlah kloroplas per pasang sel penjaga. Daun dari tunas yang diberikan perlakuan kolkisin memiliki ukuran stomata yang lebih besar dibandingkan dengan tunas kontrol. Daun dari tunas yang diberikan perlakuan kolkisin memiliki kerapatan stomata yang lebih rendah dibandingkan dengan tunas kontrol.
Hasil penelitian induksi tetraploid embrio somatik jeruk Siam Simadu secara in vitro menunjukkan bahwa perlakuan kolkisin dengan konsentrasi tinggi dapat meningkatkan persentase planlet abnormal. Planlet tetraploid Jeruk Siam Simadu dihasilkan pada perlakuan kolkisin 0.2% dan 0.3%.
SUMMARY
FITRI YULIANTI. The In Vitro Tetraploid Induction of Tangerine (Citrus nobilis Lour.) Using Colchicines. Supervised by AGUS PURWITO, DINY DINARTI and ALI HUSNI.
Seedless fruit is one of the criteria necessary to improve the quality of Simadu tangerine. The most effective method to obtain seedless triploid cultivars is hybridisation between tetraploid and diploid parents. The aim of this research was to obtain tetraploid Simadu tangerine planlet which would serve as parent to produced seedless Simadu tangerine. The experiment was conducted at Biology Cell and Tissue Laboratory of BB-Biogen and Micro Technique Laboratory of Agronomy and Horticulture Department, IPB, Bogor from January to August 2013. In vitro Simadu tangerine shoot-tips without leaves, lateral shoots without leaves and somatic embryos globular phase were treated with colchicines at four different concentrations (0%, 0.1%, 0.2%, and 0.3) for 3 hours (Shoot-tips), 6 hours (lateral shoots) and 1 hour (globular).
The result of in vitro tetraploid induction of tangerine shoot-tip showed that colchicine treatments reduced growth of shoot-tip of Simadu Tangerine. The leaves of colchicines treated shoots were thicker than control. Leaves from control (0% colchicine) and 0.1% colchicine treated shoots had 8.67 and 18.25 chloroplasts per pair of guard cells. Leaves from 0.1% colchicine treated shoots had stomata sizes were larger than control shoots. Leaves from 0.1% colchicine treated shoots had stomata density was lower than control shoots. The tetraploid Simadu tangerine shoots were produced by the treatment of 0.1% colchicine.
The result of in vitro tetraploid induction of tangerine shoot-tip showed that the shoots of colchicines treated were taller than control. The shoots of colchicines treated had leaves were wider than control. The colchicines treatments increased numbers of chloroplasts per stomata guard cell. Leaves from colchicine treated shoots had stomata sizes were larger than control shoots. Leaves from colchicine treated shoots had stomata density was lower than control shoots.
The result of in vitro tetraploid induction of tangerine somatic embryos showed that colchicine treatments with high concentration increased abnormal planlet percentage. The tetraploid Simadu tangerine planlets were produced using 0.2% colchicine and 0.3% colchicine.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
INDUKSI TETRAPLOID JERUK SIAM SIMADU (
Citrus nobilis
Lour.) MENGGUNAKAN KOLKISIN SECARA
IN VITRO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2014
Judul Tesis : Induksi Tetraploid Jeruk Siam Simadu (Citrus nobilis Lour.) Menggunakan Kolkisin secara In Vitro
Nama : Fitri Yulianti NIM : A253110131
Disetujui oleh Komisi Pembimbing
Dr Ir Agus Purwito, MScAgr Ketua
Dr Ir Diny Dinarti, MS Anggota
Dr Drs Ali Husni, MSi Anggota
Diketahui oleh
Ketua Program Studi Pemuliaan dan
Bioteknologi Tanaman
Dr Ir Yudiwanti Wahyu EK, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 24 Desember 2013
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu Wa Ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2013 ini ialah penggandaan kromosom, dengan judul Induksi Tetraploid Jeruk Siam Simadu (Citrus nobilis Lour.) Menggunakan Kolkisin secara In Vitro. Bagian dari tesis ini diajukan untuk diterbitkan di Jurnal Agronomi Indonesia dengan judul Induksi Tetraploid Tunas Pucuk Jeruk Siam Simadu (Citrus nobilis Lour.) Menggunakan Kolkisin secara In Vitro.
Ungkapan terima kasih penulis sampaikan kepada :
1. Ibu Sopiah, Ayah Mudro, Ka Faizah, Ka Fauzih, Adik Fajri, Ka Muslim, Ka Lina, De Rifat serta seluruh keluarga, atas segala doa dan kasih sayangnya. 2. Dr Ir Agus Purwito, MScAgr, Dr Ir Diny Dinarti, MSi dan Dr Drs Ali Husni,
MSi selaku pembimbing.
3. Dr Ir Trikoesoemaningtyas, MSc selaku ketua program studi Pemuliaan dan Bioteknologi Tanaman yang lama dan Dr Ir Yudiwanti Wahyu EK, MS selaku ketua program studi Pemuliaan dan Bioteknologi Tanaman yang baru.
4. Dr Ir Ni Made Armini Wiendi, MS selaku penguji luar komisi pada ujian Tesis.
5. Direktorat Jenderal Pendidikan Tinggi (DIKTI) yang memberikan beasiswa unggulan calon dosen.
6. Lembaga Penelitian dan Pengembangan Masyarakat Institut Pertanian Bogor atas sebagian biaya penelitian melalui Hibah Pascasarjana atas nama Dr Ir Agus Purwito, MScAgr.
7. Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB BIOGEN) yang memberikan fasilitas penelitian. 8. Dr Titien Ng. Praptosuwiryo dari LIPI Kebun Raya, Joko Mulyono teknisi
Laboratorium Micro Technique Departemen AGH IPB, serta Joko Tamami, Dr Mia Kosmiatin, dan Prof Dr Ika Mariska, APU dari BB BIOGEN yang telah memberi masukan pada penelitian tesis saya.
9. Tim Dosen Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB yang telah memberikan ilmu yang sangat bermanfaat.
10.Sahabatku Ony, Hoti, Nahrin, Arti, Nita, dan Nyun, teman-teman kosn, teman-teman kerja dan bermain di AGH, serta teman-teman seperjuangan Pemuliaan dan Bioteknologi Tanaman mbak winda, mbak eka, dan lain-lain.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2014
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN ix
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 1
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
2 TINJAUAN PUSTAKA 3
Tanaman Jeruk 3
Jeruk Siam Simadu 4
Buah Jeruk Tanpa Biji 5
Perkembangan Penelitian Tanaman Jeruk Tetraploid 5
Induksi Mutasi Kromosom dengan Mutagen Kimia 6
Mitosis Sel Somatik 7
3 METODE 8
Bahan 8
Alat 9
Prosedur Analisis Data 9
Pelaksanaan Percobaan 9
4 HASIL DAN PEMBAHASAN 12
Kondisi Umum 12
Percobaan I. Induksi Tetraploid Tunas Pucuk Jeruk Siam Simadu
(Citrus nobilis Lour.) Menggunakan Kolkisin secara In Vitro 14 Percobaan II. Induksi Tetraploid Tunas Samping Jeruk Siam Simadu
Menggunakan Kolkisin secara In Vitro 21
Percobaan III. Induksi Tetraploid Embrio Somatik Jeruk Siam Simadu
Menggunakan Kolkisin secara In Vitro 27
Perbandingan antara Induksi Tetraploid Tunas Pucuk, Tunas Samping, dan Embrio Somatik Jeruk Siam Simadu Menggunakan Kolkisin secara
In Vitro 30
Pembahasan Umum 30
5 SIMPULAN 33
Simpulan 33
DAFTAR PUSTAKA 33
RIWAYAT HIDUP 42
DAFTAR TABEL
1 Jumlah dan panjang akar tunas pucuk jeruk Siam Simadu yang diberikan perlakuan kolkisin pada media MS + vitamin MS + IBA 3
ppm selama satu bulan 18
2 Jumlah dan panjang akar tunas pucuk jeruk Siam Simadu yang diberikan perlakuan kolkisin pada media MS + vitamin MS + NAA 3
ppm selama satu bulan 18
3 Pengaruh perlakuan konsentrasi kolkisin terhadap tebal daun dan
jumlah kloroplas per pasang sel penjaga 19
4 Pengaruh perlakuan konsentrasi kolkisin terhadap ukuran panjang
dan lebar stomata serta kerapatan stomata 20
5 Jumlah kloroplas daun pertama, ketiga, dan kelima tunas perlakuan
kolkisin 0.1% 21
6 Jumlah dan panjang akar tunas pucuk jeruk Siam Simadu yang diberikan perlakuan kolkisin pada media MS + vitamin MS + IBA 3
ppm selama satu bulan 26
7 Jumlah dan panjang akar tunas pucuk jeruk Siam Simadu yang diberikan perlakuan kolkisin pada media MS + vitamin MS + NAA 3
ppm selama satu bulan 26
8 Pengaruh perlakuan konsentrasi kolkisin terhadap tebal daun dan
jumlah kloroplas per pasang sel penjaga 26
9 Pengaruh perlakuan konsentrasi kolkisin terhadap ukuran panjang
dan lebar stomata serta kerapatan stomata 27
10 Persentase planlet normal dan abnormal yang dihasilkan setelah
perlakuan kolkisin 28
11 Persentase planlet diploid dan tetraploid yang dihasilkan setelah
perlakuan kolkisin 29
12 Jumlah kromosom planlet diploid dan tetraploid 29
DAFTAR GAMBAR
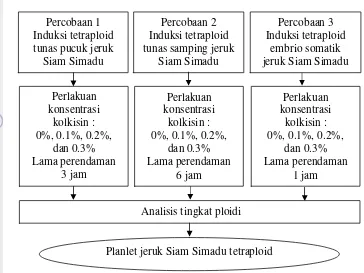
1 Bagan Alir kegiatan penelitian induksi tetraploid jeruk Siam Simadu
menggunakan kolkisin secara in vitro 3
2 Jeruk Siam Simadu (Balitjestro 2013) 4
3 Struktur kimia kolkisin (Matthew 1998) 7
4 (1) Tunas pucuk, (2) tunas samping, dan (3) embrio somatik fase
globular (kanan) in vitro jeruk Siam Simadu 9
5 Kondisi ruang kultur dan ruang tanam 12
6 (A) Daun kecil tunas pucuk, (B) buku (node) jeruk Siam Simadu yang pendek, (C) globular yang memiliki ukuran beragam 13 7 (A) Tunas samping yang membentuk kalus hijau bertekstur kompak,
(B) tunas samping yang hanya membesar, (C) tunas samping yang
8 (A) Embrio somatik yang membentuk kalus, (B) embrio somatik
yang membentuk akar 14
9 Kurva LD50 tunas pucuk jeruk Siam Simadu satu bulan setelah
perlakuan kolkisin 14
10 Tunas pucuk jeruk Siam Simadu yang mati akibat perlakuan kolkisin 15 11 Pertambahan tinggi tunas pucuk jeruk Siam Simadu pada umur
delapan minggu setelah perlakuan kolkisin 15
12 Jumlah daun tunas pucuk jeruk Siam Simadu pada umur delapan 0.2%, (H) 0.3%, stomata dengan perlakuan kolkisin (I) 0%, (J) 0.1%,
(K) 0.2%, (L) 0.3% 19
17 Daun pertama, daun ketiga, dan daun kelima tunas jeruk Siam Simadu perlakuan kolkisin 0.1% yang dianalisis jumlah kloroplas 20 18 Struktur tunas pucuk (sel-sel meristematik, bakal daun yang lebih
muda, dan bakal daun yang lebih tua) 21
19 Kurva LD50 tunas samping jeruk Siam Simadu satu bulan setelah
perlakuan kolkisin 22
20 Tunas samping jeruk Siam Simadu yang mati akibat perlakuan
kolkisin 22
21 Rata-rata jumlah tunas baru yang muncul tunas samping jeruk Siam Simadu pada umur delapan minggu setelah perlakuan kolkisin 23 22 Tinggi tunas yang baru muncul dari tunas samping jeruk Siam
Simadu pada umur delapan minggu setelah perlakuan kolkisin 23 23 Jumlah daun tunas yang baru muncul dari tunas samping jeruk Siam
Simadu pada umur delapan minggu setelah perlakuan kolkisin 24 24 Panjang daun tunas yang baru muncul dari tunas samping jeruk Siam
Simadu pada umur delapan minggu setelah perlakuan kolkisin 24 25 Lebar daun tunas yang baru muncul dari tunas samping jeruk Siam
Simadu pada umur delapan minggu setelah perlakuan kolkisin 24 26 Tunas baru yang muncul dari tunas samping jeruk Siam Simadu yang
berumur delapan minggu setelah perlakuan kolkisin (A) 0%, (B)
0.1%, (C) 0.2%, dan (D) 0.3% 25
27 Tebal daun tunas yang baru muncul dari tunas samping jeruk Siam Simadu yang berumur delapan minggu setelah perlakuan kolkisin (A)
0%), (B) 0.1%, (C) 0.2%, dan (D) 0.3% 25
28 Stomata daun tunas yang baru muncul dari tunas samping jeruk Siam Simadu yang berumur delapan minggu setelah perlakuan kolkisin (A)
0%), (B) 0.1%, (C) 0.2%, dan (D) 0.3% 27
29 Kurva LD50 embrio somatik jeruk Siam Simadu satu bulan setelah
30 Planlet normal dari perlakuan kolkisin (A) 0%, (B) 0.1%, (C) 0.2%, (D) 0.3% dan plenlet abnormal dari perlakuan kolkisin (E) 0.1%, (F)
0.2%, (G) 0.3% 29
31 Sel diploid 2n=2x=18 (atas) dan sel tetraploid 2n=4x=36 (bawah)
planlet jeruk Siam Simadu 29
DAFTAR LAMPIRAN
1. Komposisi media media dasar Murashige-Skoog (MS) 38
2. Komposisi vitamin Murashige-Skoog (MS) 38
3. Komposisi vitamin Morel and Wetmore (MW) 38
4. Hasil analisis sidik ragam peubah pertambahan tinggi tunas pucuk jeruk Siam Simadu pada umur delapan minggu setelah perlakuan
kolkisin 39
5. Hasil analisis sidik ragam peubah jumlah buku tunas pucuk jeruk Siam Simadu pada umur delapan minggu setelah perlakuan kolkisin 39 6. Hasil analisis sidik ragam peubah panjang daun tunas pucuk jeruk
Siam Simadu pada umur delapan minggu setelah perlakuan kolkisin 39 7. Hasil analisis sidik ragam peubah lebar daun tunas pucuk jeruk Siam
Simadu pada umur delapan minggu setelah perlakuan kolkisin 40 8. Hasil analisis sidik ragam peubah tinggi tunas yang baru muncul dari
tunas samping jeruk Siam Simadu pada umur delapan minggu setelah
perlakuan kolkisin 40
9. Hasil analisis sidik ragam peubah jumlah daun tunas yang baru muncul dari tunas samping jeruk Siam Simadu pada umur delapan
minggu setelah perlakuan kolkisin 40
10. Hasil analisis sidik ragam peubah panjang daun tunas yang baru muncul dari tunas samping jeruk Siam Simadu pada umur delapan
minggu setelah perlakuan kolkisin 40
11. Hasil analisis sidik ragam peubah lebar daun tunas yang baru muncul dari tunas samping jeruk Siam Simadu pada umur delapan minggu
1
PENDAHULUAN
Latar Belakang
Jeruk merupakan komoditas buah yang paling banyak diimpor di Indonesia. Berdasarkan data dari Direktorat Jenderal Hortikultura (2013) nilai impor jeruk Indonesia mencapai US $ 227.300.473. Jeruk impor lebih diminati konsumen karena memiliki kriteria yaitu warna yang menarik, kulitnya mudah dikupas, rasanya segar dan hampir tidak mempunyai biji (seedless). Jeruk Siam Simadu merupakan jeruk Siam lokal yang hampir mendekati kategori tipe jeruk yang sesuai dengan kriteria konsumen dan pasar dunia untuk dikonsumsi dalam keadaan segar tetapi mempunyai biji yang relatif banyak yaitu lebih dari 15 biji per buah sehingga kalah bersaing dengan jeruk impor (Husni et al. 2010).
Perbaikan kualitas jeruk lokal yang sudah memiliki rasa dan warna yang sesuai dengan kriteria konsumen dan pasar dapat dilakukan dengan merakit tanaman jeruk lokal tersebut memiliki buah jeruk seedless. Jeruk Siam (Citrus nobilis Lour) termasuk dalam kelompok jeruk dengan jumlah kromosom 2n=2x=18. Menurut Wu dan Mooney (2002), metode yang paling efektif untuk mendapatkan tanaman jeruk seedless atau triploid (2n=3x=27) yaitu dengan cara menyilangkan tanaman jeruk tetraploid (2n=4x=36) dengan tanaman jeruk diploid (2n=2x=18).
Tanaman jeruk tetraploid dapat dihasilkan dengan perlakuan kolkisin. Menurut Takahira et al. (2011), kolkisin dapat digunakan untuk menggandakan jumlah kromosom. Kolkisin dapat menghambat pembentukan dan aktivitas benang-benang spindle pada saat pembelahan sel mitosis serta mencegah inti dan sel membelah sehingga jumlah kromosom sel mengganda (Ascough et al. 2008). Menurut Dhooghe et al. (2011), penggandaan jumlah kromosom menggunakan kolkisin sangat tergantung pada konsentrasi kolkisin yang diberikan, lama perendaman, dan jenis eksplan.
2
dapat dilakukan dengan merakit tanaman jeruk lokal tersebut memiliki buah seedless.
Metode yang efektif digunakan untuk mendapatkan tanaman jeruk seedless atau triploid (2n=3x=27) yaitu dengan cara menyilangkan tanaman jeruk tetraploid (2n=4x=36) dengan tanaman jeruk diploid (2n=2x=18). Tanaman jeruk tetraploid dapat dihasilkan dengan perlakuan kolkisin. Kolkisin dapat digunakan untuk menggandakan jumlah kromosom dengan cara menghambat pembentukan dan aktivitas benang-benang spindle pada saat pembelahan sel mitosis serta mencegah inti dan sel membelah. Penggandaan jumlah kromosom menggunakan kolkisin sangat tergantung pada konsentrasi kolkisin yang diberikan, lama perendaman, dan jenis eksplan.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mendapatkan planlet jeruk Siam Simadu tetraploid yang akan dijadikan sebagai tetua untuk menghasilkan jeruk Siam Simadu seedless.
Manfaat Penelitian
Planlet jeruk Siam Simadu tetraploid yang diperoleh akan digunakan sebagai tetua untuk merakit tanaman triploid melalui persilangan dalam upaya mendapatkan buah jeruk Siam Simadu seedless.
Ruang Lingkup Penelitian
3
Gambar 1 Bagan Alir kegiatan penelitian induksi tetraploid jeruk Siam Simadu menggunakan kolkisin secara in vitro
2 TINJAUAN PUSTAKA
Tanaman Jeruk
Jeruk (Citrus sp) adalah tanaman buah tahunan yang berasal dari Asia. Menurut Spiegel-Roy dan Goldschmidt (1996), China di percaya sebagai tempat pertama kali jeruk tumbuh. Sejak ratusan tahun yang lalu, jeruk sudah tumbuh di Indonesia baik secara alami maupun yang dibudidayakan. Jeruk yang ada di Indonesia didatangkan dari Amerika dan Italia oleh orang Belanda (Khan 2007). Daerah-daerah yang terkenal sebagai daerah pusat jeruk di Indonesia diantaranya Garut (Jawa Barat), Tawamangu (Jawa Tengah), Batu (Jawa Timur), Tejakula (Bali), Selayar (Sulawesi Selatan), Pontianak (Kalimantan Barat), Brastagi (Sumatera Utara) dan Soe (Nusa Tenggara Timur) (Martosupono et al. 2007).
Berbagai jenis jeruk banyak dijumpai dan dibudidayakan di Indonesia mulai dari dataran rendah hingga dataran tinggi. Beberapa jenis jeruk tersebut telah menjadi unggulan daerah maupun nasional seperti jeruk manis Pacitan dari daerah Pacitan, Jawa Timur; jeruk manis Waturejo dari Jawa Tengah; keprok SoE dari Nusa Tenggara Timur; Keprok Batu 55 dari Batu, Jawa Timur; Siam Madu, Keprok Maga, dan Beras Sitepu dari Medan, Sumut; Siam Pontianak dari Kalimantan Barat; dan Pamelo Nambangan, Sri
4
Nyonya, serta Magetan dari Magetan, Jawa Timur (Martasari dan Mulyanto 2008).
Jeruk merupakan sumber vitamin C yang sangat baik. Jus jeruk mengandung asam askorbat 20-60 mg per 100 ml. Vitamin lain yang tak kalah penting adalah vitamin A, tiamin, niasin, riboflavin, asam pantotenat, biotin, asam folat, inositol, dan tokoferol. Kandungan vitamin A berkisar antara 250-420 IU, tiamin 70-120 μg,asam folat 1.2 μg, dan inositol 135 mg setiap 100 ml jus (BB Pascapanen 2009).
Jeruk Siam Simadu
Salah satu varietas atau jenis jeruk yang banyak disukai oleh masyarakat adalah jeruk Siam. Jenis jeruk ini banyak disukai masyarakat karena rasanya yang lebih manis dibanding jeruk keprok. Jeruk Siam dan jeruk keprok sulit dibedakan karena mempunyai aroma daun yang sama, ukuran bunga dan buah yang hampir sama (Badan Litbang Pertanian 2005).
Nama ilmiah jeruk siam adalah Citrus nobilis, dinamakan jeruk siam karena berasal dari Siam (Thailand) (Deptan 1994). Klasifikasi botani tanaman jeruk adalah sebagai berikut:
Divisi : Spermatophyta Sub Divisi : Angiospermae Kelas : Dicotyledonae Ordo : Rutales Famili : Rutaceae Subfamili : Aurantioidae Genus : Citrus
Spesies : Citrus nobilis Lour
Jeruk siam memiliki ciri khas yang tidak dimiliki jeruk keprok lainnya karena mempunyai kulit yang tipis sekitar 2 mm, permukaannya halus dan licin, mengkilap serta kulit menempel lebih lekat dengan dagingnya. Dasar buahnya berleher pendek dengan puncak berlekuk. Tangkai buahnya pendek, dengan panjang sekitar 3 cm dan berdiameter 2.6 mm. Biji buahnya berbentuk ovoid, warnanya putih kekuningan dengan jumlah sekitar 20 biji. Daging buahnya lunak dengan rasa manis dan harum. Bobot buah cukup berat dengan berat per buah sekitar 75.6 g. Satu pohon rata-rata menghasilkan sekitar 7.3 kg buah. Panen biasanya dapat dilakukan pada bulan Mei – Agustus (Deptan 1994).
5 Jeruk Siam Simadu (Gambar 2) berasal dari Sumatra Utara. Jeruk ini memiliki rasa yang manis sedikit asam, ukuran buah sedang, warna daging buah oranye, warna kulit buah kekuningan, dan tumbuh di dataran rendah yaitu kurang dari 1200 mdpl (Balitjestro 2013). Ketinggian tempat penanaman berpengaruh jelas terhadap rasa. Penanaman di atas 900 dpl menyebabkan rasa buah jeruk siam menjadi sedikit asam (Deptan 1994).
Buah Jeruk Tanpa Biji (Seedless)
Seedless adalah merupakan sifat buah yang memiliki sedikit biji. Menurut Khalil et al. (2011) jeruk dapat dikatakan seedless jika memiliki biji kurang dari 5 biji per buah.Sifat seedless tersebut dapat diperoleh secara alami pada beberapa jenis tanaman yang mempunyai kemampuan membentuk buah dengan biji yang sangat sedikit tanpa adanya penyerbukan dan pembuahan yang disebut dengan buah partenokarpi (Frost dan Soost 1968; Spiegel-Roy dan Goldschmidt 1996). Sifat tersebut merupakan sifat yang mempunyai nilai ekonomi tinggi pada tanaman jeruk karena merupakan karakter yang harus dimiliki buah jeruk konsumsi segar agar dapat bersaing di pasar global (Spiegel-Roy dan Goldschmidt 1996; Cai et al. 2007). Sifat tersebut juga merupakan salah satu objek penelitian yang banyak dilakukan pada program pemuliaan tanaman jeruk, baik secara konvensional maupun non konvensional (Nicotra 2007).
Metode yang paling efektif untuk mendapatkan tanaman jeruk tanpa biji atau triploid (2n=3x=27) yaitu dengan cara menyilangkan tanaman jeruk tetraploid (2n=4x=36) dengan tanaman jeruk diploid (2n=2x=18) (Wu dan Mooney 2002; Grosser dan Chandler 2004; Reforgiato Recupero et al. 2005). Menurut Aleza et al. (2009), metode yang paling efektif untuk mendapatkan tanaman jeruk triploid adalah dengan cara menyerbuki putik kultivar tetraploid dengan pollen yang berasal dari varietas diploid. Tanaman jeruk tetraploid dibutuhkan untuk menghasilkan buah jeruk tanpa biji.
Perkembangan Penelitian Tanaman Jeruk Tetraploid
Tanaman jeruk tetraploid dapat dihasilkan dari 1) pembibitan nuselus secara spontan (Barrett dan Hutchison 1978), 2) perlakuan kolkisin pada meristem aksilar (Barrett 1974), 3) persilangan jeruk 2x × 4x (Cameron dan Soost 1969), 4) variasi somaklonal yang terjadi secara spontan pada kultur jaringan (Vardi 1981; Zhang 1985), dan 5) melalui hibridisasi somatik (Kobayashi dan Ohgawara 1988; Grosser dan Gmitter 1990). Perlakuan kolkisin banyak digunakan untuk menghasilkan tanaman jeruk tetraploid karena cepat dan mudah.
6
jeruk tetraploid Frost (Citrus sinensis Osbeck). Aleza et al. (2009) dapat memperoleh tanaman jeruk tetraploid varietas Clemenules dengan pemberian kolkisin 0.1% selama 3 jam pada penyambungan tunas pucuk.
Induksi Mutasi Kromosom dengan Mutagen Kimia
Pada dasarnya evolusi tanaman terjadi karena mutasi yang terus menerus di alam. Oleh karena itu banyak yang beranggapan bahwa keragaman yang ada sekarang terutama disebabkan oleh mutasi (Lubis 2005). Mutasi adalah perubahan pada materi genetik suatu organisme yang terjadi secara tiba-tiba, acak, dan merupakan dasar bagi sumber variasi yang bersifat terwariskan (heritable). Mutasi dapat terjadi secara spontan (spontaneous mutation) dan dapat juga terjadi melalui induksi (induced mutation). Secara mendasar tidak terdapat perbedaan antara mutasi yang terjadi secara alami dan mutasi hasil induksi. Keduanya dapat menimbulkan variasi genetik untuk dijadikan dasar seleksi tanaman, baik seleksi secara alami (evolusi) maupun seleksi buatan (pemuliaan) (BATAN 2005). Menurut Crowder (2006) mutasi adalah suatu proses dimana suatu gen mengalami perubahan struktur. Dalam arti luas, mutasi dihasilkan dari segala macam tipe perubahan bahan genetik yang mengakibatkan perubahan penampakan fenotipe yang diturunkan yang bukan dihasilkan dari proses seksual. Batasan ini termasuk keragaman kromosom dan position effect maupun mutasi gen.
Bahan mutagen dapat secara kimia dan fisik. Mutasi fisik bersifat sebagai radiasi pengion (ionizing radiation) yang dapat melepas energi (ionisasi), begitu melewati atau menembus materi. Mutagen fisika termasuk diantaranya sinar-X, radiasi gamma, radiasi beta, neutrons, dan partikel dari akselerator sudah umum digunakan dalam pemuliaan tanaman. Mutagen kimia pada umumnya berasal dari senyawa alkyl (alkylating agents) misalnya seperti ethyl methane sulphonate (EMS), diethyl sulphate (DES), methyl methane sulphonate (MMS), hydroxylamine, nitrous acids, acridines, dan sebagainya. Beberapa mutagen kimia penting lainnya ialah gas metan, asam nitrat, kolkisin, digitonin, hidroksil amin, akridin, etil etan sulfonat (EES), 5-bromo urasil, 2-aminopurin.
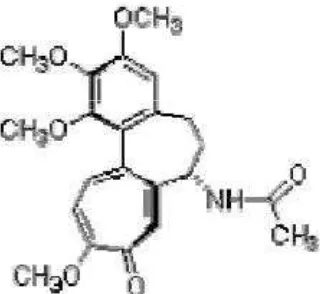
Tanaman jeruk mempunyai jumlah kromosom 2n = 2x = 18, melalui perlakuan kolkisin diharapkan terjadi ploidisasi kromosom untuk menghasilkan tanaman jeruk Siam Simadu tetraploid. Kolkisin adalah suatu alkaloid yang dihasilkan oleh tanaman krokus (Colchicum autumnale, L.) yang banyak ditanam di Eropa, India, dan Afrika Utara (Snustad et al. 1997). Lama waktu perendaman dan konsentrasi kolkisin akan mempengaruhi terjadinya poliploidi. Poliploidi adalah keadaan suatu individu yang memiliki lebih dari dua set kromosom (Welsh 1991; Snustad et al. 1997; Griffiths et al. 1999). Poespodarsono (1988) melaporkan bahwa kepekaan masing-masing spesies tanaman terhadap perlakuan kolkisin sangat berbeda. Rumus kimia kolkisin adalah C22H25O6N dan merupakan senyawa alkaloid
7
Gambar 3 Struktur kimia kolkisin (Matthew 1998)
Mitosis Sel Somatik
Mitosis merupakan pembelahan sel somatik. Setiap sel yang membelah secara mitosis akan menghasilkan dua sel baru yang jumlah kromosom dan kandungan genetiknya identik dengan sel asal (Sastrosumarjo et al. 2006). Kolkisin merupakan inhibitor mitosis karena dapat mengikat tubulin (suatu protein), konstituen utama mikrotubula. Mikrotubula mempunyai fungsi dalam pembentukan benang spindle pada mitosis. Kolkisin dapat menghambat pembentukan dan aktivitas benang-benang pembelahan pada saat mitosis, dimana pada tahap metafase kromosom tidak bergerak ke arah dua kutubnya tetapi tetap berada di daerah ekuator bahkan dapat kembali mengganda (Strickberger 1985).
Kolkisin dapat menyebabkan jumlah ploidi yang dihasilkan sel berbeda dengan normalnya karena adanya perubahan jumlah kromosom. Perubahan tersebut dapat karena komposisi molekul DNA suatu gen atau pada benang kromatinnya. Perlakuan kolkisin dalam waktu yang makin lama bisa menghasilkan pertambahan genom sebagai suatu deret ukur seperti 4x, 8x, 16x dan seterusnya (Brewbaker 1983). Ciri-ciri fisik tunas poliploid yang umum adalah meningkatnya ukuran sel, laju pertumbuhan sel lambat, daun lebih tebal, bunga lebih besar dan sedikit, buah lebih besar, serta menurunnya fertilitas pada berbagai tingkat dibandingkan dengan tunas diploid (Griffith et al. 1999).
8
3
METODE
Kegiatan penelitian dilaksanakan dari bulan Januari 2013 sampai Agustus 2013. Tempat pelaksanaan penelitian in vitro dilakukan di Laboratorium Kultur Jaringan Kelompok Peneliti Biologi Sel dan Jaringan, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB-BIOGEN), Cimanggu, Bogor. Uji sitologi dilakukan di Laboratorium Micro Technique, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini terdiri atas tiga percobaan yaitu Induksi tetraploid tunas pucuk jeruk Siam Simadu secara in vitro menggunakan kolkisin, Induksi tetraploid tunas samping jeruk Siam Simadu secara in vitro menggunakan kolkisin, dan Induksi tetraploid embrio somatik jeruk Siam Simadu secara in vitro menggunakan kolkisin.
Rancangan percobaan yang digunakan pada percobaan Induksi tetraploid tunas pucuk jeruk Siam Simadu secara in vitro menggunakan kolkisin yaitu Rancangan Kelompok Lengkap Teracak (RKLT) satu faktor yaitu konsentrasi kolkisin. Konsentrasi kolkisin yang diberikan yaitu 0%, 0.1%, 0.2% dan 0.3%. Setiap perlakuan diulang sebanyak lima kali, satu ulangan terdiri atas dua tunas pucuk jeruk yang ditanam dalam satu botol. Tunas pucuk direndam pada larutan perlakuan kolkisin 0%, 0.1%, 0.2% dan 0.3% selama tiga jam.
Rancangan percobaan yang digunakan pada percobaan Induksi tetraploid tunas samping jeruk Siam Simadu secara in vitro menggunakan kolkisin yaitu Rancangan Kelompok Lengkap Teracak (RKLT) satu faktor yaitu konsentrasi kolkisin. Konsentrasi kolkisin yang diberikan yaitu 0%, 0.1%, 0.2% dan 0.3%. Setiap perlakuan diulang sebanyak sepuluh kali, satu ulangan terdiri atas dua tunas samping jeruk yang ditanam dalam satu botol. Tunas pucuk direndam pada larutan perlakuan kolkisin 0%, 0.1%, 0.2% dan 0.3% selama enam jam.
Rancangan percobaan yang digunakan pada percobaan Induksi tetraploid embrio somatik jeruk Siam Simadu secara in vitro menggunakan kolkisin yaitu Rancangan Kelompok Lengkap Teracak (RKLT) satu faktor yaitu konsentrasi kolkisin. Konsentrasi kolkisin yang diberikan yaitu 0%, 0.1%, 0.2% dan 0.3%. Setiap perlakuan diulang sebanyak lima kali, satu ulangan terdiri atas lima embrio somatik jeruk yang ditanam dalam satu botol. Embrio somatik direndam pada larutan perlakuan kolkisin 0%, 0.1%, 0.2% dan 0.3% selama satu jam.
Bahan
9 sitologi yang digunakan yaitu Aceto orcein 2%, 8-hydroxyquinolin 0.002 M, HCL 1.0 N, CH3COOH 45%, cat kuku bening dan aquades.
Gambar 4 (1) Tunas pucuk, (2) tunas samping, dan (3) embrio somatik fase globular (kanan) in vitro jeruk Siam Simadu
Alat
Peralatan yang digunakan yaitu gelas ukur, labu takar, erlenmeyer, gelas piala, pipet volumetrik, magnetic stirer, spatula, hot plate, botol kultur, corong, timbangan analitik, pH meter, autoclave, oven, Laminar Air Flow Cabinet, cawan petri, lampu bunsen, pinset, hand sprayer, pisau, gunting, shaker, milipore 0.20 µm, jarum suntik, pensil, silet, cover glass, gelas arloji, dan mikroskop Olympus BX51.
Prosedur Analisis Data
Analisis data menggunakan uji F. Apabila hasil uji F berbeda nyata, maka dilakukan uji lanjut DMRT (Duncan’sMultiple Range Test) pada taraf nyata 5%. Pengolahan data menggunakan program Statistic Analysis System (SAS 9.1.3 portable). Penghitungan tebal daun, jumlah kloroplas pada sel penjaga (guard cell), kerapatan stomata, ukuran stomata, dan jumlah kromosom dengan menggunakan microsoft office excel serta dihitung rata-rata dan standar deviasinya.
Pelaksanaan Percobaan
Pembuatan larutan kolkisin dilakukan dengan cara melarutkan kolkisin ke dalam aquades steril, pH larutan tersebut diukur hingga 5.6. Larutan kontrol merupakan aquades steril yang diukur pH hingga 5.6. Sterilisasi larutan kolkisin dan kontrol menggunakan milipore 0.20 µ m di dalam laminar.
Pembuatan media dilakukan dengan cara menimbang hara makro MS, hara mikro MS, vitamin MW, vitamin MS dan zat pengatur tumbuh (IBA, TDZ, dan NAA) sesuai dengan takaran, lalu dibuat larutan stok dengan jumlah volume tertentu. Setiap satu liter media dibuat dengan cara mencampurkan larutan stok hara makro MS dan hara mikro MS menggunakan pipet. Campurkan vitamin ke dalam larutan tersebut. Tambahkan zat pengatur tumbuh apabila digunakan. Gula pasir sebanyak
10
30 g L-1 ditambahkan pada campuran larutan stok. Apabila media yang dibuat menggunakan EME 0.5 g L-1, maka ditambahkan ke dalam campuran larutan stok. Aquades ditambahkan sampai volume campuran larutan stok mencapai hampir 1 liter. Campuran larutan stok diukur pH hingga 5.8. Campuran larutan stok ditambahkan 2.5 g L-1 phytagel sebagai pemadat. Campuran larutan stok dimasak dan terus diaduk sampai mendidih. Media campuran tersebut dimasukkan ke dalam botol-botol sebanyak 25 ml per botol lalu ditutup dengan alumunium foil. Alumunium foil penutup botol diberi kode, kemudian media disterilisasi dalam autoclave selama 15 menit pada suhu 121 oC. Media yang telah disterilisasi disimpan di ruang media pada suhu 16 oC.
Planlet (tunas pucuk dan tunas samping) dan embrio somatik jeruk Siam Simadu diletakkan dalam ruang gelap selama satu malam kemudian diletakkan kembali ke ruang terang pada pukul 07.00. Perlakuan kolkisin dilakukan pada pukul 09.00. Hal ini dilakukan agar perlakuan kolkisin tepat diberikan saat pembelahan mitosis terjadi sehingga dapat menghambat pembentukan benang-benang spindle serta mencegah inti dan sel membelah sehingga jumlah kromosom sel mengganda.
Percobaan I. Induksi Tetraploid Tunas Pucuk Jeruk Siam Simadu (Citrus nobilis Lour.) Menggunakan Kolkisin secara In Vitro
Induksi tetraploid tunas pucuk jeruk Siam Simadu menggunakan kolkisin secara in vitro dilakukan dengan cara merendam tunas tanpa daun pada larutan perlakuan kolkisin yaitu 0%, 0.1%, 0.2% dan 0.3% yang disterilisasi dengan milipore selama 3 jam. Tunas yang telah diberi perlakuan kolkisin kemudian dibilas dengan aquades steril dan dikeringkan dengan kertas saring lalu ditanam pada media recovery (MS + vitamin MW + EME 0.5 g L-1) dan diletakkan dalam ruang terang selama dua minggu kemudian disubkultur ke media pertumbuhan (MS + vitamin MW) dan diletakkan dalam ruang terang. Induksi akar dilakukan dengan menggunakan media MS + vitamin MS + IBA 3 ppm dan media MS + vitamin MS + NAA 3 ppm. Pengamatan yang dilakukan adalah LD50
11 Percobaan II. Induksi Tetraploid Tunas Samping Jeruk Siam Simadu
Menggunakan Kolkisin secara In Vitro
Induksi tetraploid tunas samping jeruk Siam Simadu menggunakan kolkisin secara in vitro dilakukan dengan cara merendam tunas samping tanpa daun pada larutan perlakuan kolkisin yaitu 0%, 0.1%, 0.2% dan 0.3% yang disterilisasi dengan milipore selama 6 jam. Tunas yang telah diberi perlakuan kolkisin kemudian dibilas dengan aquades steril dan dikeringkan dengan kertas saring lalu ditanam pada media recovery (MS + vitamin MW + EME 0.5 g L-1) dan diletakkan dalam ruang terang selama dua minggu kemudian disubkultur ke media pertumbuhan(MS + vitamin MS + TDZ 0.2 ppm) dan diletakkan dalam ruang terang. Induksi akar dilakukan dengan menggunakan media MS + vitamin MS + IBA 3 ppm dan media MS + vitamin MS + NAA 3 ppm. Pengamatan yang dilakukan adalah LD50
(Lethal Dose), pertambahan tinggi tunas, jumlah buku, jumlah daun baru yang terbentuk, panjang, lebar dan tebal daun (diukur pada bagian tengah daun), dan analisis stomata (jumlah kloroplas, kerapatan stomata, serta ukuran panjang dan lebar stomata pada sel penjaga)
Percobaan III. Induksi Tetraploid Embrio Somatik Jeruk Siam Simadu
Menggunakan Kolkisin secara In Vitro
Induksi tetraploid embrio somatik jeruk Siam Simadu menggunakan kolkisin secara in vitro dilakukan dengan cara merendam embrio somatik pada larutan perlakuan kolkisin yaitu 0%, 0.1%, 0.2% dan 0.3% yang disterilisasi dengan milipore selama 1 jam. Embrio somatik yang telah diberi perlakuan kolkisin kemudian dibilas dengan aquades steril dan dikeringkan dengan kertas saring lalu ditanam pada media recovery (pemulihan) dan disimpan dalam ruang terang selama dua minggu kemudian disubkultur ke media yang sama dan disimpan dalam ruang terang. Pengamatan yang dilakukan adalah LD50 (Lethal Dose), persentase planlet
normal dan abnormal, jumlah kromosom serta persentase planlet diploid dan tetraploid.
Analisis kromosom dilakukan dengan cara mengambil ujung akar jeruk yang tampak aktif, biasanya berbentuk normal dengan ujung akar bening keputihan lebih kurang 1 cm (di dalam laminar). Ujung akar berasal dari planlet jeruk Siam Simadu yang diletakkan dalam ruang gelap selama satu malam kemudian diletakkan kembali dalam ruang terang selama 30 menit. Ujung akar dimasukkan ke dalam air dan dibersihkan dari agar-agar media. Ujung akar yang telah bersih dimasukkan ke dalam botol yang dilapisi alumunium foil dan berisi 8-hydroxyquinolin 0.002 M. Botol tersebut disimpan di lemari es yang tertutup rapat dan tidak terkena cahaya selama 24 jam. Ujung akar dimasukkan ke dalam CH3COOH 45% selama
10 menit. Ujung akar diangkat dan dimasukkan ke dalam botol yang berisi larutan 1 N HCL : 45% CH3COOH dengan perbandingan 3 : 1 (v/v) pada
12
letakkan di gelas arloji yang telah ditetesi aseto orcein 2% kemudian ditutup dengan cover glass. Cover glass ditekan dengan tangan agar tidak bergeser dan dipukul-pukul menggunakan ujung penghapus pensil agar sel-sel terpisah. Bersihkan sisa aseto orcein 2% yang menempel diluar cover glass menggunakan kertas saring kemudian dipanaskan sedikit menggunakan api bunsen. Cover glass ditekan halus dan dihangatkan lagi sedikit. Sekeliling cover glass diberikan cat kuku bening dan dikeringkan agar tidak bergeser. Preparat diamati menggunakan mikroskop pada perbesaran 10 x 100. Pengamatan dilakukan pada lima sel dari setiap preparat
4
HASIL DAN PEMBAHASAN
Kondisi Umum
Planlet (tunas pucuk dan tunas samping) dan embrio somatik jeruk Siam Simadu yang digunakan pada penelitian ini berasal dari planlet dan embrio somatik yang tersedia di Laboratorium Biologi Sel dan Jaringan, BB-Biogen. Planlet dan embrio somatik tersebut berasal dari nuselus yang diisolasi dari buah muda jeruk Siam Simadu yang telah berumur 30-90 hari setelah anthesis. Tunas pucuk, tunas samping, dan embrio somatik jeruk Siam Simadu yang telah diberikan perlakuan kolkisin disimpan pada ruang kultur dengan penyinaran menggunakan lampu 20 watt selama 16 jam/hari dengan intensitas cahaya rata-rata 1500-2000 lux, dengan suhu 16-20 oC. Laboratorium tempat dilakukannya penelitian sangat menjaga kestabilan suhu ruang kultur supaya tetap terjaga pada kisaran 16 - 20oC (Gambar 5). Kestabilan suhu ruang kultur tersebut dibantu dengan kondisi Air Conditioner (AC) yang tetap dihidupkan selama 24 jam.
Gambar 5 Kondisi ruang kultur dan ruang tanam
13 eksplan. Keberadaan cendawan ditandai dengan munculnya cendawan berwarna putih, hijau, dan hitam di permukaan media. Kemungkinan terjadinya kontaminasi disebabkan oleh larutan kolkisin yang kurang steril, wadah yang digunakan untuk menyimpan larutan kolkisin kurang steril, kertas saring yang digunakan kurang steril, eksplan belum benar-benar kering ketika ditiriskan saat perlakuan sehingga media menjadi berair dan meyebabkan kontaminasi.
Kendala yang terjadi secara umum saat penelitian adalah kesulitan mengukur pH larutan kolkisin hingga 5.6. Kendala yang terjadi saat induksi tetraploid tunas pucuk adalah kesulitan memotong daun terkecil tunas pucuk karena apabila tidak hati-hati meristem apikal akan ikut terpotong (Gambar 6 A). Pemotongan daun ini bertujuan agar kolkisin mudah masuk ke dalam sel-sel meristem apikal dan mengurangi terjadinya kimera. Kendala yang terjadi saat induksi tetraploid tunas samping adalah kesulitan memotong tunas samping apabila tidak hati-hati meristem akan ikut terpotong karena kebanyakan planlet jeruk Siam Simadu yang tersedia memiliki buku (node) yang pendek (Gambar 6 B). Kendala yang terjadi saat induksi tetraploid embrio somatik adalah globular yang memiliki ukuran beragam sehingga sulit memilih globular dengan ukuran yang sama agar keragaman yang dihasilkan dari percobaan ini sedikit (Gambar 6 C).
Gambar 6 (A) Daun kecil tunas pucuk, (B) buku (node) jeruk Siam Simadu yang pendek, (C) globular yang memiliki ukuran beragam
14
Beberapa tunas samping tidak membentuk tunas baru tetapi membentuk kalus atau hanya membesar (Gambar 7 B). Kalus yang terbentuk berwarna hijau bertekstur kompak (Gambar 7 A) dan putih kekuningan bertekstur remah (Gambar 7 C). Beberapa embrio somatik (globular) tidak berkecambah tetapi membentuk kalus (Gambar 8 A), beberapa kalus tersebut kembali membentuk embrio lalu berkecambah, serta beberapa embrio somatik berakar dan tidak berkecambah (Gambar 8 B).
Gambar 8 (A) Embrio somatik yang membentuk kalus, (B) embrio somatik yang membentuk akar
Percobaan I. Induksi Tetraploid Tunas Pucuk Jeruk Siam Simadu (Citrus nobilis Lour.) Menggunakan Kolkisin secara In Vitro
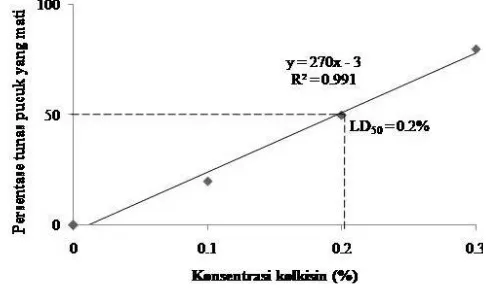
Nilai LD50 dapat diperoleh dengan menghitung pola respon kematian
tanaman terhadap berbagai konsentrasi kolkisin yang diberikan. Gambar 9 memperlihatkan bahwa semakin tinggi konsentrasi kolkisin, maka semakin tinggi persentase tunas pucuk jeruk yang mati. Pola respon kematian tunas pucuk jeruk terhadap berbagai konsentrasi kolkisin menghasilkan respon linear. Persamaaan respon kematian tunas pucuk jeruk terhadap berbagai konsentrasi kolkisin yaitu y = 270x - 3, nilai LD50 diperoleh pada
konsentrasi kolkisin sebesar 0.2%.
Gambar 9 Kurva LD50 tunas pucuk jeruk Siam Simadu satu bulan setelah
15 Meningkatnya persentase tunas pucuk yang mati disebabkan karena larutan kolkisin yang bersifat racun dapat merusak sel-sel tanaman. Menurut Suryo (2007), konsentrasi kolkisin yang terlalu tinggi akan menyebabkan kematian pada tanaman. Kematian tunas pucuk ini terjadi beberapa hari setelah perlakuan kolkisin, tunas pucuk jeruk yang awalnya berwarna hijau, kemudian berubah perlahan menjadi warna coklat dan mati (Gambar 10).
Gambar 10 Tunas pucuk jeruk Siam Simadu yang mati akibat perlakuan kolkisin
Perlakuan konsentrasi kolkisin memberikan pengaruh yang berbeda nyata terhadap pertambahan tinggi, jumlah daun, jumlah buku, panjang daun dan lebar daun tunas jeruk Siam Simadu. Induksi tetraploid menggunakan kolkisin menurunkan pertumbuhan tunas jeruk Siam Simadu. Hal ini terlihat dari perlakuan kolkisin menghasilkan pertambahan tinggi, jumlah daun, jumlah buku, panjang daun dan lebar daun yang lebih rendah dibandingkan dengan tunas kontrol (kolkisin 0%) (Gambar 11, Gambar 12, Gambar 13, Gambar 14, Gambar 15).
Keterangan: angka yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata berdasarkan DMRT pada α = 5%
16
Keterangan: angka yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata berdasarkan DMRT pada α = 5%
Gambar 12 Jumlah daun tunas pucuk jeruk Siam Simadu pada umur delapan minggu setelah perlakuan kolkisin
Keterangan: angka yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata berdasarkan DMRT pada α = 5%
Gambar 13 Jumlah buku tunas pucuk jeruk Siam Simadu pada umur delapan minggu setelah perlakuan kolkisin
Keterangan: angka yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata berdasarkan DMRT pada α = 5%
17
Keterangan: angka yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata berdasarkan DMRT pada α = 5%
Gambar 15 Lebar daun tunas pucuk jeruk Siam Simadu pada umur delapan minggu setelah perlakuan kolkisin
Semakin tinggi konsentrasi kolkisin yang diberikan maka pertambahan tinggi, jumlah daun, jumlah buku, panjang daun dan lebar daun tunas juga semakin sedikit sehingga ukuran tanaman menjadi lebih kecil dibandingkan dengan tanaman kontrol (Gambar 16 A, B, C, D). Hasil yang diperoleh dari penelitian ini memiliki kesamaan dengan penelitian-penelitian sebelumnya yaitu pada beberapa tanaman rentan terhadap perlakuan kolkisin yang menyebabkan penurunan pertumbuhan pada tanaman Gossypium arboretum L (Rauf et al. 2006), Plantanus acerifolia (Liu et al. 2007), dragonhead (Omidbaigi et al. 2010a), dan Pelargonium x hortorum (Jadrna et al. 2010).
Terhambatnya pertumbuhan tunas diduga karena proses pembelahan sel yang abnormal akibat pengaruh kolkisin. Damayanti dan Mariska (2003) menyebutkan bahwa pemberian kolkisin dapat mengakibatkan penundaan pertumbuhan akibat jaringan yang rusak dan memerlukan waktu lama untuk tumbuh. Menurut Suryo (2007) pembelahan sel menjadi lambat disebabkan jumlah kromosom yang mengganda.
Salah satu ciri fisik tunas poliploid yang umum adalah meningkatnya ukuran sel sehingga mengakibatkan daun menjadi lebih tebal (Griffith et al. 1999). Data Tabel 3 menunjukkan bahwa daun tunas pucuk yang diberikan perlakuan kolkisin lebih tebal dibandingkan dengan daun tunas pucuk kontrol. Semakin tinggi konsentrasi kolkisin, semakin tebal juga daun yang dihasilkan (Gambar 16 E, F, G, H). Hasil penelitian Omidbaigi et al. (2010) pada Ocimum basilicum L. menunjukkan bahwa tanaman tetraploid memiliki daun yang lebih tebal dibandingkan dengan tanaman diploid.
Induksi akar dilakukan dengan zat pengatur tumbuh (ZPT) golongan auksin. Auksin merupakan golongan zat pengatur tumbuh yang dapat mengatur terjadinya pertumbuhan akar (Liu et al. 1998). Gaspar et al. (1996) menyatakan bahwa auksin sangat diperlukan dalam organogenesis termasuk dalam pembentukan akar.
Berdasarkan hasil penelitian Merigo (2011), media induksi akar terbaik tunas jeruk keprok Batu 55 yaitu media MS + IBA 3 ppm. Oleh karena itu, induksi akar pada tunas pucuk hasil induksi tetraploid dilakukan pada media MS + vitamin MS + IBA 3 ppm. Penambahan auksin IBA 3 ppm dapat menginduksi pertumbuhan akar tunas pucuk kontrol (kolkisin 0%) sedangkan
18
tunas pucuk yang diberikan perlakuan kolkisin tidak (Tabel 1). Tunas pucuk hasil induksi tetraploid diinduksi akar kembali menggunakan media MS + vitamin MS + NAA 3 ppm. Media ini juga belum mampu untuk menginduksi akar tunas pucuk yang diberikan perlakuan kolkisin (Tabel 2) sehingga analisis tingkat ploidi tidak dapat dilakukan dengan cara menghitung kromosom karena tunas belum memiliki akar.
Tabel 1 Jumlah dan panjang akar tunas pucuk jeruk Siam Simadu yang diberikan perlakuan kolkisin pada media MS + vitamin MS + IBA 3 ppm selama satu bulan
Perlakuan kolkisin (%) Jumlah akar Panjang akar (cm)
0 0.8 1.5
Perlakuan kolkisin (%) Jumlah akar Panjang akar (cm)
0 0.72 1.2
0.1 0 0
0.2 0 0
0.3 0 0
Identifikasi tingkat ploidi dapat dilakukan dengan analisis stomata. Teknik ini cepat, murah, tidak merusak, tidak memerlukan peralatan yang canggih, dan memiliki akurasi yang cukup tinggi hingga 90% (Ascough et al. 2008). Menurut Rego et al. (2011), metode penghitungan jumlah kloroplas dalam sel penjaga adalah cara yang efektif dan cepat untuk menentukan tingkat ploidi. Jumlah kloroplas dalam sel penjaga dapat mengidentifikasi tanaman diploid dan tetraploid. Gu et al. (2005) dan Yu et al. (2009) juga telah meneliti tingkat ploidi berdasarkan jumlah kloroplas.
19 Tabel 3 Pengaruh perlakuan konsentrasi kolkisin terhadap tebal daun dan
jumlah kloroplas per pasang sel penjaga Konsentrasi
kolkisin (%) Rata-rata tebal daun (µ m)
Jumlah kloropas/pasang sel penjaga
0 146.01 ± 6.26 8.67 ± 0.58
0.1 185.01 ± 4.82 18.25 ± 1.71
0.2 197.04 ± 29.00 24.67 ± 3.21
0.3 205.24 ± 0.00* 32.00 ± 1.41
Keterangan : * hanya ada satu tanaman
Gambar 16 Tunas dengan perlakuan kolkisin (A) 0%, (B) 0.1%, (C) 0.2%, (D) 0.3%, tebal daun dengan perlakuan kolkisin (E) 0%, (F) 0.1%, (G) 0.2%, (H) 0.3%, stomata dengan perlakuan kolkisin (I) 0%, (J) 0.1%, (K) 0.2%, (L) 0.3%
20
tunas kontrol. Hasil penelitian Tang et al. (2011), tanaman diploid memiliki ukuran stomata yang lebih kecil dibandingkan dengan tanaman tetraploid turunannya.
Ukuran stomata yang semakin besar mengakibatkan kerapatan stomata menjadi semakin rendah (Tabel 4). Tunas yang diberikan perlakuan kolkisin memiliki kerapatan stomata lebih rendah dibandingkan dengan tunas kontrol karena tunas yang diberikan perlakuan kolkisin memiliki ukuran stomata yang lebih besar. Tunas perlakuan kolkisin 0.1% memiliki kerapatan stomata yang lebih rendah daripada tunas kontrol. Hasil yang sama juga diperoleh dari penelitian Rego et al. (2011) pada tanaman Passiflora edulis Sims., daun tetraploid memiliki kerapatan stomata yang lebih rendah dibandingkan dengan daun diploid.
Tabel 4 Pengaruh perlakuan konsentrasi kolkisin terhadap ukuran panjang dan lebar stomata serta kerapatan stomata
Konsentrasi kolkisin (%)
Panjang stomata (µm)
Lebar stomata (µm)
Kerapatan stomata (jumlah stomata mm-2) 0 18.32 ± 1.24 14.96 ± 2.84 67.52 ± 7.64
0.1 23.66 ± 2.63 21.44 ± 3.78 59.87 ± 8.70 0.2 22.34 ± 0.85 18.19 ± 1.09 54.35 ± 15.57 0.3 19.59 ± 2.52 17.31 ± 1.09 47.56 ± 51.55
Gambar 17 Daun pertama, daun ketiga, dan daun kelima tunas jeruk Siam Simadu perlakuan kolkisin 0.1% yang dianalisis jumlah kloroplas
21 Tabel 5 Jumlah kloroplas daun pertama, ketiga, dan kelima tunas perlakuan
kolkisin 0.1%
Daun Jumlah kloroplas
Tunas 1 Tunas 2 Tunas 3
Pertama 15.50 ± 1.00 16.40 ± 1.14 16.00 ± 0.82 Ketiga 16.33 ± 1.53 17.33 ± 0.58 15.75 ± 0.96 Kelima 16.67 ± 0.58 24.67 ± 2.08 17.33 ± 1.15
Kimera dapat terjadi karena tunas pucuk terdiri atas banyak sel. Bagian sel yang terluar akan mengalami penggandaan kloroplas lebih awal karena sel-sel langsung terkena kolkisin. Sel-sel meristematik dan bakal daun yang lebih muda pada meristem apikal, yang terlindung oleh bakal daun yang lebih tua (Gambar 18) akan mengganda setelah larutan kolkisin berhasil masuk ke bagian tersebut sehingga mengakibatkan penggandaan kloroplas yang berbeda dan terjadi kimera. Induksi tetraploid menggunakan tunas pucuk dapat menyebabkan persentase kimera (miksoploid) yang tinggi (Thao et al. 2003; Gu et al. 2005). Kimera juga ditemukan pada penelitian Aleza et al. (2009) dalam menghasilkan tanaman jeruk tetraploid.
Gambar 18 Struktur tunas pucuk (sel-sel meristematik, bakal daun yang lebih muda, dan bakal daun yang lebih tua) (UIC 2013)
Percobaan II. Induksi Tetraploid Tunas Samping Jeruk Siam Simadu
Menggunakan Kolkisin secara In Vitro
Pola respon kematian tunas samping jeruk terhadap berbagai konsentrasi kolkisin menghasilkan respon linear. Persamaaan respon kematian tunas samping jeruk terhadap berbagai konsentrasi kolkisin yaitu y = 279.9x + 5.447, nilai LD50 diperoleh pada konsentrasi kolkisin
22
perlakuan kolkisin, tunas samping jeruk yang awalnya berwarna hijau, kemudian berubah perlahan menjadi warna coklat dan mati (Gambar 20).
Gambar 19 Kurva LD50 tunas samping jeruk Siam Simadu satu bulan
setelah perlakuan kolkisin
Gambar 20 Tunas samping jeruk Siam Simadu yang mati akibat perlakuan kolkisin
Semakin tinggi konsentrasi kolkisin yang diberikan maka rata-rata jumlah tunas baru yang muncul semakin sedikit (Gambar 21). Hal ini disebabkan karena kolkisin yang bersifat racun sehingga mengakibatkan penundaan regenerasi dan induksi tunas. Penelitian Nilanthi et al. (2009) pada tanaman Echinacea purpurea L. memberikan hasil yang sama, semakin tinggi konsentrasi kolkisin yang diberikan maka jumlah tunas yang dihasilkan semakin sedikit.
23 Tunas kontrol dan tunas yang diberikan perlakuan kolkisin memiliki jumlah daun dan panjang daun yang hampir sama (Gambar 23 dan Gambar 24). Gambar 26 merupakan gambar tunas baru yang muncul dari tunas samping jeruk Siam Simadu yang berumur delapan minggu setelah perlakuan kolkisin.
Gambar 21 Rata-rata jumlah tunas baru yang muncul dari tunas samping jeruk Siam Simadu pada umur delapan minggu setelah perlakuan kolkisin
Gambar 22 Tinggi tunas yang baru muncul dari tunas samping jeruk Siam Simadu pada umur delapan minggu setelah perlakuan kolkisin
24
Gambar 23 Jumlah daun tunas yang baru muncul dari tunas samping jeruk Siam Simadu pada umur delapan minggu setelah perlakuan kolkisin
25
Gambar 26 Tunas baru yang muncul dari tunas samping jeruk Siam Simadu yang berumur delapan minggu setelah perlakuan kolkisin (A) 0%, (B) 0.1%, (C) 0.2%, dan (D) 0.3%
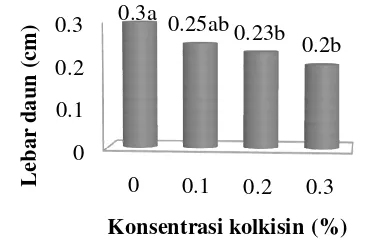
Data Tabel 8 menunjukkan bahwa daun tunas yang diberikan perlakuan kolkisin lebih tebal dibandingkan dengan daun tunas kontrol. Semakin tinggi konsentrasi kolkisin, semakin tebal juga daun yang dihasilkan (Gambar 27). Hasil penelitian Chen et al. (2010) pada Anthurium andraeanum menunjukkan bahwa tanaman tetraploid memiliki daun yang lebih tebal dibandingkan dengan tanaman diploid.
Gambar 27 Tebal daun tunas yang baru muncul dari tunas samping jeruk Siam Simadu yang berumur delapan minggu setelah perlakuan kolkisin (A) 0%), (B) 0.1%, (C) 0.2%, dan (D) 0.3%
26
Tabel 6 Jumlah dan panjang akar tunas pucuk jeruk Siam Simadu yang diberikan perlakuan kolkisin pada media MS + vitamin MS + IBA 3 ppm selama satu bulan
Perlakuan kolkisin (%) Jumlah akar Panjang akar (cm)
0 0.5 1.8
0.1 0 0
0.2 0 0
0.3 0 0
Tabel 7 Jumlah dan panjang akar tunas pucuk jeruk Siam Simadu yang diberikan perlakuan kolkisin pada media MS + vitamin MS + NAA 3 ppm selama satu bulan
Perlakuan kolkisin (%) Jumlah akar Panjang akar (cm)
0 0.3 1.6
0.1 0 0
0.2 0 0
0.3 0 0
Tunas yang diberikan perlakuan kolkisin memiliki jumlah kloroplas lebih banyak daripada jumlah kloroplas tunas kontrol (Tabel 8), sehingga dapat diduga bahwa tunas yang diberikan perlakuan kolkisin telah mengalami penggandaan kromosom. Penelitian Ye et al. (2010) pada tanaman Lagerstroemia indica L. memberikan hasil yang sama, tanaman hasil perlakuan kolkisin memiliki jumlah kloroplas yang lebih banyak dibandingkan dengan tanaman diploid.
Peningkatan jumlah kloroplas pada sel penjaga mengakibatkan ukuran stomata menjadi lebih besar (Gambar 28). Tunas yang diberikan perlakuan kolkisin memiliki ukuran panjang dan lebar stomata yang lebih besar dibandingkan dengan tunas kontrol karena memiliki jumlah kloroplas yang lebih banyak (Tabel 9). Ukuran stomata yang semakin besar mengakibatkan kerapatan stomata menjadi semakin rendah (Tabel 9). Tunas yang diberikan perlakuan kolkisin memiliki kerapatan stomata lebih rendah dibandingkan dengan tunas kontrol karena memiliki ukuran stomata yang lebih besar. Hasil yang sama juga diperoleh dari penelitian Ye et al. (2010) pada tanaman Lagerstroemia indica L. tanaman yang diberikan perlakuan kolkisin memiliki ukuran stomata yang lebih besar dan kerapatan stomata yang lebih rendah dibandingkan dengan tanaman diploid.
Tabel 8 Pengaruh perlakuan konsentrasi kolkisin terhadap tebal daun dan jumlah kloroplas per pasang sel penjaga
Konsentrasi
kolkisin (%) Rata-rata tebal daun (µm)
27 Tabel 9 Pengaruh perlakuan konsentrasi kolkisin terhadap ukuran panjang
dan lebar stomata serta kerapatan stomata Konsentrasi
kolkisin (%)
Panjang stomata (µ m)
Lebar stomata (µ m)
Kerapatan stomata (jumlah stomata mm-2) 0 16.81 ± 0.38 14.44 ± 0.40 68.12 ± 2.06
0.1 29.51 ± 7.74 30.80 ± 5.11 45.21 ± 5.49 0.2 34.48 ± 1.47 35.42 ± 0.55 43.26 ± 2.19 0.3 38.32 ± 0.34 38.42 ± 0.23 40.77 ± 1.07
Gambar 28 Stomata daun tunas yang baru muncul dari tunas samping jeruk Siam Simadu yang berumur delapan minggu setelah perlakuan kolkisin (A) 0%), (B) 0.1%, (C) 0.2%, dan (D) 0.3%
Percobaan III. Induksi Tetraploid Embrio Somatik Jeruk Siam Simadu
Menggunakan Kolkisin secara In Vitro
Pola respon kematian embrio somatik jeruk terhadap berbagai konsentrasi kolkisin menghasilkan respon linear. Persamaaan respon kematian embrio somatik jeruk terhadap berbagai konsentrasi kolkisin yaitu y = 257.1x - 0.221, nilai LD50 diperoleh pada konsentrasi kolkisin
28
Gambar 29 Kurva LD50 embrio somatik jeruk Siam Simadu satu bulan
setelah perlakuan kolkisin
Perlakuan kolkisin mempengaruhi persentase planlet normal yang dihasilkan. Embrio somatik kontrol (kolkisin 0%) menghasilkan planlet normal yang lebih banyak dibandingkan dengan embrio somatik yang diberikan perlakuan kolkisin (Tabel 10). Semakin tinggi konsentrasi kolkisin maka semakin rendah planlet normal yang dihasilkan. Hal ini disebabkan oleh pembelahan sel yang abnormal akibat perlakuan kolkisin sehingga dapat meningkatkan planlet abnormal. Zeng et al. (2006) efek samping dari penggunaan kolkisin menyebabkan pertumbuhan dan morfologi yang abnormal. Gambar 30 merupakan gambar planlet normal dan abnormal pada setiap perlakuan kolkisin.
Tabel 10 Persentase planlet normal dan abnormal yang dihasilkan setelah perlakuan kolkisin
Konsentrasi kolkisin (%) Planlet normal (%) Planlet abnormal (%)
0 100 (25/25) 0
0.1 80 (16/20) 20 (4/20)
0.2 50 (5/10) 50 (5/10)
0.3 28 (2/7) 72 (5/7)
Keterangan : Jumlah planlet normal atau abnormal/jumlah keseluruhan planlet
29
Gambar 30 Planlet normal dari perlakuan kolkisin (A) 0%, (B) 0.1%, (C) 0.2%, (D) 0.3% dan planlet abnormal dari perlakuan kolkisin (E) 0.1%, (F) 0.2%, (G) 0.3%
Tabel 11 Persentase planlet diploid dan tetraploid yang dihasilkan setelah perlakuan kolkisin
Konsentrasi kolkisin (%) Persentase planlet yang dihasilkan
Diploid Tetraploid
0 100%(25/25) -
0.1 100%(20/20) -
0.2 80%(8/10) 20%(2/10)
0.3 86%(6/7) 14%(1/7)
Keterangan : Jumlah planlet diploid atau tetraploid/jumlah keseluruhan planlet
Tabel 12 Jumlah kromosom planlet diploid dan tetraploid
Planlet Jumlah kromosom
Diploid 17.33 ± 0.58
Tetraploid 35.00 ± 1.00
30
Perbandingan antara Induksi Tetraploid Tunas Pucuk, Tunas Samping, dan Embrio Somatik Jeruk Siam Simadu Menggunakan Kolkisin
secara In Vitro
Induksi tetraploid jeruk Siam Simadu lebih baik menggunakan eksplan embrio somatik fase globular daripada tunas pucuk dan tunas samping karena embrio somatik fase globular memiliki jumlah sel yang lebih sedikit dibandingkan dengan tunas pucuk dan tunas samping sehingga munculnya kimera dapat berkurang. Embrio somatik dapat secara langsung menghasilkan akar dibandingkan dengan tunas pucuk dan tunas samping yang harus melalui tahap induksi akar terlebih dahulu karena embrio somatik berbentuk bipolar yaitu mempunyai calon meristem yaitu akar dan meristem tunas (Husni et al. 2010). Induksi tetraploid tunas pucuk dan tunas samping sampai saat ini belum dapat menginduksi akar, walaupun telah ditanam pada media yang ditambahkan auksin sehingga tidak dapat dilakukan analisis kromosom. Induksi tetraploid embrio somatik memerlukan waktu perendaman yang lebih cepat dibandingkan dengan tunas pucuk dan tunas samping karena embrio somatik memiliki ukuran yang lebih kecil dibandingkan dengan tunas pucuk dan tunas samping.
Pembahasan Umum
Induksi tetraploid menggunakan kolkisin dapat menurunkan pertumbuhan tunas jeruk Siam Simadu. Semakin tinggi konsentrasi kolkisin yang diberikan maka pertambahan tinggi, jumlah daun, jumlah buku, panjang daun dan lebar daun tunas juga semakin sedikit sehingga ukuran tanaman menjadi lebih kecil dibandingkan dengan tanaman kontrol. Hasil yang diperoleh dari penelitian ini memiliki kesamaan dengan penelitian-penelitian sebelumnya yaitu pada beberapa tanaman rentan terhadap perlakuan kolkisin yang menyebabkan penurunan pertumbuhan pada tanaman Gossypium arboretum L (Rauf et al. 2006), Plantanus acerifolia (Liu et al. 2007), dragonhead (Omidbaigi et al. 2010a), dan Pelargonium x hortorum (Jadrna et al. 2010).
Terhambatnya pertumbuhan tunas diduga karena proses pembelahan sel yang abnormal akibat pengaruh kolkisin. Damayanti dan Mariska (2003) menyebutkan pemberian kolkisin dapat mengakibatkan penundaan pertumbuhan akibat jaringan yang rusak dan memerlukan waktu lama untuk tumbuh. Menurut Suryo (2007) pembelahan sel menjadi lambat disebabkan jumlah kromosom yang mengganda.
31 Identifikasi tingkat ploidi dapat dilakukan dengan analisis stomata. Teknik ini cepat, murah, tidak merusak, tidak memerlukan peralatan yang canggih, dan memiliki akurasi yang cukup tinggi hingga 90% (Ascough et al. 2008). Menurut Rego et al. (2011), metode penghitungan jumlah kloroplas dalam sel penjaga adalah cara yang efektif dan cepat untuk menentukan tingkat ploidi. Jumlah kloroplas dalam sel penjaga dapat mengidentifikasi tanaman diploid dan tetraploid. Gu et al. (2005) dan Yu et al. (2009) juga telah meneliti tingkat ploidi berdasarkan jumlah kloroplas.
Tunas yang diberikan perlakuan kolkisin 0.1% memiliki jumlah kloroplas dua kali lebih banyak daripada jumlah kloroplas tunas kontrol (diploid) sehingga dapat diduga bahwa tunas yang diberikan perlakuan kolkisin 0.1% merupakan tunas tetraploid jeruk Siam Simadu. Penelitian Rego et al. (2011) pada tanaman Passiflora edulis Sims. memberikan hasil yang sama, daun tetraploid memiliki jumlah kloroplas dua kali lebih banyak dari daun diploid.
Lozykowska (2003) menyatakan bahwa ukuran stomata berhubungan dengan jumlah kloroplas pada sel penjaga. Peningkatan jumlah kloroplas pada sel penjaga mengakibatkan ukuran stomata menjadi lebih besar. Tunas yang diberikan perlakuan kolkisin memiliki ukuran panjang dan lebar stomata yang lebih besar dibandingkan dengan tunas kontrol karena tunas yang diberikan perlakuan kolkisin memiliki jumlah kloroplas yang lebih banyak. Tunas perlakuan kolkisin 0.1% memiliki ukuran panjang dan lebar stomata yang lebih besar daripada tunas kontrol. Hasil penelitian Tang et al. (2011), tanaman diploid memiliki ukuran stomata yang lebih kecil dibandingkan dengan tanaman tetraploid turunannya.
Ukuran stomata yang semakin besar mengakibatkan kerapatan stomata menjadi semakin rendah. Tunas yang diberikan perlakuan kolkisin memiliki kerapatan stomata lebih rendah dibandingkan dengan tunas kontrol karena tunas yang diberikan perlakuan kolkisin memiliki ukuran stomata yang lebih besar. Tunas perlakuan kolkisin 0.1% memiliki kerapatan stomata yang lebih rendah daripada tunas kontrol. Hasil yang sama juga diperoleh dari penelitian Rego et al. (2011) pada tanaman Passiflora edulis Sims., daun tetraploid memiliki kerapatan stomata yang lebih rendah dibandingkan dengan daun diploid.
Induksi tetraploid menggunakan kolkisin dapat menurunkan rata-rata jumlah tunas baru yang muncul dari tunas samping jeruk Siam Simadu. Hal ini disebabkan karena kolkisin yang bersifat racun sehingga mengakibatkan penundaan regenerasi dan induksi tunas. Penelitian Nilanthi et al. (2009) pada tanaman Echinacea purpurea L. memberikan hasil yang sama, semakin tinggi konsentrasi kolkisin yang diberikan maka jumlah tunas yang dihasilkan semakin sedikit.