ISOLASI DAN KARAKTERISASI BAKTERI ENDOFIT PADA
TANAMAN
Acacia decurrens
(J.C.Wendl.) Willd.
LUKMAN AMIR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Isolasi dan Karakterisasi Bakteri Endofit pada Tanaman Acacia decurrens (J.C.Wendl.) Willd. adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2015
Lukman Amir
NIM A154130061
RINGKASAN
LUKMAN AMIR. Isolasi dan Karakterisasi Bakteri Endofit pada Tanaman
Acacia decurrens (J.C.Wendl.) Willd. Dibimbimg oleh DWI ANDREAS SANTOSA dan GIYANTO.
Acacia decurrens merupakan tanaman dengan kemampuan tumbuh cepat dan termasuk kedalam famili Leguminosae. Jenis tanaman ini dapat dijumpai di kawasan taman nasional gunung Merapi (Selo dan Cangkringan) dan kawasan taman nasional gunung Merbabu, Indonesia. Tanaman ini terkenal di Indonesia selain karena kemampuan tumbuh cepatnya, juga karena kemampuan daya adaptasi tinggi yang terkadang mampu menginvasi suatu kawasan. Kemampuan tersebut diduga dipengaruhi kuat oleh keberadaan mikroorganisme khusunya bakteri endofit pada jaringan tanaman tersebut. Tujuan dari penelitian ini yaitu: (1) untuk mendapatkan bakteri endofit dengan cara mengisolasi, mengkarakterisasi, menyeleksi dan mengidentifikasi bakteri endofit dari tanaman
A. decurrens, (2) mempelajari peran bakteri endofit dalam meningkatkan pertumbuhan tanaman padi.
Lokasi pengambilan sampel terletak pada kawasan taman nasional gunung Merapi dan Merbabu. Proses isolasi, seleksi, karakterisasi dan identifikasi bakteri endofit dari sampel yang berupa bagian akar, batang dan daun tanaman A. decurrens dilakukan di Laboratorium Bioteknologi Lingkungan Indonesian Center for Biodiversity and Biotechnology (ICBB) Bogor.
Sebanyak 48 isolat bakteri endofit telah diisolasi dari jaringan pada akar, batang dan daun A. decurrens. Keseluruhan isolat kemudian diseleksi melalui uji patogenitas (reaksi hemolisis pada media agar darah dan hypersensitif respon menggunakan tanaman tembakau) dan dalam meningkatkan daya kecambah dan daya tumbuh benih padi. Berdasarkan hasil seleksi, diperoleh sepuluh isolat yang akan diuji lebih lanjut. Selanjutnya, kesepuluh isolat terpilih diuji dalam menambat N2, memproduksi IAA, melarutkan fosfat, melarutkan kalium, menghambat pertumbuhan bakteri (Xanthomonas oryzae pv. oryzae) dan cendawan (Rhizoctonia solani) penyebab penyakit pada tanaman. Dari hasil uji lanjut yang telah dilakukan, keseluruhan isolat terbukti mampu menambat N2 dan memproduksi IAA, enam diataranya sebagai pelarut fosfat, satu isolat dengan kemamampuan menghambat pertumbuhan X. oryzae dan satu isolat terhadap R. solani.
Pseudomonas sp. dan Bd3 memiliki kemiripan 96.1% dengan Enterobacter cloacae. Keseluruh isolat tersebut telah terdaftar dan memiliki nomor aksesi dari
European Molecular Biology Laboratory (EMBL) Nucleotide Sequence Database. Berdasarkan pada hasil sequensing gene 16S rRNA dan karakter morfologi dan biokimia, ketiga isolat tersebut kemungkinan besar merupakan genus baru dari kelas -proteobacteria.
SUMMARY
LUKMAN AMIR. Isolation and Characterization of Endophytic Bacteria from
Acacia decurrens (J.C.Wendl.) Willd. Dibimbimg oleh DWI ANDREAS SANTOSA dan GIYANTO.
Acacia decurrens is a fast growing tree from acacia species and belonging to the family Leguminosae. A. decurrens can be found in Merapi (Selo and Cangkringan) and Merbabu mountain national park, Indonesia. This plant is famous in Indonesia because of its ability to grow rapidly, adapt and even invade a territory. Microorganisms thought to play an important role in the growth of this plant, especially endophytic bacteria. The aims of this study are: (1) To obtain the endophytic bacteria by isolating, selecting, characterizing, and identifying endophytic bacteria from A. decurrens, (2) Investigated the role of endophytic bacteria in promoting the growth of the rice plant.
Sampling sites located in the national park area of Merapi and Merbabu mountain. The process of isolation, selection, characterization and identification of endophytic bacteria form roots, stems and leaves of A. decurrens conducted at the Laboratory of Environmental Biotechnology Indonesian Center for Biodiversity and Biotechnology (ICBB) Bogor.
A total of 48 endophytic bacteria isolated from roots, stems and leaves of A. decurrens that grow in the national park of Merapi and Merbabu mountain. These isolates were selected by the pathogenicity test (hemolytic reaction on blood agar media and hypersensitive response of tobacco plants) and the ability to promote the germination and growth of rice seed. Following the selection test, 10 endophytic bacteria were selected for further investigation. Further, experiments were performed with 10 isolates to determine their N2 fixation, auxin producing activities, phosphate and potassium solubilizing, antagonistic activities against
plant phytopathogenic bacteria (Xanthomonas oryzae pv. oryzae) and fungi
(Rhizoctonia solani), and plant growth promotion in rice. Our result revealed that ten bacterial isolates belonging to diazotrophic bacteria and producing IAA, while
six as phosphate solubilizing, one isolate showed antagonistic activities against X.
oryzae and one against R. solani.
These isolates were tested in promoting vegetative growth of rice plant. The experiment was a completely randomized design consisted of 12 treatments, with 5 replications. The treatments were: (treatment 1-10) endophytic bacteria with half recommended dose of N, P, K inorganic fertilizers and (treatment 11 and 12) as a control half and full recommended dose of N, P, K fertilizers. Among 10 isolates tested, the Bb4, Ca9 and Bd3 were superior isolate, which were capable to replace half recommended dose of chemical fertilizer for the vegetative growth of rice. These isolates were chosen for futher identification. Based on the 16S rRNA sequences, the isolate of Bb4 (LN907847), Ca9 (LN907849) and Bd3 (LN907848) has 96.4%, 96.2% and 96.1% similarity to Enterobacter sp.,
16S rRNA gene and further morphology and biochemical tests showed that those isolates were most probably a new genus of the γ-class of Proteobacteria.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
ISOLASI DAN KARAKTERISASI BAKTERI ENDOFIT PADA
TANAMAN AKASIA (
Acacia decurrens
(J.C.Wendl.) Willd.)
LUKMAN AMIR
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi Tanah dan Lingkungan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT karena atas segala rahmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini dilaksanakan sejak Agustus 2014 sampai Oktober 2015 dengan judul Isolasi dan Karakterisasi Bakteri Endofit pada Tanaman Acacia decurrens (J.C.Wendl.) Willd.
Penulis menyampaikan penghargaan dan terima kasih kepada Prof. Dr. Ir. Dwi Andreas Santosa MS dan Dr. Ir Giyanto M.Si selaku komisi pembimbing atas segala bimbingan, kritik, saran dan motivasi yang telah diberikan dengan tulus dan penuh kesabaran untuk penulis selama penelitian hingga penyelesaian tesis ini. Ungkapan terima kasih penulis sampaikan kepada Direktorat Jenderal Pendidikan Tinggi untuk pemberian beasiswa sehingga penulis dapat menempu pendidikan di Sekolah Pascasarjana Institut Pertanian Bogor. Terima kasih juga penulis sampaikan kepada bapak, ibu dan rekan-rekan di Laboratorium Bioteknologi Lingkungan Indonesian Center for Biodiversity and Biotechnology
(ICBB) atas fasilitas serta bantuannya selama masa penelitian dan penulisan tesis ini. Penulis juga menyampaikan terima kasih kepada Anggreny Pramitha Wulandari dan rekan-rekan yang telah membantu, memberi dorongan dan motivasi selama masa studi di IPB. Terima kasih tak terhingga penulis sampaikan kepada ayahanda, ibunda, kakak, adik dan beserta keluarga besar yang telah memberikan limpahan kasih sayang, doa dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2015
DAFTAR ISI
Halaman
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xii
PENDAHULUAN 1
Latar Belakang 1
Peruumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
METODOLOGI PENELITIAN 3
Tempat dan waktu penelitian 3
Bahan dan Alat 3
Isolasi Bakteri Endofit dari Tanaman Acacia decurrens 3
Seleksi Bakteri Endofit 4
Karakterisasi Bakteri Endofit 5 Uji Efektifitas 10 Isolat Bakteri Endofit dalam Memacu
Pertumbuhan Vegetatif Tanaman Padi
6
Identifikasi Bakteri Endofit 7
HASIL DAN PEMBAHASAN 9
Lokasi Pengambilan sampel 9
Hasil Isolasi Bakteri Endofit dari Tanaman Acacia decurrens 10
Seleksi Bakteri Endofit 11
Karakterisasi Bakteri Endofit 15 Pengaruh Bakteri Endofit terhadap Pertumbuhan
Vegetatif Tanaman Padi
18
Identifikasi Bakteri Endofit 20
PEMBAHASAN UMUM 25
SIMPULAN DAN SARAN 27
DAFTAR PUSTAKA 28
LAMPIRAN 33
RIWAYAT HIDUP 38
DAFTAR TABEL
Halaman 1. Jumlah dan keragaman bakteri endofit yang diisolasi dari tanaman
Acacia decurrens
10 2. Uji hemolisis dan hipersensitif isolat bakteri endofit 11 3. Rata-rata panjang akar, panjang pucuk, bobot basah, bobot kering
pertumbuhan padi stelah 7 hari masa inkubasi
14 4. Kemampuan menambat N2, melarutkan fosfat, kalium dan
menghambat pertumbuhan mikrob pathogen
15 5. Tinggi tanaman, jumlah daun dan jumlah anakan setelah 4MST (37
hari)
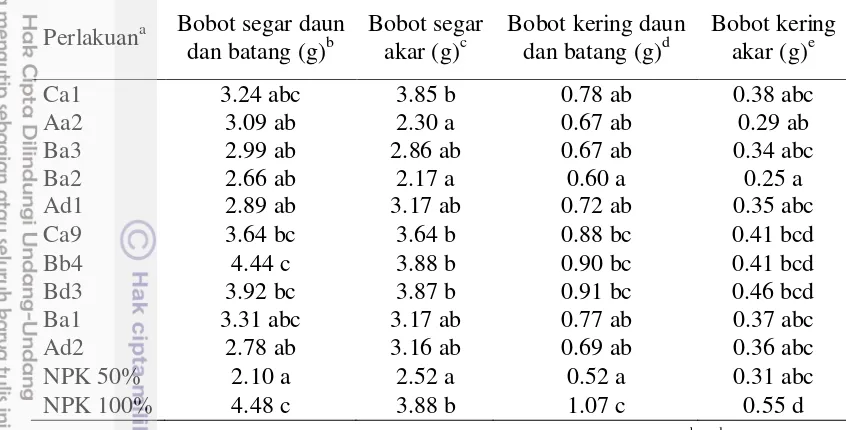
19 6. Bobot segar dan kering akar, daun dan batang 20
7. Penelusuran sekuen 16S rRNA tiga isolat bakteri endofit dengan spesies padanan
21 8. Karakter morfologi dan biokimia 3 bakteri endofit dengan bakteri
pembanding
23
DAFTAR GAMBAR
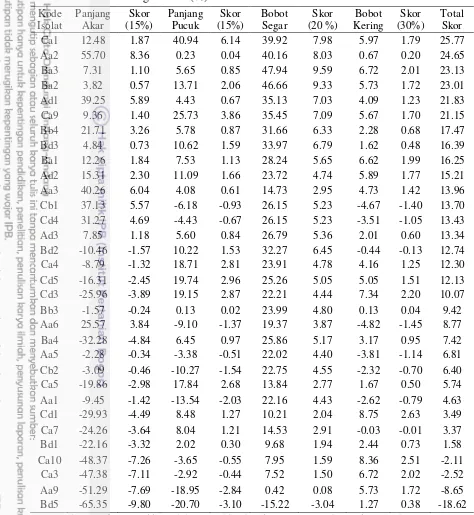
Halaman 1. Lokasi pengambilan sampel 9 2. Lokasi pengambilan sampel di 3 lokasi, (a) kawasan TNG Merapi
daerah Selo, (b) kawasan TNG Merbabu, (c) kawasan TNG Merapi daerah cangkringan
9
3. Hasil uji hemolisis dengan media agar darah setelah 17 jam masa inkubasi, a) reaksi positif ditandai dengan adanya zona bening disekitar koloni, b) reaksi negatif
11
4. Hasil uji respon hipersensitif terhadap isolat bakteri endofit pada daun tembakau. Contoh reaksi positif yang ditunjukkan oleh isolat Aa8 setelah masa inkubasi 48 jam
13
5. Kemampuan bakteri endofit dalam menambat N2 secara kualitatif terlihat dengan terbentuknya pelikel putih di bawah permukaan media NFB pada 10 isolat uji
16
6. Uji bakteri endofit dalam melarutkan fosfat setelah 4 hari masa inkubasi, a) reaksi positif terlihat dari zona bening disekitar koloni, b) reaksi negatif
7. Kemampuan 10 isolat bakteri endofit dalam menghasilkan hormon IAA
18 8. Koloni bakteri endofit a (Bb4), b (Ca9) dan c (Bd3) 20 9. Hasil elektroforesis amplifikasi gen 16S rRNA isolat Bd3, Bb4,Ca9
dengan penanda 1kb
21 10.Hasil analisis filogeni 3 isolat bakteri endofit 22
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar Belakang
Akasia (Acacia spp.) merupakan jenis tanaman yang termasuk kedalam famili Leguminosae (Glushenkova 2012). Genus akasia merupakan tanaman tropis-subtropis yang tersebar luas dari Amerika tengah melintasi Afrika hingga pada Asia tenggara dan Australia (Burley et al. 2004). Jenis tanaman ini banyak dibudidayakan di Indonesia sebagai tanaman kehutanan atau sebagai tanaman reklamasi. Salah satu jenis akasia yang ada di Indonesia yaitu Acacia decurrens (J.C.Wendl.) Willd. Akasia jenis ini dapat dijumpai di kawasan Taman Nasional Gunung Merapi dan kawasan Taman Nasional Gunung Merbabu. Tanaman ini memiliki kemampuan tumbuh yang cepat dan daya adaptasi tinggi sehingga kerap mendominasi dalam suatu kawasan. Genus Acacia spp. termasuk kedalam famili Leguminosae dengan salah satu ciri yaitu bintil akar yang terbentuk dari hasil simbiosis antara bakteri dan akar tanaman tersebut. Berdasarkan beberapa hasil penelitian ditemukan beberapa jenis bakteri yang diisolasi dari bintil akar Acacia
spp. diantaranya, yaitu Bradyrhizobium (Nuswantara et al. 1997), Rhizobium dan
Sinorhizobium (Toledo et al. 2003). Namun demikian, keberadaan bakteri endofit pada jaringan tanaman akasia khususnya Acacia decurrens belum pernah dilaporkan dan diduga banyak memberikan pengaruh terhadap pertumbuhan tanaman tersebut.
Bakteri endofit merupakan bakteri yang hidup di dalam jaringan tanaman yang bersifat netral atau bermanfaat bagi tanaman inangnya. Peran bakteri endofit dalam meningkatkan pertumbuhan tanaman diduga didukung oleh kemampuan bakteri tersebut dalam menghasilkan hormon tumbuh seperti indole-3- acetic acid
(IAA), abscisic acid (ABA), gibberallic acid (GA) dan cytokinin (CTK) (Feng et al. 2006). Selain itu, bakteri endofit juga dilaporkan dapat meningkatkan pertumbuhan tanaman melalui penambatan N2 (diazotrophic bacteria) (Doty 2011), memobilisasi fosfat (Gusmaini 2014), juga karena kemampuannya dalam meningkatkan ketahananan tanaman terhadap hama dan penyakit (Brooks et al. 1994; Duan et al. 2013).
Eksplorasi bakteri endofit dari berbagai jenis tanaman dengan berbagai kepentingan telah banyak dilakukan. Hal tersebut demi memperoleh bakteri endofit yang unggul, khususnya di bidang pertanian. Bakteri dengan kemampuan meningkatkan pertumbuhan tanaman dapat dikembangkan menjadi agen pupuk hayati yang bermutu yang dapat meningkatkan hasil produksi tanaman pangan misalnya padi (Oryza sativa). Sebagai contoh, Hidayati (2014) melaporkan bahwa aplikasi pemberian inokulum bakteri endofit yang diisolasi dari tanaman karet berpotensi sebagai bakteri pemacu pertumbuhan karena terbukti mampu meningkatkan pertumbuhan batang bawah Hevea brasiliensis.
2
pengurangan penggunaan pupuk sintetik terus dilakukan salah satunya melalui pendekatan biologis, dengan memanfaatkan bakteri endofit yang memiliki kemampuan memacu pertumbuhan tanaman.
Minimnya informasi mengenai keberadaan bakteri endofit pada tanaman A. decurrens dan juga potensi yang dimilikinya baik untuk tanaman akasia itu sendiri maupun tanaman pangan (padi), mendorong upaya untuk mengeksplorasi bakteri endofit pada tanaman tersebut.
Perumusan Masalah
Berdasarkan latar belakang diatas, dirumuskan masalah penelitian sebagai berikut:
1. laporan mengenai informasi keberadaan bakteri endofit pada tanaman A. decurrens masih belum ada, khususnya di Indonesia.
2. belum terdapat informasi terkait dengan potensi bakteri endofit pada tanaman A. decurrens khususnya dalam memacu pertumbuhan tanaman padi.
Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan sebagai berikut:
1. memperoleh bakteri endofit dari tanaman A. decurrens dengan cara mengisolasi, mengkarakterisasi, menyeleksi dan mengidentifikasi bakteri tersebut.
2. mempelajari peran bakteri endofit dari tanaman A. decurrens dalam hal memacu pertumbuhan tanaman padi.
Manfaat Penelitian
3
METODE PENELITIAN
Tempat dan Waktu Penelitian
Lokasi pengambilan sampel jaringan tanaman A. decurrens yaitu di kawasan Taman Nasional Gunung Merapi (Kabupaten Boyolali, Provinsi Jawa Tengah dan Kabupaten Sleman Daerah Istimewa Yogyakarta) dan di kawasan Taman Nasional Gunung Merbabu (Kabupaten Boyolali, Provinsi Jawa Tengah). Proses isolasi, seleksi, karakterisasi dan identifikasi molekuler bakteri endofit dilakukan di Laboratorium Bioteknologi Lingkungan Indonesian Center for Biodiversity and Biotechnology (ICBB) Bogor. Penelitian ini dilaksanakan dari Agustus 2014 - Oktober 2015.
Bahan dan Alat
Obyek penelitian berupa bagian akar, batang dan daun A. decurrens . Bahan yang digunakan untuk isolasi, seleksi, karakterisasi dan identifikasi molekuler adalah Nutrient agar (NA), Nutrient broth (NB), alkohol 70%, NaOCl, larutan fisiologis (NaCl 0,85%), aquadest, media Blood agar (yang mengandung 5% darah domba (Zimbro et al. 2009), tembakau (Nicotiana tabacum), media Pikovskaya, media Alexandrov, media NFB (nitrogen free broth) dan benih padi.
Alat yang digunakan pada umumnya untuk isolasi, seleksi, karakterisasi dan identifikasi molekuler yaitu, mortar, tabung ulir, cawan petri, erlenmeyer, tabung reaksi, vortex, shaker, pipet mikro, magnetic stirrer, mikroskop, laminar air flow
(LAF), autoclaf, inkubator, Gas Chromatography (GC), High Performance Liquid Chromatography (HPLC), sentrifus, elektroforesis, mesin Polymerase Chain Reaction (PCR).
Isolasi Bakteri Endofit dari Tanaman Acacia decurrens Pengambilan Sampel
Sumber bakteri endofit diisolasi dari jaringan pada akar, batang dan daun tanaman A. decurrens. Sampel jaringan tanaman yang telah diperoleh dimasukkan ke dalam plastik sampel kemudian disimpan dengan suhu sekitar 40C hingga tahapan isolasi dilakukan (Strobel dan Daisy 2003).
Isolasi dan Purifikasi Bakteri Endofit
Isolasi bakteri endofit dari jaringan tanaman diawali dengan proses sterilisasi permukaan. Metode sterilisasi permukaan mengikuti sebagaimana yang dikemukakan Hallmann et al. (2006) yang telah dimodifikasi.
4
selama 3 menit untuk daun dan 4 menit untuk akar dan batang. Setelah itu sampel dibilas kembali dengan air steril sebanyak 3 kali. Untuk mengetahui keberhasilan dari proses sterilisasi permukaan, sampel disapukan ke permukaan media Nutrient Agar (NA) 10%. Indikator keberhasilan yang diamati yaitu dengan tidak adanya mikrob yang tumbuh pada media yang telah disapukan sampel tersebut.
Setelah proses sterilisasi permukaan, 1 gram sampel kemudian digerus hingga halus dan dilarutkan kedalam 9 ml larutan NaCl fisiologis, kemudian dilakukan seri pengenceran hingga 10-4. Masing-masing dari seri pengenceran ditumbuhkan pada media NA 10% kemudian isolat bakteri dimurnikan pada media NA 100%.
Seleksi Isolat Bakteri Endofit
Uji Hemolisis
Pengujian ini bertujuan untuk membedakan bakteri endofit yang diisolasi dari jaringan tanaman A. decurrens berdasarkan kemampuan melisiskan sel darah merah. Isolat bakteri endofit ditumbuhkan pada media agar darah dan diinkubasi pada suhu 35 ± 20C selama 18-24 jam. Adanya zona bening disekitar koloni mengindikasikan bahwa isolat tersebut berpotensi patogen terhadap manusia dan hewan (Zimbro et al. 2009).
Uji Respon Hipersensitif
Pengujian ini bertujuan untuk mengetahui sifat patogenitas isolat bakteri endofit terhadap tanaman. Isolat bakteri endofit yang telah ditumbuhkan pada media NB kemudian diinfiltrasikan pada sisi absial daun tanaman tembakau yang berumur sekitar 2 bulan. Pengamatan yang dilakukan berupa respon dari daun tembakau yang telah disuntikkan isolat bakteri endofit setelah 48 jam. Respon yang diperlihatkan dari daun tembakau berupa reaksi nekrosis pada sekitar daun yang berarti isolat tersebut berpotensi patogen terhadap tanaman (Schaad et al.
2001).
Uji Daya Kecambah dan Daya Tumbuh
Pengujian isolat bakteri endofit terhadap daya kecambah dan daya tumbuh bertujuan untuk melihat pengaruh bakteri endofit dalam mendukung daya kecambah dan daya tumbuh benih padi. Varietas benih padi yang digunakan yaitu varietas Ciherang. Benih padi steril direndam selama kurang lebih 24 jam kedalam suspensi isolat bakteri endofit yang telah ditumbuhkan pada media cair selama 24 jam. Sebagai kontrol benih direndam dengan air steril tanpa inokulan. Benih padi yang telah direndam kemudian diletakkan pada cawan petri yang telah dilapisi dengan kertas saring, jumlah benih pada setiap cawan petri yaitu 20 dan diulang sebanyak 3 kali. Pengamatan daya kecambah dilakukan pada hari ke 2 dan pertumbuhan setelah 7 hari inkubasi. Parameter yang diamati yaitu panjang akar, panjang pucuk, berat segar dan berat kering bibit padi.
5
segar 20% dan bobot kering 30%. Masing-masing nilai dari parameter dikalikan dengan bobot masing-masing. Selanjutnya hasil perkalian dari 4 parameter tersebut dijumlahkan. 10 isolat terbaik dipilih untuk diuji lebih lanjut.
Karakterisasi Bakteri Endofit Uji Kemampuan Menambat N2
Uji kemampuan bakteri endofit dalam menambat N2 secara kualitatif dilakukan dengan cara menumbuhkan isolat bakteri endofit pada media Nitrogen Free Broth (NFB). Sebanyak 100 µ l suspensi isolat dimasukkan kedalam tabung reaksi yang berisi media NFB dan di inkubasi selama 5-7 hari. Indicator yang diamati yaitu pelikel putih yang terbentuk dibawah permukaan media.
Uji kemampuan bakteri endofit dalam menambat N2 secara kulaitatif diamati secara tidak langsung melalui reduksi astilen menjadi etilen menggunakan
Gas Chromatoghraphy (GC) (Gothwal et al. 2007). Isolat ditumbuhkan pada media cair Nitrogen free broth dan diinkubasi pada mesin pengocok selama 24 jam dengan kecepatan rotasi 180 rpm pada suhu ruang. Kemudian 20 ml suspensi isolat dimasukkan ke dalam tabung inkubasi berkapasitas 30 ml. sebanyak 10% udara dari volume tabung inkubasi dikeluarkan menggunakan alat suntik steril kemudian disubtitusi dengan gas asetilen sebanyak volume yang diambil dan diinkubasi selama 2 jam. Jumlah dari gas etilen hasil reduksi dari asetilen oleh bakteri digunakan untuk mengukur kemampuan bakteri endofit dalam menambat N2.
Uji Kemampuan Melarutkan Fosfat
Isolat bakteri endofit yang berumur 24 jam diinokulasikan pada permukaan media pikovskaya padat (Subba-Rao 1982) dan diinkubasi selama 3-6 hari pada suhu 350C. Indikator yang diamati yaitu terbentuknya zona bening disekitar koloni yang berarti isolat tersebut mampu melarutkan fosfat (Saraswati et al.
2007).
Uji Kemampuan Melarutkan Kalium
Isolat bakteri endofit yang berumur 24 jam diinokulasikan pada permukaan media Alexandrof (Hu et al. 2006) padat dan diinkubasi selama 3-6 hari pada suhu 350C. Indikator yang diamati yaitu terbentuknya zona bening disekitar koloni yang berarti isolat tersebut mampu melarutkan kalium.
Uji Kemampuan Menghasilkan Hormon Tumbuh Indol-3-Acetat Acid (IAA) Pengujian 10 isolat bakteri endofit dilakukan dengan menggunakan metode
6
Uji Antagonis Bakteri Endofit terhadap Mikrob Pathogen Tanaman
Uji antagonis isolat bakteri endofit diuji pada mikrob patogen yaitu
Xantomonas oryzae pv. oryzae dan Rhizoctonia solani. X. oryzae merupakan salah satu jenis bakteri Gram-negatif yang menyebabkan penyakit hawar daun pada padi (Furutani 2009) dan Rhizoctonia solani merupakan cendawan penyebab hawar pelepah pada padi (Neeraja et al. 2002).
Kultur cair X. oryzae disapukan secara merata kepermukaan media NA dan diikuti dengan meletakkan kertas cakram yang telah dicelupkan kedalam kultur cair bakteri endofit ke permukaan media yang telah disapukan X. oryzae
sebelumnya. Uji antagonisme bakteri endofit terhadap cendawan pathogen berupa
R. solani dilakukan pada media Potato Dextrose Agar (PDA). Isolat bakteri endofit ditumbuhkan selama 48 jam lebih awal dari cendawan patogen. Pengujian tersebut menggunakan metode dual culture seperti yang telah dilakukan sebelumnya oleh Kim et al. (2008). Indikator bahwa bakteri endofit positif menghambat pertumbuhan isolat patogen yaitu dengan terbentuknya zona bening di sekitar koloni setelah masa inkubasi selama 24-48 jam untuk bakteri dan 120 jam untuk cendawan.
Uji Efektifitas 10 Isolat Bakteri Endofit dalam Memacu Pertumbuhan Vegetatif Tanaman Padi
Percobaan ini menggunakan 10 isolat bakteri endofit hasil seleksi dari uji daya kecambah. Percobaan ini terdiri dari 12 perlakuan yang terdiri dari 10 isolat bakteri endofit (ditambah 1/2 dosis anjuran pupuk NPK) dan 2 kontrol (1/2 dan 1 dosis anjuran pupuk NPK). Percobaan menggunakan rancangan acak lengkap. Model linear yang digunakan adalah Y ij = μ + τi + εij. Yij Pengamatan pada perlakuan ke-i dan ulangan ke-j, μ adalah rataan umum, τi adalah pengaruh perlakuan ke-i dan εij adalah pengaruh acak pada perlakuan ke-i, ulangan ke-j. percobaan ini dilakukan hingga tanaman berumur 37 hari (4 minggu setelah tanam = MST). Masing-masing perlakuan diulang sebanyak 5 kali sehingga diperoleh 60 satuan percobaan.
Parameter pertumbuhan yang diamati yaitu jumlah daun (seluruh daun yang muncul dihitung), tinggi tanaman (diukur dari tanah hingga daun terpanjang), jumlah anakan, bobot basah dan bobot kering tanaman. Pengaruh perlakuan terhadap peubah-peubah yang diamati dilakukan dengan menggunakan analisis sidik ragam, dan apabila ada beda nyata diuji lanjut dengan Duncan’s Multiple
Range Test (DMRT) pada taraf kepercayaan 5%.
7
isolat. Waktu aplikasi pemberian pupuk N, P dan K berdasarkan anjuran pemupukan tanaman padi.
Identifikasi Bakteri Endofit
Identifikasi Molekuler
Identifikasi molekuler bakteri endofit dilakukan berdasarkan sekuen parsial 16S rRNA. Metode isolasi DNA mengacu pada publikasi Atashpaz et al. (2010) yang telah dimodifikasi.
Kultur bakteri yang telah ditumbuhkan pada media cair selama 12 jam dimasukkan sebanyak 1,5 ml kedalam mikro tube 3 ml kemudian disentrigusai pada 5600 xg dengan suhu 40C selama 5 menit. Hasil berupa supernatant di buang dan dimasukkan kembali sebanyak 1,5 ml kedalam tabung yang sama dan disentrifugasi hingga terbentuk pelet seberat 50-100 mg. Pelet yang diperoleh diresuspensi dengan larutan buffer lisis yang telah dihangatkan pada suhu 650C sebanyak 800 µ l. Sampel kemudian di inkubasi pada suhu 650C selama 30 menit (untuk Gram negatif) atau 2 jam (untuk Gram positif) dengan sambil dibolak-balik setiap 10 menit. Setelah di inkubasi, sampel disentrifugasi pada suhu 40C selama 5 menit. Supernatant hasil sentrifugasi kemudian dipindahkan kedalam mikro tube yang baru dan ditambahkan kloroform-isoamilalkohol (24:1 v/v) dengan volume yang sama. Sampel kemudian disentrifugasi dengan kecepatan 8064 xg pada suhu 40C selama 10 menit. Hasil sentrifugasi berupa 2 lapisan pada sampel dan lapisan diatas dipindahkan ke tabung mikro dan ditambhkan isopropanol secara perlahan demi mencegah terjadinya fragmentasi DNA. Sampel kemudian di inkubasi pada suhu -200C selama 30 menit kemudian disentrifugasi dengan kecepatan 10976 xg pada suhu 40C selama 10 menit. Supernatant hasil sentrifugasi dibuang dan pelet ditambahkan etanol 96% kemudian disentrifugasi pada kecepatan 8064 xg selama 5 menit. Setelah 5 menit, supernatant dibuang dan ditambahkan etanol 70% kedalam pelet dan disentrifugasi pada kecepatan, suhu dan waktu yang sama. Penambahan etanol 96% dan 70% disebut dengan tahap pencucian yang hasilnya berupa pelet. Pelet kemudian dikering anginkan dan ditambahkan air bebas nuclease sebanyak 50 µl.
Hasil preparasi sampel DNA kemudian diamplifikasi. Amplifikasi gen 16S rRNA menggunakan mesin Polymerase Chain Reaction (PCR, dice mini didahului oleh pra-denaturasi pada suhu 95oC selama 3 menit dan diakhiri dengan
final extension pada suhu 72oC selama 15 menit. Polimerisasi dilakukan pada suhu 700C selama 2 menit, lalu pada siklus terakhir waktu polimerisasi diperpanjang menjadi 15 menit.
8
database EMBL (European Molecular Biology Laboratory) pada situs http://www.ebi.ac.uk.. Hasil sekuensing didepositkan di EMBL Nucleotide Sequence Database. Analisis filogeni bakteri endofit menggunakan perangkat lunak The Molecular Evolutionary Genetics Analysis (MEGA) versi 6.0 (Tamura
et al. 2013).
Karakterisasi Morfologi dan Biokimia
9
HASIL DAN PEMBAHASAN
Lokasi Pengambilan Sampel
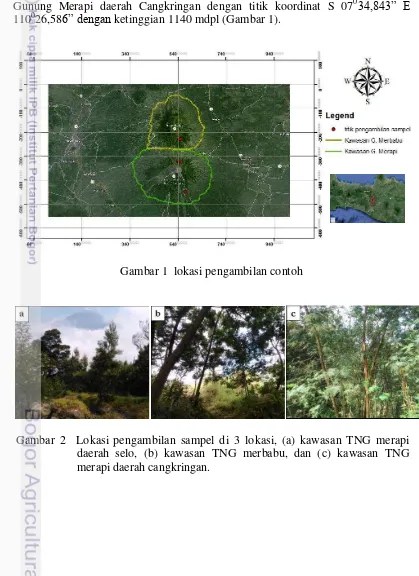
Lokasi pengambilan sampel terletak di kawasan taman nasional gunung Merapi dan Merbabu. Lokasi pertama yaitu di kawasan Taman Nasional Gunung Merapi daerah Selo, titik koordinat lokasi S 07031’22.5” E 110027’05.07” dengan ketinggian 2111 mdpl. Lokasi kedua yaitu pada kawasan Taman Nasional Gunung Merbabu daerah Selo dengan titik koordinat S 07028’44.0” E 110027’35.4” dengan ketinggian 1975 mdpl. Lokasi ketiga yaitu pada Kawasan Taman Nasional Gunung Merapi daerah Cangkringan dengan titik koordinat S 07034,843” E 110026,586” dengan ketinggian 1140 mdpl (Gambar 1).
Gambar 1 lokasi pengambilan contoh
10
Kondisi lokasi pengambilan sampel seperti yang terlihat pada Gambar 2. Pertumbuhan tanaman A. decurrens tampak lebih padat di daerah Cangkringan dibandingkan dengan 2 lokasi lainnya. Selain itu, perbedaan lain dari ketiga lokasi pengambilan sampel tersebut yaitu ukuran pohon dan umur tanaman A. decurrens.
A. decurrens yang tumbuh dilokasi Selo relatif lebih tua terlihat dari pohon yang lebih besar dan tampak berbunga. Sedangkan di Cangkringan tampak sebagian besar akasia yang tumbuh di lokasi tersebut masih muda.
Hasil Isolasi Bakteri Endofit pada Tanaman Acacia decurrens
Sejauh ini, telah banyak penelitian yang melaporkan tentang keberadaan bakteri endofit dari berbagai jenis tanaman (Mocali et al. 2003; Gao et al. 2015). Kebanyakan bakteri endofit berasal dari rizosfer dan filosfer (Ryan et al. 2008). Pada penelitian ini, sebanyak 48 isolat bakteri endofit (24 dari akar, 10 dari batang, 11 dari daun) berhasil diisolasi dari jaringan tanaman A. decurrens yang tumbuh pada kawasan taman nasional gunung Merapi dan Merbabu. Ciri morfologi koloni isolat-isolat tersebut disajikan pada Lampiran 2. Isolat-isolat tersebut merupakan hasil seleksi berdasarkan penampakan warna dan bentuk koloni yang berbeda. Penelitian ini merupakan penelitian pertama yang melaporkan tentang keberadaan bakteri endofit pada tanaman A. decurrens
khususnya yang tumbuh pada kawasan taman nasional gunung Merapi dan
Merbabu Merapi (Cangkringan) Merapi (Selo) Jumlah
11
Seleksi Isolat Bakteri Endofit Uji Hemolisis
Hasil uji hemolisis 48 bakteri endofit disajikan pada Tabel 2. Pada pengujian ini, reaksi hemolisis dapat diamati setelah ± 17 jam masa inkubasi yaitu melaui zona bening yang terbentuk disekitar koloni (Gambar 3). Diantara 48 isolat bakteri endofit terdapat 13 isolat yang menunjukkan reaksi hemolisis bertipe beta (β) pada media agar darah dengan zona bening yang terbentuk di sekitar koloni pada ± 17 jam masa inkubasi, dan 35 dengan hasil negatif atau tidak berpotensi pathogen terhadap hewan dan manusia (Tabel 2). Menurut Zimbro et al. (2009), terdapat 4 tipe hemolisis pada pengujian menggunakan media agar darah, alpha (α)-hemolysis yaitu media disekitar koloni berwarna kehijau-hijauan akibat reduksi hemoglobin menjadi met-hemoglobin, beta ( )-hemolysis yaitu sel darah merah lisis menghasilkan zona bening disekitar koloni, gamma ( )-hemolysis
berarti tidak ada hemolisis dikarenakan tidak adanya kerusakan sel darah merah dan perubahan pada media, dan alpha-prime (ά)-hemolysis yaitu suatu zona kecil dari hemolisis sempurna yang dikelilingi oleh sebagian area lisis.
Gambar 3 Hasil uji hemolisis dengan media agar darah setelah 17 jam masa inkubasi, a) reaksi positif ditandai dengan adanya zona bening disekitar koloni, b) reaksi negatif
Tabel 2 Uji hemolisis dan hipersensitif isolat bakteri endofit Kode
Simbol: + (patogen), – (tidak patogen); td (tidak diuji)
a
12
Ba1 Akar A. decurrens asal Cangkringan KTNG Merapi + td Ba2 Akar A. decurrens asal Cangkringan KTNG Merapi - - Ba3 Akar A. decurrens asal Cangkringan KTNG Merapi - - Ba4 Akar A. decurrens asal cangkringan KTNG Merapi - - Ba5 Akar A. decurrens asal Cangkringan KTNG Merapi + td Bb1 Batang A. decurrens asal Cangkringan KTNG Merapi + td Bb2 Batang A. decurrens asal Cangkringan KTNG Merapi + td Bb3 Batang A. decurrens asal Cangkringan KTNG Merapi - - Bb4 Batang A. decurrens asal Cangkringan KTNG Merapi - - Bd1 Daun A. decurrens asal Cangkringan KTNG Merapi + td Bd2 Daun A. decurrens asal Cangkringan KTNG Merapi - - Bd3 Daun A. decurrens asal Cangkringan KTNG Merapi - - Bd4 Daun A. decurrens asal Cangkringan KTNG Merapi - - Bd5 Daun A. decurrens asal Cangkringan KTNG Merapi - - Ca1 Akar A. decurrens asal Selo KTNG Merbabu - -
Simbol: + (patogen), – (tidak patogen); td (tidak diuji)
Uji Respon Hipersensitif
13
penyakit pada tanaman (Tabel 2). Respon hipersensitif yang ditunjukkan dengan reaksi nekrosis merupakan bentuk pertahanan yang ditunjukkan tanaman dari serangan pathogen (Hammond-Kosack dan Jones 1996). 32 bakteri endofit dengan hasil negatif setelah 48 jam pengamatan, tidak menunjukkan gejala seperti bercak kuning (Gambar 4) ataupun mengering seperti 3 isolat dengan hasil positif.
Gambar 4 Hasil uji respon hipersensitif terhadap isolat bakteri endofit pada daun tembakau. Contoh reaksi positif yang ditunjukkan oleh isolat Aa8 setelah masa inkubasi 48 jam
Uji Daya Kecambah dan Daya Tumbuh
Pada pengamatan daya kecambah benih padi, rata-rata daya kecambah benih padi yang diaplikasikan dengan 32 isolat berkisar 95-100%. Selain daya kecambah, parameter yang diamati yaitu daya tumbuh benih padi meliputi panjang akar, panjang pucuk, berat segar dan berat kering. Respon yang beragam ditunjukkan benih padi pada pengamatan panjang akar, panjang pucuk, bobot segar dan bobot kering (Tabel 3). Hal tersebut menunjukkan bahwa bakteri endofit berpengaruh terhadap daya tumbuh benih padi dengan kemampuan dalam memacu pertumbuhan yang berbeda-beda.
Berdasarkan seluruh parameter pengamatan (Tabel 3), tidak semua perlakuan pemberian isolat bakteri endofit menunjukkan reaksi positif atau lebih baik dari kontrol. Beberapa isolat bahkan ada yang bereaksi negatif atau tidak lebih baik dari kontrol. Hasil tersebut menunjukkan bahwa tidak semua bakteri endofit yang diisolasi dari tanaman yang memiliki kemampuan tumbuh cepat memiliki potensi pemacu pertumbuhan tanaman. Kemampuan bakteri endofit berbeda-beda, ada yang berpotensi sebagai pemacu pertumbuhan (Feng et al. 2006) agen biokontrol (Duan et al. 2013), hingga pada pemanfaatan potensi bakteri endofit dalam mendegradasi polutan organik (Afzal et al. 2014).
Isolat Ca1 menunjukkan nilai persentasi peningkatan pertumbuhan benih padi terbaik dari yang lainnya. Reaksi positif tersebut berbanding terbalik dengan hasil yang ditunjukkan isolat Bd5. Respon negatif dengan nilai persentasi perbandingan lebih rendah dibanding kontrol juga bisa diartikan bahwa isolat Bd5 menghambat pertumbuhan benih padi. Pada parameter panjang akar, isolat Aa2 memilik persentasi panjang akar 55,7% di atas kontrol. Sebaliknya pada parameter panjang pucuk perlakuan pemberian isolat Aa2 hanya mampu meningkatkan 0,23% di atas kontrol.
14
Angka positif menunjukkan lebih tinggi dibanding kontrol, 0 sama dengan kontrol ,dan minus (-) lebih rendah dari kontrol.
15
mampu memacu pertumbuhan bibit batang bawah tanaman karet (Hidayati 2014) dan meningkatkan pertumbuhan sambiloto (Gusmaini 2014). Berdasarkan hasil uji daya kecambah dan daya tumbuh benih padi, dipilih 10 isolat terbaik untuk diuji lebih lanjut. Sepuluh isolat tersebut yaitu: Ca1, Aa2, Ba3, Ba2, Ad1, Ca9, Bb4,Bd3, Ba1 dan Ad2. Kesepuluh isolat tersebut merupakan isolat-isolat yang memiliki total skor tertinggi dengan hasil lebih baik dari kontrol.
Karakterisasi Isolat Bakteri Endofit
Kemampuan Menambat N2, Melarutkan Fosfat, Kalium dan Menghambat
Pertumbuhan Mikrob Patogen
Berbagai jenis bakteri endofit penambat N2 dari bermacam-macam tanaman telah diteliti (Wang et al. 2006; Terakado-Tonooka et al. 2008) dan beberapa metode yang umum digunakan seperti menumbuhkan pada media bebas N (Baldani et al. 1992), mengukur aktifitas nitrogenase dengan menghitung produksi gas C2H4 (Mollica et al. 1985; Zayed 2012) dan mendeteksi keberadaan gen nif (Bürgmann et al. 2004; Zhang et al. 2007). Pada penelitian ini, 10 isolat bakteri endofit yang diisolasi dari akar, batang dan daun A. decurrens
menunjukkan hasil positif baik secara kualitatif (menumbuhkan pada media bebas N) maupun kuantitaif (aktifitas nitrogenase) dalam menambat N2 (Tabel 4).
Tabel 4 Kemampuan menambat N2, melarutkan fosfat, melarutkan kalium dan
Simbol: + ( mampu), - (tidak mampu); ARA: acetylene reduction assay, NFB: nitrogen free broth
16
0.141 hingga 1.168 µ mol C2H4/µL/jam. Acetylene reduction assay (ARA) merupakan metode pengujian secara tidak langsung untuk mengetahui aktivitas enzim nitrogenase dalam mereduksi acetilen menjadi gas etilen yang dapat dihitung menggunakan gas chromatography (Doty et al. 2009). Semakin tinggi produksi gas etilen berbanding lurus dengan aktivitas nitrogenase dan semakin tinggi pula aktivitas penambatan N2.
Gambar 5 Kemampuan bakteri endofit dalam menambat N2 secara kualitatif terlihat dengan terbentuknya pelikel putih di bawah permukaan media NFB pada 10 isolat uji
Sepuluh isolat tersebut secara tidak langsung mewakili jaringan akar, batang dan daun tanaman A. decurrens. Hasil dengan kemampuan terbaik ditunjukkan pada isolat Bd3. Isolat tersebut merupakan salah satu isolat yang diisolasi dari daun tanaman A. decurrens. Daun yang mendapatkan paparan langsung dari udara diduga memberi kemungkinan bagi bakteri dari jaringan tersebut menambat N2 dengan optimal.
Pada uji kemampuan melarutkan fosfat, 6 diantara 10 isolat uji mampu melarutkan tricalcium phosphate (Ca3(PO4)2) yang merupakan sumber P dalam media Pikovskaya (Tabel 4). Hasil positif ditunjukkan dengan terbentuknya zona bening di sekitar koloni (Gambar 6). Kemampuan mikroorganisme dalam melarutkan fosfat tergantung dari aktifitas biokimianya terutama dalam memproduksi dan melepaskan asam-asam organik yang kemudian mengkelat kation terikat dan mengkonversi fosfat kedalam bentuk terlarut (Kpomblekou-a dan Tabatabai 1994). Hasil tersebut mengungkapkan bahwa beberapa bakteri endofit yang diisolasi dari jaringan tanaman A. decurrens mampu menambat N2, beberapa juga mampu melarutkan fosfat. Beberapa penelitian sebelumnya mengungkapkan bahwa tidak jarang suatu mikroorganisme mampu mensekresikan beberapa hasil metabolit yang bermanfaat bagi tanaman seperti IAA, fosfat dan siderofor oleh Enterobacter asburiae strain PS2 (Ahemad dan Khan 2010) dan
Pseudomonas fluorescens (Parani dan Saha 2012) dan fosfat dan kalium (Diep dan Hieu 2013).
17
Gambar 6 Uji bakteri endofit dalam melarutkan fosfat setelah 4 hari masa inkubasi, a) reaksi positif terlihat dari zona bening disekitar koloni, b) reaksi negatif
Aktifitas metabolism yang tidak kalah penting lainnya yaitu kemampuan bakteri dalam menghasilkan asam-asam organik. Asam oksalat merupakan salah satu jenis asam organik yang berperan penting dalam melarutkan kalium terikat (Shu-Xin et al. 2007). Berbeda halnya dengan uji penambatan N2 atau pelarutan fosfat, hal sebaliknya ditunjukkan dari hasil uji bakteri endofit dalam melarutkan kalium. Sepuluh isolat uji menunjukkan hasil negatif (Tabel 4). Hal yang berbeda dari peneltian Zhang dan Kong (2014) dan Meena et al. (2015) yang melaporkan bahwa bakteri yang diisolasi dari area risosfer tersebut mampu melarutkan kalium dari bentuk yang tidak tersedia menjadi tersedia bagi tanaman. Hal tersebut diduga karena isolat uji tidak mampu melarutkan kalium yang terikat dengan mineral-mineral feldspar yang diujikan dalam media Alexandrof.
Metode dual culture pada uji antagonisme bakteri endofit dengan mikrob patogen tanaman menunjukkan bahwa isolat bakteri endofit strain Bb4 mampu menghambat pertumbuhan R. solani yang merupakan cendawan penyebab penyakit pada tanaman. Sama halnya dengan isolat Ca9 yang menunjukkan aktifitas antagonisme terhadap pertumbuhan phytopathogenic bacterium X. oryzae
pv. oryzae yang diamati melalui zona hambat antar keduanya (Tabel 4). Salah satu jenis bakteri endofit strain Pseudomonas fluorosence juga dilaporkan mampu berperan sebagai agen biokontrol karena kemampuannya menghambat pertumbuhan Rhizoctonia solani (Grosch et al. 2005).
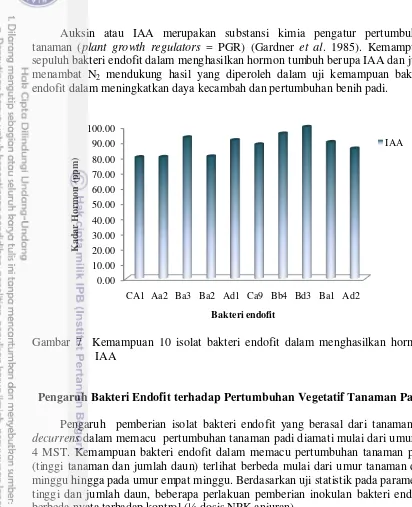
Kemampuan Menghasilkan Indol-3-Acetat Acid (IAA)
Keseluruhan isolat uji terbukti mampu menghasilkan hormon IAA (Gambar 7). Kemampuan sepuluh isolat bakteri endofit dalam menghasilkan hormon IAA berkisar dari 79,89 hingga 99,87 ppm. Sama halnya dengan hasil uji penambatan N2, kemampuan terbaik dalam memproduksi IAA ditunjukkan oleh isolat Bd3. Isolat-isolat tersebut diuji setelah masa inkubasi selama 24 jam pada media cair dimana pada waktu tersebut merupakan fase eksponensial eksponensial bagi seluruh isolat uji. Hal tersebut sedikit berbeda dengan hasil penelitian sebelumnya yang melakukan uji auxin pada fase stationer (Ji et al. 2014).
18
Auksin atau IAA merupakan substansi kimia pengatur pertumbuhan tanaman (plant growth regulators = PGR) (Gardner et al. 1985). Kemampuan sepuluh bakteri endofit dalam menghasilkan hormon tumbuh berupa IAA dan juga menambat N2 mendukung hasil yang diperoleh dalam uji kemampuan bakteri endofit dalam meningkatkan daya kecambah dan pertumbuhan benih padi.
Gambar 7 Kemampuan 10 isolat bakteri endofit dalam menghasilkan hormon IAA
Pengaruh Bakteri Endofit terhadap Pertumbuhan Vegetatif Tanaman Padi Pengaruh pemberian isolat bakteri endofit yang berasal dari tanaman A. decurrens dalam memacu pertumbuhan tanaman padi diamati mulai dari umur 1-4 MST. Kemampuan bakteri endofit dalam memacu pertumbuhan tanaman padi (tinggi tanaman dan jumlah daun) terlihat berbeda mulai dari umur tanaman dua minggu hingga pada umur empat minggu. Berdasarkan uji statistik pada parameter tinggi dan jumlah daun, beberapa perlakuan pemberian inokulan bakteri endofit berbeda nyata terhadap kontrol (½ dosis NPK anjuran).
Perlakuan pemberian bakteri endofit + ½ dosis NPK anjuran berpengaruh terhadap tinggi tanaman padi pada umur 4 MST (Tabel 5). Beberapa isolat menunjukkan hasil yang lebih baik dari NPK 50% dan tidak berbeda nyata dengan NPK 100%. Hasil terbaik terlihat pada isolat Bb4 dengan rata-rata tinggi tanaman, jumlah daun dan jumlah anakan terbaik diantara bakteri endofit lainnya dan setara dengan kontrol (1 dosis anjuran NPK). Perbedaan jumlah daun antara perlakuan terlihat mulai umur 2-4 MST. Beda nyata pada parameter pengamatan jumlah daun maupun jumlah anakan di umur 4 MST terlihat pada Tabel 5. Respon bakteri endofit yang berbeda-beda dipengaruhi salah satunya tingkat kemampuan bakteri endofit tersebut dalam bertahan hidup dan bersaing dengan mikrob lokal.
0.00
CA1 Aa2 Ba3 Ba2 Ad1 Ca9 Bb4 Bd3 Ba1 Ad2
19
Tabel 5 Tinggi tanaman, jumlah daun dan jumlah anakan setelah 4 MST (37 hari) Perlakuana Tinggi tanaman
Semua perlakuan inokulan bakteri dipupuk dengan NPK ½ dosis rekomendasi, b, c, dangka-angka
yang diikuti oleh huruf yang sama pada satu kolom, tidak berbeda nyata pada taraf uji 5% (Duncan’s multiple range test)
Pada parameter pengamatan bobot segar (akar, batang dan daun) umur 4 MST (Tabel 6), beberapa perlakuan menunjukkan hasil yang lebih baik dibanding kontrol (½ dosis NPK anjuran). Hasil terbaik ditunjukkan isolat Bb4 dengan nilai rata-rata bobot segar daun dan batang 4,44 gram yang setara dengan kontrol NPK sesuai dosis anjuran. Kemampuan tanaman dalam menyerap unsur hara dari tanah tidak lepas dari fungsi dan kinerja akar tanaman tersebut. Pada pengamatan bobot segar akar, perlakuan dengan inokulan bakteri endofit berpengaruh terhadap peningkatan bobot segar akar. Terdapat beberapa perlakuan dengan hasil setara dengan kontrol pemberian pupuk NPK sesuai dosis anjuran ditinjau dari hasil uji lanjut DMRT yang tidak berbeda nyata pada taraf nyata 5%.
20
Tabel 6 Bobot segar dan kering akar, batang dan daun setelah 4 MST (37 hari) Perlakuana Bobot segar daun
Semua perlakuan inokulan bakteri dipupuk dengan NPK ½ dosis rekomendasi, b, c, d, eangka-angka
yang diikuti oleh huruf yang sama pada satu kolom, tidak berbeda nyata pada taraf uji 5% (Duncan’s multiple range test)
Dalam hal pemanfaatan bakteri sebagai agen pemacu tumbuh tanaman, telah banyak dilaporkan temuan-temuan mengenai peningkatan pertumbuhan tanaman dengan aplikasi bakteri pemacu pertumbuhan tanaman. Sebagai contoh, kombinasi antara bakteri Azotobacter chroococcum dengan separuh dosis pupuk mampu meningkatkan pertumbuhan vegetatif Sesamum indicum dan setara dengan perlakuan dengan satu kali dosis anjuran (Maheswari et al. 2012). Pengaruh pemberian inukulan juga dilaporkan Sharma et al. (2012) dimana peningkatan yang signifikan pada pertumbuhan vegetatif apel ditunjukkan dengan pemberian simbiosis antara Glomus dan Azotobacter. Sama halnya dengan isolat Ca9, Bb4 dan Bd3 yang berdasarkan uji lanjut Duncan’s multiple range test tidak berbeda nyata di setiap parameter pengamatan dengan perlakuan NPK 100%. Isolat- isolat tersebut berpotensi mengurangi separuh penggunaan pupuk N, P dan K pada pertumbuhan vegetatif tanaman padi. Faktor pendukung ketiga bakteri endofit tersebut mampu meningkatkan pertumbuhan tanaman selain karena penambahan separuh dosis rekomendasi, juga karena kemampuan isolat-isolat tersebut dalam menambat N2 dan menghasilkan zat pemacu tumbuh tanaman berupa IAA. Beberapa faktor yang membedakan isolat Bb4, Bd3 dan Ca9 dalam hal peningkatan pertumbuhan dengan isolat-isolat lainnya yaitu potensi isolat Bb4 dan Ca9 dalam menghambat pertumbuhan mikrob potogen dan isolat Bd3 mampu menambat N2 dan memproduksi IAA lebih baik dari isolat-isolat lainnya.
Peranan bakteri endofit yang diisolasi dari jaringan tanaman A. decurrens
21
pertumbuhan salah satu bakteri penyebab penyakit hawar daun pada padi (X. oryzae) dan cendawan pathogen (R. solani).
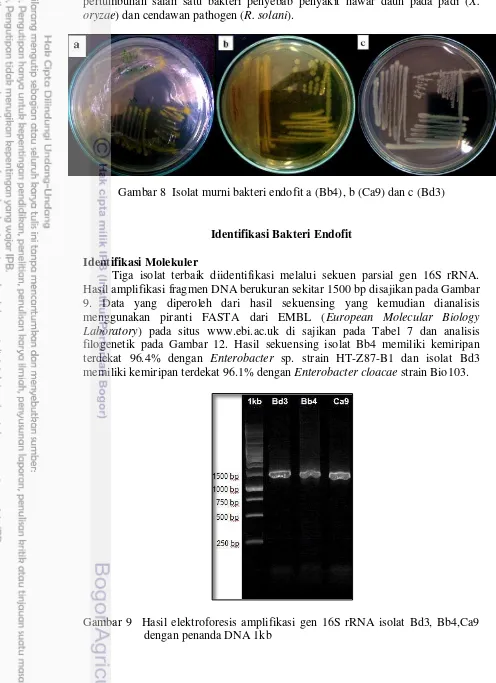
Gambar 8 Isolat murni bakteri endofit a (Bb4), b (Ca9) dan c (Bd3)
Identifikasi Bakteri Endofit Identifikasi Molekuler
Tiga isolat terbaik diidentifikasi melalui sekuen parsial gen 16S rRNA. Hasil amplifikasi fragmen DNA berukuran sekitar 1500 bp disajikan pada Gambar 9. Data yang diperoleh dari hasil sekuensing yang kemudian dianalisis menggunakan piranti FASTA dari EMBL (European Molecular Biology Laboratory) pada situs www.ebi.ac.uk di sajikan pada Tabel 7 dan analisis filogenetik pada Gambar 12. Hasil sekuensing isolat Bb4 memiliki kemiripan terdekat 96.4% dengan Enterobacter sp. strain HT-Z87-B1 dan isolat Bd3 memiliki kemiripan terdekat 96.1% dengan Enterobacter cloacae strain Bio103.
22
Berdasarkan sumbernya, kedua isolat tersebut merupakan hasil isolasi dari jaringan pada batang tanaman A. decurrens yang terletak dikawasan taman nasional gunung merapi daerah cangkringan. Isolat Bb4 dan Bd3 telah teregistrasi dan telah memperoleh nomor aksesi dari EMBL sequence of database yaitu LN907847 dan LN907848. Selain pada tanaman A. decurrens, keberadaan
Enterobacter sebagai bakteri endofit juga dilaporkan ditemukan pada tanaman kehutanan lainnya seperti Eucalyptus (Torres et al. 2008), Poppulus (Taghavi et al. 2009) dan Ulms (Mocali et al. 2003).
Tabel 7 Penelusuran sekuen 16S rRNA isolat bakteri endofit dengan spesies padanan pada EMBL sequence of database
Kode
isolat Nomor aksesi Spesies padanan Strain Homology Bb4 LN907847 Enterobacter sp. HT-Z87-B1 96.4% Ca9 LN907849 Pseudomonas sp. THG-T1 96.2% Bd3 LN907848 Enterobacter cloacae Bio103 96.1%
Hasil penelusuran sekuen 16S ribosomal RNA, isolat Ca9 memiliki kemiripan terdekat 96.2% dengan Pseudomodas sp. strain THG-T1. Sama halnya dengan kedua isolat sebelumnya, isolat Ca9 juga telah teregistrasi dengan nomor aksesi LN907849. Isolat Ca9 merupakan salah satu isolat yang diisolasi dari jaringan pada akar tanaman A. decurrens yang tumbuh pada kawsan taman nasional gunug Merbabu. Kehadiran Pseudomonas sp. sebagai bakteri endofit yang diisolasi dari akar tanaman kehutanan lainnya seperti Populus, juga telah dilaporkan sebelumnya oleh Moore et al. (2006). Pseudomonas sp. sebagai bakteri endofit juga memberi manfaatan bagi tanaman inangnya diantaranya sebagai pemacu tumbuh juga sebagai agen biokontrol (Mercado-Blanko dan Bakker 2007). Genus ini juga terbukti positif menambat N2 melalui pertumbuhan pada media bebas N dan juga positif pada uji Acetylene reduction assay
(Muthukumarsamy et al. 2007).
Hasil analisis phyogenetic tree isolat Bb4, Bd3 dan Ca9 menggambarkan hubungan kekerabatan terdekat antara bakteri endofit dengan spesies padanan yang berdasarkan pada sekuen gen partial 16S rRNA. Posisi dari masing-masing isolat bakteri endofit berdasarkan pada kekerabatan terdekat dari masing-masing genus ataupun spesies (Gambar 10). Pohon filogeni dibangun dengan menggunakan metode Maximum-likelihood dengan boostrap 1000 kali replikasi (Tamura et al. 2013).
Berdasarkan sekuen parsial 16S rRNA, ketiga isolat uji memiliki tingkat homologi dengan spesies padanan dibawah 97%. Hal tersebut memungkinkan bagi ketiga isolat uji tersebut sebagai genus baru dari -class Proteobacteria
23
Gambar 10 Hasil analisis filogeni 3 isolat bakteri endofit Karakterisasi Morfologi dan Biokimia
Tingkat kemiripan karakter morfologi dan biokimia 3 isolat bakteri endofit tersaji pada Tabel 8. Pewarnaan Gram merupakan salah satu uji pendahuluan dan tahapan penting dalam mengklasifikasikan sifat Gram suatu mikrob (Chandra dan Mani 2011). 3 isolat bakteri endofit merupakan bakteri dengan Gram negatif begitupun dengan masing-masing spesies padanan. Berdasarkan uji KOH, ketiga isolat uji menunjukkan reaksi positif. Hasil uji KOH dengan hasil pewarnaan Gram berbanding terbalik. Hasil dari uji potasium hidroksida dapat mencirikan sifat Gram suatu bakteri dan sebagai pembanding dengan pewarnaan Gram pada umumnya (Chandra dan Mani 2011).
24
Tabel 8 Karakter fisiologi biokimia 3 bakteri endofit dengan bakteri pembanding
Karakterisasi
Bentuk Irregular Bulat Irregular
Elevasi Raised Convex Raised Convex Flat
Gram stain Negatif Negatif Negatif Negatif Negatif Negatif
Bentuk sel Bacil Bacil Coccus Bacil Bacil Bacil
Keterangan : +g ada gelembung gas, +/- beberapa spesies bereaksi positif atau negatif
Secara berurutan, karakteristik morfologi dan biokimia siolat Bb4, Ca9 dan Bd3 memiliki kemiripan 92%, 81% dan 82% dengan spesies pembanding
25
PEMBAHASAN UMUM
Eksplorasi bakteri endofit pada tanaman A. decurrens di tiga titik lokasi pengambilan sampel yang terletak di kawasan taman nasional gunung Merapi (Selo dan Cangkringan) dan gunung Merbabu merupakan yang pertama kali dilaporkan khususnya di Indonesia. Dari hasil isolasi bakteri endofit melalui tahapan sterilisasi permukaan, diperoleh 48 isolat dari jaringan pada akar, batang dan daun A. decurrens.
Reaksi hemolisis yang ditunjukkan 13 isolat pada uji patogenitas mengindikasikan bahwa isolat-isolat tersebut berpotensi menyebabkan penyakit pada hewan dan manusia. sama halnya dengan uji hipersensitif, 3 dari isolat-isolat yang telah lolos uji sebelumnya menunjukkan potensi menyebabkan penyakit pada tanaman yang didasarkan pada respon hipersensitif berupa reaksi nekrosis yang merupakan respon atau bentuk pertahanan diri dari tanaman tembakau. Tahapan seleksi selanjutnya yang berupa pengaruh bakteri endofit terhadap perkecambahan dan pertumbuhan benih padi secara relatif menunjukkan peningkatan pertumbuhan dibandingkan dengan kontrol yang tanpa pemberian inokulan.
Dalam bidang pertanian, ketersediaan unsur hara N umumnya merupakan faktor pembatas dalam produksi tanaman budidaya. Ironisnya, sekitar 80% penyusun atmosfer berupa nitrogen dalam bentuk dinitrogen (N2) yang tidak tersedia bagi tanaman. Suplai nitrogen untuk tanaman umumnya melalui penambahan pupuk kimia ataupun dengan penambatan N secara biologis. Beberapa jenis mikroorganisme mampu melakukan penambatan N2 dan mengubahnya kedalam bentuk tersedia bagi tanaman. Berbagai jenis bakteri endofit penambat N2 juga telah banyak diteliti (Doty 2011). Pada penelitian ini, sepuluh isolat terpilih dari hasil seleksi terbukti mampu menambat N2 terlihat dari pelikel putih yang terbentuk pada media bebas N pada uji kualitatif. Selain itu, kesepuluh isolat tersebut juga menunjukkan reaksi positif pada uji aktifitas nitrogenase melalui gas etilen dengan hasil terbaik ditunjukkan oleh isolat Bd3. Sama halnya dengan uji kemampuan bakteri endofit dalam menambat N2, keseluruhan isolat terpilih juga mampu memproduksi IAA dengan hasil terbaik ditunjukkan oleh isolat Bd3.
26
dimanfaatkan oleh tanaman. Kemampuan bakteri endofit dalam menghambat pertumbuhan mikrob patogen merupakan peranan yang secara tidak langsung mendukung pertumbuhan tanaman. Seperti halnya dengan kemampuan isolat Ca9 dalam menghambat pertumbuhan bakteri patogen X. oryzae pv. oryzae dan isolat Bb4 dalam menghambat pertumbuhan cendawan patogen berupa R. solani. Kemampuan-kemampuan yang ditunjukkan kesepuluh isolat bakteri endofit tersebut mendukung pemilihan isolat-isolat tersebut pada uji daya kecambah dan pertumbuhan benih padi.
Hasil karakterisasi bakteri endofit yang berasal dari tanaman A. decurrens
mengungkapkan bahwa keberadaan tanaman tersebut di Indonesia sebagai tanaman dengan kemampuan tumbuh cepat dan daya adaptasi tinggi berkaitan erat dengan peranan bakteri pemacu tumbuh tanaman. Bakteri pemacu tumbuh tanaman (PGPB) (Bashan dan Holguin 1998), telah banyak dimanfaatkan melalui aplikasi terhadap tanaman-tanaman agrikultur dengan tujuan meningkatkan pertumbuhan tanaman (Gururani et al. 2013). Sama halnya dengan isolat Bb4, Bd3 dan Ca9 yang merupakan isolat-isolat terbaik dalam meningkatkan pertumbuhan vegetatif tanaman padi dengan penambahan separuh dosis rekomendasi pupuk N, P dan K. Perlakuan Bb4, Bd3 dan Ca9 yang berdasarakan hasil uji DMRT tidak berbeda nyata dibandingkan perlakuan dengan dosis penuh pupuk N, P dan K. Dari hasil percobaan ini, ketiga isolat tersebut merupakan isolat-isolat unggul yang mampu menutupi penggunaan 50% pupuk sintetik. Isolat Bb4 merupakan penambat N2 dan penghasil zat pemacu tumbuh (ZPT) IAA sekaligus juga mampu menghambat pertumbuhan cendawan penyebab penyakit pada tanaman berupa R. solani, demikian juga isolat Ca9 selain mampu menambat N2 dan memproduksi ZPT, isolat tersebut memiliki keunggulan dalam menghambat pertumbuhan bakteri penyebab penyakit hawar daun pada padi. Isolat Bd3 merupakan bakteri endofit dengan kemampuan terbaik dalam menambat N2 dan menghasilkan IAA.
27
SIMPULAN DAN SARAN
Simpulan
Dari hasil penelitian disimpulkan bahwa sebanyak 48 isolat bakteri endofit berhasil diisolasi dari jaringan pada akar, batang dan daun A. decurrens yang tumbuh di kawasan taman nasional gunung Merapi dan Merbabu. Setelah dilakukan seleksi melalui uji patogenitas dan uji daya kecambah dan pertumbuhan benih padi, diperoleh 10 isolat terpilih. Isolat-isolat tersebut dilanjutkan pada tahap karakterisasi melalui uji penambatan N2, memproduksi IAA, melarutkan fosfat, melarutkan kalium, dan menghambat pertumbuhan mikrob patogen. Berdasarkan karakterisasi tersebut, diperoleh hasil bahwa kesepuluh isolat uji mampu menambat N2 dan memproduksi IAA, enam isolat mampu melarutkan fosfat, satu isolat dengan kemampuan menghambat pertumbuhan bakteri patogen (X. oryzae pv. oryzae) dan satu lagi dengan cendawan patogen (R. solani). Kesepuluh isolat terpilih diuji dalam meningkatkan pertumbuhan vegetatif tanaman padi. Dari hasil uji tersebut, perlakuan Bb4, Bd3 dan Ca9 ditambah dengan separuh dosis rekomendasi pupuk NPK mampu mengimbangi kontrol dengan dosis rekomendasi. Isolat Bb4, Bd3 dan Ca9 diidentifikasi berdasarkan gen parsial 16S rRNA. Setelah disekuensing, isolat Bb4 terbukti memiliki kemiripan 96,4% dengan spesies padanan Enterobacter sp. strain HT-Z87-B1, isolat Bd3 memiliki kemiripan 96,1% dengan Enterobacter cloacae strain THG-T1 dan isolat Ca9 memiliki kemiripan terdekat 96.2% dengan Pseudomonas sp. strain Bio 103. Dari hasil identifikasi molekuler dan karakterisasi morfologi dan biokimia, ketiga isolat tersebut kemungkinan besar merupakan genus baru dari kelas -Proteobacteria.
Saran
28
DAFTAR PUSTAKA
Afzal M. Khan QM. Sessitsch A. 2014. Endophytic bacteria: prospects and applications for the phytoremediation of organic pollutants.
Chemosphere.117:232-242.
Ahemad M, Khan MS. 2010. Plant growth promoting activities of phosphatesolubilizing Enterobacter asburiae as influenced by fungicides.
EurAsia J BioSci. 4:88-95. doi:10.5053/ejobios.2010.4.0.11
Atashpaz S, Khani S, Barzegari A, Barar J, Vahed SZ, Azarbaijani R, Omidi Y. 2010. Arobust universal method for extraction of genomic DNA from bacterial species. Microbiology. 79(4):538-542.
Baldani VLD, Baldani JI, Olivares F, Do¨bereiner J. 1992. Identification and ecology of Herbaspirillum seropedicae and the closely related
Pseudomonas rubrisubalbicans. Symbiosis. 13:65-73.
Bashan Y, Holguin, G. 1998. Proposal for the division of plant growth-promoting rhizobacteria into two classifications: biocontrol-PGPB (plant growth-promoting bacteria) and PGPB. Soil Biology and Biochemistry. 30(8):1225-1228.
Brooks DS, Gonzalez CF, Appel DN, Filer TH. 1994. Evaluation of endophytic bacteria as potential biological-control agents for Oak Wilt. Biol. Control. 4(4):373-381.
Bürgmann, H, Widmer F, Von Sigler W, Zeyer J. 2004. New molecular screening tools for analysis of free-living diazotrophs in soil. Appl. Environ. Microbiol. 70:240-247.
Burley J, Youngquist J, Evans J. 2004. Encyclopedia of forest sciences. Elsevier. Chandra TJ, Mani PS. 2011. A study of 2 rapid tests to differentiate Gram positive
and Gram negative aerobic bacteria. J Med Allied Sci. 1(2):84-85.
Diep CN, Hieu TN. 2013. Phosphate and potassium solubilizing bacteria from weathered materials of denatured rock mountain, Ha Tien, Kiên Giang province, Vietnam.J Life Sci. 1(3):88-92.
Doty SL. 2011. Nitrogen-fixing endophytic bacteria for improved plant growth. Maheswari DK, editor. In Bacteria in Agrobiology: Plant Growth Responses. Springer Berlin Heidelberg: pp. 183-199.
Doty SL, Oakley B, Xin G, Kang JW, Singleton G, Khan Z, Vajzovic A, Staley JT. 2009. Diazotrophic endophytes of native black cottonwood and willow.
Symbiosis. 47:23–33
Drancourt M, Bollet C, Carlioz A, Martelin R, Gayral JP, Raolti D. 2000. 16 Ribosomal DNA sequence analysis of a large collection of environmental and clinic unidentifiable bacterial isolates. J Clin Microbiol. 38(10):3623-3630
Duan JL, Li XJ, Gao JM, Wang DS, Yan Y, Xue QH. 2013. Isolation and identification of endophytic bacteria from root tissues of Salvia miltiorrhiza Bge. and determination of their bioactivities. Annals Microbiol. 63(4): 1501-1512.
29
Feng Y, Shen D, Song W. 2006. Rice endophyte Pantoeaagglomerans YS19 promotes host plant growth and affects allocations of host photosynthates. J Appl Microbiol. 100(5):938-945.
Frankenberger WT, Poth M. 1987. Biosynthesis of indole-3-acetic acid by the pine ectomycorrhizal fungus Pisolithustinctorius. Appl. Environ. Microbiol. 53(12):2908-2913.
Furutani A. 2009. Molecular biological studies of the pathogenicity of Xanthomonas oryzae pv. Oryzae. J Gen Plant Pathol. 75(6):458–459. doi: 10.1007/s10327-009-0194-9
Gardner FP, Pearce RB, Mitchell L. 1985. Physiology of crop plant. Ames (US). The lowa State University.
Gao Y, Liu Q, Zang P, Li X, Ji Q, He Z, Zhao Y, Yang H, Zhao X, Zhang L. (2015). An endophytic bacterium isolated from Panax ginseng C.A. Meyer enhances growth, reduces morbidity, and stimulates ginsenoside biosynthesis. Phytochem. Lett. 11:132-138.
Glushenkova AI. 2012. Leguminosae. In Azimova SS, Glushenkova AI (eds). Lipids, Lipophilic Components and Essential Oils from Plant Sources. London (GB): Springer. p552.
Gothwal RK, Nigam VK, Mohan M K, Sasmal D, Ghosh P. 2007. Screening of nitrogen fixers from rhizospheric bacterial isolates associated with important desert plants. Appl. Ecol. Environ. Res. 6(2):101-109.
Grimont F, Grimont PA. 2006. The genus Enterobacter. In The prokaryotes. New York (US): Springer. p 197-214.
Grosch R, Faltin F, Lottmann, J, Kofoet A, Berg G. 2005. Effectiveness of 3 antagonistic bacterial isolates to control Rhizoctonia solani Kühn on lettuce and potato. Canadian Journal of Microbiology. 51(4):345-353.
Gururani MA, Upadhyaya CP, Baskar V, Venkatesh J, Nookaraju A, Park SW. 2013. Plant growth-promoting rhizobacteria enhance abiotic stress tolerance in Solanum tuberosum through inducing changes in the expression of ROS-scavenging enzymes and improved photosynthetic performance. Journal of plant growth regulation, 32(2):245-258.
Gusmaini. 2014. Pemanfataan Bakteri Endofit untuk Meningkatkan Produksi dan Kadar Andrografolid pada Tanaman Sambiloto (Andrographis paniculata). [disertasi]. Bogor (ID). Institut Pertanian Bogor
Hallmann J, Berg G, Schulz B. 2006. Isolation procedures for endophytic microorganisms. Soil Biol. 9:299-319.
Hammond-Kosack KE, Jones JDG. 1996. Resistance gene-dependent plant defense responses. Plant Cell. 8:1773-1791.
Hidayati U. 2014. Potensi bakteri endofit asal tanaman karet sebagai pemacu pertumbuhan bibit batang bawah tanaman karet (hevea brasiliensis Müll. Arg) [disertasi]. Bogor (ID): Institut Pertanian Bogor
Holt JG, Krieg NR, Sneath PHA, Staley JT, Williams ST. 1994. Bergey’s Manual of Determinative Bacteriology Ninth Edition. USA (US): Lippincott Williams& Wilkins.
30
Izumi H. (2011). Diversity of endophytic bacteria in forest trees. In Pirttil¨a AM, Frank AC, editor. Endophytes of Forest Trees: Biology and Applications. Springer Netherlands. p 95-105.
Ji SH, Gururani MA, Chun SC. 2014. Isolation and characterization of plant growth promoting endophytic diazotrophic bacteria from Korean rice cultivars. Microbiol Res. 169(1):83-98.
Kim WG, Weon HY, LeeSY. 2008. In vitro antagonistic effects of Bacilli isolates against four soilborne plant pathogenic fungi. Plant Pathology J. 24(1):52-57.
Kpomblekou-A K, Tabatabai MA. 1994. Effect of organic acids on release of phosphorus from phosphate rocks. Soil Science. 158(6):442–453.
Mac Faddin JF. 1979. Biochemical test for identification of medical bacteria. Baltimore (US). The Wiliiam and Wilkins Company.
Maheshwari DK, Dubey RC, Aeron A, Kumar B, Kumar S, Tewari S, Arora NK. 2012. Integrated approach for disease management and growth enhancement of Sesamum indicum L. utilizing Azotobacter chroococcum TRA2 and chemical fertilizer. World J. Microbiol. Biotechnol. 28(10):3015-3024. Meena VS, Maurya BR, Verma JP, Aeron A, Kumar A, Kim K, Bajpai VK. 2015.
Potassium solubilizing rhizobacteria (KSR): Isolation, identification, and K-release dynamics from waste mica. Ecol. Engineering. 81:340–347.
Mercado-Blanco J, Bakker PA. 2007. Interactions between plants and beneficial Pseudomonas spp.: exploiting bacterial traits for crop protection. Antonie van Leeuwenhoek, 92(4), 367-389.
Mocali S, Bertelli E, Di Cello F, Mengoni A, Sfalanga A, Viliani F, Fani R. 2003. Fluctuation of bacteria isolated from elm tissues during different seasons and from different plant organs. Res in Microbiol. 154(2):105-114.
Mollica ML, Van Elsas JD, Penido EG. 1985. An improved method to detect acetylene-reducing activity in Bacillus strains. J. Microbiol. Methods. 3(3):147-157.
Moore FP, Barac T, Borremans B, Oeyen L, Vangronsveld J, Van der Lelie D, Moore ER. 2006. Endophytic bacterial diversity in poplar trees growing on a BTEX-contaminated site: the characterisation of isolates with potential to enhance phytoremediation. Sys Appl Microbiol. 29(7):539-556.
Muthukumarasamy R, Kang UG, Park KD, Jeon WT, Park CY, Cho YS, Kwon SW, Song J, Roh DH, Revathi G. 2007. Enumeration, isolation and identification of diazotrophs from Korean wetland rice varieties grown with long‐term application of N and compost and their short‐term inoculation effect on rice plants. J Appl Microbiol. 102(4):981-991.
Neeraja CN, Vijayabhanu N, Shenoy VV, Reddy CS, Sarma NP. 2002. RAPD analysis of Indian isolates of rice sheath blight fungus Rhizoctonia solani. J Palant Biochemi & Biotechnol. 11:43-48.
Nuswantara S, Fujie M, Sukiman HI, Yamashita M, Yamada T, Murooka Y. 1997. Phylogeny of bacterial symbionts of the leguminous tree Acacia mangium. J Fermentation and Bioengineering. 84(6):511-518.
Parani K, Saha BK. 2012. Prospects of using phosphate solubilizing Pseudomonas