dari tahun ke tahun. Namun, dewasa ini banyak terserang penyakit Vibriosis yang disebabkan oleh bakteri berpendar Bakteri probiotik dapat dijadikan sebagai kontrol untuk menghambat pertumbuhan bakteri patogen di tambak. Isolat sp. LTS 40 merupakan kandidat bakteri probiotik karena mampu menghasilkan bakteriosin untuk menghambat pertumbuhan bakteri patogen. Produksi bakteri probiotik secara massal memerlukan biaya yang cukup besar. Untuk itu, perlu dicari media produksi yang murah. Media produksi yang digunakan sebagai sumber karbon ialah molase dan sebagai sumber nitrogen yaitu pupuk NPK, TSP, ZA, dan Urea. Tujuan dari penelitian ini untuk mendapatkan media produksi yang terbaik bagi petumbuhan sp. LTS 40 asal tambak udang. Dari uji aktivitas penghambatan menunjukkan sp. LTS 40 mampu menghambat dengan indeks penghambatan sebesar 1, 08. Uji kompetisi dalam kultur cair juga menunjukkan bahwa terjadi penghambatan hingga mencapai 100% pada rasio 1:10 pada inkubasi ke524 jam, ke548 jam, dan ke572 jam. Isolat sp. LTS 40 mempunyai pertumbuhan terbaik pada kombinasi media molase dengan NPK pada konsentrasi 0,2%. Fermentor modifikasi volume kerja 10 liter menunjukkan bakteriosin diproduksi pada saat fase eksponensial dan produksi optimum pada jam ke536 dengan zona hambat sebesar 15, 25 mm. Hal ini menunjukkan bahwa sp. LTS 40 dapat dijadikan bakteri probiotik untuk menanggulangi permasalahan kematian massal udang pada tingkat larva akibat serangan
Kata kunci: sp., bakteriosin
PUJI PURWANTI. Optimizing media for Bacteriosin Production by sp. Strain LTS 40 Isolated from Shrimp Pond. Under supervision of IMAN RUSMANA and NISA RACHMANIA MUBARIK.
Export demand on shrimp as fishery commodity has increased. However, nowadays Vibriosis diseases caused by fluorescent bacterium have decreased shrimp production. Probiotic bacteria can be used as biocontrol to inhibit the growth of in ponds. sp. LTS 40 as a probiotic candidate was able to produce bacteriosin inhibiting the growth of . Production of bacterial probiotics should be low cost using a cheap media. Media production of bacterial probiotics commonly use molase as carbon sources and fertilizers such as NPK, ZA, and urea as a source of nitrogen. The aim of this research was to get the best media composition for growth of sp. LTS 40 in producing bacteriosin. Antimicrobial activity test showed that sp. LTS 40 could inhibit the growth of with inhibition index of 1,08. Competition assay in liquid culture also showed that sp. LTS 40 could inhibit up to 100% at 24 hours, 48 hours, and 72 hours of incubation. sp. LTS 40 had a good growth on media composition of 0,2% molase and NPK. In 10 liter fermentor, bacteriosin was produced during exponential phase and optimum production was at 36 hours of incubation with inhibition zone of 15.25 mm. This result showed that sp. LTS 40 can be used as probiotics to reduce mortality of shrimp larvae caused by in shrimp cultures.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
NIM
: G34052487
Menyetujui:
Pembimbing I,
Pembimbing II,
(Dr. Ir. Iman Rusmana, M.Si)
(
Dr. Nisa Rachmania Mubarik, M.Si
)
NIP 196507201991031002
NIP 196711271993022001
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Drh. Hasim, DEA
NIP 196103281986011002
Alhamdulillahirobbil’alamin, puji syukur penulis panjatkan ke hadirat Allah SWT yang telah memberi rahmat dan kemudahan dalam menyelesaikan karya ilmiah ini. Tema penelitian penulis yaitu tentang media produksi bakteriosin dari genus , dengan judul Optimasi Media Produksi Bakteriosin dari sp. Galur LTS 40 Asal Tambak Udang. Penelitian ini dilaksanakan mulai bulan Februari sampai Mei 2009 di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Bapak Dr. Ir. Iman Rusmana, M.Si dan Ibu Dr. Nisa Rachmania Mubarik selaku pembimbing atas saran dan bimbingannya dalam pelaksanaan penelitian dan penyusunan karya ilmiah ini. Ucapan terima kasih disampaikan pula kepada Dr. M. Jusuf atas saran dan masukan yang diberikan pada ujian karya ilmiah. Terima kasih juga kepada Kartika Findy, Bonardo Tigor S, Nurlia V, Dina Dwi A, Ade Satria, Ibu Maya dan Pak Umar atas bantuan yang telah diberikan selama penelitian. Teman5teman seperjuangan di laboratorium dan keluarga besar Laboratorium Mikrobiologi atas semangat dan kebersamaannya. Penulis juga menyampaikan terima kasih kepada sahabat5sahabatku tercinta Ety N, Putri Utami S, Uzainah A, Monika N, Yohana, Sang Ayu, Ayu S dan Biologi 42 atas segala dukungan dan bantuan yang telah diberikan. Ucapan terima kasih setinggi5tinginya penulis sampaikan kepada kedua orang tua, kakak, adik, dan keluarga besar terutama Lek Sam atas do`a, dukungan, dan segala cintanya. Ucapan terima kasih disampaikan pula kepada M. Muslim yang senantiasa memberikan semangat, do’a, dan cintanya.
Semoga karya ilmiah ini dapat bermanfaat.
Penerimaan Mahasiswa Baru (SPMB) pada Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
1
! "
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vi
PENDAHULUAN 1
Latar Belakang ... 1
Tujuan ... 1
Waktu dan Tempat ... 1
BAHAN DAN METODE 1
Bahan ... 1
Penyiapan Media ... 2
Peremajaan Isolat ... 2
Aktivitas Penghambatan Isolat sp. LTS 40 ... 2
Pertumbuhan sp. LTS 40 pada Media Kombinasi ... 2
Uji Kompetisi terhadap Bakteri Indikator ... 2
Waktu Optimum Produksi Bakteriosin Isolat sp. LTS 40 Kultur 10 Liter ... 2
HASIL 3
Aktivitas Penghambatan Isolat sp. LTS 40 ... 3
Pertumbuhan sp. LTS 40 pada Media Kombinasi ... 3
Uji Kompetisi terhadap Bakteri Indikator ... 3
Waktu Optimum Produksi Bakteriosin Isolat sp. LTS 40 Kultur 10 Liter ... 4
PEMBAHASAN ... 4
SIMPULAN ... 7
SARAN ... 7
DAFTAR PUSTAKA ... 8
LAMPIRAN ... 10
! "
1 Aktivitas penghambatan sp. LTS 40 terhadap bakteri indikator
, dan dengan
metode ... 3 2 Pertumbuhan bakteri sp. LTS 40 dalam berbagai konsentrasi dan
kombinasi media... 3 3 Aktivitas penghambatan bakteriosin sp. LTS 40 terhadap
... 4
! "
1 Fermentor modifikasi... 3 2 Persentase penghambatan sp. LTS 40 terhadap bakteri
pada inkubasi jam ke524, 48, dan 72 ... 4 3 Aktivitas bakteriosin supernatan bebas sel sp. LTS 40 terhadap
... 4
! "
# $ % & "'
Permintaan dan kebutuhan udang sebagai komoditi ekspor perikanan semakin meningkat dari tahun ke tahun karena udang dapat dimanfaatkan sebagai bahan makanan yang memiliki nilai gizi tinggi. Udang juga merupakan salah satu konsumsi kegemaran masyarakat hampir di seluruh dunia. Oleh karena itu, peluang dalam mengembangkan perikanan budi daya udang guna memenuhi permintaan dunia sangat besar. Namun, dewasa ini banyak tambak udang terserang penyakit vibriosis yang disebabkan oleh
bakteri berpendar (Moriatty
1999) Bakteri ini merupakan penyebab utama serangan bakteri penyakit pada udang yang dapat terjadi mulai pada tingkat larva (Silaban 2007). Ruangpan (1998) menyatakan bahwa salah satu penyebab kematian massal pada udang budi daya yaitu penyakit vibriosis yang sebagian besar disebabkan oleh bakteri
sp.
Selain kuantitas produksi, tantangan lain yang harus dihadapi dalam pasar dunia bagi komoditi ekspor perikanan budi daya udang ialah kualitas atau mutu udang yang siap diekspor (Isramilda 2007). Residu antibiotik, bakteri patogen, biotoksin atau residu pestisida juga harus mendapatkan perhatian serius guna menjaga mutu dan keamanan produk.
Peraturan pemerintah melarang menggunakan antibiotik untuk budi daya udang tertuang dalam UU No. 31 tahun 2004 tentang perikanan yang menyatakan bahwa melarang para pengusaha perbenihan udang di Indonesia menggunakan antibiotik nitrofurans dalam proses perbenihan udang. Menurut Verschuere . (2000) penggunaan antibiotik untuk mencegah dan mengobati penyakit dapat menimbulkan masalah baru yaitu, terakumulasinya antibiotik pada lingkungan dan spesies yang dibudidayakan serta timbulnya resistensi mikrob patogen.
Alternatif pengendalian penyakit udang yang disebabkan bakteri patogen di tambak udang ialah dengan memanfaatkan bakteri probiotik. Probiotik ialah makhluk hidup yang memberikan pengaruh menguntungkan pada inang dengan memodifikasi komunitas mikrob atau berasosiasi dengan inang, memperbaiki nilai nutrisi, memperbaiki respon inang terhadap penyakit, atau memperbaiki
lingkungan kualitas ambangnya (Verschuere . 2000).
Bakteri probiotik menghasilkan senyawa metabolit yang mempunyai efek bakterisida dan bakteriostatik untuk menghambat pertumbuhan bakteri patogen atau bakteri yang dapat menurunkan kualitas udang selama dibudidayakan.
Bakteri probiotik dapat dijadikan sebagai kontrol untuk menghambat pertumbuhan bakteri patogen di tambak. Isolat sp. LTS 40 merupakan kandidat bakteri probiotik karena mampu menghasilkan bakteriosin untuk menghambat pertumbuhan bakteri patogen. Bakteriosin merupakan senyawa antimikrob yang terdiri atas protein atau polipeptida yang disintesis oleh ribosom dan umumnya menghambat spesies bakteri yang berkerabat dekat dengan bakteri penghasil bakteriosin (Jack . 1995).
Produksi bakteri probiotik secara massal memerlukan biaya yang cukup besar. Sebelumnya telah digunakan kombinasi
molase dengan dan , namun
kenaikan harga dan yang
terus meningkat mengakibatkan biaya produksi yang meningkat pula. Untuk itu, perlu dicari media produksi yang lebih murah. Media produksi yang umum digunakan sebagai sumber karbon ialah molase dan sebagai sumber nitrogen yaitu pupuk NPK, ZA, TSP, dan urea.
()( "
Penelitian ini bertujuan mendapatkan media produksi bakteriosin yang terbaik bagi petumbuhan sp. LTS 40 asal tambak udang.
&#( * " %! #
Penelitian dilakukan pada bulan Februari hingga Mei 2009 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
+ "
Bahan yang digunakan diantaranya Media (SWC) (Lampiran 1), isolat sp. galur LTS 40, bakteri indikator
%#,*%
%"-. " %*. . Media yang
digunakan ialah media yang berisi molase (Lampiran 2) yang dikombinasikan dengan pupuk NPK, ZA, TSP dan urea (Lampiran 3) (w/v) 1:1 dengan konsentrasi 0.2%, 0.1%, 0.05%, dan 0.02%.
%$%! ) " , # Peremajaan isolat dilakukan dengan menumbuhkan isolat bakteri sp. LTS 40 pada media agar5 aktivitas penghambatannya terhadap bakteri
indikator , dan
dengan menggunakan metode
(Lisboa 2006). Sebanyak 500 Hl bakteri indikator disuspensikan ke dalam 50 ml SWC semisolid. Kemudian dituang ke dalam media padat SWC, dan didiamkan hingga beku. Setelah itu, isolat sp. LTS 40 yang telah berumur dua hari ditotolkan dan diinkubasi pada suhu 30oC selama 48 jam. Bakteri yang memiliki kemampuan untuk menghasilkan zat antimikrob ditunjukkan dengan luasnya zona bening di sekitar koloni yang kemudian dihitung indeks penghambatannya. Indeks Penghambatan (IP) dihitung dengan menggunakan persamaan:
IP = Ф zona bening (mm) – Ф koloni (mm)
Ф koloni (mm)
Keterangan : Ф = Diameter
%$#(!0(+ " . *
%*. ,!0." .. Satu lup inokulan kultur isolat ditumbuhkan pada 100 ml media cair SWC 50% kemudian diinkubasi di atas inkubator berpenggoyang pada suhu ruang (28531oC) selama dua hari. Sebanyak 1 ml kultur isolat ditumbuhkan pada media dengan kombinasi molase dan pupuk NPK, molase dan pupuk ZA, molase dan pupuk TSP dan urea dengan masing5masing konsentrasi 0.2%, 0.1%, 0.05%, dan 0.02%. Kultur diinkubasi selama dua hari di atas inkubator berpenggoyang pada suhu ruang dan dilakukan pengukuran pertumbuhan selnya melalui metode pencawanan. Masing5 masing perlakuan kombinasi media ulang sebanyak dua kali.
). ,! %#. . #%$+ * &#%$.
"*.& #,$ Penghambatan isolat sp. LTS 40 terhadap bakteri indikator dilakukan dalam media SWC cair. Pada lima erlenmeyer berisi 50 ml media SWC cair masing5masing disuspensikan 100 Hl inokulum bakteri indikator umur 24 jam dengan kepadatan sekitar 107 sel/ml. Pada erlenmeyer I, II, III, IV, dan V masing5masing ditambahkan 100 Hl, 200 Hl, 400 Hl, dan 1000 Hl inokulum sp. LTS 40 sehingga diperoleh kultur
campuran dengan sp. LTS
40 dengan rasio 1:1, 1:2, 1:4, dan 1:10, sedangkan erlenmeyer kultur bakteri indikator (tanpa inokulum sp. LTS 40) sebagai kontrol negatif dan satu erlenmeyer yang disuspensikan 100 ml inokulum sp. LTS 40 digunakan sebagian kontrol positif. Pada jam ke 24 dan 48 dihitung jumlah sel s sp. LTS 40 dan bakteri indikator dengan metode cawan sebar pada media agar5 agar SWC lalu dihitung jumlah sel dan persentase penghambatannya. Penentuan persentase penghambatan terhadap bakteri indikator dengan menggunakan persamaan:
% Penghambatan = A – B x 100% A
Keterangan :
A=Jumlah sel bakteri indikator pada kontrol B=Jumlah sel bakteri indikator pada perlakuan
&#( #.!(! $,*(& . &#%$., ."
( #($ 1 .#%$
Sebanyak 100 ml sp. LTS 40 dari biakan pemula diinokulasikan ke dalam 10 liter media kombinasi terpilih atau terbaik dalam fermentor modifikasi (Gambar 1). Aerasi dilakukan dengan memompakan udara steril dengan menggunakan aerator dan filter udara. Suhu dipertahankan pada suhu ruang dan pH awal diatur pada pH netral (6.8 – 7). Inkubasi dilakukan selama 3 hari dan pengambilan contoh dilakukan secara aseptik setiap 12 jam menggunakan dan diukur jumlah selnya juga aktivitas penghambatannya melalui metode cakram
3
pengambilan contoh selanjutnya disentrifugasi dengan kecepatan 4500 g selama 15 menit kemudian dilakukan pemisahan supernatan dari filtrat selnya untuk diuji aktivitas mikrobnya terhadap bakteri indikator dengan
menggunakan metode . Pada
metode 50 Hl bakteri indikator dengan kepadatan sel 108 sel/ml disuspensikan ke dalam 50 ml SWC dan didiamkan hingga beku. Uji aktivitas supernatan bebas sel sp. LTS 40 dilakukan dengan meneteskan supernatan sebanyak 20 Hl pada kertas cakram berdiameter 6 mm dan dibiarkan mengering terlebih dahulu kemudian cakram diletakkan pada permukaan
media SWC Selanjutnya
diinkubasi pada suhu 30oC selama 24 jam dan dilakukan pengukuran diameter zona hambat yang terbentuk di sekitar kertas cakram. Zona hambat yang paling luas menunjukkan waktu produksi antimikrob yang optimum (Suparnika 2007).
Gambar 1 Fermentor modifikasi.
&#./.# %"'+ !0 # " , #
Isolat sp. LTS 40 penghasil bakteriosin yang diisolasi dari tambak udang memiliki morfologi koloni bulat, tepian tak beraturan, elevasi timbul, dan berwarna putih susu. Berdasarkan hasil uji sp. Galur LTS 40 memiliki aktivitas penghambatan terhadap ketiga bakteri indikator dengan indeks penghambatan sebesar 1,08 terhadap
1,02 terhadap dan terbesar 1,30 terhadap (Tabel 1).
Tabel 1 Aktivitas penghambatan sp. LTS 40 terhadap bakteri indikator
, dan dengan
metode
Keterangan IP = Indeks Penghambatan
%$#(!0(+ "
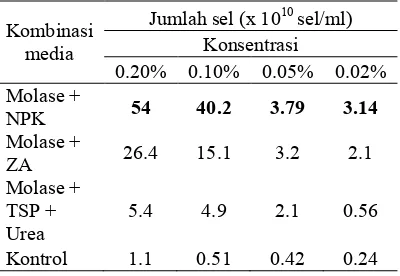
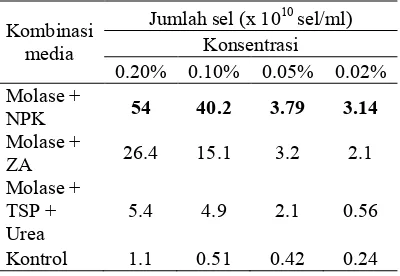
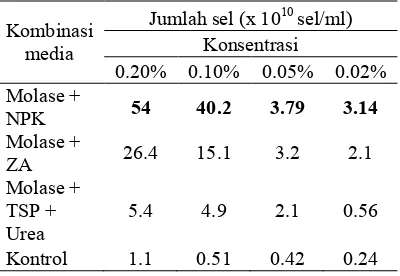
Isolat sp. LTS 40 ditumbuhkan dalam kombinasi media molase dan pupuk NPK, molase dan pupuk ZA, molase dan pupuk TSP serta urea dengan perbedaan masing5masing konsentrasi 0.2%, 0.1%, 0.05%, dan 0.02%. Kombinasi molase dan NPK pada konsentrasi 0.2% menunjukkan hasil yang terbaik yaitu diperoleh jumlah sel bakteri sebanyak 5,4x1011 sel/ml. Selanjutnya kombinasi molase dan ZA dan molase TSP dan urea berturut5turut sebanyak 2,64x1011 sel/ml dan 5,4x1010 sel/ml pada konsentrasi yang sama yaitu 0.2% (Tabel 2).
Tabel 2 Pertumbuhan bakteri sp. LTS kultur campuran menunjukkan bahwa
sp. LTS 40 mampu menghambat pertumbuhan dengan daya hambat yang tidak berbeda nyata pada inkubasi ke524 jam, 48 jam, dan 72 jam. Hal ini terlihat dari jumlah sel bakteri indikator yang dikompetisikan dengan sp. LTS 40 lebih rendah dibandingkan dengan kontrol negatif (bakteri
indikator tanpa isolat sp. LTS 40). Pada rasio 1:10, isolat sp. LTS 40 memiliki daya hambat paling tinggi dengan persen penghambatan mencapai 100% pada semua lama waktu inkubasi (Gambar 2).
Gambar 2 Persentase penghambatan sp. LTS 40 terhadap bakteri fermentor modifikasi dengan volume kerja 10 liter menunjukkan peningkatan dari jam ke512 hingga jam ke536. Hal ini ditunjukkan dari jumlah selnya yang semakin bertambah pada jam tersebut sebesar 1,8x1011 sel/ml (Gambar 3). Pada akhir jam ke536 hingga jam ke572 pertumbuhan bakteri memasuki stasioner.
Produksi bakteriosin dan uji aktivitas penghambatan supernatan isolat sp. LTS 40 yang dipanen setiap 12 jam ditunjukkan dengan luasnya zona hambat
dengan metode . Hasil uji
aktivitas bakteriosin yang dihasilkan
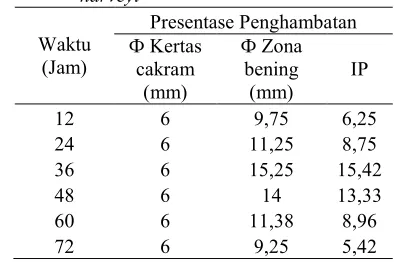
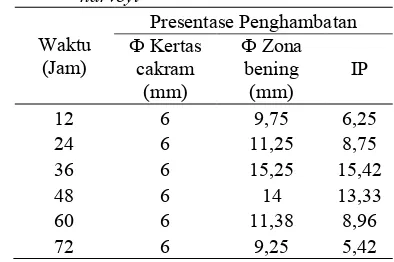
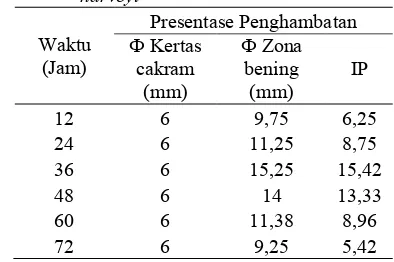
sp. LTS 40 terhadap menunjukkan terjadi penghambatan maksimum pada jam ke 36 dengan indeks penghambatan sebesar 15,42 (Tabel 3).
Tabel 3 Aktivitas penghambatan bakteriosin sp. LTS 40 terhadap
Keterangan IP = Indeks Penghambatan
Hasil perhitungan jumlah sel yang diplotkan terhadap selang waktu inkubasi, diperoleh kurva pertumbuhan isolat
sp. LTS 40 (Gambar 4). Jumlah sel paling tinggi terjadi pada jam ke536 dengan jumlah sel mencapai 1, 8x1011 sel/ml.
Aktivitas penghambatan terhadap i ditunjukkan oleh supernatan isolat
sp. LTS 40. Senyawa bakteriosin mulai diproduksi pada fase eksponensial pertumbuhan yaitu pada waktu inkubasi 12 sampai 36 jam dengan aktivitas bakteriosin tertinggi ialah pada inkubasi ke536 jam dengan zona hambat 15,25 mm. Zona hambatan paling luas menunjukkan waktu produksi bakteriosin yang optimum (Gambar 3).
Gambar 3 Aktivitas bakteriosin supernatan bebas sel sp. LTS 40 terhadap
Isolat sp. galur LTS 40 merupakan hasil isolasi dari sedimen sifon tambak udang (Lestari 2008) yang dapat menghasilkan bakteriosin (Isramilda 2007). sp. merupakan bakteri umum ditemukan pada sedimen laut dan saluran pencernaan udang (Moriarty 1999). Penggunaan isolat yang diisolasi dari lingkungan tambak sebagai bakteri kandidat probiotik akan lebih menguntungkan, karena isolat tersebut akan lebih mudah beradaptasi, mempertahankan diri, dan berkembang dalam lingkungan perairan (Isnansetyo 2005). Oleh karena itu, isolat sp. LTS 40 ditumbuhkan pada media s
(SWC) 50% untuk mengkondisikan seperti keadaan alamiahnya di tambak.
Berdasarkan uji aktivitas penghambatan
dengan metode , sp.
5
baik terhadap bakteri Gram positif dari pada bakteri Gram negatif.
Pola pertumbuhan sp. LTS 40 pada ketiga kombinasi menunjukkan hasil yang lebih tinggi dibandingkan kontrol, membuktikan bahwa kombinasi media tersebut mampu meningkatkan pertumbuhan sp. LTS 40. Pertumbuhan terbaik terdapat pada kombinasi media molase dengan NPK pada konsentrasi 0.2% sedangkan pada konsentrasi 0.1%, 0.05%, dan 0.02% menunjukkan pertumbuhan yang lebih rendah (Gambar 2). Hal yang sama pada kombinasi media molase dengan ZA, dan molase dengan TSP dan urea terbaik pada konsentrasi 0,2% (Gambar 2). Hal ini disebabkan oleh adanya perbedaan konsentrasi N yang didapat dari masing5masing kombinasi media. Kombinasi media molase dengan NPK menjadi kombinasi formula media yang terbaik karena Pupuk NPK memiliki kandungan nitrogen, fosfor dan kalium dalam bentuk ion, masing5 masing 15% sehingga tanpa diurai dapat langsung digunakan untuk pertumbuhan bakteri. Sedangkan Pupuk ZA dan urea hanya menyediakan nitrogen masing5masing 11% dan 46% untuk pertumbuhan bakteri. Pupuk ZA memiliki unsur N yang lebih kecil dibandingkan dengan NPK dan tidak terdapat unsur fosfor sehingga pertumbuhan
sp. LTS 40 lebih sedikit dibandingkan kultur di dalam NPK. Berbeda dengan kombinasi molase dengan TSP dan urea, meskipun nitrogen di dalam urea cukup tinggi dan tersedia fosfor namun tidak menghasilkan pertumbuhan yang tinggi pula. Diduga karena fosfor yang terdapat dalam kombinasi tersebut dalam bentuk senyawa P2O5, sehingga membutuhkan waktu dan mekanisme untuk memecah senyawa tersebut agar fosfor dapat digunakan. Selain itu ketersediannya yang hanya 11%, lebih sedikit dibandingkan dengan NPK membuat pertumbuhan
sp. LTS 40 pada media kombinasi ini lebih kecil. Ketersediaan fosfor merupakan salah satu unsur penting dalam pertumbuhan bakteri. Bakteri memerlukan fosfor terutama dalam bentuk fosfat yang sebagai komponen struktur sel dan sebagai simpanan energi (Volk & Wheeler 1984). Menurut Goldman dan Dennett (2000) perbedaan rasio C:N yang ideal bagi pertumbuhan bakteri marin bervariasi tergantung pada keterbatasan nutrisi (karbon dan nitrogen).
Rachmawati (2007) melaporkan bahwa rasio C:N pada kombinasi molase dengan dan molase dengan terbaik pada rasio 1:1 Pertumbuhan sel bakteri lebih
tinggi pada kombinasi molase dengan dari pada kombinasi molase dengan dengan jumlah sel bakteri sebesar 12.3x108 sel/ml. Hasil ini menunjukkan bahwa kombinasi molase dengan pupuk NPK, ZA, TSP, dan urea lebih baik dari pada penggunaan kombinasi molase dengan atau dengan jumlah sel bakteri maksimum mencapai 5,4x1011 sel/ml pada kombinasi molase dengan NPK.
Lim (1998) menyatakan bahwa setiap bakteri memerlukan sumber karbon bagi pertumbuhannya dengan cara mengubah karbon tersebut menjadi material sel melalui proses asimilasi, bakteri heterotrof menggunakan senyawa organik sebagai sumber karbonnya. Sumber karbon yang dapat digunakan oleh bakteri ini diantaranya terdapat pada molase. Molase masih mengandung kadar gula sekitar 45 – 58% yang tersusun dari sukrosa, glukosa, fruktosa dan komponen lainnya sehingga masih dapat digunakan sebagi sumber karbon yang baik bagi pertumbuhan bakteri (Paturau 1982).
Kemampuan mikroorganisme untuk memperoleh energi pada kondisi heterotrof tergantung pada kemampuan metabolismenya untuk mengoksidasi senyawa karbon (bahan organik) sebagai sumber energi utama. Senyawa karbon dalam metabolime berperan untuk menghasilkan energi melalui oksidasi senyawa tersebut dan menyediakan unsur C untuk pembentukan material sel (Prescott
2000).
Dari uji kompetisi, persentase penghambatan dengan rasio inokulum 1:1 sudah cukup bagi sp. LTS 40 untuk
menghambat pertumbuhan pada
ketiga waktu inkubasi dengan persentase 82,9% pada jam ke524, 82,8% pada jam ke5 48, dan 83% pada jam ke572. Peningkatan persentase terjadi bersamaan dengan peningkatan rasio inokulum s sp. LTS 40 terhadap . Daya hambat paling tinggi dengan persen penghambatan mencapai 100% terjadi ketika rasio 1:10 pada semua lama waktu inkubasi (Gambar 3). Uji kompetisi dalam kultur cair ebih efektif dalam menghambat bakteri indikator karena bakteriosin dapat berkontak langsung dengan bakteri indikator. Hal ini menunjukkan bahwa
sp. LTS 40 dapat dijadikan sebagai bakteri probiotik untuk menanggulangi permasalahan dalam tambak udang yang mengakibatkan kematian massal udang pada tingkat larva akibat bakteri
berbentuk sel tunggal, batang pendek bengkok atau lurus, berukuran panjang 1,4 55,0 Hm dan lebar 0,3–1,3 Hm, fermentatif terhadap glukosa, berpendar dan mempunyai flagella di salah satu kutubnya, tidak membentuk asam dari glukosa dan dapat menggunakan sukrosa sebagai sumber energinya (Lavilla5Pitogo
. 1990).
ditemukan pada hampir seluruh habitat, seperti air tawar, estuaria, air laut, tanah dan merupakan agen penyebab penyakit pada manusia, ikan dan crustacean (Singleton 1992). Masuknya patogen dalam usaha budi daya udang ditambak dapat berasal dari air laut dan benur (larva) yang digunakan. Boer (1993) melaporkan bahwa induk udang yang berasal dari air laut positif membawa bakteri berpendar sehingga dapat menularkan pada benur (larva) dan akhirnya terbawa masuk ke tambak.
Kehadiran sp. pada pemeliharaan udang tidak selalu menyebabkan kematian, bakteri ini bersifat oportunistik. Tingkat kepadatan tertentu serta kondisi hidup udang yang kurang baik menyebabkan Vibrio berubah menjadi patogen dan menginfeksi udang (Rukyani 1993). Beberapa bakteri vibrio yang sering menyebabkan kematian pada benih udang ialah
dan (Boer & Zafran 1992). Jenis yang sering menimbulkan masalah serius dalam budi daya ialah , larva yang terinfeksi terlihat bercahaya pada kondisi gelap sehingga penyakit yang ditimbulkan penyakit ini sering disebut penyakit kunang5
kunang atau .
Luminescence terjadi karena bakteri memiliki enzim luciferase yang dapat mengkatalis reaksi yang memancarkan cahaya dengan menggunakan substrat berupa senyawa aldehid yang disebut luciferin (Meighen 1991).
Isolat sp. LTS ditumbuhkan pada kombinasi media terbaik yaitu molase dengan NPK pada konsentrasi 0,2% yang berada dalam fermentor yang telah dimodifikasi (Gambar1). Fermentor modifikasi dikondisikan seperti fermentor kecil yang telah diberi aerasi dengan memompakan udara steril. Aerasi berfungsi sebagai penyuplai oksigen untuk sel sp. LTS 40, laju oksigen yang disuplai ke dalam fermentor modifikasi dijaga stabil. Laju alir oksigen yang tidak stabil dapat menurunkan daya kerja fermentor karena laju transfer oksigen yang tidak tetap dapat mengganggu metabolisme sel sp. LTS 40. Selain aerasi,
fermentor modifikasi juga dilengkapi dengan batu aerasi yang berfungsi sebagai pemecah gelembung5gelembung udara agar gelembung udara yang tebentuk berukuran kecil sehingga laju difusi oksigen ke dalam larutan lebih cepat dan meningkatkan kadar oksigen terlarutnya. Selain itu terdapat filter udara steril yang berfungsi sebagai penyaring udara dari luar yang masuk ke dalam fermentor yang berisi media sehingga terhindar dari kontaminan mikrob yang lain (Rachmawati 2007).
Tipe kultur yang digunakan dalam penelitian ini adalah sistem (sistem tertutup). Pada sistem ini, media hanya dimasukkan pada awal proses kultur sehingga tidak ada penambahan media baru. Pertumbuhan sp. LTS 40 pada fermentor modifikasi dengan volume kerja 10 liter menunjukkan peningkatan dari jam ke512 hingga jam ke536. Hal ini ditunjukkan dari jumlah selnya yang semakin bertambah pada jam tersebut yaitu 1,7x1011 sel/ml pada jam ke512, 1,75x1011 sel/ml pada jam ke524, dan 1,8x1011 sel/ml pada jam ke536 (Gambar 4). Pada akhir jam ke536 hingga jam ke572 pertumbuhan bakteri memasuki stasioner. Hal yang sama dilaporkan oleh Baruno (2008) bahwa bakteriosin dari kultur sp. Galur LTC8 dihasilkan pada jam ke512 dan produksi maksimum pada jam ke536. Hal tersebut mengindikasikan bahwa bakteriosin mulai dihasilkan pada fase pertumbuhan. Fase stasioner merupakan fase dimana sel5sel mulai tidak tumbuh lagi. Hal ini disebabkan oleh menyusutnya nutrien dalam media, keterbatasan oksigen dan akumulasi produk metabolisme yang toksik bagi organisme. Laju pertumbuhan bakteri pada fase ini melambat atau terhenti sedangkan jumlah mikrob yang hidup konstan.
Aktivitas supernatan bebas sel isolat sp. LTS 40 yang dipanen setiap 12 jam menunjukkan aktivitas penghambatan terhadap maksimum pada jam ke5 36 dengan zona hambat sebesar 15,25 mm (Tabel 2). Hasil tersebut berbeda dengan hasil yang telah dilaporkan Isramilda (2007) yang menyatakan bahwa bakteriosin yang dihasilkan isolat LTS 40 memiliki zona penghambatan sebesar 30 mm terhadap
7
tegangan permukaan (Frazier & Westhoff 1981).
Mekanisme kerja bakteriosin dalam menghambat pertumbuhan bakteri dapat dilakukan melalui hambatan terhadap pembentukkan dinding sel target, menghambat pembentukan asam nukleat atau menghambat pembentukan protein. Selanjutnya terjadi pembentukan pori5pori pada membran sel target sehingga permeabilitas membran sel terganggu (William . 1996). Hurst (1981) menyatakan bahwa mekanisme kerja bakteriosin diketahui bergantung pada konsentrasi bakteriosin, kemampuan ionisasi, suhu, pH, dan fase pertumbuhan sel target. Berdasarkan hasil penelitian menunjukkan bahwa pada inkubasi ke548 jam terjadi penurunan aktivitas penghambatan yang ditunjukkan dengan penurunan luas zona hambat. Hal ini karena inkubasi yang dilakukan lebih dari waktu optimum produksi senyawa bakteriosin dalam media. Dajani dan Wannamaker (1969) melaporkan bahwa inkubasi yang terlalu lama menyebabkan aktivitas bakteriosin menurun. Isramilda (2007) menyatakan bahwa pada inkubasi lebih dari tiga hari akan menyebabkan aktivitas antimikrob menurun. Hal ini disebabkan oleh diproduksinya inaktivator atau enzim pencernaan dan adanya reabsobsi terhadap senyawa antimikrob yang diproduksi sel. Hal yang sama dikemukakan oleh Jo (1996) bahwa jika waktu inkubasi diperpanjang maka aktivitas bakteriosin menurun, hal ini karena terbebasnya protease dari sel autolisis, karena bakterioisn merupakan molekul protaneus sehingga mudah terdegradasi.
Fase eksponensial terjadi pada waktu inkubasi ke512 jam sampai ke548 jam. Berdasarkan kurva pertumbuhan dapat diketahui bahwa senyawa antimikrob yang paling tinggi diproduksi pada fase eksponensial pertumbuhan. Berdasarkan ciri tersebut membuktikan bahwa senyawa antimikrob yang dihasilkan isolat sp. LTS 40 tersebut merupakan bakteriosin (Gambar 4). Hal ini sesuai dengan yang dilaporkan oleh Torkar & Matijasic (2003) bahwa produksi bakteriosin
dihasilkan pada fase eksponensial. Bakteriosin dapat dihasilkan oleh bakteri Gram positif maupun Gram negatif (! " 1995). Sebagian besar bakteriosin dihasilkan oleh bakteri Gram positif terutama yang paling banyak diteliti ialah dari genus
Bakteriosin dapat dibedakan dari antibiotik diantaranya dari proses produksinya
yaitu pada saat pertumbuhan bakteri mencapai fase logaritmik, sedangkan antibiotik diproduksi pada saat fase stasioner (Jack 1995). Selain itu, bakteriosin memiliki sisi pengikatan yang spesifik terhadap bakteri target, hal ini membedakan bakteriosin dari aktivitas zat antimikrob yang lain (Tagg 1976).
Menurut Gonzales (1996)
mekanisme aktivitas bakterisida beberapa bakteriosin secara umum ialah : 1) molekul bakteriosin mengalami kontak langsung dengan membran sel, 2) proses kontak ini mampu mengganggu potensial membran berupa ketidakstabilan membran sitoplasma sehingga sel menjadi tidak kuat, 3) ketidakstabilan membran memberikan dampak pembentukan lubang atau pori pada membran sel melalui gangguan terhadap gaya gerak proton, 4) terbentuknya lubang pada membran sel dapat menyebabkan perubahan gradien potensial membran dan pelepasan molekul intraseluler atau pun masuknya substansi ekstraseluler, akhirnya pertumbuhan sel menjadi terhambat dan menghasilkan proses kematian pada sel yang sensitif terhadap bakteriosin.
Isolat sp. galur LTS 40 mampu menghambat pertumbuhan
, dan
Kombinasi molase dan NPK pada konsentrasi 0,2% merupakan kombinasi terbaik yang dapat digunakan untuk media pertumbuhan sp. galur LTS 40. Uji kompetisi dan uji aktivitas supernatan dapat menghambat pertumbuhan . Bakteriosin dari sp. LTS 40 dihasilkan pada fase eksponensial dengan menggunakan media kombinasi molase dan NPK (1 : 1 w/v) pada konsentrasi 0,2%.
Aslim B, Saglam N, Beyatli Y. 2002. Determination of some properties of
isolated from soil. # " ! 26: 41548.
Baruno A. 2008. Karakterisasi antimikrob bakteriosin dari sp. galur LTC8 asal tambak udang [tesis]. Bogor : Sekolah Pascasarjana, Institut Pertanian Bogor.
Boer DR, Zafran. 1992. Bakteri sp. Sebagai patogen oportunis bagi udang
windu. ! 7: 735
76.
Dajani AS, Wannamaker LW. 1969. Demonstration of bactericidal substance againts beta5hemolytic streptococci in supernatant fluids of stapylococcal cultures. ! 97: 9855991. continuous culture under carbon and nitrogen limitation. ' ( 45: 7895800.
Hurst A. 1981. Nisin advances. ! &
% 27: 855123.
Isnansetyo A. 2005. Bakteri antagonis sebagai probiotik untuk pengendalian hayati pada aquakultur. ! " 7:15 10.
Isramilda. 2007. Karakteristik zat antimikrob penghambat pertumbuhan
dan dari
sp. asal tambak udang [tesis]. Bogor : Sekolah Pascasarjana, Institut Pertanian Bogor.
Jack RW, Tagg JR, Ray B. 1995. Bacteriocins of Gram5positive bacteria. ) 59: 1715200.
Jo YB, Kyung MB, Sung5Koo K, Hong5ki J. 1996. Evaluation at optimum conditions for bacteriocin production from ' sp. JB542 isolated from kimichi. ! %
6: 63567.
Lavilla5Pitogo CR, Baticados MCL, Cruz5 Lacierda ER. de la Pena LD. 1990. Occurence of luminous bacterial
disease of larvae in
the Philippines. &* 91:1514.
Lestari D. 2008. Isolasi dan seleksi
sp. untuk biokontrol pada tambak udang [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam IPB.
Lim D. 1998. % . Ed ke52. New York : McGraw5Hill.
Lisboa MP, Bonatto D, Bizani D, Henriques
JAP, Brandelli A. 2006.
Characterization of a bakteriosin5like substance produced by
* isolated from
Brazillian atlantic forest. +
% 9:1115118.
Meighen EA. 1991. Molecular biology of bacterial bioluminescence microbiol. Rev. Vulgaris and Syringomycin Production. ! 176: 13745 1382.
Moriarty DJW. 1999. Disease control in shrimp aquaculture with probiotic bacteria. Di dalam : Bell CR,
Rachmawati I. 2007. Penggunaan molase, fishmeal, dan soymeal sebagai media produksi
9
Ruangpan L, Na5anan P. Direkbusarakom S. 1998. Inhibitory effect of
on the growth of .
. $ 33: 2935296.
Rukyani A. 1993. "
/ 0 . Jakarta: Pusat
Penelitian dan Pengembangan Perikanan.
Saraswati R. 2003. Produksi massal sel
) dengan teknologi
bioproses. % " + 8:47552.
Silaban RC. 2007. Penggunaan probiotik sp. IRVE01 dan
IRNAE01 asal tambak udang pada larva udang
(' ) [skripsi].
Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Singleton P. 1992. + 1
% . New York: John Wiley and Sons Chichster.
Suparnika I. 2007. Aktivitas antimikrob sp. asal tambak udang [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Tagg JR, Dajani AS, Wannamaker LW. 1976. Bacteriocins of Gram positive bacteria. ) 40: 7225756.
Torkar KG, Matijasic BB. 2003. Partial characterization of bacteriocins
produced by isolate
from milk and milk products. $ # 41: 1215671
Verrschuere L, Rombaut G, Sorgeloos P, Verstaete W. 2000. Probiotic bacteria as control agent in aquaculture. ! %
64: 6555657.
Volk WA, Wheeler MF. 1984. % "
2 . Ed ke55. Markham,
penerjemah; Adisoemarto S, editor. New York: Harper & Row Publisher Inc. Terjemahan dari:
% . Ed ke55.
William RAD, Lambert PA, Singleton P.
1996. & 2 & .
11
Lampiran 1 Komposisi media yang digunakan
No. Nama media Komposisi Jumlah (g/l)
1 0 . (SWC) 50% Air laut 750 ml
Akuades 250 ml
Gliserol 1,5 ml
Ekstrak khamir 0,5
Agar 20
Bacto pepton 2,5
2 SWC Semisolid Air laut 750 ml
Akuades 250 ml
Gliserol 1,5 ml
Ekstrak khamir 0,5
Agar 10
Bacto pepton 2,5
Lampiran 2 Komposisi kimia molase (Paturau 1982)
Komponen Kisaran (%) Rata5rata (%)
Air 17525 20
Sukrosa 30540 35
Glukosa 4 5 9 7
Fruktosa 5 512 9
Gula Pereduksi 1 5 5 3
Karbohidrat lain 2 5 5 4
Abu 7515 12
Komponen nitrogen 2 5 6 4,5
Asam bukan nitrogen 2 5 6 5
Lilin, steroid, dan fosfolipid 0,151 0,4
Lampiran 3 Komposisi pupuk yang digunakan
Pupuk Komponen
Kisaran (%)
NPK N 15
P 15
K 15
ZA Nitrogen 11
Sulfur 24
TSP SiO2 37
P2O5 11
CaO 28
ABSTRAK
PUJI PURWANTI. Optimasi Media Produksi Bakteriosin dari Bacillus sp. Galur LTS 40 Asal Tambak Udang. Dibimbing oleh IMAN RUSMANA dan NISA RACHMANIA MUBARIK.
Permintaan dan kebutuhan udang sebagai komoditi ekspor perikanan semakin meningkat dari tahun ke tahun. Namun, dewasa ini banyak terserang penyakit Vibriosis yang disebabkan oleh bakteri berpendar Vibrio harveyi. Bakteri probiotik dapat dijadikan sebagai kontrol untuk menghambat pertumbuhan bakteri patogen di tambak. Isolat Bacillus sp. LTS 40 merupakan kandidat bakteri probiotik karena mampu menghasilkan bakteriosin untuk menghambat pertumbuhan bakteri patogen. Produksi bakteri probiotik secara massal memerlukan biaya yang cukup besar. Untuk itu, perlu dicari media produksi yang murah. Media produksi yang digunakan sebagai sumber karbon ialah molase dan sebagai sumber nitrogen yaitu pupuk NPK, TSP, ZA, dan Urea. Tujuan dari penelitian ini untukmendapatkan media produksi yang terbaik bagi petumbuhan
Bacillus sp. LTS 40 asal tambak udang. Dari uji aktivitas penghambatan menunjukkan Bacillus sp. LTS 40 mampu menghambat V. harveyi dengan indeks penghambatan sebesar 1, 08. Uji kompetisi dalam kultur cair juga menunjukkan bahwa terjadi penghambatan hingga mencapai 100% pada rasio 1:10 pada inkubasi ke-24 jam, ke-48 jam, dan ke-72 jam. Isolat Bacillus sp. LTS 40 mempunyai pertumbuhan terbaik pada kombinasi media molase dengan NPK pada konsentrasi 0,2%. Fermentor modifikasi volume kerja 10 liter menunjukkan bakteriosin diproduksi pada saat fase eksponensial dan produksi optimum pada jam ke-36 dengan zona hambat sebesar 15, 25 mm. Hal ini menunjukkan bahwa Bacillus sp. LTS 40 dapat dijadikan bakteri probiotik untuk menanggulangi permasalahan kematian massal udang pada tingkat larva akibat serangan V. harveyi.
Kata kunci: Bacillus sp., V. harveyi, bakteriosin
ABSTRACT
PUJI PURWANTI. Optimizing media for Bacteriosin Production by Bacillus sp. Strain LTS 40 Isolated from Shrimp Pond. Under supervision of IMAN RUSMANA and NISA RACHMANIA MUBARIK.
Export demand on shrimp as fishery commodity has increased. However, nowadays Vibriosis diseases caused by fluorescent bacterium Vibrio harveyi have decreased shrimp production. Probiotic bacteria can be used as biocontrol to inhibit the growth of V. harveyi in ponds. Bacillus sp. LTS 40 as a probiotic candidate was able to produce bacteriosin inhibiting the growth of V. harveyi. Production of bacterial probiotics should be low cost using a cheap media. Media production of bacterial probiotics commonly use molase as carbon sources and fertilizers such as NPK, ZA, and urea as a source of nitrogen. The aim of this research was to get the best media composition for growth of Bacillus sp. LTS 40 in producing bacteriosin. Antimicrobial activity test showed that Bacillus sp. LTS 40 could inhibit the growth of V. harveyi with inhibition index of 1,08. Competition assay in liquid culture also showed that Bacillus sp. LTS 40 could inhibit V. harveyi up to 100% at 24 hours, 48 hours, and 72 hours of incubation. Bacillus sp. LTS 40 had a good growth on media composition of 0,2% molase and NPK. In 10 liter fermentor, bacteriosin was produced during exponential phase and optimum production was at 36 hours of incubation with inhibition zone of 15.25 mm. This result showed that Bacillus sp. LTS 40 can be used as probiotics to reduce mortality of shrimp larvae caused by V. harveyi in shrimp cultures.
# $ % & "'
Permintaan dan kebutuhan udang sebagai komoditi ekspor perikanan semakin meningkat dari tahun ke tahun karena udang dapat dimanfaatkan sebagai bahan makanan yang memiliki nilai gizi tinggi. Udang juga merupakan salah satu konsumsi kegemaran masyarakat hampir di seluruh dunia. Oleh karena itu, peluang dalam mengembangkan perikanan budi daya udang guna memenuhi permintaan dunia sangat besar. Namun, dewasa ini banyak tambak udang terserang penyakit vibriosis yang disebabkan oleh
bakteri berpendar (Moriatty
1999) Bakteri ini merupakan penyebab utama serangan bakteri penyakit pada udang yang dapat terjadi mulai pada tingkat larva (Silaban 2007). Ruangpan (1998) menyatakan bahwa salah satu penyebab kematian massal pada udang budi daya yaitu penyakit vibriosis yang sebagian besar disebabkan oleh bakteri
sp.
Selain kuantitas produksi, tantangan lain yang harus dihadapi dalam pasar dunia bagi komoditi ekspor perikanan budi daya udang ialah kualitas atau mutu udang yang siap diekspor (Isramilda 2007). Residu antibiotik, bakteri patogen, biotoksin atau residu pestisida juga harus mendapatkan perhatian serius guna menjaga mutu dan keamanan produk.
Peraturan pemerintah melarang menggunakan antibiotik untuk budi daya udang tertuang dalam UU No. 31 tahun 2004 tentang perikanan yang menyatakan bahwa melarang para pengusaha perbenihan udang di Indonesia menggunakan antibiotik nitrofurans dalam proses perbenihan udang. Menurut Verschuere . (2000) penggunaan antibiotik untuk mencegah dan mengobati penyakit dapat menimbulkan masalah baru yaitu, terakumulasinya antibiotik pada lingkungan dan spesies yang dibudidayakan serta timbulnya resistensi mikrob patogen.
Alternatif pengendalian penyakit udang yang disebabkan bakteri patogen di tambak udang ialah dengan memanfaatkan bakteri probiotik. Probiotik ialah makhluk hidup yang memberikan pengaruh menguntungkan pada inang dengan memodifikasi komunitas mikrob atau berasosiasi dengan inang, memperbaiki nilai nutrisi, memperbaiki respon inang terhadap penyakit, atau memperbaiki
senyawa metabolit yang mempunyai efek bakterisida dan bakteriostatik untuk menghambat pertumbuhan bakteri patogen atau bakteri yang dapat menurunkan kualitas udang selama dibudidayakan.
Bakteri probiotik dapat dijadikan sebagai kontrol untuk menghambat pertumbuhan bakteri patogen di tambak. Isolat sp. LTS 40 merupakan kandidat bakteri probiotik karena mampu menghasilkan bakteriosin untuk menghambat pertumbuhan bakteri patogen. Bakteriosin merupakan senyawa antimikrob yang terdiri atas protein atau polipeptida yang disintesis oleh ribosom dan umumnya menghambat spesies bakteri yang berkerabat dekat dengan bakteri penghasil bakteriosin (Jack . 1995).
Produksi bakteri probiotik secara massal memerlukan biaya yang cukup besar. Sebelumnya telah digunakan kombinasi
molase dengan dan , namun
kenaikan harga dan yang
terus meningkat mengakibatkan biaya produksi yang meningkat pula. Untuk itu, perlu dicari media produksi yang lebih murah. Media produksi yang umum digunakan sebagai sumber karbon ialah molase dan sebagai sumber nitrogen yaitu pupuk NPK, ZA, TSP, dan urea.
()( "
Penelitian ini bertujuan mendapatkan media produksi bakteriosin yang terbaik bagi petumbuhan sp. LTS 40 asal tambak udang.
&#( * " %! #
Penelitian dilakukan pada bulan Februari hingga Mei 2009 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
+ "
Bahan yang digunakan diantaranya Media (SWC) (Lampiran 1), isolat sp. galur LTS 40, bakteri indikator
# $ % & "'
Permintaan dan kebutuhan udang sebagai komoditi ekspor perikanan semakin meningkat dari tahun ke tahun karena udang dapat dimanfaatkan sebagai bahan makanan yang memiliki nilai gizi tinggi. Udang juga merupakan salah satu konsumsi kegemaran masyarakat hampir di seluruh dunia. Oleh karena itu, peluang dalam mengembangkan perikanan budi daya udang guna memenuhi permintaan dunia sangat besar. Namun, dewasa ini banyak tambak udang terserang penyakit vibriosis yang disebabkan oleh
bakteri berpendar (Moriatty
1999) Bakteri ini merupakan penyebab utama serangan bakteri penyakit pada udang yang dapat terjadi mulai pada tingkat larva (Silaban 2007). Ruangpan (1998) menyatakan bahwa salah satu penyebab kematian massal pada udang budi daya yaitu penyakit vibriosis yang sebagian besar disebabkan oleh bakteri
sp.
Selain kuantitas produksi, tantangan lain yang harus dihadapi dalam pasar dunia bagi komoditi ekspor perikanan budi daya udang ialah kualitas atau mutu udang yang siap diekspor (Isramilda 2007). Residu antibiotik, bakteri patogen, biotoksin atau residu pestisida juga harus mendapatkan perhatian serius guna menjaga mutu dan keamanan produk.
Peraturan pemerintah melarang menggunakan antibiotik untuk budi daya udang tertuang dalam UU No. 31 tahun 2004 tentang perikanan yang menyatakan bahwa melarang para pengusaha perbenihan udang di Indonesia menggunakan antibiotik nitrofurans dalam proses perbenihan udang. Menurut Verschuere . (2000) penggunaan antibiotik untuk mencegah dan mengobati penyakit dapat menimbulkan masalah baru yaitu, terakumulasinya antibiotik pada lingkungan dan spesies yang dibudidayakan serta timbulnya resistensi mikrob patogen.
Alternatif pengendalian penyakit udang yang disebabkan bakteri patogen di tambak udang ialah dengan memanfaatkan bakteri probiotik. Probiotik ialah makhluk hidup yang memberikan pengaruh menguntungkan pada inang dengan memodifikasi komunitas mikrob atau berasosiasi dengan inang, memperbaiki nilai nutrisi, memperbaiki respon inang terhadap penyakit, atau memperbaiki
lingkungan kualitas ambangnya (Verschuere . 2000).
Bakteri probiotik menghasilkan senyawa metabolit yang mempunyai efek bakterisida dan bakteriostatik untuk menghambat pertumbuhan bakteri patogen atau bakteri yang dapat menurunkan kualitas udang selama dibudidayakan.
Bakteri probiotik dapat dijadikan sebagai kontrol untuk menghambat pertumbuhan bakteri patogen di tambak. Isolat sp. LTS 40 merupakan kandidat bakteri probiotik karena mampu menghasilkan bakteriosin untuk menghambat pertumbuhan bakteri patogen. Bakteriosin merupakan senyawa antimikrob yang terdiri atas protein atau polipeptida yang disintesis oleh ribosom dan umumnya menghambat spesies bakteri yang berkerabat dekat dengan bakteri penghasil bakteriosin (Jack . 1995).
Produksi bakteri probiotik secara massal memerlukan biaya yang cukup besar. Sebelumnya telah digunakan kombinasi
molase dengan dan , namun
kenaikan harga dan yang
terus meningkat mengakibatkan biaya produksi yang meningkat pula. Untuk itu, perlu dicari media produksi yang lebih murah. Media produksi yang umum digunakan sebagai sumber karbon ialah molase dan sebagai sumber nitrogen yaitu pupuk NPK, ZA, TSP, dan urea.
()( "
Penelitian ini bertujuan mendapatkan media produksi bakteriosin yang terbaik bagi petumbuhan sp. LTS 40 asal tambak udang.
&#( * " %! #
Penelitian dilakukan pada bulan Februari hingga Mei 2009 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
+ "
Bahan yang digunakan diantaranya Media (SWC) (Lampiran 1), isolat sp. galur LTS 40, bakteri indikator
%#,*%
%"-. " %*. . Media yang
digunakan ialah media yang berisi molase (Lampiran 2) yang dikombinasikan dengan pupuk NPK, ZA, TSP dan urea (Lampiran 3) (w/v) 1:1 dengan konsentrasi 0.2%, 0.1%, 0.05%, dan 0.02%.
%$%! ) " , # Peremajaan isolat dilakukan dengan menumbuhkan isolat bakteri sp. LTS 40 pada media agar5 aktivitas penghambatannya terhadap bakteri
indikator , dan
dengan menggunakan metode
(Lisboa 2006). Sebanyak 500 Hl bakteri indikator disuspensikan ke dalam 50 ml SWC semisolid. Kemudian dituang ke dalam media padat SWC, dan didiamkan hingga beku. Setelah itu, isolat sp. LTS 40 yang telah berumur dua hari ditotolkan dan diinkubasi pada suhu 30oC selama 48 jam. Bakteri yang memiliki kemampuan untuk menghasilkan zat antimikrob ditunjukkan dengan luasnya zona bening di sekitar koloni yang kemudian dihitung indeks penghambatannya. Indeks Penghambatan (IP) dihitung dengan menggunakan persamaan:
IP = Ф zona bening (mm) – Ф koloni (mm)
Ф koloni (mm)
Keterangan : Ф = Diameter
%$#(!0(+ " . *
%*. ,!0." .. Satu lup inokulan kultur isolat ditumbuhkan pada 100 ml media cair SWC 50% kemudian diinkubasi di atas inkubator berpenggoyang pada suhu ruang (28531oC) selama dua hari. Sebanyak 1 ml kultur isolat ditumbuhkan pada media dengan kombinasi molase dan pupuk NPK, molase dan pupuk ZA, molase dan pupuk TSP dan urea dengan masing5masing konsentrasi 0.2%, 0.1%, 0.05%, dan 0.02%. Kultur diinkubasi selama dua hari di atas inkubator berpenggoyang pada suhu ruang dan dilakukan pengukuran pertumbuhan selnya melalui metode pencawanan. Masing5 masing perlakuan kombinasi media ulang sebanyak dua kali.
). ,! %#. . #%$+ * &#%$.
"*.& #,$ Penghambatan isolat sp. LTS 40 terhadap bakteri indikator dilakukan dalam media SWC cair. Pada lima erlenmeyer berisi 50 ml media SWC cair masing5masing disuspensikan 100 Hl inokulum bakteri indikator umur 24 jam dengan kepadatan sekitar 107 sel/ml. Pada erlenmeyer I, II, III, IV, dan V masing5masing ditambahkan 100 Hl, 200 Hl, 400 Hl, dan 1000 Hl inokulum sp. LTS 40 sehingga diperoleh kultur
campuran dengan sp. LTS
40 dengan rasio 1:1, 1:2, 1:4, dan 1:10, sedangkan erlenmeyer kultur bakteri indikator (tanpa inokulum sp. LTS 40) sebagai kontrol negatif dan satu erlenmeyer yang disuspensikan 100 ml inokulum sp. LTS 40 digunakan sebagian kontrol positif. Pada jam ke 24 dan 48 dihitung jumlah sel s sp. LTS 40 dan bakteri indikator dengan metode cawan sebar pada media agar5 agar SWC lalu dihitung jumlah sel dan persentase penghambatannya. Penentuan persentase penghambatan terhadap bakteri indikator dengan menggunakan persamaan:
% Penghambatan = A – B x 100% A
Keterangan :
A=Jumlah sel bakteri indikator pada kontrol B=Jumlah sel bakteri indikator pada perlakuan
&#( #.!(! $,*(& . &#%$., ."
( #($ 1 .#%$
Sebanyak 100 ml sp. LTS 40 dari biakan pemula diinokulasikan ke dalam 10 liter media kombinasi terpilih atau terbaik dalam fermentor modifikasi (Gambar 1). Aerasi dilakukan dengan memompakan udara steril dengan menggunakan aerator dan filter udara. Suhu dipertahankan pada suhu ruang dan pH awal diatur pada pH netral (6.8 – 7). Inkubasi dilakukan selama 3 hari dan pengambilan contoh dilakukan secara aseptik setiap 12 jam menggunakan dan diukur jumlah selnya juga aktivitas penghambatannya melalui metode cakram
3
pengambilan contoh selanjutnya disentrifugasi dengan kecepatan 4500 g selama 15 menit kemudian dilakukan pemisahan supernatan dari filtrat selnya untuk diuji aktivitas mikrobnya terhadap bakteri indikator dengan
menggunakan metode . Pada
metode 50 Hl bakteri indikator dengan kepadatan sel 108 sel/ml disuspensikan ke dalam 50 ml SWC dan didiamkan hingga beku. Uji aktivitas supernatan bebas sel sp. LTS 40 dilakukan dengan meneteskan supernatan sebanyak 20 Hl pada kertas cakram berdiameter 6 mm dan dibiarkan mengering terlebih dahulu kemudian cakram diletakkan pada permukaan
media SWC Selanjutnya
diinkubasi pada suhu 30oC selama 24 jam dan dilakukan pengukuran diameter zona hambat yang terbentuk di sekitar kertas cakram. Zona hambat yang paling luas menunjukkan waktu produksi antimikrob yang optimum (Suparnika 2007).
Gambar 1 Fermentor modifikasi.
&#./.# %"'+ !0 # " , #
Isolat sp. LTS 40 penghasil bakteriosin yang diisolasi dari tambak udang memiliki morfologi koloni bulat, tepian tak beraturan, elevasi timbul, dan berwarna putih susu. Berdasarkan hasil uji sp. Galur LTS 40 memiliki aktivitas penghambatan terhadap ketiga bakteri indikator dengan indeks penghambatan sebesar 1,08 terhadap
1,02 terhadap dan terbesar 1,30 terhadap (Tabel 1).
Tabel 1 Aktivitas penghambatan sp. LTS 40 terhadap bakteri indikator
, dan dengan
metode
Keterangan IP = Indeks Penghambatan
%$#(!0(+ "
Isolat sp. LTS 40 ditumbuhkan dalam kombinasi media molase dan pupuk NPK, molase dan pupuk ZA, molase dan pupuk TSP serta urea dengan perbedaan masing5masing konsentrasi 0.2%, 0.1%, 0.05%, dan 0.02%. Kombinasi molase dan NPK pada konsentrasi 0.2% menunjukkan hasil yang terbaik yaitu diperoleh jumlah sel bakteri sebanyak 5,4x1011 sel/ml. Selanjutnya kombinasi molase dan ZA dan molase TSP dan urea berturut5turut sebanyak 2,64x1011 sel/ml dan 5,4x1010 sel/ml pada konsentrasi yang sama yaitu 0.2% (Tabel 2).
Tabel 2 Pertumbuhan bakteri sp. LTS kultur campuran menunjukkan bahwa
sp. LTS 40 mampu menghambat pertumbuhan dengan daya hambat yang tidak berbeda nyata pada inkubasi ke524 jam, 48 jam, dan 72 jam. Hal ini terlihat dari jumlah sel bakteri indikator yang dikompetisikan dengan sp. LTS 40 lebih rendah dibandingkan dengan kontrol negatif (bakteri
pengambilan contoh selanjutnya disentrifugasi dengan kecepatan 4500 g selama 15 menit kemudian dilakukan pemisahan supernatan dari filtrat selnya untuk diuji aktivitas mikrobnya terhadap bakteri indikator dengan
menggunakan metode . Pada
metode 50 Hl bakteri indikator dengan kepadatan sel 108 sel/ml disuspensikan ke dalam 50 ml SWC dan didiamkan hingga beku. Uji aktivitas supernatan bebas sel sp. LTS 40 dilakukan dengan meneteskan supernatan sebanyak 20 Hl pada kertas cakram berdiameter 6 mm dan dibiarkan mengering terlebih dahulu kemudian cakram diletakkan pada permukaan
media SWC Selanjutnya
diinkubasi pada suhu 30oC selama 24 jam dan dilakukan pengukuran diameter zona hambat yang terbentuk di sekitar kertas cakram. Zona hambat yang paling luas menunjukkan waktu produksi antimikrob yang optimum (Suparnika 2007).
Gambar 1 Fermentor modifikasi.
&#./.# %"'+ !0 # " , #
Isolat sp. LTS 40 penghasil bakteriosin yang diisolasi dari tambak udang memiliki morfologi koloni bulat, tepian tak beraturan, elevasi timbul, dan berwarna putih susu. Berdasarkan hasil uji sp. Galur LTS 40 memiliki aktivitas penghambatan terhadap ketiga bakteri indikator dengan indeks penghambatan sebesar 1,08 terhadap
1,02 terhadap dan terbesar 1,30 terhadap (Tabel 1).
Tabel 1 Aktivitas penghambatan sp. LTS 40 terhadap bakteri indikator
, dan dengan
metode
Keterangan IP = Indeks Penghambatan
%$#(!0(+ "
Isolat sp. LTS 40 ditumbuhkan dalam kombinasi media molase dan pupuk NPK, molase dan pupuk ZA, molase dan pupuk TSP serta urea dengan perbedaan masing5masing konsentrasi 0.2%, 0.1%, 0.05%, dan 0.02%. Kombinasi molase dan NPK pada konsentrasi 0.2% menunjukkan hasil yang terbaik yaitu diperoleh jumlah sel bakteri sebanyak 5,4x1011 sel/ml. Selanjutnya kombinasi molase dan ZA dan molase TSP dan urea berturut5turut sebanyak 2,64x1011 sel/ml dan 5,4x1010 sel/ml pada konsentrasi yang sama yaitu 0.2% (Tabel 2).
Tabel 2 Pertumbuhan bakteri sp. LTS kultur campuran menunjukkan bahwa
sp. LTS 40 mampu menghambat pertumbuhan dengan daya hambat yang tidak berbeda nyata pada inkubasi ke524 jam, 48 jam, dan 72 jam. Hal ini terlihat dari jumlah sel bakteri indikator yang dikompetisikan dengan sp. LTS 40 lebih rendah dibandingkan dengan kontrol negatif (bakteri
4
indikator tanpa isolat sp. LTS 40). Pada rasio 1:10, isolat sp. LTS 40 memiliki daya hambat paling tinggi dengan persen penghambatan mencapai 100% pada semua lama waktu inkubasi (Gambar 2).
Gambar 2 Persentase penghambatan sp. LTS 40 terhadap bakteri fermentor modifikasi dengan volume kerja 10 liter menunjukkan peningkatan dari jam ke512 hingga jam ke536. Hal ini ditunjukkan dari jumlah selnya yang semakin bertambah pada jam tersebut sebesar 1,8x1011 sel/ml (Gambar 3). Pada akhir jam ke536 hingga jam ke572 pertumbuhan bakteri memasuki stasioner.
Produksi bakteriosin dan uji aktivitas penghambatan supernatan isolat sp. LTS 40 yang dipanen setiap 12 jam ditunjukkan dengan luasnya zona hambat
dengan metode . Hasil uji
aktivitas bakteriosin yang dihasilkan
sp. LTS 40 terhadap menunjukkan terjadi penghambatan maksimum pada jam ke 36 dengan indeks penghambatan sebesar 15,42 (Tabel 3).
Tabel 3 Aktivitas penghambatan bakteriosin sp. LTS 40 terhadap
Keterangan IP = Indeks Penghambatan
Hasil perhitungan jumlah sel yang diplotkan terhadap selang waktu inkubasi, diperoleh kurva pertumbuhan isolat
sp. LTS 40 (Gambar 4). Jumlah sel paling tinggi terjadi pada jam ke536 dengan jumlah sel mencapai 1, 8x1011 sel/ml.
Aktivitas penghambatan terhadap i ditunjukkan oleh supernatan isolat
sp. LTS 40. Senyawa bakteriosin mulai diproduksi pada fase eksponensial pertumbuhan yaitu pada waktu inkubasi 12 sampai 36 jam dengan aktivitas bakteriosin tertinggi ialah pada inkubasi ke536 jam dengan zona hambat 15,25 mm. Zona hambatan paling luas menunjukkan waktu produksi bakteriosin yang optimum (Gambar 3).
Gambar 3 Aktivitas bakteriosin supernatan bebas sel sp. LTS 40 terhadap
Isolat sp. galur LTS 40 merupakan hasil isolasi dari sedimen sifon tambak udang (Lestari 2008) yang dapat menghasilkan bakteriosin (Isramilda 2007). sp. merupakan bakteri umum ditemukan pada sedimen laut dan saluran pencernaan udang (Moriarty 1999). Penggunaan isolat yang diisolasi dari lingkungan tambak sebagai bakteri kandidat probiotik akan lebih menguntungkan, karena isolat tersebut akan lebih mudah beradaptasi, mempertahankan diri, dan berkembang dalam lingkungan perairan (Isnansetyo 2005). Oleh karena itu, isolat sp. LTS 40 ditumbuhkan pada media s
(SWC) 50% untuk mengkondisikan seperti keadaan alamiahnya di tambak.
Berdasarkan uji aktivitas penghambatan
dengan metode , sp.
indikator tanpa isolat sp. LTS 40). Pada rasio 1:10, isolat sp. LTS 40 memiliki daya hambat paling tinggi dengan persen penghambatan mencapai 100% pada semua lama waktu inkubasi (Gambar 2).
Gambar 2 Persentase penghambatan sp. LTS 40 terhadap bakteri fermentor modifikasi dengan volume kerja 10 liter menunjukkan peningkatan dari jam ke512 hingga jam ke536. Hal ini ditunjukkan dari jumlah selnya yang semakin bertambah pada jam tersebut sebesar 1,8x1011 sel/ml (Gambar 3). Pada akhir jam ke536 hingga jam ke572 pertumbuhan bakteri memasuki stasioner.
Produksi bakteriosin dan uji aktivitas penghambatan supernatan isolat sp. LTS 40 yang dipanen setiap 12 jam ditunjukkan dengan luasnya zona hambat
dengan metode . Hasil uji
aktivitas bakteriosin yang dihasilkan
sp. LTS 40 terhadap menunjukkan terjadi penghambatan maksimum pada jam ke 36 dengan indeks penghambatan sebesar 15,42 (Tabel 3).
Tabel 3 Aktivitas penghambatan bakteriosin sp. LTS 40 terhadap
Keterangan IP = Indeks Penghambatan
Hasil perhitungan jumlah sel yang diplotkan terhadap selang waktu inkubasi, diperoleh kurva pertumbuhan isolat
sp. LTS 40 (Gambar 4). Jumlah sel paling tinggi terjadi pada jam ke536 dengan jumlah sel mencapai 1, 8x1011 sel/ml.
Aktivitas penghambatan terhadap i ditunjukkan oleh supernatan isolat
sp. LTS 40. Senyawa bakteriosin mulai diproduksi pada fase eksponensial pertumbuhan yaitu pada waktu inkubasi 12 sampai 36 jam dengan aktivitas bakteriosin tertinggi ialah pada inkubasi ke536 jam dengan zona hambat 15,25 mm. Zona hambatan paling luas menunjukkan waktu produksi bakteriosin yang optimum (Gambar 3).
Gambar 3 Aktivitas bakteriosin supernatan bebas sel sp. LTS 40 terhadap
Isolat sp. galur LTS 40 merupakan hasil isolasi dari sedimen sifon tambak udang (Lestari 2008) yang dapat menghasilkan bakteriosin (Isramilda 2007). sp. merupakan bakteri umum ditemukan pada sedimen laut dan saluran pencernaan udang (Moriarty 1999). Penggunaan isolat yang diisolasi dari lingkungan tambak sebagai bakteri kandidat probiotik akan lebih menguntungkan, karena isolat tersebut akan lebih mudah beradaptasi, mempertahankan diri, dan berkembang dalam lingkungan perairan (Isnansetyo 2005). Oleh karena itu, isolat sp. LTS 40 ditumbuhkan pada media s
(SWC) 50% untuk mengkondisikan seperti keadaan alamiahnya di tambak.
Berdasarkan uji aktivitas penghambatan
dengan metode , sp.
5
baik terhadap bakteri Gram positif dari pada bakteri Gram negatif.
Pola pertumbuhan sp. LTS 40 pada ketiga kombinasi menunjukkan hasil yang lebih tinggi dibandingkan kontrol, membuktikan bahwa kombinasi media tersebut mampu meningkatkan pertumbuhan sp. LTS 40. Pertumbuhan terbaik terdapat pada kombinasi media molase dengan NPK pada konsentrasi 0.2% sedangkan pada konsentrasi 0.1%, 0.05%, dan 0.02% menunjukkan pertumbuhan yang lebih rendah (Gambar 2). Hal yang sama pada kombinasi media molase dengan ZA, dan molase dengan TSP dan urea terbaik pada konsentrasi 0,2% (Gambar 2). Hal ini disebabkan oleh adanya perbedaan konsentrasi N yang didapat dari masing5masing kombinasi media. Kombinasi media molase dengan NPK menjadi kombinasi formula media yang terbaik karena Pupuk NPK memiliki kandungan nitrogen, fosfor dan kalium dalam bentuk ion, masing5 masing 15% sehingga tanpa diurai dapat langsung digunakan untuk pertumbuhan bakteri. Sedangkan Pupuk ZA dan urea hanya menyediakan nitrogen masing5masing 11% dan 46% untuk pertumbuhan bakteri. Pupuk ZA memiliki unsur N yang lebih kecil dibandingkan dengan NPK dan tidak terdapat unsur fosfor sehingga pertumbuhan
sp. LTS 40 lebih sedikit dibandingkan kultur di dalam NPK. Berbeda dengan kombinasi molase dengan TSP dan urea, meskipun nitrogen di dalam urea cukup tinggi dan tersedia fosfor namun tidak menghasilkan pertumbuhan yang tinggi pula. Diduga karena fosfor yang terdapat dalam kombinasi tersebut dalam bentuk senyawa P2O5, sehingga membutuhkan waktu dan mekanisme untuk memecah senyawa tersebut agar fosfor dapat digunakan. Selain itu ketersediannya yang hanya 11%, lebih sedikit dibandingkan dengan NPK membuat pertumbuhan
sp. LTS 40 pada media kombinasi ini lebih kecil. Ketersediaan fosfor merupakan salah satu unsur penting dalam pertumbuhan bakteri. Bakteri memerlukan fosfor terutama dalam bentuk fosfat yang sebagai komponen struktur sel dan sebagai simpanan energi (Volk & Wheeler 1984). Menurut Goldman dan Dennett (2000) perbedaan rasio C:N yang ideal bagi pertumbuhan bakteri marin bervariasi tergantung pada keterbatasan nutrisi (karbon dan nitrogen).
Rachmawati (2007) melaporkan bahwa rasio C:N pada kombinasi molase dengan dan molase dengan terbaik pada rasio 1:1 Pertumbuhan sel bakteri lebih
tinggi pada kombinasi molase dengan dari pada kombinasi molase dengan dengan jumlah sel bakteri sebesar 12.3x108 sel/ml. Hasil ini menunjukkan bahwa kombinasi molase dengan pupuk NPK, ZA, TSP, dan urea lebih baik dari pada penggunaan kombinasi molase dengan atau dengan jumlah sel bakteri maksimum mencapai 5,4x1011 sel/ml pada kombinasi molase dengan NPK.
Lim (1998) menyatakan bahwa setiap bakteri memerlukan sumber karbon bagi pertumbuhannya dengan cara mengubah karbon tersebut menjadi material sel melalui proses asimilasi, bakteri heterotrof menggunakan senyawa organik sebagai sumber karbonnya. Sumber karbon yang dapat digunakan oleh bakteri ini diantaranya terdapat pada molase. Molase masih mengandung kadar gula sekitar 45 – 58% yang tersusun dari sukrosa, glukosa, fruktosa dan komponen lainnya sehingga masih dapat digunakan sebagi sumber karbon yang baik bagi pertumbuhan bakteri (Paturau 1982).
Kemampuan mikroorganisme untuk memperoleh energi pada kondisi heterotrof tergantung pada kemampuan metabolismenya untuk mengoksidasi senyawa karbon (bahan organik) sebagai sumber energi utama. Senyawa karbon dalam metabolime berperan untuk menghasilkan energi melalui oksidasi senyawa tersebut dan menyediakan unsur C untuk pembentukan material sel (Prescott
2000).
Dari uji kompetisi, persentase penghambatan dengan rasio inokulum 1:1 sudah cukup bagi sp. LTS 40 untuk
menghambat pertumbuhan pada
ketiga waktu inkubasi dengan persentase 82,9% pada jam ke524, 82,8% pada jam ke5 48, dan 83% pada jam ke572. Peningkatan persentase terjadi bersamaan dengan peningkatan rasio inokulum s sp. LTS 40 terhadap . Daya hambat paling tinggi dengan persen penghambatan mencapai 100% terjadi ketika rasio 1:10 pada semua lama waktu inkubasi (Gambar 3). Uji kompetisi dalam kultur cair ebih efektif dalam menghambat bakteri indikator karena bakteriosin dapat berkontak langsung dengan bakteri indikator. Hal ini menunjukkan bahwa
sp. LTS 40 dapat dijadikan sebagai bakteri probiotik untuk menanggulangi permasalahan dalam tambak udang yang mengakibatkan kematian massal udang pada tingkat larva akibat bakteri