BAYU ROSADI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi ‘Preservasi Ovarium, Isolasi dan Kultur Folikel In Vitro pada Domba” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Juni 2010
Bayu Rosadi NIM B061040041
BAYU ROSADI. Ovary Preservation, Isolation and Follicles In Vitro Culture in Ovine. Under Direction of ARIEF BOEDIONO, M AGUS SETIADI, AND DONDIN SAJUTHI.
Ovine ovary contains about 36.000 of preantral follicles of which only 0.01% ovulates in the reproductive life. In the last decades, many studies have been carried out focusing on preservation, isolation and culture of preantral follicles from several species ovaries. In this study the effect of cooling and freezing of ovine ovarian tissue were examined on follicles morphology, number and quality of the follicles. The follicles were isolated by different methods. The developmental competence of follicles cultured in vitro were evaluated post-preservation.
The study was carried out in 2 experiments. Experiment I, ovaries were maintained in PBS at -20 oC and room temperature (RT) for 24 h, and at 5 oC for 24 h and 72 h, and vitrification by 10, 20, 30 min equilibration time. After preservation and warming, the tissues were prepared for histological examination. Experiment 2, follicles isolated from fresh ovaries both mechanically and enzymatically. Then, preantral follicles were isolated from a) fresh ovaries (control), ovaries were stored at 5 oC for: b) 24 h , c) 48 h, d) 72 h, and vitrified cortex tissue (after 6 d in vitro culture). Preantral follicles (220-240 µm) were cultured in αMEM supplemented with 5% FCS, 100 mIU/ml r-FSH and ITS (consist of 5µg/ml insulin, 5 µg/ml transferin, 5 ng/ml selenium) up to ovulation stage.
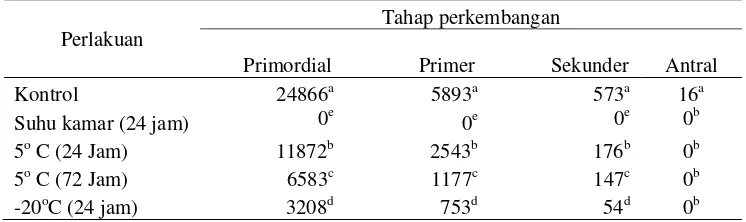
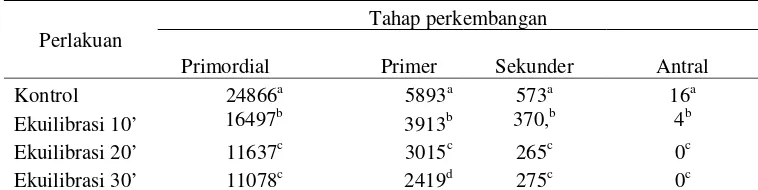
No follicle survived after 24 h storage at RT. The percentage of morphologically normal follicles was significantly reduced in ovarian tissue stored at -20 oC for 24 h and at 5 oC for 24 h and 72 h,5 oC for 24 h gave the better results. The antral follicles were damaged in all treatment. Exposing tissue to equilibration medium for 10 min had higher morphologically normal of cooled-warmed follicles, but had fewer morphologically normal follicles than fresh ovary. Experiment 2 shown that enzymatic method yielded more follicles than mechanic method, but fewer intact follicles. Follicle development up to ovulation of 5 oC storage for 24 h was equal to fresh follicles. Ovarium preserved at 5 oC for 48 h resulted in a less number of follicles that reach ovulation stage than others.Vitrification slighty reduced developmental competence in vitro.
We conclude that storage of ovine ovaries for up to 24 h at -20 oC, RT, and 5 oC declined the number of morphologically normal follicles, 5 oC storage gave the better results. Primordial follicles preserved their morphology intactness better than growing follicles. Good morphology of follicles was confirmed when exposing tissue to equilibration medium for 10 min before freezing. Ovary could be storage at 5 oC up to 48 h to maintain follicles viability. Vitrification slighty reduced follicle developmental competence in vitro.
Domba. Dibimbing oleh ARIEF BOEDIONO, M AGUS SETIADI, and DONDIN SAJUTHI.
Folikel merupakan unit struktural dan fungsional dasar dari ovarium mamalia yang menyediakan lingkungan mikro yang diperlukan untuk pertumbuhan dan maturasi oosit. Ovarium domba mengandung sekitar 36.ooo folikel preantral, diantaranya hanya 0,01% yang ovulasi sepanjang masa produktifnya. Dalam dekade terakhir, banyak penelitian telah dilakukan dengan fokus preservasi, isolasi, dan kultur folikel dari berbagai spesies. Pada penelitian ini, dipelajari pengaruh pendinginan dan pembekuan jaringan ovarium terhadap morfologi, jumlah dan kualitas folikel domba yang diisolasi dengan metode berbeda serta kompetensi perkembangan folikel in vitro pasca preservasi.
Penelitian ini dilaksanakan dalam 2 tahap. Pada tahap 1 dilakukan 2 eksperimen preservasi ovarium. Eksperimen 1, ovarium disimpan dalam larutan PBS pada suhu -20 oC dan suhu kamar selama 24 jam, dan suhu 5 oC selama 24 jam dan 72 jam. Setelah penyimpanan, folikel-folikel dievaluasi secara histologis. Dalam Eksperiment 2, cortex ovarium dipisahkan dari ovarium dan dibentuk dalam potongan berukuran ±1 mm3. Potongan jaringan diletakkan di atas hemistraw dan ditransfer ke larutan ekuilibrasi masing-masing selama 10, 20, dan 30 menit pada suhu kamar, selanjutnya dipindahkan ke larutan vitrifikasi selama 3 menit. Hemistraw beserta jaringan dicelupkan dalam nitrogen cair. Setelah penghangatan, jaringan dievaluasi secara histologis.
Pada tahap kedua dilakukan isolasi dan kultur in vitro folikel. Eksperimen 3, potongan cortex ovarium berukuran ± 1 mm3 diinkubasi dalam collagenase 1 mg/ml (C1) dan collagenase 2 mg/ml (C2) masing-masing selama 15, 30, 45, dan 60 menit. Folikel-folikel dari cacahan jaringan cortex juga diisolasi secara mekanik (M) menggunakan jarum 26G. Hasil isolasi dari ketiga perlakuan diamati dibawah mikroskop menggunakan pembesaran obyektif 40 kali. Eksperimen 4, folikel-folikel preantral diisolasi pada ovarium segar (kontrol), ovarium yang disimpan pada suhu 5 oC selama 24 jam 24), 48 jam 48), dan 72 jam (T5-72) dan jaringan cortex hasil vitrifikasi (V). Folikel-folikel berukuran 220-240 µm dikultur dalam medium αMEM disuplementasi 5% FCS, 100 mIU/ml r-FSH dan ITS (terdiri dari 5µg/ml insulin, 5 µg/ml transferin, 5 ng/ml selenium) sampai ovulasi.
Eksperimen 3 menunjukkan bahwa hasil isolasi folikel lebih banyak pada C1 dan C2 dibandingkan M (P<0,05), tetapi M memberikan jumlah folikel utuh lebih banyak dari C1 dan C2 (P<0,05). Pada Eksperimen 4 perkembangan folikel sampai ovulasi pada T5-24 tidak berbeda dengan kontrol (P<0,05) dan lebih baik dibandingkan perlakuan yang lain. Jumlah folikel hasil vitrifikasi yang mencapai ovulasi lebih rendah dibandingkan kontrol (P<0,05). Perlakuan T5-48 masih menghasilkan folikel yang mencapai ovulasi tetapi T5-72 tidak terdapat folikel yang tumbuh sampai ovulasi.
Disimpulkan bahwa penyimpanan ovarium domba selama 24 jam pada suhu -20 oC, suhu kamar, dan 5 oC menurunkan jumlah folikel dengan morfolologi normal, penyimpanan pada suhu 5 oC memberikan hasil lebih baik. Folikel-folikel primordial mempertahankan keutuhan morfologis lebih baik daripada folikel-folikel yang sedang tumbuh. Hasil vitrifikasi terbaik diperoleh dengan memaparkan jaringan cortex ke medium ekuilibrasi selama 10 menit. Hasil kultur in vitro menunjukkan bahwa ovarium dapat disimpan pada suhu 5 oC selama 48 jam. Vitrifikasi sedikit menurunkan kompetensi pertumbuhan folikel in vitro.
Kata kunci: isolasi folikel, preservasi, kultur in vitro, domba
© Hak cipta milik IPB, tahun 2010 Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan , penulisan kritik, atau tinjauan suatu masalah
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB.
BAYU ROSADI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Biologi Reproduksi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2010
Nama : Bayu Rosadi NIM : B061040041
Disetujui
Komisi Pembimbing
Prof. drh. Arief Boediono, Ph.D. Ketua
Dr. drh. M. Agus Setiadi Prof. drh. Dondin Sajuthi, MST, Ph.D. Anggota Anggota
Diketahui
Ketua Mayor Biologi Reproduksi Dekan Sekolah Pascasarjana
Prof. Dr. drh. Iman Supriatna Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
Penguji Luar Komisi pada : 1. Dr. drh. Ni Wayan Kurniani Karja, MS. Ujian Tertutup
2. Dr. drh. Ita Djuwita, M.Phil.
Penguji Luar Komisi pada : 1. Prof. Dr. drh. Tuty L Yusuf, MS. Ujian Terbuka
2. Prof. Dr. dr. Soegiharto Soebiyanto, SpOG (K)
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah memberikan rahmat dan hidayahNya sehingga penulis dapat menyelesaikan disertasi ini sebagai tugas akhir dalam studi program doktor di Institut Pertanian Bogor. Disertai ini berdasarkan hasil penelitian dengan topik ‘Preservasi Ovarium, Isolasi, dan Kultur Folikel In Vitro pada Domba’ yang dilaksanakan mulai November 2008 hingga Maret 2010.
Penulis mengucapkan terima kasih menyampaikan terima kasih kepada Prof. drh. Arief Boediono, Ph.D. selaku ketua komisi pembimbing, Dr. drh. M. Agus Setiadi dan Prof. drh. Dondin Sajuthi, MST, Ph.D. selaku anggota komisi pembimbing yang dengan penuh kesungguhan hati memberikan masukan dan arahan selama penelitian dan penulisan disertasi ini. Penulis juga menyampaikan terima kasih kepada Prof. Dr. drh. Mozes R. Toelihere, M.Sc. (Alm.) atas segala bimbingan yang pernah diberikan. Ungkapan terima kasih penulis sampaikan pula kepada Dr. Mulyoto Pangestu dan rekan-rekan beliau Dr. Sally Catt serta Dr. Sarah Jansen dari Monash Institute of Medical Research (Monash University), dan sahabat penulis dr. Jacqueline Sudiman yang membantu penulis selama melakukan penelitian di Melbourne. Ucapkan terima kasih penulis sampaikan juga kepada Dr. drh. Ita Djuwita, M.Phil. dan Dr. drh. Ni Wayan Kurniani Karja, MP selaku penguji luar komisi pada ujian tertutup, Prof. Dr. drh. Tuty L Yusuf, MS dan Prof. Dr. dr. Soegiharto Soebiyanto, SpOG(K) selaku penguji luar komisi pada ujian terbuka atas masukan berharga dalam menyempurnakan disertasi ini.
Ucapan terima kasih penulis sampaikan kepada Rektor, Dekan Sekolah Pascasarjana, Ketua Departemen KRP, dan Ketua Mayor Biologi Reproduksi yang berkenan menerima penulis untuk menempuh program doktor. Kepada seluruh staf pengajar penulis sampaikan terima kasih atas curahan ilmu dan menjadi teman diskusi yang menyenangkan dan konstruktif. Penulis mengucapkan terima kasih juga kepada seluruh staf admisitrasi di Mayor BRP dan SPs IPB atas segala pelayanan yang ramah selama ini. Ucapan terima kasih penulis sampaikan pula kepada Dekan Fakultas Peternakan dan Rektor Universitas Jambi yang telah memberikan ijin studi, dan Dirjen Dikti atas beasiswa yang diberikan.
memberikan ijin kepada penulis untuk memanfaatkan fasilitas yang ada di dalamnya.
Kepada rekan-rekan penulis, Dr. Ir. Thomas Mata Hine, M.Si, Dr. drh Enny T Setiatin, M.Sc., Ir. Satya Gunawan, MP, Sigit Prastowo, S.Pt., M.Si., Dr. drh. I Wayan Batan, M.Si. Raden Harry Murti, S.Si, Riris Lindiawati Puspitasari, S.Si, M.Si., Dwi Agustina, S.Si, M.Si, Nuril Farizah, S.Pi, M.Si, Hasbi, S.Pt dan Sri Agustina, S.Pt., M.Si, Irma Andriyani, S.Pi, M.Si, Dra. Ekayanti, M.Si, Tatan Kostaman, S.Si, s MP. serta semua rekan-rekan mahasiswa BRP atas persahabatan dan kerjasamanya. Demikian pula rekan-rekan dari Universitas Jambi, Dr.Yatno, S.Pt., M.Si., Dr. Ir. Suparjo, MP., Heru Handoko, S.Pt., M.Si., Ir. Agus Budiansyah, M.Si., Dr. Ir. Hutwan Syarifuddin, M.Si, dan Kuswanto, S.Pd atas segala dorongan moril dan bantuannya kepada penulis.
Akhirnya untuk isteri saya tercinta Anne Yulianingrum, S.Si, dan anak-anak tersayang Ayasy, Syamil, Igan, Adin, dan Dhiya, terima kasih atas pengertian, pengorbanan, dan do’a tulusnya. Terima kasih juga penulis sampaikan kepada Bapak dan Emak di Tasikmalaya yang telah membesarkan dan mendidik penulis, juga keluarga mertua Bapak Muhammad Rosyid (alm) di Ciomas atas segala dukungan moril dan ketulusan untuk ikut menjaga anak-anak saya.
Bogor, Juni 2010
Penulis dilahirkan di Tasikmalaya pada tanggal 10 Desember 1972 dari kedua orang tua Eros Rosadi dan Enah. Pendidikan Dasar dan Menengah Pertama ditempuh di Karangnunggal (Tasikmalaya), selanjutnya meneruskan pendidikan di SMAN 8 Bandung. Pendidikan sarjana diselesaikan pada tahun 1996 pada Fakultas Peternakan Universitas Jambi, penulis melanjutkan pendidikan magister di Program Studi Biologi Reproduksi Program Pascasarjana IPB tahun 1996 dan selesai tahun 1999. Penulis diterima sebagai staf pengajar pada Fakultas Peternakan Universitas Jambi tahun 1999. Sejak tahun 2004 hingga saat ini, penulis menempuh studi program doktor di program studi yang sama.
Beberapa karya yang dipublikasikan melalui jurnal atau seminar ilmiah selama pendidikan di Bogor adalah:
1. Rosadi B, Setiadi MA, Sajuthi D, Boediono A. 2010. Preservation, isolation, and developmental competence in vitro of ovine preantral follicles. Proceedings The First Congress of SEAVSA. Bogor July 20-22.
2. Rosadi B, Setiadi MA, Sajuthi D, Boediono A. 2010. Preservasi ovarium dan pengaruhnya terhadap morfologi folikel domba. Jurnal Veteriner (submitted). 3. Rosadi, B., MA Setiadi, D Sajuthi, A Boediono. 2008. Perkembangan
Embrio Mencit dan Hamster dalam Medium KSOMaa dan HECM-6. Jurnal Veteriner Vol 9 (4) : 157-162.
Gambaran Umum Perkembangan Folikel, Lingkungan dan Medium Kultur ... 7
Kultur Folikel Preantral ... 10
Regulator Perkembangan Folikel ... 12
Maturasi Oosit dan Ovulasi ... 14
Daftar Pustaka ... 17
PRESERVASI OVARIUM DAN PENGARUHNYA TERHADAP MORFOLOGI FOLIKEL ... 25
PRESERVASI, ISOLASI DAN KOMPETENSI PERTUMBUHAN IN VITRO FOLIKEL PREANTRAL DOMBA ... 41
Abstrak ... 41
Abstract ... 42
Pendahuluan ... 42
Koleksi dan Penyimpanan Ovarium ... 43
Vitrifikasi Ovarium ... 43
Kultur Jaringan Cortex Ovarium Pasca Vitrifikasi ... 44
Isolasi Folikel secara Mekanik ... 44
Isolasi Folikel secara Enzimatik ... 45
Kultur Folikel In Vitro ... 45
Pengamatan Diameter dan Maturasi Oosit ... 46
Analisis Data ... 46
Hasil dan Pembahasan ... 47
Isolasi Mekanik dan Enzimatik ... 47
Kompetensi Pertumbuhan In Vitro ... 51
Simpulan ... 63
Daftar Pustaka ... 63
PEMBAHASAN UMUM ... 69
SIMPULAN DAN SARAN UMUM ... 79
DAFTAR PUSTAKA ... 80
DAFTAR TABEL
Tabel Halaman
1. Bobot dan jumlah folikel ovarium domba ... 30
2. Persentase folikel dengan morfologi utuh setelah preservasi ... 31
3. Estimasi jumlah folikel dengan morfologi utuh perovarium setelah preservasi ... 35
4. Persentase folikel dengan morfologi utuh setelah uji toksisitas dan prosedur pendinginan-penghangatan ... 36
5. Estimasi jumlah folikel dengan morfologi utuh perovarium setelah setelah pendinginan-penghangatan……… 37
6. Hasil isolasi folikel secara mekanik dan enzimatik ... 49
7. Perkembangan folikel pada kultur in vitro ... 51
8. Lama kultur in vitro sampai ovulasi ... 59
9. Diameter folikel pada awal kultur dan saat ovulasi ... 60
10. Diameter oosit pada awal kultur dan saat ovulasi ... 61
DAFTAR GAMBAR
Gambar Halaman
1. Faktor-faktor yang terlibat dalam pengontrolan perkembangan folikel 13
2. Sinyal-sinyal intraovarian yang memediasi ovulasi pada mencit ... 16
3. Gambaran histologis folikel ... 32
4. Isolasi enzimatik jaringan korteks ovarium ... 37
5. Hasil isolasi folikel preantral ... 50
6. Perkembangan folikel in vitro ... 52
7. Folikel yang melekat ke dasar cawan kultur ... 53
DAFTAR LAMPIRAN
Lampiran Halaman
1. Medium transport dan penyimpanan ovarium ... 85
2. Medium vitrifikasi ... 86
3. Medium isolasi dan handling folikel ... 87
4. Medium kultur in vitro ... 89
PENDAHULUAN
Latar Belakang
Ovarium adalah organ reproduksi primer yang berfungsi sebagai penghasil sel gamet (oosit) dan hormon. Organ ini berfungsi penuh sepanjang masa produktif hewan dimulai dari masa pubertas. Kemampuan ovarium ini akan terhenti secara alamiah jika hewan mati. Masalah tersebut perlu mendapat perhatian terutama jika kematian terjadi pada hewan yang bernilai ekonomi tinggi atau hewan yang terancam punah. Dalam bidang reproduksi manusia, banyak peneliti memberikan perhatian pada upaya penyelamatan ovarium dari wanita-wanita penderita kanker. Seperti diketahui, ovarium sangat sensitif terhadap obat kanker kelompok alkilating agent (cyclophosphamide, busulfan, melphalan, chlorambucil, dacarbazine, procarbazine) yang diklasifikasikan memiliki resiko tinggi terhadap disfungsi gonad (Blumenfeld et al. 2000, Kenney et al. 2001, Tauchmanova et al. 2002). Untuk keperluan riset reproduksi manusia tersebut, ovarium domba dapat dijadikan sebagai model ovarium manusia karena persamaan ukuran dan kondisi jaringan (Oktay et al. 2000, Picton et al. 2008).
Pada kasus kematian hewan atau disfungsi ovarium akibat kemoterapi, sebenarnya ovarium masih dapat dimanfaatkan untuk produksi anak dengan mengaplikasikan teknologi reproduksi melalui produksi embrio in vitro. Salah satu cara yang bisa ditempuh adalah mengoptimalkan potensi folikel-folikel yang terkandung di dalamnya. Folikel merupakan struktur dasar dan unit fungsional ovarium mamalia yang menyediakan lingkungan mikro yang dibutuhkan untuk pertumbuhan dan maturasi oosit (Lucci et al. 2007).
maturasi, membentuk antrum yang terdiri dari lapisan sel theca di bagian luar dan lapisan sel granulosa di bagian dalam (Telfer et al. 2005, Nandi et al. 2009). Sementara itu oosit menyelesaikan meiosis I dan kemudian diovulasikan (Russel & Robker 2007). Kerr et al. (2006) menemukan bahwa jumlah folikel primordial relatif konstan sepanjang hidup hewan, hal ini disebabkan folikulogenesis yang aktif dan berkelanjutan dengan adanya germline stem cells postnatal di ovarium.
Pada tataran praktis, metode penyimpanan ovarium sebelum digunakan sebagai sumber folikel penting untuk diketahui karena sifat ovarium sebagai material biologis yang mudah rusak. Secara teknis hal ini dapat dipahami karena adanya kemungkinan ketidaksinkronan tersedianya ovarium dengan sistem produksi embrio in vitro pada satu waktu tertentu. Preservasi jangka pendek diperlukan untuk transportasi ovarium, terutama jika lokasi sumber ovarium jauh
dari laboratorium. Penyimpanan ovarium jangka pendek telah diteliti pada
kambing (Silva et al. 2000, Carvalho et al. 2001), domba (Matos et al. 2004), sapi (Lucci et al. 2004), babi (Lucci et al. 2007), dan anjing (Lopes et al. 2009, Lima et al. 2010). Pada penelitian-penelitian tersebut, suhu 4, 20 dan 39 oC dicoba untuk preservasi folikel preantral. Secara umum hasilnya menunjukkan bahwa
suhu 4 oC memungkinkan preservasi folikel selama 18 atau 24 jam, sedangkan
pada suhu 20 oC mampu mempreservasi folikel selama 4 atau 6 jam.
Kriopreservasi potongan jaringan cortex atau ovarium utuh yang memungkinkan penyimpanan jaringan ovarium jangka panjang diaplikasikan diantaranya untuk mempertahankan fungsi ovarium, mempertahankan spesies yang terancam punah, dan menyelidiki fenomena folikulogenesis awal (Onions et al. 2008). Pada penelitian ini akan dicoba metode penyimpanan ovarium domba
pada berbagai tingkat suhu yaitu 25 oC (suhu kamar), 5oC, -20 oC, dan -196 oC (vitrifikasi).
Identifikasi faktor-faktor yang mendorong pertumbuhan dan perkembangan folikel atau mendorong atresia menjadi satu tujuan utama dalam penelitian-penelitian folikulogenesis (Picton et al. 2008). Model rodensia adalah yang paling maju dalam penelitian perkembangan folikel in vitro. Sampai saat ini, mencit adalah satu-satunya spesies yang dapat melewati proses kultur in vitro yang komplit mulai tahap primordial sampai diperoleh anak (Cortvrindt et al. 1996, O’ Brien et al. 2003, Dole et al. 2008). Pada domba upaya produksi anak dengan titik awal folikel preantral melalui kultur in vitro tanpa kombinasi dengan metode kultur lain belum berhasil dilakukan (Nandi et al. 2009, Picton et al. 2008).
Tujuan Penelitian
Penelitian ini bertujuan mempelajari pemanfaatan ovarium untuk menghasilkan oosit matang pada domba dengan memperhatikan aspek preservasi ovarium, isolasi, kultur dan maturasi folikel dan oosit.
Tujuan khusus dari penelitian ini adalah:
a. mempelajari pengaruh suhu dan lama penyimpanan terhadap gambaran morfologis folikel-folikel dalam ovarium domba.
b. mempelajari kompetensi tumbuh in vitro folikel-folikel setelah perlakuan penyimpanan.
c. mendapatkan informasi tentang lama kultur folikel preantral sampai terbentuk ovulasi.
Manfaat Penelitian
DAFTAR PUSTAKA
Blumenfeld Z, Shapiro D, Shteinberg M, Avivi I, Nahir M. 2000. Preservation of fertility and ovarian function and minimizing gonadotoxicity in young women with systemic lupus erythematosus treated by chemotherapy. Lupus 9:401–405.
Cortvrindt R, Smitz J, Van Steirteghem AC. 1996. In vitro maturation, fertilization and embryo development of immature oocytes from early preantral follicles from prepubertal mice in a simplified culture system. Hum Reprod 11 2656–2666.
Demeestere I, Centner J, Gervy C, Englert Y, Delbaere A. 2005. Impact of various endocrine and paracrine factor on in vitro culture of preantral follicles in rodents. Reproduction 130:147-156.
Dole G, Nillson EE, Skinner MK. 2008. Glial-derived neurotrophic factor promotes ovarian primordial follicle development and cell-cell interaction during folliculogenesis. Reproduction 135 : 671-682.
Kenney LB, Laufer MR, Grant FD, Grier H, Diller L. 2001 High risk of infertility and long term gonadal damage in males treated with high dose cyclophosphamide for sarcoma during childhood. Cancer 91:613–621.
Kerr JB, Ducket R, Myers M, Britt KL, Mladenovska T, et al. 2006. Quantification of healthy follicles in the neonatal and adult mouse ovary: evidence for maintenance of primordial follicle supply. Reproduction 132: 95-109.
Lima GL, Costa LLM, Cavalcanti DMLP, Rodrigues CMF, Freire FAM et al. 2010. Short-term storage of canine preantral ovarian follicles using a powdered coconut water (ACP1)-based medium. Theriogenology doi:10.1016/j.theriogenology.2010.01.025
Lopes CAP, Santos RR, Celestinoa JJH, Meloa JAP, Chaves RN, et al.. 2009. Short-term preservation of canine preantral follicles: Effects of temperature, medium and time. Anim Reprod Sci 115: 201–214.
Lucci CM, Schreier LL, Machado GM, Amorim CA, Bao SN, Dobrinsky JR. 2007. Effects of storing pig ovaries at 4 or 20 oC for different periods of time on the morphology and viability of pre-antral follicles. Reprod Dom Anim 42: 76–82.
Nandi S, Kumar VG, Ramesh HS, Manjunatha BM, Gupta PSP. 2009. Isolation and culture of ovine and bubaline small and large pre-antral follicles: Effect of cyclicity and presence of a dominant follicle. Reprod Dom Anim 44: 74– 79.
O’Brien MJ, Pendola JK, Eppig JJ. 2003. A revised protocol for in vitro development of mouse oocytes from primordial follicles dramatically improves their developmental competence. Biol Reprod 68: 1682-1686.
Onions VJ, Mitchell MRP, Campbell BK, Webb R. 2008. Ovarian tissue viability following whole ovine ovary cryopreservation: assessing the effects of sphingosine-1-phosphate inclusion. Hum Reprod 23 (3 ):. 606–618.
Oktay K, Karlikaya GG, Aydin BA. 2000. Ovarian cryopreservation and transplantation: basic aspects. Mol Cell Endocrinol 169:105–108.
Oktem O, Oktay K. 2007. The role of extracellular matrix and activin-A in vitro growth and survival of murine preantral follicles. Reprod Sci 14 (4): 358-366.
Picton HM, Harris SE, Muruvi W, Chambers EL. 2008. The in vitro growth and maturation of follicles. Reproduction 136: 703–715.
Rosadi B, Setiadi MA, Sajuthi D, Boediono A. 2010. Preservation, isolation, and developmental competence in vitro of ovine preantral follicles. Proceedings The First Congress of SEAVSA. Bogor July 20-22.
Russell DL, Robker RL. 2007.
Molecular mechanisms of ovulation:co-ordination through the cumulus complex. Hum Reprod Update 13(3): 289– 312.
Tauchmanova L, Selleri C, De Rosa G, Pagano L, Orio F et al. 2002. High prevalence of endocrine dysfunction in longterm survivors after allogeneic bone marrow transplantation for hematologic diseases. Cancer 95: 1076– 1084.
TINJAUAN PUSTAKA
Preservasi Ovarium
Preservasi jangka pendek ovarium diperlukan untuk transportasi ovarium,
terutama jika lokasi sumber ovarium jauh dari laboratorium. Teknik penyimpanan
ovarium jangka pendek telah dicoba pada kambing (Silva et al. 2000, Carvalho et al. 2001), pada sapi (Lucci et al. 2004), babi (Lucci et al. 2007), dan anjing (Lopes et al. 2009, Lima et al. 2010). Secara umum hasilnya menunjukkan bahwa suhu 4 oC memungkinkan preservasi folikel selama 18 atau 24 jam, sedangkan
pada suhu 20 oC mampu mempreservasi folikel selama 4 atau 6 jam.
Kriopreservasi potongan jaringan cortex atau ovarium utuh
memungkinkan penyimpanan jaringan ovarium jangka panjang. Kriopreservasi
diaplikasikan diantaranya untuk mempertahankan fungsi ovarium,
mempertahankan spesies yang terancam punah, dan menyelidiki fenomena folikulogenesis awal (Onions et al. 2008). Bagi pasien penderita kanker yang menjalani kemoterapi, kriopreservasi adalah alternatif untuk mempertahankan fungsi ovarium (Amorim et al. 2009). Kriopreservasi jaringan ovarium merupakan satu-satunya pilihan yang tersedia bagi wanita yang belum pubertas dan wanita yang tidak dapat menunda awal kemoterapi (Gosden et al. 2002). Jaringan ovarium dapat dibekukan mengunakan tiga pendekatan berbeda: sebagai fragmen cortex ovarium (Tsuribe et al. 2009, Muruvi et al. 2009), sebagai keseluruhan ovarium (Bedaiwy et al. 2006, Onions et al. 2008) atau folikel-folikel terisolasi (Donnez et al. 2006).
Candy et al. 1997, Gunasena et al. 1997). Litter size yang diperoleh dari grafting ovarium hasil kriopreservasi setara dengan grafting ovarium segar (Candy et al. 2000).
Beberapa metode kripopreservasi pada saat ini adalah metode konvensional dengan metode pendinginan lambat (slow freezing) dan pendinginan cepat (rapid freezing) serta metode vitrifikasi sebagai alternatif. Vitrifikasi adalah proses pemadatan cairan yang mengandung krioprotektan konsentrasi tinggi pada suhu -196 oC tanpa pembentukan kristal es sehingga terlihat seperti kaca (Rall & Fahy 1985). Pada metode vitrifikasi konsentrasi krioprotektan yang digunakan lebih tinggi dan laju pendinginan lebih cepat, tidak menimbulkan terbentuknya kristal serta tidak membutuhkan perlatan khusus (Yoeman et al. 2005). Metode vitrifikasi dapat mempertahankan viabilitas folikel preantral lebih baik dibandingkan metode pembekuan konvensional (Chen et al. 2006).
Penggunaan konsentrasi krioprotektan yang tinggi menyebabkan tingginya tingkat toksisitas (Chen et al. 2006). Etilen glikol (EG) merupakan salah satu krioprotektan yang paling rendah tingkat toksisitasnya, daya permeasi cepat sehingga sangat baik digunakan sebagai krioprotektan. Di samping EG, krioprotektan lain yang sering digunakan sebagai kombinasinya adalah dimetilsulfoksida (DMSO) (Lucci et al. 2007).
Gambaran Umum Perkembangan Folikel, Lingkungan dan Medium Kultur
Folikel primordial terdiri dari oosit kecil yang dikelilingi oleh lapisan sel tunggal sel-sel granulosa pipih terletak di membrana basalis. Ketika folikel mulai tumbuh, oosit akan membesar dan sel-sel somatik ekspansi membentuk sel-sel granulosa mural dan sel-sel cumulus dalam folikel de Graaf (Gougeon 1996). Membrana basalis memisahkan folikel dari sel-sel stroma termasuk prekursor lapisan sel-sel theca. Ukuran yang kecil, kurangnya organel-organel sitoplasma dan ketiadaan spindle apparatus membedakan oosit-oosit primordial dari oosit tahap metafase II dan hal ini menguntungkan untuk penyimpanan suhu rendah (Gosden et al. 2002). Folikel-folikel primordial melimpah pada ovarium muda, menurun secara eksponensial seiring umur dan bervariasi sesuai bobot tubuh pada berbagai spesies (Gosden dan Telfer 1987).
Sebagian besar folikel-folikel primordial tidak berkembang lebih lanjut atau gagal mencapai ukuran ovulasi. Pada ovarium rodensia prapubertas kurang lebih setengah dari folikel berdegenerasi (atresia), proses tersebut tampak lebih jelas pada folikel antral. Atresia folikel ini melibatkan apoptosis (Tilly 1999). Kemungkinan apoptosis dimulai pada sel-sel kecambah folikel-folikel primordial dan tidak tergantung level gonadotropin, sedangkan pada tahap preantral besar dan antral proses tersebut tergantung pada gonadotropin dan ketiadaan hormon menginisiasi apoptosis sel-sel granulosa sebelum oosit dipengaruhi (Gosden et al. 2002).
(Picton et al. 2008). Perbedaan-perbedaan ini sangat relevan ketika mengembangkan sistem yang mendukung pertumbuhan dan maturasi folikel dan oosit.
Dalam kultur folikel in vitro diperlukan optimasi pH, suhu dan oksigen untuk memaksimalkan potensi oosit-oosit yang dihasilkan (Ye et al. 2007). Sebagai contoh, meskipun jaringan ovarium marmut dipaparkan ke level oksigen plasma sekitar 5% in vivo, folikel mencit yang ditumbuhkan in vitro dalam 5% oksigen menghasilkan lebih banyak oosit matang dengan kelainan kromosom dan banyak yang mati secara prematur dibandingkan folikel yang dikultur dalam 20% oksigen (Hu et al. 2001). Hal serupa terjadi pada domba, folikel-folikel domba yang ditumbuhkan dalam 5% oksigen menurunkan pembentukan antrum dan meningkatkan konsumsi laktat dan glukosa dibandingkan dengan 20% oksigen (Jin et al. 2007). Suhu medium yang digunakan untuk transportasi dan penanganan sebelum pemanenan harus dioptimalkan untuk meminimalkan apoptosis (Schmidt et al. 2003, Lucci et al. 2004)
Sejumlah sistem kultur yang berbeda telah dicoba untuk menumbuhkan folikel dari spesies-spesies yang memiliki perbedaan spesifik spesies. Pada semua protokol kultur folikel in vitro, penting untuk mengoptimalisasi: i) suplai nutrien, elektrolit, antioksidan, asam-asam amino, substrat energi, vitamin, dan growth factor; ii) penghilangan produk-produk sisa seperti ammonia yang dapat terakumulasi karena produk sisa metabolisme ini dapat menekan pertumbuhan folikel (Kerr et al. 2006). Berbagai medium dasar telah dipakai untuk kultur folikel dari spesies yang berbeda diantaranya minimum essential medium (MEM) (Cortvrindt et al. 1996, Kerr et al. 2006), Waymouth medium (Muruvi et al. 2005) dan Mc Coy’s medium (Telfer et al. 2008). Medium-medium basal tersebut perlu dilengkapi bahan-bahan tambahan yaitu antibiotik/antimikotik; sediaan komersial insulin, transferrin, dan selenium (Wright et al. 1999).
dan manusia (Roberts et al. 2002) lebih cenderung memetabolisme piruvat dan punya sedikit kapasitas untuk metabolisme glukosa. Oosit mencit diketahui berkemampuan tinggi untuk mengkonsumsi piruvat dan oksigen pada semua tahap perkembangan folikel (Harris et al. 2008) sedangkan konsumsi glukosa berada di bawah level yang dapat dideteksi (Harris et al. 2007).
Kultur Folikel Preantral
Penelitian-penelitian yang dilakukan untuk mengkultur folikel dengan berbagai metode lebih intensif dilakukan pada rodentia sebagai model dan telah dicapai beberapa keberhasilan (Picton et al. 2008). Kemajuan dalam kultur folikel rodensia sulit direplikasikan pada ruminansia dan manusia. Salah satu alasan utama kurangnya kemajuan adalah kesulitan teknis yang lebih besar untuk mengisolasi folikel sebab jaringan cortex lebih padat dan fibrous (Telfer 1996) dan isolasi folikel seringkali membutuhkan protokol berbasis enzim yang agresif (Demeestere et al. 2002).
Keberhasilan kultur folikel preantral terkendala oleh kompleksitas sinyal-sinyal, interaksi sel-sel dan sel-stroma yang diperlukan untuk menduklung pertumbuhan folikel-folikel tahap awal (Demeestere et al. 2005). Dalam dekade terakhir kemajuan dicapai pada teknik kultur dua dimensi untuk mernumbuhkan folikel preantral in vitro (Von Wolff et al. 2009, Cortvrindt et al. 1996, Liu et al. 2001). Folikel-folikel yang dikultur dalam sistem dua dimensi harus melekat ke pemukaan kultur datar dimana sel-sel somatik bermigrasi dari oosit merubah struktur tiga dimensi asal merusak interaksi sel-sel somatik-gamet yang penting untuk pertumbuhan oosit normal (West et al. 2007). Walaupun demikian, pada mencit seluruh tipe sel folikel tetap kontak dan respon terhadap stimulasi gonadotropin dipertahankan (Picton et al. 2008).
membran berpori (Nayudu dan Osborn 1992) atau dalam microdrop medium dibawah mineral oil dengan 75% folikel menghasilkan oosit tahap metafase 2 (Demeestere et al. 2002). Penambahan hCG dalam medium menghasilkan 80% folikel yang ovulasi in vitro (Rose et al. 1999).
Sistem kultur in vitro tiga dimensi yang menyerupai arsitektur internal ovarium tampaknya optimal untuk mendukung pertumbuhan folikel dan maturasi oosit. Beberapa tahun terakhir, telah dibuktikan kemungkinan untuk memelihara integritas tiga dimensi dari folikel ruminansia (Newton et al. 1999, Gutierrez et al. 2000, Thomas et al. 2007) dan folikel manusia (Picton et al. 1999, Telfer et al. 2008). Filosofi sistem ini adalah mengkultur sel granulosa dalam formasi dan bentuk yang menyerupai morfologi (Chang et al. 1977) dan fenotipe steroidogenik sel-sel granulosa in vivo (Picton et al. 1999) dibandingkan karakter fibroblastik karena perlekatan dengan permukaan cawan kultur. Sistem yang spesifik spesies ini mempertahankan integritas folikel dan folikel tetap dalam ultrastruktur normalnya (Jin et al. 2004). Dengan menggunakan sistem ini, pertumbuhan folikel dapat dimanipulasi dengan ada atau tidaknya lapisan sel theca seperti halnya komponen membrana basalis dalam medium kultur. Sel-sel theca mempunyai efek biokimia terhadap pertumbuhan dan perkembangan oosit in vitro yang dimediasi oleh sel-sel granulosa (Richard & Sirard 1996).
Sistem kultur folikel tiga dimensi dengan menggunakan alginat mendukung pertumbuhan dan maturasi folikel-folikel sekunder (Kreeger et al. 2006, Xu et al. 2009). Sistem ini menghasilkan oosit yang kompeten dan dapat difertilisasi serta menghasilkan keturunan yang normal (Xu et al. 2006a). Konsentrasi matrix hidrogel alginat dapat dimodifikasi untuk mendukung pertumbuhan folikel sekunder awal (Xu et al. 2006b).
Isolasi mekanik dan kultur in vitro juga telah dicoba pada folikel manusia (Abir et al. 1997) walaupun tingkat atresia setelah kultur tinggi. Telfer et al. (2008) mengisolasi folikel preantral manusia secara mekanik dari jaringan cortex setelah jaringan dikultur selama 6 hari. Folikel dikultur lanjut secara individual, pembentukan antrum terjadi dengan cepat yaitu dalam dua hari.
Regulator Perkembangan Folikel
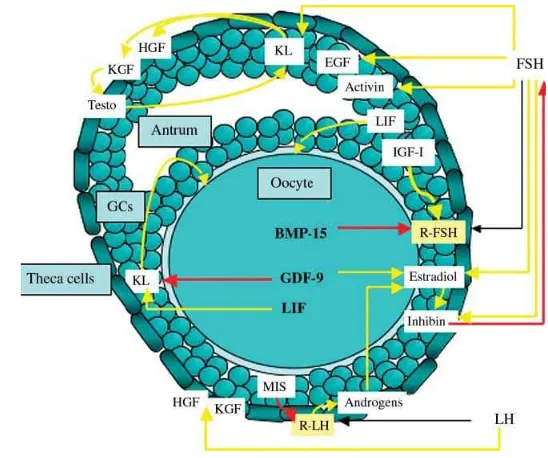
Folikulogenesis merupakan proses perkembangan yang kompleks yang diatur oleh berbagai faktor endokrin, parakrin, dan autokrin (Thomas et al. 2003, Demeestere et al. 2005, Gambar 1.), juga koneksi sel-sel dan sel-matriks intraovarian (Irving-Rodgers & Rodgers 2005). Interaksi antarsel yang krusial bagi pertumbuhan diantaranya antara sel-sel theca dan sel-sel granulosa. Sel-sel theca diketahui memproduksi transforming growth factors (TGFs) α dan β, hepatocyte growth factor (HGF), dan keratinocyte growth factor (KGF) untuk mengatur pertumbuhan dan fungsi sel-sel granulosa (Nilsson et al. 2001, Demeestere et al. 2005). Sebaliknya sel-sel granulosa memproduksi kit ligand yang mengatur pertumbuhan sel-sel theca dan menstimulasi produksi TGFs, HGF, dan KGF (Parrot et al. 1998, Nilsson et al. 2001).
insulin-like growth factor (IGF) dan protein-protein pengikatnya (Thomas et al. 2007), anggota-anggota TGFβ (Knight & Glister 2006).
Gambar 1. Faktor - faktor yang terlibat dalam pengontrolan perkembangan folikel : efek
negatif(anak panah merah), efek positif (anak panah kuning). GDF, growth
differentiation factor-9; KGF, keratinocyte growth factor; GH, growth hormone; IGF-I,
insulin growth factor-I; KL, kit ligand; LIF, leukemia inhibitory factor; EGF, epidermal
growth factor; BMP-15, bone morphogenic protein-15; HGF, hepatocyte growth factor;
MIS, mullerian-inhibiting substance; FSH, follicle-stimulating hormone; LH,
luteinizing hormone; R-LH dan R-FSH, receptors for LH dan FSH; Testo, testosterone;
GCs, granulosa cells. (Demesteere et al. 2005).
Beberapa anggota TGFβ (Transforming Growth Factor) superfamily mempunyai peran penting selama perkembangan folikel. TGF-TGF ini diproduksi baik oleh oosit maupun sel-sel somatik di sekelilingnya (sel-sel theca dan granulosa). Pro-protein convertase adalah anggota dari tujuh protein yang dikenal yang memproses ligan-ligan TGF serta produk yang disekresikan lainnya ke bentuk aktifnya (Diaz et al. 2007)
yang tergantung FSH (Shimasaki et al. 2004), dan mendorong biosintesis kolesterol dalam sel-sel cumulus (Su et al. 2008). Activin A telah dibuktikan dapat meningkatkan proliferasi sel-sel granulosa dalam kultur folikel in vitro tikus (Li et al. 1995), meningkatkan perkembangan folikel primordial manusia untuk membentuk folikel antral dengan oosit yang utuh (Telfer et al. 2008).
Faktor lain yang diketahui dapat mendorong perkembangan folikel preantral adalah EGF. Konsentrasi fisiologis EGF pada kultur folikel mencit adalah 1 ng/ml, pada konsentrasi ini EGF meningkatkan jumlah folikel yang mencapai tahap antral (Demeestere et al. 2005). Perlakuan EGF pada sel-sel granulosa dan folikel-folikel menghambat onset spontan cleavage DNA apoptosis selama kultur sebesar 40-60% melalui jalur tirosin kinase. EGF juga berperan dalam memediasi aksi LH dalam proses ovulasi (Park et al. 2004, Ashkenazi et al. 2005). Dole et al. (2008) menemukan bahwa suatu faktor yang disebut glial-derived neurotrophic factor (GDNF) mendorong perkembangan folikel primordial dan memediasi interaksi sel-sel autokrin dan parakrin yang diperlukan selama folikulogenesis.
Maturasi Oosit dan Ovulasi
Pada mamalia, meiosis terjadi dalam waktu yang panjang. Oogonia mengalami meiosis tetapi terhenti pada tahap diploten profase pertama (Eppig et al 2004). Meiosis akan dimulai kembali akibat pengaruh LH dari kelenjar pituitari selama siklus estrus atau menstruasi beberapa saat sebelum ovulasi. Proses oosit menyelesaikan pembelahan meiosis pertama dan mengalami perubahan sitoplasma kemudia berlanjut ke metafase II dikenal dengan maturasi oosit (Mehlmann 2005).
profase I (Eppig et al. 2004). Meiotic arrest tersebut diatur oleh level cAMP dalam oosit (Conti et al. 2002, Eppig et al. 2004).
Reseptor-reseptor LH berada di sel-sel granulosa mural tetapi tidak ada di sel-sel cumulus atau oosit (Peng et al. 1991, Eppig et al. 1997) sehingga mekanisme stimulasi maturasi oosit oleh LH bersifat tidak langsung. Aksi LH terhadap sel-sel granulosa mural diterjemahkan ke dalam perubahan molekul-molekul sinyal di dalam oosit untuk menginisiasi pembelahan meiosis (Mehlmann 2005). Sebelum pertengahan siklus surge LH, oosit yang sedang tumbuh membutuhkan kemampuan untuk melakukan proses maturasi. Kemampuan tersebut diperoleh di sekitar waktu pembentukan antrum (Mehlmann et al. 2004) dan berkaitan dengan pencapaian level ambang protein-protein yang mempromosi maturasi seperti CDK1 (cyclin-dependant kinase) dan cyclin pada oosit (Kanatsu-Shinohara et al. 2000).
Mekanisme aksi LH pada sel-sel granulosa kemudian menggertak oosit memulai meiosis belum diketahui (Mehlmann 2005). Beberapa penelitian menunjukkan bagaimana sinyal LH ditransmisikan dari eksterior ke interior folikel. Sel-sel granulosa mural mengekspresikan RNA yang mengkode protein-protein epidermal growth factor (EGF)-like dalam 1–3 jam setelah stimulasi reseptor LH (Park et al. 2004, Ashkenazi et al. 2005). Protein-protein tersebut khususnya amphiregulin dan epiregulin, mendorong proses maturasi oosit baik yang masih ada dalam folikel maupun cumulus oocyte complex (COC) di luar folikel (Coticchio et al. 2004, Mehlmann 2005). Protein-protein tidak dapat mendorong maturasi pada oosit tanpa sel-sel cumulusnya (Mehlmann 2005). Park et al. (2004) melaporkan bahwa penghambatan secara farmakologis reseptor EGF pada folikel yang dikultur menghambat maturasi oosit yang diinduksi LH.
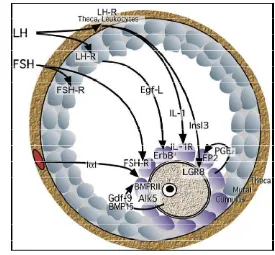
Bersaman dengan proses maturasi akhir dari oosit, inisiasi ovulasi juga berlangsung. Ovulasi in vivo terjadi karena kombinasi antara mekanisme yang meliputi: (a) mekanisme neuroendokrin dan endokrin, LH-RH, steroid, dan prostaglandin; (b) mekanisme neurobiokimia dan farmakologi; (c) mekanisme neuromuscular dan neurovascular, dan interaksi enzimatik (Hafez 1993). Ovulasi dimediasi oleh sinyal-sinyal intraovarian yang kompleks (Russel & Robker 2007, Gambar 2).
Gambar 2. Sinyal-sinyal intraovarian yang memediasi ovulasi pada mencit. Gdf-9, growth and differentiation factor-9; BMP-15, bone morphogenetic protein-15; PGE2,
prostaglandin E2; EP2, PGE2 receptor. LH-R, luteinizing hormone receptor; FSH-R,
follicle-stimulating hormone receptor; ErbB, Egf receptor family; Alk5, activin receptor-like kinase-5; BMPRII, BMP receptor type-II; LGR8, Insl3 receptor; IL-1R,
interleukin-1 receptor. (Russell & Robker 2007)
LH surge dari hipotalamus menginisiasi sinyal-sinyal sekunder dari folikel
yang terpusat pada COC. Di kompartemen theca. LH bekerja pada sel-sel theca
atau leukosit untuk menginduksi sekresi Insl-3 dan IL-1. Di lapisan granulosa
mural, Egf-L (ampiregulin, epiregulin dan betacellulin) diproduksi dan
mentranduksi sinyal ovulasi ke sel-sel cumulus. FSH bekerja secara langsung
memasuki cumulus complex dari sirkulasi. Di dalam COC, GDF-9 dan atau
BMP-15 dari oosit mempengaruhi sel-sel cumulus secara parakrin melalui dimer
reseptor Alk5/BMPRII. Prostaglandin E2 (PGE2) bekerja secara autokrin melalui
reseptor PGE2 (EP2)(Russel & Robker 2007).
DAFTAR PUSTAKA
Abir R, Roizman P, Fisch B, Nitke S, Okon E, et al. 1999. Pilot study of isolated early human follicles cultured in collagen gels for 24 hours. Hum Reprod 14: 1299–1301.
Allan CM, Wang Y, Jimenez M, Marshan B, Spaliviero J, et al. 2006. Follicle-stimulating hormone increase primordial follicle reserve in mature female hypogonadal mice. Endocrinology 188: 549-557.
Amorim CA, Van Langendonckt A, David A, Dolmans MM, Donnez J. 2009. Survival of human pre-antral follicles after cryopreservation of ovarian tissue, follicular isolation and in vitro culture in a calcium alginate matrix. Hum Reprod 24(1): 92–99.
Ashkenazi H, Cao X, Motola S, Popliker M, Conti M, et al. 2005. Epidermal growth factor family members: endogenous mediators of the ovulatory response. Endocrinology 146: 77-84.
Attisano L, Carcamo J, Ventura F, Weis FM, Massague J, et al. 1993. Identification of human activin and TGF beta type I receptors that form heteromeric kinases complexes with type II receptors. Cell 75: 671-680.
Baird DT, Webb R, Campbell BK, Harkness LM, Gosden RG. 1999. Long-term ovarian function in sheep after ovariectomy and transplantation of autografts
stored at -196oC. Endocrinology 140:462–471.
Bedaiwy MA, Hussein MR, Biscotti C, Falcone T. 2006. Cryopreservation of intact human ovary with its vascular pedicle. Hum Reprod 21 (12): 3258– 3269.
Candy CJ, Wood MJ, Whittingham DG. 1997. Effect of cryoprotectants on the survival of follicles in frozen mouse ovaries. J Reprod Fertil 110:11-19. Candy CJ, Wood MJ, Whittingham DG. 2000. Restoration of a normal
reproductive lifespan after grafting of cryopreserved mouse ovaries. Hum Reprod 15:1300-1304.
times on the quality of goat preantral follicles preserved in situ. Anim. Reprod Sci 66: 195–208.
Chang SCS, Anderson W, Lewis JC, Ryan RJ, Kang YH. 1977. The porcine ovarian follicle. II. Electron microscopic study of surface features of granulosa cells at different stages of development. Biol Reprod 16: 349– 357.
Chen SU, Chien CL, WuMY, Chen TH, Lai SM, et al. 2006. Novel direct cover vitrification for cryopreservation of ovarian tissues increases follicle viability and pregnancy capability in mice. Hum Reprod 21(11): 2794– 2800.
Conti M, Andersen CB, Richard F, Mehats C, Chun SY, et al. 2002. Role of cyclic nucleotide signaling in oocyte maturation. Mol Cell Endocrinol 187:153–159.
Cortvrindt R, Smitz J, Van Steirteghem AC. 1996. In vitro maturation, fertilization and embryo development of immature oocytes from early preantral follicles from prepubertal mice in a simplified culture system. Hum Reprod 11: 2656–2666.
Coticchio G, Rossi G, Borini A, Grøndahl C, Macchiarelli G, et al. 2004. Mouse oocyte meiotic resumption and polar body extrusion in vitro are differentially influenced by FSH, epidermal growth factor and meiosis-activating sterol. Hum Reprod 19 2913–2918.
Cox SL, Shaw J, Jenkin G. 1996. Transplantation of cryopreserved fetal ovarian tissue to adult recipient in mice. J Reprod Fertil 107: 315-322.
Donnez J, Martinez-Madrid B, Jadoul P, Van Langendonckt A, Demylle D, et al. 2006. Ovarian tissue cryopreservation and transplantation: a review. Hum Reprod Update 12 (5): 519–535.
Demeestere I, Centner J, Gervy C, Englert Y, Delbaere A. 2005. Impact of various endocrine and paracrine factor on in vitro culture of preantral follicles in rodents. Reproduction 130:147-156.
Diaz FJ, Wigglesworth K, Eppig JJ. 2007. Oocytes are required for the preantral granulosa cell to cumulus cell transition in mice. Dev Biol 305: 300–311. De Jong FH, Welschen R, Hermans WP, Smith SD, van der Molen HJ. 1979.
Effects of factors from ovarian follicular fluid and Sertoli cell culture medium on in vivo and in vitro release of piyuitary gonadotrophins in the rat: an evaluation of systems for assay of inhibin. J ReprodFertil 26: 47-59. Dole G, Nillson EE, Skinner MK. 2008. Glial-derived neurotrophic factor
Eppig JJ, Vivieros MM, Marin-Bivens C, De La Fuente R. 2004. Regulation of mammalian oocyte maturation. In The Ovary, pp 113–129. Eds PCK Leung & EY Adashi. Amsterdam: Elsevier Academic Press.
Eppig JJ, Wigglesworth K, Pendola F, Hirao Y. 1997. Murine oocytes suppress expression of luteinizing hormone receptor messenger ribonucleic acid by granulosa cells. Biol Reprod 56: 976–984.
Eppig JJ, Wigglesworth K, O’Brien MJ. 1992. Comparison of embryonic development competence of mouse oocytes grown with and without serum. Mol Reprod Dev 32: 33-34.
Fair T, Hulshof SCJ, Hyttel P, Greve T. 1997. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anat Embryo 195: 327–336.
Filali M, Hesters L, Franchin R, Tachdjian G, Frydman R, et al. 2008. Retrospective comparison of two media for in vitro maturation of oocytes. Reprode Biomed Online 16: 250–256.
Gandolfi F, Milanesi E, Pocar P, Luciano AM, Brevini TA, et al. 1998. Comparative analysis of calf and cow oocytes during in vitro maturation. Mol Reprod Dev 49: 168–175.
Ge HS, Huang XF, Zhang W, Zhao JZ, Lin JJ, et al. 2008. Exposure to human chorionic gonadotrophin during in vitro maturation does not improve the maturation rate and developmental potential of immature oocytes from patients with polycystic ovary syndrome. Fertil Steril 89: 98–103.
Gougeon A. 1996. Regulation of ovarian follicular development in primates – facts and hypotheses. Endoc Rev 17: 121–155.
Gunasena KT, Lakey JR, Villines PM. 1997. Allogeneic and xenogeneic transplantation of cryopreserved ovarian tissue to athymic mice. Biol Reprod 57: 226-231.
Gutierrez CG, Ralph JH, Telfer EE, Wilmut I, Webb R. 2000. Growth and antrum formation of bovine preantral follicles in long-term culture in vitro. Biol Reprod 62: 1322–1328.
Harp R, Leibach J, Black J. 1994. Cryopreservation of murine ovarian tissue. Cryobiology 31: 336-343.
Harris SE, Picton HM. 2007. Metabolism of follicles and oocytes during growth and maturation. In In-Vitro Maturation of Human Oocytes – Basic Science to Clinical Application, pp 15–36. Eds Tan SL, Chian RC, Buckett WM. Oxon, UK: Informa Health.
Hu Y, Betzendahl I, Cortvrindt R, Smitz J, Eichenlaub-Ritter U. 2001. Effects of low O2 and ageing on spindles and chromosomes in mouse oocytes from pre-antral follicle culture. Hum Reprod 16 :737–748.
Jin P,Harris SE, Picton HM. 2004. The effect of ascorbic acid onovine preantral follicle development in vitro. Proceedings of the Society for Reproduction and Fertility, 2004 Annual Conference, Ghent, Belgium. P22.
Kanatsu-Shinohara M, Schultz RM, Kopf GS. 2000. Acquisition of meiotic competence in mouse oocytes: absolute amounts of p34cdc2, cyclin B1, cdc25C, and wee1 in meiotically incompetent and competent oocytes. Biol Reprod 63: 1610–1616.
Kerr JB, Ducket R, M. Myers, KL Britt, T Mladenovska, Findlay JK. 2006. Quantification of healthy follicles in the neonatal and adult mouse ovary: evidence for maintenance of primordial follicle supply. Reproduction 132: 95-109.
Knight PG, Glister C. 2006. TGF-b superfamily members and ovarian follicle development. Reproduction 132 191–206.
Kreeger PK, Deck JW, Woodruff TK, Shea LD. 2006. The in vitro regulation of ovarian follicle development using alginate-extracellular matrix gels. Biomaterials 27:714–23.
Lima GL, Costa LLM, Cavalcanti DMLP, Rodrigues CMF, Freire FAM et al. 2010. Short-term storage of canine preantral ovarian follicles using a powdered coconut water (ACP1)-based medium. Theriogenology doi:10.1016/ j.theriogenology.2010.01.025
Liu J, Van der Elst J, Van den Broecke R, Dhont M. 2001. Live offspring by in vitro fertilization of oocytes from cryopreserved primordial mouse follicles after sequential in vivo transplantation and in vitro maturation. Biol Reprod 64:171–8.
Lopes CAP, Santos RR, Celestinoa JJH, Meloa JAP, Chaves RN et al. 2009. Short-term preservation of canine preantral follicles: Effects of temperature, medium and time. Anim Reprod Sci 115: 201–214.
Lucci CM, Kacinskis MA, Rumpf R, Ba´o. SN 2004. Effects of lowered temperatures and media on short-term preservation of zebu (Bos indicus) preantral ovarian follicles. Theriogenology 61: 461–472.
Martinez-Madrid B, Dolmans MM, Van Langendonckt A, Defrere S, Donnez J.2004. Freeze-thawing intact human ovary with its vascular pedicle with a passive cooling device. Fertil Steril 82:1390–1394.
Mason AJ, Niall HD, Seeburg PH. 1986. Structure of two human ovarian inhibins. Biochem Biophys. Res. Commun. 135: 957-964.
McCaffery FH, Leask R, Riley SC, Telfer EE. 2000. Culture of bovine preantral follicles in a serum-free system: markers for assessment of growth and development. Biol Reprod 63: 267–273.
McNatty KP, Heath DA, Lundy T, Fidler AE,Quirke L, et al. 1999. Control of early ovarian follicular development. J Reprod Fertil 49: 123–135.
McNatty KP, Reader K, Smith P, Heath DA, Juengel JL. 2007. Control of ovarian follicular development to the gonadotrophin-dependent phase: a 2006 perspective. Society of Reproduction and Fertility 64: 55–68.
Mehlmann LM. 2005. Stops and starts in mammalian oocytes: recent advances in understanding the regulation of meiotic arrest and oocyte maturation. Reproduction 130: 791–799.
Mehlmann LM, Saeki Y, Tanaka S, Brennan TJ, Evsikov AV, et al. 2004. The Gs-linked receptor GPR3 maintains meiotic arrest in mammalian oocytes. Science 306: 1947–1950.
Moravia W, Picton HM, Rodway RG, Joyce IM 2005 In vitro growth of oocytes from primordial follicles isolated from frozen–thawed lamb ovaries. Theriogenology 64 1357–1370.
Muruvi W, Picton HM, Rodway RG, Joyce IM. 2009. In vitro growth and differentiation of primary follicles isolated from cryopreserved sheep ovarian tissue. Anim Reprod Sci 112:36–50.
Nayudu PL, Osborn SM. 1992. Factors influencing the rate of preantral and antral growth of mouse ovarian folliecles in vitro. J Reprod Fertil 95: 349-363. Newton H, Picton HM, Gosden RG. 1999. In vitro growth of oocyte– granulosa
cell complexes isolated from cryopreserved ovine tissue. J Reprod Fertil 115: 141–150.
O’Brien MJ, Pendola JK, Eppig JJ. 2003. A revised protocol for in vitro development of mouse oocytes from primordial follicles dramatically improves their developmental competence. Biol Reprod 68: 1682-1686. Onions VJ, Mitchell MRP, Campbell BK, Webb R. 2008. Ovarian tissue viability
following whole ovine ovary cryopreservation: assessing the effects of sphingosine-1-phosphate inclusion. Hum Reprod 23 (3 ): 606–618.
Oktem O, Oktay K. 2007. The role of extracellular matrix and activin-A in vitro growth and survival of murine preantral follicles. Reprod Sci 14 (4): 358-366.
Pan H, O’Brien MJ,Wigglesworth K, Eppig JJ, Schultz RM. 2005. Transcript profiling during mouse oocyte development and the effect of gonadotrophin priming and development in vitro. Dev Biol 286: 493–506.
Park JY, Su YQ, Ariga M, Law E, Jin SL, et al. 2004. EGF-like growth factors as
mediators of LH action in the ovulatory follicle. Science 303: 682–684.
Peng XR, Hsueh AJ, LaPolt PS, Bjersing L, Ny T. 1991. Localization of luteinizing hormone receptor messenger ribonucleic acid expression in ovarian cell types during follicle development and ovulation. Endocrinology 129 3200– 3207.
Peters H, Byskov AG, Himelstein-Braw R, Faber M .1975. Follicular growth: the basic event in the mouse and human ovary. J Reprod Fertil 45: 559–566. Picton HM, Campbell BK, Hunter MG. 1999. Maintenance of oestradiol
production and cytochrome P450 aromatase enzyme messenger ribonucleic acid expression in long-term serum-free cultures of porcine granulosa cells. J Reprod Fertil 115: 67–77.
Picton HM, Muruvi W, Jin P. 2007. Interaction of oocyte and somatic cells. In In-Vitro Maturation of Human Oocytes – Basic Science to Clinical Application, pp 37–48. Eds SL Tan, RC Chian &WM Buckett. Oxon, UK: Informa Health.
Picton HM, Harris SE, Muruvi W, Chambers EL. 2008. The in vitro growth and maturation of follicles Reproduction 136: 703–715.
Rall WF, Fahy GM. 1985. Ice-free cryopreservation of mouse embryo at 196 oC. Nature 313: 573-575.
Richard FJ, Sirard MA. 1996. Effects of follicular cells on oocyte maturation.II. Theca cell inhibition of bovine oocyte maturation in vitro. Biol Reprod 54: 22–28.
Rivier C, Meunier H, V Roberts V, Vale W. 1990. Inhibin: role and secretion in the rat. Recent Prog. Horm. Res. 46: 231-57
Roberts R, Franks S, Hardy K. 2002. Culture environment modulates maturation and metabolism of human oocytes. Hum Reprod 17: 2950–2956.
Rose UM, Hanssen RG, Klosterboer HJ. 1999. Development and characterization on an in vitro ovulation model using mouse ovarian follicles. Biol Reprod 61: 503-511.
Shoji H, Tsuchida K, Kishi H, Yamakawa N, Matsuzaki T et al. 2000. Identification and characterization of a PDZ protein that interact with activin type II receptors. J Biol Chem 275: 5485-5492.
Silva JRV, Lucci CM, Carvalho FCA, Bao SN, Costa SHF, et al. 2000. effect of coconut water and Braun-Collins solutions at different suhuees and incubation times on the morphology of goat preantral follicles preserved in vitro. Theriogenology 54: 809–822.
Smith JC, Price BM, Green JB, Weigel D, Herrmann BG. 1991. Expression of a Xenopus homolog of Brachyury (T) is an immediate-early response to mesoderm. Cell 67: 79-87.
Telfer EE. 1996. The development of methods for isolation and culture of preantral follicles from bovine and porcine ovaries. Theriogenology 45: 101–110.
Telfer EE, Gosden RG, Byskov AG, Spears N, Anderson R, et al. 2005. On regenerating the ovary and generating controversy. Cell 122: 821-822. Telfer EE, McLaughlin M, Ding C, Thong KJ. 2008. A two-step serum-free
culture system supports development of human oocytes from primordial follicles in the presence of activin. Hum Reprod 23: 1151–1158.
Thomas FH, Campbell BK, Armstrong DG, Telfer EE. 2007. Effects of IGF-I bioavailability on bovine preantral follicular development in vitro. Reproduction 133: 1121–1128.
Tilly JL. 1996. Apoptosis and ovarian function. Rev Reprod 1: 162-172.
Tsuribe PM, Gobbo CAM, Landim-Alvarenga FC. 2009. Viability of primordial follicles derived from cryopreserved ovine ovarian cortex tissue. Fertil Steril 91(5) Supplement: 1976-1983.
Van Wagtendonk-de Leeuw AM, Mullaart E, de Roos APW, Merton JS, den Daas JHG, et al. 2000. Effects of different reproductive techniques: AI, MOET or IVP on health and welfare of bovine offspring. Theriogenology 53: 575– 597.
Von Wolff M, Donnez J, Hovatta O, Keros V, Maltaris T, et al. 2009. Cryopreservation and autotransplantation of human ovarian tissue prior to cytotoxic therapy–a technique in its infancy but already successful in fertility preservation. Eur J Cancer 45:1547–53.
West ER, Xu M, Woodruff TK, Shea LD. 2007. Physical properties of alginate hydrogels and their effects on in vitro follicle development. Biomaterials 28: 4439–4448.
Wu J, Emery BR & Carrell DT 2001 In vitro growth, maturation, fertilization, and embryonic development of oocytes from porcine preantral follicles. Biol Reprod 64: 375–381.
Xu M, Banc A, Woodruff TK, Shea LD. 2009. Secondary follicle growth and oocyte maturation by culture in alginate hydrogel following cryopreservation of the ovary or individual follicles. Biotechnol Bioeng 103:378–86.
Xu M, Kreeger PK, Shea LD, Woodruff TK. 2006a. Tissueengineered follicles produce live, fertile offspring. Tissue Eng 2:2739–46.
Xu M,West E, Shea LD,Woodruff TK. 2006b. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod 75:916–23.
Ye J, Coleman J, Hunter MG, Craigon J, Campbell KH, Luck MR. 2007. Physiological suhue variants and culture media modify meiotic progression and developmental potential of pig oocytes in vitro. Reproduction 133: 877– 886.
Ying SY, Zhang Z, Huang G. 1997. Expression and localization of inhibin/activin subunits and activin receptors in the normal rat prostate. Life Sci 60(6): 397-401.
PRESERVASI OVARIUM DAN PENGARUHNYA TERHADAP
MORFOLOGI FOLIKEL DOMBA
ABSTRAK
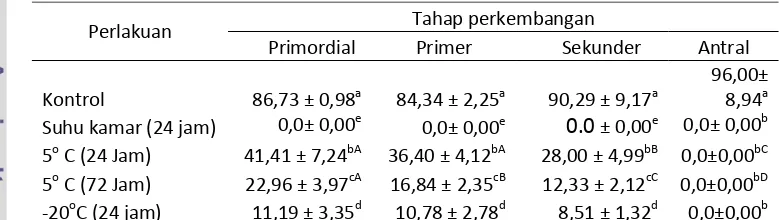
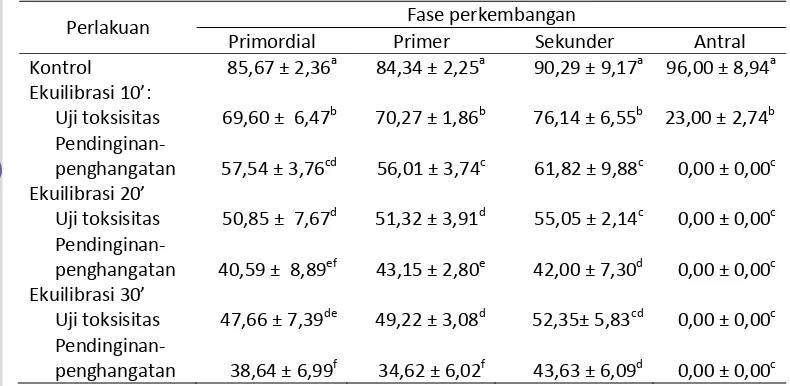
Penelitian ini bertujuan untuk mempelajari pengaruh penyimpanan ovarium pada suhu dingin dan beku terhadap morfologi folikel domba. Penelitian ini terdiri dari 2 eksperimen. Pada eksperimen 1, ovarium disimpan dalam larutan PBS pada suhu: a) -20 oC, b) suhu kamar (25 oC) selama 24 jam, c) suhu 5oC selama 24 jam dan d) 72 jam. Setelah penyimpanan, folikel-folikel dievaluasi secara histologis. Pada eksperimen 2, cortex ovarium dipisahkan dari ovarium dan dibentuk dalam potongan berukuran ±1 mm3. Potongan jaringan diletakkan di atas hemistraw dan ditransfer ke larutan ekuilibrasi masing-masing selama 10, 20, dan 30 menit pada suhu kamar, selanjutnya dipindahkan ke larutan vitrifikasi selama 3 menit. Hemistraw beserta jaringan dicelupkan dalam nitrogen cair. Setelah thawing, dilakukan preparasi histologis. Seluruh folikel mengalami kerusakan morfologi setelah penyimpanan ovarium pada suhu kamar selama 24 jam. Persentase folikel dengan morfologi normal menurun secara nyata pada jaringan ovarium yang disimpan pada suhu -20 oC selama 24 jam, pada suhu 5 oC selama 24 jam dan 72 jam, penyimpanan pada suhu 5 oC selama 24 jam memberikan hasil lebih baik (P<0,05). folikel antral rusak pada semua perlakuan. Folikel-folikel primordial mempertahankan keutuhan morfologinya lebih baik daripada folikel-folikel yang sedang tumbuh. Pemaparan jaringan ke larutan ekuilibrasi selama 10 min menghasilkan lebih banyak folikel-folikel dengan morfologi normal (P<0,05).
Kata-kata kunci: ovarium, preservasi, vitrifikasi, domba ABSTRACT
morphologically normal follicle, 5 oC storage gave the better results. Primordial follicles preserved their morphology intactness better than growing follicles. Good morphology of follicles was confirmed when exposing tissue to equilibration for 10 min.
Key words : ovarium, follicle, preservation, vitrification, ovine
PENDAHULUAN
Ovarium dari hewan yang dipotong atau mati karena sebab lain memiliki nilai ekonomis rendah karena ukurannya sangat kecil. Ovarium ini sebenarnya bisa dimanfaatkan untuk produksi anak dengan mengaplikasikan teknologi reproduksi melalui produksi embrio in vitro, salah satu caranya adalah mengoptimalkan potensi folikel-folikel yang terkandung di dalamnya. Folikel-folikel ini merupakan struktur dasar dan unit fungsional ovarium mamalia yang menyediakan lingkungan mikro yang dibutuhkan untuk pertumbuhan dan maturasi oosit, lebih dari 90% merupakan folikel preantral (Lucci et al. 2007). Cadangan folikel-folikel mamalia yang belum tumbuh berisi oosit yang beristirahat pada tahap diploten dari profase meiotik (Telfer et al. 2005), pada domba jumlahnya berkisar 36.000 folikel per ovarium (Rosadi et al. 2010). Dari sejumlah besar folikel hanya 0,01% yang ovulasi sepanjang masa produktifnya (Santos et al. 2006).
Ovarium domba berguna dalam riset reproduksi manusia sebab ovarium domba cocok sebagai model ovarium manusia karena persamaan ukuran dan
kondisi jaringan (Oktay et al. 2000, Picton et al. 2008). Penggunaan ovarium dalam riset bidang ini banyak diarahkan ke masalah infertilitas dan preservasi
ovarium khususnya pada wanita-wanita penderita kanker. Seperti diketahui,
ovarium sangat sensitif terhadap obat kanker kelompok alkilating agent
(cyclophosphamide, busulfan, melphalan, chlorambucil, dacarbazine, procarbazine, dll.) yang diklasifikasikan memiliki resiko tinggi terhadap disfungsi gonad (Blumenfeld et al. 2000, Kenney et al. 2001, Tauchmanova et al. 2002).
kualitas oosit dalam folikel-folikel preantral tergantung pada medium preservasi, suhu dan waktu inkubasi selama transportasi dan penyimpanan ovarium (Carvalho et al. 2001, Lima et al. 2010). Penyimpanan ovarium jangka pendek yang telah
dicoba pada kambing (Silva et al. 2000, Carvalho et al. 2001), sapi (Lucci et al. 2004), babi (Lucci et al. 2007) dan anjing (Lopes et al. 2009, Lima et al. 2010) menunjukkan bahwa suhu 4 oCmemungkinkan preservasi folikel selama 24 jam,
sedangkan pada suhu lebih tinggi hanya mampu mempreservasi folikel sampai 6-8 jam.
Kriopreservasi potongan jaringan cortex atau ovarium utuh yang
memungkinkan penyimpanan jaringan ovarium jangka panjang dapat
mempertahankan fungsi ovarium, dan bermanfaat dalam mempertahankan spesies yang terancam punah serta menyelidiki fenomena folikulogenesis awal (Onions et al., 2008). Kriopreservasi telah diaplikasikan untuk mempertahankan fertilitas
pada pasien kemoterapi kanker (Donnez et al. 2006).
Metode slow freezing menggunakan mesin pembekuan terprogram adalah metode konvensional kriopreservasi jaringan ovarium, proses pembekuan membutuhkan waktu lebih dari satu jam. Vitrifikasi merupakan metode alternatif untuk kriopreservasi jaringan ovarium, konsentrasi krioprotektan yang digunakan lebih tinggi dan laju pendinginan lebih cepat, tidak menimbulkan terbentuknya kristal es serta tidak membutuhkan perlatan khusus (Yoeman et al. 2005). Metode vitrifikasi dapat mempertahankan viabilitas folikel preantral lebih baik dibandingkan metode pembekuan konvensional (Chen et al 2006).
METODE PENELITIAN
Koleksi dan Penyimpanan Ovarium
Ovarium yang diperoleh dari rumah potong hewan dibawa dalam larutan NaCl fisiologis ditambah 50 µg/ml gentamycin. Interval antara pengambilan ovarium sampai pengolahan di laboratorium tidak melebihi 2 jam. Ovarium utuh dicuci tiga kali dalam phosphate-buffered saline (PBS, Sigma®, Sigma-Aldrich, USA) ditambah 50 µg/ml gentamycin, dicelupkan selama lima detik dalam larutan alkohol 70%, lalu dicuci kembali dalam larutan PBS tiga kali. Ovarium utuh kemudian dibagi secara acak menjadi beberapa perlakuan penyimpanan yaitu: a) suhu kamar selama 24 jam, b) suhu 5 oC selama 24, c) suhu 5 oC 72 jam, dan d) -20 oC selama 24 jam. Setiap perlakuan diulang 5 kali.
Vitrifikasi Ovarium
Pembuatan Preparat Histologis
Potongan jaringan cortex ovarium dari berbagai perlakuan penyimpanan dan vitrifikasi diinkubasi semalam dalam 4% para formaldehid dalam PBS (pH 7.4). Proses pengerjaan preparat histologis selanjutnya dilakukan dengan metode paraffin dan pewarnaan Hematoksilin-Eosin (Kiernan, 1990).
Penghitungan Jumlah dan Pengamatan Morfologi Folikel
Identifikasi morfologis dan estimasi total folikel primordial, primer, sekunder, atau antral diamati dengan mikroskop cahaya. Inti (folikel primordial) atau anak inti (folikel primer-antral) digunakan sebagai referensi titik hitung. Jumlah folikel dihitung dengan menggunakan metode estimasi yaitu dengan mencari terlebih dahulu untuk masing-masing tipe folikel. Jumlah setiap tipe folikel pada 25 sayatan serial pertama dijumlahkan kemudian dibandingkan dengan jumlah folikel pada setiap kelipatan lima. Folikel yang dihitung hanya folikel yang memiliki nukleolus dengan struktur yang jelas untuk menghindari perhitungan ganda.
Faktor pengali Jumlah folikel pada sayatan keJumlah folikel pada 5 sayatan pertama, 5, , 5, , dan 5
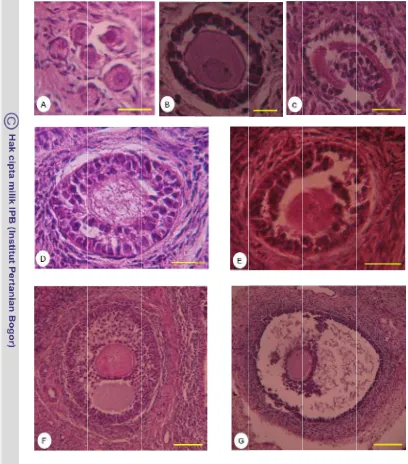
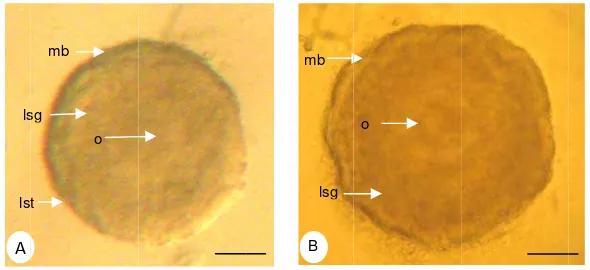
Tahap perkembangan folikel diidentifikasi berdasarkan klasifikasi Myers et al. (2004). Folikel-folikel dengan satu lapis sel-sel granulosa pipih yang inaktif
secara mitotik dikategorikan sebagai folikel primordial, Pada folikel primer lapisan sel granulosa berbentuk kuboid, diameter oosit lebih besar. Folikel sekunder mempunyai dua lapis atau lebih sel-sel granulosa kuboid. Folikel antral memiliki antrum, beberapa lapis sel granulosa dan sel-sel theca.
piknotik, sel-sel granulosa yang tidak terorganisir atau kepadatan seluler yang rendah.
Preparat histologis jaringan cortex ovarium diamati menggunakan mikroskop cahaya dengan pembesaran 400 kali. Untuk setiap perlakuan dan ulangan jumlah folikel yang diamati setiap tahap perkembangan minimal 100 folikel kecuali untuk folikel antral. Persentase folikel dengan morfologi utuh dihitung dengan persamaan:
Persentase Folikel Utuh Jumlah folikel dengan morfologi normalJumlah folikel yang dihitung %
Analisis Data
Data disajikan dalam bentuk rataan ± standar deviasi dan dianalisis menggunakan sidik ragam. Uji jarak berganda Duncan digunakan untuk menganalisis perbedaan antarperlakuan. Semua kalkulasi statistik dilakukan menggunakan perangkat lunak SPSS ver 17.0.
HASIL DAN PEMBAHASAN
Bobot dan Jumlah Folikel Ovarium Domba
Bobot ovarium domba yang dipakai pada penelitian ini adalah 0,509 ± 0,181 gram dan 0,538 ± 0,161 masing-masing pada ovarium dengan corpus luteum (CL) dan tanpa CL (Tabel 1.) Jumlah folikel rata-rata 36303± 4470, sebagian besar adalah folikel preantral (primordial, primer, dan sekunder).
Tabel 1. Bobot dan jumlah folikel ovarium domba
Bobot ovarium
Tanpa CL (n=58) (g) 0,509 ± 0,181
Dengan CL (n=32) (g) 0,538 ± 0,161
Jumlah folikel (n=7)
Primordial 20680 ± 1853,97
Intermediet (peralihan primordial-primer) 7990 ± 1355,47
Primer 6987 ± 1187,49
Sekunder 630 ± 108,17
Antral 17 ± 3,06