UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
UJI STABILITAS OBAT SPIRONOLAKTON TERHADAP
PERUBAHAN pH DENGAN MENGGUNAKAN
KROMATOGRAFI CAIR KINERJA TINGGI (KCKT)
SKRIPSI
Ririn Astri Sabdowati
1111102000040
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ii
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
UJI STABILITAS OBAT SPIRONOLAKTON TERHADAP
PERUBAHAN pH DENGAN MENGGUNAKAN
KROMATOGRAFI CAIR KINERJA TINGGI (KCKT)
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar sarjana Farmasi
Ririn Astri Sabdowati
1111102000040
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
iii
HALAMAN PERNYATAAN ORISINILITAS
Skripsi ini adalah hasil karya saya sendiri, dan semua sumber baik yang dikutip maupun dirujuk telah saya nyatakan benar.
Nama : Ririn Astri Sabdowati
NIM : 1111102000040
Tanda Tangan :
iv
LEMBAR PERSETUJUAN PEMBIMBING
NAMA : RIRIN ASTRI SABDOWATI
NIM : 1111102000040
PROGRAM STUDI : Strata-1 Farmasi
JUDUL : UJI STABILITAS OBAT SPIRONOLAKTON
TERHADAP PERUBAHAN pH DENGAN
MENGGUNAKAN KROMATOGRAFI CAIR KINERJA TINGGI (KCKT)
Disetujui Oleh:
Pembimbing I
Nelly Suryani, Ph.D, Apt
NIP. 19651024 200501 2 001
Pembimbing II
Supandi, M.Si, Apt
Mengetahui,
Kepala Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
UIN Syarif Hidayatullah Jakarta
v
HALAMAN PENGESAHAN
Skripsi ini diajukan oleh :
Nama : Ririn Astri Sabdowati
NIM : 1111102000040
Program Studi : Farmasi
Judul Skripsi : Uji Stabilitas Obat Spironolakton Terhadap Perubahan pH Dengan Menggunakan Kromatografi Cair Kinerja Tinggi (KCKT)
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
DEWAN PENGUJI
Pembimbing 1 : Nelly Suryani, Ph.D., Apt ( )
Pembimbing 2 : Supandi M.Si., Apt ( )
Penguji 1 : Umar Mansur, M.Sc., Apt ( )
Penguji 2 : Lina Elfita M.Si., Apt ( )
vi
ABSTRAK
Nama : Ririn Astri Sabdowati Program Studi : Farmasi
Judul Skripsi : Uji Stabilitas Obat Spironolakton Terhadap Perubahan PH dengan Menggunakan Kromatografi Cair Kinerja Tinggi (KCKT)
Spironolakton merupakan obat hipertensi golongan diuretik antagonis aldosteron yang umumnya dibuat dalam bentuk tablet salut film tidak dalam bentuk larutan ataupun suspensi. Di Indonesia spironolakton terkadang digabung dengan obat-obat lain terutama untuk pasien geriatrik yang mengalami komplikasi penyakit yang terkadang sulit untuk menelan obat ataupun pasien tersebut dalam keadaan koma. Pencampuran obat dan perubahan bentuk sediaan obat sebelum digunakan dapat mempengaruhi pH akhir sediaan. Sedangkan spironolakton merupakan senyawa ester yang mengandung gugus lakton yang mudah terhidrolisis pada perubahan pH. Dimana reaksi ini akan menyebabkan terjadinya degradasi spironolakton. Pada penelitian ini, persentase kadar spirononlakton dalam sediaan suspensi yang dibuat dengan cara menggerus tablet spironolakton dan mensuspensikannya dengan air diukur dengan mengunakan metode KCKT. Suspensi spironolakton yang telah dibuat ditambahkan dapar untuk memberi variasi suasana pH hingga diperoleh pH 3,5,7 dan 9 dan diujikan pada menit ke 0,15,30,45, dan 60. Persen kadar spironolakton pada ph 3 adalah 19%, 21%, 22%,27%,dan 40%. Pada pH 5 100%,88%,85%,74% dan 91%. Pada pH 7 61%,46%,38%,27%,dan 35%. Pada pH 9 54%,50%,41%,38%, dan 38%. Kadar spironolakton pada pH 3, 7, dan 9 pada semua menit sudah tidak dapat diterima, sesuai ketentuan kadar spironolakton dalam sediaan. Sedangkan pada pH 5 pada menit ke-0 saja yang masih dapat diterima. Spironolakton lebih stabil pada atau mendekati pH optimum yaitu 4.5.
vii Name : Ririn Astri Sabdowati Study program : Pharmacy
Thesis title : Stability Test on Spironolactone towards pH changes using High Performance Liquid Chromatography (HPLC)
Spironolactone is an aldosterone antagonist diuretic drug for hypertension which is generally made in form of film-coated tablets not liquid nor suspension. In Indonesia, spironolactone is sometimes combined with other medicines especially for geriatric patients who suffer complications and sometimes have difficulty in swallowing medicine or those patients who are in a comma-state. Mixture of drug and the changes of drug form before being used can affect the final pH, while spironolactone is an ester containing lactone group which is easily hydrolyzed towards change of pH. This reaction will cause degradation of spironolactone. In this research, the spironolactone percentage in suspension was created by grinding the spironolactone tablet and suspended it with water measured by using HPLC method. Buffer was added to the spironolactone suspension to give variation to pH solution until pH 3, 5, 7, and 9 were obtained which then tested on minute 0, 15, 30, 45, and 60. The percentages of spironolactone at pH 3 were 19%, 21%, 22%, 27%, and 40%. At pH 5 the percentages were 100%, 88%, 85%, 74% and 91%, while at pH 7 were 61%, 46%, 38%, 27%, and 35%. At ph 9, the percentages were 54%, 50%, 41%, 38%, and 38%. The spironolactone at pH 3, 7, and 9 at all minutes could not be accepted in accordance to the spironolactone in the formulation. Meanwhile, at ph 5, the only one that could be accepted was at minute 0. Spironolactone was more stabilized at or near optimum pH which was 4.5.
xi
DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINILITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
LEMBAR PENGESAHAN SKRIPSI... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
DAFTAR GAMBAR ... xiii
DAFTAR TABEL ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
I.1. Latar Belakang ... 1
I.2. Rumusan Masalah ... 3
I.3. Tujuan Penelitian ... 3
I.4. Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1. Stabilitas Obat ... 4
2.2. Stabilitas Obat Terhadap pH ... 6
2.3. Degradasi Obat ... 7
2.4. Tablet Salut ... 10
2.5. Spironolakton ... 10
2.6. Kromatografi Cair Kinerja Tinggi (KCKT) ... 14
BAB III METODE PENELITIAN ... 18
3.1. Tempat dan Waktu Penelitian ... 18
3.2. Alat dan Bahan ... 18
3.3. Prosedur Kerja ... 18
3.3.1 Pembuatan Fase Gerak ... 18
3.3.2 Preparasi Standar ... 18
3.3.3 Optimasi dan Validasi ... 19
3.3.4 Preparasi dan Pengujian Sampel ... 20
BAB IV HASIL DAN PEMBAHASAN... 22
4.1. Penentuan Panjang Gelombang Optimum ... 22
4.2. Pemilihan Fase Gerak ... 22
4.3. Uji Kesesuaian Sistem ... 22
4.4. Pembuatan Kurva Kalibrasi ... 23
4.5. Uji Akurasi dan Perolehan Kembali ... 24
xii
4.7. Pengukuran Kadar Spironolakton dalam Sampel ... 26
4.8. Uji Statistik Nilai Normalitas ... 29
4.9. Uji Statistik Nilai Homogenitas dan ANOVA ... 29
4.10. Pembahasan Pengukuran Kadar Spironolakton dalam Sampel ... 30
BAB V KESIMPULAN DAN SARAN ... 34
5.1. Kesimpulan ... 34
5.2. Saran ... 34
xiii
DAFTAR GAMBAR
Gambar 2.1. Contoh hidrolisis dengan katalis asam ... 8
Gambar 2.2. Contoh hidrolisis dengan katalis basa ... 8
Gambar 2.3. Struktur Spironolakton... 10
Gambar 2.4. Struktur Lakton ... 12
Gambar 2.5. Instrumen KCKT ... 15
Gambar 4.1. Kurva Kalibrasi ... 23
Gambar 4.2. Grafik perbandingan pH akhir sediaan terhadap Waktu ... 30
Gambar 4.3. Spironolakton ... 31
Gambar 4.4 Hidrolisis Gugus Ester Dalam Suasana Asam ... 32
Gambar 4.5. Hidrolisis Gugus Ester Dalam Suasana Basa ... 32
xiv
DAFTAR TABEL
Tabel 4.1. Uji kesesuaian Sistem ... 23
Tabel 4.2. Kurva Kalibrasi ... 23
Tabel 4.3. Uji Akurasi ... 24
Tabel 4.4. Uji Presisi ... 25
Tabel 4.5. Persentase Kadar Spironolakton pada pH 3 ... 26
Tabel 4.6. Persentase Kadar Spironolakton pada pH 5 ... 27
Tabel 4.7. Persentase Kadar Spironolakton pada pH 7 ... 27
Tabel 4.8. Persentase Kadar Spironolakton pada pH 9 ... 28
xv
DAFTAR LAMPIRAN
Lampiran 1. Alur Kerja ... 36
Lampiran 2. Sertifikat Spironolakton Standar Sigma ... 37
Lampiran 3. Panjang Gelombang Maksimum Spironolakton ... 38
Lampiran 4. Perhitungan Persiapan Kurva Kalibrasi ... 39
Lampiran 5. Kromatogram Larutan Standar dan Tablet ... 41
Lampiran 6. Kromatogram Kalibrasi ... 42
Lampiran 7. Kurva Dan Tabel Kalibrasi ... 43
Lampiran 8. Hasil Kromatogram Uji Kesesuaian Sistem ... 44
Lampiran 9. Hasil Uji Kesesuaian Sistem ... 45
Lampiran 10. Hasil Uji Akurasi ... 46
Lampiran 11. Hasil Uji Presisi ... 47
Lampiran 12. Perhitungan Preparasi Sampel dan Luas Area secara Manual ... 49
Lampiran 13. Hasil Kromatogram pH 3 ... 50
Lampiran 14. Hasil dan Kurva pH 3 ... 51
Lampiran 15. Hasil Kromatogram pH 5 ... 52
Lampiran 16. Hasil dan Kurva pH 5 ... 53
Lampiran 17. Hasil Kromatogram pH 7 ... 54
Lampiran 18. Hasil dan Kurva pH 7 ... 55
Lampiran 19. Hasil Kromatogram pH 9 ... 56
Lampiran 20. Hasil dan Kurva pH 9 ... 57
Lampiran 21. Kurva Perbandingan Konsentrasi terhadap Waktu ... 58
1 UIN Syarif Hidayatullah Jakarta
1.1. Latar Belakang
Stabilitas dalam arti luas dapat didefinisikan sebagai ketahanan suatu produk sesuai dengan batas-batas tertentu selama penyimpanan dan penggunaanya atau umur simpan suatu produk dimana produk tersebut masih mempunyai sifat dan karakteristik yang sama seperti pada waktu pembuatan. (David B. Troy, 2006; USP 30)
Obat dibuat dalam berbagai bentuk sediaan disesuaikan dengan cara dan tujuan pemakaian, pertimbangan sifat bahan obat dan sebagainya. Bila bentuk suatu sediaan obat diubah seperti dilarutkan, diserbuk, ditambahkan bahan tambahan lain atau dilakukan modifikasi faktor lingkungan seperti pada kondisi penyimpanan, kemungkinan dapat terjadi perubahan pada stabilitas obat tersebut.
(Connors et al, 1992)
Ada beberapa parameter yang perlu dipertimbangkan dalam memformulasi
suatu sediaan obat yang stabil. Diantaranya sifat kimia, sifat fisik, mikrobiologi, efek terapi, efek toksik. Evaluasi stabilitas sediaan tidak hanya memperhitungkan zat aktif farmasi, tetapi juga eksipien dan kemasan produk obat. Selanjutnya, karena kemudahan dan ketersediaan bahan, pada praktek umum dilakukan pembuatan cairan suspensi oral yang disiapkan dari bentuk sediaan padat seperti tablet atau kapsul yang tersedia. Oleh karena itu potensi interaksi tambahan dapat terjadi antara obat. (Niazi, Sarfaraz, 2006)
Beberapa hal yang dapat mempengaruhi stabilitas dari sediaan farmasi salah satunya adalah interaksi bahan aktif dengan bahan aktif lain dalam penggunaannya, faktor lingkungan seperti temperatur juga mempengaruhi stabilitas obat. Demikian pula faktor formulasi seperti pH, sifat dalam air dan sifat pelarutnya dapat mempengaruhi stabilitas obat (David B. Troy, 2006; USP. 30)
2
UIN Syarif Hidayatullah Jakarta
Kebanyakan molekul obat baik asam atau basa lemah akan terionisasi
yang ditentukan oleh pKa senyawa dan pH cairan biologis dimana obat itu akan terlarut. pH dari larutan obat mungkin memiliki efek yang besar pada stabilitas,
bergantung pada mekanisme reaksinya. Ketika obat diformulasikan dalam bentuk larutan, penting untuk mengetahui pH optimum sediaan. Kebanyakan obat akan berkontak dengan air dan bahkan obat berbentuk solid dapat kontak dengan air. Oleh karena itu, hidrolisis menjadi reaksi yang paling banyak ditemukan. Hidrolisis sering menjadi jalur degradasi dari obat-obat yang memiliki gugus ester dan amida. (Banker, Gilbert S and C T Rhodes, 2002; Min Li, 2012)
Spironolakton umumnya dibuat dalam bentuk tablet salut film dengan kekuatan dosis 25, 50 dan 100 mg tidak dalam bentuk larutan ataupun suspensi. Spironolakton praktis tidak larut dalam air dan larut dalam alkohol. Sedikit larut dalam kondisi basa. Sediaan larutan oral yang dibuat dengan spironolakton stabil setidaknya selama 30 hari dan biasanya memiliki nilai pH akhir 3.5 – 6.5. (Mahmoud, Ismail M et al, 2014)
Spironolakton merupakan senyawa ester yang memiliki struktur lakton yang mudah terhidrolisis. Struktur lakton merupakan salah satu dari senyawa karbonil labil yang memiliki pusat elektropositif yang mudah bereaksi dengan nukleofil. (Banker, Gilbert S and C T Rhodes, 2002)
Lakton merupakan ester siklik. Menurut studi oleh Kaufman, antara hidrolisis menghasilkan reaksi campuran yang sama dibawah katalis asam.
UIN Syarif Hidayatullah Jakarta
Di Indonesia spironolakton terkadang digabung dengan obat-obat lain terutama
untuk pasien geriatrik yang mengalami komplikasi penyakit yang terkadang sulit untuk menelan obat ataupun pasien tersebut dalam keadaan koma sehingga sulit
untuk diberikan obat berbentuk tablet. Pencampuran obat dan perubahan bentuk sediaan obat sebelum digunakan terkadang dapat mempengaruhi pH akhir sediaan. Sedangkan spironolakton merupakan senyawa ester yang mengandung gugus lakton yang mudah terhidrolisis pada perubahan pH.
Oleh karena itu perlu dilakukan uji stabilitas obat dalam pemberian obat antihipertensi Spironolakton terhadap pengaruh perubahan variasi pH yaitu 3, 5, 7 dan 9 dalam sediaan suspensi sederharna menggunakan KCKT.
1.2. Rumusan Masalah
Masalah yang diangkat dalam penelitian ini adalah di Indonesia spironolakton terkadang digabung dengan obat-obat lain sehingga dapat mempengaruhi pH akhir sediaan. Oleh karena itu perlu dilakukan uji stabilitas obat Spironolakton terhadap pengaruh perubahan variasi pH yaitu 3, 5, 7 dan 9 dalam sediaan suspensi sederharna menggunakan KCKT. Adakah penurunan kadar dari spironolakton yang disebabkan oleh pengaruh perubahan pH.
1.3. Tujuan Penelitian
Melakuan analisa kandungan kadar dari spironolakton dalam variasi suasana
pH asam dan basa 3, 5, 7, dan 9.
I.4. Manfaat Penelitian
Memberikan informasi kondisi kestabilan spironolakton dalam variasi
suasana pH asam dan basa.
Sebagai informasi bagi dokter, farmasis darn tenaga kesehatan lain di rumah
4 UIN Syarif Hidayatullah Jakarta BAB II
TINJAUAN PUSTAKA 2.1. Stabilitas Obat
Stabilitas dalam arti luas dapat didefinisikan sebagai ketahanan suatu produk sesuai dengan batas-batas tertentu selama penyimpanan dan penggunaanya atau umur simpan suatu produk dimana produk tersebut masih mempunyai sifat dan karakteristik yang sama seperti pada waktu pembuatan. Banyak faktor yang mempengaruhi stabilitas dari sediaan farmasi, antara lain stabilitas bahan aktif, interaksi antara bahan aktif dengan bahan tambahan, proses pembuatan bentuk sediaan, kemasan, cara pengemasan dan kondisi lingkungan yang dialami selama pengiriman, penyimpanan, penanganan dan jarak waktu antara pembuatan dan penggunaan. Faktor lingkungan seperti temperatur, radiasi cahaya dan udara (khususnya oksigen, karbon dioksida dan uap air) juga mempengaruhi stabilitas.
Demikian pula faktor formulasi seperti ukuran partikel, pH, sifat dari air dan sifat pelarutnya dapat mempengaruhi stabilitas. (David B. Troy,Paul Beringer, 2006;
USP 30)
Stabilitas produk obat dibagi menjadi stabilitas secara kimia dan stabilitas secara fisika. Faktor-faktor fisika seperti panas, cahaya, dan kelembapan, mungkin akan menyebabkan atau mempercepat reaksi kimia, maka setiap menentukan stabilitas kimia, stabilitas fisika juga harus ditentukan (Attwood dan Florence, 2011).
Stabilitas fisika didasari pada perubahan sifat fisika dari suatu produk yang tergantung waktu (periode penyimpanan). Contoh dari perubahan fisika antara lain migrasi (perubahan) warna, perubahan rasa, perubahan bau, perubahan tekstur atau penampilan. Evaluasi dari uji stabilitas fisika meliputi: pemeriksaan organoleptis, homogenitas, pH, bobot jenis (Attwood dan Florence, 2011).
UIN Syarif Hidayatullah Jakarta
Secara reaksi kimia, zat aktif dapat terurai karena beberapa faktor diantaranya ialah oksigen (oksidasi), air (hidrolisa), suhu (oksidasi), cahaya (fotolisis), karbondioksida (turunnya pH larutan), sesepora ion logam sebagai katalisator reaksi oksidasi. Jadi jelasnya faktor luar juga mempengaruhi ketidakstabilan kimia seperti, suhu, kelembaban udara dan cahaya (Attwood dan Florence, 2011).
Stabilitas mikrobiologi suatu sediaan adalah keadaan tetap di mana sediaan bebas dari mikroorganisme atau memenuhi syarat batas miroorganisme hingga batas waktu tertentu. Stabilitas mikrobiologi diperlukan oleh suatu sediaan farmasi untuk menjaga atau mempertahankan jumlah dan menekan pertumbuhan mikroorgansme yang terdapat dalam sediaan tersebut hingga jangka waktu tertentu yang diinginkan (Attwood dan Florence, 2011).
Stabilitas sediaan farmasi merupakan salah satu kriteria yang amat penting
untuk suatu hasil produksi yang baik. Ketidakstabilan produk obat dapat mengakibatkan terjadinya penurunan sampai dengan hilangnya khasiat, obat dapat
berubah menjadi toksik atau terjadinya perubahan penampilan sediaan (warna, bau, rasa, konsistensi dan lain - lain) yang akibatnya merugikan bagi pemakai. (Connors et al, 1994)
Obat dibuat dalam berbagai bentuk sediaan disesuaikan dengan cara dan tujuan pemakaian, pertimbangan sifat bahan obat dan sebagainya. Bila bentuk suatu sediaan obat diubah seperti dilarutkan, diserbuk, ditambahkan bahan tambahan lain atau dilakukan modifikasi faktor lingkungan seperti pada kondisi penyimpanan, kemungkinan dapat terjadi perubahan pada stabilitas obat tersebut. (Connors et al, 1994)
6
UIN Syarif Hidayatullah Jakarta
Secara fisiologis, larutan obat harus diformulasikan sedekat mungkin ke pH stabilitas optimumnya karena besarnya laju reaksi hidrolitik dipengaruhi / dikatalisis oleh gugus hidroksi. (Ansel, 1994; Lachman et al, 2007)
2.2 Stabilitas Obat Terhadap pH
Kebanyakan molekul obat baik asam atau basa lemah akan terionisasi yang ditentukan oleh pKa senyawa dan pH cairan biologis dimana obat itu akan terlarut. pH dari larutan obat mungkin memiliki efek yang besar pada stabilitas, bergantung pada mekanisme reaksinya. Ketika obat diformulasikan dalam bentuk larutan, penting untuk mengetahui pH optimum sediaan. (Banker, Gilbert S and C T Rhodes, 2002)
Kebanyakan obat parenteral, obat akan berkontak dengan air dan bahkan obat berbentuk solid dapat kontak dengan air. Oleh karena itu, hidrolisis menjadi reaksi yang paling banyak ditemukan. Hidrolisis sering menjadi jalur degradasi
dari obat-obat yang memiliki gugus ester dan amida. Ketika obat tidak terion dalam air, maka akan ada tiga kemungkinan reaksi hidrolitik. Degradasi dapat
terjadi akibat katalis asam tertentu yang disebabkan oleh kinetik pada tahap pertama, hidrolisis air (tahap kedua) dan katalisis basa spesifik (tahap ketiga). (Min Li, 2012; Banker, Gilbert S and C T Rhodes, 2002)
Lakton merupakan cincin ester. Laktonisasi yang merupakan reforming cincin ester meningkat pada lakton dengan ukuran cincin kecil dan sedang. Menurut studi oleh Kaufman, antara hidrolisis dan laktonisasi menghasilkan reaksi campuran yang sama dibawah katalis asam. Katalisasi oleh asam pada hidrolisis dari lakton bersifat reversible. (Min Li, 2012)
UIN Syarif Hidayatullah Jakarta
Sistem pH dapar yang biasanya terdegradasi dari asam atau basa lemah dan garamnya biasanya ditambahkan ke dalam sediaan cair ditambahkan untuk mempertahankan pHnya pada rentang dimana terjadinya degradasi obat minimum. (Min Li, 2012)
2.3 Degradasi Obat
Substansi obat yang digunakan dalam farmasetikal memiliki struktur molekul yang berbeda-beda. Oleh karena itu rentan terdegradasi oleh banyak dan berbagai macam jalur degradasi. Jalur degradasi antara lain adalah hidrolisis, dehidrasi, isomerisasi dan rasemisasi, eliminasi, oksidasi, photodegradasi dan interaksi kompleks dengan eksipien ataupun dengan obat lain. Ini sangat berguna untuk memperkirakan ketidakstabilan kimia yang terjadi berdasarkan struktur melekulnya. Banyak obat yang cukup stabil, tetapi kelompok dengan gugus fungsional seperti ester dan cincin laktam yang terdapat pada beberapa obat rentan
terhadap hidrolisis dan gugus fungsional seperti katekol dan fenol cukup mudah teroksidasi. (Min Li, 2012; Lee, David C, M L Webb, 2009)
a. Hidrolisis
Hidrolisis merupakan salah satu dari reaksi utama dari degradasi obat terutama dalam bentuk larutan. Hidrolisis adalah proses dua tahap, dimana nukleofil, seperti air dan ion hidroksi yang ditambahkan yang kemudian akan membentuk senayawa intermediet dari leaving group yang terlepas pada tahap kedua. Struktur senyawa mempengaruhi tingkat hidrolisis, dimana semakin kuat asam konjugasi yang terlepas maka reaksi yang terjadi semakin cepat. Banyak obat yang mengandung gugus fungsional yang sangat rentan terhadap hidrolisis.
Contoh dari dua tipe reaksi hidrolisis (Niazi, Sarfaraz, 2006):
Hidrolisis tipe satu dapat dikatalisasi baik oleh asam dan basa, oleh karena itu kontrol pH formulasi merupakan salah satu hal yang mempengaruhi tingkat dekomposisi (Niazi, Sarfaraz, 2006):.
X = OR (ester), NR1R2 (amida) (Tipe I)
8
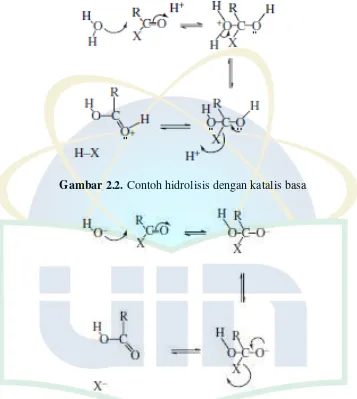
UIN Syarif Hidayatullah Jakarta Gambar 2.1. Contoh hidrolisis dengan katalis asam
Gambar 2.2. Contoh hidrolisis dengan katalis basa
Beberapa obat-obat yang memiliki gugus fungsi yang rentan terhadap hidrolisis antara lain aspirin (ester), spironolakton (tiol ester, lakton), kloramfenikol (amida), sulfonamide, fenobarbitak (imida), methicillin (lactam) dan klorambusil (alifatik terhalogenasi) (Niazi, Sarfaraz, 2006):.
UIN Syarif Hidayatullah Jakarta
b. Oksidasi
Reaksi penguraian kedua yang paling umum adalah melalui reaksi oksidasi. Penguranga/ oksidasi (redoks) merupakan reaksi yang melibatkan baik transfer oksigen atau hidrogen ataupun elektron. Oksidasi disebabkan oleh adanya oksigen dan reaksi yang dapat diinisasi oleh pemanasan, cahaya, dan paparan logam yang menghasilkan radikal bebas organic. Radikal ini menyebarkan reaksi oksidasi yang berlangsung hingga inhibitor menghancurkan radikal atau sampai terbentuknya reaksi samping yang memutuskan rantai. Sensitivitas masing-masing entisitas obat baru terhadap oksigen atmosfir harus dievaluasi untuk mententukan apakah produk akhir perlu dikemas dalam kondisi kedap udara dan jika harus mengandung antioksidan (Niazi, Sarfaraz, 2006).
Obat mungkin akan terdegradasi menjadi substansi toksik. Oleh karenanya
penting untuk mengetahui tidak hanya berapa banyak obat tersebut berkurang tapi juga apa yang menyebabkannya terdegradasi. Beberapa kasus, zat pendegradasi
mungkin berupa zat toksik. Contohnya obat pralidoxine yang terdegradasi melalui dua jalur pH. Di kondisi pH basa, produk toksik cyanid terbentuk, pada obat lain, Contohnya zat pendegradasi dari tetrasiklin adalah epianhydrotetrasiklin diketahui dapat menyebabkan sindrom fanconi. Terkadang, hasil reaksi intermediet yang terbentuk diketahui atau dicurigai memiliki efek toksik. Contohnya adalah penisilin pada pH asam akan berubah menjadi asam penicilenik yang dicurigai berkontribusi dalam efek alergi terhadap penisilin. (Yoshioka, Sumie and Stella, Valentino J, 2000)
10
UIN Syarif Hidayatullah Jakarta 2.4 Tablet Salut
Tablet salut merupakan tablet yang ditutupi dengan satu atau lebih lapisan dari campuran zat seperti gula, polimer, dan bahan- bahan lain yang terkadang juga aktif. Tablet dilapisi kerena berbagai alasan. Beberapa alasannya seperti melindungi zat aktif dari udara, kelembaban, cahaya, bau, rasa atau bahan- bahan yang dapat merusak zat aktif. (WH0, 2006)
Tablet salut dibagi menjadi (International Pharmacopoeia,2006) : a. Tablet salut gula
Tablet yang dilapisi oleh gula untuk memperbaiki/ menutup rasa dari zat aktif.
b. Tablet salut film
Tablet yang disalut dengan lapisan tipis resin, polimer dan atau platicizer yang mampu membentuk film yang bertujuan untuk memperbaiki sifat
fisika kimia zat aktif. c. Tablet modified release
Tablet yang disalut oleh matriks yang mengandung bahan pengisi yang dibuat secara terpisah atau bersama dengan zat aktif yang berguna untuk memodifikasi laju pelepasan obat dalam tubuh.
2.5 Spironolakton
o Bentuk sediaan : Letonal tablet 100 mg
o Nama IUPAC : 7α-acetylthio-3-oxo-17α-pregn-4-ene-21,17-carbolactone o Berat molekul : 416.57
o Struktur kimia : C24H32O4S
Gambar 2.3. Struktur Spironolakton
UIN Syarif Hidayatullah Jakarta o Fisikokimia :
Pemerian : hablur krem muda hingga coklat muda, bau lemah seperti
merkaptan dan stabil di udara.
Kelarutan : praktis tidak larut dalam air, mudah larut dalam benzene
dan kloroform, larut dalam etil asetat dan alkohol, sukar larut dalam minyak lemah.
o Stabilitas :
Spironolakton tersedia secara komersial dalam beberapa kekuatan tablet untuk pemberian oral untuk orang dewasa dan anak-anak. Namun, ada kalanya digunakan untuk mengobati pasien lansia atau koma yang memerlukan persiapan dan penggunaan suspensi oral. The United States Pharmacopeia (USP) telah menetapkan beyond use dating (BUD) untuk sediaan oral dan topikal dalam berbagai kegunaan. Tujuan BUD adalah untuk memastikan pasien menyadari manfaat terapeutik produk suspensi oral yang disiapkan. Studi telah dilakukan untuk menentukan stabilitas spironolakton ketika disiapkan dalam suspensi di masa lalu.
Satu studi yang dilakukan oleh Nahata et al mengemukakan stabilitas suspensi spironolakton selama setidaknya 90 hari ketika suspensi disimpan di bawah pendinginan dan pada suhu kamar. Sebuah studi serupa yang dilakukan oleh Mathur et al meneliti tiga konsentrasi suspensi spironolakton (2,5, 5, dan 10 mg mL -1) pada tiga suhu yang berbeda (5°C, suhu kamar lingkungan, dan 30°C) untuk jangka waktu empat minggu. Hasil ini menunjukkan bahwa suspensi yang
stabil untuk masa studi empat minggu. Sebuah studi oleh Allen dan Erickson (1996) mengevaluasi 25 mg mL -1 suspensi spironolakton disimpan pada suhu 5 ° C dan 25 ° C selama periode enam puluh hari dan menemukan stabilitas kimia spironolakton dapat diterima sesuai standar USP. (Basusarkar et al, 2013)
12
UIN Syarif Hidayatullah Jakarta Gambar 2.4. Struktur Lakton
(Sumber: Banker, Gilbert S and C T Rhodes, 2002s 4th Ed)
Spironolakton umumnya dibuat dalam bentuk tablet salut film dengan kekuatan dosis 25, 50 dan 100 mg tidak dalam bentuk larutan ataupun suspensi. Spironolakton praktis tidak larut dalam air dan larut dalam alkohol. Sedikit larut dalam kondisi basa dengan stabilitas maksimum pada pH 4.5. Sediaan larutan oral yang dibuat dengan spironolakton stabil setidaknya selama 30 hari dan biasanya memiliki nilai pH akhir 3.5 – 6.5. (Mahmoud, Ismail M et al, 2014)
Dekomposisi spironolakton terhadap pengaruh pH menunjukkan bahwa
nilai pH optimum stabilitas untuk spironolakton adalah 4.5 pada suhu 40oC. sedangkan pengaruh kekuatan ionik dari dapar tidak memengaruhi secara konstan
dekomposisi dari spironolakton.Sehingga dapat diasumsikan bawha spironolakton yang tidak terionisasi bereaksi dengan ion H+ dan OH- Pada penelitian ini diteliti nilai dekomposisi spironolakton terhadap pengaruh pH menurut orde satu. Pada pH 4.5 efek pH menunjukkan nilai dekomposisi minimum dengan nilai K 0.00095. sedangkan pada suasana asam pH 2.3 nilai K adalah 0.0079. pada pH 7.3 nilai K yang diperoleh adalah 0.025 dan pada ph 8.3 nilai K= 0.126. (Pramar,et al, 1991)
Pembentukan metabolit dari spironolakton menjadi canrennone juga telah dilakukan dengan menggunakan reaksi kimia menggunakan medium air pada pH 13 melalui mekanisme deasetilasi. Pada tahap pertama terjadi hidrolisis cepat pada
pH 13, spironolakton berubah menjadi metabolitnya yaitu 7α-thiol. Tahap kedua adalah eliminasi H2S secara perlahan dan membentuk canrenone. (W. Sadée, et al, 1974)
o Indikasi :
UIN Syarif Hidayatullah Jakarta
mineralokortikoid adalah protein intraseluler yang dapat mengikat aldosteron. spironolakton mengikat reseptor dan kompetitif menghambat aldosteron mengikat reseptor. ketidakmampuan aldosteron untuk mengikat reseptor mencegah reabsorpsi natrium dan klorida ion dan air yang terkait. situs yang paling penting dari reseptor ini adalah pada akhir distal rumit tubulus dan mengumpulkan sistem. (Bernal et al, 2014; Lemke, Thomas L et al)
Spironolakton menghambat efek aldosteron dengan bersaing menuju reseptor aldosteron intraseluler dalam sel tubulus distal (benar-benar bekerja pada reseptor aldosteron di saluran pengumpul). Hal ini meningkatkan ekskresi air dan natrium, sekaligus mengurangi ekskresi kalium. Spironolakton memiliki onset cukup lambat. Spironolakton memiliki aktivitas anti-androgen dengan cara mengikat reseptor androgen dan mencegah dari berinteraksi dengan dihidrotestosteron. (Kher et al, 2013)
Pada pemberian oral, sekitar 90% dari dosis spironolakton diserap dan dimetabolisme secara signifikan selama first pass metabolism oleh hati akan
membentuk metabolit aktif, yaitu canrenone. Canrenone merupakan antagonis aldosteron. Anion canrenoate tidak aktif sebagai antagonis aldosteron berbeda dengan canrenone, yang ada dalam bentuk lakton. canrenone telah diusulkan untuk menjadi bentuk aktif dari spironolakton sebagai antagonis aldosteron. pembentukan canrenone, bagaimanapun, tidak bisa sepenuhnya menjelaskan aktivitas total spironolakton. Baik canrenone dan kalium canrenoate digunakan sebagai diuretik di negara lain, namun belum tersedia di AS. (Lemke, Thomas L et al)
Pengujian kadar dengan KCKT menurut USP :
Fase gerak : Campuran methanol : air (60:40)
Larutan standar : dilarutkan dengan asetonitril:air (50:50) secara
kuantitatif hingga didapat 0,5 mg/ml
Detektor : 250 nm
Laju alir : 1 ml/ menit
Tailing factor : Tidak lebih dari 20
14
UIN Syarif Hidayatullah Jakarta 2.6 Kromatografi Cair Kinerja Tinggi (KCKT)
KCKT merupakan teknik pemisahan yang diterima secara luas untuk analisis dan pemurnian senyawa tertentu dalam suatu sampel pada sejumlah bidang antara lain; farmasi, lingkungan dan industri-industri makanan. Kegunaan umum KCKT adalah untuk pemisahan sejumlah senyawa organik, anorganik, maupun senyawa biologis, analisis ketidakmurnian (impurities) dan analisis senyawa-senyawa yang tidak mudah menguap (non volatil).
KCKT paling sering digunakan untuk: menetapkan kadar senyawa-senyawa tertentu seperti asam-asam amino, asam-asam nukleat dan protein- protein dalam cairan fisiologis, menentukan kadar senyawa -senyawa aktif obat dan lain-lain. Kelebihan KCKT antara lain:
Mampu memisahkan molekul-molekul dari suatu campuran
Resolusinya baik
Mudah melaksanakannya
Kecepatan analisis dan kepekaannya tinggi
Dapat dihindari terjadinya dekomposisi/kerusakan bahan yang
dianalisis
Dapat digunakan bermacam-macam detector
Kolom dapat digunakan kembali
Mudah melakukan rekoveri cuplikan
Tekniknya tidak begitu tergantung pada keahlian operator dan reprodusibilitasnya lebih baik
Instrumennya memungkinan untuk bekerja secara otomatis dan
kuantitatif
Waktu analisis umumnya singkat
Kromatografi cair preparatif memungkinkan dalam skala besar
Ideal untuk molekul besar dan ion.
UIN Syarif Hidayatullah Jakarta
A. Cara Kerja KCKT
Kromatografi merupakan teknik yang mana solut atau zat-zat terlarut terpisah oleh perbedaan kecepatan elusi, dikarenakan solut-solut ini melewati suatu kolom kromatografi. Pemisahan solut-solut ini diatur oleh distribusi dalam fase gerak dan fase diam. Penggunaan kromatografi cair membutuhkan penggabungan secara tepat dari berbagai macam kondisi operasional seperti jenis kolom, fase gerak, panjang dan diameter kolom, kecepatan alir fase gerak, suhu kolom, dan ukuran sampel. (Rohman, 2007)
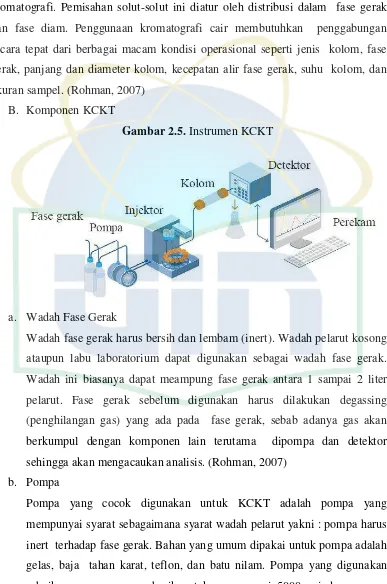
B. Komponen KCKT
Gambar 2.5. Instrumen KCKT
a. Wadah Fase Gerak
Wadah fase gerak harus bersih dan lembam (inert). Wadah pelarut kosong ataupun labu laboratorium dapat digunakan sebagai wadah fase gerak. Wadah ini biasanya dapat meampung fase gerak antara 1 sampai 2 liter pelarut. Fase gerak sebelum digunakan harus dilakukan degassing (penghilangan gas) yang ada pada fase gerak, sebab adanya gas akan berkumpul dengan komponen lain terutama dipompa dan detektor sehingga akan mengacaukan analisis. (Rohman, 2007)
b. Pompa
Pompa yang cocok digunakan untuk KCKT adalah pompa yang mempunyai syarat sebagaimana syarat wadah pelarut yakni : pompa harus
inert terhadap fase gerak. Bahan yang umum dipakai untuk pompa adalah gelas, baja tahan karat, teflon, dan batu nilam. Pompa yang digunakan
16
UIN Syarif Hidayatullah Jakarta
mengalirkan fase gerak dengan kecepatan alir 3 ml/menit. Untuk tujuan preparatif, pompa yang digunakan harus mampu mengalirkan fase gerak dengan kecepatan 20 mL/ menit. (Rohman, 2007)
c. Injektor
Ada 3 jenis injektor, yakni syringe injector, loop valve dan automatic injector (autosampler). Syringe injector merupakan bentuk injektor yang paling sederhana. Pada waktu sampel diinjeksikan ke dalam kolom, diharapkan agar aliran pelarut tidak mengganggu masuknya keseluruhan sampel ke dalam kolom. Sampel dapat langsung diinjeksikan ke dalam kolom (on column injection) atau digunakan katup injeksi. (Adnan, 1997; Meyer, 2004)
d. Kolom
Kolom merupakan jantung kromatografi. Keberhasilan atau kegagalan
analisis bergantung pada pemilihan kolom dan kondisi kerja yang tepat. Kolom dapat dibagi menjadi dua kelompok :
Kolom analitik : garis tengah dalam 2 – 6 nm. Panjang bergantung
pada jenis kemasan,untuk kemasan pelikel biasanya panjang kolom 50
– 100 cm. Untuk kemasan mikropartikel berpori, biasanya 10 – 30cm;
Kolom preparatif : umumnya bergaris tengah 6 mm atau lebih besar
dan panjang kolom 25 – 100 cm. Kolom umumnya dibuat dari stainless steel dan biasanya dioperasikan pada temperatur kamar, tetapi bisa juga digunakan temperatur lebih tinggi, terutama untuk
kromatografi penukar ion dan kromatografi eksklusi. Kemasan kolom tergantung pada mode KCKT yang digunakan. (Johnson, 1991)
e. Detektor
UIN Syarif Hidayatullah Jakarta
f. Fase Gerak
Fase gerak atau eluen biasanya terdiri atas campuran pelarut yang dapat bercampur yang secara keseluruhan berperan dalam daya elusi dan resolusi. Daya elusi dan resolusi ini ditentukan oleh polaritas keseluruhan pelarut, polaritas fase diam, dan sifat komponen-komponen sampel Dalam kromatografi cair komposisi pelarut atau fase gerak adalah satu variabel yang mempengaruhi pemisahan.(Johnson, 1991).
Gelembung udara (degassing) yang ada harus dihilangkan dari pelarut, karena udara yang terlarut keluar melewati detektor dapat menghasilkan banyak noise sehingga data tidak dapat digunakan (Johnson, 1991). C. Validasi
Validasi adalah suatu tindakan terhadap parameter tertentu pada prosedur penetapan yang dipakai untuk membuktikan bahwa parameter tersebut
memenuhi persyaratan untuk penggunaannya. Parameter analisis yang ditentukan pada uji kesesuaian system adalah akurasi, presisi, batas
deteksi, batas kuantitasi, spesifikasi, linieritas dan rentang, kekasaran (Ruggedness) dan ketahanan (Robutness). (WHO, 1992)
a. Presisi
Merupakan ukuran keterulangan metode analisis dan biasanya diekspresikan sebagai relatif standar deviasi (RSD) dari sejumlah sampel yang berbeda secara signifikan secara statistik.
b. Batas deteksi (limit of detection, LOD)
Didefinisikan sebagai konsentrasi analit terendah dalam sampel yang masih dapat terdeteksi.
c. Batas kuantitasi (limit of quantitation, LOQ)
Didefinisikan sebagai konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan.
d. Linieritas
18 UIN Syarif Hidayatullah Jakarta
BAB III
METODE PENELITIAN 3.1. Tempat dan Waktu Penelitian
Tempat Penelitian :
Penelitian dilakukan di laboratorium Pharmacy Natural Analysis Kampus FKIK UIN Syarif Hidayatullah Jakarta.
Waktu Penelitian :
Waktu Penelitian yaitu sekitar bulan November 2014 – April 2015
3.2. Alat dan Bahan
Alat yang diperlukan meliputi KCKT (Dionex Ultimate 3000) yang terdiri
dari pompa, autosampler, kolom, detector DAD (Diode Array Detector) dan program komputer PC (Chromaleon) sebagai instrumental uji utama. Spektrofotometer Uv-Visible (Hitachi u-2910), Ultrasonikator (Branson 5510), pH Meter (Horiba), dan magnetic Stirer. Neraca digital, mikropipet, syringe filter, peralatan gelas dan spuit.
Bahan yang diperlukan meliputi bahan Uji utama yaitu tablet spironolakton dengan merek letonal (mengandung Spironolakton 25 mg). spironolakton standar (Sigma-Aldirch) Aquabidest (Wida) Dan metanol Grade KCKT (Merck) Untuk pengujian pH menggunakan larutan dapar yang dibuat dari KH2PO4 dan K2HPO4.
3.3 Prosedur Kerja
3.3.1. Pembuatan Fase Gerak
Fase gerak digunakan dari campuran methanol : Air 60: 40 yang merupakan fase gerak untuk pengujian spironolakton menurut USP. Pembuatan fase gerak ini adalah dengan cara mencampurkan methanol
Grade KCKT dan Aquabidest dengan perbandingan 60:40 secara kuantitatif. Kemudian disaring dan dilakukan proses penghilangan
gelembung dengan cara sonikasi. 3.3.2. Preparasi Standar
UIN Syarif Hidayatullah Jakarta
3.3.3. Optimasi dan Validasi
Optimasi dan validasi yang dilakukan yaitu meliputi penentuan panjang gelombang maksimum, uji presisi, akurasi, LOD, LOQ dan kurva
kalibrasi larutan standar.
A. Penentuan Panjang Gelombang Maksimum
Penentuan panjang gelombang maksimum untuk spironolakton menggunakan spetrofotometer UV-Vis. Pengujian ini dengan mengencerkan larutan induk standar hingga konsentrasi 10 ppm. Larutan tersebut kemudian diuji serapannya dengan rentang panjang gelombang 200- 400 nm. dan dicatat nilai serapan dan panjang gelombang maksimumnya.
B. Uji Kesesuaian Sistem
Optimasi alat dilakukan sesuai dengan Farmakope Indonesia yatu dengan menggunakan 1 konsentrasi larutan standar yang diencerkan hingga diperoleh konsentrasi 100 ppm yang diinjeksikan sebanyak 6 kali yang dideteksi dengan menggunakan panjang gelombang maksimum.
C. Pembuatan kurva kalibrasi
Kurva kalibrasi spironolakton dibuat dengan menggunakan rentang konsentrasi spironolakton 25, 50, 75, 100, 125 dan 150 ppm yang dibuat
dengan cara mengencerkan larutan standar. Masing-masing konsentrasi diinjeksikan sebanyak 50µl duplo dengan pengujian menggunakan
panjang gelombang maksimum. Dan akan didapatkan nilai absorbansi dan dibuat dalam bentuk kurva yang linear. Serta dapat dihitung nilai LOD dan LOQ.
D. Uji Akurasi
20
UIN Syarif Hidayatullah Jakarta
dengan menggunakan panjang gelombang maksimum dan dibandingkan
hasil pembacaan nilai konsentrasi oleh KCKT dengan nilai konsentrasi yang dibuat. Pada pengujian ini akan didapatkan nilai persentase perolehan
kembali (recovery) dengan range 95%-105%, dan persentase differensiasi. E. Uji Presisi
Uji presisi dilakukan dengan menginjeksikan larutan standar yang dibuat hingga diperoleh konsentrasi 120, 100 dan 80 ppm sebanyak 3 kali. Pengujian ini dilakukan secara intraday dalam saat 0 jam, 9 jam dan 24 jam. Dan pengujian interday yaitu hari pertama (0 jam) dan hari kedua (48 jam). Lalu dihitung nilai SD dan Persentase RSD dengan batasan nilai
RSD ≤ 2.
3.3.4. Preparasi dan Pengujian Sampel
a. Pembuatan Dapar (Europe Pharmacopeia)
1. Dapar pH 3 dibuat dengan KH2PO4 0,34 gr yang dilarutkan ke dalam 40 ml aquabiset. Kemudian di cek dengan pH meter, kemudian diadjust dengan menggunakan asam ortofosfat hingga ph 3. Kemudian dicukupkan dengan aquabidest hingga 50 ml.
2. Dapar pH 9 dibuat dengan K2HPO4 0,34 gr yang dilarutkan ke dalam 40 ml aquabiset. Kemudian di cek dengan pH meter, kemudian
diadjust dengan menggunakan NaOH hingga ph 9. Kemudian dicukupkan dengan aquabidest hingga 50 ml.
b. Penyiapan Sampel
UIN Syarif Hidayatullah Jakarta
c. Pengujian Sampel
Cuplikan yang telah diambil diencerkan dengan metanol dan diajust dengan dapar fosfat untuk menyamakan pH sampel dengan pH optimum
34 UIN Syarif Hidayatullah Jakarta
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Persen kadar spironolakton dalam rentang waktu 0-60 menit pada pH 3
adalah 19%, 21%, 22%,27%,dan 40%. Pada pH 5 100%,88%,85%,74% dan
91%. Pada pH 7 61%,46%,38%,27%,dan 35%. Pada pH 9
54%,50%,41%,38%, dan 38%.
2. Kadar spironolakton pada pH 3, 7, dan 9 pada semua menit sudah tidak
dapat memenuhi syarat sesuai ketentuan kadar spironolakton dalam sediaan.
Sedangkan pada pH 5 pada menit ke-0 saja yang masih memenuhi syarat.
3. Dengan perubahan suasana pH semakin jauh dari pH optimum yaitu 4.5
baik asam maupun basa, semakin besar penurunan persentase kadar
spironolakton dalam sediaan suspensi sederhana.
5.2. Saran
1. Diperlukan pengujian dengan fase gerak yang berbeda agar dapat
memisahkan peak kromatogram yang berdempetan dengan peak
kromatogram sampel
2. Diperlukan pengujian mengenai hasil samping dari degradasi
UIN Syarif Hidayatullah Jakarta
DAFTAR PUSTAKA
Adnan, M, 1997, Teknik Kromatografi untuk Analisis Makanan, Penerbit Andi Alim, Yogyakarta
Anonim, World Health Organizations, 1992
Anonim. Europe Pharmacopeia
Ansel H.C, 1994., Pengantar Bentuk Sediaan Farmasi, ed 4, Penerjemah Farida Ibrahim, Universitas Indonesia Press, Jakarta, 155-164
Attwood D dam Florence, 2011, Physicochemical Principles of Pharmacy Ed.5, Chapman and Hall Inc
Banker, Gilbert S and C T Rhodes, 2002, Modern Pharmaceutics: Fourth Edition, Revised, and Expanded, Marcel Dekker, Inc, New York
Basusarkar, Arindam et al,2013, Chemical Stability of Compounded Spironolactone Suspension in Proprietary Oral Mix Over a 90-day Period at Two Controlled Temperatures in Different Storage Containers, Int. J. Pharm. Sci. Rev. Res., 23(1), Nov-Dec 2013, ISSN 0976044X
Bernal, Nora Provenza et al, 2014, Development, Physical-Chemical Stability, and Release Studies of Four Alcohol-Free Spironolactone Suspensions for Use in Pediatrics, dx.doi.org/10.14227/DT210114P19
Connor K.A, Amidan, Kennon L, 1994., Chemical Stability of Pharmaceuticals, John Willey and Sons, New York, 8-17
David B. Troy,Paul Beringer, 2006, Remington's Pharmaceutical Sciences, 21th ed, Lippincott Williams & Wilkins,
Departemen Kesehatan, 1995., Farmakope Indonesia, edisi IV, Direktorat Jenderal Pengawasan Obat dan Makanan, Jakarta
Haywood, Alison and Beverley, Glass, 2013, Liquid Dosage Forms Extemporaneously Prepared from Commercially Available Products- Considering New Evidence on Stability, J Pharm Sci 441- 455
Johnson, E L dan Stevenson, 1991, DASAR KROMATOGRAFI CAIR, Penerjemah: Kosasih Padmawinata, Penerbit ITB
35
UIN Syarif Hidayatullah Jakarta Lachman, L., Lieberman, H. A., Kanig, J. L., 2007, Teori dan Praktek Farmasi Industri,
Edisi ketiga, diterjemahkan oleh: Suyatmi, S., Penerbit Universitas Indonesia, Jakarta, 760-779, 1514 – 1587
Lee, David C, M L Webb, 2009, Pharmaceutical Analysis, Wiley
Lemke, Thomas L et al, Foye’s Principles of Medical Chemistry Sixth Edition, Wolters
Kluwer Health Lippincott Williams & Wilkins
Mahmoud, Ismail M et al, 2014, Extemporaneous Preparations of Pediatric Oral Formulations: Stability Studies Conducted In Spironolactone Suspensions, Powders and Capsules in Saudi Hospital Pharmacies, Journal of Global Trends in Pharmaceutical Sciences Vol. 5 Issue-2, ISSN: 2230-7346
Meyer. V R, 2004, Practical High-Performance Liquid Chromatography, Chichester: John Wiley and Sons Inc
Min Li, 2012, Organic Chemistry of Drug Degradation, The Royal Society of Chemistry, Cambridge
Munson J W, 2000, Analisa Farmasi Metode Modern, The Upjohn Company Kalamazoo, Michigan
Niazi, Sarfaraz, 2006, Handbook of Preformulation: Chemical, Biological, and Botanical Drugs, Informa Healthcare USA Inc, New York
Pramar, Yasoda and V, D. Gupta, 1990, Preformulation Studies of Spironolactone : Effect of pH, Two Buffer Species, Ionic Strength, and Temperature on Stability, Departemen of Pharmaceutics, University of Houston, TX 77030
Rohman, Abdul, 2007, Kimia Farmasi Analisis, Pustaka Pelajar, Yogjakarta
The United States pharmacopoeia, 1990, 22nd., United States Pharmacopoeia Convention, Twin Brook Parkway, Rockville, 1226-1228, 1703
W. Sadee,U.Abshagen, C. Finn, and N. Rietbrock, 1974, Conversion of Spironolactone to Canrenone and Disposition Kinetics of Spironolactone and Canrenoate-Potassium in Rats, Naunyn-Schmiedeberg’s Arch. Pharmacol. 283, 303-318
37
UIN Syarif Hidayatullah Jakarta Lampiran 1. Alur Kerja
Optimasi HPLC
didiamkan dalam rentang waktu yang dibedakan yaitu 0 menit, 15 menit, 30 menit, 45 menit dan 60 menit dan
disonikasi selama 1 menit pada setiap rentang waktu.
Analisa degradasi kadar
dengan KCKT
39
UIN Syarif Hidayatullah Jakarta Lampiran 4. Perhitungan Persiapan Kurva Kalibrasi
Massa Spironolakton standar : 50 mg
Dilarutkan dalam 50 ml methanol
= 1000µg/ml~ 1000 ppm
Diencerkan dalam labu ukur 5 ml
Seri Konsentrasi 25, 50, 75, 100, 125, 150 ppm
Pembuatan larutan konsentrasi 25 ppm
M1V1 = M2V2
1000V1 = 25.5
V1 = 0,125ml ~ 125µl
Pembuatan larutan konsentrasi 50 ppm
M1V1 = M2V2
1000V1 = 50.5
V1 = 0,25ml ~ 250µl
Pembuatan larutan konsentrasi 75 ppm
M1V1 = M2V2
1000V1 = 75.5
V1 = 0,375ml ~ 375µl
Pembuatan larutan konsentrasi 100 ppm
M1V1 = M2V2
1000V1 = 100.5
41
UIN Syarif Hidayatullah Jakarta Pembuatan larutan konsentrasi 125 ppm
M1V1 = M2V2
1000V1 = 125.5
V1 = 0,625ml ~ 625µl
Pembuatan larutan konsentrasi 150 ppm
M1V1 = M2V2
1000V1 = 150.5
UIN Syarif Hidayatullah Jakarta Lampiran 5. Kromatogram Larutan Standar dan Tablet
Kromatogram Larutan Standar
43
UIN Syarif Hidayatullah Jakarta Lampiran 7. Kurva Dan Tabel Kalibrasi
45
UIN Syarif Hidayatullah Jakarta Lampiran 9. Hasil Uji Kesesuaian Sistem
Parameter Syarat Hasil Rata-rata Keterangan
RSD Peak Waktu retensi <2
0.039
Theoritical plates (USP) ≥2500
47
UIN Syarif Hidayatullah Jakarta Lampiran 10. Hasil Uji Akurasi
konsentrasi
rata-rata 138.0616 145.3655 -5.0245 94.9755
No x A B %diff %recovery
rata-rata 187.68568 181.0775 3.6494 103.6494
No x A B %diff %recovery
UIN Syarif Hidayatullah Jakarta Lampiran 11. Hasil Uji Presisi
Kons Jam ke- Hasil
142.71406 2.3223 1.6391
48
141.31874 2.0611 1.4659
100
189.32746 1.1378 0.6029
24
49
UIN Syarif Hidayatullah Jakarta 120
217.89378 1.3285 0.6086
UIN Syarif Hidayatullah Jakarta Lampiran 12. Perhitungan Preparasi Sampel dan Perhitungan Luas Area secara Manual
Berat total sampel : 25 mg Spironolakton
Volume Suspensi : 50 ml aquadest
= 500µg/ml~ 500 ppm
Pengenceran 100 ppm, konsentrasi yang diinjekkan ke dalam KCKT
Diambil cuplikan 300 µl dan dicukupkan dengan methanol-dapar hingga 1500 µl
M1V1 = M2V2
500V1 = 100.1500
V1 = 300 µl
Rumus perhitungan Luas Area (mAu) secara manual
x
= mAu
Rumus Perhitungan Konsentrasi Akhir Spironolakton
y = 1.7856x + 2.5175
diketahui :
y = Luas Area
x = Konsentrasi Spironolakton
Rumus Perhitungan Persentase Kadar
51
UIN Syarif Hidayatullah Jakarta Lampiran 14. Hasil dan Kurva pH 3
Waktu Area / SD
Konsentrasi
Awal (ppm)
Konsentrasi
Akhir (ppm)
Persen Kadar (%)
0 36.30697 / 2.76 100 18.92331 19
15 40.24055 / 2.04 100 21.12626 21
30 42.4618 / 2.32 100 22.37024 22
45 50.07035 / 0.033 100 26.6313 27
60 73.4604 / 1.81 100 39.73057 40
53
UIN Syarif Hidayatullah Jakarta Lampiran 16. Hasil dan Kurva pH 5
Waktu Area / SD
Konsentrasi
Awal (ppm)
Konsentrasi Akhir
(ppm)
Persen Kadar
(%)
0 181.6558 / 3.23 100 100.3284 100
15 159.02 / 2.22 100 87.647 88
30 154.596 / 2.49 100 85.16941 85
45 135.2707 / 0.90 100 74.34653 74
60 164.145 / 0.58 100 90.51719 91
55
UIN Syarif Hidayatullah Jakarta Lampiran 19. Hasil dan Kurva pH 7
Waktu Area / SD
Konsentrasi
Awal (ppm)
Konsentrasi Akhir
(ppm)
Persen Kadar
(%)
0 110.9063 / 4.46 100 60.70258 61
15 83.81825 / 2.02 100 45.53133 46
30 115.9023 / 0.62 100 38.46485 38
45 202.6765 / 0.17 100 26.96664 27
60 262.6525 / 1.17 100 35.36381 35
57
UIN Syarif Hidayatullah Jakarta Lampiran 20. Hasil dan Kurva pH 9
Waktu Area / SD
Konsentrasi
Awal (ppm)
Konsentrasi
Akhir (ppm)
Persen Kadar
(%)
0 98.4725 / 1.12 100 53.73824 54
15 90.92292 / 0.21 100 49.5102 50
30 76.1625 / 0.22 100 41.24384 41
45 70.68675 / 1.11 100 38.17722 38
60 70.305 / 1.28 100 37.96343 38
59
UIN Syarif Hidayatullah Jakarta
0.0000 20.0000 40.0000 60.0000 80.0000 100.0000 120.0000
0 10 20 30 40 50 60 70
kon
sent
ra
si
Waktu
ph 3
ph 5
ph 7
ph 9
UIN Syarif Hidayatullah Jakarta Lampiran 22. Hasil Uji Statistik ANOVA, Normalitas dan Homogenitas
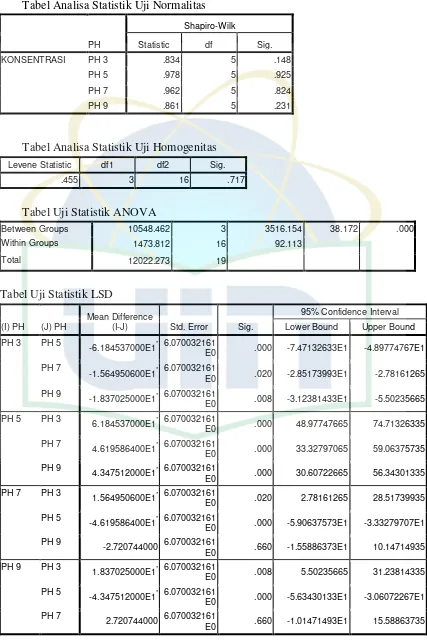
Tabel Analisa Statistik Uji Normalitas
PH
Tabel Analisa Statistik Uji Homogenitas
Levene Statistic df1 df2 Sig.
.455 3 16 .717
Tabel Uji Statistik ANOVA
Between Groups 10548.462 3 3516.154 38.172 .000 Within Groups 1473.812 16 92.113
Total 12022.273 19
Tabel Uji Statistik LSD
(I) PH (J) PH
Mean Difference
(I-J) Std. Error Sig.
95% Confidence Interval
Lower Bound Upper Bound
PH 3 PH 5 -6.184537000E1* 6.070032161
E0 .000 -7.47132633E1 -4.89774767E1
PH 7
-1.564950600E1* 6.070032161
E0 .020 -2.85173993E1 -2.78161265
PH 9
-1.837025000E1* 6.070032161E0 .008 -3.12381433E1 -5.50235665
PH 5 PH 3 6.184537000E1* 6.070032161
E0 .000 48.97747665 74.71326335 PH 7
4.619586400E1* 6.070032161E0 .000 33.32797065 59.06375735
PH 9
4.347512000E1* 6.070032161E0 .000 30.60722665 56.34301335
PH 7 PH 3
1.564950600E1* 6.070032161E0 .020 2.78161265 28.51739935
PH 5
-4.619586400E1* 6.070032161
E0 .000 -5.90637573E1 -3.33279707E1 PH 9
-2.720744000 6.070032161E0 .660 -1.55886373E1 10.14714935
PH 9 PH 3
1.837025000E1* 6.070032161
E0 .008 5.50235665 31.23814335 PH 5
-4.347512000E1* 6.070032161
E0 .000 -5.63430133E1 -3.06072267E1 PH 7
2.720744000 6.070032161