LAMPIRAN
Lampiran 2. Gambar tumbuhan dan daun kelor (Moringa oleifera Lam.)
Gambar 1. Tumbuhan kelor (Moringa oleifera Lam.)
Lampiran 3. Gambar simplisia dan serbuk daun kelor
Gambar 3. Panjang dan Lebar Daun kelor
Gambar 4. Simplisia daun kelor
Lampiran 4. Gambar mikroskopik daun kelor segar dan serbuk simplisia daun
kelor
Keterangan :
Penampang melintang daun kelor segar Perbesaran 10x40
1. Kutikula (Lapisan lilin) 2. Epidermis atas
3. Jaringan palisade (jaringan tiang) 4. Jaringan spons (jaringan bunga karang) 5. Kristal oksalat bentuk druse
6. Epidermis bawah 7. Rambut penutup 8. Berkas pembuluh 9. Stoma
1 2 3 4
6 5
Lampiran 4. (Lanjutan)
Keterangan :
Mikroskopik serbuk simplisia daun kelor Perbesaran 10x40
1. Stomata tipe anomositik pada epidermis bawah 2. Rambut penutup
3. Sel minyak 4. Berkas pembuluh
5. Kristal oksalat bentuk druse
1
2
3
4
Lampiran 5. Perhitungan hasil pemeriksaan karakterisasi simplisia daun kelor
1. Perhitungan penetapan kadar air
a. Berat sampel = 5,026 g
Volume air = Vt-Vo = 2,2 ml - 1,8 ml = 0,40 ml Kadar air = 0,40
5,026x 100% = 7,958%
b. Berat sampel = 5,015 g
Volume air = Vt-Vo = 2,15 ml - 1,8 ml = 0,35 ml Kadar air = 0,35
5,015 x 100% = 6,979%
c. Berat sampel = 5,013 g
Volume air = Vt-Vo = 2,15 ml - 1,8 ml = 0,35 ml Kadar air = 0,35
5,013 x 100% = 6,981%
Kadar air rata-rata = (7,958+6,979+6,981)%
3 = 7,306%
Kadar air simplisia = volume air
Lampiran 5. (Lanjutan)
2. Perhitungan penetapan kadar sari larut dalam air
a. Berat sampel = 5,011 g Berat sari = 0,3143 g Kadar sari = 0,3143
5,011 x 100
20 x 100% = 31,361%
b. Berat sampel = 5,017 g Berat sari = 0,2817 g Kadar sari = 0,2817
5,0170 x 100
20 x 100% = 28,074%
c. Berat sampel = 5,015 g Berat sari = 0,2710 Kadar sari = 0,2710
5,015 x 100
20 x 100% = 27,018%
Kadar sari rata-rata = (31,361 +28,074 +27,018)%
3 = 29,717%
Kadar sari = berat sari
berat sampel x 100
Lampiran 5. (Lanjutan)
3. Perhitungan penetapan kadar sari larut dalam etanol
a. Berat sampel = 5,012 g Berat sari = 0,1792 g Kadar sari = 0,1792
5,012 x 100
20 x 100% = 17,877%
b. Berat sampel = 5,015 g Berat sari = 0,2334 g Kadar sari = 0,2334
5,015 x 100
20 x 100% = 23,270%
c. Berat sampel = 5,017 g Berat sari = 0,212g Kadar sari = 0,212
5,017 x 100
20 x 100% = 21,128%
Kadar sari rata-rata = (17,877+23,270+21,128)%
3 = 20,573%
Kadar sari = berat sari
berat sampel x 100
Lampiran 5. (Lanjutan)
4. Perhitungan penetapan kadar abu total
a. Berat sampel = 2,016 g Berat abu = 0,187 g Kadar abu = 0,187
2,016 x 100% = 9,27%
b. Berat sampel = 2,012 g Berat abu = 0,175 g Kadar abu = 0,175
2,012 x 100% = 8,69%
c. Berat sampel = 2,020 g Berat abu = 0,188 g Kadar abu = 0,188
2,020 x 100% = 9,30%
Kadar abu total rata-rata = (9,27+8,69+9,30)%
3 = 9,08%
Kadar abu total = berat abu
Lampiran 5. (Lanjutan)
5. Perhitungan penetapan kadar abu tidak larut asam
a. Berat sampel = 2,016 g Berat abu = 0,017 g Kadar abu = 0,017
2,016 x 100% = 0,84%
b. Berat sampel = 2,012 g Berat abu = 0,016 g Kadar abu = 0,016
2,012 x 100% = 0,79%
c. Berat sampel = 2,020 g Berat abu = 0,021 g Kadar abu = 0,021
2,020 x 100% = 1,03%
Kadar abu total rata-rata = (0,84 + 0,79 + 1,03)%
3 = 0,88%
Kadar abu tidak larut asam = berat abu
Lampiran 6. Gambar biji kelor (Moringa oleifera Lam.)
Gambar 6. Biji kelor yang terdapat di dalam buah
Lampiran 6. (Lanjutan)
Gambar 8. Biji kelor segar dengan Gambar 9. Biji kelor kering dengan
kulit biji kulit biji
Gambar 10. Simplisia biji kelor
Lampiran 7. Gambar mikroskopik biji kelor segar dan serbuk simplisia biji kelor
Keterangan:
Penampang melintang biji kelor segar Perbesaran 10x40
1. Lapisan kutikula 2. Lapisan lendir 3. Epidermis atas
4. Jaringan palisade (jaringan tiang) 5. Parenkim dengan minyak atsiri 6. Embrio
7. Berkas pembuluh 8. Sel batu
9. Sklerenkim
Lampiran 7. (Lanjutan)
Keterangan:
Mikroskopik serbuk simplisia biji kelor Perbesaran 10x40
1. Parenkim dengan minyak atsiri 2. Sklerenkim
3. Berkas pembuluh 4. Sel batu
1
2
3
Lampiran 8. Perhitungan hasil pemeriksaan karakterisasi simplisia biji kelor
1. Perhitungan penetapan kadar air
a. Berat sampel = 5,013 g
Volume air = Vt-Vo = 2,0 ml - 1,8 ml = 0,20 ml Kadar air = 0,20
5,013 � 100% = 3,989%
b. Berat sampel = 5,015 g
Volume air = Vt-Vo = 2,0 ml - 1,8 ml = 0,20 ml Kadar air = 0,20
5,015 x 100% = 3,988%
c. Berat sampel = 5,018 g
Volume air = Vt-Vo = 2,05 ml - 1,8 ml = 0,25 ml Kadar air = 0,25
5,018 x 100% = 4,982%
Kadar air rata-rata = (3,989+3,988+4,982)%
3 = 4,319%
Kadar air simplisia = volume air
Lampiran 8. (Lanjutan)
2. Perhitungan penetapan kadar sari larut dalam air
a. Berat sampel = 5,018 g Berat sari = 0,1880 g Kadar sari = 0,1880
5,018 x 100
20 x 100% = 18,732%
b. Berat sampel = 5,024 g Berat sari = 0,376 g Kadar sari = 0,1843
5,024 x 100
20 x 100% = 18,342%
c. Berat sampel = 5,028 g Berat sari = 0,1978 Kadar sari = 0,1978
5,028 x 100
20 x 100% = 19,669%
Kadar sari rata-rata = (18,732 +18,342+19,669)%
3 = 18,914%
Kadar sari = berat sari
berat sampel x 100
Lampiran 8. (Lanjutan)
3. Perhitungan penetapan kadar sari larut dalam etanol
a. Berat sampel = 5,023 g Berat sari = 0,1540 g Kadar sari = 0,1540
5,023 x 100
20 x 100% = 15,329%
b. Berat sampel = 5,026 g Berat sari = 0,1370 g Kadar sari = 0,1370
5,026 x 100
20 x 100% = 13,629%
c. Berat sampel = 5,027 g Berat sari = 0,1612g Kadar sari = 0,1612
5,027 x 100
20 x 100% = 16,033%
Kadar sari rata-rata = (16,98+11,99+17,97)%
3 = 14,997%
Kadar sari = berat sari
berat sampel x 100
Lampiran 8. (Lanjutan)
4. Perhitungan penetapan kadar abu total
a. Berat sampel = 2,013 g Berat abu = 0,1750 g Kadar abu = 0,1750
2,013 x 100% = 8,693%
b. Berat sampel = 2,017 g Berat abu = 0,1761 g Kadar abu = 0,1761
2,017 x 100% = 8,730%
c. Berat sampel = 2,022 g Berat abu = 0,1814 g Kadar abu = 0,1814
2,022 x 100% = 8,971%
Kadar abu total rata-rata = (8,693+8,730+8,971)%
3 = 8,978%
Kadar abu total = berat abu
Lampiran 8. (Lanjutan)
5. Perhitungan penetapan kadar abu tidak larut asam
a. Berat sampel = 2,013 g Berat abu = 0,0171 g Kadar abu = 0,0171
2,013 x 100% = 0,849%
b. Berat sampel = 2,017 g Berat abu = 0,0184 g Kadar abu = 0,0184
2,017 x 100% = 0,912%
c. Berat sampel = 2,022 g Berat abu = 0,0199 g Kadar abu = 0,0199
2,022 x 100% = 0,984%
Kadar abu total rata-rata = (0,849 + 0,912 + 0,984)%
3 = 0,915%
Kadar abu tidak larut asam = berat abu
Lampiran 9. Bagan kerja penelitian untuk daun kelor
Dipisahkan dari pengotornya Dicuci, ditiriskan dan dikeringkan Ditimbang
Dikeringkan pada suhu ± 40ºC Ditimbang
Diblender/dihaluskan Daun kelor 3,0 kg
Simplisia 395 g
Serbuk daun kelor
Uji karakterisasi simplisia Penetapan kadar magnesium dan besi dengan metode AAS Daun kelor yang
telah di ambil
Pemeriksaan makroskopik
Penetapan kadar air Pemeriksaan mikroskopik
Penetapan kadar sari larut dalam air Penetapan kadar sari larut etanol Penetapan kadar abu total
Lampiran 10. Bagan alir proses destruksi kering (simplisia daun kelor)
Ditimbang 5 g di dalam krus porselen Ditambahkan 5 tetes Asam Nitrat 65% (b/v) Diarangkan di atas hot plate
Diabukan dalam tanur dengan temperatur awal 100°C dan perlahan-lahan temperatur dinaikkan hingga suhu 500°C dengan interval 25°C setiap 5 menit
Dilakukan selama 75 jam dan dibiarkan hingga dingin di dalam tanur
Ditambahkan 5 ml Asam Nitrat (1:1) Diuapkan pada hot plate sampai kering Serbuk daun kelor
Sampel yang telah mengarang
Sampel yang telah mengabu
Lampiran 11. Bagan kerja penelitian untuk biji kelor
Dikeluarkan bijinya
Dicuci, ditiriskan dan dikeringkan Ditimbang
Dikeringkan pada suhu ± 40ºC Dibuang kulit bijinya
Ditimbang
Diblender/dihaluskan Biji kelor 2,0 kg
Simplisia 235 g
Serbuk biji kelor Buah Kelor
Uji karakterisasi simplisia Penetapan kadar magnesium dan besi dengan metode AAS Pemeriksaan makroskopik
Penetapan kadar air Pemeriksaan mikroskopik
Penetapan kadar sari larut dalam air
Penetapan kadar sari larut etanol Penetapan kadar abu total
Lampiran 12. Bagan alir proses destruksi kering (simplisia biji kelor)
Ditimbang 5 g di dalam krus porselen Ditambahkan 5 tetes Asam Nitrat 65% (b/v) Diarangkan di atas hot plate
Diabukan dalam tanur dengan temperatur awal 100°C dan perlahan-lahan temperatur dinaikkan hingga suhu 500°C dengan interval 25°C setiap 5 menit
Dilakukan selama 92 jam dan dibiarkan hingga dingin di dalam tanur
Ditambahkan 5 ml Asam Nitrat (1:1) Diuapkan pada hot plate sampai kering Serbuk biji kelor
Sampel yang telah mengarang
Sampel yang telah mengabu
Lampiran 13. Bagan alir pembuatan larutan sampel
Dilarutkan dalam 5 ml Asam Nitrat (1:1) Dimasukkan ke dalam labu tentukur 100 ml
Dibilas krus porselen sebanyak tiga kali dengan 10 ml akuademineralisata
Dicukupkan dengan akuademineralisata hingga garis tanda Disaring dengan kertas saring Whatman No.42
Dibuang 10 ml untuk menjenuhkan kertas saring Dimasukkan ke dalam botol
Dilakukan analisis kualitatif
Dilakukan analisis kuantitatif dengan spektrofotometer
serapan atom pada λ 285,2 nm (lampu katoda magnesium)
untuk magnesium, λ 248,3 nm (lampu katoda besi) untuk
besi Sampel hasil
dekstruksi
Filtrat
Larutan sampel
Lampiran 14. Gambar hasil analisis kualitatif magnesium dan besi
Gambar 12. Hasil Reaksi Magnesium + NaOH + Titan Yellow menghasilkan
larutan berwarna merah terang
Lampiran 15. Data kalibrasi magnesium dengan spektrofotometer serapan atom,
perhitungan persamaan garis regresi dan koefisien korelasi (r)
No Konsentrasi (µ g/ml) (X)
Absorbansi (Y)
1. 0,0000 -0,0002
2. 0,2000 0,0314
3. 0,4000 0,0652
4. 0,6000 0,0977
5. 0,8000 0,1318
6. 1,0000 0,1684
No X Y XY X² Y²
1 0,0000 -0,0002 0,00000 0,0000 0,00000004 2 0,2000 0,0314 0,00628 0,0400 0,00098596 3 0,4000 0,0652 0,02608 0,1600 0,00425104 4 0,6000 0,0977 0,05862 0,3600 0,00954529 5 0,8000 0,1318 0,10544 0,6400 0,01737124 6 1,0000 0,1684 0,16840 1,0000 0,02835856
∑X = 3,0000
∑Y = 0,4943
∑XY= 0,36482
∑ X²= 2,2000
∑ Y² = 0,06051213
X= 0,5000 Y= 0,0823
� = ∑�� −((∑ �� ∑ �)/ �) ∑ �²−( (∑ �)² / � )
� = 0,36482 −((3,0000 � 0,4943)/ 6) 2,2000 −((3,0000)2/ 6)
� = 0,1681
Y = a X + b b = Y – a X
= 0,0823 – (0,1681 x 0,5000) = -0,00175
Lampiran 15. (Lanjutan)
r = ∑XY− [
(∑X )(∑Y ) n ]
��∑X²–(∑X)² / n � (∑Y²−(∑Y)² / n )
r = 0,36482 –�
(3,0000 )(0,4943 ) 6 �
��2,2000−(3,0000 )2
6 ��0,06051213−
(0,4943 )2 6 �
r = 0,11767
0,11769
Lampiran 16. Data kalibrasi besi dengan spektrofotometer serapan atom,
perhitungan persamaan garis regresi dan koefisien korelasi (r)
No Konsentrasi (µ g/ml) (X)
Absorbansi (Y)
1. 0,0000 -0,0001
2. 2,0000 0,0163
3. 4,0000 0,0310
4. 6,0000 0,0458
5. 8,0000 0,0597
6. 10,0000 0,0752
No X Y XY X² Y²
1 0,0000 -0,0001 0,0000 0,0000 0,00000001 2 2,0000 0,0163 0,0326 4,0000 0,00026569 3 4,0000 0,0310 0,1240 16,0000 0,00096100 4 6,0000 0,0458 0,2748 36,0000 0,00209764 5 8,0000 0,0597 0,4776 64,0000 0,00356409 6 10,0000 0,0752 0,7520 100,0000 0,00565504
∑ X = 30,0000
∑ Y = 0,2279
∑ XY = 1,6610
∑ X² = 220,0000
∑ Y² = 0,01254347
X = 5,0000 Y = 0,0379
a = ∑XY−((∑Xx∑Y)/ n) ∑X²−( (∑X)² / n )
a = 1,6610−((30,0000 x 0,2279)/ 6) 220,0000− ((30,00)2/ 6)
a = 0,00745
Y = a X + b b = Y – a X
= 0,0379 – (0,00745 x 5,0000) = 0,00065
Lampiran 16. (Lanjutan)
r = ∑XY− [
(∑X )(∑Y ) n ]
��∑X²–(∑X)² / n � (∑Y²−(∑Y)² / n )
r =
1,6610 –�(30,0000 )(0,2279 )
6 �
��220,0000−(30,0000 )2
6 ��0,01254347−
(0,2279 )2 6 �
r = 0,5215
0,5216
Lampiran 17. Rekapitulasi data kadar magnesium dan besi dalam simplisia daun
dan biji kelor sebelum uji t
Logam Sampel N o Berat Sampel (g) Absorbansi (A) Konsentrasi (µg/ml) Kadar (mg/100g) M AG NE S IUM Simplisia Daun Kelor
1 5,0753 0,0829 0,5030 619,4215 2 5,0745 0,0822 0,4990 614,5925 3 5,0741 0,0819 0,4970 612,1775 4 5,0746 0,0822 0,4990 614,5804 5 5,0748 0,0823 0,5000 615,7878 6 5,0751 0,0828 0,5020 618,2144
X 615,7956
SD 2,6479
Simplisia Biji Kelor
1 5,0865 0,0877 0,5320 209,1811 2 5,0862 0,0875 0,5300 208,4070 3 5,0859 0,0873 0,5290 208,0261 4 5,0858 0,0872 0,5290 208,0302 5 5,0856 0,0867 0,5260 206,8585 6 5,0857 0,0872 0,5290 208,0342
X 208,0895
SD 0,7507
BES
I
Simplisia Daun Kelor
1 5,0753 0,0238 3,1070 15,3045 2 5,0745 0,0239 3,1200 15,3709 3 5,0741 0,024 3,1340 15,4411 4 5,0746 0,0236 3,0800 15,1736 5 5,0748 0,0237 3,0930 15,2370 6 5,0751 0,0237 3,0930 15,2361
X 15,2938
SD 0,0987
Simplisia Biji Kelor
1 5,0865 0,0162 2,0870 4,1030 2 5,0862 0,0166 2,1400 4,2070 3 5,0859 0,0165 2,1270 4,1820 4 5,0858 0,0164 2,1140 4,1560 5 5,0856 0,0165 2,1270 4,1820 6 5,0857 0,0164 2,1140 4,1560
X 4,1643
Lampiran 18. Rekapitulasi data kadar magnesium dan besi dalam simplisia daun
dan biji kelor setelah uji t
Logam Sampel N o Berat Sampel (g) Absorbansi (A) Konsentrasi (µg/ml) Kadar (mg/100g) M AG NE S IUM Simplisia Daun Kelor
1 5,0753 0,0829 0,5030 619,4215 2 5,0745 0,0822 0,4990 614,5925 3 5,0741 0,0819 0,4970 612,1775 4 5,0746 0,0822 0,4990 614,5804 5 5,0748 0,0823 0,5000 615,7878 6 5,0751 0,0828 0,5020 618,2144
X 615,7956
SD 2,6479
Kadar Sebenarnya 615,7956 ± 4,3595 Simplisia Biji Kelor
1 5,0865 0,0877 0,5320 209,1811 2 5,0862 0,0875 0,5300 208,4070 3 5,0859 0,0873 0,5290 208,0261 4 5,0858 0,0872 0,5290 208,0302 5 5,0856 0,0867 0,5260 206,8585 6 5,0857 0,0872 0,5290 208,0342
X 208,0895
SD 0,7507
Kadar Sebenarnya 208,0895 ± 1,234 BES I Simplisia Daun Kelor
1 5,0753 0,0238 3,1070 15,3045 2 5,0745 0,0239 3,1200 15,3709 3 5,0741 0,024 3,1340 15,4411 4 5,0746 0,0236 3,0800 15,1736 5 5,0748 0,0237 3,0930 15,2370 6 5,0751 0,0237 3,0930 15,2361
X 15,2938
SD 0,0987
Kadar Sebenarnya 15,2938 ± 0,161284 Simplisia Biji Kelor
2 5,0862 0,0166 2,1400 4,2070 3 5,0859 0,0165 2,1270 4,1820 4 5,0858 0,0164 2,1140 4,1560 5 5,0856 0,0165 2,1270 4,1820 6 5,0857 0,0164 2,1140 4,1560
X 4,1766
SD 0,0214
Kadar Sebenarnya
Lampiran 19. Contoh perhitungan kadar magnesium dan besi dalam sampel
1. Contoh perhitungan kadar magnesium dalam simplisia daun kelor Berat sampel yang ditimbang = 5,0753 g
Absorbansi (Y) = 0,0829
Persamaan garis regresi: Y = 0,1681 X
−
0,00175 X = 0,0829 + 0,001750,1681 = 0,5030 µg/ml
Konsentrasi magnesium = 0,5030 µg/ml Kadar (µg/g) = Konsentrasi (µg/ml ) x Volume (ml ) x Faktor pengenceran
Berat Sampel (g)
= 0,5030 µg/ml x 100 ml x 625
5,0753 g
= 6194,2151 µg/g = 619,4215 mg/100 g
2. Contoh perhitungan kadar besi dalam simplisia daun kelor Berat sampel yang ditimbang = 5,0753 g
Absorbansi (Y) = 0,0238
Persamaan garis regresi: Y = 0,00745 X + 0,00065 X = 0,0238 – 0,00065
0,00745 = 3,1070 µg/ml
Konsentrasi besi = 3,1070 µg/ml Kadar (µg/g) = Konsentrasi (µg/ml ) x Volume (ml ) x Faktor pengenceran
Berat Sampel (g)
= 3,1070 µg/ml x 100 ml x 2,5
5,0753 g
Lampiran 19. (Lanjutan)
3. Contoh perhitungan kadar magnesium dalam simplisia biji kelor Berat sampel yang ditimbang = 5,0865 g
Absorbansi (Y) = 0,0877
Persamaan garis regresi: Y = 0,1681 X
−
0,00175 X = 0,0877 + 0,001750,1681 = 0,5320 µg/ml
Konsentrasi magnesium = 0,5320 µg/ml Kadar (µg/g) = Konsentrasi (µg/ml ) x Volume (ml ) x Faktor pengenceran
Berat Sampel (g)
= 0,5320 µg/ml x 100 ml x 200
5,0865 g
= 2091,8116 µg/g = 209,1811 mg/100 g
4. Contoh perhitungan kadar besi dalam simplisiaa biji kelor Berat sampel yang ditimbang = 5,0865 g
Absorbansi (Y) = 0,0162
Persamaan garis regresi: Y = 0,00745 X + 0,00065 X = 0,0162 – 0,00065
0,00745 = 2,0870 µg/ml
Konsentrasi besi = 2,0870 µg/ml Kadar (µg/g) = Konsentrasi (µg/ml ) x Volume (ml ) x Faktor pengenceran
Berat Sampel (g)
= 2,0870 µg/ml x 100 ml x 1
5,0865 g
Lampiran 20. Perhitungan statistik kadar magnesium dalam sampel
1. Perhitungan statistik kadar magnesium dalam simplisia daun kelor
No Xi
Kadar (mg/100 g)
(Xi-X) (mg/100 g)
(Xi-X)² (mg/100 g)
1 619,4215 3,6259 13,14715081
2 614,5925 -1,2031 1,44744961
3 612,1775 -3,6181 13,09064761
4 614,5804 -1,2152 1,47671104
5 615,7878 -0,2152 0,04631104
6 618,2144 2,4188 5,85059344
∑ Xi= 3694,7741 ∑ (Xi-X)² =35,05886355
X= 615,7956
SD =
�
∑(Xi−X)²�−1
=
�
35,05886355 mg /100 g6−1
= 2,6479 mg/100 g
Pada interval kepercayaan 99% dengan nilai α = 0,01; dk = 5 diperoleh nilai t tabel = α/ 2 = 4,0321.
Data diterima jika t hitung < t tabel
t hitung = | ��−� |
�� / √�
t hitung 1 = | 3,6259|
2,6479 / √6= 3,353
t hitung 2 = | −1,2031 |
Lampiran 20. (Lanjutan)
t hitung 3 = | −3,6181 |
2,6479 / √6 = 3,346
t hitung 4 = | −1,2152 |
2,6479 / √6 = 1,123
t hitung 5 = | −0,2152 |
2,6479 / √6 = 0,198
t hitung 6 = | 2,4188|
2,6479 / √6 = 2,237
Kadar magnesium dalam simplisia daun kelor: µ = X ± (t (α / 2, dk) x SD / √�)
= 615,7956 mg/100 g ± (4,0321 x 2,6479 mg/100 g / √6 ) = (615,7956 ± 4,3595) mg/100 g
Lampiran 20. (Lanjutan)
2. Perhitungan statistik kadar magnesium dalam simplisia biji kelor
No Xi
Kadar (mg/100 g)
(Xi-X) (mg/100 g)
(Xi-X)² (mg/100 g)
1 209,1811 1,0916 1,19159056
2 208,4070 0,3175 0,10080625
3 208,0261 -0,0634 0,00401956
4 208,0302 -0,0593 0,00351649
5 206,8585 -1,2310 1,51536100
6 208,0342 -0,0553 0,00305809
∑ Xi= 1248,5371 ∑ (Xi-X)² = 2,81835195
X= 208,0895
SD =
�
∑(Xi−X)²�−1
=
�
2,81835195 mg /100 g6−1
= 0,7507 mg/100 g
Pada interval kepercayaan 99% dengan nilai α = 0,01; dk = 5 diperoleh nilai t tabel = α/ 2 = 4,0321.
Data diterima jika t hitung < t tabel
t hitung = | ��−� |
�� / √�
t hitung 1 = | 1,0916|
0,7507 / √6 = 3,567
t hitung 2 = | 0,3175|
Lampiran 20. (Lanjutan)
t hitung 3 = | −0,0634 |
0,7507 / √6 = 0,207
t hitung 4 = | −0,0593|
0,7507 / √6 = 0,193
t hitung 5 = | −1,231|
0,7507 / √6 = 4,022
t hitung 6 = | −0,0553 |
0,7507 / √6 = 0,180
Kadar magnesium dalam simplisia biji kelor: µ = X ± (t (α / 2, dk) x SD / √�)
= 208,0895 mg/100 g ± (4,0321 x 0,7507 mg/100 g / √6 ) = (208,0895 ± 1,234) mg/100 g
Lampiran 21. Perhitungan statistik kadar besi dalam sampel
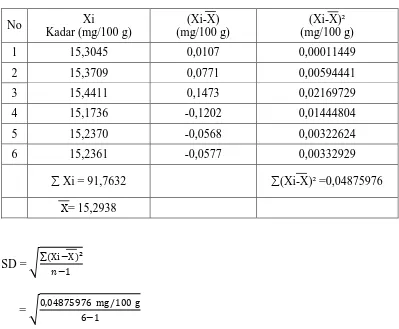
1. Perhitungan statistik kadar besi dalam simplisia daun kelor
No Xi
Kadar (mg/100 g)
(Xi-X) (mg/100 g)
(Xi-X)² (mg/100 g)
1 15,3045 0,0107 0,00011449
2 15,3709 0,0771 0,00594441
3 15,4411 0,1473 0,02169729
4 15,1736 -0,1202 0,01444804
5 15,2370 -0,0568 0,00322624
6 15,2361 -0,0577 0,00332929
∑ Xi = 91,7632 ∑(Xi-X)² =0,04875976
X= 15,2938
SD =
�
∑(Xi−X)²�−1
=
�
0,04875976 mg /100 g6−1
= 0,0987 mg/100 g
Pada interval kepercayaan 99% dengan nilai α = 0,01; dk = 5 diperoleh nilai t tabel = α/ 2 = 4,0321.
Data diterima jika t hitung < t tabel
t hitung = | ��−� |
�� / √�
t hitung 1
=
| 0,0107 |0,0987 / √6
=
0,2675t hitung 2
=
| 0,0771 | [image:38.595.112.511.154.483.2]Lampiran 21. (Lanjutan)
t hitung 3
=
| 0,1473 |0,0987 / √6
=
3,6825t hitung 4
=
|−0,1202 |0,0987 / √6
=
3,005t hitung 5
=
|−0,0568 |0,0987 / √6
=
1,420t hitung 6
=
|−0,0577 |0,0987 / √6
=
1,4425Kadar besi dalam simplisia daun kelor: µ = X ± (t (α / 2, dk) x SD / √�)
= 15,2938 mg/100 g ± (4,0321 x 0,0987 mg/100 g / √6 ) = (15,2938 ± 0,161284) mg/100 g
Lampiran 21. (Lanjutan)
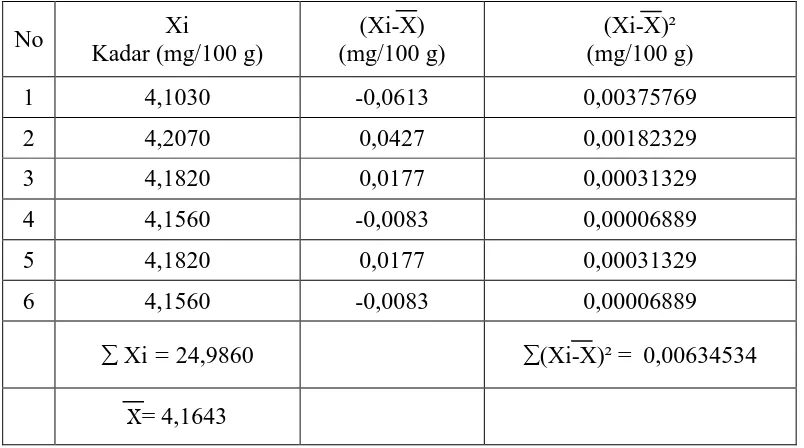
2. Perhitungan statistik kadar besi dalam simplisia biji kelor
No Xi
Kadar (mg/100 g)
(Xi-X) (mg/100 g)
(Xi-X)² (mg/100 g)
1 4,1030 -0,0613 0,00375769
2 4,2070 0,0427 0,00182329
3 4,1820 0,0177 0,00031329
4 4,1560 -0,0083 0,00006889
5 4,1820 0,0177 0,00031329
6 4,1560 -0,0083 0,00006889
∑ Xi = 24,9860 ∑(Xi-X)² = 0,00634534
X= 4,1643
SD =
�
∑(Xi−X)²�−1
=
�
0,00634534 mg /100 g6−1
= 0,0356 mg/100 g
Pada interval kepercayaan 99% dengan nilai α = 0,01; dk = 5 diperoleh nilai t
tabel = α/ 2 = 4,0321.
Data diterima jika t hitung < t tabel
t hitung = | ��−� |
�� / √�
t hitung 1 = |− 0,0613 |
0,0356 / √6 = 4,227
t hitung 2 = | 0,0427 |
[image:40.595.112.514.162.386.2]Lampiran 21. (Lanjutan)
t hitung 3 = | 0,0177|
0,0356 / √6 = 1,220
t hitung 4 = |−0,0083 |
0,0356 / √6 = 0,572
t hitung 5 = | 0,0177|
0,0356 / √6 = 1,220
t hitung 6 = |− 0,083 |
0,0356 / √6 = 0,572
Data pertama ditolak karena t hitung lebih besar dari t tabel, untuk itu perhitungan diulangi dengan cara yang sama tanpa mengikutsertakan data pertama
No Xi
Kadar (mg/100 g)
(Xi-X) (mg/100 g)
(Xi-X)² (mg/100 g)
2 4,2070 0,0304 0,00092416
3 4,1820 0,0054 0,00002916
4 4,1560 -0,0206 0,00042436
5 4,1820 0,0054 0,00002916
6 4,1560 -0,0206 0,00042436
∑Xi= 20,8830 ∑(Xi-X)² =0,00183120
X= 4,1766
SD =
�
∑(Xi−X)²�−1
=
�
0,0018312 0 mg /100 g5−1
Lampiran 21. (Lanjutan)
Pada interval kepercayaan 99% dengan nilai α = 0,01; dk = 4 diperoleh nilai t
tabel = α/ 2 = 4,6041.
Data diterima jika t hitung < t tabel
t hitung = |��−�|
�� / √�
t hitung 2 = | 0,0304|
0,0214 / √5 = 3,166
t hitung 3 = | 0,0054|
0,0214 / √5 = 0,562
t hitung 4 = |−0,0206 |
0,0214 / √5 = 2,145
t hitung 5 = | 0,0054|
0,0214 / √5 = 0,5625
t hitung 6 = |−0,0206 |
0,0214 / √5 = 2,145
Kadar besi dalam simplisia biji kelor: µ = X ± (t (α / 2, dk) x SD / √�)
= 4,1766 mg/100 g ± (4,6041 x 0,0096 mg/100 g / √5 ) = (4,1766 ± 0,0442) mg/100 g
[image:42.595.109.271.238.470.2]Lampiran 22. Pengujian beda nilai rata-rata kadar magnesium pada simplisia
daun dan biji kelor
No Daun Biji
1. X1 = 615,7956 X2 = 208,0895
2. S1 = 2,6479 S2 = 0,7507
Dilakukan uji F dengan taraf kepercayaan 99% untuk mengetahui apakah variasi kedua populasi sama (σ1 = σ2) atau berbeda (σ1 ≠ σ2).
- H0: σ1= σ2
H1: σ1≠ σ2
- Nilai kritis F yang diperbolehkan dari tabel (F 0,01/2, (5,5)) adalah = 14,94 - Daerah kritis penolakan: hanya jika F0 ≥ 14,94
F0 =
S12 S22
F0 =
(2,6479)2 (0,7507 )2
F0 = 12,3984
- Dari hasil uji ini menunjukkan H0 diterima dan H1 ditolak sehingga
disimpulkan bahwa σ1 = σ2. Berarti tidak terdapat perbedaan yang signifikan
rata-rata kadar magnesium dalam simplisia daun dan biji kelor.
- Dilanjutkan dengan uji beda rata–rata menggunakan distribusi t
- Simpangan bakunya adalah:
Sp =
�
(n1−1)S12
+ (n2−1)S22 n1+ n2−2
=
�
(6−1)(2,6479)2+ (6−1)(0,7507 )2 6 + 6−2
= �35,05687205 + 2,81775245
10
Lampiran 22. (Lanjutan)
- H0 : µ1 = µ 2
H1 : µ1≠ µ 2
- Dengan menggunakan taraf kepercayaan 99% dengan nilai α = 1%
t 0,01/2 = ± 3,1693 untuk df = 6 + 6 -2 = 10 - Daerah kritis penerimaan: - 3,1693 ≤ t0≤ 3,1693 - Daerah kritis penolakan: t0< -3,1693 dan t0> 3,1693
t0 =
(X1−X2)
���11+1
�2
= (615,7956 − 208,0895)
1,9461 �1 6+
1 6
= 407,7061
1,1235
= 362,8892
- Karena t0 = 362,8892 > 3,1693 maka hipotesis H0 ditolak. Berarti terdapat
Lampiran 23. Pengujian beda nilai rata-rata kadar besi pada simplisia daun dan
biji kelor
No Daun Biji
1. X1 = 15,2938 X2 = 4,1766
2. S1 = 0,0987 S2 = 0,0214
Dilakukan uji F dengan taraf kepercayaan 99% untuk mengetahui apakah variasi kedua populasi sama (σ1 = σ2) atau berbeda (σ1 ≠ σ2).
- H0: σ1= σ2
H1: σ1≠ σ2
- Nilai kritis F yang diperbolehkan dari tabel (F 0,01/2, (5,4)) adalah = 22,46 - Daerah kritis penolakan: hanya jika F0 ≥ 22,46
F0 =
S12 S22
F0 =
(0,0987)2 (0,0214 )2
F0 = 21,2719
- Dari hasil uji ini menunjukkan H0 diterima dan H1 ditolak sehingga
disimpulkan bahwa σ1 = σ2. Berarti tidak terdapat perbedaan yang signifikan
rata-rata kadar besi dalam simplisia daun dan biji kelor.
- Dilanjutkan dengan uji beda rata–rata menggunakan distribusi t
- Simpangan bakunya adalah:
Sp =
�
(n1−1) S12
+ (n2−1) S22 n1+ n2−2
=
�
(6−1)(0,0987)2 + (5−1)(0,0214 )2 6 + 5−2
=
�
0,04870845 + 0,001831849
Lampiran 23. (Lanjutan)
- H0 : µ1 = µ 2
H1 : µ1≠ µ 2
- Dengan menggunakan taraf kepercayaan 99% dengan nilai α = 1%
t 0,01/2 = ± 3,2498 untuk df = 6 + 5 - 2 = 9 - Daerah kritis penerimaan: - 3,2498 ≤ t0≤ 3,2498 - Daerah kritis penolakan: t0< -3,2498 dan t0> 3,2498
t0 =
(X1−X2)
���11+1
�2
= (15,2938− 4,1766 )
0,0749 �16+15
=
11,11720,0453
= 245,4128
- Karena t0 = 245,4128 > 3,2498 maka hipotesis H0 ditolak. Berarti terdapat
Lampiran 24. Hasil analisis kadar magnesium dan besi sebelum dan sesudah
penambahan masing-masing larutan baku pada simplisia daun kelor
1. Hasil analisis kadar magnesium (Mg) sebelum ditambahkan larutan baku Sampel Berat Sampel
(g) Absorbansi (A) Konsentrasi (µg/ml) Kadar (mg/100 g)
1 5,0753 0,0829 0,5030 619,4215
2 5,0745 0,0822 0,4990 614,5925
3 5,0741 0,0819 0,4970 612,1775
4 5,0746 0,0822 0,4990 614,5804
5 5,0748 0,0823 0,5000 615,7878
6 5,0751 0,0828 0,5020 618,2144
∑ 30,4484 3694,7741
Rata-rata 5,0747 615,7956
2. Hasil analisis kadar magnesium (Mg) setelah ditambahkan larutan baku
Sampel Berat Sampel (g) Absorbansi (A) Konsentrasi (µg/ml) Kadar (mg/100 g) Recovery (%) 1 5,0578 0,0909 0,5511 681,0026 106,3947 2 5,0583 0,0913 0,5535 683,9007 111,1234 3 5,0586 0,0919 0,5571 688,3080 118,3145 4 5,0580 0,0910 0,5517 681,7170 107,5603 5 5,0576 0,0904 0,5481 677,3222 100,3896 6 5,0582 0,0912 0,5529 683,1728 109,9357
∑ 30,3485 4095,4233 653,7182
Lampiran 24. (Lanjutan)
3. Hasil analisis kadar besi (Fe) sebelum ditambahkan larutan baku
Sampel Berat Sampel (g) Absorbansi (A) Konsentrasi (µg/ml) Kadar (mg/100 g)
1 5,0753 0,0238 3,1070 15,3045
2 5,0745 0,0239 3,1200 15,3709
3 5,0741 0,0240 3,1340 15,4411
4 5,0746 0,0236 3,0800 15,1736
5 5,0748 0,0237 3,0930 15,2370
6 5,0751 0,0237 3,0930 15,2361
∑ 30,4484 91,7632
Rata-rata 5,0747 15,2938
4. Hasil analisis kadar besi (Fe) setelah ditambahkan larutan baku
Sampel Berat Sampel (g) Absorbansi (A) Konsentrasi (µg/ml) Kadar (mg/100 g) Recovery (%) 1 5,0578 0,0262 3,4295 16,9519 104,8115 2 5,0583 0,0264 3,4563 17,0823 113,0816 3 5,0586 0,0265 3,4697 17,1475 117,2040 4 5,0580 0,0263 3,4429 17,0171 108,9592 5 5,0576 0,0262 3,4295 16,9522 104,8558 6 5,0582 0,0261 3,4161 16,8839 100,5374
∑ 30,3485 102,0349 649,4495
Lampiran 25. Perhitungan jumlah baku yang ditambahkan untuk persen
perolehan kembali magnesium dan besi pada simplisia daun kelor
Jumlah baku yang ditambahkan dapat dihitung menggunakan rumus berikut:
C*A = 10 % x X
V =
C∗A x BSKonsentrasi baku yang digunakan
Keterangan:
C*A = Kadar larutan baku yang ditambahkan (µg/g) X = Kadar rata–rata logam pada sampel (mg/100 g) V = Jumlah larutan baku yang ditambahkan (ml)
BS = Berat rata–rata sampel untuk uji persen perolehan kembali (g) 1. Magnesium
Berat rata–rata sampel untuk uji persen perolehan kembali (BS) = 5,0581 g Kadar rata–rata magnesium pada daun kelor yang dikeringkan (X) = 615,7956 mg/100 g
C*A = 10 % x X
= 10
100 x 615,7956 mg/100 g
= 61,5796 mg/100 g = 615,7956 µg/g
V
= C∗A x BSKonsentrasi baku yang digunakan
= 615,7956 µg/g x 5,0581 g
1000 µg/ml
Lampiran 25. (Lanjutan)
2. Besi
Berat rata–rata sampel untuk uji persen perolehan kembali (BS) = 5,0581 g Kadar rata–rata besi pada daun kelor (X) = 15,2938 mg/100 g
C*A = 10 % x X
= 10
100 x 15,2938 mg/100 g
= 1,52938 mg/100 g = 15,2938 µg/g
V
= C∗A x BSKonsentrasi baku yang digunakan
= 15,2938 µg/g x 5,0581 g
10 µg/ml
Lampiran 26. Perhitungan uji perolehan kembali kadar magnesium dan besi
dalam simplisia daun kelor
1. Perhitungan uji perolehan kembali kadar magnesium Sampel 1
Persamaan regresi : Y = 0,1681 X
−
0,00175 X = 0,0909 + 0,001750,1681 = 0,5511 µg/ml
Konsentrasi setelah ditambahkan larutan baku = 0,5511 µg/ml CF =
Konsentrasi (µg/ml )
Berat sampel x Volume (ml) x Faktor pengenceran
= 0,5511 µg/ml
5,0578 g x 100 ml x 625
= 6810,0260 µg/g = 681,0026 mg/100 g
Kadar sampel 1 setelah ditambah larutan baku (CF) = 681,0026 mg/100 g
Kadar rata-rata sampel sebelum ditambahkan lautan baku (CA) adalah kadar
rata-rata dari keenam sampel CA =
(619,4215 + 614 ,5925+612 ,1775 +614,5804 +615 ,7878 +618 ,2144 ) mg /100 g
6 = 615,7956 mg/100g
Berat sampel rata-rata uji recovery = 5,0581 g
Kadar larutan standar yang ditambahkan (C*A) adalah
C*A =
Konsentrasi baku yang ditambahkan (µg/ml )
Berat sampel rata−rata x Volume (ml)
= 1000 µg/ml
5,0581 g x 3,1 ml
= 612,8783 µg/g = 61,2878 mg/100 g
Maka % perolehan kembali magnesium = CF−CA
�∗� x 100%
= (681,0026 − 615,7956) mg /100 g
61,2878 mg /100 g x 100%
Lampiran 26. (Lanjutan)
Sampel 2
Persamaan regresi : Y = 0,1681 X
−
0,00175 X = 0,0913 + 0,001750,1681 = 0,5535 µg/ml
Konsentrasi setelah ditambahkan larutan baku = 0,5535 µg/ml CF =
Konsentrasi (µg/ml )
Berat sampel x Volume (ml) x Faktor pengenceran
= 0,5535 µg/ml
5,0583 g x 100 ml x 625
= 6839,0071 µg/g = 683,9007 mg/100 g
Kadar sampel 2 setelah ditambah larutan baku (CF) = 683,9007 mg/100 g
Kadar rata-rata sampel sebelum ditambahkan lautan baku (CA) adalah kadar
rata-rata dari keenam sampel CA=
(619,4215 + 614 ,5925+612 ,1775 +614 ,5804 +615,7878 +618 ,2144 ) mg /100 g
6 = 615,7956 mg/100g
Berat sampel rata-rata uji recovery = 5,0581 g
Kadar larutan standar yang ditambahkan (C*A) adalah
C*A =
Konsentrasi baku yang ditambahkan (µg/ml )
Berat sampel rata−rata x Volume (ml)
= 1000 µg/ml
5,0581 g x 3,1 ml
= 612,8783 µg/g = 61,2878 mg/100 g
Maka % perolehan kembali magnesium = CF−CA
�∗� x 100%
= (683,9007 − 615,7956) mg /100 g
61,2878 mg /100 g x 100%
Lampiran 26. (Lanjutan)
Sampel 3
Persamaan regresi : Y = 0,1681 X
−
0,00175 X = 0,0919 + 0,001750,1681 = 0,5571 µg/ml
Konsentrasi setelah ditambahkan larutan baku = 0,5571 µg/ml CF =
Konsentrasi (µg/ml )
Berat sampel x Volume (ml) x Faktor pengenceran
= 0,5571 µg/ml
5,0586 g x 100 ml x 625
= 6883,0802 µg/g = 688,3080 mg/100 g
Kadar sampel 3 setelah ditambah larutan baku (CF) = 688,3080 mg/100 g
Kadar rata-rata sampel sebelum ditambahkan lautan baku (CA) adalah kadar
rata-rata dari keenam sampel CA =
(619,4215 + 614 ,5925+612 ,1775 +614,5804 +615 ,7878 +618 ,2144 ) mg /100 g
6 = 615,7956 mg/100g
Berat sampel rata-rata uji recovery = 5,0581 g
Kadar larutan standar yang ditambahkan (C*A) adalah
C*A =
Konsentrasi baku yang ditambahkan (µg/ml )
Berat sampel rata−rata x Volume (ml)
= 1000 µg/ml
5,0581 g x 3,1 ml
= 612,8783 µg/g = 61,2878 mg/100 g
Maka % perolehan kembali magnesium = CF−CA
�∗� x 100%
= (688,3080 − 615,7956) mg/100 g
61,2878 mg/100 g x 100%
Lampiran 26. (Lanjutan)
Sampel 4
Persamaan regresi : Y = 0,1681 X
−
0,00175 X = 0,0910 + 0,001750,1681 = 0,5517 µg/ml
Konsentrasi setelah ditambahkan larutan baku = 0,5517 µg/ml CF =
Konsentrasi (µg/ml )
Berat sampel x Volume (ml) x Faktor pengenceran
= 0,5517 µg/ml
5,0580 g x 100 ml x 625
= 6817,1708 µg/g = 681,7170 mg/100 g
Kadar sampel 4 setelah ditambah larutan baku (CF) = 681,7170 mg/100 g
Kadar rata-rata sampel sebelum ditambahkan lautan baku (CA) adalah kadar
rata-rata dari keenam sampel CA =
(619,4215 + 614 ,5925+612 ,1775 +614,5804 +615 ,7878 +618 ,2144 ) mg /100 g
6 = 615,7956 mg/100 g
Berat sampel rata-rata uji recovery = 5,0581 g
Kadar larutan standar yang ditambahkan (C*A) adalah
C*A =
Konsentrasi baku yang ditambahkan (µg/ml )
Berat sampel rata−rata x Volume (ml)
= 1000 µg/ml
5,0581 g x 3,1 ml
= 612,8783 µg/g = 61,2878 mg/100 g
Maka % perolehan kembali magnesium = CF−CA
�∗� x 100%
= (681,7170 − 615,7956) mg/100 g
61,2878 mg/100 g x 100%
Lampiran 26. (Lanjutan)
Sampel 5
Persamaan regresi : Y = 0,1681 X
−
0,00175 X = 0,0904 + 0,001750,1681 = 0,5481 µg/ml
Konsentrasi setelah ditambahkan larutan baku = 0,5481 µg/ml CF =
Konsentrasi (µg/ml )
Berat sampel x Volume (ml) x Faktor pengenceran
= 0,5481 µg/ml
5,0576 g x 100 ml x 625
= 6773,2224 µg/g = 677,3222 mg/100 g
Kadar sampel 5 setelah ditambah larutan baku (CF) = 677,3222 mg/100 g
Kadar rata-rata sampel sebelum ditambahkan lautan baku (CA) adalah kadar
rata-rata dari keenam sampel CA =
(619,4215 + 614 ,5925+612 ,1775 +614,5804 +615 ,7878 +618 ,2144 ) mg /100 g
6 = 615,7956 mg/100 g
Berat sampel rata-rata uji recovery = 5,0581 g
Kadar larutan standar yang ditambahkan (C*A) adalah
C*A =
Konsentrasi baku yang ditambahkan (µg/ml )
Berat sampel rata−rata x Volume (ml)
= 1000 µg/ml
5,0581 g x 3,1 ml
= 612,8783 µg/g = 61,2878 mg/100 g
Maka % perolehan kembali magnesium = CF−CA
�∗� x 100%
= (677,3222 − 615,7956) mg/100 g
61,2878 mg/100 g x 100%
Lampiran 26. (Lanjutan)
Sampel 6
Persamaan regresi : Y = 0,1681 X
−
0,00175 X = 0,0912 + 0,001750,1681 = 0,5529 µg/ml
Konsentrasi setelah ditambahkan larutan baku = 0,5529 µg/ml CF =
Konsentrasi (µg/ml )
Berat sampel x Volume (ml) x Faktor pengenceran
= 0,5529 µg/ml
5,0582 g x 100 ml x 625
= 6831,7286 µg/g = 683,1728 mg/100 g
Kadar sampel 6 setelah ditambah larutan baku (CF) = 683,1728 mg/100 g
Kadar rata-rata sampel sebelum ditambahkan lautan baku (CA) adalah kadar
rata-rata dari keenam sampel CA =
(619,4215 + 614 ,5925+612 ,1775 +614,5804 +615 ,7878 +618 ,2144 ) mg /100 g
6 = 615,7956 mg/100 g
Berat sampel rata-rata uji recovery = 5,0581 g
Kadar larutan standar yang ditambahkan (C*A) adalah
C*A =
Konsentrasi bak u yang ditambahkan (µg/ml )
Berat sampel rata−rata x Volume (ml)
= 1000 µg/ml
5,0581 g x 3,1 ml
= 612,8783 µg/g = 61,2878 mg/100 g
Maka % perolehan kembali magnesium = CF−CA
�∗� x 100%
= (683,1728 − 615,7956) mg /100 g
61,2878 mg /100 g x 100%
Lampiran 26. (Lanjutan)
2. Perhitungan uji perolehan kembali kadar besi Sampel 1
Persamaan regresi: Y = 0,00745 X + 0,00065 X = 0,0262 − 0,00065
0,00745 = 3,4295 µg/ml
Konsentrasi setelah ditambahkan larutan baku = 3,4295 µg/ml CF =
Konsentrasi (µg/ml )
Berat sampel x Volume (ml) x Faktor pengenceran
= 3,4295 µg/ml
5,0578 g x 100 ml x 2,5
= 169,5154 µg/g = 16,9515 mg/100 g
Kadar sampel 1 setelah ditambah larutan baku (CF) = 16,9515 mg/100 g
Kadar rata-rata sampel sebelum ditambahkan lautan baku (CA) adalah kadar
rata-rata dari ke enam sampel CA =
(15,3045+ 15,3709+15,4411 + 15,1736 +15,2370 +15,2361) mg/100 g
6 = 15,2938 mg/100 g
Berat sampel rata-rata uji recovery = 5,0581 g
Kadar larutan standar yang ditambahkan (C*A) adalah
C*A =
Konsentrasi baku yang ditambahkan (µg/ml )
Berat sampel rata−rata x Volume (ml)
= 10 µg/ml
5,0581 g x 8 ml
= 15,8162 µg/g = 1,5816 mg/100 g
Maka % perolehan kembali besi = CF−CA
�∗� x 100%
= (16,9515 − 15,2938) mg/100 g
1,5816 mg/100 g x 100%
Lampiran 26. (Lanjutan)
Sampel 2
Persamaan regresi: Y = 0,00745 X + 0,00065 X = 0,0264 − 0,00065
0,00745 = 3,4563 µg/ml
Konsentrasi setelah ditambahkan larutan baku = 3,4563 µg/ml CF =
Konsentrasi (µg/ml )
Berat sampel x Volume (ml) x Faktor pengenceran
= 3,4563µg/ml
5,0583 g x 100 ml x 2,5
= 170,8232 µg/g = 17,0823 mg/100 g
Kadar sampel 2 setelah ditambah larutan baku (CF) = 17,0823 mg/100 g
Kadar rata-rata sampel sebelum ditambahkan lautan baku (CA) adalah kadar
rata-rata dari ke enam sampel
CA = (15,3045 + 15,3709+15,4411 + 15,1736 +15,2370 +15,2361 ) mg /100 g6 = 15,2938 mg/100 g
Berat sampel rata-rata uji recovery = 5,0581 g
Kadar larutan standar yang ditambahkan (C*A) adalah
C*A =
Konsentrasi baku yang ditambahkan (µg/ml )
Berat sampel rata−rata x Volume (ml)
= 10 µg/ml
5,0581 g x 8 ml
= 15,8162 µg/g = 1,5816 mg/100 g
Maka % perolehan kembali besi = CF−CA
�∗� x 100%
= (17,0823− 15,2938) mg /100 g
1,5816 mg /100 g x 100%
Lampiran 26. (Lanjutan)
Sampel 3
Persamaan regresi: Y = 0,00745 X + 0,00065 X = 0,0265 − 0,00065
0,00745 = 3,4697 µg/ml
Konsentrasi setelah ditambahkan larutan baku = 3,4697 µ g/ml CF =
Konsentrasi (µg/ml )
Berat sampel x Volume (ml) x Faktor pengenceran
= 3,4697µg/ml
5,0586 g x 100 ml x 2,5
= 171,4753 µg/g = 17,1475 mg/100 g
Kadar sampel 3 setelah ditambah larutan baku (CF) = 17,1475 mg/100 g
Kadar rata-rata sampel sebelum ditambahkan lautan baku (CA) adalah kadar
rata-rata dari ke enam sampel CA =
(15,3045 + 15,3709+15,4411 + 15,1736 +15,2370 +15,2361 ) mg /100 g
6 = 15,2938 mg/100 g
Berat sampel rata-rata uji recovery = 5,0581 g
Kadar larutan standar yang ditambahkan (C*A) adalah
C*A =
Konsentrasi baku yang ditambahkan (µg/ml )
Berat sampel rata−rata x Volume (ml)
= 10 µg/ml
5,0581 g x 8 ml
= 15,8162 µg/g = 1,5816 mg/100 g
Maka % perolehan kembali besi = CF−CA
�∗� x 100%
= (17,1475− 15,2938) mg /100 g
1,5816 mg /100 g x 100%
Lampiran 26. (Lanjutan)
Sampel 4
Persamaan regresi: Y = 0,00745 X + 0,00065 X = 0,0263 − 0,00065
0,00745 = 3,4429 µg/ml
Konsentrasi setelah ditambahkan larutan baku = 3,4429 µg/ml CF =
Konsentrasi (µg/ml )
Berat sampel x Volume (ml) x Faktor pengenceran
= 3,4429µg/ml
5,0580 g x 100 ml x 2,5
= 170,1710 µg/g = 17,0171 mg/100 g
Kadar sampel 4 setelah ditambah larutan baku (CF) = 17,0171 mg/100 g
Kadar rata-rata sampel sebelum ditambahkan lautan baku (CA) adalah kadar
rata-rata dari ke enam sampel CA =
(15,3045 + 15,3709+15,4411 + 15,1736 +15,2370 +15,2361 ) mg /100 g
6 = 15,2938 mg/100 g
Berat sampel rata-rata uji recovery = 5,0581 g
Kadar larutan standar yang ditambahkan (C*A) adalah
C*A =
Konsentrasi baku yang ditambahkan (µg/ml )
Berat sampel rata−rata x Volume (ml)
= 10 µg/ml
5,0581 g x 8 ml
= 15,8162 µg/g = 1,5816 mg/100 g
Maka % perolehan kembali besi = CF−CA
�∗� x 100%
= (17,0171− 15,2938) mg /100 g
1,5816 mg /100 g x 100%
Lampiran 26. (Lanjutan)
Sampel 5
Persamaan regresi: Y = 0,00745 X + 0,00065 X = 0,0262 − 0,00065
0,00745 = 3,4295 µg/ml
Konsentrasi setelah ditambahkan larutan baku = 3,4295 µg/ml CF =
Konsentrasi (µg/ml )
Berat sampel x Volume (ml) x Faktor pengenceran
= 3,4295 µg/ml
5,0576 g x 100 ml x 2,5
= 169,5221 µg/g = 16,9522 mg/100 g
Kadar sampel 5 setelah ditambah larutan baku (CF) = 16,9522 mg/100 g
Kadar rata-rata sampel sebelum ditambahkan lautan baku (CA) adalah kadar
rata-rata dari ke enam sampel CA =
(15,3045 + 15,3709+15,4411 + 15,1736 +15,2370 +15,2361 ) mg /100 g
6 = 15,2938 mg/100 g
Berat sampel rata-rata uji recovery = 5,0581 g
Kadar larutan standar yang ditambahkan (C*A) adalah
C*A =
Konsentrasi baku yang ditambahkan (µg/ml )
Berat sampel rata−rata x Volume (ml)
= 10 µg/ml
5,0581 g x 8 ml
= 15,8162 µg/g = 1,5816 mg/100 g
Maka % perolehan kembali besi = CF−CA
�∗� x 100%
= (16,9522 − 15,2938) mg /100 g
1,5816 mg /100 g x 100%
Lampiran 26. (Lanjutan)
Sampel 6
Persamaan regresi: Y = 0,00745 X + 0,00065 X = 0,0261 − 0,00065
0,00745 = 3,4161 µg/ml
Konsentrasi setelah ditambahkan larutan baku = 3,4161 µg/ml CF =
Konsentrasi (µg/ml )
Berat sampel x Volume (ml) x Faktor pengenceran
= 3,4161µg/ml
5,0582 g x 100 ml x 2,5
= 168,8397 µg/g = 16,8839 mg/100 g
Kadar sampel 6 setelah ditambah larutan baku (CF) = 16,8839 mg/100 g
Kadar rata-rata sampel sebelum ditambahkan lautan baku (CA) adalah kadar
rata-rata dari ke enam sampel CA =
(15,3045 + 15,3709+15,4411 + 15,1736 +15,2370 +15,2361 ) mg /100 g
6 = 15,2938 mg/100 g
Berat sampel rata-rata uji recovery = 5,0581 g
Kadar larutan standar yang ditambahkan (C*A) adalah
C*A =
Konsentrasi baku yang ditambahkan (µg/ml )
Berat sampel rata−rata x Volume (ml)
= 10 µg/ml
5,0581 g x 8 ml
= 15,8162 µg/g = 1,5816 mg/100 g
Maka % perolehan kembali besi = CF−CA
�∗� x 100%
= (16,8839− 15,2938) mg /100 g
1,5816 mg /100 g x 100%
Lampiran 27. Perhitungan simpangan baku relatif (RSD) kadar magnesium dan
besi dalam sampel
1. Perhitungan simpangan baku relatif (RSD) kadar magnesium dalam sampel
No. Persen perolehan kembali (Xi) (%)
(Xi - X) (%)
(Xi - X)2 (%)
1. 106,3947 -2,5583 6,54489889
2. 111,1234 2,1704 4,71063616
3. 118,3145 9,3615 87,63768225
4. 107,5603 -1,3927 1,93961329
5. 100,3896 -8,5634 73,33181956
6. 109,9357 0,9827 0,96569929
∑ Xi = 653,7182 ∑(Xi - X)2
= 175,1303494 X= 108,9530
SD =
�
∑(Xi−X)²�−1
SD =
�
175,1303494 %6−1
SD = 5,918282681 %
RSD = ��
� X 100%
RSD = 5,9182822681 %
108,9530 % X 100%
Lampiran 27. (Lanjutan)
2. Perhitungan simpangan baku relatif (RSD) kadar besi dalam sampel
No. Persen perolehan kembali (Xi) (%)
(Xi - X) (%)
(Xi - X)2 (%)
1. 104,8115 -3,43 11,7649
2. 113,0816 4,4801 23,42656801
3. 117,2040 8,9625 80,32640625
4. 108,9592 0,7177 0,51509329
5. 104,8558 -3,3857 11,46296449
6. 100,5374 -7,70576 59,37873718
∑Xi = 649,4495 ∑(Xi - X)2
=186,8746692 X= 108,2415
SD =
�
∑(Xi−X)²�−1
SD =
�
186,8746692 %6−1
SD = 6,113504219%
RSD = ��
� X 100%
RSD = 6,113504219 %
108,2415 % X 100%
Lampiran 28. Perhitungan batas deteksi (LOD) dan batas kuantitasi (LOQ)
1. Perhitungan batas deteksi dan batas kuantitasi magnesium Y = 0,1681 X
−
0,00175Slope = 0,1681
No
Konsentrasi (µg/ml)
X
Absorbansi
Y Yi Y-Yi (Y-Yi)
2
1 0,0000 -0,0002 -0,00175 0,00155 0,000002402 2 0,2000 0,0314 0,03187 -0,00047 0,000000220 3 0,4000 0,0652 0,06549 -0,00029 0,000000084 4 0,6000 0,0977 0,09911 -0,00141 0,000001988 5 0,8000 0,1318 0,13273 -0,00093 0,000000864 6 1,0000 0,1684 0,16635 -0,00205 0,000004202
∑(Y-Yi)2= 0,00000976
Simpangan Baku =
�
∑(Y−Yi )²�−2
=
�
0,000009764
= 0,001562049
Batas Deteksi = 3 X ����
�����
= 3 X 0,001562049
0,1681
= 0,0278 µg/ml
Batas Kuantitasi = 10 X ��
�
� �����
= 10 X 0,001562049
0,1681
Lampiran 28. (Lanjutan)
2. Perhitungan batas deteksi dan batas kuantitasi besi Y = 0,00745 X + 0,00065
Slope = 0,00745
No
Konsentrasi (µg/ml)
X
Absorbansi
Y Yi Y-Yi (Y-Yi)
2
1 0,0000 -0,0001 0,00065 -0,00075 0,000000562 2 2,0000 0,0163 0,01555 0,00075 0,000000562 3 4,0000 0,0310 0,03045 0,00055 0,000000302 4 6,0000 0,0458 0,04535 0,00045 0,000000202 5 8,0000 0,0597 0,06025 -0,00055 0,000000302 6 10,0000 0,0752 0,07515 0,00005 0,000000002
∑(Y-Yi)2= 0,000001932
Simpangan Baku =
�
∑(Y−Yi )²�−2
=
�
0,0000019324
= 0, 000694982
Batas Deteksi = 3 X ��
�
⁄ �����
= 3 X 0,000694982
0,00745
= 0,2798 µg/ml
Batas Kuantitasi = 10 X ��
�
� �����
= 10 X 0,000694982
0,00745
Lampiran 31. Gambar alat spektrofotometer serapan atom dan tanur
Gambar 14. Alat spektrofotometer serapan atom (Hitachi Z-2000)
[image:69.595.126.498.411.626.2]Lampiran 32. Gambar alat destilasi air dan oven
[image:70.595.112.507.122.406.2]Gambar 16. Alat destilasi (Boeco) Gambar 17. Tabung Penerima
Lampiran 33. Gambar Hotplate dan Mikroskop
Gambar 19. Hotplate (Fisions)
[image:71.595.202.433.395.703.2]DAFTAR PUSTAKA
Almatsier, S. (2004). Prinsip Dasar Ilmu Gizi. Jakarta: PT. Gramedia Pustaka Utama. Halaman 229, 247, 249, 255.
Anonim. (2008). Cegah Malnutrisi dengan Kelor. Yogyakarta: Kanisius (Anggota IKAPI). Halaman 11.
Bassett, J., Denney, R.C., Jeffery, G.H., dan Mendham, J. (1991). Vogel’s Textbook of Quantitative Inorganic Analysis Including Elementary Instrumental Analysis. Penerjemah: Ahmad Hadiyana Pudjaatmaka dan Lukman Setiono. (1994). Buku Ajar Vogel Kimia Analisis Kuantitatif Anorganik. Edisi Keempat. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 429, 526, 542, 551, 626, 710.
Budiyanto, A. K. M. (2001). Dasar-Dasar Ilmu Gizi. Yogyakarta: UMM Press. Halaman 59, 61, 65.
Depkes RI. (1986). Sediaan Galenik. Dalam: Joselin, M. (2014). Karakterisasi Simplisia dan Skrining Fitokimia Serta Uji Aktivitas Antioksidan Ekstrak Air dan Etanol Hidrilla (Hydrilla verticillata (L. f.) Royle). Medan: USU Press. Halaman 33-34.
Ditjen POM. (1979). Farmakope Indonesia. Jilid III. Jakarta: Departemen Kesehatan RI. Halaman 649, 650, 696.
Ditjen POM. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan RI. Halaman 321-325.
Ermer, J., and McB. Miller, J. H. (2005). Method Validation in Pharmaceutical Analysis. Weinheim: Wiley-VchVerlag GmbH & Co. KGa A. Halaman 171.
Gandjar, I.G., dan Rohman, A. (2009). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Halaman 298, 305-312, 319.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Review Artikel. Majalah Ilmu Kefarmasian. Halaman 119, 121-123, 130-131.
Harris, D.C. (2007). Quantitative Chemical Analysis. Seventh Edition. Newyork: W. H. Freeman and Company. Page 455.
Kemenkes RI. (2011). Farmakope Herbal Indonesia Suplemen II Edisi I. Jakarta: Kementerian Kesehatan RI. Halaman 104-106 .
Khopkar, S.M. (1985). Basic Concepts of Analytical Chemistry. Penerjemah: Saptorahardjo, A., dan Nurhadi, A. (1990). Konsep Dasar Kimia Analitik. Jakarta: UI-Press. Halaman 275, 279.
Krisnadi, A. D. (2015). Kelor Super Nutrisi. Blora: Kelorina.com. Halaman 8, 17-25, 28-29, 56-57, 105-106.
Kristianingrum, S. (2012). Jurnal Online: Kajian Berbagai Proses Destruksi Sampel dan Efeknya. Diakses: 25 November 2015. http:www.seminar.uny.ac.id.
Kurniasih. (2013). Khasiat dan Manfaat Daun Kelor. Yogyakarta: Pustaka Baru Press. Halaman 23, 26, 40, 42, 75, 145-146, 166-168.
Manan, M. H. A. (2005). Membuat Reagen Kimia di Laboratorium. Jakarta: Bumi Aksara. Halaman 39, 42, 121.
Pratiwi, E. Y. (2015). Jurnal Online: Karakterisasi Simplisia dan Analisis Kadar Kalium, Kalsium, Natrium dan Magnesium pada Serbuk Daun Kelor (Moringa oleifera Lam.) Secara Spektrofotometri Serapan Atom. Diakses: 01 September 2015. http:www.respository.usu.ac.id.
Rosmarkam, A., dan Yuwono, N.W. (2002). Ilmu Kesuburan Tanah. Yogyakarta: Kanisius. Halaman 37, 43, 63.
Sudjana. (2005). Metode Statistika. Edisi Keenam. Bandung: Tarsito. Halaman 93, 168, 239.
Tilong, A.D. (2012). Ternyata Kelor Penakluk Diabetes. Yogyakarta: DIVA Press. Halaman 11, 13-14, 18-19, 24, 33-34, 37-38.
Vogel, A.I. (1979). Textbook of Macro and Semimicro Qualitative Inorganic Analysis. Penerjemah: Setiono dan Hadyana Pudjaaatmaka. (1985). Vogel: Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Bagian I. Jakarta: Kalman Media Pustaka. Halaman 263,307.
Winarso, S. (2005). Kesuburan Tanah Dasar Kesehatan dan Kualitas Tanah. Yogyakrata: Gava Media. Halaman 148, 168.
Wijayakusuma, H dan Dalimartha, S. (2000). Ramuan Tradisional untuk Pengobatan Darah Tinggi. Jakarta: Penebar Swadaya. Halaman 13-15. WHO. (1998). Quality Control Methods for Medicinal Plant Materials.
BAB III
METODE PENELITIAN
Metode penelitian yang dilakukan ini adalah penelitian yang bersifat deskriptif, yang bertujuan menggambarkan suatu keadaan secara sistematis yaitu untuk mengetahui karakteristik simplisia daun dan biji kelor serta analisis kadar mineral magnesium dan besi.
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Farmakognosi, Laboratorium Kimia Farmasi Kualitatatif dan Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara pada bulan April – Juli 2015.
3.2 Alat-Alat
3.3 Bahan-bahan
3.3.1 Sampel
Sampel yang digunakan dalam penelitian ini adalah daun dan biji kelor yang dikeringkan yang berasal dari Jl. Mamyay Pasar I Tembung Tambak Rejo Kelurahan Kenangan Baru, Kabupaten Deli Serdang, Provinsi Sumatera Utara.
3.3.2 Pereaksi
Semua bahan yang digunakan dalam penelitian ini berkualitas pro analisa keluaran E. Merck yaitu asam nitrat pekat 65% b/v, asam klorida pekat, ammonium tiosianat, etanol, kloralhidrat, kloroform, natrium hidroksida, titan yellow 0,05% b/v dan toluene (CV. Rudang Jaya), akuademineralisata, larutan baku magnesium nitrat [Mg(NO3)2] 1000 µg/ml dan larutan baku besi nitrat
[Fe(NO3)3] 1000 µg/ml (Laboratorium Penelitian Fakultas Farmasi USU).
3.4 Pembuatan Pereaksi
3.4.1 Pereaksi Asam Klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling hingga 100 ml (Ditjen, POM., 1979).
3.4.2 Larutan Asam Nitrat (1:1) v/v
Asam Nitrat 65% sebanyak 500 ml diencerkan dengan air suling hingga 500 ml (Ditjen, POM., 1979).
3.4.3 Pereaksi Ammonium tiosianat (NH4SCN) 1,5 N
3.4.4 Pereaksi Kloralhidrat
Sebanyak 50 g kloralhidrat dilarutkan dalam 20 ml air suling (Ditjen, POM., 1979).
3.4.5 Pereaksi Natrium Hidroksida 3 N
Sebanyak 63,2 g pelet natrium hidroksida dilarutkan dengan 50 ml akuades dan aduk hingga melarut, pindahkan ke botol plastik 500 ml bertutup, encerkan larutan sampai volumnya menjadi 500 ml kemudian tutup rapat (Manan, 2005).
3.4.6 Pereaksi Titan Yellow 0,2% b/v
Sebanyak 0,2 g titan kuning dilarutkan di dalam 100 ml akuades (Manan, 2005).
3.5 Prosedur Penelitian
3.5.1 Pengambilan Sampel
Metode pengambilan sampel dilakukan dengan cara sampling purposif yang dikenal juga sebagai sampling pertimbangan yang berarti sampel ditentukan atas pertimbangan bahwa populasi sampel adalah homogen dan sampel yang tidak diambil mempunyai karakteristik yang sama dengan sampel yang sedang diteliti (Sudjana, 2005).
3.5.2 Identifikasi Sampel
3.5.3 Pembuatan Simplisia Daun dan Biji Kelor
Sampel yang telah diperoleh, dibersihkan dari kotoran-kotoran dicuci dengan air ledeng yang mengalir dan ditiriskan. Sampel dikeringkan di lemari pengering dengan suhu 400C hingga kering lalu ditimbang sebagai berat kering. Selanjutnya simplisia diblender dan disimpan dalam kantung plastik.
3.5.4 Penentuan Karakteristik Simplisia
Penentuan karakteristik simplisia meliputi pemeriksaan makroskopik, pemeriksaan mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total dan penetapan kadar abu yang tidak larut dalam asam (Ditjen, POM., 1995; Kemenkes, RI., 2011).
3.5.4.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan pada tumbuhan segar dan simplisia kering yang meliputi pemeriksaan bentuk, bau, rasa dan warna (Ditjen, POM., 1995).
3.5.4.2 Pemeriksaan Mikroskopik
3.5.4.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen). Alat terdiri dari labu alas bulat 500 ml, alat penampung, pendingin, tabung penyambung dan tabung penerima.
Cara penetapan:
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu alas bulat, didestilasi selama 2 jam. Toluen didinginkan dan volume air pada tabung penerima dibaca. Ke dalam labu alas bulat dimasukkan 5 g serbuk simplisia yang telah ditimbang seksama, lalu dipanaskan hati-hati selama 15 menit. Setelah toluen mulai mendidih, kecepatan tetesan diatur, kurang lebih 2 tetes tiap detik hingga sebagian besar air tersuling dan selanjutnya kecepatan penyulingan dinaikkan hingga 4 tetes tiap detik. Didestilasi selama 2 jam lalu toluen dibiarkan mendingin. Bagian dalam pendingin dibilas dengan toluen yang telah dijenuhkan. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin sampai suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Kadar air dihitung dalam persen (Kemenkes, RI., 2011).
3.5.4.4 Penetapan Kadar Sari yang Larut dalam Air
dihitung dalam persen terhadap bahan yang telah dikeringkan (Kemenkes, RI., 2011).
3.5.4.5 Penetapan Kadar Sari yang Larut dalam Etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml etanol 95% memakai labu bersumbat sambil dikocok sesekali selama 6 jam pertama, dibiarkan selama 18 jam kemudian disaring cepat untuk menghindari penguapan etanol. Sebanyak 20 ml filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105°C sampai bobot tetap. Kadar sari yang larut dalam etanol dihitung dalam persen terhadap bahan yang telah dikeringkan (Kemenkes, RI., 2011).
3.5.4.6 Penetapan Kadar Abu Total
Sebanyak 2 g serbuk dimasukkan ke dalam krus porselin yang telah dipijar dan ditara kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pijaran dilakukan pada suhu 600°C, didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung dalam persen terhadap bahan yang telah dikeringkan (Kemenkes, RI., 2011).
3.5.4.7 Penetapan Kadar Abu yang Tidak Larut dalam Asam
3.5.5 Penentuan Mineral Magnesium dan Besi
3.5.5.1 Proses Destruksi Kering
Simplisia daun kelor yang telah diblender ditimbang sebanyak 5 g dalam krus porselin, ditambah 5 tetes HNO3 65% (b/v), diarangkan di atas hot plate, lalu
diabukan di dalam tanur mula-mula pada temperatur 100oC dan secara perlahan-lahan dinaikkan interval 25oC setiap 5 menit sampai temperatur menjadi 500oC dan pengabuan dilakukan selama 75 jam (dihitung saat suhu sudah 500°C), lalu suhu tanur diturunkan ± 29°C, krus porselin dikeluarkan. Abu dilarutkan dalam 5 ml HNO3 (1:1) dan diuapkan di atas hot plate sampai kering (Isaac, 1990).
Hal yang sama juga dilakukan untuk simplisia biji kelor yang telah diblender, ditanur sampai temperatur 500oC dan pengabuan dilakukan selama 92 jam. Perlakuan yang sama diulang sebanyak 6 kali untuk masing-masing sampel.
3.5.5.2 Pembuatan Larutan Sampel
Sampel hasil dekstruksi yang di dalam krus porselin dilarutkan dengan 5 ml HNO3 (1:1), dituangkan ke dalam labu tentukur 100 ml, lalu krus porselen dibilas
3.5.5.3 Pemeriksaan Kualitatif
3.5.5.3.1 Magnesium
3.5.5.3.1.1 Reaksi Uji Kualitatif dengan Larutan Titan Yellow 0,2% b/v
Ke dalam tabung reaksi dimasukkan 2 ml larutan sampel, ditambah 5-6 tetes NaOH 3 N dan 3 tetes pereaksi Titan yellow. Dihasilkan endapan atau larutan warna merah terang (Vogel, 1979).
3.5.5.3.2 Besi
3.5.5.3.2.1 Reaksi Uji Kualitatif dengan Larutan (NH4SCN) 1,5 N
Ke dalam tabung reaksi di masukkan 2 ml larutan sampel hasil destruksi, ditambahkan 3 tetes ammonium tiosianat 1,5 N. Dihasilkan larutan berwarna merah (Vogel, 1979).
3.5.5.4 Pemeriksaan Kuantitatif
3.5.5.4.1 Pembuatan Kurva Kalibrasi Magnesium
Larutan baku magnesium nitrat (konsentrasi 1000 µg/ml) dipipet sebanyak 1 ml dimasukkan ke dalam labu tentukur 100 ml dan dicukupkan hingga garis tanda dengan akuademineralisata (konsentrasi 10 µg/ml).
3.5.5.4.2 Pembuatan Kurva Kalibrasi Besi
Larutan baku besi nitrat (konsentrasi 1000 µg/ml) dipipet sebanyak 2,5 ml di masukkan ke dalam labu tentukur 50 ml dan dicukupkan hingga garis tanda dengan akuademineralisata (konsentrasi 50 µ g/ml).
Larutan untuk kurva kalibrasi besi dibuat dengan memipet (1; 2; 3; 4 dan 5) ml larutan baku 50 µg/ml, masing-masing dimasukkan ke dalam tentukur 25 ml dan dicukupkan hingga garis tanda dengan akuademineralisata. Larutan ini mengandung (2,0; 4,0; 6,0; 8,0; dan 10;0) µg/ml dan diukur absorbansi pada panjang gelombang 248,3 nm dengan nyala udara-asetilen.
3.5.5.4.3 Penetapan Kadar Mineral Magnesium dan Besi dalam Sampel
Sebelum dilakukan penetapan kadar magnesium dan besi dalam sampel, terlebih dahulu alat spektrofotometer serapan atom dikondisikan dan di atur metodenya sesuai dengan mineral yang akan diperiksa.
3.5.5.4.3.1 Penetapan Kadar Magnesium dalam Sampel
Hal yang sama juga dilakukan terhadap larutan sampel hasil dekstruksi biji dengan memipet sebanyak 0,25 ml dimasukkan ke dalam labu tentukur 50 ml dan dicukupkan dengan akuademineralisata sampai garis tanda (Faktor pengenceran = 50 ml/0,25 ml = 200 kali).
3.5.5.4.3.2 Penetapan Kadar Besi dalam Sampel
Larutan sampel dari hasil destruksi daun dipipet sebanyak 10 ml dimasukkan ke dalam labu tentukur 25 ml dan dicukupkan dengan akuademineralisata sampai garis tanda (Faktor pengenceran = 25 ml/10 ml = 2,5 kali). Lalu diukur absorbansinya dengan menggunakan spektrofotometer serapan atom yang telah dikondisikan dan di atur metodenya dimana penetapan kadar besi dilakukan pada panjang gelombang 248,3 nm dengan nyala udara-asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku besi. Konsentrasi besi dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
Hal yang sama juga dilakukan terhadap larutan sampel hasil dekstruksi biji tanpa ada faktor pengenceran.
kadar mineral magnesium dan besi dalam sampel dapat dihitung dengan cara sebagai berikut:
(g) Sampel Berat FP x (ml) Volume x ) (µg/ml i Konsentras (µg/g) Mineral
Kadar =
Keterangan:
3.5.6 Analisis Data Secara Statistik
3.5.6.1 Penolakan Hasil Pengamatan
Menurut Sudjana (2005), kadar magnesium dan besi yang diperoleh dari hasil pengukuran masing-masing larutan sampel dianalisis dengan metode standar deviasi menggunakan rumus sebagai berikut:
SD =
�
∑(��−�)2
�−1
Keterangan:
Xi = kadar sampel (mg/100g)
X = kadar rata-rata sampel (mg/100g) n = jumlah pengulangan
Untuk mengetahui data diterima atau ditolak digunakan uji-t dengan rumus:
t hitung = | Xi−X | SD / √n
dan untuk menentukan kadar mineral di dalam sampel dengan interval
kepercayaan 99%, α = 0,01; dk = n-1, dapat digunakan rumus: Kadar Mineral: μ = X ± (t(α/2, dk) x SD / √�)
Keterangan:
X = kadar rata-rata sampel (mg/100g) SD = standar deviasi (mg/100g)
dk = derajat kebebasan (dk = n-1)
α = int