SCREENING ANTICANCER ACTIVITY OF SOME ORGANOTIN(IV) 3-HYDROXYBENZOATE COMPOUNDS AGAINST LEUKEMIA L-1210
By
ANI SULISTRIANI
AKTIVITAS ANTIKANKER BEBERAPA SENYAWA ORGANOTIMAH(IV) 3-HIDROKSIBENZOAT TERHADAP SEL
LEUKEMIA L-1210
Oleh
ANI SULISTRIANI
Pada penelitian ini, telah dilakukan sintesis dan karakterisasi serta uji pendahuluan aktivitas antikanker beberapa senyawa organotimah(IV) 3-hidroksibenzoat terhadap sel leukemia L-1210. Sintesis senyawa organotimah(IV) 3-hidroksibenzoat diawali dengan sintesis dibutiltimah(IV) oksida, difeniltimah(IV) dihidroksida dan trifeniltimah(IV) hidroksida dengan menggunakan bahan awal yaitu dibutiltimah(IV) diklorida, difeniltimah(IV) diklorida, trifeniltimah(IV) klorida yang direaksikan dengan NaOH dalam pelarut metanol. Ketiga senyawa tersebut masing-masing direaksikan dengan ligan asam karboksilat yaitu asam 3-hidroksibenzoat dan mengahasilkan masing-masing dibutiltimah(IV) di-3-hidroksibenzoat, difeniltimah(IV)di-3-hidroksibenzoat dan trifeniltimah(IV) 3-hidroksibenzoat dengan rendemen kristal yang dihasilkan sebanyak 96,29; 92,66; dan 81,24 %, pada waktu refluks 4 jam. Seluruh senyawa tersebut dikarakterisasi dengan menggunakan spektrofotometer IR, UV, dan
analisis unsur dengan menggunakan microelemental analyzer. Kemudian
I. PENDAHULUAN
A. Latar Belakang
Kanker adalah penyakit degeneratif yang ditandai dengan keadaan sel yang membagi secara terus-menerus (proliferasi) tanpa kontrol dan mempunyai kemampuan untuk menyebar (metastasis) ke jaringan yang berlainan secara patologi (Hawariah, 1998a). Kanker menjadi masalah utama kesehatan di seluruh dunia dan penyakit pembunuh kedua setelah kardiovaskuler (Apantaku, 2002; American Cancer Society, 2010).
Menurut data terbaru dari GLOBOCAN (2010), pada tahun 2008, di dunia tercatat lebih dari 12,7 juta kasus penyakit kanker dan 7,6 juta pasien yang diantaranya meninggal dunia. GLOBOCAN juga memperkirakan bahwa sampai tahun 2030, terdapat sekitar 21,4 juta pasien yang terjangkit kanker setiap tahunnya dan dari jumlah tersebut 13,2 juta diprediksi akan meninggal. Di Indonesia, menurut GLOBOCAN dengan jumlah penduduk 230 juta, terdapat kasus penyakit kanker sebanyak 292.300 pada tahun 2008 (GLOBOCAN, 2010). GLOBOCAN
merupakan agensi internasional yang mengadakan penelitian mengenai jumlah rata-rata penderita kanker di seluruh dunia pada tahun 2008.
secara pembedahan tidak dapat dilakukan khususnya pada sel kanker yang telah menyebar, sementara pengobatan kemoterapi dan radiasi dapat menimbulkan efek samping meskipun pengobatan kemoterapi mampu mengeluarkan keseluruhan tumor (Hawariah, 1998b). Oleh karena itu, usaha pencarian agen dengan efek samping minimum sangat diperlukan dalam pengobatan penyakit kanker, salah satunya yaitu dengan menggunakan senyawa organotimah.
Senyawa organotimah merupakan senyawa dimana atom-atom karbon dari gugus organik terikat pada logam timah. Senyawa organotimah dapat berbentuk mono-, di-, tri-, dan tetra- organotimah bergantung pada gugus alkil (R) atau aril (Ar) yang terikat pada Sn. Anion yang terikat (X) biasanya adalah klorida, fluorida, oksida, hidroksida, suatu karboksilat atau suatu thiolat (Pellerito and Nagy, 2002).
Studi aktivitas antikanker senyawa organotimah(IV) sebagai senyawa bahan alternatif antikanker telah banyak dilakukan dan masih menarik untuk terus dilakukan mengingat potensi besar yang terdapat dalam senyawa golongan ini (De Voset al., 1998; Gielen, 2003; Gleesonet al., 2008; Rehmanet al., 2009;
Hadi dan Rilyanti, 2010). Senyawa organotimah(IV) merupakan senyawa yang dikenal memiliki berbagai aktivitas biologis (Pellerito and Nagy, 2002). Senyawa organotimah(IV) ini mempunyai aplikasi yang luas diantaranya sebagai pestisida dalam pertanian (Crowe, 1989), katalis homogen (Blundenet al., 1987),
antikanker/antitumor (De Voset al., 1998; Gleesonet al., 2008; Hadi dan
Rilyanti, 2010),antifouling agentpada cat (Blunden and Hill, 1990), antimikroba,
Senyawa organotimah(IV) karboksilat mendapat perhatian khusus karena senyawa ini memiliki aktivitas biologis yang lebih kuat dibandingkan kompleks
organotimah lainnya. Aktivitas biologis ini ditentukan oleh jumlah dan gugus organik yang terikat pada atom Sn (Mahmoodet al., 2003; Pellerito and Nagy,
2002). Senyawa organotimah(IV) karboksilat dipilih dalam penelitian ini, berdasarkan aktivitas biologisnya sebagai antikanker dengan asam
3-hidroksibenzoat sebagai ligannya. Penelitian sebelumnya (Aini, 2010) dilaporkan aktivitas antikanker senyawa organotimah(IV) salisilat dengan asam salisilat sebagai ligannya diperoleh nilai IC503,86 μ g/mL. Pada penelitian lain (Sari, 2011) aktivitas antikanker senyawa organotimah(IV) benzoat dengan asam benzoat sebagai ligannya diperoleh nilai IC505, 32 μ g/mL. Jika IC50dari senyawa ini adalah≤50 µg/mL, maka, senyawa organotimah(IV) 3-hidroksibenzoat
berpotensi sebagai senyawa antikanker (Mans, 2000). Asam meta dan para hidroksibenzoat mempunyai kelarutan dalam air yang lebih besar dibandingkan dengan asam benzoat dan asam salisilat. Perubahan sifat fisika kimia tersebut mempunyai pengaruh terhadap sifat analgesik dan antibakteri dari senyawa turunan asam benzoat (Petra, 2012). Oleh sebab itu, diharapkan senyawa organotimah(IV) 3-hidroksibenzoat yang merupakan senyawa turunan asam benzoat mempunyai aktivitas antikanker dan memiliki nilai IC50lebih kecil dari penelitian sebelumnya.
Penelitian ini dilakukan untuk mensintesis senyawa dibutiltimah(IV)
di-3-hidroksibenzoat, difeniltimah(IV) di-3-hidroksibenzoat dan trifeniltimah(IV) 3-hidroksibenzoat. Senyawa yang diperoleh dikarakterisasi menggunakan
Masing-masing senyawa dibutiltimah(IV) oksida, difeniltimah(IV) dihidroksida dan trifeniltimah(IV) hidroksida direaksikan dengan asam 3-hidroksibenzoat sebagai asam karboksilatnya, menghasilkan dibutiltimah(IV)
di-3-hidroksibenzoat, difeniltimah(IV) di-3-hidroksibenzoat dan trifeniltimah(IV) 3-hidroksibenzoat. Ketiga senyawa tersebut diuji dan dibandingkan aktivitas antikankernya terhadap sel leukemia L-1210. Setelah diketahui aktivitas antikankernya, kemudian dibandingkan dengan organotimah(IV) benzoat (Sari, 2011) dan organotimah(IV) salisilat (Aini, 2010) dari penelitian sebelumnya.
Prosedur untuk sintesis masing-masing senyawa organotimah(IV) karboksilat pada penelitian ini dikembangkan dari prosedur yang digunakan oleh
Szorcsiket al. (2002) yang berhasil diadaptasi dengan hasil yang cukup
memuaskan (Hadiet al., 2008; Hadiet al., 2009; Hadi and Rilyanti, 2010)
sedangkan prosedur untuk pengujian aktivitas antikanker diadopsi dari prosedur yang dilakukan oleh Katrin dan Winarno (2008). Sel leukemia L-1210 dipilih karena sel leukemia L-1210 merupakan sel tumor yang tumbuh cepat dengan persentase sel hidup cukup tinggi dan memiliki tingkat pertumbuhan 100%. Jika suatu zat toksik terhadap sel leukemia L-1210, maka pada umumnya bersifat toksik terhadap sel-sel abnormal lainnya (Bulan dkk., 2004). Sel hidup dihitung menggunakanHaemocytometer Neubauer Improved, di bawah mikroskrop.
yang akan sangat berguna dan memegang peranan penting di bidang farmasi dan kedokteran.
B. Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut :
1. Mensintesis senyawa dibutiltimah(IV) di-3-hidroksibenzoat, difeniltimah(IV) di-3-hidroksibenzoat dan trifeniltimah(IV) 3-hidroksibenzoat.
2. Mengkarakterisasi senyawa awal dibutiltimah(IV) diklorida, difeniltimah(IV) diklorida dan trifeniltimah(IV) klorida serta senyawa hasil sintesis
dibutiltimah(IV) di-3- hidroksibenzoat, difeniltimah(IV) di-3-hidroksibenzoat, trifeniltimah(IV) 3-hidroksibenzoat, dengan rendemen tertinggi dari variasi waktu refluks menggunakan spektrofotometerUV, spektrofotometerIRdan
microelemental analyzer(tidak termasuk asam 3-hidroksibenzoat).
3. Menguji dan membandingkan aktivitas antikanker dari senyawa
dibutiltimah(IV) di-3-hidroksibenzoat, difeniltimah(IV) di-3-hidroksibenzoat dan trifeniltimah(IV) 3-hidroksibenzoat terhadap sel leukemia L-1210.
C. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan sumbangan terhadap perkembangan ilmu pengetahuan khususnya di bidang organologam dan menambah jenis senyawa organologam yang dapat digunakan dalam bidang farmasi dan kedokteran yaitu sebagainew metal-based drugs(senyawa
A. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan April sampai dengan Juli 2012 di
Laboratorium Kimia Anorganik FMIPA Universitas Lampung. Analisis senyawa menggunakan spektrofotometerUV dilakukan di Laboratorium Biokimia FMIPA
Universitas Lampung dan analisis senyawa menggunakan spektrofotometerIR
dilakukan di Laboratorium Instrumentasi FMIPA Universitas Islam Indonesia. Analisis unsur dengan menggunakanmicroelemental analyzerdilakukan di
School of Chemical and Food Technology, Universiti Kebangsaan Malaysia.
Uji aktivitas antikanker dilakukan di Laboratorium Kimia Bahan Alam, Pusat Aplikasi Teknologi Isotop dan Radiasi (PATIR) BATAN, Jakarta Selatan.
B. Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah : alat-alat gelas, satu set alat refluks,hot plate stirrer, kertas saringWhatmanNo. 42, cawan petri, desikator,
spektrofotometerUV Carry Win UV 32dan spektrofotometerIR Thermo Nicolet
Bahan-bahan yang digunakan dalam penelitian ini adalah : dibutiltimah(IV) diklorida, difeniltimah(IV) diklorida, trifeniltimah(IV) klorida, NaOH,
metanolp.a., akuabides, asam 3-hidroksibenzoat, dan isolat sel leukemia L-1210
BATAN, Jakarta Selatan.
C. Metode Penelitian
Prosedur untuk sintesis masing-masing senyawa organotimah(IV) karboksilat pada penelitian ini diadopsi dari prosedur yang dilakukan oleh Szorsciket al.
(2002); Hadiet al.(2008); Hadiet al.(2009); dan Hadi and Rilyanti. (2010).
1. Sintesis senyawa dibutiltimah(IV) oksida [(C4H9)2SnO]
Dibutiltimah(IV) diklorida [(C4H9)2SnCl2] sebanyak 0,03 mol (9,12 gram) direaksikan dengan 0,06 mol (2,40 gram) NaOH untuk mengganti ligan klor dengan oksida dalam 50 mL metanolp.a., selanjutnya endapan yang dihasilkan
disaring dengan menggunakan kertas saringWhatmanNo. 42, lalu dicuci dengan
akuabides dan metanolp.a.Pencucian endapan dengan akuabides berfungsi untuk
menghilangkan garam NaCl yang masih tercampur di dalam endapan. Pencucian dengan metanolp.a untuk menghilangkan pengotor-pengotor organik yang
bersifat polar seperti senyawa awal yang tidak ikut bereaksi. Endapan didiamkan di dalam desikator selama kurang lebih 2 minggu untuk menghasilkan
(C4H9)2SnO. Kristal (C4H9)2SnCl2dan (C4H9)2SnO dikarakterisasi dengan spektrofotometerUVpada panjang gelombang 190-380 nm (Sudjadi, 1985),
spektrofotometerIRdan dianalisis kandungan unsur C dan H dengan alat
2. Sintesis senyawa dibutiltimah(IV) di-3-hidroksibenzoat [(C4H9)2Sn(OCOC6H4OH)2]
Senyawa dibutiltimah(IV) oksida [(C4H9)2SnO] sebanyak 0,74 gram direaksikan dengan asam 3-hidroksibenzoat (C6H4OHCOOH) sebanyak 0,82 gram dengan perbandingan mol 1:2 dalam 30 mL metanolp.a.,dan direfluks dengan variasi
waktu 3, 4, 5 dan 6 jam dengan pemanas pada suhu 60°C. Setelah reaksi sempurna, metanol p.a.diuapkan dan dikeringkan di dalam desikator selama
kurang lebih 2 minggu sampai diperoleh kristal kering. Kristal hasil senyawa dengan rendemen tertinggi dari variasi waktu refluks tersebut siap untuk dikarakterisasi dengan spektrofotometerIRdan spektrofotometerUV pada
panjang gelombang 190-380 nm (Sudjadi, 1985). Dianalisis kandungan unsur C
dan H dengan alatmicroelemental analyzerdan diuji sifat antikankernya terhadap
sel leukemia L-1210. Asam 3-hidroksibenzoat juga dikarakterisasi dengan spektrofotometerUV dan spektrofotometerIRsebagai perbandingan.
3. Sintesis senyawa difeniltimah(IV) dihidroksida [(C6H5)2Sn(OH)2]
Difeniltimah(IV) diklorida [(C6H5)2SnCl2] sebanyak 0,03 mol (10,32 gram) direaksikan dengan 0,06 mol (2,40 gram) NaOH untuk mengganti ligan klor dengan hidroksida dalam 50 mL metanolp.a., selanjutnya endapan yang
dihasilkan disaring dengan menggunakan kertas saringWhatmanNo 42, lalu
dicuci dengan akuabides dan metanolp.a.kemudian didiamkan di dalam desikator
pada panjang gelombang 190-380 nm (Sudjadi, 1985), spektrofotometerIRdan
dianalisis kandungan unsur C dan H dengan alatmicroelemental analyzer.
4. Sintesis senyawa difeniltimah(IV) di-3-hidroksibenzoat [(C6H5)2Sn(OCOC6H4OH)2]
Senyawa difeniltimah(IV) dihidroksida (C6H5)2Sn(OH)2sebanyak 0,92 gram direaksikan dengan asam 3-hidroksibenzoat (C6H4OHCOOH) sebanyak 0,82 gram dengan perbandingan mol 1: 2 dalam 30 mL metanolp.a.dan direfluks dengan
variasi waktu 3, 4, 5 dan 6 jam dengan pemanas pada suhu 60°C. Setelah reaksi sempurna, metanolp.a.diuapkan dan dikeringkan di dalam desikator selama
kurang lebih 2 minggu sampai diperoleh kristal kering. Kristal hasil senyawa dengan rendemen tertinggi dari variasi waktu refluks tersebut siap untuk dikarakterisasi dengan spektrofotometerIRdan spektrofotometerUV pada
panjang gelombang 190-380 nm (Sudjadi, 1985). Kandungan unsur C dan H dianalisis dengan alatmicroelemental analyzerdan diuji sifat antikankernya
terhadap sel leukemia L-1210.
5. Sintesis senyawa trifeniltimah(IV) hidroksida [(C6H5)3SnOH]
Trifeniltimah(IV) klorida [(C6H5)3SnCl] sebanyak 0,03 mol (11,56 gram) direaksikan dengan 0,03 mol (1,20 gram) NaOH untuk mengganti ligan klor dengan hidroksida dalam 50 mL metanolp.a., selanjutnya endapan yang
dihasilkan disaring dengan menggunakan kertas saringWhatmanNo. 42, lalu
dicuci dengan akuabides dan metanolp.a.kemudian didiamkan di dalam desikator
(C6H5)3SnCl dan (C6H5)3SnOH dikarakterisasi dengan spektrofotometerUVpada panjang gelombang 190-380 nm (Sudjadi, 1985), spektrofotometerIRdan
dianalisis kandungan unsur C dan H dengan alatmicroelemental analyzer.
6. Sintesis senyawa trifeniltimah(IV) 3-hidroksibenzoat [(C6H5)3Sn(OCOC6H4OH)]
Senyawa trifeniltimah(IV) hidroksida (C6H5)3SnOH sebanyak 1,10 gram
direaksikan dengan asam 3-hidroksibenzoat (C6H4OHCOOH) sebanyak 0,41 gram dengan perbandingan mol 1:1 dalam 30 mL metanolp.a.dan direfluks dengan
variasi waktu 3, 4, 5 dan 6 jam dengan pemanas pada suhu 60°C. Setelah reaksi sempurna, metanolp.a.diuapkan dan dikeringkan di dalam desikator selama
kurang lebih 2 minggu sampai diperoleh kristal kering. Kristal hasil senyawa dengan rendemen tertinggi dari variasi waktu refluks tersebut siap untuk dikarakterisasi dengan spektrofotometerIRdan spektrofotometerUV pada
panjang gelombang 190-380 nm (Sudjadi, 1985). Kandungan unsur C dan H dianalisis dengan alatmicroelemental analyzerdan diuji sifat antikankernya
terhadap sel leukemia L-1210.
7. Pengujian Aktivitas Antikanker Terhadap Sel Leukemia L-1210
diperoleh 500 mL media (C). Keperluan uji, digunakan 15 mLcalf bovine serum
yang ditambahkan ke dalam 85 mL larutan C. Semua pekerjaan dilakukan di ruang steril.
Sel leukemia L-1210 yang menjadi target uji aktivitas antikanker ini adalah sel leukemia yang diperoleh dari sel limfosit tikus putih betina jenis DBA (Dilute
Brown Non-Agouti Mouse) yang berumur 8 bulan. Sel leukemia ini diperoleh dari The Institute of Physical and Chemical Research, Japan. Sel leukemia
disuspensikan ke dalam media yang telah mengandungcalf bovine serum
sehingga jumlah sel sekitar 2 x 106sel/mL.
Pengujian aktivitas sitotoksik sampel uji dilakukan dengan 5 variasi dosis yaitu 1, 2, 4, 8 dan 16 µg/mL. Media yang telah mengandung suspensi sel leukemia L-1210 (2 x 106sel/mL) dimasukkan ke dalammulti well plate tissue’s culture
sebanyak 1 mL dalam setiap sumuran. Percobaan dilakukan triplo, selanjutnya suspensi sel yang telah diisi zat uji diinkubasi selama 48 jam pada suhu 37°C dalam inkubator 5% CO2karena di udara hanya terdapat 5% CO2.
Perhitungan sel dilakukan menggunakanhaemocytometer neubauer improved.
Haemocytometer neubaur improvedmerupakan alat yang digunakan untuk
menghitung atau menentukan jumlah sel per satuan volume. Di dalam
Haemocytometer terdapat sebuah ruang yang digunakan untuk menghitung sel tersebut (Caprette, 2007). Suspensi sel dimasukkan ke dalam ruang dan harus cukup encer, agar sel atau partikel lain tidak tumpang tindih satu sama lain digrid
persentase inhibisi zat uji terhadap sel leukemia L-1210 tersebut. Gambar 5 merupakan alathaemocytometer neubaur improved.
Gambar 5. Haemocytometer neubauer improved.
Untuk membedakan antara sel hidup dengan sel mati maka sebelum dilakukan penghitungan, 90 µL suspensi dimasukkan ke dalamsero cluster plate
(96 sumuran) dan ditambah 10 µL larutan 1% larutantryphan bluedan
dihomogenkan. Campuran sampel uji yang telah diwarnaitryphan bluesebanyak
10 µL larutan dialirkan ke dalamhaemocytometer neubauer improved. Setelah
itu, jumlah sel yang masih hidup dihitung di bawah mikroskop. Sel hidup terlihat sebagai bulatan bening dengan bintik biru inti sel di tengah bulatan, sedangkan sel mati terlihat sebagai bercak biru pekat yang bentuknya tidak teratur.
% inhibisi =
B A
1 x 100%
A : jumlah sel hidup dalam media yang mengandung zat uji
B : jumlah sel hidup dalam media yang tidak mengandung zat uji (kontrol)
II. TINJAUAN PUSTAKA
A. Senyawa Organologam
Senyawa organologam merupakan senyawa dimana terdapat minimal satu ikatan langsung antara atom karbon dari gugus organik dengan atom logam. Senyawa yang mengandung ikatan karbon dengan fosfor, arsen, silikon, ataupun boron termasuk ke dalam senyawa organologam. Tetapi untuk senyawa yang mengandung ikatan antara atom logam dengan oksigen, belerang, nitrogen, ataupun dengan suatu halogen tidak termasuk sebagai senyawa organologam.
Sebagai contoh, suatu alkoksida seperti (C3H7O)4Ti bukan termasuk suatu senyawa organologam karena gugus organiknya terikat kepada Ti melalui oksigen, sedangkan C6H5Ti(OC3H7)3merupakan senyawa organologam karena terdapat satu ikatan langsung antara karbon dengan logam Ti (Cotton dan Wilkinson, 1989).
Berdasarkan ikatannya, senyawa organologam dapat dikelompokkan menjadi tiga golongan :
1. Senyawa ionik dari logam elektropositif
Senyawa ini terbentuk bila suatu radikal organik terikat pada logam dengan keelektropositifan yang sangat tinggi, misalnya logam alkali atau alkali tanah. Senyawa-senyawa ini tidak stabil di udara, mudah terhidrolisis dalam air dan tidak larut dalam pelarut hidrokarbon. Kestabilannya bergantung pada kestabilan radikal organiknya.
2. Senyawa organologamdengan ikatan σ (sigma)
Senyawa ini memiliki ikatan σ dua pusat dua elektron yang terbentuk antara
gugus organik dan atom logam dengan keelektropositifan rendah. Pada umumnya, senyawa organologam dengan ikatan ini memiliki ikatan utama kovalen dan sifat kimianya adalah dari kimiawi karbon yang disebabkan karena beberapa faktor, yaitu :
a. Kemungkinan penggunaan orbital d yang lebih tinggi, seperti pada SiR4 yang tidak tampak dalam CR4.
b. Kemampuan donor alkil atau aril dengan pasangan elektron menyendiri. c. Keasaman Lewis sehubungan dengan kulit valensi yang tidak penuh
seperti ada BR2atau koordinasi tak jenuh seperti ZnR2.
3. Senyawa organologam dengan ikatan nonklasik
Dalam senyawa organologam dengan ikatan nonklasik ini terdapat jenis ikatan antara logam dengan karbon yang tidak dapat dijelaskan secara ikatan ionik atau pasangan elektron. Senyawa ini terbagi menjadi dua golongan : a. Senyawa organologam yang terbentuk antara logam-logam transisi
dengan alkena, alkuna, benzena dan senyawa organik tak jenuh lainnya. b. Senyawa organologam yang memiliki gugus-gugus alkil berjembatan.
(Cotton dan Wilkinson, 1989).
B. Asam 3-hidroksibenzoat
Asam 3-hidroksibenzoat adalah senyawa dengan rumus molekulC6H4OHCOOH
yang berbentuk padatan kristal berwarna putih, dengan titik leleh 203°C dan berat molekul 138 gram/mol.
Struktur dari asam 3-hidroksibenzoat dapat dilihat pada Gambar 1.
Gambar 1. Struktur asam 3-hidroksibenzoat.
tinggi dan kemampuan membentuk kelat lebih besar dibanding bentuk meta dan para. Bentuk meta dan para hidroksibenzoat dapat membentuk ikatan hidrogen intermolekul sehingga memperbesar kelarutan dalam air dibanding bentuk orto. Perubahan sifat fisika kimia tersebut berpengaruh terhadap aktivitas analgesik dan antibakteri turunan hidroksi benzoat. Ikatan hidrogen juga membantu terhadap kestabilan konformasiα-heliks peptida-peptida dan interaksi pasangan basa khas, seperti purin dan piridin pada ADN. Obat antikanker seperti golongan senyawa pengalkilasi, dapat mengalkilasi pasangan basa ADN dan mencegah pembentukan iktan hidrogen sehingga replikasi normal dari ADN tidak terjadi (Petra, 2012).
C. Timah (Sn)
Timah atauStannum(Sn) merupakan logam lemah yang berwarna putih
keperakan yang sukar dioksidasi oleh udara pada temperatur kamar. Dalam tabel periodik timah termasuk golongan 14. Timah mempunyai titik didih 2270ºC dan titik lebur 231,97ºC. Unsur ini dijumpai sebagai timah(IV) oksida dalam bijih seperti kasiterit (SnO2) dan stanit (Cu2FeSnS4), serta diekstraksi melalui reduksi dengan karbon (Daintith, 1990).
Timah dalam bentuk senyawaannya memiliki tingkat oksidasi +2 dan +4, tingkat oksidasi +4 lebih stabil dari pada +2. Pada tingkat oksidasi +4, timah
Unsur timah (Sn) termasuk golongan unsur mineral mikroesensial. Pada tahun 1970, dilaporkan bahwa timah ternyata esensial untuk tikus-tikus percobaan. Pertumbuhan menjadi lebih baik apabila Sn ditambahkan dalam makanan yang dimurnikan, dan perbaikan pigmentasi gigi seri.
Pada salah satu percobaan, pemberian Sn dengan kadar 1-2 mg/kg makanan yang telah dimurnikan dengan asam amino sebagai bahan utamanya, terjadi perbaikan pertumbuhan sampai 60%. Diduga Sn juga esensial untuk manusia maupun hewan, tetapi kepentingan praktisnya dalam makanan ternak diragukan
(Anggorodi, 1979). Selain itu, timah juga dikelompokkan sebagai mikromineral yang esensial pada berbagai spesies dan mungkin diperlukan oleh manusia (Murrayet al., 2003).
D. Senyawa Organotimah
Senyawa organotimah adalah senyawa yang mengandung sedikitnya satu ikatan kovalen Sn-C. Sebagian besar senyawa ini dapat dianggap sebagai turunan dari RnSnX4-n(n = 1-4) dan diklasifikasikan sebagai mono-, di-, tri-, dan
tetra-organotimah(IV), tergantung dari jumlah alkil (R) atau aril(Ar) yang terikat pada atom logam. Anion yang terikat (X) biasanya adalah klorida, fluorida, oksida, hidroksida, suatu karboksilat atau suatu thiolat (Pellerito and Nagy, 2002; Hadiet al., 2008).
normal walaupun dibakar menjadi SnO2, CO2dan H2O. Kemudahan putusnya ikatan Sn-C oleh halogen atau reagen lainnya bervariasi berdasarkan gugus organiknya dan urutannya meningkat dengan urutan : Bu (paling stabil) < Pr < et < me < vinil < Ph < Bz < alil < CH2CN < CH2CO2R (paling tidak stabil).
Penggabungan SnR4melalui gugus alkil tidak teramati sama sekali. Senyawa-senyawa dengan rumus R3SnX atau R2Sn2X tergabung secara luas melalui jembatan X sehingga meningkatkan bilangan koordinasi Sn menjadi lima, enam atau bahkan tujuh. Dalam hal ini, F lebih efektif dibandingkan unsur-unsur halogen lainnya. Sebagai contoh Me3SnF memiliki struktur trigonal bipiramida, Me2SnF2memiliki struktur oktahedral sedangkan jembatan Cl yang lebih lemah memiliki struktur terdistorsi.
Empat tipe utama penstabil timah berdasarkan gugus alkilnya yaitu: oktil, butil, fenil dan metal. Dimana oktil timah memiliki kandungan timah paling sedikit, paling kurang efisien. Ligan-ligan utama yang digunakan untuk membedakan berbagai penstabil timah yaitu, asam tioglikolat ester dan asam karboksilat (Van Der Weij, 1981).
1. Senyawa organotimah halida
Senyawa organotimah halida dengan rumus umum RnSnX4-n(n = 1-3; X = Cl, Br, I) pada umumnya merupakan padatan kristalin dan sangat reaktif.
Sintesis langsung ini ditinjau ulang oleh Murphy dan Poller melalui persamaan reaksi :
2 EtI + Sn Et2Sn + I2
Metode lain yang sering digunakan untuk pembuatan organotimah halida adalah reaksi disproporsionasi tetraalkiltimah dengan timah(IV) klorida. Caranya adalah dengan mengubah perbandingan material awal, seperti ditunjukkan pada
persamaan reaksi berikut :
3 R4Sn + SnCl4 4 R3SnCl R4Sn + SnCl4 2 R2SnCl2
Senyawa organotimah klorida digunakan sebagaistarting material(bahan dasar)
untuk sintesis organotimah halida lainnya, melalui penggantian langsung ion kloridanya dengan memakai logam halida lain yang sesuai seperti ditunjukkan pada persamaan reaksi berikut :
R4SnCl4-n + (4-n) MX R4SnX4-n + (4-n) MCl (X = F, Br atau I; M = K, Na, NH4)
(Cotton dan Wilkinson, 1989).
2. Senyawa organotimah hidroksida dan oksida
Prinsip tahapan intermediet ditunjukkan pada reaksi di bawah ini :
OH
R3SnX R2Sn XR2SnOSnR2X XR3SnOSnR3OH R2SnO
X atau
R3SnOH (Cotton dan Wilkinson, 1989).
3. Senyawa organotimah karboksilat
Senyawa organotimah karboksilat pada umumnya dapat disintesis melalui dua cara yaitu dari organotimah oksida atau organotimah hidroksidanya dengan garam karboksilat dan dari organotimah halidanya dengan garam karboksilat. Metode yang biasa digunakan untuk sintesis organotimah karboksilat adalah dengan menggunakan organotimah halida sebagai material awal.
Reaksi esterifikasi dari asam karboksilat dengan organotimah oksida atau hidroksida dilakukan melalui dehidrasi azeotropik dari reaktan dalam toluena, seperti ditunjukkan pada reaksi berikut :
R2SnO + 2 R’COOH R2Sn(OCOR’)2 + H2O R3SnOH + R’COOH R3SnOCOR’ + H2O (Cotton dan Wilkinson, 1989).
E. Aplikasi Senyawa Organotimah
penstabil PVC, pestisida nonsistematik, katalis antioksidan,antifouling agent
dalam cat, penstabil pada plastik dan karet sintetik, sebagaistabilizeruntuk
parfum dan berbagai macam peralatan yang berhubungan dengan medis dan gigi (Pellerito and Nagy, 2002).
Dalam beberapa penelitian, telah didapat dan diisolasi senyawa organotimah(IV) karboksilat yang menunjukkan sifat sebagai antimikroorganisme sehingga dapat berfungsi sebagai antifungi dan antimikroba (Bonireet al., 1998). Selain itu,
senyawa organotimah(IV) karboksilat ini juga menunjukkan sifat sebagai anti tumor (Martins et al., 2001; Jinshanet al., 2001). Untuk keseluruhan
penggunaan tersebut, kurang lebih 25 kiloton timah dipergunakan setiap tahunnya (Pellerito and Nagy, 2002).
F. Analisis Senyawa Organotimah
Pada penelitian yang akan dilakukan, hasil yang diperoleh dianalisis dengan menggunakan spektrofotometerUV, spektrofotometer Inframerah (IR) dan
analisis unsur C dan H dengan menggunakan alatmicroelemental analyzer.
1. Analisis spektroskopiUV-Vissenyawa organotimah
Pada spektroskopiUV-Vis, senyawa yang dianalisis akan mengalami transisi
elektronik sebagai akibat penyerapan radiasi sinarUVdan sinar tampak oleh
maka diperlukan energi paling tinggi dan akan memberikan serapan pada 120-200 nm (1 nm = 10-7cm = 10 Å). Daerah ini dikenal sebagai daerah
ultraviolet hampa, karena pada pengukuran tidak boleh ada udara, sehingga sukar dilakukan dan relatif tidak banyak memberikan keterangan untuk penentuan struktur.
Di atas 200 nm merupakan daerah eksitasi elektron dari orbital p, orbital d dan orbitalπ terutama sistem π terkonjugasi mudah pengukurannya dan spektrumnya memberikan banyak keterangan. Kegunaan spektrofotometerUV-Visini terletak
pada kemampuannya mengukur jumlah ikatan rangkap atau konjugasi aromatik di dalam suatu molekul. Spektrofotometer ini dapat secara umum membedakan diena terkonjugasi dari diena tidak terkonjugasi, diena terkonjugasi dari triena dan sebagainya. Letak serapan dapat dipengaruhi oleh subtituen dan terutama yang berhubungan dengan subtituen yang menimbulkan pergeseran dalam diena terkonjugasi dan senyawa karbonil (Sujdadi, 1985).
Pada spektroskopiUV-Vis, spektrum tampak (vis) terentang antara 400 nm (ungu)
sampai 750 (merah) sedangkan spektrum ultraviolet (UV) terentang antara
200-400 nm. Informasi yang diperoleh dari spektroskopi ini yaitu adanya ikatan rangkap atau ikatan terkonjugasi dan gugus kromofor yang terikat pada
auksokrom. Semua molekul dapat menyerap radiasi dalam daerahUV-Viskarena
mengandung elektron, baik sekutu maupun menyendiri, yang dapat dieksitasi ke tingkat energi yang lebih tinggi. Panjang gelombang terjadinya absorpsi
panjang gelombang yang pendek untuk eksitasinya. Hal ini berarti suatu elektron dalam orbital ikatan (bonding) dieksitasikan ke orbital antibonding. Identifikasi kualitatif senyawa organik dalam daerah ini jauh lebih terbatas daripada dalam daerah inframerah, dikarenakan pita serapan pada daerahUV-Visterlalu lebar dan
kurang terperinci. Gugus-gugus fungsional tertentu seperti karbonil, nitro, dan sistem tergabung menunjukkan puncak karakteristik dan dapat diperoleh informasi yang berguna mengenai ada tidaknya gugus tersebut dalam molekul (Day dan Underwood, 1998).
2. Analisis SpektroskopiIRSenyawa Organotimah
Energi dari kebanyakan vibrasi molekul berhubungan dengan daerah inframerah. Vibrasi molekul dapat dideteksi dan diukur dengan spektrum inframerah.
Penggunaan spektrum inframerah untuk penentuan struktur senyawa organik biasanya pada bilangan gelombang 650 - 4.000 cm-1dan panjang gelombang 15,4–2,5 µm. Daerah di bawah frekuensi 650 cm-1dinamakan inframerah jauh dan daerah di atas frekuensi 4.000 cm-1dinamakan inframerah dekat. Letak puncak serapan umumnya digunakan satuan bilangan gelombang (cm-1) dan hanya sebagian kecil menggunakan panjang gelombang (µm) (Sudjadi, 1985).
Pada spektroskopiIR, radiasi inframerah dengan rentangan panjang gelombang
terjadinya vibrasi. Bila radiasi itu diserap sebagian atau seluruhnya, radiasi itu akan diteruskan. Detektor akan menangkap radiasi yang diteruskan itu dan mengukur intensitasnya (Supriyanto, 1999).
Dari daerahIRyang luas, yang biasa dikenal dan dipakai untuk spektrofotometri
IRdengan batas bilangan gelombang (v) 4000-670 cm-1. Terdapat dua jenis
informasi yang dapat dimanfaatkan dalam spektrumIR, yaitu informasi daerah
gugus fungsi (4000-1600 cm-1) dan daerah sidik jari (1000-1500 cm-1). Pada analisis spektroskopiIRterhadap senyawa organotimah karboksilat, dapat
ditunjukkan adanya serapan vibrasi ulur Sn-O pada bilangan gelombang
500-400 cm-1dan Sn-C pada bilangan gelombang 600-500 cm-1. Selain itu dapat pula ditunjukkan beberapa karakteristik absorpsi gelombangIRdari asam
karboksilat seperti yang terdapat pada Tabel 1.
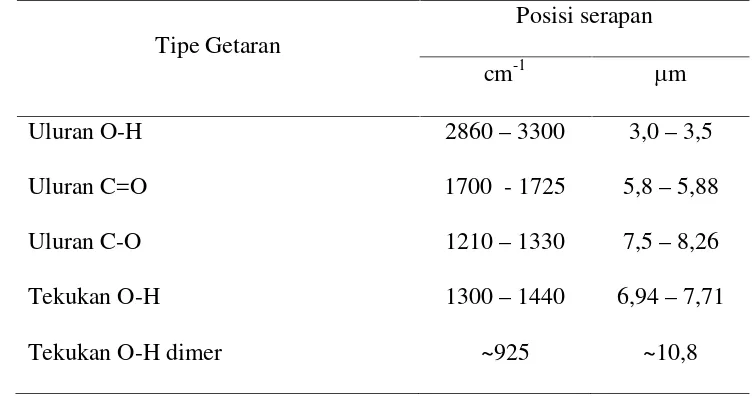
Tabel 1. Serapan karakteristikIRuntuk asam karboksilat
Tipe Getaran
Posisi serapan
cm-1 m
Uluran O-H 2860–3300 3,0–3,5
Uluran C=O 1700 - 1725 5,8–5,88
Uluran C-O 1210–1330 7,5–8,26
Tekukan O-H 1300–1440 6,94–7,71
Tekukan O-H dimer ~925 ~10,8
3. Analisis Unsur dengan MenggunakanMicroelemental analyzer
Mikroanalisis adalah penentuan kandungan unsur penyusun suatu senyawa yang dilakukan dengan menggunakanmicroelemental analyzer. Karena di Indonesia
alat ini belum umum digunakan dalam penentuan kadar unsur suatu senyawa, maka pada penelitian ini, sampel dikirim dan dianalisis diSchool of Chemical and
Food Technology, Universiti Kebangsaan Malaysia.
Unsur yang umum ditentukan adalah karbon (C), hidrogen (H), nitrogen (N), dan sulfur (S). Alat yang biasanya digunakan untuk tujuan mikroanalisis ini dikenal sebagai CHNSmicroelemental analyzer. Hasil yang diperoleh dari mikroanalisis
ini selanjutnya dibandingkan dengan perhitungan secara teori. Walaupun seringnya hasil yang diperoleh berbeda, namun analisis ini tetap sangat bermanfaat untuk mengetahui kemurnian suatu sampel (Costech Analytical Technologies, 2011).
Prinsip dasar darimicroelemental analyzer yaitu sampel dibakar pada suhu tinggi.
Produk yang dihasilkan dari pembakaran tersebut merupakan gas yang telah dimurnikan kemudian dipisahkan berdasarkan masing-masing komponen dan dianalisis dengan detektor yang sesuai. Pada dasarnya, sampel yang diketahui jenisnya, dapat diperkirakan beratnya dengan menghitung setiap berat unsur yang diperlukan untuk mencapai nilai kalibrasi terendah atau tertinggi (Caprette, 2007). Senyawa yang telah disintesisat dikatakan murni jika perbedaan hasil yang
4. Uji Pendahuluan Aktivitas Antikanker Senyawa Organotimah Terhadap Sel Leukemia L-1210
Salah satu cara uji pendahuluan dalam penentuan senyawa yang berkhasiat sebagai antikanker adalah dengan uji daya hambat terhadap pertumbuhan sel leukemia L-1210. Sel leukemia L-1210 yang menjadi target uji aktivitas antikanker ini adalah sel leukemia yang diperoleh dari sel limfosit tikus putih betina jenis DBA (Dilute Brown Non-Agouti Mouse) yang berumur 8 bulan. Sel
leukemia ini diambil dariThe Institute of Physical and Chemical Research, Japan
yang secara rutin telah digunakan untuk uji senyawa antikanker, baikin vitro
maupunin vivo(Hoshinoet al., 1966). Ekstrak kasar dari suatu bahan alam atau
aktivitas isolat (kristal) dapat diuji secara langsung dalam biakan sel leukemia L-1210. Sel tersebut dilarutkan dalam suatu larutan dan dialirkan ke dalam
haemocytometer neubauer improved. Jumlah sel yang masih hidup dihitung di
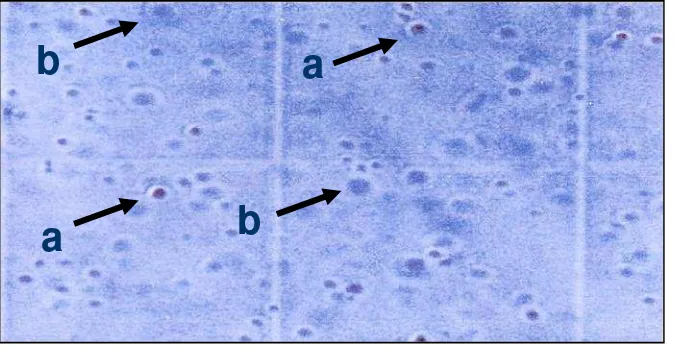
bawah mikroskop. Sel hidup terlihat sebagai bulatan bening dengan bintik biru inti sel di tengah bulatan, sedangkan sel mati terlihat sebagai bercak biru pekat yang bentuknya tidak teratur seperti pada Gambar 2.
Gambar 2.Perbandingan sel kanker hidup dan mati (a) sel hidup dan (b) sel mati.
a
b
Sebagai ukuran aktivitas sitotoksik ditentukan nilai IC50dari ekstrak kasar tesrsebut. Aktivitas isolat dikatakan aktif sebagai antikanker apabila memiliki nilai IC50 ≤ 50µg/mL (Manset al., 2000).
5. Analisis Probit
Analisis probit adalah model regresi khusus yang digunakan untuk menganalisis variabel respon binomial. Ide analisis probit pada mulanya dipublikasikan dalam majalah Science oleh Cester Ittner Bliss pada tahun 1934 yang digunakan untuk mengetahui efektivitas suatu pestisida dengan memplotkan kurva hubungan antara dosis dan respon pada berbagai konsenterasi, dan diperoleh kurva berbentuk sigmoid (Bliss, 1934). Bliss mengembangkan ide untuk mengubah kurva sigmoid tersebut ke dalam persamaan garis lurus. Pada tahun 1952 seorang profesor statistik dari Edinburgh yang bernama David Finney menggunakan ide Bliss dan menulis buku yang berjudul Analisis Probit. Sampai saat ini analisis probit masih digunakan untuk mengetahui hubungan antara dosis dan respon (Cochran and David, 1979).
G. Kanker
Kanker merupakan penyakit degeneratif yang ditandai dengan keadaan sel yang membagi secara terus-menerus (proliferasi) tanpa kontrol dan mempunyai kemampuan untuk menyebar (metastasis) ke jaringan yang berlainan secara patologi (Hawariah, 1998a).
tubuh tidak memerlukannya, sehingga akan terjadi penumpukan sel baru yang disebut tumor ganas.
Penumpukan sel tersebut mendesak dan merusak jaringan normal, sehingga mengganggu organ yang ditempatinya. Kanker dapat terjadi diberbagai jaringan dalam berbagai organ di setiap tubuh, mulai dari kaki sampai kepala. Bila kanker terjadi di bagian permukaan tubuh, akan mudah diketahui dan diobati. Namun bila terjadi di dalam tubuh, kanker itu akan sulit diketahui dan kadang - kadang tidak memiliki gejala. Kalaupun timbul gejala, biasanya sudah stadium lanjut sehingga sulit diobati (Simon, 2003).
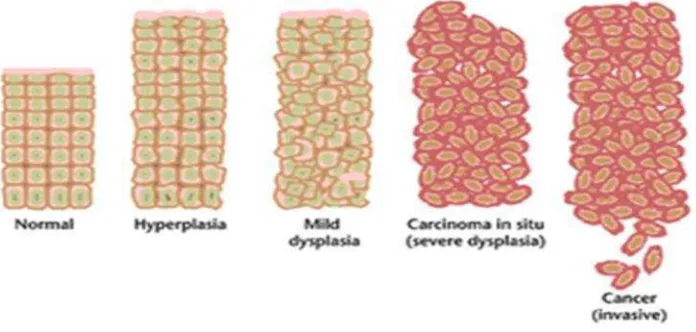
Gambar 3. Perkembangan sel normal menjadi sel kanker (Anand and Kunnumakkara, 2008).
Dalam keadaan normal, sel hanya akan membelah diri jika ada penggantian sel-sel yang telah mati dan rusak. Sebaliknya, sel kanker akan membelah terus meskipun tubuh tidak memerlukannya sehingga akan terjadi penumpukan sel baru yang disebut tumor ganas. Penumpukan sel tersebut mendesak dan merusak jaringan normal sehingga mengganggu organ yang ditempatinya (Anand and
Agens penyebab kanker dapat digolongkan ke dalam tiga kelompok besar : 1. energi radiasi
2. senyawa kimia 3. virus
Semua agens ini secara umum, bekerja dengan menimbulkan mutasi atau menyisipkan gen baru ke dalam sel (misal, oleh virus). Terdapat pula sejumlah kondisi familial yang menyebabkan kanker. Semua ini terjadi akibat mutasi pada gen spesifik. Sinar ultraviolet, sinar–x, dan sinar–γ bersifat mutagenik dan karsinogenik. Semua sinar ini merusak DNA melalui berbagai cara. Sinar–x dan sinar–γmenyebabkan terbentuknya radikal bebas di dalam jaringan. Hasilnya berupa OH*, superoksida, serta radikal lain dapat berinteraksi dengan DNA dan makromolekul lain sehingga terjadi kerusakan molekular
(Murrayet a.l, 2003).
Diperkirakan, 90-95% kanker pada manusia disebabkan oleh faktor lingkungan dan 5-10% karena faktor genetik. Faktor lingkungan yang biasanya mengarahkan kepada kematian akibat penyakit kanker adalah tembakau (25-30%), diet dan obesitas (30-35%), infeksi (15-20%), radiasi, stres, kurangnya aktivitas fisik, dan polutan lingkungan (Anand and Kunnumakkara, 2008).
hepatitis B merupakan agens etiologik utama banyak kanker hati (Murrayet al.,
2003).
Tabel 2. Beberapa jenis virus tumor penting
Kelompok Anggota
Virus DNA
Papovavirus Poliomavirus, virus SV40, virus papiloma manusia (misal, HPV-16)
Adenovirus Adenovirus 12, 18, dan 31 Herpesvirus Virus Epstein-Barr
Hepadnavirus Virus hepatitis B
Virus RNA
Retrovirus tipe C Virus leukemia dan virus sarkoma murin, virus leukemia dan sarkoma avian, virus leukemia sel T manusia tipe I dan I Retrovirus tipe B Virus tumor mammae mencit I
(Nafriadi dan Sulastia, 2007)
H. Darah
terhadap organisme dan khususnya terhadap darah sendiri. Komponen cair darah yang disebut plasma terdiri dari 91 sampai 92% air yang berperan sebagai
medium transpor, dan 8 sampai 9% zat padat. Zat padat tersebut antara lain protein-protein seperti albumin, globulin, faktor-faktor pembekuan, dan enzim. Unsur organik seperti zat nitrogen non protein (urea, asam urat, xantin, kreatinin, asam amino), lemak netral, fosfolipid, kolesterol, glukosa, dan unsur anorganik, berupa natrium, klorida, bikarbonat, kalsium, magnesium, fosfor, besi, dan iodium.
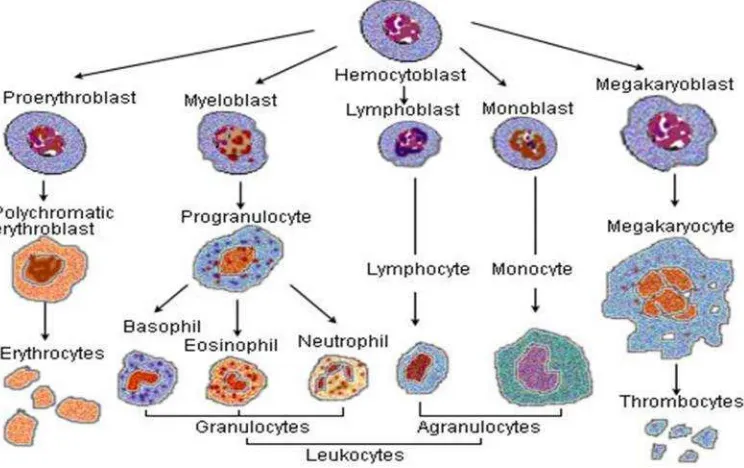
Unsur sel darah (Gambar 4) terdiri dari : 1. sel darah merah (eritrosit)
2. beberapa jenis sel darah putih (leukosit) 3. fragmen sel yang disebut trombosit
Eritrosit berfungsi sebagai transpor atau pertukaran oksigen dan karbondioksida, leukosit berfungsi untuk mengatasi infeksi, dan trombosit untuk hemostatis. Sel-sel ini mempunyai umur yang terbatas, sehingga diperlukan pembentukan optimal yang konstan untuk mempertahankan jumlah yang diperlukan untuk memenuhi kebutuhan jaringan.
1. Leukosit
Leukosit merupakan unit yang mobil/aktif dari sistem pertahanan tubuh. Leukosit ini sebagian di bentuk di sumsum tulang (granulosit dan monosit serta sedikit limfosit) dan sebagian lagi di jaringan limfe (limfosit dan sel-sel plasma). Setelah dibentuk, sel-sel ini diangkut dalam darah menuju bagian tubuh untuk digunakan. Batas normal jumlah sel darah putih berkisar dari 4000 sampai 10.000/mm3. Lima jenis sel darah putih yang sudah diidentifikasikan dalam perifer adalah neutrofil (50-75% sel darah putih total), eosinofil (1-2% ), basofil (0,5-1% ), monosit (6%) dan limfosit (25-33%).
2. Leukemia
Leukemia merupakan keganasan pada sumsum tulang. Terdapat dua jenis yang utama yaitu leukemia akut dan leukemia kronis (Davey, 2003). Leukemia terjadi ketika sel darah bersifat kanker yakni membelah tak terkontrol dan mengganggu pembelahan sel darah normal. Leukemia mula-mula dijelaskan oleh Virchow
pada tahun 1847 sebagai “darah putih”, adalah penyakit neoplastik yang ditandai
Tabel 3. Klasifikasi leukemia dari FAB (French-American-British)
Leukemia Limfoblastik Akut
L-1 Leukemia limfositik akut anak-anak; popilasi sel homogeny L-2 Leukemia limfositik akut pada dewasa; populasi sel heterogen L-3 Leukemia jenis limfoma Burkitt; sel besar, populasi sel homogeny
Leukemia Mieloblastik Akut M-0 Berdiferensiasi minimal
M-1 Diferensiasi granulositik tanpa maturasi
M-3 Diferensiasi granulositik dengan promielosit hipergranular, dihubungkan dengan koagulasi intervaskular diseminata M-4 Leukemia mielomonosit akut; garis sel monosit dan granulosit M-5a Leukemia monosit akut; berdiferensiasi buruk
M-5b Leukemia monosit akut; berdiferensiasi baik
M-6 Eritroblastosis yang menonjol dengan diseritropoiesis berat M-7 Leukemia megakariosit
A. Simpulan
Dari hasil penelitian yang telah dilakukan, diperoleh simpulan sebagai berikut :
1. Hasil sintesis senyawa dibutiltimah(IV) di-3-hidroksibenzoat, difeniltimah(IV) di-hidroksibenzoat dan trifeniltimah(IV) 3-hidroksibenzoat dengan rendemen masing-masing 96,29; 92,66 dan 81,24 % pada waktu refluks optimum 4 jam.
2. Hasil karakterisasi menggunakan spektrofotometerIRdanUVuntuk
senyawa dibutiltimah(IV) hidroksibenzoat, difeniltimah(IV) di-3-hidroksibenzoat dan trifeniltimah(IV) 3-di-3-hidroksibenzoat. Dari hasil karakterisasi terdapat pita serapan C=O pada daerah 1691,84; 1693,40; dan 1547,77 cm-1dan transisi elektr
on π-π*dan n-π*padaλmax212 dan 235, 212 dan 297, 215 dan 298 nm.
3. Berdasarkan data mikroanalisis senyawa menggunakanmicroelemental
4. Berdasarkan data IC50yang diperoleh, aktivitas antikanker senyawa trifeniltimah(IV) 3-hidroksibenzoat > trifeniltimah(IV) salisilat > trifeniltimah(IV) benzoat.
B. Saran
TERHADAP SEL LEUKEMIA L-1210
(Skripsi)
Oleh
ANI SULISTRIANI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
PENDIDIKAN FORMAL (SD s.d S1)
PENGALAMAN ORGANISASI
BEASISWA YANG PERNAH DIDAPAT
PENGALAMAN KERJA
Tahun 1996–2002 : SD Negeri 2 Margoyoso
Tahun 2002–2005 : SMP Negeri 1 Sumberejo
Tahun 2005–2008 : SMA Negeri 1 Sumberejo
Tahun 2008-Sekarang : Jurusan Kimia FMIPA, Universitas Lampung
Periode 2006-2007 : Ketua Majelis Permusyawaratan Kelas (MPK)
Periode 2007-2008 : Wakil ketua Dewan Kerja Ranting (DKR) Kec. Sumberejo Periode 2008-2009 : Anggota Muda ROIS FMIPA UNILA
Periode 2008-2009 : Kader Muda HIMAKI FMIPA UNILA
Periode 2009-2010 : Anggota Bidang Pengembangan Organisasi dan KaderisasiHIMAKI UNILA Periode 2010-2011 : Sekretaris Bidang Pengembangan Organisasi dan Kaderisasi
HIMAKI UNILA
Periode 2011-2012 : Sekretaris Departemen Sains dan Tekhnologi BEM-FMIPA Unila
Tahun 2010-2011 : Beasiswa PPA
Tahun 2011-2012 : BeasiswaPenggadaian Syari’ah
NAMA
:
Ani Sulistriani
Tempat, Tanggal Lahir : Margoyoso, 21 November 1990 Jenis Kelamin : Perempuan
Agama : Islam
Status Penikahan : Belum menikah Tinggi / Berat Badan : 155 cm/ 46 Kg Kewarganegaraan : Indonesia
Alamat Rumah : Jl. Puskesmas, Margoyoso, Sumberejo, Tanggamus, 35378
Alamat Saat Ini : Jl. Kopi No.10A Gedongmeneng, Rajabasa Bandar Lampung
No. HP : 085669722640
ASISTEN PRAKTIKUM YANG PERNAH DIJABAT
HOBI
PELATIHAN YANG PERNAH DIIKUTI
Organotimah(IV) 3-Hidroksibenzoat Terhadap Sel Leukemia L-1210
Kimia Dasar Jurusan Biologi periode 2011-2012
Kimia Dasar Jurusan Agroteknologi periode 2011-2012 Kimia Anorganik Jurusan Kimia periode 2011-2012
Membaca
Mencoba Hal Baru
Latihan Kepemimpinan Tingkat Dasar (Himaki FMIPA Unila, 2009) Pesantren Cendikiawan Muslim (ROIS FMIPA Unila, 2009)
TERHADAP SEL LEUKEMIA L-1210
Oleh
ANI SULISTRIANI
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
TERHADAP SEL LEUKEMIA L-1210
Oleh ELIANASARI
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
1. Tim Penguji
1. Ketua : Prof. Sutopo Hadi, Ph.D. ...
Penguji : Dr. Buhani, M.Si. ... Bukan Pembimbing
Penguji
Bukan Pembimbing : Drs. Wasinton Simanjuntak, Ph.D. ...
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof. Suharso, Ph.D. NIP. 196905301995121001
Penulis dilahirkan di Margoyoso kecamatan Sumberejo,
Kabupaten Tanggamus, pada tanggal 21 November 1990 sebagai anak ketiga dari empat bersaudara terlahir dari pasangan Sunarto dan Supriyani. Penulis menyelesaikan pendidikan taman kanak-kanak di TK Aisyah, Margoyoso, Tanggamus pada tahun 1996, pendidikan sekolah dasar di SD Negeri 2 Margoyoso, Tanggamus pada tahun 2002, pendidikan sekolah lanjutan tingkat pertama di SMP Negeri 1 Sumberejo pada tahun 2005 dan pendidikan sekolah menengah atas di SMA Negeri 1 Sumberejo pada tahun 2008. Pada tahun yang sama pula, penulis diterima sebagai Mahasiswi S1 Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung melalui jalur Ujian Mandiri (UM).
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum mata kuliah Kimia Dasar Jurusan Biologi, Agroteknologi, dan praktikum Kimia Anorganik I Jurusan Kimia pada tahun 2012.
Penulis juga pernah aktif di beberapa organisasi internal kampus Unila. Pada awal perkuliahan penulis tercatat sebagai Anggota Muda ROIS dan Kader Muda Himaki tahun 2008. Pada tahun 2009, penulis aktif di Himpunan Mahasiswa Kimia (Himaki) sebagai anggota bidang kaderisasi dan pengembangan organisasi.
Selama menjadi mahasiswa, penulis pernah memperoleh beasiswa PPA
Bismillahirrohmaanirrohiim. Alhamdulillahirobbil’alamin….puji syukur penulis haturkan kehadirat Allah SWT, Robb semesta alam atas segala limpahan karunia dan nikmatnya, sehingga penulis dapat menyelesaikan skripsi dengan judul
SINTESIS DAN KARAKTERISASI
SERTA UJI PENDAHULUAN AKTIVITAS ANTIKANKER BEBERAPA SENYAWA ORGANOTIMAH(IV) 3-HIDROKSIBENZOAT TERHADAP
SEL LEUKEMIA L-1210
Shalawat beriring salam selalu tercurah kepada pemimpin terbaik umat, Nabi Muhammad SAW, keluarga, sahabat dan umatnya yang senantiasa istiqomah dalam menegakkan dien Nya.
Penyelesaian skripsi ini berjalan baik berkat bantuan dan kerjasama dari semua pihak yang telah membantu penulis baik moril maupun materil, maka pada kesempatan ini penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada:
3. Bapak Drs. Wasinton Simanjuntak.,Ph.D selaku penguji II atas segala saran yang membangun kepada penulis dalam menyelesaikan skripsi ini. 4. Bapak Andi Setiawan, Ph.D., selaku Ketua Jurusan Kimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
5. Seluruh dosen Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung atas ilmu, kesabaran, pengajaran, motivasi yang telah diberikan kepada penulis.
6. Bapak Dr. Hendig Winarno, M.Sc. dan Ibu Dra. Ermin Katrin Harantung selaku pembimbing di Laboratorium Bahan Alam, Pusat Aplikasi
Teknologi Isotop dan Radiasi BATAN, Pasar Jumat, Jakarta Selatan, serta Bapak Susanto S.Si selaku staff di Laboratorium Bahan Alam, yang telah membantu dalam proses uji pendahuluan aktivitas antikanker terhadap sel leukemia L1210.
7. Orang- orang yang sangat kucintai dan kusayangi. Orang-orang yang setulus hati, memberikan curahan cinta, kasih sayang, perhatian, motivasi,
cucuran keringat dan do’a, semangat, pengorbanan yang tiada terperi,
Ayahanda dan Ibunda ku, Sunarto dan Supriyani terima kasih atas segala yang telah diberikan selama ini.
9. Sahabat sepembimbingku, Elianasari, yang telah sabar menjadi partner terbaikku selama menjalani penelitian.
10. Sahabat-sahabat kesayangan ku, Retno, Harnita, Shoffa, Mifta, Putu, Ria dan Eli atas segala kebersamaan, kekompakan, semangat, cinta, kasih sayang, nasihat, motivasi yang selama ini diberi dan rasakan bersama penulis.
11. Sahabat-sahabatku SMA Dona Ayu Amd.Keb, Benny Agustina S.Psi, Dedi Irawan C.S.T atas segala nasihat, do’a, semangat, kasih sayang, kebersamaan yang pernah diberi dan dirasakan bersama penulis.
12. Keluarga besar Himaki dan BEM FMIPA Unila,atas segala kesempatan, kepercayaan, pengalaman, pahit dan manisnya kenangan yang pernah dilalui bersama-sama dengan penulis.
13. Keluarga kecil Departemen Sains dan Teknologi BEM FMIPA, atas segala kesempatan dan kepercayaan yang pernah dilalui bersama-sama dengan penulis.
keluarga.
15. Sahabat–sahabat kimia angkatan 2004, 2005, 2006, 2009, 2010 dan 2011 atas kekeluargaan dan kebersamaannya selama menjalani pendidikan bersama penulis.
16. Keluarga kecil Pan. KWI desa Kemukus : Alan, Irke, bang Feb, Agus, Anggun, Lisa, Anike, Ilfa, Endrik, kak Mono dan uni Mifta terima kasih untuk kebersamaan dan kenangannya selama ini.
Semoga semua bantuan dan jasa yang telah diberikan kepada penulis mendapat pahala dari Allah SWT.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari sempurna, oleh karena itu saran dan kritik yang membangun sangat diharapkan dalam upaya penyempurnaan skripsi ini. Pada akhirnya, penulis berharap semoga ini dapat bermanfaat bagi penelitian dan pengembangan ilmu pengetahuan.
Bandar Lampung, 1 Agustus 2012 Penulis