PERAN EKSTRAK NUTRASETIKAL GALOHGOR UNTUK
MENGATASI RESISTENSI INSULIN PADA TIKUS
DIABETES YANG DIINDUKSI
STREPTOZOTOCIN
(STZ)
FIRDAUS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Peran Ekstrak Nutrasetikal Galohgor untuk Mengatasi Resistensi Insulin Pada Tikus Diabetes yang Diinduksi Streptozotocin (STZ) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2016
RINGKASAN
FIRDAUS. Peran Ekstrak Nutrasetikal Galohgor Untuk Mengatasi Resistensi Insulin Pada Tikus Diabetes Yang Diinduksi Streptozotocin (STZ). Dibimbing oleh RIMBAWAN, SRI ANNA MARLIYATI dan KATRIN ROOSITA.
Diabetes melitus gestasional (DMG) merupakan intoleransi glukosa pada berbagai tingkatan yang terjadi selama kehamilan. Berbagai penelitian menyebutkan prevalensi DMG meningkat tiap tahunnya. DMG pada wanita meningkatkan risiko kematian sebelum kelahiran baik pada ibu dan bayinya dan juga tingkat kesakitan pada ibu dan meningkatkan risiko berkembangnya DM tipe-2 setelah melahirkan. Nutrasetikal Galohgor telah terbukti bermanfaat bagi kesehatan masyarakat terutama dapat menginduksi produksi ASI pada ibu menyusui. Disamping itu, setidaknya 20% dari komposisi Nutrasetikal Galohgor telah terbukti memiliki potensi sebagai antidiabetes.
Penelitian ini bertujuan untuk Menganalisis potensi penghambatan enzim α -glukosidase ekstrak Nutrasetikal Galohgor dan mempelajari pengaruh intervensi Nutrasetikal Galohgor terhadap berat badan, glukosa darah, level adiponektin serum dan level glikogen hati pada tikus diabetes yang diinduksi Streptozotocin (STZ). Pada penelitian ini digunakan tikus putih strain Sprague Dawley jantan usia diatas 6 minggu dengan berat badan 180-200 g, tikus pada kelompok diabetes sebelum masa intervensi diinduksi dengan Streptozotocin dosis 40 mg/kg berat badan dan selama 4 minggu diberikan pakan standar serta sukrosa 30% b/v akuades secara ad libitum dan tikus pada kelompok kontrol normal diinduksi dengan Phosphat Buffer Saline (PBS) tanpa pemberian sukrosa. Tikus-tikus tersebut kemudian ditempatkan secara acak kedalam 7 kelompok perlakuan dan diberikan intervensi selama 14 hari menggunakan ekstrak Nutrasetikal Galohgor setara dosis 0.037 g/kg berat badan (Gal1 + STZ) dan dosis 0.37 g/kg berat badan (Gal2 + STZ), -karoten dosis 0.1 mg/kg berat badan (BCA + STZ), Quercetin dosis 15 mg/kg berat badan (QC + STZ), Metformin dosis 62.5 mg/kg berat badan (Met + STZ), dan tanpa perlakuan intervensi (kontrol + STZ dan kontrol). Kadar glukosa dan berat badan diukur tiap 3 hari sekali dan pada akhir percobaan, adiponektin diukur pada serum darah dan kadar glikogen dengan menggunakan preparat histopat hati.
Hasil penelitian ini menunjukkan Nutrasetikal Galohgor memiliki potensi penghambatan enzim α-glukosidase sebesar 1/48 kali dibanding standar (Glukobay). Nutrasetikal Galohgor dapat menurunkan glukosa darah pada tikus diabetes secara signifikan (P<0.05), meningkatkan kadar adiponektin dan kadar glikogen dibandingkan dengan kelompok kontrol diabetes. Hasil penelitian ini mengindikasikan bahwa Nutrasetikal Galohgor memiliki aktifitas antidiabetes, yang dapat menurunkan kadar glukosa darah pada tikus diabetes yang di induksi Streptozotocin (STZ).
SUMMARY
FIRDAUS. Role of Nutraceutical Galohgor Extract to Overcome Insulin Resistance at Diabetic Rat induced by Streptozotocin (STZ). Supervised by RIMBAWAN, SRI ANNA MARLIYATI and KATRIN ROOSITA.
Gestational Diabetes mellitus (GDM) is defined as glucose intolerance of various degreees that is first detected during pregnancy. Most studies report prevalence rate of GDM increased every year. Individuals with GDM have increased risk for perinatal mortality and morbidity and clearly are at increased risk for the later development of diabetes especially type-2 diabetes. Nutraceutical Galohgor has been reported to have a wide range of health benefit as Indonesian traditional medicine.
The present work was carried out to study effect of Nutraceutical Galohgor extract on potention in inhibited of α-glucosidase enzyme, reduced of blood glucose and body weight, increased adiponectin serum level and liver glycogen level in Streptozotocin induced diabetic rats. Spargue Dawley strain rat aged above 6 weeks and weight between 180-200 g were used in these study. Before intervention peroid, a number of diabetic rats groups induced with streptozotocin intraperitoneally with dosage of 40 mg/kg body weight and fed ad libitum by standar chow and 30% w/v aquades of sucrose solution during 4 weeks,and normal control group induced with phosphat buffer saline (PBS) without sucrose administration. Rats from diabetic groups were allocated randomly to 6 diabetic group and treated for 14 days with Nutraceutical Galohgor extract 0.037 g/kg
body weight (Gal1 + STZ) and 0.γ7 g/kg body weight (Galβ+ STZ); -carotene
0.1 mg/kg body weight(BCA + STZ), Quercetin 15 mg/kg (QC + STZ), Metformin 62.5 mg/kg body weight (Met + STZ) and without intervention (Control + STZ and control). Glucose level and body weight was measured every 3 days and at the end of experiment, adiponectine were measured in blood serum and glycogen with histologic specimen of liver.
Nutraceutical Galohgor had a potention on inhibiting α-glucosidase enzyme 1/48 times than Standard (Glucobay), Nutraceutical Galohgor extract (Gal1 + STZ) lowered glucose level in diabetic rats significantly (p<0.05), increasing level and liver glycogen compared to diabetic control group. Nutraceutical Galohgor extract was found to have antidiabetic activities, which might be offering protection againts insulin resistance in streptozotocin-induced diabetic rats.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Gizi Masyarakat
PERAN EKSTRAK NUTRASETIKAL GALOHGOR UNTUK
MENGATASI RESISTENSI INSULIN PADA TIKUS
DIABETES YANG DIINDUKSI
STREPTOZOTOCIN
(STZ)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul : Peran Ekstrak Nutrasetikal Galohgor untuk Mengatasi Resistensi Insulin pada Tikus Diabetes yang Diinduksi Streptozotocin (STZ) Nama : Firdaus
NRP : I151124071
Disetujui oleh Komisi Pembimbing
Dr. Rimbawan Ketua
Dr Ir Sri Anna Marliyati, MSi Anggota
Dr Katrin Roosita, SP MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Gizi Masyarakat
Prof Dr Ir Dodik Briawan, MCN
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Segala puji dan syukur dipersembahkan bagi Allah Subhanahu Wa Ta’ala atas rahmat dan karunia sehingga penulis dapat menyusun usulan penelitian
dengan judul ―Peran Ekstrak Nutrasetikal Galohgor Untuk Mengatasi Resistensi Insulin pada Tikus Diabetes yang Diinduksi Streptozotocin (STZ). Sholawat dan salam semoga selalu tercurah bagi teladan kita Nabi Muhammad Sholollahu alaihi wa salam beserta keluarga, sahabat dan kita semua. Penelitian ini merupakan bagian dari penelitian institusi IPB yang berjudul ―Pengembangan Nutrasetikal Galohgor Untuk Pencegahan Penyakit Gestational Diabetes Mellitus (GDM)‖ yang dibiayai oleh Kementerian Riset Teknologi dan Pendidikan Tinggi tahun anggaran 2014 dengan ketua tim Dr. Rimbawan.
Dalam penyusunan tesis ini, penulis mengucapkan terima kasih kepada Dr.Rimbawan sebagai ketua komisi pembimbing yang telah memberikan penulis kesempatan untuk ikut bergabung dalam penelitian Galohgor dan juga atas nasihat dan bimbingannya. Anggota komisi pembimbing, antara lain kepada Dr. Ir. Sri Anna Marliyati M.Si atas masukan, nasihat dan juga bimbingannya. Kepada Dr. Katrin Roosita SP, M.Si. atas dukungan semangat yang begitu besar dalam meneliti sehingga penulis terpacu untuk lebih banyak lagi belajar dan juga atas masukan, perbaikan penyempurnaan penulisan, nasihat dan bimbingannya.
Prof. Dr. Ir. Evy Damayanthi M.Si sebagai penguji sidang tesis atas masukan dan perbaikan penulisan. Disamping itu penghargaan penulis sampaikan kepada Prof Dr. Ir. Dodik Briawan MCN selaku ketua program studi Magister Ilmu Gizi Masyarakat atas koreksi draft tesis.
Ayahanda M. Namun (Alm) dan Ibunda tercinta Hj. Esah yang dengan penuh kesabaran telah membesarkan, merawat dan mendidik penulis. Tidak ada hal yang bisa membalas kebaikan yang begitu banyak hanya doa dan ucapan terima kasih yang akan terus penulis panjatkan sebagai bakti kecil kepada orang tua. Istri tercinta Nuraviva Mutia Rizky SE, atas segala atas dukungan, kesabaran dan motivasi yang begitu besar kepada penulis. Kakak-kakak-Ku H. Murtani A.Md.Kep, Nadih Pinardi A.Md.Kep, Doelgani A.Md.Kep, Siti Maemunah A.Md.Keb, Pidana A.Md.Kep, Ners Moerdiyono S.kep, dan adik Mardiyana Febriyanti A. Md. A.K atas doa dan dukungannya.
drh. Mawar Subangkit Msi dan Pak Mashudi atas bantuan, masukan dan kritik yang sangat berguna dalam pelaksanaan teknis penelitian. Serta teknisi pada laboratorium Pusat Studi Biofarmaka IPB, Laboratorium pilot plan SEAFAST Center IPB, Laboratorium Pusat Studi Satwa Primata LPPM IPB, dan Laboratorium Patofisiologi FKH IPB yang telah banyak sekali membantu analisis selama penelitian. Sekretariat Pascasarjana Gizi Masyarakat terutama Mba Nurul Qodariah dan Mba Nunung Cipta Diani Sp, Msi atas bantuannya dalam hal administrasi selama penulis menjalani perkuliahan. Serta Teman-teman pascasarjana Gizi terutama angkatan genap 2012/2013 atas doa, dukungan dan bantuannya.
Semoga penelitian ini bermanfaat bagi perbaikan tingkat kesehatan masyarakat di masa mendatang.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Hipotesis Penelitian 3
Manfaat Penelitian 4
2 TINJAUAN PUSTAKA 5
Nutrasetikal Galohgor 5
Diabetes Melitus 11
Resistensi Insulin 18
Jaringan Adiposa, Adipokin dan Adiponektin 20
3 KERANGKA PEMIKIRAN 23
4 METODE 26
Desain, waktu dan tempat 26
Tahapan Penelitian 27
Analisis data 30
Pertimbangan Etik 30
5 HASIL DAN PEMBAHASAN 31
Aktivitas inhibisi enzim α-glukosidase 31
Persiapan Percobaan Hewan 34
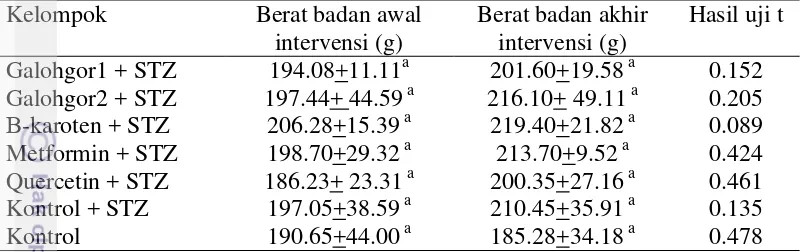
Pengaruh intervensi ekstrak Nutrasetikal Galohgor terhadap perubahan
berat badan tikus 38
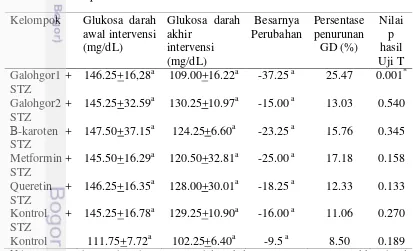
Pengaruh intervensi Nutrasetikal Galohgor terhadap perubahan glukosa
darah tikus 39
Pengaruh intervensi Nutrasetikal Galohgor terhadap kadar adiponektin
tikus 41
Pengaruh intervensi Nutrasetikal Galohgor terhadap gambaran kadar
glikogen hati tikus 42
Hubungan antara berat badan, glukosa darah, adiponektin dan glikogen
hati 45
6 SIMPULAN DAN SARAN 49
Simpulan 49
Saran 49
DAFTAR PUSTAKA 50
LAMPIRAN 68
DAFTAR TABEL
1. Kandungan gizi dan mineral makro dan ransum standar tikus
berdasarkan HarlanTM 28
2. Aktivitas inhibitor α-glukosidase Standar dan Nutrasetikal Galohgor 32
3. Berat badan dan glukosa darah tikus selama masa induksi diabetes pada kelompok diabetes dengan pemberian larutan sukrosa selama 4
minggu 37
4. Perubahan berat badan tikus semua kelompok perlakuan pada awal
dan akhir intervensi 39
5. Perubahan kadar glukosa darah tikus kelompok perlakuan dan kelompok kontrol pada awal dan akhir intervensi 40
6. Kadar adiponektin serum tikus kelompok perlakuan dan kelompok
kontrol pada akhir intervensi 41
7. Kadar glikogen hati tikus kelompok perlakuan dan kelompok kontrol
pada akhir intervensi 44
DAFTAR GAMBAR
1. Perkembangan sel- selama periode DM tipe-1 (Winter et al. 2002). 12 2. Fase perkembangan DM tipe-2. Fase kerentanan (Susceptibility),
Fase adaptasi (Adaptation), Fase kegagalan (Failure) (Alejandro et
al. 2014). 14
3. Sekresi dan aksi insulin (IDF 2013) 19
4. Struktur primer adiponektin (Ahima 2006) 21
5. Kerangka pemikiran penelitian Nutrasetikal Galohgor terhadap
DMG 25
6. Tahapan penelitian 27
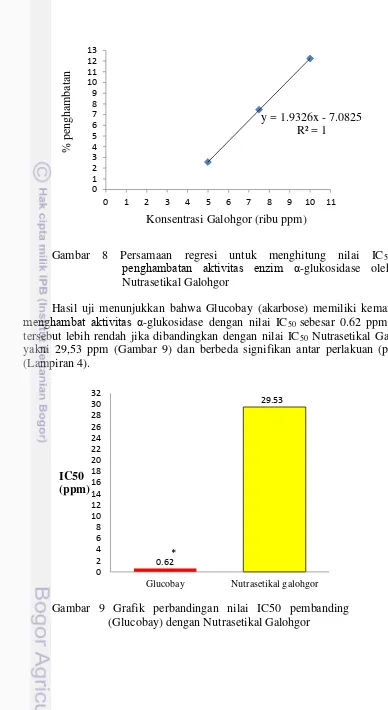
7. Persamaan regresi untuk menghitung nilai IC50 penghambatan
aktivitas enzim α-glukosidase oleh standar (glucobay) 32
8. Persamaan regresi untuk menghitung nilai IC50 penghambatan
aktivitas enzim α-glukosidase oleh Nutrasetikal Galohgor 33
9. Grafik perbandingan nilai IC50 pembanding (Glucobay) dengan
Nutrasetikal Galohgor 33
10.Masa adaptasi tikus pada rak dan kandang kelompok 35 11.Proses induksi diabetes dengan injeksi Streptozotocin secara intra-
peritonel 37
12.Gambaran histologi hati tikus dengan pewarnaan PAS pada semua
DAFTAR LAMPIRAN
1. Penelitian Nutrasetikal Galohgor yang pernah dilakukan 69 2. Bahan simplisia Galohgor dengan aktivitas antidiabetes (ditandai
dengan warna merah) (Roosita 2014) 76
3. Pembuatan larutan intervensi 77
4. Hasil uji T IC50 antara standar dengan galohgor 81 5. Hasil uji T berat badan awal induksi (BB0) dan setelah 4 minggu
induksi diabetes dengan sukrosa 30% (BB4) 82
6. Hasil uji T berat badan awal (N0) dan setelah 4 minggu masa induksi
kelompok kontrol (N4) 82
7. Hasil uji T glukosa darah awal induksi(GD0) dan setelah 4 minggu
induksi diabetes dengan sukrosa 30% (GD4) 83
8. Hasil uji T glukosa darah awal (GDN0) dan setelah 4 minggu masa
induksi kelompok kontrol (GDN4) 83
9. Hasil uji T berpasangan kadar glukosa darah kelompok diabetes dan
kontrol 84
1
PENDAHULUAN
Latar Belakang
Penyakit diabetes merupakan penyakit degeneratif yang menjadi ancaman global. Data International Diabetes Foundation (IDF) tahun 2013, menunjukkan bahwa diabetes melitus diderita oleh sebanyak 382 juta orang di seluruh dunia, menyebabkan 5.1 juta kematian serta memerlukan biaya perawatan kesehatan sekitar 548 milyar dolar Amerika Serikat. Angka prevalensi diabetes melitus di Asia Tenggara mencapai 8.7%, yang lebih tinggi dibanding angka prevalensi global sebesar 8.3%, selain itu diabetes juga merupakan penyebab 1 dari 4 kematian (IDF 2013).
Indonesia menduduki peringkat ke-7 untuk jumlah penderita diabetes (diabetesi) yakni sekitar 8.6 juta jiwa dan yang tidak terdiagnosa sekitar 4.6 juta jiwa (IDF, 2013). WHO memprediksi akan ada sekitar 21.3 juta orang di Indonesia dengan diabetes pada tahun 2030 jika pola penatalaksanaan diabetes tidak dikembangkan (AFES 2013).
Hasil Riset Kesehatan Dasar (RISKESDAS) tahun 2013 menunjukkan proporsi penduduk diatas 15 tahun dengan diabetes melitus sebesar 6.9%, angka ini meningkat jika dibandingkan Riset sebelumnya (RISKESDAS 2007) yaitu sebesar 5.7% (Balitbangkes 2007, Balitbangkes 2013). Provinsi dengan prevalensi tertinggi terdiagnosa diabetes beserta gejalanya yakni Sulawesi Tengah, Sulawesi Utara, Sulawesi Selatan dan Nusa Tenggara Timur (Balitbangkes 2013).
Diabetes diklasifikasikan menjadi diabetes tipe 1, diabetes tipe 2 dan diabetes melitus gestasional (DMG). DMG didefinisikan sebagai suatu gangguan toleransi glukosa yang timbul atau pertama kali dideteksi pada saat kehamilan. Kondisi ini terjadi pada 3-7% perempuan hamil (Zhang et al. 2010). DMG merupakan salah satu faktor risiko terjadinya komplikasi pada janin dan berkaitan dengan timbulnya diabetes melitus tipe 2 di masa yang akan datang bagi perempuan yang pernah didiagnosis DMG (Adam 2000), disamping faktor hipertensi, umur, gaya hidup, etnik, ras dan budaya (Lowdermilk, Perry and Bobak 1999; Sutanegara et al. 2000).
Seseorang yang didiagnosa DMG kemungkinan besar akan berlanjut menjadi hiperglikemia setelah melahirkan dan dapat berkembang menjadi diabetes tipe 2 (Kim et al. 2010; ADA 2013). Diabetes melitus pada kehamilan memiliki dampak yang serius baik pada ibu dan anak yang dilahirkannya jika tidak ditangani dengan baik (Purnamasari et al. 2013). Perempuan yang menderita diabetes melitus gestasional mengalami komplikasi yang terjadi pada janin terkait dengan diabetes gestasional meliputi makrosomia, prematur, Gangguan pertumbuhan janin / Intra uterine growth retardation (IUGR), kematian janin dan bayi baru lahir, malformasi kongenital, Sindrom gangguan pernapasan akut / acute respiratory distress syndrome (ARDS), bayi baru lahir (30-60 menit pertama setelah lahir) terjadi hipoglikemia, hipokalemi, hiperbilirubin, polisitemia, hipomagnesium (Wong et al. 2002).
Kondisi fisiologis seperti kehamilan dapat memunculkan gejala diabetes. Kehamilan dapat dianggap sebagai uji stres metabolik dan mampu mengungkap
2
sel- dan kadarnya meningkat selama kehamilan, berkontribusi pada resistensi insulin selama kehamilan (Zhang et al. 2010). DMG mencerminkan rendahnya tingkat proliferasi sel- pulau Langerhans dalam merespon peningkatan kebutuhan insulin selama masa kehamilan (Hellerstrom et al, 1985; Pasek dan Gannon, 2013).
Prevalensi DMG dunia telah meningkat dalam kurun waktu 20 tahun terakhir, bervariasi antar ras dan grup etnik (Ferrara 2007), dan berbeda antar kelompok ras dan budaya yang berbeda di negara yang sama (Bellamy et al. 2009). Peningkatan DMG di Amerika dari 8.1% (2007-2008) menjadi 8.5% (2009-2010) dan terus meningkat menjadi 9.2% pada tahun 2010 (Desisto et al. 2014).
Prevalensi DMG di Negara-negara Asia, juga terdapat peningkatan, di Tianjin, China DMG meningkat dari 2.4% (2002) menjadi 6.8% (2008), di Hong Kong dari 7.4% (1986) menjadi 10.4% (1998-2001), di Bangkok Thailand dari 2.0% (1987-1989) menjadi 3.0% (2001-2002),dan prevalensi di India bervariasi tergantung lokasi dan kriteria diagnosa DM dengan prevalensi tertinggi pada wilayah urban Chennai dari 17.7% (2001) dan 17.8% (2005-2007) (Hirst et al. 2012).
DMG tidak jarang ditemukan di Indonesia. Dengan menggunakan kriteria
diagnosis O’Sullivan-Mahan (3 jam OGTT 100g glukosa) dilaporkan bahwa prevalensi diabetes melitus gestasional adalah sebesar 1.9 – 3.6 % pada kehamilan umum (PERKENI 2006 dalam Purnamasari et al. 2013). Pada ibu hamil dengan riwayat keluarga menderita diabetes melitus, prevalensinya lebih tinggi mencapai 5.1%. Salah satu studi prospektif di Makassar yang dilakukan terhadap 46 wanita dengan DMG, menyatakan insiden terjadinya DM tipe-2 dan gangguan toleransi glukosa (impaired glucose tolerance/IGT) 6 tahun setelah melahirkan sebesar 56.6% (PERKENI 1997 dalam Purnamasari 2013). Meskipun masalah DMG di Indonesia nampak semakin serius, namun demikian belum terdapat data prevalensi DMG dengan pencatatan yang mewakili secara nasional di Indonesia.
Berbagai penelitian telah banyak mengaitkan peran adiponektin dengan diabetes. Adiponektin secara langsung mempengaruhi sensitifitas tubuh terhadap insulin (Kadowaki et al. 2006; Antuna-Fuente et al. 2007) dan juga menekan proses glukoneogensis di hati (Kadowaki et al. 2006). Adiponektin juga berpengaruh terhadap sekresi insulin (Gomez-Ambrossi et al, 2009). Insulin berperan menstimulasi sintesis glikogen melalui peningkatan glikogenesis di hati (Levinthal dan Tavill 1999). Peningkatan glikogen hati berpengaruh terhadap penurunan glukosa darah pada orang diabetes dengan cara menghambat enzim yang mendukung glikogenolisis yakni glucose-6-phosphatase dan phosphorylase (Shrayyef dan Gerich 2010).
Pemanfaatan sumberdaya hayati dalam membantu menyelesaikan permasalahan terutama terkait dengan kesehatan sangat perlu mendapatkan dukungan. Dengan pendekatan ilmu pengetahuan diharapkan penggunaan dan penerapan kearifan lokal menjadi maksimal guna kepentingan masyarakat yang lebih luas. Galohgor merupakan Nutrasetikal tradisional masyarakat suku Sunda yang telah digunakan secara turun-temurun dan terbukti berkhasiat untuk meningkatkan produksi ASI dan kesehatan (Roosita et al, 2003).
3 uji toksisitas, teknik ekstraksi, uji khasiat dan mekanisme efek dengan metode in-vivo dan in-vitro. Nutrasetikal Galohgor mengandung berbagai zat gizi dan senyawa bioaktif (Pajar, 2001).
Nutrasetikal Galohgor berdasarkan studi literatur mengandung setidaknya 20% bahan yang telah terbukti baik secara empiris maupun ilmiah berkhasiat antidiabetik. Sebagian dari bahan tersebut memiliki potensi penghambatan enzim
α-glukosidase yang cukup baik. Penelitian yang membuktikan pengaruh Nutrasetikal Galohgor terhadap diabetes terutama DMG belum pernah ada, sehingga penggunaan hewan dengan pendekatan preklinis sebagai langkah awal dalam mempelajari patofisiologi dan aspek klinis DMG perlu untuk dilakukan. Selama bertahun-tahun, beberapa hewan coba telah digunakan untuk mempelajari diabetes (Srinivasan dan Ramaro 2007), salah satu hewan sebagai model DMG yang paling banyak digunakan yakni tikus (Hellerstrom et al. 1985; Chatzigeorgiou et al. 2009; King 2012). Model tikus betina jika dibandingkan dengan tikus jantan memiliki perubahan hormonal yang tidak stabil yang sangat dipengaruhi oleh level hormon ovarium sehingga dikhawatirkan akan menyebabkan bias pada penelitian (Flaisher-Grinberg et al. 2009). Tikus betina juga kurang memberikan respon terhadap Streptozotocin (Etuk 2010). Oleh sebab itu dalam penelitian ini digunakan tikus jantan sebagai model DMG untuk mempelajari pengaruh Nutrasetikal galohgor terhadap resistensi insulin pada tikus diabetes yang diinduksi Streptozotocin (STZ).
Tujuan Penelitian
Tujuan Umum
Penelitian ini bertujuan untuk menganalisis pengaruh ekstrak Nutrasetikal Galohgor terhadap resistensi insulin pada tikus diabetes yang diinduksi Streptozotocin (STZ).
Tujuan Khusus
1. Menganalisis potensi penghambatan enzim α-glukosidase ekstrak Nutrasetikal Galohgor.
2. Menganalisis pengaruh ekstrak Nutrasetikal Galohgor terhadap berat badan, kadar glukosa darah, serum adiponektin dan glikogen hati pada tikus diabetes yang diinduksi Streptozotocin (STZ).
Hipotesis Penelitian
H1 : Ekstrak Nutrasetikal Galohgor memiliki potensi inhibisi yang baik terhadap enzim α-glukosidase.
H1 : Ekstrak Nutrasetikal Galohgor mampu menurunkan berat badan tikus diabetes yang diinduksi Streptozotocin.
H1 : Ekstrak Nutrasetikal Galohgor mampu menurunkan kadar glukosa darah tikus diabetes yang diinduksi Streptozotocin.
4
Manfaat Penelitian
5
2
TINJAUAN PUSTAKA
Nutrasetikal Galohgor
Selama beberapa dekade, tanaman obat telah digunakan secara global dan popularitasnya semakin meningkat. Obat tradisional dalam hal ini jamu sebagai nutrasetikal saat ini tidak hanya digunakan untuk perawatan kesehatan bagi orang miskin di negara berkembang, akan tetapi juga telah digunakan oleh berbagai negara yang menjadikan obat konvensional sebagai sistem pengobatan utama di negara tersebut (WHO 2000). Konsep nutrasetikal telah dimulai dari survey yang dilakukan di Inggris, Jerman dan Perancis yang menyimpulkan bahwa sebagian besar orang memilih metode diet untuk mencapai tingkat kesehatan yang lebih baik jika dibandingkan dengan metode aktivitas fisik dan faktor keturunan (Pandey et al 2010). Nutrasetikal merupakan berbagai substansi baik itu makanan maupun bagian dari makanan dan bahan lain yang memberikan keuntungan secara medis dan kesehatan termasuk pencegahan dan pengobatan terhadap penyakit (Chaturvedi et al 2011). Nutrasetikal merupakan istilah yang menggambarkan substansi yang oleh masyarakat tidak hanya dikenal mengandung zat gizi akan tetapi juga memiliki efek fisiologi yang menguntungkan bagi tubuh. Menurut Uni Eropa, secara umum nutrasetikal dibuat dari bahan-bahan yang efeknya dapat diterima bagi kesehatan tubuh (Mishra 2012). Risiko keracunan dan efek yang membahayakan dari obat semakin meningkatkan kesadaran masyarakat akan keamanan mengkonsumsi nutrasetikal sebagai pendekatan bagi manajemen kesehatan (Pandey et al 2010).
Nutrasetikal dapat dikelompokkan menjadi nutrasetikal potensial dan nutrasetikal yang telah ada (establish). Nutrasetikal potensial memberikan peluang keuntungan di bidang medis dan kesehatan sampai dapat dibuktikan pengaruhnya pada perbaikan keadaan penyakit tertentu (DeFelice 1994). Sebagian besar produk nutrasetikal berada pada kategori potensial, oleh karenanya diperlukan data klinis untuk membuktikan adanya manfaat bagi perbaikan kesehatan tersebut. Di negara berkembang terutama di masyarakat pedesaan, berbagai macam tanaman obat telah digunakan secara luas. Penelitian mengenai tanaman obat sebagai nutrasetikal potensial telah dilakukan dibanyak negara berkembang, dengan fokus terutama pada efek pengobatan (WHO 2000).
Galohgor merupakan salah satu jamu tradisional di daerah Jawa Barat, terutama ditemukan di desa Sukajadi kecamatan Tamansari, Kabupaten Bogor. Terbuat dari 56 jenis tanaman obat, yang terdiri dari berbagai daun-daunan, kacang-kacangan, rempah-rempah dan temu-temuan (Roosita 2003). Galohgor telah dikonsumsi oleh masyarakat setempat secara turun-temurun dan secara empiris telah terbukti berkhasiat meningkatkan volume ASI ibu menyusui (Roosita 2014), mempercepat penyembuhan rahim dan menguatkan tubuh atau meningkatkan stamina ibu (Roosita et al. 2008).
6
Bahan-bahan Antidiabetik pada Nutrasetikal Galohgor
Beberapa bahan dalam komposisi Nutrasetikal Galohgor yang secara ilmiah telah dibuktikan memiliki potensi antidibetik antara lain : Brotowali/Tinospora cripsa Mires (daun), Bawang Merah//Allium cepa Linn (umbi), Kedelai/Glicine max (biji), Kunyit/Curcuma longa (rimpang), Jahe/Zingiber officinale Rosc (rimpang), Kencur/Kaemferia galanga L (rimpang), Temulawak/Curcuma xanthorrhisa Roxb (rimpang), Kumis Kucing/Orthosiphon aristatus (daun), Suruhan/Peperomia pellucida L (daun), Alpukat/Persea americana Miler (daun), dan Jambu Batu/Psidium cujavilus (daun).
Brotowali (Tinospora cripsa Mires)
Brotowali atau dalam bahasa Sunda dikenal dengan Antawali memiliki beberapa komponen aktif yang memiliki efek baik bagi kesehatan. Brotowali mengandung columbine yang merupakan glukosida alami (Mohammed et al. 2012), tanaman ini juga mengandung vanillin, syringin, alkaloid N-formylnornuciferin, dan diterpene yang merupakan turunan dari Borapetosides B dan C (Cavin 1998). Komponen aktif Borapetoside C dari ekstrak Brotowali terbukti meningkatkan penggunaan glukosa dan menghambat perkembangan resistensi insulin dan meningkatkan sensitifitas insulin pada mencit (Ruan et al. 2012).
Brotowali dalam bentuk ekstrak dosis 50 mg/kg berat badan yang diberikan selama 2 minggu dapat meningkatkan insulin plasma dan meningkatkan toleransi glukosa tikus diabetes, pemberian Brotowali juga menunjukkan peningkatan sekresi insulin pada studi in vitro islet pulau Langerhans tikus dan manusia (Noor et al. 1989b), Efek anti-hiperglikemik pada Brotowali tidak hanya mempengaruhi penyerapan glukosa pada usus halus dan penyerapan glukosa kedalam sel periper, akan tetapi juga pada stimulasi pelepasan insulin melalui modulasi kompleks
konsentrasi sel dan ion Ca2+
pada voltage ion channels sehingga insulin dapat dengan mudah melewati ion channels (Noor dan Ashcroft 1998).
Bawang Merah (Allium cepa Linn)
7 glukosa darah secara signifikan dan meningkatkan insulin serum pada tikus diabetes (El-Soud dan Khalil 2010).
Kacang Dadap (Vigna sinensis)
Kacang dadap mengandung berbagai bahan aktif yang sangat baik untuk kesehatan. Identifikasi kandungan flavonoid kacang dadap dengan menggunanakn High-Performance Liquid Chromatography-Electrospray Mass Spectrometry menunjukkan kacang dadap mengandung gugus antosianin (malvidin 3-O-acetylglucoside dan peonidin 3-Omalonylglucoside) serta 3 gugus glikosida flavonol (myricetin-3-O-glucoside, quercetin 7-O-glucoside, and quercetin-3-O-diglucoside) (Chang dan Wong 2004). Kacang dadap yang masih mentah dapat digunaan untuk menurunkan glukosa darah (Ahmad et al. 2009). Ekstrak etanol kacang dadap mampu menurunkan kadar glukosa, total kolesterol, HDL & LDL kolesterol, trigliserida, & MDA serum tikus diabetes hiperkolesterolemia (Affandi 2006).
Kedelai (Glicine max)
Kedelai mengandung komponen fungsional antara lain Isoflavone, Phenolics, Soyasapogenols, dan Tocopherols (Kim et al. 2012). Isoflavon pada kedelai terbagi menjadi 12 isoform yang dibagi menjadi 4 bentuk berbeda yakni Aglycone (daidzein, genistein dan glycitein), Glucoside (daidzin, genistin dan glycitin), Acetylglucoside (Acetyldaidzin, Acetylgenistin dan Acetylglycitin), dan Malonylglucoside (Malonyldaidzin, Malonylgenistin dan Malonylglycitin) (Wang et al. 2013). Kandungan Isoflavon inilah yang menjadikan Kedelai memiliki kemampuan antidiabetik dan antioksidan yang sangat baik (Khusk et al. 2010).
Pemberian ekstrak kedelai kaya isoflavon sebanyak 100 mg/kg selama 6 minggu secara signifikan meningkatkan fleksibilitas metabolisme dengan penggunaan dan toleransi glukosa yang lebih baik pada tikus diabetes (Bhattamisra et al. 2013). Komponen Genistein pada isoflavon menunjukkan efek antidiabetes pada kultur sel hewan, pemberian Genistein pada konsentrasi
fisiologis (>10 μM) memberikan efek langsung terhadap proliferasi sel pankreas
(Gilbert dan Liu 2013).
Kunyit (Curcuma domestica Val)
8
asam lemak dan glukosa pada jaringan otot tikus diabetes (Na et al. 2009). Selain memiliki sifat antidiabetik, ulasan sistematis yang dilakukan oleh Zhang et al. (2013) menyebutkan bahwa Kunyit juga dapat menekan perkembangan komplikasi penyakit penyerta diabetes melitus seperti kerusakan hati dan jantung terkait diabetes, Neuropathy diabetik, Nephropathy diabetik, dan memperbaiki metablisme penderita.
Temulawak (Curcuma xanthorrhisa Roxb)
Tanaman ini merupakan tanaman asli Indonesia, yang secara lokal dikenal juga dengan nama Koneng Gede (sunda). Mengandung 1-2% curcuminoid yang terdiri dari curcumin, monodemethoxycurcumin dan bisdesmethoxycurcumin (Ruslay et al. 2007). Kandungan minyak volatil 3-12% dengan komposisi Sesquiterpenes, Xanthorrizol dan sedikit kandungan Champor (Jerikasem et al. 2005). Kandungan Xanthorrizol inilah yang membedakan antara Temulawak dan Kunyit. Temulawak mengandung berbagai senyawa flavonoid yang memiliki aktivitas antioksidan sangat baik seperti Catechin, Epicatechin, Quercetin, Myricetin, Kaemferol, Apigenin, Luteolin, dan Naringenin (Mustafa 2010).
Terdapat sedikit sekali temuan ilmiah tentang hubungan komponen aktif temulawak terhadap diabetes, akan tetapi kesamaan komposisi berbagai bahan dengan yang terdapat pada Kunyit menjadikan temulawak juga memiliki potensi sebagai antidiabetes. Salah satunya Kim et al. (2014) menyebutkan bahwa pemberian Xanthorizol dosis 10 atau 25 mg/kg/hari dan ekstrak xanthoriza dosis 50 atau 100 mg/kg/hari secara signifikan menurunkan glukosa darah puasa dan glukosa darah postprandial, menurunkan akumulasi lemak hati, menghambat produksi sitokin pro-inflamasi seperti TNF-α, IL-6, dan CRP pada jaringan adiposa, hati, dan pada jaringan otot mencit obes dengan diet tinggi lemak.
Jahe (Zingiber officinale Rosc)
Jahe memiliki potensi sebagai obat, berbagai kandungan zat aktif pada Jahe kemungkinan memberikan efek yang beragam terhadap jalur metabolisme dan terlibat pada berbagai mekanisme yang mempengaruhi berbagai aspek pada kelainan metabolik kronis seperti diabetes (Roufogalis 2014). Jahe mentah mengandung lemak atau Glycolipid hingga 9% dan Oleoresin sekitar 5-8%, kandungan bahan aromatik Oleiresin sebesar 25% dengan Gingerol utama yakni [6]-Gingerol, Gingerol lain termasuk Methylgingerol dan Gingerdiol, Dehydrogingerdione, [10]-Dehydrogingerdione, Gingerdiones, Diarylheptanoids (setara dengan curcuminoids contohnya Hexahydrocurcumin), Diterpenlactones dan Galanolactone (Chrubasic 2005).
9 peradangan (Mahluji et al. 2013). Selain sebagai anti peradangan, konsumsi 3 gram tepung jahe kering selama 30 hari dapat menurunkan glukosa darah, trigliserida, total kolesterol, LDL dan VLDL kolesterol pasien diabetes (Andallu et al. 2001). Pada hewan coba, pemberian 500 mg/kg berat badan jahe dengan ekstraksi air selama 6 minggu dapat menurunkan level serum glukosa tikus diabetes (Jafri et al. 2010), dan pemberian ekstrak alkohol jahe dengan dosis 800 mg/kg berat badan dapat menurunkan level glukosa darah puasa tikus diabetes secara signifikan setelah 1 jam perlakuan (Ojewole 2006).
Kencur (Kaemferia galanga L)
Kencur merupakan salah satu bahan herbal dalam kelas jahe-jahean (Zingiberaceae) yang termasuk kategori belum termanfaatkan dengan baik meskipun begitu banyak khasiat pengobatan yang dimilikinya. Kandungan bahan aktif pada bagian rimpang kencur antara lain Cineol, Borneol, 3-Carene, Camphene, Kaempferal, Cinnamaldehyde, asam p-methoxycinnamic dan Ethyl cinnamate, sedangkan kandungan bahan aktif pada minyak volatile kencur antara lain Ethyl-p-methoxycinnamate, Ethylcinnamate, Carvone, Eucalyptol dan Pentadecane (Tewtrakul et al. 2004).
Ekstrak kencur yang mengandung dua turunan asam cinnamic antara lain Ethyl p-methoxy cinnamate dan asam 4-Methoxy Cinnamic terbukti memiliki aktivitas antihiperglikemia pada mencit, dan ini merupakan satu-satunya penelitian yang membuktikan efek kencur terhadap diabetes. Pemberian 200 mg/kg berat badan ekstrak dengan uji toleransi glukosa mampu menghambat peningkatan level glukosa darah setelah 30 menit lebih baik 133% jika dibandingkan dengan Glibenclamide sebagai standar (Chowdhury et al. 2014). Kumis Kucing (Orthosiphon aristatus)
Nutrasetikal Galohgor juga memiliki komposisi Kumis Kucing. Tanaman ini selain digunakan untuk mengobati rematik, demam, hepatitis, batu empedu, dan hipertensi, juga mengandung berbagai komponen senyawa aktif flavonoid yang cukup tinggi seperti Eupatorin, Sinensetin, Rosmarinic acid, dan Quercetin yang sangat menjanjikan sebagai antidiabetes (Adnyana et al. 2013; Almatar 2014; Indariani et al. 2014). Pada hewan coba, pemberian 0.5 g/kg berat badan ekstrak kumis kucing terbukti mampu menurunkan konsentrasi glukosa plasma darah tikus diabetes (Sriplang et al. 2007), dan pemberian dosis yang lebih tinggi (1 g/kg berat badan) memberikan efek hipoglikemik pada tikus normal serta menghambat efek hiperglikemia yang dialami oleh tikus diabetes (Mariam et al. 1996). Pemberian ekstrak Kumis Kucing dengan sub-fraksi kloroform pada konsentrasi 2 mg/mL secara signifikan meningkatkan penyerapan glukosa pada otot diafragma dan menurunkan penyerapan glukosa pada usus halus tikus diabetes, mekanisme ini sama seperti efek metformin (Mohamed et al. 2013). Suruhan (Peperomia pellucida L)
10
dan antioksidan, juga bersifat anti peradangan dan analgesik (Aziba et al. 2001; Blank et al. 2004; Wei et al. 2011; Sheikh 2013).
Suruhan kaya akan protein kasar, karbohidrat, serat dan kandungan mineral (Ooi et al. 2012). Mineral yang terdapat pada daun Suruhan antara lain Ca, K, Mg, Na, dan Fe (Mensah et al. 2013). Kandungan Mg pada daun Suruhan cukup tinggi, Magnesium bertanggung jawab terhadap penyerapan glukosa ke dalam sel sehingga dapat menurunkan kadar glukosa darah pada orang dengan diabetes (Dean 2011). Pemberian 10% dan 20% bobot/bobot Suruhan dengan pakan selama 28 hari dapat menurunkan kadar glukosa darah tikus diabetes (Hamzah et al. 2012), penurunan kadar glukosa darah secara signifikan juga terjadi pada tikus hiperglikemik yang diberi perlakuan 40 mg/kg berat badan ekstrak Suruhan (Salma et al. 2013). Pemberian 300 mg/kg ekstrak ethyl acetate Suruhan hanya dalam tujuh hari juga dapat menurunkan glukosa darah secara signifikan pada mencit diabetes (Sheikh 2013), dengan ekstraksi yang sama pada tikus diabetes dosis 150 mg/kg berat badan secara per-oral pada hari kesembilan mengakibatkan penurunan aktivitas antidiabetes sebesar 53.44% dan tidak berbeda nyata dengan kontrol positif (Kusumawarni et al. 2012). Melalui pendekatan teknologi molecular docking disimpulkan bahwa Suruhan memiliki potensi aktivitas antidiabetik yang cukup baik (Akhilas et al. 2012).
Alpukat (Persea americana Miler)
Alpukat merupakan tanaman yang berasal dari Meksiko, Amerika Tengah dan juga biasa ditemukan dinegara-negara tropis (Lima et al. 2012). Alpukat mengandung berbagai senyawa aktif seperti Flavonoid, Alkaloid, Tannin, Saponin, dan Triterpenoid, Isoharmnetin, Luteolin, Rutin, Quercetin, dan Apigenin (Antia 2005; Lima et al. 2012; Wientarsih 2012). Komponen aktif dari ekstrak daun alpukat ini memiliki aktivitas antioskidan yang sangat baik yang dapat mencegah stres oksidatif yang sangat terkait dengan perkembangan berbagai penyakit. Bagian daun tanaman ini oleh masyarakat Amerika Latin dan Afrika digunakan untuk obat hipertensi, sakit kuning / Jaundice (Lans 2006), sakit ginjal, diare (Agra et al. 2007) dan di Indonesia banyak digunakan untuk mengatasi masalah pembentukan batu pada saluran urin/Urolithiasis (Wientarsih et al. 2012),
Alpukat juga berpotensi sebagai antidiabetes (Marrero-Faz et al. 2014). Pemberian ekstrak hidroalkohol daun Alpukat dosis 0.15 dan 0.3 g/kg berat badan mampu menurunkan level glukosa darah dan memperbaiki metabolisme tikus diabetes (Lima et al. 2012). Pemberian ekstrak air daun Alpukat dengan dosis 100-200 mg/kg berat badan secara signifikan menurunkan kadar glukosa darah tikus diabetes, dengan ekstraksi yang sama, pemberian 10% bobot/volume daun alpukat dapat menghambat aktivitas enzim protein tyrosine phosphatase 1B (PTP1B) sehingga dapat menurunkan resistensi insulin (Marrero-Faz et al. 2014). Jambu Batu (Psidium cujavilus)
11 badan secara signifikan menurunkan level glukosa darah pada model tikus dengan tes toleransi glukosa oral, sama halnya dengan dosis 0.75 g/kg berat badan pada tikus diabetes (Mazumdar et al. 2015). Berdasarkan kandungan bahan aktifnya dan hasil beberapa penelitian tersebut, hal ini menunjukkan bahwa Galohgor memiliki potensi untuk dikaji lebih luas mengenai pengaruhnya pada peningkatan perbaikan kondisi sakit tertentu dalam hal ini diabetes melitus gestasional.
Diabetes Melitus Definisi
Diabetes melitus (DM) merupakan kelompok penyakit metabolik kronis yang ditandai dengan hiperglikemia yang disebabkan gangguan dalam sekresi insulin sehingga tubuh tidak dapat menghasilkan insulin yang cukup dan gangguan aksi insulin yakni insulin tidak dapat digunakan secara efektif atau karena keduanya (Harris dan Jimmet 1997; ADA 2013; Gartner dan Hiatt 2014). Keadaan ini dapat berdampak pada beberapa komplikasi karena buruknya pengaturan metabolisme protein dan lemak, seperti komplikasi mikrovaskular antara lain diabetic retinopathy yang dapat mengakibatkan kebutaan, diabetic nephropathy seperti gagal ginjal, diabetic neuropathy yakni disfungsi sel saraf tepi, dan mengalami komplikasi makrovaskular seperti atherosklerosis (Fowler 2008). Diabetes juga berdampak pada komplikasi periodontal seperti karies gigi (Matthew 2002), oral kandidiasis dan periodontitis (Lamster et al. 2008).
Uji Diagnosis
Terdapat beberapa pengujian yang dapat digunakan untuk diagnosis diabetes, antara lain HbA1C, Glukosa plasma puasa (Fasting Plasma Glucose/FPG), dan Uji 2 jam toleransi glukosa oral (2-h PG atau Oral Glucose Tolerance Test/OGTT) (ADA 2015).
A1C >6.5%. Pengujian harus dilakukan di laboratorium yang sesuai standar The National Glycohemoglobin Standardization Program/NGSP atau laboratorium tersertifikasi untuk pengujian komplikasi dan kontrol diabetes. FPG >126 mg/dL (7.0 mmol/L), puasa didefinisikan tidak ada asupan kalori minimal selama 8 jam.
2-h PG >200 mg/dL (11.1 mmol/L) selama OGTT. Pengujian dilakukan muatan glukosa yang mengandung 75 g glukosa anhidrat yang dilarutkan dalam air.
Pada pasien dengan gejala klasik hiperglikemia. Plasma glukosa acak >200 mg/dL (11.1 mmol/L).
Klasifikasi
12
Klasifikasi diabetes melitus dengan pendekatan patogenesis yang digunakan secara umum (WHO 1999; ADA 2015) antara lain : 1) DM tipe-1, disebut juga dengan juvenile-onset diabetes yang sebelumnya mencakup istilah IDDM. 2) DM tipe-2 disebut juga adult onset diabetes mencakup istilah NIDDM. 3) Tipe
diabetes lain yang spesifik karena kerusakan genetik sel atau karena hal lain (tidak dibahas), dan 4) Diabetes Melitus Gestational
Diabetes Melitus Tipe-1 / IDDM
DM tipe-1 merupakan penyakit yang dimediasi oleh sistem imun yang
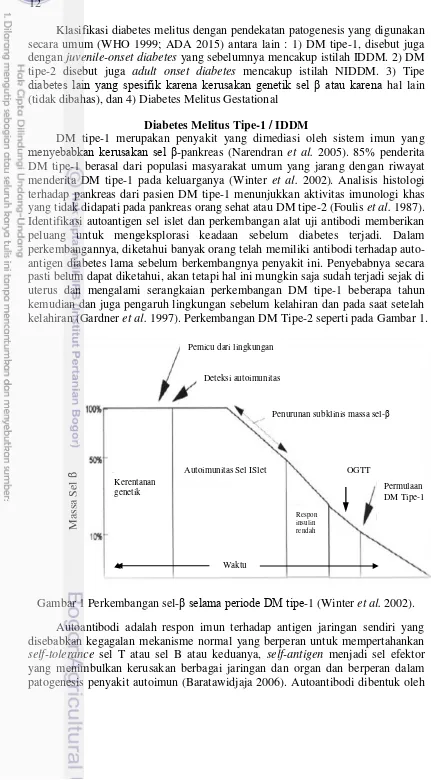
menyebabkan kerusakan sel -pankreas (Narendran et al. 2005). 85% penderita DM tipe-1 berasal dari populasi masyarakat umum yang jarang dengan riwayat menderita DM tipe-1 pada keluarganya (Winter et al. 2002). Analisis histologi terhadap pankreas dari pasien DM tipe-1 menunjukkan aktivitas imunologi khas yang tidak didapati pada pankreas orang sehat atau DM tipe-2 (Foulis et al. 1987). Identifikasi autoantigen sel islet dan perkembangan alat uji antibodi memberikan peluang untuk mengeksplorasi keadaan sebelum diabetes terjadi. Dalam perkembangannya, diketahui banyak orang telah memiliki antibodi terhadap auto-antigen diabetes lama sebelum berkembangnya penyakit ini. Penyebabnya secara pasti belum dapat diketahui, akan tetapi hal ini mungkin saja sudah terjadi sejak di uterus dan mengalami serangkaian perkembangan DM tipe-1 beberapa tahun kemudian dan juga pengaruh lingkungan sebelum kelahiran dan pada saat setelah kelahiran (Gardner et al. 1997). Perkembangan DM Tipe-2 seperti pada Gambar 1.
Gambar 1 Perkembangan sel- selama periode DM tipe-1 (Winter et al. 2002). Autoantibodi adalah respon imun terhadap antigen jaringan sendiri yang disebabkan kegagalan mekanisme normal yang berperan untuk mempertahankan self-tolerance sel T atau sel B atau keduanya, self-antigen menjadi sel efektor yang menimbulkan kerusakan berbagai jaringan dan organ dan berperan dalam patogenesis penyakit autoimun (Baratawidjaja 2006). Autoantibodi dibentuk oleh
Deteksi autoimunitas humoral
Penurunan subklinis massa sel-Pemicu dari lingkungan
Respon insulin rendah
Waktu
Permulaan DM Tipe-1 Autoimunitas Sel ISlet
Kerentanan genetik
OGTT
Massa
S
13 sistem imun ketika sistem imun itu sendiri gagal dalam membedakan antara self dan non-self. Pada keadaan normal, sistem imun dapat mengenali dan mengabaikan sel milik sendiri yang terdapat dalam tubuh dan tidak bertindak berlebihan terhadap substansi yang tidak mengancam pada lingkungan sekitar. Pada waktu bersamaan sistem imun harus dapat membuat antibodi yang target sasarannya merupakan substansi asing spesifik yang mengancam. Ketika pengaturan yang sangat ketat dan sistem yang efisien ini menjadi self-antigen, yang terjadi kemudian adalah jaringan sendiri menjadi target dan mengalami kerusakan (Pihoker et al. 2005).
Penanda kerusakan imun sel antara lain autoantibodi sitoplasmik sel Islet/ Islet-cell cytoplasmic autoantibodies (ICA), termasuk autoantibodi terhadap insulin (IAA), autoantibodi terhadap glutamic acid decarboxylase (GAD) dan autoantibodi terhadap tyrosine phosphatases insulinoma antigen 2 (IA-2) (Winter et al. 2002; Narendran et al. 2005). Keberadaan satu atau beberapa antibodi terhadap autoantigen tersebut menandakan terjadi patogenesis yang menyebabkan kematian sel Islet yang penting sebagai dasar diagnosa dini dan klasifikasi DM tipe-1 (Decochez et al. 2000; Pihoker et al. 2005).
Penapisan antibodi terhadap bayi yang baru lahir dengan orang tua terdiagnosa DM tipe-1 menginformasikan bahwa antibodi terhadap insulin merupakan yang pertama kali muncul, GAD dan IA-2 kemungkinan akan terlihat kemudian akan tetapi tidak ada urutan pasti. Dalam waktu setidaknya 2 tahun, lebih dari 10% bayi dari orang tua dengan DM tipe-1 memiliki setidaknya satu antibodi sel islet, hal ini menunjukkan proses autoimun telah terjadi sejak dini. Keberadaan imunitas sel islet tidak selalu berimplikasi terhadap hilangnya fungsi sel- , ketidaknormalan uji toleransi glukosa intravena sering kali hanya terdeteksi diakhir pada saat proses perkembangan penyakit meskipun keberadaan antibodi telah ada beberapa tahun sebelumnya (Narendran et al. 2005).
Kelainan dan kekeliruan antigen dalam mengenali self dan non-self inilah yang kemudian menyebabkan kompleks autoantibodi yang menyerang ke-lima
tipe sel islet (α, , , δ dan PP / polipeptida pankreas) yang salah satunya
14
Diabetes Melitus Tipe-2 / NIDDM
Diabetes melitus tipe-2 (DM tipe-2) disebabkan karena ketidakseimbangan antara sensitivitas insulin dan sekresi insulin. Faktor patofisiologi utama yang mendorong DM tipe-2 adalah resistensi insulin dan disfungsi sel- . Resistensi insulin kemungkinan disebabkan oleh kegagalan dalam signaling insulin, kegagalan transporter glukosa, dan lipopoksisitas. Disfungsi sel- diperkirakan karena penumpukkan amiloid (protein tak larut) pada islet pulau Langerhans, stres oksidatif, dan kelebihan asam lemak (Taylor 2012).
Faktor risiko DM tipe-2 termasuk obesitas, terutama penumpukkan lemak viseral, aktivitas fisik yang kurang, status sosial ekonomi yang rendah dan etnik
(Barnett dan Kumar β009; Speakman dan O’Rahily β01β). Sebanyak 40-70% variasi IMT dapat dijelaskan dengan faktor genetik dan peningkatan risiko 2-3 kali lipat DM tipe-2 berkaitan dengan hubungan kekerabatan. Kesamaan genetik untuk IMT dan DM tipe-2 sebesar 50-60% (Grarup et al. 2014)
Berbagai faktor berperan dalam adaptasi sel- selama riwayat perkembangan DM tipe-2, Temuan terbaru menyatakan bahwa kecenderungan genetik dan faktor lingkungan dapat berdampak pada menurunnya kapasitas respon sel- terhadap resistensi insulin dan pada akhirnya berdampak pada kegagalan respon. Terdapat 3 fase adaptasi selama perkembangan DM tipe-2 (Gambar 2) : fase kerentanan (susceptibility), fase adaptasi (adaptation) dan fase kegagalan (failure) (Alejandro et al. 2014).
Gambar 2 Fase perkembangan DM tipe-2. Fase kerentanan (Susceptibility), Fase adaptasi (Adaptation), Fase kegagalan(Failure) (Alejandro et al. 2014).
Studi longitudinal maupun cross sectional menunjukkan bahwa ketidaknormalan yang terdeteksi sejak dini pada DM tipe-2 merupakan dampak dari buruknya kemampuan tubuh dalam merespon insulin yang menyebabkan resistensi insulin (DeFronzo et al. 1992; Alejandro et al. 2014). Ketidaknormalan metabolik utama yang menyebabkan hiperglikemia pada DM tipe-2 melibatkan transport glukosa seluler pada sel- , hati, jaringan adiposa, otot kerangka dan beberapa bagian lainnya. Kunci dari Ketidaknormalan ini kemungkinan
Fase Kerentanan
Komponen genetik Lingkungan janin Gizi postnatal
Fase Adaptasi
Ekspansi massa sel beta Sekresi insulin
Fase Kegagalan
Glucolipotoxicity Stress oksidatif
Berat badan
Resistensi Insulin
Waktu
Glukosa
15 disebabkan karena hilangnya respon dari transporter glukosa dengan bentuk struktur yang sama (GLUT) terutama yang dieskpresikan pada jaringan tersebut yang mengakibatkan kekacauan homeostasis glukosa dalam tubuh (Garvey 1992).
Diabetes Melitus Gestasional (DMG)
Istilah diabetes melitus gestasional (DMG) atau Gestational diabetes mellitus pertama kali dijelaskan oleh Dr. J.P Hoet tahun 1940an pada jurnal berbahasa prancis dan diterjemahkan oleh Dr. F.D.W Lukens untuk publikasinya pada diabetes journal tahun 1951. Studi Follow up yang dilakukan oleh
O’Sullivan dan tim nya di rumah sakit kota Boston pada tahun 1960an
menujukkan bahwa terdapat sekitar 50% wanita yang didiagnosis dengan DMG menjadi tidak toleran terhadap glukosa dibanding wanita tidak hamil dengan kurun waktu yang sama dalam rentang 10 tahun setelah melahirkan. Penelitian ini merupakan studi follow up yang sangat panjang yakni Cohort terhadap kehamilan dini. Atas dasar ini kemudian O’Sullivan membuat kriteria yang menjadi landasan standar untuk mendeteksi diabetes pada kehamilan dan mengawali penelitian diabetes melitus gestasional (Knoop 2002).
Penurunan toleransi glukosa terjadi pada seseorang yang sedang hamil, sekitar 97-98% dari keseluruhan kehamilan dengan toleransi glukosa normal, hanya sekitar 2-3% (Kuhl 1991) atau bahkan 3-7% sisanya yang berkembang menjadi diabetes melitus gestasional (DMG) (Zhang et al. 2010). Studi cross sectional dan prosepective menunjukkan bahwa pasien wanita hamil dengan DMG merupakan mereka yang sebelumnya mengalami resistensi insulin (Homko 2001). DMG dapat terjadi pada trimester ke-2 dikarenakan meningkatnya resistensi insulin dan tidak mampunya sel- dalam mengkompensasi kebutuhan akan insulin yang tinggi secara konstan, mirip dengan DM tipe-2 (Zhang et al. 2010).
Definisi
DMG didefinisikan kondisi tidak mampu nya tubuh dalam mentoleransi glukosa yang pertama kali dideteksi pada wanita dalam masa kehamilan (ADA 2015). WHO (2013) bahkan mendefinisikan DMG lebih luas tidak terbatas pada toleransi glukosa saja, definisi DMG terbaru termasuk wanita dengan hiperglikemia tingkat sedang (intermediate), terganggunya toleransi glukosa (impaired glucose tolerance/IGT), dan terganggunya glikemia puasa (impaired fasting glycaemia/IFG). DMG diketahui melalui penafisan terhadap wanita hamil dengan faktor risiko klinis, atau pada wanita yang berisiko dengan pengujian ketidaknormalan toleransi glukosa (Bauchanan dan Xiang 2005).
Patologi
Selama kehamilan, kebutuhan insulin ibu meningkat karena terjadi resistensi insulin terkait dengan bertambahnya berat badan, produksi hormon plasenta, meningkatnya beban janin dan meningkatnya asupan makanan (Brelje et al. 2008; Petry 2014). Islet pankreas pulau Langerhans memenuhi kebutuhan ini dengan meningkatkan baik sekresi insulin maupun massa sel islet, menurunkan ambang batas glukosa, dan meningkatkan sekresi insulin yang distimulasi glukosa (Sorenson dan Brelje 1997; Ohara-Imaizumi et al. 2013).
16
Kehamilan mempengaruhi islet sel- melalui up-regulation struktur dan perubahan fungsi dalam merespon kebutuhan insulin jangka panjang. Perubahan adaptasi yang terjadi pada islet selama kehamilan antara lain: meningkatkan sekresi insulin yang distimulasi glukosa dengan ambang batas lebih rendah untuk sekresi insulin yang distimulasi glukosa, meningkatkan sintesis insulin, meningkatkan proliferasi sel- dan volume islet, meningkatkan pasangan gap-junction antar sel- , meningkatkan metabolisme glukosa, dan meningkatkan metabolisme c-AMP (Cyclic adenosine monophosphate) yakni second messenger yang penting pada banyak proses biologi (Sorenson dan Brelje 1997).
Studi proliferasi sel islet dan sekresi insulin selama masa kehamilan pada tikus menjelaskan bahwa terjadi pembelahan sel islet kelompok perlakuan dibanding kontrol secara signifikan pada hari 10 dan berlanjut hingga hari ke-14 dan kembali pada level kontrol pada hari ke-18 dan terhenti pada hari ke-20 perlakuan. sekresi insulin yang distimulasi glukosa pada isolasi pankreas tikus selama kehamilan meningkat pada hari ke-10, puncaknya pada hari ke-15 dan menurun mendekati level kontrol setelah melahirkan (Parsons et al. 1992). Hal ini dikarenakan begitu tingginya kebutuhan insulin pada masa kehamilan akibat beban metabolik yang tinggi.
Sekresi hormon plasenta antara lain progesteron, kortisol, plasenta laktogen, prolaktin dan growth hormon merupakan penyebab utama keadaan resistensi insulin selama kehamilan (Setji et al. 2005). Aktivasi reseptor insulin oleh hormon laktogenik baik itu laktogen plasenta maupun prolaktin menginduksi perubahan up-regulation pada fungsi islet yang merupakan karakteristik dari kehamilan (Brelje et al. 2008). Plasenta laktogen manusia (hPL) sebuah hormon polipeptida yang disekresikan hanya pada masa kehamilan oleh syncitiotropoblast berikatan dengan reseptor prolaktin (PRLR), yang diekspresikan oleh sel- ibu mempengaruhi peningkatan baik massa sel- maupun fungsinya selama kehamilan normal (Huang et al. 2009). Variasi genetik dalam bentuk Single Nukleotide Polymorphisms (SNPs) pada gen PRPL dapat menyebabkan meningkatnya risiko berkembangnya DMG. Studi in-vivo DNA sampel ibu dengan DMG dibandingkan dengan ibu normal ditemukan terdapat hubungan signifikan yang diidentifikasi dari 2 analisis SNPs yakni alel minor dari PRPL SNPs rs10068521 dan rs9292578, kedua alel minor ini mempengaruhi pengaturan transkripsi dan efisiensi dari PRPL yang lebih sering ditemukan pada ibu dengan DMG (le et al. 2013).
17 Laktogen menekan kemampuan ekspresi transkripsi koaktivator Menin yakni gen yang dapat menekan ekspresi gen p18 dan p27 yang merupakan inhibitor siklus sel. Overexspression dari Menin menyebabkan menurunnya proliferasi sel- ibu hamil yang mengakibatkan peningkatan kadar glukosa darah kronis (Karnik et al. 2007).
Selain pengaruh abnormalistas pengaturan hormonal, DMG juga dapat disebabkan disfungsi sel- antara lain karena terjadinya kerusakan autoimun, bawaan genetik (mutasi monogenik) dan juga adanya riwayat resistensi sebelumnya (Bauchanan dan Xiang 2005). Autoantibodi sel islet (ICA) ditemukan pada individu dengan kerentanan genetik yang kemungkinan lebih umum terjadi pada wanita dengan DMG dengan prevalensi 10-38% (Kuhl 1991). Prevalensi terhadap autoantibodi insulin (IAA) pada wanita dengan DMG cukup rendah berkisar antara 3% begitu juga dengan prevalensi IA2 yang berkisar hanya 0-6.2% (Djelmis et al. 2005). Autoantibodi terhadap GAD juga tidak jarang ditemukan pada wanita dengan DMG dengan prevalensi tidak berbeda antar grup etnik, antara lain 4.6% Eropa, 3.5% Asia Selatan, dan 3.2% pada Afro-karibian (Kousta et al. 2001).
Mutasi genetik yang ditemukan pada wanita dengan DMG antara lain adanya mutasi pada pola penurunan sifat autosomal dominan dan mutasi genetik pada DNA mitokondria. Mutasi autosomal dominan yakni terjadi karena adanya mutasi pengkode gen glukokinase, hepatocyte nuclear factor 1α, dan insulin promoter factor 1. Bentuk monogenik DMG ini terdapat pada 10% populasi (Bauchanan dan Xiang 2005).
Kriteria Diagnosis
International Association of Diabetes and Pregnancy Study Groups (IADPSG), sebuah tim konsensus internasional kumpulan dari berbagai praktisi obstetrik dan organisasi diabetes termasuk ADA pada tahun 2009 mengembangkan revisi rekomendasi untuk diagnosis DMG (ADA 2015) :
Semua wanita hamil (tidak melihat riwayat DM sebelumnya) dilakukan uji toleransi glukosa oral (oral glucose tolerance test/OGTT) dengan memberikan 75 gr glukosa, diukur pada 1 dan 2 jam setelah konsumsi pada 24-28 bulan kehamilan.
OGTT dilakukan pada pagi hari setelah sebelumnya puasa setidaknya 8 jam atau semalaman.
Diagnosis DMG ditetapkan ketika glukosa plasma: Puasa: > 92 mg/dL (5.1 mmol/L)
1 jam: > 180 mg/dL (10.0 mmol/L) 2 jam: > 153 mg/dL (8.5 mmol/L) Komplikasi
18
yang dapat menyebabkan pendarahan pasca melahirkan dan terjadinya shoulder dystocia yakni kesulitan saat melahirkan karena salah satu atau kedua pundak bayi tersangkut pada tulang panggul ibu, hal ini akan menyebabkan trauma saat melahirkan (Setji et al. 2005; Hadar 2014).
Komplikasi pada fetus dari ibu dengan DMG antara lain perkembangan fetus melebihi normal atau makrosomia yang dapat meningkatkan risiko kematian pada bayi pada kelahian, proses persalinan yang sulit dikarenakan ukuran bayi yang terlalu besar menghambat keluarnya bayi dari jalan rahim sehingga bayi mengalami hipoksia dan kematian, hipoglikemia yang terjadi beberapa jam setelah bayi dilahirkan dikarenakan hiperglikemia pada ibu menyebabkan hiperinsulinemia pada bayi. Komplikasi lainya seperti ketidaksempurnaan bentuk bawaan lahir, hiperbilirubinemia, polisitemia (peningkatan sel darah merah diatas normal dalam sirkulasi), hipokalsemia, dan sindrom gangguan pernapasan (Setji et al. 2005; Zhang et al. 2010; Hadar 2014; ADA 2015).
Resistensi Insulin
Diabetes tidak dapat dipisahkan dari istilah resistensi insulin. Resistensi insulin merupakan kondisi ketika tubuh menghasilkan insulin akan tetapi tidak dapat digunakan secara efektif, ketika seseorang terdampak resistensi insulin, level glukosa meningkat di dalam darah dan tidak diserap oleh sel (NIH, 2014). Keadaan inilah yang kemudian berkembang menjadi diabetes melitus tipe-2.
Gangguan fungsi sekresi dan aksi insulin pada penderita diabetes dapat melaui 3 mekanisme (Garvey 1992; Mayfield dan White, 2004) antara lain : 1) Penumpulan atau hilangnya respon insulin tahap pertama, sehingga sekresi insulin terlambat dan gagal mengembalikan lonjakan gula darah prandial dalam waktu yang normal, 2) Penurunan sensitifitas insulin sebagai respon terhadap glukosa sedemikian hingga menyebabkan hiperglikemia, 3) Gagal memberikan stimulasi terhadap respon insulin yang wajar. Manisfestasi inilah yang kemudian memunculkan resistensi pada insulin. Insulin merupakan hormon yang diproduksi oleh Pankreas, organ yang terletak di belakang lambung. Pankreas terdiri dari
kumpulan sel yang disebut dengan Islet. Sel yang terdapat dalam Islet
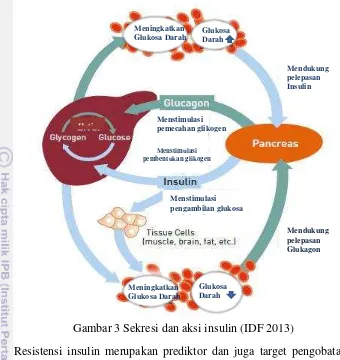
menghasilkan insulin dan melepaskannya ke darah. Insulin memainkan peranan yang penting dalam metabolisme, jalur yang memungkinkan tubuh menggunakan energi dari makanan yang dicerna. Insulin bertindak seperti penjaga pintu masuk ke dalam sel. Ketika makanan datang dalam bentuk glukosa di dalam darah, insulin yang bekerja dengan baik akan segera memberikan sinyal agar pintu sel terbuka, kemudian glukosa masuk ke dalam sel dan menggunakannya sebagai energi (ADA, 2004) . Hal ini seperti pada gambar 3.
19
Gambar 3 Sekresi dan aksi insulin (IDF 2013)
Resistensi insulin merupakan prediktor dan juga target pengobatan begitu ditemukan adanya hiperglikemi pada seseorang yang memiliki faktor risiko diabetes melitus. Resistensi insulin dapat terjadi pada jaringan otot dan juga pada jaringan adiposa. Pada otot rangka, terdampaknya ikatan insulin terhadap reseptornya nampaknya bukan satu-satunya yang menyebabkan peningkatan resistensi insulin pada penderita DMG (Damm et al. 1993). Resistensi insulin pada jaringan otot disebabkan karena mekanisme genetik terkait dengan ekspresi lipoprotein lipase (LPL) terhadap ekspresi peroxisome proliperator-activated receptor (PPAR)-δ (Taylor β01β), terpengaruhnya fungsi mitokondria (Szendroedi et al. 2007; Phielix et al. 2008; Taylor, 2012). Perubahan jalur sinyal insulin, abnormalitas penempatan subselular dari GLUT4 trasnporter dan berkurangnya jumlah insulin yang dimediasi transporter glukosa (Bauchanan dan Xiang 2005).
Akumulasi jaringan adiposa berkaitan dengan resistensi insulin (Frayn, 2001), karakteristik adiposit sebagai sumber penting perantara peradangan dengan menghasilkan sejumlah besar inflamatori sitokin dan kemokin seperti TNF-α, IL-6, MCP-1 (monocyte chemoattractant protein-1) dan juga terpengaruhnya pengaturan produksi anti-peradangan adipokin dalam hal ini adiponektin (Hsieh, c2011; Kaur, 2013). Peradangan jaringan adiposa merupakan proses kunci pokok pengaktifan jalur proinflamasi yang berpengaruh pada respon insulin yang dapat menyebabkan insulin menjadi resisten. Aktifasi jalur inflamasi pada jaringan adiposa mempengaruhi simpanan trigliserida dan meningkatkan pelepasan asam
Mendukung pelepasan Insulin
Mendukung pelepasan Glukagon Menstimulasi
pengambilan glukosa dari darah
Hati
Menstimulasi pembentukan glikogen
Menstimulasi pemecahan glikogen Meningkatkan
Glukosa Darah Glukosa Darah
Meningkatkan Glukosa Darah
20
lemak bebas, yang kemudian menyebabkan resistensi insulin pada otot dan hati (Guilherme et al, 2008).
Jaringan Adiposa, Adipokin dan Adiponektin
Adiposit telah terbukti di berbagai penelitian pada dekade ini tidak hanya berfungsi sebagai sel penyimpanan trigiserida akan tetapi memiliki fungsi yang lebih besar sebagai sel aktif dengan fungsi autikrin, parakrin dan endokrin. Jaringan adiposa telah diakui sebagai salah satu organ endokrin yang memiliki aktifitas metabolik yang tinggi (Kurlawalla-Martinez et al. 2005; Galic et al. 2010). Jaringan adiposa memainkan peranan yang penting dalam homeostasis energi, tidak hanya berperan dalam menyimpan lemak dalam bentuk trigliserida, tetapi juga merespon terhadap kebutuhan zat gizi, sinyal saraf dan hormonal dan mensekresikan adipokin yang mengontrol asupan makanan, termogenesis, imunitas dan fungsi neuroendokrin (Ahima 2006). Sel lemak yang disebut dengan adiposit menghasilkan dan mensekresikan beberapa protein yang keseluruhannya disebut dengan adipositokin atau adipokin.
Peningkatan perlemakan tubuh berpengaruh terhadap metabolisme lemak, perubahan profil adipokin dan peradangan jaringan adiposa pada sindroma metabolik. Resistensi insulin dan peradangan kronis ringan merupakan kunci penyebab sindroma metabolik yang berimpilikasi pada Diabetes melitus Terdapat 3 tipe jaringan adiposa pada mamalia yang diklasifikasikan berdasarkan penampakan warna, yakni coklat (brown adipose tissue//BAT), dan krem (beige adipose tissue/bAT), dan putih (white adipose tissue/WAT). Ketiga tipe jaringan adiposa ini memiliki kekhususan terkait komposisi sel, lokasi, jalur kontrol metabolik, kapasitas metabolik dan endokrin, dan tanggapan terhadap perubahan lingkungan. (Lanthier et al. 2014).
Adipokin
Adipokin merupakan segala substansi protein yang dihasilkan dan disekresikan oleh adiposit dari jaringan adiposa seperti leptin, adiponektin, resistin dan visfatin (Fain et al. 2004). Beberapa faktor lainnya termasuk sitokin dan kemokin seperti tumor necrosis factor-alpha (TNF-α), interleukin-6 (IL-6) dan monocyte chemoattractant protein-1 (MCP-1) yang juga dilepaskan jaringan adiposa disebut adipositokin dan juga disebut dengan adipokin (Fain et al. 2004; Antuna-Fuente et al. 2007). Sitokin merupakan suatu protein sistem imun yang mengatur interaksi antar sel dan memacu reaktivitas imun, baik pada imunitas non-spesifik maupun spesifik (Baratawidjaja 2006).
Beberapa adipokin berperan penting dalam resistensi insulin dan komplikasi kardiovaskular terkait obesitas, terutama obesitas sentral dan viseral dan juga sindrom metabolik. Keterlibatan resseptor dalam respon sistem imun memicu jalur transduksi yang mengaktifkan proses fosforilasi dan faktor transkripsi. Sitokin proinflamasi melalui aktivasi jalur transduksi mereka dapat merubah sinyal insulin dengan menginaktifasi insuline receptor substrate (IRS-1) melalui fosforilasi serin/treonin. Banyak serin/treonin kinase yang terlibat dalam
21 dan stres oksidatif pada orang obesitas dan pada DM tipe-2 (Antuna-Fuente et al. 2007).
Adiponektin
Adiponektin merupakan kelompok adipokin utama dan sangat banyak terekspresi pada jaringan adiposa dan secara langsung berpengaruh terhadap sensitifitas tubuh terhadap insulin (Kadowaki et al. 2006; Antuna-Fuente et al. 2007). Scherer et al (1995) dalam publikasinya mendeskripsikan penemuan protein sekretori dengan muatan 30 Kda atau adipocyte complement related protein 30 Kda (Acrp30) yang dihasilkan adiposit yang mana mRNA nya diinduksi lebih dari 100 kali lipat selama diferensiasi adiposit. Acrp30 ini kemudian dikenal dengan adiponektin. Acrp30 merupakan faktor yang ikut terlibat dalam penyeimbangan sistem homeostasis yang melibatkan asupan makanan, karbohidrat dan katabolisme lemak.
Adiponektin diproduksi secara khusus oleh adiposit yang sudah matang dan pada sistem sirkulasi konsentrasinya lebih dari 1000 kali konsentrasi hormon polipeptida (Kadowaki et al. 2006). Adiponektin banyak terdapat pada jaringan adiposa coklat (brown adipose tissue/BAT), jaringan adiopsa ini berperan penting dalam pengaturan suhu tubuh dengan penggunaan energi dari cadangan lemak adiposa (Viengchareun et al. 2002; Lacobellis et al. 2013). Level plasma adiponektin berkisar antara 5-30 mg/L pada subyek kurus dan mewakili 0.01% dari protein plasma (Antuna-Fuente et al. 2007). Struktur primer adiponektin mengandung urutan N-Signal terminal, daerah variable, daerah collagen-like (ekor) dan daerah C-terminal globular (kepala) (Ahima 2006) (gambar 4). Adiponektin dijumpai pada berbagai kompleks multimer plasma dan bergabung melalui bagian struktur kolagen pembentuknya untuk membangun 3 bentuk oligomerik: trimer adiponektin (molekul ringan / low-molecular weight), heksamer adiponektin (molekul berat menengah / middle molecular weight), dan 12-18-mer adiponektin (molekul dengan berat yang besar / high molecular weight) (Kadowaki et al. 2006).
Gambar 4 Struktur primer adiponektin (Ahima 2006)
Adiponektin dikatakan ―adipokin baik‖ karena aksi adiponektin sangat erat
22
dihati yakni phosphoenolpyruvate carboxykinase dan glucose-6-phosphatase (Kadowaki et al. 2006). Adiponektin menstimulasi aktivasi adenosin monophosphatase-activated protein kinase (AMPK) sehingga meningkatkan oksidasi lemak dan menghambat lipogenesis di hati (Hasenour et al. 2013). Sebagai faktor perlindingan pembuluh, adiponektin berhubungan terbalik dengan ekspresi perlekatan molekul dan tranformasi makrofag menjadi sel busa, studi in vitro juga menunjukkan bahwa adiponektin dapat menurunkan respon inflamasi sel endotel melalui inhibisi aktivasi induksi TNF-α (Leal dan Mafra β01γ).