$ # "
% & '()(
$ $ # # # $ $
# # % $ $ " 5
# 5 # $ % $ $ $
9 : " $
$ % # # 3 $ # " 7
: $ ## $ # $
$ 3 # ).( -(( ## $ $
$ $ $ $ # # 3 "
;'. <* # =( " 5 # $%
$ $ % # $ % $ %
$ $ % 5 % # $ 5 -( " # 3
% $ $$ $ $ 5 #
$ $ % # $ $ 5 #
$ " 0 >? $ -(( 3 '?
$ -(( 3 $ $ " 7
# # $ -(( 3
$ $ # >?" 7 # % $ $
5 # $ $ $ $ $ $
$ # 5 # # "
8 *% # %
" ; !
" -(( > ?
! " #
+ @ *
+, @ *-.)(/((.)
!
" " & % "
" " % " " % "
0 0
$ !
7
" 7 + % " % " #" " " 0" + %
0 % # "
% 2 '()(
7 )==( +
' % ! + )
7 )==-" !
01 + ) ! 7
)==/" ! &
% 2 1 5 B %
'(()" ! 1 5 B
! '((. " 7 '((/
$ ! % 7
0270, 40 0, """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" 5 0270, B0 ,0+ """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" :
) C+ 0 1B10+
)") B """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" ) )"' """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" -)"- 7 ! # """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" -)"> """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" -)". """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" >
' 7 +&010+ 1 70 0
'") # """""""""""""""""""""""""""""""""" . '"' """"""""""""""""""""""""""""""""""""""""""""""" / '"'") """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" D '"'"' # # """""""""""""""""""""""""""""""""""""""""""""""""""" = '"'"- """"""""""""""""""""""""""""""""""""""""""""""""""""""""""" )( '"- 4 """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" )) '"> """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" )' '". """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" )> '"/ """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" ). '"/") """""""""""""""""""""""""""""""""""""""""""""""""""""""" )/ '"/"' """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" )/ '"/"- """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" )E
- C76 6B64 C+CB 7 0+
-">") 0 6 + '((/ """"""""""""""""""""""""""""""""""" 'E 1! + '((/ """"""""""""""""""""""""" 'E 1! + '((/ """"""""""""""""""" 'E $ 1! + '((/ """""""""""""""""""""""""""""""""" 'E -">"' 0 # """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" '= 1! + '((/ """"""""""""""""""""""""" '= 0 '((- """""""""""""""""""""""""""" '=
$ H 8 *
! '((- """""""""""""""""""""""""""""""""""""""""""" '= ! 2 * * )=DD """""""""""""""""""""""""""""""" -( I " )==D """""""""" -( # I 2 * * )=DD """"""""""""""""""""" -) " )==D """""""""""""""""""""""""" -) 2 * * )=DD """""""""""""""""""""""""""""""" -' 7 1 '((' """"""""""""" -' ! 7 ! 1 '((' """"""""""" -' -">"- 0 """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" --060* )=== """"""""""""""""""""""""""""""""""""" --060* )=== """""""""""""""""""""""""""""""""""""" --$ 060* )=== """""""""""""""""""""""""""""""""""""""""" ->
$
7 5 ! '((- """""" -> # J '((/ """"""""""""""" -. # 0 )=E) """"""""""""""""""""""""" -. # 2 * * " )=DD """""""""""""""""""""""""""""""" -. -"." , $ $ """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" -/
> 0 B 0+ C 0 0 0+
>") ; """""""""""""""""""""""""""""""""""""""""""" -= >")") # ; """"""""""""""""""""""" -= >")"' # ; """""""""""""""""""""""""""""" >(
>"'" " >)
>"'") # """""""""""""""""""""""" >) 0 """"""""""""""""""""""""""""""""""""""" >) 1! """"""""""""""""""""""""""""""""""""""""""" >'
$ H
8 """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" ./ $ 7 """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" .E 0 """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" /( , """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" /' # 1! """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" /> 1! """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" //
. 1B0+ 0+ 0,0+ """""""""""""""""""""""""""""""""""""""""""""""""""""""""""" /=
- )=== """"""""""""""""" )D > * $ '((D """"""""""""""""""""""""""""""""""""""""" )E
. ! '((.
# """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""
'-/ 1! '((.
# """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" '.
D
'((-# """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" 'D E """"""""""""""""" >-= 8 * """"""""""""""""""" >.
)( """"""""" >D
)) """""""""""""""" >=
)' #
""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" .) )- """"""""""""""""""""""""
.-)> """"""""" ./
Surimi merupakan konsentrat dari protein miofibril ikan yang diperoleh dari
daging cincang yang telah mengalami pencucian untuk menghilangkan darah,
lemak, enzim dan protein sarkoplasma (Eymard 2005). Protein miofibril
dalam surimi mentah akan hilang sifat fungsionalnya selama penyimpanan beku.
Hoffman (2001) melaporkan bahwa denaturasi protein disebabkan oleh
pembentukan kristal es dalam surimi beku yang mengandung garam sehingga
meningkatkan dehidrasi dan menurunkan pH. Denaturasi protein dan peningkatan
pH berpengaruh signifikan pada kekuatan gel dan oksidasi lemak menyebabkan
perubahan pada warna.
Cara untuk melindungi protein fungsional pada surimi selama penyimpanan
beku adalah dengan menambahkan seperti sukrosa dan sorbitol
yang dicampurkan pada surimi (Zhou 2006). Mackie (1993) menjelaskan
bahwa (bahan antidenaturasi) akan meningkatkan tegangan
permukaan dan menurunkan titik beku air terperangkap dari protein miofibril,
sehingga jumlah air yang keluar selama proses dan penyimpanan beku akan
sangat berkurang dan struktur alami dari protein menjadi tetap stabil. Penggunaan
sukrosa dan sorbitol sebagai komersial bertujuan untuk
meningkatkan kemampuan pembentukan gel, meningkatkan kelarutan protein dan
menurunkan saat pemasakan (Nowsad 2000), tetapi
memberikan rasa manis dan jumlah kalori tinggi pada produk akhir surimi
(Zhou 2006).
Rasa manis disebabkan oleh gugus hidroksilnya, trihidroksi (gliserol) dan
polihidroksi lain juga berasa manis. Sorbitol mempunyai nilai kalori 2,6 kkal/g
atau setara dengan 10,87 kJ/g dan memiliki tingkat kemanisan relatif sama dengan
0,5 sampai 0,7 kali tingkat kemanisan sukrosa, sedangkan polisakarida tidak
terasa manis karena molekulnya sedemikian besarnya sehingga tak dapat masuk
ke dalam sel2sel kuncup rasa ( ) yang terdapat pada permukaan lidah
Produk biopolimer yang mengacu antara polisakarida dan protein seperti
kitin maupun turunannya dan karaginan sekarang sudah digunakan pada beragam
sektor industri untuk beberapa fungsi termasuk bahan pengental dan pembentuk
gel, emulsi dan penyebaran, menjaga flavor (Shahidi 1999). Somjit
(2005) melaporkan penggunaan kitin udang sebagai tidak bisa
berinteraksi dengan air dan bertentangan dengan struktur tiga dimensi protein
sehingga tidak bisa menekan terhadap protein sama
seperti yang terjadi pada surimi tanpa penambahan . Penggunaan
hidrolisat kitin udang menunjukkan nilai denaturasi beku yang sama dengan
surimi yang mengandung sukrosa atau glukosa, menstabilkan struktur 3 dimensi
protein dengan cara melindungi kontruksi air dalam bola hidrasi protein dan
dengan menekan dehidrasi dan pengaruh denaturasi protein akibat pembekuan.
Hidrolisat kitin udang bermanfaat dalam mengurangi rasa manis dan kalori. Ortiz
dan Aguilera (2004) mengemukakan efek dari penambahan kappa2karaginan
dapat meningkatkan tekstur gel pada surimi disebabkan mikrogel kappa2karaginan
melindungi jaringan protein surimi. Kappa2karaginan ketika temperatur menurun
mulai menyerap air dari protein dan sebagai medium untuk meningkatkan
kemampuan pembentukan gel yang menyebabkan tekanan kuat pada jaringan
protein, menghasilkan peningkatan elastisitas keseluruhan sistem struktur.
Kemampuan hidrolisat kitin dan karaginan sebagai belum
diketahui pada dan konsentrasi berapa yang mempunyai nilai optimal
dalam mempertahankan mutu surimi selama penyimpanan beku, sehingga
diperlukan penelitian tentang pengaruh dan konsentrasi pada hidrolisat
kitin dan karaginan terhadap surimi selama penyimpanan beku. Pada penelitian
ini dipelajari tentang pengaruh jenis dan konsentrasi terhadap
surimi ikan manyung selama penyimpanan beku. Ikan manyung dapat dibuat
menjadi surimi dan tergolong jenis ikan penghasil surimi dengan kekuatan gel
yang tinggi (Iwan 2002) dan surimi ikan manyung memiliki rataan
kandungan protein miofibril 78,48%, sehingga rendemen konsentrat protein
terhadap ikan utuh adalah 28,69% lebih tinggi dari rata2rata surimi jenis2jenis ikan
Surimi merupakan daging lumat yang dibersihkan dan dicuci dengan air
dingin sehingga sebagian bau, darah, lemak dan protein yang larut air hilang dan
ditambahkan untuk meningkatkan stabilitas protein selama
penyimpanan beku. Proses denaturasi protein selama pembekuan menyebabkan
menurunnya kelarutan protein miofibril, kehilangan induksi ATP pada kontraksi
otot serabut dan penurunan aktivitas ATP2ase miosin. Pada umumnya
yang digunakan adalah sukrosa dan sorbitol. Pengaruh dari
pemberian ini pada daging lumat dapat memberikan rasa manis
dan merubah warna (reaksi pencoklatan) dari produk akhir juga menambah nilai
kalori. Hidrolisat kitin dan karaginan digunakan sebagai dalam
pembuatan surimi, akan tetapi belum diketahui pada ukuran dan konsentrasi
berapa yang optimum dalam mempertahankan mutu surimi selama penyimpanan
beku.
Penelitian ini bertujuan untuk mempelajari pengaruh penambahan hidrolisat
kitin dan karaginan dengan 150 dan 300 , pada konsentrasi berbeda
selama penyimpanan beku terhadap karakteristik organoleptik, fisika, dan kimia
surimi ikan manyung.
Manfaat dari kegiatan penelitian ini adalah memberikan informasi tentang
hidrolisat kitin dan karaginan sebagai pengganti yang tidak
memberikan nilai kalori pada produk surimi.
!"# !
Hipotesis yang digunakan dalam penelitian ini adalah :
a) Hidrolisat kitin dan karaginan dengan ukuran 150 dan 300
mempunyai karakteristik berbeda.
b) Hidrolisat kitin dan karaginan dengan ukuran 150 dan 300
$ % ! !
Penggunaan sukrosa dan sorbitol pada surimi memberikan rasa manis, nilai
kalori dan merubah warna. Hidrolisat kitin dan karaginan sebagai
dengan dan konsentrasi yang tepat dapat mempertahankan mutu surimi
selama penyimpanan beku. Hidrolisat kitin dan karaginan merupakan
polisakarida yang tidak memberikan rasa manis, perubahan warna dan nilai kalori
pada produk akhir surimi. Adapun kerangka pemikiran penelitian secara lengkap
dapat dilihat pada Gambar 1.
Gambar 1 Kerangka pemikiran penelitian Keterangan:
= proses = produk Surimi
Bio2
komersial Denaturasi beku
Hidrolisat kitin 150 MS
Konsentrasi (0, 1, 2,3 dan 4 %)
Pembekuan cepat (240 ºC; 1 jam)
Penyimpanan beku (225 ºC; 90 hari)
Mempertahankan mutu dan memperpanjang umur simpan surimi Hidrolisat kitin
300 MS
Karaginan 150 MS
& ' ( %
% ! ! ! !" ! & )
Klasifikasi ikan manyung menurut Saanin (1984) adalah sebagai berikut :
Filum : Chordata
Subfilum : Vertebrata
Kelas : Pisces
Subkelas : Teleostei
Ordo : Ostariophysi
Subordo : Siluroidea
Famili : Ariidae
Genus :
Spesies :
Ikan manyung mempunyai ciri2ciri : bentuk badan memanjang, kepala picak
(gepeng), bersungut tiga pasang (dua pasang pada rahang bawah dan satu pasang
pada rahang atas), perisai kepala beralur dan berbintik2bintik. Ciri khusus dari
ikan manyung adalah adanya , yaitu sirip tambahan berupa lemak yang
terletak di belakang sirip dorsal dan tidak berhubungan. Sirip punggung, dada dan
dubur masing2masing berjari keras satu dan mengandung racun. Warna merah
sawo atau merah sawo keabuan bagian atas, putih merah maya2maya bagian
bawah. Sisip2siripnya (punggung, dubur) ujungnya gelap. Jenis ikan ini dapat
berukuran besar. Umumnya tertangkap pada ukuran 25270 cm dan dapat
mencapai panjang 150 cm. Berat ikan manyung berkisar antara 190 2 4.500 g
pada panjang 19,5 2 58 cm, dan 553 2 5.000 g pada panjang 28260 cm
(Burhanuddin 1987).
Ikan manyung merupakan salah satu ikan dasar (demersal) yang hidup di
perairan estuari dan laut. Kebanyakan ikan ini hidup di dua habitat, yaitu mula2
mula di air tawar lalu beruaya ke perairan estuari untuk memijah. Ruaya ikan
manyung ini sampai ke laut lepas (Burhanuddin 1987). Penyebaran ikan
manyung di Indonesia meliputi perairan laut barat Sumatera Selatan, Jawa, Selat
Kalimantan, selatan Sulawesi, utara Sulawesi, Maluku dan Irian. Daerah
penyebaran di dunia meliputi Thailand dan pantai Laut Cina Selatan, serta
Australia Utara dan Australia Barat Laut (Kailola 1980). Bentuk ikan manyung
dapat dilihat pada Gambar 2.
Gambar 2 Ikan manyung ( ) (PIPP 2005)
%# "# ! ! %! ! & )
Protein ikan terdiri dari tiga tipe, yaitu : sarkoplasma, miofibril dan
jaringan ikat (stroma). Persentase protein stroma dalam daging ikan lebih
sedikit dibandingkan daging lainnya. Hal inilah yang menyebabkan daging ikan
lebih lembut dibandingkan daging lainnya (Suzuki 1981).
Kandungan lemak ikan umumnya merupakan asam2asam lemak esensial
yaitu asam lemak linoleat dan linolenat. Burt (1988) menjelaskan bahwa dalam
lemak ikan lebih banyak kandungan asam lemak omega 3 dibandingkan dengan
asam lemak omega 6. Belitz dan Grosch (1999) menambahkan bahwa dalam
lemak ikan banyak terdapat asam lemak dengan rantai C202C22 dengan 5 dan 6
ikatan rangkap yang termasuk ke dalam kelompok asam lemak omega 3.
(EPA), (DHA) dan asam α2linoleat
merupakan jenis asam lemak yang termasuk ke dalam kelompok asam lemak
omega 3.
Semua vitamin yang dibutuhkan untuk nutrisi manusia terdapat pada ikan.
Minyak ikan merupakan sumber vitamin yang kaya akan vitamin A dan D.
Tokoferol atau vitamin E merupakan antioksidan alami yang terdapat pada
daging ikan sebagai pencegah oksidasi dari asam lemak tak jenuh yang terdapat
pada daging ikan (Burt 1988).
Sebagian besar kalsium pada tubuh ikan (sekitar 99%) ditemukan di
jaringan otot dan rangka. Sekitar 20 2 40% dari total kalsium terdapat pada
garam fosfat, seperti kalsium fosfat dan keratin fosfat. Sarkoplasma banyak
mengandung garam2garam potasium, kalsium, magnesium dan klor. Potasium
dan kalsium sering merupakan bagian protein kompleks (Muchtadi dan
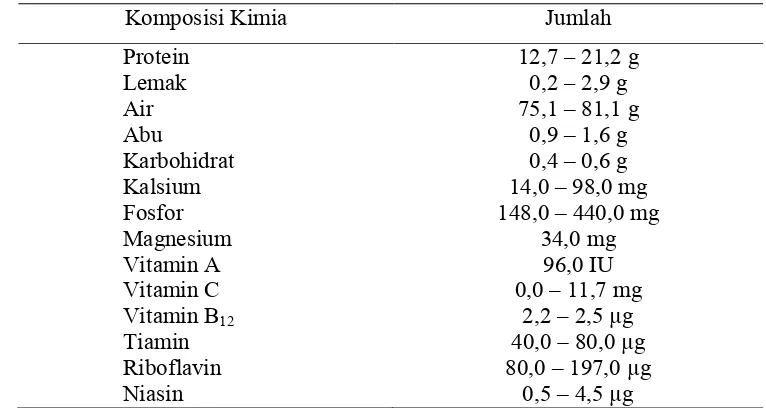
Sugiyono 1989). Komposisi kimia ikan manyung dapat dilihat pada Tabel 1.
Tabel 1 Komposisi kimia ikan Manyung ( ) dalam 100 g
daging ikan.
Karbohidrat 0,4 – 0,6 g
Kalsium 14,0 – 98,0 mg
Fosfor 148,0 – 440,0 mg
Magnesium 34,0 mg
Vitamin A 96,0 IU
Vitamin C 0,0 – 11,7 mg
Vitamin B12 2,2 – 2,5 Hg
Tiamin 40,0 – 80,0 Hg
Riboflavin 80,0 – 197,0 Hg
Niasin 0,5 – 4,5 Hg
Sumber : Wheaton dan Lawson (1985).
Protein ikan
Protein ikan digolongkan ke dalam tiga fraksi, yaitu protein miofibril (65 2
75%), protein sarkoplasma (20 2 30%) dan protein stroma (1 2 3%) (Suzuki
1981). Otot kerangka ikan terdiri atas serat pendek yang disusun diantara
lembaran2lembaran jaringan ikat. Jumlah jaringan ikat dalam otot ikan lebih
kecil dan jumlah jaringan ikat dalam mamalia dan seratnya lebih pendek.
Miofibril otot ikan beralur seperti otot mamalia dan mengandung protein utama
yang sama, yaitu miosin, aktin, aktomiosin dan tropomiosin (Cesarettin dan
Tony 2002).
a) Sarkoplasma
Protein sarkoplasma meliputi sebagian besar enzim yang terlibat dalam
metabolisme energi dan glikolisis. Sebagian besar protein sarkoplasma
berbentuk bulat. Karakteristik ini mungkin yang bertanggung jawab untuk daya
larut sarkoplasma yang tinggi dalam air (Nakai dan Modler 2000). Kandungan
miogen dalam otot ikan tergantung spesiesnya, namun pada umumnya ikan
pelagis lebih banyak kandungan miogen dibandingkan ikan demersal (Suzuki,
1981).
Protein sarkoplasma dapat menghambat dalam pembentukan gel, seperti
beberapa protease yang merusak miofibril. Protein sarkoplasma akan
mengganggu miosin selama pembentukan matriks gel, karena
protein ini mempunyai kapasitas pengikatan air yang rendah (Otterburn 1989).
b) Miofibril
Protein miofibril disebut juga protein kontraktil, terdiri dari aktin, miosin
dan protein regulasi (tropomiosin, troponin dan aktinin). Gabungan aktin dan
miosin membentuk aktomiosin. Protein miofibril sangat berperan dalam
pembentukan gel, terutama fraksi aktomiosin (Suzuki 1981). Protein ini dapat
diekstrak dengan larutan garam netral berkekuatan ion sedang (≥ 0,5 M)
(Martin 1982).
Miosin membentuk filamen tebal, termasuk protein yang memiliki sifat
berserat ( ) dan globular. Molekul miosin terdiri dari enam rantai
polipeptida yang disebut rantai berat dan empat pasang rantai ringan. Rantai
berat miosin berupa sebuah ATPase yang menghidrolisis ATP menjadi ADP dan
Pi dalam suatu reaksi terjadinya kontraksi otot. Fungsi rantai ringan sebagai
modulator aktivitas ATPase dari rantai berat yang bersambungan dengannya.
Aktin dalam bentuk filemn tipis, ditemukan dalam wujud monomer2monomer
bilobal globular (G2aktin) dan berpolimerisasi membentuk fiber2fiber (F2aktin)
(Gunawan 2001).
Pembentukan gel pada daging ikan tergantung dari sifat membentuk gel
dari miosin dan aktomiosin. Faktor2faktor yang mempengaruhi sifat gel
aktomiosin pada ikan adalah konsentrasi protein, pH, kekuatan ion, waktu dan
suhu pemanasan (Zayas 1997). Protein miofibril akan mengalami denaturasi
dengan kisaran nilai pH kurang dari 6,5, yang berdampak pada kemampuan
c) Stroma
Protein stroma (jaringan ikat) terdiri dari kolagen dan elastin. Protein ini
larut dalam larutan HCl atau NaOH. Jumlahnya sekitar 10 % dari total protein
kasar (Shahidi . 1999).
Kolagen adalah salah satu jenis protein jaringan pengikat yang dominan
baik dalam jumlah maupun peranannya, struktur kolagen menyerupai benang2
benang jala. Kolagen tidak larut dalam air maupun larutan garam tetapi larutan
alkali dan jika dipanaskan maka strukturnya akan berubah menjadi peptida2
peptida dengan berat molekul rendah (Hadiwiyoto 1993).
Sifat fungsional protein
Protein merupakan polimer dari sekitar 21 asam amino yang berlainan
disambungkan dengan ikatan peptida. Jika asam amino tersebut disambung2
sambungkan, maka akan terbentuk keragaman rantai samping. Protein yang
berbeda dapat mempunyai sifat kimia yang berbeda serta struktur sekunder dan
tersier yang sangat berbeda. Asam2asam amino yang disambungkan membentuk
rantai peptida (deMan 1997).
Berdasarkan struktur molekulnya, protein dibedakan atas protein fibrosa
dan globular. Protein, terutama protein globular, dapat berubah karena pengaruh
asam, alkali, dan panas. Protein dapat mengalami denaturasi dan koagulasi.
Denaturasi terjadi jika struktur sekunder tergantikan, tetapi struktur primernya
tidak berubah. Denaturasi dapat terjadi oleh perlakuan fisik, kimia dan
pemutusan ikatan silang protein. Koagulasi dapat terjadi karena perlakuan
panas, asam, garam, renin dan fisik. Pada protein ikan penambahan garam yang
cukup dapat mengentalkan protein, terutama miofibril sehingga terbentuk gel
yang baik (Gaman dan Sherrington 1990).
Pengelompokkan sifat fungsional protein menurut Cheftel (1985)
dibedakan menjadi 3 kelompok, yaitu :
(a) Sifat penyerapan air yang berhubungan dengan interaksi protein2air, seperti
daya serap air, kebasahan, daya lekat, viskositas dan kelarutan.
(b) Sifat yang berhubungan dengan interaksi protein2protein, seperti
(c) Sifat2sifat permukaan, seperti tegangan permukaan, emulsifikasi dan
pembentukan buih.
Denaturasi protein ikan
Denaturasi adalah perubahan struktur protein dimana pada keadaan
terdenaturasi penuh, hanya struktur primer protein saja yang tersisa. Protein tidak
lagi memiliki struktur sekunder, tersier dan quarterner, tetapi belum terjadi
pemutusan ikatan peptida pada kondisi terdenaturasi penuh ini. Denaturasi
protein yang berlebihan dapat menyebabkan insolubilisasi yang dapat
mempengaruhi sifat2sifat fungsional protein yang tergantung pada kelarutannya
(Damodaran 1996).
Denaturasi beku disebabkan oleh konsentrasi larutan garam mineral dan zat
organik yang dapat larut pada sisa fase tidak beku dalam sel. Konsentrasi garam
mineral dalam sel daging menjadi tinggi ketika air berubah menjadi kristal es.
Peningkatan ini dalam konsentrasi pekat, diikuti perubahan kekuatan ion dan pH
menyebabkan penguraian dan denaturasi protein (Suzuki 1981). Beberapa
penyebab terjadinya proses denaturasi selama penyimpanan beku yaitu:
(a) Pengaruh pH pada denaturasi
Pengaruh pH daging terhadap denaturasi tidak hanya terjadi pada temperatur
tinggi tetapi juga selama penyimpanan beku. Protein miofibril yang merupakan
indikator dari kemampuan pembentukan gel, pada pH 6,5 tidak stabil dan
kehilangan aktivitas ATPase2nya dengan cepat. Nilai pH dari daging ikan putih
seperti tidak berubah banyak setelah mati dan tetap netral selama
proses pembuatan dan penyimpanan beku surimi. Pada daging merah seperti
mackarel dan sardin, glikolisis cepat terjadi setelah mati. Penurunan dan
akumulasi dari asam laktat menyebabkan pH daging ikan menurun cepat, akhirnya
mencapai 5,6 (Park 2000).
Kemampuan pembentukan gel dari daging ikan selalu optimal pada pH
netral, dan kemampuannya menurun seiring dengan menurunnya pH. Sehingga
pengontrolan pH selama pengolahan surimi penting untuk menjaga kemampuan
(b) Pengaruh suhu dingin pada denaturasi
Daging ikan beku yang disimpan, sifat fungsionalnya seperti kapasitas
mengikat lemak, daya penahan air dan daya pembentukan gel lebih rendah
dibanding ikan segar. Penyebab utama dari perubahan kualitas ini disebabkan
denaturasi protein, terutama dari protein miofibril (Suzuki 1981).
Destabilisasi dingin dari protein miofibril dihasilkan dari melemahnya
interaksi intermolekular hidrofobik yang menstabilkan struktur asli protein, dapat
menjadi penyebab utama tidak stabilnya protein ikan. Penurunan temperatur yang
lambat menyebabkan kerusakan protein yang serius (Park 2000).
(c) Pengaruh kristal es
Struktur dan modifikasi pembentukan kristal es menuju ke redistribusi air,
menyebabkan air kembali masuk ke tempat asal (rehidrasi protein, kapasitas
mengikat air). Lapisan hidrasi menyelubungi protein, stabil menjadi struktur tiga
dimensi, kekuatan tergantung pada jaringan ikatan hidrogen. Modifikasi medium
untuk dehidrasi (pemindahan air yang terikat di protein untuk dibentuk menjadi
kristal es) atau rekristalisasi akan menghambat sistem pengikatan hidrogen dan
pembukaan zona hidrofobik atau hidrofilik. Interaksi intermolekular mengarah ke
perubahan dari struktur tiga dimensi atau intermolekuler lainnya mempengaruhi
interaksi protein2protein yang akhirnya menyatu (Park 2000).
* + &
Komponen protein yang terpenting dalam pembentukan gel ikan adalah
fraksi miosin. Kekuatan gel ikan akan meningkat sesuai dengan peningkatan
komponen miosin pada gel ikan tersebut (Cheng 1985). Bila daging ikan
mentah digiling dengan penambahan garam, maka miosin akan larut dalam
larutan garam membentuk sol yang sangat adhesif. Sol ini akan membentuk gel
dengan konstruksi seperti jala bila dipanaskan dan dapat memberikan sifat
elastis pada gel daging ikan (Tanikawa 1985).
Konstruksi jala dapat terbentuk dari konjugasi molekul2molekul protein
dengan bantuan ikatan hidrogen dan ikatan disulfida. Ditambahkan oleh Lanier
(1992) bahwa ikatan2ikatan yang terdapat dalam protein dapat berupa ikatan
pada suhu kamar dalam waktu yang sama, akan terbentuk atau dan
bila sifat elastis itu hilang serta daging menjadi kaku maka fenomena ini dikenal
dengan istilah (Tanikawa 1985).
Pembentukan gel suwari tidak hanya melalui hidrasi molekul protein, tetapi
juga oleh pembentukan struktur jaringan oleh ikatan hidrogen dan hidrofobik
dan molekul protein miofibril. ! pada suhu rendah akan membentuk
ikatan hidrogen dalam gel, sedangkan ikatan hidrofobik akan mendominasi gel
yang dibentuk melalui pada suhu tinggi. ! pada suhu tinggi dapat
menggunakan suhu antara 80 – 95 °C (Lee 1984).
Pratiwiningsih (2004) menjelaskan bahwa saat pencampuran surimi dengan
garam, ion2ion garam yang terhidrasi diabsorbsi pada permukaan protein
miofibril, sehingga meningkatkan ikatan terhadap molekul air dan menyebabkan
terbentuknya pasta yang lengket. Peningkatan suhu pada pemasakan
menyebabkan gugus sulfidril teroksidasi dan terjadi ikatan disulfida. α2helix
terbuka lipatannya karena ikatan hidrogen tidak stabil, sehingga lebih banyak
asam amino menjadi hidrofobik. Koagulasi protein menyebabkan pelepasan air
terikat oleh gel dan dispersi protein kurang homogen di seluruh matriks. Pada
pendinginan, ikatan hidrogen terbentuk, kekerasan produk bertambah dan
beberapa struktur α2heliks terbentuk kembali, struktur β2protein terbentuk di
antara rantai protein secara acak.
( ! !
Surimi adalah produk olahan hasil perikanan setengah jadi yang berupa
hancuran daging ikan yang telah mengalami proses pencucian, pengepresan dan
penambahan garam atau polifosfat, dapat juga dilanjutkan dengan pengepakan
dan pembekuan (Park 2000). Menurut Irianto (1990), sebagai bahan baku produk
lanjutan surimi memiliki sifat2sifat khusus, yaitu :
(a) Mampu membentuk gel bila dipanaskan setelah dicampur dengan garam.
(b) Mampu mengikat bahan dan bercampur dengan bahan lain tanpa merubah
sifat teksturnya.
(d) Proses pemanasan surimi untuk membentuk gel dapat dilakukan dengan
berbagai cara.
Kriteria yang paling penting dalam menentukan mutu surimi adalah
elastisitas produk yang dihasilkan karena hasil pembentukan gel ikan. Faktor2
faktor yang berpengaruh terhadap elastisitas produk surimi diantaranya: jenis
ikan, kesegaran ikan, pH, kadar air, pencucian, suhu dan waktu pemasakan dan
jumlah zat penambah (seperti garam, gula, polifosfat, monosodium glutamat,
pati, dan putih telur). Perlakuan pencincangan dan penggilingan juga
menentukan tekstur (Heruwati 1995).
Pada proses pembuatan surimi, pencucian merupakan tahapan yang penting
khususnya untuk ikan2ikan yang mempunyai kemampuan membentuk gel yang
rendah, serta berdaging merah. Pencucian surimi bertujuan melarutkan lemak,
darah, enzim dan protein sarkoplasma yang dapat menghambat pembentukan gel
ikan (Nielsen dan Pigott 1994). Pengaruh pencucian dalam pembuatan surimi
berfungsi juga untuk mendapatkan warna daging yang putih, juga untuk
menghilangkan protein sarkoplasma yang dapat menghambat pembentukan gel
(Suzuki 1981).
Setelah pencucian, dilakukan pengurangan air dengan cara pemerasan atau
sentrifuse, kemudian dilanjutkan dengan penggilingan. Penggilingan yang
digunakan sebaiknya tipe penggilingan dingin agar dapat mempertahankan mutu
surimi (Suzuki 1981). Spesifikasi persyaratan mutu surimi beku dapat dilihat
pada Tabel 2.
Tabel 2 Spesifikasi persyaratan mutu surimi beku.
Jenis Uji Satuan Persyaratan Mutu
a) Organoleptik
1) Nilai min. Koloni/g 7
b) Cemaran Mikroba :
1) ALT, maks APM/g 5 x 105
2) per 25 g < 3
3) per 25 g 3
4) ! "# Negatif
5) $ "# Negatif
c) Cemaran Kimia :
1) Abu total, maks. % b/b 1
% & '
3) Elastisitas, min g/cm2 300
*) Bila diminta oleh importir
Keterangan : ALT = Angka Lempengan Total APM = Angka Paling Memungkinkan Sumber : SNI 012269321992, BSN 1992a
$ * ( ! !
Penyediaan stok dalam waktu lama maupun untuk mempermudah
pendistribusian tanpa khawatir mengalami kemunduran mutu, maka surimi yang
telah dipak dalam kantong plastik dibekukan dalam alat pembeku yang mampu
mereduksi suhu sampai suhu pusat produk 218 °C dalam waktu maksimal 4 jam.
Master karton yang berisi produk disimpan di dalam gudang beku ( )
dengan suhu 225 ºC. Penyusunan di dalam diatur sedemikian rupa
sehingga memungkinkan terjadinya sirkulasi udara dingin dan memudahkan
pembongkaran (BSN 1992b).
Apabila daging dibekukan cepat, kristal es kecil terbentuk pada intra dan
ekstraseluler. Saat daging dibekukan lambat pembentukan pertama pada
permukaan ekstraseluler, diasumsikan karena titik beku berada di permukaan
ekstraseluler (konsentrasi padatan lebih rendah dibandingkan dibagian dalam).
Sejak tekanan uap air kristal es lebih rendah dari air yang sangat dingin, ada
kecendrungan pembekuan selanjutnya untuk air dibagian intraseluler migrasi ke
kristal es yang ada di bagian ekstraseluler. Tingkat pembekuan daging ikan
mempengaruhi tingkat denaturasi proteinnya. Pembekuan cepat umumnya lebih
mengurangi denaturasi daripada pembekuan lambat, tingkat pembekuan sedang
lebih merusak dari pada pembekuan lambat seperti perubahan tekstur dan
menurunnya kelarutan protein miofibril, kehilangan induksi ATP pada kontraksi
otot serabut dan penurunan aktivitas ATP2ase miosin (Fennema 1996; Suzuki
1981).
Hoffman (2001) mengemukakan bahwa dari sudut pandang penurunan
dengan warna, kekuatan gel dan pH, denaturasi protein dan oksidasi lemak
disebabkan oleh pembentukan kristal es dalam surimi beku yang mengandung
garam sehingga meningkatkan dehidrasi dan menurunkan pH. Denaturasi protein
dan peningkatan pH berpengaruh signifikan pada kekuatan gel dan oksidasi lemak
menyebabkan perubahan pada warna.
berfungsi menstabilkan protein miofibril pada saat
pembekuan, penyimpanan dan (Ruttanapornwareesakul 2006),
mencegah penarikan air dari protein, meningkatkan tegangan permukaan air (Park
2000). Surimi yang mengalami penyimpanan beku memerlukan proses
terlebih dahulu sebelum diolah menjadi produk jadi. & merupakan proses
yang diperlukan untuk mengkondisikan ke suhu normal surimi sebelum diolah
menjadi produk jadi agar tekstur daging tidak keras. Secara umum cepat
lebih baik dibandingkan lambat, karena pada lambat terjadi
kerusakan intraseluler yang disebabkan oleh pembentukan kristal es yang lebih
besar. Agen yang digunakan adalah yang mampu mengikat molekul air melalui
pengikatan hidrogen, disebut sebagai (FAO 1992).
Carpenter dan Crowe (1988) menyatakan bahwa polimer dengan berat
molekul yang tinggi merupakan yang baik karena dapat
dikeluarkan dari permukaan protein berdasarkan ukurannya. Namun, ilmuwan
lain menerangkan bahwa ( dari polimer dengan berat molekul yang
tinggi dan polimer glukosa berpengaruh berdasarkan kemampuan untuk
mengurangi mobilitas air dan meningkatkan air terbekukan. Mekanisme untuk
( karbohidrat didasarkan pada berat molekulnya dan stabilisasi
protein miofibril dengan karbohidrat yang berat molekulnya rendah merupakan
dasar untuk pembuatan surimi (Okada 1992).
, Sukrosa dan sorbitol
Sorbitol atau D2sorbitol atau D2glucitol atau D2sorbite adalah monosakarida
poliol (1,2,3,4,5,6—hexanehexol) dengan rumus kimia C6H1406. Sorbitol
dengan titik leleh berkisar antara 89 °C sampai dengan 101 °C, higroskopis dan
berasa manis. Sorbitol memiliki tingkat kemanisan relatif sama dengan 0,5 kali
sampai dengan 0,7 kali tingkat kemanisan sukrosa dengan nilai kalori sebesar
2,6 kkal/g atau setara dengan 10,87 kJ/g. Penggunaannya pada suhu tinggi tidak
ikut berperan dalam reaksi pencoklatan (BSN 2004).
Medina dan Garrote (2002) menambahkan bahwa sukrosa2sorbitol dapat
mempertahankan kekuatan gel surimi selama penyimpanan beku. Diduga bahwa
molekul mengikat atau berasosiasi dengan molekul protein pada
salah satu grup fungsionalnya baik dengan ikatan ionik maupun ikatan hidrogen
sehingga mencegah denaturasi protein dengan mengurangi pengikatan air dengan
protein selama penyimpanan.
, Hidrolisat kitin
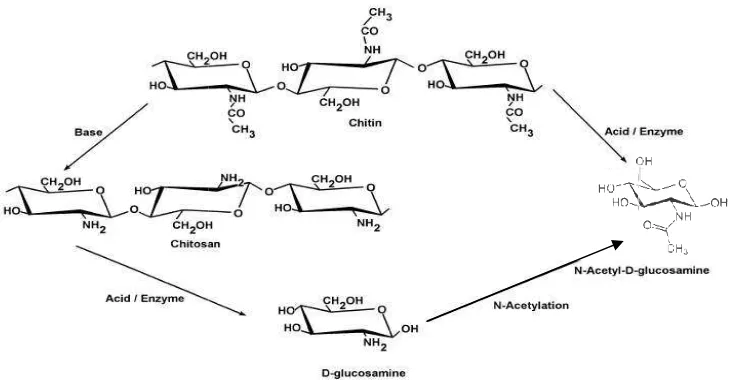
Kitin merupakan biopolimer kedua yang banyak ditemukan di alam, selain
selulosa. Kitin juga memiliki susunan kimia yang hampir menyerupai selulosa,
yaitu 22asetamida222deoksi2β2D2glukosa yang dihubungkan dengan jembatan
β(1,4) atau biasa disebut dengan N2asetil2glukosamin (Shahidi 1999). Kitin
bervariasi dalam kristalinitas, derajat ikatan kovalen dengan komponen gula dan
derajat deasetilasi. Kitin di alam telah terdeasetilasi sekitar 16 % dan mempunyai
berat molekul berkisar antara 1,03 – 2,5 x 106Da. Secara umum kitin yang telah
terdeasetilasi lebih dari 80 % dinamai kitosan dan berberat molekul
0,1 – 0,5 x 106 Da (Rochima 2005). Preparasi turunan kitin dari kitin dapat
Gambar 3 Preparasi
Umumnya kitin be
Pada dinding sel fungi, k
dinding sel lainnya, terut
kitin berasosiasi dengan
kovalen untuk membent
tidak larut dalam air,
Polisakarida ini dapat lar
anhidrat atau asam fosfat
Somjit (2005
rata2rata berat molekul b
menurunkan jumlah air
miofibril ditangkap oleh h
rantai utama kitin berp
parasi dari turunan kitin dan kitin (Shahidi 199
tin berikatan silang dengan komponen struktural
ngi, kitin berikatan silang secara kovalen dengan ko
, terutama β glukan. Pada serangga dan hewan inve
engan protein spesifik melalui ikatan kovalen mau
mbentuk struktur rangka (Blackwell 1988). Kitin
air, asam, basa, alkohol atau pelarut organik
pat larut di dalam HCl pekat, asam sulfat pekat, asam
fosfat 78279 % (Angka dan Suhartono 2000).
(2005) mengemukakan hidrolisis asam pada kitin ata
osakarida yang terdiri dari b2(124)2linked N
etamido222deoxy2D2glucose: GlcNAc) dan glucosam
lucose: GlcN), yang saat ini menarik perhatian peneli
imia, sifat fisik dan fungsi biologi dari senya
dibuat dari hidrolisis asam menjanjikan untuk dibua
nostik, fungisida dan aditif. Hidrolisat kitin udang
ekul berkisar antara 5,41 x 105 sampai 7,59 x 105
h air bebas, air bebas dalam jaringan tiga dimens
oleh hidrolisat kitin. Residu OH hidrofilik yang terl
Hidrolisat kitin menstab
berikatan dengan air dan m
, Karaginan
Karaginan dihasilka
) . Terdapat perbed
menggambarkan karagina
lainnya bervariasi dari
tersulfat dalam pola terb
biasanya sebagai polim
merupakan suatu bentuk
100 kDa (WHO 1999). P
yaitu berkisar 100 – 800
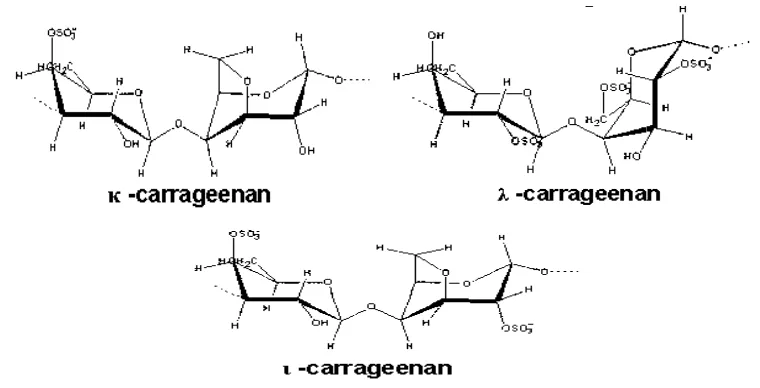
dilihat pada Gambar 4.
Gambar 4 Struktur
Lanier dan Park
membentuk gel karena
menghalangi interaksi po
aplikasi bahan pengental
sementara gel iota karagi
enstabilkan molekul air di sekeliling protein den
r dan mengubah air bebas menjadi air terikat.
asilkan dari spesies * * +
erbedaan struktur dari polisakarida alga merah. U
raginan seperti polisakarida. Karaginan tipe ι, κ,
dari formasi utama dan umum dalam unit gal
a terbatas dan/atau ditampilkan dalam bentuk 3,6
polimer A2B2A (Myslabodski 1996).
bentuk polisakarida linier dengan berat molekul
99). Pada kadungan sulfat 20 % berat karaginan cuk
800 kDa (deMan 1989). Struktur kimia karagin
uktur kimia karaginan (CPKelco 2007).
Park (2000) menambahkan kappa dan iota k
rena kandungan sulfat rendah (beban rendah sul
ksi polimer), sementara lambda karaginan digunak
gental. Kappa karaginan berbentuk keras, gel yan
karaginan lebih lembut dan mudah dibentuk. Gel y
dari kappa karaginan dapat terbentuk dengan penambahan ion potasium,
sementara gel elastis dari iota karaginan terbentuk dengan penambahan ion
kalsium. Gel kappa karaginan stabilitasnya lemah saat pembekuan atau
pencairan, sedangkan gel iota karaginan lebih stabil.
Suryaningrum (1988) menyatakan bahwa karaginan dapat membentuk gel
secara ( artinya dapat membentuk gel pada saat pendinginan dan kembali
cair pada saat dipanaskan. Pembentukan gel disebabkan terbentuknya struktur
heliks rangkap yang tidak terjadi pada suhu tinggi. Daya kelarutan karaginan
pada media pelarut dapat dilihat pada Tabel 3.
Tabel 3 Daya kelarutan karaginan pada berbagai media pelarut.
% % "" &# *
Efek kation
Gel lebih kuat dengan ion
potasium
Gel lebih kuat dengan ion kalsium
Tidak membentuk gel
Tipe gel Kuat dan rapuh
dengan sineresi
Alastis dan kohesif tanpa sineresi
Tidak membentuk gel Efek sinergis
dengan logam Tinggi Tinggi Tidak
Stabilitas
Tidak Stabil Tidak
- - -+& & &
. " ! !
Penelitian dimulai bulan Februari 2008 sampai dengan bulan Januari 2009.
Pembuatan hidrolisat kitin dan karaginan bertempat di Laboratorium Pengolahan
dan Karakteristik Bahan Baku Hasil Perikanan, Departemen Teknologi Hasil
Perairan, Fakultas Perikanan dan Ilmu Kelautan, IPB Bogor dan Balai Besar
Penelitian dan Pengembangan Pascapanen Pertanian Cimanggu Bogor.
Pembuatan surimi bertempat di Balai Besar Pengembangan dan
Pengendalian Hasil Perikanan, Departemen Kelautan dan Perikanan, Muara Baru,
Jakarta. Analisis dilakukan di Laboratorium Mikrobiologi dan Biokimia
Departemen Pengolahan Hasil Perikanan, Laboratorium Rekayasa Proses Pangan
Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian,
Laboratorium Terpadu Fakultas Kedokteran Hewan, IPB dan di Balai Besar
Pengembangan dan Pengembangan Hasil Perikanan, Departemen Kelautan dan
Perikanan, Muara Baru, Jakarta.
Bahan yang digunakan dalam penelitian ini terdiri dari empat kelompok,
yaitu bahan untuk pembuatan hidrolisat kitin, karaginan, surimi dan bahan untuk
analisis. Bahan2bahan yang digunakan dalam pembuatan hidrolisat kitin adalah
kulit udang, HCl, NaOH dan akuades. Bahan2bahan untuk pembuatan karaginan
adalah rumput laut dari Pulau Pari Kepulauan Seribu, KOH,
IPA (isopropil alkohol), akuades. Bahan2bahan yang digunakan untuk
pembuatan surimi antara lain ikan manyung ( ) dari Muara
Angke Jakarta Utara, es, akuades, garam, sukrosa dan sorbitol, hidrolisat kitin
dan karaginan. Bahan2bahan yang digunakan untuk analisis ialah NaOH, KCl,
K2SO4,CuSO4, H2SO4, H2O2, H3BO3, Na2SO4, BaSO4, BaCl2dan aquades.
Alat yang digunakan dalam penelitian ini terbagi dalam dua kelompok,
yaitu alat untuk pembuatan surimi, hidrolisat kitin, karaginan dan alat untuk
analisis. Alat untuk pembuatan surimi, hidrolisat kitin dan karaginan antara lain
150 dan 300 , gelas ukur, oven, sentrifuse, gelas ukur dan .
Alat2alat yang digunakan untuk analisis adalah selongsong kamaboko, pH meter,
gelas piala, , viscometer, whiteness meter, , oven, termometer,
inkubator, lempengan kaca 10 x 10 cm2, labu erlenmeyer, tabung soxhlet, cawan
porselin, pembakar bunsen, tanur listrik, desikator, homogenizer, sentrifuse, kertas
saring dan labu Kjeldhal.
" ! !
Penelitian pendahuluan
Penelitian ini bertujuan untuk membuat hidrolisat kitin dan karaginan
berdasarkan ukuran 150 dan 300 yang akan ditambahkan pada surimi
sebagai alternatif pada pembuatan surimi ikan manyung. Pada
pembuatan hidrolisat kitin dan karaginan pada tahap penyaringan menggunakan
150 dan 300 . Tepung hidrolisat kitin dan karaginan yang dihasilkan
dikarakterisasi sifat fisika2kimianya.
Penelitian utama
Penelitian utama bertujuan untuk mempelajari pengaruh penambahan
hidrolisat kitin dan karaginan dengan ukuran 150 dan 300 pada
penyimpanan beku surimi. Pada pembuatan surimi dilakukan penambahan
sukrosa 4 % dan sorbitol 4 % sebagai kontrol, hidrolisat kitin dan
karaginan 150 dan 300 dengan konsentrasi 0, 1, 2, 3 dan 4%. Masing2
masing perlakuan disimpan pada suhu beku 225 °C selama 0, 30, 60 dan 90 hari,
dan dikarakterisasi sifat organoleptik2fisika dan kimianya.
(a) Pembuatan hidrolisat kitin (Somjit 2005)
Kulit udang putih (, ( ) dicuci, dikeringkan. Kulit udang
dilakukan demineralisasi dengan penambahan asam klorida (HCl) 1,25 N dengan
perbandingan antara pelarut dan padatan 20 : 1 selama 5 hari. Kulit udang
ditiriskan setelah perendaman, lalu dicampur kembali dengan larutan HCl 1,25 N
dan dipanaskan pada suhu 90 2 95 °C selama 60 menit. Sampel dicuci dengan air
digunakan untuk mencuci dan menghilangkan protein dari kulit udang. Kulit
udang yang telah mengalami demineralisasi, direndam selama 3 hari dalam
larutan NaOH 3,5 N dengan perbandingan antara pelarut dan kulit udang 20 : 1.
Kulit udang yang telah direndam ditiriskan kemudian dilarutkan dalam NaOH
3,5 N dan dipanaskan pada suhu 90 – 95 °C lama pemanasan 60 menit. Hasil
pemanasan dicuci sebanyak 2 kali dan disaring sehingga didapatkan padatan.
Padatan dicuci dengan air sampai pH netral lalu direndam selama 12 jam dalam 5
volume (w : v) dari etanol 95 % untuk menghilangkan lemak dan warna, setelah
dikeringkan dalam oven pada suhu 60 °C selama 24 jam, dan diperoleh kitin
udang.
Kitin udang dan HCl 12 N diagitasi selama 1 jam dalam pada
suhu 40 °C. Reaksi hidrolitik diakhiri dengan penambahan 6 volume dari air
destilasi (v : v). Penghilangkan partikel yang tidak dapat larut, sampel yang telah
dihidrolisis disentrifugasi pada 10.000 g selama 20 menit. Supernatan
dinetralisasi dengan penambahan larutan NaOH 25 %. Sampel disaring
menggunakan saringan nilon halus menggunakan ukuran 150 setelah itu
disaring kembali menggunakan 300 . Residu dan filtrat dari penyaringan
terakhir dikeringkan menggunakan oven pada suhu 60 °C selama 48 jam dan
tepung hidrolisat kitin udang diperoleh dengan ukuran 150 dan 300 .
Tepung hidrolisat kitin dianalisis berat molekul, kadar protein, kadar lemak,
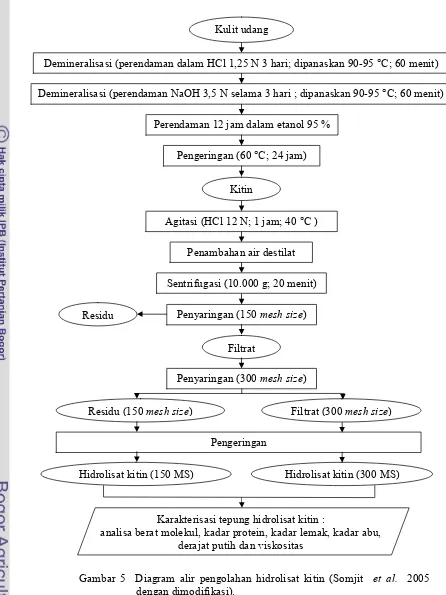
kadar abu, derajat putih dan viskositas. Diagram alir pembuatan hidrolisat kitin
Gambar 5 Diagram alir pengolahan hidrolisat kitin (Somjit 2005 dengan dimodifikasi).
Karakterisasi tepung hidrolisat kitin :
analisa berat molekul, kadar protein, kadar lemak, kadar abu, derajat putih dan viskositas
Hidrolisat kitin (150 MS) Hidrolisat kitin (300 MS)
Demineralisasi (perendaman dalam HCl 1,25 N 3 hari; dipanaskan 90295 °C; 60 menit) Kulit udang
Demineralisasi (perendaman NaOH 3,5 N selama 3 hari ; dipanaskan 90295 °C; 60 menit)
Perendaman 12 jam dalam etanol 95 %
Pengeringan (60 °C; 24 jam) jam)
Kitin
Agitasi (HCl 12 N; 1 jam; 40 °C )
Penambahan air destilat
Sentrifugasi (10.000 g; 20 menit)
Penyaringan (150 )
Residu
Filtrat
Penyaringan (300 )
Residu (150 ) Filtrat (300 )
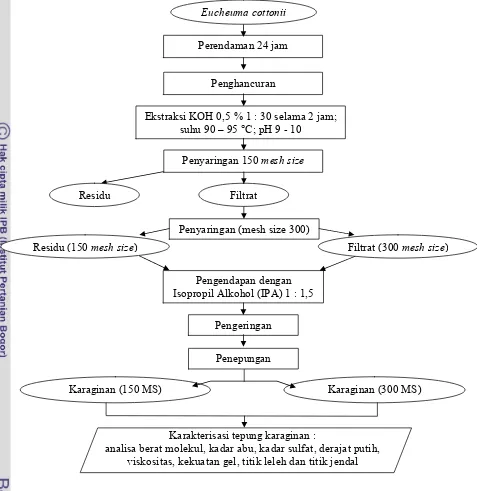
(b) Ekstraksi karaginan (Uju 2005)
Rumput laut jenis direndam selama 24 jam kemudian
dibilas dengan air hingga bersih dan ditiriskan setelah itu diblender sampai
halus. Rumput laut yang sudah diblender direbus dengan suhu 90 – 95 °C.
Perbandingan air dari rumput laut adalah 30 : 1 (v : w), ketika suhu air mencapai
90 °C ditambahkan KOH 0,5 % dan perebusan dilakukan selama 2 jam.
Hasilnya disaring melalui nilon halus dengan 150 . Filtrat kemudian
disaring kembali menggunakan 300 . Residu dari penyaringan terakhir
dan filtrat diendapkan menggunakan metil isopropil alkohol (IPA) dengan
perbandingan 1 : 1,5 lalu dibiarkan sampai terjadi endapan.
Endapan karaginan yang masih tercampur dengan alkohol disaring lagi
dengan kain kasa halus, lalu dijemur sampai kering dan dilakukan penepungan
hingga berbentuk serbuk. Tepung karaginan yang dihasilkan dilakukan analisis
berat molekul, kadar abu, kadar sulfat, derajat putih, viskositas, kekuatan gel,
titik leleh dan titik jendal. Diagram alir dari proses pembuatan karaginan dapat
Gambar 6 Diagram alir proses pengolahan karaginan (Uju 2005 dengan dimodifikasi).
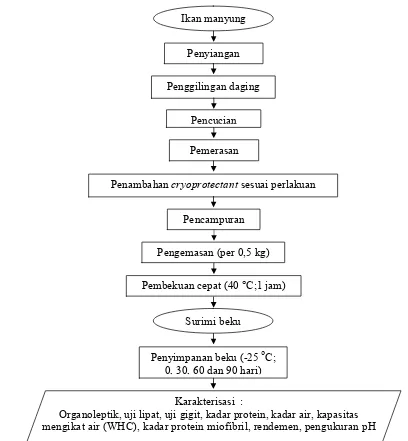
(c) Pengolahan surimi (Iwan . 2002; Prayitno 2003)
Ikan manyung dicuci untuk menghilangkan kotoran yang menempel,
kemudian disiangi untuk memisahkan daging ikan dengan bagian lain (kepala,
isi perut, sirip, tulang dan kulit). Daging ikan dilumatkan dengan Perendaman 24 jam
Penghancuran
Ekstraksi KOH 0,5 % 1 : 30 selama 2 jam; suhu 90 – 95 °C; pH 9 2 10
Penyaringan 150
Filtrat Residu
Penyaringan (mesh size 300)
Residu (150 ) Filtrat (300 )
Pengendapan dengan Isopropil Alkohol (IPA) 1 : 1,5
Pengeringan
Penepungan
Karakterisasi tepung karaginan :
analisa berat molekul, kadar abu, kadar sulfat, derajat putih, viskositas, kekuatan gel, titik leleh dan titik jendal
dan suhu dikontrol agar tetap dingin (5 °C). Daging lumat yang
dilakukan pencucian 4 kali sesuai dengan pencucian terbaik pada penelitian
yang telah dilakukan oleh Iwan (2002). Air pencuci adalah air tawar,
NaHCO3 0,5% dan larutan NaCl 0,3% (Prayitno 2003). Perbandingan air yang
didinginkan dan ikan adalah 3 : 1 (v : w). Pencucian dilakukan dengan cara
meremas2remas daging lumat selama lima menit, kemudian dilanjutkan dengan
pemerasan menggunakan kain kasa, sehingga didapatkan daging lumat,
kemudian ditambahkan berdasarkan perlakuan, dan diaduk
selama 30 menit. Surimi yang dihasilkan dibungkus per 0,5 kg dalam kantong
polyethylene dan dibekukan dalam 240 °C selama 1 jam.
Surimi beku yang diperoleh disimpan pada suhu 225 °C. Surimi dilakukan
karakterisasi organoleptik, kadar protein, kadar air, kapasitas mengikat air
(WHC), kadar protein miofibril, rendemen, pH, dan analisa kemurnian surimi
pada setiap 30 hari sampai hari ke 90. Diagram alir pembuatan surimi ikan
Gambar 7 Diagram alir pengolahan surimi beku ikan manyung (Prayitno 2003 yang dimodifikasi).
# ! !
Analisis yang dilakukan berupa karakterisasi organoleptik, fisika dan kimia
meliputi uji hedonik, analisis rendemen, pengukuran pH, derajat putih,
viskositas, kekuatan gel, titik leleh, titik jendal, uji lipat, uji gigit, berat molekul, Penyiangan
Pemerasan Pencucian Penggilingan daging
Penambahan sesuai perlakuan
Pencampuran Ikan manyung
Pengemasan (per 0,5 kg)
Pembekuan cepat (40 °C;1 jam)
Penyimpanan beku (225oC;
0, 30, 60 dan 90 hari) Surimi beku
Karakterisasi :
kadar protein, kadar lemak, kadar abu, kadar air, kadar protein miofibril, WHC
dan kadar sulfat.
3.4.1 Analisis organoleptik (BSN 2006)
Pengujian organoleptik/sensori merupakan cara pengujian menggunakan
indera manusia sebagai alat utama untuk menilai mutu produk. Penilaian
menggunakan alat indera ini meliputi spesifikasi mutu kenampakan, bau, rasa dan
konsistensi/tekstur serta beberapa faktor lain yang diperlukan untuk menilai
produk tersebut (BSN 2006).
(a) Uji sensori surimi beku (BSN 2006)
Pengujian sensori merupakan cara pengujian menggunakan indera manusia
sebagai alat utama untuk menilai mutu produk perikanan yang sudah mengalami
proses pengolahan. Tabel penilaian sensori surimi beku dapat dilihat pada
Lampiran 1.
(b) Uji organoleptik kamaboko (BSN 2006)
Pelaksanaan uji ini adalah pasta surimi dibuat menjadi kamaboko lalu
dipotong2potong dengan ketebalan ± 3 mm dan diberi kode sesuai dengan
perlakuannya. Panelis diminta untuk memberikan penilaian pada yang
telah disediakan (Lampiran 2). Penilaian dilakukan oleh 30 orang panelis semi
terlatih.
(c) Uji lipat dan gigit (BSN 2006)
Untuk menentukan uji lipat ( ) dan uji gigit ( ),
surimi beku dilelehkan dan dicampur dengan 3 % garam dan 30 % air dingin (air
es). Pencampuran dilakukan selama 15220 menit. Pasta tersebut dimasukkan ke
dalam casing PVC dengan diameter 25235 mm. Selanjutnya dilakukan pemanasan
I pada suhu 40 ºC selama 20 menit dan dilanjutkan dengan pemanasan II pada
suhu 90 ºC selama 20 menit. Angkat produk lalu dinginkan dan potong ketebalan
Uji lipat dilakukan dengan cara melipat sampel menjadi setengah lingkaran.
Jika tidak putus atau retak maka dilipat lagi menjadi seperempat lingkaran.
Tingkat kualitas uji lipat adalah sebagai berikut :
9 : tidak retak bila dilipat 4
7 : sedikit retak bila dilipat 4
5 : sedikit retak bila dilipat 2
3 : retak tetapi masih menyatu bila dilipat 2
1 : patah seluruhnya bila dilipat 2
Uji lipat dilakukan dengan cara memotong (menggigit) sampel antara gigi
seri atas dan gigi seri bawah. Tingkat kualitas uji gigit adalah sebagai berikut :
10 : amat sangat kuat kekenyalannya
9 : sangat kuat kekenyalannya
8 : kuat kekenyalannya
7 : agak kuat kekenyalannya
6 : kekenyalannya masih dapat diterima
5 : agak lunak
4 : lunak
3 : sangat lunak
1 : hancur
3.4.2 Analisis fisika
(a) Analisa rendemen (Prayitno 2003)
Pengamatan rendemen meliputi rendemen fillet dan surimi terhadap bahan
baku :
2 Rendemen fillet ikan (%) = berat daging fillet
berat ikan utuh
2 Rendemen surimi (%) = berat surimi
berat ikan utuh
(b) Kapasitas mengikat air/ (WHC) (Sudarmadji
2003)
Pertama2tama dilakukan penetapan kadar air contoh dengan metode standar
penetapan kadar air. Kemudian penetapan kadar air jus yang merupakan jumlah
air bebas pada bahan yang tidak diserap oleh bahan dan merupakan proporsi dari
jumlah air pada bahan (KA). Penetapan KJ dilakukan dengan menimbang
contoh sebanyak 1/k 0,5 g, kemudian contoh dipress diantara 2 kertas saring x 100 %
Whatman No. 4 pada plat penjepit dengan tekanan 200 kg/cm2selama 2 menit
dan setelah selesai tergambar area basah di sisi luar area bahan di bagian tengah
dari kertas saring. Area basah yang mengandung air jus diukur luasnya dengan
planimeter dan kadar air jus dihitung dengan rumus :
mg air jus = (luas area basah dalam cm2/ 0,0948) – 8
kadar air jus (KJ) = (mg air jus/mg contoh) x 100 %
WHC dihitung dengan rumus = (1 – KJ/KA) x 100 %
(c) Derajat putih (FMC Corp 1977)
Alat yang digunakan adalah Kett Digital Whiteness2meter model C2100.
Alat ini untuk mengukur tingkat warna putih dari sampel. Prinsipnya melalui
pengukuran indeks refleksi dari permukaan sampel dengan sensor foto dioda.
Semakin putih sampel, cahaya yang dipantulkan semakin banyak. Alat ini
dikalibrasi dengan standar derajat putih yang diperoleh dari asap pembakaran pita
MgO. Contoh ditempatkan dalam satu wadah tertentu, suhu sampel
diseimbangkan dengan meletakkan wadah sampel di atas tester. Wadah sampel
dimasukkan ke tempat pengukuran, sehingga alat menyala. LED akan
menampilkan nilai derajat putih dan nomor urutan pengukuran BaSO4digunakan
sebagai pembanding dengan nilai derajat putih 110%. Nilai derajat putih dihitung
dengan rumus :
Derajat putih (%) = x 100%
(d) Viskositas hidrolisat kitin (Hwang . 1997)
Viskometer terlebih dulu dicuci dengan akuades dan dikeringkan. Larutan
kitin dibuat dalam berbagai konsentrasi dalam pelarut asam asetat aqueous 0,1 M
dan sodium asetat 0,25 M. Masing2masing sampel ditempatkan di dalam
viskometer sejumlah 10 ml.
Secara perlahan sampel ditarik ke labu bagian atas viskometer. Waktu yang
dibutuhkan sampel untuk mengalir antara dua batas yang mengapit labu tersebut
dicatat. Sebagai blanko, digunakan pelarut asam asetat aqueos 0,1 M dan sodium
asetat 0,25 M dan ditentukan viskositasnya dengan cara yang sama. Nilai derajat putih
(e) Viskositas karaginan (FMC Corp 1977)
Viskositas adalah pernyataan tahanan dari suatu cairan untuk mengalir.
Satuan dari viskositas adalah poise (1 poise = 100 cP). Makin tinggi viskositas
menandakan makin besarnya tahanan cairan yang bersangkutan. Larutan sampel
dengan konsentrasi 1,5 % dipanaskan dalam bak air mendidih sambil diaduk
secara teratur sampai suhu mencapai 750C. Viskositas diukur dengan$
- .
(f) Berat molekul (Hwang . 1997)
Dari data viskositas spesifik ditentukan viskositas intrinsik dengan membuat
peta antara ηsp/C terhadap . Viskositas intrinsik adalah titik pada grafik yang
menunjukkan nilai = 0 atau dinyatakan sebagai :
= viskositas intrinsik
= konsentrasi sampel
= viskositas spesifik
Khusus untuk sampel hirolisat kitin diubah menjadi chitosan sebelum analisa
lebih lanjut. Sampel dideasetilasi dengan larutan 50 % NaOH selama 1 jam pada
suhu 110 °C. Deasetilasi dilakukan dua kali untuk memastikan daya larut yang
sempurna. Sampel yang diperoleh kemudian dicuci beberapa kali dengan air
destilasi sampai netral dan mengering.
Berat molekul dihitung dari viskositas intrinsik dengan persamaan Mark2
Houwink sebagai berikut :
/ viskositas intrinsik
. = konstanta untuk solven (tergantung jenis solven)
α = konstanta
/ = berat molekul
Perhitungan berat molekul kitosan menggunakan nilai K = 1,81 x 1023 dan
(2005). Perhitungan berat molekul karaginan menggunakan nilai K = 1,60 x 1022
dan nilai α = 0,748 yang diambil dari literatur Bi . (2007).
(g) Kekuatan gel (FMC Corp 1977)
Larutan contoh 1,6 % dan KCl 0,16 % dipanaskan dalam bak air mendidih
dengan pengadukan secara teratur sampai suhu 80 ºC. Volume larutan dibuat
sekitar 50 ml. Larutan panas dimasukkan ke dalam cetakan berdiameter kira2
kira 4 cm dan dibiarkan pada suhu 10 °C selama 2 jam. Gel dalam cetakan yang
akan bersentuhan dengan gel berada ditengahnya. diaktifkan dan
dilakukan pengamatan. Pembacaan dilakukan saat pegas kembali. Perhitungan
kekuatan gel adalah sebagai berikut :
Kekuatan gel (dyne/cm2) =0 x 980 dyne/cm2
!
Keterangan : 0 = tinggi kurva
S = luas permukaan sensing rod (cm2)
1 g = 980,78 dyne
(h) Titik leleh (Suryaningrum dan Utomo 2002)
Larutan contoh dengan konsentrasi 6,67 % (b/b) disiapkan dengan akuades.
Sampel diunkubasi pada suhu 10 °C selama ± 2 jam. Pengukuran titik leleh
dilakukan dengan cara memanaskan gel karaginan dalan . Di atas gel
karaginan tersebut diletakkan gotri dan ketika gotri jatuh ke dasar gel karaginan
maka suhu tersebut dinyatakan sebagai titik leleh karaginan.
(i) Titik jendal (Suryaningrum dan Utomo 2002)
Larutan contoh dengan konsentrasi 6,67 % (b/b) disiapkan dengan akuades
dalam gelas ukur volume 15 ml. Suhu sampel diturunkan secara perlahan2lahan
dengan cara menempatkan pada wadah yang telah diberi pecahan es. Titik jendal
diukur pada saat larutan karaginan mulai membentuk gel dengan menggunakan
3.4.3 Analisis kimia
(a) Kadar protein (AOAC 1999)
Penentuan kadar protein dilakukan dengan metode mikro Kjeldahl. Contoh
sebanyak 0,75 g dimasukkan ke dalam labu Kjeldahl, kemudian ditambahkan
6,25 g K2SO4 dan 0,6225 g CuSO4 sebagai katalisator. Sebanyak 15 ml H2SO4
pekat dan 3 ml H2O2 secara perlahan2lahan ditambahkan ke dalam labu dan
didiamkan selama 10 menit dalam ruang asam.
Tahap selanjutnya adalah proses destruksi pada suhu 410 °C selama 2 jam
atau hingga didapatkan larutan jernih, didiamkan hingga mencapai suhu kamar
dan ditambahkan 50 – 75 ml akuades. Disiapkan erlenmeyer berisi 25 ml larutan
H3BO3 4 % yang mengandung indikator ( 0,1 dan
0,1 % (2 : 1)) sebagai penampung destilat. Labu Kjeldahl dipasang pada
rangkaian alat destilasi uap. Ditambahkan 50 ml Na2SO4 (alkali). Dilakukan
destilasi dan destilat ditampung dalam erlenmeyer tersebut hingga volume destilat
mencapai 150 ml (hasil destilat berwarna hijau). Destilat dititrasi dengan HCl
0,2 N, dilakukan hingga warna berubah menjadi abu2abu natural. Blanko
dikerjakan seperti tahapan contoh. Pengujian contoh dilakukan triplo. Kadar
protein ditentukan dengan rumus :
Kadar protein (%) = x 100%
Keterangan : A = ml titrasi HCl sampel B = ml titrasi HCl blank
(b) Kadar Lemak (AOAC 1999)
Labu lemak yang telah dikeringkan di dalam oven (105 °C) ditimbang
hingga didapatkan berat tetap (A). Sebanyak 2 g contoh (C) dibungkus dengan
kertas saring bebas lemak kemudian dimasukkan kedalam selongsong lemak.
Selongsong tersebut dimasukkan kedalam tabung Soxhlet. Sebanyak 150 ml
kloroform dimasukkan ke dalam labu lemak. Contoh direfluks selama 8 jam,
setelah pelarut sudah terlihat jernih menandakan lemak sudah terekstrak semua.
Selanjutnya pelarut yang ada pada labu lemak dievaporasi untuk memisahkan (A – B)x normalitas HCl x 14,0007 x 6,25