$ # "
% & '()(
$ $ # # # $ $
# # % $ $ " 5
# 5 # $ % $ $ $
9 : " $
$ % # # 3 $ # " 7
: $ ## $ # $
$ 3 # ).( -(( ## $ $
$ $ $ $ # # 3 "
;'. <* # =( " 5 # $%
$ $ % # $ % $ %
$ $ % 5 % # $ 5 -( " # 3
% $ $$ $ $ 5 #
$ $ % # $ $ 5 #
$ " 0 >? $ -(( 3 '?
$ -(( 3 $ $ " 7
# # $ -(( 3
$ $ # >?" 7 # % $ $
5 # $ $ $ $ $ $
$ # 5 # # "
8 *% # %
" ; !
" -(( > ?
! " #
+ @ *
+, @ *-.)(/((.)
!
" " & % "
" " % " " % "
0 0
$ !
7
" 7 + % " % " #" " " 0" + %
0 % # "
% 2 '()(
' % ! + )
7 )==-" !
01 + ) ! 7
)==/" ! &
% 2 1 5 B %
'(()" ! 1 5 B
! '((. " 7 '((/
$ ! % 7
0270, 40 0, """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" 5 0270, B0 ,0+ """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" :
) C+ 0 1B10+
)") B """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" ) )"' """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" -)"- 7 ! # """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" -)"> """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" -)". """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" >
' 7 +&010+ 1 70 0
'") # """""""""""""""""""""""""""""""""" . '"' """"""""""""""""""""""""""""""""""""""""""""""" / '"'") """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" D '"'"' # # """""""""""""""""""""""""""""""""""""""""""""""""""" = '"'"- """"""""""""""""""""""""""""""""""""""""""""""""""""""""""" )( '"- 4 """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" )) '"> """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" )' '". """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" )> '"/ """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" ). '"/") """""""""""""""""""""""""""""""""""""""""""""""""""""""" )/ '"/"' """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" )/ '"/"- """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" )E
- C76 6B64 C+CB 7 0+
1! + '((/ """"""""""""""""""""""""" 'E 1! + '((/ """"""""""""""""""" 'E $ 1! + '((/ """""""""""""""""""""""""""""""""" 'E -">"' 0 # """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" '= 1! + '((/ """"""""""""""""""""""""" '= 0 '((- """""""""""""""""""""""""""" '=
$ H 8 *
! '((- """""""""""""""""""""""""""""""""""""""""""" '= ! 2 * * )=DD """""""""""""""""""""""""""""""" -( I " )==D """""""""" -( # I 2 * * )=DD """"""""""""""""""""" -) " )==D """""""""""""""""""""""""" -) 2 * * )=DD """""""""""""""""""""""""""""""" -' 7 1 '((' """"""""""""" -' ! 7 ! 1 '((' """"""""""" -' -">"- 0 """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" --060* )=== """"""""""""""""""""""""""""""""""""" --060* )=== """""""""""""""""""""""""""""""""""""" --$ 060* )=== """""""""""""""""""""""""""""""""""""""""" ->
$
7 5 ! '((- """""" -> # J '((/ """"""""""""""" -. # 0 )=E) """"""""""""""""""""""""" -. # 2 * * " )=DD """""""""""""""""""""""""""""""" -. -"." , $ $ """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" -/
> 0 B 0+ C 0 0 0+
>") ; """""""""""""""""""""""""""""""""""""""""""" -= >")") # ; """"""""""""""""""""""" -= >")"' # ; """""""""""""""""""""""""""""" >(
>"'" " >)
>"'") # """""""""""""""""""""""" >) 0 """"""""""""""""""""""""""""""""""""""" >) 1! """"""""""""""""""""""""""""""""""""""""""" >'
$ H
8 """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" ./ $ 7 """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" .E 0 """"""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" /( , """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" /' # 1! """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" /> 1! """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" //
. 1B0+ 0+ 0,0+ """""""""""""""""""""""""""""""""""""""""""""""""""""""""""" /=
- )=== """"""""""""""""" )D > * $ '((D """"""""""""""""""""""""""""""""""""""""" )E
. ! '((.
# """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""
'-/ 1! '((.
# """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" '.
D
'((-# """""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" 'D E """"""""""""""""" >-= 8 * """"""""""""""""""" >.
)( """"""""" >D
)) """""""""""""""" >=
)' #
""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""""" .) )- """"""""""""""""""""""""
.-)> """"""""" ./
Surimi merupakan konsentrat dari protein miofibril ikan yang diperoleh dari
daging cincang yang telah mengalami pencucian untuk menghilangkan darah,
lemak, enzim dan protein sarkoplasma (Eymard 2005). Protein miofibril
dalam surimi mentah akan hilang sifat fungsionalnya selama penyimpanan beku.
Hoffman (2001) melaporkan bahwa denaturasi protein disebabkan oleh
pembentukan kristal es dalam surimi beku yang mengandung garam sehingga
meningkatkan dehidrasi dan menurunkan pH. Denaturasi protein dan peningkatan
pH berpengaruh signifikan pada kekuatan gel dan oksidasi lemak menyebabkan
perubahan pada warna.
Cara untuk melindungi protein fungsional pada surimi selama penyimpanan
beku adalah dengan menambahkan seperti sukrosa dan sorbitol
yang dicampurkan pada surimi (Zhou 2006). Mackie (1993) menjelaskan
bahwa (bahan antidenaturasi) akan meningkatkan tegangan
permukaan dan menurunkan titik beku air terperangkap dari protein miofibril,
sehingga jumlah air yang keluar selama proses dan penyimpanan beku akan
sangat berkurang dan struktur alami dari protein menjadi tetap stabil. Penggunaan
sukrosa dan sorbitol sebagai komersial bertujuan untuk
meningkatkan kemampuan pembentukan gel, meningkatkan kelarutan protein dan
menurunkan saat pemasakan (Nowsad 2000), tetapi
memberikan rasa manis dan jumlah kalori tinggi pada produk akhir surimi
(Zhou 2006).
Rasa manis disebabkan oleh gugus hidroksilnya, trihidroksi (gliserol) dan
polihidroksi lain juga berasa manis. Sorbitol mempunyai nilai kalori 2,6 kkal/g
atau setara dengan 10,87 kJ/g dan memiliki tingkat kemanisan relatif sama dengan
0,5 sampai 0,7 kali tingkat kemanisan sukrosa, sedangkan polisakarida tidak
terasa manis karena molekulnya sedemikian besarnya sehingga tak dapat masuk
ke dalam sel2sel kuncup rasa ( ) yang terdapat pada permukaan lidah
Produk biopolimer yang mengacu antara polisakarida dan protein seperti
kitin maupun turunannya dan karaginan sekarang sudah digunakan pada beragam
sektor industri untuk beberapa fungsi termasuk bahan pengental dan pembentuk
gel, emulsi dan penyebaran, menjaga flavor (Shahidi 1999). Somjit
(2005) melaporkan penggunaan kitin udang sebagai tidak bisa
berinteraksi dengan air dan bertentangan dengan struktur tiga dimensi protein
sehingga tidak bisa menekan terhadap protein sama
seperti yang terjadi pada surimi tanpa penambahan . Penggunaan
hidrolisat kitin udang menunjukkan nilai denaturasi beku yang sama dengan
surimi yang mengandung sukrosa atau glukosa, menstabilkan struktur 3 dimensi
protein dengan cara melindungi kontruksi air dalam bola hidrasi protein dan
dengan menekan dehidrasi dan pengaruh denaturasi protein akibat pembekuan.
Hidrolisat kitin udang bermanfaat dalam mengurangi rasa manis dan kalori. Ortiz
dan Aguilera (2004) mengemukakan efek dari penambahan kappa2karaginan
dapat meningkatkan tekstur gel pada surimi disebabkan mikrogel kappa2karaginan
melindungi jaringan protein surimi. Kappa2karaginan ketika temperatur menurun
mulai menyerap air dari protein dan sebagai medium untuk meningkatkan
kemampuan pembentukan gel yang menyebabkan tekanan kuat pada jaringan
protein, menghasilkan peningkatan elastisitas keseluruhan sistem struktur.
Kemampuan hidrolisat kitin dan karaginan sebagai belum
diketahui pada dan konsentrasi berapa yang mempunyai nilai optimal
dalam mempertahankan mutu surimi selama penyimpanan beku, sehingga
diperlukan penelitian tentang pengaruh dan konsentrasi pada hidrolisat
kitin dan karaginan terhadap surimi selama penyimpanan beku. Pada penelitian
ini dipelajari tentang pengaruh jenis dan konsentrasi terhadap
surimi ikan manyung selama penyimpanan beku. Ikan manyung dapat dibuat
menjadi surimi dan tergolong jenis ikan penghasil surimi dengan kekuatan gel
yang tinggi (Iwan 2002) dan surimi ikan manyung memiliki rataan
kandungan protein miofibril 78,48%, sehingga rendemen konsentrat protein
terhadap ikan utuh adalah 28,69% lebih tinggi dari rata2rata surimi jenis2jenis ikan
Surimi merupakan daging lumat yang dibersihkan dan dicuci dengan air
dingin sehingga sebagian bau, darah, lemak dan protein yang larut air hilang dan
ditambahkan untuk meningkatkan stabilitas protein selama
penyimpanan beku. Proses denaturasi protein selama pembekuan menyebabkan
menurunnya kelarutan protein miofibril, kehilangan induksi ATP pada kontraksi
otot serabut dan penurunan aktivitas ATP2ase miosin. Pada umumnya
yang digunakan adalah sukrosa dan sorbitol. Pengaruh dari
pemberian ini pada daging lumat dapat memberikan rasa manis
dan merubah warna (reaksi pencoklatan) dari produk akhir juga menambah nilai
kalori. Hidrolisat kitin dan karaginan digunakan sebagai dalam
pembuatan surimi, akan tetapi belum diketahui pada ukuran dan konsentrasi
berapa yang optimum dalam mempertahankan mutu surimi selama penyimpanan
beku.
Penelitian ini bertujuan untuk mempelajari pengaruh penambahan hidrolisat
kitin dan karaginan dengan 150 dan 300 , pada konsentrasi berbeda
selama penyimpanan beku terhadap karakteristik organoleptik, fisika, dan kimia
surimi ikan manyung.
Manfaat dari kegiatan penelitian ini adalah memberikan informasi tentang
hidrolisat kitin dan karaginan sebagai pengganti yang tidak
memberikan nilai kalori pada produk surimi.
!"# !
Hipotesis yang digunakan dalam penelitian ini adalah :
a) Hidrolisat kitin dan karaginan dengan ukuran 150 dan 300
mempunyai karakteristik berbeda.
b) Hidrolisat kitin dan karaginan dengan ukuran 150 dan 300
$ % ! !
Penggunaan sukrosa dan sorbitol pada surimi memberikan rasa manis, nilai
kalori dan merubah warna. Hidrolisat kitin dan karaginan sebagai
dengan dan konsentrasi yang tepat dapat mempertahankan mutu surimi
selama penyimpanan beku. Hidrolisat kitin dan karaginan merupakan
polisakarida yang tidak memberikan rasa manis, perubahan warna dan nilai kalori
pada produk akhir surimi. Adapun kerangka pemikiran penelitian secara lengkap
dapat dilihat pada Gambar 1.
Gambar 1 Kerangka pemikiran penelitian Keterangan:
Pembekuan cepat (240 ºC; 1 jam)
Penyimpanan beku (225 ºC; 90 hari)
- - -+& & &
. " ! !
Penelitian dimulai bulan Februari 2008 sampai dengan bulan Januari 2009.
Pembuatan hidrolisat kitin dan karaginan bertempat di Laboratorium Pengolahan
dan Karakteristik Bahan Baku Hasil Perikanan, Departemen Teknologi Hasil
Perairan, Fakultas Perikanan dan Ilmu Kelautan, IPB Bogor dan Balai Besar
Penelitian dan Pengembangan Pascapanen Pertanian Cimanggu Bogor.
Pembuatan surimi bertempat di Balai Besar Pengembangan dan
Pengendalian Hasil Perikanan, Departemen Kelautan dan Perikanan, Muara Baru,
Jakarta. Analisis dilakukan di Laboratorium Mikrobiologi dan Biokimia
Departemen Pengolahan Hasil Perikanan, Laboratorium Rekayasa Proses Pangan
Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian,
Laboratorium Terpadu Fakultas Kedokteran Hewan, IPB dan di Balai Besar
Pengembangan dan Pengembangan Hasil Perikanan, Departemen Kelautan dan
Perikanan, Muara Baru, Jakarta.
Bahan yang digunakan dalam penelitian ini terdiri dari empat kelompok,
yaitu bahan untuk pembuatan hidrolisat kitin, karaginan, surimi dan bahan untuk
analisis. Bahan2bahan yang digunakan dalam pembuatan hidrolisat kitin adalah
kulit udang, HCl, NaOH dan akuades. Bahan2bahan untuk pembuatan karaginan
adalah rumput laut dari Pulau Pari Kepulauan Seribu, KOH,
IPA (isopropil alkohol), akuades. Bahan2bahan yang digunakan untuk
pembuatan surimi antara lain ikan manyung ( ) dari Muara
Angke Jakarta Utara, es, akuades, garam, sukrosa dan sorbitol, hidrolisat kitin
dan karaginan. Bahan2bahan yang digunakan untuk analisis ialah NaOH, KCl,
K2SO4,CuSO4, H2SO4, H2O2, H3BO3, Na2SO4, BaSO4, BaCl2dan aquades.
Alat yang digunakan dalam penelitian ini terbagi dalam dua kelompok,
yaitu alat untuk pembuatan surimi, hidrolisat kitin, karaginan dan alat untuk
analisis. Alat untuk pembuatan surimi, hidrolisat kitin dan karaginan antara lain
150 dan 300 , gelas ukur, oven, sentrifuse, gelas ukur dan .
Alat2alat yang digunakan untuk analisis adalah selongsong kamaboko, pH meter,
gelas piala, , viscometer, whiteness meter, , oven, termometer,
inkubator, lempengan kaca 10 x 10 cm2, labu erlenmeyer, tabung soxhlet, cawan
porselin, pembakar bunsen, tanur listrik, desikator, homogenizer, sentrifuse, kertas
saring dan labu Kjeldhal.
" ! !
Penelitian pendahuluan
Penelitian ini bertujuan untuk membuat hidrolisat kitin dan karaginan
berdasarkan ukuran 150 dan 300 yang akan ditambahkan pada surimi
sebagai alternatif pada pembuatan surimi ikan manyung. Pada
pembuatan hidrolisat kitin dan karaginan pada tahap penyaringan menggunakan
150 dan 300 . Tepung hidrolisat kitin dan karaginan yang dihasilkan
dikarakterisasi sifat fisika2kimianya.
Penelitian utama
Penelitian utama bertujuan untuk mempelajari pengaruh penambahan
hidrolisat kitin dan karaginan dengan ukuran 150 dan 300 pada
penyimpanan beku surimi. Pada pembuatan surimi dilakukan penambahan
sukrosa 4 % dan sorbitol 4 % sebagai kontrol, hidrolisat kitin dan
karaginan 150 dan 300 dengan konsentrasi 0, 1, 2, 3 dan 4%. Masing2
masing perlakuan disimpan pada suhu beku 225 °C selama 0, 30, 60 dan 90 hari,
dan dikarakterisasi sifat organoleptik2fisika dan kimianya.
(a) Pembuatan hidrolisat kitin (Somjit 2005)
Kulit udang putih (, ( ) dicuci, dikeringkan. Kulit udang
dilakukan demineralisasi dengan penambahan asam klorida (HCl) 1,25 N dengan
perbandingan antara pelarut dan padatan 20 : 1 selama 5 hari. Kulit udang
ditiriskan setelah perendaman, lalu dicampur kembali dengan larutan HCl 1,25 N
dan dipanaskan pada suhu 90 2 95 °C selama 60 menit. Sampel dicuci dengan air
digunakan untuk mencuci dan menghilangkan protein dari kulit udang. Kulit
udang yang telah mengalami demineralisasi, direndam selama 3 hari dalam
larutan NaOH 3,5 N dengan perbandingan antara pelarut dan kulit udang 20 : 1.
Kulit udang yang telah direndam ditiriskan kemudian dilarutkan dalam NaOH
3,5 N dan dipanaskan pada suhu 90 – 95 °C lama pemanasan 60 menit. Hasil
pemanasan dicuci sebanyak 2 kali dan disaring sehingga didapatkan padatan.
Padatan dicuci dengan air sampai pH netral lalu direndam selama 12 jam dalam 5
volume (w : v) dari etanol 95 % untuk menghilangkan lemak dan warna, setelah
dikeringkan dalam oven pada suhu 60 °C selama 24 jam, dan diperoleh kitin
udang.
Kitin udang dan HCl 12 N diagitasi selama 1 jam dalam pada
suhu 40 °C. Reaksi hidrolitik diakhiri dengan penambahan 6 volume dari air
destilasi (v : v). Penghilangkan partikel yang tidak dapat larut, sampel yang telah
dihidrolisis disentrifugasi pada 10.000 g selama 20 menit. Supernatan
dinetralisasi dengan penambahan larutan NaOH 25 %. Sampel disaring
menggunakan saringan nilon halus menggunakan ukuran 150 setelah itu
disaring kembali menggunakan 300 . Residu dan filtrat dari penyaringan
terakhir dikeringkan menggunakan oven pada suhu 60 °C selama 48 jam dan
tepung hidrolisat kitin udang diperoleh dengan ukuran 150 dan 300 .
Tepung hidrolisat kitin dianalisis berat molekul, kadar protein, kadar lemak,
kadar abu, derajat putih dan viskositas. Diagram alir pembuatan hidrolisat kitin
Gambar 5 Diagram alir pengolahan hidrolisat kitin (Somjit 2005 dengan dimodifikasi).
Karakterisasi tepung hidrolisat kitin :
analisa berat molekul, kadar protein, kadar lemak, kadar abu, derajat putih dan viskositas
Hidrolisat kitin (150 MS) Hidrolisat kitin (300 MS)
Demineralisasi (perendaman dalam HCl 1,25 N 3 hari; dipanaskan 90295 °C; 60 menit) Kulit udang
Demineralisasi (perendaman NaOH 3,5 N selama 3 hari ; dipanaskan 90295 °C; 60 menit)
Perendaman 12 jam dalam etanol 95 %
Pengeringan (60 °C; 24 jam) jam)
Kitin
Agitasi (HCl 12 N; 1 jam; 40 °C )
Penambahan air destilat
Sentrifugasi (10.000 g; 20 menit)
Penyaringan (150 )
Residu
Filtrat
Penyaringan (300 )
Residu (150 ) Filtrat (300 )
(b) Ekstraksi karaginan (Uju 2005)
Rumput laut jenis direndam selama 24 jam kemudian
dibilas dengan air hingga bersih dan ditiriskan setelah itu diblender sampai
halus. Rumput laut yang sudah diblender direbus dengan suhu 90 – 95 °C.
Perbandingan air dari rumput laut adalah 30 : 1 (v : w), ketika suhu air mencapai
90 °C ditambahkan KOH 0,5 % dan perebusan dilakukan selama 2 jam.
Hasilnya disaring melalui nilon halus dengan 150 . Filtrat kemudian
disaring kembali menggunakan 300 . Residu dari penyaringan terakhir
dan filtrat diendapkan menggunakan metil isopropil alkohol (IPA) dengan
perbandingan 1 : 1,5 lalu dibiarkan sampai terjadi endapan.
Endapan karaginan yang masih tercampur dengan alkohol disaring lagi
dengan kain kasa halus, lalu dijemur sampai kering dan dilakukan penepungan
hingga berbentuk serbuk. Tepung karaginan yang dihasilkan dilakukan analisis
berat molekul, kadar abu, kadar sulfat, derajat putih, viskositas, kekuatan gel,
titik leleh dan titik jendal. Diagram alir dari proses pembuatan karaginan dapat
Gambar 6 Diagram alir proses pengolahan karaginan (Uju 2005 dengan dimodifikasi).
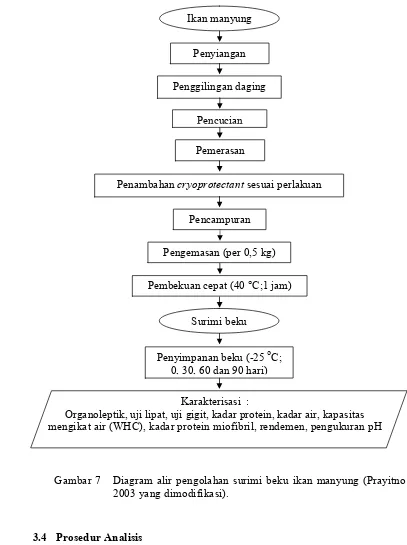
(c) Pengolahan surimi (Iwan . 2002; Prayitno 2003)
Ikan manyung dicuci untuk menghilangkan kotoran yang menempel,
kemudian disiangi untuk memisahkan daging ikan dengan bagian lain (kepala,
isi perut, sirip, tulang dan kulit). Daging ikan dilumatkan dengan Perendaman 24 jam
Penghancuran
Ekstraksi KOH 0,5 % 1 : 30 selama 2 jam; suhu 90 – 95 °C; pH 9 2 10
Penyaringan 150
Filtrat Residu
Penyaringan (mesh size 300)
Residu (150 ) Filtrat (300 )
Pengendapan dengan Isopropil Alkohol (IPA) 1 : 1,5
Pengeringan
Penepungan
Karakterisasi tepung karaginan :
analisa berat molekul, kadar abu, kadar sulfat, derajat putih, viskositas, kekuatan gel, titik leleh dan titik jendal
dan suhu dikontrol agar tetap dingin (5 °C). Daging lumat yang
dilakukan pencucian 4 kali sesuai dengan pencucian terbaik pada penelitian
yang telah dilakukan oleh Iwan (2002). Air pencuci adalah air tawar,
NaHCO3 0,5% dan larutan NaCl 0,3% (Prayitno 2003). Perbandingan air yang
didinginkan dan ikan adalah 3 : 1 (v : w). Pencucian dilakukan dengan cara
meremas2remas daging lumat selama lima menit, kemudian dilanjutkan dengan
pemerasan menggunakan kain kasa, sehingga didapatkan daging lumat,
kemudian ditambahkan berdasarkan perlakuan, dan diaduk
selama 30 menit. Surimi yang dihasilkan dibungkus per 0,5 kg dalam kantong
polyethylene dan dibekukan dalam 240 °C selama 1 jam.
Surimi beku yang diperoleh disimpan pada suhu 225 °C. Surimi dilakukan
karakterisasi organoleptik, kadar protein, kadar air, kapasitas mengikat air
(WHC), kadar protein miofibril, rendemen, pH, dan analisa kemurnian surimi
pada setiap 30 hari sampai hari ke 90. Diagram alir pembuatan surimi ikan
Gambar 7 Diagram alir pengolahan surimi beku ikan manyung (Prayitno 2003 yang dimodifikasi).
# ! !
Analisis yang dilakukan berupa karakterisasi organoleptik, fisika dan kimia
meliputi uji hedonik, analisis rendemen, pengukuran pH, derajat putih,
viskositas, kekuatan gel, titik leleh, titik jendal, uji lipat, uji gigit, berat molekul, Penyiangan
Pemerasan Pencucian Penggilingan daging
Penambahan sesuai perlakuan
Pencampuran Ikan manyung
Pengemasan (per 0,5 kg)
Pembekuan cepat (40 °C;1 jam)
Penyimpanan beku (225oC;
0, 30, 60 dan 90 hari) Surimi beku
Karakterisasi :
kadar protein, kadar lemak, kadar abu, kadar air, kadar protein miofibril, WHC
dan kadar sulfat.
3.4.1 Analisis organoleptik (BSN 2006)
Pengujian organoleptik/sensori merupakan cara pengujian menggunakan
indera manusia sebagai alat utama untuk menilai mutu produk. Penilaian
menggunakan alat indera ini meliputi spesifikasi mutu kenampakan, bau, rasa dan
konsistensi/tekstur serta beberapa faktor lain yang diperlukan untuk menilai
produk tersebut (BSN 2006).
(a) Uji sensori surimi beku (BSN 2006)
Pengujian sensori merupakan cara pengujian menggunakan indera manusia
sebagai alat utama untuk menilai mutu produk perikanan yang sudah mengalami
proses pengolahan. Tabel penilaian sensori surimi beku dapat dilihat pada
Lampiran 1.
(b) Uji organoleptik kamaboko (BSN 2006)
Pelaksanaan uji ini adalah pasta surimi dibuat menjadi kamaboko lalu
dipotong2potong dengan ketebalan ± 3 mm dan diberi kode sesuai dengan
perlakuannya. Panelis diminta untuk memberikan penilaian pada yang
telah disediakan (Lampiran 2). Penilaian dilakukan oleh 30 orang panelis semi
terlatih.
(c) Uji lipat dan gigit (BSN 2006)
Untuk menentukan uji lipat ( ) dan uji gigit ( ),
surimi beku dilelehkan dan dicampur dengan 3 % garam dan 30 % air dingin (air
es). Pencampuran dilakukan selama 15220 menit. Pasta tersebut dimasukkan ke
dalam casing PVC dengan diameter 25235 mm. Selanjutnya dilakukan pemanasan
I pada suhu 40 ºC selama 20 menit dan dilanjutkan dengan pemanasan II pada
suhu 90 ºC selama 20 menit. Angkat produk lalu dinginkan dan potong ketebalan
Uji lipat dilakukan dengan cara melipat sampel menjadi setengah lingkaran.
Jika tidak putus atau retak maka dilipat lagi menjadi seperempat lingkaran.
Tingkat kualitas uji lipat adalah sebagai berikut :
9 : tidak retak bila dilipat 4
7 : sedikit retak bila dilipat 4
5 : sedikit retak bila dilipat 2
3 : retak tetapi masih menyatu bila dilipat 2
1 : patah seluruhnya bila dilipat 2
Uji lipat dilakukan dengan cara memotong (menggigit) sampel antara gigi
seri atas dan gigi seri bawah. Tingkat kualitas uji gigit adalah sebagai berikut :
10 : amat sangat kuat kekenyalannya
9 : sangat kuat kekenyalannya
8 : kuat kekenyalannya
7 : agak kuat kekenyalannya
6 : kekenyalannya masih dapat diterima
5 : agak lunak
4 : lunak
3 : sangat lunak
1 : hancur
3.4.2 Analisis fisika
(a) Analisa rendemen (Prayitno 2003)
Pengamatan rendemen meliputi rendemen fillet dan surimi terhadap bahan
baku :
2 Rendemen fillet ikan (%) = berat daging fillet
berat ikan utuh
2 Rendemen surimi (%) = berat surimi
berat ikan utuh
(b) Kapasitas mengikat air/ (WHC) (Sudarmadji
2003)
Pertama2tama dilakukan penetapan kadar air contoh dengan metode standar
penetapan kadar air. Kemudian penetapan kadar air jus yang merupakan jumlah
air bebas pada bahan yang tidak diserap oleh bahan dan merupakan proporsi dari
jumlah air pada bahan (KA). Penetapan KJ dilakukan dengan menimbang
contoh sebanyak 1/k 0,5 g, kemudian contoh dipress diantara 2 kertas saring x 100 %
Whatman No. 4 pada plat penjepit dengan tekanan 200 kg/cm2selama 2 menit
dan setelah selesai tergambar area basah di sisi luar area bahan di bagian tengah
dari kertas saring. Area basah yang mengandung air jus diukur luasnya dengan
planimeter dan kadar air jus dihitung dengan rumus :
mg air jus = (luas area basah dalam cm2/ 0,0948) – 8
kadar air jus (KJ) = (mg air jus/mg contoh) x 100 %
WHC dihitung dengan rumus = (1 – KJ/KA) x 100 %
(c) Derajat putih (FMC Corp 1977)
Alat yang digunakan adalah Kett Digital Whiteness2meter model C2100.
Alat ini untuk mengukur tingkat warna putih dari sampel. Prinsipnya melalui
pengukuran indeks refleksi dari permukaan sampel dengan sensor foto dioda.
Semakin putih sampel, cahaya yang dipantulkan semakin banyak. Alat ini
dikalibrasi dengan standar derajat putih yang diperoleh dari asap pembakaran pita
MgO. Contoh ditempatkan dalam satu wadah tertentu, suhu sampel
diseimbangkan dengan meletakkan wadah sampel di atas tester. Wadah sampel
dimasukkan ke tempat pengukuran, sehingga alat menyala. LED akan
menampilkan nilai derajat putih dan nomor urutan pengukuran BaSO4digunakan
sebagai pembanding dengan nilai derajat putih 110%. Nilai derajat putih dihitung
dengan rumus :
Derajat putih (%) = x 100%
(d) Viskositas hidrolisat kitin (Hwang . 1997)
Viskometer terlebih dulu dicuci dengan akuades dan dikeringkan. Larutan
kitin dibuat dalam berbagai konsentrasi dalam pelarut asam asetat aqueous 0,1 M
dan sodium asetat 0,25 M. Masing2masing sampel ditempatkan di dalam
viskometer sejumlah 10 ml.
Secara perlahan sampel ditarik ke labu bagian atas viskometer. Waktu yang
dibutuhkan sampel untuk mengalir antara dua batas yang mengapit labu tersebut
dicatat. Sebagai blanko, digunakan pelarut asam asetat aqueos 0,1 M dan sodium
asetat 0,25 M dan ditentukan viskositasnya dengan cara yang sama. Nilai derajat putih
(e) Viskositas karaginan (FMC Corp 1977)
Viskositas adalah pernyataan tahanan dari suatu cairan untuk mengalir.
Satuan dari viskositas adalah poise (1 poise = 100 cP). Makin tinggi viskositas
menandakan makin besarnya tahanan cairan yang bersangkutan. Larutan sampel
dengan konsentrasi 1,5 % dipanaskan dalam bak air mendidih sambil diaduk
secara teratur sampai suhu mencapai 750C. Viskositas diukur dengan$
- .
(f) Berat molekul (Hwang . 1997)
Dari data viskositas spesifik ditentukan viskositas intrinsik dengan membuat
peta antara ηsp/C terhadap . Viskositas intrinsik adalah titik pada grafik yang
menunjukkan nilai = 0 atau dinyatakan sebagai :
= viskositas intrinsik
= konsentrasi sampel
= viskositas spesifik
Khusus untuk sampel hirolisat kitin diubah menjadi chitosan sebelum analisa
lebih lanjut. Sampel dideasetilasi dengan larutan 50 % NaOH selama 1 jam pada
suhu 110 °C. Deasetilasi dilakukan dua kali untuk memastikan daya larut yang
sempurna. Sampel yang diperoleh kemudian dicuci beberapa kali dengan air
destilasi sampai netral dan mengering.
Berat molekul dihitung dari viskositas intrinsik dengan persamaan Mark2
Houwink sebagai berikut :
/ viskositas intrinsik
. = konstanta untuk solven (tergantung jenis solven)
α = konstanta
/ = berat molekul
Perhitungan berat molekul kitosan menggunakan nilai K = 1,81 x 1023 dan
(2005). Perhitungan berat molekul karaginan menggunakan nilai K = 1,60 x 1022
dan nilai α = 0,748 yang diambil dari literatur Bi . (2007).
(g) Kekuatan gel (FMC Corp 1977)
Larutan contoh 1,6 % dan KCl 0,16 % dipanaskan dalam bak air mendidih
dengan pengadukan secara teratur sampai suhu 80 ºC. Volume larutan dibuat
sekitar 50 ml. Larutan panas dimasukkan ke dalam cetakan berdiameter kira2
kira 4 cm dan dibiarkan pada suhu 10 °C selama 2 jam. Gel dalam cetakan yang
akan bersentuhan dengan gel berada ditengahnya. diaktifkan dan
dilakukan pengamatan. Pembacaan dilakukan saat pegas kembali. Perhitungan
kekuatan gel adalah sebagai berikut :
Kekuatan gel (dyne/cm2) =0 x 980 dyne/cm2
!
Keterangan : 0 = tinggi kurva
S = luas permukaan sensing rod (cm2)
1 g = 980,78 dyne
(h) Titik leleh (Suryaningrum dan Utomo 2002)
Larutan contoh dengan konsentrasi 6,67 % (b/b) disiapkan dengan akuades.
Sampel diunkubasi pada suhu 10 °C selama ± 2 jam. Pengukuran titik leleh
dilakukan dengan cara memanaskan gel karaginan dalan . Di atas gel
karaginan tersebut diletakkan gotri dan ketika gotri jatuh ke dasar gel karaginan
maka suhu tersebut dinyatakan sebagai titik leleh karaginan.
(i) Titik jendal (Suryaningrum dan Utomo 2002)
Larutan contoh dengan konsentrasi 6,67 % (b/b) disiapkan dengan akuades
dalam gelas ukur volume 15 ml. Suhu sampel diturunkan secara perlahan2lahan
dengan cara menempatkan pada wadah yang telah diberi pecahan es. Titik jendal
diukur pada saat larutan karaginan mulai membentuk gel dengan menggunakan
3.4.3 Analisis kimia
(a) Kadar protein (AOAC 1999)
Penentuan kadar protein dilakukan dengan metode mikro Kjeldahl. Contoh
sebanyak 0,75 g dimasukkan ke dalam labu Kjeldahl, kemudian ditambahkan
6,25 g K2SO4 dan 0,6225 g CuSO4 sebagai katalisator. Sebanyak 15 ml H2SO4
pekat dan 3 ml H2O2 secara perlahan2lahan ditambahkan ke dalam labu dan
didiamkan selama 10 menit dalam ruang asam.
Tahap selanjutnya adalah proses destruksi pada suhu 410 °C selama 2 jam
atau hingga didapatkan larutan jernih, didiamkan hingga mencapai suhu kamar
dan ditambahkan 50 – 75 ml akuades. Disiapkan erlenmeyer berisi 25 ml larutan
H3BO3 4 % yang mengandung indikator ( 0,1 dan
0,1 % (2 : 1)) sebagai penampung destilat. Labu Kjeldahl dipasang pada
rangkaian alat destilasi uap. Ditambahkan 50 ml Na2SO4 (alkali). Dilakukan
destilasi dan destilat ditampung dalam erlenmeyer tersebut hingga volume destilat
mencapai 150 ml (hasil destilat berwarna hijau). Destilat dititrasi dengan HCl
0,2 N, dilakukan hingga warna berubah menjadi abu2abu natural. Blanko
dikerjakan seperti tahapan contoh. Pengujian contoh dilakukan triplo. Kadar
protein ditentukan dengan rumus :
Kadar protein (%) = x 100%
Keterangan : A = ml titrasi HCl sampel B = ml titrasi HCl blank
(b) Kadar Lemak (AOAC 1999)
Labu lemak yang telah dikeringkan di dalam oven (105 °C) ditimbang
hingga didapatkan berat tetap (A). Sebanyak 2 g contoh (C) dibungkus dengan
kertas saring bebas lemak kemudian dimasukkan kedalam selongsong lemak.
Selongsong tersebut dimasukkan kedalam tabung Soxhlet. Sebanyak 150 ml
kloroform dimasukkan ke dalam labu lemak. Contoh direfluks selama 8 jam,
setelah pelarut sudah terlihat jernih menandakan lemak sudah terekstrak semua.
Selanjutnya pelarut yang ada pada labu lemak dievaporasi untuk memisahkan (A – B)x normalitas HCl x 14,0007 x 6,25
pelarut dan lemak, kemudian labu lemak dikeringkan dalam oven 105 °C selama
30 menit. Setelah itu ditimbang hingga didapatkan berat tetap (B). Kadar lemak
dihitung dengan rumus:
Kadar lemak (%) = x 100%
(c) Kadar Abu (AOAC 1999)
Penentuan kadar abu didasarkan menimbang sisa mineral sebagai hasil
pembakaran bahan organik pada suhu sekitar 550 °C. Cawan porselin
dikeringkan di dalam oven selama satu jam pada suhu 105 0C, lalu didinginkan
selama 30 menit di dalam desikator dan ditimbang hingga didapatkan berat tetap
(A). ditimbang sampel sebanyak 2 g (B), dimasukkan ke dalam cawan porselin
dan dipijarkan di atas nyala api pembakar bunsen hingga tidak berasap lagi. Hasil
pembakaran dimasukkan ke dalam tanur listrik ( ) dengan suhu 650 °C
selama ± 12 jam. Cawan didinginkan setelah itu selama 30 menit pada desikator,
kemudian ditimbang hingga didapatkan berat tetap (C). kadar abu dihitung
menggunakan rumus :
Kadar abu (%) = x 100%
(d) Penentuan Kadar Air Cara Pengeringan (Thermogravitimetri) (Sudarmadji
2003)
Prinsipnya menguapkan air yang ada dalam bahan dengan jalan pemanasan.
Bahan ditimbang sampai berat konstan yang berarti semua air sudah diuapkan.
Cawan porselin dikeringkan dalam oven selama 30 menit lalu didinginkan dalam
desikator dan ditimbang beratnya (A). Sampel dihaluskan atau dikecilkan
ukurannya sampai homogen, diambil 2 g, dimasukkan ke dalam cawan porselin
dan ditimbang seluruhnya (B). Cawan porselin berisi sampel dimasukkan ke
dalam oven bersuhu 102 °C selama beberapa waktu sampai beratnya konstan
yaitu apabila selisih penimbangan berturut2turut kurang dari 0,2 g (C). Setiap
kali penimbangan cawan porselin berisi sampel didinginkan terlebih dahulu
dalam desikator selama 30 menit. Kadar air dihitung dengan rumus :
(e) Kadar Protein Miofibril (Zhou 2006)
Prinsip penetapan adalah membuang lemak dan protein yang terlarut pada
contoh surimi. Adonan daging contoh ditimbang 3 g (A) dihomogenisasi dalam
30 ml 0,08 M buffer borat dingin pH 7,1 selama 4 menit. Wadah sampel
ditempatkan dalam es. Setiap 20 detik homogenisasi diikuti dengan istirahat
selama 20 detik untuk menghindari kelebihan panas selama ekstraksi. Homogenat
disentrifus pada 8370 g selama 30 menit pada 4 °C. Padatan yang diperoleh
ditimbang (B). Perhitungan kadar protein miofibril menggunakan rumus :
Kadar protein miofibril (%)= x 100%
(f) Pengukuran Nilai pH (Anonim, 1981)
Prinsip penetapan adalah bahwa konsentrasi ion H+ dalam sampel yang
bersifat buffer dapat diukur dengan mengunakan potensiometer atau pH2meter.
Prosedur pengukuran nilai pH adalah sampel yang telah homogen ditimbang
sebanyak 20 g kemudian dimasukkan ke dalam . Hasil homogenisasi
ditambahkan 40 ml akuades dan diblender selama 1 menit, hasilnya dituangkan ke
dalam gelas piala 100 ml. Alat pH meter dikalibrasi dengan larutan buffer standar
yang memiliki pH 7,0 dan pH 4,0 sebelum digunakan. Pembacaan nilai pH
setelah jarum penunjuk pH2meter konstan kedudukannya.
(g) Kadar Sulfat (FMC Corp. 1977)
Prinsip yang dipergunakan adalah gugus sulfat yang telah ditimbang dan
dihidrolisis diendapkan sebagai BaSO4. Contoh ditimbang sebanyak 1 g dan
dimasukkan ke dalam labu erlemeyer yang ditambahkan 50 ml HCl 0,2 N
kemudian direfluks sampai mendidih selama 6 jam sampai larutan menjadi jernih.
Larutan ini dipindahkan ke dalam gelas piala dan dipanaskan sampai mendidih.
Selanjutnya ditambahkan 10 ml larutan BaCl2di atas penangas air selama 2 jam.
Endapan yang terbentuk disaring dengan kertas saring tak berabu dan dicuci
dengan akuades mendidih hingga bebas klorida. Kertas saring dikeringkan ke
dalam oven pengering, kemudian diabukan pada suhu 1000 °C sampai diperoleh B
abu berwarna putih. Abu didinginkan dalam desikator kemudian ditimbang.
Perhitungan kadar sulfat adalah sebagai berikut :
Kadar sulfat (%) = P x 0,4116 x 100%
Berat sampel
Keterangan:
0,4116 = massa atom relatif SO4dibagi dengan massa atom relatif
BaSO4
P = berat endapan BaSO4(g)
$ 0 1 1#*
Rancangan percobaan yang digunakan adalah Rancangan Acak Kelompok
pola faktorial dengan 2 kelompok yaitu hidrolisat kitin dan
karaginan, dengan 3 faktor yaitu :
2 Ukuran (A) : A1 = 150
Surimi dari masing2masing perlakuan disimpan selama 90 hari dan
pengujian dari masing2masing perlakuan akan dilakukan analisis setiap 30 hari.
Masing2masing pengujian diulang 2 kali. Data yang dihasilkan dilakukan
analisis ragam berdasarkan (Steel dan Torrie (1993), model matematik yang
digunakan adalah sebagai berikut:
dimana :
Yijkm = nilai pengamatan dari kelompok ke2m yang memperoleh taraf ke2i dari
faktor A, taraf ke2j dari faktor B, dan taraf ke2k dari faktor C dan ulangan ke2l.
= nilai tengah umum.
Km = Pengaruh kelompok ke2m.
Αi = pengaruh perlakuan mesh size ke2i.
Bj = pengaruh perlakuan konsentrasi ke2j.
Ck = pengaruh perlakuan C ke2k.
ABij = pengaruh interaksi perlakuan A ke2i dan perlakuan B ke2j.
ACik = pengaruh interaksi perlakuan A ke2i dan perlakuan C ke2k.
BCjk = pengaruh interaksi perlakuan B ke2j dan perlakuan C ke2k.
ABCijk = pengaruh interaksi perlakuan A ke2i, perlakuan B ke2j dan perlakuan C
ke2k.
ε
ijklm = pengaruh galat percobaan pada kelompok ke2m yang memperoleh tarafke2i dari faktor A, taraf ke2j dari faktor B, taraf ke2k dari faktor C dan taraf ke2l dari ulangan.
Apabila analisis ragam menghasilkan nilai yang berbeda nyata ( 12*23),
maka dilanjutkan dengan uji beda nyata jujur (BNJ) menggunakan Tukey. Rumus
yang digunakan adalah:
!"#%$&
dimana:
BNJα = nilai beda nyata jujur pada selang kepercayaan α
α = selang kepercayaan 95 %
q = nilai tabel q
p = banyaknya perlakuan
dbs = derajat bebas sisa
S2 = nilai kuadrat tengah sisa
R = banyak ulangan
Pada data uji organoleptik, uji lipat dan uji gigit, data dianalisis dengan metode
Kruskall2Wallis dan jika hasil uji Kruskal2Wallis menunjukkan hasil yang
berbeda nyata, selanjutnya dilakukan uji / atau uji
perbandingan berganda. Rumusan matematika uji Kruskal2Wallis sebagai
dimana:
= nilai statistik
= ukuran contoh ke2i
'
= jumlah peringkat dalam contoh ke2i
= sebaran chi2kuadrat
Analisis ragam dilakukan kembali pada perlakuan terbaik pada setiap
parameter yang dibandingkan dengan komersial (sukrosa 4% dan
sorbitol 4 %) menggunakan pola rancangan acak lengkap faktorial dengan 2 faktor
yaitu jenis sampel dan penyimpanan. Apabila hasilnya berbeda nyata dilanjutkan
dengan Uji lanjut Tukey dan model matematika sebagai berikut :
Yijk= + Αι+ Βj+ (AB)ij+
ε
ijkdimana:
Yijk = nilai pengamatan ke2i dari faktor A, taraf ke2j dari faktor B dan
ulangan ke2k. = nilai tengah umum.
Αi = pengaruh perlakuan jenis ke2i.
Bj = pengaruh perlakuan konsentrasi ke2j.
ABij = pengaruh interaksi perlakuan A ke2i dan perlakuan B ke2j.
ε
ijk = pengaruh galat percobaan pada taraf ke2i dari faktor A, taraf ke2j dari(& (
% ! ! !#2
4.1.1 Karakteristik fisiko2kimia hidrolisat kitin
Pada penelitian ini melakukan pemanfaatan limbah udang khusus kulitnya
untuk diolah menjadi hidrolisat kitin (HK). Karakteristik kimia dan fisika
hidrolisat kitin 150 dan 300 (MS) disajikan pada Tabel 4.
Tabel 4 Hasil karakterisasi hidrolisat kitin ukuran 150 dan 300
Parameter Standar mutu (*) Ukuran ( )
150 300
2 Sumber : *Somjid (2005)
2 Angka2angka pada baris yang sama untuk masing2masing parameter yang diikuti huruf berbeda (a dan b) menunjukkan berbeda nyata (p<0,05)
Kulit udang mengandung protein yang terikat secara fisik dan kovalen (Lee
dan Tan 2002), lemak terikat dengan protein atau lipoprotein (Emmawati 2005),
dan pigmen (42keto dan turunan tiga 4,4’2 diketo2β2karoten) terikat kompleks
bersama kitin (Kim 2004). Bastaman (1989) menambahkan bahwa kandungan
mineral 30 – 50% (berat kering), komposisi yang utamanya adalah kalsium
karbonat.
Proses penyaringan bertahap yaitu 150 dan 300 berpengaruh nyata
menurunkan kadar protein dan abu serta meningkatkan derajat putih hidrolisat
kitin, tetapi tidak berpengaruh terhadap nilai kadar lemak, berat molekul dan
viskositas. Penurunan kadar protein, abu (mineral), lemak dan pigmen diduga
karena masih terikat pada hidrolisat kitin ukuran 150 sehingga tertahan
saat disaring dengan nilon 300
Kadar protein, lemak dan abu hidrolisat kitin masih berada di bawah standar
Tinggginya kandungan abu (mineral) menurunkan kelarutan dari hidrolisat kitin
sehingga nilai berat molekul yang dihitung berdasarkan nilai viskositas menjadi
rendah.
4.1.2 Karakteristik fisiko2kimia karaginan
Larutan KOH yang diberikan selama proses ekstraksi mampu bereaksi
dengan gugus sulfat di dalam karaginan (K) membentuk garam K2SO4 dan asam
sulfat, kadar sulfat semakin menurun dengan meningkatnya konsentrasi larutan
KOH yang diberikan selama proses ekstraksi (Basmal 2003). Kandungan
sulfat menghasilkan gaya tolak menolak antar grup sulfat yang bermuatan negatif
disepanjang rantai polimernya menyebabkan rantai polimer kaku dan tertarik
kencang. Sifat hidrofilik menyebabkan molekul tersebut dikelilingi oleh air yang
tidak bergerak, dan hal inilah yang menyebabkan nilai viskositas karaginan
meningkat (Imeson 2000). Komposisi kimia dan fisika karaginan 150 dan
300 MS disajikan pada Tabel 5.
Tabel 5 Hasil karakterisasi karaginan ukuran 150 dan 300 MS
Parameter Standar mutu Ukuran (mesh size)
150 300
2 Sumber : Syamsuar (2006)
2 Angka2angka pada baris yang sama untuk masing2masing parameter yang diikuti huruf berbeda (a dan b) menunjukkan berbeda nyata (p<0,05)
Nilai kekuatan gel, titik leleh dan jendal masih di bawah standar mutu karena
ekstraksi karaginan dengan KOH konsentrasi 0,5 % belum optimal meningkatkan
kandungan galaktosa sebagai pembentuk gel. Namun dengan rendahnya kadar
sulfat dapat meningkatkan nilai viskositas karaginan. Suryaningrum (2003)
telah meneliti kekuatan gel karaginan dapat mencapai di atas 1.000 g/cm2
Kandungan 3,62anhidro galaktosa berbanding lurus dengan suhu
pembentukan gel dan titik leleh. Kandungan 3,62anhidro galaktosa akan
menyebabkan sifat beraturan dalam polimer karaginan dan sebagai akibatnya akan
mempertinggi potensi pembentukan heliks rangkapnya sehingga suhu
pembentukan gel lebih cepat tercapai, namun adanya sulfat cenderung
menyebabkan polimer dalam bentuk sol, sehingga titik gel makin sulit dicapai
(Moirano 1977).
Karaginan melalui proses penyaringan bertingkat (150 dan 300 )
mampu dengan nyata mengurangi kadar sulfat dan abu serta meningkatkan nilai
titik jendal dan berat molekul, tetapi terhadap parameter derajat putih dan
viskositas tidak memberikan pengaruh nyata. Umumnya nilai parameter berada di
bawah standar mutu kecuali nilai viskositas yang masih pada kisaran standar.
Selama proses penyaringan, larutan yang belum disaring harus dalam kondisi
panas agar tidak terbentuk gel. Proses penyaringan yang lama menyebabkan
larutan yang belum disaring menjadi dan terbentuk kerak di dasar tanur.
Hal ini mengakibatkan tingginya kandungan abu dan rendahnya nilai derajat putih
karaginan.
% ! ! ( ! ! & ) )! "
Selama penyimpanan beku terjadi perubahan karakteristik dari surimi.
Karakteristik surimi yang dianalisis pada penelitian ini meliputi fisika, kimia,
organoleptik, uji lipat dan uji gigit.
4.2.1 Karakteristik fisika surimi ikan manyung
Analisis untuk karakteristik fisika surimi terdiri atas analisa rendemen, uji
organoleptik penampakan dan uji WHC surimi.
(a) Analisis rendemen surimi
Ikan manyung yang diproses pada penelitian ini mendapatkan surimi dengan
rendemen 26,67 %. Rendemen produk terhadap daging utuh pada tahapan proses
pengolahan surimi sebagai berikut : 50,58 %, daging cincang
Toyoda (1992) mengemukakan bahwa rendemen produk surimi
terhadap ikan bahan bakunya dipengaruhi oleh jenis, ukuran dan kondisi biologi
ikan (musim) dan juga cara dan peralatan yang digunakan. Pada dasarnya
semakin tinggi rendemen secara ekonomis lebih menguntungkan.
(b) Uji sensori surimi beku
Prinsip analisis uji sensori adalah menilai adanya benda2benda asing selain
daging ikan seperti potongan tulang, jaringan ikat, sisik dan benda asing pada
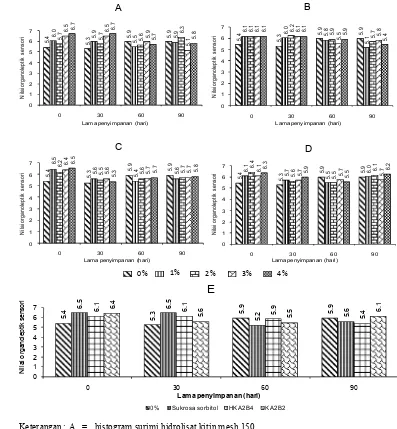
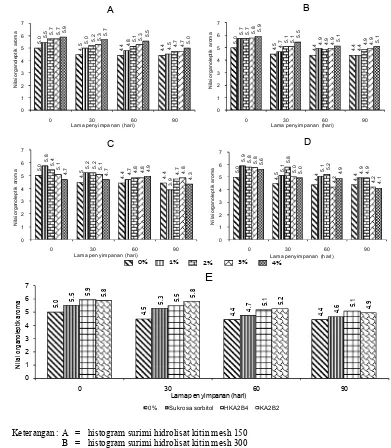
surimi selama penyimpanan beku. Gambar 8 dan Lampiran 5a disajikan nilai uji
sensori surimi ikan manyung selama penyimpanan beku.
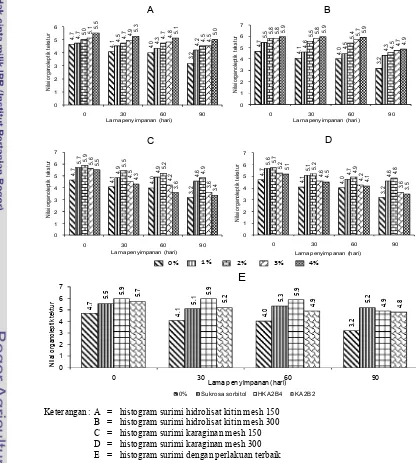
Jenis , ukuran dan penambahan konsentrasi 1 sampai 4% tidak
berpengaruh terhadap nilai sensori surimi (Lampiran 5c). Warna putih dari
hidrolisat kitin yang membaur dan karaginan yang larut dalam surimi tidak
memberikan perbedaan pada sensori surimi. Nilai sensori umumnya berada pada
kisaran 5 sampai 7 atau masih adanya serat pada surimi (Gambar 8). Rendahnya
nilai sensori surimi karena berasal dari daging surimi saja, diduga hal ini
disebabkan pada proses pengolahan tidak dilakukan penapisan ( ).
Penapisan bertujuan untuk menghilangkan sisa2sisa sisik, jaringan ikat, membran
dan duri2duri halus yang tertinggal agar didapatkan surimi bermutu baik
(BPPMHP 2001). Proses ini dilakukan setelah tahap dan pengepresan.
Selama penyimpanan umumnya terjadi penurunan terhadap nilai sensori,
namun pada perlakuan tanpa mengalami kenaikan nilai.
Denaturasi jaringan ikat terjadi yang dinilai dari penurunan jumlah serat pada
surimi kontrol negatif ini. Hal ini mengindikasikan bahwa penambahan
selain dapat menahan laju denaturasi protein miofibril juga dapat
Keterangan : A = histogram surimi hidrolisat kitin mesh 150 B = histogram surimi hidrolisat kitin mesh 300 C = histogram surimi karaginan mesh 150 D = histogram surimi karaginan mesh 300 E = histogram surimi dengan perlakuan terbaik
Gambar 8 Histogram nilai sensori surimi selama penyimpanan beku
(c) Kapasitas mengikat air/ (WHC)
Kapasitas mengikat air atau (WHC) pada bahan
pangan merupakan kemampuan untuk mempertahankan kandungan air dalam
pangan dengan kata lain sifat fisik dan kemampuan struktur pangan mencegah air
!
"
# $ % $ &' (
" "
# $ % $ &' (
"
# $ % $ &' (
)
# $ % $ &' (
*
keluar dari struktur 3 dimensi protein (Zayas 1997). Hasil uji WHC terhadap
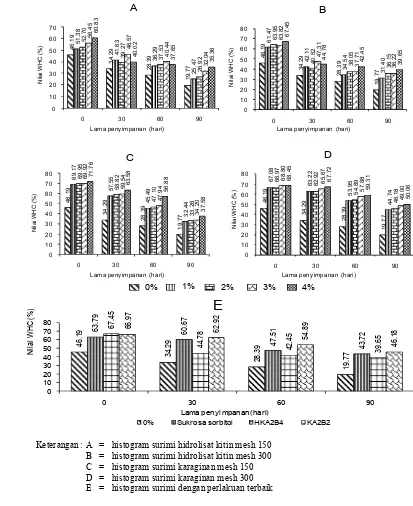
surimi ikan manyung dapat dilihat pada Lampiran 6a.
Selama penyimpanan beku surimi, terjadi penurunan nilai WHC dan kadar
protein miofibril terkait masih terjadinya proses denaturasi (Gambar 9). Bio2
dengan jenis, ukuran dan konsentrasi berbeda yang ditambahkan
dalam surimi berpengaruh nyata dalam menghambat laju denaturasi protein
miofibril selama penyimpanan beku, sehingga dapat mempertahankan air terikat
dan mengurangi air bebas yang keluar saat . Hasil ini dapat dilihat dari
nilai WHC lebih tinggi pada surimi penambahan dibandingkan
dengan yang tanpa penambahan ( 12*23) (Lampiran 6c). Lanier (1992)
menjelaskan bahwa molekul akan bereaksi dan mengikat molekul
protein melalui gugus fungsional, khususnya gugus anion yang akan
menimbulkan suatu gaya ikatan dengan protein dan meningkatkan daya ikat air
antara protein dengan melalui gugus anion yang
lain.
Penambahan bio2 dengan ukuran 300 mempunyai
nilai WHC yang lebih tinggi daripada 150 karena berhubungan dengan
luas permukaan, ukuran 300 MS lebih luas daripada 150 MS. Ukuran bio2
300 MS diduga partikelnya lebih kecil sehingga memperluas area
dalam penyerapan air dalam bahan.
Kemampuan bio2 mengikat air semakin meningkat seiring
dengan bertambahnya konsentrasi pada surimi, sehingga pada konsentrasi 4 %
menghasilkan nilai WHC tertinggi selama penyimpanan beku. Hidrolisat kitin
dengan ukuran 300 MS konsentrasi 4 % lebih optimal dalam meningkatkan nilai
WHC surimi. Karaginan 300 MS dengan konsentrasi 4 % juga lebih efektif
dalam mempertahankan kandungan air surimi selama penyimpanan beku, tetapi
kondisi pH pada surimi perlakuan ini berada pada kondisi alkali. Kondisi pH dari
perlakuan karaginan 300 MS 2 % dapat optimal dalam pembentukan gel sehingga
dipilih sebagai perlakuan terbaik.
Yamashita (2003) melaporkan bahwa penambahan konsentrasi
hidrolisat kitin dari 2,5 – 12,5 % seiring dengan menurunnya
pada konsentrasi 5,0 – 7,5 %. Hasil ini mengindikasikan hidrolisat kitin menahan
air dalam miofibril dan meningkatkan jumlah air tak terbekukan.
Keterangan : A = histogram surimi hidrolisat kitin mesh 150 B = histogram surimi hidrolisat kitin mesh 300 C = histogram surimi karaginan mesh 150 D = histogram surimi karaginan mesh 300 E = histogram surimi dengan perlakuan terbaik
Gambar 9 Histogram nilai WHC surimi selama penyimpanan beku
Dibandingkan dengan perlakuan penambahan sukrosa sorbitol
( komersial), penggunaan karaginan 300 MS pada konsentrasi 2 %
sebagai perlakuan terpilih (terbaik) secara signifikan memberikan nilai WHC
tertinggi selama penyimpanan beku. Karaginan mempunyai sifat yang mudah
larut dalam air dan diduga karena mempunyai partikel yang kecil sehingga
permukaan untuk mengikat air lebih luas. Karaginan mempunyai gugus sulfat
bermuatan negatif dan bersifat hidrofilik, sehingga dapat mengikat air atau gugus
hidroksil lainnya, dan dapat menahan keluarnya air bebas dalam bahan (Moirano
1977).
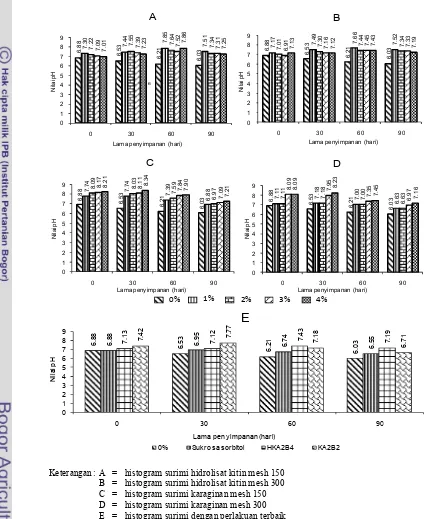
4.2.2 Karakteristik kimia surimi ikan manyung
Sifat kimia surimi merupakan salah satu indikator kemapuannya dalam
pembentukan gel setelah dibuat menjadi kamaboko. Karakteristik kimia yang
dianalisis meliputi kadar protein, kadar air, kadar protein miofibril dan nilai pH.
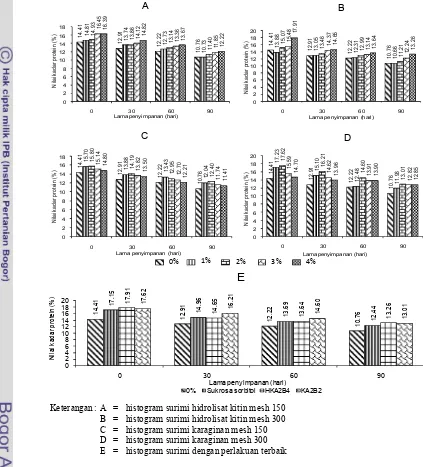
(a) Kadar protein
Penambahan bio2 berpengaruh nyata dalam menghambat laju
denaturasi protein selama penyimpanan beku karena kadar protein lebih tinggi
dari surimi tanpa ( 12*23) (Lampiran 7c). Kadar protein surimi
pada seluruh perlakuan tanpa dan dengan mengalami penurunan
yang mengindikasikan denaturasi protein terjadi selama penyimpanan beku
(Gambar 10; Lampiran 7a). Penurunan kadar protein berkorelasi positif dengan
peningkatan kadar air surimi. Kandungan air bebas dalam surimi berpotensi
terjadinya pembentukan kristal es selama penyimpanan beku yang mengakibatkan
pengumpulan molekul2molekul protein. Pembentukan kristal es akan menghambat
sistem pengikatan hidrogen dan pembukaan zona hidrofobik (Park 2000),
sehingga banyak protein yang hilang bersama air pada saat pencairan dingin atau
(Zhou 2006).
Penambahan konsentrasi hidrolisat kitin berdampak positif dengan terjadinya
peningkatan kadar protein surimi, tetapi pada karaginan terjadi penurunan kadar
protein setelah konsentrasi 3 %. Hidrolisat kitin 300 MS 4% dan karaginan 300
MS 2 % mempunyai nilai tertinggi pada masing2masing kelompok dalam
sorbitol mempunyai kemampuan yang sama dalam mempertahankan stabilitas
protein surimi selama penyimpanan beku (Lampiran 7f).
Keterangan : A = histogram surimi hidrolisat kitin mesh 150 B = histogram surimi hidrolisat kitin mesh 300 C = histogram surimi karaginan mesh 150 D = histogram surimi karaginan mesh 300 E = histogram surimi dengan perlakuan terbaik
Gambar 10 Histogram nilai kadar protein surimi selama penyimpanan beku
Somjit . (2005) mengemukakan bahwa air bebas dalam jaringan tiga
dimensi protein miofibril diikat oleh hidrolisat kitin. Residu OH hidrofilik yang
terlepas dari rantai utama kitin berperan penting dalam interaksi hidrolisat2
protein2air. Hidrolisat kitin menstabilkan molekul air di sekeliling protein dengan
cara berikatan dengan air dan mengubah air bebas menjadi air terikat. Hidrolisat
kitin mengikat air dalam struktur 3 dimensi protein dan menstabilkan struktur
molekul protein selama proses penyimpanan beku.
(b) Kadar air
Kimura (1991) mengemukakan sisi2sisi anion dan kation rantai molekul
protein miofibril jumlahnya tidak memadai untuk mengikat air pada saat proses
pembekuan, sehingga sebagian besar air bebas tertarik keluar dari struktur ikatan
protein miofibril membentuk kristal. Pada saat air lelehan dari kristal es
tidak dapat kembali ke struktur ikatan protein miofibril keluar sebagai air .
Hasil kadar air surimi selama penyimpanan beku dapat dilihat pada Lampiran 8a.
Lonergan dan Lonergan (2005) mengemukakan bahwa protein miofibril
mempunyai porsi berkisar 82 – 87 % dalam menyusun sel daging. Kandungan air
daging diperkirakan sekitar 85 % terdapat dalam miofibril. Air tertahan dengan
gaya kapiler oleh filamen tebal dan tipis dalam miofibril. Denaturasi protein
miofibril selama penyimpanan beku mengakibatkan meningkatnya kadar air
karena berkurangnya kemampuan miofibril menahan air di dalam jaringannya.
Santoso (2008) melaporkan degradasi protein miofibril menyebabkan ruang
diantara jaringan akan semakin menyempit sehingga jumlah air yang terikat
(terperangkap) akan semakin berkurang.
Penambahan bio2 dengan jenis, ukuran dan konsentrasi
berpengaruh nyata dalam menurunkan air bebas yang dapat keluar dari bahan saat
pencairan ( 12*23) dari perlakuan 0 %). Peningkatan konsentrasi bio2
menyebabkan penurunan signifikan kadar air pada setiap taraf
konsentrasi bio2 (Lampiran 8d). Semakin banyak air yang dapat
Keterangan : A = histogram surimi hidrolisat kitin mesh 150 B = histogram surimi hidrolisat kitin mesh 300 C = histogram surimi karaginan mesh 150 D = histogram surimi karaginan mesh 300 E = histogram surimi dengan perlakuan terbaik
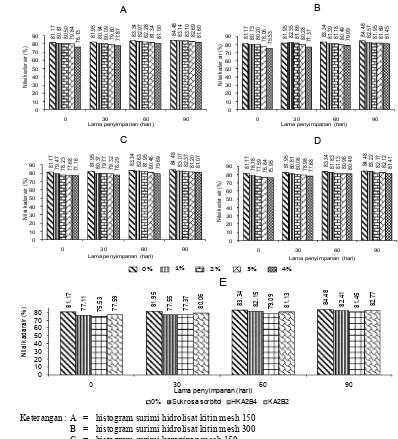
Gambar 11 Histogram nilai kadar air surimi selama penyimpanan beku
Kadar air selama penyimpanan beku pada setiap perlakuan baik kontrol tanpa
penambahan , kontrol dengan penambahan sukrosa sorbitol,
hidrolisat kitin maupun karaginan semakin meningkat seiring dengan
bertambahnya waktu penyimpanan. Lama penyimpanan beku 90 hari, kadar air
surimi masih pada kisaran kondisi daging , yang dapat digunakan untuk
pengolahan produk akhir surimi (Lampiran 8f). Park (2000) mengemukakan
pengurangan kadar air surimi setelah pencucian berkisar antara 82 – 85 %, sesuai
dengan kondisi daging .
Hidrolisat kitin 300 MS konsentrasi 4 % mempunyai kemampuan menahan
air terbaik dibandingkan dengan karaginan 300 MS konsentrasi 4 % dan sukrosa
sorbitol (p<0,05), dilihat dari rendahnya kadar air surimi hidrolisat kitin selama
penyimpanan beku. Knorr (1984) mengemukakan bahwa sifat kitin yang penting
untuk aplikasinya adalah kemampuannya mengikat air karena terdapat gugus
hidrofobik dan hidrofilik. Struktur polar kitin terdispersi membentuk misel dan
ekor hidrokarbonnya tersembunyi di sebelah dalam membentuk fase hidrofobik,
sedangkan fase hidrofilik ada di sebelah luar.
(c) Kadar protein miofibril
Protein miofibril meliputi miosin, aktin, tropomiosin dan troponin merupakan
bagian terbesar dari protein otot ikan, dan dapat terekstraksi atau larut pada
larutan garam NaCl 0,5 M. Tekstur produk ikan dan kemampuan membentuk gel
pada daging ikan cincang dan surimi dipengaruhi oleh perubahan2perubahan yang
terjadi pada protein ini (Shahidi 1999). Pada Lampiran 9a disajikan data
tentang kadar protein miofibril surimi ikan manyung selama penyimpanan beku.
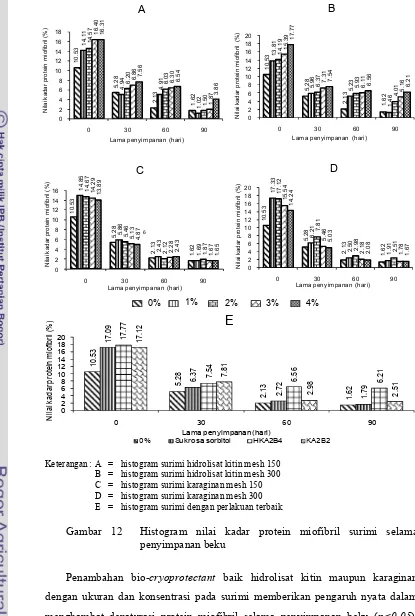
Selama penyimpanan beku surimi terjadi penurunan kadar protein miofibril
( 12*23) (Lampiran 9d). Xiong (2009) menjelaskan bahwa penurunan
kadar protein miofibril merupakan indikator dari denaturasi protein selama
penyimpanan beku disebabkan oleh pembentukan hidrogen dan ikatan
hidropobik. Santoso (2008) melaporkan bahwa penurunan protein miofibril
selama penyimpanan diduga disebabkan aktivitas enzim proteinase seperti
katepsin D, kalpain dan alkali proteinase yang banyak terdapat pada protein
sarkoplasma. Pada pembuatan surimi, proses pencucian daging lumat tidak dapat
Keterangan : A = histogram surimi hidrolisat kitin mesh 150 B = histogram surimi hidrolisat kitin mesh 300 C = histogram surimi karaginan mesh 150 D = histogram surimi karaginan mesh 300 E = histogram surimi dengan perlakuan terbaik
Gambar 12 Histogram nilai kadar protein miofibril surimi selama
penyimpanan beku
Penambahan bio2 baik hidrolisat kitin maupun karaginan
dengan ukuran dan konsentrasi pada surimi memberikan pengaruh nyata dalam
menghambat denaturasi protein miofibril selama penyimpanan beku ( 12*23).