APLIKASI METABOLOMIK UNTUK MENGIDENTIFIKASI
KOMPONEN BIOAKTIF: KOMPONEN ANTIBAKTERI
DARI EKSTRAK BUAH TAKOKAK
(
Solanum torvum
Swart)
Wahyu Haryati Maser
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA *
Dengan ini saya menyatakan bahwa tesis berjudul Aplikasi Metabolomik untuk Mengidentifikasi Komponen Bioaktif: Komponen Antibakteri dari Ekstrak Buah Takokak (Solanum torvum Swart) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014 Wahyu Haryati Maser NIM F251110041
RINGKASAN
WAHYU HARYATI MASER. Aplikasi Metabolomik untuk Mengidentifikasi Komponen Bioaktif: Komponen Antibakteri dari Ekstrak Buah Takokak (Solanum torvum Swart). Dibimbing oleh NURI ANDARWULAN dan NANCY DEWI YULIANA.
Buah takokak (Solanum torvum Swartz) merupakan sayuran lokal yang sering dikonsumsi oleh masyarakat Jawa Barat dan telah banyak digunakan sebagai obat tradisional di Indonesia. Buah takokak telah dilaporkan oleh medis dan diketahui secara tradisional dapat digunakan untuk anti-edemik, analgesik, mengurangi rasa sakit, antitusif, anti-inflamasi, sakit perut, sakit gigi, katarak, gangguan menstruasi, wasir, influenza, bengkak, bisul, nyeri, sakit pinggang, asam urat tinggi, tulang keropos, jantung berdebar-debar, dan detoksifikasi (Andarwulan et al. 2012).
Beberapa penelitian menununjukkan tanaman takokak memiliki aktivitas antibakteri (Chah et al. 2000, Bari et al. 2010, Sivapriya et al. 2011). Namun, identifikasi komponen aktif antibakteri dari buah takokak belum dilakukan. Dengan demikian, perlu adanya penelitian mengenai identifikasi komponen aktif yang memiliki aktivitas antibakteri dari buah takokak. Metode yang umum digunakan untuk mengidentifikasi komponen aktif yaitu bioassay guided isolation. Metode ini memerlukan biaya dan waktu yang cukup lama sehingga diperlukan metode baru. Pendekatan metabolomik merupakan metode alternatif dalam mengidentifikasi komponen bioaktif. Metode ini dilakukan dengan ekstraksi dan fraksinasi sampel secara komprehensif dengan menggunakan kombinasi pelarut pada tingkat kepolaran yang berbeda (Yuliana et al. 2011).
Pada tahap persiapan sampel buah takokak (Solanum torvum Swartz) diketahui hasil total tepung sebanyak 376 gram dari 4507,5 gram buah takokak segar. Jumlah ekstrak dan fraksi yang dihasilkan yaitu ekstrak M sebesar 5,62 gram, fraksi H sebesar 3,09 gram, fraksi K sebesar 1,37 gram, fraksi E sebesar 2,59 gram, dan fraksi A sebesar 11,78 gram. Hasil pengujian aktivitas antibakteri menunjukkan daya hambat (DIZ) pertumbuhan bakteri Staphylococcus aureus dengan konsentrasi 340-370 mg/ml diketahui pada fraksi K rata-rata sebesar 6,67 mm dan ekstrak M rata-rata sebesar 4,33 mm. Sedangkan hasil pengujian KLT menunjukkan bahwa pada ekstrak M terdapat 6 bercak, fraksi H terdapat 1 bercak, fraksi K terdapat 10 bercak, fraksi E terdapat 3 bercak, dan fraksi A terdapat 1 bercak. Hasil bercak KLT tersebut diduga terdapat komponen steroid pada buah takokak. Untuk mengetahui lebih lanjut, dilakukan pencarian jenis komponen aktif dengan menggunakan HPLC dan LCMS.
berkolerasi signifikan dengan aktivitas antibakteri dengan nilai Y related coefficient positif.
Pada X varian plot menunjukkan penyebaran peak area pada selang waktu retensi 17,76-18,08 menit dominan pada fraksi K. Fraksi K ulangan 4 yang diukur pada serapan UV λ = 310 nm merupakan fraksi yang memiliki peak area tertinggi. Fraksi ini yang digunakan untuk tahapan preparasi dengan menggunakan HPLC semi-preparatif. Hasil preparasi selanjutnya digunakan untuk identifikasi komponen bioaktif dengan LC-MS. Hasil identifikasi komponen bioaktif dengan LC-MS diketahui bahwa Torvoside A, Torvoside G, dan Torvoside H merupakan komponen yang diduga memiliki aktivas antibakteri pada bakteri Staphylococcus aureus.
SUMMARY
WAHYU HARYATI MASER. Metabolomic Application for Identification Bioactive Components: Antibacterial Components from Takokak Fruit Extracts (Solanum torvum Swart). Under supervised by NURI ANDARWULAN and NANCY DEWI YULIANA.
Solanum torvum Swartz, commonly known as Takokak, has been traditionally used in Indonesia to cure several diseases. Fruits of Solanum torvum Swartz are used to cure anti-edemic, as analgesic, to improve blood circulation, to alleviate pain, as antitusive, as anti-inflammatory, to relieve stomach pain, toothache, cataracts, menstruation disorders, hemorrhoids, sore breasts, influenza, swelling, ulcers, soreness, sore waist, high uric acid, bone loss, heart palpitations, and for detoxification (Andarwulan et al. 2012).
The antibacterial activity of Takokak fruit has been reported as well (Chah et al. 2000, Bari et al. 2010, Sivapriya et al. 2011). However, up to now no reports yet on compounds responsible for takokak’s antibacterial activity. Metabolomics has been found to be more efficient for identification tool of active principles in a complex mixture such as plant extract than the conventional way, which is known as bioassay guided isolation. To achieve this, a specific extraction method that is able to extract the widest possible range of metabolites, and a suitable analytical tool to detect them are required (Yuliana et al. 2011).
From 4507,5 g fresh Takokak fruits 376 g dried powder was obtained. Extraction and fractionation with diverse polarity of solvents gave 5,62 g of methanol extract (M), 3,09 g of n-hexane fraction (H), 1,37 g of chloroform fraction (K), 2,59 g of ethyl acetate fraction (E), and 11,78 g of water fraction (A). The result of antibacterial activity indicated that among all the tested extracts and fractions, M extract and K fraction exhibited medium antibacterial activity against Staphylococcus aureus while others did not. Inhibition zone diameters of M extract were between 4-4,5 mm and K fraction were between 6,5–6,8 mm. The results of TLC showed 6 spots of M extract, 1 spot of H fraction, 10 spots of K fraction, 3 spots of E fraction, and 1 spot of A fraction. The TLC spots appearance (blue fluorescence in UV 366 and 254 nm) suggested that steroid components are probably the active components of Takokak fuit. Furthermore analysis to provide chemical compoisition of the extract and fractions was conducted by with HPLC.
In further analysis, we used X varian plot to identify the extract or the fraction where the peak of 17,76 – 18,08 min retention time was dominant. It was discovered that the peak was dominant in fractions K measured at UV λ = 310 nm. Therefore, we chose this fraction for further bioactive identification step with semi-preparative HPLC and LC-MS analysis. The peaks were identified as Torvoside A, Torvoside G, and Torvoside H, three steroidal glycosides. Torvoside A, Torvoside G, and Torvoside H were shown to be abundant in Solanum torvum Swartz fruits active fraction which against Staphylococcus aureus, indicating that Torvoside A, Torvoside G, and Torvoside H might be the responsible compounds for antibacterial activity of the fraction.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
APLIKASI METABOLOMIK UNTUK MENGIDENTIFIKASI
KOMPONEN BIOAKTIF: KOMPONEN ANTIBAKTERI
DARI EKSTRAK BUAH TAKOKAK
(
Solanum torvum
Swart)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Aplikasi Metabolomik untuk Mengidentifikasi Komponen Bioaktif: Komponen Antibakteri dari Ekstrak Buah Takokak (Solanum torvum Swart)
Nama : Wahyu Haryati Maser NIM : F251110041
Disetujui oleh Komisi Pembimbing
Dr Nancy Dewi Yuliana, STP MSc Anggota
Diketahui oleh
Prof Dr Ir Nuri Andarwulan, Ms Ketua
Ketua Program Studi Ilmu Pangan
Dekan Sekolah Pascasarjana
Prof Dr Ir Ratih Dewanti-Hariyadi, MSc Tanggal ujian: 22 Januari 2014
PRAKATA
Puji dan syukur penulis ucapkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil penulis selesaikan. Judul penelitian yang dilaksanakan sejak bulan November 2012 ini adalah Aplikasi Metabolomik untuk Mengidentifikasi Komponen Bioaktif: Komponen Antibakteri dari Ekstrak Buah Takokak (Solanum torvum Swart).
Penghargaan dan ucapan terima kasih penulis ucapkan kepada Prof Dr Ir Nuri Andarwulan, Ms, dan Dr Nancy Dewi Yuliana, STP MSc selaku pembimbing, atas kesabaran dan keikhlasan memberikan bimbingan, nasehat, arahan, dan dorongan mulai dari penulisan proposal, selama pelaksanaan penelitian berlangsung hingga selesainya penulisan tesis ini. Ucapan terima kasih pula penulis sampaikan kepada Dr Ing Dase Hunaefi, STP MfoodST, Dr rer nat Anis H. Mahsunah, MSc, dan Dr Danang Waluyo yang telah banyak memberi saran.
Teristimewa penulis ucapkan terima kasih kepada kedua orangtua tercinta, ayah Mas’ud, AMaPd dan ibu Ermi atas limpahan kasih sayang dan do’a yang tulus, pengorbanan serta dukungan moril maupun materi yang diberikan kepada penulis. Kepada kakak-kakak penulis, Silvia Elsih Maser, SKM dan Brigadir Istifhar Maser serta seluruh keluarga besar di Pekanbaru, atas segala do’a dan kasih sayangnya.
Penghargaan dan terima kasih kepada para dosen dalam lingkup departemen Ilmu dan Teknologi Pangan dan Ilmu Pangan IPB atas ilmu yang penulis dapatkan selama ini. Terima kasih pula penulis sampaikan kepada mitra selama penelitian Hilda Utami Anwar, STP, Indri Indrawan, STP Msi, dan Ria Noviar, STP atas dukungan dan kebersamaannya yang tak terlupakan, teman-teman seperjuangan IPN 2011 atas semangat kebersamaan selama menempuh pendidikan bersama. Di samping itu, penulis sampaikan terima kasih kepada Bu Sekaryati dan para petani di Kampung Konservasi TOGA Bina Sehat Lestari di Gunung Leutik, Desa Benteng, Ciampea-Bogor dan peneliti serta teknisi dari Laboratorium SEAFAST IPB, Laboratorium ITP IPB, dan Laboratorium BPPT Biotek Serpong atas bantuan selama proses penelitian.
Ucapan terima kasih penulis sampaikan kepada USAID (United States Agency for International Development) dan DIKTI (Dirjen Pendidikan Tinggi) Indonesia yang telah mendanai penelitian ini. Selain itu, terima kasih penulis juga ucapkan kepada penyelenggara Beasiswa Unggulan DIKTI dan teman-teman penerima BU DIKTI Nasional serta teman-teman pengurus Yayasan Rubi Indonesia atas dukungan dan semangatnya. Terimakasih juga tak lupa penulis sampaikan kepada para ustadz dan ustadzah pembina Rumah Qur’an IPB serta teman-teman RQ IPB atas kebersamaan, do’a dan dukungannya. Kepada semua pihak yang telah membantu yang tak dapat dituliskan satu persatu, semoga Allah subhanahu wa ta’ala berkenan membalas setiap kebaikan itu dengan balasan yang lebih baik. Aamiin.
Wahyu Haryati Maser Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xii
1. PENDAHULUAN
Latar Belakang 1
Research Questions 2
Tujuan Penelitian 2
2. TINJAUAN PUSTAKA
Buah Takokak (Solanum torvum Swartz) 2
Komponen Senyawa Antibakteri dari Tumbuhan 4
Metabolomik 7
KLT, HPLC, dan LC-MS 9
3. BAHAN DAN METODE
Bahan dan Alat 10
Metode Penelitian 10
Persiapan Sampel Buah Takokak 11
Uji Kadar Air (AOAC 2000) 11
Ekstraksi dan Fraksinasi Buah Takokak 12
Uji Aktivitas Antibakteri Ekstrak dan Fraksi Buah Takokak 13 Uji KLT Ekstrak dan Fraksi Buah Takokak 13 Analisis Profil Kimia Ekstrak dan Fraksi Buah Takokak dengan
HPLC 14
Identifikasi Komponen Bioaktif dengan LC-MS 15 4. HASIL DAN PEMBAHASAN
Persiapan Sampel Buah Takokak 15
Ekstraksi dan Fraksinasi Buah Takokak 16
Uji Aktivitas Antibakteri Ekstrak dan Fraksi Buah Takokak 16
Uji KLT Ekstrak dan Fraksi Buah Takokak 18
Analisis Profil Kimia Ekstrak dan Fraksi Buah Takokak dengan HPLC 19 Identifikasi Komponen Bioaktif dengan LC-MS 22 5. KESIMPULAN DAN SARAN
Kesimpulan 25
Saran 25
DAFTAR PUSTAKA 25
LAMPIRAN 29
DAFTAR TABEL
1. Hasil-hasil penelitian mengenai komponen bioaktif dari tanaman takokak 5 2. Kombinasi pelarut yang digunakan untuk uji eluen pada uji KLT 13 3. Kombinasi fase gerak selama proses elusi untuk analisis profil kimia. A =
larutan asam asetat 0,1% dan B = asetonitril. 14 4. Kombinasi eluen yang digunakan untuk identifikasi komponen bioaktif.
A = larutan asam format 0,1% dan B = asetonitril + asam format 0,1%. 15 5. Hasil uji aktivitas antibakteri ekstrak dan fraksi buah takokak. M =
pelarut metanol 80 %, H = pelarut n-heksan, K = pelarut kloroform, E =
pelarut etil asetat, dan A = pelarut air. 17
DAFTAR GAMBAR
1. Buah takokak 3
2. Diagram alir penelitian identifikasi komponen aktif dengan menggunakan pendekatan metabolomik pada buah takokak. 11
3. Diagram alir fraksinasi buah takokak. 12
4. Contoh penghambatan pertumbuhan bakteri Staphylococcus aureus, (1) Fraksi K (hijau), kloramfenikol sebagai kontrol positif (bening bagian bawah), dan DMSO sebagai kontrol negatif (keruh pada bagian atas), (2) ekstrak M (hijau bawah), fraksi A (keruh hijau kanan atas) dan,
fraksi E (keruh hijau kiri atas). 16
5. Contoh hasil KLT fraksi K buah takokak dengan 5 kali ulangan pada λ
= 254 nm (A), dan λ = 366 nm (B). 19 6. Contoh kromatogram fraksi K buah takokak pada serapan UV 310 nm
dengan nilai Y menunjukkan peak area (mAU) dan nilai X waktu
retensi (menit). 19
7. Score plot pada berbagai ekstrak dan fraksi yang aktif ditunjukkan pada bagian kanan dan fraksi yang tidak aktif ditunjukkan pada bagian kiri. 20 8. Y related coefficient plot pada selang waktu retensi 17,76-18,08 menit
(Var. 112) terhadap aktivitas antibakteri (DIZ). Nilai koefisien relatif Y positif menunjukkan selang waktu retensi berkorelasi terhadap aktivitas
antibakteri. 21
9. X varian plot menunjukkan penyebaran peak area selang waktu retensi 17,76-18,08 menit pada ekstrak dan fraksi buah takokak yang dengan berbagai ulangan dan serapan UV. Penyebaran peak area didominasi oleh fraksi K yang selanjutnya digunakan untuk tahapan identifikasi. 21 10. Kromatogram DMSO (A) dan kromatogram fraksi K ulangan 4 pada
selang waktu retensi 17,76-18,08 menit dengan serapan UV 310 nm (B). Terlihat peak-peak pada menit ke 3,19 sampai 3,68 merupakan peak-peak yang diduga sebagai komponen aktif. 22 11. Contoh mass spectra pada menit ke 3,19 pada selang waktu retensi
12. Contoh mass spectra pada menit ke 3,32 pada selang waktu retensi 17,76-18,08 menit fraksi K ulangan 4 buah takokak. Senyawa aktif yang berada pada menit ke 3,32 adalah senyawa dengan m/z 885. 23 13. Contoh mass spectra pada menit ke 3,68 pada selang waktu retensi
17,76-18,08 menit fraksi K ulangan 4 buah takokak. Senyawa aktif yang berada pada menit ke 3,68 adalah senyawa dengan m/z 577. 24 14. Struktur kimia dari torvoside G dengan [M-H] + = 557 (1), torvoside H
dengan [M-H] + = 885 (2), dan torvoside A dengan [M-H] + = 887 (3). 24
DAFTAR LAMPIRAN
1. Hasil perhitungan kadar air buah takokak segar 30
2. Hasil tepung buah takokak 30
3. Hasil uji kadar air tepung buah takokak 31
4. Hasil ekstrak dan fraksi buah takokak 32
5. Hasil uji kadar air ekstrak dan fraksi buah takokak 33 6. Hasil uji aktivitas antibakteri ekstrak dan fraksi buah takokak 35 7. Hasil uji aktivitas antibakteri pada pelarut ekstrak dan fraksi buah
1. PENDAHULUAN
Latar Belakang
Buah takokak (Solanum torvum Swartz) merupakan sayuran lokal yang sering dikonsumsi oleh masyarakat Jawa Barat dan telah banyak digunakan sebagai obat tradisional di Indonesia. Buah takokak telah dilaporkan oleh medis dan diketahui secara tradisional dapat digunakan untuk anti-edemik, analgesik, mengurangi rasa sakit, antitusif, anti-inflamasi, sakit perut, sakit gigi, katarak, gangguan menstruasi, wasir, influenza, bengkak, bisul, nyeri, sakit pinggang, asam urat tinggi, tulang keropos, jantung berdebar-debar, dan detoksifikasi (Andarwulan et al. 2012). Buah ini umumnya dikonsumsi dengan cara dilalap mentah, direbus atau dimasak dengan tauco dan cabe hijau. Belum banyak penelitian di Indonesia yang melaporkan aktivitas antibakteri tanaman takokak. Dengan berkembangnya ilmu pengetahuan dan teknologi, maka potensi buah ini dapat digali dan dikaji kembali untuk mendapatkan manfaat yang lebih baik dalam meningkatkan kesehatan masyarakat.
Beberapa penelitian menununjukkan tanaman takokak memiliki aktivitas antibakteri (Chah et al. 2000, Bari et al. 2010, Sivapriya et al. 2011). Buah takokak dengan menggunakan ekstrak metanol telah diketahui memiliki aktivitas antibakteri pada bakteri Staphylococcus aureus dengan metode MIC (minimum
inhibitory concentrations) dengan nilai MIC sebesar 0,31 mg/ml (Chah et al.
2000). Sivapriya et al. (2011) juga melakukan pengujian aktivitas antibakteri pada kulit buah takokak terhadap Staphylococcus aureus menggunakan metode difusi sumur dengan nilai DIZ sebesar 21±1 mm pada ekstrak air, 23±2 mm pada ekstrak etanol:air (1:1), dan 15±1 mm pada ekstrak etanol. Namun, identifikasi komponen aktif antibakteri dari buah takokak belum dilakukan. Dengan demikian, perlu adanya penelitian mengenai identifikasi komponen aktif yang memiliki aktivitas antibakteri dari buah takokak.
Identifikasi komponen bioaktif dari bahan alam umumnya dilakukan dengan metode bioassay guided isolation. Bioassay guided isolation merupakan metode identifikasi dengan teknik isolasi senyawa yang berulang-ulang dengan dipandu bioaktivitas hingga mendapatkan senyawa murni. Metode isolasi berulang-ulang untuk mendapatkan senyawa murni ini memakan banyak waktu dan biaya. Dengan demikian, perlu alternatif dalam mengidentifikasi komponen bioaktif yaitu dengan menggunakan pendekatan metabolomik. Metabolomik merupakan analisis komprehensif komponen dari suatu organisme pada waktu atau kondisi tertentu (Hall, 2006). Metabolomik dapat diaplikasikan untuk mempelajari korelasi antara bioaktivitas dan profil kimia dan pada akhirnya dapat digunakan untuk mengidentifikasi komponen bioaktif pada tanaman (Yuliana et al. 2011a). Metode ini dilakukan dengan ekstraksi dan fraksinasi sampel secara komprehensif dengan menggunakan kombinasi pelarut pada tingkat kepolaran yang berbeda (Yuliana et al. 2011). Hal ini digunakan untuk mendapatkan penyebaran senyawa yang baik pada setiap ekstrak dan fraksi. Ekstrak dan fraksi yang dihasilkan selanjutnya digunakan untuk analisis bioaktivitas dan profil kimia dari buah takokak.
2
(NMR). Hanya saja, penggunaan NMR memerlukan biaya yang tinggi. Salah satu instrumen yang lebih terjangkau dan dapat digunakan adalah high performance liquid chromatography (HPLC). Menurut Choi et al. (2011), HPLC dapat digunakan untuk aplikasi metabolomik dalam menentukan perbedaan komposisi senyawa fenol pada kulit citrus kering dengan berbagai kondisi penyimpanan dan perlakuan panas. Selain itu, Yi et al. (2007) juga mengaplikasikan metabolomik dengan HPLC untuk melihat perbedaan profil kimia antara Pericarpium Citri
Reticulatae dan Pericaprium Citri Reticulatae Viride. Pengujian dengan KLT
(kromatografi lapis tipis) dapat dilakukan pada awal pengujian profil kimia untuk pendugaan adanya komponen aktif pada ekstrak dan fraksi buah takokak.
Banyaknya data yang dihasilkan dari profil kimia menyebabkan analisis statistika pada studi metabolomik harus menggunakan analisis data multivariat. Salah satu cara analisis data multivariat yang dapat digunakan untuk melihat korelasi antara waktu retensi dengan aktivitas antibakteri yaitu dengan orthogonal projection to latent sructure (OPLS). Analisis ini akan mengelompokkan sampel berdasarkan bioaktivitasnya dalam bentuk score plot. Selain itu, dengan menggunakan Y related coefficient plot dapat dilihat waktu retensi dari hasil analisis profil kimiawi sampel yang memiliki korelasi dengan aktivitas antibakteri dan yang tidak memiliki korelasi dengan aktivitas antibakteri. Dari hasil analisis OPLS, selanjutnya waktu retensi yang terpilih, akan dipekatkan dengan HPLC semi-preparatif dan dianalisis profilnya dengan kromatografi cair-spektro massa (LC-MS) untuk mengidentifikasi komponen yang diperkirakan memiliki aktivitas antibakteri.
Research Questions
Research Questions dari penelitian ini adalah apakah pendekatan metabolomik dapat digunakan untuk mengidentifikasi komponen antibakteri dari ekstrak buah takokak (Solanum torvum Swartz).
Tujuan Penelitian
Tujuan dari penelitian ini adalah mengaplikasikan pendekatan metabolomik untuk mengidentifikasi komponen dari ekstrak dan fraksi buah takokak (Solanum torvum Swartz) yang memiliki aktivitas antibakteri.
2. TINJAUAN PUSTAKA
Buah Takokak (Solanum torvum Swartz)
3
permukaan daun, dan pada batang. Duri jarang ada pada batang yang telah tua. Pada umur yang masih muda, duri berupa rambut stellate. Duri ini jarang pada permukaan atas daun tapi banyak pada permukaan bawah daun.
Daunnya sederhana berbentuk elips oval dan beragam ukurannya antara 8-15 cm dengan tangkai daun sekitar 2-5 cm. Bunga merupakan bunga sempurna dengan jumlah antara 50-100 bunga. Panjang kelopak 3-4 mm dan panjang mahkota putih 2-3 mm. Kepala sari berwarna kuning dengan panjang 6-7 mm. Buah berwarna hijau dan jumlah buah paling sedikit 10 buah dalam satu kelompok (Gambar 1). Ketika buah tua, buah menjadi berwarna kecoklatan. Buah berbentuk bulat dengan ukuran 1-1,5 cm. Biji buah berwarna putih dan jumlahnya banyak dengan ukuran sekitar 1,5-2 mm. Warna biji buah ketika tua menjadi kecoklatan (Wagner et al. 1999 dalam Starr et al. 2003).
Kingdom : Plantae
Division : Spermatophyta Sub Division : Angiospermae Class : Dicotyledonae Order : Solanales Family : Solanaceae Genus : Solanum
Spesies : Solanum torvum Swartz (Wagner et al. 1999 dalam Starr et al. 2003).
Gambar 1 Buah takokak
4
Buah takokak memiliki rasa pedas dan sejuk dimulut. Buah ini agak beracun. Apabila penderita memiliki kecenderungan glucoma maka dilarang mengkonsumsi buah takokak. Penggunaan yang berlebihan dapat menimbulkan keracunan pada tubuh manusia. Takokak merupakan salah satu jenis tanaman yang berkhasiat sebagai bahan obat tradisional dan berpotensi untuk dibudidayakan. Dalam pengobatan tradisional, bagian tanaman takokak yang sering digunakan adalah daun, buah, dan akar. Tanaman ini dipercaya mampu mengatasi sakit lambung, tidak datang haid, pinggang kaku, maupun bengkak terpukul, batu kronis, bisul atau koreng, jantung berdebar, nyeri jantung, dan menurunkan tekanan darah tinggi. Penggunaan tanaman obat ini masih dilakukan secara tradisional yaitu dengan cara direbus maupun dilalap mentah (Sirait 2009).
Takokak dikenal diberbagai daerah dengan berbagai sebutan nama. Beberapa daerah mengenal dengan sebutan terong pipit, terong rimbang (Melayu), takokak (Jawa Barat), dan terong cepoka (Jawa Tengah). Dalam pengobatan tradisional, tanaman takokak cukup dikenal, namun belum semua masyarakat mengetahui tentang identitas dan kegunaan dari tanaman tersebut. Di pedesaan bahan tanaman obat ini dipanen dari alam dan belum dibudidayakan secara luas. Di daerah Sumatera dan Bogor, masyarakat telah menggunakan tanaman ini sebagai obat alternatif yaitu dengan menggunakan buah sebagai sayur lalapan atau dimasak. Penggunaan tanaman obat ini dipercaya dan telah turun temurun digunakan secara tradisional karena khasiatnya (Sirait 2009).
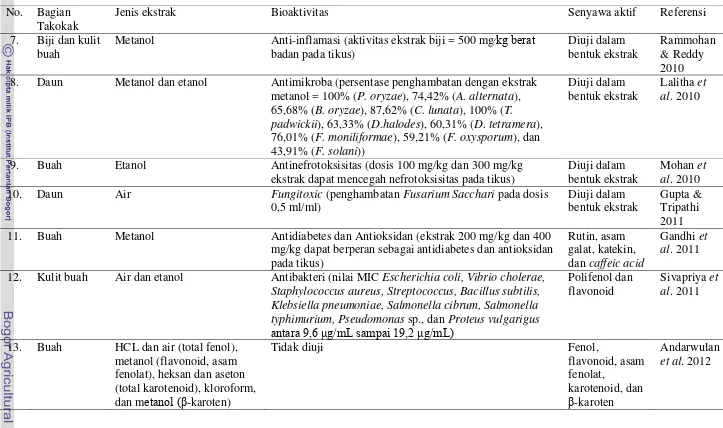
Menurut Kementerian Negara Riset dan Teknologi RI (2001), buah, bunga, dan daun dari takokak mengandung saponin, flavonoida, dan alkaloida. Daun takokak juga mengandung tanin. Dengan mengonsumsi buahnya dapat menurunkan tekanan darah tinggi dan menambah nafsu makan. Tabel 1 menunjukkan hasil-hasil penelitian mengenai komponen bioaktif dari tanaman takokak.
Komponen Senyawa Antibakteri dari Tumbuhan
Bakteri merupakan mikroorganisme prokariotik yang khas, bersel tunggal, dan tidak mengandung struktur yang dibatasi membran di dalam sitoplasmanya (Pelczar & Chan 1988). Bakteri ada yang bersifat patogen dan ada yang nonpatogen. Bakteri patogen merupakan bakteri yang berpotensi menyebabkan infeksi ataupun penyakit, baik dalam jumlah yang sedikit ataupun saat jumlahnya melebihi normal. Sementara itu, bakteri nonpatogen merupakan bakteri yang tidak berpotensi menyebabkan infeksi penyakit tertentu pada manusia ataupun hewan inangnya (Yani 2011).
Salah satu bakteri patogen yang umum memberikan penyakit adalah bakteri
Staphylococcus aureus. Staphylococcus aureus merupakan bakteri Gram positif
Tabel 1 Hasil-hasil penelitian mengenai komponen bioaktif dari tanaman takokak No. Bagian
Takokak
Jenis ekstrak Bioaktivitas Senyawa aktif Referensi
1. Aerial dan
akar
Metanol Tidak diuji Torvoside A-G Yahara et
al. 1996 2. Buah Metanol Antibakteri (nilai MIC; Actinomyces pyogenes, Bacillus
subtilis, Pseudomonas aeruginosa, Staphylococcus aureus, dan Streptococcus pyogenes, masing-masing 0,3125 mg/ml) dan antikapang (nilai MIC; Aspergillus niger = 1,25 mg/ml, Candida albicans = 0,625 mg/ml)
Diuji dalam
Tidak diuji Solasodin,
solasonin, dan solamargin
Pérez-Amador et al. 2007 5. Buah Etanol Antioksidan (nilai aktivitas antioksidan = 3,68 mg dari
trolox and 360,53 mg dari asam askorbat pada mikrosom hati manusia)
Metanol dan kloroform Antibakteri dan Antikapang (ekstrak metanol MIC pada B.
cereus dan Shigella dysenteriae = 64-128 μg ml-1 dan
penghambatan Vasin factum, Aspergillus fumigatus and C.
Tabel 1 Lanjutan hasil-hasil penelitian mengenai komponen bioaktif dari tanaman takokak No. Bagian
Takokak
Jenis ekstrak Bioaktivitas Senyawa aktif Referensi
7. Biji dan kulit buah
Metanol Anti-inflamasi (aktivitas ekstrak biji = 500 mg⁄kg berat badan pada tikus) 8. Daun Metanol dan etanol Antimikroba (persentase penghambatan dengan ekstrak
metanol = 100% (P. oryzae), 74,42% (A. alternata), 65,68% (B. oryzae), 87,62% (C. lunata), 100% (T. padwickii), 63,33% (D.halodes), 60,31% (D. tetramera), 76,01% (F. moniliformae), 59,21% (F. oxysporum), dan 43,91% (F. solani))
Diuji dalam bentuk ekstrak
Lalitha et al. 2010
9. Buah Etanol Antinefrotoksisitas (dosis 100 mg/kg dan 300 mg/kg ekstrak dapat mencegah nefrotoksisitas pada tikus)
Diuji dalam bentuk ekstrak
Mohan et al. 2010 10. Daun Air Fungitoxic (penghambatan Fusarium Sacchari pada dosis
0,5 ml/ml) 11. Buah Metanol Antidiabetes dan Antioksidan (ekstrak 200 mg/kg dan 400
mg/kg dapat berperan sebagai antidiabetes dan antioksidan pada tikus)
12. Kulit buah Air dan etanol Antibakteri (nilai MIC Escherichia coli, Vibrio cholerae, Staphylococcus aureus, Streptococcus, Bacillus subtilis, Klebsiella pneumoniae, Salmonella cibrum, Salmonella typhimurium, Pseudomonas sp., dan Proteus vulgarigus
antara 9,6 μg/mL sampai 19,2 μg/mL)
Polifenol dan fenolat), heksan dan aseton (total karotenoid), kloroform, dan metanol (β-karoten)
Tidak diuji Fenol,
7 Selain itu, menurut White et al. (2003), Staphylococcus aureus merupakan salah satu bakteri patogen yang paling umum pada manusia. Bakteri ini menjadi penyebab utama morbiditas dan kerugian ekonomi pada hewan produksi. Salah satu antimikroba yang efektif dalam penanganan bakteri ini adalah
chloramphenicol (Rubin et al. 2011). Penelitian aktivitas antibakteri yang
dilakukan oleh Rubin et al. (2011) dan Onwubiko & Sadiq (2011) menggunakan chloramphenicol sebagai kontrol positif dengan metode difusi sumur.
Beragamnya bakteri patogen yang dapat menyebabkan infeksi ataupun penyakit telah memacu penggunaan antibiotik sebagai obat utama. Penggunaan antibiotik sintetik maupun semi-sintetik umumnya memiliki efek samping tertentu yang tidak diharapkan, terutama apabila antibiotik tersebut digunakan secara terus-menerus. Salah satunya yaitu terdapat banyak mikroba patogen yang telah resisten dengan antibiotik yang ada sehingga kebutuhan akan senyawa-senyawa antibakteri pun semakin besar (Sartini et al. 2007). Oleh karena itu, penelitian-penelitian mengenai zat antibakteri alami terus dilakukan.
Tanaman pangan telah banyak diketahui kaya akan komponen bioaktif yang mempunyai khasiat sebagai antibakteri. Hingga saat ini, banyak penelitian yang dilakukan untuk mencari senyawa-senyawa metabolit sekunder dari tumbuhan yang memiliki aktivitas antibakteri (Yani 2011). Produk bahan alam seperti metabolit sekunder, baik senyawa murni maupun dalam bentuk ekstrak, memiliki peluang untuk dikembangkan dalam dunia pengobatan. Senyawa bahan alam tersebut memiliki efek terapis yang signifikan terhadap bakteri, jamur, maupun virus yang bersifat patogen terhadap hewan dan manusia. Efek terapis yang ditimbulkan juga lebih aman tanpa efek samping (Parthasarathy et al. 2009).
Murnasih (2005) melaporkan bahwa metabolit sekunder dari bahan alam atau sering disebut natural product diproduksi oleh organisme pada saat kebutuhan metabolisme primer sudah terpenuhi dan digunakan dalam mekanisme adaptasi lingkungan. Perbedaan kondisi lingkungan misalnya intensitas cahaya yang kecil, rendahnya temperatur, dan kondisi lainnya memungkinkan organisme menghasilkan metabolit yang mempunyai struktur kimia yang spesifik dan bervariasi yang sangat berpengaruh terhadap bioaktivitasnya.
Zat metabolit sekunder memiliki banyak jenis, adapun jenis dari metabolit sekunder yang dapat kita ketahui antara lain azadirachtin, salanin, meliatriol, dan nimbin. Pemanfaatan dari zat metabolit sekunder sangat banyak. Metabolit sekunder dapat dimanfaatkan sebagai antiagen pengendali hama yang ramah lingkungan (Samsudin 2008). Sebagian besar tumbuhan penghasil metabolit sekunder tetap menyimpan produknya di dalam bagian selnya yaitu pada organela sel, salah satunya adalah vakuola. Produk metabolit sekunder tumbuhan banyak di ekstrak oleh manusia untuk bahan dasar obat-obat tradisional atau untuk industri kosmetik maupun produk ekstrak tumbuhan (Purwanti 2009).
Metabolomik
8
maupun terdokumentasi dengan baik untuk pengembangan obat bagi manusia (Widyastuti et al. 2009).
Inventarisasi bahan alam yang berpotensi sebagai penghasil obat, serta pengetahuan tentang bahan aktif yang dimiliki meliputi struktur kimia dan fungsinya sebagai antiviral, anti bakteri maupun untuk efek resisten terhadap penyakit yang disebabkan oleh insekta akan membangun infomasi yang sangat penting bagi pengembangan obat baru berbasis herbal (Widyastuti et al. 2009).
Isolasi dan identifikasi bahan aktif dari bahan alam umumnya dilakukan dengan bioassay guided isolation. Bioassay guided isolation merupakan metode identifikasi komponen dengan melakukan teknik pemurnian yang dipandu bioaktivitas dengan melakukan isolasi berulang kali hingga mendapatkan senyawa murni. Metode pemurnian ini memakan banyak waktu dan biaya. Dengan demikian, perlu alternatif metode yang dapat digunakan untuk mengidentifikasi bahan aktif dari bahan alam misalnya menggunakan pendekatan metabolomik. Metabolomik merupakan strategi baru yang mendukung pendekatan holistik yang telah diperkenalkan dengan tujuan mengatasi hambatan dalam penelitian produk hayati (Yuliana et al. 2011a). Menurut Hall (2006), metabolomik didefinisikan sebagai analisis komposisi metabolit yang ada pada sel, tisu, maupun organisme secara komprehensif. Selain itu, menurut Sumner et al. (2007), metabolomik adalah analisis skala besar metabolit dan membutuhkan alat-alat bioinformatika untuk analisis data, visualisasi, dan integrasi.
Aplikasi metabolomik telah banyak dilakukan oleh berbagai peneliti. Salah satunya yaitu Choi et al. (2005) yang melakukan klasifikasi terhadap spesies Ilex dengan menggunakan nuclear magnetic resonance (NMR) dan analisis multivariat bedasarkan fingerprinting metabolomik. Selain itu, Yuliana et al. (2011) juga melakukan aplikasi metabolomik untuk identifikasi flavonoid dari Orthosiphon stamineus Benth yang aktif pada reseptor adenosin A1.
Data yang dihasilkan dari penelitian metabolomik merupakan data multidimensi hingga harus dianalisis dengan statistik mega/multivariat data (MVD). Analisis ini digunakan karena beragamnya data yang dihasilkan dari instrumen yang digunakan, baik berupa data panjang gelombang, waktu-waktu retensi, dan konsentrasi senyawa yang dihasilkan pada berbagai fraksi. Metode MDV untuk penelitian metabolomik dapat menggunakan analisis Orthogonal Projection to Latent Structure (OPLS). OPLS digunakan untuk mempelajari korelasi antara komposisi metabolit dan bioaktivitas ekstrak tanaman (Yuliana et al. 2011a).
9
KLT, HPLC, dan LC-MS
Kromatografi adalah suatu teknik pemisahan molekul berdasarkan perbedaan pola pergerakan antara fase gerak dan fase diam untuk memisahkan komponen yang berada pada larutan. Molekul yang terlarut dalam fase gerak, akan melewati kolom yang merupakan fase diam. Molekul yang memiliki ikatan yang kuat dengan kolom akan cenderung bergerak lebih lambat dibanding molekul yang berikatan lemah. Dengan ini, berbagai macam tipe molekul dapat dipisahkan berdasarkan pergerakan pada kolom. Kromatografi dibagi menjadi beberapa jenis, yaitu kromatografi cair (Liquid Chromatography), Reverse phase
chromatography, High performance liquid chromatography (HPLC), Size
exclusion chromatography (Simanjuntak 2003).
Selama beberapa tahun terakhir beberapa teknik ini telah dikembangkan untuk mendeteksi biokimia dengan berbagai instrumen analitik. Kombinasi tekonologi analitik dan deteksi biokimia telah memungkinkan evaluasi biologi dan kimia molekul bioaktif dalam analisis tunggal. Hal ini sangat mengurangi waktu yang dibutuhkan untuk karakterisasi senyawa. Kemajuan terbaru di bidang ini serta penerapan deteksi biokimia untuk penyaringan campuran yang kompleks dapat dikaji, seperti ekstrak produk alami (van Elswijk & Irth 2003).
Kromatografi lapis tipis (KLT) merupakan salah satu teknik pemisahan yang relatif murah dan handal. KLT dapat diaplikasikan luas karena tekniknya yang sederhana dan cepat (Dickson et al. 2004). Pada dasarnya, KLT merupakan teknik pemisahan komponen pada analisis kuantitatif. Teknik ini menggunakan pemisahan dengan mengikat komponen pada pelat KLT sebagai fase diam, sedangkan fase geraknya (eluen) berfungsi sebagai pembawa komponen. Komponen yang mempunyai afinitas lebih besar dari fase gerak atau afinitasnya lebih kecil dari fase diam akan bergerak lebih cepat dari pada komponen yang mempunyai sifat sebaliknya (Scott 2003).
Kromatografi cair adalah analisis kimia dengan metode kromatografi didasarkan pada pemisahan komponen yang terpartisi diantara dua fase dalam suatu kesetimbangan dinamis dan mengalir, dimana fase yang mengalir adalah fase cair. Proses ini dilakukan dengan menggerakkan suatu fase secara mekanis (fase gerak) yaitu fase cair, relatif terhadap fase lainnya yaitu fase diam pada kolom kromatografi. Kromatografi gas adalah analisis kimia dengan metode kromatografi didasarkan pada pemisahan komponen yang terpartisi diantara dua fase dalam suatu kesetimbangan dinamis dan mengalir, dimana fase yang mengalir adalah fase gas. Proses ini dilakukan dengan menggerakkan suatu fase secara mekanis (fase gerak) yaitu fase gas, relatif terhadap fase lainnya yaitu fase diam pada kolom kromatografi (Scott 2003).
Menurut Allwood & Goodacre (2010), HPLC dapat diterapkan untuk aplikasi metabolomik pada tanaman. Hanya saja, untuk dapat mengkarakterisasi komponen dapat dihubungkan dengan detektor MS atau dengan NMR (nuclear magnetic resonance). Hasil HPLC juga dapat dipurifikasi yang selanjutnya diidentifikasi senyawanya dengan menggunakan GC-MS atau LC-MS.
10
menghasilkan pola spektrum massa yang sangat spesifik untuk setiap senyawa. Pola fragmentasi (spektrum massa) ini merupakan sidik jari molekuler dari suatu senyawa. Dengan memadukan data indeks retensi dan spektrum massanya, maka identitas dari analit dapat dikenali dan dipastikan (Gelgel & Wirasuta 2008).
3. BAHAN DAN METODE
Penelitian ini dilaksanakan dari bulan November 2012 hingga Desember 2013. Penelitian ini dilakukan di Laboratorium SEAFAST IPB dan Laboratorium Kimia Pangan ITP IPB, dan BPPT Biotek serpong.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini adalah buah takokak segar yang masih muda berasal dari petani Kampung Konservasi TOGA Bina Sehat Lestari di Gunung Leutik, Desa Benteng, Ciampea-Bogor, metanol, n-heksan, kloroform, etil asetat, aquades, kertas saring, pelat KLT, kultur bakteri Staphylococcus aureus, media Nutrient Agar (NA), media Nutrient Broth (NB), chloramphenicol, DMSO, aquabides, regenerated membrane, asetonitril, asam asetat, N2 dan asam format.
Alat-alat yang digunakan pada penelitian ini adalah alat-alat pengolahan terkait persiapan sampel, pengering beku (freeze dryer), blender, refrigerator, penyaring 30 mesh, timbangan, plastik ber-seal, freezer, alat-alat gelas, vorteks, alat sonifikasi, alat sentrifugasi, rotary evaporator, inkubator 60 oC, inkubator 37 o
C, oven, cawan, oven vakum, timbangan analitik, desikator, bejana KLT, lampu UV 254 nm dan 366 nm, pipa kapiler, tabung sampel, tabung vial untuk HPLC dan LC-MS, alat degasing, alat penyaring vakum, dan HPLC Agilent Technologies dengan Multi Wavelength Detektor (MWD) dan kolom C18, 5 µm, 150x4,6 mm, software SIMCA-P 12.0 (Umetrics, Umeå, Swedia), dan UPLC-QToF-MS/MS System (Waters) dan kolom Acquity UPLC BEH C18 1,7 µm, 2,1x50 mm dengan XEVO-G2QTOF (Waters), model resolusi ESI positif, dan MassLynk versi 4.1.
Metode Penelitian
11
Gambar 2 Diagram alir penelitian identifikasi komponen aktif dengan menggunakan pendekatan metabolomik pada buah takokak.
Persiapan Sampel Buah Takokak
Buah takokak segar yang masih muda dari Perkebunan Gunung Leutik, disortir, dicuci, dan dikeringkan dengan pengering beku pada suhu -46 oC dan tekanan 0,220 mBar selama 48 jam dan ditepungkan dengan menggunakan blender. Hasil penepungan tersebut kemudian diayak menggunakan saringan 30 mesh lalu dimasukkan ke dalam plastik ber-seal dan disimpan di dalam freezer.
Uji Kadar Air (AOAC 2000)
Pengujian kadar air diawali dengan mengeringkan cawan pada oven suhu 105 oC selama 3 jam, selanjutnya cawan ditempatkan di dalam desikator sampai cawan tersebut dingin. Kemudian timbang cawan untuk mendapatkan berat cawan kering. Sampel ditimbang sebanyak 3 gram dengan menggunakan cawan kering. Cawan tersebut selanjutnya dimasukkan ke dalam oven selama 3 jam pada suhu 105 oC. Setelah kering, dilakukan pendinginan pada cawan dengan memasukkan cawan ke dalam desikator. Timbang cawan dan ulangi sampai beratnya stabil.
Kadar air = x 100% Ekstrak dan fraksi buah takokak
Selang waktu retensi pada serapan UV tertentu yang terpilih berdasarkan hasil OPLS
Preparasi sampel dengan HPLC semipreparatif
Identifikasi komponen bioaktif dengan LC-MS
Komponen aktif yang diduga memiliki aktivitas antibakteri pada bakteri Staphylococcus aureus
Analisis mutivariat data dengan OPLS Uji KLT dan analisa profil
kimia dengan HPLC
Uji Aktivitas Antibakteri dengan Metode Difusi Sumur
12
Diketahui, W1 = berat sampel sebelum dikeringkan (g) W2 = beras sampel setelah dikeringkan (g)
Ekstraksi dan Fraksinasi Buah Takokak
Ekstraksi dilakukan pada 50 g tepung takokak dengan metanol 80% dengan cara divorteks, disonikasi selama 30 menit, disentrifugasi dengan kecepatan 2000 rpm selama 5 menit, disaring, dan diambil filtratnya. Sebagian hasil ekstraksi dikeringkan dengan menggunakan rotary evaporator pada suhu 40 oC dan sebagian lagi dilakukan fraksinasi dengan berbagai pelarut pada tingkat polaritas yang berbeda. Diagram alir fraksinasi ditunjukkan pada Gambar 3.
Gambar 3Diagram alir fraksinasi buah takokak.
Pelarut yang digunakan untuk fraksinasi adalah n-heksan, kloroform, etil asetat, dan air. Hasil fraksi non polar dikeringkan dan fraksi polar difraksinasi lagi dengan pelarut selanjutnya dan begitu seterusnya. Hasil fraksinasi dikeringkan dengan menggunakan rotary evaporator dengan suhu 40 oC. Ekstraksi dan fraksinasi dilakukan dalam 5 kali ulangan. Ekstrak yang diperoleh selanjutnya dibagi menjadi dua bagian dalam volume yang sama. Sebagian ekstrak dan fraksi digunakan untuk uji aktivitas antibakteri dan sebagiannya lagi digunakan untuk analisis profil kimianya dengan KLT dan HPLC. Ekstraksi dibuat dalam 5 kali ulangan.
Fraksi Polar A Fraksi Non Polar E Ditambah H2O + etil asetat
Fraksi Non Polar K Fraksi Polar K
Ditambah H2O + kloroform
Fraksi Non Polar H Fraksi Polar H
Ekstraksi dengan metanol 80%
Ekstrak metanol + H2O + n-heksan Ekstrak M
13
Uji Aktivitas Antibakteri Ekstrak dan Fraksi Buah Takokak
Pengujian aktivitas antibakteri pada hasil ekstraksi dilakukan dengan metode difusi sumur yang dimodifikasi (CLSI 2008). Ekstrak dan fraksi dilarutkan dalam DMSO dengan konsentrasi 400 mg/ml. Kultur bakteri Staphylococcus aureus diambil satu ose dan dilarutkan dalam media NB 10 ml dan diinkubasi 37 oC selama 24 jam. Sebanyak 0,5 ml suspensi bakteri tersebut kemudian dituang ke dalam 500 ml media NA yang telah disterilisasi lalu dituang ke dalam cawan sebanyak ± 25 ml. Cawan yang berisi media tersebut kemudian didiamkan selama 1 jam hingga memadat. Pada media padat tersebut dibuat tiga buah lubang berdiameter 6 mm. Kemudian sebanyak 60 μL ekstrak dan fraksi dituangkan ke dalam salah satu sumur, sedangkan sisanya diisi oleh kontrol positif dan kontrol negatif.
DMSO digunakan sebagai kontrol negatif dan chloramphenicol (25 mg/ml) digunakan sebagai kontrol positif. Media kemudian diinkubasi pada suhu 37 oC selama 48 jam. Aktivitas antibakteri dihitung berdasarkan DIZ (diameter of inhibition zone). Pengujian dilakukan dalam 3 kali ulangan. Uji aktivitas antibakteri juga dilakukan pada pelarut yang digunakan untuk ekstraksi dan fraksinasi pada buah takokak untuk menunjukkan ada atau tidaknya pengaruh pelarut terhadap aktivitas antibakteri.
Uji KLT Ekstrak dan Fraksi Buah Takokak
Uji KLT diacu dari Dickson (2004) dengan berbagai modifikasi. Pengujian ini dilakukan dengan pemilihan fase gerak (eluen) yang terbaik dalam memisahkan komponen-komponen senyawa pada ekstrak dan fraksi dan pengujian ekstrak dan fraksi buah takokak dalam 5 kali ualangan. Pemilihan eluen dilakukan dengan menggunakan kombinasi dua pelarut yang non polar dan semi polar yaitu kloroform dan etil asetat. Kombinasi perbandingan jumlah kedua pelarut yang digunakan ditunjukkan pada Tabel 2.
Tabel 2 Kombinasi pelarut yang digunakan untuk uji eluen pada uji KLT No. Kombinasi eluen (ml)
Kloroform Etil Asetat
1. 10 0
2. 7 3
3. 5 5
4. 3 7
5. 1 9
14
ulangan. Perlakuan sama seperti pemilihan kombinasi eluen terbaik. Bercak hasil elusi diamati dibawah lampu UV dengan panjang gelombang 254 nm dan 366 nm.
Analisis Profil Kimia Ekstrak dan Fraksi Buah Takokak dengan HPLC
Analisis profil kimia ekstrak dan fraksi buah takokak diawali dengan melarutkan ekstrak dan fraksi takokak dalam DMSO dengan konsentrasi 0,8 µg/ml dan divorteks. Sebanyak 1 ml larutan ekstrak dan fraksi takokak disaring dengan penyaring regenerated membrane dan ditransfer ke vial. Sampel selanjutnya diinjek ke dalam HPLC sebanyak 40 µl. HPLC yang digunakan adalah HPLC Agilent Technologies dengan Multi Wavelength Detektor (MWD) dengan kolom C18, 5 µm, 150x4,6 mm. Ekstrak diukur pada panjang gelombang 250 nm, 270 nm, 290 nm, 310 nm, 330 nm, dan 350 nm. HPLC dioperasikan pada suhu ruang dengan laju alir 1 ml/menit. Fase gerak yang digunakan adalah fase gerak A larutan asam asetat 0,1% dan fase gerak B asetonitril. Elusi dilakukan secara gradien dalam waktu 20 menit. Berikut kombinasi fase gerak selama proses elusi yang ditunjukkan pada Tabel 3.
Tabel 3 Kombinasi fase gerak selama proses elusi untuk analisis profil kimia. A = larutan asam asetat 0,1% dan B = asetonitril.
Waktu (menit) Fase Gerak (%)
Hasil kromatogram ekstrak dan fraksi dengan data serapan UV (250 nm, 270 nm, 290 nm, 310 nm, 330 nm, dan 350 nm) pada waktu-waktu retensi dikorelasikan dengan aktivitas antibakteri yang diketahui. Kromatogram yang dihasilkan dari 5 kali ulangan ekstrak M, fraksi H, fraksi K, fraksi E, dan fraksi A dengan 6 serapan UV adalah sebanyak 150 kromatogram. Data profil kimia dari kromatogram ditunjukkan dengan selang waktu retensi setiap 0,16 menit. Data profil kimia akan dikorelasikan dengan data aktivitas antibakteri menggunakan analisis OPLS.
Analisis OPLS akan menunjukkan beberapa plot seperti score plot, Y
related coefficient plot, dan X varian plot. Score plot akan menunjukkan plot
15
Identifikasi Komponen Bioaktif dengan LC-MS
Ekstrak atau fraksi yang signifikan aktivitas antibakterinya melalui analisis OPLS selanjutnya dipreparasi dengan menggunakan HPLC semipreparatif untuk tahap identifikasi komponen bioaktif. HPLC semipreparatif yang digunakan yaitu jenis HPLC Agilent Technologies dengan Multi Wavelength Detektor (MWD) dengan kolom C18, 5 µm, 150x4,6 mm. Hasil penampungan dari HPLC semipreparatif selanjutnya dikeringkan dengan N2 dan pengering beku. Sampel hasil pengeringan kemudian dilarutkan dengan DMSO 100 µl. Sebanyak 5 μL diinjek ke dalam UPLC-QToF-MS/MS System (Waters) dengan data base MassLynk versi 4.1. Kolom yang digunakan adalah Acquity UPLC BEH C18 1,7 µm, 2,1x50 mm. LC-MS dioperasikan pada suhu 40 oC dengan laju alir 0,3 ml/menit.
Fase gerak yang digunakan adalah fase gerak A larutan asam format 0,1% dan fase gerak B asetonitril + asam format 0,1%. Elusi dilakukan secara gradien dalam waktu 9 menit dengan XEVO-G2QTOF (Waters) dan model resolusi ESI positif. Berikut kombinasi fase gerak selama proses elusi yang ditunjukkan pada Tabel 4.
Tabel 4 Kombinasi eluen yang digunakan untuk identifikasi komponen bioaktif. A = larutan asam format 0,1% dan B = asetonitril + asam format 0,1%.
4. HASIL DAN PEMBAHASAN
Persiapan Sampel Buah Takokak
Persiapan sampel diawali dengan pengambilan buah takokak segar dari Perkebunan Gunung Leutik yang dikeringkan dengan pengering beku. Sebelum dilakukan pengeringan beku, buah takokak segar diukur terlebih dahulu kadar airnya. Hasil perhitungan kadar air buah takokak segar yang ditunjukkan pada Lampiran 1. Menurut penelitian Mahapatra et al. (2011), buah takokak segar memiliki kadar air sebesar 81,3%. Buah segar tersebut berasal dari timur India. Kadar air tersebut mendekati nilai kadar air buah takokak segar yang diujikan. Buah takokak segar dari Perkebunan Gunung Leutik memiliki kadar air sekitar 80%-87%. Perbedaan tingkat kadar air ini dapat sebabkan oleh cuaca di Perkebunan Gunung Leutik yang tidak stabil.
16
sebanyak 112,5 gram, dan tahap 5 (tahap 2 dan 3) sebanyak 165 gram. Hasil penepungan dengan seluruh tahapan didapatkan total tepung sebanyak 376 gram dari 4507,5 gram buah takokak segar. Setelah didapatkan tepung buah takokak selanjutnya dilakukan pengujian kadar air tepung takokak yang dihasilkan. Hasil uji kadar air tepung buah takokak dapat dilihat pada Lampiran 3.
Ekstraksi dan Fraksinasi Buah Takokak
Ekstraksi dan fraksinasi buah takokak dilakukan dengan berbagai pelarut yang memiliki tingkat polaritas yang berbeda-beda. Hal ini dilakukan untuk mendapatkan penyebaran komponen yang baik di dalam ekstrak dan fraksi, sehingga memudahkan pembacaan kromatogram pada tahap identifikasi komponen senyawa buah takokak. Jumlah ekstrak dan fraksi yang dihasilkan yaitu ekstrak M sebesar 5,62 gram, fraksi H sebesar 3,09 gram, fraksi K sebesar 1,37 gram, fraksi E sebesar 2,59 gram, dan fraksi A sebesar 11,78 gram. Hasil ekstrak dan fraksi selanjutnya dilakukan uji kadar air. Hasil uji kadar air ekstrak dan fraksi dapat dilihat pada Lampiran 5.
Uji Aktivitas Antibakteri Ekstrak dan Fraksi Buah Takokak
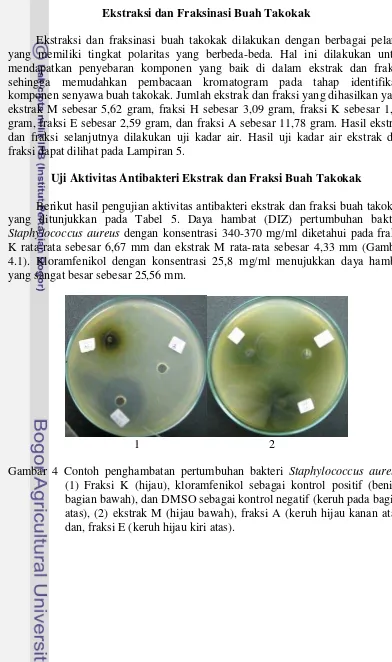
Berikut hasil pengujian aktivitas antibakteri ekstrak dan fraksi buah takokak yang ditunjukkan pada Tabel 5. Daya hambat (DIZ) pertumbuhan bakteri Staphylococcus aureus dengan konsentrasi 340-370 mg/ml diketahui pada fraksi K rata-rata sebesar 6,67 mm dan ekstrak M rata-rata sebesar 4,33 mm (Gambar 4.1). Kloramfenikol dengan konsentrasi 25,8 mg/ml menujukkan daya hambat yang sangat besar sebesar 25,56 mm.
1 2
17
Tabel 5 Hasil uji aktivitas antibakteri ekstrak dan fraksi buah takokak. M = pelarut metanol 80 %, H = pelarut n-heksan, K = pelarut kloroform, E = pelarut etil asetat, dan A = pelarut air.
18
Penelitian Chah et al. (2000) menunjukkan dengan konsentrasi 80 mg/ml ekstrak metanol buah takokak dapat memberikan daya hambat sebesar 28 mm pada bakteri Staphylococcus aureus. Hasil penelitian Chah et al. (2000) menunjukkan nilai DIZ yang lebih tinggi dibandingkan dengan penelitian yang dilakukan. Pada penelitian ini menggunakan buah yang masih muda dengan kondisi musim tropis sedangkan pada penelitian Chah et al. (2000) menggunakan buah matang dengan kondisi musim subtropis di negara Kamerun. Hal ini dapat menyebabkan perbedaan konsentrasi dan jenis komponen penyusun aktif pada buah takokak.
Penelitian Sivapriya et al. (2011) menunjukkan aktivitas antibakteri pada bakteri Staphylococcus aureus dengan menggunakan ekstrak kulit buah takokak. Aktivitas antibakteri dengan ekstrak heksan tidak memberikan daya hambat. Pada penelitian yang dilakukan juga diketahui bahwa fraksi H tidak memiliki aktivitas antibakteri (Gambar 4.2). Hanya saja, pada fraksi A tidak ditemukan daya hambat, sedangkan pada penelitian Sivapriya et al. (2011) diketahui daya hambat esktrak air sebesar 21 mm. Hal ini dapat disebabkan oleh kulit buah yang diteliti oleh Sivapriya et al. (2011) memiliki konsentrasi komponen aktifnya lebih tinggi dibandingkan dengan buah takokak. Pengujian efek pelarut metanol dan kloroform juga dilakukan dengan konsentrasi yang sama yaitu 400-300 mg/ml. Hasil pengujian menunujukkan tidak adanya efek pelarut terhadap penghambatan dari ekstrak dan fraksi buah takokak.
Uji KLT Ekstrak dan Fraksi Buah Takokak
Pengujian KLT ekstrak dan fraksi buah takokak dilakukan dengan terlebih dahulu mencari eluen terbaik untuk mengelusi ekstrak dan fraksi buah takokak. Penggunaan eluen kloroform dan etil asetat adalah disebabkan oleh dugaan adanya senyawa steroidal glycosides pada ekstrak dan fraksi buah takokak (Yahara et al. 1996 dan Arthan et al. 2002). Menurut Harborne (1973), eluen kloroform dan etil asetat dapat digunakan pada analisis kromatografi lapis tipis. Selain itu, menurut Bhawani (2010), eluen kloroform dan etil asetat dapat digunakan untuk mengidentifikasi steroid dengan menggunakan analisis kromatografi lapis tipis. Analisis ini dapat diidentifikasi dengan sinar UV dengan panjang gelombang 254 nm dan 366 nm.
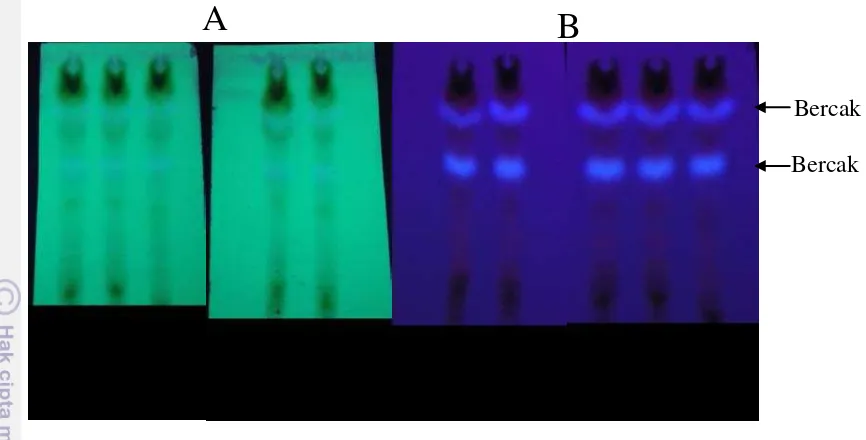
Hasil eluen terbaik adalah eluen dengan perbandingan klorofrom:etil asetat sebesar 5:5. Hasil KLT menunjukkan bahwa dengan eluen klorofrom:etil asetat dengan perbandingan 5:5 menunjukkan pemisahan bercak yang lebih baik dibandingkan dengan yang lainnya. Eluen dengan klorofrom:etil asetat (5:5) selanjutnya digunakan untuk pengujian profil kimia pada semua ekstrak dan fraksi buah takokak. Contoh hasil KLT fraksi K buah takokak ditunjukkan pada Gambar 5.
19
Gambar 5 Contoh hasil KLT fraksi K buah takokak dengan 5 kali ulangan pada λ
= 254 nm (A), dan λ = 366 nm (B).
Analisis Profil Kimia Ekstrak dan Fraksi Buah Takokak dengan HPLC
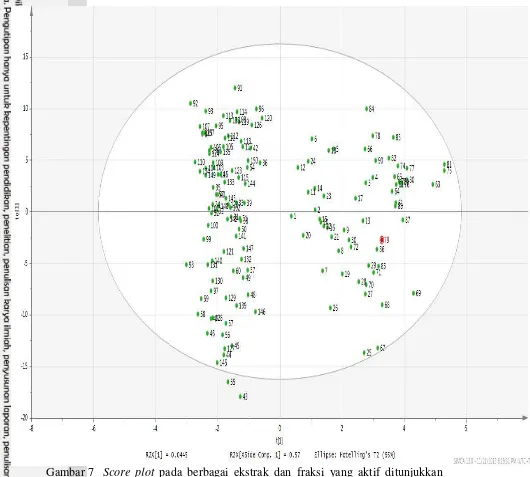
Kromatogram hasil analisis HPLC didapatkan sebanyak 150 kromatogram dari berbagai ekstrak dan fraksi. Contoh kromatogram fraksi K buah takokak pada serapan UV 310 nm ditunjukkan pada Gambar 6. Hasil score plot menunjukkan pemisahan berbagai ekstrak dan fraksi yang aktif dan yang tidak aktif (Gambar 7). Y related coefficient plot menunjukkan bahwa pada selang waktu retensi 17,76-18,08 menit diketahui berkolerasi signifikan dengan aktivitas antibakteri berupa adanya nilai Y related coefficient positif yang tertinggi di antara selang waktu retensi lainnya (Gambar 8).
Gambar 6. Contoh kromatogram fraksi K buah takokak pada serapan UV 310 nm dengan nilai Y menunjukkan peak area (mAU) dan nilai X waktu retensi (menit).
Bercak Bercak
A
B
Peak area (mAU)
20
Gambar 7 Score plot pada berbagai ekstrak dan fraksi yang aktif ditunjukkan pada bagian kanan dan fraksi yang tidak aktif ditunjukkan pada bagian kiri. Penomoran menunjukkan nomor ekstrak dan fraksi.
21
Gambar 8 Y related coefficient plot pada selang waktu retensi 17,76-18,08 menit (Var. 112) terhadap aktivitas antibakteri (DIZ). Nilai koefisien relatif Y positif menunjukkan selang waktu retensi berkorelasi terhadap aktivitas antibakteri.
Gambar 9 X varian plot menunjukkan penyebaran peak area pada selang waktu retensi 17,76-18,08 menit pada ekstrak dan fraksi buah takokak yang dengan berbagai ulangan dan serapan UV. Penyebaran peak area didominasi oleh fraksi K yang selanjutnya digunakan untuk tahapan identifikasi.
Peak Area
(mAU)
Ekstrak dan fraksi pada berbagai ulangan dan
Y Related Coefficient
Selang waktu retensi setiap 0,16 dengan simbol Var.
Var. 112
22
Identifikasi Komponen Bioaktif dengan LC-MS
Analisis menggunakan LC-MS dilakukan pada hasil preparasi fraksi K ulangan 4 pada selang waktu retensi 17,76-18,08 menit pada serapan UV λ = 310 nm sebagai sampel dan DMSO sebagai pelarut (Gambar 10). Dari kromatogram dapat diketahui bahwa peak-peak yang berada pada menit ke 3,19 sampai 3,68 merupakan peak-peak target yang kemungkinan berasal dari senyawa-senyawa aktif. Peak-peak tersebut adalah peak pada menit ke 3,19, 3,32, dan 3,68. Pada menit ke 3,19 dari mass spectra diketahui senyawa yang muncul adalah senyawa dengan [M-H]+ = 887 dan rumus molekul C45H75O17 (Gambar 11). Menurut Arthan et al. (2002), pada buah takokak terdapat senyawa torvoside A yang memiliki m/z 887 dan rumus molekul C45H75O17.
Pada menit ke 3,32 dari mass spectra diketahui senyawa yang muncul adalah senyawa dengan [M-H]+ = 885 dan rumus molekul C45H73O17 (Gambar 12). Menurut Arthan et al. (2002), pada buah takokak terdapat senyawa torvoside H yang memiliki m/z 885 dan rumus molekul C45H73O17. Menurut penelitian tersebut, torvoside H merupakan senyawa aktif terhadap virus herpes simplex tipe 1.
Gambar 10 Kromatogram DMSO (A) dan kromatogram fraksi K ulangan 4 pada selang waktu retensi 17,76-18,08 menit dengan serapan UV 310 nm (B). Terlihat peak-peak pada menit ke 3,19 sampai 3,68 merupakan peak-peak yang diduga sebagai komponen aktif.
Waktu retensi (menit)
Waktu retensi (menit)
Peak Area
(%)
Peak Area
(%)
A
23
Gambar 11 Contoh mass spectra pada menit ke 3,19 pada selang waktu retensi 17,76-18,08 menit fraksi K ulangan 4 buah takokak. Senyawa aktif yang berada pada menit ke 3,19 adalah senyawa dengan m/z 887.
Gambar 12 Contoh mass spectra pada menit ke 3,32 pada selang waktu retensi 17,76-18,08 menit fraksi K ulangan 4 buah takokak. Senyawa aktif yang berada pada menit ke 3,32 adalah senyawa dengan m/z 885. Pada menit ke 3,68 dari mass spectra diketahui senyawa yang muncul adalah senyawa dengan [M-H]+ = 577 dan rumus molekul C33H53O8 (Gambar 13). Menurut Yahara et al. (1996), pada aerial dan akar takokak terdapat senyawa torvoside G yang memiliki m/z 577 dan rumus molekul C33H53O8. Belum ada penelitian yang meneliti senyawa torvoside A, torvoside G, dan torvoside H sebagai komponen aktif antibakteri. Dengan adanya hasil analisis HPLC dan LC-MS berupa kromatogram yang menunjukkan peak pada senyawa tersebut yang dominan maka dari penelitian ini, dapat diketahui bahwa torvoside A, torvoside G, dan torvoside H merupakan komponen yang diduga memiliki aktivitas
[M-H]+
24
antibakteri pada bakteri Staphylococcus aureus. Pada Gambar 14 ditunjukkan stuktur kimia torvoside A, torvoside G, dan torvoside H.
Gambar 13 Contoh mass spectra pada menit ke 3,68 pada selang waktu retensi 17,76-18,08 menit fraksi K ulangan 4 buah takokak. Senyawa aktif yang berada pada menit ke 3,68 adalah senyawa dengan m/z 577.
O
25
5. SIMPULAN DAN SARAN Simpulan
Hasil uji aktivitas antibakteri menunjukkan daya hambat (DIZ) pertumbuhan bakteri Staphylococcus aureus pada fraksi K rata-rata sebesar 6,67 mm dan pada ekstrak M rata-rata sebesar 4,33 mm dengan konsentrasi 340-370 mg/ml. Hasil OPLS menunjukkan bahwa komponen yang diduga memiliki aktivitas antibakteri signifikan dari ekstrak buah takokak (Solanum torvum Swartz) adalah senyawa-senyawa yang muncul pada selang waktu retensi 17,76-18,08 menit dengan serapan UV λ = 310 nm dari fraksi K. Senyawa-senyawa tersebut adalah torvoside A, torvoside G, dan torvoside H. Torvoside A, torvoside G, dan torvoside H merupakan senyawa-senyawa yang diduga memiliki aktivas antibakteri pada bakteri Staphylococcus aureus.
Saran
Konfirmasi identitas senyawa torvoside A, torvoside G, dan torvoside H pada buah takokak dengan menggunakan instrumen yang lain masih perlu dilakukan.
DAFTAR PUSTAKA
[AOAC] The Association Official Analytical Chemists. 2000. Official Methods of Analysis. Washington DC: AOAC.
Allwood JW, R Goodacre. 2010. An Introduction to Liquid Chromatography– Mass Spectrometry Instrumentation Applied in Plant Metabolomic Analyses. J. Phytochem. Anal., 21: 33–47.
Andarwulan N, Dewi K, Riza AA, Hardianzah R, Anna VR, Bradley WB. 2012. Polyphenols, carotenoids, and ascorbic acid in underutilized medicinal vegetables. Journal of Functional Foods, 4: 339-347.
Arthan D, Svasti J, Kittakoop P, Pittayakhachonwut D, Tanticharoen M, Thebtaranonth Y. 2002. Antiviral isoflavonoid sulfate and steroidal glycosides from the fruits of Solanum torvum. J. Phytochemistry 59: 459-463.
Bari MA, W Islam, AR Khan, A Mandal. 2010. Antibacterial and Antifungal Activity of Solanum torvum (Solanaceae). Int. J. Agric. Biol., 12 (3): 386–390. Bhawani SA, Sulaiman O, Hashim R, Mohamad Ibrahim MN. Thin-Layer
Chromatographic Analysis of Steroids: A Review. Tropical Journal of Pharmaceutical Research June, 9(3): 301-313.
Chah KF, KN Muko, SI Oboegbulem. 2000. Antimicrobial activity of methanolic extract of Solanum torvum fruit. J. Fitoterapia, 71: 187-189.
26
Choi YH, Sarah S, Hye KK, Erica GW, Filippos M, Alfons WML, Cornelis E, Sergio DPK, Robert V. 2005. Classification of Ilex Species Based on Metabolomic Fingerprinting Using Nuclear Magnetic Resonance and Multivariate Data Analysis. J. Agric. Food Chem., 53: 1237-1245.
CLSI (Clinical Laboratory Standards Institute). 2008. Performance Standards for Antimicrobial Disk and Dilution Susceptibility Tests for Bacteria Isolated from Animals; Approved Standard-Third Edition. M31-A3. 28 (8).
Dickson H, KW Kittredge, AM Sarquis. 2004. Thin-Layer Chromatography: The “Eyes” of the Organic Chemist. Journal of Chemical Education. 81(7): 1023-1025.
Eriksson L, Johansson E, Kettaneh-Wold N, Wold S. 2001. Multi-and megavariate data analysis. Umeå: Umetrics.
Gandhi, GR, S Ignacimuthu, MG Paulraj. 2011. Solanum torvum Swartz. fruit containing phenolic compounds shows antidiabetic and antioxidant effects in streptozotocin induced diabetic rats. J. Food and Chemical Toxicology, 49: 2725–2733.
Gelgel MA, Wirasuta. 2008. Analisis toksikologi forensik dan interpretasi temuan analisis. Indonesian Journal of Legal and Forensic Sciences, Volume 1 (1): 47-55.
Gupta SK, SC Tripathi. 2011. Fungitoxic activity of Solanum torvum against Fusarium sacchari. J. Plant Protect. Sci., 47 (3): 83–91.
Hall RD. 2006. Plant metabolomics: from holistic hope, to hype, to hot topic. J. New Phytologist, 169: 453-468.
Harborne, JB. 1973. Phytochemical Methods. London: Chapman and Hall.
Jaiswal, BS. 2012. Solanum torvum: a review of its traditional uses, phytochemistry and pharmacology. Int J Pharm Bio Sci, 3(4): (P) 104-111. Kementerian Negara Riset dan Teknologi RI. 2
Juni 2012].
Kusirisin W, C Jaikang, C Chaiyasut, P Narongchai. 2009. Effect of polyphenolic compounds from Solanum torvum on plasma lipid peroxidation, superoxide anion and cytochrome P450 2E1 in human liver microsomes. J. Medicinal Chemistry, 5: 583-588.
Lalitha V, KA Raveesha, B Kiran. 2010. Antimicrobial activity of Solanum torvum Swartz. against important seed borne pathogens of paddy. Iranica Journal of Energy & Environment, 1(2): 160-164.
Mahapatra AK, S Mishra, UC Basak, PC Panda. 2011. Nutrient Analysis of Some Selected WildEdible Fruits of Deciduous Forests of India: an Explorative Study towards Non Conventional Bio-Nutrition. Advance Journal of Food Science and Technology 4(1): 15-21.
Mohan M, S Kamble, P Gadhi, S Kasture. 2010. Protective effect of Solanum torvum on doxorubicin-induced nephrotoxicity in rats. J. Food and Chemical Toxicology, 48: 436–440.
Murnasih T. 2005. Potensi mikroorganisme sebagai sumber bahan obat-obatan dari laut yang dapat dibudidayakan. Oseanografi LIPI 29(1): 1-7.
27
Onwubiko NE, NM Sadiq. 2011. Antibiotic sensitivity pattern of Staphylococcus aureus from clinical isolates in a tertiary health institution in Kano, Northwestern Nigeria. Pan African Medical Journal. 8: 4.
Parthasarathy S, JB Azizi, S Ramanathan, S Ismail, S Sasidharan, MIM Said, SM Mansor. 2009. Evaluation of antioxidant and antibacterial activities of aqueous, methanolic, and alkaloid extracts from Mitragyna speciosa (Rubiaceae family) leaves. J. Molecules, 14: 3964-3974.
Pelczar MJ, ECS Chan. 1988. Dasar-dasar Mikrobiologi Jilid 1. UI Press, Jakarta. Pérez-Amador MC, VM Ocotero, JMG Castañeda, ARG Esquinca. 2007.
Alkaloids in Solanum torvum Sw. (Solanaceae). International journal of experimental botany, 76: 39-45.
Purwanti E. 2009. Profil komponen bioaktif tanaman kava-kava (Piper methysticum, Forst) dengan pelarut etanol dan metanol. Malang: Lembaga Penelitian Universitas Muhammadiyah Malang.
Rammohan M, CS Reddy. 2010. Anti-inflammatory activity of seed and fruit wall extract of Solanum torvum. J. Hygeia. J. D. Med., 2(2): 54-58.
Rubin JE, Katherine RB, Manuel C-T. 2011. Antimicrobial susceptibility of
Staphylococcus aureus and Staphylococcus pseudintermedius isolated from
various animals. CVJ. 52: 153-157.
Samsudin. 2008. Azadirachtin metabolit sekunder dari tanaman mimba sebagai bahan insektisida botani Sartini M, Natsir D, Gemini A. 2007. Ekstraksi komponen bioaktif dari limbah
kulit buah kakao dan pengaruhnya terhadap aktivitas antioksidan dan antimikroba. Makassar: Fakultas Farmasi, Universitas Hasanuddin.
Scott RPW. 2003. Principles and Practice of Chromatography. Book 1 Chrom-Ed Book Series. Libraryforscience. LLC. 100 hal.
Simanjuntak P. 2003. Strategi pencarian senyawa bioaktif baru dari sumber bahan alami tumbuhan. Jurnal ilmu kefarmasian Indonesia. 1 (2): 19-23.
Sirait N. 2009. Terong cepoka (Solanum torvum) herba yang berkhasiat sebagai obat. Warta Penelitian dan Pengembangan Tanaman Industri. 15(1): 10-12. Sivapriya M, R Dinesha, R Harsha, SST Gowda, L Srinivas. 2011. Antibacterial
activity of different extracts of sundakai (Solanum torvum) fruit coat. International Journal of Biological Chemistry. 5 (1): 61-67.
Starr F, K Starr, L Loope. 2003. Solanum torvum. United States Geological Survey--Biological Resources Division. Haleakala Field Station, Maui, Hawai'i. 1-4.
Sumner LW, Ewa U-W, Corey DB. 2007. Metabolomics data analysis, visualization, and integration in Plant Bioinformatics: Methods and Protocols. Series: Methods in Molecular Biology. 406: 409-436.
Trygg J, Wold S. 2002. Orthogonal projections to latent structures (O-PLS). Journal of Chemometrics, Volume 16 (3): 119–128.
van Elswijk DA, H Irth. 2003. Analytical tools for the detection and characterization of biologically active compounds from nature. J. Phytochemistry Reviews, Volume 1(3): 427-439.
28
White DG, Ayers S, Maurer JJ, Thayer SG, Hofacre C. 2003. Antimicrobial susceptibilities of Staphylococcus aureus isolated from commercial broilers in northeastern Georgia. Avian Dis. 47: 203–210.
Widyastuti U, Giyanto, Suharsono, Naotake O, Shigehiko K. 2009. Sistematisasi Produk Metabolit Sekunder Alami Indonesia sebagai Bahan Obat Herbal Menggunakan Pendekatan Metabolomik. Direktorat Jendral Pendidikan Tinggi, Departemen Pendidikan Nasional.
Yahara S, T Yamashita, N Nozawa (N Fujimura), T Nohar. 1996. Steroidal glycosides from Solanum torvum. J. Phytochemistry, 43(5): 1069-1074.
Yani A. 2011. Fraksinasi komponen aktif antibakteri ekstrak kulit batang tanaman berenuk (Crescentia cujete L). Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Yi L-z, D Yuan, Y Liang, P Xie, Y Zhao. 2007. Quality control and discrimination of Pericarpium Citri Reticulatae and Pericarpium Citri Reticulatae Viride based on high-performance liquid chromatographic fingerprints and multivariate statistical analysis. J. Analytica Chimica Acta, 588: 207–215.
Yuliana ND, Alfi K, Robert V, Young H. C. 2011. Comprehensive Extraction Method Integrated with NMR Metabolomics: A new bioactivity screening method for plants, adenosine A1 receptor binding compounds in Orthosiphon stamineus Benth. J. Anal. Chem., 83: 6902–6906.
29
Lampiran 1. Hasil perhitungan kadar air buah takokak segar
Lampiran 2. Hasil tepung buah takokak
Tahap Berat buah segar (g)
Hasil pengeringan beku (g) Hasil penepungan (g)
Keterangan Buah kering Buah basah Berat tepung Sisa ampas Hilang
1. 1000 103,382 346 98,5 2,5 2,382 -
2. 780,5 17 342 - - - Sebagian besar buah busuk karena
listrik mati di hari kedua
Tahap Berat buah segar (g)
Hasil pengeringan beku (g) Hasil penepungan (g)
Keterangan Buah kering Buah basah Berat tepung Sisa ampas Hilang
4. 1488,5 116 Tidak
ampas dari tahap 1 dan 4)
4,5 1,02 -
Lampiran 3. Hasil uji kadar air tepung buah takokak
Lampiran 4. Hasil ekstrak dan fraksi buah takokak
Sampel
Lampiran 6. Hasil uji aktivitas antibakteri ekstrak dan fraksi buah takokak
Sampel
Lampiran 7. Hasil uji aktivitas antibakteri pada pelarut ekstrak dan fraksi buah takokak
Pelarut Ulangan Pelarut
Konsentrasi
(mg/ml) U
Diameter Penghambatan (mm)
Rata-Rata Diameter
Penghambatan (mm) SD RSD
RSD Horwitz
U4
1 - - - - -
2 - - - - -
3 - - - - -
U5
1 - - - - -
2 - - - - -
3 - - - - -
RIWAYAT HIDUP
Bismillahirrohmanirrohiim. Penulis dilahirkan di kota Pekanbaru 27 April 1989 anak ke-3 dari tiga bersaudara, Ayah Mas’ud dan Ibu Ermi. Pendidikan dasar, menengah pertama, dan menengah atas penulis selesaikan di kota Pekanbaru Riau yaitu SDN 018 tahun 2000, SLTPN 5 tahun 2003, SMAN 9 tahun 2006, sedangkan pendidikan tinggi penulis selesaikan di kota Bogor yaitu di Institut Pertanian Bogor Fakultas Teknologi Pertanian Departemen Ilmu dan Teknologi Pangan tahun 2010. Selanjutnya pada tahun 2011 penulis tercatat sebagai mahasiswa program pascasarjana di Program Studi Ilmu Pangan Fakultas Teknologi Pertanian Institut Pertanian Bogor.
Selama mengikuti program S-2, penulis menjadi manajer program di Yayasan Rubi Indonesia yang bergerak di bidang pendidikan dengan masa kepengurusan tahun 2011-sekarang serta penulis juga merupakan penerima Beasiswa Unggulan DIKTI tahun 2011. Penulis juga telah berhasil mengirimkan manuskrip hasil penelitian sebagai bentuk upaya publikasi pada Biotropia Journal pada tanggal 23 Desember 2013. Pada tanggal 22 Januari 2014 penulis dinyatakan lulus dalam ujian sidang tesis yang berjudul Aplikasi Metabolomik untuk Mengidentifikasi Komponen Bioaktif: Komponen Antibakteri dari Ekstrak Buah Takokak (Solanum torvum Swart).