DISAIN NESTED PRIMER GEN HEMOLISIN UNTUK
MENDETEKSI Vibrio harveyi PADA UDANG PENAEID
MELALUI PCR
WAWAN ABDULLAH SETIAWAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Disain Nested Primer Gen Hemolisin untuk Mendeteksi Vibrio harveyi pada Udang Penaeid Melalui PCR adalah benar karya saya bersama dengan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
RINGKASAN
WAWAN ABDULLAH SETIAWAN. Disain Nested Primer Gen Hemolisin untuk Mendeteksi Vibrio harveyi pada Udang Penaeid Melalui PCR. Dibimbing oleh UTUT WIDYASTUTI dan MUNTI YUHANA.
Litopenaeus vannamei atau udang putih merupakan salah satu komoditas unggulan dalam budidaya perikanan di Indonesia. Spesies penaeid ini memiliki beberapa keunggulan dibanding spesies udang lainnya, antara lain produktivitasnya yang tinggi dapat mencapai lebih dari 13.600 kg/ha, masa panennya lebih cepat, serta lebih resisten terhadap penyakit. Meskipun lebih resisten, penyakit bakterial vibrio berpendar yang disebabkan oleh Vibrio harveyi masih menjadi kendala dalam usaha pembenihan udang putih di Indonesia.
Aplikasi teknik PCR (Polymerase Chain Reaction) memungkinkan untuk melakukan deteksi dini suatu penyakit yang disebabkan oleh bakteri, termasuk vibriosis pada udang. Nested PCR merupakan variasi dari reaksi PCR biasa. Pada nested PCR dilakukan 2 kali reaksi PCR dimana hasil dari PCR pertama menjadi DNA cetakan bagi PCR kedua. Keuntungan dari nested PCR adalah meminimalkan kesalahan amplifikasi gen dengan menggunakan 2 pasang primer yang sekaligus juga dapat meningkatkan sensitivitas PCR. Gen hemolisin diketahui mempunyai spesifisitas dan sensitivitas yang lebih baik dibanding gen toxR dan gen gyrB sebagai penanda molekuler dalam mendeteksi V. harveyi. Penelitian ini bertujuan untuk mendisain primer nested PCR menggunakan gen hemolisin untuk mendeteksi Vibrio harveyi pada udang penaeid.
Sekuen gen hemolisin dari sampel V. harveyi MR5339 dan V. harveyi 275 dideteksi menggunakan primer yang didisain dari sekuen gen lengkap hemolisin
V. harveyi strain VIB 391 (nomor akses: DQ640264) mulai dari urutan ke-133 sampai urutan ke-756. Primer nested PCR didesain dari sekuen gen hemolisin isolat V. harveyi MR 5339 yang berhasil teramplifikasi oleh primer awal. PCR I
nested PCR didesain untuk mengamplifikasi urutan ke-52 sampai urutan ke-405 dan PCR II nested PCR didesain untuk mengamplifikasi urutan ke-204 sampai urutan ke-405. Hasil uji spesifisitas menunjukkan bahwa primer nested PCR hasil disain hanya mampu mengamplifikasi isolat-isolat V. harveyi. Hasil PCR bagi isolat-isolat bakteri V. parahaemolyticus, V. campbelli, Salmonella sp.,
Edwardsiella tarda, Aeromonas hydrophila, dan Streptococcus iniae yang juga diujikan diketahui tidak terdapat hasil amplifikasi. Berdasarkan uji sensitivitas diketahui bahwa primer nested PCR hasil disain mampu menDisain Primer V. harveyi sampai kepadatan 100 cfu/ml atau konsentrasi DNA sampai 101 fg/µ l. Melalui uji surveillance diketahui bahwa deteksi terendah adalah pada sampel hari ke-3 ekstrak DNA udang mati suspect V. harveyi MR 5339 infeksi awal sebanyak 101 cfu/ml.
SUMMARY
WAWAN ABDULLAH SETIAWAN. Nested Primer Design of Haemolysin Gene to Detect Vibrio harveyi in Penaeid Shrimp By PCR. Under direction of UTUT WIDYASTUTI and MUNTI YUHANA.
Litopenaeus vannamei or white shrimp is one of the most important aquaculture commodity in Indonesia. This penaeid species have several advantages compared to other shrimp species, such as higher productivity that can reach more than 13,600 kg/ha, growth faster and at beginning of introduction it was believed more resistant against diseases. However the later it was known that luminous Vibrio disease still becomes problem in white shrimp hatchery in Indonesia.
Application of PCR (Polymerase Chain Reaction) could allow early detection of disease caused by bacteria, including Vibriosis in shrimp. Nested PCR is a modification of the regular PCR reaction, which use two successive runs of PCR. The first PCR fragment product is used as template for the second PCR. The advantage of nested PCR is to minimize error by using 2 pairs of primers which also means increasing the PCR sensitivity. Haemolysin gene was known has better specificity and sensitivity than toxR gene and gyrB gene as molecular marker to detect V. harveyi. The aim of this study was to design nested PCR primers using haemolysin gene to detect V. harveyi in penaeid shrimp.
Haemolysin gene sequences from V. harveyi MR5339 and V. harveyi 275 samples was detected by primer pair that designed from complete sequence of V. harveyi VIB391 haemolysin gene (accesion number: DQ640264) from 133 to 756 sequence. Nested PCR primers was designed from sequencing result of V.harveyi MR5339 haemolysin gene which have been successfully amplified by the initial primers. Primer pairs I of nested PCR was designed to amplified the DNA fragment from positions 52 to 405. Primer pairs II of nested PCR was designed to amplified the positions 204 to 405. Specificity test showed that nested PCR primers just only amplified V. harveyi isolates. PCR results for isolates V. parahaemolyticus, V. campbelli, Salmonella sp., Edwardsiella tarda, Aeromonas hydrophila, dan Streptococcus iniae was known has no amplification. Based on sensitivity test was known that nested PCR primers designed was able to detect V. harveyi cells density of 100 cfu/ml or at concentration of 101 fg/µ l extracted DNA. From surveillance test, it was observed that lowest concentration was detected on dead shrimp DNA extract suspect V. harveyi MR 5339 initial infected 101 cfu/ml. .
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau
menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau
tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini
DISAIN NESTED PRIMER GEN HEMOLISIN UNTUK
MENDETEKSI Vibrio harveyi PADA UDANG PENAEID
MELALUI PCR
WAWAN ABDULLAH SETIAWAN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Tesis : Disain NestedPrimer Gen Hemolisin Untuk Mendeteksi Vibrio harveyi pada Udang Penaeid Melalui PCR Nama : Wawan Abdullah Setiawan
NRP : P051100031
Disetujui oleh
Komisi Pembimbing
Dr Ir Utut Widyastuti, MSi Dr Munti Yuhana, SPi, MSi
Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana
Bioteknologi
Prof Dr Ir Suharsono, DEA Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia dan rahmat-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2011 sampai bulan April 2013 ini ialah disain nested primer gen hemolisin untuk mendeteksi Vibrio harveyi pada udang penaeid melalui PCR.
Penulis sangat menyadari bahwa proses penyelesaian penelitian dan penulisan tesis ini tidak akan dapat berjalan dengan lancar tanpa dukungan banyak pihak. Karena itu, pada kesempatan ini penulis mengucapkan terima kasih yang tak terhingga kepada Ibu Dr. Ir. Utut Widyastuti, M.S. dan Ibu Dr. Munti Yuhana, S.Pi, M.Si. sebagai pembimbing atas ilmu, cara berfikir, dana dan fasilitas penelitian kepada penulis. Terimakasih penulis haturkan juga atas waktu, kesabaran, serta semangat, bimbingan dan semua masukan yang sangat berarti mulai dari penyusunan proposal, pelaksanaan penelitian hingga penulisan tesis ini yang insya Alloh akan penulis jadikan acuan dalam melangkah ke depan. Penulis juga menyampaikan terima kasih kepada Bapak Dr. Ir. Iman Rusmana, M.S. selaku penguji atas saran dan perbaikan untuk kesempurnaan tesis ini. Terimakasih dan rasa hormat juga penulis sampaikan kepada Bapak Prof. Dr. Ir. Suharsono, DEA sebagai ketua program studi Bioteknologi yang telah banyak memberikan ilmu, saran, dan masukan sejak awal perkuliahan, penelitian, hingga selesainya tesis ini.
Terima kasih penulis sampaikan pula kepada Kementerian Pendidikan dan Kebudayaan Nasional, kepada Bapak Bambang Irawan, Bapak Sumardi, dan Ibu C. N. Ekowati, serta Bapak/Ibu dosen Jurusan Biologi Universitas Lampung sebagai orang tua penulis atas arahan, kesempatan, dan penyediaan beasiswa sehingga penulis dapat melanjutkan pendidikan pada program Magister di Insitut Pertanian Bogor. Semoga penulis dapat mengaplikasikan ilmu yang penulis dapatkan bagi sebesar-besarnya kemajuan di tanah kelahiran penulis, tempat orangtua penulis mencari penghidupan pada khususnya dan khasanah ilmu pengetahuan pada umumnya.
Terimakasih dan penghargaan yang setinggi-tingginya kepada Ibu Dr. Ince Ayu Khairana Kadriah atas semua kebaikannya sehingga penulis dapat mengerjakan penelitian ini. Terima kasih dan penghargaan juga penulis sampaikan kepada Mbak Peppy Elvavina selaku teknisi di Laboratorium BIORIN atas semua masukan, kemudahan, serta kebaikannya selama penelitian. Kepada Pak Keresyanto, Pak Mulya, Pak Yanto, A’ Saeri, Mbak Nia, Mbak Ara, Pak Asep, Mbak Pipit, Pak Ranta, dan Mas Rahman, penulis ucapkan banyak terimakasih atas semua kebaikan dan kebersamaannya kepada penulis. Bapak/Ibu dan rekan-rekan Lab. BIORIN: Pak Muzuni, Bu Ratna, Pak Radite, Bu Cinta, Pak Ulung, Pak Asri, Pak Ilyas, Bu Ifa, Mbak Fajri, Mbak Nurul, Mbak Nuril, Ahya, serta adik-adik tingkat PS Bioteknologi, penulis menyampaikan terima kasih untuk semua kebersamaan yang telah memberi semangat, masukan, dan pengalaman yang tak terlupakan. Terima kasih karena sudah berbagi kebahagiaan, ilmu, dan menjadi pendukung di saat-saat tersulit dalam penyelesaian tesis ini.
Aji, Mas Swastika, Mas Fajarudin, Delih, Mbak Anky, Mbak Neng, dan Mbak Ihat, penulis menyampaikan terima kasih untuk semua kebersamaan yang telah memberi semangat dan pengalaman yang tak terlupakan.
Terima kasih dan penghargaan yang tinggi penulis haturkan kepada istri tersayang Ulia Fajriah, keempat orangtua, dan adik-adik tersayang untuk semua cinta, kasih sayang, dukungan dan perhatiannya selama ini. Terimakasih juga kepada semua pihak yang tidak dapat penulis sebutkan satu persatu yang telah membantu dan memberikan dukungan moril maupun materiil sehingga penulis mampu menyelesaikan program S2 di Institut Pertanian Bogor.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna karena keterbatasan pengetahuan dan wawasan penulis dalam bidang ini. Oleh karena itu, penulis mengharapkan saran, masukan, dan kritikan untuk perbaikan penulisan selanjutnya. Bagaimanapun, penulis berharap semoga tesis ini bermanfaat bagi kemajuan ilmu pengetahuan.
Bogor, Agustus 2014
DAFTAR ISI
3.4 Analisa DNA Vibrio dengan Elektroforesis ... 9
3.5 Uji Kemurnian dan Penghitungan Konsentrasi DNA ... 9
3.6 Desain Primer Awal Gen Hemolisin V. harveyi ... 10
3.7 PCR Menggunakan Primer Awal Gen Hemolisin V. harveyi ... 10
3.8 Elusi Sekuen Gen Hemolisin V. harveyi dan Pengurutan Sekuen Gen Hemolisin ... 11
4.1 PCR Menggunakan Primer Awal Gen Hemolisin V. harveyi MR5339 dan Pengurutan Sekuen Gen Hemolisin ... 14
4.3 Uji Sensitivitas Primer Nested PCR ... 16
4.4 Uji Spesifisitas Primer Nested PCR ... 19
4.5 Surveillance Test ... 22
5 SIMPULAN DAN SARAN 25
5.1 Simpulan ... 25
5.2 Saran ... 25
DAFTAR PUSTAKA 26
LAMPIRAN 29
DAFTAR GAMBAR
Halaman 1 Hasil uji aktivitas hemolisin isolat V. harveyi, V. parahaemolyticus,
Salmonella sp., Edwardsiella tarda, Aeromonas hydrophila, dan
Streptococcus iniae pada medium agar darah ... 4
2 Visualisasi hasil PCR dengan primer awal ... 15
3 Uji sensitivitas primer nested PCR menggunakan DNA V. harveyi MR5339 ... 17
4 Uji sensitivitas primer nested PCR menggunakan DNA V. harveyi 275 ... 18
5 Hasil uji spesifisitas pada kepadatan bakteri 105 cfu/ml s.d 100 cfu/ml ... 19
6 Hasil uji spesifisitas pada ekstrak DNA konsentrasi 102 ng/µ l s.d 101 fg/µ l ... 21
7 Visualisasi hasil PCR dengan nested PCR bagi surveillance test ... 22
8 Visualisasi hasil PCR dengan nested PCR bagi surveillance test sampel ke-7 ... 23
DAFTAR TABEL
Halaman 1 Komposisi pereaksi PCR ... 10
DAFTAR LAMPIRAN
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Disain Nested Primer Gen Hemolisin untuk Mendeteksi Vibrio harveyi pada Udang Penaeid Melalui PCR adalah benar karya saya bersama dengan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
RINGKASAN
WAWAN ABDULLAH SETIAWAN. Disain Nested Primer Gen Hemolisin untuk Mendeteksi Vibrio harveyi pada Udang Penaeid Melalui PCR. Dibimbing oleh UTUT WIDYASTUTI dan MUNTI YUHANA.
Litopenaeus vannamei atau udang putih merupakan salah satu komoditas unggulan dalam budidaya perikanan di Indonesia. Spesies penaeid ini memiliki beberapa keunggulan dibanding spesies udang lainnya, antara lain produktivitasnya yang tinggi dapat mencapai lebih dari 13.600 kg/ha, masa panennya lebih cepat, serta lebih resisten terhadap penyakit. Meskipun lebih resisten, penyakit bakterial vibrio berpendar yang disebabkan oleh Vibrio harveyi masih menjadi kendala dalam usaha pembenihan udang putih di Indonesia.
Aplikasi teknik PCR (Polymerase Chain Reaction) memungkinkan untuk melakukan deteksi dini suatu penyakit yang disebabkan oleh bakteri, termasuk vibriosis pada udang. Nested PCR merupakan variasi dari reaksi PCR biasa. Pada nested PCR dilakukan 2 kali reaksi PCR dimana hasil dari PCR pertama menjadi DNA cetakan bagi PCR kedua. Keuntungan dari nested PCR adalah meminimalkan kesalahan amplifikasi gen dengan menggunakan 2 pasang primer yang sekaligus juga dapat meningkatkan sensitivitas PCR. Gen hemolisin diketahui mempunyai spesifisitas dan sensitivitas yang lebih baik dibanding gen toxR dan gen gyrB sebagai penanda molekuler dalam mendeteksi V. harveyi. Penelitian ini bertujuan untuk mendisain primer nested PCR menggunakan gen hemolisin untuk mendeteksi Vibrio harveyi pada udang penaeid.
Sekuen gen hemolisin dari sampel V. harveyi MR5339 dan V. harveyi 275 dideteksi menggunakan primer yang didisain dari sekuen gen lengkap hemolisin
V. harveyi strain VIB 391 (nomor akses: DQ640264) mulai dari urutan ke-133 sampai urutan ke-756. Primer nested PCR didesain dari sekuen gen hemolisin isolat V. harveyi MR 5339 yang berhasil teramplifikasi oleh primer awal. PCR I
nested PCR didesain untuk mengamplifikasi urutan ke-52 sampai urutan ke-405 dan PCR II nested PCR didesain untuk mengamplifikasi urutan ke-204 sampai urutan ke-405. Hasil uji spesifisitas menunjukkan bahwa primer nested PCR hasil disain hanya mampu mengamplifikasi isolat-isolat V. harveyi. Hasil PCR bagi isolat-isolat bakteri V. parahaemolyticus, V. campbelli, Salmonella sp.,
Edwardsiella tarda, Aeromonas hydrophila, dan Streptococcus iniae yang juga diujikan diketahui tidak terdapat hasil amplifikasi. Berdasarkan uji sensitivitas diketahui bahwa primer nested PCR hasil disain mampu menDisain Primer V. harveyi sampai kepadatan 100 cfu/ml atau konsentrasi DNA sampai 101 fg/µ l. Melalui uji surveillance diketahui bahwa deteksi terendah adalah pada sampel hari ke-3 ekstrak DNA udang mati suspect V. harveyi MR 5339 infeksi awal sebanyak 101 cfu/ml.
SUMMARY
WAWAN ABDULLAH SETIAWAN. Nested Primer Design of Haemolysin Gene to Detect Vibrio harveyi in Penaeid Shrimp By PCR. Under direction of UTUT WIDYASTUTI and MUNTI YUHANA.
Litopenaeus vannamei or white shrimp is one of the most important aquaculture commodity in Indonesia. This penaeid species have several advantages compared to other shrimp species, such as higher productivity that can reach more than 13,600 kg/ha, growth faster and at beginning of introduction it was believed more resistant against diseases. However the later it was known that luminous Vibrio disease still becomes problem in white shrimp hatchery in Indonesia.
Application of PCR (Polymerase Chain Reaction) could allow early detection of disease caused by bacteria, including Vibriosis in shrimp. Nested PCR is a modification of the regular PCR reaction, which use two successive runs of PCR. The first PCR fragment product is used as template for the second PCR. The advantage of nested PCR is to minimize error by using 2 pairs of primers which also means increasing the PCR sensitivity. Haemolysin gene was known has better specificity and sensitivity than toxR gene and gyrB gene as molecular marker to detect V. harveyi. The aim of this study was to design nested PCR primers using haemolysin gene to detect V. harveyi in penaeid shrimp.
Haemolysin gene sequences from V. harveyi MR5339 and V. harveyi 275 samples was detected by primer pair that designed from complete sequence of V. harveyi VIB391 haemolysin gene (accesion number: DQ640264) from 133 to 756 sequence. Nested PCR primers was designed from sequencing result of V.harveyi MR5339 haemolysin gene which have been successfully amplified by the initial primers. Primer pairs I of nested PCR was designed to amplified the DNA fragment from positions 52 to 405. Primer pairs II of nested PCR was designed to amplified the positions 204 to 405. Specificity test showed that nested PCR primers just only amplified V. harveyi isolates. PCR results for isolates V. parahaemolyticus, V. campbelli, Salmonella sp., Edwardsiella tarda, Aeromonas hydrophila, dan Streptococcus iniae was known has no amplification. Based on sensitivity test was known that nested PCR primers designed was able to detect V. harveyi cells density of 100 cfu/ml or at concentration of 101 fg/µ l extracted DNA. From surveillance test, it was observed that lowest concentration was detected on dead shrimp DNA extract suspect V. harveyi MR 5339 initial infected 101 cfu/ml. .
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau
menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau
tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini
DISAIN NESTED PRIMER GEN HEMOLISIN UNTUK
MENDETEKSI Vibrio harveyi PADA UDANG PENAEID
MELALUI PCR
WAWAN ABDULLAH SETIAWAN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Tesis : Disain NestedPrimer Gen Hemolisin Untuk Mendeteksi Vibrio harveyi pada Udang Penaeid Melalui PCR Nama : Wawan Abdullah Setiawan
NRP : P051100031
Disetujui oleh
Komisi Pembimbing
Dr Ir Utut Widyastuti, MSi Dr Munti Yuhana, SPi, MSi
Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana
Bioteknologi
Prof Dr Ir Suharsono, DEA Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia dan rahmat-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2011 sampai bulan April 2013 ini ialah disain nested primer gen hemolisin untuk mendeteksi Vibrio harveyi pada udang penaeid melalui PCR.
Penulis sangat menyadari bahwa proses penyelesaian penelitian dan penulisan tesis ini tidak akan dapat berjalan dengan lancar tanpa dukungan banyak pihak. Karena itu, pada kesempatan ini penulis mengucapkan terima kasih yang tak terhingga kepada Ibu Dr. Ir. Utut Widyastuti, M.S. dan Ibu Dr. Munti Yuhana, S.Pi, M.Si. sebagai pembimbing atas ilmu, cara berfikir, dana dan fasilitas penelitian kepada penulis. Terimakasih penulis haturkan juga atas waktu, kesabaran, serta semangat, bimbingan dan semua masukan yang sangat berarti mulai dari penyusunan proposal, pelaksanaan penelitian hingga penulisan tesis ini yang insya Alloh akan penulis jadikan acuan dalam melangkah ke depan. Penulis juga menyampaikan terima kasih kepada Bapak Dr. Ir. Iman Rusmana, M.S. selaku penguji atas saran dan perbaikan untuk kesempurnaan tesis ini. Terimakasih dan rasa hormat juga penulis sampaikan kepada Bapak Prof. Dr. Ir. Suharsono, DEA sebagai ketua program studi Bioteknologi yang telah banyak memberikan ilmu, saran, dan masukan sejak awal perkuliahan, penelitian, hingga selesainya tesis ini.
Terima kasih penulis sampaikan pula kepada Kementerian Pendidikan dan Kebudayaan Nasional, kepada Bapak Bambang Irawan, Bapak Sumardi, dan Ibu C. N. Ekowati, serta Bapak/Ibu dosen Jurusan Biologi Universitas Lampung sebagai orang tua penulis atas arahan, kesempatan, dan penyediaan beasiswa sehingga penulis dapat melanjutkan pendidikan pada program Magister di Insitut Pertanian Bogor. Semoga penulis dapat mengaplikasikan ilmu yang penulis dapatkan bagi sebesar-besarnya kemajuan di tanah kelahiran penulis, tempat orangtua penulis mencari penghidupan pada khususnya dan khasanah ilmu pengetahuan pada umumnya.
Terimakasih dan penghargaan yang setinggi-tingginya kepada Ibu Dr. Ince Ayu Khairana Kadriah atas semua kebaikannya sehingga penulis dapat mengerjakan penelitian ini. Terima kasih dan penghargaan juga penulis sampaikan kepada Mbak Peppy Elvavina selaku teknisi di Laboratorium BIORIN atas semua masukan, kemudahan, serta kebaikannya selama penelitian. Kepada Pak Keresyanto, Pak Mulya, Pak Yanto, A’ Saeri, Mbak Nia, Mbak Ara, Pak Asep, Mbak Pipit, Pak Ranta, dan Mas Rahman, penulis ucapkan banyak terimakasih atas semua kebaikan dan kebersamaannya kepada penulis. Bapak/Ibu dan rekan-rekan Lab. BIORIN: Pak Muzuni, Bu Ratna, Pak Radite, Bu Cinta, Pak Ulung, Pak Asri, Pak Ilyas, Bu Ifa, Mbak Fajri, Mbak Nurul, Mbak Nuril, Ahya, serta adik-adik tingkat PS Bioteknologi, penulis menyampaikan terima kasih untuk semua kebersamaan yang telah memberi semangat, masukan, dan pengalaman yang tak terlupakan. Terima kasih karena sudah berbagi kebahagiaan, ilmu, dan menjadi pendukung di saat-saat tersulit dalam penyelesaian tesis ini.
Aji, Mas Swastika, Mas Fajarudin, Delih, Mbak Anky, Mbak Neng, dan Mbak Ihat, penulis menyampaikan terima kasih untuk semua kebersamaan yang telah memberi semangat dan pengalaman yang tak terlupakan.
Terima kasih dan penghargaan yang tinggi penulis haturkan kepada istri tersayang Ulia Fajriah, keempat orangtua, dan adik-adik tersayang untuk semua cinta, kasih sayang, dukungan dan perhatiannya selama ini. Terimakasih juga kepada semua pihak yang tidak dapat penulis sebutkan satu persatu yang telah membantu dan memberikan dukungan moril maupun materiil sehingga penulis mampu menyelesaikan program S2 di Institut Pertanian Bogor.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna karena keterbatasan pengetahuan dan wawasan penulis dalam bidang ini. Oleh karena itu, penulis mengharapkan saran, masukan, dan kritikan untuk perbaikan penulisan selanjutnya. Bagaimanapun, penulis berharap semoga tesis ini bermanfaat bagi kemajuan ilmu pengetahuan.
Bogor, Agustus 2014
DAFTAR ISI
3.4 Analisa DNA Vibrio dengan Elektroforesis ... 9
3.5 Uji Kemurnian dan Penghitungan Konsentrasi DNA ... 9
3.6 Desain Primer Awal Gen Hemolisin V. harveyi ... 10 3.7 PCR Menggunakan Primer Awal Gen Hemolisin V. harveyi ... 10 3.8 Elusi Sekuen Gen Hemolisin V. harveyi dan Pengurutan Sekuen
Gen Hemolisin ... 11
4.1 PCR Menggunakan Primer Awal Gen Hemolisin V. harveyi MR5339 dan Pengurutan Sekuen Gen Hemolisin ... 14
4.3 Uji Sensitivitas Primer Nested PCR ... 16 4.4 Uji Spesifisitas Primer Nested PCR ... 19 4.5 Surveillance Test ... 22 5 SIMPULAN DAN SARAN 25
5.1 Simpulan ... 25
5.2 Saran ... 25
DAFTAR PUSTAKA 26
LAMPIRAN 29
DAFTAR GAMBAR
Halaman 1 Hasil uji aktivitas hemolisin isolat V. harveyi, V. parahaemolyticus,
Salmonella sp., Edwardsiella tarda, Aeromonas hydrophila, dan
Streptococcus iniae pada medium agar darah ... 4 2 Visualisasi hasil PCR dengan primer awal ... 15
3 Uji sensitivitas primer nested PCR menggunakan DNA V. harveyi
MR5339 ... 17
4 Uji sensitivitas primer nested PCR menggunakan DNA V. harveyi 275 ... 18 5 Hasil uji spesifisitas pada kepadatan bakteri 105 cfu/ml s.d 100 cfu/ml ... 19
6 Hasil uji spesifisitas pada ekstrak DNA konsentrasi 102 ng/µ l s.d 101 fg/µ l ... 21
7 Visualisasi hasil PCR dengan nested PCR bagi surveillance test ... 22 8 Visualisasi hasil PCR dengan nested PCR bagi surveillance test
sampel ke-7 ... 23
DAFTAR TABEL
Halaman 1 Komposisi pereaksi PCR ... 10
DAFTAR LAMPIRAN
1
1
PENDAHULUAN
1.1 Latar Belakang
Litopenaeus vannamei atau udang putih merupakan salah satu komoditas unggulan dalam budidaya perikanan di Indonesia dimana produksinya pada tahun 2014 ditargetkan sebesar 511 ribu ton (KKP 2010). Spesies ini memiliki beberapa keunggulan dibanding spesies udang lainnya, antara lain produktivitasnya yang tinggi dapat mencapai lebih dari 13.600 kg/ha, masa panennya lebih cepat, serta lebih resisten terhadap penyakit (Boyd dan Clay 2002). Meskipun lebih resisten, penyakit bakterial Vibrio berpendar masih menjadi kendala dalam usaha pembenihan udang putih di Indonesia (Felix et al. 2011). Spesies bakteri Vibrio yang sering menyebabkan kematian massal terutama pada larva udang di Indonesia adalah Vibrio harveyi (Teo et al. 2000). Serangan bakteri Vibrio yang mengakibatkan kematian udang dalam waktu yang cepat dan dalam jumlah yang besar. Bakteri ini merupakan jenis patogen yang menginfeksi dan menyebabkan penyakit pada saat kondisi udang lemah dan faktor lingkungan yang ekstrim (Austin dan Zhang 2006).
Lightner (1996) menyatakan bahwa pemeriksaan Vibriosis pada udang saat ini masih dilakukan secara konvensional yaitu dengan melihat gejala klinis pada tubuh udang, mengisolasi bakteri penyebab penyakit, melakukan uji fisiologi dan biokimia, yang kesemuanya membutuhkan waktu hingga beberapa hari. Jika hasil pemeriksaan tersebut sudah positif menunjukkan Vibriosis, inipun sudah terlambat karena biasanya populasi Vibrio sudah dalam kepadatan yang tinggi, lebih dari 109 cfu/ml sehingga lebih sukar dikendalikan.
Aplikasi teknik PCR (Polymerase Chain Reaction) memungkinkan untuk melakukan deteksi dini suatu penyakit yang disebabkan oleh bakteri, termasuk Vibriosis pada udang. PCR merupakan teknik yang digunakan untuk mengamplifikasi sekuen asam nukleat menggunakan polimerisasi berulang dari sekuen DNA (Kolmodin dan Birch. 2002). Nested PCR merupakan variasi dari reaksi PCR biasa. Pada nested PCR, dilakukan 2 kali reaksi PCR dimana hasil dari PCR pertama menjadi DNA cetakan bagi PCR kedua. Keuntungan dari nested PCR adalah meminimalkan kesalahan amplifikasi gen dengan menggunakan 2 pasang primer yang sekaligus juga dapat meningkatkan sensitivitas PCR (Siebert et al. 1995).
2
Sambrook dan Russel (2001) menerangkan bahwa teknik PCR memungkinkan untuk mengamplifikasi 1 kopi cetakan DNA. Oleh karena itu, dengan menggunakan teknik nested PCR diharapkan dapat ditemukan primer nested PCR yang lebih spesifik dan sensitif bagi gen penyandi hemolisin V. harveyi sehingga keberadaan bakteri Vibrio berpendar patogenik strain lokal pada budidaya udang putih dapat dideteksi lebih dini.
1.2Tujuan Penelitian
3
2 TINJAUAN PUSTAKA
2.1 Vibriosis pada Udang Putih
Udang putih dengan nama ilmiah Litopennaeus vannamei merupakan salah satu komoditas unggulan dalam budidaya perikanan di Indonesia. Selama periode tahun 2003 s.d 2007 ekspor udang cenderung meningkat, yaitu dari 137.636 ton menjadi 160.797 ton (Poernomo 2008). Produksi udang nasional mengalami kenaikan sebesar 2,6% dari 338.060 ton tahun 2009 menjadi 352.600 ton pada tahun 2010. Pemerintah melalui Kementrian Kelautan dan Perikanan menargetkan produksi udang putih pada tahun 2014 sebesar 511 ribu ton (KKP 2010).
Udang putih memiliki beberapa keunggulan dibanding beberapa spesies udang lainnya, diantaranya masa panennya yang lebih cepat, produktifitasnya yang tinggi yang dapat mencapai lebih dari 13.600 kg/ha, dan lebih resisten terhadap penyakit (Boyd dan Clay 2002). Walaupun udang putih lebih resisten terhadap penyakit, penyakit bakterial Vibrio berpendar masih menjadi kendala dalam usaha pembenihan udang putih di Indonesia (Felix et al. 2011).
Penyakit berpendar pada larva udang merupakan penyakit yang berbahaya karena dapat menyebabkan kematian massal. Bakteri Vibrio berpendar sering dilaporkan sebagai penyebab kematian massal pada berbagai ikan laut dan udang di berbagai belahan dunia (Austin dan Zhang 2006). Bakteri Vibrio berpendar juga dilaporkan sebagai agen penyebab utama penyakit Vibriosis pada udang budidaya di wilayah Asia Tenggara yang menyebabkan kerugian yang besar (Lavilla-Pitogo et al. 1998; Liu et al. 1996). Vibriosis telah menyebabkan mortalitas pada berbagai stadia larva, pasca larva, juvenil, dan dewasa (Lightner 1996). Spesies bakteri Vibrio yang sering menyebabkan kematian massal terutama pada larva udang di Indonesia adalah Vibrio harveyi (Teo et al. 2000).
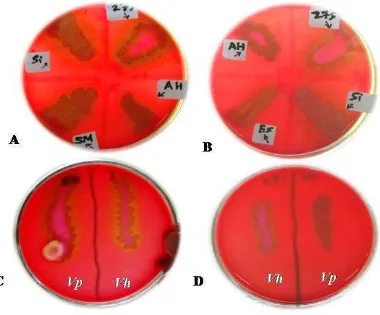
Pada sebagian besar kasus, bukti epidemiologi dan eksperimental menunjukkan bahwa hemolisin terlibat dalam patogenesis penyakit Vibriosis (Shinoda 1999). Hemolisin merupakan enzim yang bertanggung jawab terhadap kerusakan membran sel darah (hemolisis) dan dilaporkan bahwa gen hemolisin terdapat pada beberapa genus Vibrio termasuk V. harveyi (Zhang dan Austin 2005). Kadriah (2013) menerangkan bahwa selain V. harveyi, bakteri V. parahaemolyticus, Salmonella sp., Edwardsiella tarda, Aeromonas hydrophila, dan Streptococcus iniae diketahui mempunyai aktivitas α hemolisin setelah ditumbuhkan di medium agar darah. Hasil uji aktivitas hemolisin disajikan pada gambar 1.
4
Gambar 1 Hasil uji aktivitas hemolisin isolat V. harveyi, V. parahaemolyticus, Salmonella sp., Edwardsiella tarda, Aeromonas hydrophila, dan Streptococcus iniae pada medium agar darah. (A) P-275 = V. harveyi, AH: A. hydrophila, SM = Salmonella sp., Si = S. iniae. (B) P-275 = V. harveyi, Si = S. iniae, ES = E. tarda, AH = A. hydrophila. (C) Vp = V. parahaemolyticus, Vh = V. harveyi. (D) Vh = V. harveyi, Vp = V. parahaemolyticus (Kadriah 2013).
Kadriah (2013) menjelaskan bahwa spesifisitas dan sensitivitas gen hemolisin lebih baik dibanding gen toxR dan gen gyrB sebagai penanda molekuler dalam mendeteksi V. harveyi. Ketiga gen tersebut merupakan gen-gen yang aktif dalam mekanisme patogenitas bakteri genus Vibrio (Pang et al. 2005; Conejero dan Hedreyda 2004; Thaithongnum et al. 2006). Gen-gen yang bertanggung jawab dalam mekanisme patogenitas V. harveyi diekspresikan setelah kondisi kuorum bakteri ini tercapai (Madigan et al. 2012). Dengan kata lain, gen-gen tersebut termasuk dalam gen-gen yang sifat ekspresinya inducible yang terekspresi melalui pengaturan tertentu (Weaver 2012).Primer gen hemolisin hasil disain Kadriah mampu mendeteksi V. harveyi sampai kepadatan 100 cfu/ml dan konsentrasi DNA sebanyak 101 pg.
5
(2006) yang menghasilkan sensitivitas sebesar 1,5 x 101 cfu/ml. Primer hasil disain Thongkao et al. (2013) hanya mampu mendeteksi V. harveyi sampai kepadatan 1,1 x 102 cfu/ml.
Robertson et al. (1998a) pernah mendeteksi V. harveyi menggunakan metode enzyme-linked immunosorbent assays (ELISA), namun tingkat sensitivitasnya hanya sebesar 105 cfu/ml. Buchatip et al. (2010) mendeteksi V. harveyi menggunakan imunosensor berbasis quartz crystal microbalance (QCM) dimana tingkat sensitivitasnya hanya sampai kepadatan 103 cfu/ml, walaupun spesifisitasnya tinggi.
2.2 Nested PCR
PCR merupakan teknik yang digunakan untuk mengamplifikasi sekuen asam nukleat menggunakan polimerisasi berulang dari sekuen DNA. Teknik ini disusun dan dipraktikkan oleh Kary B. Mullis pada pertengahan tahun 1985. Kesederhanaan dan tingginya tingkat kesuksesan amplifikasi sekuen DNA yang diperoleh menyebabkan teknik ini semakin luas penggunaannya (Saiki et al. 1988). Dalam melakukan PCR, ekstrak DNA, enzim DNA polimerase, dan primer direaksikan dalam larutan buffer yang sesuai. Reaksi PCR dilakukan dengan bantuan alat thermocycle (Saiki et al. 1988).
Ekstrak DNA yang digunakan harus murni. Kemurnian ekstrak DNA mempengaruhi hasil PCR dimana jika pada ekstrak DNA banyak pengotornya, maka akan mengganggu proses PCR yang mengakibatkan kesalahan dalam menganalisa. DNA dikatakan murni jika rasio OD260/OD280 berkisar antara 1,8
sampai 2,0 (Sambrook dan Russel 2001). Enzim DNA polimerase saat ini sudah banyak diproduksi oleh perusahaan yang bergerak di bidang molekuler sehingga lebih memudahkan pengguna dalam melakukan PCR (Apte dan Singh 2007).
Reaksi PCR merupakan sebuah siklus yang berlangsung dalam tiga tahapan. Siklus diawali dengan tahap denaturasi pada suhu tinggi (90-95°C) yang mengakibatkan untai ganda DNA mengalami pemisahan menjadi untai tunggal. Tahap selanjutnya adalah penempelan primer (annealing) yang biasanya terjadi pada suhu 45-55°C, primer akan melekat pada DNA cetakan sesuai dengan komplementasi basa nukleotidanya. Tahap yang terakhir yaitu pemanjangan nukleotida (elongation), pembentukan molekul DNA menggunakan molekul-molekul dNTP yang merupakan komponen dari cetakan pada suhu 70-75°C (Kolmodin dan Birch. 2002).
6
Dengan menggunakan nested PCR, jika ada sekuen yang salah diamplifikasi maka kemungkinan bagian tersebut diamplifikasi untuk kedua kalinya oleh primer yang kedua sangat rendah. Dengan demikian, nested PCR sangat spesifik dalam melakukan amplifikasi karena meminimalkan kesalahan amplifikasi gen dengan menggunakan 2 pasang primer (Siebert et al. 1995). Lebih lanjut Nandagopal et al. (2010) melaporkan bahwa nested PCR dengan target sekuen IS6110 pada Mycobacterium tuberculosis mempunyai tingkat sensitivitas dan spesifisitas yang lebih tinggi dibandingkan dengan PCR biasa untuk mendeteksi bakteri tersebut dari fraksi leukosit sampel darah.
2.3 Disain Primer
Primer adalah oligonukleotida spesifik yang komplemen dengan daerah yang ditentukan pada DNA target sebagai tempat dimulainya sintesis DNA baru dengan PCR. Untuk mendapatkan daerah tertentu pada DNA target diperlukan disain primer forward dan reverse dari daerah tersebut. Khusus untuk primer reverse diperoleh dari sekuen antisensenya. Jadi nukleotida yang didapat dari sekuen ujung 3 daerah DNA target tadi dicari komplemennya baru kemudian dibalik (Glick dan Pasternak 2003).
Disain primer spesifik merupakan salah satu faktor yang mempengaruhi keberhasilan amplifikasi DNA dengan PCR. Keakuratan sekuen yang dijadikan acuan dalam pembuatan primer PCR mampu meminimalisir kesalahan amplifikasi yang berupa positif palsu maupun negatif palsu yang akan mengurangi sensitivitas dan atau spesifisitas primer (Apte dan Singh 2007). Ukuran, komposisi, dan homologi primer terhadap DNA target harus ditentukan dengan baik agar diperoleh produk amplifikasi yang diinginkan saat melakukan PCR (Glick dan Pasternak 2003).
Kolmodin dan Birch (2002) menyatakan bahwa primer yang digunakan bisa berukuran antara 20 sampai 30 nukleotida. Sambrook dan Russel (2001) menyatakan bahwa sebaiknya kandungan basa G+C adalah sekitar 50%. Apabila basa G dan C terdapat dalam jumlah banyak pada ujung 3’ akan memungkinkan
terjadinya kesalahan, misalnya terbentuk struktur “jepit rambut” (hair pin). Dalam
penentuan primer, diusahakan agar tidak terjadi perpasangan sendiri (self priming) dan dimer-duplex. Primer yang rendah kandungan basa G dan C nya masih memungkinkan untuk dipilih asalkan primernya berukuran lebih panjang untuk menghindari temperatur melting (Tm) yang terlalu rendah.
Sambrook dan Russel (2001) lebih jauh menerangkan bahwa Tm
berhubungan dengan suhu annealing atau suhu dimana dimulainya hibridisasi/penempelan primer dengan komplemennya pada template. Suhu annealing biasanya lebih rendah 5oC dari Tm. Sesuai dengan peraturan Wallace,
temperatur melting (Tm) dapat ditentukan dengan rumus:
Tm = 4°C (G+C) + 2°C (A+T), dimana
G+C merupakan banyaknya basa G dan C dalam primer yang didisain, sedangkan A+T merupakan banyaknya basa A dan T.
7
Notredame 2003). Sekuen gen dari organisme target dijadikan sebagai acuan dalam mendisain primer untuk memperoleh akurasi yang maksimal (Apte dan Singh 2007).
8
3 BAHAN DAN METODE
3.1 Bahan
Bahan yang digunakan dalam penelitian ini meliputi isolat V. harveyi MR5339 dari koleksi Laboratorium Kesehatan Ikan (LKI) Program Studi Budidaya Perairan Fakultas Perikanan IPB dan isolat V. harveyi 275, V. parahaemolyticus, V. campbelli, Salmonella sp., Edwardsiella tarda, Aeromonas hydrophila, dan Streptococcus iniae dari Laboratorium Karantina Ikan Makassar. Semua isolat bakteri yang digunakan telah diverifikasi (Kadriah 2013). Isolat-isolat V. harveyi dan V. parahaemolyticus diremajakan menggunakan medium Sea Water Complete. Isolat V. campbelli, Salmonella sp., Edwardsiella tarda, Aeromonas hydrophila, dan Streptococcus iniae masing-masing ditumbuhkan dalam medium Luria Bertani.
Sebelum dilakukan disain primer nested PCR, sekuen gen hemolisin V. harveyi sampel dideteksi menggunakan primer awal yang didisain dari gen lengkap hemolisin V. harveyi strain VIB 391 (nomor akses: DQ640264) mulai dari urutan ke-133 sampai urutan ke-756. Primer nested PCR didisain dari sekuen gen hemolisin isolat V. harveyi MR5339 yang berhasil teramplifikasi oleh primer awal. Primer I nested PCR didisain untuk mengamplifikasi urutan ke-52 sampai urutan ke-405 dan primer II nested PCR didisain untuk mengamplifikasi urutan ke-204 sampai urutan ke-405.
3.2 Peremajaan Isolat Bakteri
Isolat-isolat Vibrio diremajakan menggunakan medium Sea Water Complete/ SWC (bacto peptone 5 g, bacto-yeast extract 1 g, gliserol 3 ml, air laut 750 ml, dan akuades 250 ml). Isolat- isolat bakteri lain ditumbuhkan dalam masing-masing 3 ml medium Luria Bertani/ LB (bacto tryptone 10g, bacto-yeast extract 5g, NaCl 10 g, dan akuades 1 l). Isolat-isolat diinkubasikan pada suhu ruang selama 24 jam.
3.3 Ekstraksi DNA Bakteri
Masing-masing koloni bakteri Vibrio ditumbuhkan dalam 3 ml media SWC cair. Isolat-isolat bakteri lain ditumbuhkan dalam masing-masing 3 ml media LB cair. Isolat-isolat tersebut diinkubasi di atas shaker dengan kecepatan 250 rpm pada suhu ruang selama semalam.
dibolak-9
balik perlahan. Larutan kemudian diletakkan di dalam es selama 5 menit. Ke dalam larutan ditambahkan larutan CI (chloroform:isoamylalcohol, perbandingan 4:1) kemudian tabung dibolak-balik perlahan beberapa kali. Tabung selanjutnya disentrifugasi selama 10 menit pada kecepatan 10.000 rpm suhu 4°C.
Fase air yang berada di bagian atas selanjutnya diambil sebanyak 500 µ l lalu dimasukkan ke dalam tabung baru. Selanjutnya ditambahkan 500 µ l PCI (phenol: chloroform:isoamylalcohol, perbandingan 25:24:1). Tabung dibolak-balik perlahan lalu disentrifugasi pada kecepatan 10.000 rpm selama 10 menit suhu 4°C. Fase air yang berada di bagian atas diambil dan dimasukkan ke dalam tabung baru lalu ditambahkan 0,1 kali volume sodium asetat 2M pH 5.2 dan 2 kali volume etanol absolut, kemudian dicampurkan perlahan-lahan untuk kemudian disimpan di dalam pendingin pada suhu -20°C selama 30 menit. Larutan yang ada di dalam tabung lalu disentrifugasi selama 30 menit pada kecepatan 10.000 rpm. Semua supernatan dibuang.
Ke dalam tabung yang berisi pelet, ditambahkan 500 µ l etanol 70% lalu disentrifugasi selama 5 menit pada kecepatan 10.000 rpm. Supernatan lalu dibuang dan pelet dikeringkan dengan alat vakum pada suhu 40oC selama 15 menit. Pelet yang didapat merupakan DNA genom. Ke dalam tabung tersebut lalu ditambahkan 20 µ l dH2O dan 4 µ l/0,2 kali volume RNAse (1 mg/ml) dan
diinkubasi pada suhu 37°C selama 1 jam hingga semalaman. Setelah diinkubasi, dilakukan inaktivasi RNAse dengan menyimpan tabung pada heater blok suhu 70oC selama 10 menit.
3.4 Analisa DNA Vibrio dengan Elektroforesis
Pertama-tama, dibuat suspensi 0,8 % agarose dalam TAE 1X dengan cara melarutkan 0,8 gram agarose dalam 100 ml TAE 1X, kemudian dipanaskan dengan microwave hingga larutan menjadi jernih. Setelah agak dingin dituang ke dalam cetakan dan dibiarkan membeku. Sampel DNA sebanyak 10 μl dicampur
dengan 1 μl loading dye lalu dimasukkan ke dalam sumur gel. Marker lamda juga
dimasukkan sebagai penanda. Elektroforesis dilakukan pada tegangan 100 Volt selama 28 menit. Gel lalu dipindahkan ke dalam larutan ethidium bromide (EtBr) 0,5 mg/l selama 5 menit dan selanjutnya diamati di atas UV setelah sebelumnya dicuci dengan dH2O.
3.5 Uji Kemurnian dan Penghitungan Konsentrasi DNA
Sebanyak 1 μL sampel DNA dilarutkan dengan 699 μL ddH2O kemudian
dianalisis secara kuantitatif dengan spektrofotometer pada OD260 dan OD280.
Diukur 2 x nilai absorbansinya dengan spektrofotometer pada OD260 dan OD280
kemudian dihitung konsentrasi DNA sampel (μg/ml) pada pengenceran 700x tersebut. Dihitung rasio nilai absorbansinya pada OD260/OD280 . Setiap OD260 = 1
10
Menurut Lee et al. (1995), 2,6 fg DNA sebanding dengan 1 sel bakteri V. parahaemolyticus.
3.6 Disain Primer Awal Gen Hemolisin V. harveyi
Pertama-tama dicari sekuen gen hemolisin V. harveyi melalui website EBI (http://www.ebi.ac.uk/). Setelah didapatkan, dicari gen lainnya yang mirip dengan menggunakan program BLAST di website NCBI (http://www.ncbi.nlm.nih.gov). Sekuen hasil BLAST disimpan ke dalam 1 file fasta. File ini selanjutnya akan dianalisis clustalW menggunakan program BIOEDIT untuk mendisain primer awal.
3.7 PCR Menggunakan Primer Awal Gen Hemolisin V. harveyi
Terlebih dahulu dibuat campuran pereaksi PCR. Komposisi pereaksi PCR dijelaskan pada tabel 1 berikut:
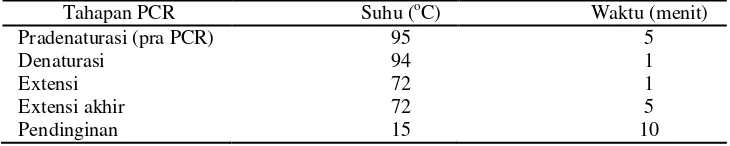
Masing-masing 2 µ l ekstrak DNA konsentrasi 100 ng/µ l dari beberapa isolat V. harveyi akan dicampurkan dengan pereaksi PCR. Pada setiap campuran pereaksi PCR hanya akan dicampurkan dengan 1 strain ekstrak DNA V. harveyi. Campuran-campuran ini lalu dihomogenkan untuk kemudian dilakukan PCR menggunakan alat thermocycler.
Pada alat thermocycler diatur program yang pradenaturasi, denaturasi, extensi, extensi akhir, dan pendinginannya disamakan untuk tiap-tiap primer. Suhu dan waktu annelingnya disesuaikan dengan masing-masing primer. Program ini dilakukan sebanyak 35 siklus. Hasil PCR kemudian dielektroforesis dengan 1% agarose. Program awal ini dipaparkan pada tabel 2.
Tabel 2. Program awal pada alat thermocycler
11
3.8 Elusi Sekuen Gen Hemolisin V. harveyi dan Pengurutan Sekuen Gen Hemolisin
Sekuen DNA V. harveyi hasil PCR di atas selanjutnya diisolasi mengikuti metode Suharsono dan Widyastuti (2010). Gel yang mengandung pita DNA yang diinginkan dipotong diatas UV. Hasil pemotongan dipindahkan ke cawan petri dan dicacah menggunakan scalpel. Gel disaring menggunakan membran hybon N netral dalam tabung mikro. Membran dibasahi dengan 50µ l buffer elusi (0,1 % SDS; 50 mM Tris pH 7,5) sebelum dimasukkan gel. Potongan gel lalu dimasukkan lalu ditambahkan lagi buffer elusi sebanyak 150 µl. Campuran disentrifugasi dengan kecepatan 10.000 rpm selama 5 menit pada suhu 20°. Ke dalam campuran ditambahkan lagi 150 µ l larutan buffer elusi diatas gel dan disentrifugasi kembali dengan kecepatan 10.000 rpm selama 5 menit. Penambahan larutan buffer elusi dilakukan hingga volume total menjadi 500 µ l.
Larutan DNA hasil penyaringan diendapkan dengan penambahan dengan 0,1 kali volume (50 µ l) NaOAc 3 M pH 5 dan ditambah dengan 2 kali volume larutan dengan etanol absolut (1 ml). Hasil penyaringan disimpan dalam freezer bersuhu -20°C selama 30 menit lalu disentrifugasi dengan kecepatan 10.000 rpm pada suhu 4° selama 20 menit. Endapan yang diperoleh dibilas dengan 500 µ l etanol 70% dan disentrifugasi dengan kecepatan 10.000 rpm pada suhu 4° selama 10 menit. Supernatan dibuang dan endapan dikeringkan dengan mesin vakum. Endapan kemudian disuspensikan dengan 10 µ l TE (10 mM Tris-HCl; 1 mM EDTA pH 8). Sekuen DNA yang didapatkan dari isolat V. harveyi ini akan dijadikan sebagai kontrol positif gen hemolisin V. harveyi pada nested PCR selanjutnya. Sekuen ini juga diurutkan basa-basanya dengan alat sequencer menggunakan jasa analisis dari 1st Base.
3.9 Disain Primer Nested PCR
Sekuen yang didapat dari hasil pengurutan akan digunakan untuk mendisain pasangan primer nested PCR. Dalam mendisain pasangan primer dari nested PCR, hasil sekuen yang didapat kemudian dianalisis culstalW menggunakan program BIOEDIT bersama sekuen-sekuen gen hemolisin sebelumnya.
12
ekstrak DNA murni isolat-isolat bakteri V. harveyi akan dilakukan uji penempelan primer bagi nested PCR hasil disain.
3.11 Uji Sensitivitas Primer Nested PCR
Untuk mengetahui sensitivitas primer nested PCR hasil disain, dilakukan pengenceran berseri terhadap genom isolat-isolat bakteri V. harveyi mulai dari pengenceran105, 104, 103, 102, 101, dan 100 cfu/ml. Pengenceran berseri juga dilakukan terhadap ekstrak DNA genom yaitu 102 ng/µ l sampai 101 fg/µ l. Masing-masing hasil pengenceran diamplifikasi dengan PCR menggunakan primer nested PCR hasil disain. Hasil PCR kemudian dielektroforesis untuk melihat ada-tidaknya pita hasil amplifikasi. Sebagai kontrol positif digunakan sekuen DNA isolat V. harveyi hasil PCR menggunakan primer awal sebanyak 102 ng/µ l dan sebagai kontrol negatif digunakan ddH2O steril.
3.12 Uji Spesifisitas Primer Nested PCR
Untuk mengetahui spesifisitas primer nested PCR tersebut terhadap isolat V. harveyi, dilakukan juga amplifikasi dengan PCR terhadap ekstrak DNA bakteri Vibrio non harveyi yaitu V. parahaemolyticus dan V. campbelli serta bakteri non Vibrio yaitu Salmonella sp., E. tarda, A. hydrophila, dan S.s iniae yang telah disiapkan sebelumnya. Sekuen DNA isolat V. harveyi hasil PCR menggunakan primer awal digunakan sebagai kontrol positif dan ddH2O steril digunakan sebagai
kontrol negatif.
3.13 Surveillance Test
Setelah dilakukan uji sensitivitas dan spesifisitas secara in vitro, dilakukan uji lapang melalui pengecekan langsung terhadap udang putih fase post larvae yang diinfeksikan dengan V. harveyi. Bakteri V. harveyi sebelumnya ditumbuhkan di media SWC padat yang mengandung antibiotik rifampisin 50 mg/l untuk memudahkan verifikasi.
Mula-mula post larvae diaklimatisasi selama 24 jam. Selanjutnya post larvae diinfeksikan selama 2 jam dalam suspensi V. harveyi dalam air laut mulai dari konsentrasi 105, 104, 103, 102, 101, dan 100cfu/ml. Air lalu diganti dengan air laut steril. Selama diuji, post larvae diberi pakan Artemia (Wickins dan Lee 2002).
13
ditumbuhkan di media SWC padat yang mengandung antibiotik rifampisin untuk verifikasi infeksi V. Harveyi sampel. Sebagai kontrol positif digunakan sekuen DNA isolat V. harveyi hasil PCR menggunakan primer awal hasil elusi. Ekstrak DNA V. harveyi MR5339 konsentrasi 102 ng/µ l juga digunakan sebagai kontrol positif untuk memperkuat data. Sebagai kontrol negatif digunakan ddH2O steril,
14
4 HASIL DAN PEMBAHASAN
4.1 PCR Menggunakan Primer Awal Gen Hemolisin V. harveyi MR5339 dan Pengurutan Sekuen Gen Hemolisin
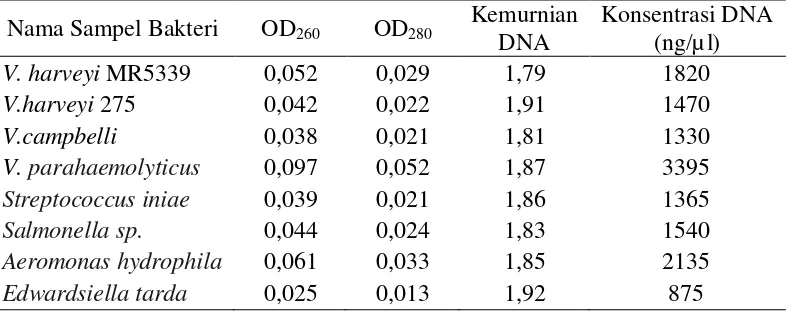
PCR menggunakan primer awal dilakukan pada ekstrak DNA V. harveyi MR5339 dan V. harveyi 275. Ekstraksi DNA juga dilakukan pada isolat-isolat bakteri lain. Semua ekstrak DNA diuji kemurnian dan konsentrasinya yang hasilnya dipaparkan pada tabel 3. Hasil penghitungan uji kemurnian melalui spektrofotometri menunjukkan bahwa ekstrak DNA yang diperoleh telah murni. Kemurnian terendah adalah pada ekstrak DNA V. harveyi yaitu 1,8 dan kemurnian tertinggi adalah pada ekstrak DNA E. tarda yaitu 1,92. Sesuai dengan pernyataan Sambrook dan Russel (2001), DNA dikatakan murni jika rasio OD260/OD280 berkisar antara 1,8 sampai 2,0. Selanjutnya Sambrook dan Russel
(2001) menerangkan bahwa kemurnian DNA mempengaruhi hasil PCR dimana jika pada ekstrak DNA banyak kontaminannya, maka akan mengganggu proses PCR.
Melalui analisa spektrofotometri juga diketahui bahwa konsentrasi DNA terendah adalah pada ekstrak DNA E. tarda yaitu 8,75 x 102 ng/μl dan tertinggi pada ekstrak DNA V. parahaemolyticus yaitu 3,395 x 103 ng/μl. Konsentrasi ini telah memenuhi syarat untuk dilakukan pengujian selanjutnya karena konsentrasi DNA tertinggi yang dibutuhkan dalam penelitian ini adalah 1 x 102ng/μl.
Tabel 3. Hasil penghitungan uji kemurnian dan konsentrasi DNA isolat bakteri.
Nama Sampel Bakteri OD260 OD280 Kemurnian
DNA
Streptococcus iniae 0,039 0,021 1,86 1365
Salmonella sp. 0,044 0,024 1,83 1540
Aeromonas hydrophila 0,061 0,033 1,85 2135
Edwardsiella tarda 0,025 0,013 1,92 875
15
terjadi karena primer awal yang didisain berasal dari daerah yang conserved dimana menurut Apte dan Singh (2007) daerah yang conserved merupakan daerah spesifik gen, bukan spesies. Primer awal ini didesain dari gen hemolisin V. harveyi strain VIB 391 (nomor akses: DQ640264). Tidak munculnya pita amplifikasi pada bakteri non Vibrio dimungkinkan karena tidak identiknya hemolisin yang dimiliki oleh bakteri non Vibrio tersebut (gambar 2). Hal ini diperkuat dengan penelusuran kemungkinan menempelnya primer awal melalui NCBI dimana tidak ditemukan adanya penempelan pada spesies non Vibrio. Dengan kata lain, primer awal hasil disain ini adalah primer spesifik gen hemolisin bakteri genus Vibrio.
Gambar 2 Visualisasi hasil PCR dengan primer awal. Visualisasi hasil PCR dengan primer awal bagi ekstrak DNA V. parahaemolyticus (A), Salmonella sp. (B), E. tarda (C), V. harveyi 275 (D), V. harveyi MR5339 (E), V. campbelli (F), A. hydrophila (G), dan S. iniae (H) dengan marker 1kb dari Invitrogen.
Sekuen gen hemolisin V. harveyi MR5339 yang teramplifikasi diketahui berukuran 624 pb dan sekuen gen hemolisin V. harveyi 275 juga berukuran 624 pb. Setelah dibandingkan dengan sekuen gen hemolisin yang ada di Genebank melalui website NCBI (http://www.ncbi.nlm.nih.gov/), kedua sekuen tersebut mempunyai kemiripan sebesar 99% dengan sekuen gen hemolisin V. harveyi strain VH34, nomor akses EU827170 (lampiran 1 dan 2).
Primer awal ini didisain dari sekuen gen lengkap V. harveyi strain VIB 391 (nomor akses: DQ640264) mulai dari urutan ke-133 sampai urutan ke-756. Tujuan primer awal ini didisain adalah untuk mendapatkan urutan nukleotida sekuen gen hemolisin V. harveyi langsung dari bakterinya dan bukan dari sekuen yang telah terdeposit di Genebank dimana diharapkan dari urutan tersebut dapat didisain primer nested PCR untuk meminimalisir kesalahan amplifikasi yang berupa positif palsu maupun negatif palsu yang akan mengurangi spesifisitas dan sensitivitas dari nested primer yang didisain. Sesuai dengan pernyataan Apte dan Singh (2007), keakuratan sekuen yang dijadikan acuan dalam pembuatan primer PCR mampu meminimalisir kesalahan amplifikasi yang berupa positif palsu maupun negatif palsu yang akan mengurangi spesifisitas dan sensitivitas primer. Komposisi, ukuran, dan homologi primer terhadap DNA target harus ditentukan dengan baik agar diperoleh produk amplifikasi yang diinginkan saat melakukan PCR (Glick dan Pasternak 2003).
16
diekspresikan setelah kondisi kuorum bakteri ini tercapai (Madigan et al. 2012). Dengan kata lain, gen-gen tersebut termasuk dalam gen-gen yang sifat ekspresinya inducible yang terekspresi melalui pengaturan tertentu (Weaver 2012). Dengan mendisain primer dari gen yang bersifat inducible, spesifisitas dan sensitivitas primer memungkinkan untuk menjadi lebih tinggi lagi.
Hemolisin merupakan eksotoksin yang mampu melisis membran sel darah yang menyebabkan terlepasnya ikatan besi pada beberapa protein seperti pada haemoglobin. Hemolisin merupakan jenis toksin yang terdistribusi paling banyak pada bakteri Vibrio patogen (Zhang dan Austin 2005). Pada sebagian besar kasus, bukti epidemiologi dan eksperimental menunjukkan bahwa hemolisin terlibat dalam patogenesis penyakit Vibriosis (Shinoda 1999). Berbagai jenis hemolisin yang diproduksi oleh bakteri genus Vibrio mempunyai kemiripan satu sama lain, tetapi tidak identik. Gen hemolisin yang dimiliki V. harveyi termasuk dalam
kategori α hemolisin yang melisis sel darah secara tidak sempurna. Hemolisin V.
harveyi dinamai Vhh yang termasuk dalam famili thermolable haemolysin/TLH (Zhang dan Austin 2005). Tidak identiknya gen hemolisin memungkinkan lebih tingginya spesifisitas dan sensitivitasnya sebagai marka molekuler dibanding dengan gen toxR maupun gen gyrB, sebagaimana yang telah dilakukan oleh Kadriah (2013).
4.2 Disain Primer Nested PCR
Primer nested PCR didisain dari informasi gen hemolisin V. harveyi MR5339 yang telah disekuen menggunakan jasa 1st Base dari PT. Genetika. Disain primer ini dimulai dengan melakukan alignment terhadap hasil sekuen gen hemolisin yang didapatkan dengan data sekuen yang terdeposit di website NCBI (Claverie dan Notredame 2003). Sekuen-sekuen hasil penjajaran tersebut selanjutnya disimpan di dalam 1 file untuk dianalisis penjajaran dengan metode clustalW pada program BIOEDIT (Hall 1999). Berdasarkan hasil analisis tersebut, dipilih daerah yang paling tidak conserved untuk dijadikan primer. Sesuai dengan pernyataan Apte dan Singh (2007), daerah yang paling tidak conserved merupakan daerah spesifik spesies tersebut sehingga pemilihan daerah tersebut meningkatkan sensitivitas dan spesifisitas dalam mengamplifikasi sekuen gen hemolisin V. harveyi.
Daerah yang paling tidak conserved dan yang paling memungkinkan dari gen hemolisin V. harveyi MR5339 diketahui berada pada urutan ke-52 sampai urutan ke-405. Daerah amplifikasi primer nested PCR hasil disain ditunjukkan pada lampiran 3. Primer I nested PCR didisain untuk mengamplifikasi urutan ke-52 sampai urutan ke-405 dan primer II nested PCR didisain untuk mengamplifikasi urutan ke-204 sampai urutan ke-405.
4.3 Uji Sensitivitas Primer Nested PCR
17
digunakan mempunyai sensitivitas hingga s.d 100 cfu/ml mendeteksi V. harveyi MR5339 (gambar 3a dan 3b). Hasil PCR dengan primer I nested PCR menghasilkan pita yang berukuran 354 pb. Adanya 2 pita yang muncul pada hasil PCR II dimungkinkan karena suhu penempelan primer yang berdekatan, yaitu 63oC untuk PCR I dan 64oC untuk PCR II sehingga primer dari PCR I yang kemungkinan terikut dari pengambilan produk PCR I ikut mengamplifikasi pada reaksi PCR II. Sesuai dengan Sambrook dan Russel (2001), pada optimasi PCR, suhu penempelan primer yang berdekatan masih memungkinkan untuk penempelan primer. Mengacu kepada kontrol positif, kemunculan 2 pita tersebut tidak mempengaruhi kesimpulan akhir penelitian ini.
Nested PCR I Nested PCR II
Gambar 3 Uji sensitivitas primer nested PCR menggunakan DNA V. harveyi MR5339. a) Hasil PCR dengan primer I nested PCR (A5 s.d. A0 = ekstrak DNA bakteri V. harveyi MR5339 pengenceran berturut-turut dari 105 cfu/ml s.d 100 cfu/ml). b) Hasil PCR dengan primer II nested PCR dan DNA produk PCR I masing-masing sebanyak 1 µ l (A5 s.d. A0 = Produk PCR I bakteri V. harveyi MR5339 pengenceran berturut-turut dari 105 cfu/ml s.d 100 cfu/ml). c) Hasil PCR dengan primer I
= marker 100 pb dari Jena Bioscience konsentrasi 60 ng.
18
Uji sensitivitas sangat diperlukan dalam disain primer untuk mendeteksi patogen karena melalui uji ini dapat diketahui adanya kemungkinan munculnya hasil negatif palsu. Tingginya sensitivitas primer PCR mampu meminimalisir hasil negatif palsu (Apte dan Singh 2007). Berdasarkan hasil penelitian ini maka dapat dikatakan bahwa primer nested hasil disain mempunyai sensitivitas yang tinggi. Primer nested PCR yang digunakan dalam penelitian ini diketahui mampu mendeteksi V. harveyi hingga kepadatan 100 cfu/ml dan ekstrak DNA hingga 101 fg/µ l sehingga selanjutnya dapat digunakan sebagai penanda molekuler bagi proses yang berhubungan dengan budidaya maupun pengolahan udang L. vannamei untuk mengantisipasi kontaminasi patogen V. harveyi.
Sebagai perbandingan, Robertson et al. (1998a) hanya mencapai sensitivitas sebesar 105 cfu/ml mendeteksi V. harveyi menggunakan metode enzyme-linked immunosorbent assays (ELISA). Deteksi V. harveyi menggunakan imunosensor berbasis quartz crystal microbalance (QCM) hanya mendeteksi sampai kepadatan 103cfu/ml, walaupun spesifisitasnya tinggi (Buchatip et al. 2010).
Thaitongnum et al. (2006) yang juga mendisain primer untuk mendeteksi V. harveyi menghasilkan sensitivitas sebesar 1,5 x 101 cfu/ml. Primer hasil disain Thongkao et al. (2013) hanya mendeteksi V. harveyi sampai kepadatan 1,1 x 102 cfu/ml. Semua hasil tersebut lebih besar dibandingkan dengan hasil uji sensitivitas dalam penelitian ini. Produk PCR I bakteri V. harveyi 275 pengenceran berturut-turut dari 105 cfu/ml s.d 100 cfu/ml). c) Hasil PCR dengan primer I nested PCR (B2n s.d B1f = ekstrak DNA V. harveyi 275 102 ng/µ l s.d , 101fg/µ l). d) Hasil PCR dengan primer II nested PCR dan DNA produk PCR I masing-masing sebanyak 1 µ l (B2n s.d B1f = ekstrak DNA V. harveyi 275 102 ng/µ l s.d 101fg/µ l). (+)1 = Kontrol positif hasil elusi V. harveyi MR5339 konsentrasi 102 ng/µ l, (-)1 = Kontrol negatif ddH2O,
19
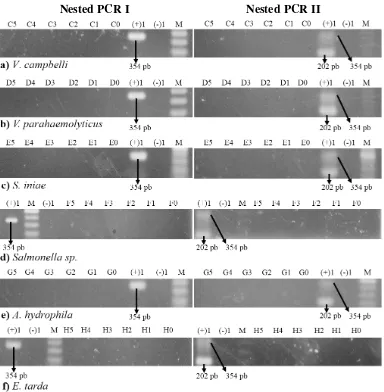
4.4 Uji Spesifisitas Primer Nested PCR
Uji spesifisitas primer nested PCR dilakukan pada kepadatan bakteri 105 cfu /ml s.d 100 cfu/ml dan ekstrak DNA 101 fg/µ l s.d. 102 ng/µ l. Dari hasil PCR ekstrak DNA bakteri V. campbelli, V. parahaemolyticus, S. iniae, Salmonella sp., A. hydrophila, dan E. tarda yang yang digunakan sebagai pembanding dalam uji spesifisitas ini, tidak ada satupun dihasilkan amplikon (gambar 5 dan 6), merujuk pada kontrol positif ((+)1) hasil elusi V. harveyi 275 konsentrasi 102 ng/µ l, kontrol negatif ((-)1) ddH2O.
Nested PCR I Nested PCR II
20
s.d. E0 = ekstrak DNA pengenceran berturut-turut dari 105 cfu/ml s.d 100 cfu/ml. PCR II: E5 s.d. E0 = Produk PCR I pengenceran berturut-turut dari 105 cfu/ml s.d 100 cfu/ml). d) Hasil uji spesifisitas bagi isolat Salmonella sp. (PCR I: F5 s.d. F0 = ekstrak DNA pengenceran berturut-turut dari 105 cfu/ml s.d 100 cfu/ml. PCR II: F5 s.d. F0 = Produk PCR I pengenceran berturut-turut dari 105 cfu/ml s.d 100 cfu/ml). e) Hasil uji spesifisitas bagi isolat A. hydrophila (PCR I: G5 s.d. G0 = ekstrak DNA pengenceran berturut-turut dari 105 cfu/ml s.d 100 cfu/ml. PCR II: G5 s.d. G0 = Produk PCR I pengenceran
Isolat-isolat V. parahaemolyticus, Salmonella sp., Edwardsiella tarda, Aeromonas hydrophila, dan Streptococcus iniae yang digunakan sebagai pembanding dalam penelitian ini diketahui mempunyai kemampuan melisis sel darah. Melalui uji aktivitas hemolisin di medium agar darah, isolat-isolat tersebut mempunyai aktivitas α hemolisin (Kadriah 2013). Tidak munculnya amplikon pada isolat V. parahaemolyticus dan V. campbelli dimungkinkan karena menurut Zhang dan Austin (2005) hemolisin yang diproduksi bakteri genus Vibrio meskipun mirip, namun tidak identik. Dengan semakin jauhnya hubungan taksonomi isolat Salmonella sp., Edwardsiella tarda, Aeromonas hydrophila, dan Streptococcus iniae, maka semakin banyak ketidakmiripan gen hemolisin yang diproduksinya. Dengan kata lain, terdapat perbedaan pada urutan basa nukleotida masing-masing gen hemolisin.
Spesifisitas primer nested hasil disain ini juga tidak terlepas dari tahapan-tahapan yang dilakukan sebelumnya. Primer nested diambil dari sekuen gen V. harveyi MR5339, bukan dari Genebank dan dipilih sekuen yang paling tidak conserved. Apte dan Singh (2007) menjelaskan bahwa keakuratan sekuen yang dijadikan acuan dalam pembuatan primer PCR mampu meminimalisir kesalahan amplifikasi yang berupa positif palsu maupun negatif palsu yang akan mengurangi sensitivitas dan atau spesifisitas primer.
21
Nested PCR I Nested PCR II
22 Kontrol positif hasil elusi V. harveyi MR5339 konsentrasi 102 ng/µ l, (-)1 = Kontrol negatif ddH2O, M = marker 100 pb dari Jena dimungkinkan untuk tervisualisasi (Sambrook dan Russel 2001). Ini juga merupakan kelebihan dari metode nested PCR yang juga membuktikan sensitivitas dan spesifisitasnya dalam mengamplifikasi urutan DNA. Siebert et al. (1995) menerangkan bahwa kelebihan dari nested PCR adalah meminimalkan kesalahan amplifikasi gen dengan menggunakan 2 pasang primer yang sekaligus juga dapat meningkatkan sensitivitas PCR. Dengan menggunakan nested PCR, jika ada sekuen yang salah diamplifikasi maka kemungkinan bagian tersebut diamplifikasi untuk kedua kalinya oleh primer yang kedua sangat rendah (Siebert et al. 1995). Lebih lanjut diketahui bahwa primer nested PCR dengan target sekuen IS6110 pada Mycobacterium tuberculosis mempunyai tingkat sensitivitas dan spesifisitas yang lebih tinggi dibandingkan dengan PCR biasa untuk mendeteksi bakteri tersebut dari fraksi leukosit sampel darah.
Nested PCR I Nested PCR II