KEMAMPUAN BATANG JAGUNG (Zea mays) DALAM
MENGADSORPSI ION LOGAM Cu (II)
SKRIPSI
Oleh
Ahmad Ridho
100405061
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK
KEMAMPUAN BATANG JAGUNG (Zea mays) DALAM
MENGADSORPSI ION LOGAM Cu (II)
SKRIPSI
Oleh
Ahmad Ridho
100405061
SKRIPSI INI DIAJUKAN UNTUK MELENGKAPI SEBAGIAN
PERSYARATAN MENJADI SARJANA TEKNIK
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK
PERNYATAAN KEASLIAN SKRIPSI
Saya menyatakan dengan sesungguhnya bahwa skripsi dengan judul:
KEMAMPUAN BATANG JAGUNG (Zea mays) DALAM
MENGADSORPSI ION LOGAM Cu (II)
dibuat untuk melengkapi sebagian persyaratan menjadi Sarjana Teknik pada Departemen Teknik Kimia Fakultas Teknik Universitas Sumatera Utara.
Skripsi ini adalah hasil karya saya kecuali kutipan-kutipan yang telah saya sebutkan sumbernya.
Demikian pernyataan ini diperbuat, apabila dikemudian hari terbukti bahwa karya ini bukan karya saya atau merupakan hasil jiplakan maka saya bersedia menerima sanksi sesuai aturan yang berlaku.
Medan, 13 Oktober 2015
PENGESAHAN
Stxipsi dengan judut :
KSMAMPUAI\I BATAIIG JAGITNG (Zer aclo) DALAM
MENGADSORPSI tON LOGAI}I Cu (rr]
Dibuat untuk melenglapi persyamtan m€qiadi Saqiana Teloik paaa Oo,parteaoen
Te,knik Kimia Fakulras T€knik Univeisits Sumse*a U{ara Slaipsi
iui
telahdiajukan
@a
sidang ujian skripsipe 2l
Oktober 2015 dao dinyatakanmauhi
syarat/mh sebagai skripsipda
Dqiart€m€n Teknik Kimia FakultasTehik Universitas Sumarera Utax&
Medaa, Oltober 2015
Dosen Pembimbing,
Dosen Penguji
I
Bode Harvento. S.T ilI.T Ph.I)
llIP:
19710130 199903I
001Dosen Penguji
II
Frride Hanum. S.T M.T
*=Q)
KOORDINATOR
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas limpahan rahmat dan karunia-Nya sehingga skripsi ini dapat diselesaikan. Tulisan ini merupakan skripsi
dengan judul “Kemampuan Batang Jagung (Zea mays) Dalam Mengadsorpsi Ion
Logam Cu (II)”, berdasarkan hasil penelitian yang penulis lakukan di Departemen Teknik Kimia Fakultas Teknik Universitas Sumatera Utara. Skripsi ini merupakan salah satu syarat untuk mendapatkan gelar sarjana teknik.
Hasil penelitian ini:
Penelitian ini memberikan informasi tambahan mengenai adsorben yang dibuat dari batang jagung dengan perlakuan berbagai bentuk sebagai pemanfaatan limbah logam berat yang terbuang
Penelitian ini membantu pengurangan logam berat dalam proses adsorpsi sehingga tidak membahayakan kehidupan masyarakat.
Selama melakukan penelitian sampai penulisan skripsi ini penulis banyak mendapat pengarahan dan bimbingan dari dosen pembimbing penulis. Untuk itu secara khusus penulis mengucapakan terima kasih dan penghargaan sebesar-besarnya kepada Bapak Bode Haryanto, S.T M.T Ph.D
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna oleh karena itu penulis mengharapkan saran dan masukan demi kesempurnaan skripsi ini. Semoga skripsi ini memberikan manfaat bagi pengembangan ilmu pengetahuan.
Medan, Oktober 2015
DEDIKASI
RIWAYAT HIDUP PENULIS
Nama : Ahmad ridho NIM : 100405061
Tempat/tgl lahir : Binjai / 14 Desember 1991 Nama orang tua : Kapten. Amin Khasiyanto Alamat orang tua :
Jl. Dahlia Ujung No. 6. Rantauprapat Asal Sekolah :
TK Islam a- ikhlas Medan tahun 1997-1998
SD Negeri 115528 Rantauprapat tahun 1998-2004
SMP Negeri 3 Rantauprapat tahun 2004-2007
MA Negeri Rantauprapat tahun 2007-2010 Pengalaman Organisasi :
KAMMI Komisariat Teknik USU periode 2013 – 2014 sebagai Ketua Umum
Covalen Study Group (CSG) periode 2012 – 2013 sebagai Anggota Bidang Sosial Kerohanian
ABSTRAK
Penelitian ini bertujuan untuk mengetahui kemampuan batang jagung dengan variasi bentuk dalam menyerap ion logam tembaga (Cu2+) pada larutan dengan pH 4,5. Batang jagung yang digunakan dibentuk berupa lingkaran, ½ lingkaran, ¼ lingkaran, 50 mesh, dan 70 mesh. Penelitian ini terbagi menjadi 4 bagian, yaitu penentuan pH netral, pengeringan batang jagung, penentuan waktu kontak optimum dan penentuan kapasitas adsorpsi. Hasil penelitian yang didapatkan adalah waktu kontak optimum yang dibutuhkan adsorben untuk menyerap ion logam Cu2+ selama 120 menit (2 jam). Kapasitas adsorpsi untuk adsorben batang jagung bentuk lingkaran sebesar 4,873 mg/g, bentuk ½ lingkaran sebesar 4,819 mg/g, bentuk ¼ lingkaran sebesar 4,870 mg/g, bentuk serbuk 50 mesh sebesar 4,946 mg/g dan bentuk serbuk 70 mesh sebesar 4,972 mg/g.
ABSTRACT
This research aims to know availability of different shape corn stalk to adsorp cuprum ion (Cu2+) from solution on pH 4,5. Corn stalk has shape square, half square, quarter square, 50 mesh and 70 mesh. This research divided 4 part, there is determine neutral pH, drying corn stalk, determine optimum contact time and determine adsorption capacity. The results of this research is optimum contact time that corn stalk need to adsorp cuprum ion (Cu2+) is about 120 minutes ( 2 h ). Adsorption capacity of corn stalk for square is 4,873 mg/g, for half square is 4,819 mg/g, for quarter square is 4,870 mg/g, for 50 mesh is 4,946 mg/g and for 70 mesh is 4,972 mg/g.
DAFTAR ISI
PERNYATAAN KEASLIAN SKRIPSI i
PENGESAHAN ii
PRAKATA iii
DEDIKASI iv
RIWAYAT HIDUP PENULIS v
ABSTRAK vi
ABSTRAC vii
DAFTAR ISI viii
DAFTAR GAMBAR x
DAFTAR TABEL xii
DAFTAR LAMPIRAN xiii
DAFTAR SINGKATAN xiv
DAFTAR SIMBOL xv
BAB I PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Perumusan Masalah 5
1.3 Tujuan Penelitian 5
1.4 Manfaat Penelitian 5
1.5 Ruang Lingkup Penelitian 5
BAB II TINJAUAN PUSTAKA 7
2.1 Tanaman Jagung 7
2.2 Pencemaran Logam Berat 8
2.3 Logam Berat 10
2.3.1 Definisi Logam Berat 10 2.3.2 Sumber dan Bentuk Logam Berat 10
2.4 Logam Tembaga (Cu) 12
2.5 Adsorpsi
2.5.1 Mekanisme Adsorpsi
13 13 2.5.2 Faktor-faktor yang Mempengaruhi adsorpsi 15
2.6 Adsorben 20
2.7 Analisa Ekonomi 20
BAB III METODOLOGI PENELITIAN 21
3.1 Lokasi dan Waktu Penelitian 21
3.2 Bahan dan Peralatan 21
3.3 Rancangan Percobaan 21
3.4 Prosedur Percobaan 22
3.4.2 Prosedur Persiapan Adsorben (Batang Jagung) 22 3.4.3 Prosedur Batch Adsorption 23
3.5 Flowchart Penilitian 25
3.5.1 Flowchart Persiapan Adsorben 25 3.5.2 Flowchart Pengeringan Adsorben Batang Jagung 25 3.5.3 Flowchart Pembuatan Larutan induk 1000 ppm 26 3.5.3 Flowchart Pembuatan Larutan Cu2+ 50 ppm 26 3.5.4 Flowchart Pembuatan Larutan HCl 0,1 M 27 3.5.5 Flowchart Pembuatan Larutan NaOH 0,1 M 27 3.5.6 Flowchart Prosedur Batch Adsorption 28
BAB IV HASIL DAN PEMBAHASAN 30
4.1 PENGERINGAN ADSORBEN DARI BATANG JAGUNG 30 4.2 PENENTUAN pH NETRAL PADA ADSORBEN
32 BATANG JAGUNG
4.3 PENENTUAN WAKTU KONTAK OPTIMUM 34
4.4 PENENTUAN KAPASITAS ADSORPSI 36
4.4.1 PENGARUH WAKTU ADSORPSI TERHADAP
36 JUMLAH KONSENTRASI TERJERAP (mg/g)
4.4.1 PENGARUH WAKTU ADSORPSI TERHADAP
38 JUMLAH KONSENTRASI TERJERAP (%)
BAB V KESIMPULAN DAN SARAN 41
DAFTAR PUSTAKA 42
LAMPIRAN 1 46
LAMPIRAN 2 49
DAFTAR GAMBAR
Gambar 2.1 Ilustrasi Proses Adsorpsi Adsorben Batang Jagung 14 Gambar 2.2 Interaksi Adsorben Batang Jagung dengan Ion Logam Cu2+ 15 Gambar 2.3 Skema yang Menggambarkan Adsorpsi, Absorpsi dan Presipitasi
Zn Pada Permukaan Besi Oksida 19
Gambar 3.1 Flowchart Persiapan Adsorben 25 Gambar 3.2 Flowchart Pengeringan Adsorben Batang Jagung 25 Gambar 3.3 Flowchart Pembuatan Larutan induk 1000 ppm 26 Gambar 3.4 Flowchart Pembuatan Larutan Cu2+ 50 ppm 26 Gambar 3.5 Flowchart Pembuatan Larutan HCl 0,1 M 27 Gambar 3.6 Flowchart Pembuatan Larutan NaOH 0,1 M 27 Gambar 3.7 Flowchart Penentuan Waktu Kontak Optimum 28 Gambar 3.8 Flowchart Penentuan Kapasitas Adosrpsi 29 Gambar 4.1 Pengeringan Batang Jagung Terhadap Waktu 31 Gambar 4.2 Penentuan pH Netral Pada Adsorben Batang Jagung 33 Gambar 4.3 Pengaruh Waktu Kontak Terhadap Jumlah Ion Logam Cu2+
yang Diadsorpsi 34
Gambar 4.4 Hubungan Antara Jumlah konsentrasi Terjerap Adsorpsi
Dengan Berbagai Bentuk Adsorben 37 Gambar 4.6 Hubungan Antara Jumlah Konsentrasi Terjerap Adsorpsi (%)
Dengan Berbagai Bentuk Adsorben 38
Gambar L3.1.1 Tumpukan Batang Jagung 52
Gambar L3.3.2 Pencucian Batang Jagung Bentuk ½ Lingkaran 55 Gambar L3.3.3 Pencucian Batang Jagung Bentuk ¼ Lingkaran 56 Gambar L3.3.4 Pencucian Batang Jagung Bentuk 50 Mesh 56 Gambar L3.3.5 Pencucian Batang Jagung Bentuk 70 Mesh 57
Gambar L3.4.1 Larutan Logam Ion Cu2+ 58
Gambar L3.3.5 Proses Adsorpsi Batang Jagung 58
Gambar L3.5.1 Peak Ion Logam Cu2+ 59
DAFTAR TABEL
Tabel 1.1 Luas Panen, Produksi dan Produktivitas Jagung Di Indonesi 1 Tabel 1.2 Data Beberapa Hasil Penelitian Terbaru Yang Memanfaatkan
Batang Jagung Sebagai Biosorban 3
Dalam Menyerap Ion Logam
Tabel 3.1 Rancangan Penelitian 22
Tabel 4.1 Batang Jagung Sebelum dan Sesudah Pengeringan 30 Tabel L-1.1 Data Pengeringan Adsorben Batang Jagung 46
Bentuk Lingkaran
Tabel L-1.2 Data Pengeringan Adsorben Batang Jagung
46 Bentuk ½ Lingkaran Dan ¼ Lingkaran
Tabel L-1.3 Data Pengeringan Adsorben Batang Jagung 46
Bentuk 50 Mesh Dan 70 Mesh 47
Tabel L-1.4 Data Hasil Kapasitas Adsorpsi Batang Jagung Pada
47 Berbagai Bentuk
Tabel L-1.5 Data Hasil Penentuan Waktu Optimum
DAFTAR LAMPIRAN
LAMPIRAN 1 DATA HASIL PERCOBAAN 46
L-1.1 DATA HASIL PERSIAPAN ADSORBEN 46 L-1.1.1 Data Pengeringan Adsorben
Batang Jagung Bentuk Lingkaran 46 L-1.1.2 Data Pengeringan Adsorben Batang
Jagung Bentuk ½ Lingkaran
Dan ¼ Lingkaran 46
L-1.1.3 Data Pengeringan Adsorben Batang
Jagung Bentuk 50 Mesh Dan 70 Mesh 46 L-1.2 DATA HASIL KAPASITAS ADSORPSI 47 L-1.3 DATA HASIL PENENTUAN WAKTU OPTIMUM 47
LAMPIRAN 2 CONTOH HASIL PERHITUNGAN 49
L-2.1 PERHITUNGAN PENGERINGAN
49 ADSORBEN BATANG JAGUNG
L-2.2 PERHITUNGAN JUMLAH Cu2+ YANG DIJERAP 50
LAMPIRAN 3 FOTO HASIL PENELITIAN 52
L3.1 FOTO PERSIAPAN ADSORBEN 52 BATANG JAGUNG
L3.2 FOTO PENGERINGAN ADSORBEN 54 BATANG JAGUNG
L3.3 FOTO PENENTUAN (KEASAMAN) pH 55 NETRAL ADSORBEN BATANG JAGUNG
L3.4 FOTO PROSES ADSORPSI ADSORBEN BATANG
58 JAGUNG DENGAN LARUTAN ION LOGAM Cu2+
L3.5 FOTO HASIL ADSORPSI BATANG JAGUNG
DAFTAR SINGKATAN
AAS Atomic Adsorption Spectroscopic SNI Standar Nasional Indonesia pH Power of Hydrogen
DAFTAR SIMBOL
Simbol Keterangan Dimensi
CuSO4.5H2O Tembaga anhidrat mg
C Karbon
O Oksigen
% Persen
HCl Asam klorida ml
NaOH Natrium Hidroksida Gr
H2O Air ml
H+ Ion hidrogen
Q Berat Cu yang terjerap oleh satu gram sampel mg/g
w Berat sampel yang digunakan g
C1 Konsentrasi larutan Cu awal ppm
C2 Konsentrasi larutan Cu akhir ppm
V Volume larutan Cu yang digunakan ml
y Absorbansi
ABSTRAK
Penelitian ini bertujuan untuk mengetahui kemampuan batang jagung dengan variasi bentuk dalam menyerap ion logam tembaga (Cu2+) pada larutan dengan pH 4,5. Batang jagung yang digunakan dibentuk berupa lingkaran, ½ lingkaran, ¼ lingkaran, 50 mesh, dan 70 mesh. Penelitian ini terbagi menjadi 4 bagian, yaitu penentuan pH netral, pengeringan batang jagung, penentuan waktu kontak optimum dan penentuan kapasitas adsorpsi. Hasil penelitian yang didapatkan adalah waktu kontak optimum yang dibutuhkan adsorben untuk menyerap ion logam Cu2+ selama 120 menit (2 jam). Kapasitas adsorpsi untuk adsorben batang jagung bentuk lingkaran sebesar 4,873 mg/g, bentuk ½ lingkaran sebesar 4,819 mg/g, bentuk ¼ lingkaran sebesar 4,870 mg/g, bentuk serbuk 50 mesh sebesar 4,946 mg/g dan bentuk serbuk 70 mesh sebesar 4,972 mg/g.
ABSTRACT
This research aims to know availability of different shape corn stalk to adsorp cuprum ion (Cu2+) from solution on pH 4,5. Corn stalk has shape square, half square, quarter square, 50 mesh and 70 mesh. This research divided 4 part, there is determine neutral pH, drying corn stalk, determine optimum contact time and determine adsorption capacity. The results of this research is optimum contact time that corn stalk need to adsorp cuprum ion (Cu2+) is about 120 minutes ( 2 h ). Adsorption capacity of corn stalk for square is 4,873 mg/g, for half square is 4,819 mg/g, for quarter square is 4,870 mg/g, for 50 mesh is 4,946 mg/g and for 70 mesh is 4,972 mg/g.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Tanaman jagung (Zea mays L.) sangat bermanfaat sebagai bahan makanan bagi kehidupan manusia maupun hewan. Di Indonesia, jagung adalah makanan pokok kedua setelah padi. Sedangkan di dunia, jagung merupakan makanan pokok ketiga setelah gandum dan padi, karena jagung mengandung zat-zat gizi yang dibutuhkan oleh tubuh manusia sama seperti gandum dan padi [1].
Produksi tanaman jagung di Indonesia pada tahun 2010 sebesar 17.844.676 ton pipilan kering, naik 214 ribu ton (1,22 persen) dibandingkan produksi pada tahun 2009, namun menurun lagi pada tahun 2011 yakni 17.643.250 ton pipilan kering [2]. Kebutuhan jagung di Sumatera Utara pada tahun 2010 mencapai 1.377.718 ton yang meningkat sebesar 18,1 persen dari tahun 2009 [3].
[image:20.595.115.530.486.633.2]Badan Pusat Statistik dan Kementrian Pertanian tahun 2013 menyebutkan, bahwa potensi jagung di Indonesia sangat menjanjikan dengan komoditas terbesar setelah tanaman padi, terlihat hasil produksi jagung yang terus meningkat tiap tahunnya, seperti yang dijelaskan dalam tabel di bawah ini.
Tabel 1.1 Luas Panen, Produksi dan Produktivitas Jagung Di Indonesia [4]
Komoditas Indikator Tahun
2010 2011 2012
Jagung
Luas Panen (Ha) 4.131.676 3.864.692 3.957.595 Realisasi Produksi
(Ton) 18.327.636 17.643.250 19.387.022 Impor (Ton) 1.527.476 2.889.173 1.889.431 (Sumber : Badan Pusat Statistik dan Kementrian Pertanian, 2013)
Dari tabel 1.1, terlihat produksi jagung di Indonesia dari tahun 2010 samapi 2012 terus meningkat. Dari segi impor jagung, kita masih membutuhkan 1-2 juta Ton tiap tahunnya.
Melihat pada Rencana Strategis Ditjen Pangan Tahun 2014, untuk tahun 2013 rencana produktivitas jagung dalam negeri mencapai 53,92 Ku/Ha dan target produksi mencapai 26.000.000 Ton jagung.
Dengan terus bertambahnya perluasan area tanaman jagung juga diikuti bertambahnya jumlah batang jagung yang dihasilkan maka ini menjadi peluang untuk meningkatkan nilai ekonominya bila diolah menjadi bahan yang bermanfaat, pemanfaatan ini juga dapat mengurangi potensi pencemaran lingkungan.
Biasanya para petani hanya mengambil buahnya saja sedangkan batang jagung dimanfaatkan sebagai bahan bakar atau cendrung dibuang begitu saja bahkan dibakar. Untuk mengurangi hal demikian, maka perlu ada pemanfaatan limbah batang jagung tersebut, salah satunya adalah dengan menjadikan bahan baku adsorben. Melihat begitu potensialnya tanaman jagung di Indonesia maka ini menjadi peluang yang menjanjikan untuk memanfaatkan batang jagung menjadi produk yang bernilai tinggi [5].
Di sisi lain, masalah lingkungan yaitu pencemaran oleh logam-logam berat seperti tembaga, kadmium, timbal dan besi. Pencemaran ini merupakan hasil dari limbah produksi yang harus diminimalisir keberadaannya dengan metode penyerapan atau adsorpsi. Limbah ion-ion logam ini merupakan masalah serius bagi lingkungan dan perlu perhatian serius. Ion logam yang berada di lingkungan dengan konsentrasi tertentu memberikan efek toksik yang berbahaya bagi kehidupan manusia dan lingkungan sekitar.
Banyak metode yang berkembang untuk menurunkan kadar ion logam berat dari perairan atau badan tanah, misalnya metoda pengendapan, evaporasi, elektrokimia dan penyerapan menggunakan adsorben baik berupa resin sintetik maupun karbon aktif. Namun metode tersebut dianggap kurang efektif sebab memerlukan biaya yang tinggi. Maka untuk itu perlu dicari metode penyerapan dengan menggunakan bahan yang relatif murah dan mudah didapat serta memiliki daya serap tinggi [6].
pulp dan alga telah banyak dikembangkan dalam menyerap ion-ion logam. Bahan penyerap non biosorben juga sudah dikembangkan seperti perlit, tanah gambut dan lumpur aktif [5].
Tabel 1.2 Data Beberapa Hasil Penelitian Terbaru Yang Memanfaatkan Batang Jagung Sebagai Biosorban Dalam Menyerap Ion Logam
Nama Peneliti (Tahun)
Penelitian Hasil Penelitian Sumber
Jurnal
Vafakhah et al. (2014)
Chen, et al. (2014)
Amegrissi, et al. (2013)
- Batang jagung - Tongkol jagung - Menyerap Cu - 70 mesh - pH 1,5-4,5
- 100 mg/L larutan Cu - 220 rpm, 1gr adsorben
- Batang jagung, 50 mesh
- Menyerap Cr(VI) - pH 1,5-5,5
- 100-400 mg/L larutan Cr
- Rentang variasi suhu 298-323 K
- 150 rpm
- Disaring pada 0,45μm - Waktu kontak 60
menit
- Batang jagung - Meyerap logam Cr - Variasi pH 2-7,5 - Variasi lama
pengontakan
- 1 gr adsorben dan 50 mesh dalam 100 ml larutan Cr dalam 200 rpm
- Menguji isothermal adsorpsi bahan
- Waktu optimum 20 menit pertama
- pH optimum 4,5 - adsorben diaktifkan
dengan senyawa asam - kapasitas adsorpsi
sebesar 0,325 mmol/g setelah dimodifikasi
- batang jagung modifikasi mampu menyerap ion logam Cr dar larutan
- mengikuti persamaan isothermal Langmuir - adsorben yang
dimodifikasi lebih baik dari yang biasa
- pH optimum 4
- batang jagung sangant bagus dalam menyerap logam Cr
- adsorben tanpa modifikasi
- waktu optimal pada 15 menit dan konstan pada 90 menit
- pH optimum pada 2-2,5 - didapatkan Langmuir
adsorpsi 0,02
Removal of copper ions from electroplating effluent solutions with native corn cob and corn stalk and chemically modified corn stalk-ELSEVIER
Removal of Cr(VI) from aqueous
solution using modified corn stalks:Characte ristic,equilibriu m, kinetic and thermodynamic study-
ELSEVIER
[image:22.595.115.554.189.724.2]Tabel 1.2 Data Beberapa Hasil Penelitian Terbaru Yang Memanfaatkan Batang Jagung Sebagai Biosorban Dalam Menyerap Ion Logam (sambungan)
Berdasar potensi dari tanaman jagung di Indonesia yang cukup besar, maka dirasa perlu bagi penulis untuk memanfaatkan batang jagung sebagai adsorben. Dalam penelitian ini larutan CuSO4.5H2O akan dikontakkan dengan batang
jagung yang dengan pengaruh bentuk adsorben, dan diharapkan untuk menghasilkan daya serap ion logam yang optimum sehingga dapat mereduksi bahaya logam dalam lingkungan dan bermanfaat bagi masyarakat.
Balakrishnan, et al. (2010)
- karbon aktif - Menyerap ion
logam Cu(II) - Variasi suhu
30-50 0, pada pH konstan 6,5 - Konsentrasi
logam 5-30 ppm, 1 jam
- suhu optimum pada 45 - setelah 40
menit penyerapan konstant - konsentrasi
optimum 10 ppm
- isotermal Langmuir lebih bagus digunakan daripada Freunglich
Studies on the adsorption mechanism of Cu(II) ions by a new activated carbon-Journal of Chemical and Pharmaceutical Research
Lelifajri. (2010) - Menyerap ion logam Cu (II) - Berat asorben
o,5 gr pada konsentrasi tetap 10 ppm - Variasi waktu
sampai 50 menit
- Variasi pH 3 hingga 7 - Menggunakan
lignin dari serbuk gergaji sebagai adsorben
- pH optimum pada pH 6 - waktu
optimum pada menit ke-30 dengan daya serap 99,3 % - konsentrasi
[image:23.595.109.512.123.559.2]1.2 Perumusan Masalah
Proses pengadsorpsian ion logam oleh batang jagung masih memiliki kekurangan dalan hal daya serap yang rendah maka dirasa perlu untuk dipelajari proses penyerapan dengan pengaruh ukuran dan bentuk batang jagung dalam menyerap logam Cu.
1.3 Tujuan Penelitian
Adapun tujuan utama dalam penelitian ini adalah untuk mendapatkan daya serap optimum adsorben dalam menyerap ion logam Cu. Adapun tujuan khusus dari penelitian ini adalah untuk mendapatkan ukuran dan bentuk batang jagung yang mampu menyerap ion logam Cu dengan baik.
1.4 Manfaat Penelitian
Manfaat dari penelitian ini adalah sebagai berikut :
a. Memberikan informasi mengenai pengaruh ukuran dan bentuk batang jagung terhadap daya serap adsorben dalam menyerap ion logam Cu.
b. Memberikan informasi mengenai potensi batang jagung yang biasanya terbuang begitu saja serta memberikan informasi awal membuat bahan baku adsorben yang murah pada skala industri.
c. Memberikan manfaat karena dapat mengurangi dampak negatif yang ditimbulkan logam Cu di lingkungan sehingga lingkungan dapat terjaga baik.
1.5 Ruang Lingkup Penelitian
Variabel-variabel dalam penilitian ini adalah sebagai berikut :
Variabel yang divariasikan : - Bentuk lingkaran penuh - Bentuk setengah lingkaran - Bentuk ¼ lingkaran - Ukuran 20 mesh - Ukuran 70 mesh
BAB II
TINJAUAN PUSTAKA
2.1 Tanaman Jagung
Menurut sejarahnya, tanaman jagung berasal dari Amerika [31]. Sedangkan di Indonesia, jagung pertama kali dikenal masyarakat sekitar 400 tahun lalu, saat itu dibawa oleh orang-orang Portugis dan Spanyol. Pada awalnya, daerah yang menjadi penghasil jagung adalah daerah Jawa Tengah, Jawa Timur dan Madura. Tanaman jagung lambat laun meluas dan luas areal tanam tanaman jagung menyeluruh semua provinsi di Indonesia dengan luas areal tanam yang beragam [32].
Klasifikasi dan sistematika tanaman jagung menurut Rukmana (2005) sebagai berikut.
Kingdom : Plantae
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Monocotyledoneae Ordo : Poales
Famili : Poaceae (Graminae) Genus : Zea
Spesies : Zea mays L.
Tanaman jagung termasuk memiliki akar yang serabut, menyebar ke samping dan ke bawah sepanjang 25 cm [33]. Tanaman jagung memiliki bagian-bagian seperti daun, buah, batang dan akar. Batang tanaman jagung bulat silindris dan tidak berlubang seperti batang padi, berisi padat dan mengandung berkas-berkas pembuluh sehingga makin memperkuat batang untuk berdiri. Demikian juga jaringan kulit yang tipis dan keras yang terdapat pada bagian luar batang jagung [31].
tinggi tanaman jagung yang beragam, tergantung pada jenis yang ditanam dan tingkat kesuburan tanah [31].
Fungsi batang jagung yang berisi berkas-berkas pembuluh adalah sebagai media pengangkut zat-zat makanan dari atas ke bawah atau sebaliknya. Unsur hara yang diserap oleh akar tanaman jagung diangkat ke atas melalui berkas-berkas pembuluh menuju daun tanaman untuk kemudian diolah dengan bantuan sinar matahari dan gas CO2 [31].
Keadaan iklim yang cocok untuk tanaman jagung adalah daerah beriklim sedang hingga beriklim subtropis/tropis yang basah. Jagung juga tumbuh di daerah antara 0o-50o Lintang Utara hingga 0o-40o Lintang Selatan. Dalam pertumbuhannya, tanaman jagung dapat hidup baik pada suhu antara 26,5-29,5oC. Bila suhu di tanam di atas 29,5oC maka air tanah cepat menguap sehingga dapat mengganggu penyerapan unsur hara oleh akar tanaman, sedangkan apabila suhu di bawah 16,5oC akan bisa mengurangi kegiatan respirasi [34].
Tanaman jagung dapat tumbuh mulai dataran rendah sampai tinggi (daerah pegunungan) dengan ketinggian 1.000 meter atau lebih di atas permukaan laut (dpl). Jagung yang ditanam di daerah ketinggian kurang dari 800 meter dari permukaan air laut dapat memberikan hasil panen yang tinggi [31].
Jumlah populasi tanaman per hektar merupakan faktor penting untuk mendapatkan hasil maksimal. Produksi yang maksimal dapat dicapai apabila menggunakan jarak tanam yang sesuai. Jenis jagung yang umurnya beragam mempunyai optimum populasi yang berbeda-beda. Jenis jagung yang berumur dalam ± 100 hari, populasi optimum adalah ± 50.000 tanaman/hektar, ditanam dengan jarak tanaman 75 x 25 cm dengan satu tanaman per lubang. Jenis jagung berumur tengah (80-90 hari) optimum populasi adalah ± 70.000 tanaman/hektar, ditanam dengan jarak tanam 75 x 25 cm. Jenis jagung yang berumur singkat (70-80 hari) dengan populasi optimum mencapai 100.000 tanaman/hektar dengan jarak tanam 75 x 10 cm [35].
2.2 Pencemaran Logam Berat
atau berubahnya tatanan (komposisi) air atau udara oleh kegiatan manusia atau proses alam, sehingga kualitas air atau udara turun sampai ke tingkat tertentu yang menyebabkan air atau udara menjadi kurang atau tidak berfungsi lagi sesuai dengan peruntukannya [7].
Bahan-bahan pencemar atau polutan adalah material atau energi yang dibuang ke lingkungan yang mengakibatkan kerusakan lingkungan baik abiotik maupun biotik [6]. Berdasarkan sumbernya, pencemaran dapat dibagi menjadi dua kelompok, yakni [8]:
a. Dari laut, misalnya tumpahan minyak baik dari sumbernya langsung maupun hasil pembuangan kegiatan pertambangan di laut, sampah dan air tumpahan minyak dari kapal tanker.
b. Kegiatan di darat melalui udara dan terbawa oleh arus sungai yang akhirnya bermuara ke laut.
Berdasarkan sifatnya, pencemaran dibagi menjadi zat yang mudah terurai (biodegradable). Contoh dari zat yang mudah terlarut adalah seperti sampah organik sedangkan zat yang sukar terurai (non biodegradable) contohnya adalah minyakdan logam berat [9].
Pencemaran oleh logam berat atau (heavy metal) terhadap lingkungan perairan terjadi karena adanya suatu proses yang melibatkan logam sebagi zat yang digunakan. Secara umum sumber utama limbah logam berat berasal dari kegiatan pertambangan, cairan limbah rumah tangga, limbah dan buangan industri dan limbah pertanian [10].
2.3 Logam Berat
2.3.1 Definisi Logam Berat
Logam berat sebenarnya digunakan dalam berbagai perpustakaan ilmiah dan secara luas dalam industri-industri pengolahan. Logam berat memiliki karakteristik yaitu memiliki gravitas spesifik yang sangat besar yaitu lebih dari 4 dan mempunyai nomor atom sebesar 22-34 dan 40-50 serta unsur-unsur lantanida juga mempunyai efek biokimia yang khusus pada makhluk hidup [12].
Logam berat juga termasuk ke dalam kriteria logam-logam biasa lainnya hanya saja sifat toksit dan bahaya yang ditimbulkan apabila berada di lingkungan dengan konsentrasi tinggi atau di atas ambang batas yang ditentukan. Sebagai contoh logam besi (Fe) bila masuk kedalam tubuh dalam jumlah yang berlebihan tapi tidak menimbulkan pengaruh yang buruk terhadap tubuh karena logam besi dibutuhkan dalam darah untuk meningkatkan kapasitas oksigen [12].
Menrut Darmono (1995), ada 4 golongan logam berat berdasarkan sifat racunnya yaitu :
a. Sangat beracun, yaitu dapat mengakibatkan kematian ataupun gangguan kesehatan yang pulih dalam waktu yang singkat. Logam-logam tersebut adalah Hg, Pb, Cd, Cr dan As.
b. Moderat, yaitu mengakibatkan gangguan kesehatan baik yang pulih maupun tidak dalam waktu yang relatif lama. Logam-logam tersebut adalah Ba, Be, Cu, Au, Li, Mn, Se, Te, Co dan Rb.
c. Kurang beracun, yaitubila dalam jumlah besar menimbulkan gangguan kesehatan. Logam-logam tersebut adalah Al, Bi, Co, Fe, Ca, Mg, Ni, K, Ag, Ti dan Zn.
d. Tidak beracun, yaitu tidak menimbulkan gangguan kesehatan. Logam-logam tersebut adalah Na, Al, Sr dan Ca.
Berdasarkan densitasnya, golongan logam dapat dibagi menjadi dua golongan yaitu golongan logam ringan dan golongan logam berat. Golongan ringan (light metal) mempunyai densitas <5 g/cm3, sedangkan logam berat
mempunyai densitas ≥5g/cm3
Logam esensial adalah logam yang sangat membantu proses fisiologi makhluk hidup dengan membantu kinerja enzim dan pembentukan organ, misalnya logam Ca, P, K, Na, Cl, S, Mg, Fe, Cu, Zn, Mn, Co, mo, I dan Se. Logam Ca, P dan Mg merupakan logam ringan yang berguna untuk pembentukan kutikula/sisik pada ikan dan udang sedangkan logam Cu, Zn dan Mn merupakan jenis logam berat yang berguna dalam pembentukan hemosianin dalam sistem darah dan enzimatik pada hewan air. Logam non esensial adalah logam yang peranannya dalam tubuh organisme belum diketahui, kandungannya dalam jaringan tubuh jumlahnya sangat sedikit [13].
2.3.2 Sumber dan Bentuk Logam Berat
Menurut libes (1992), bahwa logam berat masuk ke perairan laut melalui run off air sungai, proses hidrotermal, difusi dari sedimen dan kegiatan antropogenik.
1. Sungai
Sungai adalah sumber utama pemasok logam berat baik dalam bentuk partikel maupun terlarut yang berasal dari pelapukan batuan granit dan basalt.
2. Pasokan Atmosfer
Beberapa logam berat seperti Pb dan As yang dideposit di permukaan laut berasal dari debu yang terbawa oleh angin.
3. Proses Hidrotermal
Proses hidrotermal yang berasosiasi dengan proses tektonik akan semakin menambah konsentrasi logam berat dalam air laut. Konsentrasi logam berat akan meningkat saat air laut yang suhunya panas mengalami kontak dengan magma yang berada beberapa kilometer di bawah permukaan bumi. Kemudian larutan yang panas ini akan melepaskan logam dari batuan basalt.
4. Aktivitas Antropogenik
Dalam perairan, logam berat dapat ditemukan dalam bentuk terlarut dan tidak terlarut. Logam berat terlarut adalah logam yang membentuk kompleks dengan senyawa organik dan anorganik sedangkan logam berat yang tidak terlarut merupakan partikel yang berbentuk koloid dan kelompok senyawa logam yang teradsorpsi pada partikel-partikel tersuspensi [15].
2.4 Logam Tembaga (Cu)
Logam tembaga (Cu) merupakan logam yang penting dalam industri dewasa ini. Tembaga dengan sifat karatnya yang rendah dan mudah bercampur dengan logam-logam lain. Selain itu tembaga merupakan konduktor yang baik. Logam tembaga merupakan logam transisi dalam tabel periodik unsur dengan massa atom sebesar 63,54 Dalton dengan dua isotop berupa 63Cu dan 65Cu dengan jumlah 69,2% dan 30,8% berturut-turut berada di alam. Di alam, tembaga secara umum ditemukan dalam 4 jenis yaitu: tembaga (0), tembaga (1), tembaga (3) dan tembga (4). Walaupun tembaga (3) sangat jarang berada di alam, biasanya terikat dalam emas dan perak.Tembaga yang bercampur dalam emas dan perak termasuk dalam logam mulia. Logam mulia ini dapat ditemukan dalam bentuk elemen [16].
Sumber utama logam Cu berasal dari erosi berbagai batuan mineral yang umumnya terjadi di sungai sedangkan sumber yang berasal dari aktivitas manusia bersifat lokal dan sangat bervariasi [17]. Tembaga masuk ke dalam laut melalui proses batuan mineral dan kegiatan manusia serta sampah kota. Unsur Cu bersifat racun terhadap invertebrata dan bersifat sinergis bila berada bersama-sama dengan Zn [18].
Logam Cu juga banyak digunakan pada pabrik yang memproduksi alat-alat listrik, gelas, dan zat warna yang biasanya bercampur dengan logam lain sebagai alloy dengan perak (Ag), kadmium (Cd), timah (Sn) dan seng (Zn). Garam tembaga banyak digunakan dalam bidang pertanian misalnya larutan Bordeaux yang mengandung 1-3% tembaga sulfat (CuSO4) digunakan untuk
kesehatan karena sifatnya yang beracun. Ion tembaga dapat terakumulasi di otak, jaringan kulit, hati dan pankreas [20].
Pencemaran perairan oleh Cu umumnya hanya bersifat lokal yaitu pada daerah pantai, teluk, estuari dan tempat pembuangan limbah. Sifat racunnya tidak terlalu membahayakan bila dibandingkan dengan Pb dan Cd. Dalam air laut, kandungan unsur logam tembaga yang normal adalah 2 ppb [21].
Keberadaan logam Cu di lingkungan perlu mendapat perhatian mengingat begitu kecilnya ambang batas yang diperbolehkan. Berdasarkan Keputusan Menteri Negara KLH Kep.02/Men-KLH/1998 tentang Penetapan Baku Mutu Lingkungan, keberadaan logam Cu dalam lingkungan diharapkan nihil, sedangkan batas maksimal yang diperbolehkan adalah 1 ppm [22].
Ion logam Cu dapat berubah menjadi stabil dalam tanah setelah mengalami reaksi hidrolisis, pembentukan senyawa kompleks anorganik dan organik. Ion logam Cu lebih terikat kuat pada bahan organik bila dibandingkan dengan ion logam mikro seperti ion Zn dan Mn [23].
2.5 Adsorpsi
Adsorpsi adalah proses yang terjadi pada permukaan suatu zat padat yang berkontak dengan suatu larutan dimana terjadi akumulasi molekul-molekul larutan pada permukaan zat padat tersebut. Zat-zat organik dalam larutan yang memiliki kelarutan yang rendah di dalam air, makin mudah pula untuk diadsorpsi dari larutannya. Hal yang sama, makin kurang polar suatu senyawa organik makin baik teradsorpsi dari larutan yang bersifat polar ke permukaan yang non polar [22].
2.5.1 Mekanisme Adsorpsi
[23]. Sedangkan adsorpsi kimia merupakan hasil dari reaksi kimia antara molekul adsorbat dan adsorben dimana terjadi pertukaran elektron [24].
Adsorpsi terhadap air buangan mempunyai tahapan proses seperti berikut [23]: 1. Transfer molekul-molekul adsorbat menuju lapisan film yang mengelilingi
adsorben.
2. Difusi adsorbat melalui lapisan film (film diffusion).
3. Difusi adsorbat melalui kapiler atau pori-pori dalam adsorben (proses pore diffusion)
4. Adsorbsi adsorbat pada permukaan adsorben.
[image:33.595.263.377.335.467.2]Mekanisme adsorpsi dapat digambarkan pada gambar di bawah ini. Gambar 2.1 menunjukkan adsorbat berinteraksi dengan permukaan pada poros-poros adsorben. P e rmu k a a n B a ta n g J a g u n g
Gambar 2.1 Ilustrasi Proses Adsorpsi Adsorben Batang Jagung [43]
Dengan bantuan pengadukan, logam Cu masuk ke pori-pori adsorben batang jagung sampai ke dasar pori-pori batang jagung dan sulit untuk terlepas. Selain itu, logam Cu juga masih ada yang di ujung luar pori-pori batang jagung dan karena pengaruh pengadukan juga memungkinkan dapat terlepas kembali.
Permukaan Batang Jagung
o o o
H H H H o o H H o H Fe H o H H o H H o H H o H H
o H H
[image:34.595.153.469.82.312.2]o H H o H H o H H o H H o H H o H Fe H o H H o H H o H H o H H o H H o H H o H H o H H o H H o H Larutan
Gambar 2.2 Interaksi Adsorben Batang Jagung dengan Ion Logam Cu2+ [40]
Gambar 2.2 menjelaskan bahwa pada proses adsorpsi, ada dua bagian interaksi antara adsorben dan ion logam, yaitu innersphere dan outersphere. Inner sphere adalah interaksi antara adsorben dan ion logam Cu2+dimana atom Cu2+ kehilangan satu gugus H dan langsung berikatan dengan functional group batang jagung. Sedangkan outer sphere adalah interaksi antara adsorben dan ion logam Cu2+dimana salah satu gugus OH pada atom Cu2+ berikatan dengan functional group batang jagung.
2.5.2 Faktor-faktor yang Mempengaruhi Adsorpsi
Faktor-faktor yang mempengaruhi mekanisme adsorpsi adalah agitasi, karakteristik adsorbat, ukuran molekul adsorbat, pH larutan, temperatur dan waktu kontak [23].
1. Agitasi
Jika agitasi yang terjadi antara partikel karbon dengan cairan relatif kecil, permukaan film dari liquid sekitar partikel akan menjadi tebal dan difusi film akan terbatas.
2. Karakteristik Adsorben
Ukuran partikel dan luas permukaan merupakan karakteristik terpenting dari adsorben. Ukuran partikel adsorben mempengaruhi tingkat adsorpsi yang
Cu
terjadi, tingkat adsorpsi meningkat seiring mengecilnya ukuran partikel. Total kapasitas adsorpsi tergantung pada total luas permukaan dimana ukuran partikel adsorben tidak berpengaruh besar pada total luas permukaan adsorben.
3. Ukuran Molekul Adsorbat
Ukuran molekul merupakan bagian yang penting dalam adsorpsi karena molekul harus memasuki micropore dari partikel adsorben untuk diadsorpsi. Tingkat adsorpsi biasanya meningkat seiring dengan semakin besarnya ukuran molekul dariadsorbat. Kebanyakan limbah terdiri dari bahan-bahan campuran sehingga ukuran molekulnya berbeda-beda. Pada situasi ini akan memperburuk penyaringan molekul karena molekul yang lebih besar akan menutup pori sehingga mencegah jalan masuknya molekul yang lebih kecil.
4. Waktu Kontak
Waktu yang diperlukan untuk mencapai keadaan setimbang pada proses penyerapan ion logam oleh adsorben hanya beberapa menit saja [25]. Jumlah zat yang diadsorpsi pada permukaan adsorben merupakan proses untuk mencapai kesetimbangan karena laju adsorpsi juga diikuti dengan proses desorpsi. Pada saat mula-mula reaksi, proses adsorpsi lebih dominan daripada proses desorpsi sehingga proses adsorpsi berlangsung cepat.
Pada akhir-akhir mencapai keadaan setimbang, peristiwa adsorpsi juga cendrung mengalami perlambatan proses penyerapan pada keadaan setimbang namun hal ini tidak terlihat secara makroskopis. Pada setiap jenis adsorben yang digunakan, waktu untuk mencapai saat setimbang berbeda-beda. Perbedaan waktu untuk mencapai keadaan setimbang dikarenakan jenis interaksi yang terjadi antara adsorben dan adsorbat. Secara umum, waktu untuk mencapai kesetimbangan melalaui mekanisme secara fisika (physisorption) lebih cepat bila dibandingkan dengan mekanisme secara kimia (chemisorption) [26].
kuat yaitu ikatan kovalen dengan energi yang dilepaskan relatif tinggi, sekitar 100 kJ/mol [27].
5. Keasaman (pH)
Tingkat keasaman atau pH mempunyai pengaruh dalam proses adsorpsi. Untuk mencapai pH optimum dalam proses adsorpsi ditandai dengan jumlah maksimum yang dapat diserap adsorben adalah ditetapkan melalui uji laboratorium. Keasaman (pH) akan mempengaruhi sisi aktif biomassa serta berpengaruh pada mekanisme adsorpsi ion logam. Pada pH yang rendah, proses adsorpsi ion logam juga semakin rendah atau lambat. Hal ini dikarenakan pada kondisi asam, gugus fungsi yang terdapat pada adsorben terprotonasi sehingga terjadi pengikatan ion hidrogen (H+) dan ion hidronium [27]. Sementara itu ion-ion logam dalam larutan sebelum teradsorpsi oleh adsorben terlebih dahulu mengalami hidrolisis dan menghasilkan proton [28].
Dalam kondisi pH rendah (<7) permukaan adsorben akan bermuatan positif sehingga mengalami tolakan antara pemukaan adsorben dengan ion logam akibatnya proses adsorpsi menjadi lambat dan rendah. Sementara itu pada pH tinggi (>7), maka proses adsorpsi relatif tinggi, hal ini dikarenakan komplek hidrokso logam (MOH+) yang akan terbentuk di dalam larutan lebih banyak, demikian juga permukaan adsorben akan bermuatan negatif sehingga melepaskan proton sehingga melalui gaya elektrostatik akan terjadi tarik menarik yang menyebabkan peningkatan adsorpsi [29].
2.5.3 Kapasitas Adsorpsi
Permukaan zat padat dapat mengadsorpsi zat terlarut dari larutannya, hal ini dikarenakan adanya pengumpulan molekul-molekul suatu zat pada permukaan zat lain sebagai akibat ketidakseimbangan gaya-gaya pada permukaan tersebut. Kemampuan interaksi antara adsorbat dengan adsorben dipengaruhi dari sifat masing-masing adsorbat dan adsorbennya. Salah satu cara untuk menentukan komponen mana yang diadsorpsi lebih kuat adalah dengan menentukan kepolaran dari adsorbat dan adsorbennya. Apabila adsorbennya bersifat polar, maka komponen yang memiliki sifat polar akan terikat lebih kuat dibandingkan dengan komponen yang kurang polar.
Sifat keras dan lunaknya dari adsorbat maupun adsorben akan mempengaruhi kekuatan interaksi. Sifat keras pada kation yaitu kemampuan suatu kation untuk mempolarisasi anion dalam suatu ikatan (polarizing power cation). Kation yang mempunyai kekuatan yang besar untuk mempolarisasi anion yang cendrung bersifat keras. Kemampuan yang besar suatu kation untuk mempolarisasi anion dimiliki oleh ion-ion logam dengan ukuran (jari-jari) kecil dan muatan yang besar. Sebaliknya, kemampuan yang kecil suatu kation untuk mempolarisasi anion dimiliki oleh logam-logam dengan ukuran besar namun muatannya kecil, sehingga diklasifikasikan sebagai ion lunak.
Sedangkan pengertian keras untuk anion yaitu kemampuan suatu anion untuk mengalami polarisasi (polarisabilitas anion) akibat medan listrik dari kation. Anion yang bersifat keras adalah anion yang berukuran kecil, muatannya besar dan elektronegativitas tinggi, sebaliknya anion lunak dimiliki oleh anion dengan ukuran besar, muatannya kecil dan elektronegativitas yang rendah. Ion logam keras berikatan kuat dengan anion keras dan ion logam lunak berikatan kuat dengan anion lunak [26].
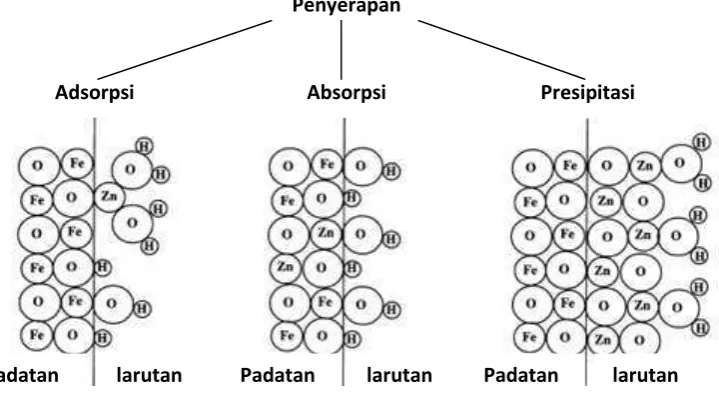
Reaksi yang melibatkan pengambilan beberapa komponen dari larutan yang mengadung mineral disebut penyerapan (sorption), absorpsi atau adsorpsi. Pada reaksi absorpsi, komponen kimia dihilangkan dari larutan dan menembus pori-pori padatan. Istilah adsorpsi digunakan jika komponen yang diambil dari larutan dan terikat pada permukaan antarmuka mineral. Dengan kata lain, adsorbat (komponen kimia yang diserap) tetap dalam bentuk 2D antarmuka larutan mineral, yang berbeda dengan padatan kimia yang ada dalam bentuk larutan 3D atau padatan yang ditunjukkan pada gambar di bawah ini.
Gambar 2.3 Skema yang Menggambarkan Adsorpsi, Absorpsi dan Presipitasi Zn Pada Permukaan Besi Oksida [40]
Jika mekanisme pengambilan komponen kimia dari larutan tidak diketahui, istilah penyerapan umum bisa dipakai untuk menjelaskannya. Pada adsorpsi fisika, adsorbat terikat pada permukaan oleh ikatan yag relatif lemah yaitu ikatan van der waals. Pada adsorpsi kimia, ikatan kimia ionik atau kovalen yang lebih kuat terbentuk antara adsorbat dan permukaan adsorben. istilah adsorpsi yang umum seringkali ditujukan kepada adsorpsi fisika, sementara adsorpsi kimia mengacu kepada adsorpsi khusus [40].
Penyerapan
Adsorpsi Absorpsi Presipitasi
larutan larutan larutan
2.6 Adsorben
Adsorben merupakan zat padat yang dapat menyerap komponen tertentu dari suatu fase fluida. Kebanyakan adsorben adalah bahan – bahan yang sangat berpori dan adsorpsi berlangsung terutama pada dinding – dinding pori atau pada letak – letak tertentu didalam partikel [42].
Penyerap biosorban seperti lumut, sekam padi, eceng gondok, genjer, lignin kayu Ailanthus altissima, limbah pulp dan alga telah banyak dikembangkan dalam menyerap ion-ion logam. Bahan penyerap non biosorben juga sudah dikembangkan seperti perlit, tanah gambut dan lumpur aktif [5].
2.7 Analisa Ekonomi
Sumber bahan baku (batang jagung) tersedia cukup banyak. Hal ini terlihat dari hasil statistik dari Badan Pusat Statistik dan Kementerian Pertanian tahun 2013 yang menunjukkan bahwa tanaman jagung cukup banyak tersedai sehingga ketersediaan limbah batang jagung koheren dengan tanaman batang jagung. Data tahun 2013 menunjukkan ada 19.387.022 Ton produksi tanaman jagung di Indonesia.
Besarnya kebutuhan dalam negeri akan komsumsi masyarakat Indonesia dan juga sebagai rangsum pakan ternak akan diperkirakan terus naik tiap tahunnya. Melihat pada Rencana Strategis Ditjen Pangan Tahun 2014, untuk tahun 2013 rencana produktivitas jagung dalam negeri mencapai 53,92 Ku/Ha dan target produksi mencapai 26.000.000 Ton jagung.
Dengan terus bertambahnya perluasan area tanaman jagung juga diikuti bertambahnya jumlah batang jagung yang dihasilkan maka ini menjadi peluang untuk meningkatkan nilai ekonominya bila diolah menjadi bahan yang bermanfaat, pemanfaatan ini juga dapat mengurangi potensi pencemaran lingkungan.
jual adsorben. Perhitungan analisisi ekonomi dapat dilihat pada tabel 2.1 dan 2.2 di bawah ini:
Tabel 2.1 Perhitungan Biaya Bahan Baku
No Bahan Baku Harga (Rp) Satuan Biaya
1 Batang Jagung - 200 gram -
Tabel 2.2 Perhitungan Biaya Kebutuhan Listrik
No
Alat Harga/kWh Kebutuhan (kW)
Waktu
(Jam) Biaya (Rp)
1 Blender Rp. 1.112 0,18 6 1.200,48
Total Rp. 1.200,48
- Total biaya produksi = biaya penyediaan bahan baku + kebutuhan listrik
= Rp. 0 + Rp. 1.200,48 = Rp. 1200,48/200 gr - Harga jual adsorben dari batang jagung
= Rp. 1200,48/200 gr
Sehingga dapat diestimasi harga jual adsorben batang jagung seharga Rp. 1200,48/200 gr atau Rp. 6.000,4/kg.
Sedangkan harga jual adsorben dipasaran sebagai berikut.
Berikut merupakan harga masing-masing jenis adsorben di pasaran [41] : 1. Karbon Aktif Lokal = Rp 15.000/kg
2. Karbon Aktif Haycarb = Rp 40.000/kg 3. Manganese = Rp 11.000/kg 4. Silika (Pasir Kuarsa) = Rp 3.000/kg 5. Zeolit = Rp 7.000/kg 6. Pasir Aktif = Rp 11.000/kg
Sebagai perbandingan, maka diambil contoh perhitungan estimasi biaya bahan baku adsorben zeolit sebagai berikut :
BAB III
METODOLOGI PENELITIAN
3.1 Lokasi dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Proses Industri Kimia, Departemen Teknik Kimia, Fakultas Teknik Universitas Sumatera Utara, Medan serta Laboratorium Penelitian, Fakultas Farmasi, Universitas Sumatera Utara, Medan. Penelitian ini dilakukan selama lebih kurang 4 bulan.
3.2 Bahan dan Peralatan
Adapun bahan yang digunakan pada penelitian ini yaitu: batang jagung (diambil dari sisa panen kebun masyarakat daerah Padang Bulan, Medan), CuSO4.
5H2O, larutan HCl 0,1 M, larutan NaOH 0,1 M, aquadest, kertas saring Whatman
41, botol sampel dan kertas label.
Adapun alat-alat yang digunakan dalam penelitian ini yaitu : magnetic stirrer atau Shaker, Ayakan 50 mesh dan 70 mesh, pH meter atau Indikator Universal, gelas ukur, beaker glass iwaki pyrex, corong, neraca analitik, botol plastik, cawan, termometer, pipet tetes, cutter dan Atomic Adsorption Spectroscopy (AAS).
3.3 Rancangan Percobaan
Lingkaran (a) ½ lingkaran (b) ¼ lingkaran (c) 50 mesh (d) 70 mesh (e) Konsentrasi larutan 50 ppm (A)
A x a A x b A x c A x d A x e
3.4 Prosedur Penelitian
3.4.1Prosedur Pembuatan Larutan
Sebelum melakukan penelitian, larutan yang harus disiapkan yaitu larutan logam Cu2+ dengan konsentrasi 50 ppm dari senyawa CuSO4. 5H2O, larutan
asam-basa yaitu larutan 0,1 M HCl dan 0,1 M NaOH dan pelarut logam yang pH-nya 4,5 sebanyak 5 L.
a. Pembuatan Larutan HCl 0,1 M (1 L)
1. Dipipet 8,36 mL dari larutan HCl 37% 2. Dimasukkan ke dalam beaker glass 1000 mL 3. Diencerkan dengan aquadest sampai batas tanda
b. Pembuatan Larutan NaOH 0,1 M (1 L)
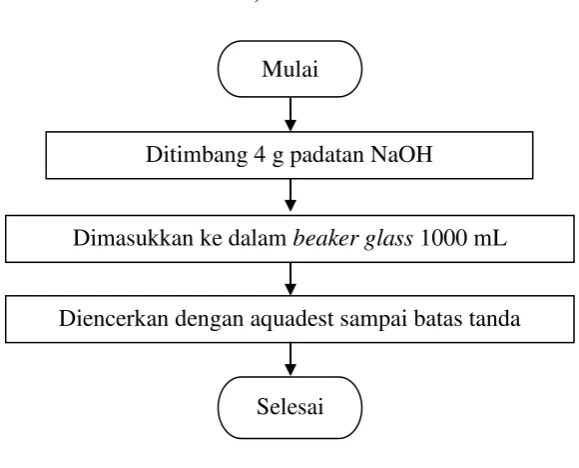
1. Ditimbang 4 g padatan NaOH
2. Dimasukkan ke dalam beaker glass 1000 mL 3. Dilarutkan dengan aquadest sampai batas tanda
c. Pembuatan Larutan Induk 1000 ppm
1. Ditimbang padatan CuSO4. 5H2O sebanyak 125 mg didalam beaker
glass
2. Diambil pelarut yang pH-nya sudah dikontrol 4,5 dan dimasukkan kedalam beaker glass sampai batas tanda 1 L.
3. Diaduk rata hingga padatan melarut
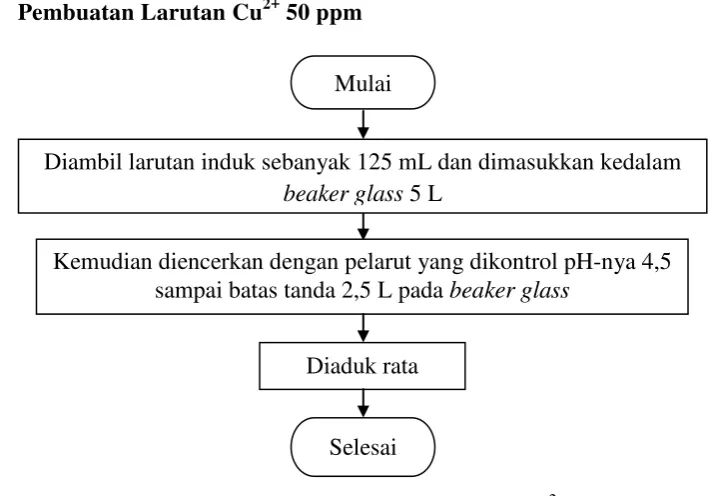
d. Pembuatan Larutan Cu2+ 50 ppm
1. Diambil larutan induk sebanyak 125 mL dan dimasukkan kedalam beaker glass 5 L
2. Kemudian diencerkan dengan pelarut yang dikontrol pH-nya 4,5 sampai batas tanda 2,5 L pada beaker glass
3.4.2Prosedur Persiapan Adsorben Batang Jagung
Prosedur persiapan adsorben sebagai berikut:
1. Batang jagung diperoleh dari sisa hasil panen kebun masyarakat 2. Batang jagung dibersihkan dari daun dan kulit luarnya
3. Kemudian batang jagung dipotong-potong dengan bentuk lingkaran penuh, setengah lingkaran dan seperempat lingkaran dan dihaluskan 50 dan 70 mesh dengan ketebalan ±5 mm
4. Lalu batang jagung yang telah dipotong-potong, di cuci dengan air distilat sebanyak 3 kali hingga pH air pencuci sama dengan pH air distilat
5. Batang jagung dikeringkan di dalam oven pada suhu ±55° C sampai berat batang jagung tersebut konstan
3.4.3Prosedur Batch Adsorption
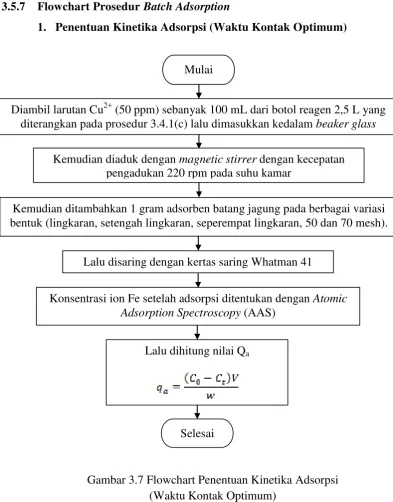
1. Penentuan Kinetika Adsorpsi (Waktu Kontak Optimum)
1. Diambil larutan Cu2+ (50 ppm) sebanyak 100 mL dari botol reagen 2,5 L yang diterangkan pada prosedur 3.4.1(c) lalu dimasukkan kedalam beaker glass
2. Kemudian diaduk dengan magnetic stirrer dengan kecepatan pengadukan 220 rpm pada suhu kamar
3. Kemudian ditambahkan 1 gram adsorben batang jagung pada berbagai variasi bentuk (lingkaran, setengah lingkaran, seperempat lingkaran, 50 dan 70 mesh)
4. Lalu diambil 2 mL sampel pada selang waktu 10 menit selama 2 jam 5. Lalu disaring dengan kertas saring Whatman 42
6. Konsentrasi ion Cu2+ pada larutan setelah adsorpsi ditentukan dengan Atomic Adsorption Spectroscopy (AAS)
2. Penentuan Kapasitas Adsorpsi
1. Diambil larutan Cu2+ (50 ppm) sebanyak 100 mL dari botol reagen 2,5 L yang diterangkan pada prosedur 3.4.1(c) lalu dimasukkan kedalam beaker glass
2. Kemudian diaduk dengan magnetic stirrer dengan kecepatan pengadukan 220 rpm pada suhu kamar
3. Kemudian ditambahkan 1 gram adsorben batang jagung pada berbagai variasi bentuk (lingkaran, setengah lingkaran, seperempat lingkaran, 50 dan 70 mesh)
4. Lalu disaring dengan kertas saring Whatman 42
5. Konsentrasi ion Cu2+ ( Ce ) pada larutan setelah adsorpsi ditentukan
dengan Atomic Adsorption Spectroscopy (AAS) 6. Lalu dihitung nilai qe
Di mana qe = jumlah ion logam yang teradsorpsi (mg/g)
C0 = konsentrasi ion logam sebelum teradsorpsi
Ce = konsentrasi ion logam setelah adsorpsi
3.5 Flowchart Penelitian
3.5.1 Persiapan Adsorben Batang Jagung
[image:46.595.112.507.84.417.2]
Gambar 3.1 Flowchart Persiapan Adsorben Batang Jagung
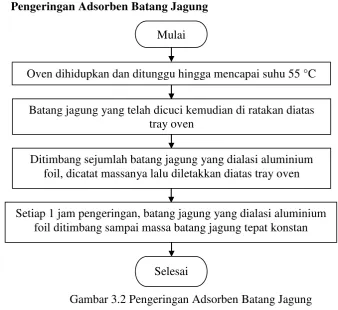
[image:46.595.138.477.450.760.2]3.5.2 Pengeringan Adsorben Batang Jagung
Gambar 3.2 Pengeringan Adsorben Batang Jagung Mulai
Batang jagung dibersihkan dari daun dan kulit luarnya
Kemudian batang jagung dipotong-potong dengan bentuk lingkaran penuh, setengah lingkaran dan ¼ lingkaran dan dihaluskan 50 dan 70 mesh
Lalu batang jagung di cuci dengan air distilat sebanyak 3 kali atau sampai hingga pH larutan pencuci sama dengan pH air distilat sebesar 4,5. Batang jagung diperoleh dari hasil panen kebun masyarakat pasar 1 Padang
Bulan Kota Medan
Selesai
Mulai
Oven dihidupkan dan ditunggu hingga mencapai suhu 55 °C
Batang jagung yang telah dicuci kemudian di ratakan diatas tray oven
Ditimbang sejumlah batang jagung yang dialasi aluminium foil, dicatat massanya lalu diletakkan diatas tray oven
Setiap 1 jam pengeringan, batang jagung yang dialasi aluminium foil ditimbang sampai massa batang jagung tepat konstan
3.5.3 Pembuatan Larutan Induk 1000 ppm
Gambar 3.3 Pembuatan Larutan Induk 1000 ppm
[image:47.595.140.497.390.638.2]3.5.4 Pembuatan Larutan Cu2+ 50 ppm
Gambar 3.4 Flowchart Pembuatan Larutan Standar Cu2+ (50 ppm) Mulai
Selesai Diaduk rata
Kemudian diencerkan dengan pelarut yang dikontrol pH-nya 4,5 sampai batas tanda 2,5 L pada beaker glass
Diambil larutan induk sebanyak 125 mL dan dimasukkan kedalam beaker glass 5 L
Mulai
Diambil pelarut yang pH-nya sudah dikontrol 4,5 dan dimasukkan kedalam beaker glass sampai batas tanda 1 L
Diaduk rata hingga padatan melarut
Ditimbang padatan CuSO4. 5H2O sebanyak 125 mg didalam
beaker glass
3.5.5 Pembuatan Larutan HCl 0,1 M
Gambar 3.5 Flowchart Pembuatan Larutan HCl 0,1 M
3.5.6 Pembuatan Larutan NaOH 0,1 M
Gambar 3.6Flowchart Pembuatan Larutan NaOH 0,1 M Mulai
Dipipet 10 mL dari larutan HCl 37%
Selesai
Dimasukkan ke dalam beaker glass 1000 mL
Diencerkan dengan aquadest sampai batas tanda
Mulai
Ditimbang 4 g padatan NaOH
Selesai
Dimasukkan ke dalam beaker glass 1000 mL
[image:48.595.172.462.387.621.2]3.5.7 Flowchart Prosedur Batch Adsorption
1. Penentuan Kinetika Adsorpsi (Waktu Kontak Optimum)
[image:49.595.112.506.86.589.2]
Gambar 3.7 Flowchart Penentuan Kinetika Adsorpsi (Waktu Kontak Optimum)
Mulai
Diambil larutan Cu2+ (50 ppm) sebanyak 100 mL dari botol reagen 2,5 L yang diterangkan pada prosedur 3.4.1(c) lalu dimasukkan kedalam beaker glass
Kemudian diaduk dengan magnetic stirrer dengan kecepatan pengadukan 220 rpm pada suhu kamar
Kemudian ditambahkan 1 gram adsorben batang jagung pada berbagai variasi bentuk (lingkaran, setengah lingkaran, seperempat lingkaran, 50 dan 70 mesh).
Lalu disaring dengan kertas saring Whatman 41
Konsentrasi ion Fe setelah adsorpsi ditentukan dengan Atomic Adsorption Spectroscopy (AAS)
Lalu dihitung nilai Qa
2. Penentuan Kapasitas Adsorpsi
[image:50.595.119.503.86.535.2]
Gambar 3.8 Flowchart Penentuan Kapasitas Adsorpsi Mulai
Diambil larutan Cu + (50 ppm) sebanyak 100 mL dari botol reagen 2,5 L yang diterangkan pada prosedur 3.4.1(c) lalu dimasukkan kedalam beaker glass
Kemudian diaduk dengan magnetic stirrer dengan kecepatan pengadukan 220 rpm pada suhu kamar
Lalu disaring dengan kertas saring Whatman 41
Selesai
Konsentrasi ion Fe setelah adsorpsi ditentukan dengan Atomic Adsorption Spectroscopy (AAS)
Lalu dihitung nilai Qe
Kemudian ditambahkan 1 gram adsorben batang jagung pada berbagai variasi bentuk (lingkaran, setengah lingkaran, seperempat
BAB IV
HASIL DAN PEMBAHASAN
4.1 PENGERINGAN ADSORBEN DARI BATANG JAGUNG
Pada penilitian ini, dilakukan persiapan batang jagung berbagai bentuk secara fisika yaitu dengan cara mengeringkan batang jagung berbentuk lingkaran, ½ lingkaran, ¼ lingkaran, 50 dan 70 mesh pada suhu tetap yaitu sebesar 550 C, dengan waktu pengeringan hingga berat batang jagung konstan sehingga dapat mengurangi kadar air dalam batang jagung. Berikut ini adalah Tabel 4.1 menunjukkan batang jagung sebelum pengeringan dan sesudah pengeringan.
Sebelum pengeringan Sesudah pengeringan
½ Lingkaran
Adsorben yang dipanaskan dengan suhu tertentu menghasilkan karakteristik yang berbeda dari sebelum pengeringan, terlihat pada segi warna dan bentuk permukaan adsorben. Hal ini disebabkan oleh tahapan proses pengeringan.
Pada hasil di atas, terlihat adsorben yang telah dikeringkan secara fisika pada suhu 550 C memiliki karakteristik dan warna yang berbeda. Terlihat dari bentuk permukaan batang jagung dan juga warna batang jagung yang lebih kecoklatan setelah pengeringan.
[image:52.595.113.523.292.507.2]Berikut adalah Gambar 4.1 yang menunjukkan data pengeringan batang jagung pada berbagai bentuk dengan menggunakan oven pada suhu 550C.
Gambar 4.1 Pengeringan Batang Jagung Terhadap Waktu
Dari grafik di atas, menunjukkan perbedaan waktu pengeringan pada masing-masing bentuk batang jagung. Untuk bentuk lingkaran, ½ lingkaran dan ¼ lingkaran waktu pengeringan paling lama adalah 5 jam sedangkan pengeringan batang jagung bentuk 50 dan 70 mesh selama 10 jam. Bentuk 50 dan 70 mesh adalah bentuk yang paling lama dalam proses pengeringan.
sehingga lebih banyak menampung air pencucian sehingga proses pengeringan berlangsung lebih lama daripada bentuk batang jagung lainnya.
Proses pengeringan adsorben batang jagung dalam penelitian ini bertujuan untuk mendapatkan kondisi berat yang sama dari batang jagung. Pengeringan batang jagung juga sekaligus mendapatkan kondisi fisik yang homogen dari adsorben sehingga pada saat kontak dengan logam, adsorben dalam kondisi yang sama.
Aktivasi adsorben batang jagung dilakukan secara fisika yaitu dengan cara pengeringan. Aktivasi bertujuan untuk memperluas pori-pori batang jagung sehingga penjerapan ion logam Cu2+ lebih efektif.
Aktivasi merupakan bagian dari proses pembuatan adsorben yakni suatu perlakuan terhadap adsorben yang bertujuan untuk memperbesar pori dengan cara memecahkan ikatan kimia atau mengoksidasi molekul-molekul permukaan sehingga mengalami perubahan sifat secara fisika yaitu luas permukaannya bertambah besar dan berpengaruh terhadap daya adsorpsi [37].
4.2 PENENTUAN pH NETRAL PADA ADSORBEN BATANG JAGUNG
Penentuan pH netral pada adsorben batang jagung pada penelitian ini bertujuan untuk mendapatkan kondisi pH yang sama pada tiap bentuk adsorben batang jagung. Penentuan pH netral yaitu dengan cara mencuci batang jagung dengan larutan aquadest sampai pH air cucian sama dengan pH aquadest.
Gambar 4.2 menunjukkan perubahan pH dalam pencucian pada batang jagung untuk tiap bentuk.
Gambar 4.2 Penentuan pH Netral Pada Adsorben Batang Jagung
Pada gambar 4.2, pencucian adsorben batang jagung dengan menggunakan aquadest. Pencucian menggunakan aquadest sebab pelarut aquadest memiliki pH netral atau 6,5. Pencucian dilakukan untuk mendapatkan pH yang netral sehingga pada saat kontak dengan larutan logam tidak mempengaruhi kondisi pH pada larutan logam.
Volume aquadest tiap pencucian sebanyak 200 mL. Penentuan pH menggunakan kertas universal indicator pH yang umum digunakan. Selain itu proses pencucian pada batang jagung adsorben bertujuan untuk menghilangkan zat-zat pengotor yang menempel pada permukaan adsorben.
Pada bentuk batang jagung lingkaran, ½ lingkaran dan ¼ lingkaran proses pencucian mengalami tiga kali pencucian. Dari awal pencucian pH batang jagung dari bentuk tersebut sudah sama dengan pH aquadest artinya sudah netral sedangkan untuk bentuk 50 dan 70 mesh mengalami pencucian sebanyak empat kali. Hal ini disebabkan pada pencucian pertama pH batang jagung adalah sebesar 5.
4.3 PENENTUAN WAKTU KONTAK OPTIMUM
Waktu kontak merupakan hal yang sangat menentukan dalam proses adsorpsi. Adsorpsi ion dari suatu zat terlarut akan meningkat apabila waktu kontaknya semakin lama. Waktu kontak yang lama memungkinkan difusi dan penempelan molekul zat terlarut yang teradsorpsi berlangsung lebih banyak. Waktu untuk mencapai keadaan setimbang pada proses jerapan logam oleh adsorben berkisar antara beberapa menit hingga beberapa jam [25].
Dalam penelitian ini, penentuan waktu kontak optimum menggunakan batang jagung berbentuk ¼ lingkaran pada waktu selama 2 jam dengan pengambilan cuplikan sebanyak 8 (10, 20, 30, 40, 60, 80, 100, 120 Menit). Proses adsorpsi pada keadaan batch dengan kecepatan pengadukan 220 rpm.
Penggunaan batang jagung ¼ lingkaran sebagai acuan penentuan waktu kontak optimum dalam penelitian ini karena bentuk ¼ lingkaran sangat cocok digunakan sebagai isian pada kolom adsorpsi.
Gambar 4.3 menunjukkan pengaruh waktu kontak terhadap jumlah ion Cu2+ yang diadsorpsi.
Gambar 4.3 Pengaruh Waktu Kontak Terhadap Jumlah Ion Logam Cu2+ yang Diadsorpsi
[image:55.595.117.508.404.667.2]Cu2+ setelah waktu 20, 30, 40, 60, 80, 100 dan 120 menit cenderung menurun namun tidak dalam skala besar.
Kapasitas adsorpsi pada menit 10 sudah mencapai maksimum yaitu sebesar 4,606 mg/g tetapi setelah itu kapasitas adsorpsi cenderung mengalami penurunan. Kapasitas adsorpsi sudah konstan setelah mencapai waktu 120 menit (2 jam ).
Dengan bantuan pengadukan, ion logam Cu2+ masuk ke pori-pori adsorben batang jagung sampai ke dasar pori-pori batang jagung dan sulit untuk terlepas. Selain itu, logam Cu2+ juga masih ada yang di ujung luar pori-pori batang jagung dan karena pengaruh pengadukan juga memungkinkan dapat terlepas kembali.
Pada menit ke-10, kapasitas adsorpsi mencapai kondisi optimum tetapi ion logam Cu2+ yang berada pada outer sphere memiliki ikatan yang lemah dengan adsorben sehingga mudah untuk terlepas. Oleh karena itu, kita harus mendapatkan waktu kontak optimum dimana ion logam Cu2+ tidak terlepas lagi yang ditandai dengan konstannya kapasitas adsorpsi.
Berdasarkan penelitian yang dilakukan oleh Vafakhah, et al (2014), hasil data menunjukkan kapasitas adsorpsi optimum terjadi pada menit ke-20 tetapi setelah itu mengalami penurunan dan sudah terjadi konstan setelah mencapai waktu 2 jam. Hasil penelitian yang penulis lakukan sama dengan data hasil penelitian yang dilakukan oleh Vafakhah, et al (2014), dengan hasil yang didapat bahwa data konstan setelah mencapai waktu 2 jam.
Dengan demikian walaupun pada menit 10 mencapai daya jerap maksimum tetapi, peneliti harus mendapatkan waktu untuk daya jerap yang konstan. Pada penelitian ini diambil pada 120 menit atau 2 jam.
Menurut Khopkar (1990) waktu kontak antara ion logam dengan adsorben sangat mempengaruhi daya serap. Semakin lama waktu kontak maka penyerapan juga akan meningkat sampai pada waktu tertentu akan mencapai maksimum dan setelah itu akan turun kembali.
4.4 PENENTUAN KAPASITAS ADSORPSI
4.4.1 PENGARUH WAKTU ADSORPSI TERHADAP JUMLAH
KONSENTRASI TERJERAP (mg/g)
Penentuan kapasitas adsorpsi adalah untuk mengetahui besarnya penjerapan logam Cu2+. Pada penelitian ini, penentuan kapasitas adsorpsi menggunakan batang jagung berbagai bentuk ( lingkaran, ½ lingkaran, ¼ lingkaran, 50 dan 70 mesh).
Daya jerap (adsorpsi) adalah peristiwa terjadinya perubahan kepekatan dari molekul, ion atau atom antar permukaan dalam dua fasa. Hal ini terjadi bila dua fasa saling bertemu, sehingga di antara kedua fasa tersebut terbentuk daerah antar muka yang sifatnya berbeda. Pada kondisi tertentu atom, ion atau molekul dalam daerah ini mengalami ketidakseimbangan gaya sehingga mampu menarik molekul lain sampai keseimbangan gaya tercapai [38].
Penentuan kapasitas adsorpsi untuk mengetahui berapa banyak jumlah ion logam Cu2+ yang terjerap oleh adsorben batang jagung. Hubungan yang menggambarkan antara jumlah ion teradsorpsi dengan adsorben adalah :
Di mana qe = jumlah ion logam yang teradsorpsi (mg/g)
C0 = konsentrasi ion logam sebelum teradsorpsi (mg/L)
Ce = konsentrasi ion logam setelah adsorpsi (mg/L)
V = volume larutan ion logam (L) W = jumlah adsorben, batang jagung (g)
Gambar 4.4 Hubungan Antara Jumlah Konsentrasi Terjerap Adsorpsi Dengan Berbagai Bentuk Adsorben
Gambar 4.4 menunjukkan bahwa jumlah konsetrasi ion logam Cu2+ yang terjerap berbeda-beda pada tiap bentuk adsorben batang jagung. Hasil penilitian menunjukkan bahwa kapasitas adsorpsi semakin tinggi seiring bertambahnya waktu.
Bentuk adsorben 50 dan 70 mesh memiliki kapasitas adsorpsi yang lebih tinggi dari bentuk lain, hal ini karena perbedaan luas permukaan. Bentuk adsorben 50 dan 70 mesh memiliki luas permukaan yang besar bila dibandingkan dengan bentuk lain sehingga membuat proses penjerapan ion logam menjadi maksimal.
Kapasitas adsorpsi pada adsorben 70 mesh pada saat 2 jam sebesar 4,972 mg/g kemudian mengalami kenaikan sebesar 4,979 mg/g pada waktu 24 jam. Sedangkan kapasitas adsorpsi adsorben bentuk 50 mesh pada saat 2 jam sebesar 4,946 mg/g kemudian mengalami kenaikan sebesar 4,979 mg/g.
Menurut Khopkar (1990) waktu kontak antara ion logam dengan adsorben sangat mempengaruhi daya serap. Semakin lama waktu kontak maka penyerapan juga akan meningkat sampai pada waktu tertentu akan mencapai maksimum dan setelah itu akan turun kembali.
Berdasarkan teori di atas dapat dikatakan penelitian ini sesuai dengan teori yang menyatakan daya jerap berbanding lurus dengan bertambahnya waktu.
4.4.2 PENGARUH WAKTU ADSORPSI TERHADAP JUMLAH
KONSENTRASI TERJERAP (%)
Penentuan kapasitas adsorpsi adalah untuk mengetahui besarnya penjerapan logam Cu2+. Pada penelitian ini, penentuan kapasitas adsorpsi menggunakan batang jagung berbagai bentuk ( lingkaran, ½ lingkaran, ¼ lingkaran, 50 dan 70 mesh).
Penentuan kapasitas adsorpsi untuk mengetahui berapa banyak jumlah ion logam Cu2+ yang terjerap oleh adsorben batang jagung.
[image:59.595.111.524.435.640.2]Gambar 4.5 menunjukkan nilai kapasitas adsorben dalam satuan persen terhadap bentuk batang jagung pada waktu 2 jam dan 24 jam.
Gambar 4.5 Hubungan Antara Jumlah Konsentrasi Terjerap Adsorpsi (%) Dengan Berbagai Bentuk Adsorben
perbedaan luas permukaan. Ukuran partikel dan luas permukaan merupakan karakteristik terpenting dari adsorben. Ukuran partikel adsorben mempengaruhi tingkat adsorpsi yang terjadi, tingkat adsorpsi meningkat seiring mengecilnya ukuran partikel. Total kapasitas adsorpsi tergantung pada total luas permukaan dimana ukuran partikel adsorben tidak berpengaruh besar pada total luas permukaan adsorben [23].
Pada bentuk adsorben 70 mesh saat waktu 2 jam sebesar 99,454 % kemudian naik sebesar 99,580 % pada waktu hingga 24 jam. Kemudian pada bentuk adsorben 50 mesh berturut-turut adalah 98,924 % dan 99,580 %. Terdapat kesamaan jumlah adsorpsi pada bentuk 70 dan 50 mesh saat 24 jam yaitu sebesar 99,580 %, hal ini terjadi disebabkan karena ukuran 70 mesh sangat ringan sehingga pada saat proses adsorpsi terdapat sebagian adsorben yang menempel di dinding erlenmeyer sehingga mengakibatkan proses adsorpsi kurang maksimal.
Untuk bentuk adsorben lingkaran pada saat 2 jam, nilai kapasitas adsorpsinya adalah 97,470 % kemudian mengalami kenaikan sebesar 97,940 % pada saat 24 jam. Secara keseluruhan nilai adsorpsi mengalami kenaikan persen kapasitas adsorpsi dari saat 2 jam dengan pengadukan sampai saat 24 jam dengan tanpa pengadukan. Berdasarkan teori, bahwa agitasi atau pengadukan akan meningkatkan interaksi antara adsorben dengan adsorbat sehingga meningkatkan nilai kapasitas adsorpsi.
Hasil penelitian ini menunjukkan bahwa nilai kapasitas adsorpsi yang tinggi terjadi tanpa pengadukan, sehingga tidak sesuai dengan teori yang ada. Sebagaimana teori mengatakan, jumlah zat yang diadsorpsi pada permukaan adsorben merupakan proses untuk mencapai kesetimbangan karena
![Tabel 1.1 Luas Panen, Produksi dan Produktivitas Jagung Di Indonesia [4]](https://thumb-ap.123doks.com/thumbv2/123dok/74196.7288/20.595.115.530.486.633/tabel-luas-panen-produksi-dan-produktivitas-jagung-indonesia.webp)


![Gambar 2.1 Ilustrasi Proses Adsorpsi Adsorben Batang Jagung [43]](https://thumb-ap.123doks.com/thumbv2/123dok/74196.7288/33.595.263.377.335.467/gambar-ilustrasi-proses-adsorpsi-adsorben-batang-jagung.webp)
![Gambar 2.2 Interaksi Adsorben Batang Jagung dengan Ion Logam Cu2+ [40]](https://thumb-ap.123doks.com/thumbv2/123dok/74196.7288/34.595.153.469.82.312/gambar-interaksi-adsorben-batang-jagung-dengan-ion-logam.webp)