ii KURNIASARI. Characteristic of Growth Ram Cauda Epididymal Sperm after Supplemented by Katuk Leaves Extract Fraction of Lipid (FL) and Katuk Leaves Extract Fraction of Delipidation (FdL). Under direction M. AGUS SETIADI and AGIK SUPRAYOGI.
This research was conducted to determine the relationship of FL and FDL on growth ram cauda epididymal sperm characteristic. This research was performed in 9 growth Priangan rams (5 years old) divided into 3 groups wich consist of 3 rams each group. The control group was given placebo and the treatment group was given FL in the dosage 270 mg/day or FdL in the dosage of 1230 mg/day for 2 months, then after treatment rams were killed. The epididimys was collected and sperm was observed by piercing and sucking by spoid for five days respectively. Epididimal weight and concentration were observed in H0, then in H0 until H4 the characteristic of sperm were observed on motility, live sperm, membrane integrity, and abnormality. The result of the experiment revealed that there was decreasing in motility, live sperm, and membrane integrity day by day. However, concentration on FL and FdL group lower than control and the life percentage in the treatment is still high until the end of observation in FL and FdL group. In general, there was no significant influence on cauda epididymal sperm characteristic after treatment with FL and FdL.
i
KARAKTERISTIK SPERMATOZOA KAUDA EPIDIDIMIS
DOMBA MASA TUMBUH SETELAH PEMBERIAN FRAKSI
LIPID (FL) DAN FRAKSI DELIPIDASI (FdL) EKSTRAK
DAUN KATUK
ADI NINGRUM KURNIASARI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
ii KURNIASARI. Characteristic of Growth Ram Cauda Epididymal Sperm after Supplemented by Katuk Leaves Extract Fraction of Lipid (FL) and Katuk Leaves Extract Fraction of Delipidation (FdL). Under direction M. AGUS SETIADI and AGIK SUPRAYOGI.
This research was conducted to determine the relationship of FL and FDL on growth ram cauda epididymal sperm characteristic. This research was performed in 9 growth Priangan rams (5 years old) divided into 3 groups wich consist of 3 rams each group. The control group was given placebo and the treatment group was given FL in the dosage 270 mg/day or FdL in the dosage of 1230 mg/day for 2 months, then after treatment rams were killed. The epididimys was collected and sperm was observed by piercing and sucking by spoid for five days respectively. Epididimal weight and concentration were observed in H0, then in H0 until H4 the characteristic of sperm were observed on motility, live sperm, membrane integrity, and abnormality. The result of the experiment revealed that there was decreasing in motility, live sperm, and membrane integrity day by day. However, concentration on FL and FdL group lower than control and the life percentage in the treatment is still high until the end of observation in FL and FdL group. In general, there was no significant influence on cauda epididymal sperm characteristic after treatment with FL and FdL.
iii KURNIASARI. Karakteristik Spermatozoa Kauda Epididimis Domba Masa Tumbuh setelah Pemberian Fraksi Lipid (FL) dan Fraksi Delipidasi (FdL) Ekstrak Daun Katuk. Dibimbing oleh M. AGUS SETIADI and AGIK SUPRAYOGI.
Hewan selalu menunjukkan kemampuannya untuk bereproduksi, hal tersebut sangat penting untuk mempertahankan kelestarian jenisnya di alam agar tidak punah. Terjadinya reproduksi membutuhkan dua komponen penting yaitu sel telur dari betina dan sel spermatozoa dari pejantan. Namun, ada kalanya pejantan tidak dapat melakukan aktivitas reproduksinya secara normal. Gangguan aktivitas reproduksi tersebut akan sangat merugikan bagi pengembangan populasi hewan terutama hewan dengan nilai genetik (plasma nutfah) yang unggul. Kegagalan pengembangan populasi tersebut dapat mengakibatkan penurunan populasi hewan jika tidak cepat ditanggulangi.
Semakin besar penurunan populasi semakin besar kemungkinan timbulnya ancaman terhadap keberlangsungan hewan bahkan dapat berujung kepada kepunahan. Salah satu cara yang dapat digunakan untuk menjaga plasma nutfah dari kepunahan adalah melalui aplikasi teknologi reproduksi dimana keberhasilan teknologi reproduksi tidak dapat lepas dari kualitas spermatozoa yang baik. Dengan demikian, upaya untuk penyelamatan plasma nutfah hewan melalui aplikasi teknologi reproduksi juga harus mendorong upaya perbaikan fungsi fisiologis pada hewan.
Daun katuk mampu meningkatkan fungsi fisiologis hewan termasuk fungsi reproduksi. Khasiat daun katuk diketahui dapat meningkatkan produksi air susu ataupun produksi telur pada hewan betina. Diyakini bahwa terdapat respon yang serupa pada hewan jantan yaitu dapat memacu peningkatan fungsi reproduksi yang diakibatkan peningkatan hormon steroid terutama testosteron. Sampai saat ini belum diketahui bagaimana efek pemberian fraksi ekstrak daun katuk terhadap fungsi reproduksi hewan jantan. Oleh karena itu langkah-langkah penelitian awal untuk mengetahui pengaruh dari pemberian fraksi ekstrak daun katuk terhadap fungsi reproduksi jantan melalui karakteristik spermatozoa di kauda epididimis domba sebagai hewan coba perlu dilakukan.
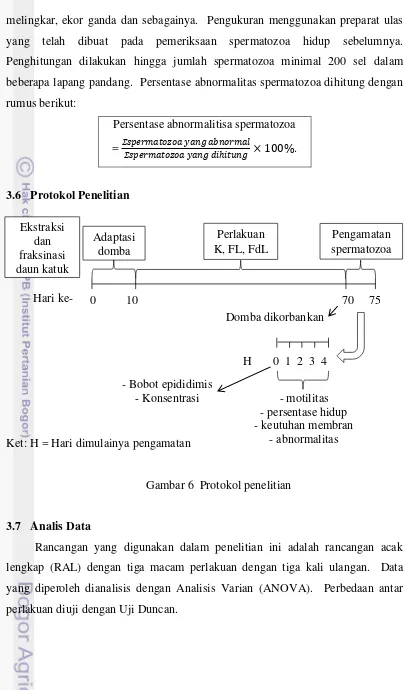
Penelitian ini menggunakan 9 ekor domba Priangan jantan berumur ± 5 bulan yang dibagi menjadi 3 kelompok perlakuan dengan masing-masing 3 domba per kelompok perlakuan. Tiga perlakuan tersebut adalah kontrol yang diberi plasebo, FL diberi dosis 270 mg/hari/ekor dalam 3 kapsul, dan FdL diberi dosis 1230 mg/hari/ekor dalam 3 kapsul. Kapsul diberikan secara oral pada pagi hari (2 kapsul) dan sore hari (1 kapsul) selama 2 bulan, kemudian pada akhir perlakuan domba dikorbankan untuk selanjutnya epididimis dipreparir. Pengamatan dilakukan terhadap bobot epididimis dan konsentrasi spermatozoa epididimis serta selama 5 hari berturut-turut diamati motilitas, persentase hidup, keutuhan membran, dan abnormalitas.
iv konsentrasi spermatozoa kauda epididimis dibandingkan kontrol. Motilitas spermatozoa pada pemberian FdL menunjukkan kecenderungan penurunan yang lebih cepat dibandingkan kelompok FL dan kontrol. Persentase hidup dan keutuhan membran spermatozoa kauda epididimis pada perlakuan FL dan FdL memperlihatkan kecenderungan nilai yang lebih besar dari H-2 hingga H-4 dibandingkan kontrol. Persentase cytoplasmic droplet dan abnormalitas lain tidak menunjukkan perbedaan nilai yang signifikan dari H-0 hingga H-4.
Pemberian fraksi ekstrak daun katuk dengan berbagai dosis tidak mempengarui bobot epididimis dan karakteristik spermatozoa kauda epididimis. Terdapat kecenderungan penurunan konsentrasi spermatozoa dan peningkatan kekuatan membran pada domba masa tumbuh.
v © Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
vi
KARAKTERISTIK SPERMATOZOA KAUDA EPIDIDIMIS
DOMBA MASA TUMBUH SETELAH PEMBERIAN FRAKSI
LIPID (FL) DAN FRAKSI DELIPIDASI (FdL) EKSTRAK
DAUN KATUK
ADI NINGRUM KURNIASARI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
vii
Nama :
NIM :
Delipidasi (FdL) Ekstrak Daun Katuk Adi Ningrum Kurniasari
B04070074
Disetujui
Pembimbing I
Dr. drh. Mohamad Agus Setiadi
Pembimbing II
Prof. Dr. drh. Agik Suprayogi, MSc. AIF
Diketahui
Wakil Dekan Fakultas Kedokteran Hewan Institut Pertanian Bogor
Dr. Nastiti Kusumorini, AIF
viii Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Mei 2010 ialah fisiologi reproduksi, dengan judul Karakteristik Spermatozoa Kauda Epididimis Domba Masa Tumbuh setelah Pemberian Fraksi Lipid (FL) dan Fraksi Delipidasi (FdL) Ekstrak Daun Katuk. Karya ilmiah ini dapat terwujud dengan baik atas dukungan dana DIPA IPB Direktorat Jendral Pendidikan Tinggi, Departemen Pendidikan Nasional dengan SPK Tahun Anggaran 2010 Nomor 8/13.24.4/SPK/PSN/2010, 5 Maret 2010 yang diketuai Prof. Dr. drh. Agik Suprayogi, MSc., AIF.
Terima kasih penulis ucapkan kepada Bapak Dr. drh. Mohamad Agus Setiadi dan Bapak Prof. Dr. Drh. Agik Suprayogi, MSc, AIF selaku pembimbing skripsi yang begitu sabar memberikan bimbingan, arahan, motivasi, waktu, dan pemikiran. Di samping itu, penghargaan penulis sampaikan kepada Mbak Hidayaturrahmah dan teman sepenelitian penulis, Arum Saksono serta Bapak Bondan selaku teknisi lab yang telah membantu sebelum dan selama pengumpulan data.
Ungkapan terima kasih juga disampaikan kepada Bapak, Mama, Dedek, Mbah Samat-Sumi, Mbah Uti-Akung tersayang serta seluruh keluarga besar, atas segala doa, motivasi, dan kasih sayangnya. Tak lupa penulis sampaikan terima kasih kepada sahabat-sahabat GIANUZZI FKH 44 dan teman-teman Wisma Naura atas motivasi dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2011
Adi Ningrum Kurniasari
ix Penulis dilahirkan di Kudus pada tanggal 31 Juli 1989 dari ayah Adi Purwanto S.Pd dan ibu Dra. Siti Zuliati. Penulis merupakan anak pertama dari dua bersaudara dengan Dita Desviani. Tahun 2007 penulis lulus dari SMA Negeri 48 Jakarta dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih mayor Fakultas Kedokteran Hewan.
x Halaman
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
1 PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan ... 3
1.3 Manfaat ... 3
2 TINJAUAN PUSTAKA 2.1 Anatomi Reproduksi Domba Jantan ... 4
2.2 Fisiologi Reproduksi Jantan ... 5
2.2.1 Masa Reproduksi ... 5
2.2.2 Pengaturan Hormonal pada Jantan ... 6
2.3 Karakteristik Botani Tanaman Katuk ... 8
2.4 Manfaat Tanaman Katuk ... 9
2.5 Kandungan Nutrisi dan Senyawa Aktif Daun Katuk ... 11
2.6 Mekanisme Senyawa Aktif Daun Katuk terhadap Fungsi Reproduksi 12
2.7 Ekstraksi dan Fraksinasi ... 15
3 METODE 3.1 Waktu dan Tempat ... 17
3.2 Ekstraksi dan Fraksinasi Daun Katuk ... 17
3.3 Pelaksanaan Penelitian ... 19
3.4 Prosedur Pengambilan Epididimis ... 19
3.5 Parameter Penelitian ... 20
3.6 Protokol Penelitian ... 22
xi
4.1 Konsentrasi Spermatozoa ... 23
4.2 Motilitas Spermatozoa ... 25
4.3 Persentase Hidup dan Keutuhan Membran Spermatozoa ... 26
4.4 Persentase Cytoplasmic Droplet dan Abnormalitas Lain Spermatozoa 29
4.5 Pembahasan Umum ... 31
5 SIMPULAN DAN SARAN 5.1 Simpulan ... 34
5.2 Saran ... 34
DAFTAR PUSTAKA ... 35
xii Halaman
1 Bobot epididimis dan konsentrasi spermatozoa di kauda epididimis setelah pemberian fraksi ekstrak daun katuk ... 2 Persentase motilitas spermatozoa di kauda epididimis setelah pemberian
fraksi ekstrak daun katuk ... 3 Persentase hidup spermatozoa di kauda epididimis setelah pemberian
fraksi ekstrak daun katuk ... 4 Persentase keutuhan membran spermatozoa di kauda epididimis setelah
pemberian fraksi ekstrak daun katuk ... 5 Persentase cytoplasmic droplet spermatozoa di kauda epididimis setelah
pemberian fraksi ekstrak daun katuk ... 6 Persentase abnormalitas spermatozoa di kauda epididimis setelah
pemberian fraksi ekstrak daun katuk ...
23
25
27
27
29
xiii Halaman 1 Hubungan hormon yang mengontrol fungsi testikuler...
2 Daun katuk ... 3 Biosintesis hormon steroid yang dipengaruhi sterol dan androstan ... 4 Bagan proses ekstraksi dan fraksinasi daun katuk ... 5 Skema perubahan morfologi spermatozoa akibat kondisi hipoosmotik ... 6 Protokol penelitian ... 7 Mekanisme pengaruh senyawa aktif daun katuk terhadap konsentrasi
dan motilitas spermatozoa domba masa tumbuh ...
8 9 14 18 21 22
xiv Halaman 1 Hasil ANOVA bobot epididimis ...
2 Hasil ANOVA konsentrasi spermatozoa epididimis ... 3 Hasil ANOVA motilitas spermatozoa ... 4 Hasil ANOVA persentase hidup spermatozoa ... 5 Hasil ANOVA keutuhan membran spermatozoa ... 6 Hasil ANOVA persentase cytoplasmic droplet spermatozoa ... 7 Hasil ANOVA persentase abnormalitas lain spermatozoa ...
1 PENDAHULUAN
1.1 Latar Belakang
Hewan selalu menunjukkan kemampuannya untuk bereproduksi, hal tersebut sangat penting untuk mempertahankan kelestarian jenisnya di alam agar tidak punah. Terjadinya reproduksi membutuhkan dua komponen penting yaitu sel telur dari betina dan sel spermatozoa dari pejantan. Namun, ada kalanya pejantan tidak dapat melakukan aktivitas reproduksinya. Hal tersebut dapat disebabkan oleh beberapa hal diantaranya pejantan tidak dapat melakukan ejakulasi secara alami, pejantan tidak dapat memberikan respon terhadap penampungan semen dengan alat bantu, pejantan terlalu dini dipotong, ataupun pejantan mati secara mendadak.
Dengan adanya gangguan aktivitas reproduksi seperti di atas, maka akan sangat merugikan bagi pengembangan populasi hewan terutama hewan dengan nilai genetik (plasma nutfah) yang unggul. Kegagalan pengembangan populasi dapat mengakibatkan penurunan populasi hewan jika tidak cepat ditanggulangi. Semakin besar penurunan populasi semakin besar kemungkinan timbulnya ancaman terhadap keberlangsungan hewan bahkan dapat berujung kepada kepunahan. Salah satu cara yang dapat digunakan untuk menjaga plasma nutfah dari kepunahan adalah melalui aplikasi teknologi reproduksi.
Sumber spermatozoa yang dapat digunakan untuk aplikasi teknologi reproduksi tersebut dapat berasal dari kauda epididimis terutama jika pejantan tidak dapat melakukan aktivitas reproduksinya. Menurut Hafez dan Hafez (2000), spermatozoa yang berada di kauda epididimis diketahui telah mengalami proses pematangan sehingga memiliki kemampuan membuahi oosit. Selain itu, kauda epididimis menyimpan 75% spermatozoa dari total spermatozoa dalam duktus epididimis.
teknologi reproduksi juga harus mendorong upaya perbaikan fungsi fisiologis pada hewan.
Daun katuk mampu meningkatkan fungsi fisiologis hewan termasuk fungsi reproduksi. Subekti (2007) mengemukakan terjadi peningkatan fertilitas dan daya tetas pada puyuh akibat pemberian ransum ekstrak daun katuk maupun tepung daun katuk. Pemberian daun katuk dalam bentuk ekstrak ternyata juga dapat meningkatkan produksi air susu pada domba (Suprayogi 2000), mencit (Sari 2004), babi (Sidauruk 2008), dan tikus (Suprayogi et al. 2009). Khasiat tersebut merupakan peran senyawa aktif dalam daun katuk yang mampu meningkatkan aktifitas hormonal, metabolisme, maupun nutrisi. Disamping itu, Suprayogi et al.
(2009) menemukan adanya senyawa aktif dalam daun katuk yang merupakan prekursor hormon androgen maupun estrogen. Hal ini diperkuat penelitian Saragih (2005) dan Subekti (2007) yang menyatakan terjadinya peningkatan konsentrasi estradiol serum pada pemberian daun katuk dalam ransum unggas. Namun mekanisme senyawa tersebut terhadap proses reproduksi jantan sampai saat ini belum diketahui secara pasti.
Mencermati hal di atas, maka terdapat pengaruh positif senyawa-senyawa aktif dalam daun katuk terhadap fungsi reproduksi. Daun katuk dapat meningkatkan produksi air susu ataupun produksi telur pada hewan betina. Diyakini bahwa terdapat respon yang serupa pada hewan jantan yaitu dapat memacu peningkatan fungsi reproduksi yang diakibatkan peningkatan hormon steroid terutama terutama testosteron.
1.2 Tujuan
Penelitian ini bertujuan untuk
1. Mengamati pengaruh fraksi ekstrak daun katuk terhadap fungsi reproduksi jantan melalui karakteristik spermatozoa di kauda epididimis domba masa tumbuh.
2. Mengamati ketahanan spermatozoa di kauda epididimis dalam upaya penyelamatan plasma nutfah hewan terkait pemanfaatan daun katuk.
1.3 Manfaat
2 TINJAUAN PUSTAKA
2.1 Anatomi Reproduksi Domba Jantan
Sistem reproduksi jantan terdiri atas skrotum, spermatic cord, testes, kelenjar asesorius, penis, preputium, dan saluran reproduksi (Bearden et al. 2004). Testes merupakan organ reproduksi primer yang memiliki fungsi penting: gametogenesis dan steroidogenesis (Pineda 2003). Testes domba mengandung banyak tubulus seminiferus yang berkelok-kelok dengan panjang 4000 meter (Wodzicka-Tomaszewska et al. 2001).
Tubulus seminiferus testes terdiri atas sel spermatogenik (sel kecambah) yang berdiferensiasi membentuk spermatozoa dan sel Sertoli yang memproduksi cairan kaya protein. Diantara tubulus seminiferus terdapat jaringan interstitial dengan komposisi pembuluh darah, limfe, saraf, dan sel Leydig yang mensekresikan hormon androgen terutama testosteron. Spermatozoa meninggalkan testes melalui duktus eferen dilanjutkan menuju duktus epididimis yang nantinya berlanjut ke duktus deferen (Hafez dan Hafez 2000).
Epididimis mengandung duktus epididimis yaitu saluran berliku yang dibagi atas kepala (kaput), badan (korpus), dan ekor (kauda). Duktus epididimis memiliki diameter 100 sampai 300 µm dan memiliki epitel yang khas berupa sel sekretoris dan sel bersilia. Epididimis memiliki fungsi utama yaitu pengangkutan spermatozoa dari rere testis ke duktus eferen, pengkonsentrasian spermatozoa, pematangan spermatozoa, dan penyimpanan spermatozoa (Toelihere 1993).
2.2 Fisiologi Reproduksi Jantan 2.2.1 Masa Reproduksi
Hewan mengalami masa tumbuh yang merupakan masa terjadinya proses pertambahan ukuran (volume, bobot, dan jumlah sel) yang terjadi selama fetus hingga akhir pubertas. Masa setelahnya merupakan masa perkembangan yaitu terjadinya diferensiasi sel menuju keadaan yang lebih dewasa sehingga mencapai dewasa penuh. Pubertas akan muncul di masa tumbuh yang secara umum diartikan sebagai perkembangan seksual dimana hewan dapat bereproduksi ditandai dengan ditemukannya spermatozoa motil dalam ejakulat pada jantan tetapi hewan belum matang penuh secara seksual (belum dewasa kelamin). Dewasa kelamin adalah masa dimana hewan menunjukkan kemampuan penuh reproduksinya (Hafez dan Hafez 2000).
Pubertas pada domba terjadi pada usia 6 bulan tetapi ada kemungkinan tertunda hingga usia 9 sampai 12 bulan yang dapat dipengaruhi oleh genetik, nutrisi, dan lingkungan (Pineda 2003), selain itu pubertas juga dapat dipengaruhi oleh ras, komposisi tubuh, bobot badan, jenis kelamin, manajemen perawatan, dan pertumbuhan kerangka tubuh (Hafez dan Hafez 2000). Sutama (1992) berpendapat bahwa domba Priangan mencapai pubertas pada umur 6 sampai 8 bulan. Sementara itu dewasa kelamin akan tercapai beberapa bulan setelahnya (Cunningham dan Klein 2007).
Sebelum pubertas sekresi gonadothropin-releasing hormone (GnRH) dan gonadotropin dijaga dalam konsentrasi yang tetap karena hipotalamus sangat sensitif terhadap efek umpan balik negatif hormon steroid, yang akan menjadi kurang sensitif setelah hewan mengalami dewasa penuh. Mekanisme efek umpan balik negatif yang sensitif terlihat pada hewan jantan muda atau pada masa tumbuh sehingga pemberian hormon steroid dari luar dapat menurunkan kadar
Terdapat perbedaan fisiologis reproduksi pada pejantan di masa belum pubertas dan telah pubertas sehingga menyebabkan perbedaan karakteristik reproduksi yang nyata pula. White et al. (2005) mengamati karakteristik testis dan epididimis beruang pada umur belum pubertas dan telah pubertas. Bobot dan volume testis, volume tubulus seminiferus dan interstitial, dan diameter tubulus seminiferus lebih rendah pada umur belum pubertas dibandingkan telah pubertas. Bobot epididimis juga lebih rendah pada umur belum pubertas.
Wildeus (1993) juga menyatakan bahwa lingkar skrotum berkorelasi positif terhadap umur dan bobot badan sapi. Sementara itu lingkar skrotum berkorelasi positif terhadap bobot, panjang, dan lebar testis. Dinyatakan pula produksi harian sperma dan jumlah sperma pada eppididimis lebih besar pada umur dewasa kelamin. Karakteristik spermatozoa dipengaruhi oleh umur, bangsa, dan efek iklim juga stress akibat perlakuan yang berulang-ulang. Sementara itu kejadian abnormalitas spermatozoa berupa abnormalitas kepala dan akrosom, proximal cytoplasmic droplet, dan total abnormalitas secara nyata dipengaruhi oleh umur (Söderquist et al. 1996).
2.2.2 Pengaturan Hormonal pada Jantan
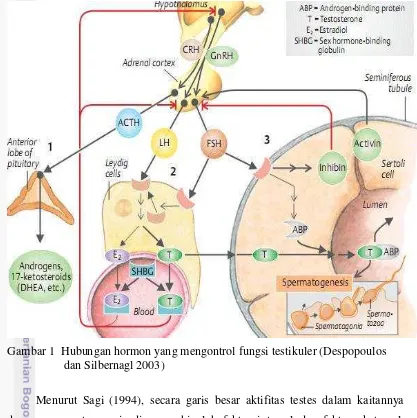
Hormon primer mengatur berbagai proses reproduksi sedangkan hormon sekunder atau metabolitnya berpengaruh secara tidak langsung. Hormon dari hipotalamus yang mengatur reproduksi adalah GnRH. GnRH secara langsung maupun melalui sistem peredaran darah menstimulasi (umpan balik positif) kelenjar hipofise anterior sehingga mensekresikan FSH dan LH.
LH berperan dalam proses pematangan spermatozoa dengan menstimulasi sekresi hormon androgen. Hormon androgen terdiri atas testosteron,
dihydrotestosterone (DHT), dan 17-ketosteroids seperti dehydroepian-drosterone
Klein 2007); dan menginduksi pembentukan reseptor LH pada sel Leydig (Despopoulos dan Silbernagl 2003).
Testosteron yang disintesis oleh sel Leydig berdifusi ke darah dan limfe, dimana akan diikat oleh ABP yang diproduksi sel Sertoli sehingga dapat masuk ke dalam lumen tubulus seminiferus testis. ABP berfungsi mengatur konsentrasi testosteron dalam testis sehingga konsentrasi testosteron yang tinggi dalam tubulus seminiferus akan menyebabkan terjadinya spermatogenesis. ABP juga menfasilitasi transportasi testosteron ke epididimis dimana testosteron akan diubah menjadi DHT yang berperan dalam perjalanan dan pematangan lebih lanjut spermatozoa di epididimis (Cunningham dan Klein 2007).
Hormon steroid seperti testosteron, DHT, dan estradiol diketahui menekan pelepasan FSH dan LH melalui efek umpan balik negatif. Pemberian testosteron dari luar untuk meningkatkan fertilitas dapat menimbulkan kontraindikasi karena dapat mengganggu sekresi hormon hipofise yang berfungsi memelihara lingkungan spermatogenik yang optimal (Pineda 2003). Inhibin bekerja bersama testosteron terlibat dalam umpan balik negatif terhadap hipofise, sedangkan aktivin dalam cairan rete testes bekerja sebagai umpan balik positif terhadap hipofise (Hafez dan Hafez 2000). Prostaglandin pada jantan mengatur beberapa aktivitas fisiologis seperti kontraksi otot polos saluran organ reproduksi, ereksi, ejakulasi, dan transportasi sperma (Pineda 2003).
Gambar 1 Hubungan hormon yang mengontrol fungsi testikuler (Despopoulos dan Silbernagl 2003)
Menurut Sagi (1994), secara garis besar aktifitas testes dalam kaitannya dengan spermatogenesis dipengaruhi oleh faktor internal dan faktor eksternal. Faktor internal antara lain temperatur tubuh, lokasi testes dan kontrol hipofisis. Faktor eksternal yang mempengaruhi adalah rangsang psikis, dan perubahan-perubahan lingkungan seperti temperatur lingkungan, makanan, zat-zat kimia tertentu, dan kontak-kontak sosial.
2.3 Karakteristik Botani Tanaman Katuk
bulat, dan berwarna hijau. Batang berkayu, tegak, saat masih muda berwarna hijau dan setelah tua berwarna coklat kehijauan. Daun berupa daun majemuk, berbentuk bulat telur dengan ujung runcing dan pangkal tumpul, jumlah daun per cabang berkisar antara 11-12 helai. Daunnya mempunyai pertulangan menyirip, bertangkai pendek, dan berwarna hijau keputihan pada bagian atas, hijau terang pada bagian bawah dan kadang-kadang terlihat ada bercak keputih-putihan Tanaman ini tumbuh baik pada daerah denngan ketinggian 1300 meter di bawah permukaan laut dan di daerah yang terbuka tetapi tidak langsung terkena sinar matahari (BPOM RI 2008).
Gambar 2 Daun katuk
2.4 Manfaat Tanaman Katuk
Daun dan akar katuk sering digunakan sebagai obat luar untuk mengobati borok, bisul, koreng, demam, darah kotor, dan frambusia. Zat yang berfungsi sebagai antikuman pada daun katuk diduga adalah tanin dan flavonoid. Tanin bersifat racun terhadap mikroba. Mekanisme kerjanya adalah sebagai berikut, yaitu berdasarkan sifat astrigensinya dapat menghambat enzim tertentu; berreaksi terhadap membran; dan pembentukan kompleks tanin dengan ion logam. Selain itu, dalam daun katuk juga terdapat senyawa alkaloid yang juga bersifat antiprotozoa dan antikuman (Santoso et al. 2002).
Penelitian terhadap aspek fisiologis dan farmakologis terhadap berbagai hewan coba telah banyak dilakukan. Suprayogi (2000) melaporkan bahwa pemberian secara oral sediaan daun katuk kering giling 7.74 g/hari pada domba laktasi selama 35 hari mampu meningkatkan produksi susu sebesar 7.75%, lebih besar dibandingkan sediaan ekstrak alkohol daun katuk 1.89 g/hari yaitu hanya 0.89% dibandingkan kontrol. Peningkatan produksi susu ini diduga karena senyawa aktif daun katuk yang mampu meningkatkan populasi dan aktifitas sintesis sel-sel kelenjar ambing. Sementara itu di saat yang sama senyawa aktif daun katuk juga mampu meningkatkan ketersediaan nutrisi di dalam darah yang berperan dalam produksi susu. Suprayogi et al. (2009) menyatakan terjadi peningkatan produksi air susu pada pemberian fraksi heksan (non-polar) sedangkan terjadi penurunan bobot badan pada pemberian fraksi etilasetat, fraksi air, dan fraksi etanol (polar dan semipolar) pada tikus.
2.5 Kandungan Nutrisi dan Senyawa Aktif Daun Katuk
Katuk banyak mengandung nutrisi yang bermanfaat yaitu protein, lemak, kalsium, fosfat, besi, steroid, flavonoid, polifenol (Agusta et al. 1997), vitamin A, B, C (244 mg/100 mg), dan E (4.16%) yang baik bagi fungsi reproduksi (Agusta
et al. 1997; Subekti 2007). Hasil penelitian Kelompok Kerja Nasional Tumbuhan Obat Indonesia menunjukkan bahwa tanaman katuk mengandung beberapa golongan senyawa kimia, antara lain alkaloid, protein, lemak, vitamin, mineral, saponin, flavonoid, dan tanin (Rukmana dan Indra 2003). Katuk mengandung asam lemak jenuh dan tak jenuh, serta kelompok fitosterol yang lebih banyak dibandingkan jenis sayuran lainnya sehingga dapat dijadikan sumber fitosterol yaitu sebesar 2.14% yang terdiri atas stigmasterol, sitosterol, dan fukosterol (Subekti 2007).
Suprayogi (2000) menemukan 7 kandungan utama daun katuk yang dapat mempengaruhi fisiologis tubuh yaitu 5 senyawa asam lemak tak jenuh (octadecanoic acids, 9-eicosyne, 5,8,11-heptadecatrienoic acid methyl ester, 9,12,15-octadecatrienoic acid ethyl ester, dan 11,14,17-eicosatrienoic acid methyl ester), 17-ketosteroid (androstan-17-one,3-ethyl-3-hydroxy-5 alpha), dan 3,4-dimethyl-2-oxocyclopent-3-enylacetic acid. Senyawa-senyawa tersebut mampu memodulasi hormon-hormon laktogenesis dan laktasi pada betina, serta sebagai eksogenous asam asetat dari saluran pencernaan dan terlibat dalam metabolisme seluler melalui siklus Krebs. Penelitian yang dilakukan Subekti (2007) dengan menggunakan gas chromatography and mas spectrometers (GCMS) menemukan beberapa golongan senyawa kimia dalam ekstrak daun katuk (dengan etanol 70%) yaitu 5 senyawa asam lemak, klorofil (phytol), tokoferol (vitamin E), stigmasterol, sitosterol, dan fukosterol.
Wang dan Lee (1997) menemukan senyawa flavonol yaitu 3-O- -D-glucosyl-7-O-α-L-rhamnosyl-kaemferol, 3-O- -D-glucosyl-(1→6)-
2.6 Mekanisme Senyawa Aktif Daun Katuk terhadap Fungsi Reproduksi Terdapat pengaruh positif senyawa-senyawa aktif dalam daun katuk terhadap fungsi reproduksi pada hewan. Daun katuk dapat meningkatkan produksi air susu dan produksi telur pada hewan betina. Penelitian Suprayogi et al. (2009) menunjukkan bahwa senyawa fraksi heksan (non-polar) memiliki respon peningkatan produksi air susu pada tikus betina bunting. Suprayogi (2000) menerangkan mengeni mekanisme peningkatan air susu terjadi melalui aksi hormonal serta aksi metabolik. Aksi hormonal daun katuk dalam meningkatkan prosuksi susu terjadi secara langsung maupun tak langsung.
Menurut Suprayogi (2000), ekstrak daun katuk mengandung asam lemak tak jenuh yang kemungkinan diubah menjadi asam lemak tak jenuh 20-C (aracchidonic, di-homo- -linolenic, dan eicosapentaenoic acids) melalui desaturasi dan elongasi. Asam lemak tak jenuh 20-C tersebut memiliki peran penting sebagai prekursor biosintesis eicosanoid seperti: prostaglandin, prostacycline, thromboxane, lipoxines, dan leukotrienes melalui mekanisme siklooksigenase atau lipoksigenase. Prostaglandin hasil biosintesis senyawa
eicosanoids bekerja langsung pada sel-sel sekretoris kelenjar ambing dengan meningkatkan populasi dan aktifitas sekretisnya. Selain senyawa tersebut, terdapat pula senyawa 17-ketosteroid, androstan-17-one,3-ethyl-3-hydroxy-5 alpha yang merupakan prekursor atau intermediate dalam biosintesis hormon steroid. Peningkatan konsentrasi hormon steroid dalam plasma darah secara tidak langsung menstimulasi sel-sel kelenjar hipofise anterior dan posterior untuk melepaskan hormon prolaktin, hormon pertumbuhan, dan oksitosin.
Selain aksi hormonal, ditemukan pula aksi metabolit dalam peningkatan prosuksi susu yang melibatkan senyawa 3,4-dimethyl-2-oxocyclopent-3-enylacetic acid, monomethyl suksinat, phenylmalonic acid, cyclopentanol, 2-methyl-acetate
dan methylpyroglutaman yang terdapat dalam ekstrak daun katuk. Senyawa-senyawa tersebut dapat mengalami hidrolisis di dalam saluran pencernaan menghasilkan produk metabolit berupa suksinat, asam malonik, asetat, dan glutamate yang berperan dalam siklus Krebs dalam produksi energi.
dehidroepiandrosterone (DHEA), selanjutnya dapat diubah menjadi androstenedion, estron, estradiol, atau dihidrotestosteron secara enzimatis dalam biosintesis hormon steroid. Hal ini diperkuat penelitian Saragih (2005) dan Subekti (2007) yang menyatakan terjadinya peningkatan konsentrasi estradiol serum pada pemberian daun katuk dalam ransum unggas petelur.
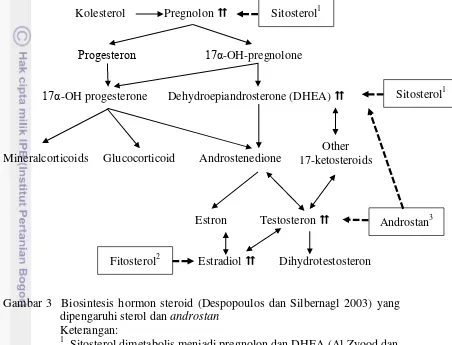
Fitosterol dalam ekstrak daun katuk (Subekti 2007) diduga juga dapat mempengaruhi fungsi reproduksi. Wu et al. (2005) menyatakan bahwa konsumsi fitosterol meningkatkan konsentrasi estradiol, estron, dan SHBG pada serum darah, sedangkan Al Zyood dan Shawakfa (2006) menyatakan bahwa sitosterol melalui metabolisme mampu diubah menjadi pregnolon dan dehidroepiandrosteron yang merupakan prekursor hormon-hormon steroid. Dapat diyakini bahwa terdapat respon yang serupa pada hewan jantan akibat kedua senyawa di atas yaitu dapat memacu peningkatan hormon steroid terutama testosteron dalam plasma darah.
Senyawa 17-ketosteroid, androstan-17-one,3-ethyl-3-hydroxy-5 alpha juga dapat meningkatkan konsentrasi ABP melalui peningkatan konsentrasi hormon steroid dalam plasma darah. Menurut Munell et al. (2002), produksi ABP dipengaruhi oleh hormon reproduksi dimana respon yang timbul tergantung pada faktor usia, dosis hormon, dan hormon lain. Tindal et al. (1978) menemukan terjadi peningkatan daerah pengikatan ABP pada tikus dewasa terhadap pemberian hormon steroid (testosteron, 5α-gihidrotestosteron, dan prekursor-prekursornya) baik secara in vivo maupun in vitro. Hal tersebut diperkuat oleh Danzo et al. (1990) bahwa testosteron merupakan hormon primer yang poten dalam menstimulasi ABP/SHBG pada tikus dewasa. Peningkatan ABP-testosteron akan meningkatkan konsentrasi ABP-testosteron dan DHT meningkat dalam testis dan epididimis. Testosteron berperan dalam menstimulasi tahap akhir spermatogenesis dan memperpanjang masa hidup spermatozoa epididimis (Hafez dan Hafez 2000)
hewan dimasa tumbuh dimana sangat sensitif terhadap efek tersebut sehingga kemungkinan besar dapat menyebabkan hambatan sekresi hormon hipotalamus-hipofise. Efek tersebut menjadi semakin kurang sensitif setelah hewan dewasa (Cunningham dan Klein 2007) sehingga diduga menyebabkan perubahan yang kurang berarti terhadap sekresi hormon hipotalamus-hipofise.
Kolesterol Pregnolon
Sitosterol dimetabolis menjadi pregnolon dan DHEA (Al Zyood dan Shawakfa 2006)
2
Fitosterol meningkatkan konsentrasi estradiol (Wu et al. 2005) 3
pada hubungan hipotalamus-hipofise-testis dalam sekresi FSH dan LH sehingga berpengaruh terhadap hormon seksual lainnya seperti testosteron (Gomez et al.
2001).
Daun katuk juga mengandung senyawa-senyawa yang bersifat sebagai antioksidan kuat (Wang dan Lee 1997; Subekti 2007; Zuhra et al. 2008) tetapi belum diketahui pasti mekanisme kerjanya terhadap organ reproduksi. Kandungan vitamin C yang tinggi dalam daun katuk (Subekti 2007) bermanfaat dalam sintesa kolagen, meningkatkan steroidogenesis, dan antioksidan (Murray et al. 2001). Vitamin C bekerja sebagai reduktir yang akan mendonorkan satu elektron membentuk semidehidroaskorbat yang tidak bersifat reaktif dan selanjutnya mengalami reaksi disproporsionasi membentuk dehidroaskorbat. Dehidroaskorbat akan terdegradasi membentuk asam oksalat dan asam treonat. Peranannya sangat penting dalam menjaga integritas membran sel (Suhartono et al. 2007).
Kandungan vitamin E dalam ekstrak daun katuk juga tinggi (Subekti 2007). Vitamin E berfungsi sebagai antioksidan dan dapat meningkatkan fungsi reproduksi. Vitamin E merupakan pemutus rantai peroksida lemak pada membran dan LDL dengan menyumbangkan ion H. Vitamin E yang larut dalam lemak merupakan antioksidan yang melindungi Poly Unsaturated Faty Acids (PUFAs) dan komponen sel serta membran sel dari oksidasi oleh radikal bebas (Hariyatmi 2004).
2.7 Ekstraksi dan Fraksinasi
Beberapa metode ekstraksi yaitu maserasi, perkolasi, soxhletasi, dan infundasi. Penelitian ini menggunakan metode maserasi untuk ekstraksi kandungan senyawa aktif daun katuk. Maserasi merupakan proses paling tepat dimana obat yang sudah halus memungkinkan untuk direndam dalam pelarut sampai meresap dan melunakkan susunan sel sehingga zat-zat yang mudah larut akan melarut (Ansel dan Howard 1995).
Fraksinasi (partisi) bertujuan untuk memisahkan senyawa-senyawa yang ada dalam ekstrak kasar. Fraksinasi merujuk pada pemisahan lebih halus. Prinsipnya dengan melakukan pemisahan komponen kimia di antara dua fase pelarut yang tidak saling bercampur di mana sebagian komponen larut pada fase pertama dan sebagian larut pada fase kedua, lalu kedua fase yang mengandung zat terdispersi dikocok, lalu didiamkan sampai terjadi pemisahan sempurna dan terbentuk dua lapisan fase cair, dan komponen kimia akan terpisah ke dalam kedua fase tersebut sesuai dengan tingkat kepolarannya dengan perbandingan konsentrasi yang tetap (Sudjadi 1986).
Menurut Winarno et al. (1973), pelarut adalah suatu cairan yang digunakan dalam proses pemecahan ikatan suatu senyawa untuk selanjutnya membentuk larutan. Pelarut polar akan lebih mudah melarutkan senyawa polar dan sebaliknya senyawa nonplar lebih mudah larut dalam senyawa non-polar. Jenis pelarut akan mempengaruhi kandungan senyawa yang terekstrak karena kelarutan suatu senyawa dalam pelarut tergantung dari gugus yang terikat pada pelarut tersebut.
3 METODE
3.1 Waktu dan Tempat
Penelitian dilaksanakan dari bulan Maret sampai Agustus 2010. Penelitian ini dilaksanakan di Laboratorium Fisiologi Departemen Anatomi, Fisiologi, dan Farmakologi FKH IPB untuk proses ekstraksi dan fraksinasi dilanjutkan di Laboratorium Fertilisasi In Vitro Bagian Reproduksi dan Kebidanan FKH IPB untuk pengamatan karakteristik spermatozoa. Kandang percobaan domba berada di lokasi Karyomendo Farm Jl. Cibanteng Proyek 100, Cihideung Ilir, Ciampea-Bogor.
3.2 Ekstraksi dan Fraksinasi Daun Katuk
Daun katuk segar diperoleh di daerah sekitar Cinangneng-Ciampea-Kabupaten Bogor. Pengolahan dilakukan merujuk pada cara yang telah dilakukan Suprayogi et al. (2010). Daun katuk segar dicuci dengan air bersih kemudian dilakukan penjemuran matahari tak langsung sampai kering-layu. Pengeringan dilanjutkan dengan menggunakan alat oven yang diatur suhunya sampai 60 0C selama semalam (± 12 jam) sehingga diperoleh daun katuk kering. Dari perhitungan pengeringan ini diperoleh 23.45% bahan kering daun katuk dari bahan segarnya.
Evaporasi
+ EtOh 500 ml + Heksan 500 ml
Separasi
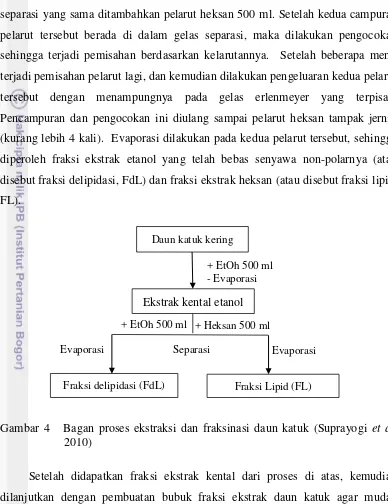
Ekstraksi dilanjutkan untuk memisahkan senyawa non-polar dengan menggunakan pelarut heksan. 20 gram ekstrak kental etanol dilarutkan dalam 500 ml etanol, kemudian dimasukkan ke gelas separasi (separation flash), pada gelas separasi yang sama ditambahkan pelarut heksan 500 ml. Setelah kedua campuran pelarut tersebut berada di dalam gelas separasi, maka dilakukan pengocokan sehingga terjadi pemisahan berdasarkan kelarutannya. Setelah beberapa menit terjadi pemisahan pelarut lagi, dan kemudian dilakukan pengeluaran kedua pelarut tersebut dengan menampungnya pada gelas erlenmeyer yang terpisah. Pencampuran dan pengocokan ini diulang sampai pelarut heksan tampak jernih (kurang lebih 4 kali). Evaporasi dilakukan pada kedua pelarut tersebut, sehingga diperoleh fraksi ekstrak etanol yang telah bebas senyawa non-polarnya (atau disebut fraksi delipidasi, FdL) dan fraksi ekstrak heksan (atau disebut fraksi lipid, FL).
Gambar 4 Bagan proses ekstraksi dan fraksinasi daun katuk (Suprayogi et al.
2010)
Setelah didapatkan fraksi ekstrak kental dari proses di atas, kemudian dilanjutkan dengan pembuatan bubuk fraksi ekstrak daun katuk agar mudah diaplikasikan terhadap domba. Pembuatan bubuk fraksi ekstrak daun katuk dilakukan dengan menambahkan bahan pengisi maltodekstrin untuk masing-masing fraksi ekstrak daun katuk sehingga diperoleh persentase bahan bubuk FdL 82% dan FL 18%. Pemilihan maltodekstrin disebabkan sifat maltodekstrin yang inert, aman, dan tidak higroskopis sehingga cocok dipakai sebagai bahan pengisi
+ EtOh 500 ml - Evaporasi Daun katuk kering
Ekstrak kental etanol
sehingga mudah dimasukkan ke dalam kapsul. Setelah menjadi bubuk, tiap-tiap bubuk fraksi dimasukkan ke dalam kapsul sehingga tiap kapsul dalam perhitungannya mengandung FdL 410 mg/kapsul atau FL 90 mg/kapsul.
3.3 Pelaksanaan Penelitian
Dua belas ekor domba priangan jantan yang diperoleh dari sekitar Bogor dengan umur sekitar 5 bulan dikandangkan dalam kandang individu. Selama 10 hari masa adaptasi, domba diberi obat anti parasit (Albendazole dan Ivermectin). Domba juga dilatih dengan pemberian konsentrat dan rumput. Formula konsentrat terbuat dari campuran bungkil kelapa, dedak padi, tepung ikan, bungkil kedelai, premiks, dan garam. Setiap domba mendapat formula pakan yang sama dengan komposisi nutrisi yang sama. Pada pagi hari dari pukul 07.00 sampai pukul 12.00 domba diberikan konsentrat dan pukul berikutnya hingga pagi hari domba diberikan pakan rumput. Domba juga diberikan minum ad libitum. Pemberian formulasi pakan dan minum tersebut dilakukan juga selama penelitian. Setelah 10 hari masa adaptasi domba dibagi menjadi 3 kelompok perlakuan (masing-masing 3 ekor) yaitu kelompok kontrol, FL, dan FdL. Masing-masing kelompok mendapat perlakuan dimana kontrol dengan plasebo (3 kapsul kosong), FL dengan dosis 270 mg/hari/ekor (3 kapsul), dan FdL dengan dosis 1230 mg/hari/ekor (3 kapsul). Dosis tersebut berdasarkan perhitungan Suprayogi et al.
(2010) yang disesuaikan terhadap konsentrasi senyawa aktif yang terkandung dalam rendemen tiap fraksi yang telah ditemukan dalam penelitian Suprayogi et al. (2009) sebelumnya. Perlakuan dilakukan selama 2 bulan.
3.4 Prosedur Pengambilan Epididimis
spuit jarum suntik. Cairan yang keluar dari kedua epididimis dicampur di atas gelas objek untuk dihomogenkan.
3.5 Parameter Penelitian
Sampel dievaluasi setiap hari selama 5 hari berturut-turut secara mikroskopis yang meliputi motilitas spermatozoa, persentasi hidup spermatozoa, persentasi keutuhan membran spermatozoa, persentasi cytoplasmic droplet
spermatozoa, dan persentasi abnormalitas lain spermatozoa sebagai berikut: a. Konsentrasi Spermatozoa
Konsentrasi spermatozoa hanya diukur sekali saja pada hari ke-0 menggunakan kamar hitung Neubauer. Pertama dilakukan pengenceran 500X dengan cara mencampurkan 1 µL cairan epididimis dengan 499 µL formal saline. Setelah homogen diteteskan ke dalam kamar hitung Neubauer, pengamatan dilakukan dengan prbesaran 400X dengan menghitung jumlah spermatozoa yang tedapat dalam lima kotak haemocytometer yaitu satu kotak pada tiap ujung dan satu kotak di tengah. Konsentrasi spermatozoa dihitung dengan rumus berikut:
Konsentrasi spermatozoa = Σ spermatozoa × (25x106) sel/ml.
b. Motilitas Spermatozoa
Pemeriksaan motilitas dilakukan dengan mencampur 1 tetes cairan epididimis dengan 3 tetes NaCl fisiologis pada gelas objek kemudian dihangatkan. Pengamatan motilitas dilakukan secara objektif dengan mikroskop cahaya pada perbesaran 100X yang dinilai dalam %.
c. Keutuhan membran Spermatozoa
jumlah spermatozoa yang membrannya masih utuh dalam beberapa layang pandang dengan jumlah sel minimal 200 sel. Spermatozoa yang membrannya masih utuh ditandai dengan ekor sperma yang melengkung (Gambar 4). Persentase membran plasma utuh dihitung dengan rumus berikut:
Persentase membran plasma utuh =
.
Gambar 5 Skema perubahan morfologi spermatozoa akibat kondisi hipoosmotik. (a) spermatozoa normal; (b) sampai (g) beragam tipe perubahan ekor (WHO 2010)
d. Spermatozoa Hidup
Pemeriksaan spermatozoa hidup mati dilakukan dengan menggunakan 3 gelas objek yang bersih dan bebas lemak. Dua tetes eosin nigrosin dicampur dengan cairan epididimis, setelah homogen lalu membuat preparat ulas, kemudian dipanaskan sampai kering. Spermatozoa yang hidup ditandai dengan tidak terwarnai spermatozoa karena tidak menyerap warna. Jumlah spermatozoa yang hidup dihitung dalam beberapa layang pandang dengan jumlah sel minimal 200 sel. Persentase spermatozoa hidup dihitung dengan rumus berikut:
Persentase spermatozoa hidup =
.
e. Abnormalitas Spermatozoa
melingkar, ekor ganda dan sebagainya. Pengukuran menggunakan preparat ulas yang telah dibuat pada pemeriksaan spermatozoa hidup sebelumnya. Penghitungan dilakukan hingga jumlah spermatozoa minimal 200 sel dalam beberapa lapang pandang. Persentase abnormalitas spermatozoa dihitung dengan rumus berikut:
4 HASIL DAN PEMBAHASAN
4.1 Konsentrasi Spermatozoa
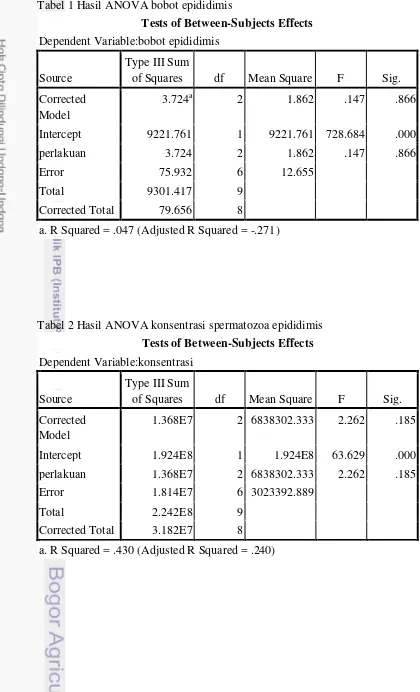
Bobot epididimis dan konsentrasi spermatozoa di kauda epididimis disajikan dalam Tabel 1.
Tabel 1 Bobot epididimis dan konsentrasi spermatozoa di kauda epididimis setelah pemberian fraksi ekstrak daun katuk
Berdasarkan analisis data, bobot epididimis tidak menunjukkan perbedaan yang nyata antar kelompok perlakuan maupun terhadap kontrol, begitu pula dengan konsentrasi spermatozoa kauda epididimia yang tidak berbeda antar perlakuan maupun terhadap kontrol. Hal ini sesuai dengan kesimpulan Cook et al. (1994) yaitu konsentrasi spermatozoa pada epididimis berkorelasi positif terhadap bobot testis maupun epididimis. Tidak adanya perbedaan nyata pada bobot epididimis antar kelompok berhubungan dengan tidak adanya perbedaan nyata pada konsentrasi spermatozoa antar kelompok dalam penelitian ini.
Rata-rata konsentrasi pada kelompok FL dan FdL lebih rendah dibandingkan terhadap kontrol meskipun tidak berbeda nyata. Lebih rendahnya konsentrasi spermatozoa pada kelompok FL dan FdL dibandingkan kontrol diduga akibat peran senyawa androstan-17-one,3-ethyl-3-hydroxy-5 alpha,
fitosterol, flavonoid, dan Papaverine Like Coumpound dalam daun katuk (Suprayogi 2000). Senyawa-senyawa tersebut diduga mampu mengganggu sekresi hormon hipotalamus-hipofise dimana mekanisme tersebut terjadi selama masa perlakuan.
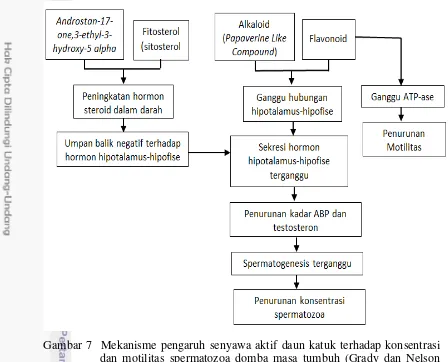
peningkatan hormon steroid dalam darah. Peningkatan kadar hormon steroid terutama testosteron dalam plasma darah akibat senyawa androstan dan fitosterol dapat menghambat sintesis dan sekresi hormon hipotalamus-hipofise melalui efek umpan balik negatif. Sementara itu senyawa flavonoid dan alkaloid ( Papaverine Like Compound) dapat menyebabkan gangguan pada poros hipotalamus-hipofise-testis yang berefek pada gangguan sekresi hormonal hipotalamus-hipofise-hipotalamus-hipofise-testis (Gomez et al. 2001).
Gangguan terhadap hormon hipotalamus-hipofise di atas dapat mengganggu sekresi GnRH maupun FSH-LH. Penurunan kadar FSH akan berpengaruh terhadap sel Sertoli yang menyebabkan terjadinya penurunan sintesis androgen-binding protein (ABP) sehingga sekresi ABP ke dalam lumen tubulus seminiferus berkurang. Penurunan kadar LH dapat menghambat sel Sertoli dalam mensitesis hormon androgen. Berkurangnya konsentrasi ABP dan hormon androgen menyebabkan testosteron yang menuju ke tubulus seminiferus berkurang sehingga mengganggu spermatogenesis yang ditandai dengan terjadinya penurunan jumlah spermatozoa.
Senyawa androstan-17-one,3-ethyl-3-hydroxy-5 alpha dan fitosterol merupakan senyawa hidrofobik sehingga mudah larut dalam pelarut non-polar misalnya heksan sedangkan senyawa flavonoid dan alkaloid-Papaverine Like Compound bersifat lebih polar (hidrofilik) sehingga mudah larut dalam pelarut polar. Diduga kuat bahwa senyawa androstan-17-one,3-ethyl-3-hydroxy-5 alpha
dan banyak terdapat dalam FL sedangkan senyawa flavonoid dan
alkaloid-Papaverine Like Compound banyak terdapat dalam FdL.
Konsentrasi kauda epididimis pada ketiga kelompok dalam penelitian ini lebih rendah dibandingkan penelitian sebelumnya. Menurut Surachman et al.
(2006) konsentrasi spermatozoa di kauda epididimis domba rata-rata sebanyak 11660 juta sel/ml (berkisar antara 10390 sampai 12420 juta sel/ml), sedangkan menurut Rizal dan Herdis (2005) konsentrasi spermatozoa di kauda epididimis pada domba Garut sebanyak rata-rata 13993.33 juta sel/ml (berkisar antara 13530 sampai 14520 juta sel/ml).
digunakan, teknik koleksi spermatozoa yang dilakukan, serta status kesehatan dari hewan tersebut. Hewan yang digunakan dalam penelitian sebelumnya adalah hewan pada masa dewasa, sedangkan domba dalam penelitian adalah domba masa tumbuh yang beumur 7 bulan sehingga diduga masih berada pada awal pubertas. Hal ini diperkuat penelitian White et al. (2005) yang menyatakan bahwa bobot dan volume testis, volume tubulus seminiferus dan interstitial, dan diameter tubulus seminiferus lebih rendah pada masa belum pubertas dibandingkan masa setelah pubertas.
4.2 Motilitas Spermatozoa
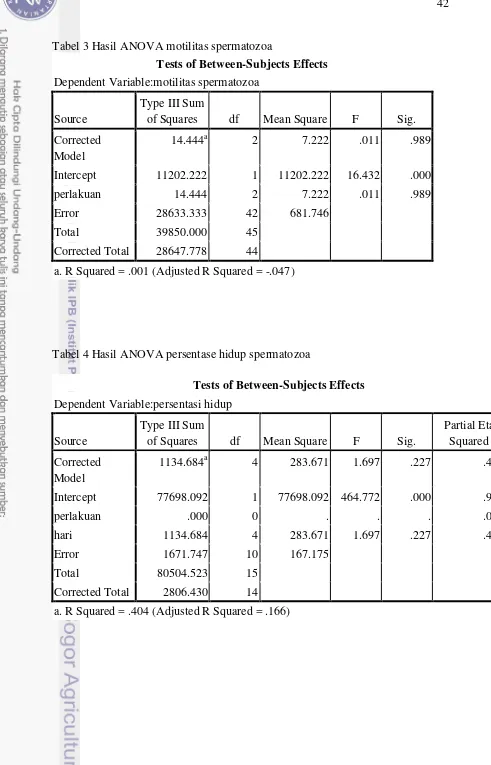
Motilitas spermatozoa dinyatakan oleh persentase spermatozoa yang bergerak maju secara progresif dari satu titik ke titik lain dalam garis lurus (Bearden et al. 2004). Nilai persentase motilitas disajikan dalam Tabel 2.
Tabel 2 Persentase motilitas spermatozoa di kauda epididimis setelah pemberian fraksi ekstrak daun katuk
Perlakuan Waktu Penyimpanan H-
0 (%) 1 (%) 2 (%) 3 (%) 4 (%) Kontrol 61.7±22.5 40.0±10.0 13.3±7.6 0 0 FL 55.0±18.0 30.0±20.0 15.0±5.0 0 0 FdL 58.0±27.5 23.0±7.5 5.0±2.0 0 0
Penyimpanan H-3 dan H-4 tidak memperlihatkan adanya motilitas lagi (0%) dikarenakan sebagian besar spermatozoa telah mengalami aglutinasi antar kepala sehingga hanya dapat bergerak di tempat. Menurut WHO (2010), aglutinasi ditunjukkan oleh menempelnya spermatozoa motil satu sama lain, baik antar kepala, antar ekor, maupun kepala dengan ekor. Aglutinasi dapat berpengaruh terhadap penilaian motilitas. Aglutinasi dapat terjadi akibat lipoprotein yang membungkus permukaan sperma. Selama pematangan beberapa unsur merembes keluar dari permukaan spermatozoa dan cenderung saling menarik satu sama lain atau mengalami aglutinasi (Toelihere 1993).
Terdapat kecenderungan penurunan yang lebih cepat pada perlakuan FdL. Sebagai mana diketahui, daun kaatuk mengandung suatu alkaloid yaitu
Papaverine Lie Compound. Diduga besar bahwa alkaloid itulah yang merupakan penyebab menurunnya motilitas spermatozoa. Alkaloid dapat mengganggu aktifitas enzim ATP-ase yang ada dalam membran sel sperma ATP-ase ini ada di bagian tengah ekor sperma dan berfungsi mempertahankan homeostatis internal untuk ion natrium dan kalium. Motilitas sperma sangat bergantung pada komposisi ion natrium dan kalium. Dengan demikian kalau aktifitas enzim ATP-ase ini terganggu maka homeostatis ion natrium dan kalium akan terganggu, sehingga motilitas sperma juga akan terganggu (Grady dan Nelson 1972).
Hafez dan Hafez (2000) menyatakan bahwa faktor endogen yang mempengaruhi motilitas spermatozoa antara lain umur, persediaan energi (ATP), pematangan spermatozoa serta integritas membran sel. Faktor eksogen yang mempengaruhi motilitas spermatozoa antara lain faktor fisiologis dan biofisik (viskositas, osmolaritas, pH, temperatur, komposisi ion, dan lainnya), stimulus/inhibin (ion inorganik, hormon, kinin, neurofarmakologi, polusi lingkungan, dan faktor imunokimia), dan cairan penangguh (plasma epididimis, dan seminal plasma).
4.3 Persentase Hidup dan Keutuhan Membran Spermatozoa
kematian sel dengan cara masuk melalui membran sel yang rusak sehingga mewarnai kepala spermatozoa. Sementara itu Hypoosmotic swelling (HOS) test
dapat menentukan keutuhan maupun kemampuan osmotik membran spermatozoa sehingga membran sel yang baik akan mampu menahan cairan yang telah masuk ke dalam membran ekor spermatozoa (Regina dan Turner 2005). Data hasil pengamatan disajikan dalam Tabel 3 dan Tabel 4.
Tabel 3 Persentase hidup spermatozoa di kauda epididimis setelah pemberian fraksi ekstrak daun katuk
Tabel 4 Persentase keutuhan membran spermatozoa di kauda epididimis setelah pemberian fraksi ekstrak daun katuk
Perlakuan Waktu Penyimpanan H-
0 (%) 1 (%) 2 (%) 3 (%) 4 (%) Kontrol 45.3±21.9 30.1±11.7 47.3±14.3 38.2±9.6 17.0±12.7 FL 35.5±22.5 36.3±29.5 59.4±17.1 31.2±10.5 24.9±16.9 FdL 56.3±33.14 27.8±15.1 55.5±16.8 37.6±9.6 26.5±16.1
Persentase spermatozoa hidup dan keutuhan membran antar kelompok perlakuan dan terhadap kontrol menunjukkan tidak adanya perbedaan secara nyata. Selain itu terlihat secara umum terjadi kecenderungan penurunan persentase hidup dan keutuhan membran pada kelompok yang normal terjadi akibat masa penyimpanan. Menurut Rizal dan Herdis (2005), diduga banyak spermatozoa yang mati akan menjadi racun bagi spermatozoa yang masih hidup selama proses penyimpanan.
Namun, spermatozoa yang hidup dan yang memiliki membran yang utuh pada kelompok perlakuan cenderung lebih banyak dibandingkan kontrol walaupun tidak signifikan. Hal tersebut diduga akibat tingginya kandungan antioksidan dalam ekstrak daun katuk yang diduga dapat meningkatkan kekuatan membran sel spermatozoa sehingga daya tahan spermatozoa meningkat. Diduga, tingginya konsentrasi vitamin E yang tinggi dapat meningkatkan konsentrasi vitamin E dalam plasma darah. Vitamin E adalah antioksidan yang bekerja sebagai pemutus rantai ikatan sehingga menetralisir peroksidasi hidrogen dan melindungi membran plasma dari peroksidasi lipid. Vitamin E dapat ditemukan dalam membran sel (Agarwal et al. 2004) sehingga diduga selama pembentukan spermatozoa, vitamin E dalam berbagai bentuk turut menyusun membran sel spermatozoas sehingga diduga selama transportasi dalam epididimis membran sel spermatozoa lebih kuat.
Vitamin C juga merupakan antioksidan penting dalam cairan ekstraselular dan memiliki kemampuan menetralisir radikal hidroksil, superoksida, dan hidrogen peroksidasi (Agarwal et al. 2004). Pemberian suplemen yang kaya akan vitamin C dapat meningkatkan konsentrasi vitamin C dalam plasma darah dan testes (Sönmez et al. 2004). Diduga secara langsung maupun selama sekresi plasma epididimis oleh sel epitel terjadi peningkatan konsentrasi vitamin C dalam plasma epididimis. Peningkatan konsentrasi vitamin C dalam plasma epididimis menyebabkan kondisi epididimis yang lebih baik dalam mempertahankan spermatozoa.
Vitamin E merupakan salah satu vitamin yang mudah larut dalam pelarut polar (lipid) misalnya heksan sehingga kemungkinan besar FL mengandung banyak vitamin E. Sementara itu vitamin C kemungkinan besar lebih mudah dipisahkan dengan pelarut polar misalnya etanol sehingga kemungkinan besar FdL mengandung banyak vitamin C.
dan Hinton 2002). Plasma epididimis mengandung antioksidan seperti fosfolipid hidroperoksidase dan glutation peroksidase. Selain itu dalam sel epitel epididimis terdapat tembaga-zinc sitoplasmik dan superoksida dismutase (Agarwal et al.
2004). Epididimis juga mengatur tingkat metabolisme spermatozoa dengan menahan tingkat metabolisme 3 sampai 5 kali dari spermatozoa dalam semen sehingga meminimalisir produksi oksigen reaktif yang dapat membahayakan kehidupan spermatozoa. Hal ini disebabkan eppididimis merupakan tempat penyimpanan spermatozoa sementara sebelum diejakulasikan (Robaire dan Hinton 2002).
Selain hal di atas, terlihat bahwa persentase keutuhan membran spermatozoa (Tabel 4) memiliki nilai rata-rata yang lebih rendah dibandingkan rata-rata persentase hidup spermatozoa (Tabel 3), hal tersebut diperkuat oleh kesimpulan Mansour (2009) dan Nur et al. (2005). Terjadinya hal tersebut diduga kuat dapat disebabkan oleh beberapa hal, yaitu kedua uji tersebut menilai daerah membran sel yang berbeda (Zhu dan Liu 2000), pada pewarnaan eosin-nigrosin beberapa spermatozoa mungkin memiliki membran yang tidak berfungsi tapi masih dapat menahan molekul eosin-nigrosin masuk ke dalam spermatozoa (Vigano et al.
1990), ataupun pada HOS test membran sel terlalu lemah atau mudah rusak sehingga memungkinkan tidak memperlihatkan peningkatan influk air sehingga tidak terlihat terjadinya perubahan terhadap ekor spermatozoa ketika diamati (Regina dan Turner 2005).
4.4 Persentase Cytoplasmic Droplet dan Abnormalitas Lain Spermatozoa Pemeriksaan morfologi spermatozoa diperlukan untuk menilai kualitas spermatozoa. Evaluasi terhadap persentase cytoplasmic droplet dan abnormalitas lain spermatozoa disajikan dalam Tabel 5 dan Tabel 6.
Tabel 5 Persentase cytoplasmic droplet spermatozoa di kauda epididimis setelah pemberian fraksi ekstrak daun katuk
Perlakuan Waktu Penyimpanan H-
Tabel 6 Persentase abnormalitas lain spermatozoa di kauda epididimis setelah
Nilai persentase cytoplasmic droplet dan abnormalitas lain selama masa penyimpanan H-0 hingga H-4 tidak menunjukkan perbedaan nyata dan cenderung memiliki nilai yang tidak jauh berbeda pada setiap harinya baik antar kelompok perlakuan maupun terhadap kontrol.
Menurut Toelihere (1993), bentuk-bentuk abnormalitas spermatozoa diklasifikasikan dalam dua kelompok yaitu abnormalitas primer dan sekunder. Abnormalitas primer terjadi karena kelainan pada tubuli seminiferi dan gangguan testikuler akibat faktor keturunan, penyakit defisiensi makanan, dan pengaruh lingkungan yang jelek. Misalnya spermatozoa dengan kepala terlalu besar (macrochephalic), kepala terlalu kecil (microcephalic), kepala rangkap, ekor berganda, bagian tengah membesar, filiformis, pertautan abaksial pada pangkal kepala, dan ekor melingkar atau terbelah. Abnormalitas sekunder terjadi setelah sel atau bakal sel kelamin jantan meninggalkan epithelium germinativum pada tubuli seminiferi, selama perjalanannya melalui saluran epididimis dan vas deferens, pemanasan yang berlebihan, pendinginan yang terlalu cepat, kontaminasi dengan air, serta perlakuan sewaktu pewarnaan dan pembuatan preparat ulas. Misalnya spermatozoa dengan kepala tanpa ekor, ekor yang terputus, proksimal droplet, distal droplet, dan akrosom yang terlepas.
Abnormalitas yang banyak teramati pada penelitian ini adalah abnormalitas sekunder yang kemungkinan besar diakibatkan oleh perlakuan sewaktu pewarnaan dan pembuatan preparat ulas. Misalnya spermatozoa dengan kepala tanpa ekor, ekor yang terputus, dan ekor yang menekuk. Tidak banyak ditemukan adanya abnormalitas primer selama pengamatan.
fitosterol, flavonoid dan Papaverine Like Coumpound dalam daun katuk seperti yang teleh dijelaskan sebelumnya. ABP berperan dalam menfasilitasi transportasi testosteron ke epididimis dimana testosteron akan diubah menjadi DHT yang berperan dalam perjalanan dan pematangan lebih lanjut spermatozoa di epididimis (Cunningham dan Klein 2007). Penurunan kadar ABP-testosteron menyebabkan pematangan spermatid terganggu sehingga ditemukan banyaknya
cytoplasmic droplet.
Selain itu tingginya persentase abnormalitas kemungkinan besar juga dipengaruhi oleh status reproduksi domba. Domba dalam penelitian ini merupakan domba masa tumbuh yang berumur 7 bulan sehingga kemungkinan domba berada pada awal pubertas sehingga banyak ditemukan spermatozoa yang belum matang. Menurut Hafez dan Hafez (2000), dalam gametogenesis gonocyte
pada awal pubertas dapat mengalami tiga kemungkinan yaitu sebagai cadangan sel dalam bentuk sel stem spermatogonia, mengalami degenerasi, atau spermiogenesis namun spermatozoa yang dibentuk masih dalam kondisi belum matang. Spermatozoa dewasa yang matang secara total akan dibentuk ketika memasuki masa akhir pubertas. Hal ini diperkuat penelitian Söderquist et al.
(1996) bahwa kejadian abnormalitas spermatozoa (abnormalitas kepala dan akrosom, proximal cytoplasmic droplet, total abnormalitas) secara nyata dipengaruhi oleh umur.
4.5 Pembahasan Umum
Selama masa perlakuan dua bulan, terlihat adanya pengaruh fisiologis terhadap domba akibat pemberian fraksi ekstrak daun katuk (Suprayogi et al.
2010; Hidayaturrahmah 2011) termasuk responnya terhadap fungsi reproduksi. Namun dalam penelitian ini tidak menunjukkan adanya pengaruh nyata pada karakteristik spermatozoa seperti di atas. Terdapat kemungkinan bahwa setelah domba dikorbankan (dipotong) respon FL dan FdL terhadap karakteristik spermatozoa akan mudah terlihat pada umur post-mortem di bawah satu hari. Maka dari itu, diperlukan pengamatan pada waktu yang singkat seperti tiap jam atau beberapa jam pasca preparasi epididimis.
Fraksi ekstrak daun katuk diduga mempengaruhi fungsi reproduksi domba yaitu gametogenesis dalam tubulus seminiferus melalui aksi hormonal selama masa perlakuan. Umur domba yang masih tergolong muda dan berada pada masa tumbuh menimbulkan kesensitifan yang tinggi terhadap efek umpan balik negatif hormonal. Hal ini terlihat pada nilai konsentrasi spermatozoa di kauda epididimis pada perlakuan yang lebih rendah dibandingkan kontrol. Terlihat pula bahwa ilai motilitas spermatozoa pada kelompok FdL cenderung lebih cepat menurun dibandingkan kelompok FL dan kontrol.
Gambar 7 Mekanisme pengaruh senyawa aktif daun katuk terhadap konsentrasi dan motilitas spermatozoa domba masa tumbuh (Grady dan Nelson 1972; Suprayogi 2000; Gomez et al. 2001)
Spermatozoa di kauda epididimis dalam penelitian ini kurang layak digunakan untuk Inseminasi Buatan karena tidak memenuhi syarat minimal persentase motilitas paling sedikit 40%, persentase kutuhan membran lebih dari 30% (Hafez ESE dan Hafez B 2000), dan abnormalitas minimal 20% (Toelihere 1993). Selain itu standar abnormalitas suatu semen yang dapat dipakai untuk inseminasi maksimal 20% karena spermatozoa yang abnormal tidak dapat membuahi ovum (Toelihere 1993).
dapat digunakan dalam produksi embrio melalui intracytoplasmic sperm injection
(ICSI) yaitu menyuntikkan spermatozoa hidup yang tak bergerak langsung ke dalam vitellus oosit (Hafez dan Hafez 2000).
BAB 5 SIMPULAN DAN SARAN
5.1 Simpulan
1. Pemberian FL dan FdL daun katuk tidak menunjukkan pengaruh nyata terhadap karakteristik spermatozoa di kauda epididimis.
2. Terdapat kecenderungan penurunan konsentrasi pada kelompok FL dan FdL, penurunan motilitas yang lebih cepat pada kelompok FdL, dan peningkatan kekuatan membran pada kelompok FL dan FdL.
3. Persentase hidup dan keutuhan membran spermatozoa hingga H-4 masih cukup tinggi.
5.2 Saran
1. Perlu dilakukan penelitian dengan selang waktu pengamatan yang lebih pendek.
2. Perlu dilakukan penelitian terhadap pengaruh fraksi ekstrak katuk terhadap hewan jantan dewasa ataupun yang mengalami gangguan reproduksi.
DAFTAR PUSTAKA
Agarwal A, Nallella KP, Allamaneni SS, Said TM. 2004. Role of antioxidants in treatment of male infertility: an overview of the literature. Reprod Biomed Online 8: 616-627.
Agusta A, Harapini M, Chairul. 1997. Analisis kandungan kimia ekstrak daun katuk (Sauropus androgynus L. Merr) dengan CGMS. Warta Tumbuhan Obat 3 (3): 31-34.
Ansel, Howard C. 1995. Introduction to Pharmaceutical Dosage Form. Ed ke-5. Georgia: Lea & Febiger Press.
Bearden HJ, Fuquy JW, Willard ST. 2004. Applied Animal Reproduction. Ed ke-6. New Jersey: Pearson Prentice Hall.
[BPOM RI] Badan Pengawas Obat dan Makanan Republik Indonesia. 2008.
Taksonomi Koleksi Tanaman Obat Kebun Tanaman Obat Citeureup. Jakarta: BPOM RI.
Cook RB, Coulter GH, Kastelic JP. 1994. The testicular vascular cone, scrotal thermoregulation, and their relationship to sperm production and seminal quality in beef bulls. Theriogenology 41: 653-671.
Cunningham JG, Klein BG. 2007. Textbook of Veterinary Physiology. Ed ke-4. Missouri: Saunders Elsevier.
Danzo BJ, Pavlou SN, Anthony HL. 1990. Hormonal regulation of androgen-binding protein in rat. J Endocrinol 127: 2829-2838.
Despopoulos A, Silbernagl S. 2003. Color Atlas of Physiology. Ed ke-5. New York: Thieme.
Gomez Y, Velazquez PN, Pelalta ID, Mendez MC, Vilchi F, Juarez MAO, Peedernera E. 2001. Follicle stimulating hormone regulates steroigenic enzymes in culture cells of the chick embryo ovary. Gen Comp Endocrinol
121 (3): 305-315.
Grady AV, Nelson, L. 1972. Cathionic influences on sperm biopotential. Exp Cell Res 73: 192-195.
Gunawan D, Mulyani S. 2004. Ilmu Obat Alam (Farmakognosi) Jilid 1. Depok: Penebar Swadaya.
Harborne JB. 1998. Phytochemical methods: a guide to modern techniques of plant analysis. UK: Thomson Sci.
Hariyatmi. 2004. Kemampuan vitamin E sebagai antioksidan terhadap radikal bebas pada lanjut usia. J MIPA 14 (1): 52-60.
Hidayaturrahmah. 2011. Dinamika lipid dan profil asam lemak volatile (VFA) parsial serta hematologi domba yang diberi fraksi ekstrak daun katuk (Sauropus androgynus L. Merr) [thesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Mansour MM. 2009. Modification of hypo-osmotic swelling test to evaluate the integrity of stallion sperm plasma membran. Global Vet 3 (4): 302-307. Mital P, Hinton BT, Dufour JM. 2011. The blood-testis and blood-apididymis
barriers are more than just their tight junctions. Biol Reprod Papers, in press.
Munell F, Suárez-Quian CA, Selva DM, Tirado OM, Reventós J. 2002. Androgen-binding protein and reproduction: where do we stand?. J Androl
23 (5): 598-609.
Murray AA, Molinek MD, Baker SJ, Kojima SN, Smith MF, Hilllier SG, Spears N. 2001. Role of ascorbic acid in promoting follicle integrity and survival in intact mouse ovarian follicle in vitro. Reproduction 121: 89-96.
Nolan JP, Hammerstedt RH. 1997. Regulation of membrane stability and the acrosome reaction in mammalian sperm. FASEB J 11:670-682.
Nur Z, Dogan I, Gunay U, Soylu MK. 2005. Relationships between sperm membrane integrity and other semen quality characteristics of the semen of saanen goat bucks. Bull Vet Int Pulawy 48: 183-187.
Pineda MH [editor]. 2003. McDonald’s Veterinary Endocrinology and
Reproduction. Ed ke-5. Iowa State: Blackwell Publishing.
Regina M, Turner. 2005. Current techniques for evaluation of stallion fertility.
Clinical Techniques in Equine Practice 4 (3): 257-268.
Rizal M, Herdis. 2005. Daya hidup spermatozoa epididimis domba garut yang dikriopreservasi menggunakan modifikasi pengencer tris. Hayati 12 (2): 61-66.
Robaire B, Hinton BT [editor]. 2002. The Epididymis: From Molecules to Clinical Practice. New York: Kluwer Academic.
Rukmana R, Indra MH. 2003. Katuk, Potensi, dan Manfaatnya. Yogyakarta: Kanisius.
Santoso U, Setianto J, Suteky T. 2002. Penggunaan ekstrak daun katuk untuk meningkatkan efisiensi produksi dan kualitas telur yang ramah lingkungan pada ayam petelur. Laporan Penelitian Hibah Bersaing Tahun 1.
Saragih DTR. 2005. Daun katuk dalam ransum ayam petelur dan pengaruhnya terhadap kandungan vitamin A, kolesterol dalam telur dan karkas, dan estradiol darah [thesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Sari DAP. 2004. Pengaruh pemberian ekstrak daun katuk kering dan katuk hijau terhadap produksi susu mencit (Mus musculus) [skripsi]. Bogor: Program Sarjana, Institut Pertanian Bogor.
Sidauruk BD. 2008. Produksi air susu induk babi dengan penambahan ekstrak daun katuk (Sauropus androginus (L.) Merr) dalam ransum pada taraf dan waktu pemberian yang berbeda [skripsi]. Bogor: Program Sarjana, Institut Pertanian Bogor.
Söderquist L, Janson L, Håård M, Einarson S. 1996. Influence of season, age, breed and some other factors on the variation in sperm morphological abnormalities in Swedish dairy AI bulls. Anim Reprod Sci 44 (2): 91-98. Sönmez M, Türk G, Yüce A. 2004. The effect of ascorbic acid supplementation
on sperm quality, lipid peroxidation and testosterone levels of male Wistar rats. Theriogenology 63 (7): 2063-2072.
Subekti S. 2007. Komponen Sterol dalam Ekstrak Daun Katuk (Sauropus androgynous (L.) Merr) dan hubungannya dengan sistem reproduksi puyuh [disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Sudjadi. 1986. Metode Pemisahan. Yogyakarta: UGM Press.
Suhartono E, Fachir H, Setiawan B. 2007. Kapita Sketsa Biokimia Ster Oksidatif Dasar dan Penyakit. Banjarmasin: Universitas Lambung Mangkurat Pustaka Benua.
Suprayogi A. 2000. Studies on the biological effects of Sauropus androgynous (L.) Merr.: effect of milk production and the possibilities of induced pulmonary disorder in lactating sheep [disertasi]. Göttingen: Faculty of Agericultural Sciences, George-August-Universitat Göttingen.
Suprayogi A, Kusumorini N, Setiadi MA, Murti YB. 2009. Produksi fraksi ekstrak daun katuk sebagai bahan baku obat perbaikan gizi, fungsi reproduksi, dan laktasi. Laporan Akhir Penelitian Lembaga Penelitian dan Pengabdian kepada Masyarakat IPB.