PENDAHULUAN
Latar belakang
Kedelai (Glycine
max
(L.) Merr.) merupakan satu di antara komoditas pertani- an penting di Indonesia. Rataan kebutuhan kedelai tiap tahun dalam periode 1984-1988 sekitar 1.87 juta ton peptan, 1992) dan dalam periode 1989- 1992 sekitar 2.06 juta ton (CBS, 1990, 1991, 1992, 1993) sedang produksi total tiap tahun dalam periode 1984-1988 sekitar 1.17 juta ton (Deptan, 1992) dan dalam periode 1989- 1993 sekitar 1.49 juta ton (CBS, 1990, 1991, 1992, 1993). Dari data tersebut di- ketahui bahwa di dalam negeri produksi kedelai belum mencukupi kebutuhan. Untuk memenuhi kekurangan tersebut diperlukan impor yang volumenya cukup tinggi yaitu rata-rata 362.600 ton tiap tahun dalam periode 1984- 1988 (CBS, 1985, 1986, 1987, 1988, 1989) dan 604.400 ton tiap tahun dalam periode 1989-1992 (CBS, 1990, 1991, 1992, 1993).
Produksi kedelai per satuan luas di Indonesia masih jauh di bawah produksi tertinggi tiap varietas yang ditanam. Dari tiap varietas unggul kedelai yang telah dilepas sejak Pelita I-IV terlihat bahwa rataan hasil tiap hektar masih jauh lebih rendah dibanding rataan hasil tertinggi (Tabel 1). Rataan hasil berkisar antara 0.89- 1.16 ton dalam periode 1984-1992 (CBS, 1985, 1986, 1987, 1988, 1989, 1990, 1991, 1992, 1993).
yaitu Meloidogyne incognita, dan M. javanica, M. arenaria, yang m e ~ p d c a n faktor pembatas penting dalam produksi kedelai (Sikora & Greco, 1990). Di antara ketiga
Tabel 1. Produktivitas Varietas Kedelai yang Dilepas dalam Pelita I
-
Pelita IVVar ietas Hasil (tonha) Varietas Hasil (tonha)
rataan tertinggi rataan tertinggi
Orba 1.5 2.7
Galunggung 1.5 2.4
Lokon 1.5 2.0
Guntur 1.5 2.0
Wilis 1.6 2.7
Dempo 1 .G 2.7
Kerinci 1.6 2.9
Merbabu
Raung 1.6 2.1
Tidar 1.6 2.4
Rinjani 1.4 2.8
Lompobatang 1.7 2.5
Tambora 1.7 2.5
1.5 2.4
Rataan semua varietas
Sumber: Manwan et al. 1990
3 Kehilangan hasil kedelai akibat nematoda puru akar sangat beragam tergantung pada kerapatan populasi awal nematoda, varietas kedelai yang ditanam, faktor-faktor lingkungan terutama kelembaban dan suhu, dan cara pengelolaan. Di Florida ke- hilangan hasil akibat serangan M. incognita telah dilaporkan mencapai 90% (Kin- loch, 1974), sedang di North Carolina kerugian lebih rendah daripada di Florida karena perbedaan suhu (Schmit & Noel, 1984 diacu oleh Sikora & Greco, 1990). Di Indonesia pendataan kehilangan hasil kedelai oleh nematoda puru akar belum dilakukan. Hasil pengamatan nematoda parasit tumbuhan pada tanaman palawija di
lahan kering di Jawa Timur, Madura dan Lombok yang dilakukan oleh Maas (1990) menunjukkan bahwa pada beberapa contoh perakaran kedelai di Madura ditemukan NPA dalam jumlah yang cukup besar yaitu berkisar antara 4 500
-
9 000 individu dalam tiap 10 gram akar. Hasil survei di beberapa sentra produksi kedelai di luar Jawa menunjukkan bahwa luas serangan NPA berkisar antara 4-326 hektar dengan intensitas serangan antara 1-5074(BPS,
1994).4
agens peluka, (3) pemodifikasi inang, (4) pemodifikasi rizosfer, dan (5) pematah ketahanan inang.
Bentuk interaksi lain antara nematoda parasit tumbuhan
dan
mikroba penghunitanah
adalah fenomena antagonistik yang megganggu nematoda. Sangat banyak jenismikroba antagonis yang secara alamiah dapat mengendalikan populasi nematoda. Antagonisme ini dalam beberapa dasawarsa terakhir banyak dimanfaatkan untuk pengendalian nematoda. Berbagai jenis organisme dapat berperan sebagai agens antagonis nematoda parasit tumbuhan (Kerry, 1987). Di antara antagonis tersebut yang paling banyak diteliti adalah golongan cendawan nematofag. Menurut Dud- dington (1975) terdapat sekitar 50 spesies cendawan yang mampu menangkap dan membunuh nematoda di dalam tanah, pada bahan organik, dan di tempat-tempat lain. Semuanya mempunyai potensi sebagai agens pengendali nematoda. Selain 50 spesies cendawan tersebut masih banyak spesies cendawan antagonis lainnya yang
secara
alamiah dapat menekan populasi nematoda (Kerry,
1987).Untuk mendapat* kualitas dan kuantitas hasil kedelai yang optimum, maka pengetahuan mengenai karakteristik hayati organisme yang terlibat di dalam ling- kungan tumbuh tanaman tersebut perlu dikaji. Dalam penelitian ini
akan
dikaji fenomena interaksi antara cendawan pengkoloni NPA dan M.incognita
pada kedelai.Cendawan yang dikaji meliputi
beberapa
isolat yang mem ben tuk kolonisecara
5
mungkin juga merupakan patogen pada kedelai sehingga perannya dalam produksi kedelai perlu diperhitungkan.
Informasi yang diperoleh dari kajian tersebut diharapkan dapat dimanfaatkm dalam pengembangan
cara
pengendalianM.
incognita
sebagai salah satu faktor pembatas produksi kedelai.Tujuan
Penelitian ini bertujuan memperoleh pengetahuan tentang interaksi antara spesies-spesies cendawan koloni NPA (stadium telur dan dewasa betina) dan M.
incognita
pada kedelai. Tujuan selanjutnya memperoleh isolat-isolat cendawan yangefektif sebagai agens pengendali M.
incognita
yang biasa menyerang kedelai.Hipotesis
1. Beberapa spesies cendawan koloni NPA betina dewasa adalah nematofag yang dapat menekan populasi nematoda tersebut.
TLNJAUAN PUSTAKA
Nematoda Puru Akar
Nematoda puru akar (NPA) (Meloidogyne spp. Goeldi) telah dilaporkan sejak 1885 sebagai penyebab kerusakan pada berbagai spesies tanaman, terutama di ka- wasan tropik dan subtropik (Franklin, 1982). Pada mulanya NPA dianggap spesies
tunggal, kemudian Chitwood (1949a diacu oleh Thorne 1961) memastikan adanya empat spesies dan satu varietas berdasarkan morfologi sidik perineum (perineal pattern) nematoda betina dewasa dan ciri morfologi lainnya. Keempat spesies terse- but adalah Meloidogyne javanica, M. arenaria, M. incognita, M. hapla, dan M. incognita var. acrita. Setelah identifikasi cara Chitwood tersebut, banyak dilapor-
kan
spesies NPA yang lain dari berbagai tempat. Sampai dengan akhir 1988 tercatat 6 1 spesies Meloidogyne (Eisenback & Triantaphyllou, 199 1).Klasifikasi
NPA termasuk ordo Tylenchida, subordo Tylenchina, famili Heteroderidae,
subfarnili Meloidog ynae; genus Meloidogyne (Franklin, 1982).
Morfologi
Meloidogyne spp., seperti halnya nematoda parasit tumbuhan lainnya, tidak
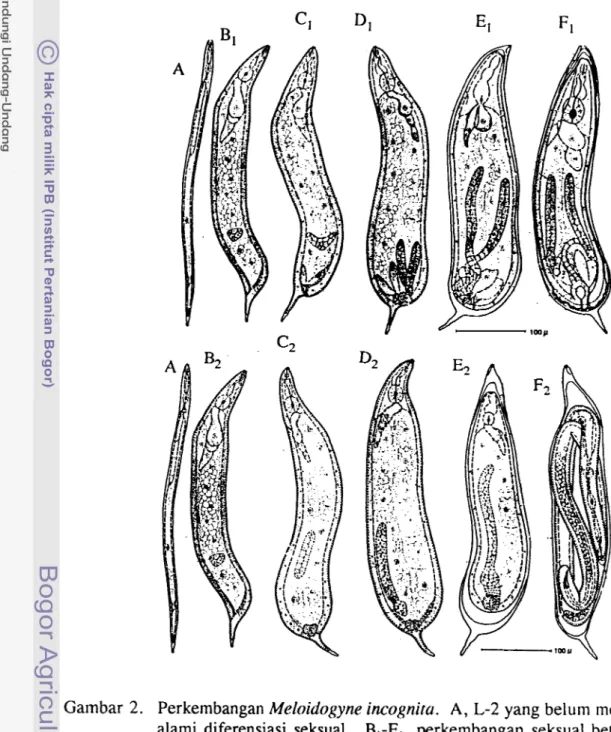
7 1. Larva
Larva instar pertama (L-1) berekor tumpul dan mengalami ganti kulit di dalam telur, sedang larva instar kedua (L-2) menetas dan kemudian hidup bebas di dalam tanah. Panjang L-2 menurut Walker (1975) berkisar antara 375 dan 500p, sedang menurut Franklin (1982) antara 330 dan 3 4 0 ~ dengan diameter menurut Walker (1975) antara 12 dan 1 5 ~ . Panjang dan bentuk ekor L-2 bervariasi (Gambar 1). Nisbah panjang badanlekor berkisar antara 10: 1 (untuk
M.
hapla) sampai dengan15: 1 (untuk M. africana) (Franklin, 1982).
M. artiello 22p M. hapla 43p M. incognita 46p
M. jawnico 49p M. arenaria 5 1p I M. nassi 70 p
8 Larva instar tiga (L-3) dan empat (L-4) NPA berkembang di dalarn jaringan tanaman inang. Perkembangan bentuk M. incogniru disajikan dalam Gambar 2.
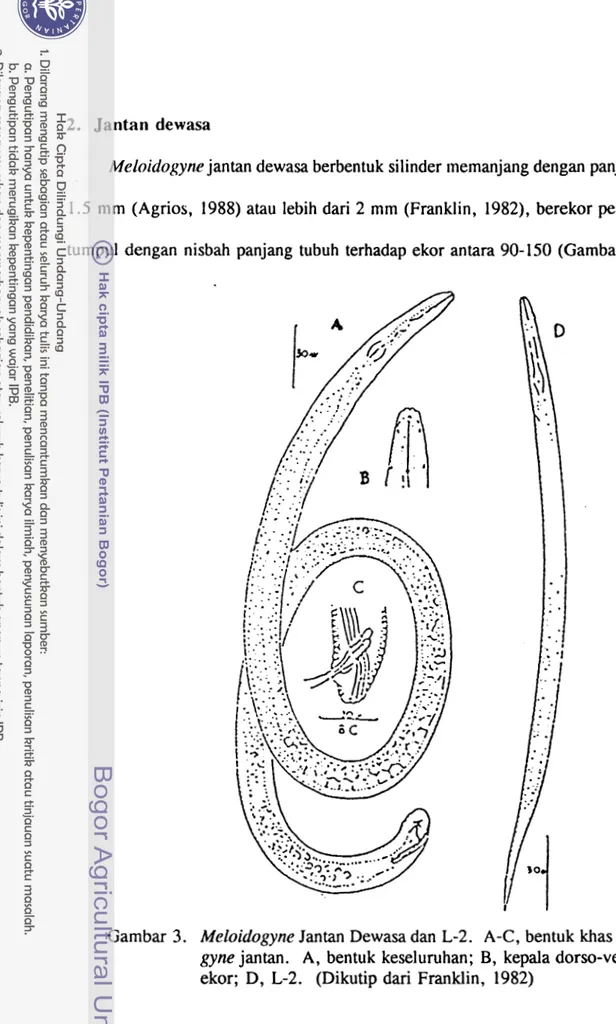
9 2. Jantan dewasa
Meloidogyne jantan dewasa berbentuk silinder memanjang dengan panjang 1.2- 1.5 mm (Agrios, 1988) atau lebih dari 2 mm (Franklin, 1982), berekor pendek dan tumpul dengan nisbah panjang tubuh terhadap ekor antara 90-150 (Gambar 3).
10
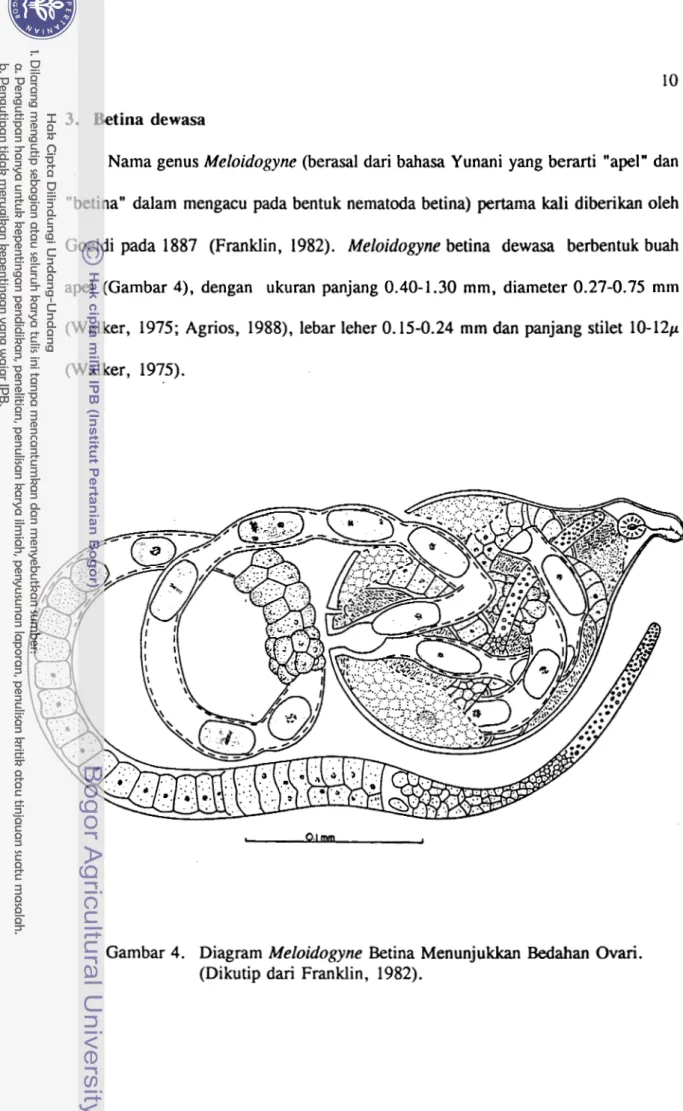
3. Betina dewasa
Nama genus Meloidogyne (berasal dari bahasa Yunani yang berarti "apel" dan "betina" dalam mengacu pada bentuk nematoda betina) pertama kali diberikan oleh Goeldi pada 1887 (Franklin, 1982). Meloidogyne betina dewasa berbentuk buah apel (Gambar 4), dengan ukuran panjang 0.40-1.30 mm, diameter 0.27-0.75 m m (Walker, 1975; Agrios, 1988), iebar leher 0.15-0.24 m m dan panjang stilet 10- 12p (Walker, 1975).
Biologi
Semua NPA umumnya penyerang akar dan merupakan parasit obligat sedenter pada tumbuhan tingkat tinggi. Adakalanya nematoda ini pada tumbuhan tertentu juga dapat menyerang selain akar, misalnya daun serta batang semanggi dan balsam (Franklin, 1982) dan daun serta bunnga Palisora barteri (Lehman & McGowan, 1986).
1. Fase telur
Telur NPA diletakkan dalam suatu paket substansi gelatin yang berfungsi se- bagai lapisan pelindung. Menurut Franklin (1982) pelindung telur tersebut adalah glikoprotein yang merupakan gelatin yang bentuknya tidak beraturan dan dihasilkan oleh kelenjar rektal nematoda betina. Satu paket telur biasanya berisi beberapa ratus sampai 1000 butir telur atau lebih. Jumlah telur terbanyak yang dihasilkan oleh satu individu dilaporkan dapat mencapai 2882 butir, tetapi biasanya sekitar 500 butir (Tyler, 1933 diacu oleh Christie, 1959).
Penetasan telur tidak memerlukan rangsangan eksudat akar (Christie, 1959), meskipun eksudat akar dapat menambah jumlah telur yang menetas (Franklin,
1982). Untuk penetasan telur diperlukan suhu, kelembaban dan oksigen yang cukup sebagai perangsang (Christie, 1959).
2. Fase hidup bebas
12 berganti kulit menjadi L-2 di dalam telur yang kemudian keluar dan merupakan fase liidup bebas yang aktif mencari makan.
Terdapat beberapa fakta bahwa L-2 tertarik pada akar. M. hapla terakumulasi di daerah perakaran tomat, Avena sativa dan Secale cereale walaupun tidak me- nyerang kedua tanaman yang disebutkan terakhir (Lownsbery & Viglierchio, 1961). M. incognita bergerak sampai 120 cm di dalam tanah mengikuti perakaran tomat dan mentimun (Bird, 1969).
Daerah ujung akar merupakan bagian yang mempunyai aktivitas metabolik tinggi dan tempat berdifusinya berbagai senyawa, yang dapat menjadi senyawa atraktan. Wieser (1955 diacu oleh Norton, 1978) mendapatkan bahwa bagi M. hapla daerah 2 mm paling ujung akar tomat merupakan daerah repelen, sedang 6 mm berikutnya (zona pemanjangan) merupakan daerah atraktan.
3. Fase parasitik
L-2 NPA masuk ke dalam jaringan akar tanaman dengan menusuk-nusukkan s tiletn ya di daerah-daerah pemanjangan
,
ramb u t akar atau pada akar-akar lateral. Bird (1967) mengemukakan bahwa tampaknya penetrasi dibantu oleh sekresi dari kelenjar esofagus sub-ventral.13 parasit sedenter selama masa hidupnya. NPA jantan mengalami metamorfosis pada pergantian kulit terakhir, kemudian keluar dari jaringan
akar
dan hidup bebas di dalam tanah. Christie (1959) mengemukakan bahwa NPA jantan sering ditemukan di sekitar kelompok telur di daerah posterior NPA betina dan diduga untuk melaku-kan
kopulasi.Walaupun pada hampir semua spesies Meloidogyne terdapat nematoda jantan, reproduksi nematoda ini hampir selalu secara partenogenesis. NPA jantan spesies- spesies yang amfimiktik yaitu M. carolinensis, M. microtyla dan
M.
megatyla akan mengawini betinanya (Triantaphyllou, 1982 diacu oleh Hadisuganda, 1989).Perkembangan populasi NPA tergantung pada kesehatan dan kesesuaian tum- buhan sebagai inangnya, suhu, kepadatan larva di dalam akar dan kesesuaian kondisi selama fase hidup bebas. Dalam kondisi suhu tinggi seperti di daerah tropik dan
subtropik satu generasi memerlukan waktu minimum 4-6 minggu sehingga dalam satu tahun, bila tumbuhan inang terus tersedia, dapat mencapai beberapa generasi, sedang di daerah beriklim dingin biasanya hanya satu generasi (Franklin, 1982).
Reaksi Inang
1. Pembentukan puru
Menurut Christie (1959) larva yang masuk ke dalam akar atau struktur lainnya yang ada di dalam tanah, menyebabkan kerusakan mekanik yang ringan kecuali bila terjadi serangan masal. Dikemukakannya bahwa pengaruh serangan tersebut pada jaringan tumbuhan paling banyak disebabkan oleh senyawa yang disekresikan mela- lui stilet ketika larva makan. Adakalanya ujung-ujung akar mengalami devitalisasi dan pertumbuhannya terhenti.
Salah satu gejala serangan NPA adalah terbentuknya puru (Gambar 5). Ter- bentuknya puru pada akar terinfeksi sebagian karena terjadinya hiperplasis dan hipertrofi sel-sel korteks dan sebagian karena perkembangan sel-sel raksasa di tempat nematoda makan. Akar yang terinfeksi NPA tidak selalu mengalami pem- besaran, tetapi sel-sel raksasa selalu terbentuk (Franklin, 1982). Sel-sel raksasa tumbuh dari sel-sel (biasanya sel-sel perisikel) yang tidak mengalami diferensiasi mungkin sebagai respons terhadap zat pengatur tumbuh yang diproduksi oleh kelen- jar esofagus sub-ventral larva yang menyerang (Dropkin, 1972). Sel-sel raksasa merupakan sinsitia yaitu sel-sel multi-nukleat dengan ketebalan dinding yang tidak beraturan dan dianggap sebagai sel-sel pentransfer makanan bagi NPA (Jones & Northcote, 1972 diacu oleh Franklin, 1982).
16 Ketahanan tumbuhan terhadap NPA dapat terjadi sebelum atau sesudah L-2 masuk ke dalam jaringan. Ketahanan sebelum masuknya L-2 ke dalam jaringan disebut ketahanan prainfeksi, sedang ketahanan sesudah L-2 masuk jaringan disebut
ketahanan pascainfeksi (Wallace, 1963).
Ketahanan prainfeksi berkaitan dengan sifat-sifat fisik, kimia atau fisiologi tumbuhan. Nematoda-nematoda endoparasit seperti NPA dalarn melakukan infeksi hams dapat menembus jaringan terluar tumbuhan inangnya, dan jaringan yang tebal dapat menjadi penghalang nematoda dalam melakukan penetrasi. Ketahanan seperti
ini merupakan ketahanan fisik. Beberapa jenis tumbuhan menghasilkan suatu senya- wa yang toksik terhadap nematoda. Misalnya varietas semangka yang membawa gen dominan tunggal (Bi) mengeluarkan eksudat akar yang mampu menolak NPA (Haynes & Jones, 1976). Contoh lain adalah Asparagus oflcinalis L. yang batang, daun, dan akarnya mengandung glikosida yang toksik terhadap Tn'chodonrs christiei Allen (Rohde & Jenkins, 1958 diacu oleh Cook & Evans, 1987).
17 (1) Terbentuk sinsitia besar berdinding tebal rangkap dua dan berinti ban yak dengan sitoplasma yang bertekstur granular. Sinsitia semacam ini sangat
sesuai untuk reproduksi NPA. Reaksi ini te rjadi pada kultivar yang rentan terhadap NPA, misalnya kultivar Pine Dell.
(2) Terbentuk sinsitia, tetapi ukurannya lebih kecil, dinding selnya lebih tipis dan sitoplasmanya lebih encer dibanding dengan yang tersebut dalam butir (1). Reaksi ini te rjadi pada kultivar yang agak tahan terhadap NPA, misalnya kulti- var Var York.
(3) Terbentuk sinsitia tetapi ukurannya kecil, sitoplasmanya mengandung banyak partikel yang berbentuk spiral, benang atau bola. Sinsitia semacam ini ter- dapat pada kultivar yang tahan terhadap NPA, misalnya kultivar Bragg.
(4) Tidak membentuk sinsitia, sel sedikit membengkak. Sel-sel di sekitar kepala nematoda mengalami nekrosis. Larva mati tanpa mengalami perkembangan. Reaksi ini menunjukkan kekebalan terhadap nematoda, misalnya kultivar McNair 600.
Tumbuhan tahan sexing mempunyai suatu respon hipersentitif (Cook & Evans, 1987). Beberapa tanaman juga menghasilkan fitoaleksin yang menghambat aktivitas
nematoda. Kaplan et al. (1979) mengaitkan produksi gliseolin pada akar suatu varietas kedelai dengan ketahanannya terhadap M. incognita. Selanjutnya Kaplan et
18 pengisapan 0, oleh larva NPA, dan hanya terbentuk oleh tanaman yang terinfeksi oleh M. incognita, serta tidak oleh spesies nematoda lainnya.
Identifikasi
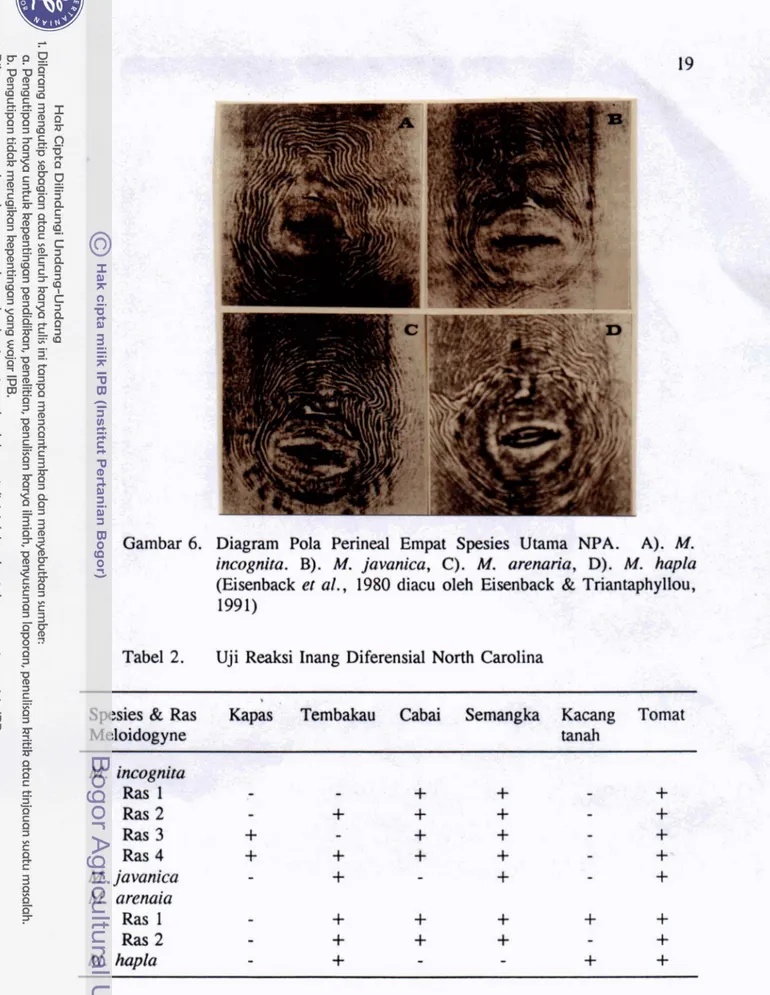
Identifikasi NPA sampai pada tingkat spesies dan ras inang merupakan prasya- rat dasar yang penting baik untuk keperluan pengendalian maupun untuk keperluan penelitian. Beberapa cara yang umum digunakan dalam identifikasi NPA adalah pola sidik perineum nematoda betina dewasa (Chitwood, 1949 diacu oleh Thorne, 1961), uji inang diferensial North Carolina (Taylor & Sasser, 1978) dan berdasarkan morfologi kepala NPA jantan dewasa (Eisenback & Hirschmann, 1981).
Karena adanya sejumlah keragaman dalam suatu populasi atau spesies maka banyak hasil identifikasi berdasarkan morfologi sidik perineum ini tidak meyakinkan (Eisenback, 1985). Oleh karena itu identifikasi berdasarkan ciri-ciri yang lain diper- lukan sebagai pelengkap. Diagram pola perineal empat spesies utama NPA disajikan dalam Gambar 6.
Gambar
6.Diagram Pola Perineal
Empat Spesies Utama
NPA. A).M.
incognita.
B).
M.
jawmica, C).M.
arenaria,D).
M.
hapla(Eisenback
etal.,
1980 diacu oleh Eisenback
&Triantaphyllou,
1991)
v .- 6 ?q-,.&
-
*
Tabel
2.Uji
Reaksi Inang Diferensial North Carolina
Spes*s
&Ras
I<rpL
T m b W
Cab&Semangka
Kacang Tomat
Mdokbgyne
tanah
J :
-M.
incognitaRasl
-
-
+
+
-
+
-
-T.
8 . 7Ras2
-
+
+
+
-
+
-.
..? .Ras3
+
-
+
+
-
.
'*
+
Ras4
+
+
+
+
-
+
M.
jawulica-
+
-
+
-
+
M.
arenaiaRasl
+
+
+
+
+
Ras2
-
+
+
+
-
+
M.
hapfa-
+
-
-
+
+
Interaksi NPA-Cendawan Tanah dalarn Perkernbangan Penyakit
Fitonematoda penghuni tanah hidup di dalam lingkungan yang penuh dengan berbagai jenis mikroorganisme. Dengan demikian interaksi yang intensif antara fitonematoda dan berbagai mikroorganisme tersebut akan selalu terjadi. Dua tipe
interaksi antara fitonematoda dan mikroorganisme tanah dalam kaitannya dengan terjadinya penyakit adalah "interaksi sinergistikw dan "interaksi antagonistik".
Nematoda tertentu mempredisposisikan tanaman terhadap serangan patogen lainnya atau mengakibatkan tanaman lebih rentan terhadap mikroorganisme yang dalam kondisi normal bukan sebagai parasit pada tanaman tersebut. Bila pengaruh kombinasi dua patogen terhadap kerusakan pada tanaman inang lebih besar daripada jumlah pengaruh masing-masing patogen secara terpisah maka interaksi demikian disebut interaksi sinergistik (Powell, 1979; Wallace, 1983). Berdasarkan pengertian tersebut maka interaksi antagonistik mempun yai arti kebalikannya, yaitu bila penga- ruh kombinasi dua organisme pada suatu tanaman lebih kecil daripada jumlah penga- ruh masing-masing patogen secara terpisah. Apabila dikaitkan dengan pertumbuhan tanaman, dalam interaksi sinergistik tanaman mengalami kerusakan lebih parah, sedang dalam interaksi antagonistik tanaman mengalami kerusakan lebih ringan.
2 1 fisiologi akar (Melendez & Powell, 1967; Johnson & Powell, 1969) dan bagian tanaman yang lain di atas permukaan tanah (Powell & Batten, 1969).
Apabila pengertian interaksi fitonematoda-cendawan dikaitkan dengan ganggu- an (kerusakan) yang ditimbulkannya pada tanaman, maka penelitian-penelitian ten-
tang pengendalian hayati fitonematoda dengan cendawan antagonisnya merupakan aspek interaksi antagonistik. Dalam sistem interaksi ini nematoda mengalami gang- gum sehingga kemampuannya dalam menimbulkan kerusakan pada tanaman menjadi berkurang
.
Interaksi Sinergistik
-
Adanya interaksi antara fitonematoda dengan mikroorganisme' lain penghuni tanah pertama kali dilaporkan oleh Atkinson (1892, diacu oleh Hussey & McGuire, 1987). Ketika itu Atkinson mengamati bahwa NPA dapat meningkatkan intensitas pen yakit layu fusarium pada kapas. Sejak itu, kajian-kajian semacam banyak dilaku- kan oleh para peneliti.
22 Pada mulanya para peneliti beranggapan bahwa interaksi sinergistik te jadi karena nematoda menyediakan jalan masuk ke jaringan akar bagi mikroba lainnya. Penemuan terakhir menunjukkan bahwa proses interaksi sinergistik fitonematoda- cendawan ternyata tidak sesederhana itu, tetapi melibatkan proses fisiologi tumbuh- an. Golden dan van Gundy (1975) menunjukkan bahwa eksudat akar yang terinfeksi
oleh nematoda berperan menentukan dalam interaksi antara M. incognita dengan R.
solani yang mengakibatkan te jadinya penyakit kompleks pada tomat dan okra. Akar berpuru pada okra dan tomat yang terserang oleh M. incognita di lapangan lebih rentan terhadap infeksi R. solani daripada akar yang tidak berpuru pada tanam-
an
yang sama. Sklerotium R. solani berkembang hanya pada permukaan puru, dan gejala pertama kerusakanakar
te jadi 4 minggu setelah puru mulai terbentuk. Hasil pengamatan histologi menunjukkan bahwa cendawan melakukan penetrasi langsung pada puru akar atau melalui jaringan yang pecah karena membengkaknya nematoda betina. Cendawan mula-mula membentuk koloni pada sel-sel raksasa kemudian menyerang sel-sel yang lain di sekitar puru. Peranan eksudat puru semakin jelas ketika van Gundy et al. (1977) mengemukakan bahwaakar
tomat yang diinokulasi dengan R. solani tidak menunjukkan gejala kerusakan, tetapi bila diberi eksudat yang dikumpulkan dari akar yang terinfeksi M. incognita, akar tomat tersebut mengalami nekrosis yang berat.Interaksi sinergistik tidak hanya terjadi melalui proses eksudasi akar berpuru.
2 3 atau daun. Intensitas serangan Altenaria tenuis meningkat pada daun tembakau yang perakarannya terserang oleh M. incognita (Powell & Batten, 1969).
Perubahan-perubahan metabolisme tanaman yang diinduksi oleh NPA me- megang peranan utama dalam terjadinya interaksi sinergistik nematoda-cendawan
(Huang, 1985; Hussey, 1985). Infeksi nematoda dapat menimbulkan perubahan kuantitas serta kualitas eksudat akar, dan perubahan komposisi nutrisi dalam jaringan tanaman (Rovira, 1965). Akar tanarnan terinfeksi nematoda menghasilkan eksudat yang mengandung asam organik, gula, polisakarida, asam amino, nukleotida dan flavonon dalam konsentrasi yang lebih tinggi daripada dalam eksudat akar sehat (Dropkin, 1980). Hasil penelitian van Gundy et al. (1977) menunjukkan bahwa ek- sudat akar tomat meningkat antara 3 dan 14 hari setelah M. incognita menginfeksi, dan karbohidrat sebagai unsur utamanya. Setelah 28 hari, dalam eksudat tersebut terjadi peningkatan kandungan nitrogen. Terjadinya perubahan (nisbah C/N) ini yang mendorong cendawan (R. solani) berubah dari saprob menjadi parasit.
24 berkitin
ke
dalamtanah
meningkatkan kembali populasi Actinomycetesdan
menelcanv g a n
F.
oxyspompada
tanaman.Inf&i
nernatoda
pada
akar
tamman selain meningkatkanaktivitas
&wandi lusr
jaringan
dcar
juga menycdiakan jaringan yang sesuai untuk m&ndukmgper-
kernbangan
nematoda.
Set-selraksasa
akibat infeksi NPA menonjukkm9ktivim
&lik
yang tinggi terutamadalam
sintesis proteindan
asam-asamamino
(Webs-ter,
1975).Kandungan
DNA, RNAclan
fotosintat dalam sel-scl fattsrsa yang lebih tinggidaripada
sel-selnormal
menyebabkan sel-selraksasa
lebihrentan
terh%dap infeksi cendawan (Bird, 1972).Peranan lain fitonematoda
dalam
penyakit kompleksadalah
p e n m a n
misten-
si
tanaman terhadap patogen sekunder. Varietas tomatdan
tembakau yang M u r u t -huvt tahan terhadap
F.
axysporwn f. sp.lycopenici
clan
Phytophthra
parasitk~wv. nicotianue menjadi
rentan
terhadap ccndawan tersebutsetelah
t e r i n f a olehM.
incognita
(Powell & Nusbaum, 1960; Sidhu & Webster, 1977). BerdrrsatSran hasil pedtiannyapada
Fusarium,
Sidhuclan
Webster (19'77) mengmukakan bahwaintePlksi
NPA-inang maghasilkan m t u senyaw pcngbikmgk e t h m m .
Senyawaini dapat ditransl*
dan
ckpat mengubahjarinp
ymgg ~ m u h
resisten tcr-W p
amlawan menjadircntan.
NPA
dalam inkmksinysr
dcngan tanman tidak selalum e n g a k i m penunm-
an
ketahanan, terutama pa& kultivar-kultivartanaman
yang mempunyai ketahananyang tinggi terhadap suatu cendawan (Abawi &
Barker,
1984; Caperton etal.,
, ?
-kg"..
Telah dikemukakan bahwa interaksi antagonistik
antara
f i t m c m k d a d -
wan, pengertiannya dikaitkan dengan cendawan
sebagaiantagonis
.
-
i
f
D
h
pengercian
ini,
cendawanm a u i berbagai mekanisme menekan
~~-
an
populasi dan menurunkan patogenisitas fitonematoda
terhadap tanaman.Interaksi antagonistik antara nematoda
dan
~ d z i ~ a npada
tanah-tanahper-
tanian
sudahdiitahui selama bertahun-tahun
(Mankau,
1980).
-wann m -
to@
umum terdapat
dalamberbagai jenis
tanah, dalamjumlah yang berlimpah,
dan
peranannya sangat penting
&lam mempertahankan
keseimbangan
hayati,
walaupun
kontribusinya
ti&
sepenuhnya diketahui (Saxena
&Mukerji, 1988).
Tedpat
kin-kira
50 spesies cendawanyang
mampu menangkap
dan
membunuh
nemamh
@&-dington, 1975). Selain itu masih banyak lagi
cendawanendoparasit,
&wan y i qmempduksi
senyawa nematotoksik,
dancendawan yang
menghasilkan
enzim pa-
degradasi
kulit telur
dan
kutikula neptoda (Rodriguez-Kabana
&Morgan-Jones,
1986). Semuanya itu mempunyai
potensi
sebagai agcnpengendali
nematoda.
Cedawan predator nmatoda
mempunyai
Jtrulaurfdrusus untuk
mmangkap~~
S t n i b r€easebut
dqatQaloagkan
k
Brlrat
s&t&wStdMf
dannon-
adhesif.
Or-adbif
tetdiri atas juiag,hita
dan
ktQQqribe,
1980;
Saxena
&
Mukeji, 1988).
Srrukturadhesif mimgkap
nematodp
d q a n suatudaya adhesif
yang kuat yang biasanya
sebagairespons
terhadap
sentuhan nematoda. Ralam
jangka
waktu
yang pendek
fungi
tumbuh
pada
nematoda
dm
metusaknya. Struktur
ncmtoda.
~ematoda
yang
mswkkc
dalamcincin tersebut akan
terjexat, hmudi.nMsafr
dan
diisap oleh
oendawan.Cincin kontraktif
akan
merrcengkeram
nematoda
4
yamg
masuk
kemudian mengisap nutrisi yang terkandung
drrlam
ttltwh
nanatda
tcnebut.
Beberapa contoh
fungi
predator
adalah
(1)
kelas
Hyphomptes:
A&bmys
duetyloidcs,
A.bmdwpczga,
A. conoidcs, A.supcrh
(Slurecrr
&Mwbji,
19%8), A.
rvbarta,
A. imgularis(Kerry
,
1987),
Monacmpn'um d m p p n ,M.
mcollis,
clan
M.
salinum
(Saxena &Mukji, 1988); (2)
k c b
Zygomycetas y a k .-_
Q
Stylopage
leiohypha
(Saxena
&Mukcji, 1988)
danCystoptage (Tribe,
1980).
=gh,
Cendawan
endoparasit menyerang nematoda melalui
spora
adhesif
ymg
meidat
pada
htikula, melalui spora yang tertelan
dan tinggal
dalam
salutlt~pen-
cuman,
atau dengan
cara
lain
(Tribe,1980).
Beberajmgenus
cendawan
endopwmit
pada
nematoda adalah
Harposporiwn, Acrostalagmus
danMe&
(Hyphomycetes);N~m~toctonus
(Basidiomycetes); Carenaria (Chitridiomycetes);
Mjaq$€igndrrt
41."
rU
Haptoglosa (Oomycetes).
Cendawancendawantersebut merupakan
parasit
obligat
I
whkggasulit
dirnanfaatkan sebagai agen
pengendali
hayati (Duddington,
1957
WYI
twl
Jatak,
1985).
sangat barryak andawan
yang blah
dihpchmmedxmtult
k d d pathbdur
~ s i s t e d a n ~ A , ~ h s n p ~ ~ p l n g s u d r h & ~ t i s o c a r s r r i n c i .
Di
anbataketiganya
hanya
P a c c i m
H k i m a(Tom)
Samson yangtdah
d h p l h -
sikan
di lapangan
clan
memberikan hasil yang memuaskan (Kerry, 1987).
Cendawanini
merupakan agen biokontrol yang
efektif untuk
mengmdaWanM.
imognicopada
terdapat di tanah-tanah di Filipina sama efektifnya dengan isolat asd Peru
dm
tidal b y a terhadap N P A , tetapi juga nematoda sistedan
spies-spesies lainnya (Molina & Davide,1986).
Terdapat
beberapa
spesies cen&wantanah
yang bultan parasit rtw predator tetapimampu
menelcan papulasifitonematoda
lcarena
menghpsillran senyawa bersifatnematisida.
Sebagai contoh, filtratbiakan
Aspergiflia niger beracun
terhadap
A p k& n c h awme
(Mankau,
1969).
Hayasi et al. (1981, diacu oleh Molina &Davide,
1986)
telah
mengisolasi tiga macarn senyawa bersifat nematisidadari
cendawanIrpex
k t u s yang efektif
terhadap
Aphelenchoides besseyi.
Molina dan Davide(1986)
melakukan evahrasiaktivitas
nematisida filtrat atau &&at b k h n17
spesiescen&wan
terhadap
M.
incognita
dan
Raabpholur simifis
bdasarltan uji mortalitasdrur
infektivitasnyapada
tomatdan
pisang. Ekstrak 4@es
yaitu
Penicilliwn
,
P. anaoficum,
A.niger
dan
Penicilliwn sp. menunjukkan aktivitas
nema
yang sangat tinggi. Tingkat aktivitas nernatisida
ke-4
berturut-turut80.8, 58.0, 49.5, dan
43.3%.Mekanisme lain antagonisme cendawan terhadap
fitonematoda
adalah mdgtui7 .
llrbvitas kitinolitibya. W u i
can
ini amlawan dapat merPdegndasi tdur mmato-da.
R ~ q u e z - K a k udan
~J~(1986) ~benunjukkan
Wwapenhrian
+$?? :
kitin
Iro
daEnm
tjrslhdrrpat
mamgmng h a i r u n , GliocMm$-,
-
-..* :BAHAN DAN METODE
Tempat dan Waktu 4
Penelitian dilakukan di Laboratorium dan Rumah Kaca Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Institut Pertanian Bogor dan berlangsung dari awal Juni 1995 sampai dengan September 1996.
Bahan Penelitian
1. Penyediaan inokulum
M.
incognitaNematoda yang digunakan dalam penelitian ini adalah M. incognita yang diambil dari tanaman kedelai di lahan Kebun Percobaan IPB Leuwi Kopo Bogor. Satu paket telur didesinfestasi dengan 0.5 % NaOCl berdasarkan metode Jacob & Bezooijen (1971) kemudian diinfestasikan ke dalam tanah dalam pot plastik, yang
telah ditanami satu bibit tomat varietas Ratna berumur 3 minggu. Tanah medium tumbuh tomat tersebut merupakan campuran tanah latosol dan pasir dengan perbandingan 1 : 1 (vlv) yang telah didesinfestasi dengan Vapam. Delapan minggu setelah infestasi, telur &a akar diekstraksi dengan metode Hussey dan Barker (1973) kemudian dibiakkan pada 20 pot tanaman tomat varietas Ratna sebagai biakan murni yang siap digunakan sebagai sumber inokulum dalam pengujian- pengujian selanj utnya.
2. Penyediaan inokulum CKM
29 dan Dramaga (Bogor). Tiap isolat CKM dibiakkan secara terpisah pada media agar kentang dektrose (AKD) dan dedak padi dicampur dengan serbuk gergaji
kayu (DK) dalam perbandingan 1: 1 (v/v) dalam 20 kantung plastik tahan
panas
berkapasitas isi satu liter menurut metode Meity S. Sinaga (komunikasi pribadi).3.
Penyediaan medium tumbuh tanaman
Tanah yang digunakan sebagai medium tumbuh tanaman dalam penelitian ini adalah tanah andosol Segunung yang didesinfestasi dengan Vapam dalam dosis
0.5
ml per liter tanah. Desinfestasi dilakukan dalam kantung-kantung plastik masing-masing berisi 4 liter tanah. Setelah 20 hari, diperkirakan residu Vapam hilang, tanah ini siap digunakan sebagai medium tumbuh tanaman dalarn perco- baan-percobaan selanjutnya.4.
Pengujian ketahanan beberapa varietas kedelai terhadap M.
incognita
Dalam rangka mendapatkan tiga varietas kedelai yang berbeda derajat ketahanannya terhadap M. incognita untuk digunakan dalam penelitian selanjut- nya, dilakukan pengujib terhadap 19 varietas kedelai yang tertera dalam Tabel 3.ekstraksi dari akar tomat biakan yang telah disiapkan seperti yang tertera dalam butir 1.
4
Tabel 3. Varietas Kedelai yang Diuji Ketahanannya terhadap
M.
incognita- - -
No. Nama varietas No. Narna varietas
Orba Petro
Lok Kalading Raung Merbabu Bala-Bala Kedung Kayu Wilis Sri Rama Ringgit Jaya Wijaya Kerinci Lok Jambi Tambora Tidar Muria Malabar Kedelai Hitam Lokon
Percobaan dilaku* dalam rancangan acak lengkap dalam 3 ulangan dan tiap ulangan terdiri atas 3 tanaman.
Peubah yang diamati adalah kepadatan populasi akhir
M.
incognita yang ditentukan berdasarkan jumlah puru, telur dan L-2per
tanaman, serta
L-2 dalam tanah per pot. Selain itu, diamati juga intensitas seranganM.
incognita berdasar-kan jumlah puru per gram aka. Pengamatan dilakukan 8 minggu setelah tanam (MST).
3 1 dihitung dari 50 ml contoh tanah. Baik contoh akar maupun contoh tanah masing-masing diambil secara komposit dari 5 titik. Telur dan L-2 pada akar diekstraksi dengan metode Hussey dan Barker (1973), sedang L-2 ddam tanah diekstraksi dengan metode corong Baermann yang dimodifikasi.
Ketahanan varietas kedelai dipilahkan berdasarkan Indeks Reproduksi (IR) menurut Triantaphyllou (1975) dengan menggunakan rumus:
Pa pada tanaman uji
IR = x 100%
Pa pada tanaman indikator Pa adalah populasi akhir M. incognita
Tanaman indikator adalah tomat varietas Rutgers yang rentan terhadap M. incognita
Berdasarkan IR nematoda, kemudian ditentukan derajat ketahanan varietas tanaman menurut Taylor (1967) yang dimodifikasi sebagai berikut:
- - - pp -
-Derajat Ketahanan Sandi Indeks Reproduksi (IR)
*
Rentan Agak tahan Moderat tahan Tahan
Sangat tahan Kebal
Untuk menduga mekanisme ketahanan varietas kedelai yang diteliti dilaku-
32 Wilis (moderat tahan), Kedelai Hitam (agak tahan) dan Lokon (rentan). Selain itu dilakukan juga analisis kandungan unsur hara mineral dalam jaringan akar
I
varietas moderat tahan (Wilis) clan rentan (Lokon) dengan metode pengabuan. Percobaan dilakukan di rumah kaca dalam pot-pot (kantung plastik hitam) berisi tanah andosol Segunung yang telah disiapkan seperti tertera dalam butir 3. Prosedur percobaan sama dengan prosedur Pengujian Ketahanan Varietas Kcdelai terhadap M.
incognita.
Percobaan d i l h a k a n dalam rancangan acak lengkap dalam
3
ulangan dantiap ulangan terdiri atas 3 tanaman.
Peubah yang diamati adalah jumlah puru per tanaman dm persentase nematoda yang bertelur 6 MSI.
5. Pengujian patogenisitas M. incognita pada tiga varietas kedelai
Tujuan penelitian ini adaiah mengetahui hubungan antara tingkat kepadatan
populasi awal M.
incognita
clan
pertumbuhan tiga varietas kedelai yang berbeda derajat ketahanannya terhadap nematoda tersebut.a. Pengujian pendahuluan di laboratorium
TPR tanaman ditentukan berdasarkan cara Elliot dan Bird (1985) sebagai berikut:
#
TPR =
(W,
-
W,)(T,
-
TI)-'
glmingguW, = bobot segar tajuk pada T, W, = bobot segar tajuk pada TI
TI
= waktu infestasiL-2
T2 = 6MSI
L-26. Inventarisasi cendawan koloni nematoda puru akar (CKM)
Untuk mengetahui jenis-jenis cendawan yang membentuk koloni
pada
NPA betina dewasa danlatau paket telurnya, dilakukan isolasi cendawan.secara
lang- sung dari contoh NPA betina dewasa yang menginfeksi akar kedelai berasal dari beberapa tempat, yaitu Wanaraja (Garut), Cipanas (Cianjur),
Kebun Percobaan IPB Leuwi Kopo Darmagadan
Sindangbarang (Bogor).Akar kedelai berpuru dicuci dengan air
sarnpai
bersih kemudian dikocokdalam larutan
0.5%
NaOCI selama30
detik dan segera dibilas dengan air steril. NPA betina dewasa dikeluarkandari
jaringan akar, kemudian dibilas dengan air steril clansecara
aseptik diletakkan pada agar air di cawan Petri. Tiap cawan Petri diisi 5 nematoda dan diinkubasikan selama 2-3 hari atau sampai terlihatadanya pertumbuhan cendawan
yang
jelas. Berbagai cendawan yang tumbuh diisolasi pada media AKDdalam
cawan Petri dan untuk yang isolat murni dibuat persediaannya dalam tabung reaksi.7. Pengujian patogenisitas isolat CKM pada kedelai
Untuk mendapatkan isolat-isolat CKM yang tidak patogenik terhadap
b
kedelai dilakukan uji patogenisitas tiap isolat
CKM
yang diperoleh terhadap kedelai.Pengujian dilakukan di laboratorium dalam tiga percobaan, yaitu untuk mengetahui : (a) daya infeksi CKM pada benih, @) daya infeksi
CKM
pada kecambah, dan (c) daya infeksi CKM pada tanaman stadium muda.a. Daya infeksi CKM pada benih. Cangkir-cangkir plastik dengan kapasitas 115 ml yang diisi 100 ml tanah yang telah diotoklaf, ditanami benih kedelai
varietas Lokon yang telah didesinfestasi dengan NaOCl clan kemudian diinokulasi dengan isolat
CKM.
Benih kedelai direndam dengan Iarutan 0.5% NaOCl selama 5 menit ke- mudian dibilas dengan air steril dan selanjutnya diinokulasi dengan isolat CKM. Inokulasi dilakukan dengan
cara
memasukkan sejumlah benih ke dalam biakan isolat CKM pada AKI) di dalam cawan Petri dan diaduk. Benih yang telah diinokulasi dengan isolat CKM kemudian ditanam dalarn tanah di cangkir plastik tersebut dan ditutup dengan kertas alumunium.Dalam
tiap cangkir ditanarni 5 butir benih kedelai.36
Peubah yang diamati adalah persentase benih yangterinfeksi CKM, setelah benih yang diinokulasi diinkubasikan pada suhu kamar selama 3 hari. Pengamat-
4
an
dilakukan dengan bantuan mikroskop cahaya terhadap benih yang telah di-keluarkan dan dibersihkan dari tanah.
b. Daya infeksi pada kecambah kedelai. Percobaan ini dilakukan pada cangkir-cangkir plastik kapasitas 115 ml yang diisi dengan 100 ml tanah yang diotoklaf. Prosedur percobaannya sarna dengan uji daya infeksi pada benih, tetapi cangkir tidak ditutup dengan kertas alumunium dan inkubasi dilakukan selama 7 hari sampai kebanyakan kecambah telah membentuk kuncup daun pertama.
Percobaan ini dilakukan di laboratorium dengan rancangan percobaan serta jumlah isolat CKM, banyaknya ulangan dan varietas kedelai yang digunakan
sama dengan percobaan daya infeksi pada benih.
Peubah yang diamati adalah persentase infeksi pada kecambah. Pengamatan
dilakukan dengan bantuan mikroskop cahaya terhadap gejala infeksi (nekrosis atau kolonisasi cendawan) pada kecambah. Pengamatan selanjutnya dilakukan dengan menginkubasikan bagian kecambah yang menunjukkan gejala nekrosis dalam ruang lembab (cawan Petri). Koloni cendawan yang muncul diamati struktur sporulasinya. Apabila hasil pengamatan menunjukkan bahwa koloni
cendawan yang muncul sama dengan isolat CKM yang diinokulasikan maka isolat yang bersangkutan dianggap patogenik terhadap kedelai.
37 Prosedur dan rancangan percobaan sama dengan uji daya infeksi pada kecambah tetapi tiap cangkir hanya diisi 3 butir benih kedelai dan inkubasi dilakukan selama *
21 hari. Inkubasi dilakukan di laboratorium pada rak-rak yang dilengkapi dengh penyinaran lampu neon 40 Watt selama 12 jam tiap hari pada siang hari. Pe-
rawatan lainnya berupa penyiraman secukupnya tiap pagi.
Pengamatan dilakukan terhadap persentase kematian tanaman
dan
tanarnan sakit secara kumulatif sejak kecambah muncul di permukaan tanah sampai dengan 21 hari setelah benih ditanam. Tiap tanaman yang sakit atau mati ditentum penyebabnya dengan menempatkan tanamanlbagian tanaman sakit tersebut dalam cawan Petri yang dilembabkan selama sekitar 1-2 hari.8. Pengujian antagonistik CKM terhadap M. incognita
Percobaan ini dilakukan untuk mendapatkan isolat-isolat
CKM
yang dapat menekan populasi M.incognita
secara
efektif in vitro. CKM yang diuji adalah isolat-isolat yang telah diisolasi dari NPA betina dan tidak patogenik terhadap kedelai. Isolat-isolat tersebut terdiri atas Paecilomyces (10 isolat),GZiocIadiwn
(6 isolat)
clan
Tnchodenna (2 isolat).
38 terhadap
M.
incognita, sebagai tanaman indi kator, berumur 3 minggu setelah ,benih ditanam.Percobaan ini dilakukan dalam rancangan acak lengkap dengan perlakuan 18 isolat dan satu kontrol. Percobaan dilakukan dalam 3 ulangan dan tiap ulangan terdiri atas 3 pot (cangkir).
Peubah yang diamati adalah daya infeksi L-2 M. incognita berdasarkan jumlah puru rata-rata tiap tanaman pada 21 hari setelah bibit tomat ditanam. Penghitungan puru dilakukan pada seluruh akar tiap tanaman, setelah akar ber- sangkutan dibongkar dan dicuci dengan air sampai bersih. Berdasarkan daya
infeksi tersebut kemudian ditentukan reduksi infeksi M. incognita dengan meng- gunakan rumus:
Ik
-
IpReduksi infeksi =
-
x 100%Ik
Ik = daya infeksi M. incognita pada kontrol
Ip = daya infeksi
M.
incognita yang diinfestasi dengan isolatCKM
Dari
hasil percobaan ini dipilih3
isolatCKM
yang paling efektif dalam menekan L-2 M. incognita, yaitu tiga isolatCKM
dengan reduksi infeksi yang paling tinggi, untuk diteliti lebih lanjut.9. Interaksi CKM dengan M. incognita pada tiga varietas kedelai
berbeda terhadap nematoda tersebut. Percobaan dilakukan di laboratorium dan
a. Penguj ian di laboratorium
Percobaan dilakukan pada pot-pot plastik dengan kapasitas isi 220 ml yang diisi dengan
180
mltanah
yang diotoklaf. Tiap pot diinfestasi dengan 20 mlbiakan
CKM
dalam substrat DK dan sesudah itu segera diinfestasi dengan300
L-
2 M. incognita. Segera setelah infestasi dilakukan, tiap pot ditanami 3 butir benih kedelai.
Percobaan terdiri atas 3 faktor, yaitu jenis isolat CKM, infestasi
M.
incog- nita dan varietas kedelai. Isolat CKM terdiri atas 4taraf,
yaitu tanpa CKM(I&
Paecilomyces sp. (I,), Gliocladiwn catenulatum (I3 dan Tn'chodem
viride (I,).
Infestasi M. incognita terdiri atas 2 taraf, yaitu tanpa nematoda (No) dan diinfes- tasi 300L-2
M. incognita tiap pot. Varietas kedelai terdiri atas 3 taraf yaitu kedelai hitam (V,), varietar Wilis (V,) dan varietas Lokon (V,). Dengan demiki- an terdapat 24 kombinasi perlakuan. Percobaan ini disusun dalam Rancangan Acak Lengkap berfaktor dengan3
ulangan.Peubah yang diamati adalah persentase kematian
tanaman,
intensitas serang- an M. incognita, persentase puru danM.
incognita betina dewasa yang terkoloni oleh isolat CKM, bobot segarakar
serta bobot segar tajuk.40 Intensitas serangan M.
incognita
ditentukan berdasarkan jumlah puru tiap gram akar. Persentase kolonisasi puru atau M.incognita
oleh isolatCKM
ditentukan dari 10 contoh puru atau M.incognita.
Contoh puru setelah dibersih-kan dari tanah, kemudian di letakkan di atas gelas obyek dan diamati dengan bantuan mikroskop cahaya. Contoh M.
incognita dewasa betina setelah dikeluar-
kan
dari puru kemudian diletakkan pada gelas obyek dan diamati di bawah mikroskop cahaya.b. Pengujian di rumah kaca
Percobaan dilakukan pada pot-pot (kantong plastik hitam) berisi 4 liter tanah andosol Segunung yang telah disiapkan seperti tertera dalam butir 3. Tiap pot, kecuali kontrol, diinfestasi dengan 100 ml biakan CKM dalam substrat DK yang telah disiapkan seperti tertera dalam butir 2. Setelah tanah diinfestasi, kemudian
diaduk dan segera ditanami 5 butir benih kedelai tiap pot. Dalam tiap pot 10 HST disisakan 3 tanaman yang vigornya paling baik dan tanah medium tumbuh- nya segera diinfestasi dengan
L-2
M.incognita.
Penilaian respns tanaman terhadap infestasi ganda M.
incognita
dan isolat CKM dilakukan berdasarkan bobot kering akar dan bobot kering tajuk3,
6 dan $9 MSI, serta tingkat pertumbuhan relatif (TPR) tanaman, intensitas serangan M.incognita
dan bobot kering biji yang dipanen pada 9MSI.
SeIain itu diamati pulakepadatan populasi akhir M.
incognita
9MSI
yang ditransformasi ke dalam logari tme.
TPR tanaman ditentukan berdasarkan
cara
Elliot dan Bird (1985) seperti dalam pengujian patogenisitas M.incognita
pada 3 varietas kedelai (butir 5).Intensitas serangan M.
incognita
ditentukan berdasarkan jumlah puru per gram akar. Populasi akhir ditentukan berdasarkan jumlah telur dan L-2 yang berhasil diekstraksi dari contohakar
dan L-2 yang berhasil diekstraksi daricontoh tanah. Ekstraksi telur dan L-2 dari
akar
dilakukan dengan metode Hussey dan Barker (1973), sedang ekstraksi L-2 dari tanah dilakukan dengan metode corong Baermann yang dimodifikasi.10. Mekanisrne antagonistik CKM terhadap
M.
icognitaa. Pengaruh filtrat biakan
CKM
terhadap penetasan telur dan mortalitas G 2 M. incognita*
Pengujian filtrat biakan isolat
CKM
terhadap penetasan telur dan mortalitas L-2 M. incognita, merupakan dua percobaan yang terpisah, masing-masing dilakukan dalam tabung reaksi yang diisi dengan enceran filtrat biakan tiap spesiesCKM
pada substrat DK berumur 10 hari.Sediaan filtrat biakan CKM dibuat dengan cara menambahkan
50
ml air suling steril pada 50 ml biakan CKM pada substrat DK dalam tabung Erlen- meyer, kemudian dikocok. FIltrat dipisahkan dengan penggunakan saringan Whatman nomor 2. Untuk rnempercepat proses penyaringan digunakan p o m phisap. Filtrat yang diperoleh merupakan enceran dengan konsentrasi 50%. Tiap tabung reaksi diisi sekitar
500
butir telur atau 500 ekorL-2
M. incog- nita dalam suspensi kemudian volumenya dijadikan 10 ml dengan menambahkan air suling steril dan filtrat biakan CKM sehingga konsentrasi filtrat biakan CKM dalam tiap tabung sesuai dengan konsentrasi yang ditentukan.Percobaan dilak&akan dalam rancangan acak lengkap faktorial yang terdiri atas 2 faktor. Faktor pertama terdiri atas filtrat biakan Puecilomyces sp. (I,),
filtrat biakan G. caternlatwn (I,) dan filtrat biakan
T.
viride (I,). Faktor kedua terdiri atas 5 tingkat konsentrasi filtrat masing-masing spesies CKM, yaitu 0, 0.5%, 1.0%, 5.0% dan 10.0%. Dengan demikian terdapat 15 kombinasi per- lakuan dan tiap perlakuan diulang 3 kali.43 telur ditentukan berdasarkan persentase telur yang tidak menetas, sedang morta- litas L-2 berdasarkan persentase L-2 yang mati.
#
b. Kolonisasi CKM terhadap
L 2
Pengujian kolonisasi spesies
CKM
terhadapL-2
dilakukan pada media agar air steril dalam cawan Petri. Sekitar50
ekor L-2M.
incognita
berumur tidak lebih dari 48 jam setelah menetas dari telur yang telah diekstrak dengan metodeHASIL
1. Ketahanan Varietas Kedelai terhadap M. incognita
#
Hasil pengujian menunjukkan bahwa varietas kedelai yang diuji umumnya tergolong agak tahan. Terdapat
2
varietas yang tergolong moderat tahan dan3
varietas yang tergolong rentan (Tabel 4).Tabel 4. Derajat Ketahanan 19 Varietas Kedelai Berdasarkan Indeks Reproduksi (IR) Relatif terhadap Tomat Varietas Rutger
Den*
No. Varietas IR" ketnhan- No. Varietas ann
Denjat 1R" kccrb.a
a@
I. Orba
2. Pctro
3. Lok. blading 4. Raung 5. Merbabu 6. Bda-bola 7. Kedung lbyu
8. Lok. Jambi 9. Sri Ram
10. Ringgit
29.26 abcdn
3 1.03 abcd
25.48 abc 36.92 abcde 33.70 bcde 42.88 abcd 29.97 abcd 35.46 abcde 38.85 abcde
23.65 ab
Tambon Ttdar Muri. Malabar Kcdelai hium Lokon
Tomat (var. Rutgem)
29.41 .bed 12.95 8
3954 bcde
41.38 bcde
40.79 bc& 51.97 dc
50.99 c&
32.68 abcde 58.83 e 100.00 f
" IR : indek reprwlulut menurut Tri.nt.phyllou (1975) " Denjat ketahanan menurut Taylor (1967)
" Nilai yang diikuti huruf yrng mmr tidak berbedr berdasarkan uji Tukey pa& a = 0.05
Karena tidak didapatkannya varietas kedelai yang tahan terhadap isolat
M.
incognita yang diteliti, maka untuk penelitian selanjutnya digunakan varietas yang
tergolong moderat tahan yaitu varietas Wilis (paling tahan di antara varietas-
varietas yang diuji). Untuk varietas yang agak tahan dipilih Kedelai Hitam dan untuk yang rentan dipilih varietas
Lokon.
varietas kedelai yang diuji tidak berbeda, walaupun antar beberapa varietas terdapat perbedaan derajat ketahanan.
4
Tabel 5. Intensitas Serangan M. incognita pada 19 Varietas Kedelai
No. Varietas Intensitas serangan')
No. Varietas Intensitas serangan' Orba Petro Lok Kalading Raung Merbabu Bala-Bala- 1
Kedung Kayu Wilis
Sri Rama Ringgit
Jaya W ijaya Kerinci Lok Jambi Tambora Tidar Muria Malabar Kedelai hitam Lokon - -- - -
-Koefisien keragaman (4%) 38.02
') Intensitas serangan M. incognita berdasarkan jumlah pum per gram akar
Nilai yang diikuti humf yang sama tidak berbeda berdasarkan uji Tukey pada
ar = 0.05
Tabel 6. Jumlah Puru dan Persentase M. incognita Bertelur pada Tiga Va- rietas Kedelai yang Ditanam dalam Tanah Medium Tumbuh yang Diinfestasi M. incognita
1
Varietas kedelai Jumlah puru per tanarnan Nematoda bertelur (%) Wilis (Va
Kedelai hitam (V,) Lokon (V,)
65.7 a') 61.8 a 61.5 a
Koefisien keragaman (%) 9.98 12.50
')
Nilai dalam lajur yang sama yang diikuti huruf yang sama tidak berbeda berdasarkan uji Tukey pada a = 0.052. Patogenisitas M. incognita terhadap Varietas Kedelai Rentan, Agak Tahan dan Moderat Tahan
Hasil pengamatan menunjukkan bahwa L-2 dengan populasi awal
sebesar
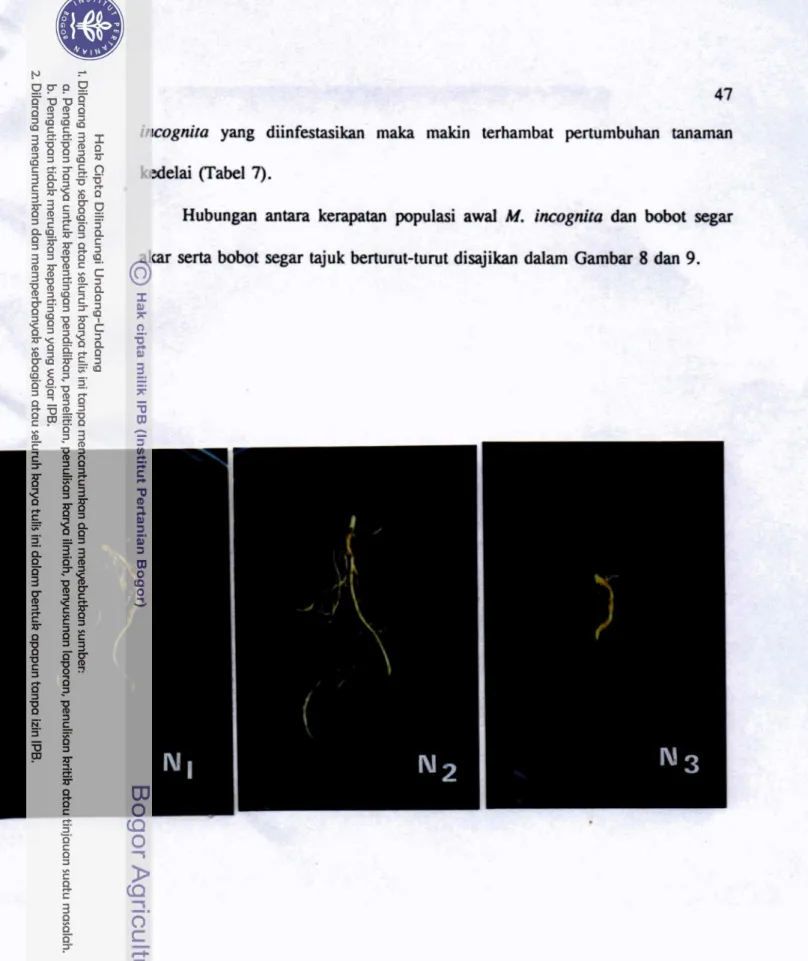
450 per 100 ml tanah menyebabkan perakaran kedelai tidak berkembang, sedang- kan dengan populasi awal yang lebih rendah (50 dan 150 ekor per 100 ml tanah), perakaran masih dapat berkembang. Keragaan contohakar
yang ditanam pada tanah dengan tiap tingkat populasi awal, dapat dilihat pada Gambar 7. Dari hasil uji ini, kemudian dilakukan pengujian selanjutnya dengan menggunakankisaran
populasi L-2sebesar
50, 250, 1250 dan 6250 ekorper
liter tanah.incognita yang
diinfestasikp
makamakin terhambat
pertumhhg - , t q-. e. + ,-!
. .
kudelai (Tabel
7). .A. . ; . .....
. ;>:.:--
. . . . . $:.5$-"5. .
;:.<*&g?$
-
Hubungan
antara kerapatan populasi
a dM.
inwgniudm
nibabotasgr
alcar
semibobot
segar tajuk berturut-turut disajikan dalam
Gambsr8
dan
9.. .
.
.Gambar
7.Keragaan
Perakaran
Kedelai
Varictas Lokon
yang Ditanam
dalam
Tanah
yangDiinfcstasi dengan
L-2
M.
incognitadengan
Populasi
AwalBerturut-turut 50 (N,),
150 (NJdan
450(N,)
Tabel 7. Bobot Akar dan Tajuk Tiga Varietas Kedelai yang Ditanam dalam Medium Tumbuh dengan Berbagai Tingkat Kepadatan Populasi Awal
+
M.
incognitaPa- Bobot rcgu akar (g)