EVALUASI PERTUMBUHAN, PENENTUAN DIFERENSIASI
KELAMIN, DAN PRODUKSI JANTAN FUNGSIONAL IKAN
PAPUYU (
Anabas testudineus
Bloch)
RAHMAT HIDAYAT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Evaluasi Pertumbuhan, Penentuan Diferensiasi Kelamin, dan Produksi Jantan Fungsional Ikan Papuyu (Anabas testudineus Bloch)” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
RAHMAT HIDAYAT. Evaluasi Pertumbuhan, Penentuan Diferensiasi Kelamin, dan Produksi Jantan Fungsional Ikan Papuyu (Anabas testudineus Bloch). Dibimbing oleh ODANG CARMAN dan ALIMUDDIN.
Ikan papuyu (Anabas testudineus) atau betok adalah ikan asli Indonesia yang memiliki nilai ekonomis dan banyak disukai oleh sebagian besar masyarakat Kalimantan. Ikan papuyu diduga memiliki perbedaan laju pertumbuhan terkait dimorfisme seksual (DS). Ikan papuyu betina lebih cepat tumbuh dibandingkan dengan ikan jantan, sehingga berpotensi dilakukannya budidaya monoseks betina. Populasi monoseks betina dapat diperoleh melalui persilangan ikan jantan fungsional (XX) dengan betina normal (XX). Ikan jantan fungsional diperoleh dengan cara maskulinisasi menggunakan hormon 17α-metiltestosteron (MT) sebelum diferensiasi kelamin (DK) terjadi. Penelitian ini telah dilakukan dalam bentuk rangkaian riset sistematis sebagai dasar pengembangan budidaya monoseks betina ikan papuyu; riset DS untuk membuktikan pertumbuhan ikan papuyu betina lebih cepat dibandingkan dengan jantan, riset DK mengungkap waktu terjadinya DK pada ikan papuyu sebagai dasar untuk perlakuan sex reversal, dan riset maskulinisasi dilakukan untuk menentukan dosis optimum pemberian MT yang menghasilkan ikan jantan fungsional.
Benih ikan papuyu varietas hijau dalam penelitian ini diperoleh dari pendederan larva hasil pemijahan lima pasang induk. Penelitian DS dilakukan dengan cara memelihara 60 ekor benih ikan papuyu umur 45 hari pascatetas (hpt) secara individu pada hapa ukuran 20×20×100 cm3 selama 135 hari. Secara
individual, bobot badan ditimbang setiap 15 hari sekali dan jenis kelamin ditentukan saat akhir penelitian dengan cara membedah ikan. Penelitian DK dilakukan dengan cara mengambil 20 ekor sampel ikan per hari mulai umur 10–29 hpt, lalu dilakukan prosedur preparasi histologi dengan pewarnaan hematoksilin-eosin. Struktur dan status diferensiasi gonad diobservasi secara histologi. Penelitian maskulinisasi ikan papuyu dilakukan pada ikan papuyu umur 14 hpt dengan perlakuan pemberian pakan berhormon dengan dosis 25, 50, 75, 100 mg MT/kg pakan dan satu perlakuan tanpa hormon MT (kontrol) selama 30 hari, kemudian rasio kelamin ditentukan pada saat akhir penelitian melalui observasi secara histologi.
Hasil penelitian menunjukkan bahwa ikan papuyu memiliki DS terkait pertumbuhan. Pertumbuhan bobot mutlak dan laju pertumbuhan bobot harian ikan betina masing-masing 48% dan 17% lebih tinggi (P<0,05) daripada ikan jantan. Gonad ikan papuyu terdiferensiasi pada umur 18–21 hpt, ditandai dengan perkembangan genital ridges seiring bertambahnya jumlah PGC dan terbentuknya ovarian cavity. Induksi sex reversal menggunakan MT secara oral pada ikan papuyu berhasil dilakukan dengan dosis 50 mg/kg pakan pada ikan umur 14 hpt selama 30 hari menghasilkan rasio jantan tertinggi (88,9%) dan berpeluang menghasilkan jantan fungsional sebesar 61,1%.
SUMMARY
RAHMAT HIDAYAT. Evaluation on Growth, Sexual Differentiation, and Functional Male Production of Climbing Perch (Anabas testudineus Bloch). Supervised by ODANG CARMAN and ALIMUDDIN.
Climbing perch (Anabas testudineus) is a native freshwater fish species of Indonesia that commercially cultured, especially in South Kalimantan district. The phenomenon that often occurs in culture of this species is a significant size difference between male and female, that possibly reflects the sexual dimorphism in growth rate; female grows faster than male. This phenomenon leads to a high potential for female monosex culture in the future. Monosex female population can be produced by mating functional male and normal female, and functional male can be generated by masculinization using androgen treatment, prior to the timing of sexual differentiation. This research was conducted to gather basic data for developing possibility of female monosex culture on this species; sexual dimorphism evaluation was conducted to examine growth rate differences between male and female quantitatively, sex differentiation study to reveal the timing of sex differentiation as an important strategy for sex reversal, and masculinization research to established the optimum dosage of 17α -methyltestosterone (MT) hormone to produce the functional males.
Green strain of climbing perch fries used in these experiments were derived from mating of five pairs of broods. For sexual dimorphism evaluation, sixty 45-days-old juveniles were randomly picked up and reared individually in 20×20×100 cm3 net cages for 135 days. Fish were fed on commercial feed (30%
protein) three times a day at 10% feeding rate. Body weight and body length were individually recorded every 15 days, the sexes were determined at the end of the experiment by surgerying the fish. For sex differentiation study, 20 fries at 10–29 days post-hatching were sampled for gonad structure and status analysis histologically. In masculinization experiment, 14-days-old juveniles were fed on artificial diet without MT (control) and four different MT contained diets namely 25, 50, 75, and 100 mg of MT per kg diet for 30 days at similar frequency and feeding rate as previous experiment. Male ratios were histologically determined at the end of the experiment.
The result showed that both growth rate and specific growth rate of female climbing perch were 48% and 17% significantly higher (P<0.05) than male respectively, and differentiated gonads were observed at 18–21 days post-hatching fish. Furthermore, oral MT administration at dose of 50 mg MT/kg diet seemed to be an optimum dosage resulted highest male ratio (88.9%) and potentially generate 61.1% of functional males.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
EVALUASI PERTUMBUHAN, PENENTUAN DIFERENSIASI
KELAMIN, DAN PRODUKSI JANTAN FUNGSIONAL IKAN
PAPUYU (
Anabas testudineus
Bloch)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa, atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan November 2014 ini ialah mengenai budidaya monoseks ikan papuyu, dengan judul “Evaluasi Pertumbuhan, Penentuan Diferensiasi Kelamin, dan Produksi Jantan Fungsional Ikan Papuyu (Anabas testudineus Bloch)”.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Odang Carman MSc dan Bapak Dr Alimuddin SPi MSc selaku pembimbing, serta Ibu Dr Ir Dinar Tri Soelistyowati DEA sebagai penguji yang telah banyak memberi saran. Terima kasih disampaikan kepada Kepala Badan Pengembangan Sumberdaya Manusia Kelautan dan Perikanan, Kementerian Kelautan dan Perikanan atas dukungan dana melalui program tugas belajar program Pascasarjana dalam negeri Tahun 2013/2015. Di samping itu, penghargaan penulis sampaikan kepada Ibu Ir Endang Mudjiutami selaku kepala Balai Perikanan Budidaya Air Tawar (BPBAT) Mandiangin yang telah memberikan kesempatan kepada penulis untuk menjalani studi di Sekolah Pascasarjana Institut Pertanian Bogor. Terima kasih juga penulis ucapkan kepada Bapak Bunasir SPi beserta staf kelompok kerja, staf perekayasa dan litkayasa, Ir Jamilah Hayati MSi beserta staf laboran BPBAT Mandiangin, yang telah membantu dan menyediakan fasilitas penelitian. Terima kasih juga disampaikan kepada Saudari Nurkardina dan tim yang secara teknis telah banyak membantu dalam pelaksanaan penelitian.
Ungkapan terimakasih juga penulis haturkan kepada istri dan kedua anak tercinta; Setiawati Hidayat, Dany Sajid El Abqary dan Ijlal Najih El Abqary, yang sabar dan setia memberikan semangat serta inspirasi. Terima kasih juga diucapkan kepada H Abdul Fatah, Ibunda Titiek Hidayati, Ayahanda Hazmi Al Askhan, Adinda Muhammad Arief Islamy, serta segenap keluarga besar Bani Fatah atas segala doa dan dukungannya selama studi. Selanjutnya, penulis juga mengucapkan terima kasih kepada rekan-rekan persaudaraan Yayasan Al Hikmah Corner; Fitria Nawir, Abung Maruli Simanjuntak, Novianto Poernomo, Yunarty, Sekar Ayu Chairunnisa, Rifqi Tamamdusturi, Asep Akmal Aonullah, Artin Indrayati, Hirmawan Tirta Yudha, Lukman Anugrah Agung, Aisyah Lukmini, dan seluruh rekan-rekan Pascasarjana Ilmu Akuakultur angkatan 2013 atas kebersamaan dan bantuannya selama penyelesaian studi.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
2 METODE 4
Waktu dan Tempat 4
Rancangan Penelitian 4
Prosedur Penelitian 4
Parameter Pengamatan 6
Analisis Data 8
3 HASIL DAN PEMBAHASAN 9
Hasil 9
Pembahasan 14
4 KESIMPULAN DAN SARAN 19
Kesimpulan 19
Saran 19
DAFTAR PUSTAKA 19
LAMPIRAN 25
DAFTAR TABEL
1 Parameter pengamatan (×) pada penelitian pengujian pertumbuhan terkait dimorfisme seksual (DS), pengkajian diferensiasi kelamin (DK), dan
maskulinisasi (M) ikan papuyu 6
2 Status gonad ikan papuyu varietas hijau pada umur 10–26 hpt 11 3 Bobot akhir, pertumbuhan bobot mutlak (PBM), laju pertumbuhan bobot
harian (LPH), dan biomassa ikan papuyu umur 105 hpt yang diberi perlakuan pemberian MT secara oral mulai umur 14 hpt selama 30 hari 14
DAFTAR GAMBAR
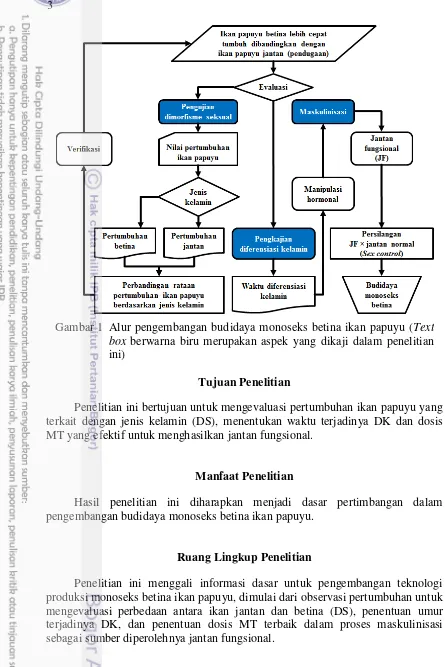
4 Alur pengembangan budidaya monoseks betina ikan papuyu (Text box berwarna biru merupakan aspek yang dikaji dalam penelitian ini) 3 5 Ikan papuyu varietas hijau jantan (A), dan betina (B). T= testis, mulai
matang mencapai tingkat kematangan gonad (TKG) III. O= ovari, gonad
telah mengisi sekitar 2/3 rongga perut (TKG IV) 9
6 Pertumbuhan ikan papuyu varietas hijau jantan (n=30) dan betina (n=26) selama pemeliharaan 180 hari. (A) Bobot rerata, (B) Pertumbuhan mutlak bobot (PBM), (C) Laju pertumbuhan bobot harian (LPH), dan (D) pertumbuhan panjang. Tanda asterik menunjukkan nilai berbeda nyata
(P<0,05). hpt= hari pascatetas 10
7 Bobot tubuh dengan dan tanpa gonad (A), dan indeks gonadosomatik (B) ikan papuyu varietas hijau jantan (n=27) dan betina (n=22) pada umur 180 hpt. Tanda asterik menunjukkan berbeda nyata (P<0,05) 10 8 Histologi ikan papuyu varietas hijau umur 18 hpt. (A) Potongan melintang
badan ikan. a = tulang belakang; b = gelembung renang; c = hati; (B) sepasang gonad yang menggantung di dinding peritonial punggung pada rongga badan, dihubungkan oleh mesogonium (m), tanda panah
menunjukkan posisi gonad. Skala = 100 μm. 11
9 Potongan melintang gonad undifferentiated ikan papuyu varietas hijau, umur (A) 10 hpt, (B) 11 hpt, (C) 15 hpt, dan (D) 18 hpt. M = mesogonium, PGC = primordial germ cell, BV = pembuluh darah. Skala
= 10 µm 12
10 Potongan melintang gonad ikan papuyu varietas hijau terdiferensiasi, umur (A) 20 hpt, (B) 21 hpt, (C) 23 hpt, dan (D) 26 hpt. M = mesogonium, Og = oogonia, Ost = oosit, OC = ovarian cavity, CN = chromatin nucleolus, PN = Perinucleolus, BV = pembuluh darah. Skala = 10 µm 12 11 Status gonad ikan papuyu varietas hijau umur 105 hpt yang diberi
perlakuan MT dosis 0, 25, 50, 75, dan 100 mg/kg pakan secara oral: (A) testis, (B) ovari, (C) interseks, (D) steril. Sc = spermatosit, Sp =
spermatid, Oc = oosit. Skala = 10 µm 13
12 Persentase jantan, interseks, steril dan kelangsungan hidup (KH) ikan papuyu varietas hijau umur 105 hpt yang telah diberi perlakuan pemberian MT secara oral mulai umur 14 hpt selama 30 hari, dosis 0 mg/kg pakan (kontrol), 25 mg/kg pakan (MT25), 50 mg/kg pakan (MT50), 75 mg/kg
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar Belakang
Ikan betok (Anabas testudineus Bloch) adalah ikan yang telah banyak dibudidayakan secara komersial di wilayah Asia Tenggara (Chotipuntu dan Avakul 2010). Di Indonesia, ikan ini tersebar di pulau Kalimantan, Jawa, Sumatera, Sumbawa, dan Manado (www.fishbase.org). Ikan betok atau papuyu di Kalimantan Selatan terdiri atas dua varian berdasarkan warna badan, yaitu warna hijau (varietas hijau), dan warna kuning (varietas galam). Ikan papuyu varietas galam memiliki bentuk badan yang lebih kecil dibandingkan dengan ikan papuyu varietas hijau (Rohansyah et al. 2010). Ikan papuyu banyak disukai oleh masyarakat Kalimantan. Harga ikan papuyu di Kalimantan (kecuali Kalimantan Barat) relatif mahal, berkisar Rp. 50.000,- sampai Rp. 80.000,- per kg (DISPERINDAGKOP 2013), bahkan dapat mencapai Rp. 150.000,- per kilogram pada bulan Maret di Kota Palangka Raya. Kenaikan harga ikan papuyu ini disebabkan menurunnya hasil tangkapan di alam akibat naiknya air sehingga menyulitkan nelayan melakukan penangkapan ikan di perairan umum.
Teknik pemijahan, pendederan dan pembesaran ikan papuyu telah dikembangkan oleh Balai Perikanan Budidaya Air Tawar Mandiangin Kalimantan Selatan dan dilakukan rilis domestikasi pada tahun 2014. Dengan menggunakan sistem pembesaran saat ini, waktu yang diperlukan untuk mencapai ukuran konsumsi (bobot 66,7-125 g/ekor) dari ukuran 1–2 g/ekor adalah sekitar 8 bulan dengan ukuran ikan hasil panen yang bervariasi (Bunasir et al. 2014). Salah satu fenomena yang sering dijumpai dalam budidaya ikan papuyu adalah perbedaan ukuran yang mencolok antara individu jantan dan betina yang menyebabkan lebih banyaknya individu di bawah ukuran pasar. Selain faktor genetik, perbedaan ini diduga disebabkan oleh adanya perbedaan laju pertumbuhan terkait dimorfisme seksual (DS), ikan papuyu betina lebih cepat tumbuh dibandingkan dengan ikan jantan. Oleh karena itu, riset kuantitatif diperlukan untuk membuktikannya.
Pengkajian terhadap pertumbuhan ikan papuyu di alam dengan pendugaan umur menunjukkan bahwa laju pertumbuhan ikan papuyu betina lebih tinggi dibandingkan dengan ikan papuyu jantan (Nagris 2010). Hal ini berbeda dengan ikan nila yang lebih cepat tumbuh pada nila jantan daripada betina (Chakraborty dan Banarjee 2010; Bhatta et al. 2012b). Selanjutnya, tingkat produksi budidaya ikan nila monoseks jantan lebih tinggi sekitar 10% (Nguyen dan David 2000) daripada campur kelamin jantan-betina. Ikan mas monoseks betina yang dibudidayakan di Eropa Tengah secara signifikan memiliki bobot panen 29,7% lebih tinggi dibandingkan dengan populasi heteroseks (Kocour et al. 2005).
2 Dalam hal ini, jantan fungsional dapat dihasilkan melalui sex reversal menggunakan hormon 17α-metiltestosteron (MT) melalui perendaman atau oral.
Sex reversal melibatkan proses hormonal untuk mengarahkan kelamin ikan saat berlangsungnya DK. Sex reversal dapat dilakukan karena determinasi kelamin pada ikan merupakan sebuah proses yang fleksibel (Piferrer dan Guiguen 2008) selama periode diferensiasi berlangsung, namun sangat sulit, bahkan tidak mungkin dilakukan setelah masa diferensiasi berlalu (Nakamura et al. 2003). Oleh karena itu, DK pada ikan papuyu penting untuk dipelajari agar diketahui waktu DK ikan yang bermanfaat sebagai dasar penentuan umur ikan dan cara yang tepat saat pemberian hormon MT dalam proses sex reversal (oral atau imersi). Diferensiasi kelamin merupakan proses transformasi dari gonad yang belum terdiferensiasi menjadi testis atau ovari, yang dipengaruhi oleh informasi genetik, lingkungan, atau keduanya sehingga secara fenotipe menghasilkan individu jantan atau betina (Piferrer 2011, Penman dan Piferrer 2008).
Dosis dan waktu pemberian hormon MT pada ikan menentukan keberhasilan proses sex reversal. Feminisasi menggunakan hormon estradiol-17β secara oral atau imersi pada larva ikan papuyu 14 hari pascatetas (hpt) selama empat minggu menghasilkan 92,6-100,0% ikan betina. Kelangsungan hidup ikan papuyu perlakuan sex reversal melalui oral (43,33%) lebih tinggi daripada melalui imersi (36,67%) (Pongthana et al. 1998). Hal yang sama diduga terjadi pada maskulinisasi ikan papuyu menggunakan MT. Dosis optimum MT yang digunakan untuk maskulinisasi ikan nila umur tujuh hpt selama 21 hari adalah 75 mg/kg pakan (Marjani et al. 2009), dan ikan mas umur 15 hpt selama 30 hari sebesar 100 mg/kg pakan (Mubarik et al. 2011). Riset penggunaan MT untuk maskulinisasi pada ikan papuyu belum pernah dilakukan, oleh sebab itu evaluasi penentuan dosis optimum MT untuk menghasilkan jantan fungsional pada ikan papuyu perlu dilakukan.
Perumusan Masalah
3
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi pertumbuhan ikan papuyu yang terkait dengan jenis kelamin (DS), menentukan waktu terjadinya DK dan dosis MT yang efektif untuk menghasilkan jantan fungsional.
Manfaat Penelitian
Hasil penelitian ini diharapkan menjadi dasar pertimbangan dalam pengembangan budidaya monoseks betina ikan papuyu.
Ruang Lingkup Penelitian
Penelitian ini menggali informasi dasar untuk pengembangan teknologi produksi monoseks betina ikan papuyu, dimulai dari observasi pertumbuhan untuk mengevaluasi perbedaan antara ikan jantan dan betina (DS), penentuan umur terjadinya DK, dan penentuan dosis MT terbaik dalam proses maskulinisasi sebagai sumber diperolehnya jantan fungsional.
4
2
METODE
Waktu dan Tempat
Penelitian dilakukan pada bulan September 2014 sampai dengan Juni 2015 di Balai Perikanan Budidaya Air Tawar Mandiangin, Kalimantan Selatan.
Rancangan Penelitian
Pengujian pertumbuhan terkait dimorfisme seksual
Penelitian dimorfisme seksual (DS) dilakukan menggunakan rancangan pra-eksperimental berupa tes awal-tes akhir kelompok tunggal (the one group pretest-posttest) ikan uji yang diberi perlakuan pemeliharaan selama 135 hari. Rancangan penelitian ini memungkinkan untuk dilakukannya perbandingan hasil observasi bobot dan panjang tubuh ikan papuyu saat awal dan akhir berdasarkan jenis kelamin.
Pengkajian diferensiasi kelamin
Penelitian diferensiasi kelamin dilakukan menggunakan rancangan penelitian deskriptif untuk menentukan waktu diferensiasi kelamin (DK) pada ikan papuyu mulai umur 10–29 hpt yang dipelihara dalam kolam pendederan. Maskulinisasi
Penelitian maskulinisasi dilakukan menggunakan rancangan acak lengkap dengan empat perlakuan MT; dosis 25 mg/kg pakan (MT25), dosis 50 mg/kg
pakan (MT50), dosis 75 mg/kg pakan (MT75) dan dosis 100 mg/kg pakan (MT100),
dengan satu kontrol (dosis MT 0 mg/kg pakan), yang diulang sebanyak tiga kali.
Prosedur Penelitian
Benih ikan papuyu diperoleh dari pendederan larva hasil pemijahan lima pasang induk ikan papuyu varietas hijau betina bobot 80–100 g, dan jantan bobot 30–60 g. Pemijahan diinduksi dengan ovaprim dosis 0,25 ml/kg induk secara intramuskuler, lalu setiap pasang induk dipijahkan di dalam akuarium 604050 (plt) cm3 yang diaerasi secara kontinyu. Setelah memijah, induk dipindahkan ke tempat pemeliharaannya, dan telur diinkubasi dalam akuarium yang sama selama 18–20 jam pada suhu 28–30 C hingga menjadi larva umur 2 hari. Selanjutnya larva ditebar dalam bak pendederan ukuran 521 m3 (ketinggian air = 60 cm) lima hari setelah diberi dolomit dosis 0,5 kg/m2 dan dipupuk dengan kotoran ayam dosis 1 kg/m2 . Selama pemeliharaan, larva diberi pakan komersial
5
Pengujian pertumbuhan terkait dimorfisme seksual
Ikan yang digunakan pada pengujian ini adalah benih ikan papuyu umur 45 hpt (rerata bobot 2,920,87 g dan panjang baku 4,19±0,39 cm) hasil pendederan di atas sebanyak 60 ekor yang diambil secara acak. Benih tersebut dipelihara secara individual selama 135 hari di dalam hapa ukuran 20×20×100 cm3 yang dipasang dalam bak beton ukuran 310×200×100 cm3 dengan ketinggian air 60 cm. Ikan diberi pakan komersial (kadar protein 30%) dengan FR 10% dari biomassa dan frekuensi tiga kali sehari (pagi, siang dan sore). Penyifonan dan penggantian air sebesar 10% volume air bak beton dilakukan setiap 15 hari sekali. Dengan cara ini, kisaran kualitas air hasil monitoring selama penelitian menunjukkan suhu 26,4–27,6 C, pH air 5,8–8,8 dan oksigen terlarut 1,1–4,6 mg/L.
Sensus pertumbuhan dilakukan setiap 15 hari sekali hingga akhir penelitian dengan cara penimbangan bobot menggunakan timbangan digital (skala terkecil 0,1 g) dan pengukuran panjang standar menggunakan penggaris aluminium (skala terkecil 0,1 cm), setiap 15 hari sekali hingga akhir penelitian. Di akhir penelitian, semua ikan dibedah, jenis kelamin ditentukan berdasarkan Behera et al. (2015) dan Jacob (2005), dan gonad ditimbang menggunakan timbangan digital (skala terkecil 0,0001 g) untuk menghitung indeks gonadosomatik (IGS).
Pengkajian diferensiasi kelamin
Ikan uji yang digunakan adalah benih ikan papuyu umur 10–29 hpt (panjang total 5,15–22,35 mm dan bobot 4,35–248,83 mg) hasil pendederan pada suhu 28–30
C sebanyak 20 sampel per pengamatan yang dilakukan setiap hari. Penimbangan bobot tubuh ikan dilakukan menggunakan timbangan digital (skala terkecil 0,0001 g) dan pengukuran panjang total menggunakan jangka sorong (skala terkecil 0,05 mm). Setiap sampel dihistologi (Lampiran 1) untuk mengamati struktur dan status gonad terkait dengan DK. Pengamatan dilakukan menggunakan mikroskop cahaya dengan pembesaran 40×, 100×, 400×, dan 1000×.
Maskulinisasi
Penyiapan pakan berhormon MT
Prosedur pencampuran MT dengan pakan mengacu pada Mubarik et al. (2011). Masing-masing jumlah hormon untuk membuat dosis sesuai perlakuan dilarutkan dalam 170 ml etanol dan disemprotkan menggunakan sprayer secara merata pada 500 g pakan komersial berupa tepung (kadar protein 30%), kemudian pakan berhormon dikering-anginkan pada suhu 27–29 C selama 24 jam untuk menghilangkan etanol. Setelah kering, pakan berhormon disimpan dalam refrigerator sebelum digunakan. Pemberian pakan berhormon dan pemeliharaan ikan
Benih ikan papuyu umur 14 hpt (bobot= 106,0±3,2 mg; panjang= 4,9±1,0 mm) sebanyak 100 ekor dipelihara dalam hapa (meshsize 1 mm) ukuran 5050100 cm3 yang dipasang dalam bak beton ukuran 310200100 cm3 (ketinggian air 60 cm)
6 pemeliharaan menunjukkan suhu 26,9–27,4 °C, pH 5,79–7,34, dan oksigen terlarut 3,19–4,38 mg/L. Bobot ikan saat awal penelitian ditimbang menggunakan timbangan digital skala terkecil 0,0001 g, kemudian setiap 30 hari ditimbang menggunakan timbangan digital skala terkecil 0,1 g, sedangkan panjang standar ikan diukur saat awal dan akhir penelitian menggunakan penggaris aluminium (skala terkecil 0,1 cm) dengan mengambil 30 ekor sampel secara acak dari tiap unit ulangan, atau dengan sensus pada unit ulangan yang kelangsungan hidupnya kurang dari 30 ekor.
Identifikasi jenis kelamin
Gonad diobservasi secara histologi melalui pewarnaan asetokarmin (Guerrero dan Shelton 1974) dan eosin-hematoksilin (Genten et al. 2009) yang prosedurnya disajikan pada Lampiran 1 dan Lampiran 2. Sampel yang diperiksa pada setiap ulangan berjumlah 30 ekor, atau dilakukan sensus pada ulangan yang jumlah individu dalam populasinya kurang dari 30 ekor. Selanjutnya, dilakukan pengamatan menggunakan alat bantu mikroskop cahaya dengan pembesaran 40×, 100×, 400×, dan 1000×. Hasil pengamatan status gonad dikelompokkan ke dalam jenis kelamin jantan, betina, interseks, dan tidak berkembang (steril), yang selanjutnya dihitung masing-masing nisbahnya.
Parameter Pengamatan
Parameter yang diamati dalam penelitian ini meliputi parameter kinerja pertumbuhan (pertumbuhan bobot mutlak dan laju pertumbuhan bobot harian), kelangsungan hidup, indeks gonadosomatik, struktur dan status gonad, serta rasio jenis kelamin. Adapun parameter pengamatan untuk setiap penelitian dirincikan dalam Tabel 1.
Pertumbuhan bobot mutlak (PBM)
Pertumbuhan bobot mutlak ikan uji dihitung berdasarkan persamaan sebagai berikut:
PBM (g) = Bt – B0 Keterangan:
Bt = bobot rata-rata ikan pada akhir penelitian (g)
B0 = bobot rata-rata ikan pada awal tebar (g)
Tabel 1 Parameter pengamatan (×) pada penelitian pengujian pertumbuhan terkait dimorfisme seksual (DS), pengkajian diferensiasi kelamin (DK), dan maskulinisasi (M) ikan papuyu
Parameter Referensi Penelitian
DS DK M Pertumbuhan bobot mutlak Loum et al. (2013) × × Laju pertumbuhan bobot harian Ling et al. (2006) × ×
Kelangsungan hidup Bungas et al. (2013) ×
Indeks gonadosomatik Asad et al. (2010) × Struktur gonad Genten et al. (2009); Nakamura (2013) × Status gonad Behera et al. (2015); Jacob (2005) ×
Guerrero dan Shelton (1974) ×
Genten et al. (2009) × ×
7
Laju pertumbuhan bobot harian (LPH)
Laju pertumbuhan bobot harian ikan uji dihitung menggunakan rumus sebagai berikut:
LPH (%/hari) = Ln(Bt) – Ln(B0) ×100 t
Keterangan:
t = lama waktu pemeliharaan (hari)
Bt = bobot rata-rata ikan pada akhir penelitian (g) B0 = bobot rata-rata ikan pada awal tebar (g) Kelangsungan hidup (KH)
Kelangsungan hidup ikan uji dihitung menggunakan persamaan sebagai berikut:
KH (%) = Nt ×100 N0 Keterangan:
Nt = Jumlah ikan pada akhir penelitian (ekor) N0 = Jumlah ikan pada awal tebar (ekor) Indeks gonadosomatik (IGS)
Indeks gonadosomatik ikan uji diketahui berdasarkan persamaan sebagai berikut:
Struktur gonad diketahui dengan mengamati gonad secara histologi. Proses DK dimulai dengan terbentuknya PGC (primordial germ cell) dan terbentuknya koloni daerah genital (genital ridges), hingga terbentuknya testis atau ovari. Status gonad
8 merah (Guerrero dan Shelton 1974). Selanjutnya, ciri gonad pada pewarnaan hematoksilin-eosin secara histologi mengacu pada Genten et al. (2009).
Rasio kelamin (RK)
Rasio kelamin dihitung menggunakan rumus sebagai berikut: RK (%) =
Nk
×100 N(j+b+i+s) Keterangan:
Nk = jumlah ikan (ekor) berstatus gonad tertentu
N(j+b+i+s) = jumlah total ikan (ekor) berstatus gonad jantan (j), betina (b), interseks
(i), dan steril (s) rata-rata ikan pada akhir penelitian (g)
Analisis Data
Uji pertumbuhan terkait dimorfisme seksual
Data kuantitatif yang diperoleh selama penelitian ditabulasi menggunakan program Microsoft Excel 2007 dan dianalisis secara statistik menggunakan software Minitab 16. Data dikelompokkan menjadi data pertumbuhan, dan IGS ikan betina dan jantan, lalu diuji normalitasnya. Uji t dilakukan pada selang kepercayaan 95%.
Pengkajian diferensiasi kelamin
Hasil pengamatan gonad ikan uji dalam penelitian DK dianalisis secara histologi.
Maskulinisasi
9
3
HASIL DAN PEMBAHASAN
Hasil
Dimorfisme seksual
Ikan uji yang bertahan hidup sampai penelitian berakhir berjumlah 56 dari 60 ekor yang dipelihara secara individual, terdiri dari 30 ekor ikan jantan (50,8%) dan 26 ekor ikan betina (44,2%), dari jumlah tersebut berhasil didapatkan nilai IGS pada 27 ekor jantan dan 22 ekor betina. Identifikasi status kelamin terhadap ikan uji secara visual menunjukkan gonad jantan berupa testis, sedangkan gonad betina berupa ovari (Gambar 2) dengan rata-rata gonad jantan telah mencapai TKG III, sedangkan gonad betina mencapai TKG IV.
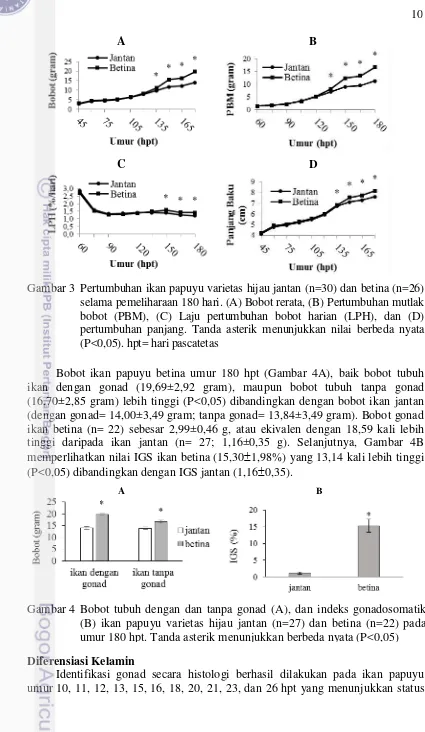
Perbedaan pertumbuhan ikan papuyu jantan dan betina disajikan pada Gambar 3. Ikan papuyu betina dan jantan memiliki bobot, pertumbuhan bobot mutlak (PBM), dan panjang baku yang sama sampai umur 120 hpt (Gambar 3A, Gambar 3B, dan Gambar 3D). Perbedaan bobot tubuh, PBM, dan panjang baku ikan betina yang lebih tinggi daripada jantan (P<0,05) baru terdeteksi pada umur 135–180 hpt. Laju pertumbuhan harian (LPH) jantan dan betina memperlihatkan nilai yang sama sampai umur 135 hpt (Gambar 3C), kemudian mulai ditemukan perbedaannya pada umur 150–180 hpt. Pada akhir pemeliharaan, ikan betina menunjukkan bobot tubuh 40% lebih tinggi daripada bobot ikan jantan, sedangkan panjang baku betina hanya 10% lebih panjang daripada jantan. Hasil yang serupa ditunjukkan pada parameter PBM dan LPH yang menunjukkan nilai lebih besar pada ikan betina daripada ikan jantan, yaitu masing-masing 48% dan 17%.
10
Bobot ikan papuyu betina umur 180 hpt (Gambar 4A), baik bobot tubuh ikan dengan gonad (19,69±2,92 gram), maupun bobot tubuh tanpa gonad (16,70±2,85 gram) lebih tinggi (P<0,05) dibandingkan dengan bobot ikan jantan (dengan gonad= 14,00±3,49 gram; tanpa gonad= 13,84±3,49 gram). Bobot gonad ikan betina (n= 22) sebesar 2,99±0,46 g, atau ekivalen dengan 18,59 kali lebih tinggi daripada ikan jantan (n= 27; 1,16±0,35 g). Selanjutnya, Gambar 4B memperlihatkan nilai IGS ikan betina (15,301,98%) yang 13,14 kali lebih tinggi (P<0,05) dibandingkan dengan IGS jantan (1,160,35).
Diferensiasi Kelamin
Identifikasi gonad secara histologi berhasil dilakukan pada ikan papuyu umur 10, 11, 12, 13, 15, 16, 18, 20, 21, 23, dan 26 hpt yang menunjukkan status
A B
C D
Gambar 3 Pertumbuhan ikan papuyu varietas hijau jantan (n=30) dan betina (n=26) selama pemeliharaan 180 hari. (A) Bobot rerata, (B) Pertumbuhan mutlak bobot (PBM), (C) Laju pertumbuhan bobot harian (LPH), dan (D) pertumbuhan panjang. Tanda asterik menunjukkan nilai berbeda nyata (P<0,05). hpt= hari pascatetas
A B
11
diferensiasi sebagaimana diperlihatkan dalam Tabel 2. Analisis histologi terhadap sampel gonad ikan umur 10–16 hpt menunjukkan status gonad yang belum terdiferensiasi dan pada umur 18–20 hpt menunjukkan 20%–40% gonad terdiferensiasi. Pada ikan papuyu yang umurnya 21 hpt atau lebih, menunjukkan bahwa 100% gonad sudah terdiferensiasi menjadi jantan atau betina.
Secara morfologi, gonad ikan papuyu menunjukkan perbedaan ukuran yang tidak selalu berkaitan dengan umurnya, dengan lebar bervariasi antara 6,6–48,4
μm dan panjang 15,4–80,9 μm. Berdasarkan karakteristik genital rides, jumlah primordial germ cells (PGC), munculnya efferent duct sebagai ciri status jantan dan ovarian cavity sebagai ciri status betina menunjukkan posisi gonad terletak dalam rongga badan, menggantung pada dinding dorsal peritonial berupa jaringan yang relatif sangat kecil dibandingkan dengan isi rongga badan (Gambar 5A). Gonad berjumlah sepasang yang ditopang oleh mesogonium (Gambar 5B).
Pengamatan yang lebih mendetail pada histologi gonad yang berumur 10, 11, 15, dan 18 hpt memperlihatkan adanya PGC dengan jumlah yang bervariasi (2–11 buah) dengan ukuran 2,4–5,8 μm. Karakteristik germ cell (GC) tersebut diperkirakan merupakan tahap awal pembentukan oogonia atau spermatogonia Tabel 2 Status gonad ikan papuyu varietas hijau pada umur 10–26 hpt
Umur ikan keterangan: 1 differentiated (terdiferensiasi); 2 undifferentiated (belum terdiferensiasi)
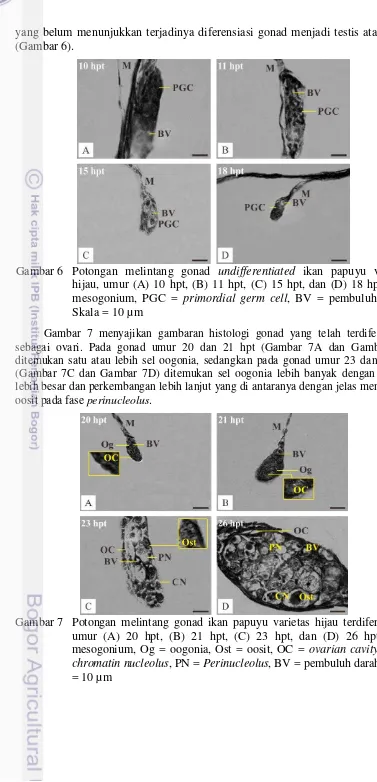
12 yang belum menunjukkan terjadinya diferensiasi gonad menjadi testis atau ovari (Gambar 6).
Gambar 7 menyajikan gambaran histologi gonad yang telah terdiferensiasi sebagai ovari. Pada gonad umur 20 dan 21 hpt (Gambar 7A dan Gambar 7B) ditemukan satu atau lebih sel oogonia, sedangkan pada gonad umur 23 dan 26 hpt (Gambar 7C dan Gambar 7D) ditemukan sel oogonia lebih banyak dengan ukuran lebih besar dan perkembangan lebih lanjut yang di antaranya dengan jelas mencirikan
oosit pada fase perinucleolus.
Gambar 6 Potongan melintang gonad undifferentiated ikan papuyu varietas hijau, umur (A) 10 hpt, (B) 11 hpt, (C) 15 hpt, dan (D) 18 hpt. M = mesogonium, PGC = primordial germ cell, BV = pembuluh darah. Skala = 10 µm
13
Maskulinisasi
Berdasarkan pengamatan status gonad pada sampel ikan yang diberi perlakuan MT menunjukkan bahwa secara umum pemberian MT menghasilkan empat karakteristik status gonad, yaitu status jantan, betina, interseks, dan steril (Gambar 8). Karakteristik gonad jantan (Gambar 8A) menunjukkan ciri jaringan testis yang sangat jelas, dicirikan dengan adanya spermatosit dan spermatid, gonad betina (Gambar 8B) dicirikan dengan adanya oosit pada jaringan ovari, gonad interseks (Gambar 8C) dicirikan dengan adanya jaringan testis dan ovari dalam satu gonad, sedangkan karakteristik steril (Gambar 8D) menunjukkan tidak adanya perkembangan sel gamet dan secara histologi tidak dapat dibedakan sebagai karakteristik jantan atau betina.
Masing-masing rasio status gonad dan persentase KH pada setiap perlakuan dan kontrol disajikan pada Gambar 9. Perlakuan MT50 dan MT75 menunjukkan pengaruh yang nyata terhadap rasio jantan (P<0,05), sedangkan perlakuan MT25 dan MT100 tidak berpengaruh terhadap rasio jantan (P>0,05). Pemberian MT dengan dosis 50 mg/kg pakan menghasilkan rasio jantan tertinggi (88,9±6,9%), diikuti oleh perlakuan pemberian MT dengan dosis 75 mg/kg pakan (57,4±9,7%). Pada selang dosis MT yang digunakan dalam penelitian ini terlihat adanya kecenderungan bahwa semakin tinggi dosis MT yang diberikan menghasilkan rasio interseks yang semakin rendah (20,9–3,3%) dan rasio steril yang secara signifikan semakin meningkat (0–32,2%). Selanjutnya, meningkatnya dosis hormon menyebabkan penurunan KH yang signifikan; dosis MT 25–50 mg/kg pakan menyebabkan kematian 27,7–34,0% lebih banyak dibandingkan dengan kontrol, dan dosis MT 75–100 mg/kg pakan menyebabkan kematian 46,7–47,7% lebih banyak dibandingkan dengan kontrol.
14
Keberhasilan maskulinisasi ikan papuyu menggunakan MT terhadap peluang untuk memproduksi jantan fungsional diperlihatkan berdasarkan selisih rasio jantan dibandingkan dengan kontrol. Dalam hal ini, perlakuan MT50 dan
MT75 secara signifikan berpeluang menghasilkan jantan fungsional (P<0,05),
dengan peluang tertinggi diperoleh pada perlakuan MT50 (61,1±6,9%). Parameter
pertumbuhan (Tabel 3) menunjukkan bahwa pemberian MT secara oral tidak berpengaruh terhadap bobot akhir, pertumbuhan mutlak bobot, maupun laju pertumbuhan bobot harian antar perlakuan (P>0,05), namun berpengaruh nyata terhadap biomassa ikan hingga umur 105 hpt, dengan biomassa tertinggi ditemukan pada perlakuan kontrol (P<0,05).
Pembahasan
Dimorfisme Seksual
Penelitian ini membuktikan adanya dimorfisme seksual (DS) terkait dengan pertumbuhan pada ikan papuyu. Pada umur 180 hpt, bobot ikan betina, baik dengan maupun tanpa gonad menunjukkan nilai yang lebih tinggi (P<0,05) daripada ikan jantan, berturut-turut 40,6% dan 20,7%. Perbedaan pertumbuhan ini menguatkan adanya fenomena bahwa variasi ukuran ikan papuyu saat panen (Bunasir et al. 2014) lebih disebabkan oleh dimorfisme seksual. Di samping itu, Gambar 9 Persentase jantan, interseks, steril dan kelangsungan hidup (KH) ikan
papuyu varietas hijau umur 105 hpt yang telah diberi perlakuan pemberian MT secara oral mulai umur 14 hpt selama 30 hari, dosis 0 mg/kg pakan (kontrol), 25 mg/kg pakan (MT25), 50 mg/kg pakan
(MT50), 75 mg/kg pakan (MT75), 100 mg/kg pakan (MT100).
Tabel 3 Bobot akhir, pertumbuhan bobot mutlak (PBM), laju pertumbuhan bobot harian (LPH), dan biomassa ikan papuyu umur 105 hpt yang diberi perlakuan pemberian MT secara oral mulai umur 14 hpt selama 30 hari
Parameter Perlakuan
Kontrol MT25 MT50 MT75 MT100
Bobot akhir (g) 7,15 ± 2,01a 7,43 ± 0,92a 5,73 ± 1,00a 10,46 ± 1,54 a 9,22 ± 3,48a
PBM (g) 7,1 ± 2,01a 7,4 ± 0,92a 5,7 ± 1,00a 10,5 ± 1,54 a 9,2 ± 3,48a
LPH (%/hari) 21,6 ± 0,9a 21,8 ± 0,4a 20,9 ± 0,6a 23,0 ± 0,5 a 22,4 ± 1,5a
Biomassa (g) 440,8 ± 54,9a 216,2 ± 8,5b 231,3 ± 28,8b 171,5 ± 19,1b 135,6 ± 30,1b
15
tingginya bobot ikan papuyu betina dibandingkan dengan ikan jantan mengindikasikan bahwa ikan betina lebih cepat tumbuh daripada ikan jantan. Dimorfisme seksual terkait pertumbuhan pada ikan papuyu ini menunjukkan perbedaan yang lebih besar (dua kali lipat) jika dibandingkan dengan udang windu (Penaeus monodon) (Gopal et al. 2010), relatif sama dengan lobster air tawar (Cherax quadricarinatus) (Rodgers et al. 2006), dan lebih rendah dengan ikan mujair (Oreochromis mossambicus) (Bhatta et al. 2012b).
Indeks gonadosomatik ikan betina lebih tinggi (P<0,05) dibandingkan dengan ikan jantan pada umur yang sama (Gambar 4B). Nilai IGS ini memberikan gambaran bahwa gonad ikan betina menyumbang sebesar 15,201,98% dari bobot totalnya, sedangkan gonad ikan jantan menyumbang hanya 1,16±0,35% dari bobot totalnya. Sebagaimana dimorfisme seksual pada ikan chinook salmon, ikan jantan memiliki bobot tubuh lebih rendah dibandingkan dengan ikan betina (Mizzau et al. 2013). Namun demikian, hal ini tidak berlaku untuk ikan Atlantic salmon yang belum dewasa (Leclercq et al. 2010) dan ikan lele Eropa (Silurus glanis) (Haffray et al. 1998) yang memiliki karakteristik sebaliknya, yaitu ikan jantan cepat tumbuh dibandingkan dengan ikan betina. Dimorfisme seksual terkait dengan pertumbuhan tersebut berhubungan erat dengan perkembangan gonad, yang mana gonad mengekspresikan hormon pertumbuhan yang diduga mengendalikan pertumbuhan bobot tubuh (Bhatta et al. 2012a). Pengkajian dimorfisme berdasarkan perbedaan TKG dan IGS pada ikan papuyu dalam penelitian ini tidak menyertakan gambaran kapan terjadinya awal matang gonad, atau kemungkinan telah terjadi rematurasi, sehingga belum dapat disimpulkan bahwa ikan papuyu betina lebih cepat matang gonad dibanding ikan jantan.
Perbedaan pertumbuhan terkait dengan jenis kelamin pada beberapa jenis ikan ekonomis mendasari perlu adanya langkah strategis terkait keunggulan antara jantan dan betina. Karakteristik keunggulan tersebut dapat menjadi pertimbangan dalam rekayasa reproduksi untuk mencetak stok induk yang akan menghasilkan benih monoseks yang unggul (Cnaani dan Levavi-Sivan 2009) atau rekayasa hormonal untuk mengarahkan jenis kelamin sesuai dengan yang diharapkan. Rekayasa jenis kelamin tentunya bertujuan untuk memaksimalkan produksi budidaya dan meningkatkan efisiensi. Pendekatan seperti ini telah dilakukan pada budidaya ikan mas monoseks betina (Kocour et al. 2005), nila monoseks jantan (Beaven dan Muposhi 2012; Chakraborty et al. 2010; Chakraborty et al. 2011; Silva et al. 2012; El-Greisy dan El-Gamal 2012; Siddik et al. 2007), yang menggambarkan bahwa budidaya secara monoseks tersebut dapat meningkatkan bobot panen, memperbaiki konversi pakan, dan mempercepat pengembalian modal usaha (Dagne et al. 2013). Oleh sebab itu, budidaya ikan secara monoseks merupakan metode yang prospektif untuk meningkatkan produksi dan perekonomian masyarakat (Chakraborty dan Banerjee 2009).
16 pemberian MT pada ikan mas diploid. Selanjutnya, jantan tersebut disilangkan dengan ikan mas krusian betina diploid dan allotetraploid, masing-masing menghasilkan ikan mas krusian monoseks betina diploid dan triploid. Hal yang sama diduga dapat diterapkan pada persilangan antara ikan papuyu jantan fungsional dengan betina normal untuk menghasilkan benih papuyu monoseks betina secara massal. Feminisasi melibatkan proses hormonal untuk mengarahkan kelamin (sex reversal) ikan saat berlangsungnya DK. Pengarahan jenis kelamin ini dapat dilakukan karena determinasi kelamin pada ikan merupakan suatu proses diferensiasi yang fleksibel (Piferrer dan Guiguen 2008). Oleh sebab itu, diferensiasi seksual penting untuk dipelajari sebagai dasar dalam aplikasi sex reversal tersebut. Diferensiasi Kelamin
Penelitian telah dilakukan untuk mengkaji diferensiasi kelamin (DK) dan berhasil mengungkap waktu terjadinya DK pada ikan papuyu berdasarkan pengamatan karakteristik gonad secara histologi. Gambaran histologi gonad ikan papuyu pada sampel ikan umur 18 hpt (Gambar 5B) menunjukkan posisi sepasang gonad terlihat menggantung dari dinding peritoneal punggung ke rongga badan, ditopang oleh sel somatik yang tipis (mesogonium), hal tersebut sesuai dengan konfirmasi Nakamura (2013). Gambaran gonad yang belum terdiferensiasi dicirikan dengan adanya sel PGC berbentuk inti tunggal dan bulatan besar yang dikelilingi oleh sel somatik (Bhatta et. al. 2012b; Tong et al. 2010; Yön dan Akbulut 2015). Okuthe et al. (2014) menyatakan bahwa GC pada gonad undifferentiated memiliki karakteristik morfologi sebagai oogonia atau spermatogonia, namun belum dapat dibedakan secara pasti sebagai ciri testis maupun ovari. Dalam penelitian ini, karakteristik GC tersebut sesuai dengan karakteristik gonad pada gambaran histologi gonad sampel ikan umur 10–18 hpt (Gambar 6) yang masih tergolong berstatus belum terdiferensiasi. Gonad yang belum terdiferensiasi terbagi dalam dua tipe berdasarkan jumlah GC gonia, yaitu GC dalam jumlah lebih banyak akan menjadi ovari dan GC dalam jumlah sedikit cenderung terdiferensiasi menjadi testis (Pandian 2013, Siegfried dan Nüsslein-Volhard 2008), kecuali pada ikan loach (Misgurnus anguillicaudatus, Cypriniformes: Cobitidae) yang menunjukkan sedikit GC pada gonad yang akhirnya terdiferensiasi menjadi ovari (Fujimoto et al. 2010).
17
2011, Guiguen et al. 2010, Ijiri et al. 2008, Kobayashi et al. 2008, Sakai et al. 2008, Hofsten dan Olsson 2005, Nagahama 2005).
Hasil pengamatan dalam penelitian DK pada ikan papuyu ini secara umum menunjukkan prediksi terjadinya diferensiasi pada umur 18–21 hpt dan menjadi pertimbangan dalam prosedur sex reversal. Oleh sebab itu, pemberian hormon secara oral maupun imersi untuk sex reversal pada ikan papuyu harus dilakukan sebelum ikan berumur 18 hpt. Berkaitan dengan hal ini, larva ikan papuyu sudah dapat memanfaatkan pakan dari luar pada umur 5–7 hari, dan tahap awal pemberian pakan serbuk dalam prosedur pembenihannya sudah dapat dilakukan saat benih berumur 8–11 hpt (Bunasir et al. 2014), sehingga sangat memungkinkan untuk dilakukan sex reversal secara oral.
Maskulinisasi
Penelitian pemberian MT sebagai hormon sex reversal secara oral dengan dosis yang berbeda telah dilakukan untuk maskulinisasi ikan papuyu dalam rangka menghasilkan jantan fungsional. Hasil penelitian memperlihatkan hubungan antara dosis MT dan rasio jantan cenderung bersifat parabolik dan puncaknya pada dosis MT 50 mg/kg pakan; dosis hormon MT kurang atau lebih dari 50 mg/kg pakan menghasilkan rasio jantan yang cenderung menurun (Gambar 9). Beberapa riset maskulinisasi pada ikan nila telah dilakukan menggunakan MT dosis 14–70 mg/kg pakan yang diberikan secara oral pada ikan umur 3–5 hari selama 24–30 hari menghasilkan 95–100% rasio jantan (Phelps dan Okoko 2011, Asaad et al. 2012, Ferdous dan Ali 2011, Asad et al. 2010). Selain itu, MT dosis 1 mg/kg pakan yang diberikan pada ikan sturgeon mulai umur tiga bulan selama 15 bulan menghasilkan 93% ikan jantan (Omoto et al. 2002). Maskulinisasi tersebut terjadi diduga karena MT menekan proses biosintesis estrogen saat diferensiasi gonad (Tzchori et al. 2004) sehingga gonad terdiferensiasi menjadi testis yang melibatkan aktivasi reseptor androgen (Golan dan Levavi-Sivan 2014) dan penghambatan sintesis estrogen (Piferrer 2011).
Rasio interseks dalam penelitian ini cenderung menurun, dan sebaliknya individu steril semakin meningkat seiring dengan peningkatan dosis MT. Ciri kelamin interseks ditandai dengan adanya jaringan testis dan ovari dalam satu gonad. Penelitian ini memperlihatkan bahwa MT dosis rendah (25 mg/kg pakan) diduga belum efektif dalam maskulinisasi ikan papuyu (Gambar 9). Individu interseks juga ditemukan pada ikan mas (Cyprinus carpio) yang diberi perlakuan MT (Mubarik et al. 2011), gupi (Poecilia reticulata) yang diberi perlakuan ekstrak tanaman gendola (Basella alba) (Chakraborty et al. 2012), dan individu interseks yang ditemukan pada benih ikan rainbow trout jantan (Oncorhynchus mykiss) diduga dikarenakan adanya respons reseptor androgen terhadap paparan estrogen (Depiereux et al. 2014). Piferrer dan Guiguen (2008) menyatakan bahwa diferensiasi kelamin selama sex reversal dipengaruhi oleh perbandingan jumlah absolut antara estrogen dan androgen, serta jenis reseptor steroid.
18 yang mengakibatkan terjadinya peningkatan abnormalitas inti eritrosit (Rivero-Wendt 2013), ketidakseimbangan atau kerusakan permanen sistem hormonal (Hachfi et al. 2012; Milnes et al. 2006), dan kerusakan gonad atau tidak terjadi proses perkembangan sel gamet (Metcalfe 2010). Gambaran gonad steril dalam penelitian ini secara signifikan ditemukan pada perlakuan pemberian MT dosis 75 dan 100 mg/kg pakan (Gambar 9). Penggunaan hormon induksi sex reversal yang melebihi dosis optimal menghasilkan individu steril juga ditemukan pada ikan mas (Bharadwaj dan Sharma 2000), mujair (Marjani et al. 2009), nila (Manosroi et al. 2004) dan blue hap (Sciaenochromis ahli) (Elmdoust et al. 2011).
Hubungan KH dengan dosis MT bersifat linear, yaitu KH cenderung semakin menurun seiring bertambahnya dosis MT. Selanjutnya, jika dibandingkan dengan KH kontrol, maka pemberian MT dosis 25, 50, 75, dan 100 mg/kg pakan berturut-turut meningkatkan mortalitas ikan sebesar 33,0%, 27,7%, 46,7%, dan 47,7%; MT dosis 25–50 mg/kg pakan merupakan dosis yang cenderung memberikan mortalitas ikan paling rendah dibandingkan dengan perlakuan lainnya. Rendahnya KH dalam penelitian ini juga ditemukan pada sex reversal ikan papuyu menggunakan estradiol (Pongthana et al. 1998) dan ikan lele Afrika (Clarias gariepinus) menggunakan testosteron propionat (Alam dan Uddin 1998).
Peluang potensi produksi jantan fungsional dihasilkan pada pemberian MT dosis 50 dan 75 mg/kg pakan. Perlakuan MT50 menghasilkan rasio jantan
19
4
KESIMPULAN DAN SARAN
Kesimpulan
Setelah pemeliharaan selama 4,5 bulan, ikan papuyu betina terbukti tumbuh lebih cepat daripada jantan. Pertumbuhan bobot mutlak dan laju pertumbuhan bobot harian ikan papuyu betina pada umur 6 bulan menunjukkan nilai 48% dan 17% lebih tinggi daripada ikan papuyu jantan. Diferensiasi kelamin pada ikan papuyu yang dipelihara pada suhu 28–30 C terjadi pada umur 18 hari pascatetas. Maskulinisasi ikan papuyu menggunakan MT dosis 50 mg/kg pakan pada ikan umur 14 hari pascatetas selama 30 hari menghasilkan rasio jantan 88,9% dan berpeluang untuk memproduksi ikan jantan fungsional sebesar 61,1%.
Saran
Uji progeni pada populasi ikan papuyu jantan hasil maskulinisasi perlu dilakukan untuk menentukan individu jantan fungsional sebagai stok induk untuk menghasilkan benih monoseks betina ikan papuyu secara massal.
DAFTAR PUSTAKA
Al-Ablani SA, Phelps RP. 2002. Paradoxes in exogenous androgen treatments of bluegill. J Appl Ichthyol. 18(1):61-64.
Alam MS, Uddin MZ. 1998. Effects of testosterone propionate on growth, survival and sex-ratio of African catfish (Clarias gariepinus Burchell). Bangla Fish Res. 2(1):31-39.
Arezo MJ, D’Alessandro S, Papa N, de Sa R, Berois N. 2007. Sex differentiation pattern in the annual fish Austrolebias charrua (Cyprinodontiformes: Rivulidae). Tissue and Cell. 39:89-98.
Asaad HM, Traifalgar RFM, Jr AES, Peralta JP, Pedroso FL. 2012. Dietary administration of dehydroepiandrosterone hormone influences sex differentiation of hybrid red tilapia (O. niloticus × O. mossambicus) larvae. J Fish Aquat Sci. 7(6):447-453.
Asad F, Ahmed I, Saleem M, Iqbal T. 2010. Hormonal masculinization and growth performance in Nile tilapia (Oreochromis niloticus) by androgen administration at different dietary protein levels. Int J Agric Biol. 12(6):939-943.
Baroiller JF, D’cotta H, Saillant E. 2009. Environmental effects on fish sex
determination and differentiation. Sex Dev. 3:118-135.
20 Behera S, Devi LM, Kumar S, Gogoi R, Samanta P, Jomang O, Baksi S. 2015. External morphology and sexual dimorphism of Anabas testudineus in natural environment. IJSN. 6(2):288-292
Bharadwaj R, Sharma LL. 2000. Effect of methyltestosterone (tablets) in sterilization and masculinization of common carp (Cyprinus carpio communis L.). Indian J Fish. 47(4):377-381.
Bhatta S, Fukada H, Higuchia M, Iwaia T, Miuraa C, Miuraa T, Yamaguchia SS. 2012a. Gonads directly regulate growth in teleosts. PNAS. 109(28):11408-11412.
Bhatta S, Iwai T, Miura T, Huguchi M, Maugars G, Chiemi M. 2012b. Differences between male and female growth and sexual maturation in tilapia (Oreochromis mossambicus). J Sci Eng Tec. 8(2):57-65.
Bunasir, Haryadi A, Hidayat R, Ilmi A, Mudjiutami E, Rifa’i A, Susanti W,
Tulus, Wahyutomo, Webby et al. 2014. Domestikasi dan Budidaya Ikan Papuyu. Banjarbaru (ID): BPBAT Mandiangin.
Bungas K, Arfiati D, Marsoedi, Halim H. 2013. Effects of protein levels on the growth of climbing perch (Anabas testudineus) galam type, in peat water. Int Res J Biological Sci. 2(4):55-58
Chakraborty SB, Banerjee S. 2009. Culture of monosex Nile tilapia under different traditional and non-traditional methods in India. World J Fish Marine Sci. 1(3): 212-217.
Chakraborty SB, Banerjee S. 2010. Comparative growth performance of mixed-sex and monomixed-sex Nile tilapia population in freshwater cage culture system under Indian perspective. Int J Biol. 2(1):44-50.
Chakraborty SB, Mazumdar D, Chatterji U, Banerjee S. 2011. Growth of mixed-sex and monomixed-sex Nile tilapia in different culture systems. Turk J Fish Aquat Sci. 11:131-138.
Chakraborty SB, Molnár T, Hancz C. 2012. Effects of methyltestosterone, tamoxifen, genistein and Basella alba extract on masculinization of guppy (Poecilia reticulata). J App Pharm Sci. 2(12):048-052
Cho HC, Hwang IJ, Baek HJ. 2014. Histological analysis of early gonadal development and sex differentiation in chameleon goby (Tridentiger trigonocephalus). Dev Reprod. 18(1):51-56.
Chotipuntu P, Avakul P. 2010. Aquaculture potential of climbing perch (Anabas testudineus) in brackish water. Walailak J Sci Tech. 7:15-21.
Cnaani A, Sivan BL. 2009. Sexual development in fish, practical applications for aquaculture. Sex Dev. 3:164-175.
Dagne A, Degefu F, Lakew A. 2013. Comparative growth performance of mono-sex and mixed-mono-sex Nile tilapia (Oreochromis niloticus L.) in pond culture system at Sebeta, Ethiopian. Int J Aqua. 3(7):30-34.
de Jesus LWO, Chehade C, Costa FG, Borella MI. 2014. Pituitary gland morphogenesis and ontogeny of adenohypophyseal cells of Salminus brasiliensis (Teleostei, Characiformes). Fish Physiol Biochem. 40(3):897-909.
21
[DISPERINDAGKOP] Dinas Perindustrian Perdagangan Koperasi Dan Usaha Kecil Menengah Pemerintahan Kabupaten Tanah Bumbu. 2013. Monitoring Harga Pasar [internet]. [diunduh 2014 Juni 10]; tersedia pada: http://disperindagkop.tanahbumbukab.go.id/index.php?option=com_content &view=article&id=123:monitoring-harga-pasar-juli-2013&catid=35:berita-terkini&Itemid=28
El-Greisy ZA, El-Gamal AE. 2012. Monosex production of tilapia (Oreochromis niloticus) using different doses of 17α-methyltestosterone with respect to the degree of sex stability after one year of treatment. Egypt J Aquat. Res. 38:59-66.
Elmdoust EAR, Farahmand H, Rafiee G, Amiri MB, Mirvaghefi AR. 2010. Masculinization of blue hap (Sciaenochromis ahli) treated with 17α -methyltestosterone. J Agri Sci Tech. 13:173-180.
Ferdous Z, Ali MM. 2011. Optimization of hormonal dose during masculinization of tilapia (Oreochromis niloticus) fry. J Bangla Agril Univ. 9(2):359-364. Fujimoto T, Nishimura T, Goto-Kazeto R, Kawakami Y, Yamaha E, Arai K.
2010. Sexual dimorphism of gonadal structure and gene expression in germ cell-deficient loach, a teleost fish. PNAS. 107(40):17211-17216.
Genten F, Terwinghe E, Danguy A. 2009. Atlas of Fish Histology. Enfield (US). Sci Pub. hlm 159-175.
George T, Pandian TJ. 1998. Dietary administration of androgens induces sterility in the female-heterogametic black molly (Poecilia sphenops Cuvier and Valenciennes, 1846). Aqua Res. 29:167-175.
Golan M, Levavi-Sivan B. 2014. Artificial masculinization in tilapia involves androgen receptor activation. Gen Comp Endocr. 207:50-55.
Gopal C, Gopikrishna G, Krishna G, Jahageerdar GS, Rye M, Hayes BJ, Paulpandi S, Kiran RP, Pillai SM, Ravichandran P et al. 2010. Weight and time of onset of female-superior sexual dimorphism in pond reared Penaeus monodon. Aquaculture. 300:237-239. disrupting chemicals [EDCs] on hypothalamic-pituitary-gonad-liver [HPGL] axis in fish. World J Fish Marine Sci. 4(1):14-30.
Haffray P, Vauchez C, Vandeputte M, Linhart O. 1998. Different growth and processing traits in males and females of European catfish (Silurus glanis). Aquat Liv Resour. 11(5):341-345.
Hofsten J, Olsson PE. 2005. Zebrafish sex determination and differentiation: involvement of FTZ-F1 genes. Reprod Biol Endocrinol. 3:1-11.
22 Jacob KP. 2005. Studies on some aspect of reproduction of female Anabas testudineus Bloch. [Thesis]. Cochin (IN): Cochin University of Science and Technology.
Kobayashi T, Kajiura-Kobayashi H, Guan G, Nagahama Y. 2008. Sexual dimorphic expression of DMRT1 and Sox9a during gonadal differentiation and hormone-induced sex reversal in the teleost fish Nile tilapia (Oreochromis niloticus). Dev Dynam. 237:297-306.
Kocour M, Linhart O, Gela D, Rodina M. 2005. Growth performance of all-female and mixed-sex common carp (Cyprinus carpio L.) populations in the Central Europe climatic conditions. J World Aqua Soc. 36(1):103-113 Komen H, Thorgaard GH. 2007. Androgenesis, gynogenesis and the production of
clones in fishes: a review. Aquaculture. 269(1):150-173.
Leclercq E, Taylor JF, Hunter D, Migaud H. 2010. Body size dimorphism of sea-reared Atlantic salmon (Salmo salar L.): implications for the management of sexual maturation and harvest quality. Aquaculture. 301: 47-56.
Ling S, Hashim R, Kolkovski S, Shu-Chien AC. 2006. Effects of varying dietary lipid and protein levels on growth and reproductive performance of female swordtails (Xiphorus helleri) (Poeciliidae). Aqua Res. 37:1267-1275.
Loum A, Sagne M, Fall J, Ndong D, Diouf M, Sarr A, Thiaw OT. 2013. Effects of dietary protein level on growth performance, carcass composition and survival rate of fry monosex Nile tilapia (Oreochromis niloticus) reared under re-circulating system. J Bio Life Sci. 4(2):13-22.
Luo K, Xiao J, Liu SJ, Wang J, He WG, Hu J, Qin Q, Zhang C, Tao M, Liu Y. 2011. Massive production of all-female diploids and triploids in the Crucian carp. Int J Biol Sci. 7(4):487-495.
Manosroi J, Petchjul K, Manosroi A. 2004. Effect of fluoxymesterone fish feed granule on sex reversal of the hybrid, Thai red tilapia (Oreochromis mossambicus L.). Asian Fish Sci. 17:323-331.
Marjani M, Jamili S, Mostafavi PG, Mashinchian A. 2009. Influence of 17-alpha methyl testosteron on masculinization and growth in tilapia (Oreochromis mossambicus). J Fish Aquat Sci. 4(1):71-74.
Metcalfe CD, Kidd KA, Sumpter JP. 2010. Endocrine and reproductive system, including their interaction with the immune system. Di dalam: Leatherland JF, Woo PTK, editor. Fish Diseases and Disorders. Volume 2. Non-Infectious Disorders. Preston (UK): CABI. hlm 85-143.
Milnes MR, Bermudez DS, Bryan TA, Edwards TM, Gunderson MP, Larkin ILV, Moore BC, Guillette LJ. 2006. Contaminant-induced feminization and demasculinization of nonmammalian vertebrate males in aquatic environments. Environ Res. 100:3-17.
Mizzau TW, Garner SR, Marklevitz SA, Thompson GJ, Morbey YE. 2013. A genetic test of sexual size dimorphism in pre-emergent Chinook salmon. PloS one. 8(10):1-6.
Mubarik MS, Ahmed I, Mateen A, Iqbal T. 2011. 17α-methyltestosterone induced masculinization and its effect on growth and meat quality of Cyprinus carpio. Int J Agri Biol. 13(6):971-975.
steroid-23
producing cells during ovarian differentiation in the protogynous Malabar grouper (Epinephelus malabaricus). Int J Dev Biol. 55:619-625.
Nagahama Y. 2005. Molecular mechanisms of sex determination and gonadal sex differentiation in fish. Fish. Physiol. Biochem. 31:105-109.
Nagris A. 2010. Ageing and growth records of Anabas testudineus (Bloch) (Anabantidae : Perciformes). Bangla J Sci Ind Res. 45(3):283-287.
Nakamura M, Bhandari RK, Higa M. 2003. The role estrogens play in sex differentiation and sex changes of fish. Fish Physiol Biochem. 28:113-117. Nakmura M. 2013. Morphological and physiological studies on gonadal sex
differentiation in teleost fish. Aqua Bio Sci Monogr. 6(1):1-47.
Nguyen CD, David CL. 2000. The culture performance of monosex and mixed-sex new-season and overwintered fry in three strains of Nile tilapia (Oreochromis niloticus) in northern. Aquaculture. 184:221-231.
Okuthe GE, Hanrahan S, Fabian BC. 2014. Early gonad development in zebrafish (Danio rerio). Afr J Biotechnol. 13(33):3433-3442.
Okutsu T, Suzuki K, Takeuchi Y, Takeuchi T, Yoshizaki G. 2006. Testicular germ cells can colonize sexually undifferentiated embryonic gonad and produce functional eggs in fish. PNAS. 103(8):2725-2729.
Omoto N, Maebayashi M, Mitsuhashi E, Yoshitomi K, Adachi S, Yamauchi K. 2002. Effects of estradiol-17 and 17-methyltestosterone on gonadal sex differentiation in the F2 hybrid sturgeon, the bester. Fish Sci. 68:1047-1054. Pandian TJ. 2013. Endocrine Sex Differentiation in Fish. CRC. New York (US):
CRC Pr. 302 hlm.
Penman DJ, Piferrer F. 2008. Fish gonadogenesis. Part I: genetic and environmental mechanisms of sex determination. Rev Fish Sci. 16(S1):16-34.
Phelps RP, Okoko M. 2011. A non‐paradoxical dose response to
17α‐methyltestosterone by Nile tilapia (Oreochromis niloticus L.): effects on the sex ratio, growth and gonadal development. Aqua Res. 42:549-558. Piferrer F, Guiguen Y. 2008. Fish gonadogenesis. Part II: Molecular biology and
genomics of sex differentiation. Rev Fish Sci. 16(S1):35-55.
Piferrer F. 2001. Endocrine sex control strategies for the feminization of teleost fish. Aquaculture 197:229-281.
Piferrer F. 2011. Endocrine control of sex differentiation in fish. Di dalam: Farrell AP, editor. Encyclopedia of Fish Physiology, From Genome to Environment. Volume 2. Gas Exchange, Internal Homeostatis, and Food Uptake. San Diego (US): Academic Pr. hlm 1490-1499.
Pongthana N, Niroth M, Kanchit W. 1998. Sex control in climbing perch(Anabas testudineus Bloch,1972). FAO Technical paper 20. Rome (IT): FAO.
Rivero-Wendt CL, Miranda-Vilela AL, Ferreira MF, Borges AM, Grisolia CK. 2013. Cytogenetic toxicity and gonadal effects of 17 α-methyltestosterone in Astyanax bimaculatus (Characidae) and Oreochromis niloticus (Cichlidae). Genet Mol Res. 12(3): 3862-3870.
Rodgers LJ, Saoud PI, Rouse DB. 2006. The effects of monosex culture and stocking density on survival, growth and yield of redclaw crayfish (Cherax quadricarinatus) in earthen ponds. Aquaculture. 259:164-168.
24 Sakai F, Kobayashi T, Matsuda M, Nagahama Y. 2008. Stability in aromatase immunoreactivity of steroid-producing cells during early development of XX gonads of the Nile tilapia (Oreochromis niloticus): an organ culture study: short communication. Zool Sci. 25(3):344-348.
Siddik MAB, Khan MMR, Hasan M. 2007. Evaluation of different diets on the growth of normal and monosex GIFT tilapia (Oreochromis niloticus L.) in Bangladesh. J Bangla Agri Univ. 5(2):377-384.
Siegfried KR, Nüsslein-Volhard C. 2008. Germ line control of female sex determination in zebrafish. Dev Biol. 324:277-287.
Silva CF, Zarazua GMS, Pacheco IT, Rangel AF. 2012. Male tilapia production techniques: A mini-review. Afr J Biotechnol. 12(36):5496-5502.
Tong SK, Hsu HJ, Chung BC. 2010. Zebrafish monosex population reveals female dominance in sex determination and earliest events of gonad differentiation. Dev Biol. 344:849-856.
Tzchori I, Zak T, Sachs O. 2004. Masculinization of genetic females of the common carp (Cyprinus carpio L.) by dietary administration of an aromatase inhibitor. Israeli J Aqua. 56(4):239-246
www.fishbase.org. List of Fish Occurrence Records for Indonesia. [diakses 2014 Juni 10]; tersedia pada: http://www.fishbase.org/country/ Species OccurrenceList.php? requesttimeout=999999&vc_code=360. [10 Juni 2014].
Yön ND, Akbulut C. 2015. Identification of primordial germ cells: cytological, histological and immunohistochemical aspects. Braz. Arch. Biol. Technol. 58(2):22-228.
25
LAMPIRAN
Lampiran 1 Prosedur preparasi histologi menggunakan pewarna
haematoxyline-eosine
1. Fiksasi
Gonad diambil dan dicuci dengan NaCl fisiologis 0,65%, difiksasi ke dalam larutan BNF (Buffered Neutral Formalin) 10% selama 24 jam lalu dicuci dengan alkohol 70% sampai warna kuning pada gonad hilang. Gonad dapat disimpan dalam larutan alkohol 70% untuk beberapa waktu lamanya sebelum proses dehidrasi.
2. Dehidrasi
Organ direndam dalam larutan alkohol bertingkat (80%, 85%, 90% dan 95%) masing-masing selama 2 jam dan dipindahkan ke dalam alkohol 100% sebanyak 4 kali masing-masing selama 1 jam
3. Clearing
Organ direndam dalam alkohol 100% + xylol (1:1), kemudian ke dalam xylol I, II, dan III masing-masing selama 45 menit.
4. Infiltring
Organ direndam dalam xylol + parafin (1:1) selama 45 menit pada suhu 60 C kemudian direndam ke dalam parafin I, II, dan III masing-masing selama 45 menit.
5. Embedding
Organ direndam ke dalam balok parafin cair pada suhu 60 C sampai parafin mengeras selama 24 jam.
6. Pemotongan
Spesimen dipotong setebal 5 mikron dengan menggunakan mikrotom, ditempelkan pada gelas obyek yang telah ditetesi ewid, direnggangkan di atas pemanas dan dikeringkan selama 24 jam pada suhu 45 C
7. Deparafinasi
Preparat direndam berturut-turut pada larutan xylol I, xylol II, alkohol 100% I, 100% II, 95%, 90%, 85%, 80%, 70%, dan 50%, untuk masing-masing preparat selama 2 menit dan dicuci sampai berwarna putih.
8. Pewarnaan
Preparat direndam dalam larutan haematoxyline selama 2 menit, dicuci dengan air keran mengalir, direndam dalam larutan eosine selama 2 menit dan di cuci kembali dengan air mengalir.
9. Dehidrasi
Preparat direndam berturut-turut di dalam alkohol 70%, 80%, 85%, 90%, 95% I, 95% II, 100% I, dan 100% II masing-masing selama 1 menit. 10. Clearing
Preparat direndam ke dalam xylol I dan xylol II masing-masing selama 1 menit.
11. Penutupan dengan kaca penutup
26 Lampiran 2 Prosedur preparasi histologi menggunakan pewarna
asetokarmin
1. Pembuatan larutan asetokarmin
Larutan asetokarmin dibuat dengan melarutkan 0,6 g bubuk karmin dalam 100 ml asam asetat. Selanjutnya larutan dipanaskan selama 2-4 menit, kemudian didinginkan dan disaring menggunakan kertas saring untuk memisahkan partikel kasarnya.
2. Pembedahan gonad ikan uji
Ikan dibedah dan diambil gonadnya 3. Penghancuran gonad
Gonad diletakkan di atas gelas obyek, kemudian dihancurkan dengan cara dicacah hingga lembut.
27
RIWAYAT HIDUP
Penulis dilahirkan di Lampung Tengah pada tanggal 11 Februari 1981 sebagai anak sulung dari pasangan Hazmi Al Askhan dan Titiek Hidayati, yang dalam masa pendidikannya diasuh oleh Abdul Fatah dan Siti Mangisah sebagai wali di Klaten, Jawa Tengah. Dalam pengasuhan wali, penulis menamatkan pendidikan di SMU Muhammadiyah I Klaten pada tahun 1999. Pada tahun yang sama, penulis diterima di Program Studi Fisika Fakultas Matematika dan Ilmu Pengetahuan Alam pada Universitas Negeri Yogyakarta, namun mengundurkan diri pada tahun 2000, dan mulai menjalani pendidikan sarjana di Program Studi Budidaya Perikanan Jurusan Perikanan Fakultas Pertanian pada Universitas Gadjah Mada Yogyakarta hingga tahun 2005.
Penulis bekerja sebagai Pegawai Negeri Sipil Pusat pada Direktorat Jenderal Perikanan Budidaya, Kementerian Kelautan dan Perikanan sejak Januari 2008 hingga sekarang, dengan penempatan tugas kerja di Balai Perikanan Budidaya Air Tawar (BPBAT) Mandiangin, Kalimantan Selatan. Penulis ikut dalam tim pengembangan budidaya ikan papuyu dan rilis domestikasi ikan papuyu varietas hijau Kalimantan Selatan yang telah diresmikan oleh Menteri Kelautan dan Perikanan pada tahun 2014. Sejak tahun 2009, penulis menjabat sebagai Pengawas Pembudidayaan Ikan di BPBAT Mandiangin hingga diberhentikan sementara dari jabatannya pada tahun 2013 untuk melanjutkan pendidikan di program studi Ilmu Akuakultur pada Sekolah Pascasarjana Institut Pertanian Bogor. Pendidikan pascasarjana tersebut dibiayai oleh Badan Pengembangan Sumberdaya Manusia Perikanan dan Kelautan, Kementerian Kelautan dan Perikanan Republik Indonesia.