SIMULASI MOLECULAR DOCKING SENYAWA KURKUMIN DAN ANALOGNYA SEBAGAI SELECTIVE ANDROGEN RECEPTOR
MODULATORS (SARMs) PADA KANKER PROSTAT
ARWANSYAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Simulasi Molecular Docking Senyawa Kurkumin Dan Analognya Sebagai Selective Androgen Receptor Modulators (SARMs) Pada Kanker Prostat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
ARWANSYAH. Simulasi Molecular Docking Senyawa Kurkumin Dan Analognya Sebagai Selective Androgen Receptor Modulators (SARMs) Pada Kanker Prostat. Dibimbing oleh Laksmi Ambarsari dan Tony Ibnu Sumaryada.
Kanker menempati peringkat tertinggi sebagai penyebab kematian di negara berkembang. Kanker disebabkan oleh beberapa faktor seperti faktor lingkungan, infeksi, makanan, bahan kimia, ketidakseimbangan metabolisme dan radiasi sinar ultraviolet. Berbagai upaya telah dilakukan untuk mengobati kanker khususnya kanker prostat yaitu dengan cara pembedahan, radioterapi, dan kemoterapi yang bertujuan untuk menghambat maupun merusak perkembangan sel-sel kanker prostat. Namun pengobatan dengan cara tersebut jika tidak ditangani dengan tepat akan merusak sel-sel normal yang ada disekitar area kanker. Salah satu terapi pengobatan kanker prostat adalah dengan menghambat aktivitas androgen pada reseptor androgen dengan penggunaan bahan bioaktif dari hasil sintesis atau isolasi bahan alam sehingga sel kanker pada prostat tidak berkembang dan akhirnya mengalami kematian sel secara terprogram (apoptosis).
Kurkumin yang dapat diperoleh dari rimpang kunyit maupun temulawak merupakan komponen bioaktif yang telah lama digunakan oleh masyarakat dalam pengobatan berbagai penyakit diantaranya dapat mengobati kanker khususnya kanker prostat. Dalam perkembangannya kurkumin telah banyak mengalami modifikasi agar didapatkan senyawa yang lebih stabil. Kurkumin yang telah dimodifikasi (analog kurkumin) diperkirakan memiliki aktivitas yang sama dengan kurkumin dalam menghibisi interaksi hormon androgen terhadap reseptornya. Potensi analog kurkumin sebagai kandidat obat dalam pengobatan kanker prostat dapat dilakukan secara in silico melalui penambatan molekular
(molecular docking). Keunggulan molecular docking ialah dapat memprediksikan
potensi kandidat obat baru terhadap suatu penyakit dengan biaya efektif dan waktu yang cepat melalui penapisan virtual atau secara komputasi. Analog kurkumin berpotensi sebagai kandidat obat dalam pengobatan kanker prostat jika energi
ikatan (∆G) dari analog kurkumin terhadap reseptor androgen lebih stabil jika dibandingkan dengan ligan pembanding (bikalutamida). Dari hasil molecular docking diperoleh energi ikatan (∆G) dari kurkumin dan analognya yang lebih
stabil jika dibandingkan dengan bikalutamida sehingga kurkumin dan analog yang digunakann memiliki potensi sebagai SARMs terhadap reseptor androgen.
Analog 2 merupakan ligan yang paling stabil jika dibandingkan dengan analog kurkumin lainnya yaitu sebesar -8,4 kkal/mol. Hal tersebut berkaitan erat dengan interaksi antara analog 2 terhadap reseptor androgen pada pembentukan konformasi yang paling stabil. Ikatan hidrogen pada analog 2 melibatkan residu Arg752, Asn705 dan Thr877. Residu-residu tersebut merupakan area penting (bindingsite) pada pengikatan reseptor androgen terhadap ligan alaminya yaitu hormon androgen. Sehingga analog 2 berpotensi paling besar dalam menghambat aktivitas hormon androgen.
SUMMARY
ARWANSYAH. Molecular Docking Simulation of Curcumin and Its Analogs as Selective Androgen Receptor Modulators (SARMs) on Prostate Cancer. Supervised by LAKSMI AMBARSARI and TONY IBNU SUMARYADA.
A cancer has been a highest mortality rate in growing countries. A cancer is caused by some of factors such as bad environments, infection, foods, chemical compounds, misdirection of metabolism, and radiation effect. Many ways to cure a cancer specially prostate cancer which has been done by operation, radiotherapy, and chemotherapy to destroy cancer cells which grow in prostate area. Those of the therapies will destroy the normal cells if the methods is not suitable with procedure standart. One of the therapies to cure a prostate cancer is performanced by inhibiting androgen acitivity to interact with androgen receptor by using bioactive of natural or synthetic compounds to make the prostate cancer cell is death (apoptosis).
Curcumin, the component of hydrophobic pholiphenol from Curcuma longa, has been used by people to cure the disease included a prostate cancer. Curcumin has been explored by modifying its functional groups to get high bioavability, and working in specific target to inhibit androgen-androgen receptor activity. Curcumin and its analogs as the drugs candidate can be predicted by molecular docking which needs an economic cost and efficient time to design a candidate drug by virtual screening (molecular docking)
The potency of test ligands (curcumin and its analogs) as the candidate drugs to cure prostate cancer if as free energy of binding (∆G) of ligan-androgen receptor interaction is more stable than a comparing ligand (bicalutamida). The data of molecular docking results show the curcumin and its analogs are more stable than bicalutamida so that test ligands have the potency as SARMs to androgen receptor. Analog 2 is the most stable of ligands (-8,4 kcal/mol) because it involve the important residues of androgen receptor to make hydrogen bonds namely Arg752, Asn705 dan Thr877. These residues are bindingsite of androgen-resecptor androgen interaction, so that analog 2 is the highest potential of the drug candidate to inhibit androgen activity.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biokimia
SIMULASI MOLECULAR DOCKING SENYAWA KURKUMIN DAN ANALOGNYA SEBAGAI SELECTIVE ANDROGEN RECEPTOR
MODULATORS (SARMs) PADA KANKER PROSTAT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis :Simulasi Molecular Docking Senyawa Kurkumin Dan Analognya Sebagai Selective Androgen Receptor Modulators (SARMs) Pada Kanker Prostat
Nama : Arwansyah NIM : G851120051
Disetujui oleh Komisi Pembimbing
Dr Laksmi Ambarsari, MS Ketua
Dr Tony Ibnu Sumaryada, MSi Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof Dr drh Maria Bintang, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat, berkah, dan karunia-Nya sehingga penulis dapat menyelesaikan tesis ini. Penelitian ini berjudul : Simulasi Docking Senyawa Kurkumin dan Analognya Sebagai Selective Androgen Receptor Modulators (SARMs) Pada Sel Kanker Prostat. Penelitian ini merupakan salah satu persyaratan dalam menyelesaikan studi di Program Pascasarjana Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Dr. Laksmi Ambarsari dan Dr. Tony Ibnu Sumaryada sebagai komisi pembimbing yang banyak memberi bimbingan dan arahan kepada penulis dalam menyelesaikan penelitian dan karya penelitian ini. Terima kasih juga penulis sampaikan kepada seluruh staf Program Studi Biokimia dan semua pihak yang telah ikut membantu dan berkontribusi dalam berbagai hal selama penyelesaian penelitian dan karya ilmiah. Terima kasih pula kepada teman-teman Biokimia atas bantuan dan kebersamaannya, kepada pihak-pihak lainnya yang tidak dapat penulis sebutkan satu persatu. Penulis menyampaikan terima kasih dan rasa hormat setinggi-tingginya kepada orang tua dan keluarga besar tercinta atas doa, pengorbanan, pengertian dan dukungan moril yang tidak ternilai selama ini.
Akhirnya, semoga karya ilmiah ini dapat memberikan manfaat bagi penulis, civitas akademika, peneliti, pemerintah dan semua pihak yang terkait, sehingga mampu memperkaya hasanah keilmuan di masa mendatang.
Bogor, Juni 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 METODE 2
Tempat dan Waktu Penelitian 2
Bahan 2
Alat 2
Prosedur Penelitian 2
3 HASIL DAN PEMBAHASAN 4
Kestabilan Struktur Reseptor Androgen 4
Ligan Yang Memenuhi Aturan Lipinski 6
Hasil Analisis Molecluar Docking Kurkumin dan Analognya 7
4 SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 15
LAMPIRAN 17
DAFTAR TABEL
Halaman
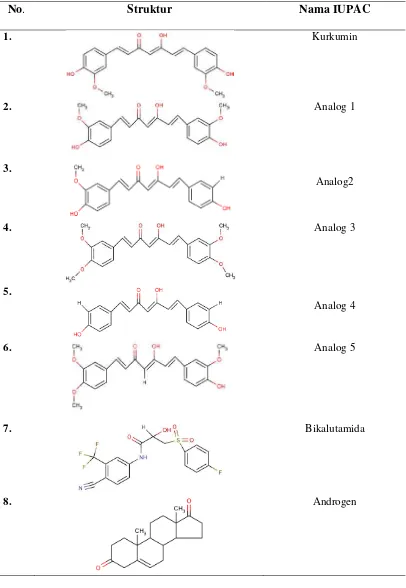
1. Struktur dari bikalutamida, kurkumin dan analognya 3 2. Karakteristik molecular kurkumin dan analognya 7 3. Interaksi yang terjadi di sekitar ligan dengan radius <5Å 13DAFTAR GAMBAR
Halaman
1. Reseptor androgen 4
2. Struktur sekunder reseptor androgen 5
3. Plot ramachandran pada reseptor androgen 6 4. Nilai energi ikatan (∆G) ligan uji dan ligan pembanding 8 5. Interaksi hormon androgen terhadap reseptor androgen
terhadap reseptor androgen 8
6. Visualisasi molecular docking dari interaksi (a) bikalutamida,
(b) analog 2 terhadap reseptor androgen dengan PyMOL 1.3 10 7. Visualisasi molecular docking dari interaksi (a) kurkumin,
(b) analog 5 terhadap reseptor androgen dengan LigPlot+ 1.5.4 11 8. Visualisasi molecular docking dari interaksi analog 1 terhadap
reseptor androgen 12
9. Visualisasi molecular docking dari interaksi (a) analog 3,
(b) analog 4 terhadap reseptor androgen dengan PyMOL 1.3 12
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar Belakang
Kanker adalah penyakit yang ditandai dengan pembelahan sel yang tidak terkendali dan kemampuan sel-sel tersebut untuk menyerang jaringan biologis yang lain (Gaurisankar & Tanya 2008; Zhuang et al. 2008). Ilmu biologi dan kedokteran saat ini sudah mengakui peran berbagai senyawa toksik yang menyebabkan terbentuknya sel kanker pada tubuh makhluk hidup dan perubahan se-sel tersebut menjadi tumor yang lebih ganas (Donaldson 2004).
Kanker yang berkembang di prostat dalam sistem reproduksi lelaki merupakan kanker prostat, hal ini terjadi ketika sel prostat mengalami mutasi dan mulai berkembang di luar kendali (Aggarwal 2008). Pengobatan kanker prostat secara umum dilakukan dengan cara operasi, radioterapi dan kemoterapi (Gan et al. 2009; Pchejetski et al. 2010). Namun pengobatan tersebut memiliki resiko efek samping yang cukup tinggi bagi pasien sehingga perlunya suatu terobosan cara pengobatan kanker prostat dengan efektifitas tinggi dan efek samping yang minimal.
Salah satu upaya pengobatan kanker prostat adalah dengan menghambat aktivitas androgen pada reseptor androgen. Reseptor androgen memiliki peran pada regulasi proses proliferasi sel kanker prostat (Lavery & Bevan 2010). Efek proliferasi ini dapat dihambat dengan pengeblokan reseptor tersebut oleh senyawa yang mampu berkompetisi dengan hormon androgen (Nakamura et al. 2002). Senyawa yang dapat berkompetisi dengan androgen dikenal sebagai Selective Androgen Receptor Modulators (SARMs) (Bhasin and Jasua 2009). Kurkumin secara in vitro terbukti menghambat pertumbuhan sel kanker prostat karena memiliki sifat antiandrogenik (Ohtsu et al. 2002; Deeb et al. 2004).
Kurkumin merupakan polifenol hidrofobik yang berasal dari rimpang tanaman kunyit (Curcuma Longa) (Grynkiewicz & Slifirski 2012). Kurkumin memiliki aktivitas farmakologi yang luas dan secara tradisional telah dimanfaatkan dalam penyembuhan penyakit. Kurkumin menunjukkan aktivitas antioksidan, antikanker, antiinflamasi dan hepatoprotektif (Anand et al. 2008; Shahani et al. 2010).
Kurkumin telah banyak mengalami modifikasi agar didapatkan senyawa yang lebih stabil dan memiliki aktivitas yang lebih spesifik terhadap protein target (Fitriasari et al. 2008). Kurkumin yang telah dimodifikasi (analog kurkumin) diperkirakan memiliki aktivitas yang sama dengan kurkumin dalam menghibisi interaksi hormon androgen terhadap reseptornya.
2
Penelitian ini dirancang untuk mengetahui potensi kurkumin dan analognya sebagai SARMs pada reseptor androgen dengan memperhatikan afinitas dan interaksi ligan ketika terikat pada reseptor androgen (2PIV) melalui teknik molecular docking.
Tujuan Penelitian
Penelitian dengan metode komputasi (in silico) melalui teknik moleculer docking bertujuan untuk memberikan gambaran afinitas dan interaksi kurkumin dan senyawa analognya terhadap reseptor androgen sekaligus mengetahui senyawa mana yang paling potensial sebagai SARMs sebelum dilakukan uji secara in vitro/in vivo.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi tentang senyawa kurkumin dan analognya sebagai antikanker pada kanker prostat secara in silico.
2 METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan pada bulan Juli-Desember 2013 di Laboratorium Komputasi Biofisika, Departemen Fisika, Fakultas MIPA, Institut Pertanian Bogor (IPB), Bogor.
Bahan dan Alat
Bahan yang digunakan dalam simulasi docking teknik in silico ini berupa struktur dua dimensi dari ligan uji analog kurkumin dan ligan pembanding berupa bikalutamida yang dapat di unduh di Pubmed database (PMID: 12408714) (http://www..ncbi.nlm.nih.gov/ pubmed/). Sedangkan makromolekul yang dipilih adalah reseptor androgen (AR) dengan kode 2PIV, dapat diunduh di Protein Data Bank (PDB) (http://www.rscb.org/pdb/). Alat yang digunakan berupa perangkat keras dan perangkat lunak. Perangkat keras terdiri atas komputer dengan spesifikasi RAM (Random Access Memory) delapan gigabyte, Quad Core Processor (Intel CoreI7, Amerika), Graphic Card NVIDIA Ge Force GTS 9400 (Taiwan), dan sistem operasi Microsoft Windows 8 (Amerika). Perangkat lunak berupa LigPlot+ 1.5.4 (Roman Lawkowski), PyMOL 1.3 (Delano Scientific LLC, Italia), AutoDock Vina berbantu AutoDock Tools 1.5.6 (The Scripps Research Institute, Amerika).
Prosedur Penelitian
Preparasi struktur ligan
3 kurkumin dan analognya (PMID: 12408714) dibuat dalam struktur dua dimensi (2D) kemudian ditransformasikan menjadi struktur tiga dimensi (3D) dengan paket program Marvinsketch 6.0 (Tabel 1). Ligan dianggap memiliki potensi bioavabilitas yang tinggi jika memenuhi aturan Lipinski.
Tabel 1 Struktur dari bikalutamida, kurkumin dan analognya
No. Struktur Nama IUPAC
1. Kurkumin
2. Analog 1
3.
Analog2
4. Analog 3
5.
Analog 4
6. Analog 5
7. Bikalutamida
4
Preparasi struktur makromolekul
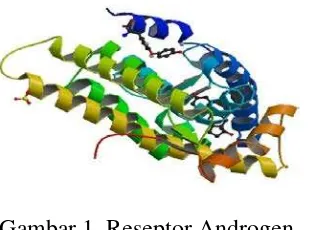
Protein yang digunakan adalah reseptor androgen (kode PDB: 2PIV) yang diperoleh dari database Protein Data Bank (PDB) pada situs http/www/pdbbeta.rscb.org/pdb (Gambar 1). Data tersebut memuat koordinat semua atom residu, faktor struktur kristalografi dan data eksperimen NMR sehingga dapat ditentukan struktur tiga dimensi reseptor androgen.
Gambar 1 Reseptor Androgen
Simulasi docking ligan uji dan ligan pembanding terhadap reseptor androgen
Struktur reseptor androgen (2PIV) dan ligan uji berupa kurkumin dan analognya dan ligan pembanding berupa bikalutamida dalam format *.pdb diubah ke dalam format *.pdbqt melalui program Auto Dock Tools 1.5.6 (Shi et al 2012). Metode docking dilakukan dengan menambatkan setiap ligan pada reseptor androgen dengan koordinat penambatan (Grid Center) x = 21, y = 5, z = 11 Å dan ukuran Grid Box x= 50, y= 24, z= 48 Å. Masing-masing ligan berada pada kondisi fleksibel yang akan berinteraksi dengan biomakromolekul pada kondisi rigid (Kumar et al 2012). AutoDock Vina digunakan pada simulasi docking ligan uji dan ligan pembanding terhadap reseptor androgen. Hasil docking di-scoring dan diperoleh nilai terbaik (ΔG paling negatif) diamati pada area penambatan ligan terhadap reseptor androgen. Area penambatan masing-masing ligan terhadap reseptor androgen dalam format *.pdbqt dikonversi ke dalam format *.pdb melalui program AutoDock Tools 1.5.6. Interaksi berupa ikatan hidrogen, interaksi hidrofobik, dan jarak ikatan dapat divisualisasikan dengan menggunakan LigPLot+ 1.5.4 dan PyMOL 1.3 dengan radius ineteraksi 5Å dari posisi ligan tertambat.
3 HASIL DAN PEMBAHASAN
Kestabilan Struktur Reseptor Androgen
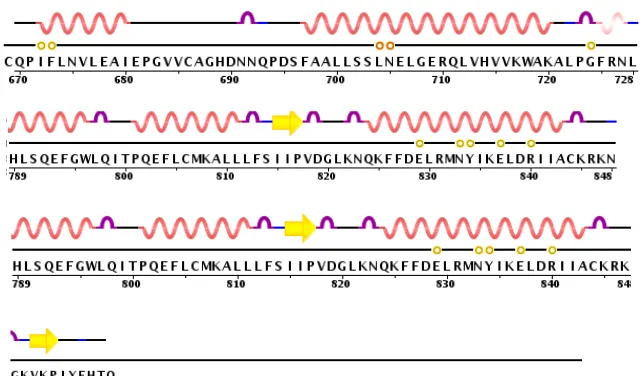
5 Reseptor androgen merupakan protein dari jenis reseptor inti (nuclear receptor) yang aktivitasnya dapat di aktifkan oleh terbentuknya interaksi ikatan dengan hormon androgen. Reseptor androgen dikenal sebagai NR3C4 (nuclear receptor subfamily 3, group C, member 4) yang berfungsi sebagai faktor transkripsi pada regulasi ekspresi gen kususnya perkembangan fenotip seksual pria. Reseptor androgen terdiri dari 249 residu yang membentuk struktur sekunder berupa 2 pasang beta-hairpin, 13 turn, 1 helix-3/10, dan 13 alpha-helix (Gambar 2). Struktur sekunder terbentuk karena adanya ikatan hidrogen antara atom oksigen pada gugus karbonil dengan atom hidrogen pada gugus amida. Dalam proses pelipatan protein keseluruhan struktur sekunder akan membentuk struktur tersier pada protein globular yang distabilkan oleh empat jenis interaksi yag bekerja sama mempertahankan simpul rantai polipeptida pada keadaan suhu, pH dan konsentrasi ion normal. Interaksi tersebut berupa ikatan hidrogen di antara gugus R residu yang berdekatan di dalam rantai, gaya tarik ionik di antara gugus R yang bermuatan, Interaksi hidrofobik pada residu nonpolar, dan terbentuknya jembatan kovalen pada residu yang mempunyai gugus sulfida.
Gambar 2 Struktur sekunder reseptor androgen Keterangan:
= Beta hairpin = Turn
= Alfa heliks = 3/10-heliks
6
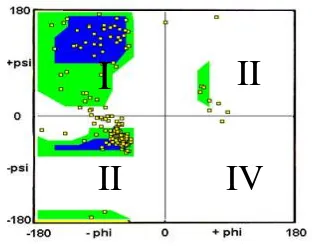
Kombinasi sudut dihedral tersebut dapat diinterpretasikan dengan membuat diagram ramachandran (Gambar 3).
Gambar 3 Plot Ramachandran pada reseptor androgen
Plot Ramachandran digunakan dalam visualisasi koordinat tiga dimensi protein yang telah ditentukan melalui eksperimen ke dalam koordinat
internal. Koordinat internal terdiri dari sudut dihedral Φ (phi) sebagai sumbu x dan sudut ψ (psi) sebagai sumbu y residu asam amino dari struktur protein (Bosco KH & Brasseur R 2005). Plot ini memperlihatkan konformasi yang mungkin dari
sudut Φ dan ψ untuk polipeptida. Kuadran pertama dan kedua pada plot ramachandran terdapat banyak residu dari asam amino yang disebabkan oleh rendahnya efek sterik pada konformasi dari asam-asam amino yang membentuk
struktur heliks dan β-Sheet pada rantai protein. Sedangkan pada kuadran keempat hanya terdapat asam amino glisin. Hal tersebut disebabkan oleh rantai samping dari residu glisin yang hanya terikat oleh hidrogen, sehingga glisin memiliki efek sterik yang rendah terhadap asam amino yang lain pada struktur protein yang stabil.
Ligan Yang Memenuhi Aturan Lipinski
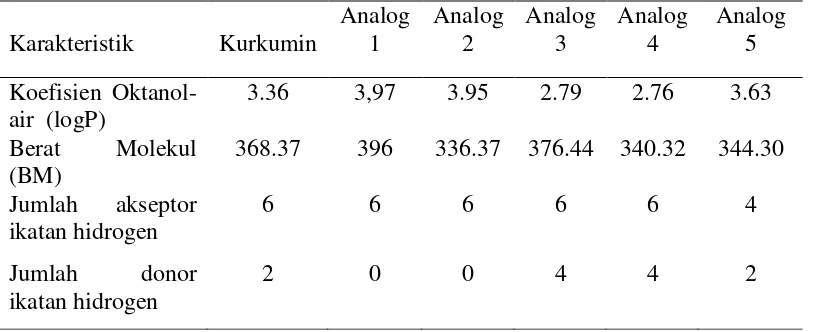
Pemilihan suatu ligan yang digunakan dalam penambatan terhadap protein target dilakukan dengan skrining awal ligan. Ligan dianggap memiliki potensi dapat masuk ke dalam membran sel dan diserap oleh tubuh jika memenuhi aturan Lipinski dengan kriteria: (1) berat molekul <500 gram/mol, (2) jumlah grup donor proton ikatan hidrogen <5, (3) jumlah grup akseptor proton ikatan hidrogen <10, (4) nilai logaritma koefisien partisi dalam air dan 1-oktanol <5 (Lipinksi et al. 2001). Kurkumin dan analog yang digunakan dalam penelitian ini telah diseleksi dengan aturan Lipinski (Tabel 2) sehingga ligan tersebut dianggap memiliki potensi bioavabilitas yang tinggi bagi tubuh. Bioavabilitas merujuk pada kemampuan suatu obat dapat diserap dan beredar dalam tubuh (Veber et al. 2002).
Dalam pengembangan bahan obat menjadi bentuk obat, koefisien partisi harus dipertimbangkan terlebih dahulu. Koefisien partisi (log P) merupakan rasio konsentrasi dari suatu senyawa dari dua campuran yang tidak saling larut dalam pelarut pada keadaan setimbang. Koefisien partisi (P) menggambarkan rasio pendistribusian obat ke dalam pelarut sistem dua fase, yaitu pelarut organik dan air. Ligan uji yang digunakan menunjukkan harga log P <5 (Tabel 2 ) sehingga kurkumin dan analog yang digunakan berpotensi dapat diserap oleh tubuh menuju ke protein target yang diinginkan. Aturan Lipinski juga menyebutkan pentingnya mempertimbangkan ikatan hidrogen yang terjadi antara ligan dan protein.
I
II
7 Menurut aturan Lipinski jumlah grup donor proton ikatan hidrogen <5 dan jumlah grup akseptor proton ikatan hidrogen <10. Hal tersebut berkaitan erat dengan kestabilan konformasi dari protein yang berikatan. Protein diprediksikan akan mengalami perubahan konformasi yang stabil jika terdapat banyak ikatan hidrogen yang terjadi antara ligan (inhibitor) dengan protein yang ditargetkan. Selain itu, proses absorpsi obat perlu dipertimbangkan dalam merancang suatu kandidat obat karena jumlah obat yang dapat di absorpsi berkaitan dengan jumlah obat yang dapat di distribusikan ke area target yang diinginkan. Penyerapan obat ke dalam tubuh membutuhkan proses yang tepat disebabkan obat harus melewati barier absorpsi yang kompleks. Barier absorpsi merupakan epitelium yang berada pada membran sel. Obat yang dirancang agar dapat melewati barier absorpsi diperlukan adanya mekanisme transport. Pada dasarnya obat bergerak secara difusi pasif, yakni pergerakkan obat dari konsentrasi tinggi ke konsentrasi rendah, bersifat spontan, non selektif, bergantung pada konsentarasi dan proses transport akan berhenti jika konsentrasi obat dan area target telah mencapai konsentrasi yang sama. Sehingga dalam memilih suatu kandidat obat perlu dipertimbangkan mengenai berat molekul suatu obat agar dapat berdifusi ke dalam membrane sel. Aturan Lipinski menyatakan berat molekul yang ideal bagi suatu ligan adalah <500 gram/mol agar ligan dapat diserap oleh tubuh. Kurkumin dan analognya memiliki berat molekul <500 gram/mol sehingga ligan uji yang digunakan berpotensi dapat diserap oleh tubuh.
Tabel 2. Karakteristik molecular kurkumin dan analognya
Karakteristik Kurkumin
Hasil Analisis MolecularDocking Kurkumin dan Analognya
8
moleculer docking berupa energi ikatan (ΔG) dan interaksi yang terjadi antara ligan dan protein.
Energi Ikatan (ΔG) Bikalutamida dan Analog Kurkumin
Dari proses docking akan diperoleh energi bebas Gibbs (ΔG) yang
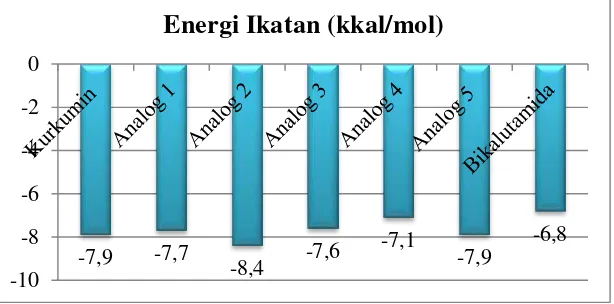
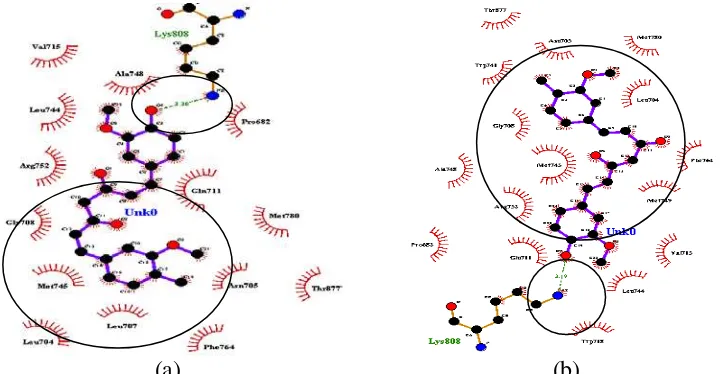
merupakan parameter kestabilan konformasi antara ligan dengan reseptor androgen. Secara termodinamika, interaksi ligan dan protein dapat terjadi apabila kompleks yang dihasilkan memiliki nilai ΔG< 0. Semakin kecil harga energy ikatan (ΔG), ikatan ligan dengan reseptor semakin stabil. Ligan uji yang digunakan berupa kurkumin dan analognya sedangkan yang menjadi ligan pembanding merupakan bikalutamida. Bikalutamida merupakan obat komersil yang digunakan dalam pengobatan kanker prostat karena kemampuannya dalam menghambat aktivitas reseptor androgen (Scher et al. 1997). Selain itu, jika diperhatikan pada tabel 1, kurkumin dan analognya memiliki kemiripan struktur dengan bikalutamida karena terdapat gugus fenil (aromatik) dikedua ligan sehingga struktur ligan akan berpengaruh pada geometri ligan setelah berinteraksi dengan reseptor androgen dalam penentuan keadaan stabil dari masing-masing ligan-reseptor. Hasil molecular docking menunjukkan kurkumin dan analognya memiliki nilai energi ikatan yang lebih rendah dibandingkan energi ikatan pada bikalutamida sebesar -6,8 kkal/mol (Gambar 4), sehingga ligan uji berupa kurkumin dan analognya berpotensi sebagai SARMs bagi aktivitas reseptor androgen dalam pengobatan kanker prostat. Dari kelima analog yang diujikan harga energi ikatan terbaik dimiliki oleh analog 2 (5-Hydroxy-1-(4-hydroxy-3-methoxy-phenyl)-7-(4-hydroxy-phenyl) -hepta-1,4,6-trien-3-one) sebesar -8,4 kkal/mol.
Gambar 4 Nilai energi ikatan (ΔG) ligan uji dan ligan pembanding Interaksi (ikatan hidrogen, interaksi hidrofobik dan interaksi elektrostatik) Analog Kurkumin dan Bikalutamida
9 Ikatan hidrogen pada bikalutamida terhadap reseptor androgen terjadi pada residu Leu704, dan Asn705. Jika dibandingkan dengan kandidat obat yang memiliki energi ikatan yang terendah yaitu analog 2 (
5-Hydroxy-1-(4-hydroxy-3-methoxy-phenyl)-7-(4-hydroxy-phenyl)-hepta-1,4,6-trien-3-one) menunjukkan bahwa ikatan
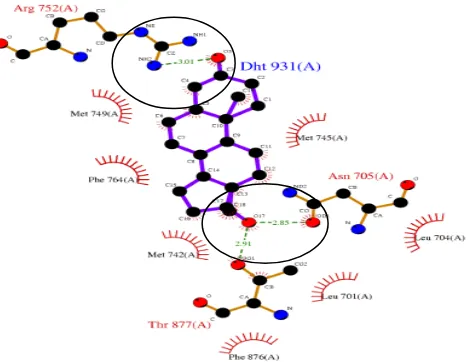
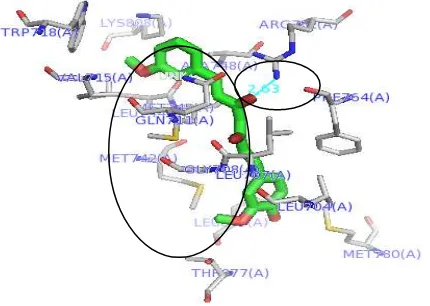
hidrogen terbentuk pada residu Arg752, Asn705 dan Thr877. Penelitian in vitro yang dilakukan oleh perpina et al (2007) menunjukkan bahwa ikatan hidrogen pada ligan alami berupa androgen terhadap reseptor androgen terjadi pada residu Arg752, Asn705, dan Thr877 (Gambar 5).
Gambar 5 Visualisasi interaksi (ikatan hidrogen, interaksi hidrofobik dan interaksi eletrostatik) hormon androgen terhadap reseptor androgen
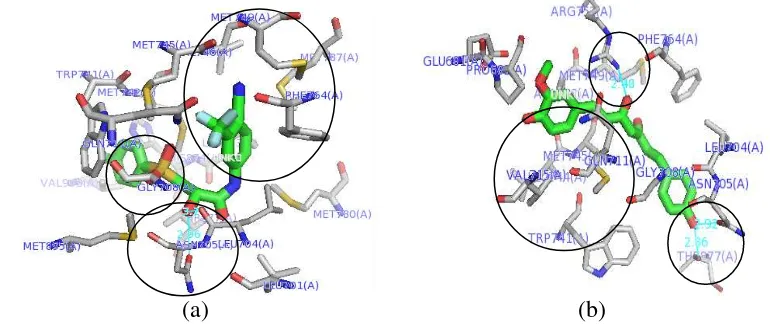
Adanya kesamaan residu yang terlibat pada area bindingsite dari reseptor androgen menyebabkan analog 2 dapat menghambat aktivitas reseptor androgen dengan berkompetisi secara kompetitif (competitive inhibitor) dengan ligan androgen. Sedangkan pada ligan bikalutamida terdapat satu residu yang sama dengan interaksi androgen dengan reseptornya yaitu pada residu Asn705. Adanya pengikatan residu yang sama dengan androgen menyebabkan bikalutamida dapat mengubah konformasi dari reseptor androgen sehingga mencegah terjadinya ikatan antara androgen dengan reseptornya dalam mengaktivasi proses transkripsi mRNA. Selain itu energi ikatan (ΔG) yang dimiliki oleh analog 2 lebih rendah yaitu sebesar -8.4 kkal/mol jika dibandingkan dengan bikalutamida sebesar -6.8 kkal/mol (Gambar 4). Perbedaan nilai energi ikatan (ΔG) pada bikalutamida dengan analog 2 diprediksikan karena adanya perbedaan pengikatan ligan terhadap asam amino pada reseptor androgen (Gambar 6). Residu yang terlibat dalam interaksi ligan-reseptor akan mempengaruhi kestabilam konformasi dari reseptor androgen.
Karakteristik dari residu yang terlibat dalam interaksi juga menentukan kestabilan interaksi ligan-reseptor. Pada analog 2 melibatkan residu Arg752, Asn705, dan Thr877. Residu-residu tersebut merupakan asam amino yang memiliki sifat hidrofilik yang tinggi jika dibandingkan dengan residu Leu704 dan Asn705 pada
bikalutamida sehingga residu yang bersifat hidrofilik akan berinteraksi dengan
ligan-10
reseptor juga berperan penting dalam pengikatan terhadap residu reseptor androgen sehingga modifikasi terhadap gugus fungsi pada kurkumin (analog kurkumin) dapat menentukan stabilitas ligan berinteraksi dengan reseptor androgen. Ikatan hidrogen terbentuk pada gugus hidroksil (-OH3) analog 2 terhadap gugus hidroksil (-OH) dari Asn705 dan Thr705 serta pada gugus hidroksil (-OH1) analog 2 terhadap gugus amina (-NH
2) dari Arg752 pada jarak ikatan sebesar 2,48Å 2,92 Å, dan 2,86Å, sehingga ikatan hidrogen yang terbentuk lebih kuat dalam mempertahankan kestabilan dari konformasi ligan-reseptor jika dibandingkan dengan bikalutamida yang memiliki jarak ikatan sebesar 3,23Å, dan
2,96Å. Interaksi hidrofobik juga berperan dalam menentukan stabilitas ligan
terhadap reseptor androgen. Interakasi hidrofobik merupakan interaksi yang bersifat menghindari lingkungan cair dan cenderung berkelompok di sebelah dalam struktur globular dari protein sehingga meminimalkan interaksi residu nonpolar dengan air (Lins & Brasseur 1995). Pada bikalutamida interaksi hidrobik terhadap ligan terjadi pada area <5Å pada residu Met749, Met745, Val746, Met780, Gly708, Met742, Leu873, Trp741, Val903, Met895 sedangkan analog 2 melibatkan residu Pro682, Ala748, Leu744, Met745, Val715, Gly708, Trp741, Met 749, Phe764, Leu704. Residu yang terlibat pada interaksi hidrofobik merupakan residu dari asam amino yang bersifat nonpolar. Residu asam amino yang bersifat non polar (hidrofobik) cenderung membentuk kelompok (cluster) berupa selimut rantai pada bagian interior protein.
(a) (b)
Gambar 6 Visualisasi molecular docking dari interaksi (ikatan hidrogen, interaksi hidrofobik dan interaksi eletrostatik) (a) bikalutamida, (b) analog 2 terhadap reseptor androgen dengan PyMOL 1.3
11 1990). Hasil molekular docking pada analog 2 menunjukkan residu-residu yang berperan dalam terbentuknya interaksi elektrostatik melibatkan residu-residu yang bermuatan seperti Arg752, Thr877, Asn705, Glu681, Gln711 dan gugus hidroksil (-OH) pada ligan (tabel 3). Selain terjadi pada analog 2, interaksi juga terjadi pada empat ligan lainnya. Jika kita perhatikan pada tabel 2, kurkumin (
5-Hydroxy-1,7-bis-(4-hydroxy-3-methoxy-phenyl)-hepta-1,4,6-trien-3-one) dan analog 5 (
1-(3,4-Dimethoxy-phenyl)-5-hydroxy-7-(4-hydroxy-3-methoxy-phenyl)-hepta-1,4,6-trien-3-one) )memiliki
energi ikatan yang sama yaitu sebesar -7,9 kkal/mol. Ikatan hidrogen pada kedua ligan uji tersebut terjadi pada gugus hidroksil (-OH4) ligan terhadap residu yang sama yaitu gugus amina pada residu Lys808. Asam amino lisin merupakan kelompok asam amino yang memiliki gugus rantai samping yang bermuatan positif dan memiliki sifat hidrofilik yang tinggi jika dibandingkan dengan asam amino yang lain sehingga residu lisin cenderung untuk membentuk ikatan hidrogen dan interaksi elektrostatik dengan ligan ataupun residu yang lain untuk membentuk konformasi yang stabil (Gambar 7). Interaksi elektrostatik melibatkan residu yang bermuatan dan bersifat polar seperti Asn705, Gln711 Leu744, Met745, Arg752 Thr877 , Glu681 pada kurkumin dan analog 5. Interaksi hidrofobik juga berperan dalam menentukan stabilitas kurkumin dan analog 5 terhadap reseptor androgen, dapat kita perhatikan pada tabel 3 bahwa kurkumin pada area <5Å cenderung membentuk interaksi hidrofobik yang melibatkan residu nonpolar seperti residu Pro682, Val715, Leu704, Leu707, Gly708, , Leu744, Met745, Ala748, Phe 764, Met780. Sedangkan pada analog 5 melibatkan residu Leu873, Met895, Leu704, Trp741, Phe764, Leu707, Met745, Leu744, Gln711, Pro682, Ala748, Val715. Residu yang terlibat pada interaksi hidrofobik akan berada pada wilayah interior protein yang akan menjaga kestabilan dari struktur tersier protein.
(a) (b)
Gambar 7 Visualisasi molecular docking dari interaksi (ikatan hydrogen, interaksi hidrofobik dan interaksi elektrostatik) (a) kurkumin, (b) analog 5 terhadap reseptor androgen dengan LigPlot+ 1.5.4
Analog kurkumin berupa analog 1 (
5-Hydroxy-1,7-bis-(4-hydroxy-3-methoxy-phenyl)-hepta-1,4,6-trien-3-one), analog 3 (
1,7-Bis-(3,4-dimethoxy-phenyl)-5hydroxy-hepta-1,4,6-trien-3-one) dan analog 4 (
5-Hydroxy-1,7-bis-(4-hydroxy-phenyl)-hepta-1,4,6 trien-3-one) juga berpotensi sebagai inhibitor bagi aktivitas reseptor androgen
12
bikalutamida yaitu sebesar -7,7 kkal/mol, -7,6 kkal/mol dan -7,8 kkal/mol. Residu yang terlibat pada area penambatan (docking) analog 1, analog 3 dan analog 4 terhadap reseptor androgen ditunjukkan pada tabel 3. Pada analog 1, ikatan hidrogen terjadi pada residu Arg752 terhadap gugus keton (-CO2) pada ligan (Gambar 8). Arg752 merupakan salah satu residu pada pengikatan ligan androgen dengan reseptor androgen sehingga dengan adanya pengikatan terhadap residu Arg752 oleh ligan yang lain maka ligan tersebut dapat menghambat terjadinnya interaksi androgen terhadap reseptor androgen.
Gambar 8 Visualisasi molecular docking dari interaksi (ikatan hidrogen, interaksi hidrofobik dan interaksi eletrostatik) analog 1 terhadap reseptor androgen
Pada analog 3, ikatan hidrogen terjadi pada residu Arg752 dan Thr877 terhadap gugus keton (-CO2) dan metoksi (-OCH
3) pada ligan. Area bindingsite reseptor androgen terhadap ligan androgen melibatkan residu asparagin, arginin dan threonin, pada analog 3 memiliki dua residu yang sama dengan androgen sehingga diprediksikan analog 3 dapat menghambat interaksi antara androgen dengan reseptornya. Sedangkan analog 4, ikatan hidrogen terjadi pada residu Gly683 dan Gln711 yang berikatan dengan gugus hidroksil (-OH3) pada ligan (Gambar 9). residu Gln711 diprediksikan merupakan residu yang terlibat pada area bandingsite karena disetiap interaksi ligan uji melibatkan residu glutamin sehingga dapat menghambat aktivitas reseptor androgen.
13 Gambar 9 Visualisasi molecular docking dari interaksi (ikatan hidrogen, interaksi
hidrofobik dan interaksi eletrostatik) (a) analog 3, (b) analog 4 terhadap reseptor androgen dengan PyMOL 1.3
Modifikasi terhadap gugus fungsi pada kurkumin (analog kurkumin) menghasilkan interaksi ligan-reseptor yang lebih stabil jika dibandingkan dengan bikalutamida. Berdasarkan hasil simulasi docking gugus hidroksil (-OH) pada analog-analog kurkumin diprediksikan gugus penting pada pengikatan dengan reseptor androgen. Pada tabel 3, kurkumin dan analog-analog yang digunakan secara keseluruhan melibatkan gugus hidroksi (-OH) pada pengikatan ligan terhadap reseptor androgen, hal tersebut disebabkan oleh kecenderungan dari gugus-gugus penting ligan yang cenderung untuk berikatan dengan residu yang berperan penting pada area pengikatan ligan (binding site) hingga diperoleh konformasi yang paling stabil. Area binding site merupakan wilayah pengikatan protein terhadap molekul-molekul dan ion-ion (ligan) yang melibatkan residu-residu asam amino yang berperan penting pada pengikatan dengan ligan, sehingga akan terbentuk suatu konformasi stabil dari interaksi ligan-reseptor yang akan mempengaruhi struktur dan fungsi dari reseptor. Interaksi yang terjadi pada ligan terhadap residu asam amino dari reseptor androgen melibatkan beberapa residu asam amino yang selalu muncul disetiap interaksi ligan dan makromolekul. Pada tabel 4 dapat kita lihat bahwa residu Lys808, Leu704, Gln711, selalu muncul disetiap interaksi ligan dan reseptor androgen sehingga residu-residu tersebut diprediksikan berperan penting pada area bindingsite pada reseptor androgen. Tabel 3 Interaksi yang terjadi di sekitar ligan dengan radius <5Å
Senyawa Jarak ikatan hidrogen (Å)
Residu Gugus fungsi
14
Penelitian ini dapat disimpulkan bahwa interaksi yang terjadi antara ligan dan residu-residu asam amino pada reseptor androgen terbentuk sebagai ikatan hidrogen (gugus OH3 dan OH4 pada analog kurkumin), interaksi hidrofobik (Pro682, Ala748, Leu744, Met745, Val715, Gln711, Gly708, Trp741, Met 749, Phe764, Leu704) dan interaksi elektrostatik (Arg752, Glu68, Lys808). Analog-analog kurkumin memiliki konformasi yang stabil (ΔG < -7,0 kkal/mol) jika dibandingkan dengan bikalutamida (ΔG = -6,8 kkal/mol) sehingga analog kurkumin berpotensi sebagai SARMs terhadap reseptor androgen. Berdasrkan harga energi ikatan (ΔG), analog 2 merupakan ligan yang paling stabil (ΔG = -8,4 kkal/mol) dalam menghambat aktivitas reseptor androgen sekaligus memiliki potensi yang paling tinggi sebagai kandidat obat dalam pengobatan kanker prostat.
Saran
15 (kurkumin analog) dapat dikembangkan ke dalam suatu fomulasi obat bagi pengobatan kanker prostat.
DAFTAR PUSTAKA
Aggarwal BB. 2008. Prostate cancer and curcumin. Cancer Biology & Therapy. 7(9): 1436-1440.
Anand P, Thomas SG, Kunnumakkara AB, Sundaram C. 2008. Review bioavability of curcumin : problem and promises. Mol Pharm, 4(6): 807-818. Bosco KH, Brasseur R. 2005. The Ramachandran plots of glycine and pre-proline.
BMC Struc Bio. 5:1-14.
Conney AH. 2003. Enzyme induction and dietary chemicals as approaches to cancer chemoprevention: the seventh dewitt s. goodman lecture. Cancer Res. 63: 7005-7031.
Deeb D, jiang H, Gao X, Hafner MS. 2004. Curcumin sensitizes prostate cancer cells to tumor necrosis factor-related apoptosis-inducing ligand/Apo2L by inhibiting nuclear factor-KB through suppression of IKBA phosphorylation. Mol Cancer Ther. 3(7): 803-812.
Donaldson MS. 2004. Nutrition and cancer: A review of the evidence for an anti-cancer diet. Nut Jour. 3:1-19.
Fitriasari A, Wijayanti NK, Ismiyati N, Dewi D, Kundarto W, Sudarmanto BA, Meiyanto E. 2008. Studi potensi kurkumin dan analognya sebagai Selective
Estrogen Receptor Modulators (SERMs): Docking pada reseptor estrogen β.
Pharmacon. 9(1): 27-32.
Gan L, Chen S, Wang Y. 2009. Inhibition of the androgen receptor as a novel mechanism of taxol chemotherapy in prostate cancer. Cancer Res. 69: 8386-8394.
Gaurisankar S and Tanya D. 2008. Anti cancer effects of curcumin: cycle of life and death. Cell Div. 2008. 3:1-14.
Grynkiewicz & Ślifirski 2012. Curcumin and curcuminoids in quest for medicinal status. Acta Bio Pol. 59(2): 201–212.
Lavery DN, Bevan CL. 2010. Androgen receptor signalling in prostate cancer: the functional consequences of acetylation. Jour Biomed Biotech. 20(11):1-7. Lins L, Brasseur R. 1995. The hydrophobic effect in protein folding. Faseb J. 9:
535-540.
Lipinski CA, Lombardo F, Segawa T, Ko D. 2001. Experimental and computational approaches to estimate solubility and permeability in drug discovey and development setting. Adv Drug Deliv Rev. 46: 3-26.
Nakamura K, Yasunaga Y, Segawa T, Ko D. 2002. Curcumin down-regulates ar gene expression and activation in prostate cancer cell lines. Inter Jou of Oncology. 21: 825-830.
Ohtsu H, Xiao Z, Ishida J, Nagai M. 2002. Antitumor Agents 217. Curcumin analogues as novel androgen receptor antagonists with potential as anti-prostate cancer agents. J. Med. Chem. 45: 5037-5042.
16
Pebriana RB, Romadhan AF, Yunianto A, Rokhman MR. 2008. Docking kurkumin dan senyawa analognya pada reseptor progesteron: studi interaksinya sebagai selective progesterone receptor modulators (SPRMs) Pharmacon. 9(1): 14-20.
Perpina EE, Arnold AA, Baxter D, Webb P. 2007. A surface on the androgen receptor that allosterically regulates coactivator binding. Proc Natl Acad Sci U S A. 104: 16074-16079.
Scher H, Liebertz C, Kelly WK, Mazumdar M. 1997. Bicalutamide for Advanced Prostate Cancer: The Natural Versus Treated History of Disease. Journal of Clinical Oncology. 15(8): 2928-2938.
Shahani K, Swaminathan SK, Freeman D. 2010. injectable sustained release microparticles of curcumin: a new concept for cancer chemoprevention. Cancer res. 70: 4443-4452.
Sharp KA, Honig B. 1990. Electrostatic interactions in macromolecules: theory and applications. Annu Rev Biophys Biophys Chem. 19: 301-322.
Singh R, Chaturvedi N, Singh VK. 2012. In silico study of herbal compounds as novel MAO inhibitors for parkinsons disease treatment. Life Scie Phar Res. 2: 81-98.
17
18
Lampiran 1. Diagram Alir Penelitian Preparasi iigan kurkumin
dan Analognya
Gambar struktur ligan dengan Marvinsketch
Ligan disimpan dengan format PDB
Preparasi Protein Reseptor Androgen
Download protein (http/www/pdbbeta.rscb
Reseptor androgen (kode PDB: 2PIV)
Grid Box pada area ligan dan reseptor androgen
Simulasi molecular docking dengan AutoDock Vina
Hasil Simulasi Docking
Energi Ikatan (ΔG)
Interaksi ligan terhadap reseptor androgen
Visualisasi 2D dengan LigPlot
19
Lampiran 2. Sudut dihedral Phi(φ ) dan Psi(ψ) dari struktur sekunder protein Struktur Sekunder Sudut
Phi(φ)
Sudut Psi(ψ)
Alpha-L 57 47
3-10 Helix -49 -26
µ- Heliks -57 -80
Tipe II-Heliks -79 150
Β-Sheet -120 120
20
Lampiran 3. Prosedur penggunaan autodock vina TAHAP PERSIAPAN a. Protein diunduh pada website rscb.org
Hasil unduhan molekul 3D3L diedit dengan NotePad++ untuk menghilangkan molekul air, ligan, dan senyawa kontaminan lainnya. Selanjutnya disimpan dalam format .pdb
b. Struktur Ligan dibuat dengan Menggunakan MarvinSketch 6.0
Hasil struktur molekul ligan dibuat dalam bentuk 2D dan diubah ke dalam bentuk 3D, kemudian disimpan dalam format .pdb
Hal yang harus diperhatikan sebelum melakukan simulasi docking: 1. File protein disipan dalam format pdb
21 3. Semua file simulasi docking disimpan dalam satu direktori kerja (file
protein, file ligan, dll)
SIMULASI DOCKING
AutoDock Vina merupakan salah satu piranti lunak yang digunakan untuk simulasi docking. Berikut ini adalah cara melakukan metode docking menggunakan AutoDock Vina.
a. Instalasi AutoDock Vina
AutoDock Vina dapat diunduh pada situs www.vina.scripps.edu
AutoDock Vina dapat digunakan dengan beberapa paket program yang perlu diinstal terlebih dahulu, yaitu:
1.Python 2.5 atau yang lebih baru 2.MGL Tools
Adapun urutan instalasinya adalah sebagai berikut: 1.Instal python 2.5
2.Instal MGL Tools 3.Instal Autodock Vina
b. Persiapan Docking dengan MGLTools
1. reseptor androgen disiapakan dengan AutoDock Tools (Program MGL Tools)
22
3. File reseptor dibuka pada lembar kerja sofware
Klik File>Read Molecule>Pilih molekul yang akan dibuka (protein3D3L.pdb)
23 5. Struktur reseptor disimpam ke dalam format .pdbqt
Klik Grid>Macromolecule>Choose
Pada pilihan choose macromolecule klik Protein>Select Molecule.
24
Klik ligan>Open>Pilih file ligan (ligan.pdb). Untuk menyembunyikan visualisasi protein (hanya menampilkan ligan saja), dapat dilakukan dengan tombol hide pada tab PMV Molecules
8. Ikatan ligan diseleksi pada setiap atom yang dapat mengalami rotasi struktur
25
Tipe/definisi ikatan dapat diubah dengan cara meng-klik kiri pada ikatan yang ingin diubah tipenya. Apabila telah sesuai, maka klik done. 9. Struktur ligan disimpa dalam format .pdbqt
26
c. Docking dengan AutoDock Vina
1. file parameter disiapkan sebelum dilakukan simulasi docking
a. File dibuat dengan isi parameter grid di bawah ini dengan menggunakan notepad dan disimpan dengan nama conf.txt
b. Parameter skrip disi sesuai pada preparasi ligan-resptor (sesuai grid box)
receptor = protein.pdbqt ligand = ligand.pdbqt center_x = 2.361 center_y = -3.056 center_z = -3.472 size_x = 70 size_y = 68 size_z = 50
Perhatikan spasi dan tanda titik.
2. Simulasi docking dijalankan pada Command prompt (Windows)/Terminal (Linux). Masuk ke direktori tempat menyimpan seluruh file keperluan docking.
27 3. Hasil Docking dianalisis dengan LigPlot (2D) atau PyMOL (3D)
1. jalankan program LigPlot++ (klik ganda LigPlus.jar)
2. file struktur hasil docking yang telah diubah format ke dalam format pdb di inputkan pada software visualisasi
28