SIMULASI DOCKING SENYAWA KURKUMIN DAN
ANALOGNYA SEBAGAI INHIBITOR ENZIM
12-LIPOKSIGENASE
GITA SYAHPUTRA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis Simulasi Docking Senyawa Kurkumin dan Analognya sebagai Inhibitor Enzim 12-Lipoksigenase adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2014
RINGKASAN
GITA SYAHPUTRA. Simulasi Docking Senyawa Kurkumin dan Analognya sebagai Inhibitor Enzim 12-Lipoksigenase. Dibimbing oleh LAKSMI AMBARSARI dan TONY IBNU SUMARYADA.
Kurkumin adalah metabolit sekunder yang dihasilkan dari tanaman kunyi
(Curcuma longa) dan temulawak (Curcuma xanthorrhiza) dan temulawak yang
dapat dimanfaatkan sebagai terapi inflamasi. Kurkumin dapat menghambat kerja enzim lipoksigenase yang merupakan enzim pendegradasi asam arakidonat yang bertanggung jawab pada efek inflamasi
Interaksi kurkumin dengan enzim 12-lipoksigenase dapat dipelajari melalui simulasi docking. Simulasi docking digunakan dalam mendesain obat secara komputasi. Dalam penelitian ini kurkumin dan analognya diinteraksikan dengan enzim lipoksigenase untuk mendapatkan interaksi yang optimum dengan parameter yang diamati adalah energi bebas Gibbs (∆G) serta ikatan kimia yang
terbentuk.
Dalam penelitian ini menggunakan metode simulasi docking dengan aplikasi AutoDockVina. Ligan yang digunakan adalah kurkumin enol, kurkumin keto, bisdemetoksikurkumin, demetoksikurkumin, analog 1, dan analog 2 sedangkan reseptornya adalah enzim 12-lipoksigenase. Aplikasi lain yang digunakan adalah PyMol, LigPlot, dan VMD untuk persiapan ligan dan reseptor sertaToxTree untuk prediksi toksisitas berdasarkan QSAR.
Hasil yang diperoleh adalah analog 2 memiliki kestabilan yang paling baik dengan nilai ∆G sebesar -8,8 kkal/mol. Analog 2 diprediksi bersifat toksik dan
berpotensi sebagai senyawa karsinogenik. Analog 1 merupakan alternatif senyawa sintetik yang potensial sebagai inhibitor enzim 12-lipksigenase berdasarkan nilai energi bebas Gibbs (∆G) -8,6 kkal/mol, sifat solubilitas, geometri struktur, dan
prediksi toksisitas. Gugus fungsi yang berperan dalam interaksi ligan-reseptor secara umum adalah gugus fungsi OH pada struktur aromatik, dan gugus fungsi CO pada struktur rantai tengah.Berdasarkan analisis interaksi kurkumin dan analognya dapat diketahui bahwa kunyit dan temulawak dapat digunakan sebagai terapi herbal untuk mengurangi efek inflamasi.
SUMMARY
GITA SYAHPUTRA. Docking Simulation of Curcumin and Its Analogs as Inhibitors on 12-Lipoxygenase Enzyme.Supervised by LAKSMI AMBARSARI and TONY IBNU SUMARYADA
Curcumin is a secondary metabolite which produced from Curcuma longa
and Curcuma xanthorrhiza can be used as an inflammatory therapy. Curcumin
can inhibit lipoxygenase enzymes which are arachidonic acid degrading enzymes that are responsible for the inflammatory effects.
Interaction of curcumin with 12-lipoxygenase enzyme can be studied through the docking simulations. Docking simulations used in computational drug design. In this study the docking of curcumin and its analogs with lipoxygenase enzymes is amiedto obtain an optimum interaction with the observed parameters like Gibbs free energy ( G) and the chemical bonds that are formed.
In this research, the docking simulations were performed using AutoDockVina program. Ligans used are enolcurcumin, ketocurcumin, bisdemetoxycurcumin, demetoxycurcumin, analog 1, and analog 2 while 12-lipoxygenase enzyme was used as the receptor. PyMOL, LigPlot, and VMD were used for the data analysis in this research and for toxicity prediction, based QSAR, using AutoDockVina program
The result shows that analog 2 has the best stability with G of -8.8 kcal / mole. However, analog 2 predicted to be toxic because of potentially carcinogenic compounds. Analog 1 has shown potential to become an alternative modification compound as inhibitor of the enzyme 12-lipksigenase based on the value of the Gibbs free energy ( G) -8.6 kcal / mol, solubility properties, geometry structure, and toxicity prediction. Functional groups that play a role in ligand-receptor interactions in general is OH in aromatic structures, and CO in the middle of the chain structure. Based on the analysis of the interaction of curcumin and its analogs, Curcuma longa and Curcuma xanthorriza can be used as a herbal therapy to reduce the effects of inflammation.
©Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
SIMULASI DOCKING SENYAWA KURKUMIN DAN
ANALOGNYA SEBAGAI INHIBITOR ENZIM
12-LIPOKSIGENASE
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2014
Disetujui oleh Komisi Pembimbing
Dr. Laksmi Ambarsari, M.S Dr. Tony Ibnu Sumaryada, M.Si Ketua Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof. Dr. drh. Maria Bintang, M.S
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MSc. Agr
Tanggal Ujian:14 Mei 2014 Tanggal Lulus :
Judul Tesis : Simulasi Docking Senyawa Kurkumin dan Analognya sebagai Inhibitor Enzim 12-Lipoksigenase
Nama : Gita Syahputra
PRAKATA
Puji dan syukur penulis ucapkan kehadirat Allah subhanahuwata’ala atas rahmat dan karunia-Nya sehingga penulisan tesis ini dapat diselesaikan. Tesis ini disusun sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program studi Biokimia Sekolah Pascasarjana, Institut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan terima kasih yang sebesar-besarnya kepada :
1. Dr. Laksmi Ambarsari, M.S dan Dr. Tony Ibnu Sumaryada, M.Si selaku dosen pembimbing yang telah banyak memberikan ilmu, arahan, bimbingan, waktu, saran, dan masukan kepada penulis dalam penulisan tesis.
2. Dr. I Made Artika, M.App.Sc selaku dosen penguji luar komisi atas masukan dan saran bagi penulisan tesis ini.
3. Ibunda Anggarsih Tyas Utami dan ayahanda Gatot Mulyanto, atas segala doa, perhatian, cinta kasih, motivasi, dan dukungan yang selama ini senantiasa mengalir tak henti-hentinya kepada penulis.
4. Hari Fitriansyah dan Syahfarhan Pahlevi, kakak dan adik tersayang atas segala doa dan dukungannya kepada penulis
5. Keluarga Bude Sri Wuryani atas segala doa, dukungan, dan motivasi kepada penulis
6. Rekan seperjuangan di S2 Biokimia 2012 yang selalu menyemangati satu sama lain.
7. Pihak yang tidak dapat dituliskan satu per satu, terimakasih atas kerjasamanya.
Bogor, Mei 2014
DAFTAR ISI
Waktu dan Lokasi Penelitian 4
Alat dan Bahan 4
Ikatan Kimia Residu dengan Kurkumin Enol, Bisdemetoksikurkumin, dan Demetoksikurkumin 20
2 Energi bebas Gibbs (∆G) hasil docking 14
3 Ikatan hidrogen dan interaksi asam amino 22
4 Prediksi toksisitas ligan 24
DAFTAR GAMBAR
1 Struktur 5-lipoksigenase, 12-lipoksigenase, 15-lipoksigenase, dan
molekul 3D3L 7
2 Struktur sekunder enzim 12-lipoksigenase 8
3 Plot Ramachandran dari enzim 12-lipoksigenase 9
4 Struktur kurkumin keto, kurkumin enol, bisdemetoksikurkumin,
demetoksikurkumin 10
5 Struktur analog 1 dan analog 2 beserta gugus fungsi yang diganti dan
atau ditambahkan 11
6 Struktur asam kaffeat, etodolak, dan asam arakidonat 11 7 Interaksi dua dan tiga dimensi antara analog 2 dengan reseptor 16 8 Interaksi dua dan tiga dimensi antara asam arakidonat dengan
reseptor 17
9 Interaksi dua dan tiga dimensi antara etodolak dengan reseptor 18 10 Interaksi dua dan tiga dimensi antara asam kaffeat dengan reseptor 19 11 Interaksi dua dan tiga dimensi antara analog 1 dengan reseptor 19 12 Interaksi dua dan tiga dimensi antara kurkumin keto dengan reseptor 20 13 Interaksi dua dan tiga dimensi antara kurkumin enol dengan reseptor 21 14 Interaksi dua dan tiga dimensi antara bisdemetoksikurkumin dengan
reseptor 21
15 Interaksi dua dan tiga dimensi antara demetoksikurkumin dengan
reseptor 22
16 Struktur kurkumin enol, bisdemetoksikurkumin, dan demetoksikurkumin dengan gugus hidroksi (OH) dan keton (CO)
yang berperan dalam ikatan hidrogen 23
17 Gugus yang berperan dalm sifat karsinogen pada analog 2 25
DAFTAR LAMPIRAN
1 Jenis 20 asam amino 34
2 Kontak residu dengan ligan 35
3 Persiapan ligan dan protein target 36
4 Simulasi docking 40
5 Pengamatan interaksi hasil docking 46
6 Hasil deteksi rotatable bond ligan 47
Latar Belakang
Salah satu cara tubuh untuk mempertahankan diri dari agen patologis adalah dengan melakukan tindakan inflamasi. Ciri-ciri makroskopik dari proses inflamasi yaitu, rubor (merah), tumor (bengkak), dolor (nyeri), kalor (panas), dan penurunan fungsi tubuh. Agen patologis penyebab inflamasi adalah mikroba, benda tajam, suhu, sinar X atau UV, listrik, zat kimia, dan lainnya. Inflamasi yang terjadi terus menerus akan menyebabkan berbagai penyakit hingga terjadinya proliferasi sel kanker (Kumar etal, 2005, Underwood, 2004, Constantinides, 1993)
Siklooksigenase (SOX) dan lipoksigenase (LOX) pada manusia merupakan enzim yang berperan terhadap degradasi asam arakidonat melalui membran fosfolipid. Siklooksigenase mengubah asam arakidonat menuju prostaglandin, sedangkan lipoksigenase mengubah asam arakidonat menjadi asam hidroperoksieikosatetranoat (HPETE) dan menjadi hidroksieikosatetraenoat (HETE) atau menjadi leukotrien. Prostaglandin dan leukotrien merupakan senyawa yang bertanggung jawab pada terjadinya inflamasi. Pengobatan inflamasi yang dilakukan selama ini menggunakan obat jenis NSAID (Non Steroidal
Anti-inflamatory Drugs), tetapi obat tersebut memiliki efek samping pada
gastrointestinal, yaitu dapat menyebabkan iritasi lambung dan pendarahan (Wong et al. 2001).
Terapi herbal merupakan salah satu alternatif pengobatan inflamasi salah satunya menggunakan kurkumin. Kurkumin adalah metabolit sekunder dapat dimanfaatkan sebagai terapi antiinflamasi. Kurkumin dilaporkan dapat menghambat kinerja enzim lipoksigenase (LOX) yang merupakan enzim pendegradasi asam arakidonat. Kurkumin memiliki ketahanan terhadap pH lambung (Kumar et al, 2007, Tanu, et.al, 2002, Wong et.al, 2001, Jankun, et.al. 2000, Jankun et.al. 2006, Huang et.al. 1995, Aggrawal, et.al, 2008). Namun, efek kurkumin terhadap enzim 12-lipoksigenase belum banyak diketahui interaksi kestabilannya. Hal tersebut dapat diketahui secara in silico menggunakan metode simulasi docking.
Kunyit (Curcuma longa)dan temulawak (Curcuma xanthorhiza) merupakan tanaman yang biasa digunakan dan merupakan komoditas bahan alam andalan Indonesia. Kedua tanaman tersebut dilaporkan mengandung senyawa kurkuminoid yang bermanfaat untuk terapi suatu penyakit. Temulawak mengandung turunan kurkuminoid berupa kurkumin dan demetoksikurkumin, adapun pada kunyit mengandung kurkumin, demetoksikurkumin, dan bisdemetoksikurkumin (Kertia & Sudarsono, 2005). Dalam perkembangannya, kurkumin dilaporkan memiliki beberapa manfaat antara lain sebagai antioksidan (Majed, et al. 1995, Rao, et al. 1993), antikanker (Huang, et.al. 1995, Aggrawal,
et.al, 2008, Shisodia, et.al, 2007, Kunnumakkara, et.al, 2008a, Kunnumakkara,
et.al, 2008b), anti-HIV (Mazmuder et.al, 1997, Barthelemy, et.al, 1998, Jagetia,
et.al, 2007), hepatoprotektif dan neproprotektif (Goel, et.al, 2008). Beberapa
2
1999). Kurkuminoid diketahui berpotensi sebagai antiinflamasi (Jankun, et.al. 2000, Jankun et.al. 2006, Huang et.al. 1995, Aggrawal, et.al, 2008).
Berdasarkan hasil analisis struktur kurkumin, secara farmakologi aktivitas kurkumin terdapat pada gugus-gugus fungsionalnya seperti ikatan rangkap pada rantai tengah, gugus gugus β-diketon, dan gugus hidroksi fenolik. Aktifitas antiinflamasi oleh kurkumin terdapat pada gugus fungsi hidroksi fenolik (Mukhopadhyay et.al, 1982). Penelitian mengungkapkan bahwa kurkumin dapat menghambat enzim 12-lipoksigenase pada trombosit manusia. Kurkumin dengan dosis tertentu dapat menekan pembentukan leukotrien. Hasil penelitian menyebutkan bahwa dosis kurkumin 5-10 M berpotensi menghambat metabolisme asam arakidonat sekitar 50% (Huang et.al. 1995)
Penggunaan senyawa analog kurkumin digunakan untuk pengembangan kandidat obatn dengan mencari senyawa yang berpotensi memiliki aktivitas farmakologi yang sama dengan kurkumin. Strategi yang digunakan adalah dengan mencari senyawa baru dengan dua cara, yaitu: (1) modifikasi struktur dan turunan kurkumin serta (2) formulasi. Penelitian hingga kini banyak dilakukan modifikasi analog dan turunan kurkumin, untuk memperoleh senyawa yang lebih potensial, stabil, aman, dan memiliki aktivitas yang lebih spesifik (Ritmaleni dan Ari Simbara, 2010). Modifikasi struktur senyawa kurkumin secara in silico diharapkan dapat menjadi langkah awal desain senyawa obat sebelum dilakukan penelitian secara in vivo dan in vitro. Selain itu, pendekatan secara in silico dapat memberikan keuntungan yaitu menghemat biaya dan waktu penelitian.
Modifikasi struktur molekul berguna untuk mendapatkan struktur yang lebih stabil dalam berinterksi dengan protein target (enzim 12-lipoksigenase). Modifikasi struktur senyawa kurkumin bertujuan untuk mengetahui kandidat obat yang potensial berdasarkan kemampuan interaksinya (interaksi inhibisi) dengan enzim yang berkaitan dengan aktivitasnya. Salah satu modifikasi struktur senyawa kurkumin yaitu Pentagamavunon-0 (PGV-0) (Yuwono, T dan Oetari, R.A, 2004). Adelin (2013) melakukan penelitian dengan memodifikasi struktur kurkumin dan melihat pengaruh inhibisi terhadapat enzim siklooksigenase-2 secara in silico.
Penelitian mengenai interaksi molekular antara 12-lipoksigenase dengan kurkumin, bisdemetoksikurkumin, dan demetoksikurkumin telah dilakukan oleh Utami (2009), Tasbichaty (2010), dengan menganalisis dinamika molekularnya. Akan tetapi, energi bebas Gibbs (∆G) yang didapatkan memiliki nilai ∆G positif, yang menunjukan tidak adanya interaksi antara enzim 12-lipoksigenase dengan kurkumin dan kedua turunan alaminya. Selain itu penelitian lain yang serupa telah dilakukan oleh Edwita (2012), tetapi penelitian tersebut tidak menggambarkan kestabilan interaksi dengan perhitungan energi bebas Gibbs (∆G) dan tidak diketahui residu yang terlibat dengan enzim.
Prediksi toksisitas (QSAR) dari ligan diamati dengan ToxTree. Manfaat penelitian ini dapat digunakan sebagai informasi ilmiah kandidat obat dari bahan aktif senyawa kurkumin dan analognya sebagai inhibitor enzim 12-lipoksigenase.
Perumusan Masalah
Pemanfaatan kurkumin telah dilakukan secara empirik oleh masyarakat tanpa adanya suatu kontrol. Kurkumin tersebut dilaporkan dapat menjadi terapi herbal untuk penyembuhan penyakit. Beberapa penelitian menyebutkan bahwa kurkumin dapat menginhibisi enzim 12-lipoksigenase sehingga dapat mengurangi efek inflamasi. Pemanfaatan kurkumin dan turunannya sebagai terapi herbal suatu penyakit belum diketahui senyawa aktif spesifik yang bertanggung jawab dalam mengurangi efek inflamasi. Melalui teknik in silico, penelitian ini dapat diketahui interaksi antara kurkumin dan analognya sebagai inhibitor enzim 12-lipoksigenase.
Tujuan Penelitian
Tujuan penelitian ini adalah mendapatkan energi bebas Gibbs (∆G) dan interaksi ikatan kimia yang terbentuk antara kurkumin dan analognya terhadap enzim 12-lipoksigenase dengan simulasi docking. Penelitian ini juga menentukan senyawa analog kurkumin terbaik sebagai inhibitor enzim 12-lipoksigenase
2 METODE
Waktu dan Lokasi Penelitian
Penelitian ini dilakukan pada bulan Juli - Desember 2013 di Laboratorium Komputer, Departemen Fisika, Institut Pertanian Bogor (IPB), Bogor, Jawa Barat.
Alat dan Bahan
Penelitian ini dilakukan secara in silico sehingga alat yang digunakan berupa seperangkat peralatan komputer. Bahan pada penelitian in silico tidak menggunakan bahan alami, tetapi menggunakan struktur kimia enzim 12-lipoksigenase, kurkumin dan analognya yang dapat diunduh melalui situs database.
Peralatan yang digunakan dalam penelitian ini dibagi dalam dua kelompok, yaitu piranti keras dan piranti lunak. Piranti keras yang digunakan dalam penelitian memiliki spesifikasi Random Access Memory (RAM) 12GB, prosesor Intel Core i7 3,3 GHz. Perangkat computer tersebut telah dilengkapi piranti lunak Marvin Sketch 6.0, AutoDock Vina, PyMol 1.3, LigPlot ++ 1.4.5, VMD.
Bahan – bahan yang digunakan dalam penelitian ini adalah struktur molekul enzim 12-lipoksigenase, kurkumin enol, kurkumin keto, bisemetoksikurkumin, demetoksikurkumin, serta dua buah analog (analog 1 dan analog 2). Kontrol agonis adalah subtsrat asam arakidonat yang berikatan secara normal dengan enzim 12-lipoksigenase, sedangkan sebagai kontrol antagonis digunakan etodolak dan asam kaffeat. Data struktur kristal 3 dimensi (3D) dari enzim 12-lipoksigenase diunduh dari RSCB PDB (Berman et.al 2000)
Prosedur Penelitian Pencarian struktur reseptor dan ligan
Tahap awal untuk melakukan simulasi docking adalah menentukan reseptor dan ligan yang akan diuji. Reseptor yang digunakan berupa enzim 12-lipoksigenase. Struktur protein target dapat diunduh melalui situs
www.rscb.org/pdb, adapun struktur ligan dapat diperoleh dengan menggambarkan
struktur 2 dimensi (2D) dan 3 dimensi (3D) pada piranti lunak MarvinSketch. Simulasi docking diperlukan struktur 3D dari protein target dan ligan. Sebelum melakukan simulasi docking, data-data struktur molekul dan data lainnya disimpan dalam satu folder pada satu direktori kerja.
Sebelum dilakukan simulasi docking perlu dilakukan analisis sifat bioavaibilitas ligan dengan menggunakan aturan Lipinski (Lipinski, 2007). Protein yang akan dilakukan simulasi docking perlu dilakukan analisis struktur sekunder dan posisi ramachandran dengan menggunakan piranti lunak VMD. Prosedur penelitian lengkap dapat dilihat pada lampiran 3.
Simulasi docking
-Pengaturan grid box -Pendeteksian rotatable bond -Interaksi protein dan ligan
-Mendapatkan energi bebas Gibbs (∆G)
yang akan dilakukan simulasi menggunakan format .pdbqt yang merupakan format untuk molekul yang telah ditambahkan muatan atom. Kalkulasi docking menggunakan algoritma Lamarckian Genetic Algorithm (LGA). Setiap ligan yang disimulasi dilakukan replikasi sebanyak sepuluh kali untuk mendapatkan energi bebas Gibbs (∆G) yang terbaik. Prosedur penelitian lengkap dapat dilihat pada
lampiran 4.
Evaluasi hasil docking
Tahap terakhir adalah evaluasi hasil docking dengan menggunakan piranti lunak Ligplot ++ dan PyMol . Hasil yang didapatkan adalah interaksi antara kurkumin dengan enzim 12-lipoksigenase. Penentuan konformasi protein dengan ligan hasil docking dengan memilih konformasi ligan yang memiliki energi bebas Gibbs (∆G) yang paling rendah. Analisis ikatan hidrogen dan residu kontak antara
ligan dan protein target dapat diamati dengan menggunakan piranti lunak Ligplot ++ dengan format .pdb. Prosedur penelitian lengkap dapat dilihat pada lampiran 5
Diagram Alir Penelitian
-Pencarian struktur kurkumin dan analognya
Ikatan Hidrogen Interaksi Hidrofob
3 HASIL DAN PEMBAHASAN
Docking adalah metode yang digunakan untuk memprediksikan orientasi
antara satu molekul dengan molekul yang lainnya ketika terjadi suatu gaya satu sama lain untuk membentuk suatu ikatan yang stabil (Langauer dan Rarey, 1996). Prinsipnya adalah teknik penempatan ligan ke dalam sisi aktif reseptor yang dilanjutkan dengan evaluasi molekul berdasarkan konformasi struktur dan sifat seperti elektrostatik (Kroemer, 2003). Simulasi docking dapat dipergunakan untuk memperoleh mekanisme kerja suatu senyawa kimia atau makromolekul seperti protein maupun peptida, dalam skala molekuler sehingga dimungkinkan untuk mendesain obat berbasis struktur (Ali et.al, 2007). Kegunaannya adalah pembuatan konformasi ligan-protein. Pada program penambatan, proses pencarian posisi dengan mengkondisikan ligan bersifat fleksibel dan protein bersifat kaku. Setiap posisi dievaluasi berdasarkan bentuk dan karakteristik seperti elektrostatik untuk menemukan posisi yang paling disukai (Okimoto et al. 2009)
Enzim 12-Lipoksigenase (Reseptor)
Tahap awal pada penelitian ini adalah pencarian struktur reseptor dan ligan. Reseptor adalah makromolekul yang digunakan sebagai target spesifik dari penambatan suatu ligan (obat, hormon, neurotransmiter), sedangkan ligan adalah senyawa dengan bobot molekul kecil yang terikat spesifik pada reseptor (Okimoto
et al. 2009). Struktur ligan disiapkan menggunakan piranti lunak MarvinSketch,
sedangkan struktur reseptor diunduh dari Protein Data Bank (PDB) pada website www.rscb/pdb.org. Tahap ini bertujuan untuk mempersiapkan reseptor dan ligan untuk dapat dilakukan simulasi docking.
Protein Data Bank (PDB) adalah arsip dari data struktural makromolekular
biologis yang mencakup lebih dari 32.500 struktur. Data tersebut terdiri atas proyek yang menyumbangkan struktur, pengidentifikasi target, nama protein, organism sumber, status produksi (klon, ekspresi, dan kristalisasi), referensi terkait, serta link untuk proyek terkait. Protein target dapat dicari berdasarkan nama protein, nama pengidentifikasi target, sekuens yang mirip, program, atau organism asal. Hasil yang disimpan dalam format FASTA, .txt, dan .pdb (Kouranov et al. 2006). MarvinSketch merupakan aplikasi untuk menggambar struktur kimia yang dapat menampilkan karakteristik dari struktur tersebut dengan menggunakan menu-menu yang disediakan.
Hasil yang didapatkan pada tahap ini adalah struktur enzim 12-lipoksigenase yang diunduh dari PDB dengan indeks 3D3L, sedangkan ligan yang digunakan adalah kurkumin enol, kurkumin keto, bisdemetoksikurkuimin, demetoksikurkumin, analog 1, dan analog 2 yang strukturnya dirancang melalui Marvin Sketch merujuk pada database NCBI (National Center for Biotechnology
Information).
arachidonate 12-lipoxygenase, 12S-type (CASP Target)). Makromolekul 3D3L adalah struktur enzim 12-lipoksigenase yang berikatan dengan Fe (zat besi). Makromolekul 3D3L terdapat pada sitoplasma sel pada jaringan kulit manusia. Protein 3D3L merupakan monomer dengan dua subunit (gambar 1d), yang tiap subunitnya memiliki 663 residu asam amino. Kristal 3D3L memiliki resolusi 2,6 Å dan menempati volume sebesar 5,9 x 7,0 x 7,8 nm3 (Tresaugues, 2008). Struktur protein 3D3L memiliki dua subunit, tetapi hanya digunakan salah satu subunitnya saja. Hal ini didasarkan pada penelitian Tresaugues (2008), yang melaporkan bahwa kedua subunit memiliki jumlah, urutan asam amino, sifat fisik serta asam amino pengikat ligan yang sama.
(a) (b) (c)
(d)
Gambar 1 Struktur (a) 5- lipoksigenase, (b) 12-lipoksigenase (c) 15-lipoksigenase, dan (d) molekul 3D3L
8
dan air. Penghilangan molekul ligan dan air digunakan untuk mendapatkan struktur sekunder 3D3L dan kemudian disimpan dalam format .pdb (gambar 1b). Struktur dari enzim 12-lipoksigenase yang telah siap untuk dilakukan simulasi
docking (gambar 2)
Struktur sekunder merupakan rantai polipeptida yang membentuk susunan yang ikatan hidrogen teratur di antara ikatan peptida. Struktur α-heliks dan β-sheet terbentuk akibat adanya ikatan hidrogen di dalam atau di luar rantai. Ikatan hidrogen memberikan stabilitas yang tinggi pada α-heliks dan β-sheet (Lehininger, 1982)
Keterangan: : lembaran beta : spiral alfa : putaran
: tidak ada struktur sekunder : spiral phi : spiral 3/10 : belokan
: jembatan beda
Gambar 2 Struktur sekunder enzim 12-lipoksigenase (sumber: www.pdb.org) Hasil pengamatan struktur sekunder (PDB) dapat diketahui bahwa enzim 12-lipoksigenase terdiri atas 44% α-heliks dan 4% β-sheet. Adapun 52% strukturnya merupakan struktur turn dan loop. Turn dan loop merupakan struktur sekunder yang menghubungkan struktur α-heliks dan β-sheet dengan panjang bervariasi dan bentuk tak beraturan (Ngili, 2013). Residu pada enzim 12-lipoksigenase yang dapat membentuk struktur turn maupun loop adalah prolin, treonin, atau serin. Prolin yang memiliki struktur imidazol sedangkan treonin dan serin memiliki struktur alifatik yang fleksibel untuk membentuk struktur loop dan turn. (Ngili, 2013)
Ψ
Φ
Gambar 3 Plot Ramachandran dari enzim 12-lipoksigenase menggunakan VMD Hasil yang didapatkan bahwa plot Ramachandran yang dimiliki oleh enzim 12-lipoksigenase menunjukan bahwa lebih dari 90% residu asam amino terdapat pada daerah hijau atau biru (kuadran I dan III). Adapun residu yang berada di luar wilayah hijau biru (kuadran II dan IV) merupakan asam amino yang memiliki halangan sterik yang besar, sehingga menurunkan jumlah konformasi yang terbentuk, seperti residu Glisin (Gly)..
Sudut phi (Φ) dan psi (Ψ) menggambarkan koordinat tiga dimensi protein. Sudut phi terbentuk sepanjang ikatan N – Cα, sedangkan sudut psi terbentuk sepanjang ikatan Cα – C. Setiap residu asam amino memiliki sudut phi dan psi tertentu untuk membentuk struktur sekunder yang stabil. Asam amino yang berada pada koordinat I stabil pada struktur β-sheet paralel dan antiparalel, adapun koordinat II menggambarkan asam amino yang stabil pada α-helix (tangan kiri). Koordinat III merupakan asam amino yang stabil pada struktur α-helix (tangan kanan), sedangkan koordinat IV merupakan ditempati oleh asam amino dengan halangan sterik yang besar (Ngili, 2013)
Kurkumin dan Analognya (Ligan)
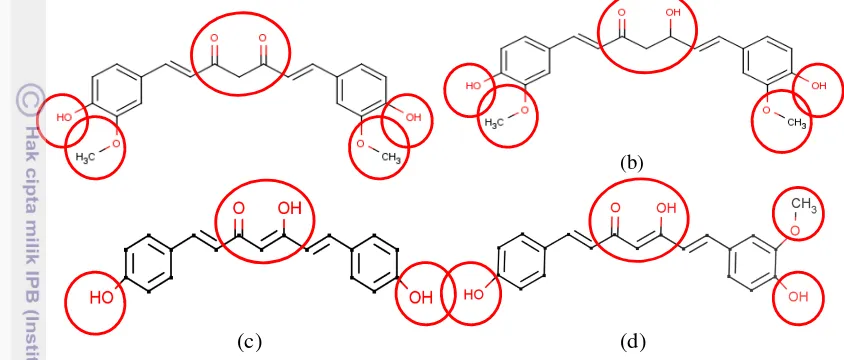
Ligan yang digunakan dalam penelitian ini adalah senyawa kurkumin dan analognya yaitu kurkumin enol dan keto, bisdemetoksikurkumin, demetoksikurkumin, analog 1, dan analog 2. Struktur ligan dapat diketahui dari website www.ncbi.nih.gov/pubmed. Sebelum dilakukan simulasi docking, ligan disiapkan dengan cara menggambar struktur dalam struktur dua dimensi kemudian diubah menjadi tiga dimensi dalam format .pdb menggunakan Marvin Sketch (gambar 4)
Kurkumin dan analognya memiliki struktur dasar yang sama, dengan adanya dua gugus benzena dan rantai alifatik ditengahnya. Kurkumin keto memiliki gugus metoksi (OCH3) dan hidroksi (OH) pada kedua gugus benzena, sedangkan pada rantai tengah adanya gugus diketon (CO) (gambar 4a). Kurkumin enol (gambar 4b) memiliki struktur yang sama dengan kurkumin keto, hanya berbeda pada rantai tengahnya, kurkumin keto menambahkan satu gugus hidroksi (OH) pada gugus diketon (CO) pada kurkumin keto. Struktur bisdemetoksikurkumin
I II
10
dan demetoksikurkumin (gambar 4c dan 4d) memiliki struktur yang hampir mirip, keduanya memiliki gugus hidroksifenolik pada kedua gugus benzena. Rantai tengah kedua struktur tersebut memiliki gugus hidroksi dan keton. Namun pada demetoksikurkumin memiliki perbedaan dengan adanya tambahan gugus metoksi pada salah satu gugus benzena.
(a) (b)
(c) (d)
Gambar 4 Struktur (a) kurkumin keto (b) kurkumin enol (c) bisdemetoksikurkumin (d) demetoksikurkumin
Penggunaan ligan (kurkumin dan analognya) adalah merujuk pada aktifitas farmakologinya sebagai penghambat eznim 12-lipoksigenase. Kurkumin memilik efek farmakologi sebagai antiinflamasi dengan menghanmbat enzim 12-lipoksigenase (Nardo et al. 2009). Penelitian membuktikan bahwa respon imun oleh kurkumin memainkan peranan penting dalam pengobatan inflamasi (Srivastava et al. 2010). Kurkumin memperlihatkan aktivitas antiinflamasi dan antipoliferasi dengan menurunkan oksidatif reaktif (ROS/reactive ocygen species) (Ravindran et al. 2010).
Kurkumin juga dilaporkan dapat menghambat pembentukan sel kanker, seperti kanker prostat, kanker payudara, dan kanker paru-paru (Nie et al. 1998), (Natarajan et al. 1997), (Soriano et al. 1999). Mekanisme antiinflamasi yang terlibat dalam potensi antikanker adalah: (1) penghambatan NF-kB dan COX-2 (peningkatan kadar COX-2 berhubungan dengan jenis kanker) (Surh et.al, 2001., Huang, et.al. 1991) ,(2) penghambatan metabolisme asam arakidonat melalui enzim lipoksigenase dan pengikatan radikal bebas oleh jalur enzimatik ini (Huang, et.al. 1991), (3) penurunan ekspresi inflamasi IL-1b, Il-6, dan TNF-α, yang mengakibatkan hambatan pertumbuhan sel kanker (Cho et.al, 2007), (4) penghambatan regulasi enzim seperti protein kinase C, yang dapat bertindak sebagai agen inflamasi dan proliferasi sel tumor (Liu et.al, 1993).
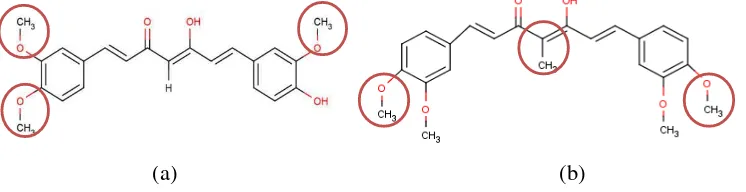
kandidat obat baru. Analog kurkumin yang digunakan dalam penelitian ini dipilih yang memiliki gugus fungsi yang ditambahkan atau diganti dengan gugus hidroksi (-OH) atau metoksi (-OCH3). Gugus fungsi pada analog dengan gugus yang lebih polar memungkinkan adanya interaksi yang lebih baik terhadap residu asam amino enzim 12-lipoksigenase.
(a) (b)
Gambar 5 Struktur (a) analog 1 (b) analog 2 beserta gugus fungsi yang diganti dan atau ditambahkan
Ligan yang digunakan sebagai kontrol dalam penelitian ini merupakan obat antiinflamasi yang telah digunakan yaitu etodolak dan asam kaffeat. Kontrol lainnya merupakan asam arakidonat yang merupakan ligan alami dari enzim 12-lipoksigenase.
(a) (b)
(c)
12
asam arakidonat (gambar 6c) merupakan asam lemak essensial yang tersusun dari 20 atom C dengan empat ikatan rangkap.
Alasan penggunaan asam kafeat dan etodolak merujuk pada struktur dari keduanya yang memiliki cincin siklik yang dimiliki juga oleh kurkumin (gambar 6), asam kafeat dan etodolak dilaporkan menghambat spesifik pada enzim 12-lipoksigenase.
Sifat Ligan Berdasarkan Aturan Lipinski
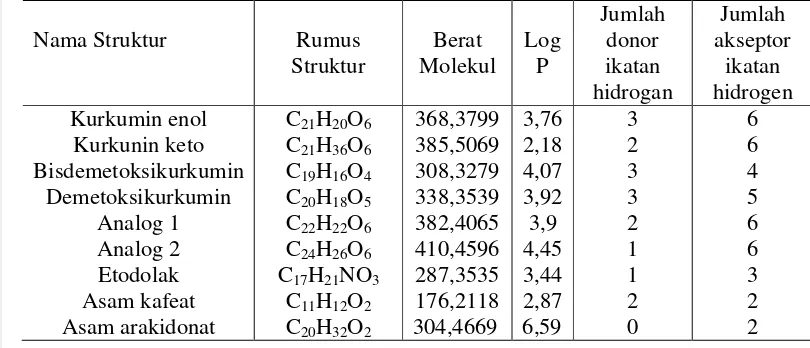
Pemilihan ligan dan analognya serta kontrol yang digunakan dalam penelitian ini selanjutnya dilakukan analisis menggunakan aturan Lipinski. Aturan Lipinski dapat menunjukan tingkat hidrofob/hidrofilitas molekul obat sebelum dilakukan simulasi docking. Aturan Lipinski tersebut adalah (1) berat molekul kurang dari 500 Da (2) logP kurang dari 5, (3) jumlah donor ikatan hidrogen kurang dari 5, dan (4) jumlah akseptor ikatan hidrogen kurang dari 10 (Lipinski
et.al, 1997). Berdasarkan data dari tabel 3 dapat dilihat bahwa kurkumin dan
analognya memiliki berat molekul kurang dari 500 mg/mol, nilai hydrogen bond
donor maupun acceptor, dan nilai log P yang memenuhi kriteria dari Aturan
Lipinski.
Tabel 1 Sifat ligan berdasarkan Aturan Lipinski
Lipinski menggambarkan solubilitas senyawa tertentu untuk menembus membran sel oleh difusi pasif (Lipinski et.al, 1997).
Hasil Analisis Docking
Simulasi docking bertujuan untuk mengetahui orientasi antara kurkumin dan analognya terhadap enzim 12-lipoksigenase untuk membentuk ikatan yang stabil. Adapaun parameter kestabilan yang ditentukan adalah energi bebas Gibbs (∆G) dan interaksi ikatan kimia yang terbentuk. Simulasi docking merupakan pendekatan untuk desain rasional obat menggunakan komputasi untuk menguji aktivitas biologis suatu senyawa. (Giraldo et.al, 2007, Reddy et.al, 2007)
Docking merupakan metode simulasi untuk mengetahui orientasi antara
ligan dengan reseptor. Proses docking terbagi atas dua jenis, yaitu blind docking
dan oriented docking. Blind docking merupakan proses docking yang dilakukan
tanpa mengetahui letak sisi aktif dari reseptor dengan tepat, sedangkan oriented
docking merupakan proses docking yang dilakukan dengan telah mengetahui letak
sisi aktif dari reseptor dengan tepat. Penelitian ini dilakukan dengan proses blind
docking, karena belum mengetahui parameter grid box dari enzim
12-lipoksigenase. Reseptor yang digunakan bersifat rigid sedangkan ligan besifat fleksibel. (Giraldo et.al, 2007, Reddy et.al, 2007)
AutoDock Vina adalah salah satu piranti lunak docking, dirancang untuk
memprediksikan bagaimana molekul-molekul kecil seperti substrat atau inhibitor terikat pada reseptor dalam bentuk struktur 3D. Pada dasarnya, AutoDock Vina terdiri dari dua program utama, yaitu AutoDock yang membantu proses docking dari ligand ke sekumpulan grids yang mendiskripsikan protein yang dituju,
AutoGrid yang membantu perhitungan grids tersebut. Hal ini dapat digunakan
sebagai pedoman dalam perancangan struktur kimia agar diperoleh ikatan yang lebih baik lagi. Bahan yang telah siap dipreparasi dengan parameter AutoGrid, kemudian dilakukan validasi menggunakan kontrol. Setelah itu, dilakukan penambatan dan dilakukan analisis visual dengan piranti lunak tertentu (Lindstrom, et. al. 2008, O. Troot dan A.J Olson, 2010)
Proses docking pada AutoDock Vina menggunakan algoritma Lamarckian
Genetic Algorithm (LGA). Algoritma tersebut merupakan penggabungan antara
algoritma Local Search dan Genetic Algorithm. Nilai energi hasil docking dipengaruhi oleh search run, yang merupakan pengulangan yang dilakukan dalam proses docking (Samira, 2009). Penelitan ini dilakukan pengulangan sebanyak 10 kali dalam sekali docking, sehingga akan dihasilan 10 pose pada ligan untuk mendapatkan energi bebas Gibbs (∆G) terbaik (Lampiran 7)
14
berotasi bebas untuk mencari tempat paling stabil pada reseptor (Samira, 2009). Koordinat grid box yang digunakan adalah x=-0,722, y=-4,000 dan z=-6,889
Energi Bebas Gibbs (∆G) Reseptor dengan Ligan
Simulasi docking pada penelitian ini dilakukan dalam kondisi ligan fleksibel. Kondisi fleksibel digunakan untuk penyesuaian struktur ligan yang paling stabil berinteraksi dengan reseptor. Parameter kestabilan yang diamati adalah energi bebas Gibbs (∆G). Semakin negatif nilai ∆G menunjukan tingkat kestabilan yang baik antara ligan dan reseptor, sehingga ikatan yang terbentuk akan semkain kuat. Tabel 2 menunjukan energi bebas Gibbs (∆G) hasil simulasi docking. Hasil simulasi docking berdasarkan nilai ∆G menyatakan kurkumin dan analognya memiliki kestabilan yang baik.
Hasil simulasi docking yang dilakukan sebanyak 10 kali memiliki 10 pose hasil docking yang memiliki energi ikatan masing-masing. Analog 2 memiliki kestabilan yang paling baik merujuk dari nilai ∆G (-8,8 kkal/mol). Kurkumin dan analognya memiliki nilai ∆G lebih rendah dari asam arakidonat yang merupakan ligan alami dari enzim 12-lipoksigenase (tabel 2) Hal ini menyatakan bahwa kurkumin dan analognya memiliki kestabilan yang lebih baik dibanding ligan alami (asam arakidonat). Kurkumin dan analognya dilaporkan menunjukan aktivitas antiinflamasi dengan menghambat metabolisme asam arakidonat melalui enzim lipoksigenase dan menghambat radikal bebas pada jalur enzimatik tersebbut (Huang et.al, 1991) Asam arakidonat akan menghasilkan leukotrien akibat reaksi enzimatik oleh enzim 12-lipoksigenase sehingga dapat terjadinya inflamasi. Senyawa kurkumin dan analognya dilaporkan dapat menghambat pembentukan leukotrien sehingga menghambat terjadinya inflamasi (Wong et.a, 200l) Sedangkan, etodolak dan asam kafeat memiliki nilai (∆G) yang lebih tinggi dari pada senyawa kurkumin dan analognya. Hal ini dapat diartikan bahwa senyawa kurkumin dan analognya dapat berikatan lebih stabil terhadap reseptor enzim 12-lipoksigenase. Senyawa kurkumin dan analognya diprediksi memiliki aktivitas inhibitor terhadap enzim 12-lipoksigenase.
Beberapa penelitian mengenai nilai ∆G dari interaksi kurkumin dengan beberapa protein telah dilakukan. Penelitian Zukhrullah, et.al (2012) menyatakan bahwa interaksi kurkumin dengan siklooksigenase-2 menghasilkan nilai ∆G sebesar -6,51 kkal/mol. Putra, et.al (2008) melaporkan nilai ∆G kurkumin dengan reseptor estrogen alfa sebesar -11, 17 kkal/mol. Hal ini dapat dinyatakan bahwa nilai interaksi kurkumin dengan enzim 12-lipoksigenase termasuk stabil dan baik. Tabel 2 Energi bebas Gibbs (∆G) hasil docking
No. Nama Senyawa Energi Bebas Gibbs (∆G (kkal/mol))
1 Kurkumin enol -8,4
2 Kurkumin keto -8,3
3 Bisdemetoksikurkumin -7,8
4 Demetoksikurkumin -7,3
Ikatan Kimia Residu dengan Ligan
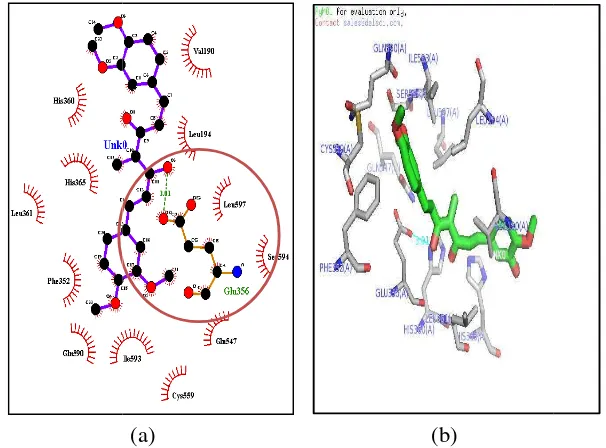
Pengamatan interaksi residu (asam amino) bertujuan untuk mengidentifikasikan interaksi yang terjadi antara ligan dan reseptor. Ikatan hidrogen meruapakan interaksi yang dapat menstabilkan ikatan ligan dengan reseptor. Interaksi lain antara ligan dan reseptor yang dapat meningkatkan kestabilan konformasi adalah interaksi elektrostatik dan interaksi van der Walls. Pengamatan interaksi residu menggunakan piranti lunak PyMol untuk pengamatan 3D dan LigPlot untuk pengamatan 2D. Garis putus-putus mendeskripsikan ikatan hidrogen yang terjadi antara residu dengan gugus pada ligan.
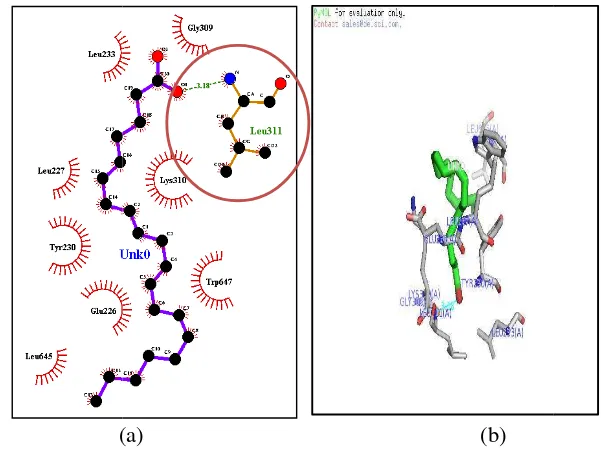
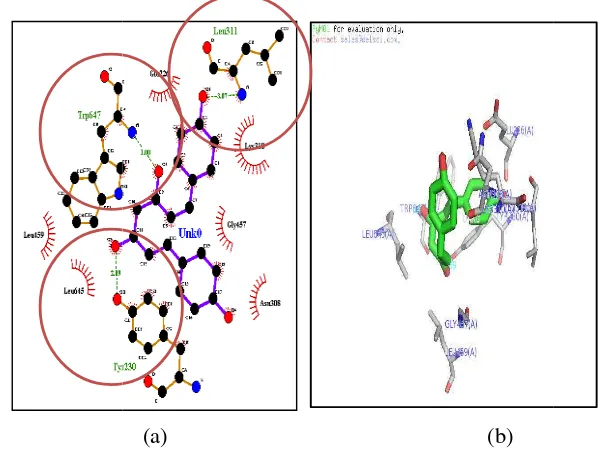
Ikatan Kimia Residu dengan Analog 2
Analog 2 merupakan ligan yang memiliki kestabilan yang baik dengan enzim 12-lipoksigenase dibandingkan dengan ligan lainnya karena memiliki nilai ∆G yang lebih rendah (Tabel 2). Energi yang rendah menunjukan bahwa ligan tersebut stabil ketika berikatan dengan reseptor. Faktor-faktor yang menyebabkan analog 2 dan enzim 12-lipoksigenase memiliki interaksi kestabilan yang baik adalah adanya peran gugus fungsi, ikatan hidrogen (jumlah ikatan hidrogen dan panjang ikatan hidrogen) yang terbentuk, dan daerah interkasi hidrofob. (Giraldo
et.al, 2007, Reddy et.al, 2007)
Residu yang memiliki interaksi baik ikatan hidrogen maupun interaksi hidrofobik adalah Val (190), Leu (194), Leu (597), Ser (594), Glu (356), Gln (547), Cys (559), Ile (593), Gln (590), Phe (352), Leu (361), His (365), His (360). Pengamatan menunjukan adanya ikatan hidrogen yang terjadi antara Glu (356) dengan salah satu gugus keton pada analog 2 dengan jarak 3.01 Ā. Ikatan hidrogen tersebut terjadi dengan cara atom O pada gugus Glu (356) merupakan residu asam amino bermuatan negatif pada gugus karboksil (COO) dengan atom O dari gugus keton (CO) pada analog 2 (gambar 7). Gugus keton cenderung sebagai akseptor pada ikatan hidrogen, karena memiliki kecenderungan kuat untuk menarik elektron. Hal ini sesuai dengan laporan dari Mukhopadhyay et.al. (1982) yang menyatakan bahwa gugus keton merupakan daerah aktivitas farmakologi kurkumin sebagai antiinflamasi.
Adanya residu asam amino hidrofobik seperti Val (190), Leu (194), Leu (597), Leu (361) dan adanya residu Phe (352), Ile (593), Ser (594), merupakan residu yang menjadi target interaksi dengan ligan. Interaksi hidrofobik merupakan interaksi antara gugus nonpolar molekul ligan dan daerah nonpolar reseptor. Interaksi hidrofobik mampu menstabilkan interaksi ligan-reseptor dengan menurunkan nilai ∆G karena interaksi tersebut merupakan paduan antara ikatan-ikatan yang interaksinya lemah seperti ikatan-ikatan van der Waals, dipol-dipol, dan elektrostatik.
Daerah interaksi hidrofobik analog 2 dengan enzim 12-lipoksigenase sesuai dengan Penelitian dari Tasbichaty (2010) yang menyatakan bahwa residu Phe (352), Ile (593), Ser (594), dan Val (418) merupaan residu penting dalam pengkitan dengan ligan. Hal ini dikarenakan nilai RMSF (Root Mean Square
Fluctuation) keempat residu tersebut memiliki fleksibilitas yang rendah. Analog 2
kkal/mol). Selain itu a analog 2 adalah satu bu terlibat dalam ikatan hidr
u adanya ikatan hidrogen menambah stabil ika rapa residu asam amino pada enzim 12-lipoksigena
(a) (b)
raksi dua dimensi (a) dan tiga dimensi (b) antara a ngan reseptor
dengan Asam Arakidonat
miliki kontak adalah Gly (309), Leu (311), Lys u (226), Tyr (230), Leu (227), Leu (233). Hasil pe nya satu ikatan hidrogen antara gugus amina (NH3
proton dengan gugus hidroksi (OH) dari asam (gambar 8). Asam arakidonat merupakan ligan se tetapi tidak terikat stabil pada sisi aktif e arakidonat sebesar -7,1 kkal/mol, apabila diba
nilai ∆G lebih tinggi. Hal ini dapat dilihat dari str memiliki struktur karbon lurus, berbeda denga ki dua struktur aromatik pada strukturnya. Struktur bilan pengikatan antara analog 2 dengan e n itu struktur aromatik yang nonpolar pada anolog
pada enzim 12-lipoksigenase, untuk membentuk dapat dilihat bahwa ada 13 residu asam am k dengan analog 2, berbeda dengan asam arakidon amino. Konformasi stabil asam arakidonat tid u hidrofob penarik ligan, sehingga kurang stabilny n juga mempengaruhi lebih stabilnya interaksi kidonat. Jumlah ikatan hidrogen pada asam araki
uah. Namun, perbedaanya terjadi antara gugus fung hidrogen dan panjang ikatan hidrogen. Gugus ya
dalam ikatan hidrogen pa atom O dari gugus keton gugus hidroksi (OH). kkal/mol lebih tinggi etodolak berjumlah tiga residu hidrofob lebih se struktur alifatik sehingga lipoksigenase. Fleksibili dimana strukturnya terli memiliki 5 buah lebih s buah.
n pada analog 2 adalah pada gugus karboksil (CO ton (CO) lebih kuat terikat daripada gugus amina . Kekuatan ikatan tersebut mempengaruhi panja
2 panjang ikatan yang terbentuk adalah 3,01 Ā, sebesar 3,18 Ā.
(a) (b) Interaksi dua dimensi (a) dan tiga dimensi (b) ant arakidonat dengan reseptor
dengan Etodolak
miliki kontak adalah Leu (311), Gly (309), Glu ( (647), Tyr (230), Lys (310), Leu (233) (gambar 9) ktif yang biasa digunakan sebagai inhibitor e etodolak dengan enzim 12-lipoksigenase adalah s
dibandingkan dengan analog 2. Ikatan hidroge iga buah yaitu pada kedua atom O1 dan O2 pa
tom O1 memiliki satu ikatan hidrogen dengan n panjang 3,09 Ā , sedangkan atom O2 memiliki da Tyr (230) dengan panjang 3,08 Ā, dan dengan gu
n panjang 2,96 Ā. Etodolak memiliki lebih bany alog 2, tetapi belum mampu membuat nilai ∆G lebi aruhi oleh: (1) Residu hidrofob yang berada di enarik ligan tidak berada di sekeliling etodolak ( h sedikit dari analog 2 (3) struktur etodolak tidak
ngga kurang fleksibel dalam berinteraksi dengan bilitas struktur etodolak dapat dilihat dari penga
rlihat kaku. Berdasarkan jumlah rotatable bond h sedikit dari jumlah rotatable bond analog 2 ber
Gambar 9 I interaksi hidrofob pada (352), Glu (356), Leu Interaksi dua dimensi (a) dan tiga dimensi (b) ant etodolak dengan reseptor
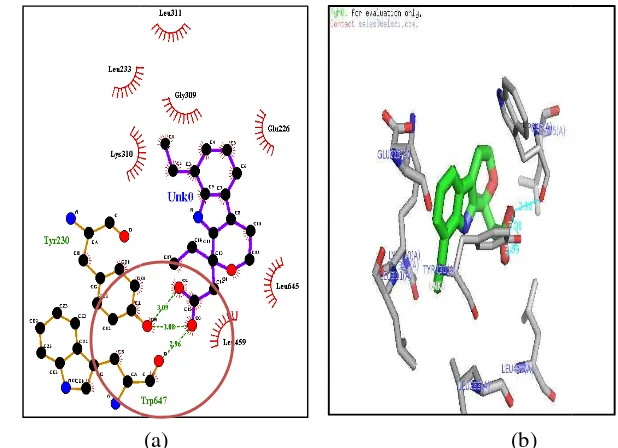
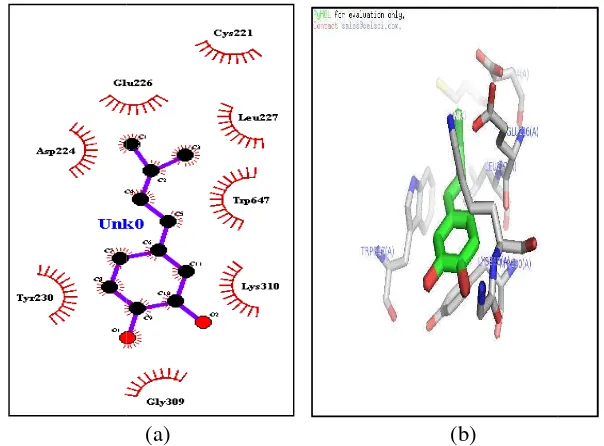
dengan Asam Kafeat, Analog 1, dan Kurkumin
miliki kontak adalah Cys (221), Leu (227), Trp ( (230), Asp (224), Glu (226) (gambar 10). Hasil pe k adanya ikatan hidrogen antara asam kaffeat deng
m 12-lipoksigenase.
kaffeat merupakan yang paling tinggi diantara lig diksi bahwa konformasi terhadap enzim 12-lipoks
ini disebabkan karena secara struktural asam nzene 1,2-diol, inti hidrokarbon relatif rigid, sehingg
tom yang bersifat nukleofilik atau elektrofi hidrogen dengan ligan. Residu asam amino dise merupakan residu pengikat ligan dan residu as hnya hanya delapan buah, sehingga interaksi analog 1 dengan kurkumin keto memiliki p da enam residu yaitu His (365), His (360), Val (
eu (361) (gambar 11 dan 12). Keenam residu nting dalam pengikatan ligan maupun binding n dengan interaksi hidrofob pada asam kaffeat, da analog 1 maupun kurkumin keto. Hal ini dapa
abilan asam kaffeat lebih lemah dibanding analog
Gambar 10
Gambar 11
Pengamatan menun analog 1 dan kurkumin ikatan-ikatan lemah sepe sampai 40 kJ/mol (Com berperan dalam kestabila
(a) (b)
10 Interaksi dua dimensi (a) dan tiga dimensi (b) a asam kaffeat dengan enzim 12 lipoksigenase
(a) (b) r 11 Interaksi dua dimensi (a) dan tiga dimensi (b) analog 1 denganenzim 12 lipoksigenase nunjukan tidak adanya ikatan hidrogen yang terj
in keto. Ikatan kimia yang memungkinkan terja perti ikatan van der Waals, yang memiliki energi ompanion, 1991). Interaksi hidrofoik dengan bany
lan ligan-reseptor.
antara
(b) antara
fleksibilitas yang lebih stabil dengan energi pali dihasilkan sebesar -7,8 bisdemetoksikrukumin m sedangkan ikatan hidrog ketiga ikatan hidrogen te
(a) (b)
12 Interaksi dua dimensi (a) dan tiga dimensi (b) a kurkumin dengan reseptor
bas Gibbs (∆G) yang rendah dari analog 1 (-8,6 to (-8,3 kkal/mol) dari pada asam kafeat dihas an-protein. Struktur ligan analog 1 maupun kurkum kestabilan dikarenakan adanya struktur alifatik yang
bih tinggi sehingga dapat menghasilkan konform paling minimum.
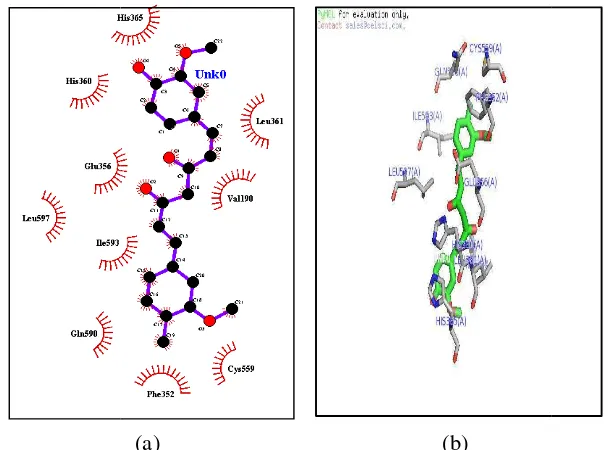
dengan Kurkumin Enol, Bisdemetoksikurkum
ino yang memiliki kontak dengan kurkumin enol k adalah Cys (559), Ile (593), Gln (590), Ser ( (365), Leu (361), Arg (189), Val (190), Leu (597), at tiga ikatan hidrogen yang menyebabkan kurkum
ng kecil yaitu pada gugus hidroksi (OH) pada dua rg (189), masing-masing memiliki jarak 3,17 da h satu faktor yang menentukan kestabilan dari ko n menghasilkan ∆G sebesar -8,4 kkal/mol.
ino yang memiliki kontak dengan bisdemetosi ki kontak adalah Leu (311), Lys (310), Gly (457), A
Leu (459), Trp (647), Glu (226) (gambar 14). Nila 7,8 kkal/mol. Secara umum gugus keto (C n memiliki ikatan hidrogen pada Trp (647) dan
ogen lainnya terjadi pada hidroksi (OH) dengan L tersebut mempengaruhi ikatan antara ligan-resept
Gambar 13
Gambar 14 Berdasarkan intera lipoksigenase, ada sekita asam arakidonat (lampir dari bisdemetoksikurkum
(a) (b) 13 Interaksi dua dimensi (a) dan tiga dimensi (b) a kurkumin enol dengan enzim 12 lipoksigenase
(a) (b) 14 Interaksi dua dimensi (a) dan tiga dimensi (b) a bisdemetoksikurkumin dengan enzim 12 lipoks nteraksi antara bisdemetoksikurkumin dengan e kitar tujuh residu yang sama dengan residu yang be
piran 2). Hal ini menyatakan bahwa lokasi konform kumin sama dengan lokasi konformasi stabil
antara
antara poksigenase
arakidonat. Terdapat tuj hidrogen dapat terjadi hidrogen yang baik adala
Pengamatan ikata Interaksi yang terjadi a hanya ikatan hidrogen, hidrogen yang dapat dike akibat ligan yang fleksi interaksi non kovalen ata ligan dan reseptor dapa yang paling umum terjad
tujuh residu yang sama yaitu Leu (311), Lys ( (645), Trp (647), Glu (226). Berdasarkan lokasi ko
erupakan satu – satunya ligan diluar kontrol yang ngan asam arakidonat.
(a) (b) 15 Interaksi dua dimensi (a) dan tiga dimensi (b) a demetoksikurkumin dengan enzim 12 lipoksige amino yang memiliki kontak dengan demetosi kontak adalah Gln (590), Ile (593), Leu (597), L Arg (189), Glu (369), Leu (366), His (365), His
emetoksikurkumin memiliki empat ikatan hidr on (CO), dan dua buah gugus hidroksi (OH).
il pengamatan interaksi antara reseptor dengan l h jarak ikatan masing – masing ligan dengan gug
tan hidrogen dan interaksi hidrofobik bertuju antara ligan dan reseptor enzim 12-lipoksigenase en adalah suatu interaksi elektrostatik antara atom m elektronegatif dengan atom elektronegatif lainny di antara intermolekul dan intramolekul. Renta dalah berada pada 2,5-3,5 Ā.
atan hidrogen menggunakan piranti lunak Li i antara ligan dan reseptor enzim 12-lipoksigena n, karena adanya keterbatasan piranti lunak, hany diketahui. Ikatan kimia selain ikatan hidrogen da ksibel berinteraksi dengan reseptor. Interaksi dap n atau non ikatan (non-bonded interaction) yang ter
pat meningkatkan afinitas ligan terhadap resept jadi adalah interaksi elektrostatik dan ikatan van de
Tabel 3 Ikatan hidrogen dan interaksi asam amino
Senyawa Hasil Simulasi Docking
Jarak ikatan (Ā) Asam amino dan gugus fungsi yang berikatan Ikatan hidrogen dan asam amino yang berinteraksi antara reseptor enzim 12-lipoksigenase. Semua ligan kecuali kurkumin keto, analog 1, dan asam kafeat tidak ditemukan ikatan hidrogen, kemungkinan ikatan yang terjadi adalah ikatan elektostatik atau van der Waals. Ikatan hidrogen dapat membantu kestabilan antara ligan dan protein target. Data pada table 5 dapat disimpulkan bahwa jarak ikatan hidrogen yang terbentuk antara ligan dengan reseptor pada rentang 2,5-3,5 Ā (tabel 3)
24
Secara umum, ikatan hidrogen kurkumin dan analognya dipengaruhi oleh gugus fungsi OH pada struktur aromatik, dan gugus fungsi CO pada struktur rantai tengah pada residu Arg (189) (gambar 16). Hal ini sesuai dengan laporan dari Mukhopadhyay et.al (1982) yang menyatakan bahwa gugus hidroksi pada struktur aromatik dan gugus keton pada rantai tengah struktur kurkumin memiliki aktivitas farmakologi. Penelitian ini sejalan dengan pernayataan tersebut bahwa terdapat ikatan hidrogen pada gugus-gugus fungsi tersebut ( tabel 3)
Toksisitas Ligan Berdasarkan QSAR
Eksplorasi dan usaha mensinteis dan mendesain stuktur senyawa aktif sebagai kandidat obat yang aman terus dikembangkan. Dalam mengetahui kandidat obat dari suatu senyawa tertentu perlu dilakukan uji toksisitas agar aman digunakan oleh manusia. Pengujian toksisitas secara in silico diharapkan berguna untuk membantu uji toksisitas dalam skala laboratorium agar lebih efektif dan efisien dalam penggunaan waktu, pendanaan serta mengurangi faktor coba-coba. Pengujian toksisitas secara in silico dapat mengurangi penggunaan hewan sebagai bahan uji karena adanya masalah etika (Antonio, et.al, 2009). Industri kimia dn farmasi mengidentifikasikan senyawa baru yang diusulkan sebagai bahan aktif obat sebelum diproduksi dalam skala industri
Prediksi sifat toksisitas ligan bertujuan untuk mengetahui karakter daya toksisitas dari masing-masing ligan. Toksisitas ligan dapat diprediksi dengan metode QSAR (Quantitative Structure-Activity Relationship). Prediksi toksisitas dengan metode QSAR berdasarkan bentuk dan struktur molekul suatu senyawa dapat dimungkinkan untuk memprediksi jenis efek yang ditimbulkan. Prediksi yang digunakan adalah adanya hubungan kuantitatif antara sifat mikroskopis (struktur molekul) dengan sifat makroskopis (Lee et.al, 1996) Toksisitas ligan diprediksi menggunakan piranti lunak ToxTree 2.6.
Tabel 4 Prediksi toksisitas berdasarkan aturan Benigni/Bossa
No Prediksi Toksisitas KE KK BDK DK A1 A2 ED AK 1 Peringatan struktur untuk sifat
genotoksik karsinogenik
3 Potensi karsinogen
berdasarkan QSAR − − − − − − − −
4 Potensi mutasi oleh
S.typhimurium berdasakan
QSAR
− − − − − − − −
5 Tidak bersifat genotoksik karsinogenik
√ √ √ √ √ √ √ √
6 Tidak bersifat nongenotoksik karsinogenik
√ √ √ √ √ − √ √ Ket: KE: Kurkumin enol KK: Kurkumin keto BDK: Bisdemetoksi kurkumin
Aturan Benigni/Bossa memiliki beberapa parameter yaitu peringatan struktur yang bersifat karsinogenik yang diturunkan dan tidak diturunkan, adanya potensi mutasis oleh S.Typhimurium dengan prediksi uji Ames, dan adanya sifat karsinogen yang diturunkan atau tidak diturunkan berdasarka prediksi uji in vitro.
Prediksi toksistas berdasarkan aturan Benigni/Bossa didasarkan pada keberadaan sifat mutagen dan karsinogen berdasarkan gugus-gugus dari struktur kimia masing-masing ligan (Benigni et.al, 2008) (tabel 4). Sifat toksisitas berdasarkan aturan Benigni/Bosa menggambarkan bahwa struktur dari analog 2 diprediksi merupakan bahan karsinogenik yang tidak diturunkan. Berdasarkan analisis gugus fungsi, yang menyebabkan analog 2 bersifat karsinogenik adalah adanya gugus asam n-alkilkarboksilat. Gugus asam n-alkilkarboksilat akan menyediakan radikal bebas yang dapat mengganggu sistem tubuh. Berikut ini adalah lokasi gugus yang berperan, pada gambar 16
Gambar 17 Gugus yang berperan dalam sifat karsinogen pada analog 2 Analog 2 merupakan ligan yang bersifat karsinogen, untuk mengetahui batas aman sifat karsinogennya perlu dilakukan uji lanjutan tentang tingkat toksisitas senyawa tersebut melalui aturan Cramer (1978). Aturan Cramer menjelaskan tingkat toksisitas senyawa melalui oral dibagi ke dalam tiga kelas. Kelas I (rendah) merupakan senyawa dengan tingkat toksisitas rendah berdasarkan struktur kimia dan efisiensi metabolisme yang baik di dalam tubuh. Kelas II (menengah) berdasarkan pada senyawa yang tidak terlalu toksik seperti kelas I, namun memiliki struktur yang memiliki efisiensi metabolisme yang tidak baik seperti kelas III. Kelas III (tinggi) berdasarkan pada tingginya tingkat toksisitas dari gugus fungsi yang reaktif pada struktur senyawa tersebut. Berdasarkan aturan Cramer, analog 2 termasuk ke dalam kelas III, yang termasuk jenis senyawa dengan tingkat toksisitas yang tinggi. Oleh karena itu analog 2 tidak dapat digunakan sebagai kandidat obat, karena bersifat toksik walaupun dalam konsentrasi rendah.
Toksisitas analog 2 juga dipengaruhi oleh logP dari aturan Lipinski. Nilai log P dari analog 2 adalah 4,45 yang hampir mendekati angka 5. Nilai log P tersebut memiliki sifat terlalu hidrofobik cenderung memiliki tingkat toksisitas yang tinggi karena akan tertahan lebih lama pada lapisan lipid pada membrane sel dan terdistribusi lebih luas di dalam tubuh. Nilai log P mempengaruhi kelarutan ligan agar dapat berdifusi menembus membran sel (Lipinski et.al, 1997)
Diskusi Umum
26
menyatakan bahwa interaksi antara kurkumin dan analognya makin stabil. Paramater kestabilan juga dilihat dari interaksi yang terjadi antara ligan dan reseptor, diketahui melalui ikatan hidrogen, ikatan hidrofob dan interaksi kimia lain yang membentuk kestabilan antara ligan dan reseptor. Prediksi toksisitas dengan QSAR (Quantitative Structure-Activity Relationship) dapat memberikan prediksi toksisitas ligan berdasarkan struktur suatu senyawa.
Potensi kurkumin dan analognya sebagai inhibitor enzim 12-lipoksigenase dapat diperoleh dari nilai ∆G dan interaksi yang terbentuk antara ligan dengan reseptor. Potensi ligan yang akan dijadikan kandidat suatu obat harus memiliki prediksi toksisitas dengan QSAR yang aman baik secara mutagen dan karsinogen. Kandidat obat yang akan dikembangkan dengan pengujian lebih lanjut (in vivo
dan in vitro) diharapkan memiliki kestabilan yang baik antara ligan dengan
reseptor serta tidak memiliki prediksi toksisitas yang buruk baik secara mutagen maupun karsinogen.
Berdasarkan hasil yang didapatkan kurkumin dan analognya memiliki konformasi yang stabil dibandingkan dengan kontrol yang digunakan (asam arakidonat, etodolak, dan asam kaffeat). Beberapa faktor yang menyebabkan nilai ∆G yang lebih rendah dari kontrol adalah: (1) kurkumin dan analognya terikat stabil pada residu – residu pengikat ligan Phe (352), Ile (593), Ser (594), dan Val (418), (2) terikat pada residu binding site enzim 12-lipoksigenase His (360), His (365), His (540), Asn (544), dan Ile (663) (3) truktur kurkumin dan analognya yang memiliki topografi struktur yang relatif sama, sehingga daerah pengikatan dengan residu hidrofobik yang relatif sama (4) gugus fungsi yang terlibat adalah OH dan CO yang tepat pada daerah aktivitas farmakologi kurkumin.
Analog 2 merupakan ligan paling stabil dalam hal stabilitas terikat pada residu enzim 12-lipoksigenase. Kestabilan tersebut dilihat dari ∆G (-8,8 kkal/mol) dan konformasi ligan terikat pada residu – residu pengikat ligan dengan adanya ikatan hidrogen. Namun, analog 2 yang diprediksi dengan QSAR bersifat toksik pada gugus asam n-alkilkarboksilat. Sebagai kandidat inhibitor enzim 12-lipoksigenase, analog 2 tidak dapat digunakan walaupun ligan tersebut adalah ligan paling stabil terikat pada enzim 12-lipoksigenase.
Bisdemetoksikurkumin merupakan kandidat senyawa yang memiliki lokasi konformasi kestabilan yang sama dengan ligan alami (asam arakidonat). Hal ini dapat menyatakan bahwa bisdemetoksikurkumin berpotensi pada penghambatan enzim 12-lipoksigenase dengan terikat pada binding site asam arakidonat.
Hasil simulasi docking dan prediksi QSAR didapatkan bahwa kurkumin, bisdemetoksikurkumin, dan demetoksikurkumin yang terdapat pada kunyit dan temulawak berpotensi sebagai inhibitor enzim 12-lipoksigenase. Hal ini dapat menyatakan bahwa ketiga ligan tersebut memiliki interaksi yang baik dan prediksi toksisitas yang aman. Kunyit dan temulawak yang mengandung bahan aktif kurkumin dapat dinyatakan bahwa kedua tanaman herbal tersebut berpotensi sebagai antiinflamasi dan aman untuk dikonsumsi oleh masyarakat.
Dalam perkembangannya, kunyit dan temulawak dilaporkan memiliki beberapa manfaat antara lain sebagai antioksidan (Majed, et al. 1995, Rao, et al. 1993), antikanker (Huang, et.al. 1995, Aggrawal, et.al, 2003, Shisodia, et.al, 2007, Kunnumakkara, et.al, 2008a, Kunnumakkara, et.al, 2008b), antivirus (Bourne, 1999), anti-HIV (Mazmuder et.al, 1997, Barthelemy, et.al, 1998, Jagetia,
negara seperti India, Cina, dan negara-negara Asia Tenggara seperti Indonesia, memanfaatkan zat warna kuning dari kunyit sebagai bahan tambahan makanan, bumbu, maupun obat-obatan yang tidak berakibat toksik (Meiyanto, 1999). Kunyit diketahui berpotensi sebagai antiinflamasi (Jankun, et.al. 2000, Jankun
4 SIMPULAN DAN SARAN
Simpulan
Kurkumin dan analog 1 memiliki interaksi dengan kestabilan yang baik terhadap enzim 12-lipoksigenase. Gugus fungsi yang berperan dalam interaksi ligan-reseptor secara umum adalah gugus OH pada struktur aromatik (benzena), dan gugus fungsi CO pada struktur rantai tengah. Residu yang berperan dalam interaksi ligan dengan reseptor pada asam amino Arg (189). Simulasi docking dapat memberikan informasi bahwa kunyit dan temulawak yang digunakan oleh masyarakat selama ini terbukti secara ilmiah memiliki potensi sebagai antiinflamasi.
Saran
Analog 2 yang merupakan senyawa modifikasi yang harus dihindari untuk disintesis dan digunakan karena terbukti bersifat karsinogen. Struktur senyawa kontrol yang digunakan disarankan mirip dengan struktur ligan yang akan diuji.
DAFTAR PUSTAKA
Aggarwal BB, Kumar A, Bharti AC. 2008. Anticancer potential of curcumin: preclinical and clinical studies. Anticancer Res. 23, 363–98.
Ali, H. I. 2007. Antitumor studies. Part 3: Design, synthesis, antitumor activity, and molecular docking study of novel 2-methylthio-, 2-amino and 2-(N-substituted amino)-10-alkyl-2-deoxo-5-deazaflavins. Bioorganic & Medicinal Chemistry
Annual Reports in Medicinal Chemistry, 1-10
Barthelemy, S., L. Vergnes, M. Moynier, D. Guyot, Labidalle, and E. Bahraoui. 1998. Curcumin and curcumin derivatives inhibit Tat-mediated transactivation of type 1 human immunodeficiency virus long terminal repeat. Research in Virology149, 43-52
Berman, H.M, Westbrook, J., Feng, Z, Gilliland, G., Bhat, T.N., Weissig, H., Shidyyalov, I.N., Bourne, P.E. 2000. The Protein Data Bank. Nucleic Acids Research Vol 28, 235-242
Brash, Alan. 1999. Lipoxygeneses: Occurrence, Functions, Catalysis, and Acquisition of Substrate. The Journal of Biological Chemistry, 34, 23679-23682 1beta, IL-6, and TNF-alpha as well as cyclin E in TNF-alpha-treated HaCaT cells; NF-kappaB and MAPKs as potential upstream targets. Int J Mol Med. 19, 469-474.
Companion, A.L. 1991. Ikatan Kimia edisi kedua. ITB Press, Bandung
Constantinides,P. 1993. General Pathobiology. Appleton & Lange, Norwalk, Connecticut.
Delano, W.L. 2004. PyMOL User Guide.
http://pymol.sourceforge.net/userman.pdf/
Duvoix, A, Blasius, Delhalle, Schnekneburger, Morceau, Henry, Dicato, Diederich. 2004. Chemopreventative and therapeutic effects of curcumin. Cancer Letters, 223, 181-190.
Edwita, A.P. 2012. Analisis Dinamika Molekuler Senyawa Kompleks 12-Lipoksigenase dengan Kurkumin dan Dua Turunannya. Skripsi Sarjana Farmasi. Departemen Farmasi, FMIPA, UI: Depok\
Goel A., Kunnumakkara A.B, Aggarwal, B.B. 2008. Curcumin as “Curecumin”: From Kitchen to Clinic. Biochem Pharmacol. 75: 787-809
Henderson W.R., Jr. 1994. The role of leukotrienes in inflammation. Ann Intern Med. ;121:684–697.
Huang M.T, Lysz T, Ferraro T. 1991. Inhibitory effects of curcumin on in vitro lipoxygenase and cyclooxygenase activities in mouse epidermis. Cancer Res. 51, 813-819.
30
Mice, Proceeding International Symposium on Curcumin Pharmacochemistry, 29-31 August 1995, Yogyakarta, Indonesia
Huerta, L., Haseltine, F., Liu, Y., Gregory, D., Seto, B (2001). NIH Working Definition of Bioinformatics and Computational Biology. www.bisti.nih.gov/docs/compubiodef.pdf
Jagetia. G.C., Aggarwal, B.B. 2007. “Spicing up” of The Immune System by Curcumin. J Clin Immunol. 27: 19-35
Jankun, E.S., McCabe N.P., Selman. S.H., Jankun. J. 2000. Curcumin inhibits lipoxygenase by binding to its central cavity: theoretical and X-ray evidence. International Journal of Molecuklar Medicine 6, 521-526
Jankun, Jerzy., Aleem, A.M., Malgorzewicz, Sylvia., Szkudlarek, M., Zavodszky, M.I., DeWitt, L.D., Feig, M., Selman, S.H., Jankun, E.S. 2006. Synthetic curcuminoids modulate the arachidonic acid metabolism of human platelet 12-lipoxygenase and reduce sprout formation of human endothelial cells. Mol Cancer Ther 5, 1371-1382
Kertia, N dan Sudarsono, 2005, Prospek Manfaat Rimpang Temoe Lawak bagi Kesehatan, Seminar Nasional Obat Tradisional, Dies Fakultas Farmasi UGM tanggal 25 September 2005 di Yogyakarta.
Kouranov, A., Xie, L., Cruz, la, J.d., Chen, L., Westbrook, J.,et al. 2006. The RSCB PDB Information Portal for Structural Genomic, Nucleic Acid Research, 34. 302-305
Kroemer, R.T. 2003. Molecular modelling probes: docking and scoring, Biochemical Transactions. 31, 980-984
Kumar, Abbas, Fausto (eds). 2005. Robbin’s and Cotran Pathologic Basis Of Disease. Elsevier Saunder, Philadelpia, Pennsylvania. 7 th ed.
Kunnumakkara, A.B (a)., Anand, P., Aggarwal, B.B. 2008. Curcumin Inhibots Proliferation, Invasion, Angiogenesis and Metastasis of Different Cancers Through Interaction with Multiple Cell Signaling Proteins
Kunnumakkara, A.B (b)., Diagaradjane, P., Guha, S., Deorukhar A., Shentu, S., Aggrawal, B.B., et,al. 2008. Curcumin Sensitizes Human Colorectal Cancer Xenografts in Nude Mice to Gamma-Raiation by Targeting Nuclear Factor-kappaB-Regulated Gene Products. Clin Cancer Res. 14. 2128-36
Lee, K.W., Kwon, S.Y., Hwang, S., Lee, J.U., Kim, H., 1996. Quantitative Structure –Activity Relationship (QSAR) Study on C-7 Subtituted Quinolone, Bull. Korean Chem. Soc., 17, 147-152
Lehninger, A.L. 1982. Dasar-Dasar Biokimia. Erlangga, Jakarta
Lengauer T, Rarey M. 1996. Computational methods for biomolecular docking. Curr OpinStruct Biol. Jun;6(3):402-6. Review. PubMed PMID: 8804827. Lindstrom, W., Morris, G.M., Weber, C., Huey, R. 2008. Using AutoDock 4 for
Virtual Screening. La Jolla
Majeed M., Badmaev V., Shivakumar U, and Rajendran R. 1995. Curcuminoids-Antioxidant Phytonutrients. Nutriscience Publishers, Inc., Piscataway, New Jersey
Meiyanto, E. 1999. Kurkumin sebagai obat kanker: Menelusuri mekanisme aksi. Majalah Farmasi Indonesia10 (4), 224-236
Mogul, R. dan Holman, T.R. 2002. Allosteric inhibitors of lipoxygenase. United States Patent. 18, 179-193
Mukhopadhyay, A., N. Basu, N. Ghatak and P.K. Gujral, 1982. Antiinflammatory and irritant activities of curcumin analogues in rats. Agents Actions, 12, 508-515.
Nardo, De, Nardo CM, De, Nguyen T, Hamilton JA, Scholz GM. 2009. Signaling crosstalk during sequential TLR4 and TLR9 activation amplifies the inflammatory response of mouse macrophages. J. Immunol. 183, 8110-8118 Natarajan, R., Esworthy, R., Bai, W., Gu, J.L., Wilczynski, S., Nadler, J.L. 1997.
Increase 12-lipoxygenase expression in breast cancer cell an tissues. Regulation by epidermal growth factor. J.Clin. Endocrinol. Metab 82, 1790-1798
Nie, D., Hillman, G.G., Geddes, T., Tang, K., Pierseon, C., Grignon, D.J and Honn, K.V. 1998. Platelet-type 12-lipoxygenase in human prostate carcinoma stimulates angiogenesis and tumor growth. Cancer Res, 58, 4047-4051
Nogrady, T, 1985, Medicinal Chemistry A Biochemical Approach, Oxford University Press, Oxford
O. Trott dan A.J Olson. 2010. AutoDock Vina.Improving The Speed and Accuracy of Docking with A New Scoring Function, Efficient Optimaization and Multithreading. Journal of Computational Chemistry. 31. 455-461
Ohtsu, H., Xiao, Z, Ishida, J., et.al. 2002. Curcumin Analogues as Novel Androgen Receptor Antagonists with Potential as Anti-Prostate Cancer Agents. J.Med Chem, 45, 5037-5042
Okimoto, N., Futasugi, N., Fuji, H., Suenaga, A., Morimoto, G., et.al. 2009. High Performance Drug Discovery: Computational Screening by Combining Docking and Molecular Dynamics Simulation, PLoS Computational Biology. Vol 10. 1-13
Pollock,S dan Safer, H.M. 2001. Bioinformatics in The Drug Discovery Proccess. Putra, I.G.N, Nurcahata, B.M, Rachmatika, B., et,al. 2008. Kurkumin dan
Analognya sebagai Selective Estrogen Receptor Modulators (SERMS): Kajian Berdasarkan Metode Docking pada Reseptor Estrogen Alfa. Pharmacon 9 (1), 6-13
Rao, C.V. 1993. Antioxidant activity of curcumin and related compounds. Lipid peroxide formation in experimental inflammation. Cancer Res. 55,259 Ravindran J, Prasad S, Aggarwal BB. 2010. NF-kappaB and cancer: how intimate
is this relationship. Mol Cell Biochem.336(1-2):25-37.
Ritmaleni dan S. Ari. 2010. Sintesis tetrahidro pentagamavunon-0. Majalah Farmasi Indonesia 21(2). 100-105.
Samira. 2009. Karya Sarjana Utama Kimia: Perancangan Peptida Siklis sebagai Inhibitor Potensial untuk Enzim NS3-NS2B Protease Virus Dengue secara In Silico Melalui Molecular Docking. Departemen Kimia FMIPA-UI