ASOSIASI AKTIVITAS SELULOLITIK DAN ANALISIS
MOLEKULER DENGAN METODE
Rep
-PCR DARI
Xanthomonas oryzae pv. oryzae
TRIA WULAN
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Asosiasi Aktivitas Selulolitik dan Analisis Molekuler dengan Metode Rep-PCR dari Xanthomonas oryzae pv. oryzae adalah benar karya saya dengan arahan dari komisi pembimbing
dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor. Juni 2014
Tria Wulan
ABSTRAK
TRIA WULAN. Asosiasi Aktivitas Selulolitik dan Analisis Molekuler dengan Metode Rep-PCR dari Xanthomonas oryzae pv. oryzae. Dibimbing oleh LAKSMI
AMBARSARI dan FATIMAH.
Bakteri Xanthomonas oryzae pv. oryzae merupakan bakteri penyebab
penyakit hawar daun pada padi. Sebanyak 27 isolat Xoo yang digunakan berasal
dari beberapa daerah di Indonesia kemudian diuji aktivitas selulolitiknya dengan menggunakan media CMC, dianalisis karakteristik molekulernya menggunakan teknik Rep-PCR, serta dianalisis asosiasi diantara keduanya dengan menggunakan
program Tassel. Tujuan dari penelitian ini adalah untuk mengetahui asosiasi
antara aktivitas selulolitik dan analisis molekuler dengan metode Rep-PCR yang
dihasilkan dari bakteri Xoo. Pengujian selulolitik yang dilakukan pada 27 isolat Xoo, diperoleh isolat 7624 yang diketahui sebagai ras IV memiliki rataan zona
bening terbesar yaitu 1.43 cm sedangkan isolat Xoo12-253 menghasilkan rataan zona bening terkecil sebesar 0.31 cm. Untuk analisis molekuler digunakan primer BOXA1R, (GTG)5, dan ERIC untuk mengamplifikasi DNA genom Xoo dan menghasilkan pita DNA yang polimorfik antar primer dari tiap isolat. Nilai PIC terbesar diperoleh oleh primer ERIC dengan nilai 0.34. Hasil asosiasi dari pengujian selulolitik dan analisis molekuler DNA dengan Rep-PCR diketahui
memiliki korelasi yang rendah serta tidak ada asosiasi yang signifikan antar keduanya.
Kata kunci : analisis molekuler, Rep-PCR, selulolitik, Xanthomonas oryzae
ABSTRACT
TRIA WULAN. Association Cellulolytic Activity and Molecular Analysis with
Rep-PCR Method from Xanthomonas oryzae pv. oryzae. Supervised by LAKSMI
AMBARSARI and FATIMAH.
Xanthomonas oryzae pv. oryzae (Xoo) causes bacterial leaf blight (BLB)
of rice. Twenty seven Xoo from several regions in Indonesia were tested
cellulolytic activity with CMC media, molecular analysis were analyzed using the technique of Rep-PCR, and analyzed the association between the two by using the
program Tassel. The purpose of this study is to investigate the association
between cellulolytic activity and molecular analysist with Rep-PCR method from Xoo DNA bacteria. The results of cellulolytic activity from 27 isolates Xoo, 7624
isolate known as type IV has the largest clear zone is 1.43 cm and Xoo12-253 isolate has the smallest clear zone is 0.31 cm. For the molecular characteristics, used BOXA1R, (GTG)5, and ERIC primers to amplify genomic DNA and produces polymorphic Xoo DNA bands different between three primers. Most PIC
value obtained by the ERIC primer with value 0.34. The results of testing the association of cellulolytic activity and molecular characteristics of DNA amplification by Rep-PCR were known that have a low correlation and no significant association between the two.
ASOSIASI AKTIVITAS SELULOLITIK DAN ANALISIS
MOLEKULER DENGAN METODE
Rep
-PCR DARI
Xanthomonas oryzae pv. oryzae
TRIA WULAN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Asosiasi Aktivitas Selulolitik dan Analisis Molekuler dengan Metode Rep-PCR dari Xanthomonas oryzae pv. oryzae
Nama : Tria Wulan NIM : G84100075
Disetujui
Dr Laksmi Ambarsari, MS Pembimbing I
Dr Fatimah, MSi Pembimbing II
Diketahui
Dr Ir I Made Artika, MAppSc Ketua Departemen
KATA PENGANTAR
Alhamdulillah, segala puji kepada Allah SWT karena atas limpahan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan penulisan karya ilmiah yang berjudul “Asosiasi Aktivitas Selulolitik dan Analisis Molekuler dengan Metode Rep-PCR dari Xanthomonas oryzae pv. oryzae”. Karya ilmiah ini
merupakan prasyarat untuk memperoleh gelar Sarjana Sains di Departemen Biokimia FMIPA IPB.
Penulis menyampaikan terima kasih kepada Dr. Laksmi Ambarsari, MS. selaku pembimbing utama dan Dr. Fatimah, MSi selaku pembimbing kedua yang telah menyempatkan waktunya untuk membimbing dan memberikan arahan serta motivasi selama penulisan karya ilmiah ini. Segenap terima kasih penulis juga sampaikan pada Bapak Apon Zaenal, Kak Ike, Kak Bugi, Kak Aksar, Kak Taufik, Kak Kus, dan Kak Andin yang telah memberikan bimbingan selama penulis melakukan penelitian di LIPI Cibinong, serta Bapak Mahruf dan Mbak Oya yang telah membantu dan membimbing selama di Laboratorium Biologi Molekuler BIOGEN.
Terima kasih juga penulis sampaikan kepada Papa, Mama, Kakak-kakak, Riyan Anugrah, serta rekan-rekan Biokimia angkatan 47 yang telah memberikan dukungan dan motivasi selama penulisan karya ilmiah ini. Penulis menyadari penulisan karya ilmiah ini masih jauh dari kesempurnaan. Saran dan kritik dari pembaca diharapkan dapat menyempurnakan tulisan ini. Penulis juga berharap karya ilmiah ini dapat bermanfaat dan memberikan inspirasi positif kepada pembaca.
Bogor, Juni 2014
DAFTAR ISI
DAFTAR GAMBAR xi
DAFTAR TABEL xi
DAFTAR LAMPIRAN xi
PENDAHULUAN 1
METODE 2
Alat 3
Bahan 3
Prosedur Penelitian 4
HASIL 7
Hasil Peremajaan Xanthomonas oryzae pv. oryzae (Xoo) 7
Aktivitas Selulolitik Bakteri Xoo pada Media CMC 8
Kualitas DNA Genom Bakteri Xoo 9
Pita Polimorfik DNA Bakteri Xoo 10
Klasterisasi Bakteri Xoo 12
Asosiasi Aktivitas Selulolitik dengan Amplifikasi DNA Xoo 14
PEMBAHASAN 16
Hasil Peremajaan Bakteri Xanthomonas oryzae pv. oryzae (Xoo) 16
Aktivitas Selulolitik Bakteri Xoo pada Media CMC 16
Kualitas DNA Genom Bakteri Xoo 18
Pita Polimorfik DNA Bakteri Xoo 19
Klasterisasi Bakteri Xoo 20
Asosiasi Aktivitas Selulolitik dan Amplifikasi DNA Xoo 21
SIMPULAN DAN SARAN 22
Simpulan 22
Saran 23
DAFTAR PUSTAKA 23
LAMPIRAN 27
DAFTAR GAMBAR
1 Hasil peremajaan bakteri Xoo pada media WA 7
2 Zona bening yang terbentuk akibat aktivitas selulase 8 3 Elektroforegram hasil isolasi DNA genom bakteri Xoo 10
4 Elektroforegram hasil amplifikasi DNA Xoo dengan primer BOXA1R 10
5 Elektroforegram hasil amplifikasi DNA Xoo dengan primer (GTG)5 11 6 Elektroforegram hasil amplifikasi DNA Xoo dengan primerERIC 11
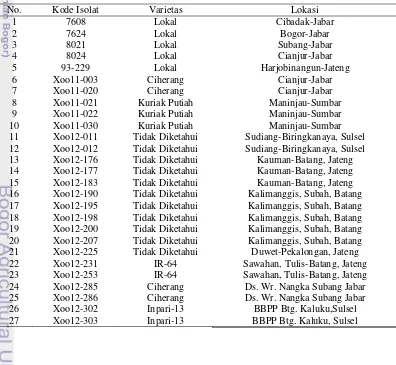
7 Dendrogram hasil amplifikasi DNA Xoo dengan primer BOXA1R 12
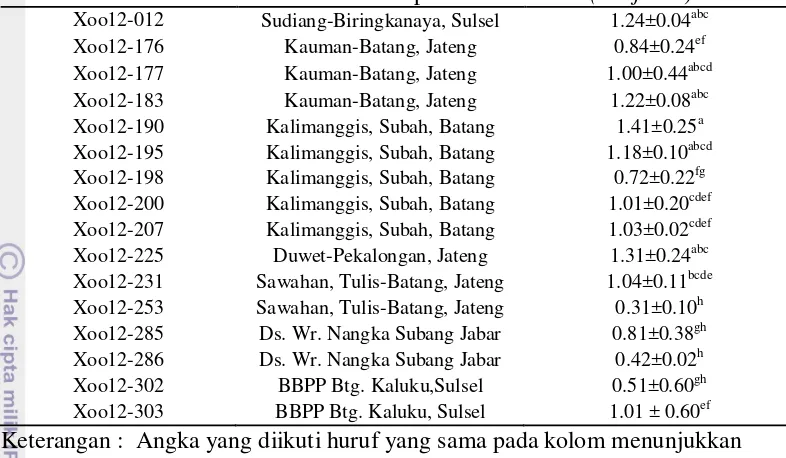
8 Dendrogram hasil amplifikasi DNA Xoo dengan primer (GTG)5 13 9 Dendrogram hasil amplifikasi DNA Xoo dengan primer ERIC 14
10 Struktur selulosa 17
DAFTAR TABEL
1 Daftar asal daerah isolat Xoo 3
2 Aktivitas selulolitik bakteri Xoo pada media CMC 8
3 Hasil perhitungan statistik pada primer Rep-PCR 12
4 Isolat Xoo berdasarkan klaster pada primer dan diameter zona bening 14
5 Hasil analisis asosiasi fenotip dengan genotip 15
DAFTAR LAMPIRAN
1 Skema alir penelitian 28
2 Alur isolasi DNA genom 29
3 Hasil pengukuran zona bening dari aktivitas enzim selulase bakteri Xoo 30
4 Hasil aktivitas selulase 27 isolat Xoo pada media CMC 33
5 Hasil uji statistik aktivitas selulase dengan SPSS 34
6 Hasil kuantitatif isolasi DNA genom Xoo 36
7 Elektroforegram hasil isolasi DNA genom Xoo 37
PENDAHULUAN
Kebutuhan padi di Indonesia terus meningkat seiring dengan meningkatnya kebutuhan pangan. Peningkatan produksi padi mengalami banyak kendala karena adanya serangan pada padi yang dapat menurunkan produksi padi. Salah satu penyakit utama padi sawah di Indonesia adalah hawar daun bakteri atau kresek yang disebabkan oleh Xanthomonas oryzae pv. oryzae (Xoo) (IRRI 2010).
Pada tingkat keparahan 20%, sebulan sebelum panen, penyakit sudah mulai menurunkan hasil. Hasil padi turun 4% setiap kali penyakit bertambah parah 10%. Serangan HDB dapat terjadi pada fase benih, tanaman muda, dan tanaman dewasa. Serangan ini menyebabkan turunnya produksi padi. Lahan yang terserang penyakit HDB sangat luas, khususnya di Indonesia. Tahun 2006, luas lahan di Indonesia yang terserang HDB sebesar 74.243 ha. Tahun 2010, luas lahan yang terserang HDB sebesar 54.796 ha, dan serangan ini meningkat pada masa tanam 2010-2011 menjadi sebesar 64.123 ha (Direktorat Perlindungan Tanaman 2011).
Berbagai upaya pengendalian penyakit hawar daun bakteri telah dilakukan, diantaranya dengan penggunaan antibiotik oxytetracycline, streptomycin, dan chloramphenicol (Khan et al. 2005), peramalan datangnya
serangan patogen (Liu et al. 2006), sanitasi di pertanaman padi (IRRI 2010),
penggunaan kombinasi agensia antagonis Pantoea agglomerans, Pseudomonas fluorescens dan Bacillus subtilis (Babu dan Thind 2005). Cara pengendalian
tersebut belum memberikan hasil yang memuaskan karena X. oryzae pv. oryzae
mempunyai tingkat keragaman yang tinggi. Keragaman jenis Xoo terbentuk dari
karakteristik molekuler Xoo itu sendiri. Karena diketahui bakteri Xoo dari
berbagai daerah di Indonesia memiliki genetik yang cukup beragam (Djatmiko dan Prihatiningsih 2011). Menurut Kadir (2009) menyatakan bahwa bakteri Xoo
mampu membentuk ras baru dengan cepat di lapang, sejalan dengan perkembangan penggunaan varietas padi. Di Jawa Barat, Daerah Istimewa Yogyakarta, dan Jawa Tengah, populasi Xoo ras VIII dilaporkan paling dominan
dan memiliki wilayah sebar sangat luas, baik di wilayah dataran rendah maupun dataran sedang. Sementara itu Xoo ras III dan IV merupakan ras yang terdapat di
daerah tertentu, terutama di dataran rendah pada lokasi penanaman padi. Ras IV diketahui sebagai ras yang paling ganas dan relatif lama bertahan. Hal ini menandakan bahwa kemampuan virulensi tiap ras berbeda-beda pada daerah di Indonesia.
Bakteri Xanthomonas oryzae pv. oryzae termasuk bakteri patogen yang
dapat menyebabkan penurunan produksi padi di Indonesia. Bakteri Xoo
melakukan beberapa strategi untuk dapat melumpuhkan inang (tanaman padi), diantaranya harus dapat masuk ke dalam inang, menembus pertahanan inang, dan merusak sel inang. Tentu untuk menembus pertahanan inang dibutuhkan faktor virulensi oleh sebuah bakteri patogen. Diantara faktor virulensi pada bakteri patogen tumbuhan terdapat enzim pendegradasi dinding sel pada tumbuhan, seperti selulase, pektinase, xilanase, dan protease yang dikeluarkan oleh bakteri patogen tumbuhan untuk merusak komponen pada dinding sel tumbuhan inang dan memiliki peranan penting dalam virulensi (Hu et al. 2007). Salah satu enzim
dan memiliki peran untuk menghidrolisis selulosa dengan memecah ikatan β -1,4-D-glikosidik untuk menghasilkan oligosakarida maupun glukosa (Lelana 2009). Menurut Temuujin et al. (2011), melaporkan bahwa selulase merupakan faktor
virulensi terpenting pada Xoo karena memiliki gen yang paling banyak diantara
enzim ekstraseluler lainnya.
Studi mengenai karakteristik pada bakteri dapat dilakukan dari aspek fenotipe dan genotipe. Karakter fenotipe seperti patogenisitas, spesifisitas inang, virulensi, dan distribusi geografis berkaitan erat dengan keragaman genetik dari bakteri. Namun karakter fenotipe belum bisa untuk memastikan adanya perubahan secara genetik, karena sangat dipengaruhi faktor lingkungan yang akan memicu adaptasi yang bersifat sementara atau permanen. Oleh karena itu, terdapat metode genotipe yang dapat mempelajari karakteristik bakteri tanpa dipengaruhi faktor lingkungan. Salah satunya dengan marka molekuler (Yildrim et al. 2011).
Marka molekuler bisa digunakan sebagai alat untuk mempelajari perbedaan dan perubahan genetik antar waktu atau lokasi dari suatu tingkat taksa atau populasi (Perrier et al. 2009). Repetitive PCR (Rep-PCR) merupakan metode
amplifikasi fragmen DNA dengan menggunakan primer yang berkomplemen dengan sekuens berulang yang terdapat pada bakteri (Lisek et al. 2011). Setiap
mikroorganisme memiliki sekuen yang berulang (repetitive sequence) dengan
jumlah dan jarak yang bervariasi (Prihantoro et al. 2012). Rep-PCR telah diakui
sebagai teknik PCR berbasis sederhana dengan karakteristik sebagai berikut: (i) Memiliki kekuatan diskriminatif yang tinggi, (ii) biaya rendah, (iii) cocok untuk strain yang tinggi, dan (iv) alat yang handal untuk mengklasifikasikan berbagai bakteri Gram negatif dan beberapa Gram positif (Yildrim et al. 2011).
Keshavarz (2011) menyatakan bahwa metode Rep-PCR dapat digunakan
untuk melakukan karakterisasi molekuler pada bakteri Xoo yang berasal dari
populasi berbagai daerah di Malaysia. Masih sedikit data yang melaporkan mengenai korelasi antara genotipe dengan fenotipe yang dihasilkan yang mungkin memiliki latar belakang genetik yang harus diketahui lebih jauh, sehingga dilakukan penelitian untuk mengetahui ada atau tidaknya hubungan antara kemampuan selulolitik yang berbeda dengan analisis molekuler dengan metode
Rep-PCR dari Xoo yang diperoleh dari berbagai daerah di Indonesia.
Penelitian ini bertujuan untuk mengetahui hubungan antara aktivitas selulolitik dan analisis molekuler yang dihasilkan dari bakteri Xoo. Penelitian ini
diharapkan dapat membantu pembudidayaan varietas padi yang tahan HDB akibat beragamnya genetika pada bakteri Xoo melalui analisis molekuler serta
karakterisasi faktor virulensi yang dimiliki bakteri Xoo melalui pengujian
selulolitik.
METODE
Waktu dan Tempat Penelitian
Alat
Alat yang digunakan meliputi, cawan Petri, neraca analitik, tabung reaksi, gelas ukur, gelas piala, inkubator, mesin autoklaf, shaker, bunsen, labu
Erlenmeyer, alumunium foil, plastic wrap, pipet mikro, tabung Eppendorf, kapas,
PCR plate. Selain itu juga digunakan perangkat seperti mesin Nanodrop, laminar air flow cabinet, mesin elektroforesis, UV Illuminator ChemiDoc EQ Biorad, dan
mesin Biometra Thermocycler.
Bahan
Bahan-bahan yang digunakan yaitu 27 buah isolat bakteri Xoo dari koleksi
BB-BIOGEN (Tabel 1), sukrosa, pepton, Ca(NO3)4H2O, Na2HPO47H2O, FeSO47H2O, agar bakto, bubuk Nutrient Broth (NB), akuades, Tris HCl pH 8, EDTA pH 8, NaCl 5 M, Sodium Dodesil Sulphate (SDS), Polivinyl Pirolidone
(PVP), kalium asetat , etanol absolut, etanol 70%, RNAse, bufer Tris-EDTA (TE), tisu kimwipes, Primer BOXAIR, ERIC1R, ERIC2, dan (GTG)5, dNTP mix
Thermo Scentific, Dreamtaqbuffer PCR 10x + MgCl2, Thermo Scientific Taq polymerase, DNA ladder Vivantis 100bp plus, basa tris, asam borat, etidium bromide (EtBr), karboksimetil selulosa, natrium fosfat, natrium azida, kongo red
0.1%, NaCl 1 M, kalium klorida.
Tabel 1 Daftar asal daerah isolat Xoo
No. Kode Isolat Varietas Lokasi
1 7608 Lokal Cibadak-Jabar
2 7624 Lokal Bogor-Jabar
3 8021 Lokal Subang-Jabar
4 8024 Lokal Cianjur-Jabar
5 93-229 Lokal Harjobinangun-Jateng
6 Xoo11-003 Ciherang Cianjur-Jabar
7 Xoo11-020 Ciherang Cianjur-Jabar
8 Xoo11-021 Kuriak Putiah Maninjau-Sumbar
9 Xoo11-022 Kuriak Putiah Maninjau-Sumbar
10 Xoo11-030 Kuriak Putiah Maninjau-Sumbar
11 Xoo12-011 Tidak Diketahui Sudiang-Biringkanaya, Sulsel
12 Xoo12-012 Tidak Diketahui Sudiang-Biringkanaya, Sulsel
13 Xoo12-176 Tidak Diketahui Kauman-Batang, Jateng
14 Xoo12-177 Tidak Diketahui Kauman-Batang, Jateng
15 Xoo12-183 Tidak Diketahui Kauman-Batang, Jateng
16 Xoo12-190 Tidak Diketahui Kalimanggis, Subah, Batang
17 Xoo12-195 Tidak Diketahui Kalimanggis, Subah, Batang
18 Xoo12-198 Tidak Diketahui Kalimanggis, Subah, Batang
19 Xoo12-200 Tidak Diketahui Kalimanggis, Subah, Batang
20 Xoo12-207 Tidak Diketahui Kalimanggis, Subah, Batang
21 Xoo12-225 Tidak Diketahui Duwet-Pekalongan, Jateng
22 Xoo12-231 IR-64 Sawahan, Tulis-Batang, Jateng
23 Xoo12-253 IR-64 Sawahan, Tulis-Batang, Jateng
24 Xoo12-285 Ciherang Ds. Wr. Nangka Subang Jabar
25 Xoo12-286 Ciherang Ds. Wr. Nangka Subang Jabar
26 Xoo12-302 Inpari-13 BBPP Btg. Kaluku,Sulsel
Prosedur Penelitian
Penelitian diawali dengan tahapan awal yaitu melakukan peremajaan bakteri Xanthomonas oryzae pv. oryzae pada media Wakimoto Agar di cawan
Petri untuk mendapat biakan murni. Setelah bakteri dapat tumbuh baik pada cawan Petri kemudian dipindahkan pada agar miring sebagai biakkan simpan. Tahapan pertama yaitu melakukan penapisan pada bakteri Xoo yang dapat
menghasilkan selulase. Tahapan ini dilakukan pengukuran zona bening yang terbentuk pada media yang mengandung CMC karena adanya aktivitas enzim selulase dari isolat yang diuji. Hasil pengukuran zona bening tiap isolat kemudian dilakukan uji lanjut Duncan dengan aplikasi program SPSS.
Tahapan selanjutnya yaitu melakukan isolasi untuk memperoleh DNA dari bakteri Xoo dengan metode Shanti (2001). DNA yang diperoleh kemudian di
amplifikasi dengan menggunakan teknik Rep-PCR. Primer yang digunakan yaitu
BOXA1R, ERIC, dan (GTG)5. Setelah diperoleh pita dari hasil amplifikasi dengan teknik Rep-PCR kemudian dilakukan skoring dengan angka biner untuk
klasterisasi dengan dendrogram dengan bantuan aplikasi program NTSYS 2.10 serta perhitungan nilai PIC dengan aplikasi program Cervus. Kemudian
melakukan analisis ada tidaknya asosiasi antara aktivitas selulolitik dengan analisis molekuler yang dihasilkan dari amplifikasi DNA Xoo dengan
menggunakan program Tassel (alur penelitian dicantumkan di Lampiran 1).
Pembuatan Media Wakimoto Agar (IRRI 1996)
Sebanyak 20 g sukrosa, 5 g pepton, 0.5 g Ca(NO3)4H2O, 1.82 g Na2HPO47H2O, 0.05 g FeSO47H2O, 18 g bakto agar dicampurkan dalam 1 liter akuades pada labu Erlenmeyer 1000 mL, diaduk, ditutup dengan alumunium foil, dan di autoklaf selama 15 menit pada suhu 121°C. Kemudian media yang masih panas dituangkan pada cawan Petri untuk media cawan dan tabung reaksi yang tertutup kapas steril yang dimiringkan untuk media miring, lalu didinginkan. Proses dilakukan dalam laminar air flow cabinet.
Peremajaan Bakteri Patogen Xanthomonas oryzae pv. oryzae (Xoo) (IRRI 1996)
Bakteri Xoo dari stok digoreskan dan ditumbuhkan pada medium Wakimoto Agar pada cawan Petri yang telah diberi label sesuai dan diinkubasi
pada suhu 28°C selama 24-48 jam. Proses ini dilakukan dalam laminar air flow cabinet. Bakteri yang telah tumbuh ditandai dengan munculnya koloni berwarna
kuning mengkilat. Satu ose koloni dari cawan digoreskan ke dalam media miring WA yang telah ditandai berdasarkan penomoran Xoo, dan disimpan pada suhu
28°C hingga uji selanjutnya. Proses ini dilakukan di dalam laminar air flow cabinet.
Pengujian Selulolitik pada Xoo (Chatterjee et al. 1995)
Bakteri Xoo yang telah ditumbuhkan dari agar miring WA diambil
sebanyak satu ose, kemudian dipindahkan ke dalam media NB dan digoyang pada alat penggoyang dengan kecepatan 200 rpm pada suhu 28°C selama 24 jam hingga mencapai OD ± 1.0 . Bakteri yang sudah dikultur kemudian disentrifugasi pada 6000 rpm selama 10 menit. Pisahkan antara supernatan dan pelet kemudian ambil 30 µL kultur yang ditempatkan dalam sebuah lubang di media uji agar yang berisi 0.1% karboksimetil selulosa (CMC), 50 mM natrium fosfat (pH 7,0), 0.8% agarosa, dan 0.02% natrium azida. Cawan Petri diinkubasi selama 20 jam pada suhu 28°C. Kemudian cawan diwarnai dengan 0.1% kongo red selama 10 menit dan dicuci beberapa kali dengan 1 M NaCl. Setelah pencucian, pengujian selulolitik ditentukan dengan mengukur diameter zona bening dari daerah sekitar lubang. Setiap pengujian sampel dilakukan ulangan sampai 3 kali untuk analisis statistik dengan Rancangan Acak Lengkap (RAL) dengan program SPSS.
Isolasi DNA Genom Xoo (Shanti et al. 2001)
Isolasi DNA genom dilakukan dengan metode Shanti et al. (2001). Media
NB sebanyak 5 mL dimasukkan ke tabung reaksi dan disterilisasi. Sebanyak satu lup koloni bakteri Xoo diambil dari kultur stok dengan menggunakan ose steril
yang diinokulasikan ke dalam media NB steril dan diinkubasi selama semalam pada suhu ruang di inkubator bergoyang. Sebanyak 1 mL inokulum dipindahkan ke dalam tabung Eppendorf dan disentrifugasi dengan kecepatan 6000 rpm selama 5 menit. Pelet diresuspensi dengan bufer ekstraksi (100 mM Tris HCl pH 8, 100 mM EDTA, 250 mM NaCl, 1% SDS, 1% PVP) sebanyak 650 µL dan diinkubasi selama 30 menit pada suhu 65°C, setiap 10 menit sekali tabung dibolak-balik. Selanjutnya ditambahkan dengan 100 µL kalium asetat 5 M dan disentrifugasi dengan kecepatan 13000 rpm selama 5 menit. Supernatan yang diperoleh dipresipitasi dengan etanol absolut dingin dengan perbandingan 2:1. Selanjutnya, disentrifugasi kembali dengan kecepatan 13000 rpm selama 5 menit. Pelet yang diperoleh diresuspensi kembali dengan etanol 70% dan disentrifugasi dengan 10000 rpm selama 10 menit. Setelah diuapkan, ditambahkan dengan 30µL RNAse 0,1mg/mL dan 100 µL TE bufer sebagai DNA stok (Bagan alir isolasi genom dapat dilihat pada Lampiran 2).
Uji Kuantitatif DNA dengan Nanodrop (Thermo Fisher Scientific 2009)
Sebanyak 2 µL larutan bufer TE 0.1x dimasukkan ke dalam lubang ukur pada mesin nanodrop kemudian tombol read blank ditekan pada komputer. Kertas
tisu Kimwipes digunakan untuk membersihkan sisa bufer TE. Kemudian sampel
DNA dimasukan sebanyak 2 µL ke dalam lubang ukur, kemudian dipilih menu
read sample. Hasil pengukuran berupa nilai kemurnian sampel akan muncul
dalam satuan konsentrasi ng/µL. Kemurnian DNA dapat dilihat pada Å260/Å280.
Uji Kualitatif DNA dengan Elektroforesis Gel Agarosa (Sambrook dan Russell 2001)
loading dye, kemudian dimasukkan ke dalam sumur gel. Selanjutnya dirunning
pada voltase 100 volt selama ± 90 menit. Pita-pita DNA kemudian dilihat dengan UV Transiluminator.
Amplifikasi DNA dengan PCR
Hasil isolasi DNA yang telah disamakan konsentrasinya selanjutnya diamplifikasi dengan mesin PCR. Proses amplifikasi DNA dari bakteri Xoo
menggunakan dengan primer BOXA1R:5-’CTACGGCA AGGCGACGCTGAC G-3’, ERIC1R: 5’-ATGTAAGCTCCTGGG GATTCAC-’3, ERIC2:5’-AAG TAAGTGACTGGGGTGAGCG-’3, dan (GTG)5: 5’-GTGGTGGTGGTGGTG-3’ (Li et al. 2011). Tahap awal untuk proses amplifikasi DNA yaitu disiapkannya
Profil PCR yang digunakan untuk primer BOXA1R adalah pre-denaturasi 95°C selama 7 menit; denaturasi pada suhu 95°C selama 1 menit, penempelan primer 47°C selama 1 menit, pemanjangan primer 65°C selama 8 menit. Proses tersebut diulang sebanyak 35 siklus. Selanjutnya pendinginan pada suhu 65ºC selama 15 menit.
Profil PCR yang digunakan untuk primer ERIC adalah pre-denaturasi 95°C selama 7 menit; denaturasi pada suhu 95°C selama 1 menit, penempelan primer 43°C selama 1 detik, pemanjangan primer 65°C selama 8 menit. Proses tersebut diulang sebanyak 35 siklus. Selanjutnya pendinginan pada suhu 65ºC selama 15 menit. proses amplifikasi selesai kemudian gel divisualisasi dengan proses elektroforesis.
Elektroforesis Hasil PCR dengan Gel Agarosa (Sambrook dan Russell 2001)
Tahapan untuk melakukan visualisasi pada elektroforesis gel agarosa adalah pertama disiapkan seperangkat bak elektroforesis yang telah berisi larutan TBE 0.5x. Agarosa sebanyak 2.25 gram dilarutkan dalam 150 mL TBE 0.5x. Larutan kemudian dipanaskan dalam microwave selama kurang lebih 2 menit,
Tahap selanjutnya yaitu sampel DNA dialiri arus dengan voltase 70 volt. Proses elektroforesis dilakukan selama ± 180 menit. Kemudian gel diwarnai dengan larutan etidium bromida selama 10 menit. Pewarnaannya dihilangkan dengan akuades selama 5 menit. Pita-pita DNA selanjutnya dilihat dengan perangkat UV Transiluminator dan didokumentasikan.
Analisis Data
Hasil pengukuran zona bening yang terbentuk akibat dari aktivitas selulase kemudian diuji lanjut Duncan pada tiap isolat dengan aplikasi SPSS. Hasil visualisasi dari proses elektroforesis yaitu pita-pita pada gel agarosa kemudian dianalisis dengan PhotoCapMW. Pola pita yang terbentuk dijadikan data biner
terhadap dan dibuat dendrogramnya dengan metode unweighted pair group method arithmetic mean (UPGMA) dengan menggunakan program NTSYS 2.10.
Perhitungan nilai Polymorphism Information Content (PIC) diperoleh dengan
program Cervus. Kemudian menganalisis ada tidaknya asosiasi antara besar
diameter zona bening dan analisis molekuler yang dihasilkan dari aktivitas selulolitik yang dihasilkan Xoo dengan program Tassel (Sharma et al. 2009).
HASIL
Hasil Peremajaan Xanthomonas oryzae pv. oryzae (Xoo)
Sebanyak 27 isolat bakteri Xoo yang diperoleh dari koleksi Laboratorium Biologi Molekuler BB-Biogen yang berasal dari beberapa daerah di Indonesia telah diremajakan ke media Wakimoto Agar (WA). Isolat-isolat Xoo didapatkan
dari beberapa wilayah yang menunjukkan bahwa penyakit HDB merupakan penyakit utama yang menyerang daerah tersebut yakni Sumatera Barat, Jawa Barat, Jawa Tengah, dan Sulawesi Selatan.
Saat diremajakan, isolat digores pada media WA di petridish. Isolat
kemudian diinkubasi pada suhu 28°C selama 3-5 hari hingga menghasilkan koloni. Ketika sudah tumbuh dengan baik, isolat kemudian digores pada media agar miring WA pada tabung reaksi untuk penyimpanan dan untuk tahapan isolasi DNA. Morfologi visual yang diperoleh pada peremajaan isolat ini warna koloni yaitu kuning muda, memiliki ujung bulat, dan permukaan yang cembung dan berlendir (Gambar 1).
Gambar 1 Hasil peremajaan bakteri Xoo pada media WA
Aktivitas Selulolitik Bakteri Xoo pada Media CMC
Selulolitik merupakan aktivitas bakteri dalam perombakan selulosa dengan bantuan enzim selulase. Pengujian selulolitik yang dilakukan menggunakan media agar spesifik carboxymethyl cellulose (CMC) sebanyak 3
kali ulanganpada 27 isolat bakteri patogen Xoo (Lampiran 5). Zona bening
yang terbentuk akibat adanya aktivitas enzim selulase dari bakteri Xoo. Warna
merah pada media disebabkan media CMC yang diwarnai oleh congo red 0.1%
(Gambar 1).
Gambar 2 Zona bening yang terbentuk akibat aktivitas selulase (a) isolat 7624, (b) isolat Xoo12-190, (c) isolat 8024, (d) isolat Xoo12-253. (Keterangan: daerah yang ditunjuk tanda panah merupakan daerah zona bening yang terbentuk)
Analisis statistik (Tabel 2) yang telah dilakukan, diketahui bahwa zona bening paling besar dihasilkan oleh isolat 7624 (diketahui sebagai ras IV yang memiliki virulensi tinggi) dengan rataan zona bening 1.43 cm dan tidak berbeda nyata (P>0.05) dengan isolat Xoo12-190, Xoo11-020, Xoo11-021, Xoo12-225, 7608, Xoo11-003, 93-229, Xoo12-177, Xoo12-195 namun berbeda nyata (P<0.05) dengan isolat lainnya. Isolat 8024 yang menghasilkan rataan diameter zona bening sebesar 0.76 cm (diketahui sebagai ras VIII yang memiliki virulensi moderat) tidak berbeda nyata (P>0.05) dengan isolat 011, 8021, Xoo12-231, Xoo11-030, Xoo12-200, Xoo12-207, Xoo11-022, Xoo12-285, Xoo13-303, dan Xoo12-176 namun berbeda nyata dengan isolat Xoo12-302, Xoo12-286, dan Xoo12-253. Zona bening terkecil dihasilkan oleh isolat Xoo12-253 (dengan rataan zona bening 0.30 cm).
Isolat Daerah Zona Bening (cm)
7608 Cibadak-Jabar 1.30 ± 0.12abc
7624 Bogor-Jabar 1.43 ± 0.27a
8021 Subang-Jabar 1.05±0.22bcde
8024 Cianjur-Jabar 0.76 ± 0.04efg
93-229 Harjobinangun-Jateng 1.28±0.14abc
Xoo12-012 Sudiang-Biringkanaya, Sulsel 1.24±0.04abc
Xoo12-176 Kauman-Batang, Jateng 0.84±0.24ef
Xoo12-177 Kauman-Batang, Jateng 1.00±0.44abcd
Xoo12-183 Kauman-Batang, Jateng 1.22±0.08abc
Xoo12-190 Kalimanggis, Subah, Batang 1.41±0.25a
Xoo12-195 Kalimanggis, Subah, Batang 1.18±0.10abcd
Xoo12-198 Kalimanggis, Subah, Batang 0.72±0.22fg
Xoo12-200 Kalimanggis, Subah, Batang 1.01±0.20cdef
Xoo12-207 Kalimanggis, Subah, Batang 1.03±0.02cdef
Xoo12-225 Duwet-Pekalongan, Jateng 1.31±0.24abc
Xoo12-231 Sawahan, Tulis-Batang, Jateng 1.04±0.11bcde
Xoo12-253 Sawahan, Tulis-Batang, Jateng 0.31±0.10h
Xoo12-285 Ds. Wr. Nangka Subang Jabar 0.81±0.38gh
Xoo12-286 Ds. Wr. Nangka Subang Jabar 0.42±0.02h
Xoo12-302 BBPP Btg. Kaluku,Sulsel 0.51±0.60gh
Xoo12-303 BBPP Btg. Kaluku, Sulsel 1.01 ± 0.60ef
Keterangan : Angka yang diikuti huruf yang sama pada kolom menunjukkan tidak berbeda nyata pada uji Duncan pada taraf 5%.
Kualitas DNA Genom Bakteri Xoo
DNA genom dari bakteri Xoo hasil isolasi dilihat kualitasnya dengan dua
parameter, yaitu uji kuantitatif DNA dengan alat Nanodrop dan uji kualitatif DNA dengan menggunakan elektroforesis gel agarosa. DNA yang sudah terisolasi akan terbentuk pita dari hasil elektroforesis gel agarosa, sedangkan untuk mengetahui konsentrasi dan kemurnian dari DNA yang telah diperoleh dilakukan dengan pembacaan absorban dengan menggunakan alat Nanodrop.
Uji ini dilakukan pengukuran dengan alat Nanodrop. Dari hasil pengukuran akan diperoleh nilai konsentrasi serta kemurnian dari DNA yang telah diisolasi. Konsentrasi DNA diketahui dari absorban DNA pada panjang gelombang 260 nm. Nilai 1.0 pada panjang 260 nm setara dengan 50 ng µL-1 utas ganda DNA. Rasio panjang gelombang A260 dengan A280 digunakan untuk mengetahui nilai kemurnian DNA terhadap kontaminasi protein termasuk RNA. Nilai kemurnian yang diperoleh pada sampel Xoo masih cukup baik, didalam
kisaran 1.8-2.0 namun terdapat beberapa sampel yang nilai kemurniannya kurang dan lebih dari kisaran tersebut (Lampiran 6). Hal ini disebabkan oleh banyak faktor salah satunya yaitu DNA yang tidak terlarut sempurna sehingga mempengaruhi pembacaan pada alat Nanodrop. Sedangkan untuk perolehan nilai konsentrasi pada DNA genom Xoo sangat bervariasi. Nilai konsentrasi yang
diperoleh dari yang terendah yaitu 45.6 ng µL-1 yang terdapat pada sampel 231 dan sampel yang memiliki konsentrasi DNA tertinggi pada sampel Xoo12-285 sebesar 1640.8 ng µL-1.
Parameter berikutnya dalam melihat kualitas DNA yang telah diisolasi yaitu dengan uji kualitatif. Uji kualitatif dilakukan dengan melihat DNA hasil isolasi pada gel agarosa 0.8%. Berdasarkan hasil yang diperoleh pada beberapa sampel Xoo (Gambar 2), DNA yang telah diisolasi terdapat smear pada beberapa
sampel, misalnya pada kedua sampel Xoo12-285 dan Xoo12-286. Namun pita yang dihasilkan dari hasil isolasi ini cukup baik karena hanya terbentuk satu pita.
Gambar 3 Elektroforegram hasil isolasi DNA genom bakteri Xoo M= Marker 100 bp ; Lajur 1= 8021 (2); L2= 8021(1);
L3=Xoo11 021(2); L4 = Xoo11-021 (1); L5 = Xoo12-225 (2); L6=Xoo12-225 (1); L7=Xoo12-286 (2);L8= Xoo12-286(1); L9= Xoo12-022 (1); L10= Xoo12-190 (2); L11= Xoo12-190 (1); L12= 207 (2); L13= 207 (1); L14= Xoo12-285 (2); L15= Xoo12-Xoo12-285 (1); L16= Xoo12-303 (2); L17= Xoo12-303(1)
Pita Polimorfik DNA Bakteri Xoo
Sebanyak 27 isolat bakteri Xoo diamplifikasi dengan menggunakan
Rep-PCR. Jenis primer yang digunakan yaitu BOXA1R, (GTG)5, dan ERIC. Banyaknya pita yang dihasilkan oleh primer BOXA1R yaitu 4 sampai 7 pita (Gambar 4). Ukuran pita DNA yang teramplifikasi oleh primer BOXA1R berkisar antara 350-2500 bp. Primer (GTG)5 dapat menghasilkan sebanyak 5 sampai 12 pita DNA sedangkan ukuran pita DNA yang teramplifikasi berkisar antara 300-3000 bp (Gambar 5). Untuk primer ERIC, banyak pita yang dihasilkan sebanyak 3 sampai 9 pita dan ukuran pita DNA yang teramplifikasi berkisar antara 300-3000 bp (Gambar 6).
Gambar 4 Elektroforegram hasil amplifikasi DNA Xoo dengan primer BOXA1R
M= Marker 100 bp ; L1= Xoo11-030; L2= Xoo11-003; L3 =Xoo12-183; L4= Xoo11-020; L5= Xoo12-231; L6=Xoo12-176; L7=Xoo12-253; L8= Xoo12-012; L9= Xoo12-177; L10= 7624; L11= 93-229; L12= Xoo12-011; L13=Xoo12-198; L14=Xoo12-200; L15=Xoo12-195; L16=Xoo11-021; L17= 8021; L18= 7608; L19= 8024; L20= Xoo12-286; L21= Xoo12-285; L22= Xoo12-303; L23= Xoo12-225; L24=Xoo11-022; L25=Xoo12-207; L26=Xoo12-190; L27=Xoo12-302
300 bp 500 bp 3000 bp
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17
2500bp
Gambar 5 Elektroforegram hasil amplifikasi DNA Xoo dengan primer (GTG)5 M= Marker 100 bp ; L1= Xoo11-030; L2= Xoo11-003; L3 =Xoo12-183; L4= Xoo11-020; L5 = Xoo12-231; L6=Xoo12-176; L7=Xoo12-207; L8= Xoo12-190; L9= Xoo11-021; L10= Xoo12-198; L11= Xoo12-253; L12= Xoo12-012; L13= Xoo12-200; L14=Xoo12-177; L15=93-229; L16=7608; L17= 8024; L18= 286; L19= 225; L20= 302; L21= 7624; L22= 011; L23= 303; L24= 8021; L25= Xoo11-022; L26= 195; L27= Xoo12-285
Gambar 6 Elektroforegram hasil amplifikasi DNA Xoo dengan primer ERIC
M= Marker 100 bp; L1= Xoo11-030; L2= Xoo11-003; L3 =Xoo12-183; L4= Xoo11-020; L5 = Xoo12-231; L6=Xoo12-176; L7=Xoo12-195; L8= Xoo12-012; L9= Xoo12-200; L10= Xoo12-177; L11= 7624; L12= 93-229; L13= Xoo12-011; L14=7608; L15=8024; L16=Xoo12-303; L17= Xoo12-285; L18= Xoo12-286; L19= Xoo12-225; L20= Xoo12-207; L21= Xoo12-190; L22= Xoo11-022; L23= Xoo11-021; L24= 8021; L25= Xoo12-198; L26= Xoo12-253; L27= Xoo12-302
Perhitungan statistik dengan menggunakan program Cervus untuk mengetahui hasil perhitungan jumlah alel per lokus yang dihasilkan dari tiap primer, nilai heterozigositas (He) untuk menggambarkan ukuran variasi genetik yang dihasilkan diperoleh nilai He terbesar pada primer ERIC, sedangkan
Polymorphism Information Content (PIC) untuk mengetahui seberapa tingkat
polimorfisme yang dihasilkan dari suatu marka molekular. Untuk nilai PIC terbesar diperoleh oleh primer ERIC yang memiliki nilai sebesar 0.34 (Tabel 3).
1200bp
M 1 2 3 4 5 6 7 8 9 M 10 11 12 13 14 15 16 17 18 M 19 20 21 22 23 24 25 26 27 M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 M 20 21 22 23 24 25 26 27
Tabel 3 Hasil perhitungan statistik pada primer Rep-PCR
Primer Jumlah alel/lokus He* PIC**
BOXA1R 3.000 0.3126 0.27
(GTG)5 3.000 0.2624 0.23
ERIC 2.438 0.4489 0.34
*) Heterozigositas
**)
Polymorphism Information Content
Klasterisasi Bakteri Xoo
Analisis klaster ini dilakukan berdasarkan hasil amplifikasi DNA Xoo
dengan primer BOXA1R, (GTG)5, dan ERIC kemudian dianalisis dengan menggunakan program NTSYS 2.1 yang menghasilkan dendrogram. Amplifikasi DNA Xoo dengan menggunakan primer BOXA1R, menghasilkan dendrogram
dengan sebanyak 2 klaster pada koefisien kemiripan 0.65 (Gambar 7). Dua klaster tersebut terdiri atas klaster 1 yaitu dengan isolat 030, 003, Xoo11-020, Xoo12-183, Xoo12-231, 93-229, Xoo12-198, Xoo12-200, Xoo12-195, Xoo11-021, Xoo12-286, Xoo12-012, Xoo12-011, Xoo12-177, 7624, 8021, dan 8024. Klaster 2 terdiri atas Xoo12-285, Xoo12-303, dan Xoo12-302, Xoo12-253, Xoo12-207, Xoo11-022 dan Xoo12-190.
Kemiripan pola pita yang dihasilkan isolat tersebut dapat disebabkan oleh kemiripan daerah asal isolat tersebut yaitu Jawa Tengah. Namun terdapat isolat yang berasal dari daerah yang berbeda misalnya Xoo11-003, Xoo11-020, Xoo12-286, 8021, dan 8024 yang berasal dari Jawa Barat, dan Xoo12-021 yang berasal dari Sumatera Barat. Pada klaster 2 terdapat isolat Xoo12-285 yang berasal dari Jawa Barat serta Xoo12-302 dan Xoo12-303 yang berasal dari Sulawesi Selatan. Xoo12-253, Xoo12-190, dan Xoo12-207 yang berasal dari Jawa Tengah dan Xoo11-022 yang berasal dari Sumatera Barat.
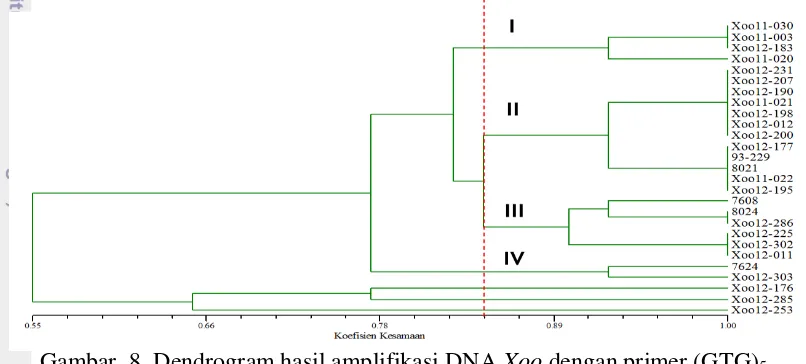
Amplifikasi DNA Xoo dengan menggunakan primer (GTG)5, menghasilkan dendrogram dengan sebanyak 4 klaster pada koefisien kemiripan 0.65 (Gambar 6). Empat klaster tersebut terdiri atas klaster 1 yaitu dengan isolat Xoo11-030, Xoo11-003, Xoo12-183, dan Xoo11-020. Klaster 2 terdiri atas isolat Xoo12-231, Xoo12-207, Xoo12-190, Xoo11-021, Xoo12-198, Xoo12-012, Xoo12-200, Xoo12-177, 93-229, 8021,Xoo11-022, dan Xoo12-195. Klaster 3 terdiri atas isolat 7608, 8024, 286, 225, 302, dan Xoo12-011 sedangkan klaster 4 terdiri atas isolat 7624 dan Xoo12-303. Sedangkan isolat Xoo12-176, Xoo12-253, dan Xoo12-285 tidak termasuk dalam klaster.
Berdasarkan dendrogram yang terbentuk (Gambar 8), isolat Xoo11-030, Xoo11-003, Xoo11-020 dan Xoo12-183 terbentuk menjadi 1 klaster namun terdiri atas beberapa daerah yaitu Jawa Barat, Jawa Tengah, dan Sumatera Barat. Isolat 231. 207, 190, Xo11-021, 198, 012, Xoo12-200, Xoo12-177, 93-229, 8021, Xoo11-022, dan Xoo12-195 tergabung menjadi klaster 2 dan sebagian besar terdiri atas daerah Jawa Tengah, namun terdapat juga isolat yang berasal dari Sulawesi Selatan dan Sumatera Barat. Klaster 3 terdiri atas isolat 7608, 8024, Xoo12-286, Xoo12-225, Xoo12-302 terdiri atas daerah Jawa Barat dan Sulawesi Selatan. Klaster 4 terdiri atas isolat 7624 yang berasal dari Jawa Barat dan Xoo12-303 yang berasal dari Sulawesi Selatan.
Gambar 8 Dendrogram hasil amplifikasi DNA Xoo dengan primer (GTG)5 Amplifikasi DNA Xoo dengan menggunakan primer ERIC, menghasilkan
Gambar 9 Dendrogram hasil amplifikasi DNA Xoo dengan primer ERIC Asosiasi Aktivitas Selulolitik dengan Amplifikasi DNA Xoo
Setelah dilakukan pengukuran zona bening yang dihasilkan dari uji selulolitik dan analisis molekuler kemudian dilakukan analisis asosiasi antara kedua analisis tersebut berdasarkan Tabel 4.
Tabel 4 Isolat Xoo berdasarkan klaster pada primer dan diameter zona bening
No. Kode Isolat Diameter Zona Bening BOXA1R (GTG)Primer
5 ERIC
1 7608 1.30 ± 0.12 * III III
2 7624 1.43 ± 0.27 I IV III
3 8021 1.05±0.22 I II IV
4 8024 0.76 ± 0.04 I III III
5 93-229 1.28±0.14 I II III
6 Xoo11-003 1.30±0.17 I I I
7 Xoo11-020 1.36±0.08 I I I
8 Xoo11-021 1.31±0.08 I II III
9 Xoo11-022 0.87±0.12 II II I
10 Xoo11-030 1.00±0.10 I I I
11 Xoo12-011 1.05±0.15 I III III
12 Xoo12-012 1.24±0.04 I II II
13 Xoo12-176 0.84±0.24 * * II
14 Xoo12-177 1.00±0.44 I II III
15 Xoo12-183 1.22±0.08 I I I
16 Xoo12-190 1.41±0.25 II II *
17 Xoo12-195 1.18±0.10 I II V
18 Xoo12-198 0.72±0.22 I II V
19 Xoo12-200 1.01±0.20 I II *
20 Xoo12-207 1.03±0.02 II II I
21 Xoo12-225 1.31±0.24 * III I
22 Xoo12-231 1.04±0.11 I II I
23 Xoo12-253 0.31±0.10 II * *
24 Xoo12-285 0.81±0.38 II * *
25 Xoo12-286 0.42±0.02 I III IV
26 Xoo12-302 0.51±0.60 II III *
27 Xoo12-303 1.01 ± 0.60 II IV *
Tiap isolat Xoo yang diuji dengan menggunakan primer Rep-PCR yaitu
BOXA1R, (GTG)5, dan ERIC dan tiap primer menghasilkan pita yang berbeda. Dengan menggunakan aplikasi Tassel dilakukan analisis GLM untuk mengetahui
asosiasi antara marka molekuler dan zona bening. Asosiasi marka molekuler dengan zona bening dikatakan berbeda nyata apabila memiliki nilai P-Value<
0.001. Namun setelah dianalisis tidak terdapat marka spesifik yang berasosiasi dengan zona bening yang ditunjukkan pada Tabel 5.
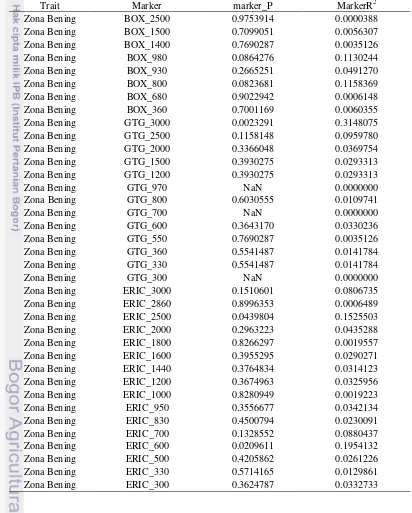
Tabel 5 Hasil analisis asosiasi fenotip dengan genotip
Trait Marker marker_P MarkerR2
Zona Bening BOX_2500 0.9753914 0.0000388
Zona Bening BOX_1500 0.7099051 0.0056307
Zona Bening BOX_1400 0.7690287 0.0035126
Zona Bening BOX_980 0.0864276 0.1130244
Zona Bening BOX_930 0.2665251 0.0491270
Zona Bening BOX_800 0.0823681 0.1158369
Zona Bening BOX_680 0.9022942 0.0006148
Zona Bening BOX_360 0.7001169 0.0060355
Zona Bening GTG_3000 0.0023291 0.3148075
Zona Bening GTG_2500 0.1158148 0.0959780
Zona Bening GTG_2000 0.3366048 0.0369754
Zona Bening GTG_1500 0.3930275 0.0293313
Zona Bening GTG_1200 0.3930275 0.0293313
Zona Bening GTG_970 NaN 0.0000000
Zona Bening GTG_800 0.6030555 0.0109741
Zona Bening GTG_700 NaN 0.0000000
Zona Bening GTG_600 0.3643170 0.0330236
Zona Bening GTG_550 0.7690287 0.0035126
Zona Bening GTG_360 0.5541487 0.0141784
Zona Bening GTG_330 0.5541487 0.0141784
Zona Bening GTG_300 NaN 0.0000000
Zona Bening ERIC_3000 0.1510601 0.0806735
Zona Bening ERIC_2860 0.8996353 0.0006489
Zona Bening ERIC_2500 0.0439804 0.1525503
Zona Bening ERIC_2000 0.2963223 0.0435288
Zona Bening ERIC_1800 0.8266297 0.0019557
Zona Bening ERIC_1600 0.3955295 0.0290271
Zona Bening ERIC_1440 0.3764834 0.0314123
Zona Bening ERIC_1200 0.3674963 0.0325956
Zona Bening ERIC_1000 0.8280949 0.0019223
Zona Bening ERIC_950 0.3556677 0.0342134
Zona Bening ERIC_830 0.4500794 0.0230091
Zona Bening ERIC_700 0.1328552 0.0880437
Zona Bening ERIC_600 0.0209611 0.1954132
Zona Bening ERIC_500 0.4205862 0.0261226
Zona Bening ERIC_330 0.5714165 0.0129861
PEMBAHASAN
Hasil Peremajaan Bakteri Xanthomonas oryzae pv. oryzae (Xoo)
Xanthomonas oryzae pv. oryzae (Xoo) merupakan bakteri Gram negatif
yang menyebabkan penyakit hawar daun bakteri (HDB) pada padi. Berdasarkan bentuknya, bakteri Xoo dikelompokkan menjadi bakteri basil karena memiliki
tubuh yang menyerupai batang. Bakteri Xoo ini bersifat aerob, serta memiliki alat
gerak berupa flagel namun ukurannya sangat kecil dengan tebal sekitar 0.02-0.1 mikro. Flagel yang dimilikinya hanya satu sehingga bakteri Xoo termasuk dalam
bakteri monotrik (CABI 2008). Menurut Liu et al. (2006) menyatakan bahwa
bakteri Xoo memiliki fenotip pada media padat yakni berlendir, cembung, bulat
dan berwarna kuning karena adanya pigmen Xanthomonadin.
Isolat-isolat Xoo ditumbuhkan pada media Wakimoto Agar (WA) karena
terbukti pada media tersebut dapat menghasilkan kultur murni dan bersih jika dibandingkan dengan media Yeast Dextrose Calcium Carbonate (YDC) (Noor et al. 2006). Selain itu, penggunaan media WA dimaksudkan untuk meningkatkan
pertumbuhan bakteri Xoo karena dalam media ini mengandung unsur-unsur
nitrogen yang sangat dibutuhkan untuk pertumbuhan bakteri Xoo. Menurut IRRI
(2010) menyatakan bahwa penyakit HDB yang disebabkan oleh Xoo ini dapat
berkembang lebih pesat pada media yang mengandung unsur nitrogen yang tinggi. Isolat yang digunakan merupakan koleksi dari BB-Biogen. Isolat Xoo
yang diremajakan dalam media agar miring dan diinkubasi selama 3-5 hari dalam suhu 28°C, menghasilkan warna kuning pada permukaan isolat (Gambar 1). Hal ini menunjukkan bahwa adanya pigmen Xanthomonadin yang dihasilkan oleh
Xoo. Tujuan dari inkubasi selama waktu 3-5 hari dengan tujuan agar
memperbanyak koloni yang tumbuh pada media WA. Suhu inkubasi yang digunakan yaitu 28°C merupakan suhu optimum untuk pertumbuhan bakteri Xoo yang berkisar antara 25-30°C (Liu et al 2006).
Aktivitas Selulolitik Bakteri Xoo pada Media CMC
Media Carboxymethyl Cellulose (CMC) sebagai media seleksi
pertumbuhan untuk mikroorganisme yang mempunyai kemampuan selulolitik. CMC merupakan eter polimer selulosa linear. Supernatan dari hasil sentrifugasi media NB dengan bakteri Xoo kemudian diletakkan pada media CMC padat yang
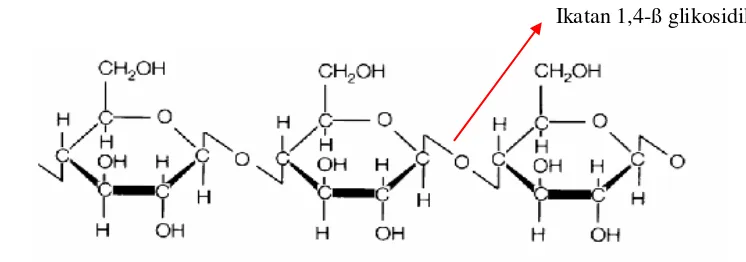
mengandung CMC 0.1% (b/v) yang berfungsi sebagai penyedia substrat selulosa. Pewarna Congo red yang digunakan pada pengujian aktivitas selulolitik akan
mengikat pada ikatan 1,4-ß glikosidik di dalam selulosa (Gambar 10) sehingga menimbulkan warna merah, sedangkan warna bening yang timbul disekitar lubang mengindikasikan bahwa selulosa sudah terurai menjadi monosakaridanya. Karena ikatan 1,4-ß glikosidik sudah dilepaskan oleh enzim selulase yang dihasilkan bakteri tersebut maka congo red tidak dapat mengikat glukosa, kemudian
Gambar 10 Struktur selulosa (Hilden dan Johanson 2004)
Hasil uji selulolitik menunjukkan bahwa isolat 7624 merupakan isolat yang mampu menghasilkan rataan zona bening yang paling besar diantara isolat lain. Menurut Sudir dan Suprihanto (2006) menyatakan bahwa isolat 7624 termasuk ras IV yang memiliki virulensi tinggi pada padi. Di Indonesia, isolat Xoo
diwakili oleh tiga ras Xoo yang paling dominan yaitu ras III, IV, dan VIII
(Suparyono et al. 2004), diketahui bahwa ras IV memiliki tingkat virulensi
tertinggi, diikuti oleh patotipe VIII dan III. Selain isolat 7624, terdapat isolat lain yang cukup tinggi menghasilkan zona bening yaitu isolat Xoo12-190.
Berdasarkan isolat-isolat yang diuji terdapat isolat 8024 yang merupakan bagian dari ras VIII yang memiliki virulensi moderat (Sudir dan Suprihanto 2006). Diketahui bahwa rataan zona bening yang dihasilkan 8024 dan berbeda nyata (P>0.05) dengan isolat 7624. Isolat-isolat yang berasal dari IV dan VIII sering digunakan untuk uji virulensi langsung pada tanaman padi di lapangan (Sudir dan Suprihanto 2006). Di daerah Jawa Barat, Daerah Istimewa Yogyakarta, dan Jawa Tengah, populasi Xoo ras VIII dilaporkan endemik di beberapa lokasi
pertanaman padi. Di lapang, persebaran ras IV tidak begitu luas seperti ras VIII namun virulensi Xoo ras IV relatif lama bertahan, dan ditenggarai sebagai ras
yang tetap ganas hingga saat ini (Kadir 2009). Sedangkan untuk virulensi selulase terkecil dimiliki oleh isolat Xoo12-253.
Penelitian ini menggunakan isolat Xoo yang berasal dari berbagai daerah
yaitu Jawa Barat, Jawa Tengah, Sumatera Barat dan Sulawesi Selatan yang berasal dari varietas padi yang berbeda-beda.Varietas padi yang digunakan merupakan inang bagi bakteri Xoo. Uji selulolitik menunjukkan bahwa besar zona
bening yang dihasilkan tiap isolat tidak bergantung menurut daerah asal bakteri tersebut. Tidak ada daerah yang menghasilkan dominan zona bening terbesar dan terkecil.
Bakteri patogen seperti Xoo melakukan beberapa strategi untuk dapat
melumpuhkan inang, diantaranya harus dapat masuk ke dalam inang. Pada tanaman inang, bakteri patogen dapat masuk melalui stomata, hidatoda, atau luka. Dinding sel tanaman terdiri dari komponen kompleks yang membentuk penghalang fisik untuk pertahanan patogen. Selain protein dan lignin, sebagian besar komponen dinding sel polisakarida, seperti selulosa, hemiselulosa dan pektin. Xoo membutuhkan sejumlah besar enzim ekstraseluler untuk mengatasi
polisakarida, untuk menurunkan pertahanan inang dengan mendegradasi dinding sel tanaman sehingga patogen untuk menembus ke dalam jaringan tanaman (Sun
protease, dan xilanase memiliki peranan penting sebagai virulensi pada bakteri patogen Xoo. Diketahui bahwa selulase merupakan faktor virulensi terpenting
pada Xoo (Temuujin et al. 2011)
Penyakit hawar daun bakteri berkembang pesat pada varietas padi yang rentan. Bakteri patogen Xoo mempunyai tingkat virulensi yang bervariasi
berdasarkan kemapuannya menginfeksi varietas padi yang mempunyai gen dengan resistensi yang berbeda dan interaksi antara gen virulen patogen dan gen tahan tanaman (Jha et al. 2007). Beragamnya patotipe di lapangan karena adanya
perbedaan sifat fisiologis tanaman maupun faktor lingkungan (suhu dan kelembapan). Faktor yang berpengaruh terhadap interaksi stadium tumbuh tanaman dengan variasi patotipe patogen adalah fenomena sifat tahan yang muncul pada saat tanaman mencapai umur tertentu, mutasi gen patogen, dan sifat heterogen alamiah yang ada pada populasi patogen (Djatmiko dan Prihatiningsih 2011).
Kualitas DNA Genom Bakteri Xoo
Isolasi DNA genom bakteri Xoo pada penelitian ini menggunakan metode
Shanti (2001). Metode ini digunakan untuk isolasi DNA genom karena mudah dan tidak membutuhkan waktu yang lama (Shanti 2001). Tahap penting proses isolasi DNA ialah tahap pemecahan dinding sel untuk mengeluarkan DNA (Bintang 2010). Bakteri ditumbuhkan terlebih dahulu pada media Nutrient Broth (NB)
sebelum proses isolasi DNA selama 24 jam, kemudian disentrifugasi dan diambil peletnya.
DNA diperoleh dengan menggunakan bufer ekstraksi. Bufer ekstraksi ditambahkan pada pelet yang sebelumnya telah dipisahkan dari supernatannya. Bufer ekstraksi yang digunakan terdiri atas Tris-HCl, EDTA, NaCl, SDS 20%, dan PVP. Larutan Tris-HCl berfungsi sebagai larutan penyangga yang menjaga kestabilan pH. Penambahan EDTA adalah untuk mengkelat ion Mg2+ yang berfungsi untuk menjaga stabilitas pada membran sel. Larutan NaCl yang ditambahkan pada bufer ekstraksi bertujuan untuk memisahkan molekul DNA dari komponen lainnya (protein dan polisakarida) dengan cara membentuk ikatan ionik dengan asam nukleat (kondisi ionik yang lebih stabil). Larutan bufer ekstraksi juga ditambahkan PVP (Polyvinylpoly-pyrrolidone) yang mencegah
terbentuknya warna coklat polifenol pada DNA. Pencegahan ini dilakukan dengan menghambat aktivitas enzim polifenol oksidase yang dapat mendegradasi rantai DNA dan menyebabkan teroksidasinya senyawa fenol (Bintang 2010).
DNA bakteri Xoo yang telah diperoleh dari isolasi DNA kemudian diuji
secara kuantitatif dan kualitatif. Kualitas DNA yang terlihat dari dua parameter uji tersebut tentu berkaitan erat dengan proses isolasi DNA yang dilakukan. Uji kuantitatif dilakukan untuk mengetahui ada atau tidaknya kontaminasi protein dan RNA pada DNA yang diisolasi. Nilai kemurnian seluruh DNA hasil isolasi cukup beragam, terdapat sampel yang sesuai dengan batasan rasio absorbans A260/A280 yaitu 1.8-2.0 (Sambrook dan Russel 2001). Walaupun terdapat sampel yang memiliki rasio kurang atau lebih dari batasan yang ditentukan, namun DNA hasil isolasi dapat digunakan untuk amplifikasi PCR karena dalam metode Rep-PCR kualitas DNA tidak mengharuskan menggunakan DNA yang murni (Lisek et al.
sebagai cetakan DNA. Konsentrasi DNA hasil isolasi juga beragam (Lampiran 6), sehingga dilakukan proses pengenceran untuk menyeragamkan konsentrasi DNA. Konsentrasi DNA dari seluruh sampel diseragamkan menjadi 25 ng µL-1. Penyeragaman konsentrasi DNA dilakukan agar jumlah DNA yang digunakan diperikirakan sama untuk setiap tahapan PCR. Hal ini penting sebagai upaya untuk mendapatkan hasil PCR yang konsisten dan menghindari kesalahan analisis akibat kelebihan atau kekurangan jumlah DNA yang digunakan.
Hasil uji kualitatif menunjukkan terdapat beberapa sampel DNA Xoo lain
yang masih menunjukkan fragmen smear (Lampiran 7). Fragmen smear adalah
fragmen yang muncul akibat terpotongnya untaian DNA utuh penyusun kromosom selama proses ekstraksi DNA. Terpotongnya fragmen tersebut dapat disebabkan oleh kerusakan mekanis sebagai akibat aktivitas enzimatis oleh enzim DNase selama rangkaian pengerjaan isolasi (Noferta 2011). Pita DNA yang terlihat pada gel agarosa menunjukkan intensitas yang berbeda tiap contohnya dan konsentrasi DNA yang diperoleh juga berbeda-beda. Umumnya, konsentrasi DNA genom yang tinggi akan menghasilkan intensitas pita yang tinggi. Hal yang mempengaruhi tinggi dan rendahnya konsentrasi DNA ini yaitu kandungan senyawa yang terdapat pada sampel, prosedur ekstraksi, dan metode pengendapan atau presipitasi DNA (Chen et al. 2010).
Pita Polimorfik DNA Bakteri Xoo
Isolat Xoo sebanyak 27 buah telah diamplifikasi dengan menggunakan
teknik Rep-PCR. Pendekatan teknik repetitive PCR (Rep-PCR) merupakan salah
satu teknik untuk menganalisis karakteristik molekuler pada bakteri. Rep-PCR
akan mengamplifikasi pada urutan DNA yang berulang. Urutan DNA yang berulang ini dapat digunakan untuk membedakan ras bakteri yang sebelumnya sulit dibedakan dengan metode klasifikasi yang baku. Prosedur repetitive PCR
(Rep-PCR) melibatkan penggunaan satu primer nukleotida dengan sekuens
berulang. Sekuens berulang ini dapat dikategorikan menjadi empat bagian yaitu
Repetitive Extragenic Palindromic (REP) dengan panjang urutan 35-40 bp, Enterobacterial Repetitive Intergenic Consensus (ERIC) dengan panjang urutan
124-127 bp, elemen BOX dengan panjang urutan 154 bp, dan (GTG)5 (Lisek et al. 2011).
Berdasarkan hasil amplifikasi dari 27 buah isolat Xoo, diketahui bahwa
setiap isolat memiliki pita yang bervariasi tergantung dari primer yang digunakan. Jumlah dan intensitas pita yang dihasilkan setelah amplifikasi DNA dengan PCR sangat tergantung bagaimana primer mengenal urutan DNA komplementernya pada cetakan DNA (DNA template) sehingga kemiripan dengan isolat lain pun
rendah. (Poerba 2008). Berdasarkan penelitian yang dilakukan, diketahui bahwa dengan menggunakan primer ERIC dapat menghasilkan variasi pita pada DNA genom Xoo. Namun terdapat dua isolat yang menunjukkan DNA yang cukup
berbeda dibanding dengan isolat lainyaitu pada isolat Xoo12-176 dan Xoo12-253. Isolat tersebut menunjukkan profil pita DNA yang cukup berbeda saat diamplifikasi dengan primer ERIC metode Rep-PCR. Munif et al. (2004)
menyatakan bahwa metode Rep-PCR pada setiap primer yang digunakan mampu
juga disebut polimorfisme apabila primer mengamplifikasi daerah genom yang bervariasi, sebaliknya monomorfisme jika primer mengamplifikasi daerah genom yang tidak bervariasi.
Berdasarkan analisis statistik dari hasil amplifikasi DNA dari 27 isolat Xoo
(Tabel 2) diketahui bahwa nilai heterozigositas (He) tertinggi dihasilkan dari primer ERIC. Semakin besar nilai He yang diperoleh menunjukkan bahwa tingginya variasi genetik yang dihasilkan (Mulyadana 2010). Hal ini menunjukkan bahwa primer ERIC yang memiliki variasi genetik yang tinggi.Selain nilai heterozigositas, dihitung juga nilai PIC (Polymorphism Information Content).
Nilai PIC mengacu pada nilai suatu penanda untuk mendeteksi tingkat polimorfisme. Terjadinya perbedaan tingkat polimorfisme karena primer mengamplifikasi DNA genom yang bervariasi. Semakin banyak variasi daerah DNA genom yang diamplifikasi oleh primer maka semakin tinggi juga tingkat polimorfisme suatu organisme (Poerba 2008).
Nilai PIC tergantung dari banyaknya frekuensi dan distribusi alel yang ditemukan (Suryatini 2011). Menurut Tasliah et al. (2013) menyatakan bahwa
kriteria nilai PIC adalah (PIC>0.5) sangat informatif, (0.5>PIC>0.25) cukup informatif, dan ((PIC<0.25) kurang informatif. Hal ini menunjukkan bahwa primer (GTG)5 kurang informatif untuk digunakan sebagai penanda molekuler. Dalam penelitian ini primer ERIC memiliki nilai PIC yang lebih besar dibandingkan dengan primer BOXA1R. Semakin besar nilai PIC suatu primer maka primer tersebut semakin bagus digunakan sebagai penanda molekuler. Menurut penelitian yang dilakukan oleh Rezai et al. (2012) menyatakan bahwa
primer ERIC dapat menghasilkan nilai PIC terbesar pada analisis karakteristik molekuler pada bakteri Xanthomonas citri di Iran. Primer ERIC juga
menunjukkan nilai PIC terbesar dibanding dengan primer BOXA1R pada penelitian yang dilakukan pada bakteri Sinorizobium meliloti. Namun primer
BOXA1R memiliki nilai PIC yang tinggi pada bakteri Rhizobium sullae
(Elboutahiri et al 2008)
Klasterisasi Bakteri Xoo
Sebanyak 27 isolat Xoo diamplifikasi DNA genomnya dengan
Terdapat isolat yang berasal dari Jawa Tengah dan isolat yang berasal dari Sumatera Barat yang selalu terbentuk satu kluster pada primer BOXA1R dan (GTG)5, namun pada primer ERIC isolat-isolat tersebut terpisah dan terbagi dalam klaster yang berbeda. Pada primer ERIC, isolat-isolat yang berasal dari Sumatera Barat mengelompok menjadi satu klaster bersama dengan isolat lain yang berasal dari Jawa Barat dan Jawa Tengah, seperti pada klaster 1, 2, dan 3. Sedangkan isolat yang berasal dari Sulawesi Selatan bergabung dengan isolat asal Jawa Tengah (pada klaster 2) dan bergabung pada isolat asal Sumatera Barat, Jawa tengah, dan Jawa Barat (pada klaster 3), dan isolat berasal dari Jawa Barat dan Jawa Tengah mampu membentuk klaster masing-masing menurut daerahnya. Menurut Poerba (2008), sampel yang berasal dari satu wilayah cenderung berkerabat dekat dan mengelompok pada jarak genetik yang dekat. Hal ini disebabkan adanya kisaran geografi yang rendah, secara genetika lebih seragam dibandingkan dengan populasi yang tersebar luas. Keshavarz (2011) menyatakan bahwa karakteristik molekuler yang dilakukan dengan primer ERIC pada bakteri
Xoo yang berasal dari Semenanjung Malaysia, dapat dipisahkan berdasarkan
daerah asal bakteri tersebut yang mungkin menunjukkan bahwa ada kekerabatan antara ras bakteri Xoo.
Keragaman genetik yang cukup tinggi dari bakteri Xoo yang diuji
kemungkinan dapat disebabkan perbedaan daerah asal setiap isolat atau telah terjadi mutasi dalam sel inang yang berbeda. Hasil klasterisasi ini penting artinya dan diperlukan untuk membantu mengembangkan varietas padi tahan HDB secara spesifik lokasi di Indonesia. Adanya campuran patotipe yang diperoleh dari daerah yang sama, mengimplikasikan perlunya upaya pergiliran menggunakan varietas tahan berlatar belakang tahan kombinasi (pyramiding gen) (Suryadi et al.
2014).
Menurut hasil penelitian yang dilakukan oleh Gonzales et al. (2006)
menunjukkan bahwa perbedaan diantara karakteristik genom pada isolat Xoo yang
berasal dari Asia dan Afrika dengan teknik Rep-PCR dengan menggunakan
primer ERIC. Keshavarz et al. (2011) menyatakan bahwa genus Xanthomonas
yang diamplifikasi dengan primer ERIC dapat menghasilkan pola sidik jari yang kompleks karena menghasilkan pita yang lebih banyak dan bervariasi ukurannya. Jika dibandingkan dengan amplifikasi dengan primer BOXA1R dan (GTG)5, jumlah pita yang dihasilkan tidak banyak dan ukuran yang kurang bervariasi. Yang dan Yen (2012) menyatakan bahwa primer BOXA1R cukup baik untuk membedakan spesies dari bakteri E.coli. Li et al. (2011) juga menyatakan bahwa
isolat Xoo tidak dapat dibedakan secara genetik dengan primer (GTG)5, namun primer ini dapat digunakan untuk mengidentifikasi spesies pada Lactobacillus, Enterococci, dan bakteri asam asetat.
Asosiasi Aktivitas Selulolitik dan Amplifikasi DNA Xoo
Setelah dilakukan analisis pada pengujian selulolitik dan analisis molekuler pada bakteri Xoo kemudian dianalisis apakah terdapat asosiasi diantara
yang dihasilkan serta berdasarkan hasil analisis General Linear Model (GLM)
dengan aplikasi program komputer Tassel.
Hasil asosiasi yang diperoleh dari Tabel 4 menunjukkan bahwa hasil pengelompokkan yang diperoleh dari analisis karakteristik molekuler Rep-PCR tidak mengelompok berdasarkan ukuran zona bening yang dihasilkan dari pengujian selulolitik. Isolat Xoo yang menghasilkan diameter zona bening besar
tidak selalu mengelompok dengan isolat Xoo yang dapat menghasilkan zona
bening yang besar. Diketahui juga dari pengelompokkan yang diperoleh dari analisis karakteristik molekuler, bahwa isolat mengelompok tidak berdasarkan daerah dari asal isolat Xoo. Seperti yang diketahui, asal isolat yang digunakan
berasal dari Jawa Barat, Jawa Tengah, Sumatera Barat, dan Sulawesi Selatan. Isolat Xoo asal Jawa Barat dan Jawa Tengah diketahui bahwa isolat asal daerah
tersebut memiliki virulensi yang cukup tinggi jika dibandingkan dengan isolat dari daerah lain (Kadir 2009).
Sedangkan berdasarkan hasil asosiasi yang diperoleh dengan menggunakan aplikasi program Tassel (Tabel 5) dengan melihat nilai P-Value
yang dihasilkan. P-Value dari asosiasi fenotipe dan genotipe yang diperoleh
dibawah 0.001 yang artinya berbeda nyata. Dari semua pengukuran zona bening dan marka molekular yang digunakan menghasilkan nilai yang tidak berbeda nyata sehingga hasil analisis asosiasi diatas menunjukan bahwa tidak terdapat asosiasi atau tidak ada kaitan antara fenotipe (pengujian selulolitik) dan genotipe (analisis molekuler) dengan marker molekular yang digunakan yaitu ERIC, BOXA1R, dan (GTG)5 dari bakteri Xoo yang diperoleh dari berbagai daerah di Indonesia. Hal ini diduga karena urutan nukleotida pada genom Xoo yang
diamplifikasi dengan Rep-PCR tidak berpengaruh pada urutan nukleotida
penghasil selulase sehingga memiliki korelasi yang rendah diantara keduanya. Hasil analisis pada asosiasi ini juga didukung dengan penelitian yang dilakukan oleh Tajima et al. (2000) mengenai asosiasi fenotipe eksopolisakarida
(EPS) dan keragaman genetik. Penelitian dilakukan padabakteri Bradyrhizobium japonicum, Shinorhizobium meliloti, dan Rhizobium leguminosarum dengan
teknik Rep-PCR membentuk pengelompokkan yang diketahui memiliki korelasi
yang rendah terhadap eksopolisakarida yang dihasilkan. Sehingga dapat diketahui bahwa korelasi pada karakteristik molekuler yang dihasilkan dari amplifikasi Rep
-PCR memiliki korelasi yang sangat rendah dan tidak terdapat asosiasi yang signifikan terhadap faktor virulensi yang dihasilkan oleh bakteri patogen Xoo.
SIMPULAN
Isolat 7624 diketahui sebagai penghasil selulase tertinggi sebagai patogen potensial dan tergolong dalam klaster 3 pada primer ERIC sedangkan isolat Xoo12-253 diketahui sebagai penghasil selulase terendah. Berdasarkan hasil asosiasi dari uji aktivitas selulolitik dan analisis molekuler dengan Rep-PCR
SARAN
Analisis molekular yang dilakukan dengan metode Rep-PCR cukup
mudah dan cepat namun jumlah isolat yang digunakan perlu ditambah. Primer ERIC merupakan primer yang cukup baik untuk membedakan diantara spesies pada Xanthomonas oryzae pv. oryzae. Selain itu diperlukan penelitian lebih lanjut
untuk memanfaatkan isolat Xoo yang berpotensi menghasilkan aktivitas selulase
yang tinggi serta eksplorasi lebih lanjut pada faktor virulensi lainnya pada Xoo
misalnya eksopolisakarida dan xilanase.
DAFTAR PUSTAKA
Babu AG dan Thind BS. 2005. Potential use of combination of Pantoea agglomerans, Pseudomonas fluorescens, and Bacillus subtilis AS
biocontrol agents for the control of bacterial blight of rice [terhubung berkala]. http://www.agridept.gov.lk/ other_sub_pages.php?id=8 (29 Mei 2014).
Bintang M. 2010. Biokimia Teknik Penelitian. Jakarta (ID): Penerbit Erlangga.
[CABI] Commonwealth Agricultural Bureau International. 2008. Xanthomonas oryzae pv. oryzae. Wallingford (UK): CABI.
Chatterjee A, Cui Y, Liu Y, Dumenyo KC, dan Chatterjee AK. 1995. Inactivation of rsmA leads to overproduction of extracellular pectinase, cellulose and
proteases in Erwiniacarotovora subsp. carotovora in the absence of the
starvation/cell-density-sensing signal, N-(3-oxohexanoyl)-L-homoserine
lactone. J.Appl Environ Microbiol 61:1959-1967.
Chen H, Rangasamy M, Tan SY, Wang H, Siegfried BD. 2010. Evaluation of five methods for total DNA extraction from western corn rootworm beetles.
PlosONE 5: 1-6.
[Ditjen TP] Direktorat Perlindungan Tanaman Pangan. 2011. Prakiraan Serangan BLB pada Padi di Indonesia Masa Tanam Tahun 2011. Jakarta (ID): Ditjen TP.
Djatmiko HA dan Prihatiningsih N. 2011. Penentuan patotipe dan karakteristik molekuler Xanthomonas oryzae pv. oryzae pada tanaman padi di wilayah
Banyumas. J. HPT Tropika 11(1):35-46.
Elboutahiri N, Thami-Alami I, Zaid E, Udupa SM. 2008. Genotypic characterization of indigenous Sinorhizobium meliloti and Rhizobium sullae
by rep- PCR, RAPD and ARDRA analyses. African Journal of Biotechnology 8 (6): 979-985.
Hilden L, Johanson G. 2004. Recent developments on cellulases and carbohydrate binding molecules with cellulose affinity. Biotechnol Lett 26:1683-1693.
Hu J, Qian W, He C. 2006. The Xanthomonas oryzae pv. oryzae eglXoB
endoglucanase gene is required for virulence to rice. FEMS Microbiol Lett :