DINAMIKA PERKEMBANGAN OVARIUM
RUSA TIMOR
(Cervus timorensis)
DENGAN
TINJAUAN KHUSUS PADA GAMBARAN DAN
KARAKTERISTIK HISTOKIMIA FOLIKEL
NAJDA RIFQIYATI
SEKOLAH PASCASARJANA
INSTITUT PERT ANIAN BOGOR
BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul Dinamika Perkembangan Ovarium Rusa Timor (GeNus timorensis) dengan Tinjauan Khusus pada Gambaran dan Karakteristik Histokimia Folikel adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Dafiar Pustaka di bagian akhir tesis ini.
Bogar, Mei 2006
Najda Rifqiyati
Histokimia Folikel. Dibimbing oleh MOZES R. TOELIHERE dan SRIHADI AGUNGPRIYONO.
Rusa timor (GeNus timorensis) adalah salah satu ruminansia asli Idonesia. Rusa timor merupakan rusa tropik yang belum banyak teliti di Indonesia termasuk aspek biologi reproduksinya. Data biologi reproduksi sangat penting
untuk mendukung penerapan teknologi reproduksi sebagai upaya
perkembangbiakan rusa untuk mencegah kepunahan populasi dan
meningkatkan pemanfaatan rusa timor sebagai satwa harapan dengan kualitas maksimal.
Penelitian ini menggunakan dua ekor rusa timor betina dewasa. Ovarium diambil dari hewan yang telah dikorbankan atau disembelih. Kemudian diukur morfometri makroskopisnya dalam kondisi segar. Pengamatan mikroskopis ovarium dilakukan dengan metode pewamaan HE, AB-PAS dan histokimia lektin. Ovarium rusa timor berbentuk ovoid dengan panjang 0.37-054 cm, Ie bar 0.33-0.46 cm, tebal 0.17-0.33 cm dan berat 0.40-1.28 g. Pada ovarium rusa timor ditemukan sembilan tipe folikel pad a tahap perkembangannya dan ditemukan corpus luteum (Cl) serta corpus albikans. Kedelapan tipe folikel ini dikelompokkan menjadi empat yaitu tipe pertama termasuk pada kelompok folikel primer, tipe dua sampai empat termasuk dalam folikel sekunder. Tipe lima sampai tujuh dikelompokkan folikel tersier dan folikel tipe delapan digolongkan dalam kelompok folikel de Graaf. Diameter folikel de Graaf pada ovarium rusa timor mencapai 5.4 mm. Karbohidrat asam dan karbohidrat netral ditemukan pada bagian zona pelusida, liquor folikuli, matriks sel granulosa dan matriks sel teka dengan intensitasnya bervariasi pada setiap perkembangan folikel. Pada folikel preantral ditemukan karbohidrat dengan residu gula D-N-asetilgalaktosamin, galaktosa dan manosa pad a sitoplasma dan zona pelusida oosit, sel granulosa dan sel teka. Pada folikel antral sitoplasma oosit mempunyai D-N-asetilgalaktosamin dan galaktosa tidak mempunyai manosa. Pada zona pelusida, bagian liquor folikuli, sel granulosa dan sel teka mempunyai D-N-asetilgalaktosamin, galaktosa, manosa dan glukosa.
TINJAUAN KHUSUS PADA GAMBARAN DAN
KARAKTERISTIK HISTOKIMIA FOLIKEL
OLEH
NAJDA RIFQIYATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Prgram Studi Biologi Reproduksi
SEKOLAH PASCASARJANA
INSTITUT PERT ANIAN BOGOR
BOGOR
Nama
NRP
: Najda Rifqiyati
: B651030041
Disetujui
Komisi Pembimbing
Prof. Dr. drh. Mozes R. Toelihere, M.Se Ketua
drh. Srihadi Agungpriyono, Ph.D Anggota
Ketua Program Studi Biologi Reproduksi
../
Dr. drh. Tuty L. Yusuf, M.S.
Tanggal Ujian: 11 April 2006
Diketahui
Dekan Sekolah Paseasarjana
Prof. Dr. Ir. Syafrida Manuwoto, MSe
Tanggal Lulus:
anugerah dan hidayah-Nya sehingga karya ilmiah ini berhasil diselesaikan.
Penelitian dilaksanakan dari bulan Juli 2004 sampai selesai dengan judul "
Dinamika Perkembangan Ovarium Rusa Timor (GeNus timorensis) dengan Tinjauan Khusus pad a Gambaran dan Karakteristik Histokimia Folikel.
Pada kesempatan ini penulis sampaikan terima kasih dan penghargaan
yang sebesar-besamya kepada:
1. Prof. Dr. drh. Mozes R. Toelihere (in memori) dan drh. Srihadi Agungpriyono,
Ph.D selaku komisi pembimbing atas bimbingan, masukan, kesabaran dan
semua yang terberi, serta Dr. drh. Ita Djuwita, M.Phil. selaku dosen penguji
luar komisi atas masukan, saran dan arahan yang diberikan.
2. Seluruh staf pengajar di Departemen Klinik, Reproduksi dan Patologi serta
Departemen Anatomi, Fisiologi dan Farmakologi atas pancaran ilmunya.
3. dr. Charles Mesang dan keluarga atas lokasi penelitiannya serta
teman-teman tim "rusa": Bu WM. Marlen Nalley, Mbak Ristika, Pak Siswanto atas
kebersamaan dan kerja samanya.
4. Ayah Bunda yang teristimewa dalam hid up, atas semangat dan motivasi yang
diberikan dan yang selalu menyertakan penulis dalam doa-doanya. Mas
Najieb, Mbak Nur, Atik dan Fauzi atas perhatian dan kasih sayangnya, serta
untuk si kecil Fairuz, Hanan dan Nadhif atas senyum cerianya.
5. Mas Ketut atas foto preparatnya, teman-teman seperjuanganku Esthi, Mimi,
Mbak Yusfi, Ika, Puji, Nirma, Nur, Santi, Putut atas bantuan dan kerja
samanya serta saudara-saudaraku di Wisma Vaillya 24 : Wike, Wiwit,
Jannah, Oja, lis, Ria atas keceriaan dan kebersamaan yang tercipta.
6. Seseorang yang berarti dalam hidup, yang menyempurnakan separuh dien
dan menemani dalam belajar tentang kehidupan.
7. Teman-teman BRP, Mbak Indira, Hafiz, Pak Maidaswar, Pak Syafriadi dan
teman BRP lainnya atas masukan dan diskusinya. Dan semua pihak yang
telah memberikan kontribusi dalam penelitian ini.
Tesis ini masih jauh dari sempuma, kritik dan saran sangat diharapkan
demi kesempurnaan di masa datang. Semoga tesis ini bermanfaat.
Bogor, Mei 2006
Najda Rifqiyati
Muchlasien dan ibu Ora. Aisyah. Penulis adalah putri kedua dari tiga bersaudara. Tahun 1997 penulis lulus dari SMU AI Islam I Surakarta dan pada tahun yang sama lulus UMPTN di Universitas Sebelas Maret (UNS). Penulis memilih jurusan Biologi, Fakultas Matematika dan IImu Pengetahuan Alam. Penulis lulus pada tahun 2002. Pad a tahun 2003 penulis diterima di Program Studi Biologi Reproduksi FKH IPB.
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... . viii
DAFTAR LAMPI RAN ... x
PENDAHULUAN Latar Belakang ... . Kerangka Pemikiran ... . Tujuan Penelitian ... . Manfaat Penelitian ... . TINJAUAN PUSTAKA KI as( (as( usa (mor Tk . R T· (C ervus Imorensis
t·
. )
... . Keunggulan Rusa ... . Organ Reproduksi Betina ... . Ovarium ... . Siklus Estrus ... . Folikulogenesis .: ... . Karbohidrat ... . Pewarnaan Histokimia AB-PAS ... . Lektin ... . BAHAN DAN METODE 1 3 4 4 5 6 7 7 8 10 15 16 16 Waktu dan Tempat Penelitian ... 17Materi Penelitian .... ... ... ... ... ... ... ... ... ... 17
Metode Penelitian . ... ... .... ... ... ... ... ... ... ... ... ... ... 17
Analisis Data ... .... ... ... .... ... ... ... ... ... ... ... ... .... ... ... 20
HASIL DAN PEMBAHASAN Saluran Reproduksi Rusa Timor Betina ... 21
Struktur Makroskopis Ovarium . ... ... ... ... ... ... ... ... .... 23
Struktur Mikroskopis Ovarium ... ... ... ... ... ... ... ... ... ... 25
Morfologi Folikel Pad a Berbagai Tahap Perkembangan ... 27
Karakteristik Histokimia Folikel Ovarium ... 40
SIMPULAN DAN SARAN... 53
DAFTAR PUSTAKA... 55
LAMPIRAN ... 59
Halaman
1. Kandungan gizi daging rusa dengan hewan ternak lain per 100 gram. 6 2. Jenis, sumber dan dosis lektin yang digunakan dalam penelitian... 20 3. Beberapa ukuran ovarium rusa timor dibanding ruminansia lain ... 25 4. Jumlah dan diameter folikel (mm) serta diameter oosit (mm) pada
rusa timor, Gervus timorensis . .... ... ... ... ... ... ... .... ... ... 29 5. Sebaran karbohidrat asam dan karbohidrat netral pada berbagai tipe
folikel ovarium rusa timor, Gervus timorensis ... ... ... ... 41 6. Pola distribusi ikatan lektin pada bagian-bagian folikel dari ovarium
rusa timor, Gervus timorensis . ... ... ... ... ... ... ... 48
Halaman
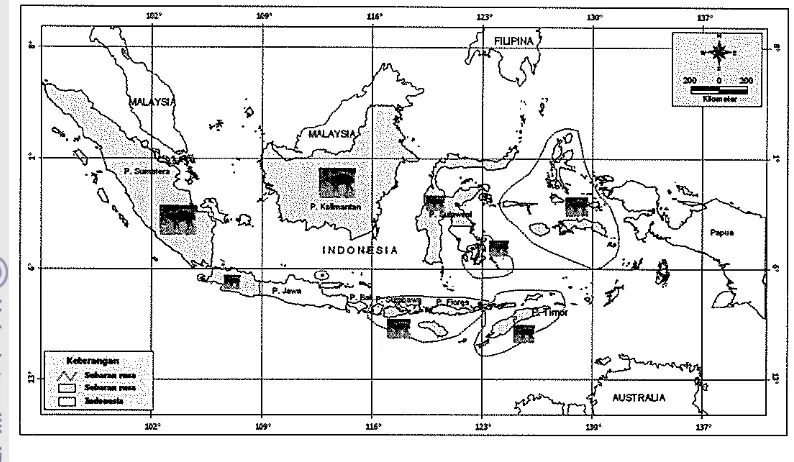
1. Peta penyebaran rusa di Indonesia ... ... 6
2. Organ reproduksi betina rusa wapiti yang dibuka bagian distalnya ... 7
3. Gambaran skematis potongan ovarium... 8
4. Pol a pertumbuhan ranggah pada rusa timor (Cervus timorensis) ... 9
5. Konsentrasi progesteron plasma rusa timor selama 3 bulan ... 10
6. Skema tahap perkembangan folikel ... 12
7. Gambaran folikel sekunder secara umum ... 13
8. Organ reproduksi betina rusa timor (Cervus timorensis) ... .... ... 21
9. Gambaran permukaan internal mukosa uterus rusa timor (C. timorensis) .. ... ... ... ... ... ... .... ... 23
10. Ovarium rusa timor (C. timorensis)...... 24
11. Gambaran umum histologi ovarium rusa timor ... ... ... ... ... ... ... ... 26
12. Gambaran morfologi berbagai folikel pada tahap awal perkembangan 30 13. Diargam persentase jumlah folikel ovarium rusa timor pada fase folikuler dan fase luteal. ... 31
14. Folikel pada ovarium rusa timor ... 33
15. Folikel antral dan bagian-bagiannya... 34
16. Tahap perkembangan folikel antral... 35
17. Diagram skema gelombang pertumbuhan folikel selama satu siklus estrus... 36
18. Diagram diameter folikel ovarium rusa timor pada fase folikuler dan fase luteal ... , ... ... ... .... ... 37
19. Diagram diameter oosit rusa timor pada fase folikuler dan fase luteal 38 20. Gambaran corpus luteum dan corpus albikans pada ovarium rusa timor ... 39
21. Diagram intensitas reaksi AS-PAS pada sel-sel granulosa... 42
22. Distribusi reaksi positif AS yang menunjukkan substansi karbohidrat asam (warna biru) pada folikel ovarium rusa timor ... 43
23. Diagram intensitas reaksi AS-PAS pada zona pelusidal ... 44
24. Diagram intensitas reaksi AS-PAS pada liquor folikuli ... 45
25. Distribusi karbohidrat asam (biru panah) pad a corpus luteum dan corpus albikans ... .... .... .... ... ... ... ... ... ... ... ... ... ... ... ... ... ... 46
28. Distribusi ikatan lektin pad a folikel antral tahap akhir ... ... ... 51
Halaman
1. Tahapan, bahan dan alat dalam pengamatan anatomi, morfometri
dan proses pembuatan prepararat histologi ... 60
2. Prosedur pembuatan preparat dengan pewarnaan Hematoksilin Eosin (HE) ... 61
3. Prosedur pewarnaan AS . ... ... ... ... ... ... 62
4. Prosedur pewarnaan PAS ... 63
5. Prosedur pewarnaan histokimia lektin... 64
6. Cara pembuatan larutan pewarnaan Hematoksilin eosin (HE) ... 65
7. Pembuatan larutan untuk pewarnaan AS dan PAS ... 66
8. Pembuatan larutan untuk pewarnaan lektin ... ... ... ... ... .... 67
Latar Belakang
Rusa merupakan salah satu satwa ruminansia yang dikelompokkan dalam ordo Artiodactyla dan famili Gervidae. Indonesia mempunyai beberapa jenis rusa, dari genus Gervus yaitu rusa timor (Gervus timorensis) dan rusa sambar (Gervus unicolor'), rusa bawean (Axis kuhlil) dari genus Axis dan rusa muncak atau kijang (Muntiacus muntjak) yang termasuk dalam genus Muntiacus. Rusa total (Axis axis) seperti yang dipelihara di istana Bogar merupakan jenis eksotik yang didatangkan dari Srilangka. Di Indonesia penelitian tentang rusa tropik (rusa timor, rusa sambar, rusa bawean dan rusa totol) belum banyak dilakukan termasuk bidang biologi reproduksinya, sehingga informasi yang tersedia pad a umumnya berasal dari hasil-hasil penelitian rusa di daerah temperate seperti pada fallow deer (Dama dama), wapiti (Gervus canadiensis),
red deer (Gervus elaphus) dan Odocoileus sp (white tailed, black tailed dan mule Deer) (Masyud 1997).
Rusa timor (Gervus timorensis) merupakan salah satu satwa ruminansia asli Indonesia yang pada awalnya merupakan satwa liar yang dilindungi. Undang-Undang no. 5 tahun 1990 tentang konservasi sumber daya alam hayati dan ekosistemnya, merupakan landasan hukum bagi perlindungan rusa di Indonesia. Namun kenyataan menunjukkan bahwa populasi rusa di Indonesia semakin menu run akibat perburuan liar dan ekspor ke luar negeri secara ilegal, karena keberadaan rusa di negara empat musim telah diakui sebagai hewan ternak.
Rusa merupakan salah satu potensi sumber daya alam hayati yang cukup prospektif untuk dikembangkan di Indonesia, karena merupakan sumber protein hewani yang rendah kolesterol dan karkasnya mencapai 56.9% (Draw 1985, diacu dalam Teddy 1998). Disamping itu, rusa juga memberi produk sampingan yang mempunyai nilai ekonomi tinggi, diantaranya adalah velvet, ekor, otot kaki dan alat reproduksi jantan yang diekspor ke Korea atau Gina sebagai bahan obat-obatan. Kulit dan tanduknya dapat digunakan sebagai bahan baku industri (Semiadi dan Nugraha 2004).
12/5/1990 yang diperbaharui dengan SK mentan no. 404/KPTS/OT. 210/6/2002,
rusa telah resmi dimasukkan dalam kelompok hewan ternak yang dapat dikembangbiakkan sebagaimana hewan ternak lainnya (Semiadi dan Nugraha
2004).
Upaya perkembangbiakan rusa di luar habitatnya melalui penangkaran dan aplikasi teknologi reproduksi misalnya dengan inseminasi buatan merupakan salah satu upaya untuk mencegah kepunahan serta meningkatkan pemanfaatan rusa timor sebagai satwa harapan sumber protein hewani. Untuk penerapan teknologi reproduksi tersebut, diperlukan data tentang biologi reproduksi rusa timor di daerah tropis yang belum ban yak dikaji.
Penelitian pad a rusa timor telah dilakukan dalam hal nutrisi, perilaku, tingkat daya dukung dan keadaan morfologinya. Akan tetapi di bidang reproduksi belum banyak dikaji. Salah satu ciri dari rusa asal daerah tropik yang hidup di daerah subtropik atau daerah beriklim sedang ialah kemampuannya untuk berkembang biak sepanjang tahun (Semiadi 1998). Oi luar negeri telah banyak dilakukan penelitian tentang biologi reproduksi rusa wapiti dan red deer yang meliputi anatomi, kajian tingkah laku, fisiologi bahkan sampai teknologi reproduksi (Haigh dan Hudson 1993). Sedangkan data biologi reproduksi rusa timor di daerah tropik masih sangat jarang, terutama yang berkaitan dengan karakteristik morfologi ovarium dan folikel.
Kemampuan bereproduksi merupakan salah satu indikator keberhasilan dari kehidupan hewan. Organ reproduksi sangat berperan dalam proses perkembangbiakan makhluk hidup, sehingga merupakan salah satu materi yang perlu dipelajari untuk keberhasilan penerapan teknologi reproduksi secara efisien dan efektif dalam rangka peningkatan populasi. Ovarium adalah organ reproduksi primer yang menghasilkan garnet betina berupa oosit, yang sangat esensial dalam fertilisasi. Oisamping itu, ovarium juga menghasilkan hormon-hormon yang berperan dalam mengatur proses reproduksi diantaranya adalah estrogen, progesteron, oksitosin, relaksin, inhibin dan aktivin (Senger 1999). Penentuan status fungsional ovarium yang berlangsung secara siklik (siklus ovarial) dapat diidentifikasi dengan adanya corpus luteum atau folikel dominan pad a ovarium.
medula dan mengandung folikel-folikel (Ross et al. 1995). Selama siklus estrus, folikel-folikel akan mengalami beberapa tahap perkembangan (folikulogenesis) dengan struktur komponen yang berbeda-beda.
Penelitian pad a morfologi ovarium rusa timor sejauh ini belum pernah dilaporkan. Penelitian ini mengkaji gambaran morfologis ovarium dan siklus ovarial dengan tinjauan khusus pada tipe-tipe folikel serta karakteristik histokimia folikel pad a berbagai tahap folikulogenesis rusa timor.
Kerangka Pemikiran
Ovarium merupakan sumber folikel dimana ovum dibentuk. Dalam perkembangannya, pertumbuhan dan perkembangan folikel yang berlanjut ke corpus luteum berlangsung secara siklik dalam siklus ovarial yang periodik dan berkesinambungan selama masa produktif reproduksi pada hewan betina. Folikel tersebar pada stroma korteks dan mempunyai ukuran yang bervariasi. Masing-masing folikel mengandung satu oosit. Ukuran folikel ini menunjukkan tahap perkembangan oosit. Berdasarkan tahap perkembangannya, folikel dikategorikan menjadi tiga tahap yaitu folikel primordial, folikel pertumbuhan (folikel primer, sekunder dan tersier atau antral) dan folikel matang atau folikel de Graaf (Ross
et al. 1995). Selama perkembangan, foUkel akan mengalami pertumbuhan yang melibatkan perubahan-perubahan pad a lapisan sel folikel (sel-sel granulosa), oosit primer dan stroma di sekitar fOlikel. Morfologi folikel pada tahap-tahap perkembangan telah dilaporkan pada hewan-hewan domestik seperti sapi, domba dan kambing. Pada rusa timor (Gervus timorensis), belum ada laporan yang menggambarkan ciri-ciri morfologi folikel ovarium pad a berbagai tahap perkembangannya.
proses perkembangan secara morfologis dengan karbohidrat dan glikoprotein sebagai marker. Deteksi unsur karbohidrat dan glikoprotein yang ada pada folikel ovarium dilakukan dengan memakai metode histokimia.
Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan untuk :
1. Mempelajari anatomi dan morfometri ovarium rusa timor (Gervus timorensis).
2. Mempelajari gambaran histologis dan karakteristik histokimia folikel ovarium rusa timor (Gervus timorensis) pada berbagai tahap perkembangan folikel dengan metode histokimia AB-PAS dan histokimia lektin.
Manfaat Penelitian
Klasifikasi Rusa Timor (Cervus timorensis)
Rusa adalah salah satu satwa ruminansia yang dikelompokkan dalam ordo Artiodactyla, famili Cervidae dengan 17 genus dan 42 spesies. Distribusi rusa sangat luas, spesies yang berasal dari luar negeri diantaranya adalah fallow deer (Dama dama), chinese water deer, barasingha, thamin, hog deer, wapiti
(Cervus canadiensis), rusa merah (Gervus e/aphus), Pere David's deer, A/cas sp, Pudu sp, Hippocame/us sp, marsh deer (B/asticerus dchotomus), pampas deer
(Ozotoceras bezoarlicus), brockets (Mazama sp), Rangifer tarandus, sika deer
(Gervus nippon nippon) dan Odocoi/eus sp (white tailed, black tailed dan mule deer) (Masyud 1997).
Di Indonesia rusa terdistribusi di daerah Sumatera, Jawa, Nusa Tenggara, Kalimantan, Sulawesi, Maluku dan beberapa pulau lain (Gambar 1). berdasarkan jenis pakannya rusa dapat diklasifikasikan sebagai intermediate feeders, yaitu satwa pemakan tumbuhan jenis campuran antara semak (browse!')
dan rumput (graze!') dan bagian tumbuhan lain seperti daun, batang atau ranting yang lunak, rumput, umbi-umbian dan buah-buahan (Feriyanto 2002),.
Berdasarkan klasifikasi, rusa timor termasuk dalam : Filum : Chordata
Subfilum : Vertebrata Class : Mammalia Ordo : Artiodactyla Subordo : Ruminansia Famili : Cervidae Subfamilia : Cervinae Genus : Gervus
AUSTRAUA
Gambar 1 Peta penyebaran rusa di Indonesia. (Schroder 1976).
Keunggulan Rusa
Rusa merupakan satwa temak yang dapat diandalkan untuk produksi daging berkualitas. Persentase karkas rusa lebih tinggi dibanding hewan temak sapi atau domba. Karkas rusa dapat mencapai 56-58%, sapi 51-55% dan domba berkisar 40-50% (Subekti 1995, diacu dalam Satria 2001). Dari segi kandungan gizi, kualitas daging rusa tidak kalah dengan pada hewan temak lainnya (Tabel 1 ).
Tabel1 Kandungan gizi daging rusa dan hewan temak lain per 100 gram Hewan Kalori (k.k) Lemak (g) Kolestrol (mg) Protein (g)
Red deer 159 3.30 66 25
Sapi 214 9.76 92 31
Babi 219 10.64 101 29
Domba 178 7.62 83 25
Ayam 159 3.42 83 31
Kalkun 154 3.45 68 29
Ikan Salmon 138 5.75 39 20
(Sumber : Semiadi dalam Satria 2001)
[image:19.550.85.482.65.296.2]dimanfaatkan untuk pengobatan. Satu batang (stick) velvet mempunyai fungsi yang berbeda antar bagian. Pada bag ian atas berguna untuk pertumbuhan, bag ian tengah untuk pengobatan arthritis dan osteomyelitis, bag ian bawah untuk pengobatan defisiensi kalsium orang dewasa. Selain itu ranggah velvet dapat memberi efek farmakologi, diantaranya adalah sebagai sumber gonadotropin, efek hemopoetik, hipotensi, anti stres, penyembuhan dari kerusakan hati, me rang sang pertumbuhan dan menunda proses penuaan (Fenessy et al. 1985).
Organ Reproduksi Setina
Organ reproduksi betina terdiri atas ovarium, oviduct, uterus, cervix uteri, vagina dan organ genetalia ekstemal (Gambar 2). Organ reproduksi ini ditahan oleh ligamen yang menggantung ovarium yaitu mesovarium, mesosalphinx yang menggantung saluran telur dan mesometrium yang menggantung uterus. Pada sa pi dan domba, pelekatan ligamen ini adalah dorsolateral bagian ileum membentuk seperti tanduk domba yang cekung ke dorsal dan ovarium terletak di dekat pelvis (Hafez dan Hafez 2000).
ᄋᄋセNゥZZZセ@
4 >,,:.: .
Gambar 2 Organ reproduksi betina rusa yang dibuka bag ian distalnya. 1.
Ovarium
ovarium, 2. oviduct (tuba Faliopii), 3. ligamen, 4. comua uterus, 5. corpus uterus, 6. cervix, 7. vagina (Haigh dan Hudson 1993).
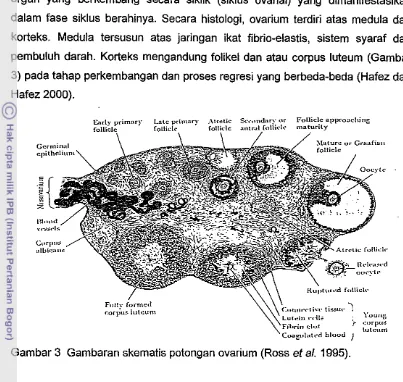
berbentuk seperti ginjal atau berbentuk gumpalan anggur. Ovarium merupakan organ yang berkembang secara siklik (siklus ovarial) yang dimanifestasikan dalam fase siklus berahinya. Secara histologi, ovarium terdiri atas medula dan korteks. Medula tersusun atas jaringan ikat fibrio-elastis, sistem syaraf dan pembuluh darah. Korteks mengandung folikel dan atau corpus luteum (Gambar 3) pada tahap perkembangan dan proses regresi yang berbeda-beda (Hafez dan Hafez 2000).
Germinal
epitheliuTII
Corpus
:llbi(::II''''
. prim;u"y
Full...- formed coq;u$lu{(:um
Follicle 。ーーイッセ」ャオョァ@ mOlturity
".,,,,,,·,·,i .... · tissuc'
l
. Youllg
?" cur pus lutcum
cセァオャ。エ@ t'd blood )
Gambar 3 Gambaran skematis potongan ovarium (Ross et al. 1995).
Siklus estrus
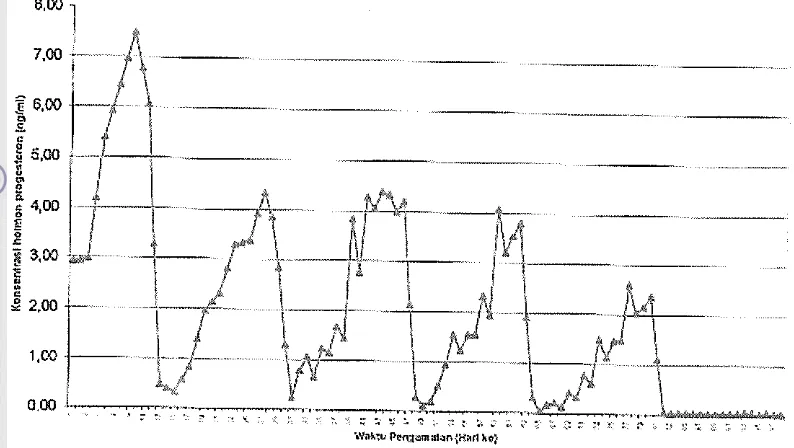
Pubertas pada rusa sebagaimana pada ruminansia lainnya, lebih berhubungan dengan berat badan dan umur. Rusa bunting pada berat badan 55-59 kg. Rusa timor mencapai dewasa kelamin pada usia tujuh sampai sembilan bulan dengan usia awal berreproduksi optimal antara 15 sampai 18 bulan (Masyud 1997, Takandjandji 1997) dengan masa reproduksi aktif dua sampai 12 tahun (Takandjandji 1997). Rusa timor di habitat alaminya, gejala berahi tertihat antara bulan Juli dan September (Hoogerwerf 1970, diacu dalam Masyud 1997). Lama berahi rusa 48 jam (Semiadi 1995). Lama siklus dari ovulasi pertama ke ovulasi kedua adalah 21±1,3 hari dengan puncak progesteron sebesar 4,5±0,43 nglml sesudah 14,0±0,8 hari (Masyud 1997). Biasanya rusa melahirkan seekor anak pada setiap kelahiran.
[image:21.557.73.476.92.474.2]temperate berhubungan dengan pergantian musim. Sedangkan rusa tropik tidak tergantung musim. (Semiadi 1995).
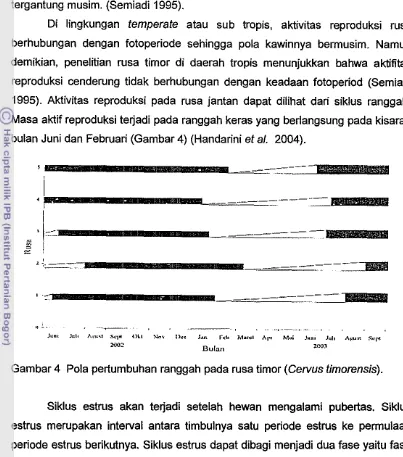
Di ling kung an temperate atau sub tropis, aktivitas reproduksi rusa berhubungan dengan fotoperiode sehingga pola kawinnya bermusim. Namun demikian, penelitian rusa timor di daerah tropis menunjukkan bahwa aktifitas reproduksi cenderung tidak berhubungan dengan keadaan fotoperiod (Semiadi 1995). Aktivitas reproduksi pad a rusa jantan dapat dilihat dari siklus ranggah. Masa aktif reproduksi terjadi pada ranggah keras yang berlangsung pada kisaran bulan Juni dan Februari (Gambar 4) (Handarini et al. 2004).
'/"'
LiセMMMM
セ@ )
]]]セMM]ZMZjiiiゥiA@
, --:11 _ _ _ _ _ _
<! _.
Jlln. ),,1, 1\.· ... 1 s."f" ()LI セ|@ i^」セ@ l"n reb M",,,' AI" MoM J"", Joll j|セNLNオG@ セBiB@
RPPセ@ Bulan ZAHNGqセ@
Gambar 4 Pola pertumbuhan ranggah pada rusa timor (Gervus timorensis).
Siklus estrus akan terjadi setelah hewan mengalami pubertas. Siklus estrus merupakan interval antara timbulnya satu periode estrus ke permulaan peri ode estrus berikutnya. Siklus estrus dapat dibagi menjadi dua fase yaitu fase folikuler dan fase luteal. Fase folikuler atau fase estrogenik adalah periode dari regresinya corpus luteum sampai ovulasi. Sedangkan fase luteal atau fase progestasional adalah periode dari ovulasi sampai corpus luteum mengalami regresi. Pada mamalia, umumnya fase folikuler lebih pendek dibandingkan fase luteal (Senger 1999).
[image:22.558.76.479.87.544.2]hari dengan lama estrus kurang dari 24 jam, dan siklus estrus pada rus merah adalah 18 hari (Haigh dan Hudson 1993).
Gambar 5 Konsentrasi progesteron plasma rusa timor selama 3 bulan (Toelihere et al. 2003).
Folikulogenesis
Folikulogenesis adalah proses perubahan yang ditandai dengan adanya proliferasi dan differensiasi komponen sel pada folikel. Dinamika folikel terjadi selama folikulogenesis. Dinamika folikel merupakan perubahan tahap perkembangan folikel mulai dari folikel primordial sampai folikel tersier termasuk perubahan ekspresi mRNA yang mengkode reseptor gonadotropin, hormon steroid dan diikuti seleksi folikel. Perkembangan folikel akan menyediakan lingkungan yang optimal untuk maturasi oosit sehingga siap untuk fertilisasi.
Folikulogenesis berhubungan dengan perkembangan sekelompok folikel dengan berbagai tahap perkembangan, kemudian sejumlah folikel akan terseleksi untuk berkembang lebih lanjut (Armstrong dan Webb 1997). Folikulogenesis dapat dibagi menjadi tiga tahap :
1. Rekrutmen, tahap pertumbuhan pool folikel yang cepat. Pertumbuhan ini terjadi dari folikel primordial menjadi folikel primer dan folikel sekunder.
2. Seleksi, Proses penseleksian folikel untuk pertumbuhan lebih lanjut menjadi folikel subordinat.
[image:23.552.86.483.112.336.2]Dominasi folikel dan penghambatan pertumbuhan folikel subordinat disebabkan oleh meningkatnya follicle Growth Inhibiting Factor (FGIF) yang diproduksi oleh folikel dominan. FGIF akan menghambat proliferasi sel granulosa yang menstimulasi FSH dan aktivitas aromatase, selain itu juga menghambat vaskularisasi folikel subordinat.
Selain hormon, proses folikulogenesis dikontrol oleh faktor endokrin atau parakrin seperti Growth Factor seperti insulin-like Growth Factor (lGF),
Transforming Growth Factor
13
(TGF13),
Fibroblast Growth Factor (FGF) danEpidermal Growth Factor (EGF). IGF berfungsi untuk menstimulasi proliferasi dan differensiasi sel granulosa dan sel teka, serta mengatur ォ・セ。@ gonadotropin pada level seluler. TGF
13
berperan untuk menghambat fragmen sel granulosa dan sel teka. FGF akan menstimulasi proliferasi sel teka, menghambat stimulasi FSH yang menginduksi ekpresi reseptor LH pada sel granulosa, dan mereduksi ikatan IGF pada jaringan teka. FGF bersama Extra Celluler Matrix (ECM) dapat mengatur stabilitas dan penggabungan Growth Factor (Armstrong dan Webb1997).
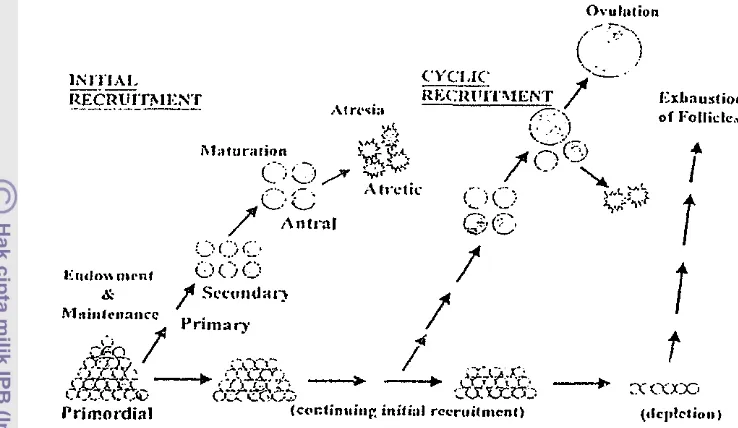
Menurut McGee dan Hsueh (2000), ada dua tahap utama yang terjadi pad a perkembangan folikel yaitu Initial recruitment dan cyclic recruitment
(Gambar 6). Initial recruitment adalah perkembangan folikel yang bertangsung terus-menerus mulai dari pembentukan folikel sampai sebelum masa pubertas. Perkembangan ini terjadi pad a folikel tahap primordial, dim ana perkembangan folikel tidak dipengaruhi hormon gonadotropin. Folikel akan berkembang dari tahap primordial, primer sampai tahap folikel sekunder. Folikel yang tidak berkembang akan mengalami dormansi. Oosit mulai tumbuh namun perkembangan tidak mencapai germinal vesicle breakdown (GVBD). Sedangkan
cyclic recruitment dimulai setelah masuk masa pubertas. Perkembangan エ・セ。、ゥ@
pada folikel tahap antral dimana perkembangan telah dipengaruhi oleh FSH dan LH. Folikel yang tidak berkembang akan mengalami atresi. Oosit berkembang sempuma dan mampu mencapai tahap germinal vesicle breakdown (GVBD).
folikel (Junqueira et al. 1997). Sel folikel pipih ini kemudian akan berubah menjadi kuboid (Guerin 2003).
INITIAL
-Aセs⦅セセiセイゥ|ャjNZ[MGZA@ Exhau!dion
of Follicle .•
..
I
r
r
t
- :x COX:'
(tlcl'!clion)
Gambar 6 Skema tahap perkembangan folikel (McGee dan Hsueh 2000).
1. Folikel primer
Oosit primer (tahap diktioten) mulai membesar, inti oosit akan membesar dan disebut vesikel germinal. Selapis sel folikel berubah dari pipih menjadi kuboid. Folikel ini disebut folikel primer unilaminer. Kemudian sel folikel berproliferasi melalui mitosis dan membentuk epitel berlapis atau lapisan granulosa. Folikel tersebut menjadi folikel primer multilaminer dimana terdapat pertautan antara sel-sel folikel (Junqueira et a/. 1997). 8eberapa saat postnatal, oosit primer tetap dalam tahap profase dan tidak mengalami pembelahan meiosis I dengan adanya Oosit Maturation Inhibitor (OMI) yang dikeluarkan oleh sel folikel. Memasuki pubertas, folikel primordial mulai mencapai kematangan pada setiap daur ovarium.
2. Folikel sekunder
[image:25.555.81.450.104.318.2]membentuk teka interna ini disebut juga folikel preantral (Guerin 2003). Sel teka ini berkembang dan menghasilkan androstenedion yang akan dikonversi menjadi estrogen oleh sel granulosa.
Sf.CONDARY ioセャicャャ@
2 3
9 8 I,
4 "
6
7
5
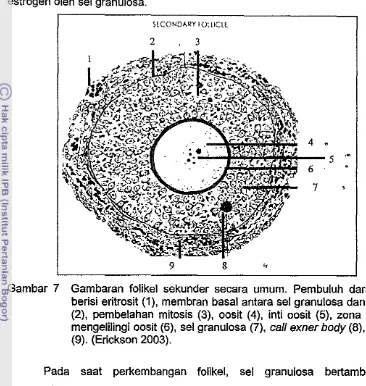
Gambar 7 Gambaran folikel sekunder secara umum. Pembuluh darah yang berisi eritrosit (1), membran basal antara sel granulosa dan sel teka (2), pembelahan mitosis (3), oosit (4), inti oosit (5), zona pelusida mengelilingi oosit (6), sel granulosa (7), call exner body (8), sel teka (9). (Erickson 2003).
Pada saat perkembangan folikel, sel granulosa bertambah dan memproduksi cairan yang disebut liquor folikuli dan ditimbun diantara sel-sel folikel sehingga terbentuk rongga disebut antrum folikuli yang berisi cairan terse but. Cairan ini terdiri atas beberapa makromolekul seperti glikosaminoglikan, protein dan steroid (progesteron, androgen, estrogen) (Junqueira et al. 1997).
3. Folikel tersier dan folikel de Graaf
[image:26.557.78.444.111.497.2]mengalami degenerasi selama atresi, sel-sel teka intema tetap aktif mensekresi steroid seperti androgen ovarium (Junqueira et al. 1997).
4. Corpus luteum (Cl)
Pada fase luteal, sel granulosa juga menghasilkan steroid yaitu progesteron. Secara bertahap, sel granulosa akan membentuk parenkim besar-besar dan mengandung lutein. Sel teka membentuk stroma seperti fibroblast. Perkembangan Cl dibagi dalam tiga tahapan yaitu
1. Tahap proliferasi. Sel granulosa dan teka berproliferasi dan hipertrofi, membentuk sel granulosa lutein yang akan membentuk parenkim. Sel lain membentuk sel teka lutein untuk stroma CL.
2. Tahap vaskularisasi. Jalinan pembuluh darah teka interna memberikan vaskularisasi intensif pada Cl untuk menjalankan perannya sebagai kelenjar endokrin.
3. Tahap pemasakan. sel granulosa lutein menyempurnakan organoid yang fungsional (apparatus Golgi, mitokondria, sER) untuk menghasilkan progesteron.
Sel granulosa lutein mengandung pig men lutein (kuning) atau butir lipoid (tidak berwarna) yang merupakan campuran fosfatida dan serebrosida, sedangkan sel teka lutein lebih kecil dan mengandung kolestero!. Cl pada kuda, sa pi dan karnivora berwarna kuning karena mengandung lutein. Pada domba, kambing dan babi berwarna putih keabu-abuan atau berwama daging karena tidak ada pigmen lutein (Hartono 1992).
Karbohidrat
Karbohidrat merupakan salah satu komponen yang dibutuhkan dalam fungsi metabolik dan struktural pad a sel-sel makhluk hidup. Fungsi struktural karbohidrat dalam sel misalnya adalah sebagai komponen pada dinding sel. Sedangkan untuk fungsi metabolik misalnya sebagai sumber energi dan senyawa yang terlibat pada berbagai proses metabolisme. Karbohidrat yang terdapat dalam sel sebagian besar berbentuk karbohidrat kompleks atau glikokonjugat.
Glikokonjugat merupakan karbohidrat yang terikat secara kovalen pada protein dan lipid, misalnya glikoprotein, proteoglikan dan glikolipid. Glikoprotein terdapat dalam cairan dan jaringan. Jenis karbohidrat yang menjadi unsur pembentuk glikoprotein adalah manosa (Man), galaktosa (Gal), N-asetilglukosamin (GlcNAc), N-asetilgalaktosamin (GaINAc), arabinosa (Ara) , xilosa (xyl), L-fukosa (fuc) dan asam N-asetilneuraminat (Murray et al. 2003).
Menurut Bancroft dan Stevens (1982), karbohidrat kompleks dibagi menjadi dua kelompok yaitu karbohidrat netral dan karbohidrat asam. Karbohidrat asam mengandung gugus asam yaitu sulfat dan gugus karboksil. Sedangkan karbohidrat netral tidak berikatan dengan gugus asam. Selain sebagai molekul struktural, glikoprotein juga mempunyai beberapa fungsi diantaranya adalah sebagai pengenal atau pengikat sel, mempengaruhi penyisipan ke dalam membran, migrasi intrasel, penyortiran, sekresi, serta untuk perkembangan dan diferensiasi embrionik (Murray et al. 2001). Kurahmoru et al. (1995) menyatakan bahwa selain sebagai komponen jaringan, glikokonjugat berperanan dalam proses diferensiasi, maturasi sel, dan interaksi antar sel. Proses pre-implantasi dan post-implantasi berhubungan dengan perubahan glikokonjugat pada endometrium (Murray et al. 2001). Jenis karbohidrat pada glikoprotein yang ditemukan pada manusia adalah Galaktosa, Glukosa, Manosa, Asetilneuraminat, Fukosa, N-asetilgalaktosamin dan N-asetilglukosamin (Murray et al. 1995).
spesifik pada zona pelusida oosit mammalia ini dapat berperan dalam menentukan spesifik-spesies alamiah dalam interaksi garnet dan untuk mencegah fertilisasi interspesies yang terjadi antar spesies yang mempunyai kekerabatan dekat (Skutelsky et al. 1994).
Pewarnaan histokimia AS-PAS
Pewarnaan AB (pH 2,5) mengikat gugus karboksil dan sulfat-ester. Semua mukosubstansi asam akan terwarnai. Pewarnaan ini tidak biasa mewarnai inti atau RNA sitoplasma (Kiernan 1990). Reaksi positif pewarnaan AB akan terlihat biru dan adanya tembaga pthalocyanin.
Reaksi positif dengan pewarnaan PAS menunjukkan adanya gula heksosa netral dan atau asam sialik. Pada pewarnaan ini, digunakan asam periodat untuk mengoksidasi glikol yang ada dalam jaringan menjadi aldehid. Aldehid ini akan berikatan dengan schiff reagent yang menunjukkan reaksi positif dengan warna merah magenta. Kelompok glikol terdapat pada gula netral, asam sialat, asam uronat dan gula N-asetilglukosamin serta N- N-asetilgalaktosamin (Kiernan 1990). Glukosa, galaktosa, manosa dan fukosa merupakan gula netral utama yang terdapat dalam mukosubstansi.
Lektin
Penelitian ini dilaksanakan pad a bulan Juli 2004 sampai Juli 2005 di Laboratorium Riset Anatomi Departemen Anatomi, Fisiologi dan Farmakologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Pengambilan sam pel dilakukan di penangkaran rusa "Molek' Pondok Gede, Bekasi.
Materi Penelitian
Penelitian ini menggunakan dua ekor rusa timor (Gervus timorensis)
betina dewasa kelamin masing-masing berumur tiga dan empat tahun. Penentuan fase folikuler dan fase luteal dilakukan dengan melihat adanya folikel dominan atau corpus luteum. Setelah hewan disembelih, ovarium kanan dan kiri diambil dan dipisahkan dari uterus dan bagian-bagian lain yang melekat, kemudian dicuci dalam larutan NaGI fisiologis dengan suhu 30-35 °G yang selanjutnya dilakukan fiksasi dengan larutan Bouin's.
Metode Penelitian Pengamatan Makroskopis Ovarium
Pengamatan anatomi makroskopis dilakukan dengan melihat bentuk ovarium, status ovarium dengan melihat adanya folikel dominan atau corpus luteum yang tampak pada permukaan ovarium. Pada penelitian ini digunakan ovarium pad a fase folikuler dan fase luteal. Data morfometri diambil dengan mengukur berat, panjang, lebar, tebal dan volume ovarium dalam kondisi segar. Pengukuran morfometri (Sikar 1983) meliputi:
a. Pengukuran berat ovarium dengan timbangan digital dilakukan sebelum proses fiksasi,
b. Pengukuran panjang ovarium menggunakan jangka sorong digital dengan mengukur jarak dari ekstremitas cranialis ke ekstremitas caudalis.
c. Pengukuran lebar ovarium diukur dari bag ian yang terpaut ke permukaan bebas.
d. Pengukuran tebal ovarium diukur dari permukaan medial ke permukaan lateral.
Pengamatan Mikroskopis Ovarium
Untuk pengamatan mikroskopis, sam pel jaringan ovarium yang diambil segera difiksasi dalam larutan Souin's selama 24 jam, kemudian disimpan dalam alkohol 70% sebagai stopping point sampai proses selanjutnya. Sam pel dipotong kecil, kemudian didehidrasi dalam seri larutan alkohol selama 6 sampai 8 jam dengan konsentrasi bertingkat 70%, 80%, 90%, 95%, 100% (3x) , dijernihkan (cleanng) dalam silol tiga kali masing-masing selama satu jam, kemudian diinfiltrasi dengan parafin (histoplast, thermo shandon, Pitlburgh, USA) 3x45 menit yang dilanjutkan penanaman (embedding) dalam parafin. Siok parafin kemudian disayat secara serial dengan ketebalan 5 \.1m (Van den Hurk R. et a/. 1993). Pewarnaan dilakukan dengan prosedur (Kiernan 1990) sebagai berikut :
a.
Pewarnaan hematoksilin-eosin (HE)b. Pewamaan Alcian Blue (AB) dan Periodic Acid Schiff (PAS)
Setelah proses deparafinisasi dan rehidrasi seperti di atas (prosedur pewarnaan HE), sediaan direndam dalam larutan 3% asam asetat untuk menurunkan pH sediaan, kemudian diwarnai dengan pewarnaan alcian blue (AB) pH 2.5, setelah perendaman kembali dengan larutan asam asetat dan pembilasan dengan akuades Pewarnaan kontras (counterstain)
menggunakan nuclear fast red. Selanjutnya dilakukan dehidrasi dan clearing
dalam alkohol dengan konsentrasi yang meningkat dan silol kemudian sediaan ditutup dengan gelas penutup menggunakan entellan® sebagai perekat. Reaksi positif terhadap pewarnaan AB pada jaringan ditunjukkan dengan warna biru.
Untuk pewarnaan Periodic Acid Schiff (PAS), setelah sediaan dideparafinisasi dan rehidrasi, maka sediaan dioksidasi dengan as am periodat 1 %, kemudian dibilas dengan akuades. Berikutnya adalah perendaman dengan pereaksi Schiff, diikuti pembilasan dengan air sulfit. Untuk melihat kontras warna maka inti diwarnai dengan hematoksilin, lalu dibilas dengan air kran dan akuades dan terakhir dilakukan dehidrasi,
clearing dan penutupan sediaan dengan gelas penutup. Reaksi positif PAS pada jaringan ditunjukkan dengan warna merah magenta.
c. Pewamaan Histokimia Lektin
Sediaan dimasukkan dalam inkubator 60°C selama 30 menit. Kemudian dilakukan proses deparafinisasi dan rehidrasi. Sediaan dicuci dengan PBS kemudian dimasukkan dalam hidrogen peroksida (H202) 0,3% dalam PBS
untuk menghambat aktivitas enzim perioksidase endogen. Sediaan kemudian dicuci dengan air mengalir dan larutan PBS 0.01 M. Inkubasi dengan lektin yang berlabel peroksidase (Tabel 2) dilakukan selama dua jam dalam inkubator 37 DC. Kemudian sediaan dicuci dengan PBS untuk menghilangkan sisa lektin yang tidak berikatan. Visualisasi dilakukan dengan 0.05% DAB (diaminobenzidine) dan 0.3% H202 pada buffer tris 0.05 M, pH 7.6.
dilakukan dengan cara penggantian lektin dengan PBS. Kontrol positif dan kontrol negatif ini selain digunakan sebagai standar pengamatan, juga untuk memastikan kebenaran dalam prosedur kerja yang dilakukan. Sehingga reaksi yang terjadi merupakan reaksi lektin yang digunakan.
Tabel 2 Jenis, sumber, spesifikasi gula dan dosis yang digunakan dalam penelitian
Lektin Sumber Spesifikasi gula Oosis (I-Iglml)
PHA Phaseolus vulgaris GalNAc 5
RCA Ricinus communis Gal, GalNAc a 5
Con A Canavalia ensiformis Man a, Glca 10
LCA Lens culinaris Mana 5
Keterangan : PHA = Phaseolus Vulgaris Erythroagglutinin, RCA = Ricinus Communis Agglutinin, ConA = Concanavalin A, LCA = Lens culinaris Agglutinin. GalNAc = D-N-Asetilgalaktosamin, Gal = Galaktosa, Man a = manosa, Glc a = glukosa.
Pengamatan dilakukan terhadap morfologi secara umum, jenis-jenis karbohidrat dan distribusinya pada folikel dan jaringan-jaringan lain dalam ovarium. Pengamatan terhadap afinitas dan intensitas reaksi positif lektin pad a sel-sel dan jaringan dilakukan pada 2 preparat untuk masing-masing lektin. Hasil pengamatan terhadap afinitas dan intensitas digolongkan secara subyektif menjadi lima kelompok yaitu kuat (+++), sedang (++), lemah (+), sang at lemah(+I-), dan tidak ada reaksi/negatif (-). Pengamatan dan pemotretan preparat dilakukan dengan mikroskop yang dilengkapi kamera (Nikon Eclips, Tokyo, Japan).
Analisis Data
[image:33.557.74.485.123.769.2]Rusa timor (Gervus timorensis) yang digunakan pada penelitian ini berumur tiga dan empat tahun. Pada umur terse but, rusa timor telah masuk masa aktif reproduksi, seperti yang dilaporkan Takandjandji (1997) bahwa masa aktif reproduksi rusa timor adalah 2-12 tahun.
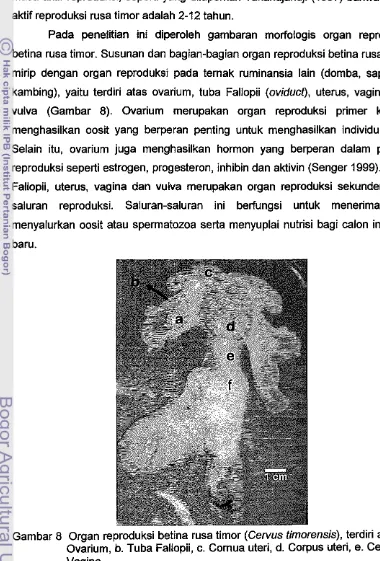
Pada penelitian ini diperoleh gambaran morfologis organ reproduksi betina rusa timor. Susunan dan bag ian-bag ian organ reproduksi betina rusa timor mirip dengan organ reproduksi pada ternak ruminansia lain (domba, sapi dan kambing), yaitu terdiri atas ovarium, tuba Fallopii (oviduct), uterus, vagina dan vulva (Gam bar 8). Ovarium merupakan organ reproduksi primer karena menghasilkan oosit yang berperan penting untuk menghasilkan individu baru. Selain itu, ovarium juga menghasilkan hormon yang berperan dalam proses reproduksi seperti estrogen, progesteron, inhibin dan aktivin (Senger 1999). Tuba Fallopii, uterus, vagina dan vulva merupakan organ reproduksi sekunder atau saluran reproduksi. Saluran-saluran ini berfungsi untuk menerima dan menyalurkan oosit atau spermatozoa serta menyuplai nutrisi bagi calon individu baru.
[image:34.552.76.456.155.716.2]Tuba Fallopii rusa timor mempunyai panjang 14.0-17.1 cm dengan diameter 0.03-0.08 cm dan berat 0.20-0.99 gram. Ukuran ini relatif sama dengan tuba Fallopii pada domba (15-19 cm) dan babi (15-30 cm) (Toelihere,
1979). Diameter tuba Fallopii rusa timor lebih kecil dibandingkan dengan yang ditemukan pada kerbau yaitu di bagian kiri sebesar 0.2 ± 0.01 cm dan bagian kanan sebesar 0.21 ± 0.01 cm (Sikar, 1983).
Uterus rusa timor bertipe bicornis, terbagi alas sepasang cornua (kanan dan kiri), corpus dan cervix uteri. Cornua uteri melengkung seperti tanduk dengan panjang 10.3-13.6 em. Ukuran ini relatif sama dengan yang dilaporkan pada rusa merah (6.5-13 em), dan lebih panjang daripada cornua wapiti (Gervus canadiensis) yang dilaporkan mempunyai panjang 5-8 cm (Haigh dan Hudson
1993). Corpus dan cervix uteri rusa timor masing-masing memiliki panjang
1.2-1.6 em dan 4.5-5.6 cm. Pada corpus dan cornua uteri rusa timor ditemukan
adanya karunkulae sebagaimana yang ditemukan pada uterus do mba, sapi dan kambing. Karunkulae merupakan daerah mukosa uterus yang berbentuk tonjolan tak berkelenjar pada uterus, yang mengandung banyak pembuluh darah. Karunkulae berperan sebagai tempat bertautnya cotyledon dengan adanya viii chorion. Viii ini akan menghubungkan komunikasi antara fetus dan induk (Toelihere 1979). Karunkulae tidak ditemukan pada uterus kuda dan babi (Toelihere 1979). Hal ini karena tipe implantasi pada kuda dan babi adalah
difuse, sedangkan implantasi pada ruminansia umumnya bertipe cotyledonary
(T oelihere 1979). Viii chorion pada kuda dan babi tersebar di seluruh permukaan plasenta. Ukuran panjang cervix rusa timor ini lebih pendek dibanding cervix pada rusa wapiti (10-15 cm) dan rusa merah (5-7 cm) (Haigh dan Hudson 1993),
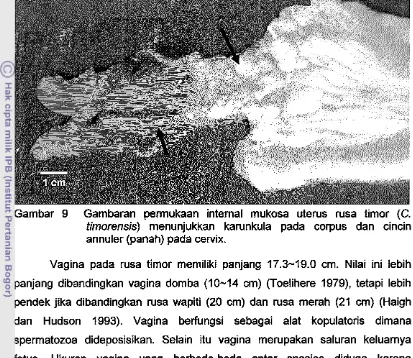
serta sa pi (8-10 em) dan domba (4-10 em) (Toelihere 1979). Ukuran diameter cervix akan lebih kecil pada betina yang belum pernah bunting (Haigh dan Hudson 1993). Mukosa cervix pad a rusa timor mempunyai 4-5 cincin annuler (Gambar 9). Hal ini kurang lebih sam a dengan yang dilaporkan pad a rusa wapiti,
4-6 cincin (Haigh dan Hudson 1993). Sapi mempunyai 4 cincin (Hafez dan Hafez
2000). Cincin ini terdiri atas lapisan otot licin yang 「・セ。ャ。ョ@ sirkuler, berfungsi untuk membantu menutup uterus dari kontaminasi mikroba (Anonim 2005).
Cervix pada babi berbentuk corong sedangkan pada kuda berupa lipatan
berrnukus. Bentuk cervix ini disesuaikan dengan bentuk glans penis pada hewan
jantannya (Anonim 2005).
Gambar 9 Gambaran perrnukaan internal mukosa uterus rusa timor (C.
timorensis) menunjukkan karunkula pada eorpus dan einein annuler (panah) pada cervix.
Vagina pada rusa timor memiliki panjang 17.3-19.0 em. Nilai ini lebih
panjang dibandingkan vagina domba (10-14 em) (Toelihere 1979), tetapi lebih
pendek jika dibandingkan rusa wapiti (20 em) dan rusa merah (21 em) (Haigh
dan Hudson 1993). Vagina berfungsi sebagai alat kopulatoris dimana
spermatozoa dideposisikan. Selain itu vagina merupakan saluran keluarnya
fetus. Ukuran vagina yang berbeda-beda antar spesies diduga karena
disesuaikan dengan morfometri penis dari hewan jantannya.
Struktur Makroskopis Ovariurn
Ovarium rusa timor berbentuk ovoid (Gam bar 10) dan terletak di dekat
tepi pelvis dan memiliki ukuran panjang 0.37-0.54 em, lebar 0.33-0.46 em, tebal
0.17-0.33 em serta berat 0.40-1.28 9 (Tabel 3). Ovarium yang berbentuk ovoid
seperti bentuk ovarium pada domba atau kambing (Azis 1994, Kusnandar 2001).
Hafez dan Hafez (2000) menyatakan bahwa ovarium sapi dan kambing
mempunyai bentuk oval seperti buah almond. Sedangkan ovarium babi seperti
buah anggur dengan ukuran lebih besar dari ovarium domba. Ovarium kuda
mempunyai bentuk seperti ginjal dan 2-3 kali lebih besar daripada ovarium sapi.
[image:36.550.74.487.132.490.2]0.17-0.33 em dan berat 0.40-1.28 g. Ukuran ovarium rusa timor ini lebih keeil jika dibandingkan dengan ovarium rusa wapiti saat estrus pada musim tidak kawin (1.5xO.8xO.5 em) dan dengan ovarium kambing dan domba. Toelihere
(1979) mengatakan bahwa bentuk dan ukuran ovarium bisa berbeda
berdasarkan spesies dan siklus berahinya. Ovarium sapi mempunyai ukuran
3.5x2.5x1.5 em (Anonim 2005). Sedangkan ukuran ovarium pada domba dan
kambing relatif lebih besar dibanding ovarium rusa (Tabel 3). Menurut Arthur
et
al. (1996), ovarium domba pada saat anoestrus berukuran 1.3 x1.1 x 0.8 em.
Gambar 10 Ovarium rusa timor (C. timorensis) memperlihatkan bentuk ovoid dari ovarium. Bar: 3 mm.
Tabel 3 b・「・イ。セ。@ ukuran ovarium rusa timor dibanding ruminansia lain
Parameter Posisi Rusa 1 Rusa 2 Domba Kambing Wapiti (Haigh & (Azis 1994) Hudson 1993)
Berat (g) Kanan 0.40 1.28 0.70 1.20 Kiri 0.60 0.80 0.74 1.49
Panjang (em) Kanan 0.40 0.37 1.40 1.49 1.50 Kiri 0.44 0.54 1.57 1.65
Lebar (em) Kanan 0.34 0.33 1.05 0.90 0.80 Kiri 0.38 0.46 1.10 1.12
Tebal (em) Kanan 0.26 0.17 0.97 0.69 0.50 Kiri 0.30 0.33 0.77 0.85
Bentuk Ovoid Ovoid Oval Oval Oval
Ukuran panjang, lebar, tebal ovarium yang diperoleh pada kedua rusa, memperlihatkan bahwa ovarium kiri cenderung lebih besar. Hal ini sarna dengan yang ditemukan pada ovarium kambing yang mempunyai ovarium kiri cenderung lebih besar walaupun ukuran ovarium kanan dan kiri tidak berbeda nyata (Azis 1994). Dari kedua rusa yang digunakan untuk penelitian ini, ukuran ovarium rusa 2 relatif lebih besar dibanding dengan ovarium rusa 1. Hal ini karena rusa 2 berada pada fase luteal. Pada fase luteal terbentuk corpus luteum yang dapat menyebabkan bertambahnya ukuran dan berat ovarium. Perbedaan ukuran ini juga diamati pada kambing (Kusnandar 2001), walaupun perbedaan ukuran ovarium pada kedua fase tersebut tidak menunjukkan perbedaan yang nyata. Perbedaan ini juga ditemukan pada ovarium sapi. Ovarium sebelah kiri
(2.57x1.91x1.61 cm) lebih besar dibanding ovarium kanan (2.51x1.84x1.53 cm)
(Tian dan Zhao 2000).
Struktur Mikroskopis Ovarium
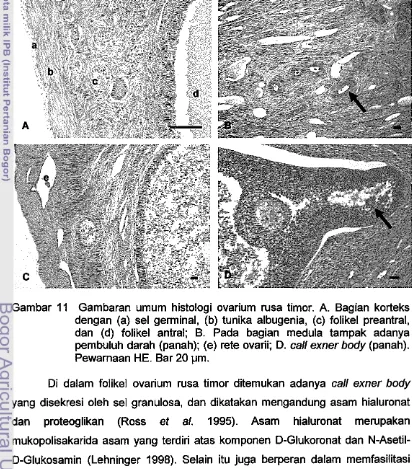
Secara mikroskopis, perrnukaan ovarium dilapisi oleh epitel selapis (epitel genminal) yang berbentuk kubus rendah. Tepat di bawah (ke arah dalam) epitel genminal ini terdapat stroma yang membentuk tunika albuginea, lapisan jaringan ikat padat tidak teratur. Ovarium dapat dibagi atas dua bag ian yaitu bag ian korteks dan bag ian medula. Berbagai tipe folikel tersebar di bag ian korteks dan berkembang ke arah medula (Gambar 11A). Pada bagian medula ditemukan adanya pembuluh darah (Gam bar 118), otot polos dan sel hilus. Pada foUkel ovarium rusa timor ditemukan adanya rete ovarii (Gam bar 11 C) dan call exner body (Gambar 11 D).
pada ovarium sapi. Rete ovarii diperlukan pada awal pembentukan sel folikuler. Hal ini dibuktikan pada penelitian transplantasi. Folikel pada ovarium transplantasi yang mengandung rete ovarii akan berkembang, sedangkan yang tidak mengandung rete ovarii akan gagal membentuk folikel (Byskov 1977, diacu dalam Jones 1977). Manurut Jones (1977), rete ovarii ini dapat menginisiasi awal pembelahan meiosis. Namun rete ovarii tidak berperan dalam pembentukan folikel pada kelinci dan marmut (Oeanesly 1975, diacu dalam Jones 1975). Selain rete ovarii, perkembangan folikel juga ditentukan oleh adanya sel folikuler atau sel granulosa.
Gambar 11 Gambaran umum histologi ovarium rusa timor. A. Bagian korteks dengan (a) sel germinal, (b) tunika albugenia, (c) folikel preantral, dan (d) folikel antral; B. Pada bag ian medula tampak adanya pembuluh darah (panah); (e) rete ovarii; O. call exner body (panah). Pewamaan HE. Bar 20 Ilm.
Oi dalam folikel ovarium rusa timor ditemukan adanya call exner body
[image:39.552.76.488.249.718.2]dalam pertumbuhan sel serta komunikasi antar sel (Murray et al. 1997). Call exner body diduga sebagai prekursor liquor folikuli.
Morfologi Folikel Pada Berbagai Tahap Perkembangan
Pada ovarium rusa timor ditemukan folikel dari berbagai tahap perkembangan (folikulogenesis). Masing-masing tipe folikel mempunyai struktur dan ukuran yang berbeda-beda (Tabel 4). Berdasarkan karakteristik pada struktur morfologi dan ukurannya, folikel yang ditemukan pad a ovarium rusa timor ini dapat dibedakan menjadi 8 tipe dan dua jenis corpus yaitu corpus luteum dan corpus albikans.
Hafez dan Hafez (2000) mengatakan bahwa perkembangan dan maturasi folikel terjadi dengan adanya perubahan bentuk secara subseluler pada beberapa komponen folikel seperti differensiasi oosit, proliferasi dan differensiasi sel granulosa dan sel teka. Perubahan ini dipengaruhi oleh faktor intraovari, faktor intrafolikel ataupun faktor hormonal. Perubahan molekuler juga エ・セ。、ゥ@
pada proses pperkembangan folikel, seperti pembentukan zona pelusida, reseptor FSH dan LH, pembentukan hormon (Ross et al. 1995). Faktor hormonal (antara lain androgen dan estrogen) akan menginduksi proliferasi dan diferensiasi sel-sel teka dan sel-sel granulosa serta meningkatkan kemampuan folikel dalam memproduksi estradiol dan merespon gonadotropin. Menurut pendapat lain (Anonim 2005), maturasi folikel terbagi atas beberapa tahap folikel yaitu folikel primer, sekunder, tersier (antral) dan folikel de Graaf.
Selama perkembangan dalam satu siklus estrus, ada dua tahap proses
エ・セ。、ゥョケ。@ diferensiasi ovum yaitu proses mitosis dan meiosis. Pada saat prenatal
oogonium mengalami proliferasi secara mitosis (multiplikasi) dari sel germinal. Kemudian oogonia mengalami pembelahan meiosis I menjadi oosit primer sampai tahap diploten profase. Perkembangan ini terhenti sampai individu masuk masa pubertas. Setelah pubertas folikel akan berkembang lebih lanjut dan oosit primer akan berkembang menjadi oosit sekunder melalui pembelahan meiosis II (Banks 1986).
Perkembangan oosit akan diikuti dengan pembentukan zona pelusida. Diameter folikel dan diameter oositnya mengalami peningkatan. Gambaran yang ditemukan menunjukkan karakteristik folikel yang berada pada tahap awal perkembangan (Gambar 12). Menurut Rajput dan Sahrma (1996), diameter folikel primer pada domba adalah 40,.,30 11m dengan diameter oosit 25,.,35 11m sedangkan pad a kerbau diameter folikelnya adalah 35"-'48 11m dengan diameter oosit 21,.,28 11m.
Pada folikel tipe satu (1), sel granulosa berbentuk kuboid pendek (Gambar 128). Oosit besar dan berada di tengah folikel. Folikel ini merupakan fOlikel tipe dua (2). Sel granulosa selapis kemudian akan berubah menjadi kuboid tinggi. Oosit akan berkembang diikuti dengan pembentukan zona pelusida. Zona pelusida mulai terbentuk antara sel granulosa dan oosit. Membran basal tampak membatasi sel-sel granulosa dengan stroma disekitamya (Gambar 12C). Folikel tipe ini mempunyai diameter dengan kisaran antara 0.035-0.062 mm. Menurut Hyttel et al. (1996), bertambah besamya diameter berhubungan dengan differensiasi oosit. Selama perkembangan oosit, di ooplasm a terbentuk kompleks golgi, retikulum endoplasm a, lipid droplet dan membran vesikel. Aktivitas transkripsi dilakukan selama perkembangan oosit untuk sintesis protein yang digunakan untuk proses pembelahan meiosis oosit atau untuk dikeluarkan dari sel.
Secara ultrastruktur perubahan-perubahan pada folikel akan terjadi selama perkembangan folikel. Pada folikel primordial akan terbentuk coated pits
dan vesikel. Pada folikel primer ditemukan beberapa mikrovili dan mitokondria.
Gap junction terbentuk pada folikel sekunder. Mikrovili menjadi kuat, jumlah coated pits berkurang dan ditemukan adanya sekelompok cortical granule. Pada folikel tersier awal akan terbentuk atrum folikuli, jumlah cortical granule
Folikel sel Posisi oosit
teka folikuli pelusida F. folikuler F. luteal F. folikuler F. luteal F. folikuler F. luteal granulosa
Tipe 1 1 konsentrik 31 8 0.051 0.045 0.032 0.022
Tipe 2 1-2 + + konsentrik 15 8 0.076 0.071 0.044 0.035
Tipe 3 2-3 + konsentrik 3 4 0.095 0.109 0.048 0.038
Tipe 4 3-4 ++ ++ konsentrik 2 5 0.168 0.276 0.063 0.086
Tipe 5 4-5 ++ ++ +++ konsentrik 6 0.299 0.368 0.089 0.089
Tipe 6 5-6 +++ +++ +++ konsentrik 4 0.616 0.661 0.117 0.104
Tipe 7 >6 +++ +++ +++ eksentrik 1 0.402 0.560 0.114 0.101
Tipe 8 >6 +++ +++ +++ eksentrik 5.400 2.107 0.160 0.098
[image:42.801.46.682.107.391.2]Braw-Tal dan Yossefi (1997) menyatakan bahwa awal perkembangan folikel dapat dibedakan menjadi dua tahap, yaitu tahap perubahan sel granulosa dari pipih menjadi kuboid pendek dan tahap kedua adalah meningkatnya jumlah sel granulosa yang diikuti dengan peningkatan ukuran oosit. Perubahan dari folikel primordial menjadi folikel yang berkembang lebih lanjut memiliki tiga ciri yaitu adanya perubahan bentuk sel granulosa dari pipih menjadi kuboid, adanya proliferasi sel granulosa dan oosit bertambah besar (Hirshfield 1991, diacu dalam Braw-Tal dan Yossefi 1997). Menurut Senger (1999), sel granulosa pada folikel primer mulai mengekspresi reseptor FSH dengan dibentuknya aktivin. Perkembangan folikel ini meliputi tiga macam maturasi (pematangan) yaitu maturasi oosit, maturasi inti dan maturasi sitoplasma.
Gambar 12 Gambaran morfologi berbagai folikel pada tahap awal perkembangan. A. Beberapa folikel tipe 1 dengan sel granulosa pipih (panah); B. Folikel tipe 2 dengan selapis sel granulosa yang berbentuk kuboid pendek (panah); C. Folikel tipe 2 dengan sel granulosa berbentuk kuboid tinggi (panah). Pewamaan HE. Bar 201Jm.
[image:43.552.74.486.257.771.2]membran basal (Gambar 14B). oosit berada di tengah folikel dan dikelilingi oleh sel-sel granulosa. Folikel tipe ini memiliki diameter antara 0.037-0.1 mm. Zona pelusida tampak relatif sempuma mengelilingi oosit (Gambar 14C). Pada mencit dan manusia, zona pelusida terbentuk sempurna mengelilingi oosit pada tahap folikel primer (Himelstein-Braw et al. 1976; Oakberg 1979 diacu dalam Braw-Tal dan Yossefi 1997). Pada ovarium sapi terbentuknya zona pelusida secara sempurna terjadi pada folikel preantral tahap akhir (Braw-Tal dan Yossefi 1997). Zona pelusida pada rusa timor tampak terbentuk secara sempurna lebih awal dari sapi, yaitu pada folikel preantral dengan dua lapis sel granulosa. Zona pelusida adalah selubung ekstraseluler tebal yang mengelilingi oosit mamalia. Zona pelusida mengandung reseptor spermatozoa yang merupakan perantara interaksi spermatozoa-oosit, yang mengawali fertilisasi, menginduksi reaksi akrosom dan berperan dalam hambatan (zona block) terhadap polisperma (Ross et al. 1995)
Folikel tipe satu (1) dan dua (2) banyak ditemukan pada ovarium fase folikuler (Gambar 13). Diameter folikel dan diameter oosit pada folikel-folikel ini pada ovarium fase folikuler lebih besar dibanding pada ovarium fase luteal. Hal ini karena pada fase luteal banyak ditemukan folikel dominan yang dapat menekan pertumbuhan folikel subordinat ataupun folikel tahap awal. Folikel dominan menghasilkan inhibin dan estrogen yang akan menghambat sekresi FSH.
30 28
セ@ セセ@
.e
22.c 20 !! 18 E 16
.a
14 ., 12 .. 10セ@
8i!! 6
.. 4
... 2
o
--=
1.
- II - I -- I---- -- - . '-セ@
'--2 3
--
-- -
r--: - - セ@
r--t;::;::
.c---t--'-r=
4 5 6
Tipe follkel
J.,
7...
セ@ 8 of. folikuler!II f luteal
[image:44.555.70.485.41.798.2]Pada folikel tipe tiga (3), sel-sel granulosa berproliferasi menjadi lebih banyak. Pada tahap ini, zona pelusida tampak menebal mengelilingi oosit (Gambar 14D). Sel granulosa yang terletak setelah lapisan pertama berbentuk kuboid sedangkan pada lapisan pertama sel ini berbentuk kuboid tinggi. Diameter folikel tipe ini berkisar antara 0.067-0.27 mm. Folikel tipe tiga (3) lebih banyak ditemukan pada ovarium fase luteal dibanding pada ovarium fase folikuler (Gam bar 14). Diameter folikelnyapun relatif lebih besar pada ovarium fase luteal, sedangkan diameter oositnya lebih besar pada fase folikuler.
Folikel pada tahap perkembangan selanjutnya dikategorikan sebagai folikel tipe empat (4). Pada folikel ini jumlah sel-sel teka bertambah banyak, lapis sel granulosa bertambah menjadi tiga sampai empat lapisan dan ditandai dengan penebalan zona pel us ida (Gambar 14E), oosit masih konsentrik. Perbandingan antara diameter folikel dan diameter oosit semakin besar. Sel granulosa telah banyak yang menempel pada zona pelusida, yang nantinya akan membentuk corona radiata. Di antara sel-sel granulosa tampak adanya ruangan yang berisi matriks (Gambar 14F). Sel-sel teka ekstema telah terbentuk. Folikel ini memiliki diameter antara 0.084-0.42 mm. Pembuluh darah akan terbentuk setelah terbentuknya teka ekstema pada folikel tipe (4). Darah bersirkulasi di sekitar folikel, membawa nutrisi dan gonadotropin ke folike!. Dengan pengaruh LH, sel teka intema akan memproduksi androstenidion dan testosteron. Dengan pengaruh FSH, testosteron ini akan diubah menjadi estrogen oleh membran sel granulosa. Estrogen ini akan terkumpul dalam antrum folikuli dan akan menginduksi proliferasi sel granulosa dan pertumbuhan folikel (Banks 1986).
Gambar 14 Folikel pada ovarium rusa timor. A. Folikel tipe 2, tampak membran basal yang jelas (anak panah); B. Sel granulosa mulai berproliferasi; C. Folikel tipe 2 (0) oosit, (n) nukleolus, (g) sel granulosa, zona pelusida telah sempurna (anak panah); O. Folikel tipe 3; E. Folikel tipe 4; F. Folikel tipe 4 tahap akhir. Oi antara sel granulosa tampak ada ruangan yang berisi matriks (Pewarnaan HE. Bar 20 IJm).
[image:46.553.75.483.63.658.2]banyak. Oosit masih berada ditengah dengan zona pelusida yang semakin tebal. Zona pelusida dan sel teka eksterna tampak sangat jelas. Sel-sel granulosa mengumpul ke bag ian tepi. Folikel tipe empat (4), lima (5) dan enam (6) lebih banyak ditemukan pada ovarium fase luteal dibandingkan pada ovarium fase folikuler. Diameter folikel relatif lebih besar pada ovarium fase luteal, namun diameter oositnya lebih besar pada fase folikuler.
Gambar 15 Folikel antral dan bagian-bagiannya. a. Antrum folikuli yang berisi liquor folikuli, b. Oosit, c. Sel granulosa, d. Cumulus oophorus, e. Sel-sel teka, f. Nukleus, membran basal (panah tipis), zona pelusida (panah tebal). Pewarnaan HE. Bar 20 IJm.
Pada folikel tipe tujuh (7), tampak oosit telah mulai menuju perifer karena terdesak oleh perluasan antrum (Gam bar 16C). Pada tahap lebih lanjut oosit mulai tertanam di bag ian tepi folikel dengan cumulus oophorus (Gam bar 160). Diameter dari folikel tipe ini berkisar antara 0.40 sampai 1.3 mm.
[image:47.553.165.394.182.425.2]ovarium, fase folikuler maupun fase luteal, ditemukan adanya folikel tersier. Namun folikel tersier pada ovarium fase folikuler memiliki diameter folikel (5.4 mm) dan diameter oosit (0.160 mm) yang jauh lebih besar dibanding pada ovarium fase luteal (Gambar 18). Hal ini diduga rusa timor memiliki gelombang folikel dalam siklus estrusnya. Kenitz (2003) menyatakan bahwa sapi memiliki 2, 3 atau 4 gelombang folikel selama satu siklus estrus. Menurut Adam (1999), diacu dalam Kenitz (2003), 95% siklus estrus sa pi terdiri dari dua atau tiga gelombang folikel (Gam bar 17).
[image:48.550.76.474.165.740.2]Antrum foUkuli pada folikel yang berkembang akan mengalami perluasan terus-menerus, sehingga oosit akan terdesak ke tepi dan akan tertanam dalam cumulus oophorus sampai エ・セ。、ゥ@ ovulasi (Gam bar 16F). Pada foUkel de Graaf, diameter foUkel dapat mencapai 5.4 mm (Gambar 18) dengan diameter oosit 0.160 mm. Antrum folikuli akan mendominasi bag ian dalam dari folikel de Graaf. Pada domba diameter foUkel tersier lebih dari 5 mm (Maracek at a/. 2002). Hasil penelitian McLeod at al. (2001) menunjukkan bahwa diameter foUkel antral yang besar pada rusa merah di fase folikuler mencapai 8.3 ± 0.38 mm. Folikel dominan pada sapi dapat mencapai diameter 15 mm (Tian dan Zhao 2000).
QVイMMMMMMMMMMMMMMMMMMMMMMMMMMMMMMMMMMMMMセ@
o
l
セセセᄋセセイGセ@
______
セ@
__________________
セセセセセ@
o
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 0 1Days of oestrous cycle
••• dom. foil. first wave - dem. foil. second wave- .. progesterone
Gambar 17 Diagram skema gelombang pertumbuhan foUkel selama satu siklus estrus. (Kenitz 2003).
[image:49.550.77.474.75.650.2]menyebabkan inisiasi sintesis enzim kolagenase oleh sel teka interna. Enzim ini akan mempermudah degradasi sel-sel pada tunika albuginea pada sisi ovulasi.
6 5.5 セ@ 5
セ@
4.5-
4
セ@
3.5:: 3
セ@
2.5-m
2E 1.5
IV
'S
10.5
a
01 2 3
-- dIl
lセ@
4 5 6 7
tipe folikel - I - I - I-- l- I- t- I-8 of. folikuler
Ii!I f.luteal
Gambar 18 Diagram diameter folikel ovarium rusa timor pada fase folikuler dan fase luteal.
Menurut Senger (1999), dinamika folikel antral terdiri atas tiga tahap yaitu:
1. tahap recruitmen folikel, merupakan awal pertumbuhan folikel antral dan mulai memproduksi estrogen.
2. tahap seleksi folikel, seleksi folikel yang nantinya dapat berkembang menjadi folikel dominan.
3. tahap dominasi folikel, yang merupakan perkembangan akhir dari folikel yang terseleksi untuk menjadi folikel dominan yang siap diovulasikan. Folikel-folikel lain yang tidak terseleksi akan atresi.
[image:50.553.78.468.73.324.2]estrogen yang memberikan feed back negatif terhadap sekresi FSH dan feed back negatif terhadap sekresi LH. Selain itu, folikel antral juga memproduksi inhibin yang dapat menghambat sekresi FSH sehingga perkembangan folikel kecil terhambat (Hafez dan Hafez 2000). Menurut Armstrong dan Webb (1997), folikel dominan juga menghasilkan FGIF yang menghambat proliferasi sel granulosa yang menstimulasi FSH dan menghambat aktivitas aromatase. Selain itu juga menghambat vaskularisasi folikel subordinat.
Seperti pada domba dan kambing, pada rusa timor perkembangan folikel juga エ・セ。、ゥ@ pada ovarium fase luteal. Pada fase tersebut ditemukan berbagai tipe folikel yang berkembang dari tipe primordial sampai folikel antral. Hal ini mencerminkan adanya dinamika folikel pada semua fase estrus. Pada fase luteal ditemukan adanya folikel tersier, namun folikel ini tidak akan terovulasi selama corpus luteum belum regresi karena tidak エ・セ。、ゥ@ LH surge. Hal ini karena sekresi LH yang penting untuk pertumbuhan folikel antral akan ditekan oleh adanya progesteron (Ravindra et al. 1994). Menurut Mc Leod et al. (2001), perkembangan folikel antral pada red deer mirip dengan ruminansia monovulatori, dan minimal terdapat satu folikel besar pada fase folikuler dan fase luteal. Pada penelitian ini ditemukan bahwa diameter oosit pada ovarium fase folikuler relatif lebih besar dibanding pada ovarium fase luteal (Gam bar 19) di berbagai tahap perkembangan (tipe 1-9). Hal ini diduga karena perkembangan oosit pada fase folikuler dipengaruhi oleh FSH, sedangkan pada fase luteal sekresi FSH dihambat oleh adanya hormon progesteron.
....
0.18 0.16 0.14'8
0.12セ@ 0.1
セ@
0.08 E !1! 0.06 " 0.04 0.02o
fit
It
1 2
--
--
--
- --- -
-3 4 5
tipe folikel - セ@ -
----
---6 7
-セ@ :... 8
o f.folikuler Eli! f.luteal
[image:51.550.70.481.143.747.2]Pada CL, sel granulosa dan lapisan teka interna mengalami perubahan morfologi menjadi sel luteal walaupun antrum masih tampak (Gambar 20A). Diameter folikel tipe ini adalah 0.5 mm. Corpus albikans merupakan corpus luteum yang telah mengalami regresi. Pada corpus tipe ini antrum secara keseluruhan telah menjadi jaringan ikat yang berwarna keputihan (Gam bar 20B). Diamater corpus albikans berkisar antara 0.1-0.9 mm. CL hanya ditemukan pada ovarium fase luteal dengan diameter 0.5 mm, sedangkan corpus albikans ditemukan di kedua fase ovarium.
Gambar 20 Gambaran corpus luteum dan corpus albikans pada ovarium rusa timor (A). Pada bag ian tengah corpus albikans tampak adanya jaringan ikat berwarna putih (B). Pewarnaan HE. Bar: 40llm.
Setelah エ・セ。、ゥ@ ovulasi, maka folikel akan membentuk CL. Pada awalnya sel granulosa dan lapisan teka interna mengalami perubahan morfologi menjadi sel luteal. Ada dua tipe sel luteal ya