KTERISASI PROTEIN IRlUNOGLOBULIN Y (Ig Y)
NG TELUR H5N,, H5N2 DAN H5N9 MENGGUNAKAN
METODE
SODIUM DODECYL SULPHATE-POLY
ACRILMIDE GEL ELECTROPHORESIS
(SDS-PAGE)
DHESIANTI TRI
AYANI
RAKULTAS KEDOKTERAN WEWAN
ILNSTITUT PERTANIAN BOGOR
ABSTRAK
DHESIANTI TRI HANDAYANI. Karakterisasi Protein Imunoglobulin Y (IgY) H;N1, HsN2 dan HsN9 Menggunakan Metode Sodium Dodecyl Sulphate Poly Acrylamide Gel Electrophoresis (SDS-PAGE). Dibimbing oleh RETNO DAMAJANTI SOEJOEDONO dan SRI MURTINI.
KARAKTERISASI PROTEIN IMUNOGLOBULIN
Y
(IG
Y)
H5N1, H5N2 DAN H a 9
MENGGUNAKAN METODE
SODIUM
DODECYL SULPHATE POLY ACRYLAMIDE GEL
ELECTROPHORESIS
(SDS-PAGE)
DHESIANTI TRI HANDAYANI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sajana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Karakterisasi Protein Imunoglobulin Y ( I g v H5N1, HsN2 d m HsN9 Menggunakm Metode Sodium Dodecyl Sulphate Poly Aciylamide Gel Electrophoresis (SDS-PAGE)
Nama : Dhesianti Tri Handayani
NRP
: B04104138Disetujui
Prof. Dr. ~ r h . Retno Damaianti Soeioedono. MS Dr. Drh. Sri Murtini, MS
Pembimbing 1 Pembimbing I1
Wakil Dekan
I
Tanggal Lulus : '
1
1
NOV
2088
PRAKATA
Puji syukur kehadirat Allah SWT atas rahmat, keridhoan dan h i d a y m y a sehingga penulis dapat menyelesaikan skripsi ini sebagai salah satu syarat untuk memperoleh gelar sarjana kedokteran hewan di Fakultas Kedokteran Hewan IPB. Shalawat dan salam selalu tercurah kepada junjungan Nabi Muhammad SAW.
Penulis juga tidak lupa mengucapkan terima kasih yang sebesar-besamya kepada:
1. Orangtua tercinta Bapak Tarmudji dan Ibu Sumartun yang selalu setia memberikan doa, semangat dan kasih sayang kepada penulis, Mas- masku yang penulis banggakan mas Sugeng dan Mas Yudi dan adikku Candra.
2. Prof. Dr.Drh Retno Damajanti Soejoedono sebagai pembimbing skripsi sekaligus dosen pembimbing akademik atas nasehat, arahan, perhatian, waktu dan kesabarannya yang telah diberikan kepada penulis.
3. Dr. Drh. Sri Murtini, MS sebagai dosen pembimbing skripsi atas arahan, motivasi, perhatian, waktu dan kesabaran yang telah diberikan kepada penulis.
4. Drh. Okti Nadia Poetri, Msi atas masukkannya dan bantuannya dalam penyusunan skripsi.
5. Dr. Drh. Hj. Agustin Indrawati, Mbiomed atas masukkannya.
6. Staf dan pegawai lab imunologi ( Mas Wahyu, Pak Lukman, mas Ivan) atas kerjasama dan bantuannya.
7. Teman- teman sepenelitian yang selalu bersama dalam perjuangan ini (yus dan Sugi).
8. Keluarga di Green House (Rita, Feni, Ami, M' Siti), Keluarga di Wisma Jamila (Camay dan Upik'dut), keluarga di pondok Sakha ( all MY40), Iswara Crew (Weni, Ratih, Rina), Bunsay, NenekQ, Ria, Aqil, Ratna, d m Tia.
9. Keluarga di IMAKAHI cabang FKH IPB dan IMAKAHI seluruh Indonesia.
11. Saudarali di PMP BAJAY atas motivasinya.
12. Saudardi Asteroidea yang Terbaik dan Teristimewa.
13. Beasiswa Utusan Daerah Kutai Kartanegara (BUD KUKAR).
Terimakasih atas segala semangat. Inspirasi dan persaudarannya (Ukhuwah) yang sangat luar biasa. Semoga Allah SWT membalas semua kebaikan yang telah diberikan. Penulis menyadari masih banyak terdapat kekurangan dalam tulisan iili, oleh karena itu saran kritik yang membangun sangat diharapkan. Penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi kita selnua.
RIWAYAT HIDUP
Penulis dilahirkan di Sei Mariam pada tanggal 11 Desember 1985. Penulis adalah putri ke tiga dari empat saudara dari pasangan Bapak Tarmudji dan Ibu Sumartun. Penulis menempuh pendidikan Taman Kanak-Kanak di TK Dahlia Anggana (1991-1992), Sekolah dasar di SDN Inpres 017 Tenggarong (1992- 1998), kemudian penulis melanjutkan studi di SLTPN 1 Tenggarong (1998-2001), selanjutnya meneruskan pada SIviUN 1 Tenggarong dan diterima di Fakultas Kedokteran Hewan Institut Pertanian Bogor melalui jalur BUD (Beasiswa Utusan Daerah).
DAFTAR IS1
Halaman
...
DAFTAR IS1...
vltiDAFTAR GAMBAR
...
ixDAFTAR TABEL
...
xPENDAHULUAN Latar Belakang
...
I Tujuan...
3...
Manfaat 3 TINJAUAN PUSTAKA Virus Avian Influenza...
4Antibodi Ayam (IgY)
...
6Vaksin dan Vaksinasi Avian Influenza
...
9Pernumian Imunoglobulin Y (IgY)
...
12SDS-PAGE
...
12METODE PENELITIAN Waktu dan Ternpat Penelitian
...
15Bahan d m Alat
...
15Metode Penelitian
...
Koleksi Telur 15 Metode Pemurnian Protein PEG 6000-Klorofoim...
16...
SDS-PAGE 16
...
HASIL DAN PEMBAHASAN 18
KESIMPULAN
...
Kesiinpulan 22
...
DAFTAR GAMBAR
Gambar 1 Virus Avian Influenza
...
4 Gambar 2 Mekanisme sederhana SDS-PAGE...
17...
Latar Belakang
Avian Infuenza (AI) merupakan penyakit hewan yang disebabkan oleh virus dan bersifat zoonosis. Wabah A1 atau biasa disebut penyakit flu burung telah berjanglut dibanyak negara di Asia termasuk Indonesia sejak akhir tahun 2003. Dampak negatif penyakit ini sangat mempengaruhi sektor pertanian, industri perunggasan, dan perdagangan intemasional, bahkan terhadap kesehatan manusia. Penyakit Avian Influenza dikhawatirkan menjadi pandemi di wilayah Asia dan dunia pada umumnya (Naipospos 2007).
Menurut (WHO) terdapat enam fase global pandemi influenza berdasarkan sejumlah faktor epidemiologi pada manusia sebelum suatu pandemi ditetapkan. Keenam fase ini dikelompokkan dalam tiga periode, yaitu periode interpandemi, periode waspada pandemi, dan periode pandemi. Sampai saat ini, WHO menetapkan bahwa tahapan pandemi influenza di dunia berada di fase 3, yaitu infeksi pada manusia, namun tidak ada penularan antar manusia. Meningkatnya kasus infeksi Avian Infuenza yang menyebabkan kematian pada manusia dikhawatirkan dapat berkembang menjadi wabah pandemik yang berbahaya bagi umat manusia di muka bumi ini. Kasus Avian Influenza HsNl yang pertama kali menyerang dan menewaskan 6 orang penduduk Hongkong pada tahun 1997 dari 18 orang yang terinfeksi (Horimoto & Kawaoka 2005). Kasus Avian Infuenza pada manusia pertama di Indonesia yang terjadi pada pertengahan 2005. Data WHO sampai dengan 29 juli 2008 inenunjukkan kasus A1 pada manusia di Indonesia telah mencapai 136 kasus dengan 11 1 orang diantaranya meninggal (WHO 2008).
dihadapi Indonesia adalah distribusi petemakan ayam sangat bersifat acak, lalu- lintas unggas sulit terkendali, dan adanya keterbatasan dana kompensasi bagi peternak (Naipospos 2007).
Berdasarkan pertimbangan diatas maka pelnerintah menetapkan sembilan langkah strategi sebagai tindakan penanggulangan, yang salah satunya adalah tindakan vaksinasi. Vaksinasi dilakukan pada semua jenis unggas sehat di daerah yang yang telah diketahui terinfeksi maupun terancam terinfeksi virus AI.
Vaksin yang digunakan adalah vaksin inaktif yang terdaftar pada instansi pemerintah berwenang ( Soejoedono dan Handharyiui 2005). Vaksin yang dapat digunakan dalam pencegahan dan pemberantasan A1 adalah vaksin inaktif homolog. Vaksin homolog adalah vaksin dengan subtipe virus yang sana dengan virus penyebab penyakit. Virus A1 yang beredar di Indonesia adalah tipe H5N1, maka vaksin yang digunakan adalah vaksin dari virus H5Nl. Deptan (2005) menyatakan bahwa vaksinasi terhadap A1 sebaiknya menggunakan vaksin heterolog. Berdasarkan Swat Edaran (SE) Dijen Petemakan No.98/PD.640/F/12.06 tanggal 15 Desember 2006 bahwa penggunaan vaksin homolog dihentikan. Vaksin heterolog adalah vaksin yang berisi virus dengan mempunyai molekul HA yang sama dengan penyebab wabah A1 di lapangan akan tetapi mempunyai NA yang berbeda, sebagai contohnya vaksin H5N2 atau H5N9. Penerapan vaksin heterolog digolongkan sebagai vaksin DIVA (Differentiating Infection from Vaccinated Animal) membedakan hewan yang terinfeksi alami dengan hewan yang divaksinasi. Dengan mendeteksi antibodi yang spesifik terhadap subtipe NA, ciri serologik vaksiil dan unggas yang terinfeksi dapat dibedakan (Cattoli 2003). Namun metoda ini dapat sangat i-umit dan vaksin ini pun h a n g sensitif.
Tujuan
Tujuan penelitian ini untuk melihat karakteristik protein (IgY anti H5N1, IgY anti H5N2, IgY anti H5N9) dilihat dari susunan protein d m berat molekul yang terbentuk.
Manfaat
TINJAUAN PUSTAKA
Virus Avian Influenza
Virus influenza m e ~ p a k a n virus RNA termasuk dalam famili
Orthomynoviridae d m genus ~rthomyxuvirus. Virus ini merupakan virus yang berasam inti RNA dengan rantai tunggal. Pengamatan dengan mikroskop elektron,
Orrhomyxovirus berbentuk spherical atau partikel filament dengan diameter 80-
100 nrn (Jordon 1990). Komposisi kimianya protein 70-75 %, lemak 20-24%, karbohidrat, dan 1 % RNA. Virus influenza rusak pada suhu 56 C, dilarutkan pada pelarut lemak, asam, formaldehid, beta-propiolaktone, atau radiasi dengan sinar ultraviolet. Infektivitasnya turun pada freezing dan thawing atau penyimpanan -20 C. Virus Avian Influenza dapat di lihat pada ganlbar 1.
@ PB1. PBZ, PA
T w
: NP
1,
@ I w2 @ NS2
[image:14.514.26.449.26.639.2]NSl
Gambar 1 Virus Avian Influenza (Anonirn 2008a)
Asam nukleat virus ini beruntai kmggal, terdiri dari 8 segmen gen yang mengkode sekitar 11 jenis protein. Virus influenza mempunyai selubung yang terdiri dari kompleks protein dan karbohidrat. Virus ini mempunyai tonjolan
Dari ketiga genera ini, tipe A dapat menginfeksi hewan peliharaan seperti halnya ayam, itik, kalkun, burung puyuh, babi dan kuda.
Haemaglutinin (HA) merupakan molekul trimer berbentuk batang, dan neuraminidase (NA) berupa molekul tetramer berbentuk jamur. Kedua molekul HA dan NA itu merupakan glikoprotein dan membawa epitop khusus-subtipe (Fenner et a1 1995). Heamaglutinin (HA) berfungsi untuk penempelan virus pada sel host (Kuby 2007). Hemaglutinin virus influenza (HA) terikat pada reseptor glikoprotein yang rantai samping oligosakaridanya berujungkan asam sialat (Fenner et a1 1995). Sejauh ini telah ditemukan 16 subtipe dari H (HI-H16) dan 9 subtipe dari N (Nl-N9) pada unggas, beberapa darinya ditemukan dalam beberapa kombinasi antara HA dan NA pada berbagai spesies mamalia. Kombinasi antigen HA dan NA menghasilkan lebih dari 144 kombinasi subtipe virus AI, seperti HsN1, H;N2, H7N1, dan kombinasi lainnya. Berdasarkan tingkat keganasannya digolongkan menjadi dua, yaitu Highly Pathogenic Avian Infuenza (HPAI) dan Low pathogenic Avian Infuenza (LPAI) (Dhmmayanti 2003;
Soejoedono dan Handharyani 2005). Diantara 16 subtipe virus A1 hanya H5 dan H7 yang bersifat ganas (virulen) pada unggas (OIE 2006).
Wabah virus Influenza dapat menjadi pandemik karena mudahnya virus bermutasi, baik secara antigenik drift maupun antigenik shift sehingga membentuk varian-varian baru yang lebih patogen. Mutasi terjadi melalui antigenik drift jika titik mutasi terjadi di dalam gen yang mengkode protein HA dan NA sebagai usaha dalam mempertahankan diri dari sistem imun inang. Mutasi terjadi melalui antigenik shift bila ada penggabungan gen dari dua jenis virus yang berbeda yang menginfeksi sebuah sel secara bersamaan (Murphy et a1 2006 dalam Nurfitriani 2007).
Menurut (WHO) terdapat enam fase global pandemi influenza berdasarkan sejumlah faktor epidemiologi pada manusia sebelum suatu pandemi ditetapkan. Keenam fase ini dikelompokkan dalam tiga periode, yaitu periode interpandemi, periode waspada pandemi, dan periode pandemi, adapun penjabarannya sebagai berikut :
1. Periode Interpandemi
Fase 2 : Infeksi pada hewan dengan resiko penularan tinggi pada manusia. 2. Periode Waspada Pandemi
Fase 3 : Infeksi pada manusia, namun tidak ada penularan antar manusia Penularan dari unggas ke rnanusia sangat jarang dan terbatas pada kontak yang dekat.
Fase 4 : Infeksi pada manusia dengan bukti penularan antar manusia yang terbatas (kelompok kecil).
Fase 5 : Infeksi pada manusia dengan penularan antar manusia daliun keloinpok yang semakin luas.
3. Pandeini
Fase 6 : Pandemi (penularan yang meningkat dan berkesinambungan pada masyarakat umum).
Sampai saat ini, WHO menetapkan bahwa tahapan pandemi influenza di dunia berada di fase 3, yaitu infeksi pada manusia, namun tidak ada penularan antar manusia.
Antibodi Ayam (IgY)
Sistem kekebalan adalah sistem perlindungan tubuh terhadap invasi mikroorganis atau bahan organik asing yang dapat menimbulkan respon kekebalan. Respoil kekebalan terbagi dua yaitu respon humoral dan respon yang diperantarai oleh sel. Respon humoral ditandai oleh sintesis dan sekresi zat antibodi ke dalam sirkulasi darah atau cairan oleh sel-sel limfosit B dan plasma di dalan organ limfoid. Respon yang diperantarai oleh sel melibatkan pembentukan sel khusus dan sekresi signal kimia yang mengaktifkan makrofag untuk menghancurkan mikroorganisme tersebut (Alberts et a1 1989 dalam Simorangkir
1993).
reseptornya akan dihasilkan antibodi spesifik. Dengan demikian akan dihasilkan bermacam-macam antibodi.
Antibodi/iinunoglobulin merupakan kumpulan protein yang sangat heterogen dan heterogenitas ini disebabkan antara lain oleh perbedaan susunan asam anino. Akibat perbedaan asam amino, struktur molekul menjadi berbeda. Selanjutkan akan menimbulkan keragaman dalan detenninan antigenik imunoglobulin yaitu isotipe, alotipe dan idiotipe (Tizard 1988).
Secara m u m sistein imun pada unggas menyerupai sistem imun pada mamalia. Sistem imun ayam terdiri dari bursa fabrisius, suinsuin tulang, limfa, timus, glandula Harderian, limfonodulus, sirkulasi limfosit dan jaringan limfoid di traktus alimentarius. Sistem imun ayam sangat responsif terhadap protein asing atau mikroorganisme yang inemaparnya (akibat vaksinasi atau infeksi alam) sehingga kuning telur ayam mengandung lebih dari 200 antibodi yang berbeda (Davis & Reeves 2002 dalam Rawendra 2005). Menurut Carlender (2002), ayam memiliki sensitivitas tinggi terhadap protein asing sehingga dalam jumlah sedikit dapat meinberikan respon pembentukan antibodi.
Antibodi pada ayam berbeda dengan yang terdapat pada mamalia, Terdapat tiga kelas antibodi atau imunoglobulin. Diantara tiga kelas immunoglobulin ayam
(IgA, IgM, IgY) yang analog dengan immunoglobulin mamalia, IgY merupakal imunoglobulin yang tersedia dalam jumlah banyak diteinukan dalam serum, diturunkan secara vertikal melalui telur dan berada dalan kuning telur (Narat 2003; Gassman et a1 1990). Rose & Orlans (1981) dalam Rawendra (2005) menjelaskan proses transfer antibodi dari serum ke kuning telur terdiii dari dua tahap. Tahap pertama, antibodi ditransfer dari serum meiluju kuning telur dengan proses yang analog dengan proses antibodi pada fetus melalui plasenta pada mamalia. Tahap kedua, antibodi ditransfer d a i kantung embrio kepada embrio yang sedang berkemba~g. Keberadaan IgY dalam kuning telur inempunyai jarak 4 sampai 7 hari setelah antibodi dalam sei-um (Carlender 2002).
berat molekul 180,000 kDa yang masing-masing rantai beratnya 67 sampai 70 kDa, dua rantai ringan dengan berat molekul 22,000 sampai 30,000 kDa, koefisien sediinentasi 7,8 S, dan titik isoelektrik 5,7-7,6 ( Davalos & Patoja et a1
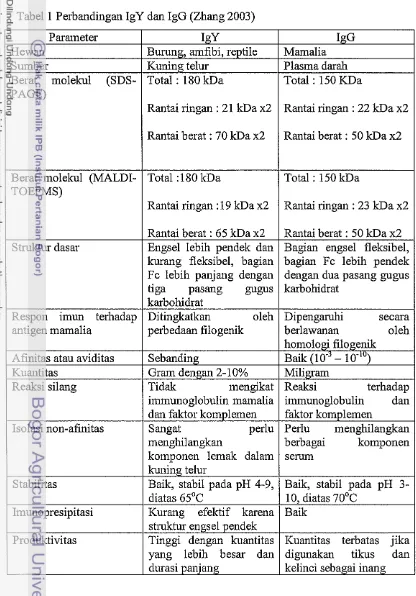
[image:18.514.40.456.153.749.2]2000). Perbedaan antara IgY dan IgG dapat di lihat pada tabel 1.
Tabel 1 Perbandingan IgY dan IgG (Zhang 2003)
PAGE)
Parameter Hewan
Sumber
Berat molekul (SDS-
IgY
Burung, amfibi, reptile Kuning telur
Total : 180 kDa
Rantai ringan : 21 kDa x2
IgG Mamalia Plasma darah Total : 150 KDa
Rantai ringan : 22 kDa x2
Rantai berat : 70 kDa x2 Rantai berat : 50 kDa x2
Berat molekul (MALDI- TOEFMS)
Stabilitas
Imunopresipitasi
Produktivitas
Total :I80 kDa
Rantai ringan :19 kDa x2
Total : 150 kDa
Rantai ringan : 23 kDa x2
Baik, stabil pada pH 4-9, diatas 65°C
Kurang efektif karena sb-uktur engsel pendek Tinggi dengan kuantitas yang lebih besar dan durasi panjang
Baik, stabil pada pH 3-
10, diatas 70°C Baik
Telur merupakan sumber Ig Y yang sangat penting karena mengandung 50-100 ing Ig Y per butir telur. Ig Y unggas memiliki sifat yang lebih stabil Skalabilitas
Antibodi monoclonal
Supresi imun
Diagnostik
Pengobatan
terhadap suhu dan peiubahan pH dibandingkan dengan Ig G, serta tidak menyebabkan reaksi silang dengan komponen struktural jaringan mamalia dan sel darah merah mamalia (Larsson et a1 1993). Hal ini memberikan indikasi
penggunaan Ig Y dalam diagnostik immunologis akan menghasilkan reaksi yang lebih spesifik.
IgY merupakan protein sehingga mengalami denaturasi akibat adanya Mudah dan praktis
Perlu pengembangan lebih lanjut
Kemungkinan berguna untuk xenotransplantasi Berguna dan praktis untuk berbagai aplikasi
Akan dikembangkan lebih jauh seperti dalam pengobatan alternatif
antibiotik
pengaruh suhu, pH maupun aktivitas enzim protease. IgY yang diiusak oleh enzim akan berupa Fab, Fab'2 dan ffagmen Fc. Selain IgY dalam fraksi yang terlarut air (WSF) dapat ditemukan koinponen-komponen lain. Dalam tahap pemumian protein dapat ditemukan kontaminan protein lain sebanyak 5% sampai
10% atau bahkan lebih (Wilson dan Walker 2000).
Relatif sulit
Dikembangkan dengan baik
Beberapa produk sedang dikembangkan
Di gunakan secara luas, khususnya antibodi monoclonal
Berkembang baik
Vaksin dan Vaksinasi Avian Influenza
ekskresi virus, (iv) pembedaan secara serologik antara hewan yang terinfeksi d a i hewan yang divaksinasi (Deptan 2005).
Kebijakan mengenai pelaksanaan dan cakupan vaksinasi diatur dalam pedoman pencegahan, pengendalian dan pemberantasan penyakit hewan menular Influenza pada unggas (Avian Influenza). Dalam kebijakan tersebut antara lain ditetapkan cakupan vaksinasi ineliputi seluruh unggas terancam (100%) di daerah tertular dan daerah terancam yaitu ayam buras, bebek, itik, entok, kalkun, angsa, burung dara, burung puyuh, b u m g dardmerpati, unggas lain dan ayam ras (pedaging dan petelur) yang tennasuk petemakan sektor 3 dan 4 (tahun 2006 hanya peternakan sektor 4). Vaksinasi untuk ayam ras petelur, ayam buras, angsa, itik dan entok dilakukan vaksinasi setiap 3-4 bulan (satu tahun minimal tiga kali vaksinasi) p e p t a n 2007).
Surat Keputusan (SK) Direktur Jenderal (Di jell) Bina Produksi Petemakan
No.17/Kpts/PD.640/F/02.04 tanggal 4 Februari 2004, yang disempurnakan dalam Peraturan Direktur Jenderal Peternakan No.46/PD.640/F/08.05 tanggal 6 Agustus 2005, pada tahun 2006 ditetapkan prosedur operasional standar pengendalian penyakit flu b u m g di Indonesia. Dalam peraturan tersebut ditetapkan tentang vaksinasi, yang menyebutkan bahwa "Vaksin A1 yang digunakan adalah vaksin inaktif strain LPAI (Low Pathogenic Avian Influenza) subtipe Hs (H5N1) yang memiliki homologi sequens nukleotida atau asam amino dari antigen H diatas 80% terhadap isolat lokal". Hal tersebut juga sejalan dengan pedoman yang ditetapkan oleh OIE yang menyatakan bahwa sebagai petunjuk m u m di satu negarddaerah sebaiknya hanya satu tipe vaksin yang digunakan. Selain itu OIE juga menyatakan bahwa penggunaan vaksin inaktif strain LPAI dapat meinbedakan apabila terjadi epidemi karena infeksi virus di lapangan atau karena vaksinasi DIVA (Diferentiating Infected and Vaccinated Animal).
vaksin antara lain lemak nabati, minyak mineral dan Al(OH)3 (Malole 1988 dalam Hartati 2005).
Kualitas vaksin terutama ditentukan oleh pembuatan vaksin, distribusi dan penyimpanan, titer vaksin dan masa kedaluarsa. Cara pemberian vaksin juga mempengaruhi aspek vaksinasi. Selain itu inetode vaksinasi, program vaksinasi, vaksinator dan peralatan vaksinasi beserta saranalprasarana peternakan ayam, meliputi umur/variasi umur dan status kesehatan, kesemuanya memegang peranan dalam keberhasilan penanggulangan penyakit Avian Injluenza. Kunci keberhasilan vaksinasi ditentukan oleh penggunaan vaksin yang berkualitas tinggi yang harus didukung oleh manajemen optimal, terutruna biosekuriti yang ketat. Vaksin hams diberikan terlebih dahulu sebelum terjadinya infeksi oleh agen infeksi lapang. Vaksin juga hams membetikan perlindungan kolektif pada semua ayan (Deptan 2007).
Prinsip dasar pemakaian vaksin Avian Injluenza adalah virus vaksin (master seed) hams homolog dengan subtipe HA atau subtipe HA dan NA virus asal lapang. Menurut regulasi OIE, master seed vaksin liarus berasal dari isolat virus Avian Influenza low pathogenic (LPAI) yang telah dikarakterisasi (diinumikan) dan koinposisi genetiknya stabil. Proses inaktivasi sempurna (uji laboratorik) selama itu vaksin harus bebas pencemaran agen infeksius lainnya, mengandung konsentrasi antigen tinggi dan menggunakan adjuvan berkualitas tinggi. Vaksin hams mempunyai tingkat keamanan, potensi dan efektifitas yang tinggi (uji
laboratorik dan uji lapang).
Karakteristik vaksin Avian Injluenza yang ideal menurut Asinara 2007, vaksin dapat merangsang respon kekebalan humoral (HMI-humoral mediate immunity) dan kekebalan seluler (CMI-cell mediate immunity), sehingga perlindungan terhadap ayanl cepat terbentuk. Kriteria lain yang diharapkan pada vaksin Avian Injluenza adalah harga relatif tidak inahal, mudah dibetikan pada ayam, perlindungan efektif dan dapat dicapai dengan dosis tunggal (ayam semua uinur). Respon antibodi yang timbul dapat dibedakan dengan respon akibat virus Avian Injluenza asal lapang, subtipe HA homolog, subtipe NA heterolog dengan
Pemurnian Imunoglobulin Y (IgY)
Menurut Heyhnan 1995 menyatakan metode untuk pemurnian imunoglobulin ini terbagi 2 dengan 2 kategori terpisah yakni solubilitas diferensial (garam, PEG, presipitasi asam kaprilat, dan lain-lain) dan lcromatografi (filtrasi gel, pertukaran ion, hidroksi apatit dan afinitas).
Polyetylenglycol (PEG) adalah polimer etilen oksida dengan berat molekul 200 Da sampai 20 kDa. Polyetylenglycol digunakan bersama amonium sulfat dalam purifikasi protein. Penggunaan inolekul ionik (Polyetylenglycol ) dan non ionik (amonium sulfat) secara bersana-sama dalam pemurnian protein lebih menguntungkan sebab dapat mempersingkat waktu peinumian dibandingkan menggunakan hanya satu molekul (KO 2005 dalam Asturi 2006).
Metode pemurnian IgY selain menggunakan amonium sulfat dan PEG juga dapat menggunakan kloroform, lithium sulfat atau sodium sitrat. Total konsentrasi protein dan IgY menggunakan kloroform 1,4-2,8 kali lebih tinggi dibandingkan metode yang lain. Namun komposisi protein cemaran pada metode kloroform juga 10% lebih tinggi dibandingkan metode lithium sulfat dan sodium sitrat. Aktifitas IgY dilaporkan lebih rendah pada peinumian dengan menggunakan lithium sulfat dan sodium sitrat dibandingkan dengan inei~ggunakan PEG dan kloroform (Bizhanov dan Vysniauskis 2000 dalam Asturi 2006)
Sodium Dodecyl Sulphate-Poly Acrilanlide Gel Elektrophoresis SDS-PAGE
mengalami migrasi ke katoda dalam agar elektroforesis (Johnstone and Thorpe 1987 dalam Simoranglar 1993).
Berdasarkan pemisahan tersebut elektroforesis dapat digunakan untuk menentukan berat molekul, mendeteksi kemurnian, serta menetapkan titik isoelektrik. Sebagai alat analisa, elektroforesis sangat sederhana, cepat dan mempunyai sensitifitas tinggi. Elektroforesis digunakan sebagai secara analitik untuk mempelajari sifat dari spesies bemuatan tunggal dan juga untuk teknik pemisahan (Gordon 1983).
Elektroforesis gel dapat terbagi atas gel poliakrilamida. Gel poliakrilamida relatif lebih baik, karena ukuran porinya dapat diatur. Gel poliakrilamida mulai di gunakan oleh Davis & Raymond (1959). Gel ini terbentuk oleh adanya polimerisasi dari monomer akrilamida menjadi rantai yang panjang oleh adanya ikatan silang dengan komponen N,N7-metilen bisakrilamid. Polimerisasi ini diawali dengal adanya reaksi antara ammonium persulfat sebagai katalis dengan
N.N.NY.N'-tetrametilendiarnin
(TEMED) (Gordon 1983).Metode SDS-PAGE merupakan metode yang paling sering digunakan untuk menganalisa campuran protein secara kualitatif. Metode ini khususnya berguna untuk meinonitor hasil purifikasi dan inetode ini memisahkan protein berdasarkan perbedaan berat molekul. Peniunbahan SDS pada gel polikarilamida menghasilkan SDS-PAGE yang digunakan untuk sampel terdenaturasi. SDS merupakan detergen anionik dan bersanla dengan R-merkaptoetanol yang dilanjutkan dengan pemanasan akan merusak struktur tiga diinensi protein melalui pemecahan ikatan disulfida menjadi gugus sulfidril. SDS-PAGE digunakan pada pH netral, dimana pada pH 7 SDS akan membentuk komplek negatif dengan protein, sehingga sampel akan bergerak ke arah elektroda positif (Gordon 1983).
adalah gel penyerap. Gel penyerap dapat bertindak sebagai penyaring dengan proses perlambatan, atau dalam beberapa kasus secara komplit menghalangi pergerakan dari makromolekul yang besar, sementara itu membiarkan molekul yang lebih kecil untuk lebih bebas bermigrasi. Oleh karena agarose gel cair umumnya lebih kaku dan lebih mudah untuk ditangani daripada poliakrilamida pada konsentrasi yang sama, agarose digunakan
untuk
memisahkan protein besar dan protein kompleks. Polikarilamida, yang penanganannya sangat mudah dan untuk meningkatkan konsentrasi, digunakan untuk memisahkan kebanyakan gel berpori-pori untuk perlambatan (Gordon 1983).Pada dasarnya, protein adalah senyawa amfoter yang muatannya ditentukan oleh pH media. Pada larutan dengan pH di atas titik isoelektrik, protein mempunyai muatan negatif dan bermigrasi menuju anoda pada medan listrik. Dibawah titik isoelektrik, protein bermuatan positif dan akan bermigrasi menuju katoda. Muatan yang dibawa oleh protein adalah tambahan tersendiri untuk
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilakukan dari bulan Deseinber 2007 sampai bulan Juni 2008 di Laboratorium Terpadu Departemen Ilinu Penyakit Hewan dan Kesehatan Masyasakat Veteriner dan Kandang Hewan Percobaan Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah 17 ekor ayarn Single Comb Brown Leghorn umur 20 minggu. Vaksin inaktif H5N1, vaksin inaktif H5N2, vaksin inaktif H5N9, phosphat buffer saline (PBS), (Na2HP04 0,l M pH 7,5), polietyleneglycol (PEG) 6000, ammonium sulfat [(NH4)2S04], Na-Azide 0,1%, Aquabides steril pH 8, kloroform, sampel Ig Y, gel pemisah (Poly Acrylamide 12
%), gel pengumpul (Poly Acrylamide 4%), running buffer, sampel buffer, Comassie Brilliant Blue (sigmam Chemical Co), pemucat metanol dan asam asetat glasial.
Alat yang digunakan yaitu ; alat suntik volume 1 ml dan 3 31, tabung mikro, mikropipet (1-10 p1, 10-100 p1, 100-1000 pl), nzicroplate u bottom, gelas ukur berbagai volume, vortex, kertas saring, magnetic stirrer (Luchi HSD-4P), refrigerator (SanyoMedicool), deep freezer (Sanyo Ultralow), sentrifuse ( S o w a l Super T21), penangas air (Eyela NTS-1300), gelas objek, spektrofotometer (Hitachi U 20).
Metode Penelitian Koleksi telur
Metode Pemurnian Protein PEG 6000 dan Moroform
Kuning telur dipisahkan dari putih telurnya dan diletakkan pada kertas saring. Membran kuning telur disayat kemudian cairan kuning telur ditampung pada gelas ukur. Kemudian ditambahkan PBS (pH 7,6) sebanyak 20 in11 butir telur dan dihomogenkan. Secara perlahan-lahan ditambahkan 25 ml k l o r o f o d u t i r telur, sehingga terbentuk cairan semisolid. Cairan ini kemudian disentrifus dengan kecepatan 1200 g selama 30 menit suhu 27°C. Supernatan diambil dan pelet dibuang. Supernatan ini disebut Water Soluble Fraction (WSF).
Water Soluble Fraction ini ditambahkan PEG 6000 hingga konsentrasi akhir 12% (wlv), kemudian disentrifus dengan kecepatan 15.700 g selama 10 menit suhu 27°C
.
Dari hasil sentrifuse pelet ditampung dan supematan dibuang. Pelet yang diperoleh ditambahkan 2 in1 PBSIbutir telur dan dihomogenkan. Cairan ini yang kemudian digunakan pada SDS-PAGE.SDS-PAGE
Penentuan berat dan susunan protein dianalisis dengan metode Sodiunz Deodecyl Sulphate-PoIy Acrilamide (SDS-PAGE) (Gordon 1983). SDS-PAGE ini menggunakan gel pemisah dengan konsentrasi 12%, gel pengumpul 4%, larutan pewama Commasie Blue dan larutan pencuci.
Larutan gel pemisah 12% dimasukkan kedalam 2 lempeng kaca elektroforesis, yang sebelumnya telah dibersihkan dengan alkohol 70% dan pada kedua sisi tepi bagian dalam diberi spacer kemudian lempeilg kaca dihimpitkan dan selanjutnya dijepit. Gel pemisah segera dilapisi dengan penambahan air. Setelah gel peinisah membeku, lapisan air dibuang dan gel pengumpul 4% dimasukkan hingga mencapai permukaan lempeng kaca dan terbentuk gel elektroforesis (GE). Kemudian sisir segera dimasukkan dan diangkat setelah gel pengumpul membeku sehingga tercetak sumur sumur.
dijalankan dengan arus 50 mA dengan voltase 100 V selama 3 jam. Elektroforesis berakhir apabila pewarna sampel mencapai batas 0,5 cm dari bagian bawah gel. Setelah proses elektroforesis berakhir, gel diangkat dari lempeng kaca dan direndam di dalam pewarnaan Commasie Blue (Sigma@ Chemical Co) selama 3 jam pada suhu ruang sambil diagitasi perlahan. Pewarna yang tidak terikat pada
protein dihilangkan dengan merendam gel pada larutan pemucat (campuran metanol dan asam asetat glasial) sehingga gel tampak bening atau pita-pita protein yang terbentuk terlihat jelas. Mekanisme sederhana SDS PAGE dapat di lihat pada gambar 2.
HASIL
DAN
PEMBAHASAN
Teknik SDS-PAGE dilakukan dengan tujuan untuk meilgkarakterisasi protein IgY HsNl, HsN2 dan HsNs. Pita protein dari hasil elektroforesis SDS- PAGE menunjukkan karakteristik dari polipeptida penyusun IgY tersebut (Simoranglur 2005). Metode SDS-PAGE memiliki kelebihan yaitu mekanismenya dalam mengklasifikasi suatu protein berdasarkan berat molekulnya dari bahan yang digtu~akan. Mekanisme dari perjalanan penentuan berat molekul ini diawali deilgan iinmunoglobulin yang telah diperoleh di masukkan kedalam sumur gel yang terdapat paling atas, gel tersebut adalah buffer gel pengumpul deilgan pori yang lebih besar. Gel ini akan mei~gumpulkan protein (imrnu~~oglobulin yang diperoleh), selanjutnya immunoglobulin akan bermigrasi dari yang memiliki berat molekul paling tinggi akan berada pada lapisail paling atas dari gel pemisah (Wilson &Walker 2000).
Penelitian ini menggunakan gel poliakrilamida sebesar 12%, sehiilgga mobilitas protein yang diperoleh besar serta berat molekul yang tinggi dapat dipisahkan. Hal ini sesuai dengan Hames Rickwood (1990) dalam Simoranglur (1993), yaitu semakin tinggi konsentrasi gel poliakrilamida yang digunakan semakin tinggi semakin kecil ukuran molekul yang dipisahkan dan inakin besar mobilitas inolekul tersebut. Keberhasilan pemisahan suatu senyawa dipengaruhi pula oleh banyak faktor antar laill buffer, suhu, waktu, dan besarnya arus listrik yang digunakan (Hames & Rickwood 1990 dalam Simoranglur 1993). Suhu dapat inempengaruhi kekentalan media dan jari-jari ion, sehingga mobilitas akan b e r p e n g d . Waktu dan arus listrik yang optimum akan menghasilkan pola pemisahan inolekul yang optimum (Wilson &Walker 2000).
Marker IgY HsNt
H5N2
H5N9Kontrol
Gambar 3 Profil pita protein hasil SDS-PAGE dengan pewafnaan Cornrnasie Brilliant Blue
IgY kontrol men~pakan immunoglobulin Y pada ayam yang tidak mendapat paparan antigen. Susunan protein pada IgY kontrol terdiri atas 6 pita protein, yaitu 178,263 kDa, 159,453 kDa, 112,535 kDa, 89,061 kDa, 46,807 kDa dan 42,112 kDa. Protein dengan berat molekul 178,263 kDa pada IgY kontrol dan IgY HjN1 diduga merupakan imm~~noglobulin Y (IgY). Sun et a1 (2001) menyatakan berat
molekul IgY sebesar 167,250 kDa dan Narat (2003) menyatakan bahwa IgY mempunyai berat molekul yang lebih besar dibandingkan IgG, yaitu sekitar 180 kDa atau lebih.
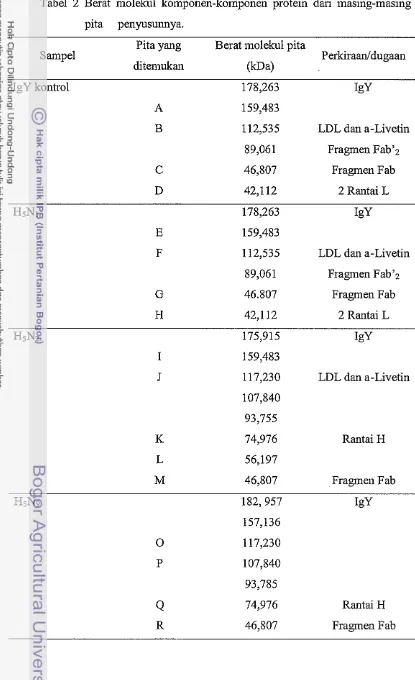
Sun et a1 (2001) menyatakan, bahwa degradasi IgY akan menghasilkan
[image:29.518.71.442.59.469.2]Tabel 2 Berat molekul komponen-komponen protein dari masing-masing pita penyusunnya.
Pita yang Berat molekul pita
Sampel Perkiraanldugaan
ditemukan @a)
IgY kontrol 178,263 Igy
A 159,483
B 112,535 LDL dan a-Livetin 89,061 Fragmen Fab'z C 46,807 Fragmen Fab D 42,112 2 Rantai L
HsNi 178,263 Igy
E 159,483
F 112,535 LDL dan a-Livetin 89,061 Fragmen Fab':! G 46.807 Fragmen Fab H 42,112 2 Rantai L
HsNz 175,915 Igy
I 159,483
J 117,230 LDL dan a-Livetin 107,840
93,755
K 74,976 Rantai H L 56,197
M 46,807 Fragmen Fab
H5N9 182,957 Igy
157,136 0 117,230 P 107,840 93,785
[image:30.514.39.454.85.765.2]Protein pada IgY HsN2 terdiri atas 8 pita protein, dengan komposisi 6 pita protein berada diatas 70 kDa, pada IgY HsNI hanya terdapat 4 pita protein diatas 70 kDa. Pita dengan ukuran 175,915 kDa diduga sebagai IgY, sesuai dengan kisaran Narat (2003) tentang berat molekul IgY. Ukuran molekul ini lebih rendah dibandingkan pada IgY kontrol dan IgY H5N1. Terdapat pita protein dengan ukuran 74,974 kDa yang juga diduga mendekati ukuran rantai berat dari IgY. Zhang (2003) meilyatakan berat molekul rantai berat pada 67,000-70,000 kDa.
IgY H5N9 terdiri atas 7 pita protein dan terdapat 6 pita protein yang berada diatas ukuran 70 kDa, sangat jauh berbeda dengan dengan IgY HsN,. Selain IgY ditemukan komponen-komponen lain dalam water solublefraction. Dalam tahap pemurnian protein dapat ditemukau kontaminan protein lain sebanyak 5% sampai 10% atau bahkan lebih (Wilson dan Walker 2000). Pada pita
J
dan P dengan berat molekul 117,230 kDa, 107,840 kDa. 93,785 memiliki kemungkinan LDL terlarut dan a-livetin. Davis dan Reeves (2002) dalam Rawendra (2005) menyatakan molekul protein yang beiukuran 80 kDa merupakan a-livetin dan LDL protein bei-ukuran 16 kDa, 62 kDa, 71 kDa, 82 kDa dan 135 kDa. Susunan pita protein pada IgY HsN9 secara garis besar mempunyai kemiripan dengal IgY HsN2. baik dari jnmlah pita protein maupun penyusunnya. Hal ini diduga karena Ig Y berasal dari paparan antigen yang memiliki kesamaan pada protein HA saja. Susunan protein IgY HsNl berbeda dengan IgY H5N2 dan berbeda sekali dengan IgY HSN9, perbedaan ini dapat mempengaruhi keinampua~ netralisasi terhadap virus. Vaksin inaktif H5N2 hanya mampu rnenginduksi pembentukan antibodi protektif sebesar 60% pada serum d m 16.67% pada telur sehingga tidak mampu menginduksi pembentukan antibodi protektif pada induk dan telur sebagai maternal antibodi (Yusran 2008). Sedangkan pada vaksin H5N9 juga tidak memiliki kemampuan yang signifikan dalam menginduksi maternal antibodi pada telur (IgY) terhadap infeksi dari virus avian influenza subtipe HsNl (Sugiarto 2008).KESIMPULAN
KesimpulanDAFTAR PUSTAKA
Asmara, W. 2007. Peran Biologi Molekuler dalam Pengendalian Avian Influenza dan Flu Burung. [Terhubung berkala].
http:/koimasfbpi.go.id/files/naskahpidato~G~BesarUGM~Widya~As
mara - .pdf
Asturi, Anggi Aulia. 2006. Pulifikasi dan Karakteristik Imunoglobuliil Y (IgY) Kuning Telur Ayam Spesifik Salinonela Enteritidis Menggunakan Metode Sodium Dodecyl Sulphate Poly Acrilamide Gel Elektrophoresis (SDS-PAGE) [Skripsi]. Bogor: Fakultas Kedokteran Hewan. Institut Pertanian Bogor.
Carlender D. 2002. Avian Ig Y Antibody: In vitro and In vivo. [Disertasi]. Uppsala: Acta University Upsaliensis.
Cattoli G, Capua I. 2007. Diagnosing Avian Influenza Infection in Vaccination Population by System for Differantianting Infectied Vaccinated Animal (DNA). Dev. Biol(130):137-143
Davalos P et al. Collodial Stability of Ig G and Ig Y - Coated Latex Microspheres. Biointerfaces.20(2): 165-175.
Departemen Pertanian RI. 2005. Arah Kebijakan Pemerintah pusat dalam Program Penanggulangan Wabah A1 Indonesia. http://www.deptan RI.go.id/News.html[16 Juli 20081.
Febriawan, Arief. 2006. Purifikasi dan Karakterisasi Imunoglobulin Y (IgY) Kuning Telur Ayam Spesifik Streptococcus mutans Menggunakan Metode Sodium Dodecyl Sulphate Poly Acrilamide Gel Elektrophoresis (SDS-PAGE) [Sknpsi]. Bogor: Fakultas Kedokteran Hewan. Institut Pertanian Bogor.
Fenner, J et al. 1995. Virologi Veteriner. Putra, D.K.H penterjemah. Veterinary Virology. Semarang: IKIP semarang Press.
Gassman M, Thommes P, Weiser T, Hubscher U. 1990. Efficient production of chicken egg yolk antibodies againts a conserved mammalian protein. FASEB J4:2528-2532.
Hartati, Y. 2005. Respon Kekebalan Vaksin Avian Influenza Inaktif pada Ayam Indukan Pedaging Strain Hubbard [Skripsi]. Bogor: Fakultas Kedokteran Hewan. Institut Pertanian Bogor.
Heytrnen M.J. 1995. Purzj?hzsi Imunoglobulin. Didalam : Artama WT, Penerjemah; Burgess WG, editor. Teknologi ELISA Dalam Diagnosis dan Penelitian. Yogyakarta: UGM Press. Fakultas Kedokteran Hewan.
Hidayati A. 2004. Karakterisasi Imunoglobulin Y (IgY) Sebagai Dasar Dalam Pembuatan KIT Diagnostik Untuk Deteksi Eschenia coli Enteropatogenik (EPEC) K.l.l [Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Horimoto T, Kawaoka Y. 2005. Influenza: Lessons from the past pandemics, warning from current incidents. Nature Rev Microbiol; 3(8): 591-600.
Kuby J. 1997. Immunology 3Ih ed. W. H Freeman and Company: New York.
Kuby 5.2007. Immunology 5"' ed. W. H. Freemen and Company: New York.
Larsson A, Sjoquist J. 1998. Chicken Antibodies: A tool to Avoid False Positive Result by Rhematoid Factor in Latex Fixation Test. J Immunol Method. P:108.
Lay BW, Hastowo S. 1992. Mikrobiologi. Rajawali Press: Jakarta. P:306.
Mustopa, A. 2. 2004. Peran Imunoglobuliil Y (IgY) Sebagai Anti Adhesi dan
Opsonin untuk Pencegahan Serangan Escherichia coli Enteropatogenik (EPEC) K 1.1 [Tesis]. Sekolah Pascasarjana. Institut Pertanian Bogor.
Naipospos,T.S.P. 2007. Kesehatan Hewan untuk Kesejahteraan Manusia. Bogor: CIVAS Press.
Narat Mojca. 2003. Production of Antibodies in Chickens. Food Technol. Biotecnol. 41 (3) : 256-267
Nurfitriani, Ani Siti. 2007. Evaluasi Hasil Vaksinasi Avian Influenza (AI) di Kecamatan Jatianangor Kabupaten Sumedang [Skripsi]. Bogor: Fakultas Kedokteran Hewan. Institut Pertanian Bogor.
[terhubung berkala]. http://www.oie.int/eng/nonnes/manual/A - 00037.htm.[18 Juli 20081
Radji. M. 2006. Avian Influenza A (H5N1): Patogenesis, Pencegahan dan Penyebaran pada Manusia. Majalah Ilmu Kefarmasian (3): 55-65.
Ramlah. 2008. Purifikasi dan Karakteriasasi Imunoglobulin Y (IgY) Spesifik KHV dari Serum Ayam Single Comb Brown Leghorn [Skripsi]. Bogor: Institut Pertanian Bogor.
Rawendra R. 2005. Imunoglobulin Y (IgY) Fraksi L m t Air (WSF) Kuning Telur Kering Beku Anti Enteropathogenic Eschericia coli (EPEC) [Disertasi]. Sekolah Pascasarjana. Institut Pertanian Bogor.
Simoranglur M. 1993. Isolasi da11 Ideiltifikasi Imunoglobulin Gama (IgG) Serum Ayan Buras dan Ayam Ras dengan Metode Kromatografi Peitukaran ion dan Imunokimia [Tesis]. Sekolah Pascasa~jana. Institut Pertanian Bogor.
Soejoedono RD, Handaryani E. 2005. Flu Burung. Penebar Swadaya. Jakarta
Soejoedono RD, Wibawan IWT, Hajati 2. 2005. Pemanfaatan Telur Ayam
sebagai Pabrik Biologis : Produksi "Yolk Immunoglobulin" (IgY) Auti Plaque dan Diare dengan Titik Berat pada Anti Streptococcus mutan, Eschericia coli dan Salmonella Enteridis. Kerja sama Lembaga Penelitian dan Pemberdayaan Masyarakat Institut Pertanian Bogor, Kementarian Riset dan Teknologi dan Lembaga Ilmu Pengetahuan Indonesia.
Sugiarto. 2008. Evaluasi Antibodi Asal Induk (Mateinal Antibodi) pada Kuning Telur Asal Ayam Single Comb Leghorn yang Divaksinasi dengan Vaksin Avian Influenza H5N9 [Skripsi]. Bogor: Institut Pertanian Bogor.
Sun S, Mo W, Ji Y, Liu S. 2001. Preparation and Mass Spectrometric Study of Egg Yolk Antibody (IgY) Againts Rabies Erus. Rapid Commun Mass Spectrom 15(9): 708-712.
Tizard. 1987. Pengantar Imunologi Veteriner. Edisi 11. Partodiredjo, M, penerjemah. Surabaya: Airlangga Uiliversity Press. Terjemahan dari:
introduction to Veterinary Immunology
Tizard. 2000. Veterinaly Immunology an Introduction 5th. USA: W.B. Saunders Company.
[WHO].World Health Organization. 2008. Cases Table of Avian Znluenza.
http;//www.who.int/csr/diseases/avian influenzdcountry/cases table 2008 7 12/en/index.html. [24 Juli 20081.
Wilson K, Walker J. 2000. Principle and Technique of Practical Biochemistry Edisi ke-5. London: Cambridge University Press.
Yusran, Wa Ode. 2008. Gambaran Titer Antibodi Anti Hj pada Serum dan Kuning Telur Ayam Single Comb Brown Leghorn yang Divaksinasi dengavaksin Inaktif HjN2 [Skripsi]. Bogor: Institut Pertanion Bogor.