Serapan Nitrogen dan Pertumbuhan Tanaman Padi
LILIK TRI INDRIYATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nitrogen dan Pertumbuhan Tanaman Padi
Abstrak
Penggunaan bahan organik pada lahan-lahan sawah yang ditujukan untuk mengurangi ketergantungan terhadap pupuk kimia merupakan usaha yang mengarah pada pertanian yang berkelanjutan dan perbaikan efisiensi pupuk oleh tanaman padi di lahan-lahan sawah. Oleh karena itu diperlukan pemahaman yang lebih baik tentang transformasi N dalam tanah tergenang, terutama transformasi N secara biologi dari N-organik yang terkandung dalam bahan N-organik menjadi bentuk N tersedia bagi tanaman dan bentuk gas, yang tujuannya untuk: (1) meningkatkan efisiensi penggunaan N-tanah dan N-bahan organik oleh tanaman padi, (2) menentukan potensi denitrifikasi, dan (3) membantu penyeleksian praktek-praktek pengelolaan N menuju pertanian yang berkelanjutan. Percobaan dilakukan di laboratorium dan rumah kaca Departemen Tanah, Fakultas Pertanian, IPB. Percobaan inkubasi di laboratorium dilakukan untuk menentukan pelepasan dan ketersediaan N dalam tanah tergenang yang diberi jerami padi, kompos jerami padi 4 dan 8 bulan atau kombinasinya dengan urea, dan untuk mengetahui perubahan pH tanah tergenang selama masa inkubasi, serta menguji tingkat dekomposisi jerami padi terhadap ketersediaan N dalam tanah tergenang selama masa inkubasi 120 hari. Taraf N dari urea atau bahan organik yang diberikan ke dalam tanah adalah 92 kg ha-1 atau setara dengan 200 kg urea ha-1, 8,52 ton jerami padi ha-1, 6,39 ton kompos 4 bulan ha-1, 6,17 ton kompos 8 bulan ha-1. Untuk perlakuan kombinasi antara urea dan bahan organik masing-masing setara dengan setengah dari takaran perlakuan
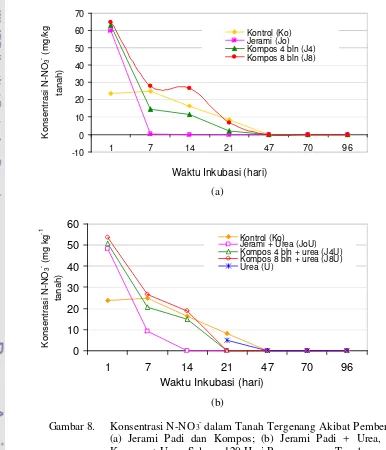
tunggal. Pada minggu pertama dari penggenangan tanah, konsentrasi N-NO3- pada
semua tanah yang diberi perlakuan menurun secara tajam. Hal ini karena terjadi reduksi
N-NO3- menjadi gas N2O dan N2 pada awal penggenangan tanah akibat perubahan
kondisi tanah dari aerob menjadi anaerob. Data ini konsisten dengan hasil fluks gas N2O yang berasal dari tanah yang diberi perlakuan. Setelah hari ke -7 dari masa inkubasi
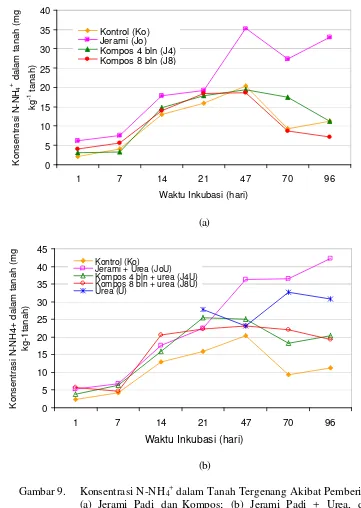
konsentrasi N-NH4+ meningkat secara perlahan, dan sejak hari ke-21 dari masa
inkubasi, tanah yang diberi jerami padi memperlihatkan pelepasan N-NH4+ yang lebih besar dibandingkan dengan perlakuan lainnya. Dengan makin lamanya masa penggenangan tanah, bentuk N mineral yang dominan yang dilepaskan selama masa
inkubasi adalah N-NH4+, karena kondisi tanah yang anaerob menghalangi terjadinya
proses nitrifikasi oleh bakteri aerob obligat. Kompos jerami padi 4 dan 8 bulan memperlihatkan laju pelepasan N-NH4+ yang lebih lambat dan ketersediaan N-NH4+ yang lebih rendah daripada jerami padi.
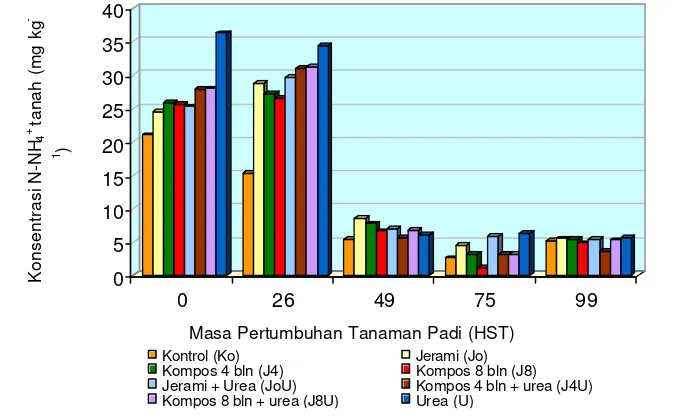
Hasil percobaan pot di rumah kaca menunjukkan bahwa jerami padi yang diberikan ke dalam tanah tergenang memberikan pengaruh yang nyata lebih tinggi bila dibandingkan dengan kompos terhadap peningkatan bobot kering tanaman padi, jumlah anakan, serapan N dan efisiensi penggunaan N oleh tanaman padi, serta peningkatan aktivitas enzim nitrogenase. Kandungan N-NH4+ tanah pada percobaan pot meningkat sampai 26 hari setelah tanam (HST), dan kemudian menurun secara tajam karena diserap oleh tanaman padi. Hal ini menunjukkan bahwa pertumbuhan tanaman padi yang paling aktif terjadi antara tahap pembentukan anakan dan awal pembentukan malai. Fluks gas N2O tertinggi terjadi pada awal penggenangan tanah, dan tanah yang
dibandingkan dengan tanpa perlakuan. Hal ini berkaitan dengan perubahan kondisi tanah dari aerob menjadi anaerob, dan kandungan C-organik yang mudah didekomposisi dalam jerami padi lebih tinggi, dimana C-organik tersebut merupakan sumber energi bagi bakteri denitrifikasi. Emisi total gas N2O dari tanah tergenang yang diberi jerami padi lebih rendah dibandingkan dengan perlakuan lainnya. Hal ini karena pemberian jerami padi ke dalam tanah tergenang meningkatkan kondisi tanah menjadi lebih reduktif , sehingga N lebih banyak hilang dalam bentuk gas N2 daripada gas N2O, yang mengakibatkan terjadinya penurunan emisi gas N2O dari tanah yang diberi jerami. Tanpa memandang tingkat dekomposisi bahan organik yang diberikan ke dalam tanah, semakin lama tanah bersifat anaerob proses nitrifikasi menjadi terhambat sehingga ketersediaan nitrat membatasi terjadinya proses denitrifikasi. Secara umum pemberian bahan jerami padi atau komposnya ke dalam tanah tergenang meningkatkan aktivitas enzim nitrogenase. Tetapi pemberian jerami padi ke dalam tanah tergenang tampaknya memicu peningkatan aktivitas enzim nitrrogenase yang lebih tinggi bila dibandingkan
dengan pemberian kompos. Peningkatan aktivitas penambatan N2 ini secara tidak
NITROGEN TRANSFORMATION IN FLOODED SOIL :
Application of Rice Straw and Urea and Its Relation with Nitrogen
Uptake and Rice Plant Growth
Abstract
The use of organic materials aimed at reducing the dependence on inputs such as chemical fertilizers can contribute to sustainability and improving the low N fertilizer efficiency of rice plants in paddy soils. Therefore, better understanding of N transformation in flooded soils, particularly the microbial transformation of N-organic amendments to plant-available N and gaseous N forms is needed: (1) for most efficient use of soil and organic materials N by rice plant, (2) for determining the potential of denitrification and (3) for aiding in the selection of N management practices for sustainable agriculture. The experiments were conducted in the laboratory and glasshouse of Soil Department, Faculty of Agriculture, Bogor Agricultural University. An incubation experiment in laboratory was conducted to observe the release of N and its availability in flooded soil amended with rice straw, 4 month- and 8 month-compost of rice straw or their combination with urea ; to study the change of soil pH during incubation period; to verify the effect of the chemical composition of rice straw or composts of rice straw on N availability in flooded soil during 120 days. Nitrogen from urea or organic materials was applied at the rate of 92 kg ha-1 or equivalent to 200 kg urea ha-1, 8.52 ton rice straw ha-1, 6.39 ton 4-month-compost of rice straw ha-1, and 6.17 ton 8-month-compost of rice straw ha-1. The first time of soil flooding, NO3--N concentrations in all of the amended soils sharply decreased. It might be due to the reduction of NO3--N to N2O and N2 gas since the initial of incubation period as a consequence of the change of soil condition from aerobic to anaerobic condition. These data were consistent with the result of N2O emission derived from the amended soils. The concentration of NH4+-N was gradually increased after 7 days of incubation period. Since 21 days of incubation period, the rice straw amended soils showed the larger NH4+-N release than the other treatments. The longer soil flooded, the dominant form of mineral nitrogen that was released in soil during the incubation period was NH4+-N, because the anaerobic soil condition inhibited the nitrification process. The 4-month- and 8-month-compost of rice straw showed the slower N mineralization rate and the lower N availa bility than rice straw.
decreased. Regardless the degree of decomposition of the organic materials added to soils, the longer anaerobic of soil nitrification process was inhibited, so that nitrate availability hampered denitrification process. Generally, the application of rice straw or rice straw composts to flooded soil increased the activity of nitrogenase enzyme. The application of rice straw, however, promoted the activity of nitrogenase enzyme higher
than rice straw composts. The increase of this N2 fixation promoted indirectly N
PERNYATAAN MENGENAI DISERTASI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi yang berjudul :
TRANSFORMASI NITROGEN DALAM TANAH TERGENANG : Aplikasi
Jerami Padi dan Urea serta Hubungannya dengan Serapan Nitrogen dan Pertumbuhan Tanaman Padi
adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari peneliti lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Januari 2006
Lilik Tri Indriyati
TRANSFORMASI NITROGEN DALAM TANAH TERGENANG :
Aplikasi Jerami Padi dan Urea serta Hubungannya dengan
Serapan Nitrogen dan Pertumbuhan Tanaman Padi
LILIK TRI INDRIYATI
Disertasi sebagai salah satu syarat untuk memperoleh gelar
Doktor pada Program Studi Ilmu Tanah
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : TRANSFORMASI NITROGEN DALAM TANAH
TERGENANG : Aplikasi Jerami Padi dan Urea serta
Hubungannya dengan Serapan Nitrogen dan Pertumbuhan Tanaman Padi
Nama Mahasiswa : LILIK TRI INDRIYATI
NIM : 995198
Program Studi : ILMU TANAH
Disetujui
Komisi Pembimbing,
Prof. Dr. Ir. Supiandi Sabiham, M.Agr. Ketua
Prof. Dr. Ir. Latifah K. Darusman, MS Prof. Dr. Ir. ,Sudarsono, MSc
Anggota Anggota
Prof. Dr. Ir. Rykson Situmorang, MS Dr. Ir. Widjang Herry Sisworo, APU
Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana,
Ilmu Tanah,
Dr. Ir. Komaruddin Idris, MS Prof. Dr. Ir. Syafrida Manuwoto, MSc
RIWAYAT HIDUP
Penulis dilahirkan di Lumajang, Jawa Timur pada tanggal 15 Maret 1966.
Penulis adalah anak bungsu dari tiga bersaudara dari ayah Slamet dan ibu Satuyah.
Penulis menempuh pendidikan dasar di SD Negeri Jagalan Tempeh dan lulus
pada tahun 1977. Penulis melanjutkan pendidikan ke SMP Negeri Tempeh dan lulus
pada tahun 1981. Tahun 1984 penulis lulus dari Sekolah Menengah Pembangunan
Pertama (SMPP) Negeri Lumajang. Pada tahun yang sama penulis diterima di Institut
Pertanian Bogor (IPB) melalui Jalur Penelusuran Minat dan Kemampuan (PMDK)
dan setahun kemudian penulis menjadi mahasiswa Jurusan Tanah, Fakultas Pertanian.
Selanjutnya pada September 1992 penulis berangkat ke Jepang unt uk melanjutkan
pendidikan program S2 di Tokyo University of Agriculture (Tokyo Nogyou Daigaku).
Bulan Maret 1993 penulis resmi terdaftar sebagai mahasiswa program Master (S2) di
Laboratorium Ilmu Tanah, Departemen Kimia Pertanian (Nougeikagaku) dengan
beasiswa dari INPEX FOUNDATION dan penulis lulus pada bulan Maret tahun
1995. Pada Februari 2000 penulis resmi sebagai mahasiswa program doktor (S3)
pada Program Studi Ilmu Tanah, Sekolah Pascasarjana, Institut Pertanian Bogor.
Sejak tahun 1992 penulis resmi diterima sebagai staf pengajar dan peneliti di
Jurusan Tanah (sekarang Departemen Ilmu Tanah dan Sumberdaya Lahan), Fakultas
PRAKATA
Puji dan syukur yang tak terhingga penulis panjatkan kepada Tuha n Yesus
Kristus yang telah memberi kekuatan, rahmat dan kasihNya sehingga disertasi ini
berhasil diselesaikan. Ucapan terimakasih yang sebesar-besarnya disampaikan
kepada Prof. Dr. Ir. Supiandi Sabiham, M.Agr. yang telah banyak memberikan
bimbingan dan saran dalam perencanaan, pelaksanaan penelitian sampai penyelesaian
penulisan disertasi ini dan sekaligus sebagai Ketua Laboratorium Kimia dan
Kesuburan Tanah dimana penulis bekerja, atas kesempatan yang telah diberikan
kepada penulis untuk melanjutkan pendidikan program doktor. Penghargaan yang
sama juga penulis sampaikan kepada Prof. Dr. Ir. Latifah K. Darusman, MS., Prof.
Dr. Ir. Rykson Situmorang, MS., Prof. Dr. Ir. Sudarsono, MSc., dan Dr. Ir. Widjang
Herry Sisworo, APU masing-masing sebagai Anggota Komisi Pembimbing atas saran
yang telah diberikan dalam perencanaan, pelaksanaan penelitian, dan penulisan
disertasi ini.
Penghargaan dan ucapan terimakasih juga disampaikan kepada :
1. Dekan Sekolah Pascasarjana Institut Pertanian Bogor yang telah memberikan
kesempatan belajar, serta para staf pengajar yang telah memberikan bekal ilmu
pengetahuan dan wawasan untuk lebih maju dan berkembang lebih jauh.
2. Direktur QUE Project beserta jajarannya atas segala fasilitas, bantuan dana dan
dorongan semangat kepada penulis dalam melaksanakan dan menyelesaikan
pendidikan S3 ini.
3. Dr. Ir. Sri Djuniwati sebagai penguji luar pada ujian tertutup
4. Dr. Ir. Basuki Sumawinata dan Dr. Ir. A. Karim Makarim, APU sebagai penguji
luar komisi pada ujian terbuka doktor
5. Ibu Yosephine Prasetyo dan Ibu Yayu dari International Centre for Research in
Agrofestry (ICRAF) atas bantuan dan perkenannya kepada penulis
menggunakan alat Gas Chromatografi untuk analisis gas N2O, serta Lusi
Hutabarat yang membantu penulis da lam menganalisis gas N2O.
6. Dr. Ir. Iswandi Anas, MSc yang telah mengijinkan penulis untuk bekerja dan
menggunakan alat Gas Chromatografi (GC) di Laboratorium Biologi Tanah,
7. Ibu Elsye Sisworo yang telah membantu dalam analisis 15N dan N-total tanaman
padi serta bimbingannya dalam memahami penggunaan 15N dalam penelitian.
8. Saudari Iim dan Pak Sukoyo atas bantuannya dalam pelaksanaan penelitian di
Laboratorium, juga Pak Romli atas bantuannya selama penelitian di Rumah
Kaca
9. Fitrasari (Mahasiswi S1) atas bantuan dan kerjasamanya dalam pelaksanaan
penelitian di Rumah Kaca dan Laboratorium
10. Staf Pengajar di Laboratorium Bagian Kimia dan Kesuburan pada khususnya
dan staf pengajar serta para pegawai di Departemen Ilmu Tanah dan
Sumberdaya Lahan pada umumnya yang secara langsung maupun tidak
langsung telah memberikan semangat pada penulis untuk menyelesaikan
pendidikan S3.
11. Rekan-rekan mahasiswa Pascasarjana IPB dan teman-teman Family Altar (FA)
terutama Ibu Tina Sitompul, Ibu Evi, Ibu Elly dan Bapak Daniel, serta
teman-teman lainnya atas kerjasama, persahabatan, dan dukungan doanya selama ini
12. Kedua orang tuaku, mertua, kakak-kakakku Wiwik Eko Widayati dan Tutik
Dwi Handayani, mak nyik, keponakanku Yudi, Dita, Rangga, Yedi dan seluruh
keluarga atas doa, bantuan dan dorongan semangatnya
13. Suamiku terkasih, Jefta Charles Welhelmus Ronabiha serta kedua anakku
Matheos Bernhard Ronabiha dan Jeremia Bire Ronabiha atas limpahan kasih
sayangnya, doa, kesabaran, pengorba nan dan dorongan semangat yang tulus
14. Semua pihak yang telah banyak membantu baik materi maupun dorongan
semangat sehingga penelitian dan penulisan disertasi ini dapat diselesaikan.
Penulis berharap disertasi ini bisa bermanfaat bagi pengembangan ilmu da n
semua pihak yang menggunakannya.
Bogor, Januari 2006
Halaman
2.1. Pengaruh Penggenangan Tanah terhadap Sifat-sifat Tanah …….. 6
2.1.1. Pengaruh Penggenangan terhadap Sifat Fisikokimia Tanah 6 2.1.2. Pengaruh Penggenangan terhadap Sifat Biokimia Tanah .. 7 3.3.4.3. Penetapan Aktivitas Enzim Nitrogenase (Fiksasi N2) ………... 35
3.4. Rancangan Percobaan dan Analisis Statistik ………. 36
4.1. Perubahan Sifat Kimia Jerami Padi Selama Pengomposan ... 38
4.2. Percobaan di Laboratorium ……… 40
4.2.1. Nitrogen Tersedia Dalam Tanah Tergenang Akibat Pemberian Jerami Padi, Kompos atau Kombinasinya dengan Urea serta Faktor yang Mengendalikannya …….. 40
4.2.2. Nilai pH Tanah Tergenang Akibat Pemberian Jerami Padi, Kompos dan atau Urea …...……....….. 46
4.3. Percobaan di Rumah Kaca ……….… 50
4.3.1. Konsentrasi N-NH4+ dapat dipertukarkan Dalam Tanah yang Ditanami Tanaman Padi ………...… 50
4.3.2. Jumlah Anakan dan Bobot Kering Tanaman Padi ...….. 52
4.3.3. Pelepasan N ke Dalam Tanah dan Serapan N Tanaman .... 54
4.3.4. Fluks Gas N2O dari Tanah dalam Kondisi Tergenang Akibat Pemberian Jerami Padi, Kompos dan atau Urea ... 62
4.3.5. Aktivitas Enzim Nitrogenase dalam Tanah Tergenang Akibat Pemberian Jerami Padi, Kompos dan atau Urea ... 68
V. PEMBAHASAN UMUM ………. 71
5.1. Implikasi pada Pengelolaan Nitrogen dari Pupuk Mineral dan Jerami Padi ……... 73
VI. KESIMPULAN DAN SARAN …………...………... 76
6.1. Kesimpulan ……… 76
6.2. Saran ……….. 76
VII. DAFTAR PUSTAKA ………..………. 77
DAFTAR TABEL
Tabel Halaman
Teks
1 Sifat Kimia Dystrudept Darmaga ………..… 28
2 Perlakuan, Jumlah N dan Takaran Bahan Organik dan Urea yang
Diberikan ke Dalam Tanah pada Kondisi Tergenang ………….... 31
3 Sifat Kimia Jerami Padi dan Kompos ...………..…….. 38
4 Nilai pH Tanah Tergenang yang Diberi Jerami Padi, Kompos dan
atau Urea ……...………. 49
5 Jumlah Anakan Tanaman Padi per Pot pada Setiap Stadia
Pertumbuhan Tanaman Padi ……….………. 52
6 Total Serapan Nitrogen oleh Tanaman Padi dan Serapan N yang
Berasal dari Pupuk (Jerami Padi, Kompos dan Urea), Tanah dan
15N-ZA pada Stadia Pembentukan Anakan ……….……... 55
7 Total Serapan Nitrogen oleh Tanaman Padi dan Serapan N yang
Berasal dari Pupuk (Jerami Padi, Kompos dan Urea), Tanah dan
15N-ZA pada Stadia Awal P embentukan Malai …….………...….. 56
8 Total Serapan Nitrogen oleh Tanaman Padi dan Serapan N yang
Berasal dari Pupuk (Jerami Padi, Kompos dan Urea), Tanah dan
15N-ZA pada Stadia Pengisian Bulir Padi ... 58
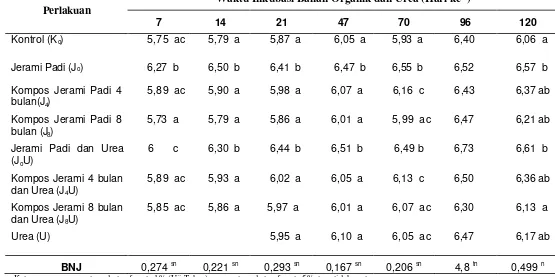
9 Konsentrasi N-NH4+ dan N-NO3- (mg kg-1) Dalam Tana h
Tergenang Pada Setiap Stadia Pertumbuhan Tanaman Padi ... 65
10 Nilai Rata-rata Fluks Gas N2O dan Pendugaan Total Nitrogen
yang Hilang Sebagai Gas N2O dari Tanah Tergenang Akibat
Pemberian Jerami Padi, Kompos dan atau Urea ……… 67
11 Nilai Acetylene Reduction Assay (ARA) di Daerah Perakaran
Tanaman Padi (nmol C2H4 g-1 BK Akar jam-1) pada Tiga Stadia
DAFTAR
LAMPIRAN
Lampiran Halaman
Teks
1 Cara Penghitungan Serapan 15N, dan N dari Bahan Organik dan
Urea ... 85
2 Komposisi Kimia dari Sereal dan Jerami Padi
(www.fiberfu tures.org) ... 87
3 Sidik Ragam pH Tanah Akibat Pemberian Jerami Padi, Kompos,
Urea dan Kombinasinya pada Inkubasi Tanah di Laboratorium ... 87
4 Sidik Ragam Konsentrasi N-NH4+ Tanah (mg kg-1) Akibat
Pemberian Jerami Padi, Kompos, Urea dan Kombinasinya pada
Setiap Stadia Pertumbuhan Tanaman Padi ... 89
5 Sidik Ragam Jumlah Anakan per Pot Akibat Pemberian Jerami
Padi, Kompos, Urea dan Kombinasinya pa da Setiap Stadia
Pertumbuhan Tanaman Padi ……….………. 90
6 Sidik Ragam Bobot Kering Tanaman Padi (g per pot) Akibat
Pemberian Jerami Padi, Kompos, Urea dan Kombinasinya pada
Setiap Stadia Pertumbuha n Tanaman Padi ……….... 91
7 Sidik Ragam Serapan 15N (mg per pot) Tanaman Padi Akibat
Pemberian Jerami Padi, Kompos, Urea dan Kombinasinya pada
Setiap Stadia Pertumbuhan Tanaman Padi ………. 92
8 Sidik Ragam Serapan N yang Berasal dari Tanah (mg per pot)
Pemberian Jerami Padi, Kompos, Urea dan Kombinasinya pada
Setiap Stadia Pertumbuhan Tanaman Padi ………. 93
9 Sidik Ragam Serapan N yang Berasal dari Pupuk (mg per pot)
Akibat Pemberian Jerami Padi, Kompos, Urea dan Kombinasinya
pada Setiap Stadia Pertumbuhan Tanaman Padi ………... 94
10 Sidik Ragam Efisiensi Penggunaan N Pupuk (%) oleh Tanaman
Padi Akibat Pemberian Jerami Padi, Kompos, Urea dan
Kombinasinya pada Setiap Stadia Pertumbuhan Tanaman Padi ... 95
11 Sidik Ragam Fluks Gas N2O (mg m-2 jam-1) Akibat Pemberian
Jerami Padi, Kompos, Urea dan Kombinasinya Saat Inkubasi
Bahan Organik pada Setiap Stadia Pertumbuhan Tanaman Padi .. 96
12 Sidik Ragam Acetylene Reduction Assay (ARA) di Daerah
Perakaran Tanaman Padi (nmol C2H4 g-1 BK Akar jam-1) Akibat Pemberian Jerami Padi, Kompos, Urea dan Kombinasinya pada
Setiap Stadia Pertumbuhan Tanaman Padi ..…... 97
13 Jumlah Anakan Tanaman Padi per Pot pada Setiap Stadia
Pertumbuhan Tanaman Padi ……….. 98
14 Bobot Kering Tanaman Padi (g per pot) pada Setiap Stadia
15 Nilai pH Tanah Dalam Kondisi Tergenang pada Inkubasi di
Laboratorium ……….……… 100
16 Konsentrasi N-NH4+ Tanah (mg kg-1) Dalam Kondisi Tergenang
pada Inkubasi di Laboratorium ……….…. 101
17 Konsentrasi N-NO3- Tanah (mg kg-1) Dalam Kondisi Tergenang
pada Inkubasi di Laboratorium ………. 102
18 Konsentrasi N-NH4+ (mg kg-1) Dalam Tanah pada Setiap Stadia
Pertumbuhan Tanaman Padi ……….. 103
19 Konsentrasi N-NO3- (mg kg-1) Dalam Tanah pada Setiap Stadia
Pertumbuhan Tanaman Padi ………...… 104
20 Serapan Nitrogen Tanaman Padi pada Stadia Pembentukan
Anakan ... 105
21 Serapan Nitrogen Tanaman Padi pada Stadia Awal Pembentukan
Mala i ……… ………. 106
22 Serapan Nitrogen Tanaman Padi pada Stadia Pengisian Bulir Padi 107
23 Serapan Nitrogen Tanaman Padi pada Saat Panen ...……. 108
24 Konsentrasi 15N dan Nitrogen Dalam Tanaman yang Diperoleh
dari Jerami Padi, Kompos dan Urea serta yang Diperoleh dari
Tanah pada Stadia Pembentukan Anakan ... 109
25 Konsentrasi 15N dan Nitrogen Dalam Tanaman yang Diperoleh
dari Jerami Padi, Kompos dan Urea serta yang Diperoleh dari
Tanah pada Stadia Awal Pembentukan Malai ... 110
26 Konsentrasi 15N dan Nitrogen Dalam Jerami yang Diperoleh dari
Jerami Padi, Kompos dan Urea serta yang Diperoleh dari Tanah
pada Stadia Pengisian Bulir Padi ... 111
27 Konsentrasi 15N dan Nitrogen Dalam Gabah yang Diperoleh dari
Jerami Padi, Kompos dan Urea serta yang Diperoleh dari Tanah
pada Stadia Pengisian Bulir Padi ... 112
28 Konsentrasi 15N dan Nitrogen Dalam Jerami yang Diperoleh dari
Jerami Padi, Kompos dan Urea serta yang Diperoleh dari Tanah
pada Saat Panen ... 113
29 Konsentrasi 15N dan Nitrogen Dalam Gabah yang Diperoleh dari
Jerami Padi, Kompos dan Urea serta yang Diperoleh dari Tanah
pada Saat Panen ...……...……… 114
30 Hasil Analisis Gas N2O pada Setiap Stadia Pertumbuhan
Tanaman Padi ……… 115
31 Nilai Acetylene Reduction Assay (ARA) di Daerah Perakaran
Tanaman Padi (nmol g-1 BK akar jam-1) pada Setiap Stadia
Pertumbuhan Tanaman Padi ………..………. 121
DAFTAR GAMBAR
Gambar Halaman
Teks
1 Skema dari Lapisan Oksidasi – Reduksi (Sumber: Mikkelsen,
1987) ... 8
2 Skema Transformasi Nitrogen dalam Ekosistem Tanah Sawah Tergenang (Sumber: Mikkelsen, 1987) ...…………...…. 12
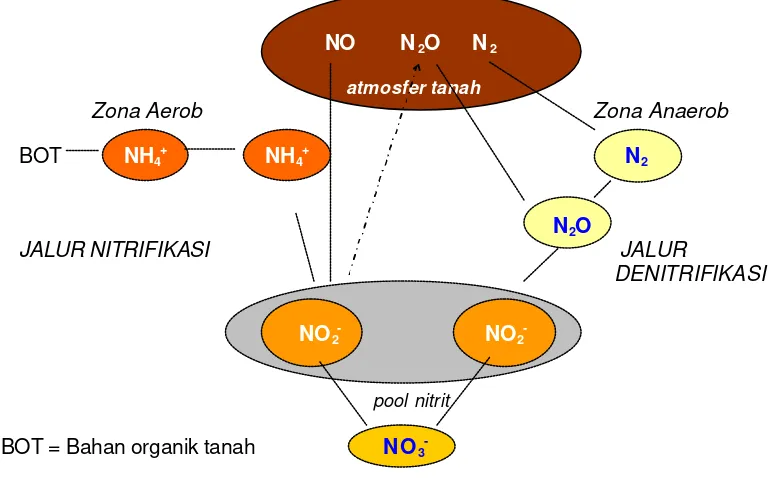
3 Model Pasangan Proses Nitrifikasi – Denitrifikasi yang Menggambarkan Mekanisme Kedua Proses Tersebut dengan Penekanan Khusus pada Pembentukan N2O dan N2 (Sumber: Russow et al., 2000) …... 23
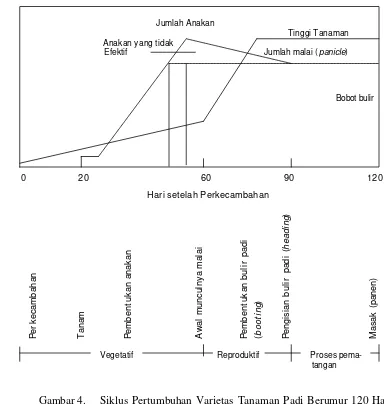
4 Siklus Pertumbuhan Varietas Tanaman Padi Berumur 120 Hari (Sumber: Yoshida, 1981) ... 25
5 Skema Waktu Pembuatan Kompos 4 dan 8 bulan ... 29
6 Skema Percobaan di Rumah Kaca ………. 32
7 Pengukuran Gas N2O dengan Alat Sungkup ..….………... 34
8 Konsentrasi N-NO3- Dalam Tanah Tergenang Akibat Pemberian (a) Jerami Padi dan Kompos; (b) Jerami Padi + Urea, dan Kompos + Urea Selama 120 Hari Penggenangan Tana h …... 40
9 Konsentrasi N-NH4+ Dalam Tanah Tergenang Akibat Pemberian (a) Jerami Padi dan Kompos; (b) Jerami Padi + Urea, dan Kompos + Urea Selama 120 Hari Penggenangan Tanah …... 43
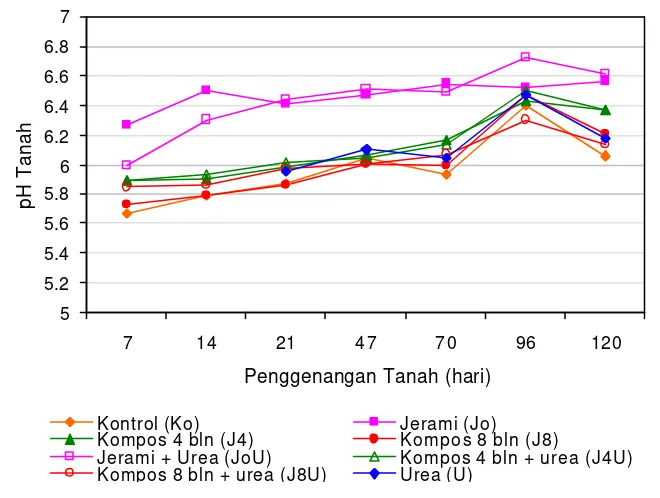
10 Nilai pH Tanah Tergenang yang Diberi Jerami Padi, Kompos dan atau Urea ………...…….………...……. 47
11 Konsentrasi N-NH4+ Tanah pada Kondisi Tanah Tergenang pada Setiap Stadia Pertumbuhan Tanaman Padi ………...….. 50
12 Bobot Kering Tanaman dari Stadia Pembentukan Anakan sampai Stadia Pengisia n Bulir ………...… 54
13 Hubungan Antara N yang Dilepaskan Dalam Tanah dan Serapan N Tanaman pada 75 HST (Stadia Pengisian Bulir) …...……. 59
14 Hubungan Antara Serapan N Tanaman Padi dan Jumlah Anakan pada 75 HST (Stadia Pengisian Bulir) …...………..….. 60
15 Hubungan Antara Serapan N Tanaman Padi dan Bobot Kering Tanaman Padi pada 75 HST (Stadia Pengisian Bulir) ...…….. 60
16 Hubungan Antara Serapan N dari Pupuk (Jerami Padi, Kompos dan atau Urea) dan Bobot Kering Tanaman pada 75 HST (Stadia Pengisian Bulir) ……...…………..……….…….. 61
18 Fluks Gas N2O dalam Tanah Tergenang Akibat Pemberian Jerami
1.1. Latar Belakang
Tanaman yang banyak mengonsumsi pupuk, terutama pupuk nitrogen (N)
adalah tanaman padi sawah, yaitu sebanyak 72 % dan 13 % untuk palawija
(Agency for Agricultural Research and Development, 1992). Hal ini terutama
disebabkan oleh tersedianya varietas padi unggul yang sangat responsif terhadap
N. Nitrogen merupakan input produksi yang sangat penting dan salah satu unsur
hara yang memengaruhi pertumbuhan dan produksi padi. Tetapi menurut Kyuma
(1983) konsentrasi N-total dalam sebagian besar tanah sawah di daerah tropika
termasuk rendah, yaitu kurang dari 0,15%. Selanjutnya Kyuma menjelaskan
bahwa kondisi ini mencerminkan rendahnya kandungan N dalam tanah yang
dapat dimineralisasi.
Tanaman padi dapat menggunakan N, baik yang berasal dari pupuk N
mineral maupun dari bahan organik. Akan tetapi N dalam bahan organik harus
dimineralisasi lebih dulu sebelum dapat dimanfaatkan oleh tanaman padi. Pada
umumnya N dari pupuk mineral tidak dapat digunakan oleh tanaman padi secara
efisien, karena pupuk N sangat mudah larut dan bersifat sangat mobil. Selain itu
dalam kondisi sawah yang tergenang, N pupuk banyak yang hilang dalam bentuk
gas (Buresh dan De Datta, 1991). Hal ini menyebabkan petani seringkali
memberikan pupuk mineral dengan takaran secara berlebihan, agar bisa
memperoleh hasil yang tinggi. Di beberapa lokasi di Indonesia, para petani
memberikan pupuk melebihi takaran pupuk yang direkomendasikan. Pemberian
pupuk mineral secara berlebihan dapat mengganggu keseimbangan hara dalam
tanah, meningkatkan biaya produksi, dan mengakibatkan munculnya dampak
negatif pada lingkungan. Kehilangan N dalam bentuk gas tersebut terjadi melalui
proses denitrifikasi (gas N2O dan N2) (Kakuda et al., 1999 dan Ostrom et al.,
2000) maupun volatilisasi (gas NH3) (Mikkelsen et al., 1978), dua proses penting
sebagai penyebab hilangnya N dari sistem tanah-tanaman. Tetapi sampai saat ini
penyebab utama ketidakefisienan pupuk N dalam budidaya padi sawah diduga
karena proses nitrifikasi – denitrifikasi dalam lapisan aerob – anaerob (Nugroho
tanaman atau dari antar muka (interface) tanah–air atau setelah adanya
pengeringan dan pembasahan tanah secara bergantian. Menurut Yoshida dan
Padre Jr (1975) dengan penggenangan secara terus-menerus selama masa
pertumbuhan padi, N pupuk yang hilang dari sistem tanah-tanaman berkisar
antara 28,4% dan 18,4% berturut-turut untuk perlakuan tanpa dan dengan jerami.
Kehilangan N tanah karena siklus penggenangan dan pengeringan berkisar 15 –
20%, sementara N pupuk yang hilang dalam kondisi sawah adalah 44,2% dan
18,4% berturut-turut untuk perlakuan tanpa dan dengan jerami padi (Patrick dan
Wyatt, 1964). Hilangnya N pupuk karena denitrifikasi selain merugikan petani
secara ekonomi, gas N2O yang terbentuk dari proses ini merupakan gas rumah
kaca yang 300 kali lebih radiatif daripada CO2 dan memiliki masa hidup (lifetime)
di atmosfer 150 tahun (Intergovernmental Panel on Climate Change/IPCC, 1992).
Denitrifikasi merupakan sumber utama dari NOx stratosfer, yang merupakan
katalis alami utama dari proses yang menyebabkan terjadinya penipisan lapisan
ozon stratosfer (IPCC, 1994). Dengan demikian usaha meningkatkan serapan N
pupuk oleh tanaman dapat mencegah akumulasi N mineral dalam tanah sehingga
diharapkan akan meningkatkan efisiensi penggunaan N pupuk. Salah satu cara
yang bisa dilakukan adalah dengan menyelaraskan pola penyediaan N dalam tanah
dengan laju serapan N tanaman padi, sehingga akumulasi N mineral dalam tanah
dapat dikurangi, sekaligus memperkecil peluang N hilang dari sistem
tanah-tanaman.
Selama beberapa dekade yang lalu, peningkatan ketersediaan serta
kemudahan mendapatkan pupuk mineral berakibat pada penurunan penggunaan
pupuk organik, misalnya jerami padi. Akan tetapi karena akhir -akhir ini dunia
dilanda krisis energi dan harga pupuk terus meningkat, maka pemanfaatan bahan
organik atau sisa -sisa tanaman sebagai sumber unsur hara mulai dipertimbangkan
kembali. Pengembalian sisa panen (jerami) dan penambahan kompos atau pupuk
organik, selain untuk memperbaiki atau meningkatkan kandungan bahan organik
tanah, diharapkan juga sebagai sumber hara N bagi tanaman padi. Nitrogen dalam
bahan organik akan dilepas ke dalam tanah melalui proses pelapukan biologi yang
disebut mineralisasi. Sebagian dari N dalam sisa panen akan dikonversikan
dimanfaatkan kembali oleh tanaman. Ada hubungan yang erat antara kesuburan
tanah dengan kandungan bahan organik tanah, karena bahan organik
memengaruhi sifat-sifat fisik dan kimia tanah. Selain itu, bahan organik
merupakan sumber karbon (C) dan N serta energi yang diperlukan untuk
pertumbuhan populasi dan aktivitas jasad renik tanah. Pembebasan N dari bahan
organik bersifat lambat tersedia (slow release) sehingga akumulasi N mineral
dalam tanah diharapkan akan berkurang dan selanjutnya dapat mengurangi
hilangnya N dalam bentuk gas.
Sumber utama bahan organik yang mudah diperoleh di laha n sawah adalah
jerami padi. Namun sampai saat ini belum banyak petani yang memanfaatkan
bahan tanaman sisa-sisa panen sebagai sumber bahan organik di lahan sawah.
Bahan ini banyak dibuang dengan cara membakarnya. Pembakaran bagian
tanaman sisa-sisa panen tidak hanya akan berakibat pada menurunnya kandungan
bahan organik tanah, tetapi juga lenyapnya beberapa unsur hara seperti N dan S.
Pembakaran jerami padi menyebabkan polusi udara dengan adanya emisi gas-gas
seperti CO, NOx dan CO2 yang merugikan kesehatan manusia dan ekosistem.
Pemberian bahan organik seperti jerami padi dalam bentuk kompos atau pupuk
hijau ke dalam lahan sawah dianggap efektif untuk mempertahankan atau
meningkatkan kesuburan tanah. Jerami padi dianggap sebagai sumber bahan
organik yang sangat penting dan tepat karena ketersediaannya di lahan sawah dan
kandungan haranya yang relatif lengkap untuk pertumbuhan tanaman padi (Ueno
dan Yamamuro, 2001). Menurut Ponnamperuma (1984) jerami padi mengandung
kira-kira 0,6% N, 0,1% P, 0,1% S, 1,5% K, 5% Si dan 40% C dan ketersediaan
jerami padi di lahan sawah bervariasi antara 2-8 ton/ha per musim tergantung pada
varietas dan pengelolaan yang dilakukan. Jerami padi juga secara tidak langsung
mengandung sumber senyawa N-C yang menyediakan substrat untuk metabolisme
jasad renik yaitu gula, pati (starch), selulosa, hemiselulosa, pektin, lignin, lemak
(fat), dan protein. Senyawa-senyawa ini terdiri dari 40% C dari bobot kering
jerami (Ponnamperuma, 1984). Jerami padi merupakan sumber energi yang baik
bagi jasad renik, karena itu pemberian jerami merangsang fiksasi N2 oleh bakteri
heterotrofik dan fototrofik dalam tanah-tanah tergenang (Matsuguchi, 1979;
Untuk meningkatkan pemanfaatan N bahan organik oleh tanaman padi,
maka perlu diprediksi jumlah N yang bisa disuplai oleh bahan organik dan yang
tersedia bagi tanaman. Jumlah N yang tersedia bagi tanaman tergantung pada
mineralisasinya menjadi amonium (N-NH4+) dan nitrat (N-NO3-) dalam tanah.
Keberadaan kedua bentuk senyawa N ini di dalam tanah menjadi penentu
ketersediaan unsur hara N untuk memenuhi kebutuhan tanaman sepanjang masa
pertumbuhannya. Dinamika dekomposisi bahan organik selain dipengaruhi oleh
praktek budidaya padi sawah (lama penggenangan, metode pemberian, dan
aplikasi N mineral) dan sifat-sifat tanah, juga sangat dipengaruhi oleh komposisi
kimia dari bahan organik (Becker et al., 1994). Komposisi kimia bahan organik
sangat beragam tergantung pada jenis atau sumber bahan organik dan tingkat
pelapukannya. Komposisi kimia bahan organik sangat memengaruhi transformasi
N dalam tanah. Karena unsur hara N adalah penentu produktivitas tanaman, maka
proses transformasi N dalam tanah perlu dipelajari antara lain : (1) untuk
mengetahui faktor yang berpengaruh dan keter kaitannya dengan serapan N,
pertumbuhan dan hasil tanaman padi; (2) untuk meningkatkan keefisienan
penggunaan pupuk N oleh tanaman padi dengan memperbaiki keselarasan antara
jumlah N tersedia dan serapan N tanaman padi; dan (3) untuk mengetahui
pengaruh de komposisi bahan organik terhadap transformasi N dalam tanah sawah.
1.2. Tujuan
Penelitian ini dilakukan dengan tujuan untuk :
1. Menentukan sumbangan dari bahan organik (dengan tingkat dekomposisi yang
berbeda) dan dari kombinasi pupuk urea dengan bahan organik dalam
menyediakan kebutuhan N tanaman pada kondisi tanah tergenang
2. Menetapkan jumlah N yang hilang dalam bentuk gas N2O dari proses
dekomposisi bahan organik (jerami padi dan kompos jerami) pada kondisi
tanah tergenang.
3. Mempelajari pengaruh pemberian jerami padi, kompos dan campuran jerami
dan urea, serta campuran kompos dan urea terhadap aktivitas penambatan N2
oleh bakteri penambat N di daerah perakaran tanaman padi, pertumbuhan dan
1.3. Hipotesis
Hipotesis penelitian ini adalah :
1. Sumbangan kompos terhadap konsentrasi N tanah (N -NH4+ dan N-NO3-)
lebih tinggi daripada jerami. Pemberian urea, dan campuran antara urea
dengan kompos atau jerami dapat meningkatkan ketersediaan N dalam tanah
bagi pertumbuhan padi sawah.
2. Pemberian kompos terhadap pertumbuhan dan serapan N tanaman padi lebih
baik dibandingkan dengan pemberian jerami.
3. Pemberian jerami padi ke dalam tanah pada kondisi tergenang mengurangi
emisi gas N2O.
4. Pemberian jerami padi ke dalam tanah dalam kondisi tergenang dapat
meningkatkan aktivitas enzim nitrogenase yang berperan dalam penambatan
II. TINJAUAN PUSTAKA
2.1. Pengaruh Penggenangan Tanah terhadap Sifat-sifat Tanah
Sifat-sifat fisik, kimia, dan biologi tanah tergenang sangat berbeda dengan
sifat-sifat tanah lahan kering. Dalam tanah sawah, oksigen yang semakin
berkurang, pembuatan teras, dan pembentukan gundukan/pematang akan
mengubah sifat kimia tanahnya dan adanya genangan air di atas permukaan tanah
dapat melindungi tanah dari sebagian kerusakan akibat proses -proses yang
memengaruhi produktivitas jangka panjangnya, seperti erosi tanah.
2.1.1. Pengaruh Penggenangan terhadap Sifat Fisikokimia Tanah
Dengan penggenangan, air memenuhi ruang pori tanah, dan udara dalam
tanah dikeluarkan. Tiadanya oksigen dalam tanah maka organisme tanah akan
menggunakan sumber penerima elektron lain dari komponen tanah lainnya
sebagai pengganti oksigen, dan akibatnya tanah menjadi bersifat reduktif.
Oksigen terlarut dalam air genangan yang berasal dari atmosfer atau dari aktivitas
fotosintetik berbagai hidrofit, akan berdifusi ke lapisan tanah permukaan di bawah
air genangan yang bersifat oksidatif. Walaupun lapisan yang lebih dalam dari
tanah tergenang tetap tereduksi, lapisan teroksidasi tersebut sering berperan
penting dalam transformasi kimia dan siklus hara yang terjadi dalam tanah
tergenang. Pada lapisan tanah teroksidasi yang tipis tersebut, jasad renik
melakukan proses biologi yang bersifat aerobik dan berbagai senyawa mineral
berada dalam bentuk teroksidasi seperti SO42-, NO3-, Fe3+ dan Mn4+, sedangkan
pada zona anaerob yang lebih bawah didominasi oleh bentuk-bentuk tereduksi
seperti senyawa fero (Fe2+) dan mangano (Mn2+), ammonia, dan sulfida (S2-)
(Mohanty dan Dash, 1982). Karena adanya besi feri (Fe3+) dalam lapisan
teroksidasi, tanah sering berwarna coklat atau merah kecoklatan. Sebaliknya
warna sedimen tereduksi yang didominasi oleh besi fero (Fe2+) sering memberikan
warna abu kebiruan sampai abu kehijauan karena adanya proses gleisasi. Sebelum
perubahan ini terjadi, organisme telah mereduksi ion nitrat menjadi gas N2O dan
2.1.2. Pengaruh Penggenangan terhadap Sifat Biokimia Tanah
Konsentrasi O2 di bawah lapisan tanah teroksidasi yang tipis menurun
tajam dan mendekati nol. Laju penipisan O2 ini tergantung pada suhu,
ketersediaan bahan organik untuk respirasi jasad renik, dan kadang-kadang pada
kebutuhan O2 dari reduktan seperti besi fero (Gambrell dan Patric k, 1978). Pada
kondisi tanpa O2 jasad renik aerob mati atau menjadi tidak aktif dan jasad renik
anaerob fakultatif atau anaerob obligat menjadi aktif dalam zona anaerob.
Organisme-organisme ini menciptakan zona tereduksi dengan sistem potensial
redoks campuran yang memengaruhi sifat kimia dan elektrokimia tanah (Mitsch
dan Gosselink, 1993). Skema dari profil tanah tergenang ditunjukkan dalam
Gambar 1.
Akibat dari penggenangan, potensial redoks dari lapisan tanah yang
tereduksi menurun tajam. Potensial redoks (Eh), suatu ukuran tekanan elektron
(atau ketersediaan elektron) dalam larutan, sering digunakan untuk
mengkuantifikasi derajat reduksi elektrokimia dari tanah-tanah tergenang.
Oksidasi terjadi tidak hanya selama pengambilan oksigen tetapi juga bila ion
hidrogen dilepaskan (misalnya : H2S S2- + 2H+) atau, yang lebih umum bila
secara kimia memberikan elektron (misal: Fe2+ Fe3+ + e-). Reduksi adalah
proses yang berlawanan yaitu memberikan oksigen, menerima hidrogen
(hidrogenasi), atau menerima elektron. Potensial redoks dapat diukur dalam tanah
tergenang dan merupakan ukuran kuantitatif dari kecenderungan tanah untuk
mengoksidasi atau mereduksi bahan atau komponen tanah (Faulkner dan
Richardson, 1989). Tanah yang teraerasi dicirikan dengan potensial redoks +400
milivolt (mV) atau lebih besar. Bila proses reduksi cukup intens, tanah dapat
mempunyai potensial redoks –300 mV. Tingkat oksidasi dan reduksi dari sistem
redoks, seperti oksigen, nitrat, nitrit, mangan, besi, dan sulfur juga berbagai
senyawa organik yang mudah terdekomposisi menentukan potensial redoks tanah
(Qixiao dan Tianren, 1997).
Dalam lapisan tanah tereduksi, untuk menggantikan oksigen yang
diperlukan dalam metabolisme aerob, organisme anaerob menggunakan penerima
elektron lain yang lebih lemah. Penerima elektron yang terkuat setelah O2 adalah
Kedalaman Tanah (cm) NH3
Gambar 1. Skema dari Lapisan Oksidasi – Reduksi (Sumber: Mikkelsen, 1987)
+220 mV dan proses ini disebut denitrifikasi. Nitrat bersifat stabil hanya pada
lapisan tanah bagian atas, yaitu di bawah genangan air dan tapak-tapak mikro
yang bersifat aerob dalam lapisan anaerob seperti di sekitar perakaran tanaman
padi. Daerah di sekitar perakaran padi, kira-kira tiga milimeter tebalnya,
merupakan zona teroksidasi (Zhiyu et al., 1990). Kondisi teroksidasi ini terjadi
karena adanya transpor oksigen melalui aerenchyma dari tanaman padi ke daerah
dekat permukaan akar. Nitrat tersebut biasanya bergerak ke bawah ke dalam
lapisan tereduksi melalui difusi dan aliran massa yang selanjutnya secara biologi
didenitrifikasi menjadi N2 dan N2O (Mikkelsen et al., 1995). Apabila O2 dan
NO3- habis terpakai, maka potensial redoks turun dan hidroksida Mn4+ dan Fe3+
akan direduks i masing-masing menjadi Mn2+ pada +200 mVdan Fe2+ pada +120
mV. Bentuk-bentuk tereduksi dari Fe dan Mn ini mempunyai kelarutan yang
lebih besar daripada bentuk teroksidasinya. Akibatnya, ketersediaan Fe dan Mn
meningkat di bawah kondisi tergenang. Bila suplai penerima elektron lebih kecil
daripada laju suplai elektron maka kondisi reduksi yang lebih kuat akan terjadi
direduksi menjadi sulfida (S2-). Bila SO42- habis maka jasad renik akan
menggunakan energi yang tersimpan dalam senyawa organik dengan mereduksi
H+ dan H2 dan bahan organik ddekomposisi secara anaerob menjadi CO2,
asam-asam organik dan alkohol. Pada kondisi sangat tereduksi dekomposisi bahan
organik menghasilkan CH4, biasanya pada nilai Eh di bawah –250 sampai – 300
mV. Tanah cenderung mempertahankan nilai Eh pada selang tertentu sampai
komponen tanah yang teroksidasi habis, misalnya tanah yang direduksi akan
cenderung mempertahankan Eh pada sekitar +220 mV selama ada NO3-. Bila
NO3- habis, maka Eh turun dan selanjutnya terjadi reduksi penerima elektron yang
lebih lemah daripada NO3-.
Dengan penggenangan terjadi akumulasi N-NH4+ dan hilangnya N-NO3
-yang sebelumnya sudah ada dalam tanah. Dalam tanah-tanah tergenang, amonia,
amin, merkaptan dan sulfida dihasilkan dari dekomposisi protein. Mineralisasi N
berkorelasi positif dengan persentase C- dan N-organik dalam tanah tetapi
berkorelasi negatif dengan nisbah C/N (Mikkelsen, 1987), nisbah lignin/nitrogen
(L/N) (Becker et al., 1994), dan nisbah tannin/nitrogen (T/N) (Clement et al.,
1995).
Salah satu akibat penting dari penurunan potensial redoks setelah
penggenangan adalah perubahan pH (Qixiao dan Tianren, 1997). Reaksi tanah
(pH) dari sebagian besar tanah-tanah setelah penggenangan cenderung mendekati
netral. Dalam sebagian besar proses reduksi yang terjadi dalam tanah, seperti
reduksi oksida -oksida besi, mangan dan sulfat, terjadi konsumsi proton. Tetapi
asam-asam organik dan karbon dioksida (CO2) ya ng dihasilkan selama
dekomposisi bahan organik dapat memberikan proton ke dalam tanah, yang
menyebabkan penurunan pH. Oleh karena itu, arah dan besarnya perubahan pH
tanah selama penggenangan ditentukan oleh jumlah relatif proton yang
dikonsumsi dan dilepaskan. Dalam tanah sawah yang masam, pada awal
dekomposisi bahan organik tanah, dengan reduksi oksida-oksida besi dan mangan,
nilai pH meningkat tajam sebagai hasil dari konsumsi proton yang jauh lebih besar
daripada pelepasan proton. Tetapi pada tahap dekomposisi bahan organik yang
aktif, pH dapat menurun karena produksi proton yang cepat. Selanjutnya pH
dan Tianren, 1997). Reaksi tanah (pH) tanah sawah alkalin dikendalikan oleh
kesetimbangan kimia dari sistem CaCO3-CO2 dalam tanah-tanah berkapur
(Ponnamperuma, 1977; Qixiao dan Tianren, 1997), sistem Na2CO3-CO2 untuk
tanah sodik (Ponnamperuma, 1977). Biasanya nilai pH menurun karena adanya
akumulasi CO2 selama penggenangan. Penurunan pH tanah-tanah alkalin dan
peningkatan pH tanah-tanah masam tersebut menguntungkan pertumbuhan
tanaman.
Akibat penggenangan, kekuatan ion (ionic strength) dalam larutan tanah
meningkat, kemudian menurun. Dalam tanah-tanah masam atau agak masam,
reduksi feri dan mungkin mangani yang tidak larut menjadi bentuk yang lebih
larut menyebabkan peningkatan kekuatan ion. Dalam tanah netral sampai alkalin,
Ca2+ dan Mg2+ juga menyebabkan peningkatan kekuatan ion. Bahan organik
meningkatkan kelarutan Fe, Ca dan Mg. Jika tanah yang awalnya banyak
mengandung N-NO3-, kekuatan ion dalam tanah dapat berkurang dengan
penggenangan karena hilangnya NO3- akibat denitrifikasi (Mikkelsen, 1987).
Proses reduksi tanah yang terjadi dalam tanah tergenang merupakan proses
biokimia, dan jasad renik bertanggung jawab pada perubahan-perubahan
(transformasi) yang terjadi di dalam tanah. Proses reduksi tidak terjadi pada tanah
yang steril. Tanaman padi juga memengaruhi tingkat reduksi tanah karena adanya
sekresi O2 dari akar-akar tanaman padi.
2.2. Pengaruh Penggenangan terhadap Tanaman Padi
Padi merupakan tanaman yang unik karena dapat bertahan hidup dan
bereproduksi di bawah kondisi lahan kering, tergenang dan air dalam. Walaupun
medium berair (aquatik) cocok untuk pertumbuhan dan hasil tanaman padi, tetapi
pertumbuhan akar memerlukan suplai O2 dan melepaskan CO2 selama respirasi.
Hal ini dapat dilakukan oleh tanaman padi karena adanya sistem saluran pembawa
udara (aerenchyma) yang mampu mengalirkan O2 dari daun ke korteks akar,
sehingga akar -akar tanaman padi dapat mengaerasi tanah tanpa mengambil O2 dari
2.3. Transformasi Nitrogen dalam Tanah Tergenang
Nitrogen (N) merupakan unsur hara pembatas pertumbuhan tanaman
dalam tanah-tanah tergenang, baik tana h-tanah tergenang tersebut merupakan
lahan basah alami ataupun pada lahan basah pertanian seperti tanah sawah
(Gambrell dan Patrick, 1978). Transformasi N dalam tanah tergenang melibatkan
berbagai proses mikrobiologi, dan beberapa proses tersebut menyebabkan hara N
menjadi kurang tersedia bagi tanaman. Ion ammonium merupakan bentuk utama
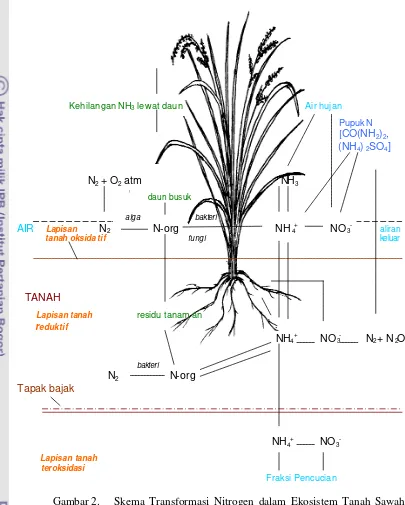
dari N yang dimineralisasi dalam sebagian besar tanah tergenang. Gambar 2
menggambarkan interaksi kompleks yang ada dalam tanah-tanah tergenang yang
menyebabkan unsur hara N hilang dari tanah. Kehilangan N dapat terjadi dalam
lapisan tanah yang teroksidasi dan tereduksi, dari air genangan, terbawa oleh
aliran permukaan, pencucian, serapan N oleh tanaman dan karena mekanisme
lainnya.
Nitrogen mengalami beberapa transformasi fisikokimia dan biologi dalam
tanah. Transformasi fisikokimia meliputi terperangkapnya (fiksasi) NH4+ dalam
kisi-kisi minerali liat dan volatilisasi NH3. Transformasi N secara biologi meliputi
mineralisasi-imobilisasi, fiksasi N2 atmosfer secara biologi,
nitrifikasi-denitrifikasi, dan serapan tanaman.
Sistem budidaya padi yang melibatkan penggenangan secara terus
-menerus dan berkala memengaruhi perilaku N tanah dan N yang diberikan ke
dalam tanah. Kondisi khusus yang terjadi di bawah lingkungan tanah tergenang
mempercepat proses amonifikasi dan menekan nitrifikasi bila tidak ada O2.
Dengan penggenangan, N-NH4+ terakumulasi dalam tanah dan N -NO3- hilang.
Sumber-sumber pupuk N untuk tanaman padi dapat dibagi menjadi dua
kelompok, yaitu sisa-sisa tanaman (pupuk organik) dan pupuk N mineral.
Sebelum N yang terkandung dalam sisa-sisa tanaman menjadi tersedia bagi
tanaman, sisa tanaman yang diberikan ke dalam tanah harus mengalami
dekomposisi atau degradasi secara biologi lebih dulu. Urea mengalami hidrolisis
enzimatik dan diubah menjadi N -NH4+ (Kirk dan Olk, 2000):
Kehilangan NH3 lewat daun Air hujan
Pupuk N
[CO(NH2)2,
(NH4) 2SO4]
N2 + O2 atm NH3 daun busuk
alga bakteri
AIR Lapisan N2 N-org NH4+ NO3- aliran tanah oksida tif fungi keluar
TANAH
Lapisan tanah residu tanam an reduktif
NH4+ NO3- N2 + N2O
bakteri N2 N-org
Tapak bajak
NH4+ NO3 Lapisan tanah
teroksidasi
Fraksi Pencucian
Gambar 2. Skema Transformasi Nitrogen dalam Ekosistem Tanah Sawah Tergenang (Sumber: Mikkelsen, 1987).
2.3.1. Pergerakan Nitrogen dalam Tanah Tergenang
Pergerakan N dalam tanah berperan penting dalam menentukan bentuk
kimia dan kete rsediaannya bagi pertumbuhan tanaman. Menurut Mikkelsen
(1987) dua proses penting yang terlibat dalam pergerakan atau pengangkutan N
massa, dan (2) difusi molekul atau ion karena adanya gradien konsentrasi.
Proses-proses ini memengaruhi difusi molekul dari bahan terlarut, seperti NH4+, NO2-,
NO3-, urea dan gas-gas termasuk O2, NH3, N2 dan N2O (Rolston et al., 1990).
Dalam tanah-tanah tergenang, pergerakan N terlarut dari lapis an tanah
tereduksi (anaerob) ke lapisan permukaan yang aerob terjadi terutama melalui
difusi dan dipengaruhi oleh gradien konsentrasi, sumber N, dan konsentrasi dalam
lapisan anaerob (Reddy dan Patrick, 1984). Difusi ammonium dapat
menyebabkan terjadinya pergerakan ammonium terlarut dari tanah ke air
genangan, bahkan bila bahan pupuk dimasukkan ke dalam tanah (deep-placed).
Nitrat yang ada dalam air genangan, dalam lapisan aerob, atau yang ada di
lapisan oksidatif di sekitar akar padi segera berdifusi ke dalam lapisan anaerob
yang terletak di bawahnya. Nitrogen-nitrat yang berdifusi ke dalam lapisan
anaerob tampaknya hilang melalui denitrifikasi; sedangkan N-NH4+ yang berdifusi
dari lapisan tanah aerob ke dalam air genangan rentan terhadap nitrifikasi dan
volatilisasi ammonia (Savant dan De Datta, 1982).
Pergerakan N-NH4+ dari tapak-tapak pertukaran ke dalam larutan dapat
terjadi sebagai akibat dari adanya serapan tanaman, imobilisasi N yang
membentuk jaringan tubuh jasad renik, nitrifikasi dan volatilisasi.
2.3.2. Mineralisasi dan Imobilisasi Nitrogen
Ketersediaan N bagi tanaman sebagian besar dikendalikan oleh besarnya
pengaruh dua proses di dalam tanah yang saling berlawanan, yaitu mineralisasi
dan imobilisasi N. Mineralisasi N merupakan salah satu dari berbagai proses
dalam siklus N di alam yang paling penting. Mineralisasi N adalah transformasi
biologi dari N yang terikat secara organik menjadi N-mineral (N-NH4+ dan
N-NO3-) selama proses dekomposisi (Gambrell dan Patrick, 1978), dan dimulai
dengan aminisasi dan amonifikasi, berturut-turut adalah konversi mikrobiologi
dari N-organik menjadi R-NH2 dan menjadi N-NH4+ (Mikkelsen et al., 1995), dan
selanjutnya menjadi N-NO3- melalui proses nitrifikasi. Tahap aminisasi dan
amonifikasi berlangsung dengan bantuan jasad renik heterotrof, sedangkan
nitrifikasi terjadi karena peranan bakteri ototrof. Pada kondisi tergenang,
mineralisasi berhenti pada pembentukan N-NH4+ karena kondisi oksidatif yang
Imobilisasi N merupakan proses kebalikan dari mineralisasi N, dan didefinisikan
sebagai konversi N-mineral menjadi bentuk N-organik dalam jaringan tubuh jasad
renik (Soil Science Society of America, 1987). Imobilisasi (sintesis) dan
mineralisasi atau pelepasan N dari senyawa organik dalam tanah terjadi karena
aktivitas jasad renik yang mengarah pada pertukaran secara terus -menerus antara
bentuk-bentuk N-organik dan mineral (Mikkelsen, 1987). Mineralisasi dan
imobilisasi merupakan proses yang berlawanan yang terjadi secara serentak dan
terus-menerus dan sangat memengaruhi ketersediaan N bagi tanaman dan
konversi N dalam tanah dalam bentuk organik atau terfiksasi. Konsentrasi
N-NH4+ dapat meningkat atau menurun tergantung pada dominasi relatif kedua
proses tersebut. Proses amonifikasi, yang melibatkan hidrolisis enzimatik dan
deaminasi N organik tanah menjadi ammonium, terjadi secara bersamaan dengan
proses assimilatory dari imobilisasi N oleh mikrorganisme tanah.
Pembebasan N -NH4+ ke dalam tanah tergenang tergantung pada kebutuhan
N populasi jasad renik tanah, nisbah C/N dari sisa-sisa tanaman yang
terdekomposisi (Mikkelsen, 1987), komposisi kimia bahan organik dan beberapa
faktor lingkungan. Komponen organik dalam sisa-sisa tanaman umumnya dibagi
menjadi enam kategori, yaitu selulosa, hemiselulosa, lignin, fraksi larut air
(meliputi gula sederhana, asam amino, dan asam-asam alifatik), komponen larut
dalam eter dan alkohol, dan protein (Nagarajah, 1997). Lignin merupakan
komponen organik dari sisa-sisa tanaman yang paling tahan terhadap pelapukan.
Secara agronomi, N yang dimineralisasi sangat penting dan merupakan 50-80%
dari N-total yang diasimilasi oleh tanaman padi (Mikkelsen et al, 1995).
Untuk mencapai penggunaan N tanah yang efisien da lam bentuk N
terfiksasi secara biologi, sisa-sisa tanaman, dan pupuk, maka perlu
dipertimbangkan aspek laju-waktu proses mineralisasi relatif terhadap kebutuhan
N tanaman padi. Dalam jangka pendek, suplai N untuk tanaman padi diatur oleh
laju mineralisasi N-organik menjadi N-NH4+. Senyawa N-organik, terutama
protein dan turunannya mengalami pelapukan secara anaerob menghasilkan
bentuk-bentuk yang lebih sederhana, seperti asam amino (Nagarajah, 1997).
Nitrogen-asam amino lebih rentan terhadap mineralisasi daripada fraksi N tanah
menghasilkan pelepasan N-NH4+ yang merupakan bentuk akhir dari senyawa N
dan bersifat stabil dalam lapisan tereduksi. Dalam tanah tergenang, laju
mineralisasi N sisa-sisa tanaman yang diberikan ke dalam tanah ditentukan
terutama oleh nisbah L/N-nya (Becker et al., 1994).
Suplai N melalui mineralisasi bahan organik tanah telah diteliti oleh
Stanford dan Smith (1972). Mereka melakukan percobaan di laboratorium untuk
menentukan besarnya N yang dimineralisasi atau dilepaskan dari bahan organik
tanah. Smith et al. (1977) juga telah melakukan percobaan di lapang dengan
mengukur jumlah N mineral dalam pot-pot yang berisi tanah tanpa tanaman yang
dibenamkan ke dalam tanah. Hasil yang diperoleh menunjukkan bahwa potensi
mineralisasi N tanah di lapang sesuai dengan hasil pengukuran dari percobaan
laboratorium. Percobaan ini menunjukkan bahwa sebagian dari N dalam tanah
berasal dari proses mineralisasi senyawa N yang mudah dimineralisasi, dan
sisanya diasumsikan sebagai bentuk senyawa N yang tidak tersedia dan tetap
berada dalam bahan organik tanah yang relatif stabil.
2.3.3. Nitrogen terlarut dan dapat dipertukarkan
Nitrogen terlarut dan dapat dipertukarkan (N-tersedia) merupakan fraksi N
yang sangat penting sebagai nutrisi tanaman. Sumber utama dari N-tersedia
berasal dari pupuk dan N hasil mineralisasi. Nitrogen-NH4+ yang dibebaskan
selama pelapukan sisa-sisa tanaman, dengan cepat dijerap pada kompleks
pertukaran kation dan berada dalam keseimbangan dengan N-NH4+ dalam larutan
tanah. Proporsi relatif dari kedua bentuk N tersebut sebagian besar diatur oleh
kapasitas pertukaran kation (KTK) tanah (Mikkelsen, 1987; Ando et al., 1996)
dan sifat dari kompleks pertukaran kation (Nagarajah, 1997). Beberapa dari
N-NH4+ juga berada dalam bentuk tidak dapat dipertukarkan (terperangkap dalam
kisi-kisi mineral liat). Proses ini terjadi dalam tanah yang banyak mengandung
mineral liat 2:1 seperti vermikulit dan illit.
Setelah beberapa hari penggenangan, konsentrasi N-NH4+ dapat
dipertukarkan dalam tanah dapat meningkat karena mineralisasi bahan organik
tanah dan pelepasan N-NH4+ yang terfiksasi dalam kisi mineral liat. Menurut
Mikkelsen (1987) pemberian jerami padi akan menurunkan tingkat N tersedia
periode waktu tertentu N yang terimobilisasi tersebut akan dilepaskan kembali
melalui mineralisasi sehingga menjadi tersedia bagi tanaman padi.
2.3.4. Penambatan (Fiksas i) N2 Secara Biologi
Dalam sistem pertanian subsisten (di banyak bagian dari Asia tropis),
usaha tani padi sawah telah dilakukan secara terus menerus selama berabad-abad
tanpa pemberian pupuk N tanpa memperlihatkan penurunan konsentrasi N tanah
yang nyata. Di antara proses-proses yang turut menyumbang suplai N di lahan
sawah, penambatan N2 secara biologi dianggap sebagai faktor penting dalam
mempertahankan kesuburan N tanah. Data neraca N dari beberapa percobaan
jangka panjang di lapang menunjukkan bahwa sumbangan penambatan N secara
biologi ke dalam tanah selama musim pertanaman padi sawah berkisar dari 19
sampai 38 kg N ha-1 di Jepang, dan 30 sampai 52 kg N ha-1 di Philipina.
Sumbangan N ini terutama berasal dari jasad renik asli (indigenous) yang bersifat
asosiatif dan penambat N2 yang hidup bebas, yang meliputi bakteri heterotrof dan
fototrof serta cyanobakteri (alga hijau-biru) yang ada dalam sistem
tanah-tanaman-air genangan lahan sawah (Kundu dan Ladha, 1995).
Sumber unsur hara N terbesar adalah N2 udara yang merupakan 80% dari
atmosfer bumi. Akan tetapi sebagian besar organisme hanya dapat menggunakan
N yang bersenyawa dengan atom-atom lainnya untuk membentuk suatu ion seperti
NH4+ atau NO3-. Bentuk N sebagai N2 tidak dapat digunakan secara langsung
oleh sebagian besar tanaman karena adanya ikatan rangkap tiga yang membuatnya
menjadi molekul yang bersifat inert (Deacon, 2003). Gas N2 ini sangat stabil dan
tersedia melimpah bagi organisme yang mampu memanfaatkannya. Penambatan
atau fiksasi N2 secara biologi dapat mengkonversikan gas N2 menjadi N organik
melalui aktivitas organisme tertentu, baik aerob maupun anaerob, yang memiliki
enzim nitrogenase. Dengan demikian penambatan N2 secara biologi menjadi
sumber N utama bagi lahan sawah dalam system pertanian padi sawah yang
bersifat tradisional dan subsisten.
Nitrogenase merupakan enzim yang sangat sensitif terhadap O2 (Bergesen,
1980). Ekosistem sawah sangat cocok untuk proses fiksasi N2 karena tegangan O2
dalam ekosistem sawah rendah. Fiksasi N2 dapat terjadi dalam air genangan,
permukaan daun dan batang tanaman (Reddy dan Graetz, 1988). Fiksasi N2 pada
kondisi sawah dapat dilakukan oleh bakteri non-simbiotik (alga hijau-biru), dan
pada kondisi lahan kering dilakukan oleh bakteri simbiotik dari genus Rhizobium,
atau oleh aktinomisetes. Roger dan Watanabe (1986) mengklasifikasikan
organisme penambat N2 secara ekologi menjadi : (1) tiga kelompok jasad renik
autotrof yang terdiri dari bakteri fotosintetik, alga hijau biru yang hidup bebas
(non-simbiotik), dan Anabaena azollae sp. yang berasosiasi dengan tanaman paku
air Azolla, dan (2) tiga kelompok jasad renik heterotrof yang terdiri dari bakteri
penambat N2 dalam tanah (aerob, anaerob fakultatif dan anaerob obligat) yang
hidup bebas, bakteri penambat N2 yang berasosiasi dengan akar-akar tanaman
padi, dan organisme yang bersimbiose dengan legum (Rhizobium). Sampai saat
ini hanya tanaman legum yang mampu menambat N2 dan pupuk hijau Azolla yang
digunakan sebagai sumber N bagi tanaman padi melalui penambatan N2 secara
biologi (Mikkelsen et al., 1995).
Menurut Kundu dan Ladha (1995) tanah yang sangat reduktif (yang
tercipta karena penggenangan secara terus -menerus selama masa pertumbuhan
tanaman padi) dan pelumpuran yang intens memberikan pengaruh yang kurang
baik bagi bakteri penambat N asli (indigenous) dalam tanah sawah. Oleh karena
itu, sistem yang dapat mendorong atau meningkatkan penambatan N2 akan sangat
membantu mempertahankan kesuburan N pada tanah-tanah sawah (Ladha dan
Kundu, 1997). Selain pemberian pupuk hijau dari tanaman yang mampu
menambat N2 seperti Sesbania dan Azolla, pemberian sisa tanaman dengan nisbah
C/N yang besar (seperti halnya jerami padi) juga dapat meningkatkan penambatan
N2. Jerami padi merupakan sumber energi yang baik bagi bakteri heterotrof, dan
pengembalian jerami padi ke dalam lahan sawah secara nyata dapat meningkatkan
fiksasi N2 oleh bakteri heterotrof maupun fototrof (Matsuguchi, 1979; Ventura et
al., 1986; Adachi et al., 1997). Roger dan Ladha (1990) juga menyatakan bahwa
pemberian jerami ke dalam tanah dapat memberikan N sebesar 2-4 kg N untuk
setiap ton jerami. Hal ini menurut Ponnamperuma (1984) karena pemberian
jerami padi dan N mineral meningkatkan populasi bakteri aerob penambat N2.
Selain itu Greenland (1997) menyatakan bahwa aktivitas bakteri penambat N2 dan
mereka sebagian besar tergantung pada ketersediaan fosfor (P) dalam tanah sawah
tetapi konsentrasi N yang tinggi dalam tanah sawah cenderung menghambat
fiksasi N2.
2.3.5. Volatilisasi Amonia
Volatilisasi ammonia (NH3) merupakan mekanisme kehilangan N yang
penting dalam sistem pertanaman yang dipupuk. Menurut Mikkelsen (1987)
faktor-faktor dominan yang memengaruhi volatilisasi NH3 adalah pH tanah dan pe
(- log konsentrasi elektron), tekanan parsial CO2 (pCO2) dan kimia karbonat, sifat
pertukaran kation dan aktivitas jasad renik. Selain itu, kecepatan angin,
konsentrasi NH3 terlarut dan tekanan parsial NH3 dalam air dan udara, suhu udara
dan radiasi langsung juga memengaruhi volatilisasi NH3. Menurut Zhenghu dan
Honglang (2000) laju volatilisasi ammonia berkorelasi positif dengan pH tanah,
kandungan CaCO3, dan garam total, tetapi berorelasi negatif dengan kandungan
bahan organik, KTK, dan kandungan liat. Dari ketiga faktor yang berkorelasi
negatif, KTK merupakan faktor yang korelasinya sangat tinggi dengan volatilisasi
ammonia, sedangkan faktor pH tanah merupakan faktor yang dominan di antara
ketiga faktor yang berkorelasi positif. Menurut Zhenghu dan Honglang (2000)
bahan organik berpengaruh secara tidak langsung pada penurunan volatilisasi
ammonia melalui pengaruhnya terhadap penurunan pH tanah dan meningkatnya
KTK tanah karena adanya pembentukan berbagai asam-asam organik dan humus
selama proses dekomposisi bahan organik. Amonia yang dihasilkan dalam sistem
karbonat aquatik melibatkan reaksi berikut (Mikkelsen et al., 1978):
NH4+ + OH- (NH3)aq + H2O
NH4+ + HCO3- (NH3) aq + H2O + CO2
2NH4+ + CO32- 2(NH3) aq + H2O + CO2
Volatilisasi ammonia terjadi bila pH air genangan meningkat di atas pH
7,5 (Greenland, 1997). Hilangnya gas CO2 yang meningkat karena meningkatnya
suhu air genangan pada siang hari dapat menyebabkan pH meningkat. Akan
tetapi penyebab utama peningkatan pH dalam air genangan tanah sawah adalah
pertumbuhan alga atau adanya proses biologi yang berlawanan yaitu fotosintesis
perubahan tekanan parsial CO2 dalam air genangan, dan sistem karbonat ini sangat
menentukan pH air. Nilai pH air genangan ditentukan oleh konsentrasi CO2 dalam
air (Manahan, 1994). Sistem karbonat atau sistem CO2 - HCO3- - CO32- dalam air
digambarkan oleh reaksi berikut dan konstanta kesetimbangannya (Manahan,
1994):
CO2 + H2O HCO3- + H+ K1 = 4,45 x 10-7 (pK1 = 6,35)
HCO3- CO32- + H+ K2 = 4,69 x 10-11 (pK2 = 10,33)
Dari persamaan di atas, bila fotosintesis aktif maka akan terjadi penurunan
konsentrasi CO2 dalam sistem dan hal ini menyebabkan persentase fraksi mol
asam karbonat meningkat, akibatnya pH sistem meningkat. Tingkat perubahan
pH yang disebabkan oleh jasad renik ditentukan oleh jumlah, jenis dan aktivitas
organisme yang ada. Korelasi antara pH air dan sistem asam karbonat bersifat
kompleks dan tidak dapat digambarkan secara lengkap tanpa mempertimbangkan
sejumlah variabel. Dengan memperhatikan reaksi biokimia dari jasad renik
aquatik, reaksi yang paling sederhana adalah :
fotosintesis
nCO2 + nH2O (CH2O)n + nO2 respirasi
Setiap hari terjadi fluktuasi pH dalam air genangan dari 7,5 – 9,5 dan nilai pH
maksimum terjadi kira-kira pada pukul 14.00 dan menurun sepanjang sore hari.
Pola perubahan pH ini sesuai dengan siklus fotosintesis dan respirasi dari jasad
renik aquatik (Mikkelsen, 1987).
Amonia dan bentuk ionnya (NH4+) merupakan hasil dekomposisi bahan
organik tanah dan sisa-sisa tanaman yang terjadi dalam perairan alami.
Penggunaan pupuk N pada lahan sawah juga menyebabkan konsentrasi garam
N-NH4+ terlarut meningkat. Pupuk ammonium dalam air dapat berdisosiasi
langsung, atau seperti urea terdekomposisi melalui hidrolisis katalitik
menghasilkan ion-ion NH4+. Ion-ion NH4+, yang memiliki ikatan sangat lemah
dengan molekul air, dominan dalam air dengan pH di atas 7,2. Dengan
meningkatnya konsentrasi ion hidroksil (OH-) dalam air, maka terjadi peningkatan
perubahan ion NH4+ menjadi NH3 yang dapat menghilang dari air dalam bentuk
NH3 dari sumber N yang berbeda pada tanah liat tergenang, dan menyatakan
bahwa kehilangan NH3 pada dasarnya terjadi selama sembilan hari pertama
setelah pemberian pupuk N. Kehilangan tersebut kecil bila pH tanah di bawah
7,4. Percobaan lapang yang mereka lakukan menunjukkan bahwa kehilangan N
setelah pemberian 100 kg N/ha dengan cara disebar adalah sebesar 3,8% untuk
ammonium sulfat (ZA) dan 8,2% dengan pemberian urea. Menurut Vlek dan
Stumpe (1978) volatilisasi NH3 dari tanah yang dipupuk urea lebih besar daripada
tanah yang dipupuk ammonium sulfat. Hal ini terjadi karena hidrolisis urea dalam
tanah mendorong terciptanya lingkungan yang ideal untuk volatilisasi, yaitu
alkalinitas dan pH yang tinggi. Volatilisasi ammonia berkurang 50% bila pupuk
dimasukkan ke dalam tanah.
2.3.6. Nitrifikasi dan Denitrifikasi
Oksidasi biologi dari N-NH4+ menjadi N-NO3- (nitrifikasi) menghasilkan
konversi atau perubahan kation NH4+ yang relatif tidak mobil menjadi bentuk
anion (NO3-) yang lebih mobil, yang pada gilirannya anion ini rentan terhadap
denitrifikasi. Menurut Kakuda et al. (1999), denitrifikasi merupakan proses utama
kehilangan N dalam tanah sawah. Tanah tergenang merupakan lingkungan yang
ideal untuk denitrifikasi karena lingkungan tanah tergenang memiliki suatu
lapisan permukaan teroksidasi yang tipis yang di bawahnya adalah lapisan
tereduksi yang tebal. Lapisan tanah teroksidasi mendukung proses nitrifikasi dan
lapisan tanah tereduksi merupakan lapisan tanah yang kekurangan oksigen dan
menyediakan bahan organik yang mudah didekomposisi untuk mendukung proses
reduksi bentuk-bentuk N teroksidasi (denitrifikasi). Adanya lapisan zona aerob
dan anaerob dalam tanah tergenang, begitu juga dalam rhizosfer (karena adanya
bagian tanaman padi yang mengangkut O2 ke rhizosfer), memudahkan terjadinya
reaksi nitrifikasi-denitrifikasi. Sebagaimana diketahui bahwa akar-akar tanaman
tersebar dalam tanah permukaan dan tanah di bawah perm ukaan (subsurface).
Reaksi ini tampaknya terjadi secara serentak. Denitrifikasi dalam rhizosfer
dipengaruhi oleh metabolisme tanaman dan lingkungan tanah (Kakuda et al.,
1999). Hal ini didukung oleh adanya suplai C dari akar (Mahmood et al., 1997).
Eksudat senyawa organik oleh akar-akar yang hidup merangsang respirasi bakteri
berasal dari akar bila suplai C dari tanah terbatas (Prade dan Trolldenier, 1990).
Namun demikian, pertumbuhan tanaman padi juga berpengaruh terhadap
kehilangan N melalui denitrifikasi, yaitu bahwa serapan N oleh tanaman dapat
mengurangi jumlah N yang hilang melalui denitrifikasi.
Ion nitrat (NO3-) merupakan ion bermuatan negatif sehingga tidak dapat
dijerap oleh partikel tanah yang bermuatan negatif dan selanjutnya menjadi sangat
mobil dalam larutan. Bila ion nitrat tidak segera diasimilasi oleh tanaman atau
jasad renik (assimilatory nitrate reduction), atau hilang melalui pencucian, maka
ion nitrat berpotensi mengalami dissimilatory nitrogenous oxide reduction, suatu
istilah yang mengacu pada beberapa jalur mekanisme reduksi nitrat (Wiebe et al.,
1981), yang paling umum adalah reduksi nitrat menjadi ammonia dan
denitrifikasi. Jasad renik yang bertanggung jawab pada proses denitrifikasi dalam
tanah adalah bakteri heterotrof. Jasad renik ini membutuhkan oksida-oksida N
sebagai penerima elektron terakhir dan C-organik sebagai donor elektron, serta
kondisi anaerob. Denitrifikasi adalah proses reduksi bentuk-bentuk N mineral
teroksidasi menjadi gas nitrogen, terutama N2O dan N2, yang dilakukan oleh jasad
renik dalam kondisi anaerob, dimana nitrat (NO3-) bertindak sebagai penerima
elektron terakhir atau NO3- direduksi. Proses ini menyebabkan N-NO3- hilang
karena dikonversi menjadi gas N2O dan N2. Jalur pembentukan gas-gas tersebut
digambarkan sebagai berikut (Firestone, 1982; Ostrom et al., 2000) :
Denitrifikasi :
2 NO3- 2 NO2- 2 NO N2O N2
Nitrifikasi :
O2
2 NH4+ 2 NH2OH 2 (NOH) 2 NO 2 NO2
jalur 1 N2O jalur 2 NO2
Nitrifikasi – Denitrifikasi :
O2
2 NH4+ 2 NH2OH 2 (NOH) 2 NO 2 NO2