TOLERANSI BEBERAPA GENOTIPE KEDELAI TERHADAP
CEKAMAN KEKERINGAN
PIENYANI ROSAWANTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Toleransi Beberapa Genotipe Kedelai terhadap Cekaman Kekeringan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
PIENYANI ROSAWANTI. Toleransi Beberapa Genotipe Kedelai terhadap Cekaman Kekeringan. Dibimbing oleh MUNIF GHULAMAHDI dan NURUL KHUMAIDA.
Cekaman kekeringan menyebabkan pengaruh negatif terhadap pertumbuhan dan perkembangan tanaman sehingga terjadi penurunan pada produksi hasil tanaman. Kondisi kekeringan menyebabkan perubahan karakter anatomi, morfologi dan fisiologi genotipe kedelai. Tujuan penelitian ini adalah: (1) uji cepat untuk memilih genotipe yang toleran terhadap cekaman kekeringan secara in vitro, (2) uji genotipe kedelai yang toleran terhadap cekaman kekeringan secara ex vitro, (3) mempelajari karakter anatomi, morfologi dan fisiologi genotipe kedelai terhadap cekaman kekeringan, (4) mempelajari pengaruh genotipe kedelai pada kondisi kekeringan terhadap pertumbuhan dan komponen hasil, dan (5) mempelajari kerusakan akar tanaman pada saat kondisi kekeringan.
Penelitian ini terdiri atas 3 percobaan antara lain: Percobaan I, uji cepat secara in vitro beberapa genotipe kedelai terhadap cekaman kekeringan, dilakukan di Laboratorium Kultur Jaringan II AGH-IPB; Percobaan II, pertumbuhan dan perkembangan genotipe kedelai pada cekaman kekeringan, dilakukan di Rumah Kaca Cikabayan IPB dan Laboratorium Mikroteknik IPB serta Percobaan III, perubahan anatomi dan kerusakan akar tiga genotipe kedelai pada cekaman kekeringan, dilakukan di Laboratorium Mikroteknik IPB.
Bahan tanam yang digunakan pada percobaan I dan II adalah 10 genotipe kedelai yaitu Ratai, Seulawah, Slamet, Tanggamus, Wilis, GC 22-10, PG 57-1, SC 21-5, SC 39-1 dan SP 30-4, sedangkan pada percobaan III hanya 3 genotipe yaitu Wilis, PG 57-1 dan SC 39-1. Pada percobaan I perlakuan cekaman kekeringan dilakukan pada fase kecambah (umur 7 hari setelah tanam) selama 3 hari menggunakan Rancangan Acak Lengkap (RAL) dengan 3 ulangan. Pada percobaan II perlakuan cekaman kekeringan dilakukan pada fase vegetatif (21 hari setelah tanam) menggunakan Rancangan Acak Kelompok Lengkap (RAKL) dengan 3 ulangan. Percobaan III terdiri dari 2 pendekatan, yaitu mempelajari anatomi akar; dan pewarnaan kerusakan akar menggunakan bahan reaksi Schiff”s. Percobaan dirancang dalam Rancangan Acak Kelompok Lengkap (RAKL) dengan 3 ulangan.
Hasil penelitian pada percobaan I menunjukkan bahwa bahwa cekaman kekeringan dengan simulasi PEG menyebabkan perubahan karakter morfologi dan fisiologi tanaman kedelai. Karakter yang dapat dijadikan sebagai kriteria seleksi berdasarkan sidik lintas adalah rasio panjang akar-tajuk dan rasio klorofil a/b. Indeks sensitivitas pada kondisi cekaman kekeringan (PEG 10%) berdasarkan rasio bobot kering akar-tajuk mengelompokkan genotipe GC 22-10 dan SC 39-1 kedalam kategori genotipe agak toleran.
terkecil pada Wilis (26.8%) dan terbesar pada SC 39-1 (68.7%). Indeks sensitivitas pada kondisi cekaman kekeringan (PEG 20%) berdasarkan indeks panen mengelompokkan Wilis toleran; Ratai, Seulawah, Slamet, Tanggamus, GC 22-10, PG 57-1, SP 30-4 agak toleran; sedangkan SC 39-1 tergolong peka. Karakter yang dapat dijadikan sebagai kriteria seleksi berdasarkan sidik lintas adalah bobot kering daun, rasio panjang akar-tajuk, jumlah daun trifoliat, tebal daun, klorofil a, klorofil b, klorofil total, rasio klorofil a/b, prolin, jumlah polong hampa dan bobot biji.
Pada perobaan III, perlakuan cekaman kekeringan dengan simulasi PEG menyebabkan terjadinya perubahan anatomi dan fisiologi pada akar tanaman. Genotipe dan PEG berpengaruh terhadap ukuran korteks, stele dan xylem. PG 57-1 mengalami penurunan tebal korteks, diameter stele dan diameter xilem sebaliknya pada SC 39-1 terjadi peningkatan. Cekaman kekeringan (PEG 20%) juga dapat menimbulkan kerusakan pada membran akar yang ditunjukkan dengan terjadinya peroksida lipid.
Berdasarkan hasil penelitian, uji cepat secara in vitro dapat digunakan sebagai metode untuk mengetahui toleransi beberapa genotipe kedelai terhadap cekaman kekeringan berdasarkan karakter panjang akar, rasio panjang akar-tajuk dan kandungan klorofil b (uji-t α 1%).
SUMMARY
PIENYANI ROSAWANTI. Tolerance of Some Soybean Genotypes towards Drought Stress. Supervised by MUNIF GHULAMAHDI and NURUL KHUMAIDA.
Drought stress leads to a negative effect on plant growth and development, consequently, it gives bad effect on the production of crops – the decrease of production. Drought condition caused the changes in anatomical, morphological and physiological characters of soybean genotype. The purpose of this research were: (1) to do a rapid test for selecting genotypes that were tolerant to drought stress in vitro, (2) to test soybean genotypes that were tolerant to drought stress ex vitro, (3) to study the morphological and physiological characters of soybean genotypes to drought stress, (4) to study the effect of soybean genotypes to drought conditions on growth and yield components, and (5) to study the damage plant roots during drought conditions.
This research consists of three experiments: Experiment I, rapid test in vitro of several soybean genotypes to drought stress, was conducted in the Tissue Culture Laboratory II AGH-IPB; Experiment II, the growth and development of soybean genotypes to drought stress was conducted in the Cikabayan greenhouse IPB, and Experiment III, anatomical changes and root damage of three soybean genotypes to drought stress, was conducted in the Microtechnique Laboratory AGH-IPB.
Plant material used in experiment I and II were ten genotypes of soybean i.e. Ratai, Seulawah, Slamet, Tanggamus, Wilis, GC 22-10, PG 57-1, SC 21-5, SC 39-1 dan SP 30-4, whereas in experiment III was three genotypes i.e. Wilis, PG 57-39-1 and SC 39-1. Treatment in the first experiment was conducted at a germination phase (7 DAP) by PEG for 3 days, using a completely randomized design (CRD) with 3 replications. Treatment in the second experiment was conducted at a vegetative phase (21 DAP) using complete randomized block design (RAKL) with 3 replications. Treatment in the third experiment was conducted at a germination phase (7 DAP) by PEG for 3 days. The third experiment consisted of two approaches, i.e. studying the anatomical; and root damage by using the reagent Schiff 's. This experiment using complete randomized block design (RAKL) with 3 replications.
ratio of lenght root-shoot, trifoliat leaf number, leaf thickness, chlorophyll a, chlorophyll b, ratio chlorophyll a/b, prolin, empty pod number and seeds number. Based on index of drought sensitivity (PEG 20%) on harvest index indicated that Wilis was as tolerant; Ratai, Seulawah, Slamet, Tanggamus, GC 22-10, PG 57-1, SC 21-5 and SP 30-4 were as medium; while SC 39-1 was as sensitive.
The results of the third experiment showed that drought stress with PEG simulation caused the changes in anatomical and physiological characters of soybean plant roots. Genotype and PEG affected the size of the cortex, stele and xylem. PG 57-1 genotype showed the decrease of cortical thickness, diameter of stele and the diameter of xylem, on the other hand, in SC 39-1, there was an increase. Drought stress (PEG 20%) could also cause damage to the root membrane indicated by the occurrence of lipid peroxides.
Based on this research, a rapid test in vitro can be used as a method to determine the tolerance of some soybean genotypes to drought stress based on the character of root length, root-crown length ratio and chlorophyll b content (t-test α 1%).
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Agronomi dan Hortikultura
TOLERANSI BEBERAPA GENOTIPE KEDELAI TERHADAP CEKAMAN KEKERINGAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Toleransi Beberapa Genotipe Kedelai terhadap Cekaman Kekeringan
Nama : Pienyani Rosawanti
NIM : A 252120271
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Munif Ghulamahdi, MS Ketua
Dr Ir Nurul Khumaida, MSi Anggota
Diketahui oleh
Ketua Program Studi Agronomi dan Hortikultura
Dr Ir Maya Melati, MS, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc. Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu Wa Ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksankan sejak bulan Desember 2012 sampai Desember 2013 ini ialah cekaman kekeringan, dengan judul Toleransi Beberapa Genotipe Kedelai terhadap Cekaman Kekeringan.
Penulis menyampaikan penghargaan dan terima kasih kepada:
1 Prof Dr Ir Munif Ghulamahdi, MS dan Dr Ir Nurul Khumaida, MSi selaku komisi pembimbing atas segala bimbingan, saran dan kritikan selama penyusunan proposal, pelaksanaan penelitian dan penulisan tesis.
2 Dr Ir Trikoesoemaningtyas, MSc selaku penguji luar komisi pada ujian tesis dan Dr Ir Endah Retno Palupi, MSc selaku penguji dari Program Studi Agronomi dan Hortikultura atas saran-sarannya untuk perbaikan tesis.
3 DIKTI atas beasiswa dan bantuan penelitian yang diberikan kepada penulis untuk menempuh S2 di IPB.
4 Seluruh staf pengajar pada Program Studi Agronomi dan Hortikultura, yang telah mendidik dan membekali penulis tentang ilmu agronomi dan hortikultura. 5 Orangtua (Bapak Drs Daryono dan Ibu Retno Mulatnuwati), kakak dan
adik-adikku atas doa, kasih sayang, semangat dan dukungan yang terus diberikan. 6 Laboratorium beserta seluruh staf (Laboratorium Kultur Jaringan dan
Mikroteknik-Fakultas Pertanian IPB) atas segala materi dan fasilitas yang diberikan kepada penulis.
7 Laboratorium Pemuliaan Tanaman/Tim Pemulia Tanaman yang telah menyediakan sebagian bahan tanaman pada penelitian ini.
8 Seluruh rekan S2 dan S3 mayor AGH, PBT dan ITB atas kebersamaan selama penulis menempuh pendidikan dan penelitian di Sekolah Pascasarjana IPB. 9 Serta teman-teman lain yang tidak dapat penulis sebutkan satu persatu atas
dukungan dan semangat yang diberikan kepada penulis dalam penyelesaian studi dan tesis ini.
Akhir kata, semoga karya ilmiah ini dapat menjadi ilmu dan amalan baik bagi penulis dan bermanfaat bagi kita semua.
DAFTAR ISI
DAFTAR ISI vii
DAFTAR TABEL viii
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN x
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
Hipotesis Penelitian 2
Ruang Lingkup Penelitian 3
2 TINJAUAN PUSTAKA 6
3 UJI CEPAT (EARLY SCREENING) BEBERAPA GENOTIPE KEDELAI TERHADAP CEKAMAN KEKERINGAN SECARA
IN VITRO 10
Abstrak 10
Pendahuluan 11
Bahan dan Metode 11
Hasil dan Pembahasan 13
4 PERTUMBUHAN DAN PERKEMBANGAN GENOTIPE KEDELAI
PADA CEKAMAN KEKERINGAN 26
Abstrak 26
Pendahuluan 27
Bahan dan Metode 27
Hasil dan Pembahasan 29
5 PERUBAHAN ANATOMI DAN KERUSAKAN AKAR TIGA
GENOTIPE KEDELAI PADA CEKAMAN KEKERINGAN 52
Abstrak 52
Pendahuluan 52
Bahan dan Metode 53
Hasil dan Pembahasan 54
PEMBAHASAN UMUM 60
SIMPULAN UMUM 62
DAFTAR PUSTAKA 63
DAFTAR TABEL
1 Rekapitulasi sidik ragam karakter 10 genotipe terhadap perlakuan PEG
pada akhir percobaan di laboratorium 13
2 Respon panjang kecambah, panjang akar primer dan jumlah rambut akar kedelai pada perlakuan genotipe dan konsentrasi PEG 14 3 Respon rasio panjang akar-kecambah dan bobot kering kecambah 10
genotipe kedelai pada perlakuan genotipe dan konsentrasi PEG 16 4 Respon bobot kering akar dan rasio bobot kering akar-kecambah 10 7 Korelasi antar peubah pada percobaan in vitro 20 8 Pengaruh langsung dan tidak langsung antara peubah terhadap
kandungan klorofil total pada kondisi cekaman kekeringan
21 9 Pemilihan karakter untuk kriteria seleksi kecambah kedelai toleran
kekeringan
22 10 Indeks sensitivitas kekeringan (S) 10 genotipe kedelai dengan
perlakuan cekaman kekeringan PEG 6000 (10%)
23 11 Indeks sensitivitas kekeringan (S) 10 genotipe kedelai dengan
perlakuan cekaman kekeringan PEG 6000 (20%) 24 12 Rekapitulasi sidik ragam karakter 10 genotipe kedelai terhadap
perlakuan PEG di rumah kaca 30
13 Respon tinggi tajuk 10 genotipe kedelai 31
14 Pengaruh konsentrasi PEG 6000 terhadap peubah tinggi tajuk, panjang
akar primer dan jumlah akar lateral 31
15 Interaksi genotipe dan konsentrasi PEG terhadap peubah jumlah akar lateral kedelai
32 16 Pengaruh konsentrasi PEG 6000 terhadap peubah rasio panjang
akar-tajuk, bobot kering daun, bobot kering akar dan rasio bobot kering akar-daun kedelai
33 17 Interaksi genotipe dan konsentrasi PEG terhadap rasio panjang
akar-tajuk kedelai
33 18 Interaksi genotipe dan konsentrasi PEG terhadap peubah bobot kering
daun kedelai (g)
34 19 Interaksi genotipe dan konsentrasi PEG terhadap peubah bobot kering
akar kedelai (g)
34 20 Respon rasio bobot kering akar-daun 10 genotipe kedelai 35 21 Respon klorofil a, klorofil b, klorofil total (μmol g-1) dan rasio klorofil
a/b daun kedelai
DAFTAR TABEL (lanjutan)
24 Pengaruh konsentrasi PEG 6000 terhadap peubah jumlah daun trifoliat, luas daun, tebal daun dan jumlah trikoma kedelai
39 25 Pengaruh genotipe terhadap luas daun spesifik kedelai 40 26 Interaksi genotipe dan konsentrasi PEG terhadap peubah tebal daun
(cm) kedelai
41 27 Interaksi genotipe dan konsentrasi PEG terhadap peubah jumlah
trikoma (n/mm²) kedelai
41 28 Interaksi genotipe dan konsentrasi PEG terhadap peubah jumlah
stomata dan kerapatan stomata daun kedelai 42
29 Pengaruh konsentrasi PEG 6000 terhadap peubah jumlah polong isi, jumlah polong hampa, jumlah biji, bobot biji dan indeks panen kedelai 43 30 Interaksi genotipe dan konsentrasi PEG terhadap peubah jumlah biji
per tanaman
44 31 Interaksi genotipe dan konsentrasi PEG terhadap peubah bobot biji per
tanaman (g)
44 32 Interaksi genotipe dan PEG terhadap peubah indeks panen 45 33 Korelasi antara peubah pada percobaan di rumah kaca 48 34 Pengaruh langsung dan tidak langsung antara peubah terhadap indeks
panen pada kondisi cekaman kekeringan 49
35 Pemilihan karakter untuk seleksi tanaman kedelai toleran kekeringan 50 36 Indeks sensitivitas kekeringan (IS) 10 genotipe kedelai dengan
perlakuan cekaman kekeringan PEG 6000 (20%) pada indeks panen 51 37 Interaksi genotipe dan konsentrasi PEG terhadap peubah tebal korteks
akar kedelai
54 38 Interaksi genotipe dan konsentrasi PEG terhadap terhadap peubah
diameter pendek dan panjang stele akar kedelai 56 39 Interaksi genotipe dan konsentrasi PEG terhadap peubah diameter
pendek dan panjang xylem akar keelai 56
DAFTAR GAMBAR
1 Kerangka berpikir penelitian toleransi beberapa genotipe kedelai
terhadap cekaman kekeringan 4
2 Diagram alir kegiatan penelitian toleransi beberapa genotipe kedelai
terhadap cekaman kekeringan 5
3 Rasio klorofil a/b genotipe kedelai pada perlakuan PEG 0% dan 20% 39 4 Kandungan prolin daun genotipe kedelai pada perlakuan PEG 0% dan
20% 40
5 Keragaan anatomi akar kedelai 55
6 Penampilan akar genotipe kedelai dengan perlakuan PEG 0% dan 20% 57 7 Penampang melintang akar genotipe kedelai dengan perlakuan PEG
DAFTAR LAMPIRAN
1 Analisis klorofil 71
2 Analisis prolin 72
3 Rumus indeks luas daun 73
4 Pengukuran tebal daun 74
5 Menghitung jumlah bulu daun 75
6 Menghitung jumlah dan kerapatan stomata 76
7 Deskripsi kedelai varietas Tanggamus dan Wilis 77 8 Deskripsi kedelai varietas Ratai dan Seulawah 78
9 Deskripsi kedelai varietas Slamet 79
10 Deskripsi kedelai genotipe GC 22-10, PG 57-1, SC 21-5, SC 39-1 dan
SP-30-4 80
11 Potensi hasil genotipe kedelai dengan perlakuan cekaman kekeringan
simulasi PEG 20% di tahap fase vegetatif 81
12 Dokumentasi percobaan in vitro 82
13 Keragaan 10 genotipe kedelai (31 hst) 83
1 PENDAHULUAN
Latar Belakang
Kedelai (Glycine max (L.) Merr.) merupakan salah satu komoditas tanaman pangan yang penting dalam mendukung ketahanan pangan di Indonesia. Kedelai dimanfaatkan sebagai bahan pangan, bahan baku industri, pakan ternak dan sebagai food therapy (Pitojo 2003). Kebutuhan kedelai dari tahun ke tahun terus meningkat. Permintaan kedelai meningkat pesat seiring dengan laju pertambahan penduduk dan meningkatnya kesadaran pentingnya nilai gizi bagi kesehatan. Tahun 2012-2014, rata-rata kebutuhan kedelai nasional sebesar 2.59 juta ton per tahun sedangkan rata-rata produksi dan produktivitas nasional per tahun, berturut-turut hanya sebesar 800.00 ton/ha dan 1.5 ton/ha (Bappenas 2014). Hal ini berarti terdapat kesenjangan antara produksi dengan kebutuhan. Kondisi tersebut mendorong pemerintah untuk meningkatkan produksi kedelai dalam negeri melalui strategi peningkatan produktivitas dan perluasan areal tanam terutama melalui pemanfaatan lahan–lahan marginal antara lain pada lahan kering.
Sejak masa pertumbuhan sampai pengisian polong, tanaman kedelai sangat memerlukan air. Waktu kritis terhadap kebutuhan air adalah pada masa awal pertumbuhan, pembungaan dan masa pengisian polong (Adisarwanto 2005). Ketersediaan air yang rendah menyebabkan terjadinya cekaman kekeringan dan dapat mengganggu pertumbuhan dan perkembangan tanaman kedelai. Penggunaan irigasi pada budidaya tanaman kedelai kurang ekonomis, maka diperlukan arah pengembangan genotipe kedelai yang toleran terhadap cekaman kekeringan. Usaha untuk mengurangi resiko penurunan hasil akibat cekaman kekeringan dapat dilakukan dengan menggunakan genotipe yang toleran terhadap kekeringan. Salah satu metode pemuliaan tanaman untuk mendapatkan suatu genotipe yang diharapkan adalah dengan melakukan seleksi. Seleksi dengan perlakuan cekaman kekeringan pada beberapa genotipe dilakukan untuk mendapatkan genotipe yang toleran kekeringan dan berdaya hasil tinggi.
Program pemuliaan tersebut dapat didukung dengan adanya informasi mengenai karakter morfologi dan fisiologi yang berkaitan erat dengan mekanisme toleransi terhadap kekeringan sehingga proses seleksi dapat berjalan lebih efisien dan efektif. Informasi tersebut dapat menjadi pengetahuan yang sangat bermanfaat untuk pengembangan dan peningkatan hasil kedelai di lahan-lahan kering non irigasi di Indonesia. Usaha perakitan genotipe kedelai yang toleran terhadap cekaman kekeringan sedang giat dilakukan. Untuk keperluan tersebut perlu dilakukan uji cepat genotipe kedelai terhadap cekaman kekeringan baik melalui percobaan in vitro maupun di rumah kaca. Screening awal dengan menggunakan metode cepat dapat dimanfaatkan untuk deteksi dini toleransi cekaman kekeringan dan mendapatkan karakter seleksi untuk program pemuliaan tanaman.
tinggi. Pemilihan metode/uji cepat yang efektif merupakan tahap yang penting dalam program pemuliaan untuk perbaikan tanaman. Metode yang sederhana tetapi efektif akan mempercepat perolehan hasil. Teknik penapisan dini perlu dikembangkan untuk menentukan genotipe kedelai yang toleran kekeringan. Metode yang baik diharapkan murah, cepat pelaksanaannya dan handal untuk menapis genotipe sekaligus dalam jumlah banyak dan dapat memisahkan genotipe toleran dan peka. Pengembangkan metode penapisan yang lebih efisien sangat diperlukan sehingga dapat dimanfaatkan untuk penapisan cekaman kekeringan pada populasi tanaman yang besar dalam ruang terbatas.
Respon yang terjadi dapat di uji dengan menggunakan indeks kekeringan untuk memisahkan antara genotipe yang peka dan toleran. Indeks kekeringan dengan berbagai kategori berdasarkan kehilangan hasil dalam kondisi kekeringan dibandingkan dengan kondisi normal telah digunakan untuk skrining genotipe toleran kekeringan pada gandum (Akcura et al. 2011) dan jagung (Moradi et al. 2012). Tingkat toleransi tanaman terhadap cekaman dapat diduga berdasarkan besarnya penurunan relatif berbagai peubah pertumbuhan dan hasil yang dipanen dari tanaman dalam kondisi tanpa cekaman dan dalam kondisi tercekam. Pendekatan ini telah digunakan oleh peneliti lain untuk mengidentifikasi tanaman yang toleran cekaman kekeringan, seperti pada kedelai (Sunaryo 2002) dan kacang tanah (Riduan et al. 2005).
Metode uji cepat untuk tanaman toleran cekaman abiotik dapat dilakukan pada fase kecambah dan vegetatif (awal pertumbuhan vegetatif). Metode seleksi untuk cekaman kekeringan dengan menggunakan simulasi PEG yang telah dikembangkan adalah perlakuan kekeringan di lapangan (Farid 2003; Adisyahputra et al. 2005). Metode tersebut mempunyai kelemahan, antara lain: sulitnya menjaga keseragaman tekanan seleksi yang diberikan dan lamanya waktu yang diperlukan untuk menyelesaikan seleksi.
Oleh karena itu pengembangan metode uji cepat terus dikembangkan dengan melakukan uji beberapa genotipe tanaman pada berbagai konsentrasi PEG dan berbagai tahap pertumbuhan yang berbeda.
Tujuan Penelitian
1 Uji cepat untuk memilih genotipe yang toleran terhadap cekaman kekeringan secara in vitro.
2 Uji genotipe kedelai yang toleran terhadap cekaman kekeringan secara ex vitro. 3 Mempelajari karakter anatomi, morfologi dan fisiologi dan genotipe kedelai
terhadap cekaman kekeringan.
4 Mempelajari pengaruh genotipe kedelai pada kondisi kekeringan terhadap pertumbuhan dan komponen hasil.
5 Mempelajari kerusakan akar tanaman pada saat kondisi kekeringan. Manfaat Penelitian
percobaan ini dapat mengembangkan metode cepat secara in vitro untuk menguji genotipe kedelai toleran kekeringan pada awal fase vegetatif.
Hipotesis
1 Uji cepat secara in vitro dapat digunakan sebagai metode untuk mengetahui toleransi genotipe kedelai terhadap cekaman kekeringan.
2 Uji secara in vitro memiliki kesesuaian yang tinggi dengan seleksi cepat secara ex vitro.
3 Terdapat karakter anatomi, morfologi dan fisiologi yang berbeda pada kedelai terhadap cekaman kekeringan.
4 Terdapat perbedaan keragaan/respon kedelai pada kondisi kekeringan terhadap pertumbuhan dan komponen hasil.
5 Terdapat kerusakan pada membran akar pada saat kondisi kekeringan. Ruang Lingkup Penelitian
Salah satu program perbaikan varietas kedelai khususnya untuk lahan kering adalah pengembangan varietas yang toleran terhadap kekeringan. Untuk mendukung program tersebut diperlukan adanya informasi berbagai respon tanaman berkaitan erat dengan mekanisme toleransi terhadap kekeringan. Selain itu perlu dilakukan uji cepat genotipe kedelai terhadap cekaman kekeringan pada berbagai percobaan, baik melalui percobaan in vitro maupun di rumah kaca. Adanya screening awal dengan menggunakan metode cepat dapat dimanfaatkan untuk deteksi dini toleransi cekaman kekeringan. Informasi tentang pengaruh perlakuan cekaman kekeringan pada pertumbuhan vegetatif terhadap pertumbuhan dan hasil kedelai dapat berguna untuk menapis sifat toleransi genotipe kedelai terhadap cekaman kekeringan. Pemilihan genotipe yang toleran terhadap cekaman kekeringan harus merupakan genotipe yang mempunyai daya hasil yang tinggi.
Kerangka berpikir penelitian disajikan pada Gambar 1.
2 TINJAUAN PUSTAKA
Morfologi Tanaman Kedelai
Kedelai (Glycine max (L.) Merill termasuk ke dalam divisi Spermatophyta, kelas Dicotyledoneae, ordo Rosales, famili Leguminoseae, genus Glycine, dan spesies Glycine max (L.) Merill. Batang kedelai memiliki tinggi 30-100 cm, memiliki 3-6 cabang. Tipe pertumbuhan batang dibedakan menjadi determinate, indeterminate dan semideterminate. Tipe determinate memiliki karakteristik tinggi tanaman pendek dampai sedang, ujung batang hampir sama besar dengan batang bagian tengah, daun teratas sama besar dengan daun batang tengah dan berbunga serempak. Tipe indeterminate memiliki karakteristik tinggi tanaman sedang sampai tinggi, ujung batang lebih kecil dari bagian tengah, agak melilit dan beruas panjang, daun teratas lebih kecil dari daun batang tengah dan pembungaan terjadi secara bertahap dari bagian pangkal ke bagian atas. Tipe semideterminate memiliki karakteristik antara kedua tipe lainnya.
Pada buku (node) pertama tanaman yang tumbuh dari biji terbentuk sepasang daun tunggal. Selanjutnya, pada semua buku di atasnya terbentuk satu daun bertiga. Daun tunggal memiliki tangkai pendek dan daun bertiga memiliki tangkai agak panjang. Masing-masing daun berbentuk oval, tipis dan berwarna hijau. Permukaan daun berbulu halus (trikoma) pada kedua sisi. Tunas atau bunga akan muncul pada ketik daun. Setelah tua daun menguning dan gugur, dimulai dari daun yang menempel di bagian bawah batang. Buah kedelai berbentuk polong, tiap tanaman mampu menghasilkan 100-250 polong. Polong kedelai berbulu dan berwarna kuning kecoklatan atau abu-abu. Dalam polong terdapat 1-4 biji yang berbentuk bulat, lonjong, bundar, bulat agak pipih berwarna kuning, hitam, hijau dan coklat. Akar tanaman kedelai berupa akar tunggang tumbuh ke arah bawah yang membentuk cabang-cabang akar yang berkembang menyamping (horizontal) tidak jauh dari permukaaan akar. Jika kelembaban turun, akar akan berkembang lebih ke dalam agar dapat menyerap air dan unsur hara.
Pada pertumbuhan dan perkembangannya tanaman kedelai memerlukan tanah yang memiliki aerasi, drainase dan kemampuan menahan air yang cukup baik. Kelembaban tanah berpengaruh terhadap pertumbuhan tanaman sejak perkecambahan benih hingga tanaman tua.
Pengaruh Cekaman Kekeringan terhadap Pertumbuhan Tanaman
transpirasi serta fotosintesis. Rendahnya kandungan air tanah dapat membatasi penyerapan unsur hara oleh akar tanaman (Marschner 1995).
Cekaman kekeringan pada tanaman dapat menyebabkan turunnya potensial air dan rendahnya tekanan turgor. Pertumbuhan sel, fotosintesis dan produktivitas tanaman sangat dipengaruhi oleh potensial air (Taiz dan Zeiger 2002). Tekanan turgor yang tinggi dibutuhkan untuk pemanjangan sel, sehingga adanya cekaman air akan menghambat pertumbuhan dan perkembangan sel tanaman. Laju pertumbuhan sel-sel tanaman dan efisiensi proses fisiologisnya mencapai tingkat tertinggi bila sel-sel berada pada turgor maksimum ( Fitter dan Hay 1981).
Fitter dan Hay (1981); Gardner et al. 1991 mengemukakan bahwa daun yang hidup biasanya mempunyai potensial air yang lebih besar dari -15 bar. Bila potensial air daun turun sampai -15 bar dan tetap sebesar itu maka transpirasi akan berkurang dengan menutupnya stomata, yang biasanya diikuti dengan pelayuan sementara daun. Batas ambang potensial air pada daun kedelai sekitar -1,02 Mpa (-10,2 bar) (Lei et al. 2006). Di bawah itu hasil fotosintesis pada daun akan berkurang. Laranjo et al. (2006) menyatakan bahwa potensial air daun dan fotosíntesis menurun pada varietas kacang almond yang dalam kondisi tidak di airi.
Taiz dan Zeiger (2002) mengemukakan bahwa kekurangan air dapat menyebabkan penurunan kandungan air relatif daun dan bobot kering tanaman. Peningkatan hasil tanaman salah satunya ditentukan oleh adanya peningkatan luas daun dan hasil fotosintesis per area luas daun (Gardner et al. 1991; Marschner 1995). Cekaman kekeringan dapat menghambat sintesis karbohidrat karena terhambatnya proses fotosintesis (Kozlowski 1968).
Cekaman kekeringan merupakan salah satu kondisi lingkungan yang dapat mempengaruhi pertumbuhan dan produktivitas tanaman. Kekeringan dapat menyebabkan perubahan anatomi, morfologi, fisiologis, biokimia dan molekuler pada tanaman. Kemampuan tanaman untuk beradaptasi terhadap cekaman kekeringan tergantung pada intensitas dan periode cekaman, fase pertumbuhan dan genotipe tanaman (Kalefetoglu dan Ekmekci 2005). Respon tanaman terhadap cekaman kekeringan berbeda-beda tergantung pada lama, intensitas cekaman, spesies tanaman dan tahap pertumbuhan tanaman (Kusvuran 2012).
Tanaman kedelai yang mengalami kekeringan pada fase vegetatif mengalami penurunan pertumbuhan dan perkembangan yang sangat besar (Aboyami 2008), seperti dengan adanya penurunan tinggi tanaman, jumlah nodus, panjang akar, bobot kering akar dan tajuk (Riduan 2005). Ini merupakan strategi konservatif untuk mempertahankan penggunaan energi, dimana tanaman akan mengembangkan respon yang lebih komplek untuk perbaikan toleransi terhadap periode kekurangan air lebih lanjut (Kron et al. 2008).
Pada saat terjadi cekaman kekeringan, tanaman lebih banyak mengembangkan sistem perakaran (Lynch 2007). Sel-sel akar mengalami perubahan antara lain dengan meningkatkan atau mengurangi jumlah maupun ukuran dalam menghadapi cekaman kekeringan.
Cekaman kekeringan juga dapat meningkatkan kandungan peroksida lipid. Peroksida lipid merupakan peristiwa auto oksidasi dimana lipid membran mengalami kelebihan oksigen radikal bebas (superoksida). Peroksidasi lipid merupakan gejala yang paling jelas dari kerusakan pada sel dan jaringan tanaman (Beltagi et al. 2013). Malondialdehyde (MDA) merupakan produk akhir dari peroksida lipid dan keberadaannya bisa menunjukkan tingkat kerusakan yang terjadi pada tanaman. Tingkat kerusakan pada sel akar akibat peroksida lipid berbeda untuk tiap spesies, bahkan tiap varietas dalam satu spesies. Pada varietas jagung yang peka terhadap cekaman kekeringan mengalami peroksidasi lipid lebih tinggi daripada varietas yang toleran (Valentovic et al. 2006).
Mekanisme Toleransi Tanaman terhadap Cekaman Kekeringan
Sangat penting bagi tanaman dari seluruh spesies untuk menghindarkan diri dari cekaman kekeringan atau untuk mengembangkan adaptasi secara anatomi, morfologi dan fisiologi agar dapat mentolerir cekaman kekeringan (Fitter dan Hay 1981). Tiap varietas tanaman memiliki reaksi yang sangat kompleks dalam menghadapi cekaman kekeringan yang ditunjukkan oleh perubahan morfologi dan fisiologi tanaman yang berbeda. Ada dua macam toleransi tanaman dalam menghadapi cekaman kekeringan yaitu:
1 Dehydration avoidance, yaitu kemampuan tanaman yang tetap menjaga potensial jaringan dengan meningkatkan penyerapan air atau menekan kehilangan air. Pada mekanisme ini biasanya tanaman mempunyai kemampuan untuk meningkatkan sistem perakaran, regulasi stomata, pengurangan absorbsi radiasi dengan pembentukan lapisan lilin, bulu yang tebal dan penurunan permukaan evapotranspirasi melalui penyempitan daun serta pengguguran daun tua.
2 Dehydration tolerance, yaitu kemampuan tanaman untuk menjaga tekanan turgor sel dengan menurunkan potensial airnya melalui akumulasi solut seperti gula, asam amino dan prolin.
PEG untuk Simulasi Lingkungan Cekaman Kekeringan
Simulasi lingkungan yang mengalami cekaman kekeringan dapat dilakukan dengan perlakuan pemberian PEG (poly-ethylene glycol). Simulasi cekaman kekeringan banyak dilakukan dengan menggunakan larutan osmotikum yang dapat mengontrol potensial air dalam media tanam. PEG merupakan bahan yang terbaik untuk mengontrol potensial air karena diserap tanaman sehingga tidak menyebabkan keracunan pada tanaman (Verslues et al. 2006). PEG adalah senyawa insert non ionik dan polimer dari etylene oxyde dengan rumus HCOH2 (CH2OCH2)nCH2OH;n adalah banyaknya grup oksi etilen. Senyawa ini tidak mudah dipecah oleh senyawa hidup sehingga tidak bersifat toksid. PEG memiliki berat molekul 3.000-20.000 yang dapat larut sempurna dalam air (Mexal et al. 1975).
Penggunaan PEG yang dilarutkan dalam air dapat digunakan untuk meniru besarnya potensial air (Michel dan Kaufmann 1973), dengan adanya kekuatan matriks sub unit etilen oksida pada polimernya, dimana molekul H2O akan tertarik ke atom oksigen pada sub unit etilen oksida melalui ikatan hidrogen (Steuter 1981). Total massa atau sub unit (-CH2-O-CH2-) dalam rantai polimer PEG merupakan faktor penting yang mengontrol besarnya penurunan potensial air. Penggunaan PEG 6000 dipilih karena mempunyai daya kerja yang lebih baik pada tanaman dibanding PEG dengan berat molekul yang lebih rendah (Kaufmann dan Eckard 1971; Michel 1971). PEG 6000 mempunyai berat molekul yang cukup besar sehingga tidak dapat masuk ke dalam dinding sel tanaman (Chazen dan Neumann 1994). Semakin pekat konsentrasi PEG, semakin banyak zat terlarut yang menahan masuknya air ke dalam jaringan tanaman, akibatnya akar tanaman semakin sulit untuk menyerap air. Keunggulan sifat PEG tersebut memungkinkan PEG dapat digunakan sebagai alternatif dalam seleksi kedelai pada kondisi cekaman kekeringan pada fase perkecambahan dan fase vegetatif.
3 UJI CEPAT (
AN
EARLY SCREENING
) BEBERAPA
GENOTIPE KEDELAI TERHADAP CEKAMAN
KEKERINGAN SECARA
IN VITRO
Abstrak
Pengembangan uji cepat (an early screening) untuk toleransi kekeringan pada kedelai bertujuan untuk memisahkan genotipe toleran dan peka. Kunci untuk uji cepat yang efisien adalah kemampuan untuk menyaring sejumlah besar bahan tanaman dalam waktu yang singkat. Tujuan dari percobaan ini adalah untuk melakukan uji cepat untuk memilih genotipe kedelai secara in vitro dan mempelajari karakter morfologi dan fisiologi terhadap cekaman kekeringan pada fase kecambah. Percobaan dilaksanakan di Laboratorium Kultur Jaringan II AGH-IPB, menggunakan sepuluh genotipe kedelai (Ratai, Seulawah, Slamet, Tanggamus, Wilis, GC 22-10, PG 57-1, SC 21-5, SC 39-1 dan SP 30-4) dan PEG (0%, 10% dan 20%). Hasil percobaan menunjukkan bahwa cekaman kekeringan dengan simulasi PEG menyebabkan perubahan karakter morfologi dan fisiologi tanaman kedelai. Karakter yang dapat dijadikan sebagai kriteria seleksi berdasarkan sidik lintas adalah rasio panjang akar-tajuk dan rasio klorofil a/b. Indeks sensitivitas pada cekaman kekeringan (PEG 10%) berdasarkan rasio bobot kering akar-tajuk mengelompokkan genotipe GC 22-10 dan SC 39-1 kedalam kategori genotipe agak toleran.
Kata kunci: fase kecambah, indeks sensitivitas, PEG, sidik lintas, toleran
A QUICK TEST (AN EARLY SCREENING) OF SOME SOYBEAN GENOTYPES TOWARD DROUGHT STRESS IN VITRO
Abstract
The development of a quick test (an early screening) for the tolerance of drought stress in soybean aims to screening the tolerant and sensitive genotypes. The key of the efficient a quick test is the ability to screen of large amounts for the plant material in the short time. The purpose of this experiment were to do a quick test for selecting genotypes that were tolerant to drought stress in vitro and to study the anatomical and physiological characters of soybean genotypes to drought stress at a germination phase. This experiment was conducted in the Tissue Culture Laboratory II AGH-IPB using ten genotypes of soybean (Ratai, Seulawah, Slamet, Tanggamus, Wilis, GC 22-10, PG 57-1, SC 21-5, SC 39-1, SP 30-4) and PEG (0%, 10%, 20%). The results showed that drought stress with PEG simulation caused the changes in morphological and physiological characters of soybean. The characters which could be use to be as selection criteria base on path analysis were root-shoot lenght ratio and chlorophyll b content. Based on index of drought sensitivity (PEG 10%) on root-shoot dry weight ratio indicated that GC 22-10 and SC 39-1 were as medium tolerant.
PENDAHULUAN
Pengembangan genotipe kedelai toleran terhadap cekaman kekeringan sangat diperlukan untuk pengembangan kedelai pada lahan-lahan dengan kondisi dan lingkungan yang tidak dapat memenuhi ketersediaan air yang cukup. Seleksi terhadap genotipe kedelai merupakan salah satu langkah yang baik untuk mengetahui genotipe kedelai yang tahan terhadap cekaman kekeringan. Uji cepat berdasarkan sifat-sifat morfologi dan fisiologi yang berkaitan dengan ketahanan terhadap cekaman kekeringan akan memberikan harapan bagi perbaikan genetik tanaman kedelai di Indonesia. Mekanisme adaptasi tanaman kedelai terhadap intensitas cekaman kekeringan perlu dipelajari untuk memperoleh karakter-karakter yang berkaitan erat dengan kriteria seleksi tanaman. Untuk mengatasi masalah biaya dan waktu, maka diperlukan adanya metode uji cepat. Metode uji ini berguna untuk memperoleh kriteria seleksi tanaman yang dilihat melalui mekanisme adaptasi tanaman.
Uji cepat toleransi kedelai secara in vitro banyak kelebihan antara lain waktu yang singkat dan cepat, ruang yang diperlukan kecil, mudah untuk dikendalikan dan tidak dipengaruhi oleh kondisi luar yang tidak stabil. Beberapa percobaan in vitro dengan menggunakan PEG pada beberapa genotipe kedelai telah banyak dilakukan (Sunaryo 2002; Kosmiatin et al. 2005; Kosturkova et al. 2008; Sakthivelu et al. 2008). Percobaan in vitro dengan menggunakan PEG juga dilakukan pada beberapa tanaman lain yaitu pada beberapa genotipe kacang tanah (Susilawati 2003) dan kacang moth (Vigna aconitifolia) (Soni et al. 2011.) Diharapkan dengan adanya percobaan ini dapat mengembangkan metode cepat secara in vitro untuk seleksi genotipe kedelai toleran kekeringan pada awal fase vegetative. Tujuan percobaan ini untuk melakukan uji cepat untuk memilih beberapa genotipe kedelai yang tahan terhadap cekaman kekeringan secara in vitro serta mempelajari karakter morfologi dan fisiologi beberapa genotipe kedelai terhadap cekaman kekeringan.
BAHAN DAN METODE
Bahan Tanam
Bahan tanaman yang digunakan adalah 10 genotipe kedelai yang terdiri dari 5 varietas nasional yaitu: Ratai, Seulawah, Slamet, Tanggamus, Wilis dan 5 galur silangan Ceneng, Godek, Slamet, Pangrangro, yaitu: GC 22-10, PG 57-1, SC 21-5, SC 39-1 dan SP 30-4.
Metode Penelitian
Rancangan Percobaan
(Mexal 1975). Perlakuan diulang sebanyak tiga kali. Jumlah satuan percobaan adalah 90. Satu satuan percobaan terdiri dari 2 botol masing-masing terdapat 3 benih sehingga jumlah keseluruhan tanaman adalah 540 tanaman. Penelitian dilakukan di Laboratorium Kultur Jaringan II Departemen Agronomi dan Hortikultura IPB.
Prosedur Percobaan
Pembuatan Larutan PEG 6000
Larutan PEG dibuat dengan melarutkan kristal PEG 6000 dengan larutan 0.5 MS lalu ditambah air sampai volumenya mencapai 1 liter. Banyaknya PEG 6000 yang dilarutkan disesuaikan dengan perlakuan (konsentrasi PEG) yang dibutuhkan. Misalnya untuk membuat larutan 10% PEG dilakukan dengan cara melarutkan 100 gram kristal PEG 6000 + larutan 0,5 MS + aquades steril sampai mencapai volume 1 liter. Kemudian larutan tersebut di autoclave selama 30 menit. Persiapan Bahan Tanam
Sebelum penanaman benih dilakukan sterilisasi terhadap benih dan semua peralatan yang akan digunakan di ruang steril untuk mencegah kontaminasi. Sterilisasi semua peralatan di dalam autoclave selama 1 (satu) jam. Sterilisasi permukaan benih dilakukan dengan cara merendam benih kedelai dalam larutan Bayclin 10 ml selama 5 menit, lalu dikocok dengan shaker selama 10 menit kemudian dicuci dengan air steril (aquades) sebanyak dua kali.
Setelah itu benih dikecambahkan dalam botol dengan media air steril dan dibiarkan tumbuh sampai mempunyai daun terbuka (± 10 hari setelah tanam). Benih yang telah berkecambah dipindahkan ke dalam botol yang telah diberi kertas saring pada dasarnya dan telah berisi media MS dan larutan PEG sesuai dengan masing-masing konsentrasi. Setelah itu semua botol yang telah diaplikasikan, dipindahkan ke dalam ruang kultur dan dilakukan pengamatan untuk mengamati pertumbuhannya selama 3 hari.
Pengamatan (dilakukan pada akhir percobaan) meliputi:
1 Panjang kecambah (hipokotil dan epikotil) (cm), diukur dari pangkal batang sampai pucuk tanaman.
2 Panjang akar (cm), diukur dari pangkal akar sampai ujung akar dengan cara meluruskan akar yang bergulung.
3 Jumlah rambut akar, diamati dengan menghitung semua jumlah akar yang tumbuh pada akar primer.
4 Bobot kering kecambah (hipokotil dan epikotil) (g). Kecambah dimasukkan ke dalam oven dengan suhu 700C selama 48 jam sampai beratnya konstan, lalu ditimbang dengan timbangan analitik.
5 Bobot kering akar (g). Akar dicuci sampai bersih dan dimasukkan kedalam oven dengan suhu 700C selama 48 jam sampai beratnya konstan, lalu ditimbang dengan timbangan analitik.
6 Rasio bobot kering akar dan kecambah. Dihitung dengan rumus sebagai berikut: rasio bobot kering akar- kecambah = bobot kering akar/bobot kering kecambah.
8 Kandungan klorofil a, klorofil b dan klorofil total (umol/g). Analisis klorofil menggunakan metode Sims dan Gamon (2002) ( Lampiran 1).
Indeks Kepekaan/Sensitivitas Kekeringan (IS)
Indeks sensitivitas merupakan peubah untuk tingkat sensitivitas dengan menggunakan rumusyang dikemukakan oleh Fischer dan Maurer (1978):
IS = (1 - Yp/Y) (1 - Xp/X)
Keterangan= IS: indeks sensitivitas kekeringan; Yp: rata-rata suatu kultivar yang mendapatkan stres kekeringan; Y: rata-rata suatu kultivar yang tidak mendapatkan stres kekeringan; Xp: rata-rata dari seluruh kultivar yang mendapatkan stres kekeringan; X: rata-rata dari seluruh kultivar yang tidak mendapatkan stres kekeringan.
Analisis Data
Data yang diperoleh di analisis ragam menggunakan uji F pada taraf nyata 5%, dan uji lanjut menggunakan DMRT (Duncan Multiple Range Test) pada taraf 5 %.
HASIL DAN PEMBAHASAN
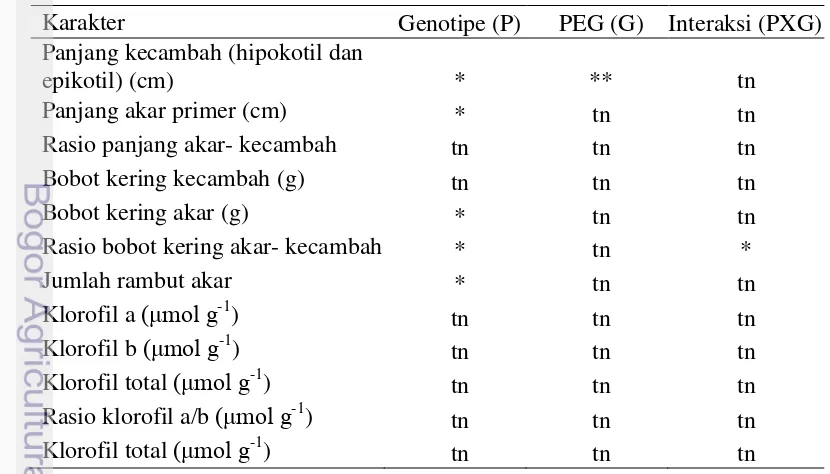
Hasil analisis sidik ragam (Tabel 1) menunjukkan bahwa genotipe berpengaruh terhadap peubah panjang kecambah, panjang akar primer, bobot kering akar, rasio bobot kering akar- kecambah dan jumlah rambut akar. PEG berpengaruh terhadap peubah panjang kecambah sedangkan interaksi antara genotipe dan PEG terdapat pada peubah rasio bobot kering akar- kecambah. Tabel 1 Rekapitulasi sidik ragam karakter genotipe kedelai terhadap perlakuan
PEG pada akhir percobaan di laboratorium
Karakter Genotipe (P) PEG (G) Interaksi (PXG)
Panjang Kecambah (Hipokotil dan Epikotil)
Cekaman kekeringan menyebabkan menurunnya potensial air tanaman akibat berkurangnya difusi air dari larutan tanah ke dalam tanaman sehingga menurunkan turgor sel. Menurunnya tekan turgor sel tanaman juga mnenyebabkan terhambatnya proses pembelahan dan pembesaran sel (Taiz dan Zeiger 2002) sehingga tanaman menjadi pendek. Wilis mempunyai panjang kecambah yang lebih besar (16.23 cm) dibandingkan dengan genotipe lainnya dan tidak berbeda nyata dengan Ratai, Slamet, Tanggamus, PG 57-1dan SC 39-1 (Tabel 2). Tiap genotipe memiliki panjang kecambah yang beragam ketika menghadapi perlakuan cekaman kekeringan.
PEG berpengaruh terhadap panjang kecambah kedelai. PEG 0% tidak berbeda nyata dengan PEG 10% tetapi berbeda nyata dengan PEG 20%. Perbedaan laju pertambahan panjang kecambah diduga berkaitan dengan kadar air yang tersedia. Pada konsentrasi PEG 0% dan 10% pembelahan, pembesaran dan pemanjangan sel berjalan dengan baik. Sedangkan pada konsentrasi PEG 20% diduga terjadi penghambatan pembelahan, pembesaran dan pemanjangan sel akibat rendahnya kadar air yang tersedia.
Tabel 2 Respon panjang kecambah, panjang akar primer dan jumlah rambut akar kedelai pada perlakuan genotipe dan konsentrasi PEG
Perlakuan Panjang berbeda nyata pada taraf uji 5% (DMRT), angka yang ditampilkan merupakan data rataan, untuk pengolahan data di transformasi √(x+0.5).
PEG, semakin tinggi konsentrasi PEG yang diberikan, penurunan tajuk tanaman semakin besar. Beberapa penelitian dengan konsentrasi PEG yang bervariasi menunjukkan respon penurunan kecambah yang berbeda-beda. Hasil penelitian lain yang menunjukkan respon penurunan panjang tajuk akibat cekaman kekeringan ditunjukkan oleh tanaman rumput Gajah dan Raja (Sinaga 2005), kacang tanah (Riduan et al. 2005) dan kacang moth (Soni et al. 2011).
Panjang Akar Primer
Panjang akar merupakan karakter yang penting untuk melihat respon tanaman terhadap cekaman kekeringan, karena akar adalah organ utama pada tanaman yang berfungsi untuk menyerap air dan unsur hara yang terlarut di dalamnya. Pada saat terjadi cekaman kekeringan, tanaman yang mampu beradaptasi akan melakukan perpanjangan akar untuk memperbesar area penyerapan air. Perbedaan panjang akar menunjukkan bahwa tiap genotipe memiliki respon akar yang berbeda-beda dalam menghadapi cekaman kekeringan dengan menggambarkan sistem perakaran yang dimiliki.
Wilis mempunyai panjang akar yang lebih besar (8.46 cm) dibandingkan dengan lainnya dan tidak berbeda nyata dengan Ratai, Seulawah, Slamet, Tanggamus, GC 22-10, PG 57-1, SC 21-5 dan SC 39-1 (Tabel 2). Tiap genotipe memiliki panjang akar yang beragam ketika menghadapi perlakuan cekaman kekeringan.
Jumlah Rambut Akar
Pada saat terjadi cekaman kekeringan sistem perakaran akan mengalami perubahan dan pertambahan struktur yaitu bertambahnya jumlah rambut-rambut akar untuk mendukung fungsi akar primer dalam penyerapan air. Pada rumput P. dilatatum (pakan ternak) terjadi peningkatan jumlah rambut akar yang akan meningkatkan kemampuan tanaman untuk menyerap air (Vasselati et al. 2001).
Wilis mempunyai jumlah rambut akar (23.05) yang lebih banyak dibandingkan dengan genotipe lainnya (Tabel 2). Tiap genotipe memiliki respon jumlah rambut akar yang beragam ketika menghadapi perlakuan cekaman kekeringan. Rambut akar merupakan bagian akar yang mengalami perkembangan akar tergantung genotipe dan lingkungannya. Rambut akar memberikan permukaan yang sangat luas untuk berhubungan dengan volume yang besar dari bagian-bagian tanah untuk pengambilan mineral (Gardner 1991).
Rasio Panjang Akar-Kecambah dan Bobot Kering Kecambah
Tabel 3 Respon rasio panjang akar-kecambah dan bobot kering kecambah 10 genotipe kedelai pada perlakuan genotipe dan konsentrasi PEG
Perlakuan Rasio panjang akar- kecambah (cm) Bobot kering kecambah (g)
Genotipe: berbeda nyata pada taraf uji 5% (DMRT), angka yang ditampilkan merupakan data rataan, untuk pengolahan data di transformasi √(x+0.5).
Bobot Kering Akar dan Rasio Bobot Kering Akar-Kecambah
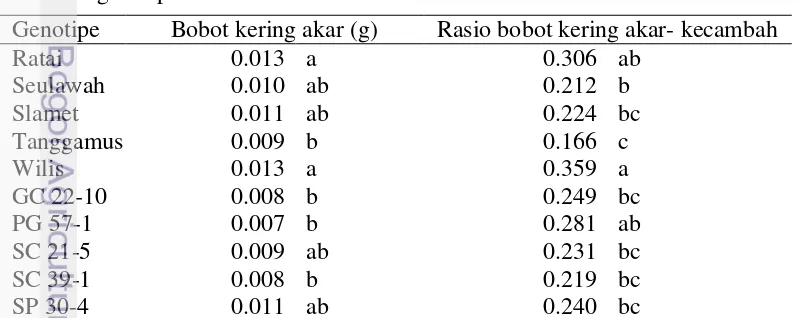
Bobot kering merupakan hasil akumulasi fotosintesis tumbuhan selama pertumbuhannya (Levitt 1980). Tanaman yang memiliki sifat toleran terhadap kekeringan mengalami peningkatan rasio bobot kering akar (Makbul et al. 2011). Ratai dan Wilis mempunyai bobot kering akar yang lebih besar (0.013 g) dibandingkan dengan genotipe lainnya (Tabel 4).
Tabel 4 Respon bobot kering akar dan rasio bobot kering akar- kecambah 10 genotipe kedelai
Genotipe Bobot kering akar (g) Rasio bobot kering akar- kecambah
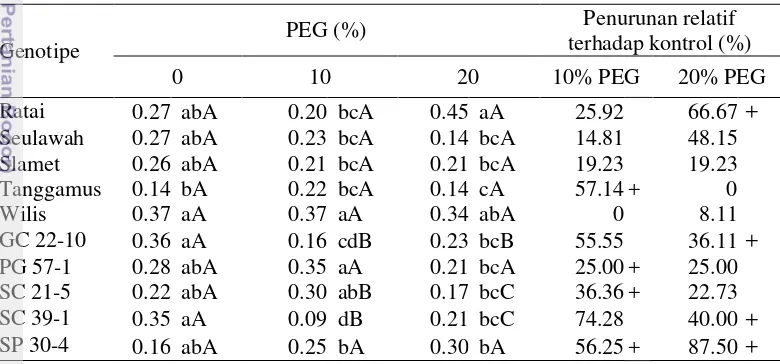
Wilis mempunyai rasio bobot kering akar- kecambah yang lebih besar (0.359 g) dibandingkan dengan genotipe lainnya dan tidak berbeda nyata dengan genotipe Ratai dan PG 57-1 (Tabel 4). Pada saat terjadi cekaman kekeringan (PEG 20%) kenaikan rasio bobot kering akar- kecambah hanya terjadi pada Ratai, GC 22-10, SC 39-1 dan SP 30-4 (66.67%, 3.61%, 40% dan 87.50%). Pada genotipe lainnya terjadi penurunan kecuali pada Slamet. Penurunan tersebut diindikasikan terjadi peningkatan bobot kering akar. Hal ini merupakan respon tanaman kedelai untuk mengembangkan perubahan fisiologi terhadap cekaman kekeringan dengan peningkatan rasio bobot kering akar-tajuk (Hanum et al. 2007; Makbul et al. 2011).
Peningkatan rasio bobot akar-kecambah menunjukkan bahwa tanaman melakukan mekanisme toleransi dengan cara meningkatkan perkembangan dan pertumbuhan akar dibandingkan dengan pertumbuhan dan perkembangan tajuk. Sistem perakaran ditingkatkan agar lebih efisien dan efektif dalam memperbaiki serapan air. Hal ini sejalan dengan hasil penelitian pada tanaman kacang moth (Soni et al. 2011), jagung (Farsiani dan Ghobadi 2009) dan rumput Raja (Sinaga 2005).
Tabel 5 Interaksi genotipe dan konsentrasi PEG terhadap peubah rasio bobot kering akar- kecambah menunjukkan adanya peningkatan; angka yang ditampilkan merupakan data rataan, untuk pengolahan data di transformasi √(x+0.5).
Kandungan Klorofil
rendah sehingga pengaruh cekaman kekeringan mungkin belum terlihat meskipun beberapa genotipe mengalami penurunan klorofil.
Tabel 6 Respon klorofil a, b, total dan rasio klorofil a/b daun kedelai pada perlakuan genotipe dan konsentrasi PEG
Perlakuan Klorofil a (μmol/g) Klorofil b (μmol/g) Klorofil total (μmol/g) Rasio klorofil a/b berbeda nyata pada taraf uji 5% (DMRT), angka yang ditampilkan merupakan data rataan, untuk pengolahan data di transformasi √(x+0.5).
Korelasi Antara Peubah
Menurut Mattjik dan Sumertajaya (2002), korelasi merupakan gambaran keeratan hubungan antara satu peubah dengan peubah lainnya, bila nilai korelasi antara dua peubah mendekati 1 atau -1 menunjukkan hubungan kedua peubah sangat erat. Analisis korelasi antara peubah pada percobaan in vitro ini disajikan pada Tabel 7.
Panjang akar berkorelasi positif nyata dengan panjang tajuk. Hal ini berarti peningkatan panjang akar seiring dengan peningkatan panjang tajuk. Rasio panjang akar-tajuk berkorelasi positif sangat nyata dengan panjang akar. Korelasi positif antara rasio panjang akar-tajuk dengan panjang akar sangat erat, dapat diartikan bahwa peningkatan panjang akar seiring dengan peningkatan rasio panjang akar-tajuk.
Rasio bobot kering akar-tajuk berkorelasi positif nyata dengan panjang tajuk, negatif sangat nyata dengan bobot kering tajuk dan positif sangat nyata dengan bobot kering akar. Artinya peningkatan rasio bobot kering akar-tajuk seiring dengan peningkatan bobot kering akar dan penurunan bobot kering tajuk.
peningkatan bobot kering akar, rasio bobot kering akar-tajuk dan diameter akar serta penurunan bobot kering tajuk.
Klorofil a berkorelasi positif nyata dengan panjang tajuk, negatif sangat nyata dengan bobot kering tajuk, positif sangat nyata dengan bobot kering akar, rasio bobot kering akar-tajuk dan jumlah rambut akar. Klorofil b berkorelasi positif nyata dengan panjang tajuk, negatif sangat nyata dengan bobot kering tajuk, positif sangat nyata dengan bobot kering akar, rasio bobot kering akar-tajuk, jumlah rambut akar dan klorofil a. Klorofil total berkorelasi positif nyata dengan panjang tajuk, negatif sangat nyata dengan bobot kering tajuk, positif sangat nyata dengan bobot kering akar, rasio bobot kering akar-tajuk, jumlah rambut akar, klorofil a dan klorofil b. Korelasi positif antara klorofil dengan panjang tajuk, bobot kering akar, rasio bobot kering akar-tajuk, diameter akar dan jumlah rambut akar menunjukkan bahwa peningkatan kandungan klorofil seiring dengan peningkatan panjang tajuk, bobot kering akar, rasio bobot kering akar-tajuk, diameter akar dan jumlah rambut akar. Korelasi negatif antara kandungan klorofil dengan bobot kering tajuk menunjukkan bahwa peningkatan bobot kering tajuk akan seiring dengan penurunan kandungan klorofil. Sedangkan korelasi positif sangat nyata antara klorofil a, b dan total menunjukkan bahwa peningkatan masing-masing klorofil saling mempengaruhi satu sama lainnya.
Sidik Lintas untuk Menentukan Karakter Seleksi Toleran Kekeringan
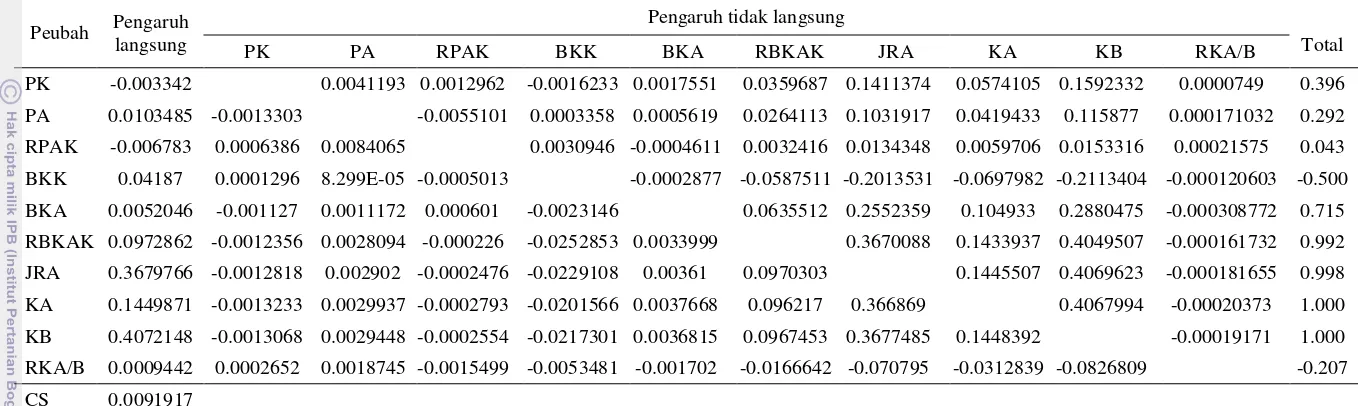
Tabel 7 Korelasi antar peubah pada percobaan in vitro
Peubah PK PA RPAT BKK BKA RBKAK JRA KA KB RKA/B KT
PK 1
PA 0.39806** 1
RPAT -0.19109 0.81234* 1
BKK -0.03877 0.00802 0.07391 1
BKA 0.33723 0.10796 -0.0886 -0.05528 1
RBKAK 0.36972** 0.27148 0.03332 -0.60390* 0.65324* 1
JRA 0.38355** 0.28043 0.03651 -0.54719* 0.69362** 0.99737** 1
KA 0.39597** 0.28929 0.04118 -0.48141* 0.72374* 0.98901* 0.99699* 1
KB 0.39103** 0.28456 0.03765 -0.51899* 0.70736* 0.99444* 0.99938* 0.99898* 1
RKA/B -0.07936 0.18114 0.2285 -0.12773 -0.32702 -0.17129 -0.19239 -0.21577 -0.20304 1
KT 0.39588** 0.292 0.04309 -0.50007* 0.71494* 0.99194* 0.99841* 0.99967* 0.99969* -0.20694 1
a
Tabel 8 Pengaruh langsung dan tidak langsung antara peubah terhadap kandungan klorofil total pada kondisi cekaman kekeringan
Peubah Pengaruh
langsung
Pengaruh tidak langsung
Total
PK PA RPAK BKK BKA RBKAK JRA KA KB RKA/B
PK -0.003342 0.0041193 0.0012962 -0.0016233 0.0017551 0.0359687 0.1411374 0.0574105 0.1592332 0.0000749 0.396
PA 0.0103485 -0.0013303 -0.0055101 0.0003358 0.0005619 0.0264113 0.1031917 0.0419433 0.115877 0.000171032 0.292
RPAK -0.006783 0.0006386 0.0084065 0.0030946 -0.0004611 0.0032416 0.0134348 0.0059706 0.0153316 0.00021575 0.043
BKK 0.04187 0.0001296 8.299E-05 -0.0005013 -0.0002877 -0.0587511 -0.2013531 -0.0697982 -0.2113404 -0.000120603 -0.500
BKA 0.0052046 -0.001127 0.0011172 0.000601 -0.0023146 0.0635512 0.2552359 0.104933 0.2880475 -0.000308772 0.715
RBKAK 0.0972862 -0.0012356 0.0028094 -0.000226 -0.0252853 0.0033999 0.3670088 0.1433937 0.4049507 -0.000161732 0.992
JRA 0.3679766 -0.0012818 0.002902 -0.0002476 -0.0229108 0.00361 0.0970303 0.1445507 0.4069623 -0.000181655 0.998
KA 0.1449871 -0.0013233 0.0029937 -0.0002793 -0.0201566 0.0037668 0.096217 0.366869 0.4067994 -0.00020373 1.000
KB 0.4072148 -0.0013068 0.0029448 -0.0002554 -0.0217301 0.0036815 0.0967453 0.3677485 0.1448392 -0.00019171 1.000
RKA/B 0.0009442 0.0002652 0.0018745 -0.0015499 -0.0053481 -0.001702 -0.0166642 -0.070795 -0.0312839 -0.0826809 -0.207
CS 0.0091917
a
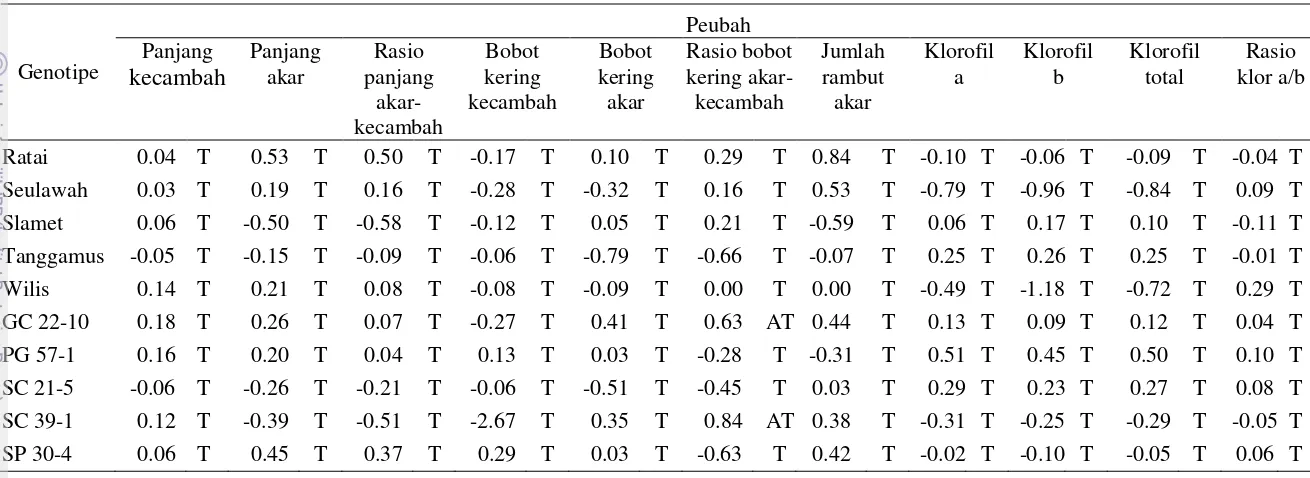
Menurut Yunianti et al. (2010), pemilihan peubah untuk kriteria seleksi dapat dipilih dengan melihat peubah yang mempunyai pengaruh langsung positif, koefisien yang bertanda sama dengan pengaruh langsung dan selisih antara koefisien korelasi dan pengaruh langsung <0.5, maka dalam percobaan ini yang dapat dijadikan sebagai kriteria seleksi kedelai toleran kekeringan adalah rasio panjang akar-kecambah dan rasio klorofil a/b (Tabel 9).
Tabel 9 Pemilihan karakter untuk kriteria seleksi kecambah kedelai toleran kekeringan rasio bobot kering akar- kecambah, JRA: jumlah rambut akar, KA: klorofil a, KB: klorofil b, KT: klorofil total, RKA/B: rasio klorofil a/b.
Indeks Sensitivitas Kekeringan (IS) sebagai Penduga Toleransi Tanaman Kedelai terhadap Cekaman Kekeringan
Penentuan genotipe yang toleran terhadap cekaman kekeringan dilakukan melalui penghitungan indeks sensitivitas (IS) kekeringan. Nilai indeks sensitivitas kekeringan (IS) merupakan salah satu alat penduga toleransi genotipe kedelai terhadap cekaman kekeringan (Fischer dan Maurer 1978). Kriteria untuk menentukan tingkat sensitivitas kultivar terhadap stres kekeringan adalah jika: IS ≤ 0.5 = toleran; 0.5 < IS ≤ 1.00 = agak toleran; IS > 1.00 = peka (sensitif). Nilai indeks sensitivitas (IS) genotipe kedelai disajikan pada tabel 10 dan 11.
SIMPULAN
Perlakuan cekaman kekeringan dengan simulasi PEG menyebabkan penurunan pertumbuhan kecambah kedelai. Perlakuan cekaman kekeringan dengan simulasi PEG berpengaruh pada panjang kecambah, panjang akar primer, bobot kering akar, rasio bobot kering akar- kecambah dan jumlah rambut akar. Rasio bobot kering akar-kecambah Wilis pada PEG 10% tidak mengalami penurunan, sedangkan pada PEG 20% mengalami penurunan paling rendah dibandingkan dengan genotipe lainnya.
4 PERTUMBUHAN DAN PERKEMBANGAN GENOTIPE
KEDELAI PADA CEKAMAN KEKERINGAN
Abstrak
Genotipe toleran kekeringan dan berdaya hasil tinggi sangat diperlukan untuk pengembangan kedelai pada lahan kering. Respon tanaman pada kondisi kekeringan tergantung pada genotipe. Tujuan percobaan ini adalah mempelajari pengaruh cekaman kekeringan terhadap karakter anatomi, morfologi, fisiologi dan komponen hasil pada genotipe kedelai terkait karakter untuk kriteria seleksi. Percobaan dilaksanakan di rumah kaca Cikabayan-IPB menggunakan sepuluh genotipe kedelai (Ratai, Seulawah, Slamet, Tanggamus, Wilis, GC 22-10, PG 57-1, SC 21-5, SC 39-57-1, SP 30-4) dan PEG (0%, 20%). Cekaman kekeringan hanya diberikan pada fase vegetatif. Hasil percobaan menunjukkan bahwa cekaman kekeringan dengan simulasi PEG menyebabkan perubahan karakter anatomi, morfologi, fisiologi dan komponen hasil tanaman kedelai yaitu pada rasio panjang akar-tajuk, bobot kering daun, bobot kering akar, jumlah rambut akar, jumlah daun trifoliat, jumlah stomata, kerapatan stomata, jumlah trikoma, kandungan klorofil, jumlah biji, bobot biji per tanaman dan indeks panen. Penurunan indeks panen terbesar terjadi pada SC 39-1 (0.69%) dan terkecil pada Wilis (0.27%). Indeks sensitivitas pada kondisi cekaman kekeringan berdasarkan indeks panen menggolongkan Wilis toleran, Ratai, Seulawah, Slamet, Tanggamus, GC 22-10, PG 57-1, SP 30-4 agak toleran sedangkan SC 39-1 tergolong peka.
Kata kunci: fase vegetatif, indeks sensitivitas, PEG, toleran
THE GROWTH AND DEVELOPMENT OF THE SOYBEAN GENOTYPE TO DROUGHT STRESS
Abstract
The genotypes of drought stress tolerant and high yielding needed for soybean cultivation on the dryland. Crop responses to drought stress depend on their genotypes. The purpose of this experiment was to study the effect of drought stress on anatomical, morphological, physiological and yield component of soybean genotypes, which related to selection criteria characters. This experiment was conducted in the Cikabayan greenhouse IPB using ten genotypes of soybean (Ratai, Seulawah, Slamet, Tanggamus, Wilis, GC 22-10, PG 57-1, SC 21-5, SC 39-1, SP 30-4) and PEG (0%, 20%). The drought stress was applied only at a vegetative phase. The result showed that drought stress with PEG simulation caused the changes in anatomical, morphological, physiological characters and yield component of soybean i.e. on root-shoot length ratio, leaf dry weight, root dry weight, lateral roots number, trifoliat leaf number, stomata number, stomata density, trichome number, chlorophyll content, seeds number, seed weight and harvest index. The decreasing of index harvest in SC 39-1 is higher (0.69%) on the other hand, in Wilis is lower (0.27%). Based on index of drought sensitivity (PEG 20%) on harvest index indicated that Wilis was as tolerant; Ratai, Seulawah, Slamet, Tanggamus, GC 22-10, PG 57-1, SC 21-5 and SP 30-4 were as medium; while SC 39-1 was as sensitive.
PENDAHULUAN
Pemanfaatan lahan-lahan marginal di Indonesia terutama lahan kering perlu ditingkatkan untuk pemenuhan kebutuhan bahan pangan terutama kedelai. Kekeringan pada fase vegetatif menyebabkan terjadinya penurunan hasil produksi tanaman kedelai (Kisman 2010), sehingga diperlukan genotipe kedelai yang toleran kekeringan dan mempunyai daya hasil yang tinggi. Salah satu program perbaikan genotipe khususnya untuk lahan kering adalah pengembangan genotipe kedelai yang tahan terhadap kekeringan. Informasi berbagai respon tanaman yang berkaitan erat dengan mekanisme toleransi terhadap kekeringan sangat diperlukan untuk mendukung program tersebut. Pemilihan genotipe yang toleran terhadap cekaman kekeringan harus merupakan genotipe yang mempunyai daya hasil yang tinggi. Seleksi terhadap genotipe kedelai yang memiliki toleransi yang baik terhadap kekeringan telah dilakukan. Namun, genotipe kedelai yang memiliki sifat toleran terhadap kekeringan belum tentu memiliki sifat –sifat unggul seperti produksi hasil yang tinggi di lapang.
Beberapa percobaan ex vitro dengan menggunakan PEG pada beberapa genotipe kedelai telah banyak dilakukan (Sunaryo 2002), juga pada tanaman lain seperti pada beberapa genotipe kacang tanah (Susilawati 2003). Diharapkan ada kesesuaian yang tinggi antara percobaan in vitro dengan percobaan ex vitro. Tujuan percobaan ini adalah mempelajari karakter anatomi, morfologi dan fisiologi beberapa genotipe kedelai setelah mengalami cekaman kekeringan pada fase vegetatif serta mempelajari pengaruh beberapa genotipe kedelai pada kondisi kekeringan terhadap pertumbuhan dan komponen hasil.
BAHAN DAN METODE
Bahan Tanam
Bahan tanaman yang digunakan adalah 10 genotipe kedelai yang terdiri dari 5 varietas nasional yaitu: Ratai, Seulawah, Slamet, Tanggamus, Wilis dan 5 galur silangan Ceneng, Godek, Slamet, Pangrangro, yaitu: GC 22-10, PG 57-1, SC 21-5, SC 39-1 dan SP 30-4.
Metode Penelitian
Prosedur Percobaan Persiapan Bahan Tanam
Percobaan ini dilakukan dalam polibag berdiameter 20 cm yang diisi campuran tanah dan pasir dengan perbandingan 2 : 1 sebanyak 8 kg. Setiap polibag ditanam 2 benih kedelai dan pada umur 3 minggu dilakukan penjarangan dengan meninggalkan satu tanaman per polibag yang pertumbuhannya paling baik. sebelum penanaman dilakukan pemupukan dasar dengan menggunakan Urea, SP-18 dan KCl. Pemupukan kedua dilakukan setelah tanaman berumur 3 minggu. Penyiangan dilakukan secara berkala dengan mencabut tanaman pengganggu yang tumbuh di dalam polibag. Pemeliharaan dilakukan terus menerus hingga tanaman dipanen.
Pemberian Perlakuan Cekaman Kekeringan
Larutan PEG dibuat dengan melarutkan kristal PEG 6000 sesuai konsentrasi perlakuan dengan air sampai volume mencapai 1 liter. Larutan PEG diberikan pada tanaman sejak tanaman memiliki daun trifoliat yang telah berkembang sempurna sebanyak 20 ml setiap 2 hari sekali sampai tanaman mulai memasuki fase reproduktif (± umur 30 hari).
Pengamatan
1 Tinggi tajuk (cm). Diukur dari pangkal batang sampai pucuk tanaman.
2 Panjang akar (cm). Diukur dari pangkal akar sampai ujung akar dengan cara meluruskan akar yang bergulung.
3 Jumlah cabang akar. Menghitung semua jumlah akar yang tumbuh pada akar primer.
4 Jumlah daun trifoliat. Dihitung semua daun trifoliat pada tanaman.
5 Luas daun (cm2). Dihitung dengan menggunakan metode gravimetrik (rumus pada Lampiran 3).
6 Tebal daun (cm). Diamati dengan menggunakan mikroskop stereo (cara pengukuran pada Lampiran 4).
7 Jumlah trikoma, jumlah stomata dan kerapatan stomata (n/mm2). Diamati dengan menggunakan mikroskop stereo (cara penghitungan pada lampiran 5 dan 6).
8 Bobot kering daun (g). Daun dimasukkan ke dalam oven dengan suhu 700C selama 48 jam sampai beratnya konstan, lalu ditimbang dengan timbangan analitik.
9 Bobot kering akar (g). Akar dipisahkan dari tajuknya kemudian dicuci sampai bersih dan dimasukkan ke dalam oven dengan suhu 700C selama 48 jam sampai beratnya konstan, lalu ditimbang dengan timbangan analitik.
10 Rasio bobot kering akar dan daun. Dihitung dengan rumus sebagai berikut: rasio bobot kering akar-daun = bobot kering akar/bobot kering daun.
11 Rasio panjang akar dan panjang tajuk. Dihitung dengan rumus sebagai berikut: rasio panjang akar-tajuk = panjang akar/panjang tajuk.
12 Kandungan klorofil a, klorofil b dan klorofil total (umol/g). Sampel yang diambil adalah daun ketiga dari pucuk tanaman. Analisis klorofil menggunakan metode Sims dan Gamon (2002) ( Lampiran 1).
13 Kandungan prolin (μmol prolin/ g bobot basah). Sampel yang diambil adalah daun ketiga dari pucuk tanaman. Analisis prolin menggunakan metode Bates
bobot kering biji (g) bobot kering tanaman (g) Produksi tanaman
Nilai produksi hasil tanaman diamati setelah melakukan panen pada saat tanaman sudah menunjukkan gejala matang fisiologis (90% polong telah berubah warna menjadi coklat, daunnya menguning dan rontok). Pengamatan yang dilakukan meliputi:
1 Jumlah polong isi per tanaman dan jumlah polong hampa per tanaman (biji dalam polong berbentuk gepeng dan keriput).
2 Jumlah biji per tanaman yaitu semua biji bernas (biji berkembang penuh). 3 Bobot biji per tanaman (g) yaitu bobot biji kering oven 2 x 24 jam pada suhu
700C.
4 Indeks panen (IP) yang menunjukkan distribusi asilmilat ditentukan dengan persamaan :
IP =
Indeks Kepekaan/Sensitivitas Kekeringan (IS)
Indeks sensitivitas merupakan peubah untuk tingkat sensitivitas dengan menggunakan rumus yang dikemukakan oleh Fischer dan Maurer (1978):
IS = (1 - Yp/Y) (1 - Xp/X)
Keterangan= IS: indeks sensitivitas kekeringan; Yp: rata-rata suatu kultivar yang mendapatkan stres kekeringan; Y: rata-rata suatu kultivar yang tidak mendapatkan stres kekeringan; Xp: rata-rata dari seluruh kultivar yang mendapatkan stres kekeringan; X: rata-rata dari seluruh kultivar yang tidak mendapatkan stres kekeringan.
Kriteria untuk menentukan tingkat sensitivitas kultivar terhadap stres kekeringan adalah jika: IS ≤ 0.5μ toleran, 0.5 < IS ≤ 1.00μ agak toleran, IS > 1.00: peka (Fischer dan Maurer 1978)
Analisis Data
Analisis data dilakukan dengan analisis ragam, apabila berpengaruh nyata akan dilakukan analisis lanjutan dengan uji jarak berganda atau DMRT (Duncan Multiple Range Test) pada taraf 5%.
HASIL DAN PEMBAHASAN
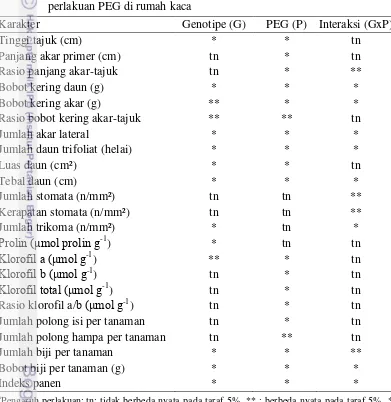
trifoliat, luas daun, tebal daun, klorofil a, klorofil b, klorofil total, prolin, jumlah polong isi per tanaman, jumlah polong hampa per tanaman, jumlah biji per tanaman, bobot biji per tanaman dan indeks panen. Interaksi terdapat pada peubah rasio panjang akar-tajuk, bobot kering daun, bobot kering akar, jumlah akar lateral, jumlah daun trifoliat, tebal daun, rasio klorofil a/b, jumlah stomata, kerapatan stomata dan jumlah trikoma, jumlah biji per tanaman, bobot biji per tanaman dan indeks panen (Tabel 12).
Tabel 12 Rekapitulasi sidik ragam karakter 10 genotipe kedelai terhadap perlakuan PEG di rumah kaca
Pengaruh perlakuan;tn: tidak berbeda nyata pada taraf 5%, ** : berbeda nyata pada taraf 5%, *:
berbeda nyata pada taraf 1%.
Tinggi Tajuk