STRUKTUR POPULASI PARASITOID TELUR
Trichogrammatoidea armigera
PADA BEBERAPA
TIPE AGROEKOSISTEM
DIANA NOVIANTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Struktur Populasi Parasitoid Telur Trichogrammatoidea armigera Pada Beberapa Tipe Agroekosistem adalah benar-benar merupakan hasil karya sendiri dan belum pernah digunakan untuk memperoleh gelar sejenis. Semua sumber data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, September 2006
Diana Novianti
ABSTRAK
DIANA NOVIANTI. Struktur Populasi Parasitoid Telur Trichogrammatoidea armigera Pada Beberapa Tipe Agroekosistem. Dibimbing oleh MUHAMMAD JUSUF, DAMAYANTI BUCHORI, dan BAHAGIAWATI AMIRHUSIN.
Parasitoid telur T. armigera sebagai agensia pengendali hayati merupakan alternatif pengendalian hama ramah lingkungan. Keefektivan parasitoid dipengaruhi oleh struktur populasi yang terbentuk. Kesulitan dalam menganalisis struktur populasi parasitoid telur adalah menghitung jumlah aliran gen, sehingga digunakan pendekatan tidak langsung secara molekuler dengan penanda DNA. Secara langsung dengan melakukan uji ketidaksesuaian reproduksi yang menunjukkan hasil yaitu terjadi ketidaksesuaian reproduksi antara parasitoid yang berasal dari Gunung Bunder II dengan yang berasal dari Cugenang, tanpa melihat besar kecilnya jarak genetik antara individu-individu tersebut. Tetapi yang terjadi antara parasitoid dari lokasi yang sama menunjukkan adanya kesesuaian reproduksi. Hasil ini membuktikan bahwa terjadi ketidaksesuaian reproduksi antara parasitoid yang berasal dari lokasi yang berbeda.
Berdasarkan analisis RAPD-PCR dengan 4 macam primer terhadap 19 sampel yang berasal dari 3 lokasi menunjukkan bahwa dalam setiap lokasi ditemukan adanya subpopulasi terutama pada parasitoid-parasitoid yang berasal dari satu telur inang. Gunung Bunder II dan Cugenang masing-masing membentuk metapopulasi sedangkan lokasi Gunung Bunder I tidak dapat diketahui struktur populasinya karena kekurangan sampel. Dendrogram menunjukkan semua parasitoid dari ketiga lokasi bercampur dan tersebar ke semua klaster.
STRUKTUR POPULASI PARASITOID TELUR
Trichogrammatoidea armigera
PADA BEBERAPA
TIPE AGROEKOSISTEM
DIANA NOVIANTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Judul Tesis : Struktur Populasi Parasitoid Telur Trichogrammatoidea armigera Pada Beberapa Tipe Agroekosistem
Nama : Diana Novianti
NIM : P055020191
Disetujui,
Komisi pembimbing
Dr. Ir. Muhammad Jusuf, DEA Ketua
Dr. Ir. Damayanti Buchori, M.Sc Dr. Ir. Bahagiawati Amirhusin, M.Sc
Anggota Anggota
Diketahui,
Ketua Program Studi Bioteknologi Dekan Sekolah Pascasarjana
Dr. Ir. Muhammad Jusuf, DEA Dr. Ir. Khairil Anwar Notodiputro, MS
RIWAYAT HIDUP
Penulis dilahirkan di Mempawah, Kabupaten Pontianak, Kalimantan Barat pada tanggal 3 November 1977 sebagai anak kedua dari pasangan Ayahanda Sartono dan Ibunda Nani Suwarni.
PRAKATA
Puji dan syukur penulis panjatkan pada Allah SWT atas segala karunia- Nya sehingga penelitian dan penulisan tesis yang merupakan salah satu syarat untuk meraih gelar Magister Sains di Sekolah Pasca Sarjana, Institut Pertanian Bogor dapat diselesaikan. Penelitian ini dilaksanakan sejak bulan Mei 2004, dengan judul “Struktur Populasi Parasitoid Telur Trichogrammatoidea armigera
Pada Beberapa Tipe Agroekosistem”.
Penulis menyampaikan terima kasih dan penghargaan yang sebesar-besarnya kepada Dr. Ir. Muhammad Jusuf, DEA selaku ketua komisi pembimbing sekaligus ketua program studi Bioteknologi SPs IPB atas dorongan, nasehat dan bimbingan selama penulis menjalani pendidikan dan penelitian. Terima kasih kepada Dr. Ir. Damayanti Buchori, M.Sc dan Dr. Ir. Bahagiawati Amirhusin, M.Sc selaku anggota komisi pembimbing yang telah banyak bersabar dan banyak membimbing serta mengarahkan penulis selama penelitian dan penulisan tesis. Terima kasih kepada Dr.Ir. Dedi Duryadi Solichin selaku dosen penguji tesis atas segala masukannya.
Di samping itu penulis menyampaikan terima kasih kepada Bapak Reflinur MSi rekan seperjuangan di IPB atas kerjasama, motivasi dan diskusi dengan penulis selama penelitian dan perkuliahan di IPB. Terima kasih kepada Ibu Dr. Dwinita atas pengarahan di laboratorium BB Biogen Bogor serta masukan-masukan yang berarti. Kepada Bapak Bandung Sahari MSi terima kasih atas waktu dan kerjasamanya dalam menjawab pertanyaan-pertanyaan tentang penelitian ini.
Penulis juga mengungkapkan terima kasih yang setulus-tulusnya serta syukur atas kesabaran dan pengertian Ayahanda H. Sartono SH MSi dan Ibunda Hj. Nani Suwarni, abang Eko Yulianto SET dan adik Rengga Damayanti SH. MSi, terima kasih untuk doa, dorongan, motivasi, kasih sayang sehingga penulis dapat menyelesaikan studi dan penelitian. Untuk Mas Rafli I. Kawulusan SP atas cinta dan kasih sayangnya, wah ternyata IPB telah mencari dan memberi yang terbaik buatku.
Tidak lupa terima kasih buat rekan-rekan seperjuangan Biotek 2002 (Mbak Win, Berty, Kiki, Roberdi, Mbak Anik, Kusuma, Bang Molah, Pipit, Uni Dewi, Bang Yamin, Apon, Fatimah), bang ilyas, kak lila, Yuyun, Diana kalimantan, Uci, Nila, temen-temen kos (Yati, Mbak Neni, Niken, Mbak Niken, Rya, Erin, dan Kak Ita) atas dorongan semangat dan kasih sayangnya kepada penulis dalam menyelesaikan penelitian ini. Serta lab’s crew yang tidak dapat disebutkan satu persatu tetapi telah banyak membantu penulis terutama saat begadang.
Penulis menyadari bahwa di dalam penyusunan tulisan ini masih banyak kekurangan dan kelemahan. Oleh sebab itu penulis sangat berharap adanya kritik dan saran dari pembaca demi perbaikan tulisan ini. Semoga karya ilmiah ini dapat bermanfaat di kemudian hari. Amiin.
Bogor, September 2006
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 3
Hipotesis ... 3
TINJAUAN PUSTAKA ... 4
Trichogrammatoidea armigera : Sistematika dan Inang ... 4
Struktur Populasi Parasitoid pada Agroekosistem ... 6
Peranan Teknologi Molekuler dalam Struktur Populasi ... 7
Ketidaksesuaian Reproduksi (Incompatibility Reproductive) ... 9
BAHAN DAN METODE ... 11
Tempat dan Waktu Penelitian ... 11
Sampling parasitoid telur T. armigera pada H. armigera ... 11
Pemeliharaan parasitoid telur di laboratorium ... 13
Identifikasi spesies parasitoid telur T. armigera ... 14
Isolasi DNA genom total T. armigera ... 14
Amplifikasi DNA dengan teknik RAPD-PCR ... 15
Separasi dan visualisasi hasil PCR ... 15
Skoring dan Analisis pola pita DNA ... 16
Uji ketidaksesuaian reproduksi ... 17
HASIL PENELITIAN ... 19
Sampling T. armigera dan persebaran H. armigera ... 19
Analisis struktur populasi parasitoid telur T. armigera ... 26
Pengaruh struktur populasi pada ketidaksesuaian reproduksi ... 30
PEMBAHASAN ... 35
Sampling T. armigera dan persebaran H. armigera ... 35
Analisis struktur populasi parasitoid telur T. armigera ... 36
Pengaruh struktur populasi pada ketidaksesuaian reproduksi ... 42
DAFTAR TABEL
Halaman
Tabel 1 Data keadaan lokasi sampling di daerah Bogor dan sekitarnya ... 12
Tabel 2 Data parasitoid telur T. armigera ... 19
Tabel 3 Data sampel female lineT. armigera ... 25
Tabel 4 Jumlah lokus yang dihasilkan dari 4 primer RAPD-PCR... 27
Tabel 5 Hasil perhitungan parameter struktur populasi ... 28
Tabel 6 Matriks jarak genetik 19 sampel dari 4 primer RAPD-PCR ... 32
DAFTAR GAMBAR
Halaman
Gambar 1 Skema pembagian kelompok T. armigera sampai famili ... 4
Gambar 2 Ukuran imago T. armigera pada penggaris sentimeter ... 5
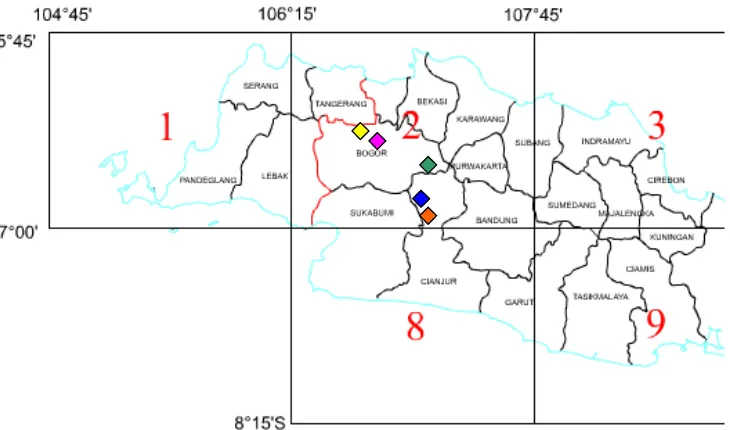
Gambar 3 Peta lokasi pengambilan sampel di Bogor dan sekitarnya ... 11
Gambar 4 Ilustrasi sampling di lapangan ... 13
Gambar 5 Distribusi telur inang dan parasitoid di GB I Bogor ... 20
Gambar 6 Distribusi telur inang dan parasitoid di GB II Bogor ... 21
Gambar 7 Distribusi telur inang dan parasitoid di Cibodas Cianjur ... 22
Gambar 8 Distribusi telur inang dan parasitoid di Cugenang Cianjur ... 23
Gambar 9 Distribusi telur inang dan parasitoid di WK Cianjur ... 24
Gambar 10 Hasil amplifikasi DNA produk PCR dengan primer RUT2 ... 26
STRUKTUR POPULASI PARASITOID TELUR
Trichogrammatoidea armigera
PADA BEBERAPA
TIPE AGROEKOSISTEM
DIANA NOVIANTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Struktur Populasi Parasitoid Telur Trichogrammatoidea armigera Pada Beberapa Tipe Agroekosistem adalah benar-benar merupakan hasil karya sendiri dan belum pernah digunakan untuk memperoleh gelar sejenis. Semua sumber data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, September 2006
Diana Novianti
ABSTRAK
DIANA NOVIANTI. Struktur Populasi Parasitoid Telur Trichogrammatoidea armigera Pada Beberapa Tipe Agroekosistem. Dibimbing oleh MUHAMMAD JUSUF, DAMAYANTI BUCHORI, dan BAHAGIAWATI AMIRHUSIN.
Parasitoid telur T. armigera sebagai agensia pengendali hayati merupakan alternatif pengendalian hama ramah lingkungan. Keefektivan parasitoid dipengaruhi oleh struktur populasi yang terbentuk. Kesulitan dalam menganalisis struktur populasi parasitoid telur adalah menghitung jumlah aliran gen, sehingga digunakan pendekatan tidak langsung secara molekuler dengan penanda DNA. Secara langsung dengan melakukan uji ketidaksesuaian reproduksi yang menunjukkan hasil yaitu terjadi ketidaksesuaian reproduksi antara parasitoid yang berasal dari Gunung Bunder II dengan yang berasal dari Cugenang, tanpa melihat besar kecilnya jarak genetik antara individu-individu tersebut. Tetapi yang terjadi antara parasitoid dari lokasi yang sama menunjukkan adanya kesesuaian reproduksi. Hasil ini membuktikan bahwa terjadi ketidaksesuaian reproduksi antara parasitoid yang berasal dari lokasi yang berbeda.
Berdasarkan analisis RAPD-PCR dengan 4 macam primer terhadap 19 sampel yang berasal dari 3 lokasi menunjukkan bahwa dalam setiap lokasi ditemukan adanya subpopulasi terutama pada parasitoid-parasitoid yang berasal dari satu telur inang. Gunung Bunder II dan Cugenang masing-masing membentuk metapopulasi sedangkan lokasi Gunung Bunder I tidak dapat diketahui struktur populasinya karena kekurangan sampel. Dendrogram menunjukkan semua parasitoid dari ketiga lokasi bercampur dan tersebar ke semua klaster.
STRUKTUR POPULASI PARASITOID TELUR
Trichogrammatoidea armigera
PADA BEBERAPA
TIPE AGROEKOSISTEM
DIANA NOVIANTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Judul Tesis : Struktur Populasi Parasitoid Telur Trichogrammatoidea armigera Pada Beberapa Tipe Agroekosistem
Nama : Diana Novianti
NIM : P055020191
Disetujui,
Komisi pembimbing
Dr. Ir. Muhammad Jusuf, DEA Ketua
Dr. Ir. Damayanti Buchori, M.Sc Dr. Ir. Bahagiawati Amirhusin, M.Sc
Anggota Anggota
Diketahui,
Ketua Program Studi Bioteknologi Dekan Sekolah Pascasarjana
Dr. Ir. Muhammad Jusuf, DEA Dr. Ir. Khairil Anwar Notodiputro, MS
RIWAYAT HIDUP
Penulis dilahirkan di Mempawah, Kabupaten Pontianak, Kalimantan Barat pada tanggal 3 November 1977 sebagai anak kedua dari pasangan Ayahanda Sartono dan Ibunda Nani Suwarni.
PRAKATA
Puji dan syukur penulis panjatkan pada Allah SWT atas segala karunia- Nya sehingga penelitian dan penulisan tesis yang merupakan salah satu syarat untuk meraih gelar Magister Sains di Sekolah Pasca Sarjana, Institut Pertanian Bogor dapat diselesaikan. Penelitian ini dilaksanakan sejak bulan Mei 2004, dengan judul “Struktur Populasi Parasitoid Telur Trichogrammatoidea armigera
Pada Beberapa Tipe Agroekosistem”.
Penulis menyampaikan terima kasih dan penghargaan yang sebesar-besarnya kepada Dr. Ir. Muhammad Jusuf, DEA selaku ketua komisi pembimbing sekaligus ketua program studi Bioteknologi SPs IPB atas dorongan, nasehat dan bimbingan selama penulis menjalani pendidikan dan penelitian. Terima kasih kepada Dr. Ir. Damayanti Buchori, M.Sc dan Dr. Ir. Bahagiawati Amirhusin, M.Sc selaku anggota komisi pembimbing yang telah banyak bersabar dan banyak membimbing serta mengarahkan penulis selama penelitian dan penulisan tesis. Terima kasih kepada Dr.Ir. Dedi Duryadi Solichin selaku dosen penguji tesis atas segala masukannya.
Di samping itu penulis menyampaikan terima kasih kepada Bapak Reflinur MSi rekan seperjuangan di IPB atas kerjasama, motivasi dan diskusi dengan penulis selama penelitian dan perkuliahan di IPB. Terima kasih kepada Ibu Dr. Dwinita atas pengarahan di laboratorium BB Biogen Bogor serta masukan-masukan yang berarti. Kepada Bapak Bandung Sahari MSi terima kasih atas waktu dan kerjasamanya dalam menjawab pertanyaan-pertanyaan tentang penelitian ini.
Penulis juga mengungkapkan terima kasih yang setulus-tulusnya serta syukur atas kesabaran dan pengertian Ayahanda H. Sartono SH MSi dan Ibunda Hj. Nani Suwarni, abang Eko Yulianto SET dan adik Rengga Damayanti SH. MSi, terima kasih untuk doa, dorongan, motivasi, kasih sayang sehingga penulis dapat menyelesaikan studi dan penelitian. Untuk Mas Rafli I. Kawulusan SP atas cinta dan kasih sayangnya, wah ternyata IPB telah mencari dan memberi yang terbaik buatku.
Tidak lupa terima kasih buat rekan-rekan seperjuangan Biotek 2002 (Mbak Win, Berty, Kiki, Roberdi, Mbak Anik, Kusuma, Bang Molah, Pipit, Uni Dewi, Bang Yamin, Apon, Fatimah), bang ilyas, kak lila, Yuyun, Diana kalimantan, Uci, Nila, temen-temen kos (Yati, Mbak Neni, Niken, Mbak Niken, Rya, Erin, dan Kak Ita) atas dorongan semangat dan kasih sayangnya kepada penulis dalam menyelesaikan penelitian ini. Serta lab’s crew yang tidak dapat disebutkan satu persatu tetapi telah banyak membantu penulis terutama saat begadang.
Penulis menyadari bahwa di dalam penyusunan tulisan ini masih banyak kekurangan dan kelemahan. Oleh sebab itu penulis sangat berharap adanya kritik dan saran dari pembaca demi perbaikan tulisan ini. Semoga karya ilmiah ini dapat bermanfaat di kemudian hari. Amiin.
Bogor, September 2006
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 3
Hipotesis ... 3
TINJAUAN PUSTAKA ... 4
Trichogrammatoidea armigera : Sistematika dan Inang ... 4
Struktur Populasi Parasitoid pada Agroekosistem ... 6
Peranan Teknologi Molekuler dalam Struktur Populasi ... 7
Ketidaksesuaian Reproduksi (Incompatibility Reproductive) ... 9
BAHAN DAN METODE ... 11
Tempat dan Waktu Penelitian ... 11
Sampling parasitoid telur T. armigera pada H. armigera ... 11
Pemeliharaan parasitoid telur di laboratorium ... 13
Identifikasi spesies parasitoid telur T. armigera ... 14
Isolasi DNA genom total T. armigera ... 14
Amplifikasi DNA dengan teknik RAPD-PCR ... 15
Separasi dan visualisasi hasil PCR ... 15
Skoring dan Analisis pola pita DNA ... 16
Uji ketidaksesuaian reproduksi ... 17
HASIL PENELITIAN ... 19
Sampling T. armigera dan persebaran H. armigera ... 19
Analisis struktur populasi parasitoid telur T. armigera ... 26
Pengaruh struktur populasi pada ketidaksesuaian reproduksi ... 30
PEMBAHASAN ... 35
Sampling T. armigera dan persebaran H. armigera ... 35
Analisis struktur populasi parasitoid telur T. armigera ... 36
Pengaruh struktur populasi pada ketidaksesuaian reproduksi ... 42
DAFTAR TABEL
Halaman
Tabel 1 Data keadaan lokasi sampling di daerah Bogor dan sekitarnya ... 12
Tabel 2 Data parasitoid telur T. armigera ... 19
Tabel 3 Data sampel female lineT. armigera ... 25
Tabel 4 Jumlah lokus yang dihasilkan dari 4 primer RAPD-PCR... 27
Tabel 5 Hasil perhitungan parameter struktur populasi ... 28
Tabel 6 Matriks jarak genetik 19 sampel dari 4 primer RAPD-PCR ... 32
DAFTAR GAMBAR
Halaman
Gambar 1 Skema pembagian kelompok T. armigera sampai famili ... 4
Gambar 2 Ukuran imago T. armigera pada penggaris sentimeter ... 5
Gambar 3 Peta lokasi pengambilan sampel di Bogor dan sekitarnya ... 11
Gambar 4 Ilustrasi sampling di lapangan ... 13
Gambar 5 Distribusi telur inang dan parasitoid di GB I Bogor ... 20
Gambar 6 Distribusi telur inang dan parasitoid di GB II Bogor ... 21
Gambar 7 Distribusi telur inang dan parasitoid di Cibodas Cianjur ... 22
Gambar 8 Distribusi telur inang dan parasitoid di Cugenang Cianjur ... 23
Gambar 9 Distribusi telur inang dan parasitoid di WK Cianjur ... 24
Gambar 10 Hasil amplifikasi DNA produk PCR dengan primer RUT2 ... 26
DAFTAR LAMPIRAN
Halaman
PENDAHULUAN
Latar Belakang
Populasi adalah sekelompok organisme yang berasal dari satu spesies yang mendiami habitat tertentu (Lincoln et al. 1982). Individu-individu yang berasal dari satu spesies tersebut memiliki jenis kelamin dan kelompok umur yang berbeda-beda. Di dalam suatu populasi terjadi interaksi antar individu-individu tersebut, misalnya melalui perkawinan. Perkawinan akan menyebabkan terjadinya aliran gen dari satu generasi ke generasi berikutnya. Di alam, populasi dapat dijumpai dalam bentuk random (acak) atau terstruktur (tidak random). Adanya jenis kelamin dan kelompok umur dari individu dalam suatu populasi serta adanya aliran genetik dalam populasi tersebut akan mengakibatkan populasi menjadi terstruktur (Roderick 1996).
Keadaan populasi di alam perlu dipelajari agar faktor yang mempengaruhi kelimpahan dan keberadaan suatu spesies dalam skala ruang dan waktu dapat diketahui (Berryman 2002). Mengetahui struktur populasi suatu spesies pada lahan pertanian terutama spesies-spesies serangga sangat penting bagi praktisi di bidang pengendalian hayati (Vaughn & Antolin 1998) karena dapat mempengaruhi kesuksesan penekanan populasi serangga hama di lapang terutama dengan menggunakan serangga parasitoid (Roderick & Navajas 2003).
Salah satu parasitoid yang penting dalam mengendalikan serangga hama adalah parasitoid telur Trichogrammatoidea armigera, spesies dari famili Trichogrammatidae (Hymenoptera) yang dapat menyerang berbagai jenis serangga hama terutama dari ordo Lepidoptera (Alba 1988) yang merupakan hama penting pada tanaman jagung (Nurindah & Bindra 1989). Selain itu parasitoid telur dapat mengendalikan hama pada fase paling awal sehingga kerusakan tanaman dapat dicegah sedini mungkin (Laba 1998).
tanamannya akan mempengaruhi kekayaan dan kefektifan komunitas musuh alami (Szentkiralyi & Kozar 1991) yang ada, termasuk diantaranya komunitas parasitoid (Corbett & Rosenheim 1996, Marino & Landis 1996).
Struktur populasi parasitoid dapat terbentuk oleh beberapa faktor antara lain (1) perilaku parasitoid (Via 1994; Vaughn & Antolin 1998); (2) kondisi agroekosistem dan (3) faktor abiotik yang berpengaruh pada distribusi parasitoid (Szentkiralyi & Kozar 1991, Roderick 1996, Slatkin 1994). Struktur populasi parasitoid di alam biasanya terbentuk melalui mekanisme perkawinan antar individu, apabila perkawinan terjadi secara acak dimana setiap individu mempunyai peluang yang sama untuk dapat berkopulasi dengan individu lainnya tanpa melihat jarak antar individu tersebut pada suatu area maka populasi parasitoid akan menjadi berkesinambungan. Struktur populasi seperti ini dikenal sebagai populasi tradisional (panmictic population) (McCullough 1996).
Di lapang tidak semua populasi selalu berbentuk random (acak), bahkan pada beberapa kasus dapat ditemukan adanya perkawinan antar individu yang tidak sepenuhnya acak melainkan terbatas pada individu-individu dalam kelompok-kelompok (subpopulasi). Struktur populasi yang terdiri atas beberapa subpopulasi dikenal sebagai metapopulasi (McCullough 1996). Metapopulasi dapat mendorong terjadinya adaptasi lokal di dalam subpopulasi karena ada perbedaan lingkungan skala kecil, adaptasi ini dapat meningkatkan perbedaan genetik antar sub-subpopulasi (Vaughn & Antolin 1998). Hal tersebut diduga terjadi pada parasitoid karena ditemukannya suatu fenomena ketidaksesuaian reproduksi (reproductive incompatibility) dimana genotipe-genotipe yang berbeda dalam satu spesies mengalami hambatan melakukan kopulasi sehingga sulit menghasilkan keturunan (Sorati et al. 1996).
Keberadaan metapopulasi di lapang memberikan implikasi yang cukup besar bagi pengendalian hayati (McCullough 1996), misalnya keberadaan struktur populasi akan mempengaruhi keragaman genetik yang ada sehingga pengambilan sampel (untuk keperluan ”mass rearing”) perlu mengantisipasi situasi seperti ini.
pita dan 1 jika ada pita. Data biner digunakan untuk menghitung beberapa parameter yaitu nilai keragaman genetik (Heterosigositas / H) Nei yang berkisar antara 0 – 0.5 (Nei 1973), nilai indeks fiksasi (Fst) antara 0 – 1 dan laju efektif migrasi (Nm) antara 0 – ~ dengan satuan individu/generasi, penghitungan ini menggunakan program komputer POPGENE 3.2 (Yeh et al. 1999).
Populasi yang acak dapat digambarkan dengan nilai keragaman genetik (H) yang tinggi menunjukkan besarnya laju migrasi yang terjadi (nilai Nm tinggi). Nilai H dan Nm yang tinggi mengakibatkan indeks fiksasi (Fst) rendah sehingga dengan Fst yang tidak terlalu besar maka perkawinan antar individu dapat terjadi secara acak. Hal ini sebaliknya terjadi pada populasi terstruktur atau metapopulasi yang menunjukkan nilai keragaman genetik (H) rendah, laju migrasi (Nm) juga rendah dan nilai Fst menjadi tinggi sehingga perkawinan terbatas pada individu-individu dalam kelompok-kelompok kecil (subpopulasi).
Diantara berbagai metode analisis DNA, RAPD-PCR merupakan salah satu teknik analisis DNA yang cepat dalam memberikan hasil (Kambhampati et al. 1992), mudah dalam pelaksanaannya dan akurat dalam mendeteksi keragaman berdasarkan pada amplifikasi daerah-daerah yang bervariasi pada suatu genom dengan menggunakan satu primer acak serta tidak memerlukan pengetahuan sekuen DNA (Williams et al. 1990). Menurut Hoy (1994) hasil pola pita DNA dengan teknik RAPD-PCR dapat memberikan informasi tentang variasi genetik dalam keseluruhan genom serangga.
Tujuan
1. Mempelajari struktur populasi parasitoid telur T. armigera dari beberapa tipe agroekosistem tanaman jagung dan geografi yang berbeda.
2. Mengetahui aliran genetik populasi-populasi T. armigera
TINJAUAN PUSTAKA
Trichogrammatoidea armigera : Sistematika dan Serangga Inang
Parasitoid telur Trichogrammatoidea sebagai salah satu agensia pengendali hayati merupakan suatu alternatif pengendalian hama yang ramah lingkungan dan memiliki potensi dalam menggantikan peran pestisida yang berbahaya bagi lingkungan dan kesehatan manusia. Parasitoid ini diklasifikasikan dalam Kelas: Insekta, Ordo: Hymenoptera, Subordo: Apocrita, Superfamili: Chalcidoidea, Famili: Trichogrammatidae (Borror et al. 1992).
Viggiani (1972 dalam Nagarkatti & Nagaraja 1977) membagi famili Trichogrammatidae ke dalam dua subfamili, yaitu Trichogrammatinae dan Oligosetinae. Subfamili Trichogrammatinae terdiri dari dua kelompok yaitu Trichogrammatini (16 genera) dan Paracentrobini (3 genera), sedangkan untuk Subfamili Oligosetinae adalah: Chaetostrichini (4 genera) dan Oligositini (5 genera). Famili Trichogrammatidae secara skematis dapat dilihat pada Gambar 1.
Gambar 1 Skema pembagian kelompok T. armigera dari superfamili sampai genera (Meilin 1999)
Trichogrammatidae memiliki tubuh dengan ukuran sangat kecil yaitu < 0.5 mm (Gambar 2). Sayapnya memiliki rumbai (fringe setae) dan matanya berwarna
Oligosetinae Trichogrammatinae
TRICHOGRAMMATIDAE Chalcidoidea
merah (Kalshoven 1981). Secara morfologi, imago spesies T. armigera mudah diidentifikasi dimana imago jantan dan betina memiliki kepala berwarna kuning tua cerah, antena berwarna kuning tua, toraks berwarna coklat tua, dan abdomen berwarna gelap, serta mempunyai ukuran tubuh 0.40-0.42 mm (Kalshoven 1981). Pada imago jantan memiliki antenna dengan rambut-rambut dengan gada dan funikula dengan panjang 2-3 kali dari lebar maksimum gada. Gadanya beruas tiga dan funikula beruas dua. Sedangkan antena betina memiliki rambut-rambut yang pendek pada funikula dan gada (Meilin 1999).
Gambar 2 Ukuran T. armigera pada penggaris sentimeter (CABI 1999)
Identifikasi secara morfologi, seperti sayap, antena, dan warna ternyata tidak stabil dan dapat dipengaruhi oleh lingkungan seperti suhu dan serangga inang yang digunakan dalam perbanyakan (Nagarkatti & Nagaraja 1977), sehingga tidak akurat lagi dalam karakterisasi spesies Trichogrammatoidea.
Pada penelitian sebelumnya tentang keragaman parasitoid telur di Pulau Jawa ditemukan tiga spesies Trichogrammatoidea yang memarasit telur P. xylostella sebagai inangnya, yaitu T. flandersi, T. cojuangcoi, dan T. armigera.
Spesies T. flandersi dan T. cojuangcoi merupakan spesies yang baru ditemukan di Indonesia (Meilin 1999).
T. armigera merupakan spesies parasitoid yang memiliki banyak inang. Selain inang P. xylostella, parasitoid ini juga memarasit hama Crocidolomia binotalis, H. armigera, Spodoptera incertulas, dan Etiella zinckenella (Meilin 1999).
Struktur Populasi Parasitoid pada Agroekosistem
Peranan parasitoid di agroekosistem dapat ditingkatkan keberadaannya dengan menyediakan sumber daya yang dibutuhkan oleh parasitoid, seperti inang alternatif, makanan untuk imago parasitoid (polen, nektar, dll), persediaan makanan yang selalu ada, tersedianya habitat di saat musim dingin berkepanjangan, dan iklim mikro yang sesuai (Dyer & Landis 1997). Sumber-sumber daya ini dapat tersedia jika lahan dipenuhi oleh tanaman yang beraneka-ragam (polikultur) (Altieri et al. 1978), atau dengan menjaga keberadaan semak-semak di sekitar lahan (Foster & Ruesink 1984).
Keberadaan parasitoid di agroekosistem dipengaruhi oleh keberadaan inangnya, oleh karena itu struktur populasi inang akan sangat mempengaruhi struktur populasi parasitoid yang ada (Roderick & Navajas 2003). Tetapi hal ini tidak berarti bahwa struktur populasi parasitoid mutlak dipengaruhi struktur populasi inangnya. Ada beberapa faktor lain yang sangat mempengaruhi struktur populasi parasitoid yaitu perilaku kopulasi (mating behaviour), perilaku pencarian inang (host searching behaviour), dan kemampuan terbang (Vaughn & Antolin 1998).
sebagai agens pengendali hayati harus mampu berkopulasi dengan individu-individu dari satu spesies yang berasal dari mana saja sehingga populasi parasitoid dapat berkesinambungan dan mempunyai kemampuan terbang yang tinggi di lapangan sehingga dapat menyebar ke segala penjuru dalam mencari inangnya.
Bila ternyata struktur populasi parasitoid terdiri dari sub-subpopulasi kecil, maka perlu dipikirkan lebih lanjut apa implikasi dari kondisi ini terhadap pengendalian hayati. Apakah hal ini akan berakibat pada pengambilan sampling parasitoid untuk “mass rearing”?. Dengan adanya beberapa subpopulasi maka dalam pencarian strain parasitoid yang paling baik perlu diambil sampel dari tiap-tiap subpopulasi tersebut. Oleh karena itu dalam penelitian ini sampling pada setiap lokasi dilakukan menyeluruh sehingga dapat menggambarkan struktur populasi parasitoid tersebut di lapang (Buchori et al. 2003). Saat ini keberadaan struktur populasi parasitoid dapat diketahui dan diteliti melalui pendekatan molekuler (Roderick & Navajas 2003).
Peranan Teknologi Molekuler dalam Analisa Struktur Populasi
Teknik molekuler merupakan teknologi terbaru yang sangat membantu dalam studi-studi tentang biologi serangga, ekologi serangga, dan genetika populasi baik pada habitat alaminya juga pada skala laboratorium. Analisis protein secara elektroforesis telah banyak bermanfaat bagi sebagian besar serangga, tetapi terdapat beberapa kelompok serangga yang sangat sulit untuk dideteksi variasi genetiknya, sehingga tidak dapat diteliti kecuali dengan menggunakan penanda-penanda DNA (Hoy 1994). Studi genetika populasi mempelajari bagaimana prinsip-prinsip genetika dapat diaplikasikan pada analisis keseluruhan populasi (Hartl 1988).
salah satu teknik yang dapat dilakukan dalam mempelajari variasi genetik serangga (Hoy 1994).
Penghitungan nilai keragaman genetik menggunakan beberapa software
komputer. Pita-pita polimorfik yang dihasilkan dari analisis RAPD-PCR diskoring secara kualitatif berdasarkan ada (1) dan tidak ada (0) pita pada setiap sampel. Data ditampilkan dalam bentuk matriks kemudian dianalisis untuk mendapatkan variasi genetik yang dikenal dengan nilai keragaman genetik (H) Nei (Nei 1973), menggunakan software POPGENE 3.2 (Yeh et al. 1999). Dengan software ini juga dapat digunakan untuk memperoleh nilai indeks fiksasi (Fst) dan laju efektif migrasi (Nm).
Analisis pita-pita DNA RAPD-PCR menghasilkan nilai-nilai H’Nei, Fst dan Nm yang dapat menggambarkan struktur populasi parasitoid (Apostol et al. 1996) dan (Zhou et al. 2000). Kedua penelitian ini menggunakan penanda RAPD meskipun RAPD merupakan penanda dominan sehingga pita-pita yang dihasilkan bukan berupa alel-alel yang dapat diketahui heterosigositasnya melainkan lokus-lokus dominan. Untuk mengetahui tingkat heterosigositas jika menggunakan teknik ini yaitu dengan cara pendekatan asumsi Hardy-Weinberg dalam penghitungan data. Kemudian dari kedua penelitian ini juga diperoleh informasi jika ukuran atau jumlah sampel kecil maka nilai Fst dan Nm dapat menjadi bias.
Studi variasi genetik pada prinsipnya bertujuan untuk mengkaji genotipe individu-individu di dalam atau antar populasi dan untuk mengetahui faktor-faktor yang menyebabkan terjadinya variasi genetik dari populasi tersebut. Variasi genetik dapat terjadi akibat adanya perubahan susunan sejumlah rantai nukleotida dari DNA. Perubahan itu dapat mempengaruhi fenotipe suatu organisme sehingga dapat dilihat secara langsung dengan mata atau melihat reaksinya terhadap perubahan lingkungan tertentu. Akan tetapi, apabila terjadinya variasi genetik karena terjadinya perubahan basa beberapa nukleotida saja, perubahan genetik mungkin tidak terekspresi secara fenotipe (Bustamam & Moeljopawiro 1998).
dapat memperbaiki hal itu dengan meningkatkan aliran gen diantara populasi-populasi (Slatkin 1994).
Ketidaksesuaian Reproduksi (Reproductive Incompatibility)
Penyebaran individu dari satu populasi ke populasi yang lain dapat meningkatkan aliran genetik diantara populasi-populasi tersebut. Biasanya penyebaran ini dilakukan dengan cara melakukan perkawinan.
Parasitoid dapat menghasilkan keturunan dengan cara kawin (seksual) dan tidak kawin (aseksual), betina diperoleh dari telur yang dibuahi oleh sperma jantan sehingga dilakukan dengan cara kawin. Induk betina dan jantan dapat mewariskan materi genetiknya sehingga anak betinanya mempunyai kromosom yang lengkap menjadi diploid. Sebaliknya serangga jantan diperoleh dengan cara aseksual, jantan hanya menerima materi genetik dari ibunya dan membawa setengah dari jumlah kromosom menjadi haploid. Serangga betina setelah kawin akan menyimpan sperma jantan di dalam spermateka (kantung sperma) sehingga betina dapat mengatur sendiri jenis kelamin anaknya. Pada saat serangga betina mengeluarkan telur, dia dapat membiarkan sperma membuahi telur untuk mendapat anak betina atau menahan sperma untuk anak jantan (Walter 2000).
Menurut Hamilton (1967) parasitoid ini memiliki ciri-ciri perilaku kawin sebagai berikut : (1) reproduksi adalah haplodiploid; (2) betina memutuskan berjumlah lebih banyak; (3) fase pradewasa merupakan serangga yang hidup secara berkelompok; (4) ada paling kurang 1 jantan tiap kelompok; (5) jantan dewasa lahir pertama; (6) jantan kawin beberapa kali dalam suksesi yang cepat; (7) mating terjadi segera setelah betina lahir atau bahkan sebelumnya; (8) jantan tinggal di dalam kelompok; dan (9) jumlah sperma yang diterima oleh setiap betina cukup untuk membuahi semua atau sebagian besar telur-telur.
maka populasi parasitoid terancam kepunahan sehingga program pengendalian hayati yang dilakukan menjadi gagal.
BAHAN DAN METODE
Tempat dan waktu
Penelitian dilakukan di Laboratorium Bioekologi Parasitoid dan Predator Departemen Hama dan Penyakit Tumbuhan IPB dan Laboratorium Biologi Molekuler Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Bogor. Dilaksanakan pada bulan Mei 2004 - Mei 2005.
Metode Penelitian
Sampling parasitoid telur T. armigera pada hama jagung H. armigera
Gambar 3 Peta lokasi pengambilan sampel di Bogor dan sekitarnya Keterangan : lokasi sampling Gunung Bunder I Ciampea, Bogor
lokasi sampling Gunung Bunder II Ciampea, Bogor
lokasi sampling Kebun Raya Cibodas, Puncak, Kabupaten Bogor lokasi sampling Cugenang, Cianjur
lokasi sampling Warung Kondang, Cianjur
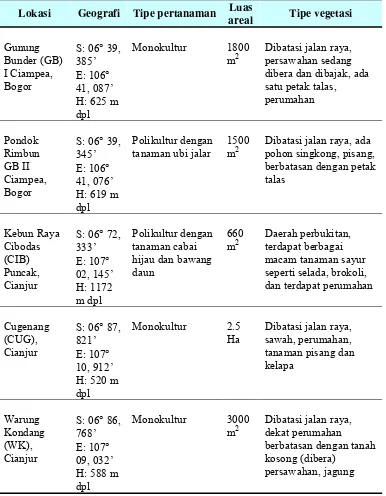
Tabel 1 Data keadaan lokasi sampling di daerah Bogor dan sekitarnya
Lokasi Geografi Tipe pertanaman Luas
areal Tipe vegetasi
Gunung Bunder (GB) I Ciampea, Bogor
S: 06° 39, 385’ E: 106° 41, 087’ H: 625 m dpl
Monokultur 1800 m2
Dibatasi jalan raya, persawahan sedang dibera dan dibajak, ada satu petak talas, perumahan Pondok Rimbun GB II Ciampea, Bogor
S: 06° 39, 345’ E: 106° 41, 076’ H: 619 m dpl
Polikultur dengan tanaman ubi jalar
1500 m2
Dibatasi jalan raya, ada pohon singkong, pisang, berbatasan dengan petak talas Kebun Raya Cibodas (CIB) Puncak, Cianjur
S: 06° 72, 333’ E: 107° 02, 145’ H: 1172 m dpl Polikultur dengan tanaman cabai hijau dan bawang daun
660 m2
Daerah perbukitan, terdapat berbagai macam tanaman sayur seperti selada, brokoli, dan terdapat perumahan
Cugenang (CUG), Cianjur
S: 06° 87, 821’ E: 107° 10, 912’ H: 520 m dpl
Monokultur 2.5 Ha
Dibatasi jalan raya, sawah, perumahan, tanaman pisang dan kelapa
Warung Kondang (WK), Cianjur
S: 06° 86, 768’ E: 107° 09, 032’ H: 588 m dpl
Monokultur 3000 m2
Dibatasi jalan raya, dekat perumahan
berbatasan dengan tanah kosong (dibera)
Umur tanaman jagung yang tepat untuk sampling adalah 60-70 hari setelah tanam (HST), yaitu pada saat keluarnya rambut pada tongkol jagung dan rambut belum kering. Selanjutnya sampling parasitoid dilakukan dengan cara
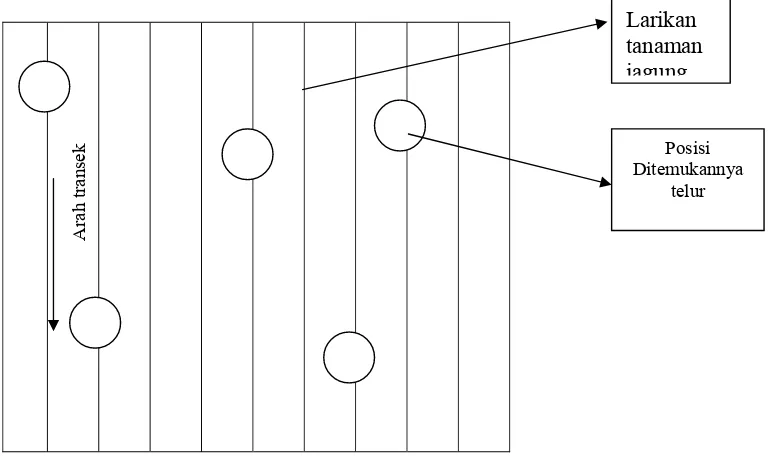
Gambar 4 Ilustrasi sampling di lapangan
mengumpulkan telur hama jagung H. armigera ada sepanjang larikan tanaman jagung yang disebut transek. Pada satu petak sampling diperlukan 5 transek dengan jarak antar transek adalah 10 larikan tanaman jagung. Telur-telur tersebut selanjutnya disimpan dalam tabung reaksi dan diberi label.
Telur-telur H. armigera dan parasitoid yang diperoleh dari kelima lokasi kemudian dipetakan pada gambar yang sesuai dengan posisi ditemukannya pada lokasi sampling menggunakan Microsoft Visio 2003. Selain itu hasil perolehan telur inang maupun parasitoidnya ditabulasi dan dihitung untuk mengetahui persebaran inang parasitoid telur tersebut secara statistik. Analisis menggunakan Chi-Square dengan mengikuti rumus sebaran Poison.
Pemeliharaan parasitoid telur di laboratorium
Telur hama jagung yang diperoleh dari lapang (5-8 hari setelah sampling) dibiarkan menetas dan selanjutnya keluar parasitoid telurnya. Jika terdapat parasitoid jantan dan betina yang berasal dari hasil tetasan satu telur inang
Larikan tanaman jagung
Posisi Ditemukannya
telur
Arah
t
ran
ditunggu sampai parasitoid tersebut melakukan kopulasi. Pada tahapan berikutnya, masing-masing parasitoid betina dipelihara secara individual dalam sebuah tabung dan setiap tabung disebut satu populasi atau satu female line.
Parasitoid telur dipelihara di laboratorium menggunakan telur inang pengganti, yaitu Corcyra cephalonica yang merupakan hama gudang. Telur inang ini ditempelkan pada kertas karton yang disebut pias menggunakan gum arabic. Setelah itu pias disimpan dalam freezer selama 2 jam. Selanjutnya pias dimasukkan ke dalam tiap tabung agar dapat diparasit dan sebagai pakan bagi parasitoid dewasa, ke dalam tabung tersebut dioleskan madu 10%. Pengamatan pias dilakukan setiap hari dan kira-kira 7-9 hari pias akan menetas.
Identifikasi spesies parasitoid telur T. armigera
Penelitian ini difokuskan pada spesies di atas sehingga semua sampel female line harus diidentifikasi. Identifikasi dilakukan setelah female line berkembang biak dengan baik. Kemudian membuat spesimen dari beberapa ekor parasitoid jantan masing-masing female line tersebut. Identifikasi dengan cara melakukan pengamatan terhadap alat genitalianya. Hasil pengamatan dibandingkan dengan gambar identifikasi menurut Alba (1988). Female line yang telah teridentifikasi spesiesnya dengan tepat, digunakan untuk penelitian ini.
Analisis Struktur Populasi Parasitoid Telur T. armigera Berdasarkan Karakter Molekuler
Isolasi DNA genom total T. armigera
dengan cara teknik sentrifugasi selama 15 menit pada 12000 rpm. Pindahkan supernatan yang mengandung DNA (kira-kira 700 μl) ke dalam tabung eppendorf yang baru.
DNA dipresipitasi dengan menambahkan 1X volume isopropanol dingin (v/v) yaitu 700 μl dan diinkubasi pada suhu –200
C selama semalam. Kemudian tabung disentrifugasi pada kecepatan 12000 rpm selama 15 menit untuk mendapatkan pelet DNA. Pelet DNA yang diperoleh dicuci 2 kali dengan ETOH 70% (v/v) dan dikeringanginkan. Pada tahapan terakhir pelet DNA diresuspensi dengan 30 μl buffer TE 1X dan disimpan di freezer untuk digunakan selanjutnya.
Amplifikasi DNA dengan teknik RAPD-PCR
Teknik PCR dilakukan dengan mengamplifikasi fragmen DNA dari sampel yang diisolasi tersebut di atas dengan menggunakan 4 primer RAPD, yaitu RUT1 (5’-ccctggacgtctacaat-3’), RUT2 (5’-ggtgcgggaa-3’), IDT45 (5’-tggcgcagtg-3’) dan IDT48 (5’-acgccagagg-3’). Reaksi PCR dilakukan dalam volume total 22 μl, yang terdiri dari 18 μl PCR supermix (dari Invitrogen), 2 μl primer (5 pmol/μl),
dan 2 μl DNA sampel. Proses amplifikasi dilakukan dalam mesin PCR MJ Research PCT-100 dengan tahapan pre- denaturate pada suhu 94°C selama 2
menit, dilanjutkan dengan 45 siklus tahapan denaturate pada suhu 94°C selama 45
detik, annealing 36°C selama 1 menit, dan elongation pada suhu 72°C selama 2
menit. Proses amplifikasi diakhiri dengan tahapan final elongation pada suhu 72°C selama 8 menit.
Separasi dan visualisasi hasil PCR
Alel : AA = p2 Aa = 2pq aa = q2 Jadi nilai hi = 2pq dan nilai Heterosigositas (H) =
direndam dalam larutan ethidium bromida selama 10 menit dan dibilas di air selama 30 menit sambil digoyang. Setelah itu fragmen DNA divisualisasi dan didokumentasi dengan meletakkan gel di bawah sinar UV dengan bantuan alat Chemidoc.
Skoring dan analisis pola pita DNA
Tiap pita yang muncul pada gel diskor secara visual. Pita yang muncul pada ukuran yang sama diberi skor 1 dan jika tidak muncul diberi skor 0. Setiap pita DNA yang muncul dan mempunyai ukuran berbeda dengan pita yang lain disebut sebagai satu lokus dan dalam satu lokus terdapat alel. Hasil skoring kemudian dianalisis dengan program komputer untuk mengetahui nilai-nilai berikut ini, yaitu
(1) nilai PIC (Polymorphic Information Contents) yang bertujuan untuk mengetahui tingkat polimorfisme yang dihasilkan oleh masing-masing primer. Dengan mengetahui nilai ini maka dapat diketahui primer mana yang dapat terus digunakan dalam penelitian-penelitian selanjutnya yang sejenis.
(2) nilai heterosigositas genetik (H) dengan menghitung frekuensi alel pada setiap lokus menggunakan program SPSS ver.11. Nilai H ini untuk mengetahui lokus-lokus dominan yang muncul dalam bentuk pita apakah merupakan homosigot atau heterosigot. Dengan mengetahui nilai heterosigositas maka dapat diketahui tingkat keragaman genetik suatu individu. Rumus yang digunakan merupakan rumus turunan dari asumsi kesetimbangan Hardy-Weinberg yaitu :
PIC Value = Jumlah skor 1 yang polimorfik
Jumlah pita dari satu primer X Jumlah sampel X 100%
1
s q
Heterosigositas subpopulasi (Hs) = 1 - ∑kwk∑iX2ki
(3) nilai H’Nei, merupakan nilai heterosigositas yang dirumuskan oleh Nei (1973) dan terdapat dalam software komputer. Nilai ini menunjukkan nilai keragaman genetik dalam populasi dan antar populasi.
(4) nilai Fst (fixation index) menunjukkan ada tidaknya aliran genetik pada
populasi atau mengindikasikan terjadinya perkawinan dengan populasi asing.
Serta (5) nilai Nm (migration rate) menunjukkan nilai laju migrasi genetik atau
ada tidaknya pengaruh aliran genetik terhadap populasi. Nilai H’Nei, Fst, dan Nm
tersebut dihitung menggunakan program komputer POPGENE ver 1.32.
Disamping itu, data yang diperoleh juga ditampilkan dalam bentuk dendrogram berdasarkan metode UPGMA dengan menggunakan program komputer NTSys versi 2.1. Kemudian tingkat kepercayaan pohon filogenetik yang diperoleh dianalisa menggunakan Bootstrap iterasi 1000x dengan program komputer Freetree dan Treeview32. Dengan program ini juga dapat dihasilkan tabel matrik jarak genetik antar female line sehingga dapat diketahui seberapa jauh perbedaan genetik female line satu dengan yang lain.
Uji Ketidaksesuaian Reproduksi (reproductive incompatibility test) Kegiatan ini memerlukan imago betina yang masih perawan dari masing-masing populasi female line, yaitu yang baru keluar dari telur inang dan belum pernah berkopulasi. Imago betina perawan diperoleh dengan memisahkan setiap
q Heterosigositas total (Ht) = 1 - ∑iχi2
Fst = 1 - Hs
Ht
Nm = 0.5 x 1 – Fst
telur terparasit dari pias, satu-persatu disimpan dalam masing-masing tabung eppendorf. Setelah telur menetas diamati apakah ada jantan yang dihasilkan, karena jika terdapat jantan dari telur yang sama dikhawatirkan betina tersebut telah melakukan kopulasi, sehingga tidak dapat digunakan dalam uji ini. Begitu juga jantan yang akan digunakan, walaupun jantan dapat melakukan kopulasi beberapa kali tetapi dalam uji ini diharapkan jantan sama sekali belum melakukan kopulasi. Sehingga untuk mendapatkannya sama dengan betina perawan.
Jantan dan betina perawan yang diperoleh dari masing-masing populasi kemudian diperlakukan dengan perkawinan silang, yaitu mengawinkan satu individu jantan, misalnya yang berasal dari populasi A dengan satu individu betina perawan yang berasal dari populasi B, begitu juga sebaliknya, satu individu betina perawan A dikawinkan dengan satu individu jantan dari populasi B. Jadi ada dua jenis perlakuan kawin antar dua populasi sedangkan populasi-populasi yang digunakan yaitu dari semua populasi female line dengan dikombinasikan. Dari dua jenis perlakuan kawin ini kemudian diulang sebanyak empat kali. Masing-masing ulangan menggunakan individu yang berbeda tetapi berasal dari populasi yang sama tiap perlakuan.
Proses kopulasi dilakukan dengan cara memasukkan setiap pasangan dalam satu tabung kemudian diamati perilakunya apakah terjadi kopulasi atau tidak kemudian dibiarkan sampai beberapa jam. Setelah itu dimasukkan pias dengan jumlah telur inang sebanyak kira-kira 30 butir dan diolesi madu.
HASIL PENELITIAN
Sampling T. armigera dan persebaran hama jagung H. armigera
Telur H. armigera banyak ditemukan pada saat keluarnya rambut pada tongkol jagung, dan sebelum rambut tersebut kering, yaitu sekitar 60-70 hari setelah tanam (HST). Parasitoid telur T. armigera umumnya memarasit telur H. armigera yang telah diletakkan pada rambut jagung tersebut.
[image:41.612.128.518.366.480.2]Berdasarkan sampling telur H. armigera di lima lokasi diperoleh telur H. armigera terparasit dengan sejumlah female line yang berbeda-beda. Dari kelima lokasi sampling tersebut, female line yang dapat dianalisis lebih lanjut dengan teknik molekuler hanya didapatkan dari telur hama terparasit yang berasal dari tiga lokasi sampling, yaitu Gunung Bunder I, Gunung Bunder II, dan Cugenang, data yang lengkap dapat dilihat pada tabel di bawah ini.
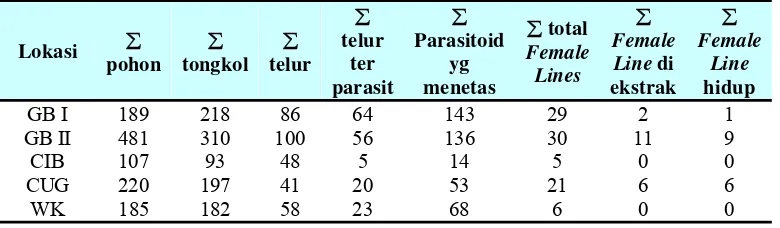
Tabel 2 Data parasitoid telur T. armigera pada penelitian ini
Lokasi ∑
pohon ∑ tongkol ∑ telur ∑ telur ter parasit ∑ Parasitoid yg menetas
∑ total
Female Lines
∑
Female Line di ekstrak
∑
Female Line
hidup
GB I 189 218 86 64 143 29 2 1 GB II 481 310 100 56 136 30 11 9
CIB 107 93 48 5 14 5 0 0
CUG 220 197 41 20 53 21 6 6
WK 185 182 58 23 68 6 0 0
Keterangan : GB : Gunung Bunder CIB : Cibodas CUG : Cugenang WK : Warung Kondang
Berikut adalah peta distribusi inang dan parasitoid di lokasi sampling Gunung Bunder I dan seterusnya pada masing-masing lokasi sampling.
Gambar 5 Peta distribusi inang dan parasitoid di Gunung Bunder I Keterangan : lokasi pohon / tongkol dimana telur inang ditemukan parasitoid yang keluar dari telur inang, bukan female line
female line
female line yang dapat diekstrak DNA
masih terdapat pohon-pohon jagung setelahnya
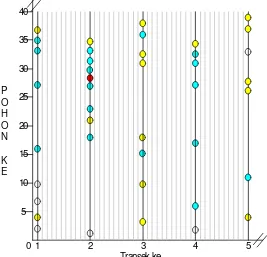
Lokasi GB I menunjukkan pola distribusi inang yang acak dan inang menyebar sama banyak di semua transek. Di lokasi ini kecenderungan inang untuk meletakkan telur-telurnya secara berdekatan dalam satu transek tampak jelas karena pada gambar terlihat ditemukannya telur-telur inang pada pohon-pohon yang lokasinya berurutan seperti pada transek 2 dan transek yang lain. Distribusi parasitoid selain mengikuti pola distribusi inangnya juga menunjukkan
0 1 2 3 4 5
Transek ke -5
10 15 20 25 30 35 40
P O H O N
Gambar 6 Peta distribusi inang dan parasitoid di Gunung Bunder II Keterangan : lokasi pohon / tongkol dimana telur inang ditemukan parasitoid yang keluar dari telur inang, bukan female line
female line
female line yang dapat diekstrak DNA
masih terdapat pohon-pohon jagung setelahnya
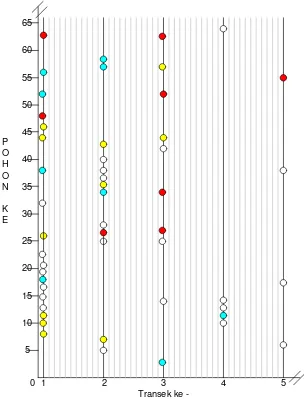
Gambar di atas menunjukkan pada lokasi GB II telur inang dapat ditemukan secara acak di semua transek. Dari transek pertama ditemukan lebih banyak telur inang dibandingkan transek-transek yang lain. Seperti GB I telur-telur inang yang berada dalam satu transek ditemukan pada pohon-pohon jagung yang berdekatan. Hal ini menunjukkan kecenderungan inang untuk meletakkan telurnya pada
0 1 2 3 4 5
Transek ke -5
10 15 20 25 30 35 40 45 50 55 60 65
P O H O N
tongkol-tongkol jagung yang berdekatan kecuali pada transek kelima dimana hanya sedikit telur inang yang ditemukan dengan jarak yang saling berjauhan antara satu dengan lainnya. Parasitoid juga ditemukan di lokasi ini dan menunjukkan pola distribusi yang mengikuti distribusi inang dimana pada telur inang yang diperoleh juga ditemukan parasitoidnya. Walaupun frekuensi telur terparasit lebih kecil dibandingkan dengan frekuensi telur inang karena terdapat beberapa telur-telur inang yang tidak terparasit.
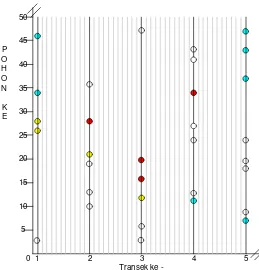
Gambar 7 Peta distribusi inang dan parasitoid di Cibodas
Keterangan : lokasi pohon / tongkol dimana telur inang ditemukan parasitoid yang keluar dari telur inang, bukan female line
female line
female line yang dapat diekstrak DNA
masih terdapat pohon-pohon jagung setelahnya
Pola distribusi inang di Cibodas juga menunjukkan pola yang acak karena pada semua transek ditemukan telur-telur inang. Telur-telur inang paling banyak ditemukan pada transek satu dan lima dengan jarak ditemukannya berdekatan termasuk pada transek-transek yang lain. Tetapi parasitoid sangat sedikit
0 1 2 3 4 5
Transek ke -5
10 15 20 25
P O H O N
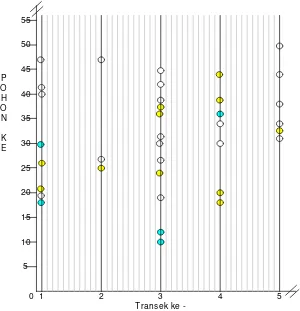
Gambar 8 Peta distribusi inang dan parasitoid di Cugenang
Keterangan : lokasi pohon / tongkol dimana telur inang ditemukan parasitoid yang keluar dari telur inang, bukan female line
female line
female line yang dapat diekstrak DNA
masih terdapat pohon-pohon jagung setelahnya
Lokasi sampling di Cugenang menunjukkan pola distribusi inang yang sama dengan lokasi-lokasi sampling sebelumnya yaitu acak. Tetapi pada lokasi ini banyaknya telur-telur inang yang ditemukan pada masing-masing transek hampir sama. Sehingga dapat dikatakan inang merata di semua bagian petak sampling. Kecenderungan inang untuk meletakkan telur-telurnya yang berdekatan agak tidak terlihat di lokasi ini karena ada jarak yang cukup jelas antar pohon ditemukannya telur inang. Hal ini tidak banyak mempengaruhi parasitoidnya karena parasitoid tetap mengikuti distribusi inangnya walaupun frekuensi ditemukannya tetap lebih kecil jika dibandingkan dengan frekuensi inang.
0 1 2 3 4 5
Transek ke -5
10 15 20 25 30 35 40 45 50
P O H O N
Gambar 9 Peta distribusi inang dan parasitoid di Warung Kondang Keterangan : lokasi pohon / tongkol dimana telur inang ditemukan parasitoid yang keluar dari telur inang, bukan female line
female line
female line yang dapat diekstrak DNA
masih terdapat pohon-pohon jagung setelahnya
Dari lokasi Warung Kondang ini, tampak adanya pola distribusi inang yang sama dengan lokasi GB II yaitu acak. Tetapi telur inang yang paling banyak ditemukan adalah pada transek tiga dimana letaknya di tengah petak sampling. Inangnya juga cenderung meletakkan telur pada tongkol-tongkol jagung yang berdekatan sehingga jika ditemukan satu telur inang pada satu pohon maka kemungkinan akan ditemukan juga telur inang di pohon-pohon sekitarnya.
0 1 2 3 4 5
Transek ke -5
10 15 20 25 30 35 40 45 50 55
P O H O N
Peta distribusi dari semua lokasi di atas menunjukkan keadaan di lapang dimana pola distribusi inang adalah acak dan pola distribusi parasitoid yang mengikuti pola inangnya tetapi hal itu juga harus ditunjang dengan hasil penghitungan data yang diperoleh. Data-data dan hasil penghitungannya dapat dilihat pada tabel-tabel di Lampiran 4 dimana dari hasil analisa persebaran telur inang H. armigera adalah acak karena (S2 / χ) > 1. Hal ini juga didukung oleh analisa Chi-square yang signifikan berarti pola distribusinya acak.
Untuk lokasi Gunung Bunder I diantara 64 telur hama yang terparasit diperoleh 29 female line, tetapi hanya 2 female line yang diekstraksi DNA-nya. Pada Gunung Bunder II dari 56 telur hama yang terparasit, hanya 11 female line
[image:47.612.139.503.426.691.2]dan Cugenang dari 20 telur hama yang terparasit diperoleh 6 female line yang diekstraksi DNA-nya. Secara keseluruhan ada 19 female line berasal dari tiga lokasi sampling yang diekstrak DNA kemudian dianalisis dengan teknik RAPD-PCR. Data ke-19 female line dapat dilihat pada tabel di bawah ini sesuai urutan pada gel di Gambar 10 halaman berikutnya.
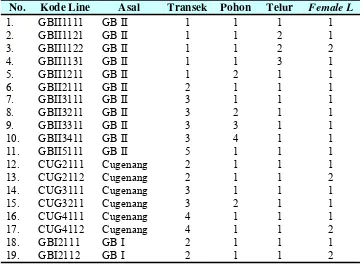
Tabel 3 Data sampel female line parasitoid telur T. armigera
Data yang tercantum pada tabel di atas adalah informasi tentang lokasi petak penelitian dimana sampel parasitoid ditemukan, penamaan female line
berdasarkan posisi asal sampel tersebut mulai dari transek, pohon jagung dan telur hama inang. Selanjutnya ke-19 sampel ini diekstrak DNA-nya dan DNA tersebut digunakan sebagai DNA template pada teknik RAPD-PCR yang dilakukan.
Analisis Struktur Populasi Parasitoid Telur T. armigera Berdasarkan Karakter Molekuler
Teknik RAPD-PCR pada penelitian ini menggunakan 4 macam primer. Satu
primer biasanya terdiri atas 10 oligonukleotida yang mengandung GC minimal 60% (Williams et al. 1990). Teknik RAPD-PCR dilakukan untuk melihat perbedaan genetik diantara individu-individu dengan melihat pola pita-pita sekuen
DNA yang terbentuk pada gel elektroforesis. Gel elektroforesis sebagai media visualisasi pita-pita tersebut. Hasil visualisasi 19 sampel secara berurutan sesuai tabel di atas dapat dilihat pada gambar di bawah ini.
Gambar 10 Hasil amplifikasi DNA produk PCR menggunakan primer RUT2 M = marker 100 bp DNA ladder, 1 – 19 = sampel female line
1 – 11 = female line dari Gunung Bunder II 12 – 17 = female line dari Cugenang 18 & 19 = female line dari Gunung Bunder I
Perbedaan genetik diantara individu-individu parasitoid yang diuji dapat dilihat berdasarkan tingkat polimorfisme pada beberapa lokus RAPD yang
200bp 1000bp
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
Tipe primer RAPD-PCR yang paling baik adalah yang paling banyak mendeteksi lokus genom suatu organisme sehingga menghasilkan tingkat polimorfisme paling tinggi. Tipe primer ini dapat digunakan pada penelitian-penelitian sejenis. Untuk mengetahui tingkat polimorfisme maka dilakukan penghitungan nilai PIC (Polymorphic Information Contents).
Berdasarkan nilai PIC ternyata primer RUT2 (5’-ggtgcgggaa-3’) memberikan nilai yang tertinggi yaitu 39.63% dibandingkan dengan primer yang lain. Sehingga primer RUT2 dapat direkomendasikan untuk digunakan dalam penelitian selanjutnya yang sejenis. Hasil penghitungan selengkapnya dapat dilihat pada tabel berikut ini.
Tabel 4 Jumlah lokus yang dihasilkan pada 19 parasitoid telur T. Armige
ra
Primer Sekuen ∑
lokus/pita
∑ pita poli morfik
∑ pita mono morfik
Nilai PIC
RUT 1 5’-ccctggacgtctacaat-3’ 16 14 2 24.67%
RUT 2 5’-ggtgcgggaa-3’ 17 14 3 39.63%
IDT 45 5’-tggcgcagtg-3’ 13 10 3 27.13%
IDT 48 5’-acgccagagg-3’ 12 10 2 11.84%
Jumlah 58 48 10 26.95%
Lokus-lokus yang terdeteksi pada DNA genom parasitoid dengan keempat
primer tersebut selanjutnya diterjemahkan sebagai data biner (dapat dilihat di lampiran) dalam menganalisis perbedaan dan kemiripan genetik parasitoid. Data biner dimasukkan ke dalam program komputer untuk melakukan penghitungan nilai-nilai heterosigositas (H), indeks fiksasi (Fst), dan laju migrasi (Nm).
Umumnya dari satu telur hama H. armigera akan keluar tiga imago parasitoid yang terdiri dari jantan dan betina, jika yang keluar jantan semua atau betina semua maka parasitoid-parasitoid ini tidak akan digunakan untuk analisis lebih lanjut. Tetapi jika parasitoid yang keluar terdapat betina dan jantan maka betina tersebut dapat digunakan dalam penelitian dengan cara dikawinkan terlebih dahulu dengan jantannya kemudian dipelihara secara individu dan diperbanyak melalui telur-telur inang pengganti. Betina-betina parasitoid ini akan berkembang-biak sampai beberapa generasi dan selanjutnya disebut sebagai female line.
diperoleh empat telur hama masing-masing menghasilkan dua female line yang berasal dari ketiga lokasi. Berdasarkan hasil penghitungan pada tabel di bawah ternyata terdapat keragaman genetik antar female line ini, meskipun nilai keragamannya yang ditunjukkan oleh H’Nei dan H sangat kecil.
Tabel 5 Hasil penghitungan H’Nei, Fst, Nm dan H dengan program komputer
Sumber
Keragaman Sampel H’Nei + sd Fst Nm H
1. Satu telur antar female lines 2. Satu pohon antar telur 3. Satu transek antar pohon 4. Satu lokasi antar transek 5. Setiap lokasi antar sampel 6. Sampel dari 3 lokasi
GBII1121& GBII1122. CUG2111& CUG2112. CUG4111& CUG4112. GBI2111& GBI2112. GBII1111, GBII1121, GBII1122 & GBII1131
a) Transek 1 GB II
b) Transek 3 GB II
c) Transek 3 Cugenang
a) Transek GB II b) Transek Cugenang c) Transek GB I
Gng Bunder II Cugenang Gng Bunder I
GB II + Cugenang + GB I
0.0345 +0.1278
0.069 + 0.1739
0.0603 +0.1643 0.0776 +0.1826 0.1034 +0.1785 0.1434 +0.1912 0.2155 +0.2065 0.1897 +0.2447 0.1852 +0.1724 0.2193 +0.1992 0.0776 +0.1826 0.1852 +0.1724 0.2193 +0.1992 0.0776 ±0.1826
armigera sehingga menjadi dasar dalam analisis struktur populasi parasitoid tersebut.
Tidak dapat dipastikan apakah female line-female line yang keluar dari satu telur hama berasal dari satu induk betina parasitoid yang memarasit telur hama tersebut hanya dengan melihat nilai keragaman genetiknya. Untuk lebih memastikan apakah mereka berasal dari satu induk maka pada kegiatan mendatang perlu dilakukan kegiatan sekuensing DNA female line tersebut, misalnya terhadap gen penyandi 18s ribosomal DNA. Urutan basa nukleotida yang diperoleh dari hasil sekuensing dapat disejajarkan (alignment) sehingga diketahui tingkat homologinya, jika tingkat homologinya diatas 90% maka mereka dapat dikatakan berasal dari satu induk.
Untuk menghitung nilai Fst menggunakan asumsi Hs (heterosigositas
subpopulasi) dan Ht (heterosigositas total), sedangkan nilai Nm diperoleh dengan
melakukan pembagian terhadap Fst. Pada tabel di atas terdapat nilai 0 pada Fst dan
tak berhingga (∼) pada Nm di lokasi GB I. Ini disebabkan oleh sampel female line
yang didapat dari lokasi tersebut hanya dua dan itupun berasal dari satu telur hama maka antara Hs dan Ht sama, sehingga hasil penghitungan nilai Fst 0 dan nilai Nm
menjadi tak berhingga.
Tabel 5 juga menunjukkan nilai-nilai Fst dan Nm yang sama antara sumber
Struktur Populasi Parasitoid Telur T. armigera dan Pengaruhnya terhadap Ketidaksesuaian Reproduksi
Untuk lebih memudahkan dalam menggambarkan struktur populasi tersebut maka dengan bantuan program komputer dapat dibuat dendrogram kemiripan genetik 19 sampel. Berdasarkan hasil analisis kemiripan genetik melalui
Unweighted Pair Group Method Using Arithmatic (UPGMA) diperoleh pengelompokkan 19 sampel parasitoid telur dalam bentuk pohon filogenetik (dendrogram).
[image:52.612.128.510.263.508.2]
Gambar 11 Dendrogram kemiripan genetik 19 sampel parasitoid T. armigera
berdasarkan 4 primer acak
Keterangan : Nilai bootstrap ditunjukkan oleh angka-angka merah pada percabangan.
Female line yang berwarna sama berasal dari lokasi yang sama GBI biru berasal dari Gunung Bunder I
GBII merah berasal dari Gunung Bunder II CUG hijau berasal dari Cugenang
1000x iterasi kedua kelompok ini mempunyai nilai confident 100%. Hal ini menunjukkan bahwa pembagian parasitoid ini menjadi dua kelompok utama sudah menunjukkan kelompok yang stabil. Menurut Felsenstein (1985) klaster-klaster yang memiliki nilai bootstrap 95% atau lebih dapat dikatakan sebagai klaster yang benar-benar stabil. Sampel yang berasal dari dua lokasi sampling berbeda tetapi berada pada kelompok yang sama pada dendogram menunjukkan bahwa tidak terjadi pemisahan kelompok berdasarkan lokasi sampling.
Pada dendogram terlihat di lokasi GB II terdapat satu tongkol yang memiliki 3 telur inang, salah satu telur inang menghasilkan 2 female line tetapi kedua
female line tersebut berada pada kelompok yang terpisah bahkan salah satu dari kedua female line tersebut mengelompok dengan female line yang berasal dari telur inang yang lain tetapi masih berada pada satu tongkol. Kedua hal ini menunjukkan adanya 2 kemungkinan yang terjadi di lapang yaitu kemungkinan pertama adalah antara telur inang pertama dan kedua ternyata diparasit oleh induk betina parasitoid yang sama dan kemungkinan kedua adalah female line-female line yang berasal dari telur inang yang sama bukan berasal dari induk betina parasitoid yang sama. Kemungkinan kedua ini sangat mungkin terjadi di alam karena hal ini juga terdapat di lokasi Cugenang, bahkan kelompoknya terpisah jauh antara female line-female line yang berasal dari satu telur inang.
Tabel 6 Matriks jarak genetik 19 sampel T. armigera hasil RAPD-PCR GBI I11 11 GBI I11 21 GBI I11 22 GBI I11 31 GBI I12 11 GBI I21 11 GBI I31 11 GBI I32 11 GBI I33 11 GBI I34 11 GBI I51 11 CUG 2 11 1 CUG 2 11 2 CUG 3 11 1 CUG 3 21 1 CUG 4 11 1
GBII1111 0.00
GBII1121 0.09 0.00
GBII1122 0.05 0.08 0.00
GBII1131 0.29 0.19 0.28 0.00
GBII1211 0.32 0.25 0.35 0.28 0.00
GBII2111 0.19 0.10 0.18 0.21 0.18 0.00
GBII3111 0.19 0.10 0.18 0.25 0.14 0.08 0.00
GBII3211 0.33 0.22 0.32 0.25 0.18 0.23 0.19 0.00
GBII3311 0.22 0.17 0.18 0.30 0.32 0.19 0.22 0.37 0.00
GBII3411 0.35 0.36 0.33 0.45 0.37 0.37 0.33 0.43 0.31 0.00
GBII5111 0.20 0.10 0.19 0.25 0.19 0.12 0.08 0.24 0.19 0.27 0.00
CUG2111 0.21 0.11 0.20 0.27 0.24 0.17 0.12 0.21 0.24 0.28 0.04 0.00
CUG2112 0.32 0.20 0.30 0.23 0.21 0.17 0.17 0.07 0.32 0.46 0.23 0.14 0.00
CUG3111 0.44 0.36 0.47 0.39 0.24 0.33 0.33 0.30 0.45 0.24 0.30 0.36 0.33 0.00
CUG3211 0.48 0.36 0.46 0.38 0.25 0.29 0.29 0.35 0.41 0.40 0.27 0.32 0.38 0.15 0.00
CUG4111 0.42 0.38 0.40 0.33 0.36 0.36 0.36 0.37 0.40 0.24 0.33 0.39 0.40 0.35 0.35 0.00
CUG4112 0.24 0.15 0.23 0.32 0.15 0.16 0.09 0.10 0.23 0.30 0.17 0.18 0.22 0.37 0.33 0.39
GBI2111 0.09 0.08 0.12 0.27 0.25 0.14 0.14 0.30 0.17 0.36 0.14 0.19 0.29 0.36 0.40 0.42
GBI2112 0.22 0.13 0.22 0.31 0.14 0.15 0.07 0.27 0.18 0.29 0.08 0.12 0.25 0.36 0.28 0.38
Keterangan : Nilai 0 (warna kuning) = tidak ada jarak karena merupakan populasi yang sama
Nilai jarak genetik ke-19 sampel parasitoid tersebut seperti terlihat pada tabel sangat bervariasi, yaitu berkisar antara 0.04 - 0.48. Jarak genetik terdekat (0.04) adalah antara parasitoid telur CUG2111 dari Cugenang dengan GBII5111 dari Gunung Bunder II dan jarak genetik (0.48) terjauh adalah antara CUG3211 dari Cugenang dan GBII1111 dari Gunung Bunder II.
Meskipun sudah diketahui jarak genetik terdekat dan terjauh, data ini belum dapat menjelaskan adanya pengaruh yang cukup signifikan dari perbedaan lokasi pengambilan sampel yang mempunyai tipe pertanaman dan letak geografis tertentu terhadap komposisi genetik parasitoid ini. Ditunjukkan dengan parasitoid-parasitoid yang berasal dari satu lokasi dapat memiliki hubungan kekerabatan yang dekat dan jauh dengan parasitoid-parasitoid yang berasal dari lokasi yang lain. Jadi tidak ada dua lokasi yang memiliki kekerabatan yang dekat saja atau yang jauh saja.
Struktur populasi yang dapat dilihat sebagai hasil penghitungan beberapa sumber keragaman ditambah dengan adanya dendrogram perlu diuji apakah ada hubungan atau pengaruh struktur populasi tersebut dengan aspek biologi parasitoid terutama pada aspek reproduksi. Oleh karena itu dilakukan uji ketidaksesuaian reproduksi diantara populasi-populasi sampel parasitoid.
Sampel parasitoid yang mampu bertahan hidup sampai dengan dilakukan uji ini ternyata sangat sedikit sehingga kombinasi pasangan kawin juga sedikit, ini ditunjukkan dengan lebih banyak daerah yang kosong berarti tidak dilakukan uji tersebut dibandingkan dengan tanda (+) dan (-). Uji ini dilakukan masing-masing empat ulangan untuk setiap pasang dan data yang diperoleh ditampilkan dalam bentuk tanda (+) jika terjadi kesesuaian reproduksi dan tanda (-) jika terjadi ketidaksesuaian reproduksi.
Tabel 7 Data uji ketidaksesuaian reproduksi
♀
X
♂
GBII1111 GBII1122 GBII1211 GBII2111 GBII3111 GBII3311 GBII3411 GBII5111 CU
G2111
C
U
G3111
C
U
G4111
C
U
G4112
GBI2112
GBII1111 K + + +
GBII1122 + K + + - -
GBII1211 + K + +
GBII2111 + K + + - -
GBII3111 + + K
GBII3311 + K + GBII3411 + K +
GBII5111 + K +
CUG2111 - K +
CUG3111 - K +
CUG4111 - - + + + K +
CUG4112 + K
GBI2112 + + + K
Keterangan : Kosong = tidak dilakukan uji perkawinan
K = kontrol, terjadi kesesuaian reproduksi pada pembiakan massal + = terjadi kesesuaian reproduksi
- = terjadi ketidaksesuaian reproduksi
Pengujian ketidaksesuaian reproduksi parasitoid T. armigera dilakukan di laboratorium dengan mengawinkan female line parasitoid yang masih hidup secara acak. Setelah diperoleh data hasil pengujian ketidaksesuaian reproduksi, kemampuan kopulasinya dihubungkan dengan nilai matriks jarak genetik masing-masing sampel parasitoid (Tabel 6) sehingga bisa ditelusuri kembali apakah parasitoid-parasitoid yang memiliki jarak genetik yang jauh akan lebih sulit untuk saling berkopulasi dibandingkan dengan parasitoid-parasitoid yang memiliki jarak genetik yang dekat atau ada fenomena lain yang mempengaruhi kopulasi ini.
PEMBAHASAN
Sampling T. armigera dan persebaran H. Armigera
Survei lokasi merupakan suatu kegiatan yang sangat penting dilakukan sebelum sampling untuk mendapatkan lokasi pertanaman jagung yang tepat dan mendukung dalam menemukan telur H. armigera yang terparasit oleh parasitoid. Peluang untuk mendapatkan H. armigera yang terparasit ini sangat didukung oleh tipe agroekosistem tanaman jagung, lansekap di sekitarnya dan letak lokasinya secara geografis (Swift et al. 1996). Oleh karena itu sebelum melakukan sampling dilakukan beberapa kali survei lokasi untuk mendapatkan lokasi sampling yang tepat. Dari sekian kali survei diperoleh lima lokasi sampling dimana hasil samplingnya dapat dilihat pada Tabel 2 dan 3 hasil penelitian.
Besar kecilnya jumlah parasitoid yang diperoleh pada saat sampling dapat dipengaruhi oleh beberapa faktor, misalnya struktur fisik lokasi sampling dan sumber daya yang tersedia bagi parasitoid tersebut. Walaupun sederhananya struktur fisik lansekap suatu lokasi pertanian, tidak menjamin beberapa spesies parasitoid mau hidup di sana karena kebanyakan spesies parasitoid membutuhkan sumber daya yang tersedia di habitat non pertanian (Landis & Menalled 1998). Selain itu jumlah parasitoid dapat dipengaruhi oleh jumlah perolehan telur inang dari hasil sampling kelima lokasi.
Hal di atas dapat dibuktikan melalui gambar distribusi telur inang dan parasitoid yang ada pada hasil penelitian. Dari gambar terlihat pola distribusi telur inang dalam ruang adalah acak (random). Dimana telur inang menyebar secara acak di seluruh ruang pada lokasi sampling. Pola distribusi telur inang yang acak (random) sesuai dengan aturan sebaran Poison. Oleh karena itu untuk menghitung chi-square-nya maka digunakan rumus pada sebaran Poison.
parasitoid mengikuti atau sama dengan pola distribusi telur inang terutama di lokasi-lokasi Gunung Bunder I, Gunung Bunder II, Warung Kondang, dan Cugenang. Sedangkan di Cibodas parasitoid yang ditemukan sangat sedikit sehingga tidak memperlihatkan pola distribusinya. Hal ini menunjukkan bahwa terdapat pengaruh pola distribusi telur inang terhadap pola distribusi parasitoid. Sehingga dapat dibuktikan bahwa struktur populasi inang dapat mempengaruhi struktur populasi parasitoid.
Tipe agroekosistem pertanaman jagung juga mempengaruhi perolehan jumlah parasitoid, ini terbukti pada lokasi sampling di Gunung Bunder II yang mempunyai tipe agroekosistem polikultur memberikan jumlah total female line
dan jumlah total female line yang diekstrak DNA lebih banyak dibandingkan dengan lokasi-lokasi yang lain. Ini juga menunjukkan bahwa female line yang berasal dari lokasi Gunung Bunder II mempunyai kemampuan bertahan hidup yang sangat tinggi dalam kondisi laboratorium karena mampu beradaptasi pada lingkungan yang heterogen di alam.
Analisis Struktur Populasi Parasitoid Telur T. armigera Berdasarkan Karakter Molekuler
Sebagian besar populasi alami organisme mempunyai variasi genetik yang bermacam-macam. Pada organisme yang mengalami reproduksi secara seksual, sepasang individu atau lebih umumnya berbeda secara genetik,