PENGEMBANGAN DAN VALIDASI METODE ANALISIS
PENETAPAN KADAR VITAMIN A DALAM MINYAK GORENG
SAWIT SECARA KROMATOGRAFI CAIR KINERJA TINGGI
SLAMET SUKARNO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TUGAS AKHIR DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tugas akhir ”Pengembangan dan Validasi Metode Analisis Penetapan Kadar Vitamin A dalam Minyak Goreng Sawit Secara Kromatografi Cair kinerja Tinggi” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam Daftar Pustaka di bagian akhir tugas akhir ini.
Bogor, September 2011
ABSTRACT
SLAMET SUKARNO. The Development and Validation of Method Analysis for Vitamin A Determination in Palm Oil by High Performance Liquid Chromatography. Under Direction of FERI KUSNANDAR and HANIFAH NURYANI LIOE.
The fortification of vitamin A in cooking palm oil is being mandatorily regulated in 2013. To control the implementation this standard, the laboratory capacity to analyze vitamin A is required. The vitamin A analysis must be valid, selective, rapid, easy and practical. The objective of this study was to validate a modified standardized method of vitamin A analysis by a High Performance Liquid Chromatography (HPLC).
All validation parameters (liniearity, accuracy, precision, selectivity, robustness, LOD, and LOQ) met the requirement. Vitamin A in palm oil matrix could be analyzed by HPLC method by using a mobile phase of acetonitrile:water (80:20) with flux rate of 1,75 mL/min, and ultraviolet detector at 325 nm. This condition used a C-18 column.
RINGKASAN
SLAMET SUKARNO. Pengembangan dan Validasi Metode Analisis Penetapan Kadar Vitamin A dalam Minyak Goreng Sawit secara Kromatografi Cair kinerja Tinggi. Dibimbing oleh FERI KUSNANDAR dan HANIFAH NURYANI LIOE.
Penyakit akibat kurang vitamin A (KVA) merupakan masalah global yang menimpa sebagian besar penduduk di dunia termasuk juga di Indonesia. KVA disebabkan oleh kurangnya vitamin A di dalam jaringan yang dapat menimbulkan gangguan secara subklinis atau klinis. Salah satu kebijakan pemerintah yang ditempuh untuk menanggulangi masalah KVA adalah fortifikasi vitamin A ke dalam minyak goreng sawit. Tahun 2013 pemerintah akan mengimplementasikan Standar Nasional Indonesia (SNI) wajib minyak goreng sawit yang difortifikasi dengan vitamin A. Menurut Rancangan Standar Nasional Indonesia (RSNI) tentang persyaratan mutu minyak goreng sawit, jumlah vitamin A yang harus ditambahkan ke dalam produk tersebut minimal 45 IU/g. Seiring dengan peraturan dan kondisi diatas maka perlu dilakukan pengawasan atau monitoring terhadap kadar vitamin A dalam minyak goreng sawit, baik pada tingkat industri, distributor dan konsumen. Untuk itu dibutuhkan suatu metode analisis yang valid, selektif, cepat, mudah dan praktis untuk identifikasi dan penetapan kadar vitamin A, khususnya vitamin A dalam minyak goreng sawit.
Metode analisis vitamin A dalam minyak goreng sawit masih sulit didapat, namun metode analisis vitamin A dalam produk pangan dengan menggunakan peralatan moderen, diantaranya dengan menggunakan kromatografi cair kinerja tinggi (KCKT) sudah banyak yang dikembangkan oleh peneliti terdahulu. Namun kelemahan dari metode yang ada adalah kerumitan dalam penyiapan sampel (saponifikasi, ekstraksi dan pemekatan atau penguapan pelarut organik yang digunakan). Oleh karena itu, perlu dilakukan pengembangan metode analisis penetapan kadar vitamin A minyak goreng sawit yang mudah dan praktis, namun memberikan hasil yang valid. Metode analisis yang dikembangkan oleh peneliti ini berbasis kromatografi, tanpa proses saponifikasi, tanpa ekstrasi dan tanpa penguapan pelarut organik.
Tujuan dari penelitian ini adalah mendapatkan kondisi optimum untuk analisis vitamin A dalam minyak goreng sawit, melakukan validasi metode analisis yang sudah dipilih pada optimasi metode dan melakukan uji coba penetapan kadar vitamin A dalam minyak goreng sawit yang beredar di pasaran menggunakan metode yang telah dikembangkan.
Teknik penyiapan sampel dilakukan dengan cara melarutkan sampel meng-gunakan campuran n-pentana dan 2-propanol, ditambahkan larutan butil hidroksi toluena sebagai antioksidan dan tetra-n-butil amonium hidroksida untuk melaku-kan reaksi subsitusi retinil palmitat menjadi retinol, yang selanjutnya dianalisis dengan menggunakan kromatografi cair kinerja tinggi.
Kromatografi cair kinerja tinggi (KCKT) dilakukan dengan menggunakan teknik isokratik menggunakan kolom C18 (Waters Xbridge®, dengan panjang 250
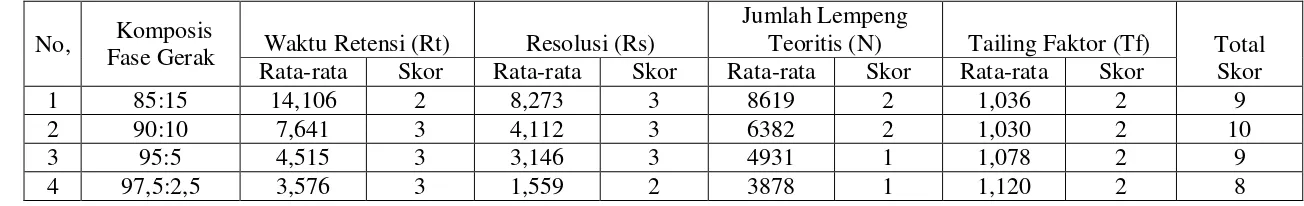
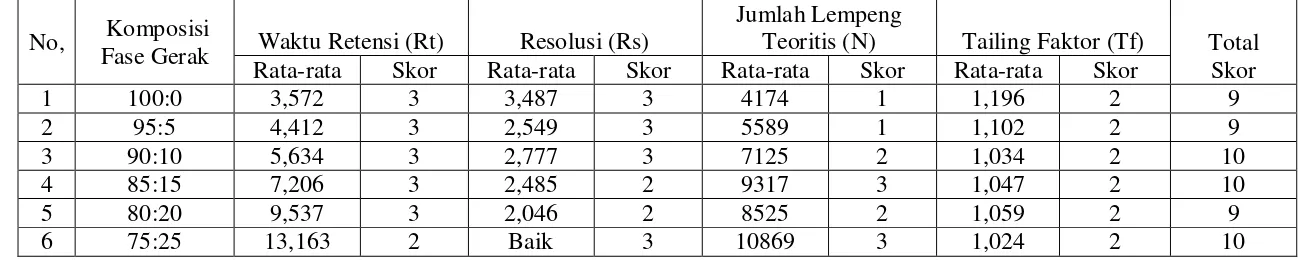
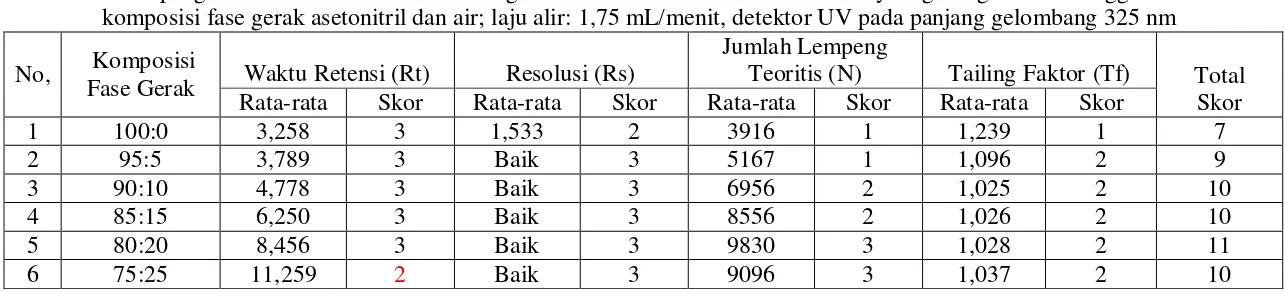
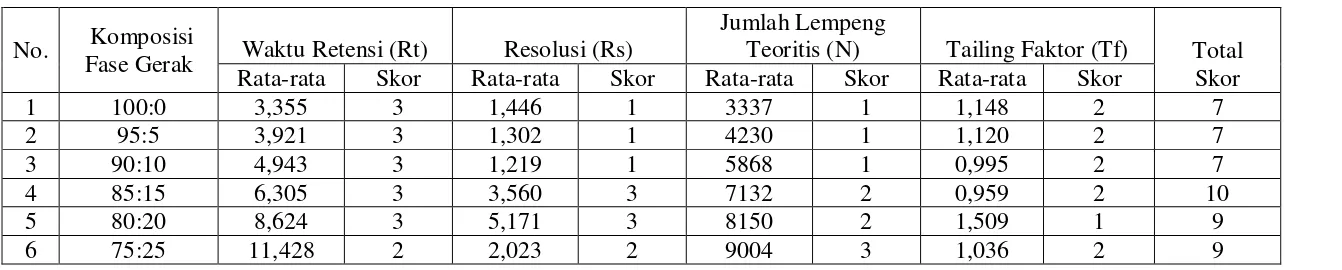
1,0 mL/menit; metanol dan air (97,5:2,5; 95:5; 90:10; dan 85:15) dengan laju alir 1,5 mL/menit; asetonitril dan metanol (75:25; 50:50; dan 25:75) dengan laju alir 1,0 mL/menit, asetonitril dan air (100:0; 95:5; 90:10; 85:15; 80:20 dan 75:25) dengan laju alir: 1,5 dan 1,75 mL/menit dan detektor yang digunakan detektor ultraviolet dan detektor fluoresens. Kromatogram yang dihasilkan dievaluasi berdasarkan waktu retensi (Rt), resolusi (Rs), jumlah lempeng teoritis (N) dan faktor ikutan (Tf). Hasil pemilihan kondisi optimum yang memberikan skor tertinggi adalah: komposisi fase gerak asetonitril dan air (80:20), laju alir 1,75 mL/menit menggunakan detektor ultraviolet pada panjang gelombang 325 nm.
Metode ini valid yang ditunjukkan dengan kurva kalibrasi dan linieritas pada rentang konsentrasi 0,4443 IU/mL sampai dengan 13,5233 IU/mL dengan koefesien regresi (r) 0,99997 dan standar deviasi relatif regresi linier (Vxo) 2,54
%; presisi dengan 3 tingkat konsentrasi dengan nilai % RSD antara 1,87 sampai 1,97; akurasi dengan 3 tingkat konsentrasi yang memberikan nilai persen pero-lehan kembali antara 96,84 - 102,39 %; selektivitas dan robustness bila diban-dingkan dengan hasil uji presisi yang memberikan nilai yang tidak berbeda bermakna, batas deteksi (LOD) 1,66 IU/g dan batas kuantisasi (LOQ) 5,89 IU/g.
Hasil analisis terhadap 4 merek sampel minyak goreng sawit yang beredar di pasaran menggunakan metode analisis hasil pengembangan diperoleh kadar vitamin A berturut-turut adalah: 16,75; 28,39; 29,07 dan 66,35 IU/g. Matriks sampel yang terkandung dalam berbagai merek minyak goreng sawit yang beredar di pasaran tidak mengganggu dalam analisis penetapan kadar vitamin A.
©Hak Cipta milik IPB, tahun 2011 Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
PENGEMBANGAN DAN VALIDASI METODE ANALISIS
PENETAPAN KADAR VITAMIN A DALAM MINYAK GORENG
SAWIT SECARA KROMATOGRAFI CAIR KINERJA TINGGI
SLAMET SUKARNO
Tugas Akhir
sebagai salah satu syarat untuk memperoleh gelar Magister Profesi Pada Program Studi Teknologi Pangan
SEKOLAH PASCA SARJANA INSTITUT PERTANIAN BOGOR
Judul Tugas Akhir : Pengembangan dan Validasi Metode Analisis Penetapan Kadar Vitamin A dalam Minyak Goreng Sawit secara Kromatografi Cair Kinerja Tinggi
Nama Mahasiswa : Slamet Sukarno Nomor Pokok : F252070025
Program Studi : Magister Profesi Teknologi Pangan
Menyetujui, Komisi Pembimbing
Dr. Ir. Ferif Kusnandar, M.Sc Dr. Ir. Hanifah Nuryani Lioe, MSi (Ketua) (Anggota)
Mengetahui
Ketua Program Studi Dekan Sekolah Pasca Sarjana Magister Profesi Teknologi Pangan
Dr. Ir. Lilis Nuraida, M.Sc Dr. Ir. Dahrul Syah, M.Sc. Agr
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tugas akhir ini disusun sebagai syarat untuk memperoleh gelar Magister Profesi pada Program Magister Profesional Teknologi Pangan. Tema penelitian ini diangkat dari masalah yang dijumpai oleh peneliti dalam pekerjaan sehari-hari. Tugas akhir ini diharapkan dapat memberikan manfaat bagi pembaca, dapat memberikan kontribusi bagi dunia pendidikan di Indonesia mengenai validasi metode analisis untuk pengujian kimia pangan dan bagi pemerintah dalam rangka pengawasan program fortifikasi vitamin A dalam minyak goreng sawit.
Terima kasih yang mendalam penulis ucapkan kepada Dr. Ir. Feri Kusnandar, MSc. dan Dr. Ir. Hanifah Nuryani Lioe, MSi. selaku komisi pembimbing yang telah membimbing penulis dengan sabar dalam menyusun tugas akhir ini, mulai dari awal hingga akhir. Ucapan terimakasih juga penulis sampaikan kepada Dr. Ir. Nuri Andarwulan, MSi. selaku penguji luar komisi yang telah banyak memberikan masukan dalam penyusunan tesis ini. Terima kasih juga disampaikan kepada Dr. Lilis Nuraida, MSc selaku Koordinator Program Studi Magister Profesi Teknologi Pangan yang telah membantu, memberikan dorongan dan kesempatan yang begitu banyak kepada penulis.
Penulis juga menyampaikan terima kasih kepada seluruh dosen pengajar di Program Studi Teknologi Pangan yang telah mencurahkan pengetahuan kepada penulis selama menjalani kuliah di sekolah pascasarjana Magister Profesi Teknologi Pangan. Tidak lupa terima kasih juga kepada ibu Tika dan ibu Mar yang telah banyak membantu dalam masalah administrasi.
Terima kasih juga penulis ucapkan kepada Drs. Siam Subagyo, Apt., MSi selaku Kepala Pusat Pengujian Obat dan Makanan Nasional, yang telah memberikan kesempatan kepada penulis untuk melanjutkan pendidikan pascasarjana di kampus tercinta, IPB.
Tak lupa kepada Dra. Niza Nemara, Apt., MSi selaku Kepala Bidang Pangan, penulis ucapkan terimaksih yang sebesar-besarnya atas dukungannya selama ini. Penulis juga mengucapkan terima kasih kepada sejawat di Bidang Pangan Pusat Pengujian Obat dan Makanan Nasional terutama kepada ibu Herni, ibu Yuli dan pak Yanto. Terima kasih juga kepada teman-teman yang telah memberikan motivasi kepada penulis. Juga kepada teman-teman MPTP batch 4, terima kasih semua. Penulis juga mengucapkan terima kasih sebesar-besarnya kepada istri, anak, orang tua dan keluarga tercinta atas dukungan dan doanya.
Penulis menyadari bahwa karya ilmiah ini belum sempurna, sehingga penulis lain dapat melanjutkan untuk penyempurnaannya. Semoga karya ilmiah ini bermanfaat.
Bogor, September 2011
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 3 Oktober 1965 sebagai anak kedua dari ayah Musnindar (almarhum) dan Ibu Hartini. Tahun 1985 penulis lulus dari SMA Negeri 1 Jakarta dan pada tahun yang sama penulis diterima di Jurusan Farmasi Fakultas MIPA Universitas Indonesia Depok dan mendapatkan gelar sarjana Farmasi pada tahun 1991. Penulis melanjutkan ke program profesi apoteker pada perguruan tinggi yang sama dan menamatkannya pada tahun 1993.
Mulai tahun 1993 penulis bekerja sebagai pegawai negeri sipil di Instalasi Farmasi Rumah Sakit Umum Daerah Sintang Kalimantan Barat sampai dengan tahun 1996. Selanjutnya pada tahun 1996 penulis mutasi kerja ke Balai Pengawas Obat dan Makanan di Pontianak hingga tahun 2003. Sejak tahun 2003 hingga sekarang penulis mutasi kerja ke Pusat Pengujian Obat dan Makanan Nasional, Badan POM RI di Jakarta dan ditempatkan pada Laboratorium Pangan. Berbagai pelatihan, seminar dan tugas-tugas kantor tentang laboratorium kimia pangan dan keamanan pangan telah diikuti oleh penulis selama bekerja di Badan POM RI.
xi
DAFTAR ISI ... xi
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
I PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Tujuan ... 3
1.4 Manfaat ... 4
1.5 Ruang Lingkup Penelitian ... 4
II TINJAUAN PUSTAKA 2.1 Vitamin A ………... 5
2.2 Minyak Goreng Sawit ……... 8
2.3 Fortifikasi Pangan ... 11
2.4 Metode Analisis Penetapan Kadar Vitamin A ... 13
2.5 Instrumentasi KCKT ... 18
2.6 Validasi Metode Analisis ... 22
III BAHAN DAN METODE 3.1 Waktu dan Tempat ... 27
3.2 Alat dan Bahan ... 27
3.3 Metode Penelitian ... 28
IV HASIL DAN PEMBAHASAN ………... 41
V KESIMPULAN DAN SARAN 5.1 Kesimpulan ………... 69
5.2 Saran ……... 69
DAFTAR PUSTAKA ………. 71
xii Halaman Tabel 1 Rumus empiris dan bobot molekul dari vitamin A alkohol (retinol)
dan ester vitamin A (ester retinil) ... 5
Tabel 2 Sifat-sifat kimia fisika retinol dan retinil palmitat ... 6
Tabel 3 Angka kecukupan gizi (AKG) vitamin A ……….. 8
Tabel 4 RSNI 3 Persyaratan mutu minyak goreng sawit ……… 11
Tabel 5 Keberterimaan akurasi berdasarkan persen rekoveri ... 25
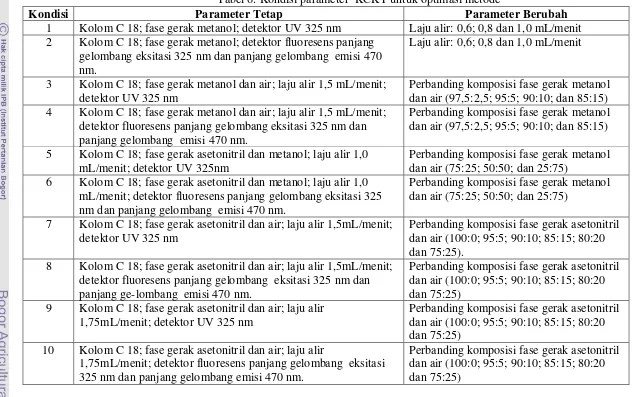
Tabel 6 Kondisi parameter KCKT untuk optimasi metode ……… 31
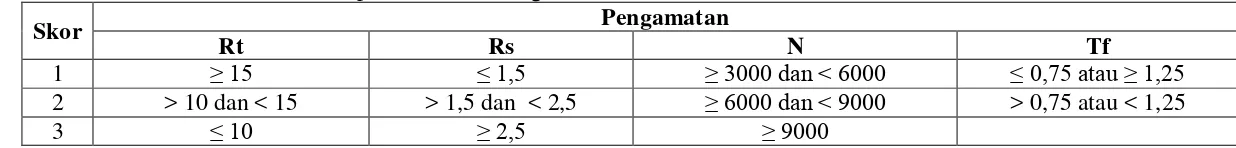
Tabel 7 Penentuan skor untuk penilaian kromatogram ... 32
Tabel 8 Data hasil uji penetapan aktivitas baku vitamin A ... 41 Tabel 9 Data pengamatan kromatogram KCKT vitamin A (dalam matriks
minyak goreng sawit) menggunakan komposisi fase gerak metanol 100 % kecepatan laju alir 1,0 mL/menit, 0,8 mL/menit dan 0,6 mL menit dan detektor UV………
47
Tabel 10 Data pengamatan kromatogram KCKT vitamin A (dalam matriks minyak goreng sawit) menggunakan komposisi fase gerak metanol 100 % kecepatan laju alir 1,0 mL/menit, 0,8 mL/menit dan 0,6 mL/menit dan detektor fluoresens ………...
47
Tabel 11 Data pengamatan kromatogram vitamin A dalam matriks minyak goreng sawit menggunakan variasi komposisi fase gerak methanol:air dengan perbandingan: 85:15; 90:10; 95:5 dan 97,5:2,5 pada kecepatan laju alir 1,5 mL/menit dan detektor UV ……….
47
Tabel 12 Data pengamatan kromatogram vitamin A dalam matriks minyak goreng sawit menggunakan variasi komposisi fase gerak methanol:air dengan perbandingan: 85:15; 90:10; 95:5 dan 97,5:2,5 pada kecepatan laju alir 1,5 mL/menit dan detektor fluoresens ………..
48
Tabel 13 Data pengamatan kromatogram vitamin A dalam matriks minyak goreng sawit menggunakan variasi komposisi fase gerak asetonitril :metanol dengan perbandingan: 75:25; 50:50 dan 25:75 pada kecepatan laju alir 1,0 mL/menit dan detektor UV ………
48
Tabel 14 Data pengamatan kromatogram vitamin A dalam matriks minyak goreng sawit menggunakan variasi komposisi fase gerak asetonitril: metanol dengan perbandingan 75:25; 50:50 dan 25:75 pada kecepatan laju alir 1,0 mL/menit dan detektor fluoresens ………..
49
Tabel 15 Data pengamatan kromatogram vitamin A dalam matriks minyak goreng sawit menggunakan variasi komposisi fase gerak asetonitril dan air dengan perbandingan: 100:0; 95:5; 90:10; 85:15; 80:20 dan 75:25 pada kecepatan laju alir 1,5 mL/menit dan detektor dengan detektor UV ………
49
Tabel 16 Data pengamatan kromatogram vitamin A dalam matriks minyak goreng sawit menggunakan variasi komposisi fase gerak asetonitril dan air dengan perbandingan: 100:0; 95:5; 90:10; 85:15; 80:20 dan 75:25 pada kecepatan laju alir 1,5 mL/menit dan detektor dengan
xiii dan air dengan perbandingan: 100:0; 95:5; 90:10; 85:15; 80:20 dan 75:25 pada kecepatan laju alir 1,75 mL/menit dan detektor dengan detektor UV ……… Tabel 18 Data pengamatan kromatogram vitamin A dalam matriks minyak
goreng sawit menggunakan variasi komposisi fase gerak asetonitril dan air dengan perbandingan: 100:0; 95:5; 90:10; 85:15; 80:20 dan 75:25 pada kecepatan laju alir 1,75 mL/menit dan detektor dengan detektor fluoresens ……….
51
Tabel 19 Data hasil uji kesesuaian sistem (UKS) baku vitamin A ... 52 Tabel 20 Data uji presisi penetapan kadar vitamin A dalam matriks minyak
goreng sawit ...
57 Tabel 21 Data uji akurasi penetapan kadar vitamin A dalam matriks minyak
goreng sawit ………...
58 Tabel 22 Data uji selektivitas (spesifisitas) vitamin A dalam matriks minyak
goreng sawit ………...
61 Tabel 23 Data hasil uji robustness dengan perubahan penambahan jumlah
pereaksi menjadi: n-pentana 3 mL, larutan antioksidan butil hidroksi toluena 3 mL dan larutan tetra-n-butil amonium hidroksida 10,5 mL ...
62
Tabel 24 Data hasil uji robustness dengan perubahan pengurangan jumlah pereaksi n-pentana 2 mL, larutan antioksi dan butil hidroksi toluena 2 mL dan larutan tetra-n-butil amonium hidroksida 9,5 mL ……….
62
Tabel 25 Data hasil uji robustness dengan perubahan komposisi fase gerak asetonitril:air (81:19) dan kecepatan laju alir 1,74 mL/menit …….…...
63 Tabel 26 Data hasil uji robustness dengan perubahan komposisi fase gerak
asetonitril:air (79:21) dan kecepatan laju alir 1,76 mL/menit ….……...
63 Tabel 27 Data uji robustness vitamin A dalam matriks minyak goreng sawit
dengan perubahan metode penggunakan kolom C 18 yang mereknya berbeda (kolom merek Shimadzu Shim-pack, Jepang: panjang 250 mm, diameter dalam 1,46 mm dan ukuran partikel 5 µm) ……….
64
Tabel 28 Data hasil analisis penetapan kadar vitamin A dalam minyak goreng sawit yang beredar di pasaran ………
xiv Halaman Gambar 1 Struktur molekul vitamin A alkohol (retinol), ester vitamin A (ester
retinil) ……….. 5
Gambar 2 Diagram blok sistem KCKT ... 19 Gambar 3 Reaksi antara vitamin A palmitat dengan tetra-n-butil ammonium
hidroksida ...
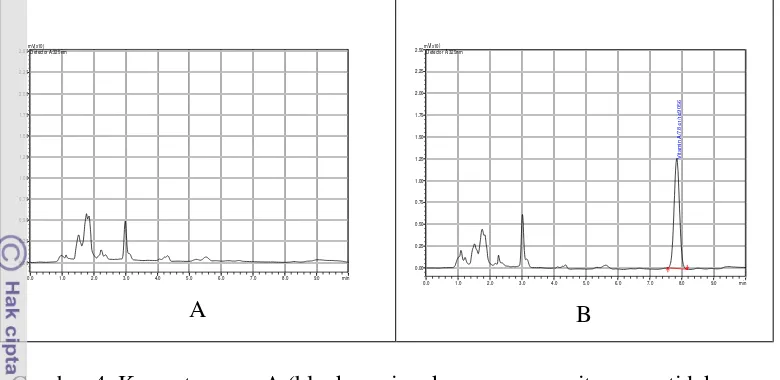
42 Gambar 4 Kromatogram A (blanko minyak goreng sawit yang tidak
mengandung vitamin A) dan kromatogram B (baku vitamin A palmitat dalam matriks minyak goreng sawit); yang dianalisis menggunakan KCKT kolom C18 pada kondisi optimum dengan komposisi fase gerak yang terdiri dari campuran asetonitril:air (80:20), laju alir 1,7 mL/menit dengan detektor UV pada panjang gelombang 325 nm………...
46
Gambar 5 Kurva kalibrasi baku vitamin A dalam matriks minyak goreng sawit 53 Gambar 6 Hubungan antara konsentrasi vitamin A dengan faktor respon
detektor ... Gambar 7 Hubungan antara konsentrasi vitamin A terhadap residual …………. 54 Gambar 8 Kromatogram A (campuran senyawa kimia yang sedang dilakukan
uji selektivitasnya: butil hidroksi anisol, butil hidroksi toluena, propil galat, tersier butil hidrokuinon, vitamin D, vitamin E dan beta karoten) dan kromatogram B (baku vitamin A) dalam matriks sampel minyak goreng sawit yang dianalisis menggunakan KCKT kolom C18 pada kondisi optimum dengan komposisi fase gerak yang terdiri dari campuran asetonitril:air (80:20), laju alir 1,75 mL/menit dengan detektor UV pada panjang gelombang 325 nm ………..
59
Gambar 9 Kurva regresi kadar vitamin A terhadap tinggi noise dengan sinyal (S/N) ...
xv Lampiran 1 Contoh menghitung aktivitas baku vitamin A ... 76 Lampiran 2 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak metanol 100 %, laju alir 1,0 mL/menit (memberikan tekanan 78 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 77 Lampiran 3 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak metanol 100 %, laju alir 1,0 mL/menit (memberikan tekanan 78 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang
gelombang emisi 470 nm ………. 77
Lampiran 4 Kromatogram KCKT vitamin A (dalam matriks minyak goreng sawit) menggunakan fase gerak metanol 100 %, laju alir 0,8 mL/menit (memberikan tekanan 64 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 78 Lampiran 5 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak methanol 100 %, laju alir 0,8 mL/menit (memberikan tekanan 64 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang
gelombang emisi 470 nm ………. 78
Lampiran 6 Kromatogram KCKT vitamin A (dalam matriks minyak goreng sawit) menggunakan fase gerak methanol 100 %, laju alir 0,6 mL/menit (memberikan tekanan 45 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 79 Lampiran 7 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak metanol 100 %, laju alir 0,6 mL/menit (memberikan tekanan 45 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang
gelombang emisi 470 nm ………. 79
Lampiran 8 Kromatogram KCKT vitamin A (dalam matriks minyak goreng sawit) menggunakan fase gerak metanol:air (85:15) laju alir 1,5 mL/menit (memberikan tekanan 200 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 80 Lampiran 9 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak metanol:air (85:15) laju alir 1,5 mL/menit (memberikan tekanan 200 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang
gelombang emisi 470 nm ………. 80
xvi fluoresens pada panjang gelombang eksitasi 325 nm dan panjang gelombang emisi 470 nm ………. 81 Lampiran 12 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak metanol:air (95:5) laju alir 1,5 mL/menit (memberikan tekanan 147 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 82 Lampiran 13 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak metanol:air (95:5) laju alir 1,5 mL/menit (memberikan tekanan 147 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang
gelombang emisi 470 nm ………. 82
Lampiran 14 Kromatogram KCKT vitamin A (dalam matriks minyak goreng sawit) menggunakan fase gerak metanol:air (97,5:2,5) laju alir 1,5 mL/menit (memberikan tekanan 132 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 83 Lampiran 15 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak metanol:air (97,5:2,5) laju alir 1,5 mL/menit (memberikan tekanan 132 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang
gelombang emisi 470 nm ………. 83
Lampiran 16 Kromatogram KCKT vitamin A (dalam matriks minyak goreng sawit) menggunakan fase gerak asetonitril:metanol (75:25) laju alir 1,0 mL/menit (memberikan tekanan 49 kgf) dengan detektor UV pada panjang gelombang 325 nm ……….. 84 Lampiran 17 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak asetonitril:metanol (75:25) laju alir 1,0 mL/menit (memberikan tekanan 49 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang
gelombang emisi 470 nm ………. 84
Lampiran 18 KCKT vitamin A (dalam matriks minyak goreng sawit) menggunakan fase gerak asetonitril:metanol (50:50) laju alir 1,0 mL/menit (memberikan tekanan 54 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 85 Lampiran 19 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak asetonitril:metanol (50:50) laju alir 1,0 mL/menit (memberikan tekanan 54 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang
gelombang emisi 470 nm ………. 85
xvii fluoresens pada panjang gelombang eksitasi 325 nm dan panjang
gelombang emisi 470 nm ………. 86
Lampiran 22 Kromatogram KCKT vitamin A (dalam matriks minyak goreng sawit) menggunakan fase gerak asetonitril:air (100:0) laju alir 1,5 mL/menit (memberikan tekanan 71 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 87 Lampiran 23 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak asetonitril:air (100:0) laju alir 1,5 mL/menit (memberikan tekanan 71 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang
gelombang emisi 470 nm ………. 87
Lampiran 24 Kromatogram KCKT vitamin A (dalam matriks minyak goreng sawit) menggunakan fase gerak asetonitril:air (95:5) laju alir 1,5 mL/menit (memberikan tekanan 75 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 88 Lampiran 25 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak asetonitril:air (95:5) laju alir 1,5 mL/menit (memberikan tekanan 75 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang
gelombang emisi 470 nm ………. 88
Lampiran 26 Kromatogram KCKT vitamin A (dalam matriks minyak goreng sawit) menggunakan fase gerak asetonitril:air (90:10) laju alir 1,5 mL/menit (memberikan tekanan 85 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 89 Lampiran 27 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak asetonitril:air (90:10) laju alir 1,5 mL/menit (memberikan tekanan 85 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang gelombang emisi 470 nm ………... 89 Lampiran 28 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak asetonitril:air (85:15) laju alir 1,5 mL/menit (memberikan tekanan 94 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 90 Lampiran 29 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak asetonitril:air (85:15) laju alir 1,5 mL/menit (memberikan tekanan 94 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang
gelombang emisi 470 nm ………. 90
xviii fluoresens pada panjang gelombang eksitasi 325 nm dan panjang gelombang emisi 470 nm ………... 91 Lampiran 32 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak asetonitril:air (75:25) laju alir 1,5 mL/menit (memberikan tekanan 113 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 92 Lampiran 33 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak asetonitril:air (75:25) laju alir 1,5 mL/menit (memberikan tekanan 113 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang
gelombang emisi 470 nm ………... 92
Lampiran 34 Kromatogram KCKT vitamin A (dalam matriks minyak goreng sawit) menggunakan fase gerak asetonitril : air (100:0) laju alir 1,75 mL/menit (memberikan tekanan 83 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 93 Lampiran 35 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak asetonitril:air (100:0) laju alir 1,75 mL/menit (memberikan tekanan 83 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang gelombang emisi 470 nm ………... 93 Lampiran 36 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak asetonitril:air (95:5) laju alir 1,75 mL/menit (memberikan tekanan 90 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 94 Lampiran 37 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak asetonitril:air (95:5) laju alir 1,75 mL/menit (memberikan tekanan 90 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang gelombang emisi 470 nm ………... 94 Lampiran 38 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak asetonitril:air (90:10) laju alir 1,75 mL/menit (memberikan tekanan 100 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 95 Lampiran 39 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
sawit) menggunakan fase gerak asetonitril:air (90:10) laju alir 1,75 mL/menit (memberikan tekanan 100 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang gelombang emisi 470 nm ………... 95 Lampiran 40 Kromatogram KCKT vitamin A (dalam matriks minyak goreng
xix fluoresens pada panjang gelombang eksitasi 325 nm dan panjang
gelombang emisi 470 nm ………... 96
Lampiran 42 Kromatogram KCKT vitamin A (dalam matriks minyak goreng sawit) menggunakan fase gerak asetonitril:air (80:20) laju alir 1,75 mL/menit (memberikan tekanan 123 kgf) dengan detektor UV pada panjang gelombang 325 nm ………. 97
Lampiran 43 Kromatogram KCKT vitamin A (dalam matriks minyak goreng sawit) menggunakan fase gerak asetonitril:air asetonitril:air (80:20) laju alir 1,75 mL/menit (memberikan tekanan 123 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang gelombang emisi 470 nm ……….. 97
Lampiran 44 Kromatogram KCKT vitamin A (dalam matriks minyak goreng sawit) menggunakan fase gerak asetonitril:air (75:25) laju alir 1,75 mL/menit (memberikan tekanan 130 kgf) dengan detektor UV pada panjang gelombang 325 nm ………..………….. 98
Lampiran 45 Kromatogram KCKT vitamin A (dalam matriks minyak goreng sawit) menggunakan fase gerak asetonitril:air (75:25) laju alir 1,75 mL/menit (memberikan tekanan 130 kgf) dengan detektor fluoresens pada panjang gelombang eksitasi 325 nm dan panjang gelombang emisi 470 nm ………... 98
Lampiran 46 Data kurva kalibrasi baku vitamin A dalam matriks minyak goreng sawit ... 99
Lampiran 47 Contoh menghitung faktor respon detektor ……….. 99
Lampiran 48 Data hubungan antara konsentrasi vitamin A dengan faktor respon detektor ………. 100
Lampiran 49 Data hubungan antara konsentrasi vitamin A dengan residual ... 101
Lampiran 50 Contoh menghitung kadar vitamin A dalam sampel (pada uji presi-si) ……….. 102
Lampiran 51 Contoh menghitung RSD Horwitz ………... 103
Lampiran 52 Contoh menghitung akurasi vitamin A ... 104
Lampiran 53 Contoh cara menghitung uji t ………... 105
1.1 LATAR BELAKANG
Kesehatan masyarakat dunia dewasa ini bukan dihadapkan pada
masalah defisiensi gizi makro, tetapi pada masalah defisiensi gizi mikro.
Masalah defisiensi gizi mikro yang yang utama dihadapi adalah anemia gizi
besi, gangguan akibat kekurangan iodium (GAKI) dan kekurangan vitamin A
(KVA) (Martianto, 2011). Kekurangan zat gizi mikro berpotensi mengganggu
kesehatan masyarakat, sehingga dapat merusak kualitas sumber daya manusia
Indonesia. Subdit Bina Gizi Mikro Direktorat Bina Gizi Masyarakat juga
mengemukakan bahwa masalah kekurangan gizi di kalangan masyarakat
Indonesia terjadi pada setiap siklus kehidupan (World Bank 2006).
Sampai saat ini, penduduk Indonesia, terutama yang berpenghasilan
rendah baik di perkotaan dan pedesaan, masih banyak yang mengalami
masalah kekurangan zat gizi mikro. Data Organisasi Kesehatan Dunia
(WHO) pada 2009 menunjukkan lebih dari sembilan juta anak-anak Indonesia
dan satu juta perempuan menderita kekurangan vitamin A. Tercatat pula 25 -
30 % kematian bayi dan balita di dunia disebabkan oleh kekurangan vitamin
A, sedangkan di Indonesia sekitar 14,6 % anak di atas usia satu tahun
mengalami kekurangan vitamin A. (Krisnamurthi, 2010)
Penyakit akibat kurang vitamin A (KVA) disebabkan oleh kurangnya
vitamin A di dalam jaringan yang dapat menimbulkan gangguan secara
subklinis maupun klinis. Menurut WHO, kurang vitamin A subklinis ditandai
dengan nilai retinol serum 0,35 – 0,70 µmol/L (10 -20 µg/dL), meskipun
pada kadar retinol serum sampai 1,05 µ mol/L masih dijumpai gejala
sub-klinis. Gejala KVA subklinis ditandai dengan gangguan diferensiasi sel dan
gangguan pada sistem imunitas. KVA klinis terjadi bila retinol serum kurang
dari 0,35 µmol/L (kurang dari 10 µg/dL) dengan gejala antara lain buta senja,
gangguan pertumbuhan dan xeroptalmia (Smith, 2000).
Program penanggulangan kekurangan vitamin A di Indonesia dilakukan
dengan 3 cara yaitu: diversifikasi konsumsi pangan, suplementasi vitamin A
untuk menanggulangi masalah kekurangan vitamin A harus tepat untuk
menjawab kebutuhan dan harus menggunakan sistem dan teknologi yang
tersedia. Kombinasi beberapa intervensi mencakup promosi pemberian air
susu ibu (ASI), modifikasi makanan (misalnya meningkatkan ketersediaan
pangan dan meningkatkan konsumsi pangan), fortifikasi pangan dan
suple-mentasi. Fortifikasi vitamin A ke dalam minyak goreng sawit perlu dilakukan
dengan alasan (1) produk pangan di Indonesia sebagian besar menggunakan
minyak goring, (2) untuk mengurangi penyakit akibat KVA, maka perlu
adanya kebijakan yang tepat untuk menanggulangi masalah KVA, (3) salah
satu kebijakan yang ditempuh adalah fortifikasi vitamin A dalam minyak
goring, dan (4) pemerintah akan menetapkan standar yang mewajibkan kepada
seluruh produsen minyak goreng sawit untuk melakukan fortifikasi vitamin A
ke dalam produknya.
Target pencapaian persiapan program fortifikasi minyak goreng sawit
dengan vitamin A adalah sebagai berikut:
1. Tahun 2004-2011 : dilaksanakan studi konsumsi (intake minyak goreng),
stabilitas, efficacy, effectiveness.
2. Tahun 2011-2012 SNI wajib untuk minyak goreng sudah selesai
disiapkan.
3. Tahun 2011-2013 dilaksanakan pilot project di beberapa wilayah
(dimulai di Jawa Timur dan Jawa Barat).
4. Tahun 2011-2012 selesai dilaksanakan capacity building.
5. Tahun 2013 diimplementasikan SNI Wajib minyak goreng yang
difortifikasi.
6. Tahun 2013-2014 dilaksanakan monitoring dan evaluasi dampak
forti-fikasi wajib.
1.2 PERUMUSAN MASALAH
Seiring dengan peraturan dan kondisi di atas, maka perlu dilakukan
pengawasan atau monitoring terhadap pemenuhan kadar vitamin A dalam
minyak goreng sawit, baik pada tingkat industri, distributor dan konsumen.
dan praktis untuk mengidentifikasi dan menetapkan kadar vitamin A,
khususnya vitamin A dalam minyak goreng sawit. Namun analisis vitamin A
dalam produk pangan sulit dilakukan dengan metode yang tersedia, karena
matriks pangan yang kompleks dan adanya bahan tambahan yang
ditam-bahkan dalam produk pangan.
Di antara metode resmi atau metode standar pengujian vitamin A yang
ada saat menggunakan metode analisis dengan kromatografi cair kinerja
tinggi (KCKT). Kesulitan yang dihadapi dalam penggunaan metode yang ada
tersebut adalah dalam tahap persiapan sampel yang harus melewati tahapan
saponifikasi, ekstraksi dan pemekatan atau penguapan pelarut organik yang
digunakan untuk ekstraksi. Panjangnya proses persiapan tersebut
menyebab-kan hasil diperoleh kurang baik. Oleh karena itu, perlu dikembangmenyebab-kan metode
analisis untuk penetapan kadar vitamin A dalam minyak goreng sawit dengan
menggunakan KCKT tanpa proses saponifikasi, ekstraksi dan penguapan
pelarut organik.
Suatu metode baru atau metode yang dimodifikasi dapat digunakan bila
telah dilakukan validasi yang kondisinya disesuaikan dengan kondisi
labora-torium dan peralatan yang tersedia, meskipun metode yang akan digunakan
tersebut telah dipublikasikan dalam jurnal, buku teks atau buku resmi
(Indra-yanto, 1994). Validasi metode juga perlu dilakukan bila dilakukan
penyeder-hanaan atau perbaikan metode oleh karena ada perbedaan dan keterbatasan
alat, pereaksi atau kondisi lain yang menyebabkan metode tersebut tidak
dapat diterapkan secara keseluruhan. Apabila dari hasil validasi metode
tersebut sudah memberikan hasil yang baik, maka metode ini dianggap valid,
dapat dipercaya dan dapat digunakan untuk analisis rutin.
1.3 TUJUAN PENELITIAN
1. Melakukan pengembangan metode analisis penetapan kadar vitamin A
dalam minyak goreng sawit menggunakan KCKT menggunakan kolom C
18, yaitu menentukan komposisi fase gerak dan laju alir yang cocok
dalam pemisahan vitamin A dari komponen-komponen yang lain
detektor fluoresens) pada penetapan kadar vitamin A dalam minyak
goreng sawit.
2. Melakukan validasi metode analisis hasil pengembangan untuk
membuk-tikan bahwa metode yang telah dikembangkan tersebut valid.
3. Melakukan uji coba metode yang telah dikembangkan dan telah
divali-dasi untuk membuktikan bahwa metode tersebut dapat digunakan untuk
penetapan kadar vitamin A dalam minyak goreng sawit yang beredar di
pasaran tanpa adanya gangguan matriks sampel yang ada di dalam
berbagai merek minyak goreng sawit.
1.4 MANFAAT PENELITIAN
Hasil dari penelitian ini diharapkan dapat menghasilkan metode analisis
yang handal (valid, selektif, cepat, mudah dan praktis) untuk analisis
penetapan kadar vitamin A dalam minyak goreng, sehingga dapat dijadikan
kontrol yang lebih baik terhadap industri pangan dalam mensukseskan
fortifikasi vitamin A dalam minyak goreng sawit. Penelitian ini juga
diharapkan dapat menambah pengetahuan baru bagi peneliti dan memberikan
kontribusi bagi dunia pendidikan di Indonesia mengenai validasi metode
analisis pangan.
1.5 RUANG LINGKUP PENELITIAN
Penelitian ini merupakan penelitian laboratorium yang dilakukan
dengan cara: mencari komposisi fase gerak, laju alir, dan detektor yang
digunakan dalam pemisahan vitamin A dengan komponen-komponen lainnya
menggunakan KCKT, sehingga didapatkan suatu metode untuk penetapan
kadar vitamin A dalam minyak goreng sawit. Untuk membuktikan
kehan-dalan metode yang didapat, maka dilakukan validasi terhadap metode tersebut
dengan parameter validasi meliputi: linieritas, presisi, akurasi, selektivitas,
robustness, batas deteksi dan batas kuantisasi; dan uji coba metode tersebut
untuk penetapan kadar vitamin A dalam berbagai merek minyak goreng sawit
2.1 VITAMIN A
Vitamin A merujuk pada semua senyawa isoprenoid dari
produk-produk hewani yang mempunyai aktivitas all trans-retinol ( Rohman dan Ibnu,
2007). Menurut Almatsier (2009), vitamin A merupakan terminologi nama
generik yang menyatakan semua senyawa retinoid dan karotenoid (prekursor/
pro vitamin A) yang mempunyai aktivitas biologis seperti retinol. Bentuk
kimiawi senyawa retinoid berupa retinol (vitamin A bentuk alkohol), retinal
(aldehida), ester retinil dan asam retinoat. Menurut CE (2007) struktur kimia,
rumus empiris dan bobot molekul dari: retinol, retinil asetat, retinil propionat
dan retinil palmitat dapat dilihat pada Gambar 1 dan Tabel 1. Menurut
Eitenmiller dkk, (2008) sifat-sifat kimia-fisika dari retinol dan retinil palmitat
dapat dilihat pada Tabel 2.
CH3
H3C CH3 CH3
O
R
CH3
Gambar 1. Struktur molekul vitamin A alkohol (retinol) dan ester vitamin A (ester retinil)
Tabel 1. Rumus empiris dan bobot molekul dari vitamin A alkohol (retinol) dan ester vitamin A (ester retinil)
Tabel 2. Sifat-sifat Kimia Fisika Retinol dan Retinil Palmitat
Sifat Kimia Fisika Retinol Retinil Palmitat
Bentuk Kristal kuning Kristal, amorf atau cairan
kental berwarna kuning
Kelarutan Larut dalam: metanol,
etanol, propanol, Sumber: Eitenmiller dkk (2008)
Vitamin A pada umumnya stabil terhadap panas, asam, dan alkali,
namun mempunyai sifat yang mudah teroksidasi oleh udara dan akan rusak
bila dipanaskan pada suhu tinggi bersama udara, sinar, dan lemak yang sudah
tengik (Winarno, 2008). Menurut Favaro dkk, (1991) di dalam Hariyadi
(2011) vitamin A yang difortifikasikan ke dalam minyak goreng stabil selama
6-9 bulan jika disimpan dalam wadah tertutup dan terlindung dari cahaya,
vitamin A relatif stabil setelah proses penggorengan.
Menurut CE (2007), aktifitas vitamin A dinyatakan dalam Retinol
Ekivalen (R.E.), 1 mg R.E. sebanding dengan aktifitas 1 mg All-trans retinol.
Aktifitas ester retinol lain dihitung secara stoikiometris, sehingga didapat 1
mg R.E. vitamin A sebanding dengan: 1,147 mg all-trans-retinyl acetate,
1,195 mg all-trans-retinyl propionate dan 1,832 mg all-trans palmitate. Unit
Internasional atau International Units (IU) juga digunakan untuk menyatakan
aktifitas vitamin A. 1 IU Vitamin A ekivalen dengan aktivitas 0,300 μg
All-trans retinol. Aktifitas retinol ester lain dihitung secara stoikiometris,
sehingga didapat 1 IU vitamin A sebanding dengan aktifitas: 0,334 μg
all-trans-retinyl acetate, 0,359 μg all-trans-retinyl propionate, dan 0,550 μg
Aktifitas vitamin A ditentukan dengan tujuan untuk menghitung jumlah
yang dibutuhkan pada pembuatan konsentrat. Menurut BP Commision (2009),
aktivitas vitamin A palmitat ditetapkan dengan cara menimbang 25-100 mg
vitamin A dengan akurasi 0,1 %, dilarutkan dengan menggunakan 5 mL
pentana dan diencerkan dengan 2-propanol hingga diperolah konsentrasi 10 -
15 IU/mL. Pengukuran absorbansi dilakukan pada panjang gelombang yang
menghasilkan serapan maksimum pada 326 nm. Aktivitas vitamin A dihitung
dalam satuan internasional unit (IU) per gram dengan persamaan:
A326 = Absorbansi pada panjang gelombang 326 nm
V = total volume pengenceran untuk mendapatkan kadar 10 – 15 IU/mL
1900 = faktor untuk mengkonversi absorbansi spesifik ester retinol menjadi
IU per gram
m = bobot substansi yang di uji (dalam gram).
Vitamin A merupakan zat gizi yang penting (esensial) bagi manusia,
karena zat gizi ini tidak dapat disintesa oleh tubuh, sehingga harus dipenuhi
dari luar. Vitamin A penting untuk kesehatan mata dan mencegah kebutaan
dan yang lebih penting lagi vitamin A meningkatkan daya tahan tubuh.
Anak-anak yang cukup mendapatkan vitamin A, bila terkena diare, campak atau
penyakit infeksi lainnya maka penyakit-penyakit tersebut tidak mudah
men-jadi parah, sehingga tidak membahayakan jiwa anak. Dengan adanya
bukti-bukti yang menunjukkan peranan vitamin A dalam menurunkan angka
kematian, maka selain untuk mencegah kebutaan, pentingnya vitamin A saat
ini lebih dikaitkan dengan kelangsungan hidup, kesehatan dan pertumbuhan
anak (Depkes, 2009a). Fungsi vitamin A didalam tubuh adalah untuk
diferen-siasi sel penglihatan, spermatogenesis, perkembangan embrio, imunitas,
mempengaruhi indra perasa, pendengaran, nafsu makan, serta pertumbuhan
(Bagriansky dan Ranum, 1998). Fungsi lain dari vitamin A adalah membantu
memelihara penglihatan di dalam gelap dan mencegah rabun senja serta
perkembangan gigi, sebagai koenzim dalam sintesis glikoprotein, memiliki
fungsi seperti hormon steroid, diperlukan untuk pembentukan tiroksin dan
pencegahan goiter, sintesis protein dan sintesis kortikosteron dari kolesterol,
serta sintesis normal dari glikogen (Berdarnier dkk, 2002).
Angka kecukupan gizi untuk vitamin A biasanya dinyatakan dalam satuan
retinol ekivalen (RE). Satu RE setara dengan 1 mikrogram retinol atau 6
mikrogram beta karoten atau 12 mikrogram beta karoten campuran. Status
vitamin A dikatakan baik jika konsentrasi vitamin A dalam hati sebesar 20
mikrogram/gram. Penggunaan setiap harinya adalah sekitar 0,5% dari
persediaan tersebut. Konsumsi vitamin A yang baik adalah jika setengahnya
bisa disimpan didalam tubuh (Muhilal, Jalal dan Hardiansyah, 1998). Angka
kecukupan gizi vitamin A rata-rata yang dianjurkan perhari dapat dilihat pada
Tabel 3.
Tabel 3. Angka Kecukupan Gizi Vitamin A
Kelompok Usia (tahun) Angka Kecukupan (RE)
Bayi
Sumber: FAO/WHO (2001) dalam Muhilal dan Sulae-man (2004)
2.2 MINYAK GORENG SAWIT
Menurut Badan POM (2006), minyak goreng (frying oil atau frying fat)
adalah: minyak dan lemak yang digunakan untuk menggoreng yang diperoleh
dari proses rafinasi/pemurnian (refining/purifying) minyak nabati dalam
kadar air tidak lebih dari 0,15 %, kadar asam lemak bebas tidak lebih dari 0,3
%, kadar asam lemak linoleat tidak lebih dari 2 % dan bilangan peroksida
tidak lebih dari 10 mek O2/kg.
Minyak kelapa sawit (Refined Bleached Deodorized Palm Oil/RBDPO)
adalah: minyak yang diperoleh dari hasil proses rafinasi/pemurniaan minyak
kelapa sawit mentah. Karakteristik dasar minyak kelapa sawit meliputi:
bilangan penyabunan 190 mg KOH/g, bilangan iod 50 Wijs hingga 55 Wijs,
titik leleh 33 oC hingga 39 oC dan bilangan peroksida tidak lebih dari 10 mek
O2/kg (Badan POM, 2006).
Minyak olein kelapa sawit (Refined Bleached Deodorized Palm Oilein)
adalah fraksi cair minyak kelapa sawit berwarna kekuningan yang diperoleh
dari hasil proses rafinasi/pemurniaan minyak olein kelapa sawit mentah
(Crude Palm Oil/CPO) atau fraksinasi minyak kelapa sawit yang sudah
dirafi-nasi (RBD palm oil). Karakteristik dasar minyak olein kelapa sawit meliputi
titik leleh/lebur tidak lebih dari 30oC, bilangan iod tidak kurang dari 56 Wijs,
bilangan penyabunan 194 mg KOH/g hingga 202 mg KOH/g dan bilangan
peroksida tidak lebih dari 10 mek O2/kg (Badan POM, 2006).
Minyak stearin kelapa sawit (Refined Bleached Deodorized Palm
Stearin) adalah fraksi padat minyak kelapa sawit yang berwarna kekuningan
yang diperoleh dari hasil proses rafinasi/pemurnian stearin kelapa sawit
mentah (Crude Palm Stearin) atau fraksinasi minyak kelapa sawit yang sudah
dirafinasi (RBD palm oil). Karakteristik dasar minyak olein kelapa sawit
meliputi: titik leleh/lebur tidak kurang dari 44oC dan bilangan iod tidak lebih
dari 48 Wijs (Badan POM, 2006).\
Minyak sawit (palm oil) berbeda dengan minyak inti sawit (palm kernel
oil). Minyak sawit diperoleh dari daging buah kelapa sawit bagian mesokarp,
sedangkan minyak inti sawit diperoleh dari biji buah kelapa sawit. Minyak
kelapa sawit diperoleh melalui proses ekstraksi secara rendering atau
penge-presan dan proses pemurnian yang terdiri atas pengendapan dan pemisahan
gum, netralisasi, pemucatan dan deodorisasi. Secara umum minyak kelapa
memiliki aroma yang sedap dan stabil atau tahan terhadap ketengikan
(Winarno, 2008).
Melalui proses rafinasi, pemucatan dan penghilangan bau atau disingkat
RBD (Refined, Bleached, Deodorized), minyak kelapa sawit dapat diubah
menjadi produk yang bernilai tinggi. Proses rafinasi dan fraksinasi
menghasilkan minyak yang tidak berwarna, jernih dan bersih dari kotoran
yang dikenal dengan RBD oil. Kehilangan beta karoten yang terkandung
dalam minyak kelapa sawit banyak terjadi selama proses-proses tersebut
berlangsung (Muchtadi, 1996).
Menurut Olson (1990), minyak kelapa sawit yang tidak mengalami
proses penjernihan dan bleaching memiliki warna merah karena banyak
mengandung karoten (α dan β karoten) dalam jumlah yang banyak.
Kandungan karotenoid sebanyak 0,5 mg/mL minyak kelapa sawit. Kebutuhan
vitamin A pada anak usia pra-sekolah dapat dicukupi dari konsumsi 7 mL
minyak kelapa sawit merah per hari. Menurut Martianto, Marliyati dan
Komari (2007), walaupun memiliki kandungan karotenoid yang tinggi,
minyak kelapa sawit merah tidak dapat diterima dalam banyak penggunaan
karena warna merah yang kuat dan rasanya yang sangat khas.
Menurut Kemperin (2010), minyak goreng sawit adalah: bahan pangan
dengan komposisi utama trigliserida berasal dari minyak sawit, dengan atau
tanpa pengubahan kimiawi, termasuk hidrogenasi, pendinginan dan telah
melalui proses pemurnian dengan penambahan vitamin A. Komposisi minyak
goreng sawit terdiri atas bahan baku minyak sawit dan bahan tambahan
pangan (BTP) yang penggunaannya disesuaikan dengan ketentuan yang
berlaku untuk diizinkan penggunaannya pada minyak goreng sawit. Adapun
persyaratan mutu minyak goreng sawit sesuai dengan RSNI 3 Minyak goreng
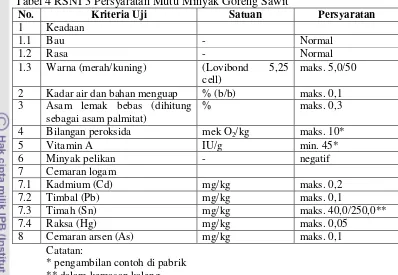
Tabel 4 RSNI 3 Persyaratan Mutu Minyak Goreng Sawit
No. Kriteria Uji Satuan Persyaratan
1 Keadaan
1.1 Bau - Normal
1.2 Rasa - Normal
1.3 Warna (merah/kuning) (Lovibond 5,25 cell)
maks. 5,0/50
2 Kadar air dan bahan menguap % (b/b) maks. 0,1 3 Asam lemak bebas (dihitung
sebagai asam palmitat)
* pengambilan contoh di pabrik ** dalam kemasan kaleng
2.3 FORTIFIKASI PANGAN
Menurut Soekirman (2003), kekurangan zat gizi mikro dapat diatasi
dengan berbagai pendekatan seperti diversifikasi pangan, suplementasi dan
fortifikasi pangan. Fortifikasi adalah penambahan satu atau lebih zat gizi
mikro tertentu ke dalam bahan pangan dengan tujuan utama adalah
mening-katkan mutu gizi makanan. Fortifikasi dapat bersifat sukarela maupun wajib.
Fortifikasi yang dilakukan secara sukarela adalah fortifikasi yang dilakukan
oleh produsen untuk meningkatkan nilai tambah produknya, sedangkan
fortifikasi wajib merupakan fortifikasi yang diharuskan dan terdapat dalam
undang-undang maupun peraturan pemerintah dengan tujuan melindungi
rakyat dari kurang gizi. Target utama dari fortifikasi wajib ini adalah
masyarakat miskin yang umumnya menderita kekurangan gizi mikro seperti
kekurangan yodium, zat besi, dan vitamin A. Bahan pangan yang dapat
dilakukan fortifikasi harus memenuhi beberapa kriteria yaitu:
1. Bahan pangan harus dikonsumsi oleh semua atau sebagian besar populasi
sasaran.
3. Rasa, penampakan dan bau bahan pangan yang difortifikasi tidak boleh
berubah.
4. Zat yang digunakan untuk fortifikasi harus stabil pada kondisi yang
ekstrim seperti pemasakan, pemrosesan, pengangkutan dan penyimpanan
5. Harga bahan pangan hasil fortifikasi tidak naik secara berarti.
Menurut Soekirman (2003) syarat-syarat bahan pangan yang akan
dilakukan fortifikasi adalah produsen yang memproduksi dan mengolah bahan
pangan tersebut terbatas jumlahnya, tersedianya teknologi fortifikasi untuk
bahan pangan yang dipilih dan bahan pangan tersebut tetap aman untuk
dikonsumsi dan dan tidak membahayakan kesehatan.
Menurut Martianto (2011), minyak goreng merupakan bahan pangan
yang diproduksi secara terpusat dan dikonsumsi secara luas oleh masyarakat,
sehingga dapat dipakai sebagai alternatif bahan pangan untuk difortifikasi.
Fortifikasi vitamin A ke dalam minyak goreng sawit perlu dilakukan dengan
alasan: (1) Produk makanan Indonesia sebagian besar menggunakan minyak
goreng; (2) Untuk mengurangi penyakit akibat KVA, maka perlu adanya
kebijakan yang tepat untuk menanggulangi masalah KVA; (3) Salah satu
kebijakan yang ditempuh adalah fortifikasi vitamin A dalam minyak goreng,
dan (4) Pemerintah akan menetapkan standar yang mewajibkan kepada
seluruh produsen minyak goreng sawit untuk melakukan fortifikasi vitamin A
ke dalam produknya.
Menurut Hariyadi (2011), fortifikasi vitamin A pada minyak goreng
dapat dilakukan dengan alasan: (1) Vitamin A dan pro-vitamin A sangat
mudah larut dalam minyak goreng; (2) Vitamin A umumnya lebih stabil
dalam minyak goreng dari pada dalam bahan pangan lainnya; (3) Minyak
goreng (lipida) membantu proses absorbsi dan pemanfaatan vitamin A; (4)
Minyak goreng digunakan oleh masyarakat luas; (5) Teknologinya tersedia
dan sederhana, dan (6) Biaya fortifikasi terjangkau.
2.4 METODE ANALISIS PENETAPAN KADAR VITAMIN A
Secara umum pengujian vitamin A dalam bahan pangan terdiri atas 3
tahap yaitu: tahap saponifikasi, tahap ektraksi, tahap pemekatan atau
penguapan pelarut organik dan tahap pengukuran menggunakan instrumen.
Saponifikasi dilakukan dengan menggunakan kalium hidroksida dengan
pelarut campuran etanol dan air, penambahan zat anti oksidan (asam askorbat,
pirogalol, butil hidroksi toluena) dan pemanasan pada suhu 60–80oC
(Eitenmiller, 2008). Tahap ekstraksi dilakukan menggunakan pelarut organik
seperti petroleum eter (Eitenmiller, 2008); eter, campuran etanol dengan tetra
hidrofuran (USP Convention 2008). Selanjutnya dilakukan pemekatan atau
penguapan terhadap pelarut organik yang digunakan, lalu dilarutkan kembali
dengan pelarut lainnya seperti metanol atau etanol dan selanjutnya siap untuk
ditetapkan kadarnya menggunakan instrumen seperti: spektrofotometri atau
kromatografi cair kinerja tinggi. Metode penetapan kadar vitamin A
menggunakan instrumen akan dijelaskan sebagai berikut:
2.4.1 Metode Spektrofotometri
2.4.1.1 Pengukuran secara langsung.
Spektrum absorbsi ultraviolet vitamin A dan vitamin A asetat
mempunyai absorbsi maksimal pada panjang gelombang antara 325
sampai 328 nm dalam berbagai pelarut. Larutan vitamin A dalam
isopropanol absorbansinya diukur pada panjang gelombang maksimal
(λmaks) dan pada dua titik, yaitu satu disebelah kanan λmaks dan satunya
pada sebelah kiri λmaks. Absorbansi pada λmaks dikoreksi terhadap
senyawa pengganggu dengan menggunakan formula koreksi karena
senyawa-senyawa ini akan ikut menyerap pada daerah UV. Beberapa
pengganggu terutama pada minyak ikan adalah vitamin A2, kitol,
anhidro vitamin A dan asam polien. Pada vitamin A sintetik senyawa
pengganggunya adalah senyawa-senyawa antara (Rohman dan
2.4.1.2 Pengubahan retinol atau akseroftol menjadi anhidroakseroftol
Akseroftol mudah diubah menjadi anhidroakseroftol dengan
bantuan sejumlah kecil asam mineral atau asam organik kuat. Metode
Budowski dan Bondi, akseroftol diubah menjadi anhidroakseroftol
dalam pelarut benzen dengan katalisator asam toluen-p-sulfonat pada
temperatur kamar. Kenaikan absorbansi pada 399 nm merupakan hasil
dehidrasi yang berbanding langsung dengan jumlah akseroftol yang
terkandung. Reaksi ini dapat dihentikan dengan penambahan alkali.
Pengukuran absorbansi pada 358 nm, 377 nm dan 399 nm dalam
benzen merupakan cara yang baik untuk mengetahui kemurnian
akseroftol yakni dengan melihat bahwa A399 nm/A377 nm sebesar 0,868
dan A358 nm/A377 nm sebesar 0,692 (Rohman dan Sumantri, 2007).
2.4.1.3 Metode Maleat anhidrat untuk isomer vitamin A
Maleat anhidrat bereaksi dengan all-trans dan 9-cis isomer
vitamin A menghasilkan senyawa yang tidak memberikan warna biru
ketika diuji dengan menggunakan antimon (III) klorida. Potensi
kehilangan terhadap all-trans dan 9-cis isomer dapat terjadi, sehingga
perlu dilakukan dua kali pengukuran nilai antimon (III) klorida,
pertama untuk isomer campuran dan setelah penghilangan kedua
isomer tersebut. Dari perbedaan nilai pengukuran ini, maka komposisi
isomer dalam campuran dan potensi biologisnya dapat ditentukan.
2.4.1.4 Penentuan secara simultan retinol (vitamin A1) dan
dehidro-retinol (vitamin A2)
Prinsip dari metode ini adalah perbedaan panjang gelombang
maksimum dan nilai ekstinsi dari masing-masing vitamin A1 dan A2.
Vitamin A1 mempunyai panjang gelombang maksimum pada 326 nm
sedangkan vitamin A2 mempunyai panjang gelombang maksimum
2.4.2 Metode kolorimetri
2.4.2.1 Metode Carr-Price
Metode Carr-Pierce mencakup perlakuan vitamin A dengan
antimon (III) klorida; warna biru yang timbul memberikan serapan
maksimum pada panjang gelombang 620 nm dan mematuhi hukum
Lambert-Beer. Antimon (III) klorida yang digunakan sebagai reagen
penghasil warna bersifat korosif, dan membutuhkan penanganan secara
khusus dan kadang-kadang menyebabkan kerusakan terhadap peralatan
spektrofotometer. Dilihat dari formasi antimon (III) klorida, zat ini
sulit untuk untuk dibersihkan dari kuvet dan juga peralatan preparasi.
Warna biru yang timbul sangat tidak stabil dan pengukuran absorbansi
harus dilakukan antara 5-10 detik dari penambahan reagen (Rohman
dan Sumantri, 2007).
2.4.2.2 Pengukuran secara spektrofotometri dengan menggunakan
Asam trifluoro asetat
Asam trifluoro asetat bereaksi dengan vitamin A dan turunannya
sehingga mengasilkan warna biru yang memberikan serapan
maksi-mum pada panjang gelombang 616 nm. Reaksi warna yang terjadi
mematuhi hukum Lambert-Beer pada kisaran konsentrasi vitamin A
sebesar 10-6 dan 10-5 M (Libman, 1966).
2.4.2.3Pengukuran secara spektrofotometri dengan menggunakan
gliserol diklorohidrin aktif
Gliserol diklorohidrin aktif bereaksi dengan vitamin A dalam
kloroform untuk menghasilkan warna ungu yang stabil dan
mem-punyai serapan maksimum pada panjang gelombang 555 nm. Reaksi
warna yang terjadi mematuhi hukum Lambert-Beer pada kisaran yang
lebar. Intensitas warna yang timbul 1/3 jika dibandingkan dengan
intensitas warna biru dari metode Carr-Pierce yang menggunakan
antimon (III) klorida. Reaksi bergantung pada suhu pengujian dan
disarankan pembuatan kurva kalibrasi dan analisis sampel dilakukan
2.4.2.4Pengukuran dengan menggunakan Asam fosfotungstat
Vitamin A dalam kloroform bereaksi dengan asam fosfotungstat
dalam etil asetat dengan adanya asetat anhidrat maka menghasilkan
warna biru dan memberikan serapan maksimum pada panjang
gelom-bang 620 nm. Reaksinya mematuhi hukum Lambert-Beer. Pada
pema-nasan dengan suhu 50°C menggunakan penangas air, warna biru yang
ada akan berubah menjadi biru keunguan, ungu, dan akhirnya menjadi
merah dan mempunyai serapan maksimum pada 530 nm. Warna merah
yang timbul juga mematuhi hukum Lambert-Beer dan cocok untuk
pengujian vitamin A, akan tetapi metode ini kurang sensitif untuk
bahan dengan kadar vitamin A rendah (Libman, 1966).
2.4.2.5Pengukuran secara kolorimetri dengan aluminium klorida
Metode ini mencakup reaksi larutan jenuh aluminium klorida
dalam kloroform anhidrat dengan vitamin A. Warna yang timbul
mempunyai serapan maksimum pada panjang gelombang 618 nm dan
mematuhi hukum Lambert-Beer (Libman, 1966).
2.4.2.6Pengukuran menggunakan asam fosfomolibdat
Metode ini melibatkan reaksi vitamin A dengan asam
fosfo-molibdat; warna biru yang timbul memberikan serapan maksimum
pada panjang gelombang 700 serta mematuhi hukum Lambert-Beer
(Libman, 1966).
2.4.3 Metode Spektrofluorometri
Berdasarkan sifat vitamin A yang dapat memberikan flourosensi,
maka vitamin A dalam bahan pangan yang telah diekstrasi dapat
diu-kur menggunakan spektrofluorometer pada panjang gelombang
eksi-tasi 330 nm dan emisi 480 nm. Pengukuran dengan metode
spektro-fluorometri lebih spesifik dibandingkan cara spektrofotometri, karena
banyak senyawa yang memberikan serapan pada daerah UV, namun
tidak memberikan sifat flourosensi (Angustin dkk 1985).
2.4.4 Metode Kromatografi
2.4.4.1Pengukuran dengan kromatografi lapis tipis
Vitamin A dapat dipisahkan dengan komponen lainnya secara
kromatografi lapis tipis menggunakan fase diam silika gel F254 dan fase
gerak campuran siklo heksana dan eter dengan perbandingan 4:1, noda
yang telah terpisah dideteksi menggunakan asam fosfomolibdat dan
bercak biru hijau yang terjadi menunjukkan adanya vitamin A.
Perkiraan harga Rf vitamin A dalam bentuk alkohol, asetat dan
palmitat berturut-turut adalah 0,1; 0,45 dan 0,7 (Depkes 1995). Untuk mendeteksi noda vitamin A dapat juga digunakan larutan antimon (III)
klorida yang akan memberikan warna biru (Depkes 1979) atau
menggunakan UV pada pada panjang gelombang 254 nm (CE 2007).
Sebagai fase gerak selain menggunakan campuran siklo heksana dan
eter, juga dapat digunakan campuran siklo heksana dan etil asetat
dengan perbandingan 9:1 (Libman 1966).
2.4.4.2 Kromatografi Cair Kinerja Tinggi
Vitamin A dapat ditetapkan kadarnya menggunakan KCKT
menggunakan kolom fase normal atau kolom fase terbalik. Dengan
menggunakan kolom fase normal, vitamin A ditetapkan kadarnya
menggunakan fase diam kolom silika, fase gerak n-heksana dan
dideteksi menggunakan UV 325-nm (USP Convention 2008). Sebagai
fase gerak dapat juga digunakan campuran heptana dan diisopropil
eter, 95:5; heksana dan dietil eter 98:2; 1-5 % 2-propanol dalam
heptana; heksana dan metil etil keton, 90:10 (Nollet 2000). Dengan
kolom fase terbalk, vitamin A ditetapkan kadarnya menggunakan fase
diam kolom C18, fase gerak campuran metanol dan air dengan
perbandingan 860:140 dan dideteksi menggunakan UV 328-nm atau
313-nm (AOAC International, 2005). Sebagai fase gerak dapat juga
digunakan campuran asetonitril dengan air 90:10 (Eitenmiller, 2008);
campuran asetonitril dengan air, 90:10 atau campuran metanol dengan
proses saponifikasi, ekstraksi, pemekatan dan melarutkan kembali
menggunakan pelarut yang sesuai.
2.5 INTRUMENTASI KCKT
Kromatografi Cair Kinerja Tinggi atau KCKT atau biasa juga disebut
dengan HPLC (High Performance Liquid Chromatography) merupakan teknik
pemisahan yang diterima secara luas untuk analisis dan pemurnian senyawa
tertentu dalam suatu sampel. Kegunaan umum KCKT adalah untuk pemisahan
senyawa organik, anorganik, maupun senyawa biologis. KCKT merupakan
metode yang tidak destruktif dan dapat digunakan baik untuk analisis
kuali-tatif maupun kuantikuali-tatif (Rohman 2007).
Kromatografi adalah suatu prosedur pemisahan zat terlarut oleh suatu
proses migrasi difrensial dinamis dalam sistem yang terdiri dari dua fase atau
lebih, salah satu diantaranya bergerak secara berkesinambungan dalam arah
tertentu dan di dalam zat tersebut menunjukkan perbedaan morbilitas
disebab-kan adanya perbedaan dalam adsorbsi, partisi, kelarutan, tedisebab-kanan uap, ukuran
molekul atau kerapatan muatan ion (Depkes 2009b)
Instrumentasi KCKT pada dasarnya terdiri atas komponen pokok yaitu
wadah fase gerak, sistem penghantaran fase gerak, alat untuk memasukkan
sampel kolom, detektor, wadah penampung buangan fase gerak, tabung
peng-hubung dan suatu komputer atau integrator atau perekam (Johnson, 1991).
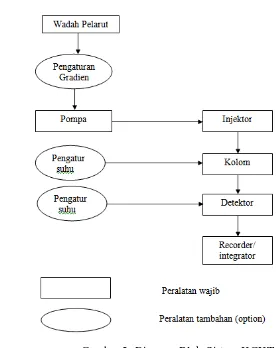
Diagram blok untuk sistem kromatografi cair kinerja tinggi ditunjukkan pada
Gambar 2. Diagram Blok Sistem KCKT
2.5.1 Wadah Fase Gerak pada KCKT
Wadah fase gerak harus bersih dan lembam (inert). Wadah ini
biasanya dapat menampung fase gerak antara 1 sampai 2 liter pelarut.
Fase gerak sebelum digunakan harus dilakukan degassing (penghilang
gas) yang ada pada fase gerak, sebab adanya gas akan berkumpul
dengan komponen lain terutama di pompa dan detektor sehingga akan
mengacaukan analisis.
2.5.2 Fase Gerak Pada KCKT
Fase gerak atau eluen biasanya terdiri atas campuran pelarut
yang dapat bercampur yang secara keseluruhan berperan dalam daya
elusi dan resolusi. Daya elusi dan resolusi ini ditentukan oleh polaritas
keseluruhan pelarut, polaritas fase diam dan sifat
gerak), kemampuan elusi meningkat dengan meningkatnya polaritas
pelarut. Sementara untuk fase terbalik (fase diam kurang polar
dari-pada fase gerak), kemampuan elusi menurun dengan meningkatnya
polaritas pelarut.
Fase gerak yang paling sering digunakan untuk pemisahan
dengan fase terbalik adalah campuran larutan buffer dengan metanol
atau campuran air dengan asetonitril. Untuk pemisahan dengan fase
normal, fase gerak yang paling sering digunakan adalah campuran
pelarut-pelarut hidrokarbon dengan pelarut yang terklorisasi atau
menggunakan pelarut-pelarut jenis alkohol.
2.5.3 Pompa pada KCKT
Pompa yang digunakan untuk KCKT adalah pompa yang
mempunyai syarat sebagaimana syarat wadah pelarut yakni pompa
harus inert terhadap fase gerak. Pompa yang digunakan sebaiknya
mampu memberikan tekanan sampai 5000 psi dan mampu mengalirkan
fase gerak dengan kecepatan alir 1-3 mL/menit. Untuk tujuan
prepa-ratif, pompa yang digunakan harus mampu mengalirkan fase gerak
dengan kecepatan 20 mL/menit.
Tujuan penggunaan pompa atau sistem penghantaran fase gerak
adalah untuk menjamin proses penghantaran fase gerak berlangsung
secara tepat, reproduksibel, konstan dan bebas dari gangguan.
2.5.4 Injektor/Penyuntikan Sampel Pada KCKT
Sampel-sampel cair dan larutan disuntikkan secara langsung ke
dalam fase gerak yang mengalir di bawah tekanan menuju kolom
menggunakan alat penyuntik yang terbuat dari tembaga tahan karat dan
katup teflon yang dilengkapi dengan keluk sampel (sampel loop)
internal atau eksternal.
Pada saat pengisian sampel digelontor melewati keluk sampel
dan kelebihannya dikeluarkan ke pembuang. Pada saat penyuntikan,
mengge lontor sampel ke kolom. Presisi penyuntikan dengan keluk
sampel ini dapat mencapai nilai RSD 0,1%.
2.5.5 Kolom Pada KCKT
Kolom KCKT pada umumnya terbuat dari pipa baja tahan karat.
Panjang kolom antara 10-30 cm dengan diameter dalam 4,5-5,0 mm.
Kolom diisi dengan yang sesuai untuk pemisahan sampel tertentu.
Kolom untuk pemisahan analitik umumnya mempunyai diameter
dalam 2-4 mm. Kolom dapat dipanaskan sampai 60oC agar dihasilkan
pemisahan yang lebih efisien. Jika tidak dinyatakan lain, kolom
dipertahankan pada suhu kamar.
Fase diam pada KCKT berupa silika yang dimodifikasi secara
kimiawi, silika yang tidak dimodifikasi, atau polimer-polimer stiren
dan divinil benzene. Permukaan silika adalah polar dan sedikit asam
karena adanya residu gugus silanol (Si-OH), Oktadesil silan (ODS atau
C18) merupakan fase diam yang paling banyak digunakan karena
mampu memisahkan senyawa-senyawa dengan kepolaran yang rendah,
sedang, maupun tinggi. Fase diam eksklusi dan penukar ion dapat
menggunakan silika atau polimer.
2.5.6 Detektor KCKT
Detektor pada KCKT ada 2 yaitu (1) Detektor universal (yang
mampu mendeteksi zat secara umum, tidak bersifat spesifik dan tidak
bersifat selektif) seperti detektor indeks bias dan detektor spektrometri
massa, dan (2) Detektor yang spesifik yang hanya akan mendeteksi
analit secara spesifik dan selektif, seperti detector UV-VIS, detektor
fluoresensi dan elektro kimia.
2.5.7 Komputer, Integrator atau Rekorder.
Alat pengumpul data seperti komputer, integrator atau rekorder,
dihubungkan dengan detektor. Alat ini akan mengukur sinyal
elektro-nik yang dihasilkan oleh detektor lalu memplotkannya sebagai suatu
2.6 VALIDASI METODE ANALISIS
Suatu metode analisis terdiri atas serangkaian langkah yang harus
diikuti untuk tujuan analisis kualitatif dan kuantitatif dengan menggunakan
teknik tertentu. Faktor-faktor yang harus diperhatikan dalam melakukan
pemilihan metode analisis adalah: tujuan analisis, biaya yang dibutuhkan,
serta waktu yang diperlukan; level analit yang diharapkan dan batas deteksi
yang diperlukan; macam sampel yang akan dianalisis serta pra-perlakuan
sampel yang dibutuhkan; jumlah sampel yang dianalisis; ketepatan dan
ketelitian yang diinginkan untuk analisis kuantitatif; ketersediaan bahan
rujukan, senyawa baku, bahan-bahan kimia, dan pelarut yang dibutuhkan;
peralatan yang tersedia; kemungkinan adanya gangguan pada saat deteksi
atau pada saat pengukuran sampel. Menurut Rohman dan Ibnu (2007),
kriteria yang harus dipenuhi suatu metode analisis yang baik adalah:
1. Peka (sensitive) artinya metode harus dapat digunakan untuk
mene-tapkan kadar senyawa dalam konsentrasi yang kecil.
2. Selektif, artinya untuk penetapan kadar senyawa tertentu, metode
tersebut tidak banyak terpengaruh oleh adanya senyawa lain.
3. Tepat (precise) artinya metode tersebut menghasilkan suatu hasil
analisis yang sama atau hampir sama dalam satu seri pengukuran
(penetapan).
4. Teliti (accurate) artinya metode dapat menghasilkan nilai rata-rata
(mean) yang sangat dekat dengan nilai sebenarnya (true value).
5. Kasar (rugged) artinya ada perubahan komposisi pelarut atau variasi
lingkungan tidak menyebabkan perubahan hasil analisis.
6. Praktis artinya metode tersebut mudah dikerjakan serta tidak banyak
memerlukan waktu dan biaya.
Pengembangan metode analisis biasanya didasarkan pada metode yang
sudah ada menggunakan instrumen yang sama atau hampir sama.
Pengem-bangan metode analisis biasanya membutuhkan syarat-syarat metode
tertentu dan memutuskan jenis alat yang akan digunakan. Pada tahap